Спосіб одержання 8-йодометил(метиліден)-7,8-дигідро-1н-імідазо-[1,2-а]піразоло[4,3-е]піримідин-4-(6н)-онів
Номер патенту: 49840
Опубліковано: 11.05.2010
Автори: Бентя Антон Валентинович, Васькевич Руслан Іванович, Станінець Василь Іванович, Вовк Михайло Володимирович
Формула / Реферат
Спосіб одержання 8-йодометил(метиліден)-7,8-дигідро-1H-імідазо-[1,2-а]піразоло[4,3-е]піримідин-4-(6H)-онів загальної формули:
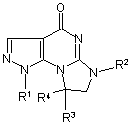 ,
,
де R1=Н, Ph; R2=Н, СН2СН=СН2; R3=Н; R4=ІСН2; R3R4=ІСН=,
який відрізняється тим, що 6-хлоропіразоло[3,4-d]піримідин-4-они вводять в реакцію з аліл- або пропаргіламінами в розчині етанолу при 90-100 °С з подальшою взаємодією утворених 6-аліл(пропаргіл)амінопіразоло[3,4-d]піримідин-4-онів з йодом в оцтовій кислоті при кімнатній температурі, наступною обробкою отриманих імідазо[1,2-а]піразоло[3,4-е]піримідин-9-ій пентайодидів 5 %-ним водним розчином сульфіту натрію і виділенням як проміжних, так і цільових продуктів звичайними методами.
Текст
Спосіб одержання 8-йодометил(метиліден)7,8-дигідро-1H-імідазо-[1,2-а]піразоло[4,3е]піримідин-4-(6H)-онів загальної формули: O 2 де R1=Н, Ph; R2=Н, СН2СН=СН2; R3=Н; R4=ІСН2; R3R4=ІСН=, який відрізняється тим, що 6-хлоропіразоло[3,4d]піримідин-4-они вводять в реакцію з аліл- або пропаргіламінами в розчині етанолу при 90-100 °С з подальшою взаємодією утворених 6аліл(пропаргіл)амінопіразоло[3,4-d]піримідин-4онів з йодом в оцтовій кислоті при кімнатній температурі, наступною обробкою отриманих імідазо[1,2-а]піразоло[3,4-е]піримідин-9-ій пентайодидів 5 %-ним водним розчином сульфіту натрію і виділенням як проміжних, так і цільових продуктів звичайними методами. N N R2 U N Корисна модель відноситься до органічної хімії, а саме до способу одержання нових похідних гетероциклічної системи 1H-імідазо[1,2- ]піразоло[4,3-е]піримідину загальної формули: O N N N N N R2 R1 R4 R3 1 2 3 де R =Н, Ph; R =Н, СН2СН=СН2; R =Н; 4 3 4 R =ІСН2; R R =ІСН= Сполуки даного типу можуть знайти застосування як біологічно активні речовини, а також як базові системи для дизайну та синтезу речовин із потенційною фармакологічною дією. Названі сполуки, їх властивості та застосування в патентних виданнях і науковій літературі не описані. Найближчими структурними аналогами сполук, які заявляються є 1,3,5-тризаміщені гексагідроциклопента[4,5]імідазо[1,2- ]піразоло[4,3е]піримідин-4(1Н)-они формули O R2 3 N R N N N N R1 де R1, R2=H, Me, Bz; R3=Me, Ph В ряду похідних наведеної гетероциклічної системи виявлені ефективні інгібітори фосфодіестераз [1], що створює позитивні передумови для їх 49840 , (11) R3 (13) R1 R4 UA N (19) N 3 49840 використання при лікуванні серцево-судинних захворювань [2-4]. Незважаючи на те, що описані в літературі [1, 5] методи їх синтезу дають змогу отримувати стереорегулярні продукти, самі по собі вони є багатоступеневими, вимагають застосування важкодоступних реагентів, причому ключові стадії - імідазоанелювання піримідинового циклу за участю аміноциклопентенового фрагмента та відновлення останнього відбуваються тільки в присутності дорогих металокомплексних паладієвих каталізаторів. При цьому очистка як проміжних, так і цільових продуктів здійснюється за допомогою колонкової хроматографії, що значно обмежує їх препаративні масштаби. Окрім цього, метод не дозволяє здійснювати синтез сполук із функціональними замісниками в імідазольному циклі, що є важливим для його спрямованої модифікації біофорними угрупованнями. Задачею винаходу є спосіб отримання нових поліфункціональних похідних 1Н-імідазо[1,2- ]піразоло[4,3-е]піримідину загальної формули: O N N N N R2 N R1 R4 R3 де R =Н, Ph; R2=Н, СН2СН=СН2; R3=Н; 4 3 4 R =ІСН2; R R =ІСН= Спосіб одержання сполук, які заявляються, полягає в тому, що препаративно доступні 6хлоропіразоло[3,4-d]піримідин-4-они [6,7] вводять в реакцію з аліл- або пропаргіламінами в розчині етанолу при 90-100°С з подальшою взаємодією утворених 6-аліл(пропаргіл)амінопіразоло[3,4d]піримідин-4-онів з йодом в оцтовій кислоті при кімнатній температурі та наступною обробкою отриманих імідазо[1,2- ]піразоло[3,4-е]піримідин9-ій пентайодидів 5 %-ним водним розчином сульфіту натрію. Проміжні і цільові продукти виділяють з реакційної суміші стандартними методами. Виходи кінцевих продуктів сягають 70-95 %. 1 O O NH N N N A R2 NH NH B N Cl N N R1 R1 NH N I5N R2 Na2SO3 R1 R4 3 I2 O + N N B R2 O N A N N N N N R2 R1 R4 R3 1 2 R3 де R =Н, Ph; R =H, CH2CH=CH2; А-В=НC=СН2, С=СН; R3=Н; R4=ІСН2; R3R4=ІСН= Запропонований підхід є синтетичною реалізацією принципу внутрішньомолекулярної електрофільної циклізації алкенільних або алкінільних структур гуанідинового типу і відкриває ефективний шлях до сполук, які можуть знайти практичне застосування як перспективні біорегулятори, а також, завдяки наявності в імідазолідиновому цик 4 лі схильних до хімічної модифікації йодометильної(метиліденової) та алільної груп, як базові сполуки для створення комбінаторних бібліотек потенційних фармацевтичних сполук. Отриманий результат не був заздалегідь передбачуваним, оскільки, по-перше, базуючись на літературних даних стосовно йодоциклізації Nалілзаміщених гуанідинів [8], не виключалась можливість формування на стадії циклізації гідрованого піримідинового кільця. По друге, наявність в 6-аліл(пропаргіл)амінопіразоло[3,4-d]піримідин-4онах двох нуклеофільних центрів (атоми N5 та N7) створювала певні передумови для альтернативного процесу утворення трициклічних сполук лінійного типу: R3 4 O R N N N N R R1 Насправді ж ключовий в запропонованій схемі процес йодоциклізації в 6аліл(пропаргіл)амінопіразоло[3,4-d]піримідин-4онів характеризується високою регіоселективністю і в м'яких умовах перебігає за. участю більш нуклеофільного атома N7 піримідинового циклу. Його первинними продуктами є солеподібні імідазо[1,2]піразоло[3,4-е]піримідин-9-ій пентайодиди, які отримуються в аналітично чистому вигляді і при дії сульфіту натрію практично кількісно перетворюються в цільові сполуки. Будова та склад всіх отриманих сполук доведені даними елементного аналізу, ІЧ-спектрів та спектрів ЯМР 1Н. Винахід ілюструється загальними методами одержання 6-аліл(пропаргіл)амінопіразоло[3,4d]піримідин-4-онів, імідазо[1,2- ]піразоло[3,4е]піримідин-9-ій пентайодидів, 1H-імідазо[1,2- ]піразоло[4,3-е]піримідин-4(6H)-онів та фізикохімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання 6аліл(пропаргіл)амінопіразоло-[3,4-d]піримідин-4онів. Суміш 10 ммоль відповідного 6хлоропіразоло[3,4-d]піримідин-4-ону, 40 ммоль аліл(пропаргіл)аміну в 15 мл етанолу нагрівали в запаяній ампулі при 90-100°С впродовж 4 год. Реакційну суміш охолоджували, осад, який утворився, відфільтровували, промивали етанолом і сушили на повітрі. Приклад 1. 6-(Проп-2-ен-1-іламіно)-1,5-дигідро-4Hпіразоло[3,4-d]піримі-дин-4-он. Вихід 84 %, т.топл. 295-297°С. ІЧ спектр, см-1: 720, 780, 830, 940, 1010, 1080, 1130, 1300, 1370, 1520, 1600, 1680, 3090. Спектр ЯМР 1Н, δ, м.ч.: 3.93 т (2Н, СН2, J 4.8 Гц), 5.12 д (1Н, СН, J 10.2 Гц), 5.21 д (1Н, СН, J 17.1 Гц), 5.86-5.99 м (1Н, СН), 6.54-6.63 м, (1Н, NH), 7.74 с (1Н, СН), 10.42 с (1Н, NH), 12.90 с (1Н, NH). Спектр ЯМР 13С, 6, м.ч.: 42.42 (СН2), 99.39 (С3а), 115.38 (СН2), 134.56 (С3 + СН), 153.37 (С7а) 155.88 2 5 (С6), 157.89 (С4). Знайдено, %: С 59.44; Н 4.86; N 36.39. C8H9N5O. Вирахувано, %: С 59.26; Н 4.74; N 36.63. Приклад 2. 6-(Проп-2-ен-1-іламіно)-1-феніл-1,5-дигідро4H-піразоло[3,4-d]піримідин-4-он. Вихід 89 %, т.топл. 211-213°С. ІЧ спектр, см-1: 710, 750,780, 830, 920, 960, 990, 1060, 1110, 1290, 1400, 1500, 1550, 1590, 1620, 1690, 3150, 3250, 3400, 3480. Спектр ЯМР 1Н, δ, м.ч.: 4.00 т (2Н, СН2, J 5.4 Гц), 5.15 д (1H, СН, J 10.5 Гц), 5.27 д (1Н, СН J 17.1 Гц), 5.88-6.01 м (1H, СН), 6.82-6.94 м, (1Н, NH), 7.30 т (1НAr J 7.5 Гц), 7.51 т (2HAr J 7.8 Гц), 8.04 с (1H, CH), 8.13 д (2HAr J 7.8 Гц), 10.77 с (1Н, NH). Спектр ЯМР 13С, 5, м.ч.: 42.87 (СН2), 101.17 (С3а), 115.81 (СН2), 120.19 (2СНAr), 126.08 (СНАr) 128.73(2СНАr), 134.42 (СН), 135.83 (С3), 139.00 (САr), 153.73 (С7а), 154.24 (С6), 157.58 (С4). Знайдено, %: С 63.23; Н 4.83; N 25.95. C14H13N5O. Вирахувано, %: С 62.91; Н 4.90; N 26.20. Приклад 3. 6-(Дипроп-2-ен-1-іламіно)-1,5-дигідро-4Hпіразоло[3,4-d]піри-мідин-4-он. Вихід 78 %, т. топл. 242-244°С. ІС спектр, см-1: 720, 770, 930, 1010, 1070, 1260, 1290, 1320, 1410, 1600, 1690, 3120, 3190. Спектр ЯМР 1Н, δ, м.ч.: 4.09-4.23 м (4Н, 2СН2), 5.11-5.24 м (4Н, 2СН2), 5.76-5.93 м (2Н, 2СН), 7.80 уш.с, (1Н, СН), 10.54 уш.с (1Н, NH), 12.94 уш.с (1Н, NH). Знайдено, %: С 56.86; Н 5.76; N 30.53. C11H13N5O. Вирахувано, %: С 57.13; Н 5.67; N 30.28. Приклад 4. 6-(Дипроп-2-ен-1-іламіно)-1-феніл-1,5-дигідро4H-піразоло[3,4-d]піримідин-4-он. Вихід 86 %, т.топл. 190-192°С. ІЧ спектр, см-1: 910, 960, 1120, 1260, 1310, 1390, 1500, 1580, 1710. Спектр ЯМР 1 Н, δ, м.ч.: 4.18-4.26 м (4Н, 2СН2), 5.18-5.26 м (4Н, 2СН2), 5.82-5.97 м (2Н, 2СН), 7.31 т (1НАr J 7.2 Гц), 7.52 т (2НAr J 7.5 Гц), 8.07 с (1Н, СН), 8.13 д (2НAr J 8.1 Гц), 10.90 с (1Н, NH). Знайдено, %: С 66.11; Н 5.66; N 23.01. C17H17N5O. Вирахувано, %: С 66.43; Н 5.58; N 22.79. Приклад 5. 6-(Проп-2-ін-1-іламіно)-1-феніл-1,5-дигідро-4Hпіразоло[3,4-d]піримідин-4-он. Вихід 84 %, т.топл. 242-244°С. ІЧ спектр, см-1: 720, 760, 760, 860, 980, 1070, 1110, 1300, 1400, 1500, 1550, 1590, 1610, 1690, 3280, 3460. Спектр ЯМР 1Н, δ, м.ч.: 3.20-3.25 м (1Н, СН), 4.11-4.20 м (2Н, СН2), 7.05-7.13 м (1Н, NH), 7.33 т (1НАr, J 7.5 Гц), 7.52 т, (2HAr, J 7.8 Гц), 8.08 с (1Н, СН), 8.19 д (2HAr J 7.8 Гц), 10.98 с (1Н, NH). Знайдено, %: С 63.67; Н 4.26; N 26.54. C14H11N5O. Вирахувано, %: С 63.39; Н 4.18; N 26.40. Загальний спосіб одержання 8йодометил(метиліден)-7,8-дигідро-1H-імідазо-[1,2]піразоло[4,3-e]піримідин-4-(6H)-онів. До суспензії 10 ммоль 6аліл(пропаргіл)амінопіразоло[3,4-d]-піримідин-4ону в 5 мл оцтової кислоти додавали при кімнатній температурі розчин 7.61 г (30 ммоль) йоду в 600 мл оцтової кислоти і перемішували впродовж 24 год. Солеподібний осад відфільтровували, промивали гексаном, переносили у 50 мл ацетонітрилу і до отриманого розчину додавали при перемішу 49840 6 ванні 5 %-ний розчин сульфіту натрію до зникнення коричневого забарвлення. Суміш розчинників випарювали до 2/3 об'єму, осад, який утворився, відфільтровували, промивали дистильованою водою і сушили на повітрі. Приклад 6. 8-(Йодометил)-4-оксо-1-феніл-1,4,5,6,7,8гексагідроімідазо[1,2- ]піразоло-[4,3-e]піримідин-9ій пентайодид. Вихід 81 %, т.топл. 219-221°С. ІЧ спектр, см-1: 770, 860, 980, 1110, 1150, 1230, 1280, 1340, 1580, 1670, 1710. Спектр ЯМР 1Н, δ, м.ч.: 2.77-2.81 м (2Н, СН2), 3.49-3.53 м (1Н, СН), 4.014.08 м (1Н, СН), 4.58-4.66 м (1Н, СН), 7.67-7.74 м (5НАr), 8.36 с (1Н, СН). Знайдено, %: С 16.12; Н 1.39; N 7.00; І 74. 35. С14Н13I6N5О. Вирахувано, %: С 16.35; Н 1.27; N6.81; І 74.02. Приклад 7. 8-(Йодометил)-4-оксо-6-(проп-2-ен-1-іл)-1феніл-1,4,5,6,7,8-гексагідроімідазоло[1,2]піразоло[4,3-e]піримідин-9-ій пентайодид. Вихід 97 %, т.розкл. 194-196°С. ІЧ спектр, см-1: 770, 860, 980, 1280, 1580, 1670, 1720. Спектр ЯМР 1Н, δ, м.ч.: 2.72-2.83 м (2Н, СН2), 3.47-3.51 м (1Н, СН), 4.02-4.09 м (1Н, СН), 4.21-4.25 м (2Н, 2СН), 4.564.62 м (1H, СН), 5,33 д (1Н; СН J 11.1 Гц), 5,42 д (1Н; СН J 16.8 Гц), 5.79-5.92 м (1Н, СН), 7.66-7.74 м (5НАr), 8.30 с (1Н, СН). Знайдено, %: С 59.44; Н 5.16; N 14.09. C17H17I6N5O. Вирахувано, %: С 19.10; Н 1.60; N 6.55; І 71,24. Приклад 8. 8-(Йодометил)-7,8-дигідро-1H-імідазо[1,2]піразоло[4,3-е]піри-мідин-4(6Н)-он. Вихід 81 %, т.топл. 327-329°С. ІЧ спектр, см-1: 780, 850, 980, 1020, 1120, 1180, 1270, 1340, 1460, 1500, 1600, 3290. Спектр ЯМР 1Н, δ, м.ч.: 3.32-3.38 м (1Н, СН), 3.71-3.74 м (1Н, СН), 3.85-4.00 м (1Н, СН), 4.604.70 м (1Н, СН), 8.19 с (1Н, СН), 9.46-11.94 розмитий сигнал (1Н, СН). Спектр ЯМР 13С, δ, м.ч.: 10.04 (СН2), 47.23 (С7), 55.40 (С8), 102.34 (С3а), 128.21 (С3) 148.29 (С9а), 158.03 (С5а), 165.85 (С4). Знайдено, %: С 30.47; Н 2.70; N 22.19; І 39.66. C8H8IN5O. Вирахувано, %: С 30.30; Н 2.54; N 22.09; І 40.02. Приклад 9. 8-(Йодометил)-1-феніл-7,8-дигідро-1Німідазо[1,2- ]піразоло[4,3-е]піримідин-4(6Н)-он. Вихід 78 %, т.топл. 220-222°С. ІЧ спектр, см-1: 760, 780, 930, 960, 990, 1030, 1050, 1170, 1230, 1280, 1330, 1420, 1580,1640. Спектр ЯМР 1Н, δ, м.ч.: 2.58-2.64 м (1Н, СН), 2.77-2.81 м (1Н, СН), 3.253.29 м (1Н, СН), 3.79-3.86 м (1Н, СН), 4.45-4.54 м (1Н, СН), 7.59-7.77 м (5НАr), 7.99 с (1Н, СН), 8.269.15 розмитий сигнал (1Н, СН). Спектр ЯМР 13С, δ, м.ч.: 7.50 (СН2), 46.35 (С7), 56.59 (С8), 103.06 (С3а), 126.36 (2СНАr), 129.46 (2СНАr), 129.70 (СНАr), 137.26 (С3 + СAr), 141.32 (С9а), 157.25 (С6), 165.42 (С4). Знайдено, %: С 42.31; Н 3.16; N 18.03; І 32.60. C14H12IN5O. Вирахувано, %: С 42.77; Н 3.08; N 17.81; І 32.28. Приклад 10. 8-(Йодметил)-6-(проп-2-ен-1-іл)-7,8-дигідро1H-імідазо[1,2- ]піразоло[4,3-е]піримідин-4(6H)-он. Вихід 71 %, т.топл. 158-160°С. ІЧ спектр, см-1: 780, 940, 1080, 1180, 1270, 1330, 1370, 1410, 1440, 1510, 1530, 1590, 1640, 2930, 3340. Спектр ЯМР 1 Н, δ, м.ч.: 3.33-3.38 м (1Н, СН), 3.73-3.77 м (1Н, 7 49840 СН), 3.84-3.90 м (1Н, СН), 3.93-4.12 м (3Н, СН+СН2), 4.59-4.66 м (1H, СН), 5.24 д (1Н, СН, J 10.2 Гц), 5.34 д (1Н, СН, J 17.1 Гц), 5.77-5.90 м (1Н, СН), 8.18 с (1Н, СН), 13.20 уш.с (1Н, NH). Спектр 13 ЯМР С, δ, м.ч.: 10.17 (СН2), 45.99 (СН2), 51.04 7 (С ), 52.98 (С8), 102.76 (С3а), 117.93 (СН2), 132.28 (С3 + СН), 141.36 (С9а), 156.55 (С5а), 166.87 (С4). Знайдено, %: С 37.33; H 4.36; N 19.50; I 35.17. C11H12IN5O. Вирахувано, %: С 36.99; Н 3.39; N 19.61; 135.53. Приклад 11. 8-(Йодметил)-6-(проп-2-ен-1-іл)-1-феніл-7,8дигідро-1H-імідазо[1,2- ]піразоло[4,3-е]піримідин4(6H)-он. Вихід 93 %, т.топл. 235-237°С. ІЧ спектр, см-1: 720, 740, 760, 780, 940, 980, 1080, 1280, 1320, 1400, 1450, 1540, 1580, 1620, 1660. Спектр ЯМР 1 Н, δ, м.ч.: 2.57-2.61 м (1H, СН), 2.80-2.84 м (1Н, СН), 3.24-3.27 м (1Н, СН), 3.81-3.87 м (1Н, СН), 4.04 д (2Н, СН2, J 5.4 Гц), 4.44-4.49 м (1Н, СН), 5.25 д (1Н, СН, J 10.2 Гц), 5.33 д (1Н, СН, J 17.1 Гц), 5.77-5.91 м (1Н, СН), 7.59-7.75 м (5НАr) 8.00 с (1Н, СН). Спектр ЯМР 13С, δ, м.ч.: 7.49 (СН2), 46.39 (СН2), 50.49 (С7), 54.53 (С8), 103.05 (С3а), 118.38 (СН2), 126.25 (2СНАr), 129.46 (2СНАr), 129.79 (СНАr), 131.55 (СН), 137.14 (САr), 137.27 (С3), 141.36 (С9а), 154.96 (С5а), 164.87 (С4). Знайдено, %: С 47.33; Н 3.62; N 15.95; I 29.64. C17H16IN5O. Вирахувано, %: С 47.13; Н 3.72; N16.16; 129.29. Приклад 12. 8-(Йодометиліден)-1-феніл-7,8-дигідро-1Hімідазо[1,2- ]піразоло[4,3-e]піримідин-4(6H)-он. -1 Вихід 70 %, т.топл. 199-201°С. ІЧ спектр, см : 740, 760, 780, 820, 970, 1080, 1180, 1240, 1330, 1380, 1410, 1600, 1670, 2810, 3020, 3430. Спектр ЯМР 1 Н, δ, м.ч.: 4.12-4.17 м (2Н, СН2), 4.56-4.59 м (1Н, СНІ), 7.51-7.61 м (5НАr), 8.10 с (1Н, СН). Спектр ЯМР 13С, 5, м.ч.: 52.56 (С7), 64.61 (СШ), 102.86 (С3а), 125.73 (2СНАr), 130.32 (2СНАr), 131.72 (С9а), 132.35 (2НАr), 136.16 (С8), 139.38 (С3 + САr), 154.97 (С5а), 156.17 (С4). Знайдено, %: С 43.25; Н 2.72; N Комп’ютерна верстка Д. Шеверун 8 18.08; I 32.75. С15Н15N3О4. Вирахувано, %: С 42.94; Н 2.58; N 17.90; I 32.44. Література: 1. Хіа Y., Chackalamannil S., Czarniecki M., Tsai H., Vaccaro H., Cleven R., Cook J., Fawzi A., Watkins R., Zhang H. Synthesis and evaluation of polycyclic pyrazolo[3,4-d]pyrimidines as PDE1 and PDE5 cGMP phosphodiesterase inhibitors // J. Med. Chem. - 1997. - Vol.40, № 26, P. 4372-4377. 2. Beavo J.A. Cyclic nucleotide hosphodiesterases: functional implications of multiple isoforms // Physiol. Rev. - 1995. - Vol.75. - P. 725-748. 3. Syberts E.J., Czarniecki M, Ahn H.-S. cGMP phosphodiesterase inhibition: a new mechanism for the discovery of therapeutic agents // Curr. Pharm. Des. - 1995. - Vol. 1, № 3. - P. 373-390. 4. Syberts E.J., Ahn H.-S. Inhibitors of type I and IV phosphodiesterases : elevation of cGMP as a therapeutic strategy // Annu. Rep. Med. Chem. - 1996. Vol. 31. - P. 61-70. 5. Jiang M.X-W., Warshakoon N.C., Miller M.J. Chemoenzymatic asymmetric total synthesis of phosphodiesterase inhibitirs: preparation of a polycyclic pyrazolo[3,4-d]pyrimidine from an acylnitroso DielsAlder cycloadduct-derivatived aminocyclopentenol // J. Org. Chem. - 2005. - Vol. 70, № 7. - P. 2824-2827. 6. Robins R.K., Potential purine antagonists. IX. Futher studies of some 4,6-disubstituted pyrazolo[3,4d]pyrimidines // J. Amer. Chem. Soc - 1957. - Vol. 79. - P. 6407-6415. 7. Cheng C.C., Robins R.K. Potential purine antagonists. XII. Synthesis of l-alkyl(aryl)-4,6disubstituted pyrazolo[3,4-d]pyrimidines // J. Org. Chem. - 1958. - Vol. 23. - P. 852-861. 8. Albrecth С, Barnes S., Bockemeier H., Davis D., Dennis ML, Evans D.M., Fletcher M.D., Jones I., Leitmann V., Murphy P.J., Rowles R., Nash R., Stephenson R., Norton P.N., Hursthouse M.B. Tetrahedron Lett - 2008. - Vol. 49, № 1. - P. 185-188. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 8-iodomethyl(methylidene)-7,8-dihydro-1h-imidazo-[1,2-a]pyrazolo[4,3-f]pyrimidine-4-(6 h)-ones
Автори англійськоюBentia Anton Valentynovych, Vaskevych Ruslan Ivanovych, Stanynets Vasyl Ivanovych, Vovk Mykhailo Volodymyrovych
Назва патенту російськоюСпособ получения 8-йодометил(метилиден)-7,8-дигидро-1н-имидазо-[1,2-а]пиразоло[4,3-е]пиримидин-4-(6н)-онов
Автори російськоюБентя Антон Валентинович, Васькевич Руслан Иванович, Станинец Василий Иванович, Вовк Михаил Владимирович
МПК / Мітки
МПК: C07D 231/00, C07D 235/00, C07D 239/00
Мітки: спосіб, одержання, 8-йодометил(метиліден)-7,8-дигідро-1н-імідазо-[1,2-а]піразоло[4,3-е]піримідин-4-(6н)-онів
Код посилання
<a href="https://ua.patents.su/4-49840-sposib-oderzhannya-8-jjodometilmetiliden-78-digidro-1n-imidazo-12-apirazolo43-epirimidin-4-6n-oniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 8-йодометил(метиліден)-7,8-дигідро-1н-імідазо-[1,2-а]піразоло[4,3-е]піримідин-4-(6н)-онів</a>
Попередній патент: Спосіб виготовлення декоративних виробів
Наступний патент: Інструмент для виділення грижового мішка при пластиці післяопераційної вентральної грижі
Випадковий патент: Спосіб термічної обробки рейок








