Похідні хіноліну й ізохіноліну, їх застосування як інгібіторів запалення, фармацевтичний препарат на їх основі
Номер патенту: 78304
Опубліковано: 15.03.2007
Автори: Шеке Хайке, Ярох Штефан, Ревінкель Хартмут, Леманн Манфред, Шмеес Норберт, Кролікієвіч Конрад, Шоттеліус Арндт, Скубалла Вернер, Бергер Маркус
Формула / Реферат
1. Сполуки загальної формули I
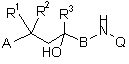 , (I)
, (I)
у якій
А означає арильну, бензильну або фенетильну групу, кожна з яких необов'язково може бути заміщена одним або декількома залишками із групи, яка включає C1-C5алкіл, C1-C5алкоксигрупу, C1-C5алкілтіогрупу, C1-C5перфторалкіл, галоген, гідроксигрупу, ціаногрупу, нітрогрупу, -O-(CH2)n-O-, -O-(CH2)n-CH2-, -O-CH=CH-, -(CH2)n+2-, де n означає 1 або 2, а кінцеві атоми кисню та/або атоми вуглецю з'єднані з безпосередньо розташованими поруч вуглецевими атомами кільця, або групу NR4R5, де R4 й R5 незалежно один від одного можуть являти собою водень, C1-C5алкіл або (CO)-C1-C5алкіл,
R1 й R2 незалежно один від одного являють собою атом водню, метильну або етильну групу або разом з вуглецевим атомом ланцюга утворюють С3-C6циклоалкільне кільце,
R3 являє собою C1-C3алкільну групу або за певних умов частково або повністю фторовану C1-C3алкільну групу,
В означає необов'язково заміщену метильною або етильною групою метиленову групу або карбонільну групу, й
Q означає приєднану через будь-яке положення хінолінільну або ізохінолінільну групу, яка необов'язково може бути заміщена одним або декількома залишками із групи, яка включає C1-C5алкіл, який необов'язково може бути заміщений 1-3 гідроксигрупами та/або 1-3 СООR6-групами, C1-C5алкоксигрупу, C1-C5алкілтіогрупу, C1-C5перфторалкіл, галоген, гідроксигрупу, кисневий атом карбонілу, ціаногрупу, нітрогрупу, групу NR4R5, де R4 й R5 незалежно один від одного можуть являти собою водень, C1-C5алкіл або (СО)-C1-C5алкіл, групу СООR6, де R6 являє собою водень або C1-C5алкільну групу, групу (СО)NR7R8, де R7 й R8 незалежно один від одного являють собою водень або C1-C5алкільну групу, (C1-C5алкілен)-О-(СО)-(C1-C5)алкіл,
а також їх рацемати або представлені окремо стереоізомери й необов'язково їх фізіологічно сумісні солі.
2. Сполуки за п. 1, у яких Q означає приєднану через будь-яке положення хінолінільну або ізохінолінільну групу, яка необов'язково може бути заміщена одним або декількома залишками із групи, яка включає С1-C5алкіл, який необов'язково може бути заміщений 1-3 гідроксигрупами або 1-3 СООR6-групами, кисневий атом карбонілу, групу СООR6, де R6 являє собою водень або С1-C5алкільну групу, групу (CO)NR7R8, де R7 й R8 незалежно один від одного являють собою водень або C1-C5алкільну групу, (C1-C5алкілен)-O-(CO)-(C1-C5)алкільну групу.
3. Сполуки загальної формули I за п. 1:
 , (I)
, (I)
у якій
А означає арильну, бензильну або фенетильну групу, кожна з яких необов'язково може бути заміщена одним або декількома залишками із групи, яка включає C1-C5алкіл, C1-C5алкоксигрупу, C1-C5алкілтіогрупу, C1-C5перфторалкіл, галоген, гідроксигрупу, ціаногрупу, нітрогрупу, -O-(CH2)n-O-, -O-(CH2)n-CH2-, -O-CH=CH-, -(CH2)n+2-, де n означає 1 або 2, а кінцеві атоми кисню та/або атоми вуглецю з'єднані з безпосередньо розташованими поруч вуглецевими атомами кільця, групу NR4R5, де R4 й R5 незалежно один від одного можуть являти собою водень, C1-C5алкіл або (CO)-C1-C5алкіл,
R1 й R2 незалежно один від одного являють собою атом водню, метильну або етильну групу або разом з вуглецевим атомом ланцюга утворюють С3-C6циклоалкільне кільце,
R3 являє собою C1-C3алкільну групу або за певних умов частково або повністю фторовану C1-C3алкільну групу,
В означає необов'язково заміщену метильною або етильною групою метиленову групу або карбонільну групу, й
Q означає приєднану через будь-яке положення хінолінільну або ізохінолінільну групу, яка необов'язково може бути заміщена одним або декількома залишками із групи, яка включає C1-C5алкіл, C1-C5алкоксигрупу, C1-C5алкілтіогрупу, C1-C5перфторалкіл, галоген, гідроксигрупу, ціаногрупу, нітрогрупу і групу NR4R5, де R4 й R5 незалежно один від одного можуть являти собою водень, C1-C5алкіл або (СО)-C1-C5алкіл,
а також їх рацемати або представлені окремо стереоізомери й необов'язково їх фізіологічно сумісні солі.
4. Сполуки за п. 2 або 3, у яких В означає метиленову групу.
5. Сполуки за п. 2 або 3, у яких А означає арильний залишок.
6. Сполуки за п. 5, у яких А означає арильний залишок, який необов'язково може бути заміщений одним або декількома залишками із групи, яка включає С1-C5алкіл, С1-C5алкоксигрупу, С1-C5перфторалкіл, галоген, гідроксигрупу, нітрогрупу, -O-(CH2)n-O-, -O-(CH2)n-CH2-, -O-CH=CH- і -(CH2)n+2-, де n означає 1 або 2, а кінцеві атоми кисню та/або атоми вуглецю з'єднані з безпосередньо розташованими поруч вуглецевими атомами кільця.
7. Сполуки за п. 2 або 3, у яких R1 й R2 разом з вуглецевим атомом ланцюга утворюють С3-C6циклоалкільне кільце.
8. Сполуки за п. 2 або 3, які відрізняються тим, що Q означає приєднану через будь-яке положення необов'язково заміщену хінолінільну групу.
9. Сполуки за п. 5, які відрізняються тим, що А означає заміщений гідроксигрупою або метоксигрупою й атомом галогену фенільний залишок.
10. Сполуки за п. 1, які відрізняються тим, що вони являють собою (+)-енантіомери.
11. Сполуки за п. 1, які відрізняються тим, що вони являють собою
(–)-енантіомери.
12. Застосування сполук за п. 1 для одержання відповідних лікарських засобів.
13. Застосування сполук за п. 1 для одержання лікарського засобу, призначеного для лікування запальних захворювань.
14. Фармацевтичний препарат, який містить принаймні одну сполуку за п. 1 або суміші таких сполук, а також фармацевтично прийнятні носії.
Текст
1. Сполуки загальної формули I H N ЗАСТОСУВАННЯ (19) 1 R R3 A61P 21/00 A61P 25/00 A61P 27/02 (2007.01) A61P 27/16 (2007.01) A61P 29/00 A61P 31/04 (2007.01) A61P 31/12 (2007.01) A61P 31/20 (2007.01) A61P 35/00 A61P 35/02 (2007.01) A61P 37/02 (2007.01) A61P 37/06 (2007.01) A61P 37/08 (2007.01) A61P 43/00 C07D 215/40 (2007.01) C07D 215/42 (2007.01) C07D 217/22 (2007.01) C07D 217/24 (2007.01) C07D 405/12 (2007.01) ДО ПАТЕНТУ НА ВИНАХІД (54) ПОХІДНІ ХІНОЛІНУ Й ІЗОХІНОЛІНУ, ЇХ ФАРМАЦЕВТИЧНИЙ ПРЕП АРАТ НА ЇХ ОСНОВІ 1 C2 ОПИС ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ R (13) 3 78304 4 атом карбонілу, ціаногрупу, нітрогр упу, гр упу Q означає приєднану через будь-яке положення NR4R5, де R4 й R5 незалежно один від одного мохінолінільну або ізохінолінільну групу, яка необожуть являти собою водень, C1-C5алкіл або (СО)в'язково може бути заміщена одним або декількоC1-C5алкіл, групу СООR6, де R6 являє собою вома залишками із групи, яка включає C1-C5алкіл, C1день або C1-C5алкільну групу, груп у (СО)NR7R8, де C5алкоксигрупу, C1-C5алкілтіогрупу, C1R7 й R8 незалежно один від одного являють собою C5перфторалкіл, галоген, гідроксигрупу, ціаногруводень або C1-C5алкільну груп у, (C1-C5алкілен)-Опу, нітрогруп у і груп у NR4R5, де R4 й R5 незалежно (СО)-(C1-C5)алкіл, один від одного можуть являти собою водень, C1а також їх рацемати або представлені окремо стеC5алкіл або (СО)-C1-C5алкіл, реоізомери й необов'язково їх фізіологічно сумісні а також їх рацемати або представлені окремо стесолі. реоізомери й необов'язково їх фізіологічно сумісні 2. Сполуки за п.1, у яких Q означає приєднану чесолі. рез будь-яке положення хінолінільну або ізохінолі4. Сполуки за п.2 або 3, у яких В означає метиленільну груп у, яка необов'язково може бути заміщенову гр уп у. на одним або декількома залишками із групи, яка 5. Сполуки за п.2 або 3, у яких А означає арильний включає С 1-C5алкіл, який необов'язково може бути залишок. заміщений 1-3 гідроксигрупами або 1-3 СООR66. Сполуки за п.5, у яких А означає арильний загрупами, кисневий атом карбонілу, груп у СООR6, лишок, який необов'язково може бути заміщений де R6 являє собою водень або С 1-C5алкільну груодним або декількома залишками із групи, яка пу, груп у (CO)NR 7R8 , де R7 й R8 незалежно один включає С 1-C5алкіл, С1-C5алкоксигрупу, С1від одного являють собою водень або C1C5перфторалкіл, галоген, гідроксигрупу, нітрогруC5алкільну групу, (C1-C5алкілен)-O-(CO)-(C1пу, -O-(CH2)n-O-, -O-(CH2) n-CH2-, -O-CH=CH- і C5)алкільну груп у. (CH2)n+2-, де n означає 1 або 2, а кінцеві атоми 3. Сполуки загальної формули I за п. 1: кисню та/або атоми вуглецю з'єднані з безпосере2 1 дньо розташованими поруч вуглецевими атомами R R3 R H кільця. N (I) 7. Сполуки за п.2 або 3, у яких R1 й R2 разом з вугB Q A лецевим атомом ланцюга утворюють С 3HO , C6циклоалкільне кільце. у якій 8. Сполуки за п.2 або 3, які відрізняються тим, А означає арильну, бензильну або фенетильну що Q означає приєднану через будь-яке положенгруп у, кожна з яких необов'язково може бути заміня необов'язково заміщену хінолінільну гр упу. щена одним або декількома залишками із групи, 9. Сполуки за п.5, які відрізняються тим, що А яка включає C1-C5алкіл, C1-C5алкоксигрупу, C1означає заміщений гідроксигрупою або метоксигC5алкілтіогрупу, C1-C5перфторалкіл, галоген, гідрупою й атомом галогену фенільний залишок. роксигрупу, ціаногрупу, нітрогр упу, -O-(CH2)n-O-, 10. Сполуки за п.1, які відрізняються тим, що O-(CH2)n-CH2-, -O-CH=CH-, -(CH 2)n+2-, де n означає вони являють собою (+)-енантіомери. 1 або 2, а кінцеві атоми кисню та/або атоми вугле11. Сполуки за п.1, які відрізняються тим, що цю з'єднані з безпосередньо розташованими поруч вони являють собою вуглецевими атомами кільця, групу NR4R5, де R4 й (–)-енантіомери. R5 незалежно один від одного можуть являти со12. Застосування сполук за п.1 для одержання бою водень, C1-C5алкіл або (CO)-C1-C5алкіл, відповідних лікарських засобів. 1 2 R й R незалежно один від одного являють собою 13. Застосування сполук за п.1 для одержання атом водню, метильну або етильну групу або ралікарського засобу, призначеного для лікування зом з вуглецевим атомом ланцюга утворюють С 3запальних захворювань. C6циклоалкільне кільце, 14. Фармацевтичний препарат, який містить приR3 являє собою C1-C3алкільну групу або за певних наймні одну сполуку за п.1 або суміші таких споумов частково або повністю фторовану C1лук, а також фармацевтично прийнятні носії. C3алкільну груп у, В означає необов'язково заміщену метильною або етильною групою метиленову груп у або карбонільну груп у, й Даний винахід стосується похідних хіноліну й ізохіноліну, способу їх одержання і їх застосування як інгібіторів запалення. З рівня техніки, зокрема із [заявок DE 10038639 й WO 02/10143], відомі інгібітори запалення загальної формули (I) де залишок бензоксазинони їх застосуванні нях проявляють Аr включає фталіди, тіофталіди, або фталазинони. Ці сполуки при в експериментальних дослідженрізну активність у відношенні про 5 78304 6 тизапальних і небажаних метаболічних ефектів і кільці 1-3 замісники, переважно 2 замісники. тим самим вони перевершують описані дотепер Наступні схеми заміщення в кільці А є особлинестероїдні глюкокортикоїди або мають принаймні вим об'єктом винаходу: 2,5-двозаміщені фенільні таку ж хорошу дію. Однак вибірність подібних спопохідні й 2,4-двозаміщені фенільні похідні, причолук з рівня техніки по відношенню до інших стероїму положення 1 зайняте сполукою з ланцюгом. дних рецепторів вимагає подальшого удосконаОсобливим об'єктом винаходу є сполуки, які лення. Виходячи із цього, в основу даного несуть в арильному залишку один або декілька винаходу була покладена задача запропонувати замісників із групи, яка включає С1-С5алкіл, С1сполуки з поліпшеною вибірністю по відношенню С5алкоксигрупу, С1-С5перфторалкіл, галоген, гіддо інших стероїдних рецепторів. Вказана задача роксигрупу, нітрогрупу, -О-(СН2) n-О-, -О-(СН2)nвирішується за допомогою сполук, охарактеризоСН2- і -О-СН=СН - і -(СН2)n+2-, где n означає 1 або ваних у формулі винаходу. 2, а кінцеві атоми кисню та/або атоми вуглецю Відповідно до цього даний винахід стосується з'єднані з безпосередньо розташованими поруч сполук загальної формули І вуглецевими атомами кільця. До найбільш переважних належать сполуки формули І, де А означає фенільне кільце, яке до(I) датково до сполуки з ланцюгом заміщене гідроксиабо метоксигрупою і галогеном. С1-С5алкільні групи в групі A, R3 , R4, R 5, R6, R7 у якій й R8 можуть мати прямий або розгалужений ланА означає арильну, бензильну або фенетильцюг й являти собою метальну, етильну, нну гр уп у, кожна з яких необов'язково може бути пропільну, ізопропільну, н-бутильну, ізобутильну, заміщена одним або декількома залишками із грутрет-бутильну, н-пентильну, 2,2пи, яка включає С1-С5алкіл, С1-С5алкоксигрупу, С1диметилпропільну, 2-метилбутильну або 3С5алкілтіогрупу, С1-С5перфторалкіл, галоген, гідметилбутильну груп у, переважною з яких є метилроксигрупу, ціаногрупу, нітрогр упу, -О-(СН2)n-О-, ьна або етильна група. За певних умов вони моO-(CH2)n-CH2-, -O-CH=CH-, -(СН2)n+2-, де n означає жуть бути заміщені 1-3 гідроксигрупами та/або 1-3 1 або 2, а кінцеві атоми кисню та/або атоми вуглеСОOR6-гр упами. Переважні з них гідроксигрупи. цю з'єднані з безпосередньо розташованими поруч Під (С1-С5алкілен)-О-(СО)-(С1-С5)алкільною вуглецевими атомами кільця, або групу NR4R5, де групою мається на увазі, наприклад, -СН2-О-СО4 5 R й R незалежно один від одного можуть являти СН3-група. собою водень, С1-С5алкіл або (СО)-С1-С5алкіл, Як частково або повністю фторована С 11 2 R й R незалежно один від одного являють С3алкільна група можуть розглядатися наступні собою атом водню, метальну або етильну гр упу частково або повністю фторовані групи: фтормеабо разом з вуглецевим атомом ланцюга утворютил, дифторметил, трифторметил, фторетил, 1,1ють С3-С6циклоалкільне кільце, дифторетил, 1,2-дифторетил, 1,1,1-трифторетил, 3 R являє собою С1-С3алкільну груп у або за пететрафторетил і пентафторетил. Переважною з вних умов частково або повністю фторовану С 1них є трифторметильна або пентафторетильна С3алкільну груп у, група. В означає необов'язково заміщену метильною Алкільні залишки R1 й R2 можуть утворювати або етильною групою метиленову груп у або карразом з вуглецевим атомом ланцюга 3-6-членне бонільну груп у й кільце. Переважним є циклопропільне кільце. Q означає приєднану через будь-яке полоСрСзалкоксигрупи в групах А та Q можуть маження хінолінільну або ізохінолінільну групу, яка ти прямий або розгалужений ланцюг й являти сонеобов'язково може бути заміщена одним або дебою метокси-, етокси-, н-пропокси-, ізопропокси-, кількома залишками із групи, яка включає С1н-бутокси-, ізобутокси-, трет-бутокси-, н-пентокси-, С5алкіл, який необов'язково може бути заміщений 2,2-диметилпропокси-, 2-метилбутокси- або 36 1-3 гідроксигрупами та/або 1-3 СОOR -групами, метилбутоксигрупу. Переважною з них є метоксиС1-С5алкоксигрупу, С1-С5алкілтіогрупу, С1або етоксигрупа. С5перфторалкіл, галоген, гідроксигрупу, кисневий С1-С5алкілтіогрупи в групах А та Q можуть маатом карбонілу, ціаногрупу, нітрогр упу, гр упу ти прямий або розгалужений ланцюг й являти со4 5 4 5 NR R , де R й R незалежно один від одного мобою метилтіо-, етилтіо-, н-пропілтіо-, ізопропілтіо-, жуть являти собою водень, С1-С5алкіл або (СО)н-бутилтіо-, ізобутилтіо-, трет-бутилтіо-, н6 6 С1-С5алкіл, групу COOR , де R являє собою вопентилтіо-, 2,2-диметилпропілтіо-, 27 8 день або С1-С5алкільну групу, груп у (CO)NR R , де метилбутилтіо- або 3-метилбутилтіогр упу. Пере7 8 R й R незалежно один від одного являють собою важною з них є метилтіо- або етилтіогрупа. водень або С1-С5алкільну груп у, (С1-С5алкілен)-ОПоняттям "атом галогену", відповідно "галоген" (СО)-(С1-С5)алкіл, позначають атом фтору, хлору, брому або йоду. а також їх рацематів або представлених окреПереважним є атом фтору, хлору або брому. мо стереоізомерів і необов'язково їх фізіологічно Група NR4R5 може являти собою, наприклад, сумісних солей. NH2, N(H)CH3, N(CH3)2, N(H)(CO)CH3, Як група А переважною є арильна група. АриN(CH3)(CO)CH3, N[(CO)CH3]2, N(H)CO2CH3, льна група включає феніл і нафтил, переважний з N(CH3)CO2CH3 або N(CO2CH3)2. яких феніл. Як алкільні залишки R4 й R5 переважний С 1Заміщені арильні, бензильні або фенетильні С3алкіл, а як ацильні залишки R4 й R5 переважний групи додатково до сполуки з ланцюгом несуть у (СО)-С1-С3алкіл. 7 78304 8 Як група NR7R8 може розглядатися, напригруп у. клад, NH2, N(H)CH3, N(CH3)2, N(C2H5)2, NH(C2H5), Об'єктом винаходу є сполуки, у яких В означає N(C3H7)2, N(C 4H9)2 або N(C 5H11)2. метиленову гр упу, a Q означає необов'язково заПереважними для залишку В є метиленова міщену хінолінільну гр упу. група й карбонільна група. Особливо переважна з Ще одним об'єктом винаходу є сполуки, у яких них метиленова група. А означає необов'язково заміщену фенільну групу, Об'єктом винаходу є сполуки загальної форQ означає необов'язково заміщену хінолінільну мули І, у якій Q означає приєднану через будь-яке груп у, а В означає метиленову груп у. положення, необов'язково заміщену хінолінільну Запропоновані у винаході сполуки загальної груп у. формули І завдяки наявності асиметричних Залишок Q через будь-який вуглецевий атом центрів можуть бути представлені у вигляді різних кільця може бути з'єднаний з (NH)-групою ланцюстереоізомерів. Як рацемати, так і представлені га. Переважними для хінолінового кільця є полоокремо стереоізомери є об'єктом даного винаходу. ження 4, 5 й 8, а для ізохінолінового кільця - полоОсобливим об'єктом даного винаходу є предження 1. ставлені окремо стереоізомери, тобто (+)Ще одним об'єктом винаходу є сполуки загаенантіомери й (-)-енантіомери. льної формули І, у якій А означає арильну, бензиКрім того, запропоновані у винаході сполуки в льну або фенетильну груп у, кожна з яких необотих випадках, коли вони містять гідроксигрупу в αв'язково може бути заміщена одним або положенні по відношенню атома азоту хінолінілу декількома залишками із групи, яка включає С1або ізохінолінілу, відрізняються наявністю кетоС5алкіл, С1-С5алкоксигрупу, С1-С5алкілтіогрупу, С1єнольної таутомерії. Відповідно до винаходу обидС5перфторалкіл, галоген, гідроксигрупу, ціаногруві форми є об'єктом винаходу, навіть якщо, наприпу, нітрогруп у, -О-(СН2) n-О-, -О-(СН2)n-СН2-, -Оклад в експериментальній частині, представлена СН=СН-, -(СН2)n+2-, де n означає 1 або 2, а кінцеві тільки одна з обох та утомерних форм. атоми кисню та/або атоми вуглецю з'єднані з безДаний винахід стосується також способу одепосередньо розташованими поруч вуглецевими ржання сполук формули І, а також їх застосування атомами кільця, або групу NR4R5, де R4 й R5 незаяк лікарських засобів. Застосування вказаних сполежно один від одного можуть являти собою волук для одержання лікарських засобів, призначедень, С1-С5алкіл або (СО)-С1-С5алкіл, них для лікування захворювань, так чи інакше зуR1 й R2 незалежно один від одного являють мовлених запальними процесами, також є собою атом водню, метильну або етильну гр упу об'єктом винаходу. або разом з вуглецевим атомом ланцюга утворюСпособи одержання сполук, відомі [із заявок ють С3-С6циклоалкільне кільце, WO 98/54159, WO 00/32584 й WO 02/10143], моR3 являє собою С1-С3алкільну груп у або за пежуть використовуватися також для одержання вних умов частково або повністю фторовану С 1запропонованих у даному винаході сполук. Для С3алкільну груп у, приєднання характерної для сполук відповідно до В означає необов'язково заміщену метильною винаходу хінолінової або ізохінолінової групи можабо етильною групою метиленову груп у або карна проводити наступні операції: бонільну груп у й A1) Для випадку, коли В означає СО Q означає приєднану через будь-яке положення хінолінільну або ізохінолінільну групу, яка необов'язково може бути заміщена одним або декількома залишками із групи, яка включає С1С5алкіл, С1-С5алкоксигрупу, С1-С5алкілтіогрупу, С1a-Кетокислоту загальної формули II, де A, R1 й С5перфторалкіл, галоген, гідроксигрупу, ціаногру2 R мають значення, вказані для формули (І), за пу, нітрогруп у і груп у NR4R5, де R4 й R5 незалежно допомогою амінохіноліну, аміноізохіноліну або один від одного можуть являти собою водень, С1(частково) гідрованого похідного хіноліну, відповіС5алкіл або (CO)-С1-С5алкіл, дно ізохіноліну (Q-NH2) за відомою фахівцю метоа також їх рацемати або представлені окремо дикою переводять в a-кетоамід формули (III), де A, стереоізомери й необов'язково їх фізіологічно суR1 й R2 мають вказані вище значення. Так, напримісні солі. клад, використовуючи дегідратуючі агенти сполуЩе одним об'єктом винаходу є сполуки загачення, які відомі з хімії пептидів, такі як дициклогельної формули І, де Q означає приєднану через ксилкарбодіімід, або за рахунок попереднього будь-яке положення хінолінільну або ізохінолінільперетворення кислоти у відповідний хлорангідрид ну гр упу, яка необов'язково може бути заміщена кислоти, наприклад за допомогою тіонілхлориду одним або декількома залишками із групи, яка або РОСl3, і наступної взаємодії з Q-NH2 одержувключає С 1-С5алкіл, який необов'язково може бути 6 ють а-кетоамід (III) заміщений 1-3 гідроксигрупами або 1-3 СОOR групами, кисневий атом карбонілу, груп у COOR6, де R6 являє собою водень або С 1-С5алкільну групу, груп у (CO)NR 7R8 , де R7 й R8 незалежно один від одного являють собою водень або С 1Сполуку (III) або з використанням сполуки луС5алкільну групу, (С1-С5алкіл)-О-(СО)-(С1жного металу, наприклад реактиву Гриньяра або С5)алкільну груп у. алкіллітію, або реакцією зі сполукою формули (IV) Об'єктом винаходу є сполуки загальної фор(R9)3Si-R3 (IV) мули І, де Q означає однозаміщену хінолінільну де R3 має вказане вище значення, a R9 являє 9 78304 10 собою С 1-С5алкільну груп у, у присутності каталізачення, a LG означає будь-яку груп у, яка вилучатора, наприклад фторидних солей або основ, тається, таку як галогенід або сульфонат, з метою ких, зокрема, як карбонати лужних металів [Journ. одержання вказаної в заголовку сполуки формули Am. Chem. Soc. Ill, 1989, с.393], перетворюють у (І) піддають взаємодії зі сполукою загальної форвказану в заголовку сполук у формули (І). мули (IX) або (X) А2) Для випадку, коли В означає СО Як альтернатива ті ж a-кетокислоти (II) можна за звичайними методами, наприклад за допомогою тіонілхлориду в метанолі або етанолі або за допомогою метилйодиду й карбонату лужного металу, етерифікувати із утворенням сполук формули (V) де A, R1 й R2 мають вказані вище значення, a R являє собою С 1-С4алкіл, і потім аналогічно до описаної в розділі А1) і послідовно здійснюваної реакції при одержанні зі сполуки (III) сполуки (І) перетворювати їх у сполуку формули (VI). 10 Складний ефір у стандартних умовах, наприклад з використанням водного розчину гідроксиду лужного металу, омиляють з утворенням кислоти (VI; R10 означає Н). Потім цю кислоту за реакцією сполучення взаємодією з амінохіноліном або аміноізохіноліном або (частково) гідрованим похідним хіноліну, відповідно ізохіноліну (Q-NH2) з використанням звичайного активатора реакції, наприклад тіонілхлориду, при необхідності в присутності каталізатора, такого як диметиламінопіридин, перетворюють у вказану в заголовку сполуку формули (І). Б) Для випадку, коли В означає необов'язково заміщену метилом або етилом метиленову гр упу а) Сполуку загальної формули (VII) або (VIII) де А, В, R1, R2 й R3 мають вказані вище зна де R12 являє собою атом водню, С1-С5ацильну груп у або алкокси- або арилоксикарбонильну групу, a Q має вказане вище значення, при цьому залишок R12 відщеплюють або, оксазолідинон, який утворюється як проміжний продукт, [порівн., наприклад, SJ. Brickner, D.K. Hutchinson, M.R. Barbachyn, P.R. Manninen, D.A. Ulanowicz, S.A. Gannon, K.C. Grega, S.K. Hendges, D.S. Toops, C.W. Ford, G.E. Zurenko, Journ. Med. Chem. 39, 1996, с.673] розщеплюють, наприклад, за допомогою водних гідроксидів лужних металів. б) Відповідно до іншого варіанта сполуки формули (VII) або (VIII) піддають взаємодії з азотними нуклеофілами, наприклад з азидними солями або аміаком, при цьому в першому випадку потім здійснюють реакцію відновлення, яка здійснюється за відомою фахівцю методикою, наприклад за допомогою комплексних гідридів, таких як алюмогідрид літію, або каталізований перехідним металом гідрогеноліз, з одержанням у результаті сполук формули (XI) Залишки R1-R3, А й В у наведеній формулі мають значення, ідентичні до вказаних вище. в) Сполуку формули (XI) при каталізі основами, наприклад у присутності третинних амінооснов або карбонатів або гідроксидів лужних металів, або при каталізі перехідними металами, наприклад паладієвому каталізі [J.P. Wolfe, S. Wagaw, J.F. Marcoux, S.L. Buchwald, Ace. Chem. Res. 31, 1998, c.805; J.F. Hartwig, Ace. Chem. Res. 31, 1998, с.852], можна переводити з використанням галогенізованого хіноліну або ізохіноліну у вказану в заголовку сполуку формули (І). г) На завершення слід назвати ще одну можливість одержання вказаної в заголовку сполуки формули (І), який полягає в тому, що її синтезують шляхом відновного амінування сполуки формули (XII) за допомогою Q-NH2, використовуючи при цьому як відновник, наприклад ціаноборогідрид натрію або триацетоксиборогідрид натрію. R11 у наведеній формулі являє собою метил або етил відповідно до значень замісників, вказаних в розділі Б) для метиленової групи. У тих випадках, коли сполуки загальної формули (І) представлені у вигляді солей, такими солями можуть бути, наприклад, гідрохлориди, сульфати, нітрати, фосфати, півалати, малеати, фумарати, тартрати, бензоати, мезилати, цитрати або сукцинати. 11 78304 12 Якщо запропоновані у винаході сполуки предактивність еластази як міру визначення дифузії ставлені у вигляді рацемічних сумішей, то за донейтрофільних гранулоцитів. Як було встановлено помогою звичайних, відомих фахівцеві методів в ході проведених дослідів, сполуки загальної форозділення рацематів їх можна розділяти на чисті, рмули І здатні пригнічувати всі три вказані парамеоптично активні форми. Так, наприклад, рацемічні три запалення як при місцевому, так і системному суміші можна розділяти хроматографією на носії, застосуванні. який вже має оптичну активність (матеріал Одним з небажаних ефектів, які найбільш часCHIRALPAK AD ®), на чисті ізомери. Інша можлито проявляються при глюкокортикоїдної терапії, є вість полягає в тому, що вільну гідроксигрупу в так званий "стероїдний діабет" [порівн. Hatz, HJ, складі рацемічної сполуки загальної формули І Glucocorticoide: Immunologische Grundlagen, етерифікують оптично активною кислотою, після Pharmakologie und Therapierichtlinien, вид-во чого отримані складні діастереоізомерні ефіри Wissenschafliche Verlagsgesellschaft mbH, Stuttgart розділяють шляхом фракціонованої кристалізації (1998)]. Причина даного ефекту зумовлена стимуабо хроматографічним шляхом і розділені ефіри ляцією глюконеогенезу в печінці в результаті індуомиляют відповідно з утворенням оптично чистих кції відповідальних за це ферментів і дією вільних ізомерів. Як оптично активна кислота може викоамінокислот, які утворюються при розщепленні ристовуватися, наприклад, мигдалева кислота, білків (катаболічна дія глюкокортикоїдів). Ключокамфорсульфонова кислота або винна кислота. вим ферментом катаболічного обміну речовин у Зв'язування сполук із глюкокортикоїдним репечінці є тирозин-амінотрансфераза (ТАТ). Активцептором (GR) і з іншими рецепторами стероїдних ність даного ферменту можна виявляти фотометгормонів (мінералкортикоїдним рецептором (MR), ричним шляхом на гомогенатах печінки, і цей попрогестероновим рецептором (PR) і андрогенним казник є достовірною мірою для визначення рецептором (AR)) досліджують за допомогою небажаних метаболічних ефектів глюкокортикоїотриманих рекомбінатним шляхом рецепторів. У дів. Для дослідження індукції ТАТ тварин через цих дослідженнях використовують цитозольні пре8год. після обробки тестованими сполуками умерпарати клітин Sf9, інфікованих рекомбінатними твляють, видаляють у них печінку й на гомогенаті бакуловірусами, які кодують GR. На відміну від визначають активність ТАТ. У ході дослідів було порівняльної субстанції [3Н]-дексаметазону сполувстановлено, що сполуки загальної формули І при ки за винаходом проявляють афінність до GR, їх застосуванні в дозах, у яких вони проявляють ступінь якої змінюється від високої до дуже висопротизапальну ефективність, не індукують тирокої. зин-амінотрансферазу зовсім або індукують її лиКрім того, описані в даній заявці хіноліни й ізоше в мінімальному ступені. хіноліни формули І мають високу вибірність по Завдяки своїй протизапальній й додатково до відношенню до глюкокортикоїдного рецептора. цієї протиалергічної, імуносупресивної й антипроТак, сполука, представлена в прикладі 4, характеліферативної дії запропоновані у винаході сполуки ризується наступним профілем дії: IC50(GR)=0,6загальної формули І можуть застосовуватися як 1,3нМ; IC50(MR), IC 50(PR), IC50(AR)>1мкМ. медикаменти для лікування або профілактики наЯк важливий, молекулярний механізм протиступних захворювань ссавців тварин і людини. При запальної дії глюкокортикоїдів розглядається опоцьому під поняттям "ЗАХВОРЮВАННЯ" маються середковане рецептором GR пригнічення трансна увазі наступні показання: крипції цитокінів, адгезійних молекул, ферментів й 1) захворювання легень, які супроводжуються інших факторів, які сприяють запальним процесам. запальними, алергічними та/або проліферативниЦе пригнічення ініціюється взаємодією GR з іншими процесами: ми факторами транскрипції, наприклад АР-1 й NF- хронічно обструктивні захворювання легень каппа-В [див. оглядову статтю Cato, АСВ and Wade будь-якого генезу, насамперед бронхіальна астма, Ε, в BioEssays 18, 1996, стор.371-378]. - бронхіт різного генезу, Запропоновані у винаході сполуки загальної - всі форми рестриктивних захворювань леформули І інгібують стимульовану ліпополісахагень, насамперед алергічний альвеолит, ридом (ЛПС) секрецію цитокіну IL-8 у людських - всі форми набряку легень, насамперед токмоноцитах лінії ТНР-1. Концентрацію цитокінів сичний набряк легень, визначали в супернатанті за допомогою комерцій- саркоїдози й гранулематози, насамперед но доступного набору для ELISA-аналізу (твердохвороба Бека; фазного імуноферментного аналізу). 2) ревматичні захворювання/аутоімунні захвоПротизапальну ефективність сполук загальної рювання/захворювання суглобів, які супроводжуформули І досліджували в досвідах на тварин ються запальними, алергічними та/або проліфера(щурах і мишах) на прикладі запалення, індуковативними процесами: ного кротоновим маслом [Journ. Exp. Med. 182, - всі форми ревматичних захворювань, насам1995, стор.99-108]. Із цією метою вуха піддослідперед ревматоїдний артрит, гостра ревматична них тварин (місцеве застосування) обробляли лихоманка, ревматична поліміалгія, розчином кротонового масла в етанолі. Обробку - реактивний артрит, досліджуваними сполуками (також при місцевому - запальні захворювання м'яких тканин іншого або системному застосуванні) проводили одночагенезу, сно або за дві години до обробки кротоновим мас- артритні симптоми при дегенеративних залом. Через 16-24год. вимірювали вагу вух як міру хворюваннях суглобів (артрози), визначення запального набряку, активність перок- травматичні артрити, сидази як міру визначення дифузії гранулоцитів й - колагенози будь-якого генезу, наприклад, си 13 78304 14 стемний червоний вовчок, склеродермія, поліміозапальними, алергічними та/або проліферативнизит, дерматоміозит, синдром Шегрена, синдром ми процесами: Стілла, синдром Фелті; - алергічний кератит, увеїт, ірит, 3) алергії, які супроводжуються запальними - кон'юнктивіт, та/або проліферативними процесами: - блефарит, - всі форми алергічних реакцій, наприклад, на- неврит зорового нерва, бряк Квінке, сінний нежить, укус комахи, алергічні - хоріоїдит, реакції на лікарські засоби, препарати крові, конт- симпатична офтальмія; растні речовини й т.п., анафілактичний шок, кро11) захворювання в ділянці вуха, горла, носа, пивниця, контактний дерматит; які супроводжуються запальними, алергічними 4) запалення стінки судини (васкуліти): та/або проліферативними процесами: - надозний панартеріїт, темпоральний артеріїт, - алергічний риніт, сінний нежить, вузлова еритема; - зовнішній отит, наприклад, зумовлений кон5) дерматологічні захворювання, які супровотактною екземою, інфекцією й т.п., джуються запальними, алергічними та/або пролі- середній отит; феративними процесами: 12) неврологічні захворювання, які супрово- атопічний дерматит (насамперед у дітей), джуються запальними, алергічними та/або пролі- псоріаз, феративними процесами: - червоний волосяний лишай, - набряк головного мозку, насамперед набряк - еритематозні захворювання, зумовлені різголовного мозку, зумовлений пухлиною, ними патогенними факторами, наприклад, проме- множинний склероз, невим впливом, хімікаліями, опіками й т.п., - гострий енцефаломієліт, - бульозні дерматози, - менінгіт, - захворювання лишайного характеру, - різні форми судомних нападів, наприклад - шкірний свербіж (наприклад, алергічного геBNS-судороги; незу), 13) захворювання крові, які супроводжуються - себорейна екзема, запальними, алергічними та/або проліферативни- розацеа, ми процесами: - звичайна пухирчатка, - набута гемолітична анемія, - багатоформна ексудативна еритема, - ідіопатична тромбоцитопенія; - баланіт, 14) пухлинні захворювання, які супроводжу- вульвіт, ються запальними, алергічними та/або проліфера- випадання волос, таке як колоподібне облитивними процесами: сіння, - гострий лімфолейкоз, - шкірна Т-клітинна лімфома; - злоякісна лімфома, 6) захворювання нирок, які супроводжуються - лімфогранулематоз, запальними, алергічними та/або проліферативни- лімфосаркома, ми процесами: - широке метастазування, насамперед при ра- нефротичний синдром, ку молочної залози, бронхів і передміхурової за- всі типи нефритів; лози; 7) захворювання печінки, які супроводжуються 15) ендокринні захворювання, які супровозапальними, алергічними та/або проліферативниджуються запальними, алергічними та/або проліми процесами: феративними процесами: - гострий розпад печінкових клітин, - ендокринна орбітопатія, - гострий гепатит різного генезу, наприклад, - тиреотоксичний криз, вірусними, токсичними, індукованими лікарськими - тиреоїдит Де Кервена, засобами, - аутоімунний тиреоїдит Ха шимото, - хронічно агресивний та/або хронічно перемі- базедова хвороба; жний гепатит; 16) трансплантація органів і тканин, реакція 8) захворювання шлунково-кишкового тракту, "трансплантат проти хазяїна" які супроводжуються запальними, алергічними 17) важкі шокові стани, наприклад, анафілакта/або проліферативними процесами: тичний шок, системний запальний фактор імунної - регіональний ентерит (хвороба Крона), відповіді; - виразковий коліт, 18) замісна терапія при: - гастрит, - вродженій первинній недостатності наднир- рефлюкс-езофагіт, кових залоз, такій, наприклад, як конгенітальний - гастроентерити іншого генезу, наприклад, адреногенітальний синдром, ендемічний спру; - набутій первинній недостатності надниркових 9) проктологічні захворювання, які супровозалоз, такій, наприклад, як хвороба Адісона, аутоджуються запальними, алергічними та/або проліімунний адреналіт, постінфекційний, пухлини, меферативними процесами: тастази й т.п., - екзема заднього проходу, - вродженій вторинній недостатності наднир- тріщини, кових залоз, такій, наприклад, як конгенітальний - геморой, гіпопітуїтаризм, - ідіопатичний практит; - набутій вторинній недостатності надниркових 10) захворювання очей, які супроводжуються залоз, такій, наприклад, як постінфекційна, пухли 15 78304 16 ни й т.п.; ду, сполучними, засобами утримання вологи, 19) блювота, яка супроводжуються запальнизмащувальними речовинами, абсорбентами, розми, алергічними та/або проліферативними процеріджувачами, смаковими добавками, барвниками й сами: т.п. і переводять у необхідну для застосування - наприклад, у сполученні з антагоністом 5форму. У цьому зв'язку можна послатися на [пубНТЗ при блювоті, зумовленій цитостатиками; лікацію Remington's Pharmaceutical Science, 15-е 20) болю запального генезу, наприклад, люмвид., в-во Mack Publishing Company, East Pennsylбаго. vania, 1980]. Крім того, запропоновані у винаході сполуки Для перорального застосування можуть призагальної формули І можуть застосовуватися тазначатися насамперед таблетки, драже, капсули, кож для терапії й профілактики не вказаних вище пілюлі, порошки, гранули, пастилки, суспензії, хвороб, для боротьби з якими в цей час викорисемульсії або розчини. товують синтетичні глюкокортикоїди [порівн. Hatz, Для парентерального введення можуть приHJ, Glucocorticoide: Immunologische Grundlagen, значатися композиції для ін'єкції й інфузії. Pharmakologie und Therapierichtlinien, вид-во WisДля внутрішньосуглобової ін'єкції можуть заsenschafliche Verlagsgesellschaft mbH, Stuttgart, стосовуватися відповідним чином приготовлені 1998]. кристалічні суспензії. Всі вищезгадані показання 1)-20) докладно Для внутрішньом'язової ін'єкції можуть засто[описані в Hatz, HJ, в Glucocorticoide: Immunoloсовува тися водні й масляні розчини або суспензії gische Grundlagen, Pharmakologie und Theraй відповідні препарати в депо-формі. pierichtlinien, вид-во Wissenschafliche VerlagsgeДля ректального введення нові сполуки моsellschaft mbH, Stuttgart (1998)]. жуть застосовуватися у формі супозиторіїв, капДля досягнення необхідної терапевтичної дії сул, розчинів (наприклад у вигляді клізм) і мазей, при вищезгаданих хворобах призначувана доза при цьому мається на увазі як системна, так і місможе змінюватися залежно, наприклад, від ефекцева терапія. тивності сполуки загальної формули І, від індивіДля пульмонального застосування нові сполудуальних особливостей пацієнта, методики ввеки можуть призначатися у вигляді аерозолів й індення й типу й ступеня тяжкості захворювання, а галяційних засобів. також від того, чи передбачається застосування в При місцевому застосуванні на очах, для слупрофілактичних або терапевтичних цілях. хового проходу, середнього вуха, порожнини носа Винахід стосується також й навколоносових пазух нові сполуки можуть вико1) застосування запропонованої у винаході ристовуватися у відповідних фармацевтичних сполуки формули І або суміші таких сполук для композиціях у вигляді крапель, мазей і настойок. одержання медикаменту, призначеного для лікуДля місцевого застосування можуть призначавання відповідного ЗАХВОРЮВАННЯ; тися композиції у вигляді гелів, мазей, жирних ма2) способу лікування відповідного ЗАХВОРЮзей, кремів, паст, пудри, молочка й настойок. Для ВАННЯ, який полягає в тому, що в складі медикадосягнення задовільного фармакологічного ефекменту пацієнтові, який потребує подібного медиту дозування сполук загальної формули І у цих каменту, вводять таку кількість сполуки відповідно композиціях повинна становити від 0,01 до 20%. до винаходу, яка пригнічує хвороба; Винахід стосується також застосування запро3) фармацевтичної композиції для лікування понованих у ньому сполук загальної формули І як відповідного ЗАХВОРЮВАННЯ, таке лікування терапевтичної діючої речовини. Винахід стосуєтьпередбачає використання однієї із запропоновася також застосування запропонованих у ньому них у винаході сполук або суміші таких сполук і сполук загальної формули І як терапевтичної діюпринаймні однієї фармацевтичної допоміжної речої речовини разом з фармацевтично сумісними й човини та/або носія. прийнятними допоміжними речовинами й носіями. У принципі задовільних результатів для тваВинахід стосується також фармацевтичної компорин можна очікувати при введенні їм добової дози, зиції, яка містить одну з фармацевтично активних, яка містить від 1 до 100000мкг сполуки за винахозапропонованих у ньому сполук або їх суміш або дом на кг ваги тіла. Для великих ссавців, у тому фармацевтично прийнятну сіль такої сполуки й числі й для людини, рекомендується добова доза фармацевтично прийнятну сіль або фармацевтичв межах від 1 до 100000мкг/кг ваги тіла. Переважно прийнятні допоміжні речовини й носії. ною є доза в межах від 10 до 30000мкг/кг ваги тіла, Нижче винахід більш докладно пояснюється більш переважна доза від 10 до 10000мкг/кг ваги на прикладах, які не обмежують його обсяг. Синтіла. При необхідності цю дозу доцільно вводити тез важливих попередніх продуктів, не представдекілька разів на добу. Для лікування гострого лених в експериментальній частині опису, стосушоку (наприклад анафілактичного шоку) можна ється рівня техніки, і відповідну інформацію про ці призначати разові дози, які помітно перевищують продукти можна одержати із [заявок WO 98/54159 вказані вище межі. й WO 02/10143]. Склад для фармацевтичних препаратів на осЕкспериментальна частина нові нових сполук одержують за відомою технолоПриклад 1 гією шляхом переробки діючої речовини із тради1-(хінолін-8-іламіно)-4-(5-фтор-2-метоксифеційно використовуваними в галениці носіями, ніл)-4-метил-2-(трифторметил)пентан-2-ол наповнювачами, речовинами, які сприяють розпа 17 78304 200мг (0,68ммоля) 2-[2-(5-фтор-2метоксифеніл)-2-метилпропіл)-2-(трифторметил) оксирану [WO 00/32584] і 99мг (0,68ммоля) 8амінохіноліну протягом 20год. нагрівають в 0,2мл 3,4,5,6-тетрагідро-2-(H)-піримідону (DMPU) до 130°С. Після очищення реакційної суміші на силікагелі з використанням суміші гексан-етилацетат (0-20%) одержують 230мг продукту. 1 H-ЯМР (CDCI3): δ=1,47 (s, 3Н), 1,65 (s, 3Н), 2,25 (d, 1H), 2,85 (d, 1H), 3,30 (АВ-система, 2H), 3,85 (s, 3H), 6,13 (шир., d, 1H), 6,80 (dd, 1H), 6,95 (ddd, 1H), 7,13 (d, 1H), 7,20 (dd, 1H), 7,32 (z, 1H), 7,45 (m, 1H), 8,18 (m, 1H), 8,72 (dd, 1H). Приклад 2 1-(хінолін-8-іламіно)-4-(5-фтор-2-гідроксифеніл)-4-метил-2-(трифторметил)пентан-2-ол 200мг (0,46ммоля) 1-(хінолін-8-іламіно)-4-(5фтор-2-метоксифеніл)-4-метил-2(трифторметил)пентан-2-олу в 20мл СН 2Сl2 змішують при 0°С з 9мл 1-молярного розчину триброміду бору в СН2Сl2. Після 20-годинного витримування при кімнатній температурі суміш зливають у насичений розчин NaHCO3, перемішують протягом 20хв. й екстрагують СН 2Сl2. Потім об'єднані органічні екстракти промивають водою, сушать (Na2SO4) і концентрують під вакуумом. Після хроматографії на силікагелі з використанням суміші гексан-етилацетат (0-25%) одержують 190мг продукту. 1 Н-ЯМР (CDCI3): δ=1,48 (s, 3Н), 1,62 (s, 3Н), 2,20 (d, 1H), 3,18 (d, 1H), 3,35 (s, 2H), 6,45 (d, 1H), 6,52 (dd, 1H), 6,65 (ddd, 1H), 7,08 (dd, 1H), 7,15 (d, 1H), 7,35 (t, 1H), 7,50 (dd, 1H), 8,25 (d, 1H), 8,83 (dd, 1H). Приклад 3 1-(хінолін-5-іламіно)-4-(5-фтор-2-метоксифеніл)-4-метил-2-(трифторметил)пентан-2-ол Аналогічно до прикладу 1 200мг (0,48ммоля) 2-[2-(5-фтор-2-метоксифеніл)-2-метилпропіл]-2(трифторметил)оксирану піддають взаємодії з 99мг (0,68ммоля) 5-амінохіноліну. Після хроматографії на силікагелі з використанням суміші гексанетилацетат (0-70%) одержують 58мг продукту. 1 Н-ЯМР (CDCI3): δ=1,47 (s, 3Н), 1,56 (s, 3Н), 2,38 (d, 1H), 2,78 (d, 1H), 3,15 (dd, 1H), 3,33 (dd, 1H), 3,85 (s, 3H), 4,65 (шир., 1H), 6,10 (d, 1H), 6,80 (dd, 1H), 6,93 (ddd, 1H), 7,10 (dd, 1H), 7,37 (dd, 1H), 7,50 (t, 1H), 7,61 (d, 1H), 8,18 (d, 1H), 8,80 (dd, 1H). 18 Приклад 4 1-(хінолін-5-іламіно)-4-(5-фтор-2-метоксифеніл)-4-метил-2-(трифторметил)пентан-2-ол Аналогічно до прикладу 2 58мг (0,13ммоля) 1(хінолін-5-іламіно)-4-(5-фтор-2-метоксифеніл)-4метил-2-(трифторметил)пентан-2-олу в 6мл СН2Сl2 піддають взаємодії з 2,6мл 1-молярного розчину триброміду бору в СН 2СІ2. Після хроматографії на силікагелі з використанням суміші гексанетилацетат (0-70%) одержують 22мг продукту. 1 Н-ЯМР (CDCI3): δ=1,48 (s, 3Н), 1,54 (s, 3Н), 2,45 (d, 1H), 2,82 (d, 1H), 3,20 (dd, 1H), 3,40 (dd, 1H), 5,05 (шир., 1H), 6,25 (d, 1H), 6,70 (m, 1H), 6,85 (dd, 1H), 6,95 (dd, 1H), 7,45 (dd, 1H), 7,53 (d, 1H), 7,58 (d, 1H), 8,32 (d, 1H), 8,68 (d, 1H). Приклад 5 1-(хінолін-4-іламіно)-4-(5-фтор-2-метоксифеніл)-4-метил-2-(трифторметил)пентан-2-ол 1-аміно-4-(5-фтор-2-метоксифеніл)-4-метил-2(трифторметил)пропан-2-ол 1,0г (3,4ммоля) 2-[2(5-фтор-2-метоксифеніл)-2-метилпропіл]-2(трифторметил)оксирану в 68мл ТГФ протягом 6год. нагрівають зі зворотним холодильником з 1,1г азиду натрію й 180мг хлориду амонію в 14мл води й 26мл етанолу. Після цього суміш концентрують, розбавляють простим ефіром, промивають водою, сушать (Na2SO4) і концентрують. Після хроматографії на силікагелі з використанням суміші гексан-етилацетат (0-15%) одержують 950мг 1-азидо-4-(5-фтор-2-метоксифеніл)-4-метил-2(трифторметил)пропан-2-олу. Останній розчиняють в 29мл ТГФ і при 0°С порціями змішують із 270мг алюмогідриду літію. Через 1 годину суміш обробляють етилацетатом і водою й фільтрують через целіт. Етилацетатну фазу сушать (Na2SO4) і концентрують під вакуумом. Таким шляхом одержують 920мг аміну. 1 H-ЯМР (CDCI3): δ=1,4 (s, 3Н), 1,5 (s, 3Н), 2,15 (d, 1H), 2,45 (d, 1H), 2,55 (d, 1H), 2,75 (d, 1H), 2,80 (m), 3,8 (s, 3H), 6,8 (dd, 1H), 6,9 (td, 1H), 7,05 (dd, 1H). 1-(хінолін-4-іламіно)-4-(5-фтор-2-метоксифеніл)-4-метил-2-(трифторметил)пентан-2-ол 500мг (1,6ммоля) 1-аміно-4-(5-фтор-2метоксифеніл)-4-метил-2-(трифторметил)пропан2-олу, 265мг (1,6ммоля) 4-хлорхіноліну й 183мг (1,6ммоля) діазабіцикло-[2.2.2]октану протягом 3год. нагрівають до 150°С. Потім суміш розчиняють в СН 2Сl2 і воді. Після цього водну фазу екстрагують СН 2СI2, об'єднані органічні екстракти промивають водою, сушать (Na2SO4) і концентрують під вакуумом. Після хроматографії на силікагелі з використанням суміші СН 2Сl2-метанол (0-10%) одержують 305мг продукту. 19 78304 20 Н-ЯМР (D6-ДМСО): δ=1,40 (s, 3Н), 1,57 (s, 3Н), (d, 1H), 9,80 (шир., 2Н). 2,10 (d, 1H), 2,88 (d, 1H), 3,05 (dd, 1H), 3,15 (dd, Приклад 9 1H), 3,80 (s, 3H), 5,96 (d, 1H), 6,00 (s, 1H), 6,26 1-(хінолін-5-іламіно)-4-метил-4-феніл-2-(три(шир. t, 1H), 6,98 (d, 1H), 7,02 (td, 1H), 7,10 (dd, 1H), фтор-метил)пентан-2-ол 7,45 (t, 1H), 7,60 (t, 1H), 7,77 (d, 1H), 7,95 (d, 1H), 8,30 (d, 1H). Приклад 6 1-(хінолін-4-іламіно)-4-(5-фтор-2-гідроксифеніл)-4-метил-2-(трифторметил)пентан-2-ол 2-(2-метил-2-фенілпропіл)-2-('трифторметил') оксиран 10,4г 4-метил-2-оксо-4-фенілпентанової кислоти [WO98/54159] в 250мл диметилформаміду при -5°С змішують із 4,1мл тіонілхлориду й через 15хв. із 4мл метанолу. Після 15-годинного витримування при кімнатній температурі суміш розбавАналогічно до прикладу 2 200мг (0,46ммоля) ляють водою й екстрагують етилацетатом. Органі1-(хінолін-4-іламіно)-4-(5-фтор-2-метоксифеніл)-4чні екстракти промивають водою, сушать (Na2SO4) метил-2-(трифторметил)пентан-2-олу піддають і концентрують. Таким шляхом одержують 9,3г взаємодії з 9мл 1-молярного розчину триброміду метилового ефіру 4-метил-2-оксо-4бору в СН2СI2. Після хроматографії на силікагелі з фенілпентанової кислоти. Останній в 558мл ДМФ використанням суміші СН 2СI2-метанол (0-15%) при -5°С змішують із 15,5мл (104,63ммоля) (триодержують 138мг продукту. 1 фторметил)триметилсилану й 20,5г (63,28ммоля) H-ЯМР (D6-ДМСО): δ=1,40 (s, 3Н), 1,58 (s, 3Н), карбонату цезію й протягом 16год. перемішують 1,95 (d, 1Н), 3,00-3,50 (m, 3Н), 6,05 (m+d, 2H), 6,65 при кімнатній температурі. Далі до суміші додають (шир., 1Н), 6,80 (dd, 1H), 6,86 (td, 1H), 7,05 (dd, 1H), воду, екстрагують етилацетатом, промивають ор7,50 (t, 1H), 7,65 (t, 1H), 7,80 (d, 1H), 8,02 (d, 1H), ганічну фазу водою й сушать (Na2SO4). Сконцент8,32 (d, 1H), 9,82 (шир., 1H). рований проміжний продукт розчиняють в 200мл Приклад 7 ТГФ і додають 50мл 1-молярного розчину фториду 4-(5-фтор-2-метоксифеніл)-1-(ізохінолін-1-ілатетрабутиламонію в ТГФ. Після цього перемішуміно)-4-метил-2-(трифторметил)пентан-2-ол ють протягом 2год., додають воду, екстрагують етилацетатом, промивають органічну фаз у водою й сушать (Na2SO4). Після хроматографії на силікагелі з використанням суміші гексан-етилацетат (030%) одержують 8,35г метилового ефіру 2гідрокси-4-метил-4-феніл-2-(трифторметил)пентаАналогічно до прикладу 1 200мг (0,68ммоля) нової кислоти. Потім цей ефір (8,3г, 28,59ммоля) 2-[2-(5-фтор-2-метоксифеніл)-2-метилпропіл]-2розчиняють в 180мл ТГФ і протягом 2,5год. мали(трифторметил)оксирану піддають взаємодії з ми порціями додають 1,52г (36,20ммоля) алюмогі99мг (0,68ммоля) 1-аміноізохіноліну. Після хромадриду літію. Після повного перетворення по краптографії на силікагелі з використанням суміші геклях додають 5мл етилацетату, а потім ще через сан-етилацетат (0-60%) одержують 65мг продукту. 10хв. обережно додають 10мл води. Потім відфі1 Н-ЯМР (CDCI3): δ=1,45 (s, 3Н), 1,72 (s, 3Н), льтровують від утвореного осаду і ретельно про2,40 (d, 1H), 3,00 (d, 1H), 3,40 (d, 1H), 3,88 (s, 3H), мивають етилацетатом. Після хроматографії на 4,23 (d, 1H), 6,40 (d, 1H), 6,63 (d, 1H), 6,82 (dd, 1H), силікагелі з використанням суміші гексан6, 89 (td, 1H), 7,15 (dd, 1H), 7,45 (d, 1H), 7,55 (t, 1H), етилацетат (0-35%) одержують 5,40г 4-метил-47,65 (t, 1H), 8,45 (шир., 1Н). феніл-2-(трифторметил)пентан-1,2-діолу. Далі до Приклад 8 діолу (5,40г, 20,59ммоля) в 43мл ТГФ додають 5,6г 4-(5-фтор-2-гідроксифеніл)-1-(ізохінолін-1-іла(21,35ммоля) трифенілфосфіну, а потім при охоміно)-4-метил-2-(трифторметил)пентан-2-ол лодженні льодом-4,3мл (27,31ммоля) діетилового ефіру азодикарбонової кислоти. Потім реакційну суміш протягом 3год. нагрівають зі зворотним холодильником і після охолодження концентрують. Після хроматографії на силікагелі з використанням суміші гексан-етилацетат (0-15%) одержують 4,18г продукту. Аналогічно до прикладу 2 65мг (0,15ммоля) 41 Н-ЯМР (CDCI3): δ=1,37 (s, 3Н), 1,41 (s, 3Н), (5-фтор-2-метилфеніл)-1-(ізохінолін-1-іламіно)-42,20 (m, 1H), 2,27 (d, 1H), 2,55 (d, 1H), 2,67 (d, 1H), метил-2-(трифторметил)пентан-2-олу піддають 7,18-7,35 (m, 5H). взаємодії з 2,7мл 1-молярного розчину триброміду 1-(хінолін-5-іламіно)-4-метил-4-феніл-2-(трибору в СН2СI2. Після хроматографії на силікагелі з фторметил)пентан-2-ол використанням суміші гексан-етилацетат (0-80%) Аналогічно до прикладу 1 піддають взаємодії одержують 33мг продукту. 1 300мг (1,22ммоля) 2-(2-метил-2-фенілпропіл)-2Н-ЯМР (CDCI3): δ=1,40 (s, 3Н), 1,60 (s, 3Н), (трифторметил)оксирану й 882мг (6,12ммоля) 52,00 (d, 1H), 2,87 (d, 1H), 3,53 (d, 1H), 4,23 (d, 1H), амінохіноліну. Після хроматографії на силікагелі з 6,25 (d, 1H), 6,70-6,90 (m, 3H), 7,00 (dd, 1H), 7,42 (t, використанням суміші гексан-етилацетат (0-75%) 1H), 7,48 (d, 1H), 7,58 (t, 1H), 8,05 (шир., 1H), 8,22 одержують 85мг продукту. 1 21 78304 22 Н-ЯМР (CDCI3): δ=1,45 (s, 3Н), 1,60 (s, 3Н), Приклад 12 2,30 (d, 1H), 2,36 (d, 1Н), 3,02 (dd, 1H), 3,05 (s, 1H), 4-(1,3-бензодіоксол-4-іл)-N-(хінолін-5-іл)-23,25 (dd, 1H), 4,24 (dd, 1H), 6,11 (d, 1H), 7,28-7,56 гідрокси-4-метил-2-(трифторметил)пентанамід (m, 8H), 8,04 (d, 1H), 8,86 (dd, 1H). Приклад 10 4-метил-1-(2-метилхінолін-5-іламіно)-4-феніл2-(трифторметил)пентан-2-ол 1 Аналогічно до прикладу 1 піддають взаємодії 500мг (2,05ммоля) 2-(2-метил-2-фенілпропіл)-2(трифторметил)оксирану й 650мг (4,10ммоля) 5аміно-2-метилхіноліну. Після хроматографії на силікагелі з використанням суміші гексанетилацетат (0-70%) одержують 485мг продукту. 1 Н-ЯМР (CDCI3): δ=1,44 (s, 3Н), 1,59 (s, 3Н), 2,30 (d, 1H), 2,35 (d, 1H), 2,72 (s, 3H), 3,01 (dd, 1H), 3,04 (s, 1H), 3,23 (dd, 1H), 4,18 (dd, 1H), 6,04 (d, 1H), 7,21 (d, 1H), 7,30 (dt, 1H), 7,37-7,51 (m, 6H), 7,92 (d, 1H). Приклад 11 Амід N-(хінолін-5-іл)-4-(5-фтор-2-метоксифеніл)-2-гідрокси-4-метил-2-(трифторметил)пентанової кислоти 540мг (2,13ммоля) 4-(5-фтор-2-метоксифеніл)4-метил-2-оксопентанової кислоти [WO 00/32584] в 15мл ДМФ при -5°С в атмосфері аргону змішують із 0,18мл тіонілхлориду. Після 20-хвилинного перемішування в діапазоні температур від -3°С до +3°С додають 470мг (3,26ммоля) 5-амінохіноліну. Після цього дають суміші нагрітися до кімнатної температури, потім перемішують ще 16год., змішують із 10%-ною лимонною кислотою, екстрагують етилацетатом, промивають органічну фазу водою й сушать (Na2SO4). Після хроматографії на силікагелі з використанням суміші гексанетилацетат (0-75%) одержують 680мг аміду N(хінолін-4-іл)-4-(5-фтор-2-метоксифеніл)-4-метил2-оксопентанової кислоти, яку розчиняють в 22мл ДМФ і о холоджують до 0°С. Після цього розчин змішують із 1,80мл (трифторметил)триметилсилану й 2,43г карбонату цезію й протягом 16год. перемішують при кімнатній температурі. Потім додають воду, екстрагують етилацетатом, промивають органічну фазу водою й сушать над сульфатом натрію. Сконцентрований проміжний продукт розчиняють в 10мл ТГФ і додають 5,5мл 1-молярного розчину фториду тетрабутиламонію. Після цього перемішують протягом 1,5год., додають воду, екстрагують етилацетатом, промивають органічну фазу водою й сушать над сульфатом натрію. Після хроматографії на силікагелі з використанням суміші гексан-етилацетат (070%) одержують 420мг продукту. 1 Н-ЯМР (CDCI3): δ=1,44 (s, 3Н), 1,46 (s, 3Н), 2,80 (d, 1Н), 3,10 (d, 1H), 3,57 (s, 1H), 3,89 (s, 3H), 6,81 (dd, 1H), 6,89 (m, 1H), 6,99 (dd, 1H), 7,45 (dd, 1H), 7,73 (t, 1H), 7,95 (d, 1H), 7,99 (d, 1H), 8,00 (d, 1H), 8,83 (шир., 1H), 8,95 (dd, 1H). Метиловий ефір 1,3-бензодіоксол-4-карбонової кислоти 50г 2,3-дигідроксибензойної кислоти в 450мл метанолу при кімнатній температурі по краплях змішують із 50мл тіонілхлориду. Потім розчин протягом 5год. нагрівають до 60°С і перемішують ще протягом ночі при кімнатній температурі. Після цього розчинник повністю видаляють під вакуумом, масло, що залишилося, розчиняють у діетиловому ефірі й екстрагують насиченим розчином бікарбонату. Після промивання розсолом, сушіння сульфатом натрію й видалення під вакуумом розчинника одержують 46г метилового ефіру 2,3дигідроксибензойної кислоти. Останній змішують із 56,7г карбонату калію в 575мл ДМФ й 20,2мл дибромметану й суміш протягом 5год. нагрівають до 100°С в атмосфері аргону. Після цього суміш ще протягом ночі перемішують при кімнатній температурі. Потім змішують із водою й тричі екстрагують етилацетатом. Органічну фазу декілька разів промивають водою й суша ть над сульфатом натрію. Розчинник видаляють під вакуумом і таким шляхом одержують 50,2г метилового ефіру 1,3бензодіоксол-4-карбонової кислоти у ви гляді твердої речовини коричневого кольору. T пл: 55-57°C. 4-(1,3-бензодіоксол-4-іл)-4-метил-2-оксопентанова кислота 4,76г метилового ефіру 1,3-бензодіоксол-4карбонової кислоти в 65мл сухого ТГФ при кімнатній температурі по краплях додають до 21мл 3молярного розчину метилмагнійхлориду в ТГФ в атмосфері аргону. Після цього перемішують протягом 3год. і потім повільно змішують із 1н. соляною кислотою. Після екстракції етилацетатом і промивання органічної фази водою сушать сульфатом натрію й відганяють розчинник під вакуумом. Таким шляхом одержують 5,0г 1-(1,3бензодіоксол-4-іл)-1-метилетанолу у вигляді масла коричневого кольору. 3,6г цього масла й 5,4г етилового ефіру 2-(триметилсилілокси)акрилової кислоти в 80мл дихлорметану при -70°С змішують із 18мл тетрахлориду олова. Після 15-хвилинного перемішування при -70°С розчин зливають на напівнасичений розчин карбонату натрію, змішують із етилацетатом й інтенсивно перемішують. Потім фази розділяють і водну фазу двічі екстрагують етилацетатом. Органічну фазу промивають розсолом, сушать сульфатом натрію й відганяють розчинник під вакуумом. Таким шляхом одержують масло жовтого кольору, яке змішують із 60мл 1н. розчину їдкого натрію й 120мл метанолу й протягом 3год. перемішують при кімнатній температурі. Після цього під вакуумом відганяють метанол й екстрагують водну фазу діетиловим ефіром. Потім підкисляють водну фазу, додаючи до неї 120мл 1н. соляної кислоти, і тричі екстрагують діетиловим ефіром. Ефірну фазу сушать і під вакуумом видаляють розчинник. Таким шляхом одержують 4,2г 4-(1,3-бензодіоксол-4-іл)-4-метил-2 23 78304 24 оксопентанової кислоти у ви гляді масла жовтого Приклад 14 кольору. МС (ЕІ): М+=250 (М=250). N-(хінолін-5-іл)-4-(2-хлор-5-фторфеніл)-24-(1,3-бензодіоксол-4-іл)-N-(хінолін-5-іл)-4-мегідрокси-4-метил-2-(трифторметил)пентанамід тил-2-оксопентанамід 100мг 4-(1,3-бензодіоксол-4-іл)-4-метил-2оксопентанової кислоти в 1мл диметилацетаміду при 0°С змішують із 0,034мл тіонілхлориду й перемішують протягом 20хв. Потім додають 61мг 5амінохіноліну й перемішують протягом ночі при N-(хінолін-5-іл)-4-(2-хлор-5-фторфеніл)-4-мекімнатній температурі. Після цього зливають на тил-2-оксопентанамід розчин гідрокарбонату натрію й тричі екстрагують З 520мг 4-(2-хлор-5-фторфеніл)-4-метил-2етилацетатом. Далі промивають розсолом, сушать оксопентанової кислоти [WO 02/10143] відповідно і видаляють розчинник під вакуумом. Масло, яке до прийнятої методики для 4-(1,3-бензодіоксол-4залишилося, розділяють товстошаровою хроматоіл)-N-(хінолін-5-іл)-4-метил-2-оксопентаміду (приграфією (силікагель, суміш ацетон-гексан, 1:1). клад 12) після хроматографії на силікагелі одерТаким шляхом одержують 25мг 4-(1,3жують 400мг N-(хінолін-5-іл)-4-(2-хлор-5бензодіоксол-4-іл)-N-(хінолін-5-іл)-4-метил-2фтор феніл)-4-метил-2-оксопентанаміду. tпл:145оксопентанаміду у вигляді пінистої речовини жов+ 146°С. того кольору. МС (ЕІ): M =376,3 (М=376,4). N-(хінолін-5-іл)-4-(2-хлор-5-фторфеніл)-24-(1,3-бензодіоксол-4-іл)-N-(хінолін-5-іл)-2-гідгідрокси-4-метил-2-(трифторметил)пентанамід рокси-4-метил-2-(трифторметил)пентанамід З 384мг N-(хінолін-5-іл)-4-(2-хлор-5-фтор22мг 4-(1,3-бензодіоксол-4-іл)-N-(хінолін-5-іл)феніл)-4-метил-2-оксопентанаміду відповідно до 4-метил-2-оксопентанаміду й 0,04мл трифтормеприйнятої методики для 4-(1,3-бензодіоксол-4-іл)тилтриметилсилану в 1мл ДМФ при 0°С змішують N-(хінолін-5-іл)-2-гідрокси-4-метил-2-(трифтормеіз 11мг карбонату цезію. Через 2 години на кінчику тил)пентанаміду (приклад 12) одержують після шпателя додають хлорид тетрабутиламонію й ще хроматографії на силікагелі 60мг N-(хінолін-5-іл)-4через 20хв. реакційний розчин зливають на воду. (2-хлор-5-фторфеніл)-2-гідрокси-4-метил-2Далі тричі екстрагують етилацетатом, промивають (трифторметил)пентанаміду. t m: 188-189°С. водою й розсолом, сушать і видаляють розчинник Приклад 15 під вакуумом. Масло, яке залишилося, розділяють N-(хінолін-5-іл)-3-[1-(2-хлор-4-фторфеніл)цикшляхом хроматографії на силікагелі. Таким шлялопропіл]-2-гідрокси-2-(трифторметил)пропанамід хом одержують 11мг 4-(1,3-бензодіоксол-4-іл)-N(хінолін-5-іл)-2-гідрокси-4-метил-2(трифторметил)пентанаміду у вигляді твердої речовини. Tпл: 164-167°C. Приклад 13 N-(хінолін-5-іл)-4-(2-хлорфеніл)-2-гідрокси-4N-(хінолін-5-іл)-3-[1-(2-хлор-4-фторфеніл)цикметил-2-(трифторметил)пентанамід лопропіл1-2-оксопропанамід N-(хінолін-5-іл)-4-(2-хлорфеніл)-4-метил-2-оксопентанамід З 200мг 4-(2-хлорфеніл)-4-метил-2-оксопентанової кислоти [WO 00/32584] відповідно до прийнятої методики для 4-(1,3-бензодіоксол-4-іл)-N(хінолін-5-іл)-4-метил-2-оксопентанаміду після хроматографії на силікагелі одержують 152мг N(хінолін-5-іл)-4-(2-хлорфеніл)-4-метил-2оксопентанаміду. МС (ЕІ): М+=366, 368 (3:1): (М=366,8). N-(хінолін-5-іл)-4-(2-хлофеніл)-2-гідрокси-4метил-2-(трифторметил)пентанамід З 142мг N-(хінолін-5-іл)-4-(2-хлофеніл)-4метил-2-оксопентанаміду відповідно до прийнятої методики для 4-(1,3-бензодіоксол-4-іл)-N-(хінолін5-іл)-2-гідрокси-4-метил-2-(трифторметил)пентанаміду (приклад 12) після хроматографії на силікагелі одержують 82мг N-(хінолін-5-іл)-4-(2хлорфеніл)-2-гідрокси-4-метил-2-(трифторметил) пентанаміду. t пл.: 210-214°С. З 512мг 3-[1-(2-хлор-4-фторфеніл)циклопропіл]-2-оксопропіонової кислоти [WO 02/10143] відповідно до прийнятої методики для 4-(1,3бензодіоксол-4-іл)-N-(хінолін-5-іл)-2-гідрокси-4метил-2-(трифторметил)пентанаміду (приклад 12) одержують після хроматографії на силікагелі 535мг N-(хінолін-5-іл)-3-[1-(2-хлор-4-фторфеніл) циклопропіл]-2-оксопропанаміду у вигляді пінистої речовини. N-(хінолін-5-іл)-3-[1-(2-хлор-4-фторфеніл)циклопропіл]-2-гідрокси-2-(трифторметил)пропанамід З 535мг N-(хінолін-5-іл)-3-[1-(2-хлор-4фтор феніл)циклопропіл]-2-оксопропанаміду відповідно до прийнятої методики для 4-(1,3бензодіоксол-4-іл)-N-(хінолін-5-іл)-2-гідрокси-4метил-2-(трифторметил)пентанаміду (приклад 12) після хроматографії на силікагелі одержують 200мг N-(хінолін-5-іл)-3-[1(-2-хлор-4-фторфеніл)циклопропіл]-2-гідрокси-2-(трифторметил)пентанаміду. tпл: 220-221°С. Приклад 16 4-(4-бром-2-метоксифеніл)-1-(хінолін-5-іламіно)-2-гідрокси-4-метил-2-(трифторметил)пентан-2ол 25 78304 26 метил-2-оксопентанамід З 630мг 4-(5-бром-2-метоксифеніл)-4-метил-2оксопентанової кислоти відповідно до прийнятої методики для 4-(1,3-бензодіоксол-4-іл)-N-(хінолін5-іл)-4-метил-2-оксопентанаміду (приклад 12) пісАналогічно до прикладу 1 піддають взаємодії ля хроматографії на силікагелі одержують 730мг 4200мг 2-[2-(4-бром-2-метоксифеніл)-2(5-бром-2-метоксифеніл)-N-(хінолін-5-іл)-4-метилметилпропіл]-2-(трифторметил)оксирану [WO 2-оксопентанаміду. tпл: 133-135°C. 00/32585] і 5-амінохінолін. Після хроматографії на 4-(5-бром-2-метоксифеніл)-N-(хінолін-5-іл)-2силікагелі з використанням суміші гексангідрокси-4-метил-2-(трифторметил)пентанамід етилацетат (1:1) одержують 43мг 4-(4-бром-2З 617мг 4-(5-бром-2-метоксифеніл)-N-(хінолінметоксифеніл)-1-(хінолін-5-іламіно)-2-гідрокси-45-іл)-4-метил-2-оксопентанаміду відповідно до метил-2-(трифторметил)пентан-2-олу. tпл: 181°С. прийнятої методики для 4-(1,3-бензодіоксол-4-іл)Приклад 17 N-(хінолін-5-іл)-2-гідрокси-4-метил-24-(5-бром2-метоксифеніл)-N-(хінолін-5-іл)-2(трифторметил)пентанаміду (приклад 12) після гідрокси-4-метил-2-(трифторметил)пентанамід хроматографії на силікагелі одержують 484мг 4-(5бром-2-метоксифеніл)-N-(хінолін-5-іл)-2-гідрокси-4метил-2-(трифторметил)пентанаміду. tпл: 243245°C. Приклад 18 4-(4-бром-2-метоксифеніл)-N-(хінолін-5-іл)-2гідрокси-4-метил-2-(трифторметил)пентанамід 1-(5-бром-2-метоксифеніл)-1-метил етанол 62мл 3-молярного розчину метилмагнійброміду в тетрагідрофурані протягом однієї години при 0°С по краплях додають до 18,6г метилового ефіру 5-бром-2-метоксибензойної кислоти й 180мл діетилового ефіру. Через 16год. при кімнатній те4-(4-бром-2-метоксифеніл)-N-(хінолін-5-іл)-4мпературі й при охолодженні льодом змішують із метил-2-оксопентанамід насиченим розчином хлориду амонію й етилацетаЗ 630мг 4-(4-бром-2-метоксифеніл)-4-метил-2том. Етилацетатну фазу промивають водою, суоксопентанової кислоти [WO 98/54159] відповідно шать (Na2SO4) і упарюють. Після дистиляції з видо прийнятої методики для 4-(1,3-бензодіоксол-4користанням трубки з кульовим розширенням (tкип: іл)-N-(хінолін-5-іл)-4-метил-2-оксопентанаміду 140°С/0,04гПа) одержують 16,7г кристалічного 1(приклад 12) після хроматографії на силікагелі (5-бром-2-метоксифеніл)-1-метилетанолу, tпл: 66одержують 363мг 4-(4-бром-2-метоксифеніл)-N68°C. (хінолін-5-іл)-4-метил-2-оксопентанаміду. tпл: 114Етиловий ефір 4-(5-бром-2-метоксифеніл)-4115°С. метил-2-оксопентанової кислоти 4-(4-бром-2-метоксифеніл)-N-(хінолін-5-іл)-29,8г 1-(5-бром-2-метоксифеніл)-1-метилетагідрокси-4-метил-2-(трифторметил)пентанамід нолу й 15,24г етилового ефіру 2З 528мг 4-(4-бром-2-метоксифеніл)-N-(хінолін(триметилсилілокси)акрилової кислоти в 150мл 5-іл)-4-метил-2-оксопентанаміду відповідно до дихлорметану при -70°С змішують із 5,6мл тетраприйнятої методики для 4-(1,3-бензодіоксол-4-іл)хлориду олова. Через 20хв. при -70°С розчин злиN-(хінолін-5-іл)-2-гідрокси-4-метил-2вають на напівнасичений розчин карбонату калію (трифторметил)пентанаміду (приклад 12) після й змішують із дихлорметаном. Дихлорметанову хроматографії на силікагелі одержують 280мг 4-(4фазу промивають розчином карбонату калію, 1бром-2-метоксофеніл)-N-(хінолін-5-іл)-2-гідрокси-4молярною соляною кислотою й водою, сушать метил-2-(трифторметил)пентанаміду. tпл: 208(Na2SO4) і концентрують. Після дистиляції з вико209°С. ристанням трубки з кульовим розширенням одерПриклад 19 жують 5,2г етилового ефіру 4-(5-бром-2N-(хінолін-5-іл)-2-гідрокси-4-метил-4-феніл-2метоксифеніл)-4-метил-2-оксопентанової кислоти, (трифторметил)пентанамід tкип.: 160°С/0,04гПа. 4-(5-бром-2-метоксифеніл)-4-метил-2-оксопентанова кислота Етиловий ефір 4-(5-бром-2-метоксифеніл)-4метил-2-оксопентанової кислоти в 30мл метанолу N-(хінолін-5-іл)-4-метил-2-оксо-4-фенілпентай 12мл 1-молярного розчину їдкого натрію перенамід мішують протягом 1 години при кімнатній темпераЗ 515мг 4-метил-2-оксо-4-фенілпентанової китурі й відганяють метанол. Після цього змішують із слоти [WO98/54159] відповідно до прийнятої меводою й гексаном, водну фазу при охолодженні тодики для 4-(1,3-бензодіоксол-4-іл)-N-(хінолін-5льодом підкисляють розведеною соляною кислоіл)-4-метил-2-оксопентанаміду (приклад 12) після тою й змішують із етилацетатом. Етилацетатну хроматографії на силікагелі одержують 370мг Nфазу промивають водою, сушать (Na2SO4) і конце(хінолін-5-іл)-)-4-метил-2-оксо-4-фенілпентанаміду. нтрують. Після кристалізації з гексану одержують tпл: 98-99°С. 1,8г 4-(5-бром-2-метоксифеніл)-4-метил-2N-(хінолін-5-іл)-2-гідрокси-4-метил-4-феніл-2оксопентанової кислоти. tпл: 80°С. (трифторметил)пентанамід 4-(5-бром-2-метоксифеніл)-N-(хінолін-5-іл)-4 27 78304 28 1 З 200мг N-(хінолін-5-іл)-4-метил-2-оксо-4Н-ЯМР (CDCI3): δ=1,4 (s, 3Н), 1,5 (s, 3Н), 2,25 фенілпентанаміду відповідно до прийнятої мето(d, 1Н), 3,4 (d, 1Н), 3,6 (шир., 1Н), 3,85 (s, 3Н), 6,8 дики для 4-(1,3-бензодіоксол-4-іл)-N-(хінолін-5-іл)(dd, 1Н), 6,85-7,0 (m, 2H), 9,05 (s, 1H). 2-гідрокси-4-метил-2-(трифторметил)пентанаміду 4-(5-фтор-2-метоксифеніл)-1-(2-метоксихіно(приклад 12) після хроматографії на силікагелі лін-5-іламіно)-4-метил-2-(трифторметил)пентан-2одержують 85мг N-(хінолін-5-іл)-2-гідрокси-4ол метил-4-феніл-2-(трифторметил)пентанаміду. tпл: 300мг (0,97ммоля) 4-(5-фтор-2-метоксифеніл)181-182°C. 2-гідрокси-4-метил-2-(трифторметил)пентаналю й Приклад 20 202мг (1,16ммоля) 5-аміно-2-метоксихіноліну в 4-(5-фтор-2-метоксифеніл)-1-(2-метоксихіно10мл оцтової кислоти протягом 5год. нагрівають зі лін-5-іламіно)-4-метил-2-(трифторметил)пентан-2зворотним холодильником. Потім суміш витримуол ють для охолодження до кімнатної температури, додають до неї 640мг (3ммоля) триацетоксиборогідриду натрію й перемішують при кімнатній температурі протягом 15 год. Після додавання толуолу суміш концентрують, залишок розчиняють в етилацетаті, промивають насиченим розчином NaHCO3, сушать і концентрують. Після колонкової 1-оксид 5-нітрохіноліну хроматографії на силікагелі з використанням суРозчин 25,5г (146 ммолів) 5-нітрохіноліну в міші гексан-етилацетат одержують 146мг продукту 544мл оцтової кислоти й 272мл 30%-ного водного у вигляді безбарвного масла. 1 розчину Н2О 2 протягом 100хв. нагрівають до 62H-ЯМР (CDCI3): δ=1,45 (s, 3Н), 1,55 (s, 3Н), 69°С. Потім реакційну суміш зливають на насиче2,3 (d, 1H), 2,8 (d, 1H), 3,1 (d, 1H), 3,2 (s, 1H), 3,3 (d, ний розчин NaCl й екстрагують етилацетатом. Об'1H), 3,85 (s, 3H), 4,05 (s, 3H), 5,95 (m, 1H), 6,8 (m, єднані екстракти шляхом додавання толуолу кон2H), 6,9 (td, 1H), 7,1 (dd, 1H), 7,35 (m, 2H), 7,85 (d, центрують до об'єму приблизно 50мл. Після 1H). колонкової хроматографії на силікагелі з викорисMC (ES): m/e=467. танням суміші етилацетат-МеОН одержують 12,3г Приклад 21 продукту у вигляді твердої речовини жовтого ко4-(5-фтор-2-гідроксифеніл)-1-(2-метоксихінолін льору. -5-іламіно)-4-метил-2-(трифторметил)пентан-2-ол 1 Н-ЯМР (CDCI3): δ=7,5 (dd, 1H), 7,85 (t, 1H), 8,45 (d, 1H), 8,5 (d, 1H), 8,6 (d, 1H),9,15(d, 1H). 2-метокси-5-нітрохінолін Суспензію з 1г (5ммолів) 1-оксиду 5нітрохіноліну, 1,23г (6,4ммоля) хлорангідриду толуолсульфокислоти й 1,4мл (9,9ммоля) триетиламіну в 30мл МеОН перемішують протягом 20год. 100мг (0,21ммоля) 4-(5-фтор-2-метоксифеніл)при кімнатній температурі. Тверду речовину відфі1-(2-метоксихінолін-5-іламіно)-4-метил-2льтровують за допомогою вакуум-фільтра й про(трифторметил)пентан-2-олу в 9мл СН 2СI2 при мивають МеОН. Таким шляхом одержують 565мг кімнатній температурі змішують із 4мл 1продукту сві тло-жовтого кольору. молярного розчину триброміду бору в СН 2СІ2 . По1 H-ЯМР (CDCI3): δ=4,1 (s, 3Н), 7,15 (d, 1Н), 7,7 тім через 15год. суміш при кімнатній температурі (t, 1H), 8,15 (d, 2H), 8,8 (d, 1H). зливають у насичений розчин NaHCO3, 10хв. пе5-аміно-2-метоксихінолін ремішують й екстрагують етилацетатом. Об'єднані 550мг (2,7ммоля) 2-метокси-5-нітрохіноліну органічні екстракти суша ть (Na2SO4) і концентруперемішують в 15мл етилацетату в присутності ють під вакуумом. Після хроматографії на силіка138мг 10%-ного паладію на активованому вугіллі гелі з використанням суміші гексан-етилацетат протягом 5год. в атмосфері водню. Після цього одержують 73мг продукту. 1 суміш фільтрують і фільтрат концентрують. Таким Н-ЯМР (CDCI3): δ=1,5 (s, 3Н), 1,6 (s, 3Н), 2,35 шляхом одержують 520мг масла світло-жовтого (d, 1Н), 2,8 (d, 1H), 3,2 (d, 1H), 3,3 ( шир., 1H), 3,4 (d, кольору. 1H), 4,05 (s, 3H), 6,0 (m, 1H), 6,7 (dd, 1H), 6,8 (td, 1 Н-ЯМР (CDCI3): δ=4,05 (s, 3Н), 6,65 (d, 1Н), 1H), 6,85 (d, 1H), 7,1 (dd, 1H), 7,35 (m, 2H), 7,95 (d, 6,85 (d, 1H), 7,3 (d, 1H), 7,4 (t, 1H), 8,0 (d, 1Н). 1H). 4-(5-фтор-2-метоксифеніл)-2-гідрокси-4-метилMC(ES):m/e=453. 2-(трифторметил)пентаналь Приклад 22 1,5г (4,8ммоля) 4-(5-фтор-2-метоксифеніл)-41-(2-етоксихінолін-5-іламіно)-4-(5-фтор-2-меметил-2-трифторметилпентан-1,2-діолу й 3,4мл токсифеніл)-4-метил-2-(трифторметил)пентан-2-ол (24,4ммоля) триетиламіну в 17мл ДМСО й 53мл СН2СI2 при 10°С порціями змішують із 3г (18,9ммоля) комплексу піридин-триоксид сірки. Через 3 години при 12-18°С й охолодженні льодом суміш гідролізують насиченим розчином NH4Cl й екстрагують етилацетатом. Об'єднані екстракти 2-етокси-5-нітрохінолін сушать (Na2SO4) і концентрують. Таким шляхом Суспензію з 1г (5ммолів) 1-оксиду 5одержують 1,57г продукту у вигляді масла світлонітрохіноліну, 1,23г (6,4ммоля) хлорангідриду тожовтого кольору. 29 78304 30 луол сульфокислоти й 1,4мл (9,9ммоля) триетилодження до кімнатної температури, розбавляють ламіну в 30мл EtOH перемішують протягом 60год. водою, підлуговують NaHCO3, екстрагують етилапри кімнатній температурі. Тверду речовину відфіцетатом, сушать об'єднані органічні екстракти льтровують за допомогою вакуум-фільтра й про(Na2SO4) і концентрують. Після очищення залишку мивають ЕtOН. Таким шляхом одержують 870мг хроматографією на силікагелі з використанням продукту. суміші гексан-етилацетат одержують 670мг твер1 Н-ЯМР (CDCI3): δ=1,45 (t, 3Н), 4,55 (q, 2Н), 7,1 дої речовини жовтого кольору. 1 (d, 1Н), 7,65 (t, 1H), 8,1 (d, 2H), 8,8 (d, 1H). Н-ЯМР ([D]6-ДМСО): δ=5,85 (s, 2Н), 6,25 (d, 5-аміно-2-етоксихінолін 1Н), 6,35 (d, 1Н), 6,45 (d, 1Н), 7,1 (t, 1H), 8,1 (d, 1Н), 860мг (3,9ммоля) 2-етокси-5-нітрохіноліну пе11,4 (шиp.s, 1H). ремішують в 25мл етилацетату в присутності 4-(5-фтор-2-метоксифеніл)-1-(2-гідроксихіно235мг 10%-ного паладію на активованому вугіллі лін-5-іламіно)-4-метил-2-(трифторметил)пентан-2протягом 4,5год. в атмосфері водню. Потім суміш ол й 4-(5-фтор-2-метоксифеніл)-1-(2-хінолон-5фільтрують і фільтрат концентрують. Таким шляіламіно)-4-метил-2-(трифторметил)пентан-2-ол хом одержують 720мг масла світло-жовтого коАналогічно до прикладу 20 піддають взаємодії льору. 226мг (0,73ммоля) 4-(5-фтор-2-метоксифеніл)-21 H-ЯМР (CDCI3): δ=1,45 (t, 3Н), 4,5 (q, 2Н), 6,65 гідрокси-4-метил-2-(фторметил)пентаналю й 140мг (d, 1Н), 6,85 (d, 1Н), 7,3 (d, 1Н), 7,4 (t, 1H), 8,0 (d, (0,87ммоля) 5-аміно-2-хіноліну й таким шляхом 1H). одержують 200мг продукту. 1 1-(2-етоксихінолін-5-іламіно)-4-(5-фтор-2Н-ЯМР ([D]6-ДМСО): δ=1,35 (s, 3Н), 1,55 (s, метоксифеніл)-4-метил-2-(трифторметил)пентан3Н), 2,05 (d, 1Н), 2,8-3,05 (m, 3Н), 3,8 (s, 3Н), 5,3 2-ол (m, 1Н), 5,7 (d, 1H), 5,9 (s, 1H), 6,35 (d, 1H), 6,55 (d, Аналогічно до прикладу 20 піддають взаємодії 1H), 6,9-7,15 (m, 3H), 7,85 (d, 1H), 11,5 (шиp.s, 1H). 500мг (1,6ммоля) 4-(5-фтор-2-метоксифеніл)-2MC(ES):m/e=453. гідрокси-4-метил-2-(трифторметил)пентаналю й Приклад 25 363мг (1,9ммоля) 5-аміно-2-етоксихіноліну й таким 4-(5-фтор-2-гідроксифеніл)-1-(2-гідроксихінолін шляхом одержують 338мг продукту. -5-іламіно)-4-метил-2-(трифторметилпентан-2-ол й 1 Н-ЯМР (CDCI3): δ=1,4 (t, 3Н), 1,45 (s, 3Н), 1,65 4-(5-фтор-2-гідроксифеніл)-1-(2-хінолон-5-іламіно)(s, 3Н), 2,3 (d, 1Н), 2,8 (d, 1H), 3,1 (d, 1H), 3,2 (s, 4-метил-2-(трифторметил)пентан-2-ол 1H), 3,3 (d, 1H), 3,85 (s, 3H), 4,55 (q, 2H), 5,95 (m, 1H), 6,8 (m, 2H), 6,95 (td, 1H), 7,1 (dd, 1H), 7,35 (m, 2H), 7,85 (d, 1H). MC(ES): m/e=481. Приклад 23 Аналогічно до прикладу 21 з 140мг 1-(2-етоксихінолін-5-іламіно)-4-(5-фтор-2(0,31ммоля) 4-(5-фтор-2-метоксифеніл)-1-(2гідроксифеніл)-4-метил-2-(трифторметил)пентангідроксихінолін-5-іламіно)-4-метил-2-(трифторме2-ол тил)пентан-2-олу одержують 32мг продукту. 1 Н-ЯМР (D]6-ДМСО): δ=1,4 (s, 3Н), 1,55 (s, 3Н), 1,9 (d, 1Н), 2,8-3,1 (m, 3Н), 5,25 (m, 1Н), 5,65 (d, 1H), 5,9 (s, 1H), 6,35 (d, 1H), 6,55 (d, 1H), 6,75 (dd, 1H), 6,85 (td, 1H), 7,0 (d, 1H), 7,1 (t, 1H), 7,85 (d, 1H), 9,75 (шиp.s, 1H), 11,5 (шиp.s, 1H). Аналогічно до прикладу 21 з 200мг MC (ES): m/e=439. (0,42ммоля) 1-(2-етоксихінолін-5-іламіно)-4-(5Приклад 26 фтор-2-метоксифеніл)-4-метил-2-(трифторметил) 1-(2-ацетиламінохінолін-5-іламіно)-4-(5-фторпентан-2-олу одержують 172мг продукту. 2-метоксифеніл)-4-метил-2-(трифторметил)пен1 Н-ЯМР (CDCI3): δ=1,45 (t, 3Н), 1,5 (s, 3Н), 1,6 тан-2-ол (s, 3Н), 2,35 (d, 1Н), 2,8 (d, 1Н), 3,2 (d, 1H), 3,3 (шир., 1H), 3,4 (d, 1H), 4,5 (q, 2H), 6,0 (m, 1H), 6,7 (dd, 1H), 6,8 (m, 3H), 7,1 (dd, 1H), 7,35 (m, 2H), 7,95 (d, 1H). MC (ES): m/e=467. Приклад 24 2-хлор-5-нітрохінолін 4-(5-фтор-2-метоксифеніл)-1-(2-гідроксихінолін До 84мл 100%-ної азотної кислоти по краплях -5-іламіно)-4-метил-2-(трифторметил)пентан-2-ол обережно додають 69мл 96%-ної сірчаної кислоти. й 4-(5-фтор-2-метоксифеніл)-1 -(2-хінолон-5Потім при охолодженні льодом додають 25г іламіно)-4-метил-2-(трифторметил)пентан-2-ол (152ммоля) 2-хлорхіноліну й протягом 1 години нагрівають суміш до 60°С. Після охолодження до кімнатної температури суміш обережно вносять у суміш води з льодом. Після 15-хвилинного перемішування тверду речовину промивають водою й сушать під вакуумом при 40°С. Після колонкової 5-аміно-2-хінолон хроматографії на силікагелі з використанням су1,45г (8,3ммоля) 5-аміно-2-метоксихіноліну наміші гексан-етилацетат одержують 10,7 г твердої грівають зі зворотним холодильником в 29мл 6н. речовини білого кольору. НСI протягом 4,5год. Потім витримують для охо 31 78304 32 1 Н-ЯМР (CDCI3): δ=7,65 (d, 1Н), 7,85 (t, 1H), Н-ЯМР (CDCI3): δ=1,5 (s, 3Н), 1,6 (s, 3Н), 2,2 8,35 (d, 1H), 8,4 (d, 1H), 9,0 (d, 1H). (s, 3Н), 2,35 (d, 1Н), 2,85 (d, 1H), 3,2 (dd, 1H), 3,35 2-аміно-5-нітрохінолін (dd, 1H), 4,4 (шир., 3Н), 6,05 (d, 1H), 6,6 (dd, 2H), 450мг (2,2ммоля) 2-хлор-5-нітрохіноліну, 10мл 6,75 (td, 1H), 7,1 (dd, 1H), 7,15 (d, 1H), 7,4 (t, 1H), 25%-ної аміачної води й 10мл ТГФ протягом 8год. 7,95 (d, 1H), 8,2 (d, 1H), 8,35 (шир. 1Н). перемішують у посудині, яка працює під тиском, MC (ES): m/e=480. при 120°С. Потім суміш розбавляють розчином Приклад 28 NaCl й екстрагують етилацетатом. Об'єднані орга1-(2-амінохінолін-5-іламіно)-4-(5-фтор-2-метокнічні фази сушать (Na2SO4) і концентрують. Таким сифеніл)-4-метил-2-(трифторметил)пентан-2-ол шляхом одержують 370мг продукту. 1 Н-ЯМР ([D] 6-ДМСО): δ=6,9 (шиp.s, 2Н), 7,0 (d, 1Н), 7,65 (t, 1H), 7,8 (d, 1H), 7,9 (d, 1H), 8,35 (d, 1H). 2-ацетиламіно-5-нітрохінолін 360мг (1,9 моля) 2-аміно-5-нітрохіноліну протягом 15год. перемішують із 4мл (50ммолів) піридиРозчин 535мг (1,05ммоля) 1-(2-ацену й 2мл (21ммоль) ацетангідриду при кімнатній тиламінохінолін-5-іламіно)-4-(5-фтор-2-метокситемпературі. Після цього суміш зливають у насифеніл)-4-метил-2-(трифторметил)пентан-2-олу в чений розчин NaHCO3, перемішують протягом ЗО 18мл суміші EtOH-ΤΓΦ (2:1) протягом 90хв. нагріхв, розбавляють насиченим розчином NaCl й екствають зі зворотним холодильником з 12мл 3н. розрагують етилацетатом. Екстракти сушать (Na2SO4) чину їдкого натрію. Після цього суміш розбавляють і концентрують. Таким шляхом одержують 410мг насиченим NaCl й екстрагують етилацетатом. Експродукту жовтого кольору. тракти сушать (Na2SO4) і концентрують під вакуу1 H-ЯМР (CDCI3): δ=2,3 (s, 3Н), 7,75 (t, 1Н), 8,1 мом. Після колонкової хроматографії на силікагелі (d, 1Н), 8,2 (шир. 1Н), 8,25 (d, 1H), 8,65 (d, 1H), 9,0 за допомогою етилацетату одержують 380мг про(d, 1H). дукту у вигляді масла жовтого кольору. 1 2-ацетиламіно-5-амінохінолін Н-ЯМР ([D]6-ДМСО): δ=1,35 (s, 3Н), 1,55 (s, 400мг (1,7ммоля) 2-ацетиламіно-5-нітрохіно3Н), 2,05 (d, 1Н), 2,7-3,0 (m, 3Н), 3,8 (s, 3Н), 5,05 ліну й 105мг 10%-ного паладію на активованому (m, 1H), 5,55 (d, 1H), 6,05 (шир., 1H), 6,25 (s, 2H), вугіллі перемішують в 20мл суміші етилацетат6,6 (d, 1H), 6,75 (d, 1H), 6,9-7,2 (m, 3H), 7,85 (d, МеОН (3:1) протягом 4год. в атмосфері водню при 1H). кімнатній температурі. Потім суміш фільтрують, MC (ES): m/e=452. концентрують й очищають за допомогою колонкоПриклад 29 вої хроматографії на силікагелі з використанням 1-(2-амінохінолін-5-іламіно)-4-(5-фтор-2-гідросуміші гексан-етилацетат. Таким шляхом одержуксифеніл)-4-метил-2-(трифторметилпентан-2-ол ють 210мг продукту. 1 H-ЯМР ([D]6-ДМСО): δ=2,15 (s, 3Н), 5,9 (s, 2Н), 6,6 (d, 1Н), 6,95 (d, 1Н), 7,35 (t, 1H), 8,1 (d, 1H), 8,5 (d, 1H). 1-(2-ацетиламінохінолін-5-іламіно)-4-(5-фтор2-метоксифеніл)-4-метил-2-(трифторметил)пенАналогічно до прикладу 28 з 48мг (0,1ммоля) тан-2-ол 1-(2-ацетиламінохінолін-5-іламіно)-4-(5-фтор-2Аналогічно до прикладу 20 263мг (0,86ммоля) гідроксифеніл)-4-метил-2-(трифторметил)пентан4-(5-фтор-2-метоксифеніл)-2-гідрокси-4-метил-22-олу одержують 21мг продукту. (трифторметил)пентаналю піддають взаємодії з 1 Н-ЯМР ([D]6-ДМСО): δ=1,4 (s, 3Н), 1,55 (s, 3Н), 205мг (1,0ммоль) 2-ацетиламіно-5-амінохіноліну й 1,95 (d, 1Н), 2,85 (dd, 1Н), 3,05 (d, 1H), 5,05 (m, 1H), таким шляхом одержують 197мг продукту. 5,6 (d, 1H), 6,25 (s, 2H), 6,6 (d, 1H), 6,7 (m, 2H), 6,8 1 Н-ЯМР (CDCI3): δ=1,45 (s, 3Н), 1,55 (s, 3Н), (m, 1Н), 6,95 (dm, 1H), 7,1 (t, 1H), 7,85 (d, 1H). 2,25 (s, 3Н), 2,3 (d, 1Н), 2,8 (d, 1Н), 3,15 (dd, 1H), MC(ES):m/e=438. 3,2 (шир., 1H), 3,3 (dd, 1H), 3,85 (s, 3H), 4,3 (шир., Приклад 30 3Н), 5,95 (d, 1Н), 6,8 (dd, 2H), 6,9 (td, 1H), 7,1 (dd, 1-(2-(ацетил(метил)аміно)хінолін-5-іламіно)-41H), 7,2 (d, 1H), 7,4 (t, 1H), 8,0 (d, 1H), 8,3 (m, 2H). (5-фтор-2-метоксифеніл)-4-метил-2-(трифтормеMC (ES): m/e=494. тил)пентан-2-ол Приклад 27 1-(2-ацетиламінохшолін-5-іламіно)-4-(5-фтор2-гідроксифеніл)-4-метил-2(трифторметил)пентан-2-ол 1 Аналогічно до прикладу 21 з 100мг (0,20ммоля) 1-(2-ацетиламінохінолін-5-іламіно)-4(5-фтор-2-метоксифеніл)-4-метил-2-(трифторметил)пентан-2-олу одержують 79мг продукту. 2-метиламіно-5-нітрохінолін 1,0г (4,8ммоля) 2-хлор-5-нітрохіноліну й 20мл 2-молярного розчину метиламіну в метанолі протягом 8год. нагрівають у посудині, яка працює під тиском, до 120°С. Після додавання толуолу суміш концентрують. Залишок очищають за допомогою колонкової хроматографії на силікагелі з використанням суміші гексан-етилацетат. Таким шляхом 33 78304 34 одержують 580мг продукту. 5-іламіно)-4-(5-фтор-2-гідроксифенілУ4-метил-21 Н-ЯМР (CDCI3): δ=3,1 (d, 3Н), 4,95 (шир., 1Н), (трифторметил)пентан-2-ол 6,8 (d, 1Н), 7,55 (t, 1Н), 7,95 (2d, 2H), 8,6 (d, 1H). 2-ацетил(метил)аміно-5-нітрохінолін 580мг (2,4ммоля) 2-метиламіно-5-нітрохіноліну перемішують із 4мл (50ммолів) піридину й 2мл (21ммоль) ацетангідриду протягом 15год. при кімнатній температурі й протягом 4,5год. при 60°С. 200мг (0,39ммоля) 1-(2-(ацетил(метил)аміПісля цього суміш розбавляють етилацетатом, но)хінолін-5-іламіно)-4-(5-фтор-2-метоксифеніл)-4зливають у насичений розчин NaHCO3, перемішуметил-2-(трифторметил)пентан-2-олу в 17мл ють протягом 30хв. й екстрагують етилацетатом. СН2СI2 змішують при 0°С з 7,6мл 1-молярного розЕкстракти сушать (Na2SO4) і концентрують. Заличину триброміду бору в СН 2СI2 . Через 15год. при шок очищають хроматографією на силікагелі з кімнатній температурі додають ще 7,6мл 1використанням суміші гексан-етилацетат. Таким молярного розчину триброміду бору в СН 2СI2 і шляхом одержують 660мг твердої речовини жовпротягом 20год. перемішують при кімнатній темтого кольору. пературі. Далі суміш зливають у насичений розчин 1 Н-ЯМР (CDCI3): δ=2,35 (s, 3Н), 3,6 (s, 3Н), NaHCO3, розбавляють насиченим розчином NaCl й 7,75 (t, 1Н), 7,9 (d, 1H), 8,25 (d, 1H), 8,3 (d, 1H), 9,0 етилацетатом, перемішують 15хв. й екстрагують (d, 1H). етилацетатом. Об'єднані органічні екстракти су2-ацетил(метил)аміно-5-амінохінолін шать (Na2SO4) і концентрують. Після хроматогра650мг (2,7ммоля) 2-ацетил(метил)аміно-5фії на силікагелі з використанням суміші гексаннітрохіноліну й 161мг 10%-ного паладію на активоетилацетат одержують 98мг продукту. 1 ваному вугіллі протягом 2год. перемішують в 25мл Н-ЯМР (CDCI3): δ=1,4 (t, 3Н), 1,55 (s, 3Н), 2,3 етилацетату при кімнатній температурі в атмос(d, 1Н), 2,45 (s, 3H), 2,6 (d, 1H), 2,95 (t, 1H), 3,25 фері водню. Потім суміш фільтрують і концентру(dd, 1H), 3,65 (s, 3H), 3,95 (s, 1H), 4,1 (m, 1H), 5,7 ють. Таким шляхом одержують 490мг продукту. (шиp.s, 1H), 6,45 (dd, 1H), 6,6 (td, 1H), 6,9 (dd, 1H), 1 H-ЯМР (CDCI3): δ=2,2 (s, 3Н), 3,5 (s, 3Н), 4,2 7,6 (d, 1H), 7,95 (d, 1H), 8,05 (s, 1H). (шир., 2Н), 6,8 (d, 1H), 7,4 (d, 1Н), 7,45 (d, 1H), 7,5 MC (ES): m/e=650, 652, 654 (1:2:1). (t, 1Н), 8,2 (d, 1H). Приклад 33 1-(2-(ацетил(метил)аміно)хінолін-5-іламіно)-41-(6,8-дибром-2-(метиламіно)хінолін-5-іламі(5-фтор-2-метоксифеніл)-4-метил-2но)-4-(5-фтор-2-гідроксифеніл)-4-метил-2-(три(трифторметил)пентан-2-ол фторметил)пентан-2-ол Аналогічно до прикладу 20 піддають взаємодії 576мг (1,9ммоля) 4-(5-фтор-2-метоксифеніл)-2гідрокси-4-метил-2-(трифторметил)пентаналю й 480мг (2,2ммоля) 2-ацетил(метил)аміно-5амінохіноліну й таким шляхом одержують 330мг продукту. 1 Аналогічно до прикладу 28 з 100мг Н-ЯМР (CDCI3): δ=1,45 (s, 3Н), 1,55 (s, 3Н), (0,15ммоля) 1-(2-(ацетил(метил)аміно)-6,82,2 (s, 3Н), 2,4 (d, 1H), 2,75 (d, 1H), 3,15 (dd, 1H), дибромхінолін-5-іламіно)-4-(5-фтор-23,2 (s, 1Н), 3,35 (dd, 1H), 3,5 (s, 3H), 3,85 (s, 3H), гідроксифеніл)-4-метил-2-(трифторметил)пентан4,3 (m, 1H), 6,1 (d, 1H), 6,8 (dd, 1H), 6,95 (td, 1H), 2-олу одержують 97мг продукту. 7,1 (dd, 1H), 7,3-7,5 (m, 3H), 8,0 (d, 1H). 1 Н-ЯМР ([D]б -ДМСО): δ=1,3 (s, 3Н), 1,5 (s, 3Н), MC (ES): m/e=508. 1,95 (d, 1Н), 2,95 (d, 3Н), 3,0 (d, 1Н), 3,15 (dd, 1H), Приклад 31 4,4 (m, 1H), 6,15 (s, 1H), 6,65 (m, 2H), 6,75 (td, 1H), 4-(5-фтор-2-метоксифеніл)-4-метил-1-(26,85 (dd, 1H), 7,35 d, 1H), 7,55 (d, 1H), 7,8 (s, 1Н), (метиламіно)хінолін-5-іламіно)-2-(трифторме9,55 (s, 1H). тил)пентан-2-ол Приклад 34 4-(5-фтор-2-гідроксифеніл)-4-метил-1-(2(метиламіно)хінолін-5-іламіно)-2-(трифторметил) пентан-2-ол Аналогічно до прикладу 28 з 83мг (0,16ммоля) 1-(2-(ацетил(метил)аміно)хінолін-5-іламіно)-4-(5фтор-2-метоксифеніл)-4-метил-2-(трифторметил) пентан-2-олу одержують 48мг продукту. 1 Н-ЯМР (CDCI3): δ=1,4 (t, 3Н), 1,5 (s, 3Н), 2,2 (d, 1Н), 2,75 (d, 1Н), 2,95 (d, 3Н), 3,0 (m, 1H), 3,2 (m, 1H), 3,8 (s, 3H), 4,0 (m, 1H), 5,05 (шир., 1H), 5,75 (d, 1H), 6,5 (d, 2H), 6,75 (dd, 1H), 6,9 (td, 1H), 7,05 (dd, 1H), 7,1 (m, 1H), 7,2 (m, 1H), 7,65 (d, 1H). MC (ES): m/e=466. Приклад 32 1-(2-(ацетил(метил)аміно)-6,8-дибромхінолін 45мг (0,07ммоля) 1-(6,8-дибром-2(метиламіно)хінолін-5-іламіно)-4-(5-фтор-2гідроксифеніл)-4-метил-2-(трифторметил)пентан2-олу й 50мг 10%-ного паладію на активованому вугіллі протягом 90хв. перемішують в 2мл в атмосфері водню. Потім суміш фільтрують і концентрують. Після колонкової хроматографії на силікагелі з використанням суміші етилацетат-МеОН одержують 19мг продукту. 35 78304 36 Н-ЯМР ([D]6-ДМСО): δ=1,4 (s, 3Н), 1,55 (s, 3Н), 1,9 (d, 1Н), 2,8 (d, ЗН й т, 1Н), 3,05 (d, 1Н), 3,15 (d, 1Н), 4,95 (т, 1Н), 5,6 (d, 1Н), 5,95 (s, 1Н), 6,6 (d, 1H), 6,75 (dd, 1Н), 6,8 (d, 1Н), 6,85 (td, 1Н), 7,0 (dd, 1Н), 7,05 (t, 1Н), 7,8 (d, 1Н), 9,7 (s, 1Н). МС (ES): m/е=452. Приклад 35 4-(5-фтор-2-метоксифеніл)-4-метил-1-(2Амід 5-амінохінолін-2-карбонової кислоти метилхінолін-5-іламіно)-2-(трифторметил)пентан840мг (4,16ммоля) метилового ефіру 52-ол амінохінолін-2-карбонової кислоти розчиняють в 70мл 7н. розчину аміаку в метанолі. Далі суміш перемішують протягом 3,5год. при 40°С, а потім протягом 20год. при кімнатній температурі. Після видалення розчинника під вакуумом проводять очищення на силікагелі з використанням суміші гексан-етилацетат (0-100%), а також суміші етила300мг (0,97ммоля) 4-(5-фтор-2-метоксифеніл)цетат-метанол (0-10%). Таким шляхом одержують 2-гідрокси-4-метил-2-(трифторметил)пентаналю й 690мг (88% від теорії) продукту. 184мг (1,16ммоля) 5-аміно-2-метилхіноліну нагрі1 Н-ЯМР (ДМСO-d6): δ=6,11 (s, 2Н), 6,78 (d, 1Н), вають в 10мл оцтової кислоти протягом 6год. до 7,27 (d, 1Н), 7,51 (t, 1H), 7,70 (s, 1H), 7,96 (d, 1H), 125°С. Потім після охолодження до кімнатної тем8,20 (s, 1H), 8,68 (d, 1H). ператури змішують із 320мг (1,51ммоля) триацетоАмід 5-[4-(5-фтор-2-метоксифеніл)-2-гідроксиксиборогідриду натрію й залишають для перемі4-метил-2-трифторметилпентиліденаміно]хіноліншування протягом наступних 16год. Після 2-карбонової кислоти додавання ще 320мг (1,51ммоля) триацетоксибоРозчин 290мг (1,55ммоля) аміду 5рогідриду натрію й 2-годинного перемішування амінохінолін-2-карбонової кислоти, 616мг додають толуол і концентрують під вакуумом. За(2,0ммоля) 4-(5-фтор-2-метоксифеніл)-2-гідроксилишок розчиняють в етилацетаті, органічну фазу 4-метил-2-трифторметилпентаналю, 3,80мл конпромивають насиченим розчином гідрокарбонату центрованої оцтової кислоти в 30мл толуолу пронатрію й насиченим розчином хлориду натрію й тягом 20год. кип'ятять зі зворотним холодильнисушать над сульфатом натрію. Після хроматограком з використанням водовіддільника. Потім фії на силікагелі з використанням суміші гексанрозчинник видаляють під вакуумом. Після очиетилацетат (0-60%) одержують 221мг продукту. 1 щення залишку на силікагелі з використанням суН-ЯМР (CDCI3): δ=1,46 (s, 3Н), 1,57 (s, 3Н), міші гексан-етилацетат (0-70%) одержують 438мг 2,33 (d, 1Н), 2,72 (s, 3Н), 2,78 (d, 1Н), 3,12 (dd, 1H), (59% від теорії) продукту. 3,30 (dd, 1H), 3,84 (s, 3H), 4,23 (шир., 1H), 6,01 (d, 1 H-ЯМР (300МГц, ДМСО-d6): δ=1,33 (s, 3Н), 1H), 6,80 (dd, 1H), 6,94 (ddd, 1H), 7,12 (dd, 1H), 7,21 1,53 (s, 3Н), 2,20 (d, 1Н), 3,33 (d, 1H), 3,77 (s, 3H), (d, 1H), 7,41 (t, 1H), 7,46 (d, 1H), 7,88 (d, 1H). 6,31 (s, 1H), 6,48-6,55 (m, 1H), 6,70-6,75 (m, 3H), Приклад 36 7,59 (s, 1H), 7,70 (t, 1H), 7,82 (шир., 1H), 7,98 (d, 4-(5-фтор-2-гідроксифеніл)-4-метил-1-(21H), 8,31 (шир., 1H), 8,82 (d, 1H). метилхінолін-5-іламіно)-2-(трифторметил)пентанАмід 5-[4-(5-фтор-2-метоксифеніл)-2-гідрокси2-ол 4-метил-2-трифторметилпентиламіно]хінолін-2карбонової кислоти 253мг (0,53ммоля) аміду 5-[4-(5-фтор-2метоксифеніл)-2-гідрокси-4-метил-2-трифторметилпентиліденаміно]хінолін-2-карбонової кислоти розчиняють в 10мл суміші тетрагідрофуранАналогічно до прикладу 35 153мг (0,34ммоля) метанол (50%) і змішують із 101мг (2,65ммоля) 4-(5-фтор-2-метоксифеніл)-4-метил-1-(2-метилхіборогідриду натрію. Через 20год. розчинник виданолін-5-іламіно)-2-(трифторметил)пентан-2-олу в ляють під вакуумом. У результаті наступної пере17мл СН2СI2 піддають взаємодії з 6,8мл 1кристалізації залишку й очищення сконцентровамолярного розчину триброміду бору в СН 2СІ 2. Пісного маточного розчину на силікагелі з ля хроматографії на силікагелі з використанням використанням суміші гексан-етилацетат (0-50%) суміші гексан-етилацетат (0-55%) одержують 99мг одержують 116мг (46% від теорії) продукту. 1 продукту. H-ЯМР (300МГц, ДМCO-d6): δ=1,38 (s, 3Н), 1 H-ЯМР (CDCI3): δ=1,51 (s, 3Н), 1,59 (s, 3Н), 1,56 (s, 3Н), 2,05 (d, 1Н), 2,91-2,96 (m, 2H), 3,07 (d, 2,41 (d, 1Н), 2,70 (s, 3Н), 2,80 (d, 1Н), 3,24 (dd, 1Н), 1Н), 3,78 (s, 3Н), 5,59 (t, 1Н), 5,99 (s, 1H), 6,02 (d, 3,42 (dd, 1H), 4,32 (шир., 1H), 6,06 (d, 1H), 6,63 (dd, 1Н), 6,91-7,06 (m, 2H), 7,08 (dd, 1H), 7,32 (d, 1H), 1H), 6,80 (ddd, 1H), 7,09 (dd, 1H), 7,18 (d, 1H), 7,35 7,46 (t, 1H), 7,72 (шир., 1Н), 8,03 (d, 1H), 8,21 (шир., (t, 1H), 7,42 (d, 1Н), 7,87 (d, 1H). 1H), 8,49 (d, 1H). Приклад 37 Приклад 38 Амід 5-[4-(5-фтор-2-метоксифеніл)-2-гідроксиАмід 5-[4-(5-фтор-2-гідроксифеніл) 2-гідрокси4-метил-2-трифторметилпентиламіно]хінолін-24-метил-2-трифторметилпентиламіно]хінолін-2карбонової кислоти карбонової кислоти 1 37 78304 38 карбонової кислоти піддають взаємодії з 31мг (0,8ммоля) натрію в 5,0мл метанолу й 1,0мл тетрагідрофурану. Після відповідної переробки й хроматографії на силікагелі з використанням суміші гексан-етилацетат (0-100%) одержують 50мг (54% від теорії) продукту. 1 Н-ЯМР (300МГц, ДМСO-d6): δ=1,38 (s, 3Н), 1,56 (s, 3Н), 2,05 (d, 1Н), 2,88-3,11 (m, 3Н), 3,78 (s, 220мг (0,46ммоля) аміду 5-[4-(5-фтор-23Н), 5,82-5,84 (m, 1Н), 5,94 (s, 1H), 6,14 (d, 1H), метоксифеніл)-2-гідрокси-4-метил-2-трифторме6,89-7,09 (m, 3H), 7,31 (d, 1H), 7,54 (t, 1H), 7,93 (d, тилпентиламіно]хінолін-2-карбонової кислоти роз1H), 8,61 (d, 1H). чиняють в 5,0мл дихлорметану й змішують із Приклад 40 9,2мл 1н. розчину триброміду бору в дихлорметаАмід 8-[4-(5-фтор-2-метоксифеніл)-2-гідроксині. Через 20год. реакцію припиняють при кімнатній 4-метил-2-трифторметилпентиламіно]хінолін-2температурі додаванням до реакційної суміші мекарбонової кислоти танолу. Потім під вакуумом видаляють розчинник, розчиняють залишок у насиченому розчині гідрокарбонату натрію й етилацетаті, екстрагують етилацетатом і сушать об'єднані органічні фази над сульфатом натрію. Після видалення розчинника й очищення на силікагелі з використанням суміші гексан-етилацетат (0-100%) одержують 60мг (28% від теорії) продукту. 1 H-ЯМР (300МГц, ДМСО-d6): δ=1,40 (s, 3Н), 1,57 (s, 3Н), 1,93 (d, 1Н), 2,98 (dd, 1Н), 3,16-3,20 (m, 2H), 5,52 (шир., 1Н), 5,99 (шир., 1Н), 6,68 (dd, 1H), 6,78-6,84 (m, 1Н), 7,01 (dd, 1H), 7,32 (d, 1H), 7,45 (t, 1H), 7,71 (s, 1H), 8,03 (d, 1H), 8,21 (s, 1Н), 8,46 (d, 1H), 9,73 (s, 1H). Приклад 39 Нітрил 5-[4-(5-фтор-2-метоксифеніл)-2гідрокси-4-метил-2-трифторметилпентиламіно]хінолін-2-карбонової кислоти Нітрил 5-[4-(5-фтор-2-метоксифеніл)-2гідрокси-4-метил-2-трифторметилпентиліденаміно] хінолін-2-карбонової кислоти 220мг (0,46ммоля) аміду 5-[4-(5-фтор-2метоксифеніл)-2-гідрокси-4-метил-2-трифторметилпентиліденаміно]хінолін-2-карбонової кислоти й 1,80мл (3,2ммоля) триетиламіну розчиняють в 18мл дихлорметану й змішують із 0,44мл (1,38ммоля) трифтороцтового ангідриду. Через 2хв. реакцію припиняють додаванням до реакційної суміші води. Потім тричі екстрагують етилацетатом і промивають об'єднані органічні фази 1н. розчином гідроксиду натрію. Після сушіння над сульфатом натрію, видалення розчинника під вакуумом, а також хроматографії на силікагелі з використанням суміші гексан-етилацетат (0-100%) одержують 190мг (90% від теорії) продукту. 1 H-ЯМР (300МГц, CDCI3): δ=1,37 (s, 3Н), 1,57 (s, 3Н), 2,30 (d, 1Н), 3,47 (d, 1Н), 3,80 (s, 3Н), 4,69 (s, 1Н), 6,38-6,43 (m, 1Н), 6,59-6,60 (m, 2H), 6,80 (dd, 1H), 7,54 (s, 1H), 7,65 (t, 1H), 7,74 (d, 1H), 8,03 (d, 1H), 8,44 (d, 1H). Нітрил 5-[4-(5-фтор-2-метоксифеніл)-2гідрокси-4-метил-2-трифторметилпентиламіно]хінолін-2-карбонової кислоти Аналогічно до прикладу 37 90мг (0,2ммоля) нітрилу 5-[4-(5-фтор-2-метоксифеніл)-2-гідрокси-4метил-2-трифторметилпентиліденаміно]хінолін-2 Амід 8-амінохінолін-2-карбонової кислоти Аналогічно до прикладу 37 120мг (0,59ммоля) метилового ефіру 8-амінохінолін-2-карбонової кислоти піддають взаємодії з 10мл 7н. розчину аміаку в метанолі. Після очищення на силікагелі з використанням суміші гексан-етилацетат одержують 79мг (72% від теорії) продукту. 1 Н-ЯМР (300МГц, ДМСО-d6): δ=6,51 (шир., 2Н), 6,84 (d, 1Н), 7,04 (d, 1Н), 7,35 (t, 1Н), 7,58 (шир., 1Н), 8,03 (d, 1Н), 8,27 (d, 1Н), 8,87 (шир., 1Н). Амід 8-[4-(5-фтор-2-метоксифеніл)-2-гідрокси4-метил-2-трифторметилпентиліденаміно]хінолін2-карбонової кислоти Аналогічно до прикладу 37 535мг (2,86ммоля) суміші амідів 5- і 8-амінохінолін-2-карбонової кислоти піддають взаємодії з 1,06г (3,43ммоля) 4-(5фтор-2-метоксифеніл)-2-гідрокси-4-метил-2(трифторметил)пентаналю в 4,50мл концентрованої оцтової кислоти й 20мл толуолу. Через 40год. проводять очищення на силікагелі з використанням суміші гексан-етилацетат (0-40%) і таким шляхом одержують 624мг (46% від теорії) необхідного продукту. 1 H-ЯМР (300МГц, CDCI3): δ=1,37 (s, 3Н), 1,60 (s, 3Н), 2,27 (d, 1Н), 3,46 (d, 1H), 3,70 (s, 3H), 5,08 (s, 1H), 5,60 (шир., 1H), 6,34-6,48 (m, 2H), 6,83 (dd, 1H), 7,00 (d, 1H), 7,49-7,59 (m, 2H), 7,65-7,78 (m, 2H), 8,32 (s, 2H). Амід 8-[4-(5-фтор-2-метоксифеніл)-2-гідрокси4-метил-2-трифторметилпентиламіно]хінолін-2карбонової кислоти 703мг (1,47ммоля) аміду 8-[4-(5-фтор-2метоксифеніл)-2-гідрокси-4-метил-2-трифторметилпентиліденаміно]хінолін-2-карбонової кислоти в 10мл метанолу й 5,0мл тетрагідрофурану змішують із 449мг (11,8ммоля) борогідриду натрію. Потім через 16год. концентрують розчинник, розчиняють залишок у воді й етилацетаті, екстрагують етилацетатом і сушать об'єднані органічні фази над сульфатом натрію. Після видалення розчинника й очищення на силікагелі з використанням суміші гексан-етилацетат (0-50%), а також суміші дихлорметан-метанол (0-7%) одержують 358мг 39 78304 40 (51% від теорії) продукту. Після додавання 2,75г (2,5ммоля) 1 Н-ЯМР (300МГц, ДМСО-d6): δ=1,39 (s, 3Н), трис(дибензиліденацетон)дипаладію реакційну 1,58 (s, 3Н), 2,10 (d, 1Н), 2,86 (d, 1Н), 3,13 (d, 2H), суміш кип'ятять зі зворотним холодильником про3,76 (s, 3H), 5,87 (s, 1H), 6,24 (d, 1H), 6,81-6,97 (m, тягом 20год. Потім фільтрують через целіт і про3H), 7,06-7,11 (m, 2H), 7,32 (t, 1H), 7,76 (шир., 1H), мивають етилацетатом. Далі фільтрат змішують із 8,06 (d, 1H), 8,31 (d, 1H), 8,45 (шир., 1H). насиченим розчином хлориду амонію. Після цього Приклад 41 екстрагують етилацетатом і сушать об'єднані орНітрил 8-[4-(5-фтор-2-метоксифеніл)-2ганічні фази над сульфатом натрію. Після видагідрокси-4-метил-2-трифторметилпентиламіно]хілення розчинника під вакуумом і наступної хроманолін-2-карбонової кислоти тографії на силікагелі з використанням суміші гексан-етилацетат (5-20%) одержують 3,05г (62% від теорії) продукту. 1 Н-ЯМР (300МГц, CDCI3): δ=5,78 (d, 1H), 6,40 (d, 1H), 7,03 (dd, 1H), 7,75-7,81 (m, 2H), 8,28-8,38 (m., 2H), 8,95 (d, 1H). 2-етилхінолін-5-іламін 1,0г (5,0ммолів) 5-нітро-2-вінілхіноліну розчиняють в 30мл етилацетату. Після додавання 100мг 185мг (0,386ммоля) аміду 8-[4-(5-фтор-2паладію на активованому вугіллі й 50мг карбонату метоксифеніл)-2-гідрокси-4-метил-2-трифторменатрію реакційну суміш витримують для перемітилпентиламіно]хінолін-2-карбонової кислоти в шування в атмосфері водню протягом 20год. при 5,0мл диметилформаміду змішують із 397мг кімнатній температурі. Потім суміш фільтрують (2,80ммоля) дифосфорпентоксиду. Через п'ять через целіт і промивають етилацетатом. Після днів при кімнатній температурі відфільтровують видалення розчинника під вакуумом і хроматогранерозчинні компоненти. Потім фільтрат розбавляфії на силікагелі з використанням суміші гексанють етилацетатом і насиченим розчином хлориду етилацетат (0-100%), а потім за допомогою суміші натрію. Далі екстрагують етилацетатом, сушать етилацетат-метанол (0-30%) одержують 720мг об'єднані органічні фази над сульфатом натрію, (84% від теорії) продукту. 1 після чого концентрують розчинник. Залишки диН-ЯМР (300МГц, ДМСО-d6): δ=1,29 (t, 3Н), метилформаміду видаляють під високим вакуу2,86 (q, 2Н), 5,87 (шир, 2Н), 6,63 (d, 1Н), 7,09 (d, мом. Після очищення на силікагелі з використан1Н), 7,25 (d, 1Н), 7,35 (t, 1Н), 8,41 (d, 1Н). ням суміші гексан-етилацетат (0-30%) одержують 1-(2-етилхінолін-5-іліміно)-4-(5-фтор-2-меток102мг (57% від теорії) продукту. сифеніл)-4-метил-2-(трифторметил)пентан-2-ол 1 Н-ЯМР (300МГц, ДМСO-d6): δ=1,37 (s, 3Н), Аналогічно до прикладу 37 334мг (1,94ммоля) 1,56 (s, 3Н), 1,99 (d, 1Н), 2,95 (dd, 1Н), 3,03 (d, 1Н), 2-етилхіноліну-5-іламіну піддають взаємодії з 3,13 (dd, 1H), 3,79 (s, 3H), 6,16-6,17 (m, 2H), 6,23 500мг (1,62ммоля) 4-(5-фтор-2-метоксифеніл)-2(d, 1H), 6,76-6,79 (m, 2H), 7,01 (dd, 1H), 7,15 (d, гідрокси-4-метил-2-трифторметилпентаналю в 1H), 7,43 (t, 1H), 7,96 (d, 1H), 8,44 (d, 1H). 2,20мл концентрованої оцтової кислоти й 15мл Приклад 42 толуолу. Після очищення на силікагелі з викорис1-(2-етилхінолін-5-іламіно)-4-(5-фтор-2-метоктанням суміші гексан-етилацетат (0-100%) одерсифеніл)-4-метил-2-(трифторметил)пентан-2-ол жують 600мг (80% від теорії) відповідного іміну. 1 H-ЯМР (300МГц, CDCI3): δ=1,38 (s, 3Н), 1,41 (t, 3Н), 1,57 (s, 3Н), 2,30 (d, 1Н), 3,03 (q, 2H), 3,42 (d, 1H), 3,80 (s, 3H), 4,88 (s, 1H), 6,40-6,56 (m, 3H), 6,81 (dd, 1H), 7,37 (d, 1H), 7,47-7,55 (m, 2H), 7,92 (d, 1H), 8,20 (d, 1H). 1-(2-етилхінолін-5-іламіно)-4-(5-фтор-2-метоксифеніл)-4-метил-2-(трифторметил)пентан-2-ол 2-хлор-5-нітрохінолін 600мг (1,3ммоля) 1-(2-етилхінолін-5-іліміно)-410,0г (61,1ммоля) 2-хлорхіноліну розчиняють в (5-фтор-2-метоксифеніл)-4-метил-2-(трифторме34мл концентрованої сірчаної кислоти. Потім при тил)пентан-2-олу в 5,0мл метанолу при 0°С змі0°С порціями додають 8,4г (76,4ммоля) нітрату шують із 197мг (5,2ммоля) борогідриду натрію. калію. Через 20год. при кімнатній температурі реаПісля цього через 2 години при кімнатній темперакційну суміш зливають на суміш води з льодом і турі додають воду й під вакуумом видаляють меводною фазою екстрагують етилацетатом. Об'єдтанол. Потім екстрагують водну фазу ди хлорметанані органічні фази промивають насиченим розчином, сушать об'єднані органічні фази над ном гідрокарбонату натрію й суша ть над сульфасульфатом натрію й під вакуумом видаляють розтом натрію. Після видалення розчинника під чинник. Після очищення на силікагелі з викорисвакуумом і хроматографії на силікагелі з використанням суміші гексан-етилацетат (0-100%) одертанням суміші гексан-етилацетат (10-100%) одержують 400мг (66% від теорії) продукту. жують 5,06г (40% від теорії) продукту. 1 1 H-ЯМР (300МГц, CDCI3): δ=1,37 (t, 3Н), 1,46 Н-ЯМР (300МГц, CDCI3): δ=7,62 (d, 1Н), 7,84 (s, 3Н), 1,57 (s, 3Н), 2,33 (d, 1H), 2,78 (d, 1H), 2,98 (t, 1Н), 8,33 (d, 1Н), 8,39 (d, 1H), 8,98 (d, 1H). (q, 2H), 3,13 (dd, 1H), 3,19 (шир., 1H), 3,30 (dd, 1H), 5-нітро-2-вінілхінолін 3,84 (s, 3H), 4,24 (шир., 1H), 6,01 (d, 1H), 6,80 (dd, 5,06г (24,5ммоля) 2-хлор-5-нітрохіноліну, 1,26г 1H), 6,91-6,98 (m, 1H), 7,12 (dd, 1H), 7,23 (d, 1H), (4,9ммоля) трифенілфосфіну й 8,0г (25,2ммоля) 7,38-7,49 (m, 2H), 7,91 (d, 1H). три-н-бутилвінілолова розчиняють в 60мл толуолу. 41 78304 42 Приклад 43 Приклад 45 1-(2-етилхінолін-5-іламіно)-4-(5-фтор-2-гідрок1-(хінолін-5-іламіно)-3-[1-(5-фтор-2-гідроксисифеніл)-4-метил-2-(трифторметил)пентан-2-ол феніл)циклопроп-1-іл]-2-(трифторметил)пропан-2ол 230мг (0,49ммоля) 1-(2-етилхінолін-5-іліміно)4-(5-фтор-2-метоксифеніл)-4-метил-2-(трифторметил)пентан-2-олу в 4,5мл дихлорметану при 0°С змішують із 7,30мл (7,30ммоля) 1-молярного розчину триброміду бору. Через 23 години при кімнатній температурі реакцію припиняють додаванням до реакційної суміші 30мл метанолу. Потім реакційну суміш протягом 1 години витримують для перемішування при кімнатній температурі, після чого під вакуумом видаляють розчинник. Після хроматографії на силікагелі з використанням суміші етилацетат-метанол (0-10%) одержують 60мг (27% від теорії) продукту. 1 Н-ЯМР (300МГц, ДМСO-d6): δ=1,29 (t, 3Н), 1,40 (s, 3Н), 1,56 (s, 3Н), 1,93 (d, 1Н), 2,87 (q, 2H), 2,95 (d, 1H), 3,08-3,20 (m, 2H), 5,34 (шир, 1H), 5,89 (d, 1H), 5,96 (s, 1H), 6,73 (шир, 1H), 6,83-6,88 (m, 1H), 7,01 (dd, 1H), 7,14 (d, 1H), 7,27-7,34 (m, 2H), 8,18 (d, 1H), 9,73 (s, 1H). Приклад 44 1-(хінолін-5-іламіно)-3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]-2-(трифторметил)пропан-2-ол 1-(хінолін-5-іліміно)-3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]-2-(трифторметил)пропан-2-ол Аналогічно до прикладу 37 362мг (2,5ммоля) 5-амінохіноліну піддають взаємодії з 640мг (2,09ммоля) 3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]-2-гідрокси-2-(трифторметил)пропаналю й 2,80мл концентрованої оцтової кислоти в 19мл толуолу. Через 6год. проводять хроматографічне очищення на силікагелі з використанням суміші гексан-етилацетат (0-100%) і таким шляхом одержують 810мг (90% від теорії) продукту. МС (ES+): m/z (відн. інт-сть, %)=433 (М+1, 100). 1-(хінолін-5-іламіно)-3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]-2-(трифторметил)пропан-2-ол Аналогічно до прикладу 1 810мг (1,87ммоля) 1-(хінолін-5-іліміно)-3-[1-(5-фтор-2-метоксифеніл) циклопроп-1-іл]-2-(трифторметил)пропан-2-олу піддають взаємодії з 288мг (7,61 моля) борогідриду натрію в 6,0мл метанолу й 3,0мл тетрагідрофурану. Після хроматографії на силікагелі з використанням суміші гексан-етилацетат (0-100%) одержують 660мг (81% від теорії) продукту. 1 H-ЯМР (400МГц, CDCI3): δ=0,85-0,99 (m, 4H), 2,19 (d, 1H), 2,32 (d, 1H), 3,19-3,29 (m, 2H), 3,70 (s, 3H), 3,83 (s, 1H), 4,47 (t, 1H), 6,31 (d, 1H), 6,61 (dd, 1H), 6,84 (ddd, 1H), 7,06 (dd, 1H), 7,33 (dd, 1H), 7,46-7,52 (m, 2H), 8,05 (d, 1H), 8,87 (dd, 1H). Аналогічно до прикладу 38 піддають взаємодії 330мг (0,76ммоля) 1-(хінолін-5-іламшо)-3-[1-(5фтор-2-метоксифеніл)циклопроп-1-іл]-2(трифторметил)пропан-2-олу з 3,80мл (3,80ммоля) 1-молярного розчину триброміду бору в 6,90мл дихлорметану. Через 2 години реакцію обривають. Після перекристалізації з етилацетату й метанолу одержують 292мг (91% від теорії) продукту. 1 Н-ЯМР (400МГц, ДМСО-d6): δ=0,63-0,65 (m, 1Н), 0,79-0,84 (m, 3H), 1,97 (d, 1H), 2,62 (d, 1H), 3,35 (m, 2H), 5,93 (шир., 1H), 6,26 (шир., 1H), 6,42 (dd, 1H), 6,51 (d, 1H), 6,64 (td, 1H), 6,91 (dd, 1H), 7,31 (d, 1H), 7,71 (t, 1H), 7,83 (dd, 1H), 9,08-9,12 (m, 2H), 9,34 (s, 1H). Приклад 46 3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]1-(2-метилхінолін-5-іламіно)-2-(трифторметил)пропан-2-ол 3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]1-(2-метилхінолін-5-іліміно)-2-(трифторметил)пропан-2-ол Аналогічно до прикладу 1 352мг (2,23ммоля) 5-аміно-2-метилхіноліну піддають взаємодії з 650мг (2,12ммоля) 3-[1-(5-фтор-2метоксифеніл)циклопроп-1-іл]-2-гідрокси-2(трифторметил)пропаналю й 2,80мл концентрованої оцтової кислоти в 19мл толуолу. Після хроматографії на силікагелі з використанням суміші гексан-етилацетат (0-100%) одержують 870мг (92% від теорії) продукту. МС (ES+): m/z (відн. інт-сть, %)=447 (М+1, 100). 3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]1-(2-метилхінолін-5-іламіно)-2-(трифторметил)пропан-2-ол Аналогічно до прикладу 37 870мг (1,95ммоля) 3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]-1-(2метилхінолін-5-іліміно)-2-(трифторметил)пропан-2олу піддають взаємодії з 96мг (2,53ммоля) борогідриду натрію в 6,0мл метанолу й 3,0мл тетрагідрофурану. Після перекристалізації з гексану й етилацетату одержують 790мг (90% від теорії) продукту. 1 H-ЯМР (400МГц, CDCI3): δ=0,83-0,97 (m, 4H), 2,19 (d, 1H), 2,31 (d, 1H), 2,72 (s, 3H), 3,21-3,25 (m, 2H), 3,70 (s, 3H), 3,79 (s, 1H), 4,41 (t, 1H), 6,25 (dd, 1H), 6,61 (dd, 1Н), 6,86 (ddd, 1H), 7,05 (dd, 1H), 7,21 (d, 1Н), 7,43-7,44 (m, 2H), 7,94 (d, 1H). 43 78304 44 Приклад 47 тографії на силікагелі з використанням суміші гек3-[1-(5-фтор-2-гідроксифеніл)циклопроп-1-іл]сан-етилацетат (0-100%) одержують 250мг (73% 1-(2-метилхінолін-5-іламіно)-2-(трифторметил)провід теорії) продукту. 1 пан-2-ол Н-ЯМР (300МГц, CDCI3): δ=4,28 (шир., 2Н), 6,92 (d, 1Н), 7,58-7,69 (m, 3Н), 8,36 (d, 1Н). 4-(5-фтор-2-метоксифеніл)-4-метил-2-трифторметил-1-(2-(трифторметил)хінолін-5-іліміно) пентан-2-ол Аналогічно до прикладу 37 250мг (1,18ммоля) 5-аміно-2-(трифторметил)хіноліну піддають взаєАналогічно до прикладу 38 395мг (0,88ммоля) модії з 438мг (1,42ммоля) 4-(5-фтор-23-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]-1-(2метоксифеніл)-2-гідрокси-4-метил-2-(трифтормеметилхінолін-5-іламіно)-2-(трифторметил)пропантил)пентаналю й 1,30мл концентрованої оцтової 2-олу піддають взаємодії з 4,30мл (4,3ммоля) 1кислоти в 20мл толуолу. Після хроматографії на молярного розчину триброміду бору в 8,0мл дихсилікагелі з використанням суміші гексанлорметану. Через 1 годину при 0°С реакцію приетилацетат (0-100%) одержують 500мг (84% від пиняють. Шляхом наступної перекристалізації з теорії) продукту. 1 етилацетату, ацетону й метанолу одержують H-ЯМР (300МГц, CDCI3): δ=1,38 (s, 3Н), 1,58 257мг (67% від теорії) продукту. (s, 3Н), 2,31 (d, 1H), 3,47 (d, 1H), 3,80 (s, 3H), 4,75 МС (ES+): m/z (відн. інт-сть, %)=435 (М+1, (s, 1H), 6,39-6,45 (m, 1H), 6,51-6,58 (m, 2H), 6,82 100). (dd, 1H), 7,55 (s, 1H), 7,64 (t, 1H), 7,78 (d, 1H), 8,10 Приклад 48 (d, 1H), 8,49 (d, 1H). 4-(5-фтор-2-метоксифеніл)-4-метил-2-три4-(5-фтор-2-метоксифеніл)-4-метил-2-трифторметил-1-(2-(трифторметил)хінолін-5-іламіно) фторметил-1-(2-(трифторметил)хінолін-5-іламіно) пентан-2-ол пентан-2-ол Аналогічно до прикладу 37 500мг (0,99ммоля) 4-(5-фтор-2-метоксифеніл)-4-метил-2-трифторметил-1-(2-(трифторметил)хінолін-5-іліміно)пентан-2олу піддають взаємодії з 154мг (4,04ммоля) борогідриду натрію в 5,0мл метанолу. Після очищення на силікагелі з використанням суміші гексан2-(трифторметил)хінолін етилацетат (0-100%) одержують 420мг (84% від Відповідно до описаної в літературі методики теорії) продукту. 1 Н-ЯМР (300МГц, CDCI3): δ=1,47 (s, ЗН), 1,55 [Baraznenok I.L., Nenajdenko V.G., Balenkova E.S., Eur. Journ. Org. Chem., 1999, стор.937-941] 1,2г (s, 3Н), 2,42 (d, 1H), 2,74 (d, 1H), 3,03 (s, 1H), 3,16 (7,18ммоля) (Е)-4-(диметиламіно)-1,1,1-трифтор-3(dd, 1H), 3,34 (dd, 1H), 3,85 (s, 3H), 4,38 (dd, 1H), бутен-2-ону піддають взаємодії з 2,03г (7,18ммоля) 6,20 (d, 1H), 6,79 (dd, 1H), 6,91-6,97 (m, 1H), 7,10 трифтороцтового ангідриду й 1,30мл (14,36ммоля) (dd, 1H), 7,52-7,65 (m, 3H), 8,14 (d, 1H). Приклад 49 аніліну в 72мл 1,2-дихлоретану, а потім в 36мл ксилолу. Після відповідної переробки й очищення 4-(5-фтор-2-гідроксифеніл)-4-метил-2-трина силікагелі з використанням суміші гексанфторметил-1-(2-(трифторметил)хінолін-5-іламіно) етилацетат (0-100%) одержують 1,01г (71% від пентан-2-ол теорії) продукту. 5-нітро-2-(трифторметил1хінолін 1,52г (7,7ммоля) 2-(трифторметил)хіноліну розчиняють в 7,90мл концентрованої сірчаної кислоти й при 0°С порціями додають 1,47г нітрату калію. Через 20год. при кімнатній температурі роз100мг (0,20ммоля) 4-(5-фтор-2-метоксифеніл)чин зливають на суміш води з льодом. Потім екст4-метил-2-трифторметил-1-(2-(трифторметил)хінорагують етилацетатом, промивають об'єднані орлін-5-іламіно)пентан-2-олу в 2,0мл дихлорметану ганічні фази насиченим розчином гідрокарбонату змішують при кімнатній температурі з 4,0мл натрію й сушать над сульфатом натрію. Після ви(4,0ммоля) 1-молярного розчину триброміду бору. далення розчинника й хроматографії на силікагелі Через 20год. реакцію припиняють при кімнатній з використанням суміші гексан-етилацетат (10температурі додаванням до суміші 20мл метанолу. 100%) одержують 390мг (21% від теорії) продукту. 1 Потім реакційну суміш витримують для перемішуН-ЯМР (300МГц, CDCI3): δ=7,92-8,00 (m, 2H), вання при кімнатній температурі протягом 30хв., а 8,53-8,58 (m, 2H), 9,26 (d, 1Н). потім видаляють розчинник під вакуумом. Після 5-аміно-2-(трифторметил)хінолін хроматографії на силікагелі з використанням су390мг (1,61ммоля) 5-нітро-2-(трифтормеміші гексан-етилацетат (0-100%) одержують 79мг тил)хіноліну розчиняють в 13мл метанолу. Після (80% від теорії) продукту. додавання 39мг паладію на активованому вугіллі й 1 H-ЯМР (300МГц, CDCI3): δ=1,51 (s, 3Н), 1,57 19мг карбонату калію реакційну суміш витримують (s, 3Н), 2,45 (d, 1H), 2,76 (d, 1H), 3,21-3,27 (m, 2H), для перемішування протягом 20год. при кімнатній 3,42 (dd, 1H), 4,43 (шир., 1H), 5,60 (шир, 1H), 6,23 температурі в атмосфері водню. Після цього філь(d, 1H), 6,59 (dd, 1H), 6,75-6,87 (m, 1H), 7,07 (dd, трують через целіт і промивають етилацетатом. 1H), 7,51-7,65 (m, 3H), 8,14 (d, 1H). Після видалення розчинника під вакуумом і хрома 45 78304 46 Приклад 50 20год. при кімнатній температурі. Після багатокра1-(2-(ацетоксиметил)хінолін-5-іламіно)-4-(5тного співвипарювання з толуолом і наступної фтор-2-метоксифеніл)-4-метил-2-(трифторметил) хроматографії на силікагелі з використанням супентан-2-ол міші гексан-етилацетат (0-100%) одержують 410мг (87% від теорії) продукту. 1 Н-ЯМР (300МГц, CDCI3): δ=2,23 (s, 3Н), 5,42 (s, 2H), 7,70 (d, 1H), 7,81 (t, 1H), 8,37-8,40 (m, 2H), 9,02 (d, 1H). 2-(ацетоксиметил)-5-амінохінолін Розчин 410мг (1,67 моля) 2-(ацетоксиметил)-5нітрохіноліну в 61мл ацетону протягом 2год. ви1-(1,2-дигідроксіетил)-5-нітрохінолін тримують для перемішування в атмосфері водню До розчину 3,18г (15,88ммоля) 5-нітро-2при кімнатній температурі в присутності 410мг нівінілхіноліну в 140мл ацетону й 21мл води при 0°С келю Ренея. Потім відфільтровують через целіт за додають 336мг (2,5ммоля) гідрату N-оксиду медопомогою вакуум-фільтра й додатково промиватилморфоліну й 10,22мл розчину тероксиду осмію ють ацетоном. Після видалення розчинника й нав ізопропанолі й реакційну суміш витримують для ступної хроматографії на силікагелі з використанперемішування протягом 24год. при кімнатній темням суміші гексан-етилацетат (10-100%) пературі. Після цього видаляють розчинник під одержують 230мг (64% від теорії) продукту. 1 вакуумом і розчиняють залишок в етилацетаті. Н-ЯМР (300МГц, CDCI3): δ=2,19 (s, 3Н), 4,20 Органічну фазу промивають водою й насиченим (шир., 2Н), 5,37 (s, 2H), 6,81 (dd, 1Н), 7,41 (d, 1H), розчином хлориду натрію. Водн у фазу екстрагують 7,51-7,53 (m, 2H), 8,19 (d, 1H). дихлорметаном, діетиловим ефіром й етилацета1-(2-(ацетоксиметил)хінолін-5-іліміно)-4-(5том. Об'єднані органічні фази сушать над сульфафтор-2-метоксифеніл)-4-метил-2-(трифторметил) том натрію. Після видалення розчинника й очипентан-2-ол щення на силікагелі з використанням суміші Аналогічно до прикладу 37 230мг (1,06ммоля) гексан-етилацетат (0-100%), а також суміші етила2-(ацетоксиметил)-5-амінохіноліну піддають взаєцетат-метанол (0-20%) одержують 1,64г (44% від модії з 273мг (0,88ммоля) 4-(5-фтор-2теорії) продукту. метоксифеніл)-2-гідрокси-4-метил-2-(трифторме1 Н-ЯМР (300МГц, ДМСО-d6): δ=3,62-3,81 (m, тил)пентаналю й 1,20мл концентрованої оцтової 2H), 4,78-4,84 (m, 2H), 5,76 (d, 1H), 7,90-7,96 (m, кислоти в 20,0мл толуолу. Після хроматографії на 2Н), 8,37-8,42 (m, 2Н), 8,83 (d, 1H). силікагелі з використанням суміші гексан5-нітрохінолін-2-карбальдегід етилацетат (0-100%) одержують 360мг (81% від До розчину 1,64г (7,0ммолів) 1-(1,2теорії) продукту. 1 дигідроксіетил)-5-нітрохіноліну в 42мл тетрагідроH-ЯМР (300МГц, CDCI3): δ=1,37 (s, 3Н), 1,57 фурану й 7,0мл води додають 2,99г (14,0молів) (s, 3Н), 2,21 (s, 3Н), 2,32 (d, 1Η), 3,44 (d, 1H), 3,79 перйодату натрію. Через 20год. при кімнатній тем(s, 3H), 4,84 (s, 1H), 5,40 (s, 2H), 6,42-6,56 (m, 3H), пературі додають етилацетат і промивають органі6,82 (dd, 1H), 7,45-7,60 (m, 3H), 7,95 (d, 1H), 8,31 чну фазу насиченим розчином хлориду натрію. (d, 1H). Після сушіння органічної фази над сульфатом на1-(2-(ацетоксиметил)хінолін-5-іламіно)-4-(5трію, видалення розчинника й очищення на силікафтор-2-метоксифеніл)-4-метил-2-(трифторметил) гелі з використанням суміші гексан-етилацетат (0пентан-2-ол 100%) одержують 1,40г (99% від теорії) продукту. Розчин 170мг (0,34ммоля) 1-(21 Н-ЯМР (300МГц, CDCI3): δ=7,94 (t, 1H), 8,24 (ацетоксиметил)хінолін-5-іліміно)-4-(5-фтор-2(d, 1H), 8,53 (d, 1H), 8,58 (d, lH),9,18(d, 1H), 10,24 метоксифеніл)-4-метил-2-(трифторметил)пентан(s, 1H). 2-олу в 1 ,5мл метанолу й 0,8мл тетрагідрофурану 2-(гідроксиметил)-5-нітрохінолін змішують із 53мг (1,38ммоля) борогідриду натрію. 700мг (3,46ммоля) 5-нітрохінолін-2Через 3 години при кімнатній температурі реакцію карбальдегіду розчиняють в 13мл метанолу й припиняють додаванням до реакційної суміші во7,0мл тетрагідрофурану й при 0°С змішують із ди. Потім екстрагують етилацетатом, промивають 523мг (13,9ммоля) борогідриду натрію. Через 5год. об'єднані органічні фази насиченим розчином хлореакцію припиняють додаванням до суміші води. риду натрію й сушать над сульфатом натрію. ПісПотім видаляють розчинник під вакуумом, розчиля видалення розчинника й наступної хроматогняють залишок у дихлорметані й воді, екстрагують рафії на силікагелі з використанням суміші гексанводну фазу ди хлорметаном і сушать об'єднані етилацетат (0-100%) одержують 94мг (55% від органічні фази над сульфатом натрію. Після видатеорії) продукту. 1 лення розчинника й очищення на силікагелі з виH-ЯМР (300МГц, CDCI3): δ=1,46 (s, 3Н), 1,56 користанням суміші гексан-етилацетат (0-100%) (s, 3Н), 2,19 (s, 3Н), 2,35 (d, 1H), 2,77 (d, 1H), 3,10одержують 390мг (55% від теорії) продукту. 3,16 (m, 2H), 3,31 (dd, 1H), 3,84 (s, 3H), 4,28 (dd, 1 H-ЯМР (300МГц, CDCI3): δ=4,13 (шир., 1Н), 1H), 5,36 (s, 2H), 6,07 (d, 1H), 6,80 (dd, 1H), 6,914,99 (s, 2H), 7,55 (d, 1H), 7,82 (t, 1H), 8,36-8,41 (m, 6,98 (m, 1H), 7,11 (dd, 1H), 7,37-7,53 (m, 3H), 7,99 2H), 8,99 (d, 1H). (d, 1H). 2-(ацетоксиметил)-5-нітрохінолін Приклад 51 Розчин 390мг (1,91ммоля) 2-(гідроксиметил)-54-(5-фтор-2-метоксифеніл)-1-(2-(гідроксименітрохіноліну й 2,5мл оцтового ангідриду в 5,0мл тил)хінолін-5-іламіно)-4-метил-2-(трифторметил) піридину витримують для перемішування протягом пентан-2-ол 47 78304 48 карбонової кислоти в 12мл концентрованої сірчаної кислоти. Через 4 дні при кімнатній температурі реакційну суміш зливають на суміш води з льодом. Тверду речовину, яка випала в осад, відфільтровують за допомогою вакуум-фільтра, промивають невеликою кількістю води й сушать під високим Взаємодією 170мг (0,34ммоля) 1-(2вакуумом. Сирий продукт розчиняють в 50мл ме(ацетоксиметил)хінолін-5-іламіно)-4-(5-фтор-2танолу. Після додавання 10мл концентрованої метоксифеніл)-4-метил-2-(трифторметил)пентансірчаної кислоти реакційний розчин кип'ятять зі 2-олу з 53мг (1,38ммоля) борогідриду натрію в зворотним холодильником, а потім перемішують 1,5мл метанолу й 0,8мл тетрагідрофурану одерпротягом 36год. при кімнатній температурі. Далі жують 43мг (27% від теорії) продукту (порівн. приреакційний розчин концентрують до однієї третини клад 14). від первинного об'єму й зливають на суміш води з 1 Н-ЯМР (300МГц, CDCI3): δ=1,46 (s, 3Н), 1,57 льодом. Після цього екстрагують етилацетатом, (s, 3Н), 2,35 (d, 1H), 2,77 (d, 1H), 3,10-3,16 (m, 2H), промивають об'єднані органічні фази насиченим 3,32 (dd, 1H), 3,84 (s, 3H), 4,29 (dd, 1H), 4,41 (шир., розчином гідрокарбонату натрію, потім насиченим 1Н), 4,89 (s, 2H), 6,07 (d, 1H), 6,79 (dd, 1H), 6,91розчином хлориду натрію, суша ть над сульфатом 6,97 (m, 1H), 7,12 (dd, 1H), 7,20 (d, 1H), 7,42-7,51 натрію й видаляють розчинник під вакуумом. Си(m, 2H), 7,95 (d, 1H). рий продукт розчиняють в 80мл суміші метанолПриклад 52 ацетон (50%) і змішують із паладієм на активова4-(5-фтор-2-гідроксифеніл)-1-(2-(гідроксименому вугіллі й карбонатом калію. Далі протягом тил)хінолін-5-іламіно)-4-метил-2-(трифторметил) 20год. перемішують при кімнатній температурі в пентан-2-ол атмосфері водню. Після відфільтровування через целіт за допомогою вакуум-фільтра й промивання ацетоном видаляють розчинник під вакуумом й очищають залишок на силікагелі з використанням суміші гексан-етилацетат (0-60%). Таким шляхом одержують 850мг (27% від теорії) продукту. 1 H-ЯМР (300МГц, CDCI3): δ=4,07 (s, 3Н), 6,90 290мг (0,62ммоля) 4-(5-фтор-2-метоксифеніл)(d, 1H), 7,58 (t, 1H), 7,75 (d, lH),8,12(d, 1H), 8,33 (d, 1-(2-(гідроксиметил)хінолін-5-іламіно)-4-метил-21H). (трифторметил)пентан-2-олу в 7,0мл дихлорметаМетиловий ефір 5-[4-(5-фтор-2-метоксифеніл)ну при кімнатній температурі змішують із 12,5мл 2-гідрокси-4-метил-2-(трифторметил)пентилідена(12,5ммоля) 1-молярного розчину триброміду боміно]хінолін-2-карбонової кислоти ру. Через 20год. при кімнатній температурі реакцію Аналогічно до прикладу 37 200мг (1,0ммоль) припиняють додаванням до реакційної суміші меметилового ефіру 5-амінохінолін-2-карбонової китанолу. Потім під вакуумом видаляють розчинник, слоти піддають взаємодії з 371мг (1,2ммоля) 4-(5розчиняють залишок у насиченому розчині гідрофтор-2-метоксифеніл)-2-гідрокси-4-метил-2-(трифкарбонату натрію й етилацетаті, екстрагують етиторметил)пентаналю й 1,10мл концентрованої лацетатом і сушать об'єднані органічні фази над оцтової кислоти в 20мл толуолу. Після хроматогсульфатом натрію. Після видалення розчинника й рафії на силікагелі з використанням суміші гексаночищення на силікагелі з використанням суміші етилацетат (0-100%) одержують 420мг (85% від гексан-етилацетат (0-70%), а також суміші етилатеорії) продукту. 1 цетат-метанол (0-10%) одержують 160мг (51% від Н-ЯМР (300МГц, CDCI3): δ=1,38 (s, 3Н), 1,59 теорії) продукту. (s, 3Н), 2,29 (d, 1H), 3,47 (d, 1H), 3,80 (s, 3Н), 4,10 1 Н-ЯМР (300МГц, ДМСО-d6): δ=1,46 (s, 3Н), (s, 3Н), 4,79 (s, 1H), 6,40-6,45 (m, 1H), 6,53-6,56 (m, 1,56 (s, 3Н), 1,93 (d, 1H), 2,94 (dd, 1H), 3,09-3,21 2H), 6,81 (dd, 1H), 7,54 (s, 1H), 7,60 (t, 1H), 8,18 (d, (m, 2H), 4,67 (d, 2H), 5,34-5,37 (m, 1H), 5,51 (t, 1H), 1H), 8,23 (d, 1H), 8,45 (d, 1H). 5,91 (d, 1H), 5,98 (s, 1H), 6,73 (dd, 1H), 6,81-6,87 Метиловий ефір 5-[4-(5-фтор-2-метоксифеніл)(m, 1H), 7,01 (dd, 1H), 7,14 (d, 1H), 7,32 (t, 1H), 7,54 2-гідрокси-4-метил-2-(трифторметил)пентиламіно] (d, 1H), 8,28 (d, 1H), 9,74 (s, 1H). хінолін-2-карбонової кислоти Приклад 53 Аналогічно до прикладу 40 420мг (0,85ммоля) Метиловий ефір 5-[4-(5-фтор-2-метоксифеніл)метилового ефіру 5-[4-(5-фтор-2-метоксифеніл)-22-гідрокси-4-метил-2-(трифторметил)пентиламіно] гідрокси-4-метил-2-(трифторметил)пентиліденаміхінолін-2-карбонової кислоти но]хінолін-2-карбонової кислоти розчиняють в 10мл метанолу й змішують із 130мг (3,41ммоля) борогідриду натрію. Після хроматографії на силікагелі з використанням суміші гексан-етилацетат (0-100%) одержують 75мг (18% від теорії) продукту. 1 Н-ЯМР (300МГц, CDCI3): δ=1,46 (s, 3Н), 1,56 (s, 3Н), 2,36 (d, 1H), 2,78 (d, 1H), 3,04 (s, 1H), 3,15 (dd, 1H), 3,50 (dd, 1H), 3,84 (s, 3H), 4,08 (s, 3H), Метиловий ефір 5-амінохінолін-2-карбонової 4,35 (dd, 1H), 6,16 (d, 1H), 6,77 (dd, 1H), 6,89-6,95 кислоти (m, 1H), 7,10 (dd, 1H), 7,52 (t, 1H), 7,71 (d, 1H),8,11 2,8г (...ммоля) нітрату калію при 0°С порціями (s,2H). додають до розчину 3,5г (20,21ммоля) хінолін-2 49 Приклад 54 5-[4-(5-фтор-2-метоксифеніл)-2-гідрокси-4метил-2-(трифторметил)пентиламіно]хінолін-2карбонова кислота 78304 50 (s, 3H), 4,81 (s, 1H), 6,46-6,49 (m, 2H), 6,57 (dd, 1H), 6,78 (dd, 1H), 7,50 (s, 1H), 7,56 (t, 1H), 7,95 (d, 1H), 8,23 (шир., 1H), 8,34 (d, 1H), 8,46 (d, 1H). Метиламід 5-[4-(5-фтор-2-метоксифеніл)-2гідрокси-4-метил-2-(трифторметил)пентиламіно]хінолін-2-карбонової кислоти 155мг (0,315ммоля) метиламіду 5-[4-(5-фтор2-метоксифеніл)-2-гідрокси-4-метил-2-(трифторметил)пентиліденаміно]хінолін-2-карбонової кислоти розчиняють в 10мл етанолу й змішують із 0,09мл (0,4ммоля) тетраетилату титану, а також з 94мг (2,6ммоля) борогідриду натрію. Через 5год. реакРозчин 60мг (0,12ммоля) метилового ефіру 5цію припиняють додаванням до реакційної суміші [4-(5-фтор-2-метоксифеніл)-2-гідрокси-4-метил-2насиченого розчину хлориду натрію й етилацета(трифторметил)пентиламіно]хінолін-2-карбонової ту. Потім відфільтровують нерозчинні компоненти кислоти в 10мл метанолу змішують із 0,5мл суміші. Після цього фільтрат екстрагують етилаце(0,5ммоля) 1н. розчину їдкого натрію. Через 2,5 татом, сушать об'єднані органічні фази над сульгодини під вакуумом видаляють розчинник й очифатом натрію й під вакуумом видаляють розчинщають залишок на силікагелі з використанням суник. Після хроматографії на силікагелі з міші дихлорметан-метанол (6-25%). Таким шляхом використанням суміші гексан-етилацетат (0-50%) одержують 47мг (82% від теорії) продукту. 1 одержують 110мг (71% від теорії) продукту. H-ЯМР (300МГц, ДМСО-d6): δ=1,38 (s, 3Н), 1 Н-ЯМР (300МГц, ДМСО-d6): δ=1,38 (s, 3Н), 1,54 (s, 3Н), 2,04 (d, 1H), 2,91-3,06 (m, 3Н), 3,75 (s, 1,56 (s, 3Н), 2,06 (d, 1H), 2,86-2,97 (m, 5H), 3,07 3Н), 5,49 (шир., 1Н), 5,94 (d, 1Н), 6,11 (шир, 1Н), (dd, 1H), 3,78 (s, 3H), 5,98 (s, 1H), 6,03 (d, 1H), 6,866,83-6,88 (m, 1H), 6,93-6,97 (m, 1Н), 7,07 (dd, 1Η), 7,05 (m, 2H), 7,07 (dd, 1H), 7,32 (d, 1H), 7,46 (t, 1H), 7,34 (t, 1Н), 7,44 (d, 1H), 8,00 (d, 1H), 8,38 (d, 1H). 8,03 (d, 1H), 8,49 (d, 1H), 8,81 (q, 1H). Приклад 55 Приклад 56 Метиламід 5-[4-(5-фтор-2-метоксифеніл)-2Метиламід 5-[4-(5-фтор-2-гідроксифеніл)-2гідрокси-4-метил-2-трифторметилпентиламіно]хігідрокси-4-метил-2-(трифторметил)пентиламіно]хінолін-2-карбонової кислоти нолін-2-карбонової кислоти Метиламід 5-амінохінолін-2-карбонової кислоти 76мг (0,376ммоля) метилового ефіру 5амінохінолін-2-карбонової кислоти розчиняють в 10мл 2-молярного розчину метиламіну в метанолі. Після кип'ятіння зі зворотним холодильником протягом 90хв. і наступного витримування протягом 16год. при кімнатній температурі видаляють розчинник під зниженим тиском й очищають залишок на силікагелі з використанням суміші гексанетилацетат (0-80%). Таким шляхом одержують 72мг (95% від теорії) продукту. 1 Н-ЯМР (300МГц, ДМСО-d6): δ=2,87 (d, 3Н), 6,10 (s, 2Н), 6,77 (d, 1H), 7,27 (d, 1H), 7,51 (t, 1H), 7,95 (d, 1H), 8,68 (d, 1H), 8,79-8,80 (m, 1H). Метиламід 5-[4-(5-фтор-2-метоксифеніл)-2гідрокси-4-метил-2-(трифторметил)пентиліденаміно]хінолін-2-карбонової кислоти Аналогічно до прикладу 37 220мг (1,08ммоля) метиламіду 5-амінохінолін-2-карбонової кислоти піддають взаємодії з 550мг (1,78ммоля) 4-(5-фтор2-метоксифеніл)-2-гідрокси-4-метил-2(трифторметил)пентаналю й 3,0мл концентрованої оцтової кислоти в 30мл толуолу. Після хроматографії на силікагелі з використанням суміші гексанетилацетат (0-70%) одержують 259мг (48% від теорії) продукту. 1 Н-ЯМР (300МГц, CDCI3): δ=1,37 (s, 3Н), 1,56 (s, 3Н), 2,29 (d, 1H), 3,11 (d, 3H), 3,48 (d, 1H), 3,81 Аналогічно до прикладу 38 97мг (0,197ммоля) метиламіду 5-[4-(5-фтор-2-метоксифеніл)-2гідрокси-4-метил-2-(трифторметил)пентиламіно]хінолін-2-карбонової кислоти піддають взаємодії з 8,0мл (8,0ммолів) 1-молярного розчину триброміду бору. Після відповідної переробки й очищення на силікагелі з використанням суміші гексанетилацетат (0-70%) одержують 18мг (18% від теорії) продукту. 1 H-ЯМР (300МГц, ДМСО-d6): δ=1,40 (s, 3Н), 1,57 (s, 3Н), 1,93 (d, 1H), 2,87 (d, 3H), 2,97 (dd, 1H), 3,13-3,20 (m, 2H), 5,51-5,54 (m, 1H), 5,98 (s, 1H), 6,04 (d, 1H), 6,67 (dd, 1H), 6,76-6,83 (m, 1H), 7,00 (dd, 1H), 7,32 (d, 1H), 7,45 (t, 1H), 8,03 (d, 1H), 8,46 (d, 1H), 8,80-8,82 (m, 1H), 9,72 (шир., 1H). Приклад 57 4-(4-хлор-2-метоксифеніл)-1-(2-(гідроксиметил)хінолін-5-іламіно)-4-метил-2-(трифторметил) пентан-2-ол Метиловий ефір 5-[4-(4-хлор-2-метоксифеніл)2-гідрокси-4-метил-2-(трифторметил)пентиліденаміно]хінолін-2-карбонової кислоти Аналогічно до прикладу 1 250мг (1,24ммоля) 51 78304 52 метилового ефіру 5-амінохінолін-2-карбонової ки2-гідрокси-4-метил-2-(трифторметил)пентиліденаслоти піддають взаємодії з 484мг (1,49ммоля) 4-(4міно]хінолін-2-карбонової кислоти хлор-2-метоксифеніл)-2-гідрокси-4-метил-2224мг (0,69ммоля) 4-(5-хлор-2-метоксифеніл)(трифторметил)пентаналю й 1,40мл концентрова2-гідрокси-4-метил-2-(трифторметил)пентаналю й ної оцтової кислоти в 20мл толуолу. Після хрома195мг (0,96ммоля) метилового ефіру 5тографії на силікагелі з використанням суміші гекамінохінолін-2-карбонової кислоти розчиняють в сан-етилацетат (0-100%) одержують 500мг (79% 20мл толуолу. Після додавання 5,0мл концентровід теорії) продукту. ваної оцтової кислоти протягом 16год. кип'ятять зі 1 H-ЯМР (300МГц, CDCI3): δ=1,36 (s, 3Н), 1,58 зворотним холодильником з використанням водо(s, 3Н), 2,28 (d, 1H), 3,45 (d, 1H), 3,84 (s, 3H), 4,11 віддільника. Після видалення розчинника залишок (s, 3H), 4,79 (s, 1H), 6,38 (d, 1H), 6,48 (dd, 1H), 6,67 розчиняють в 10мл тетрагідрофурану, потім дода(d, 1H), 7,00 (d, 1H), 7,52 (s, 1H), 7,65 (dd, 1H), 8,18ють 0,3мл (1,4ммоля) тетраетилату ти тану й реак8,25 (m, 2H), 8,48 (d, 1H). ційну суміш знову кип'ятять зі зворотним холоди4-(4-хлор-2-метоксифеніл)-1-(7-(гідроксимельником. Після видалення розчинника, а також тил)хінолін-5-іламіно)-4-метил-2-(трифторметил) очищення на силікагелі з використанням суміші пентан-2-ол гексан-етилацетат (0-100%) одержують 120мг Аналогічно до прикладу 40 200мг (0,39ммоля) (33% від теорії) продукту. 1 метилового ефіру 5-[4-(4-хлор-2-метоксифеніл)-2H-ЯМР (300МГц, CDCI3): δ=1,37 (s, 3Н), 1,51 гідрокси-4-метил-2-(трифторметил)пентиліденамі(t, 3Н), 1,57 (s, 3Н), 2,99 (d, 1H), 3,49 (d, 1H), 3,81 но]хінолін-2-карбонової кислоти розчиняють в (s, 3H), 4,57 (q, 2H), 4,83 (s, 1H), 6,52-6,58 (m, 1H), 5,0мл метанолу й змішують із 60мг (1,56ммоля) 6,79 (dd, 1H), 7,02 (d, 1H), 7,51 (s, 1H), 7,61 (t, 1H), борогідриду натрію. Після хроматографії на силі8,18-8,26 (m, 2H), 8,46 (d, 1H). кагелі з використанням суміші гексан-етилацетат 4-(5-хлор-2-метоксифеніл)-1-(2-(гідроксиме(0-100%) одержують 70мг (37% від теорії) продуктил)хінолін-5-іламіно)-4-метил-2-(трифторметил) ту. пентан-2-ол 1 Н-ЯМР (300МГц, ДМСО-d6): δ=1,37 (s, 3Н), Аналогічно до прикладу 40 120мг (0,23ммоля) 1,55 (s, 3Н), 2,04 (d, 1H), 2,82-2,91 (m, 2H), 2,98етилового ефіру 5-[4-(5-хлор-2-метоксифеніл)-23,02 (m, 1H), 3,81 (s, 3H), 4,67 (d, 2H), 5,39-5,42 (m, гідрокси-4-метил-2-трифторметилпентиліденаміно] 1H), 5,49 (t, 1H), 5,87 (d, 1H), 5,95 (s, 1H), 6,95 (dd, хінолін-2-карбонової кислоти піддають взаємодії з 1H), 7,01 (d, 1H), 7,17 (d, 1H), 7,29-7,37 (m, 2H), 35мг (0,92ммоля) борогідриду натрію. Після відпо7,53-7,55 (d, 1H), 8,29 (d, 1H). відної переробки й очищення на силікагелі з викоПриклад 58 ристанням суміші гексан-етилацетат (0-100%), а 4-(4-хлор-2-гідроксифеніл)-1-(2-(гідроксиметакож суміші етилацетат-метанол (0-20%) одертил)хінолін-5-іламіно)-4-метил-2-(трифторметил) жують 61мг (55% від теорії) продукту. 1 пентан-2-ол H-ЯМР (300МГц, CDCI3): δ=1,47 (s, 3Н), 1,59 (s, 3Н), 2,29 (d, 1H), 2,82 (d, 1H), 3,05-3,16 (m, 2H), 3,29-3,36 (m, 1H), 4,23-4,26 (m, 1H), 4,32-4,52 (шир., 1Н), 4,88 (s, 2H), 6,04-6,06 (m, 1H), 6,79 (d, 1H), 7,18-7,21 (m, 2H), 7,36 (d, 1H), 7,48-7,50 (m, 2H), 7,95 (d, 1H). Аналогічно до прикладу 38 110мг (0,23ммоля) Приклад 60 4-(4-хлор-2-метоксифеніл)-1-(2-(гідроксиметил) 3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]хінолін-5-іламіно)-4-метил-2-(трифторметил)пен1-(2-(гідроксиметил)хінолін-5-іламіно)-2-(трифтортан-2-олу піддають взаємодії з 4,60мл (4,60ммоля) метил)пропан-2-ол 1-молярного розчину триброміду бору. Після відповідної переробки й очищення на силікагелі з використанням суміші гексан-етилацетат (0-100%), а також суміші етилацетат-метанол (0-20%) одержують 54мг (50% від теорії) продукту. 1 Н-ЯМР (300МГц, ДМСО-d6): δ=1,39 (s, 3Н), 1,57 (s, 3Н), 1,94 (d, 1H), 2,91 (dd, 1H), 3,04-3,13 Метиловий ефір 5-{3-[1-(5-фтор-2(m, 2Н), 4,67 (d, 2Н), 5,34-5,37 (m, 1H), 5,50 (t, 1H), метоксифеніл)циклопроп-1-іл]-2-гідрокси-2-(три5,87 (d, 1H), 5,97 (s, 1H), 6,80-6,83 (m, 2H), 7,16 (d, фторметил)пропілиденаміно}хінолін-2-карбонової 1H), 7,34 (t, 1H), 7,53 (d, 1H), 8,27 (d, 1H), 10,20 (s, кислоти 1H). Аналогічно до прикладу 37 306мг (1,2моля) 5Приклад 59 {3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]-24-(5-хлор-2-метоксифеніл)-1-(2-(гідроксимегідрокси-2-(трифторметил)пропаналю піддають тил)хінолін-5-іламіно)-4-метил-2-(трифторметил) взаємодії з 170мг (0,84ммоля) метилового ефіру 5пентан-2-ол амінохінолін-2-карбонової кислоти в 4,0мл концентрованої оцтової кислоти й 20мл толуолу. Після відповідної переробки й очищення на силікагелі з використанням суміші гексан-етилацетат (0-70%) одержують 204мг (49% від теорії) продукту. 1 Н-ЯМР (300МГц, CDCI3): δ=0,61-0,68 (m, 1H), 0,76-0,80 (m, 1H), 0,94-1,00 (m, 1H), 1,06-1,12 (m, Метиловий ефір 5-[4-(5-хлор-2-метоксифеніл)1H), 2,16 (d, 1H), 2,90 (d, 1H), 3,84 (s, 3H), 4,10 (s, 53 78304 54 3H), 4,82 (s, 1H), 6,58 (d, 1H), 6,63-6,66 (m, 2H), використанням суміші гексан-етилацетат (0-100%) 6,75 (d, 1H), 7,63 (t, 1H), 7,74 (s, 1H), 8,19-8,26 (m, одержують 60мг (55% від теорії) продукту. 1 2H), 8,60 (d, 1H). H-ЯМР (300МГц, CDCI3): δ=1,37 (s, 3Н), 1,52 3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл|(s, 3Н), 2,34 (d, 1H), 3,08 (d, 1H), 4,11 (s, 3H), 4,83 1-(2-(гідроксиметил)хінолін-5-іламіно)-2-(трифтор(s, 1H), 5,94 (s, 1H), 6,02 (s, 1H), 6,37 (d, 1H), 6,54 метил)пропан-2-ол (t, 1H), 7,58-7,70 (m, 2H), 8,20-8,26 (m, 2H), 8,57 (d, Аналогічно до прикладу 40 200мг (0,41ммоля) 1H). метилового ефіру 5-{3-[1-(5-фтор-24-(7-хлорбензо[1,3]діоксол-4-іл)-2-(2-(гідроксиметоксифеніл)циклопроп-1-іл]-2-гідрокси-2-(триметил)хінолін-5-іламіно)-4-метил-2-(трифтормефторметил)пропілиденаміно}хінолін-2-карбонової тил)пентан-2-ол кислоти піддають взаємодії з 156мг (4,1ммоля) Аналогічно до прикладу 40 60мг (0,11ммоля) борогідриду натрію. Після відповідної переробки й метилового ефіру 5-[4-(7-хлобензо[1,3] діоксол-4очищення на силікагелі з використанням суміші іл)-2-гідрокси-4-метил-2-(трифторметил)пентилідегексан-етилацетат (0-75%) одержують 119мг (63% наміно]хінолін-2-карбонової кислоти піддають взавід теорії) продукту. ємодії з 18мг (0,46ммоля) борогідриду натрію. Піс1 H-ЯМР (300МГц, ДМСО-d6): δ=0,58-0,61 (m, ля відповідної переробки й очищення на силікагелі 1Η), 0,78-0,91 (m, 3H), 1,90 (d, 1H), 2,65 (d, 1H), з використанням суміші гексан-етилацетат (03,17-3,18 (m, 2H), 3,61 (s, 3H), 4,68 (d, 2H), 5,31 (t, 100%), а також суміші етилацетат-метанол (0-20%) 1H), 5,51 (t, 1H), 5,97 (s, 1H), 6,13 (d, 1H), 6,61 (dd, одержують 21мг (39% від теорії) продукту. 1 1H), 6,85 (td, 1H), 7,01 (dd, 1H), 7,17 (d, 1H), 7,38 (t, Н-ЯМР (300МГц, ДМСО-d6): δ=1,37 (s, 3Н), 1H), 7,54 (d, 1H), 8,37 (d, 1H). 1,53 (s, 3Н), 2,11 (d, 1H), 2,55 (d, 1H), 3,01-3,19 (m, Приклад 61 2H), 4,67 (d, 2H), 5,42-5,46 (m, 1H), 5,50 (t, 1H), 3-[1-(5-фтор-2-гідроксифеніл)циклопроп-1-іл]5,98-6,08 (m, 4H), 6,86 (s, 2H), 7,18 (d, 1H), 7,36 (t, 1-(2-(гідроксиметил)хінолін-5-іламіно)-2-(три фтор1H), 7,55 (d, 1H), 8,32 (d, 1H). метил)пропан-2-ол Приклад 63 4-(5-хлор-2,3-дигідробензофуран-7-іл)-2-(2(гідроксиметил)хінолін-5-іламіно)-4-метил-2-(трифторметил)пентан-2-ол Аналогічно до прикладу 38 100мг (0,22ммоля) 3-[1-(5-фтор-2-метоксифеніл)циклопроп-1-іл]-1-(2(гідроксиметил)хінолін-5-іламіно)-2-(трифторметил) =пропан-2-олу піддають взаємодії з 4,40мл (4,40ммоля) 1-молярного розчину триброміду бору. Після відповідної переробки й очищення на силікагелі з використанням суміші гексанетилацетат (0-100%), а також суміші етилацетатметанол (0-20%) одержують 50мг (50% від теорії) продукту. 1 Н-ЯМР (300МГц, ДМСО-d6): δ=0,66-0,73 (m, 1Н), 0,83-0,88 (m, 3H), 2,04 (d, 1H), 2,54 (d, 1H), 3,24-3,26 (m, 2H), 4,68 (d, 2H), 5,32 (t, 1H), 5,51 (t, 1H), 5,95 (s, 1H), 6,23 (d, 1H), 6,60 (d, 1H), 6,73-6,79 (m, 1H), 6,94 (dd, 1H), 7,16 (d, 1H), 7,39 (t, 1H), 7,54 (d, 1H), 8,33 (d, 1H), 9,49 (s, 1H). Приклад 62 4-(7-хлорбензо[1,3]діоксол-4-іл)-2-(2-(гідроксиметил)хінолін-5-іламіно)-4-метил-2-(трифторметил)пентан-2-ол Метиловий ефір 5-[4-(7-хлорбензо[1,3]діоксол4-іл)-2-гідрокси-4-метил-2-(трифторметил)вентиліденаміно]хінолін-2-карбонові кислоти Аналогічно до прикладу 37 70мг (0,21ммоля) 4-(7-хлорбензо[1,3]діоксол-4-іл)-2-гідрокси-4метил-2-(трифторметил)пентаналю піддають взаємодії з 50мг (0,25ммоля) метилового ефіру 5амінохінолін-2-карбонової кислоти в 0,5мл концентрованої оцтової кислоти й 20мл толуолу. Після відповідної переробки й очищення на силікагелі з Метиловий ефір 5-[4-(5-хлор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2(трифторметил)пентиліденаміно"|хінолін-2-карбонової кислоти Аналогічно до прикладу 37 160мг (0,47ммоля) 4-(5-хлор-2,3-дигідробензофуран-7-іл)-2-гідрокси4-метил-2-(трифторметил)пентаналю піддають взаємодії з 116мг (0,57ммоля) метилового ефіру 5амінохінолін-2-карбонової кислоти в 1,0мл концентрованої оцтової кислоти й 20мл толуолу. Після відповідної переробки й очищення на силікагелі з використанням суміші гексанетилацетат (0-100%) одержують 110мг (45% від теорії) продукту. 1 Н-ЯМР (300МГц, CDCI3): δ=1,34 (s, 3Н), 1,55 (s, 3Н), 2,27 (d, 1H), 2,65-2,73 (m, 1H), 2,91-3,01 (m, 1H), 3,35 (d, 1H), 4,11 (s, 3H), 4,42-4,58 (m, 2H), 4,79 (s, 1H), 6,58 (s, 1H), 6,65 (d, 1H), 6,82 (d, 1H), 7,61-7,67 (m, 2H), 8,21 (d, 1H), 8,27 (d, 1H), 8,47 (d, 1H). 4-(5-хлор-2,3-дигідробензофуран-7-іл)-2-(2(гідроксиметил)хінолін-5-іламіно)-4-метил-2-(трифторметил)пентан-2-ол Аналогічно до прикладу 40 110мг (0,21ммоля) метилового ефіру 5-[4-(5-хлор-2,3дигідробензофуран-7-іл)-2-гідрокси-4-метил-2(трифторметил)пентиліденаміно]хінолін-2карбонової кислоти піддають взаємодії з 32мг (0,84ммоля) борогідриду натрію. Після відповідної переробки й очищення на силікагелі з використанням суміші гексан-етилацетат (0-100%), а також суміші етилацетат-метанол (0-30%) одержують 55 78304 56 68мг (65% від теорії) продукту. кційної суміші насиченого розчину хлориду натрію 1 H-ЯМР (300МГц, ДМСО-d6): δ=1,34 (s, 3Н), й етилацетату. Утворений осад відфільтровують 1,53 (s, 3Н), 2,03 (d, 1H), 2,77 (d, 1H), 2,85-3,12 (m, через целіт за допомогою вакуум-фільтра. Фільт4H), 5,32-5,36 (m, 1H), 5,51 (t, 1H), 5,96 (d, 1H), 6,02 рат промивають насиченим розчином хлориду (s, 1H), 7,03 (s, 1H), 7,07 (s, 1H), 7,18 (d, 1H), 7,37 натрію й сушать над сульфатом натрію. Після ви(t, 1H), 7,54 (d, 1H), 8,29 (d, 1H). далення розчинника й очищення на силікагелі з Приклад 64 використанням суміші гексан-етилацетат (0-70%) Діетиламін 5-[4-(5-фтор-2-метоксифеніл)-2одержують 220мг (92%) продукту. 1 гідрокси-4-метил-2-(трифторметил)пентиламіно]хіH-ЯМР (300МГц, CDCI3): δ=1,20 (t, 3Н), 1,31 (t, нолін-2-карбонової кислоти 3Н), 1,46 (s, 3Н), 1,56 (s, 3Н), 2,34 (d, 1H), 2,78 (d, 1H), 3,13 (dd, 1H), 3,19 (s, 1H), 3,31 (dd, 1H), 3,41 (q, 2H), 3,60 (q, 2H), 3,84 (s, 3H), 4,33-4,37 (m, 1H), 6,08 (d, 1H), 6,79 (dd, 1H), 6,89-6,96 (m, 1H), 7,11 (dd, 1H), 7,42-7,51 (m, 2H), 7,55 (d, 1H), 8,03 (d, 1H). Приклад 65 Діетиламін 5-|'4-(5-фтор-2-гідроксифеніл)-2Діетиламід 5-амінохінолін-2-карбонової кислогідрокси-4-метил-2-(трифторметил)пентиламіно]хіти нолін-2-карбонової кислоти Суспензію 1,06г (7,95ммоля) хлориду алюмінію в 35мл толуолу при охолодженні льодом змішують із 1,70мл (15,7ммоля) діетиламіну. Через 1 годину при кімнатній температурі додають 350мг (1,73ммоля) метилового ефіру 5-амінохінолін-2карбонової кислоти й реакційну суміш витримують для перемішування протягом 5год. при 40°С. Реакцію припиняють додаванням до реакційної суміші 210мг (0,39ммоля) діетиламіду 5-[4-(5-фтор-2води. Після цього екстрагують дихлорметаном і метоксифеніл)-2-гідрокси-4-метил-2-(трифтормесушать об'єднані органічні фази над сульфатом тил)пентиламіно]хінолін-2-карбонової кислоти натрію. Після видалення розчинника й очищення змішують із 7,8мл (7,8ммоля) 1-молярного розчину на силікагелі з використанням суміші дихлорметриброміду бору в дихлорметані. Через 20год. при тан-метанол (0-10%) одержують 210мг (50% від кімнатній температурі реакцію припиняють додатеорії) продукту. ванням до реакційної суміші води. Після цього екс1 Н-ЯМР (300МГц, ДМСО-d6): δ=1,11 (t, 3Н), трагують етилацетатом, промивають об'єднані 1,19 (t, 3Н), 3,27 (q, 2H), 3,48 (q, 2Н), 6,06 (s, 2Н), органічні фази насиченим розчином гідрокарбона6,74 (d, 1H), 7,17 (d, 1Н), 7,42-7,47 (m, 2H), 8,61 (d, ту натрію й сушать їх над сульфатом натрію. Після 1H). видалення розчинника й очищення на силікагелі з Діетиламін 5-[4-(5-фтор-2-метоксифеніл)-2використанням суміші гексан-етилацетат (0-100%) гідрокси-4-метил-2-(трифторметил)пентиліденаміодержують 56мг (28%) продукту. 1 но]хінолін-2-карбонової кислоти H-ЯМР (300МГц, ДМСO-d6): δ=1,10 (t, 3Н), Розчин 210мг (0,86ммоля) діетиламіну 51,19 (t, 3Н), 1,40 (s, 3Н), 1,57 (s, 3Н), 1,93 (d, 1Н), амінохінолін-2-карбонової кислоти, 266мг 2,96 (dd, 1H), 3,11-3,29 (m, 4H), 3,48 (q, 2H), 5,48(0,86ммоля) 4-(5-фтор-2-метоксифеніл)-2-гідрокси5,52 (m, 1H), 5,97 (s, 1H), 6,01 (d, 1H), 6,70 (dd, 1H), 4-метил-2-(трифторметил)пентаналю й 0,36мл 6,79-6,85 (m, 1H), 7,00 (dd, 1H), 7,22 (d, 1H), 7,41 (t, (1,73ммоля) тетраетилату титану в 15мл тетрагід1H), 7,51 (d, 1H), 8,40 (d, 1H), 9,73 (s, 1H). рофурану перемішують протягом 1 години при Приклад 66 кімнатній температурі, а потім протягом 3год. при 4-(5-фтор-2-метоксифеніл)-1-(2-(морфолін-480°С. Після видалення розчинника й очищення на ілметил)хінолін-5-іламіно)-4-метил-2-(трифтормесилікагелі з використанням суміші гексантил)пентан-2-ол етилацетат (0-70%) одержують 230мг (52% від теорії) продукту. 1 Н-ЯМР (300МГц, CDCI3): δ=1,23 (t, 3Н), 1,33 (t, 3Н), 1,37 (s, 3Н), 1,57 (s, 3Н), 3,38-3,50 (m, 3Н), 3,63 (q, 2H), 3,81 (s, 3Н), 4,82 (s, 1H), 6,43-6,50 (m, 2H), 6,56 (dd, 1H), 6,79 (dd, 1H), 7,50 (s, 1H), 7,55 (t, 1H), 7,68 (d, 1H), 7,99 (d, 1H), 8,39 (d, 1H). 2-бромметил-5-нітрохінолін Діетиламін 5-[4-(5-фтор-2-метоксифеніл)-2Розчин 800мг (4,25ммоля) 5-нітро-2гідрокси-4-метил-2-(трифторметил)пентиламіно] метилхіноліну в 20мл тетрахлорметану змішують хінолін-2-карбонової кислоти із 11мг (0,04ммоля) бензоїлпероксиду й 794мг (4,46ммоля) N-бромсукциніміду. Потім реакційну Розчин 230мг (0,45ммоля) діетиламіду 5-[4-(5фтор-2-метоксифеніл)-2-гідрокси-4-метил-2-(трисуміш кип'ятять зі зворотним холодильником профторметил)пентиліденаміно]хінолін-2-карбонової тягом 8год. при УФ-опроміненні. Нерозчинні комкислоти й 0,132мл (0,58ммоля) тетраетилату ти тапоненти відфільтровують і фільтрат концентрують. ну в 14мл етанолу змішують із 135мг (3,55ммоля) Після очищення на силікагелі з використанням суміші гексан-етилацетат (0-100%) одержують борогідриду натрію. Через 6год. при кімнатній температурі реакцію припиняють додаванням до реа320мг (28% від теорії) продукту. 57 78304 58 H-ЯМР (300МГц, CDCI3): δ=4,72 (s, 2H), 7,79Приклад 67 7,82 (m, 2H), 8,35-8,39 (m, 2H), 9,02 (d, 1H). 4-(5-фтор-2-гідроксифеніл)-1-(2-(морфолін-42-(морфолін-4-ілметил)-5-нітрохінолін ілметил)хінолін-5-іламіно)-4-метил-2-(трифторме460мг (1,72ммоля) 2-бромметил-5тил)пентан-2-ол нітрохіноліну й 0,54мл (6,2ммоля) морфоліну розчиняють в 150мл толуолу. Після додавання 1,07г (7,74ммоля) карбонату калію реакційну суміш кип'ятять зі зворотним холодильником протягом 2 год. Потім відфільтровують карбонат калію й фільтрат концентрують. Після очищення на силікагелі з Аналогічно до прикладу 38 80мг (0,15ммоля) використанням суміші гексан-етилацетат (0-100%) 4-(5-фтор-2-метоксифеніл)-1-(2-(морфолін-4-ілмеодержують 190мг (40% від теорії) продукту. 1 тил)хінолін-5-іламіно)-4-метил-2-(трифторметил) H-ЯМР (300МГц, CDCI3): δ=2,55-2,58 (m, 4H), пентан-2-олу змішують із 3,0мл (3,0ммоля) 13,74-3,77 (m, 4H), 3,86 (s, 2H), 7,78 (t, 1H), 7,87 (d, молярного розчину триброміду бору в дихлорме1H), 8,33-8,39 (m, 2H), 8,95 (d, 1H). тані. Після відповідної переробки й очищення на 5-аміно-2-(морфолін-4-ілметил)хінолін силікагелі з використанням суміші гексан190мг (0,7ммоля) 2-(морфолін-4-ілметил)-5етилацетат (0-100%), а також суміші етилацетатнітрохіноліну розчиняють в 10мл метанолу. Після метанол (0-20%) одержують 53мг (68% від теорії) додавання 19мг паладію на активованому вугіллі й продукту. 19мг карбонату калію реакційну суміш витримують 1 Н-ЯМР (300МГц, ДМСО-d6): δ=1,40 (s, 3Н), для перемішування протягом 4год. при кімнатній 1,56 (s, 3Н), 2,40-2,43 (m, 4Н), 2,93 (dd, 1Н), 3,09температурі в атмосфері водню. Потім суміш фі3,20 (m, 2H), 3,58-3,61 (m, 4H), 3,69 (s, 2H), 5,33льтрують через целіт і промивають етилацетатом. 5,37 (m, 1H), 5,93 (d, 1H), 5,96 (шир., 1H), 6,72 (dd, Після видалення розчинника під вакуумом і хрома1H), 6,80-6,86 (m, 1H), 6,99 (dd, 1H), 7,17 (d, 1H), тографії на силікагелі з використанням суміші гек7,32 (t, 1H), 7,51 (d, 1H), 8,24 (d, 1H), 9,74 (шир., сан-етилацетат (0-100%), а також суміші етилаце1Н). тат-метанол (0-100%) одержують 134мг (79% від Приклад 68 теорії) продукту. 1 Амід 5-[4-(4-хлор-2-метоксифеніл)-2-гідроксиН-ЯМР (300МГц, CDCI3): δ=2,55-2,57 (m, 4H), 4-метил-2-(трифторметил)пентиламіно]хінолін-23,73-3,76 (m, 4H), 3,82 (s, 2H), 4,18 (шир., 2Н), 6,79 карбонової кислоти (d, 1H), 7,45-7,59 (m, 3Н), 8,14 (d, 1H). 4-(5-фтор-2-метоксифеніл)-1-(2-(морфолін-4ілметил)хінолін-5-іліміно)-4-метил-2-(трифторметил)пентан-2-ол Аналогічно до прикладу 37 180мг (0,74ммоля) 5-аміно-2-(морфолін-4-ілметил)хіноліну піддають взаємодії з 274мг (0,89ммоля) 4-(5-фтор-2Амід 5-[4-(4-хлор-2-метоксифеніл)-2-гідроксиметоксифеніл)-2-гідрокси-4-метил-2-(трифторме4-метил-2-(трифторметил)пентиліденаміно]хінолін тил)пентаналю в 0,8мл концентрованої оцтової -2-карбонової кислоти кислоти й 20мл толуолу. Після очищення на силіАналогічно до прикладу 37 160мг (0,87ммоля) кагелі з використанням суміші гексан-етилацетат аміду 5-амінохінолін-2-карбонової кислоти підда(0-100%) одержують 220мг (56% від теорії) продукють взаємодії з 341мг (1,05ммоля) 4-(4-хлор-2ту. 1 метоксифеніл)-2-гідрокси-4-метил-2-(трифтормеН-ЯМР (300МГц, CDCI3): δ=1,37 (s, 3Н), 1,57 тил)пентаналю в 0,96мл концентрованої оцтової (s, 3Н), 2,29 (d, 1H), 2,55-2,58 (m, 4H), 3,46 (d, 1H), кислоти й 20мл толуолу. Після очищення на силі3,75-3,77 (m, 4H), 3,80 (s, 3H), 3,85 (s, 2H), 4,88 (s, кагелі з використанням суміші гексан-етилацетат 1H), 6,38-6,45 (m, 2H), 6,53 (dd, 1H), 6,79 (dd, 1H), (0-100%) одержують 340мг (79% від теорії) продук7,47-7,52 (m, 2H), 7,67 (d, 1H), 7,94 (d, 1H), 8,28 (d, ту. 1H). 1 Н-ЯМР (300МГц, CDCI3): δ=1,37 (s, 3Н), 1,58 4-(5-фтор-2-метоксифеніл)-1-(2-(морфолін-4(s, 3Н), 2,27 (d, 1H), 3,44 (d, 1H), 3,84 (s, 3H), 4,80 ілметил)хінолін-5-іламіно)-4-метил-2-(трифторме(s, 1H), 5,71 (шир., 1H), 6,39 (d, 1H), 6,44 (dd, 1H), тил)пентан-2-ол 6,66 (d, 1H), 6,99 (d, 1H), 7,51 (s, 1H), 7,62 (dd, 1H), Аналогічно до прикладу 40 220мг (0,41ммоля) 7,99 (d, 1H), 8,07 (шир., 1Н), 8,33 (d, 1H), 8,49 (d, 4-(5-фтор-2-метоксифеніл)-1-(2-(морфолін-4-ілме1H). тил)хінолін-5-іламіно)-4-метил-2-(трифторметил) Амід 5-[4-(4-хлор-2-метоксифеніл)-2-гідроксипентан-2-олу розчиняють в 10мл метанолу й змі4-метил-2-(трифторметил)пентиламіно1хінолін-2шують із 315мг (8,25ммоля) борогідриду натрію. карбонової кислоти Після відповідної переробки й очищення одержуАналогічно до прикладу 40 340мг (0,69ммоля) ють 109мг (50% від теорії) продукту. 1 аміду 5-[4-(4-хлор-2-метоксифеніл)-2-гідрокси-4H-ЯМР (300МГц, CDCI3): δ=1,46 (s, 3Н), 1,56 метил-2-(трифторметил)пентиліденаміно]хінолін(s, 3Н), 2,34 (d, 1H), 2,52-2,55 (m, 4H), 2,77 (d, 1H), 2-карбонової кислоти розчиняють в 10мл метанолу 3,09-3,16 (m, 2H), 3,31 (dd, 1H), 3,72-3,75 (m, 4H), й декілька разів змішують із 110мг (2,89ммоля) 3,81 (s, 2H), 3,85 (s, 3H), 4,26-4,29 (m, 1H), 6,05 (d, боргідриду натрію. Після відповідної переробки й 1H), 6,81 (dd, 1H), 6,91-6,98 (m, 1H), 7,11 (dd, 1H), очищення на силікагелі з використанням суміші 7,39-7,56 (m, 3H), 7,94 (d, 1H). гексан-етилацетат (0-100%) одержують 280мг 1 59 78304 60 (82% від теорії) продукту. водою й насиченим розчином хлориду натрію ор1 H-ЯМР (300МГц, ДМСО-d6): δ=1,37 (s, 3Н), ганічну фазу сушать звичайним способом. Після 1,56 (s, 3Н), 2,06 (d, 1H), 2,85-3,06 (m, 3Н), 3,81 (s, відфільтровування сушильного агента й видален3Н), 5,57-5,61 (m, 1H), 5,96 (s, 1H), 6,00 (d, 1H), ня розчинника центрифугуванням одержують 6,95 (dd, 1H), 6,98 (d, 1H), 7,29-7,35 (m, 2H), 7,46 (t, 196,5мг (88,1%) необхідного аміну. 1H), 7,71 (шир., 1H), 8,04 (d, 1H), 8,21 (шир, 1H), МЗ (СІ) т/е (відносна інтенсивність): 161 (М+1, 8,48 (d, 1H). 100). Приклад 69 д. 5-{(Е/2)-[4-(5-фтор-2-метоксифеніл)-25-{[4-(5-фтор-2-метоксифеніл)-2-гідрокси-4гідрокси-4-метил-2-(трифторметил)пентиліден]аміметил-2-(трифторметил)пентил]аміно} ізохінолін-1 но}ізохінолін-1 (2Н)-он (2Н)-он 140,1мг (0,455ммоля) 4-(5-фтор-2метоксифеніл)-2-гідрокси-4-метил-2-(трифторметил)пентаналю протягом ночі перемішують із 72,8мг (0,455ммоля) 5-аміноізохінолін-1(2Н)-ону в 0,74мл льодяної оцтової кислоти. Потім суміш концентрують до утворення сухо го залишку й залишок хроматографують на сорбенті Flashmaster а. Метиловий ефір 2-метил-3-нітробензойної (елюент: суміш етилацетат-гексан). Таким шляхом кислоти виділяють 103,6мг (52,5%) необхідної сполуки. 20г (110,4ммоля) 2-метил-3-нітробензойної киМС (ES+) m/е (відносна інтенсивність): 451 слоти протягом 10год. кип'ятять зі зворотним хо(М+1, 100). лодильником в 100мл метанолу після додавання e. 5-{[4-(5-фтор-2-метоксифеніл)-2-гідрокси-42мл концентрованої сірчаної кислоти. Після цього метил-2-(трифторметил)пентил]аміно} ізохінолін-1 викристалізований при охолодженні продукт від(2H)-он фільтровують за допомогою вакуум-фільтра й су103,6мг (0,239ммоля) описаної вище в п.д шать. Фільтрат концентрують до утворення сухого сполуки змішують із 2,6мл дихлоретану й 0,1мл залишку, потім твердий залишок розчиняють в льодяні оцтові кислоти. Після додавання 75,9мг етилацетаті й розчин двічі промивають насиченим (0,359ммоля) триацетоксиборогідриду натрію сурозчином гідрокарбонату натрію. Після сушіння міш перемішують протягом ночі. Потім реакційну над сульфатом натрію одержують інший продукт. суміш змішують із насиченим розчином гідрокарУ цілому одержують 16,4г (76,3%) необхідного бонату натрію й двічі екстрагують етилацетатом. продукту. Після цього об'єднані органічні фази промивають б. 5-нітроізокумарин водою й насиченим розчином хлористого натрію, 16,4г (84,03ммоля) описаної в п. а сполуки сушать, фільтрують і концентрують. Після хромапротягом 12год. перемішують із 26,8г (225,1ммоля) тографії на сорбенті Flashmaster (елюент: суміш Ν,Ν-диметилформаміддиметилацеталю в 85мл етилацетат-гексан) виділяють 36мг (34,6%) необдиметилформаміду при 130°С. Потім відганяють хідної сполуки. розчинник з використанням роторного випарника, МС (ES+) m/е (відносна інтенсивність): 453 залишок розчиняють у метил-трет-бутиловому (M+1, 100). ефірі й тричі промивають водою. Після промиванПриклад 70 ня насиченим розчином NaCl сушать органічну 5-{[4-(5-фтор-2-гідроксифеніл)-2-гідрокси-4фазу. Після відфільтровування сушильного агента метил-2-(трифторметил)пентил]аміно}ізохінолінй видалення розчинника центрифугуванням хро1(2Н)-он матографують утворений залишок на силікагелі (елюент: суміш етилацетат-гексан). Таким шляхом виділяють 8,73г (54,4%) необхідної сполуки. МС (СІ) m/е (відносна інтенсивність): 209 (М+18 , 52), 191 (М+, 29), 179 (100). в. 5-нітроізохінолін-1(2Н)-он 2,51г (13,13ммоля) 5-нітроізокумарину додають до 100мл етанолу. Під тиском в автоклав подають аміак. При цьому продукт випадає в осад і його відфільтровують за допомогою вакуумфільтра. Таким шляхом виділяють 1,98г (79,7%) необхідної сполуки. МС (СІ) m/е (відносна інтенсивність): 208 (М+18 , 60), 191 (М+1, 100), 161 (81). г. 5-аміноізохінолін-1(2Н)-он 268,3мг (1,51ммоля) 5-нітроізохінолін-1(2Н)ону поміщають у реакційну посудину разом з 376,5мг хлориду амонію й 2,6мл води в 14мл етанолу й 5,4мл тетрагідрофурану. Після додавання порціями 1,23г цинкового порошку (нагрівання до 30-35°С) суміш перемішують протягом 2год. Потім вакуум-фільтрацією реакційну суміш фільтр ують через скловолокнистий фільтр, після чого промивають етилацетатом. Після промивання фільтрату 30мг (0,066ммоля) синтезованої в прикладі 69 є сполуки змішують із 0,76мл 1-молярного розчину триброміду бору в ди хлорметані. Після 4годинного перемішування при кімнатній температурі реакційну суміш розбавляють етилацетатом й однократно промивають насиченим розчином гідрокарбонату натрію. Після сушіння органічної фази (над сульфатом натрію) і відфільтровування сушильного агента центрифугуванням видаляють розчинник. Після хроматографії на сорбенті Flashmaster (елюент: суміш етилацетат-гексан) одержують 15,9мг (56,7%) необхідної сполуки. МС (ES+) m/е (відносна інтенсивність): 439 (M+1, 100). Виходячи з відповідних альдегідів, аналогічним шляхом синтезували наступні сполуки: 5-{[4-(3-фтор-2-гідроксифеніл)-2-гідрокси-4метил-2-(трифторметил)пентил]аміно}ізохінолін
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinoline and isoquinoline derivatives, use thereof as anti-inflammatory agents and pharmaceutical preparation based thereon
Автори англійськоюJaroch Stefan, Rehwinkel Hartnut, Berger Markus, Schmees Norbert, Skuballa Werner, Schaecke Heike
Назва патенту російськоюПроизводные хинолина и изохинолина, их применение в качестве ингибиторов воспаления, фармацевтический препарат на их основе
Автори російськоюЯрох Штефан, Шмеес Норберт, Бергер Маркус, Ревинкель Хартмут, Скубалла Вернер, Шеке Хайке
МПК / Мітки
МПК: A61P 9/00, C07D 405/12, A61P 17/14, A61P 37/06, C07D 217/22, A61P 27/16, A61P 29/00, A61K 31/4706, A61P 7/06, A61P 35/00, A61P 17/06, A61P 1/04, A61P 7/02, C07D 215/40, A61P 21/00, A61P 17/04, A61P 17/02, A61P 5/14, A61P 13/12, A61K 31/472, A61P 37/08, A61P 31/20, A61P 19/02, C07D 215/42, A61P 43/00, A61P 37/02, A61P 31/04, A61P 17/00, A61K 31/47, A61P 11/00, A61P 11/06, A61P 27/02, A61P 31/12, A61P 25/00, A61K 31/5377, C07D 215/38, A61P 35/02, C07D 217/24
Мітки: інгібіторів, основі, ізохіноліну, запалення, фармацевтичний, похідні, застосування, препарат, хіноліну
Код посилання
<a href="https://ua.patents.su/38-78304-pokhidni-khinolinu-jj-izokhinolinu-kh-zastosuvannya-yak-ingibitoriv-zapalennya-farmacevtichnijj-preparat-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні хіноліну й ізохіноліну, їх застосування як інгібіторів запалення, фармацевтичний препарат на їх основі</a>
Попередній патент: Спосіб перемаршрутизації трафіку mpls у кільцевих мережах та вузол мережі для здійснення способу
Наступний патент: Пристрій для відбору проб води
Випадковий патент: Спосіб вирощування гречки в проміжних посівах












