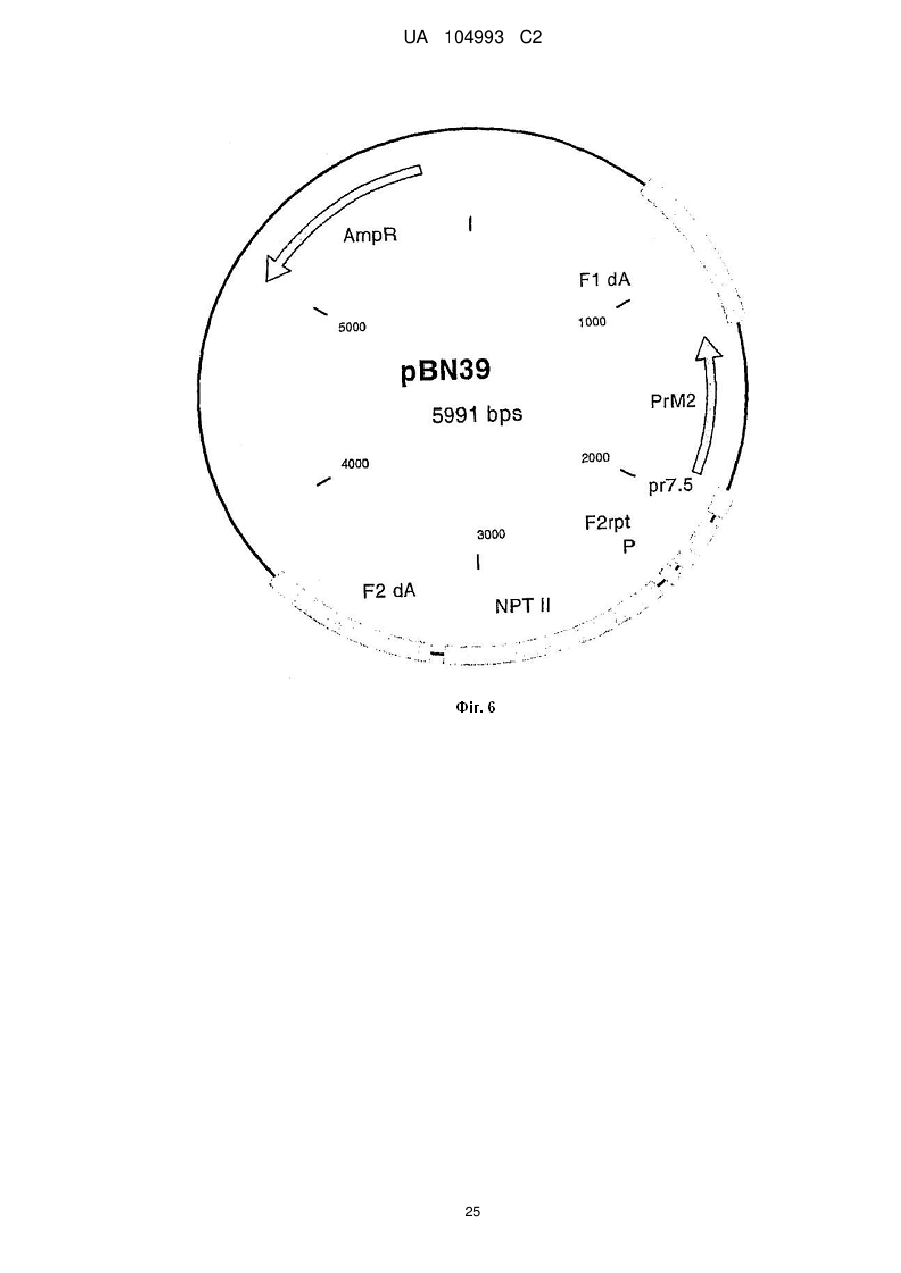
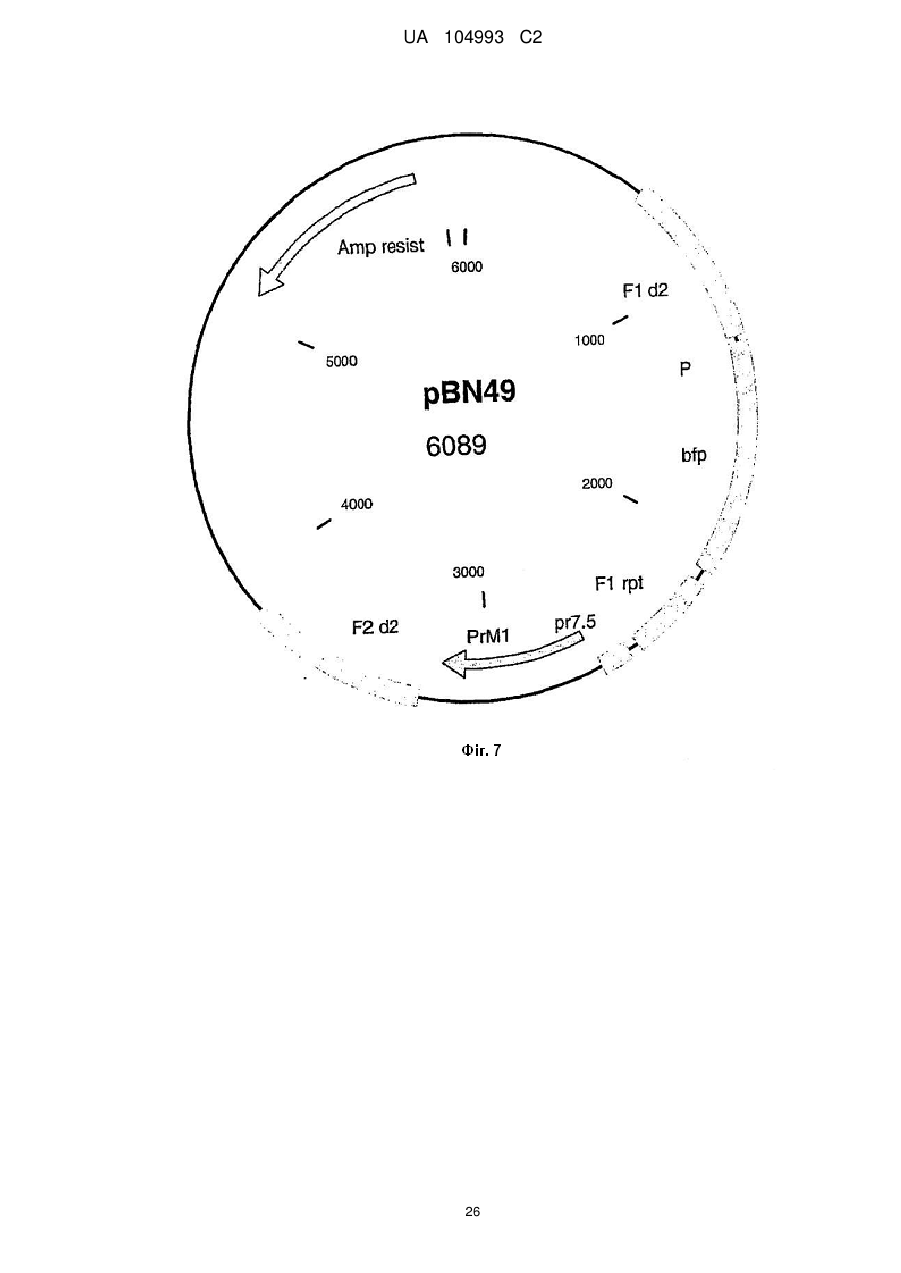
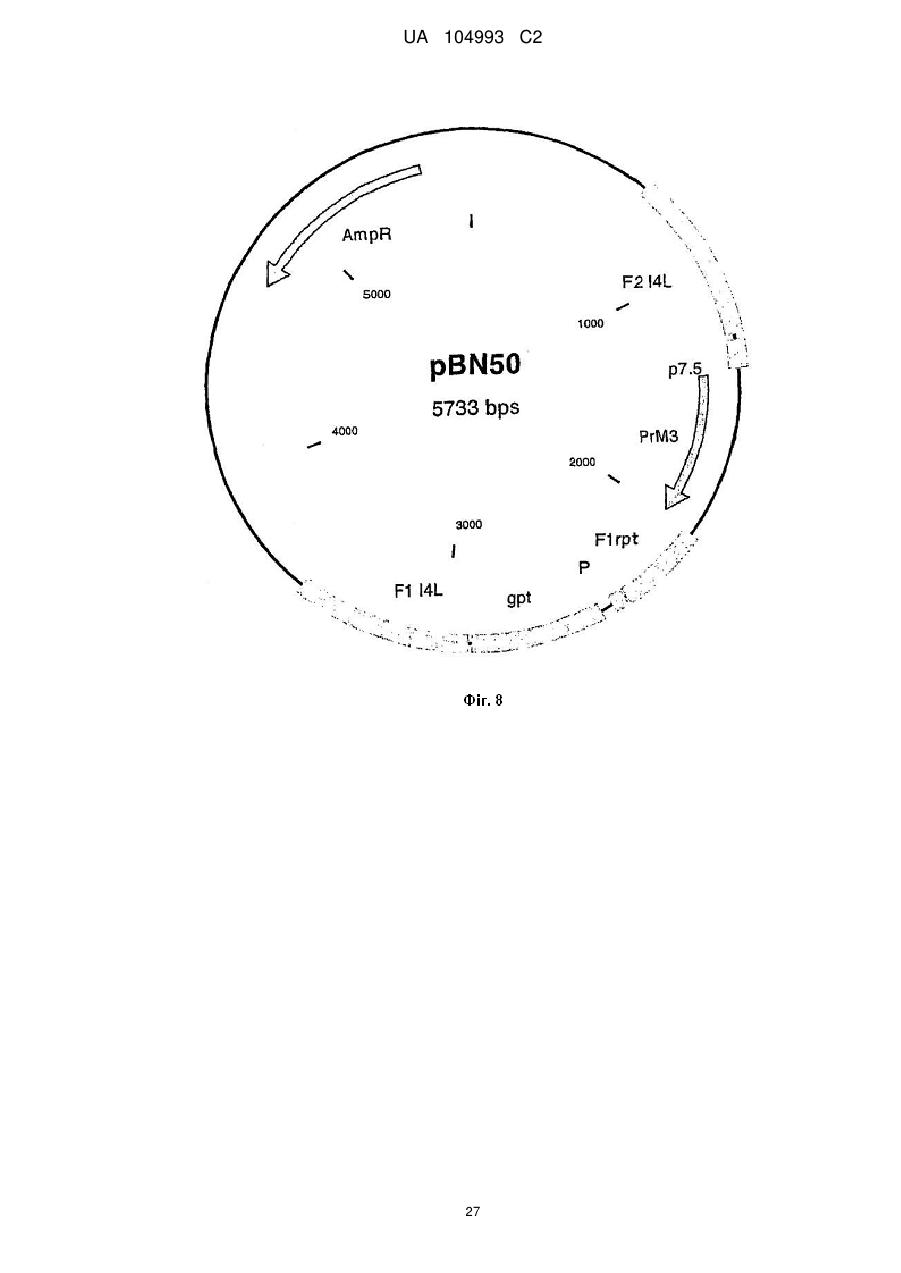
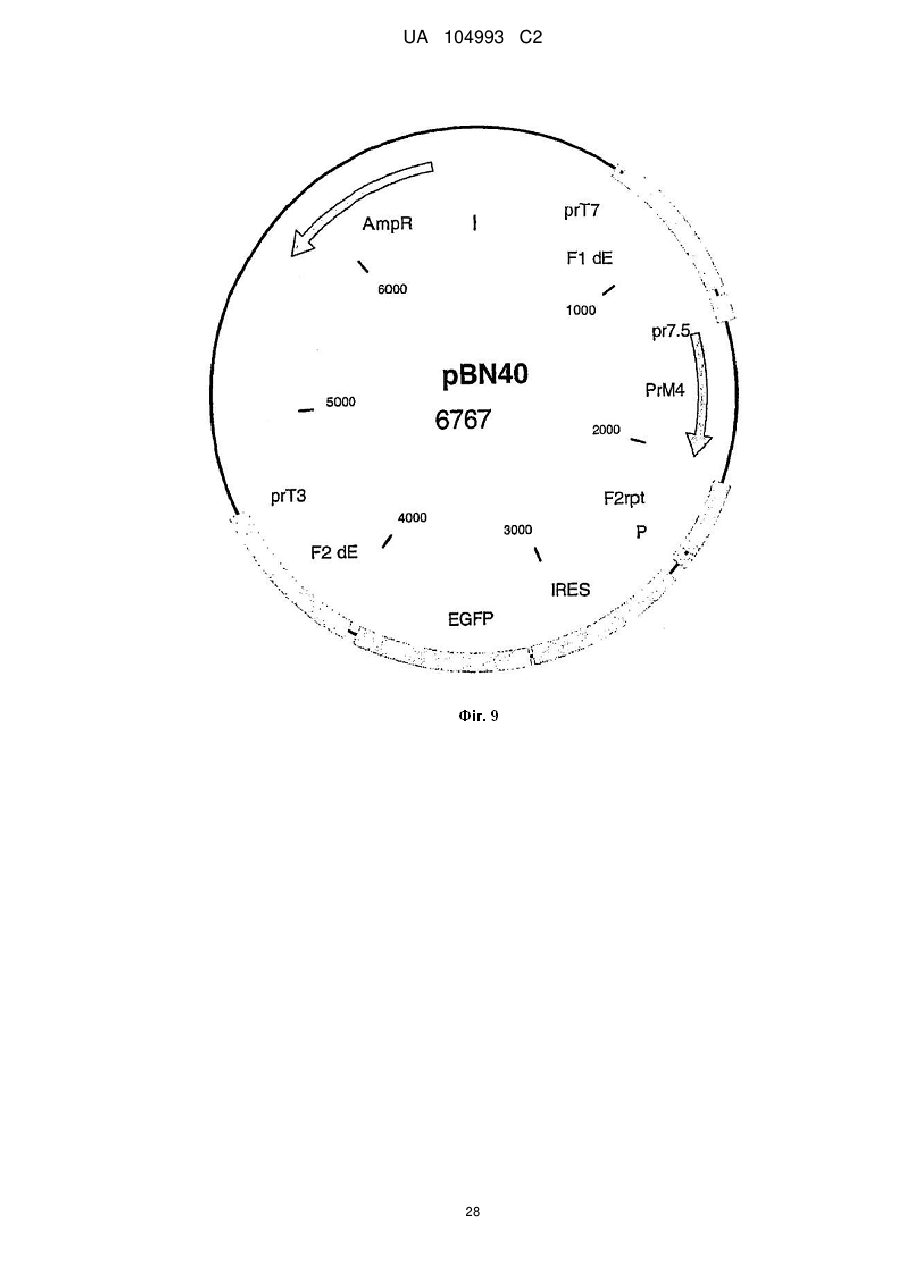
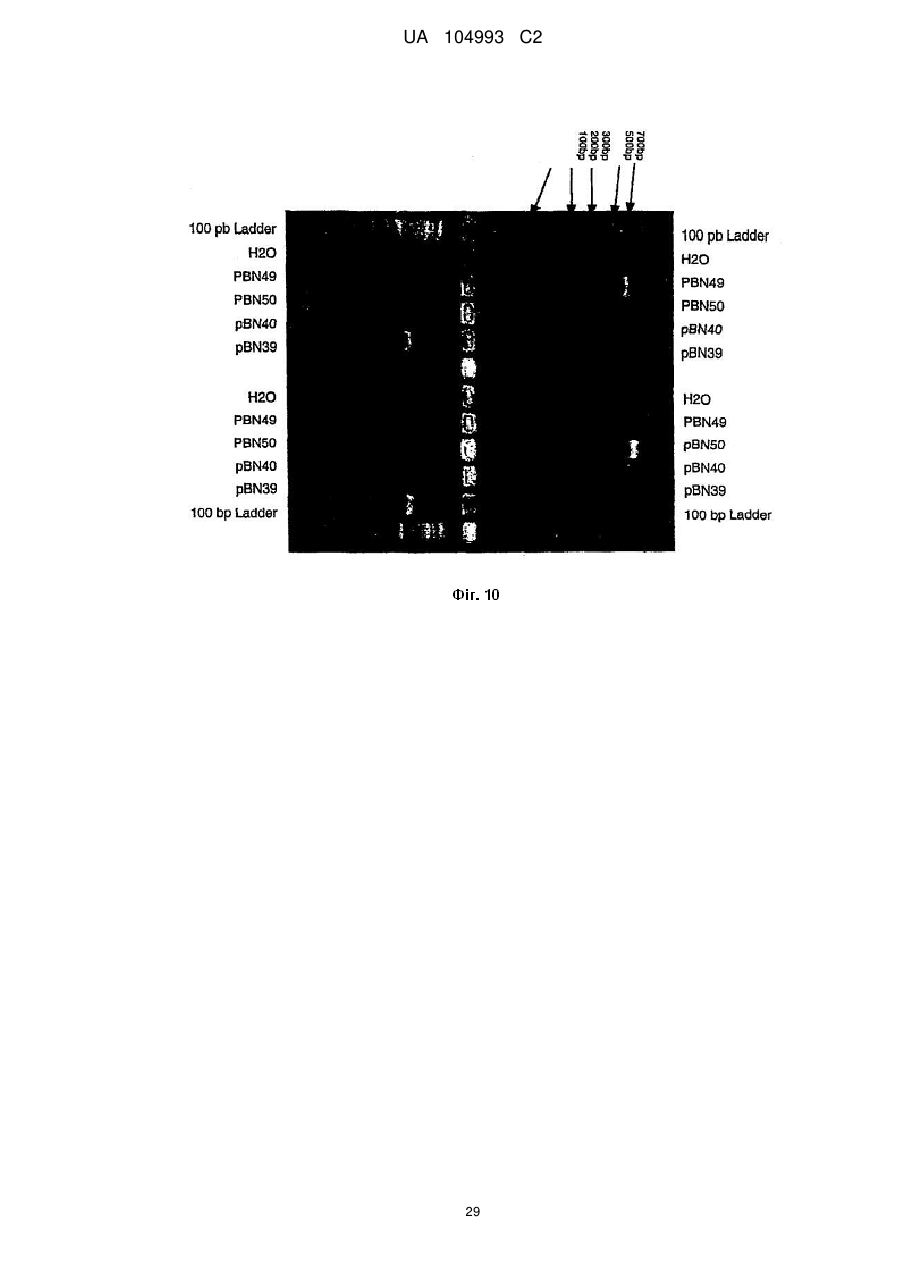
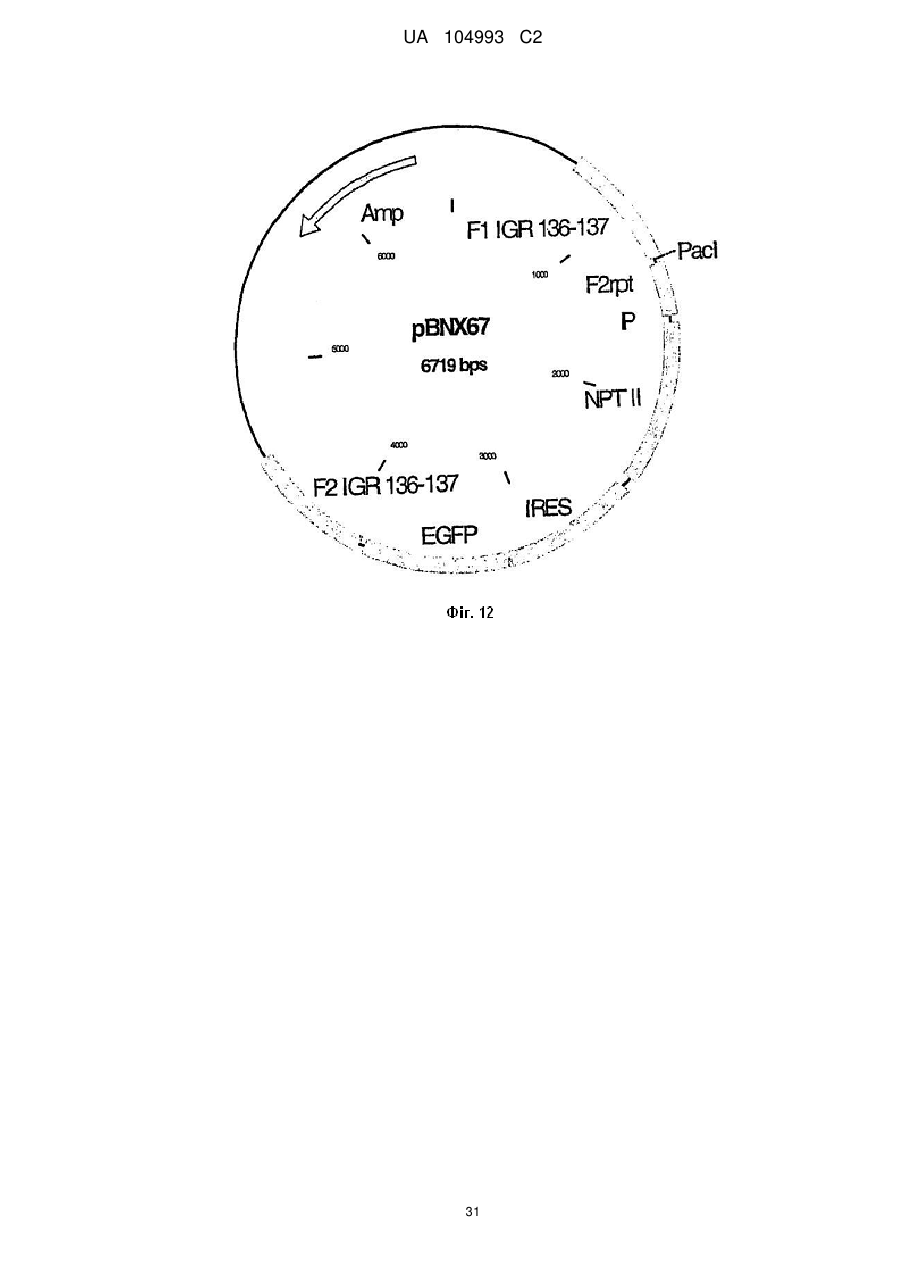
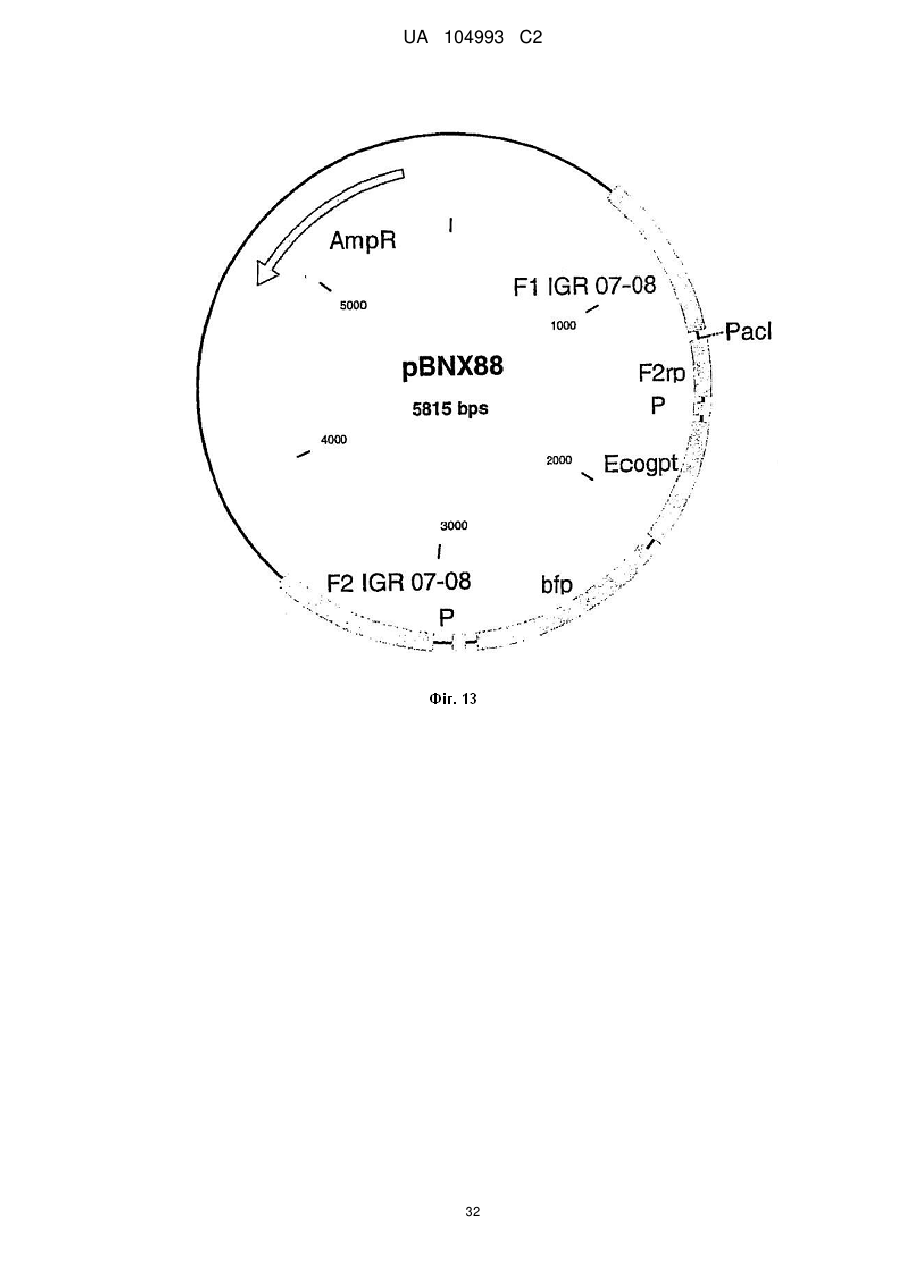
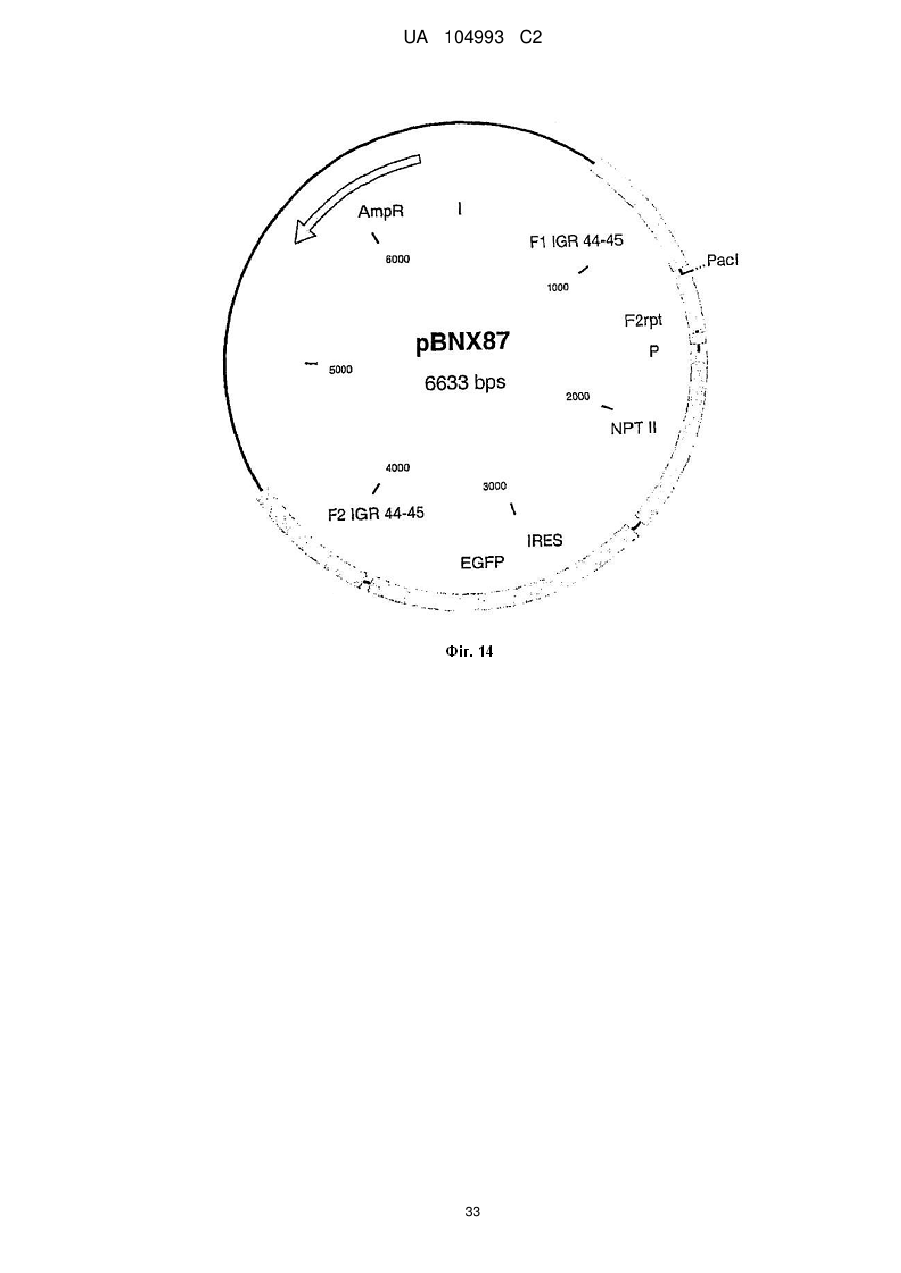
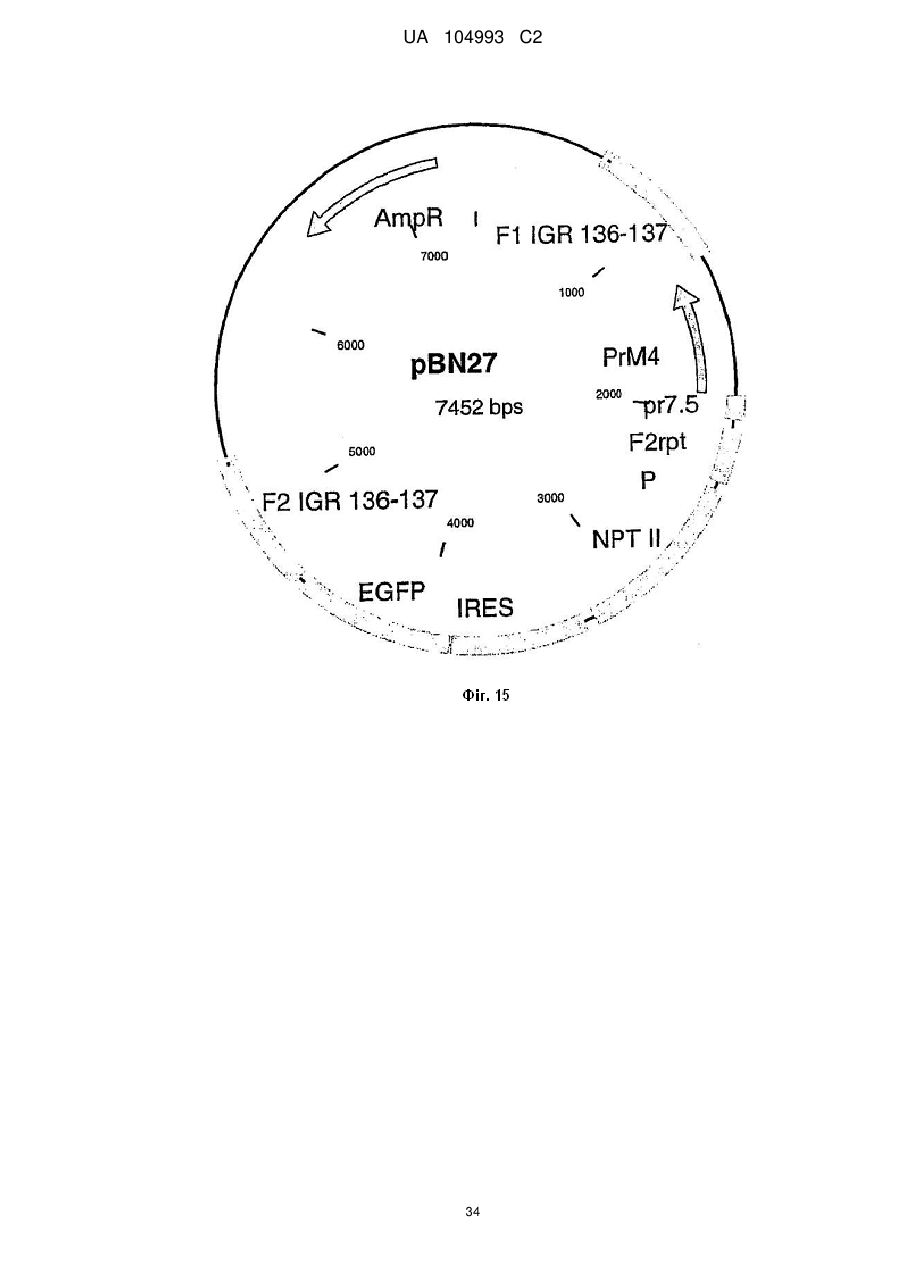
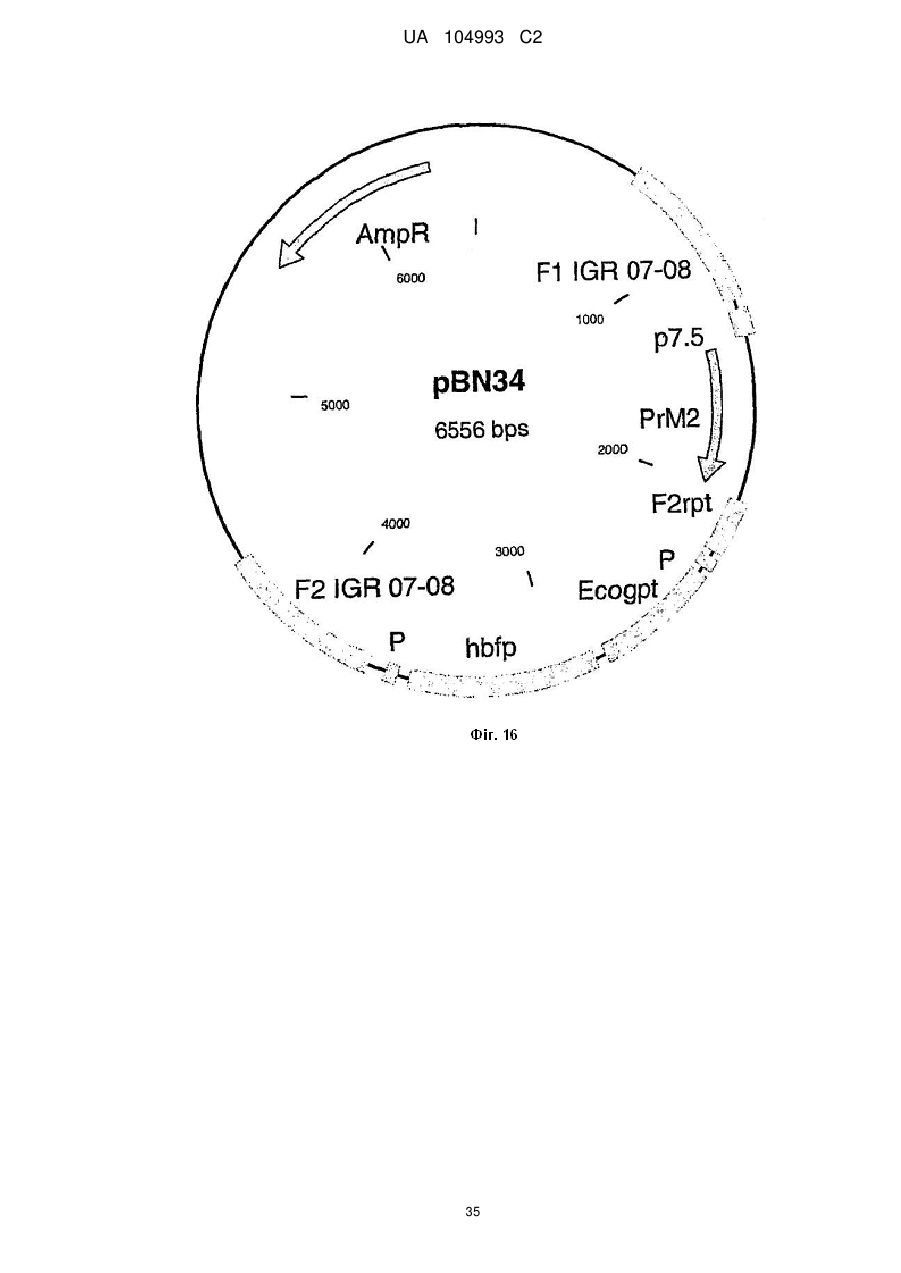
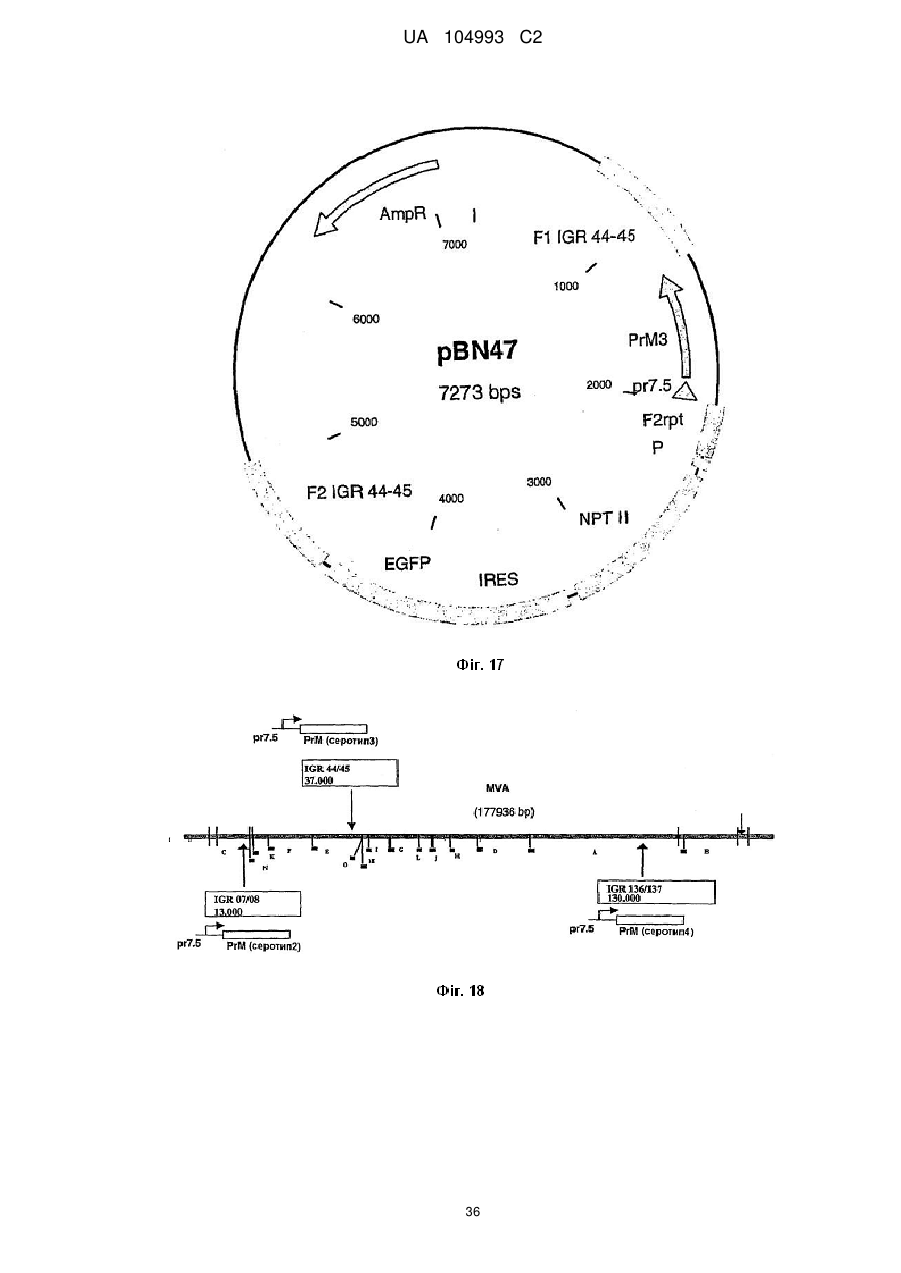
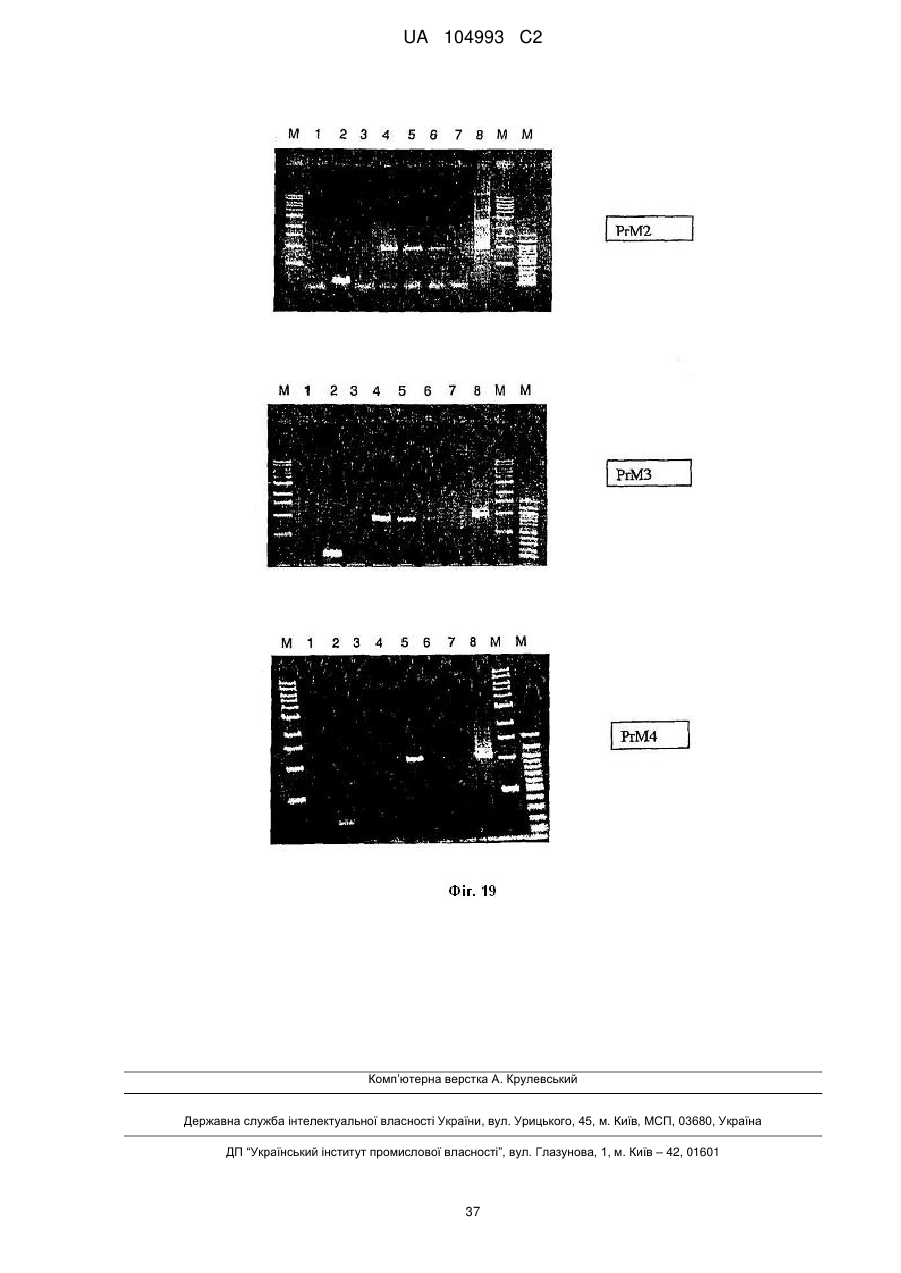
Рекомбінантний поксвірус, який експресує гомологічні гени, вставлені в поксвірусний геном
Формула / Реферат
1. Рекомбінантний модифікований вірус вакцинії Ankara (MVA), що містить щонайменше дві гомологічні чужорідні послідовності, крім чужорідних генів, з гомологією, яка становить щонайменше 50 %, в якому кожна з вказаних послідовностей вбудована в окремий сайт інсерції вірусного геному.
2. Рекомбінантний вірус MVA, що містить щонайменше дві гомологічні чужорідні послідовності, при цьому вказані послідовності мають гомологію, яка становить щонайменше 60 %.
3. Рекомбінантний вірус MVA за п. 1 або 2, в якому послідовності мають гомологію 65-75 %.
4. Рекомбінантний вірус MVA за п. 1 або 2, в якому чужорідні послідовності ідентичні.
5. Рекомбінантний вірус MVA за п. 4, в якому послідовності являють собою ранній/пізній промотор р7.5 вірусу вакцинії.
6. Рекомбінантний вірус MVA за будь-яким з пп. 1-5, де MVA є MVA-BN, депонованим у Європейській колекції культур клітин тварин (ЕСАСС) під номером V00083008.
7. Рекомбінантний вірус MVA за пп. 1-6, де вірус MVA є дефіцитним за реплікацією або некомпетентним за реплікацією в клітинах ссавців, включаючи клітини людини.
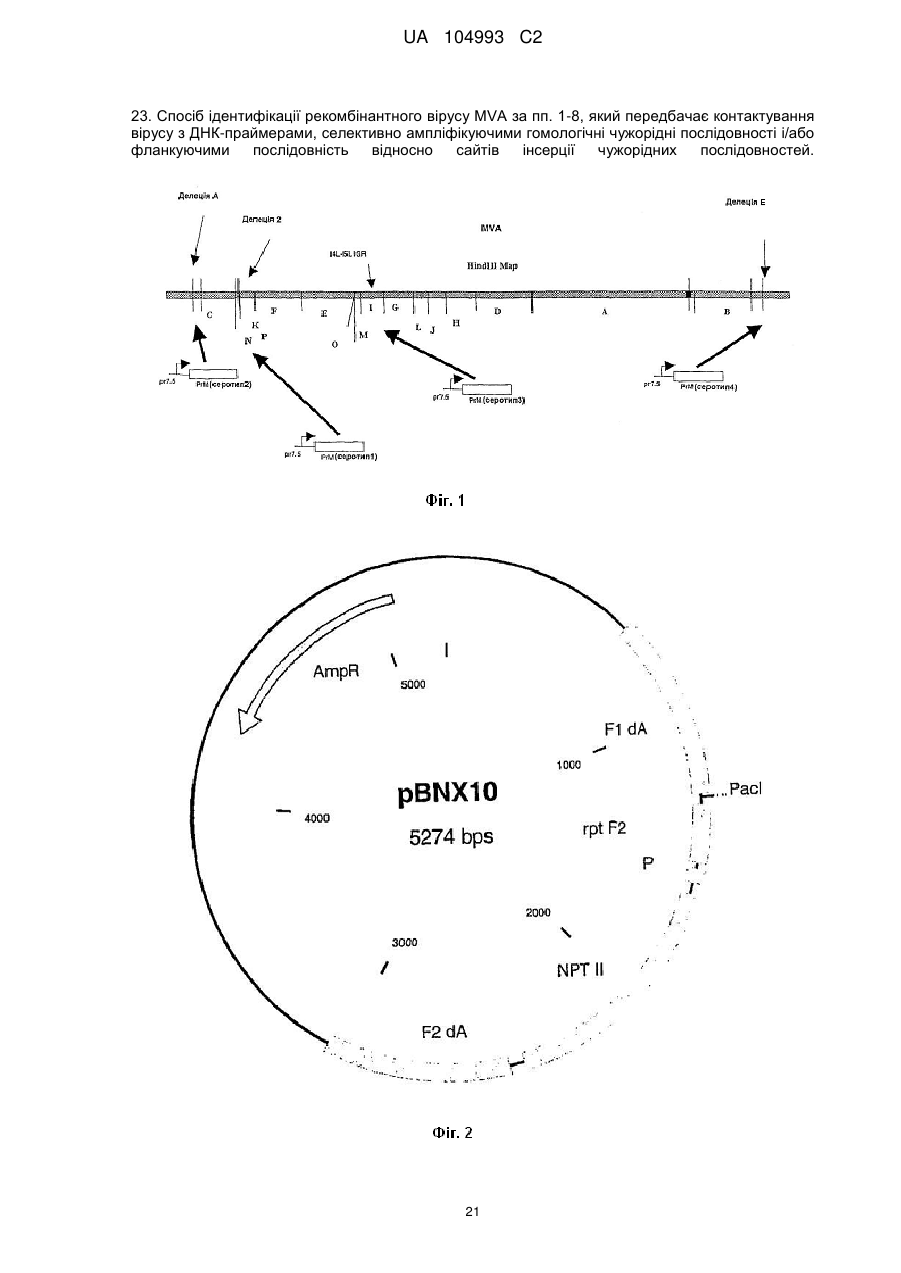
8. Рекомбінантний вірус MVA за пп. 1-7, в якому послідовності вбудовані у сайт, що зустрічається в природі, делеції, і/або у міжгенну ділянку геному вірусу MVA.
9. Рекомбінантний вірус MVA за пп. 1-8 як лікарський засіб або вакцина.
10. Вакцина для впливу на імунну відповідь, переважно на її індукування у тварини, включаючи людину, що містить рекомбінантний вірус MVA за будь-яким з пп. 1-8.
11. Фармацевтична композиція, що містить рекомбінантний вірус MVA за будь-яким з пп. 1-8 і фармацевтично прийнятний носій, розріджувач, ад'ювант і/або добавку.
12. Рекомбінантний вірус MVA за будь-яким з пп. 1-8, вакцина за п. 10 або композиція за п. 11 для впливу на імунну відповідь, переважно її індукування у тварини, включаючи людину.
13. Застосування рекомбінантного вірусу MVA за будь-яким з пп. 1-8 для приготування лікарського засобу.
14. Спосіб впливу на імунну відповідь, переважно її індукування у тварини, включаючи людину, який передбачає введення терапевтично ефективної кількості рекомбінантного вірусу MVA за будь-яким з пп. 1-8, вакцини за п. 10 або композиції за п. 11 тварині або людині, яка підлягає лікуванню.
15. Клітина, яка містить рекомбінантний вірус MVA за пп. 1-8.
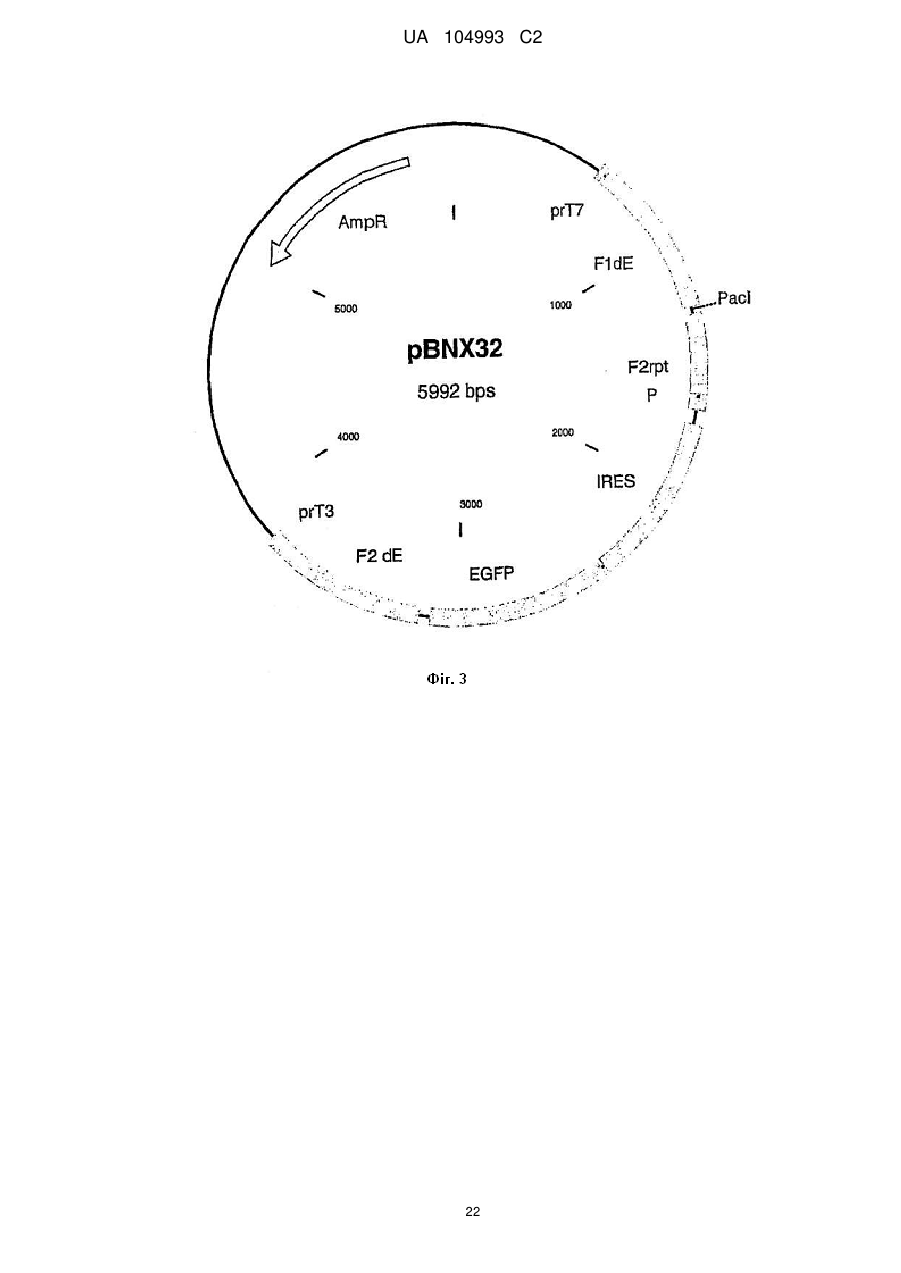
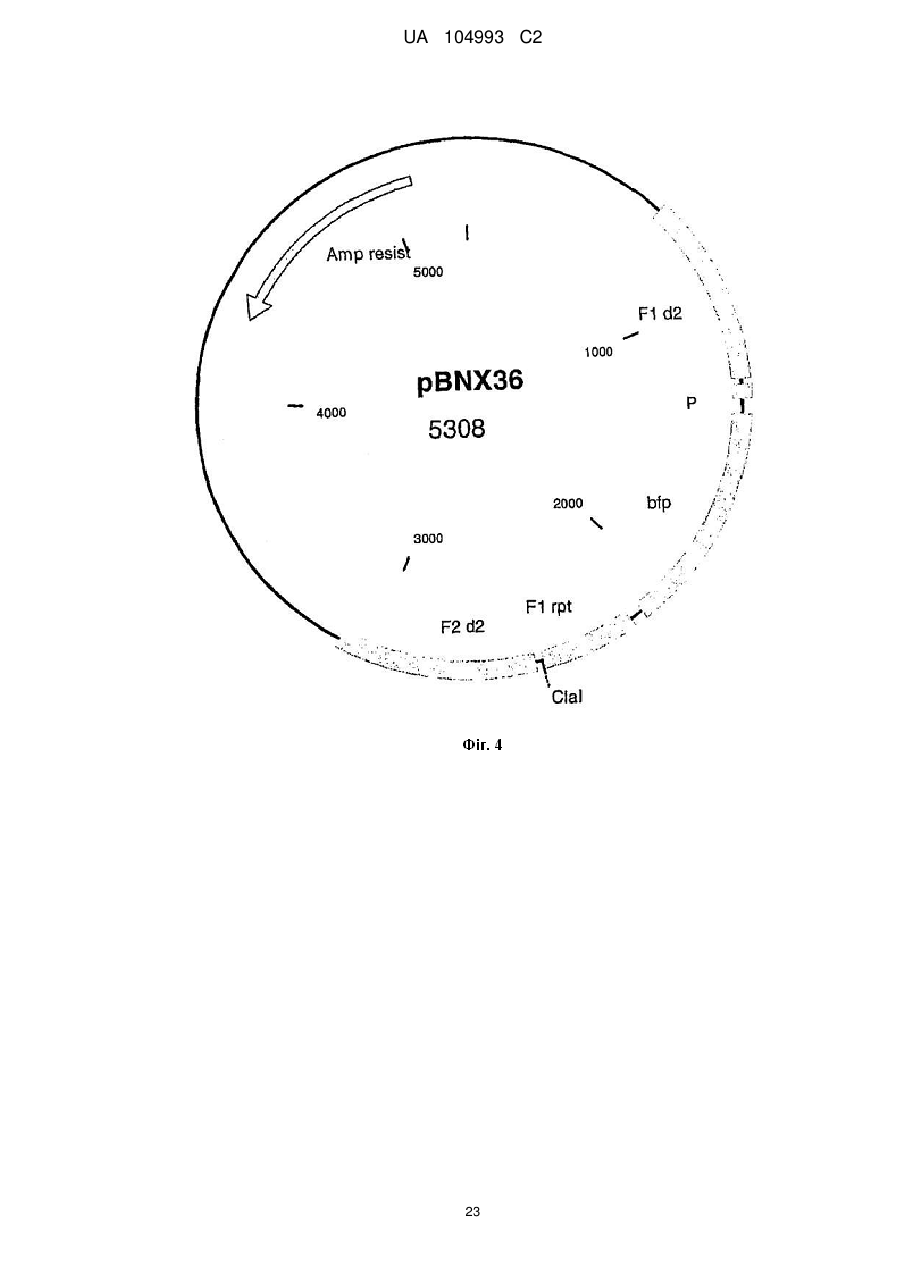
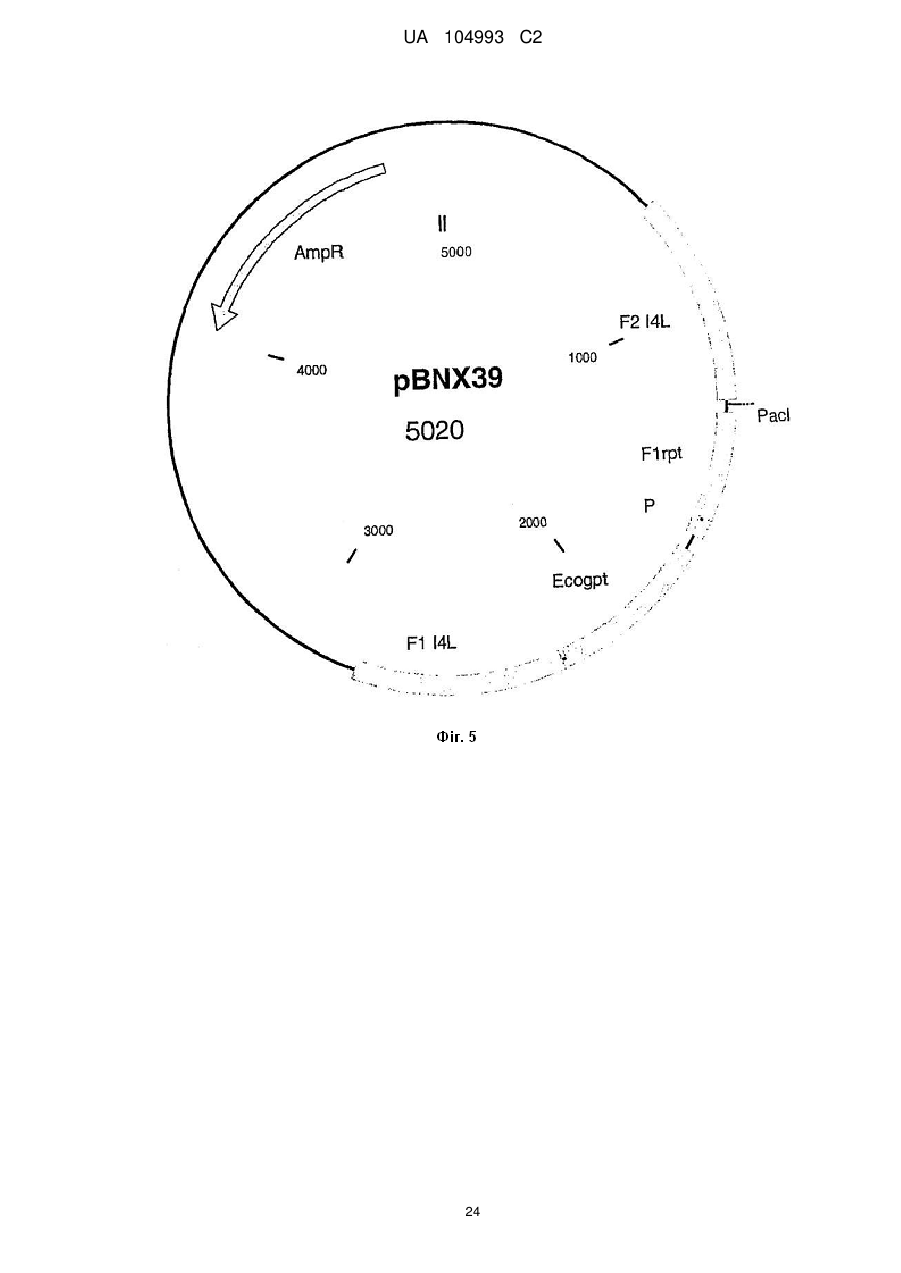
16. Спосіб одержання рекомбінантного вірусу MVA за пп. 1-8, який передбачає стадії інфікування клітини вірусом MVA;
трансфекції інфікованої клітини першою векторною конструкцією, що містить чужорідну послідовність, яка підлягає включенню у геном вірусу MVA, і геномну послідовність вірусу MVA, здатну направляти інтеграцію гетерологічної послідовності, яка підлягає інсерції у сайт інсерції геному вірусу MVA;
ідентифікації, виділення і необов'язково очищення утвореного рекомбінантного вірусу MVA;
повторення вказаних вище стадій з використанням рекомбінантного вірусу MVA, одержаного на попередніх стадіях, для інфекції клітини і додаткової векторної конструкції, яка містить наступну чужорідну послідовність, яка підлягає включенню у геном вірусу MVA, де вказана послідовність є гомологічною відносно послідовності першої векторної конструкції.
17. Набір, що містить дві або більше векторних конструкцій, причому кожна конструкція містить послідовність, де послідовності, включені у різні вектори, є гомологічними послідовностями з гомологією, яка становить щонайменше 50 %, і де кожна послідовність фланкована послідовністю ДНК вірусу MVA, здатною направляти інтеграцію гомологічних послідовностей у геном MVA, і
засоби для ідентифікації і/або селекції рекомбінантних вірусів MVA, які включили вказані гомологічні послідовності у свій геном.
18. Набір за п. 17, де кожна гомологічна послідовність фланкована послідовністю ДНК вірусу MVA, здатною направляти інтеграцію вказаних гомологічних послідовностей кожної векторної конструкції в особливий сайт інсерції геному вірусу MVA.
19. Послідовність ДНК, одержана або гомологічна рекомбінантному MVA-вірусному геному рекомбінантного вірусу MVA за пп. 1-8, де вказана послідовність ДНК містить щонайменше дві гомологічних послідовності і щонайменше частину послідовностей геному вірусу MVA.
20. Спосіб реєстрації клітин, інфікованих рекомбінантним вірусом MVA за пп. 1-8, який передбачає введення послідовності ДНК за п. 19 у вказані клітини.
21. Спосіб ідентифікації рекомбінантного вірусу MVA за пп. 1-8, який передбачає введення послідовності ДНК за п. 19 у вказаний вірус.
22. Спосіб виявлення клітин, інфікованих рекомбінантним вірусом MVA за пп. 1-8, який передбачає контактування клітини з ДНК-праймерами, селективно ампліфікуючими гомологічні чужорідні послідовності і/або фланкуючими послідовність відносно сайтів інсерції чужорідних послідовностей.
23. Спосіб ідентифікації рекомбінантного вірусу MVA за пп. 1-8, який передбачає контактування вірусу з ДНК-праймерами, селективно ампліфікуючими гомологічні чужорідні послідовності і/або фланкуючими послідовність відносно сайтів інсерції чужорідних послідовностей.
Текст
Реферат: Винахід належить до рекомбінантного поксвірусного вектора на основі модифікованого вірусу Ankara (MVA), здатного експресувати дві або більше гомологічні чужорідні послідовності, які походять від різних варіантів мікроорганізмів, та які мають гомологію 50 % або вище. Також винахід стосується способу одержання такого рекомбінантного поксвірусу та використання такого рекомбінантного поксвірусу як медикаменту або вакцини. Крім того, він стосується способу впливу, переважно індукуючого, на імунну відповідь в організмі живих тварин, включаючи людину. UA 104993 C2 (12) UA 104993 C2 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується рекомбінантного поксвірусу, який експресує два або більше гомологічних генів. Вказані гени є гетерологічними до вірусного геному, але гомологічними в порівнянні один з одним. Головними чином, гени одержують з близьких варіантів або підтипів мікроорганізмів. Також винахід стосується способу одержання такого поксвірусу та застосування такого поксвірусу як ліків або вакцини. Крім того, винахід стосується способу, який забезпечує вплив, переважно індукуючий, на імунну відповідь в живих тваринах, включаючи людину. Передумови створення винаходу Кожний живий організм постійно наражається на небезпеку бути інфікованим або патогенними агентами, такими як бактерії, віруси, гриби, або паразитами. Так звана імунна система захищає організм від перманентних інфекцій, захворювань або інтоксикацій, спричинених такими агентами. Імунну систему ссавців можна поділити на специфічну та неспецифічну частини, не дивлячись на те, що обидві частини тісно переплітаються. Неспецифічна імунна відповідь безпосередньо запускає захист проти широкого кола патогенних речовин або інфекційних агентів. Специфічна імунна відповідь запускається після лаг (lag) фази, коли організм вперше заражається відповідною речовиною. Головним чином ця специфічна відповідь базується на продукуванні антигенспецифічних антитіл та на утворенні макрофагів та лімфоцитів, наприклад, цитотоксичних Т-клітин. Специфічна імунна відповідь є відповідальною за той факт, що індивідуум, який перехворів на специфічну інфекцію, є захищеним від цієї специфічної інфекції, але все ще залишається сприйнятливим до інших інфекційних захворювань. Взагалі, повторне зараження тим самим або дуже подібним інфекційним агентом викликає набагато слабші симптоми або такі симптоми відсутні взагалі. Цей так званий імунітет продовжує існувати протягом тривалого часу, в деяких випадках навіть довічно. Часто основний ефект, котрий може бути використаний для запропонованих вакцинацій, розглядають як імунологічну пам'ять. Термін "вакцинація" описаний як спосіб, коли індивідуума заражають нешкідливою, частково інактивованою або повністю інактивованою формою інфекційного агента, яка забезпечує вплив, переважно індукуючий, на імунну відповідь у вказаного індивідуума, котра є причиною довготривалого, якщо не довічного, імунітету проти специфічного інфекційного агента. Збудником натуральної віспи людини є Variola virus. Variola virus належить до родини Poxviridae, родини великих за розміром ДНК-вмісних вірусів, які розмножуються в цитоплазмі клітин як хребетних, так і безхребетних. Базуючись на природі хазяїна: хребетні та комахи, родина Poxviridae може бути розділена на дві підродини - Chordopoxvirinae та Entomopoxvirinae. Chordopoxvirinae, крім інших, містить rd рід Orthopoxvirus та Avipoxvirus (Fields Virology, ed. by Fields B.N., Lippincott-Raven Publishers, 3 edition 1996, ISBN: 0-7817-0253-4, Chapter 83). Рід Orthopoxvirus містить Variola virus - збудник натуральної віспи людини, а також інші економічно важливі віруси, наприклад, віруси верблюжої віспи, коров'ячої віспи, віспи овець, віспи кіз, мавпячої віспи і вакциніявірус. Всі члени цього роду генетично зв'язані і мають подібну морфологію або ряд хазяїнів. Ендонуклеазні карти рестрикції показали високу ідентичність послідовностей, аж навіть до 90 % між різними членами Orthopoxvirus (Mackett & Archard, [1979], J Gen Virol, 45:683-701). Variola virus (VV) - це назва, надана агенту, який використовується щонайменше останні 100 років для вакцинації проти віспи. Невідомо, чи VV - це новий вид, отриманий від вірусу коров'ячої віспи або вакциніявірусу шляхом довготривалих серійних пасажів, чи це живий представник зараз вимерлого вірусу або, можливо, продукт генетичної рекомбінації. Більше того, в ході історії VV виникло багато штамів Variola virus. Ці різні штами демонструють перемінну імуногенність і в тій чи іншій мірі переплітаються з потенційними ускладненнями, найсерйознішим з яких є поствакцинальний енцефаліт. Проте багато з цих штамів використовувались для вакцинації проти віспи. Наприклад, штам NYCBOH, Western Reserve or Wyeth використовувалися перш за все в США, тоді коли штами Ankara, Bern, Copenhagen, Lister i MVA використовувалися для вакцинації в Європі. В результаті глобальної програми вакцинації різними штамами VV в 1980 році WHO остаточно оголосила про успішне викорінення Variola virus. Сьогодні VV переважно використовується як лабораторний штам, але поряд з цим він все ще розглядається як прототип Orthopoxvirus, що є причиною того, чому VV став одним з rd найбільш вивчених вірусів (Fields Virology, ed. by Fields B.N., Lippincott-Raven Publishers, 3 edition 1996, ISBN: 0-7817-0253-4, Chapter 83 and 84). Ще недавно VV та інші поксвіруси використовувалися для вставлення і експресії чужорідних генів. Основна технологія вставки чужорідних генів в живий інфекційний поксвірус включає 1 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 рекомбінацію між послідовністю покс-ДНК, яка фланкуює чужорідний генетичний елемент в донорській плазміді, і гомологічною послідовністю, присутньою в поксвірусі-рятівнику (rescuing). В основному, генетична рекомбінація - це обмін відповідними секціями ДНК між двома ланцюгами ДНК. В деяких вірусах РНК може замінити ДНК. Гомологічні секції нуклеїнової кислоти - це секції нуклеїнові кислоти (ДНК або РНК), які мають ту ж саму послідовність нуклеотидів. Генетична рекомбінація може зустрічатися в природі під час реплікації або при виробництві нового вірусного геному в інфікованій клітині-хазяїні. Тому генетична рекомбінація між вірусними генами може відбуватися протягом вірусного реплікаційного циклу, який має місце в клітині-хазяїні, що співінфікована двома або більше різними вірусами, або іншими генетичними конструкціями. Секція ДНК від першого геному рівнозначно використовується при конструюванні секції геному другого співінфекційного вірусу, в якому ДНК є гомологічною до тією, що взята від першого вірусного геному. Для успішної експресії вставленої генетичної послідовності ДНК модифікованим інфекційним вірусом необхідні дві умови. По-перше, вставка повинна здійснюватись не в суттєву ділянку вірусу для того, щоб модифікований вірус залишався життєздатним. Другою необхідною умовою для експресії вставленої ДНК є присутність промотору у певному положенні по відношенню до вставленої ДНК. Згідно з правилами промотор повинен бути розміщений вище від послідовності ДНК, яка буде експресуватись. Придатність рекомбінантних експресійних VV, наприклад, поверхневих антигенів вірусу гепатиту В (HBsAg), гемаглютиніну вірусу грипу (InfHA) або спорозоїта Plasiaodiurn knowlesi, як живих вакцин для профілактики інфекційних захворювань була продемонстрована і розглянута (Smith, et al. [1984] Biotechnology and Genetic Engineering Revie VVs 2, 383-407). Додатковою перевагою VV є місткість - здатність прийняти велику кількість чужорідних послідовностей, генів або антигенів в межах одного геному VV (Smith & Moss [1983], Gene, 25 (1):21-28). До того ж, повідомлялося, що імунітет до цілого ряду гетерологічних інфекційних захворювань можна викликати єдиним щепленням полівалентної вакцини (Perkus et al, [1985]/ Science, Vol. 229, 981-984). Один приклад експресії різних антигенів єдиним VV був описаний Bray et al. Було показано, що рекомбінантний VV, який є здатним експресувати три різні структурні протеїни четвертого серотипу вірусу тропічної лихоманки (Dengue virus), а саме - капсид (С), передмембрану (prM), протеїн оболонки (Е), і два неструктурні протеїни четвертого серотипу вірусу тропічної лихоманки, а саме NS1 і NS2a, був здатним захистити мишей від гомологічного вірусу тропічної лихоманки четвертого серотипу в контрольному зараженні (Bray et al., [1989], Virology 28532856). Вірус тропічної лихоманки з його чотирма серотипами, серотип 1 вірусу тропічної лихоманки (Den-1) - серотип 4 вірусу тропічної лихоманки (Den-4), є одним з важливих членів виду Flavivirus, що стосується інфікування людей. Інфікування вірусом тропічної лихоманки приводить до ряду хвороб: від таких, що за симптомами подібні до грипу, до тяжких або фатальних захворювань - геморагічної тропічної лихоманки (DHF) з шоковим синдромом (DSS). Спалахи тропічної лихоманки продовжують бути головною проблемою організацій охорони здоров'я в густонаселених областях тропічних і субтропічних регіонів, багатих на москітні вектори. Турбота про нерозповсюдження інфекції тропічної лихоманки та інших захворювань, індукованих Flaviviruses, що переносяться москітами, в багатьох частинах світу привела до активізації зусиль в напрямку розробки вакцин проти тропічної лихоманки, які могли б запобігти як тропічній лихоманці (DF), так і геморагічній тропічній лихоманці (DHF), та вакцин, корисних при захисті індивідуумів, щеплених проти інфекцій, індукованих декількома або всіма флавівірусами, які переносяться москітами. Тоді як більшість випадків DF доведена після першого інфікування будь-яким з чотирьох серотипів, великий відсоток випадків DHF зустрічається у суб'єктів, які вдруге інфіковані серотипом, який відрізняється від того, що спричинив перше зараження вірусом тропічної лихоманки. Ці спостереження дали початок гіпотезі, згідно з якою послідовне інфікування індивідуумів, які мають антитіла до одного серотипу вірусу лихоманки, через певний інтервал часу в ряді випадків може привести до DHF. Відтак, вакцинація проти одного серотипу не призводить до повного захисту від інфікування вірусом тропічної лихоманки, але тільки до захисту від інфікування тим самим штамом вірусу тропічної лихоманки. Навіть більше того, персона, щеплена проти одного серотипу, має підвищений ризик розвитку тяжких ускладнень, наприклад, геморагічної тропічної лихоманки, коли вказана персона інфікована штамом іншого серотипу вірусу тропічної лихоманки. 2 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 Тому є потреба у мультивалентній вакцині, яка містить антигени до всіх чотирьох серотипів вірусу тропічної лихоманки. До цього часу пропонувалось виготовляти мультивалентну вакцину шляхом змішування панелі (набору) рекомбінантних VV, кожний VV кодує послідовності різних вірусів (Moss/ [1990] Immunology, 2, 317-327] Імунологія, 2, 317-327). Проте така мультивалентна вакцина має окремі недоліки. По-перше, є обтяжливим одержувати декілька незалежних рекомбінантних VV. Поряд з відокремленими виробничими процесами, перевірка і гарантія якості - це також надзвичайно тривалий процес. По-друге, інфікування сумішшю рекомбінантних вірусів, які експресують різні послідовності, завжди несе ризик, що результат інфікування не є добре прорахованим. Головний ризик - це те, що тільки індивідуальні рекомбінанти, але не все різні рекомбінанти, що містяться у вакцині, інфікуватимуть клітини-мішені. Однією з причин може бути нерівномірне розповсюдження рекомбінантних вірусів. Іншою причиною може бути інтерференція між різними рекомбінантними вірусами при інфікуванні окремих клітин. Такі інтерференції відомі як феномен суперінфікування. В даному випадку тільки деякі антигени, але не всі різні антигени мультивалентної вакцини, в фіналі будуть експресуватись в інфікованих клітинах, а тому і бути присутніми у імунній системі хворого. Як результат, імунний захист буде отриманий тільки проти деяких з антигенів, але далекий від забезпечення повного імунного захисту проти різних антигенів, які містяться або представлені мультивалентною вакциною. В контексті вакцини проти інфікування вірусом тропічної лихоманки, підхід через мультивалентну вакцину має недоліки, оскільки різні послідовності експресуються в різних кількостях або в непередбаченій формі, як це було показано для протеїну оболонки вірусу тропічної лихоманки 2 (Deuble et al, [1988], J. Virol 65:2853), тому така вакцинація надзвичайно ризикована для хворого. Неповна вакцинація з використанням панелі рекомбінантних Vaccinia вірусів забезпечить імунний захист тільки проти деяких, але не всіх серотипів вірусу тропічної лихоманки. На жаль, у разі зараження тропічною лихоманкою неповна вакцинація є надзвичайно неприйнятною, оскільки вона збільшує ризик летальних ускладнень, наприклад, геморагічної тропічної лихоманки. Об'єкт винаходу Таким чином, об'єктом даного винаходу є стійка, ефективна і надійна вакцина проти інфекційних захворювань, які можуть викликатися більше ніж одним штамом, клейдом, варіантом, підтипом або серотипом мікроорганізму, який спричиняє вказане інфекційне захворювання. Ще одним об'єктом даного винаходу є стійка, ефективна і надійна вакцина проти зараження вірусом тропічної лихоманки, яка дозволяє одержати надійну вакцинацію проти всіх серотипів вірусу тропічної лихоманки. Детальний опис винаходу Даний винахід заснований на ідеї включення у поксвірус гомологічних генів, одержаних від різних штамів, клейдів, варіантів, підтипів або серотипів мікроорганізму, який спричиняє інфекційне захворювання. Як вже згадано вище, вони складають, наприклад, 4 групи, підтипи або серотипи існуючого вірусу тропічної лихоманки, всі вони містять ті ж самі види генів, наприклад такі, як ген, що кодує капсидний протеїн (С), ген, що кодує передмембрану (PrM) або протеїн оболонки (Е). Проте послідовність нуклеїнової кислоти того ж самого виду гена не є повністю ідентичною і відповідно не є ідеально гомологічною у всіх 4 серотипів: наприклад, порівняння (з Lasergene 4.05 Magalign, Macintosh) послідовностей гена PrM усіх чотирьох серотипів вірусу тропічної лихоманки - 1, 2, 3 та 4 (PrM 1-4) - виявило 66,5-72,9 % ідентичність послідовностей, тобто, гомологія становить приблизно 65-75 %. Передбачається, що відмінності та гомологічні варіації в генах різних підтипів мікроорганізму, який викликає інфекційне захворювання, є причиною того, чому вакцинація проти одного підтипу автоматично не приводить до захисту проти інфікування іншими варіантами того ж мікроорганізму. Таким чином, метою винаходу було одержати рекомбінантний вірус, який містить тісно споріднені або гомологічні гени, отримані від різних штамів, клейдів, варіантів, підтипів або серотипів мікроорганізму, який викликає інфекційне захворювання. Проте, як також вже було вказано вище, гомологічна рекомбінація між гомологічними послідовностями відбувається протягом життєвого циклу вірусу та навіть має місце між секціями ДНК, які не є ідеально гомологічними. Тому очікується, що вставка гомологічних генів в один вірусний геном приведе до гомологічної рекомбінації і делецій вставлених гомологічних генів. Проте, при одержанні рекомбінантного поксвірусу, який містить в своєму геномі принаймні два чужорідних гени з гомологією принаймні 60 %, несподівано було знайдено, що вказані гомологічні гени залишаються жорстко вставленими у вірусний геном. 3 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 60 Навіть якщо гомологічні гени, переважно з гомологією принаймні 50 %, вставлені в різні інсерційні сайти вірусного геному, гени також залишаються жорстко вставленими у вірусний геном: В даному випадку очікувалось, що додатковим результатом рекомбінації, яка відбувається між вказаними гомологічними генами, буде втрата вірусних генів, важливих для ампліфікації вірусу та для вірусного життєвого циклу відповідно, тобто очікували, що вірусний життєвий цикл буде серйозно пошкоджений. Оскільки частота рекомбінації є пропорційною відстані між двома зв'язаними генами, крім того, очікували, що частота рекомбінації, яка відбувається між двома або більше гомологічними генами, локалізованими в різних інсерційних сайтах, буде високою, а тому призведе до делецій вказаних генів та/або серйозних інтерференцій. Дивовижним відповідно було те, що рекомбінація не відбувалась, але гомологічні гени залишались жорстко вставленими в різні інсерційні сайти вірусного геному. Згідно з попереднім рівнем техніки рекомбінантні поксвіруси, які містять чужорідні ДНК від флавівірусів, наприклад від Japanese Encaphalitis Virus (JEV), Yellow Fever Virus (YFV) і вірусу тропічної лихоманки, уже відомі (US Patent No. 5,514,375). Проте, кожний ген, одержаний від вказаних флавівірусів, був вставлений тільки один раз і тільки в один і той самий інсерційний сайт. Крім того, порівняння послідовностей за допомогою гомологічного комп'ютерного програмного забезпечення (Lasergene 4.05 Megalign, Macintosh) для генів, вставлених в геном поксвірусу, виявило таку гомологію: для одержаних від JEV - 20,2-29,6 %, від YFV - 29,2-45,3 % і від вірусу тропічної лихоманки - 22,8-29,5 %. Подібне розкрито у заявці WO 98/13500, де описана вставка антигенів вірусу тропічної лихоманки в один і той самий інсерційний сайт модифікованого Анкара вірусу коров'ячої віспи (MVA), особливо у делеційний сайт II. В патенті США 5,338,683 описана вставка 13 і 14 gp генів глікопротеїну герпесвірусу в два різні інсерційні сайти одного рекомбінантного поксвірусу; проте обидва гени мають гомологію тільки 25,2 %. Порівняння між собою послідовностей генів гемаглютиніну та нуклеопротеїну вірусу грипу, вставлених в один і той самий інсерційний сайт (делеційний сайт III) модифікованого Анкара вірусу коров'ячої віспи (MVA), показало гомологію 49,1 % (Патент США 5,676,950; Sutter et al, [1994], Vaccine 12:1032). В патенті США 5,891,442 розкрито рекомбінантний поксвірус, який містить кодуючі послідовності для поліпротеїнів VP2, VP3 і VP4 збудника інфекційного захворювання bursal. Вказані гени злиті і тому були вставлені в один і той самий інсерційний сайт та мають гомологію 41,9-50,3 %. На завершення, патент США 6,217,882 описує рекомбінантний свінпоксвірусний вектор, який містить 50 gp та 63 gp антигенів псевдосказу з гомологією 52,7 %, вставлених в один і той самий інсерційний сайт. Підсумовуючи, може статися, що згідно з попереднім рівнем техніки гомологічні гени або послідовності, які мають гомологію принаймні 50 %, цілком вставляються в один і той самий або поокремий інсерційний сайт в межах вірусного геному. Згідно з дійсним винаходом гомологічні гени або послідовності мають гомологію принаймні 50 %, тобто гомологію 50-100 %, тобто принаймні 50 % ідентичних пар нуклеотидів. Гени або послідовності, що мають гомологію нижчу за 50 %, можуть розглядатися як гетерологічні. В контексті даного винаходу термін "гомологічний" або "гомологія" використовується, коли гени або послідовності порівнюються один з одним, тоді як терміни "чужорідний" ген, "екзогенна" або "гетерологічна" послідовність використовуються, коли гени або послідовності порівнюються з поксвірусним геномом; тобто вказані терміни застосовуються до ДНК послідовності, що зазвичай не зустрічається в природі і яка згідно з винаходом зв'язана з поксвірусом. Відтак, дійсний винахід стосується рекомбінантних поксвірусів, які містять принаймні два гени, які є гетерологічними у порівнянні з вірусним геномом, але які є гомологічними по відношенню один до одного. Термін "гени" належить до кодуючих послідовностей, які кодують, наприклад, протеїни, поліпептиди, пептиди, антигени і тому подібне. Протеїни, поліпептиди, пептиди, які транслюються від гомологічних генів, виконують ті ж самі задачі і демонструють ті ж самі функціональні властивості. Гомологічні гени регулярно одержують від різних, але близьких джерел або організмів. Згідно з одним прикладом втілення даного винаходу гомологія кодуючих послідовностей переважно становить 70-80 %, ще краще 80-90 % або 90-100 %. Краще всього, коли гомологія становить 65-75 %. Оскільки згідно з даним винаходом рекомбінантний поксвірус містить релевантну генетичну інформацію в одній єдиній інфекційній одиниці або тільки в одній частинці вірусу, то ризик нерівномірного зараження і незбалансованої експресії різних гомологічних послідовностей відсутній. Тому, згідно з даним винаходом, рекомбінантний поксвірус, який містить або здатний 4 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 експресувати окремі близько або навіть дуже близько зв'язані гени або майже ідентичні послідовності в одній інфікованій клітині, є особливо вигідним для одержання мультивалентних вакцин. Ця перевага є особливо цікавою для розробки вакцин проти захворювань, які можуть викликатися близько зв'язаними штамами або серотипами вірусу, наприклад вірусу тропічної лихоманки. Рекомбінантні поксвіруси, які містять гомологічні гени різних серотипів вірусу тропічної лихоманки, описані в Прикладах. Згідно з даним винаходом гомологічні гени або послідовності можуть походити від будьякого мікроорганізму, наприклад, від будь-якого вірусу, окрім вірусного вектора, будь-якої бактерії, будь-якого гриба або паразита. Переважно гомологічні гени або послідовності отримані від інфекційного або патогенного мікроорганізму і краще всього від різних штамів або клейдів, варіантів, підтипів або серотипів вказаного мікроорганізму. Терміни "штам" або "клейд" - це технічні терміни, які добре відомі фахівцю в даній галузі та відносяться до таксономії мікроорганізмів. Таксономічна система класифікує всі охарактеризовані на сьогодні мікроорганізми в ієрархічний спосіб - родина, рід, види, штами (Fields Virology, ed. by Fields B.N., Lippincott-Raven Publishers, 4* edition 2001). В той час як критерієм для членства в родині є філогенетична схожість, рід містить всі члени, об'єднані загальними характеристиками, види визначаються як політетичні (об'єднані на підставі порівняння декількох ознак) класи, які складаються з врахуванням гомологічного походження та здатності займати специфічні екологічні ніші. Термін "штам" або "клейд" описує мікроорганізм, тобто вірус, який розділяє загальні характеристики, подібну основну морфологію або структуру та організацію генома, але відрізняється за біологічними властивостями, подібний ряд хазяїв, тропізм тканин, географічне розповсюдження, атенуацію та патогенність. Термін "варіанти" або "серотипи", крім того, визначає відмінності між членами того ж самого штаму, також названими підтипами, які демонструють індивідуальний інфекційний спектр або антигенні властивості внаслідок незначних змін в геномі. Згідно з подальшим втіленням даного винаходу гомологічні гени або послідовності відбираються з вірусів, переважно таких вірусів, які належать до роду Flaviviruses, переважно таких як, але не обмежуючись цим, вірус тропічної лихоманки, West Nile virus або Japanese encephalitis virus; які належать до роду Retroviruses, переважно таких як, але не обмежуючись цим, Human Immunodeficiency Virus (HIV); які належить до роду Enteroviruses, переважно таких як, але не обмежуючись цим, збудники захворювань рук, ніг та роту, EV71; які належить до роду Rotaviruses або які належать до роду Orthomyxoviruses, переважно таких як, але не обмежуючись цим, вірус грипу. Найбільша перевага віддається гомологічним генам, одержаним від Flavivirus. Згідно з переважним прикладом втілення, гомологічні гени вибирають з генів вірусу тропічної лихоманки, переважно С, NS1 та/або NS2, краще Е, ще краще PrM. Найпереважнішими є гомологічні гени, одержані від різних серотипів вірусу, коли вказані гени можуть бути одержані від одного, двох, трьох або від усіх чотирьох серотипів вірусу тропічної лихоманки. Згідно з ще одним прикладом втілення гомологічні гени вибирають з різних штамів або клейдів HIV. Переважно гомологічні гени вибирають з gag/pol кодуючої послідовності, більш переважно - з env кодуючої послідовності або ще краще - з комбінації структурних або регуляторних HIV кодуючих послідовностей. Вірусний вектор, придатний для даного винаходу, вибирають з групи поксвірусів, які можна легко культивувати у вибраних клітинах хазяїна, наприклад в клітинах птахів, але які є надзвичайно дефектними за реплікацією або фактично не відтворюються в людині або в людських клітинах. Згідно з одним із переважних втілень поксвірус згідно з даним винаходом вибирають з групи, яка складається з canarypox viruses (Plotkin et al. [1995] Dev Biol Stand, vol 84: pp. 165-170. Taylor et al. [1995] Vaccine, Vol 13. No. 6: pp. 539-549), fowlpox viruses (Afonso et al. [2000] J Virol, pp. th 3815-3831. Fields Virology, ed. by Fields B.N., Lippincott-Raven Publishers, 4 edition 2001, Chapter 85: page 2916), penguin pox viruses (Stannard et al. [1998] J Gen Virol, 79, pp. 1637-1649) або їх похідних. Оскільки ці віруси належать до роду Avipoxviruses, то вони можуть легко культивуватись та ампліфікуватись в клітинах птахів. Проте в людських клітинах та в клітинах ссавців вони є реплікаційно дефектними, це означає, що ніякого суттєвого продукування потомства інфекційних вірусів не відбувається. Згідно з подальшим втіленням даного винаходу Vaccinia viruse (вірус коров'ячої віспи або вакциніявірус), переважно ослаблений Vaccinia viruse, використовується для одержання рекомбіиантних поксвірусів, які містять два або більше гомологічних гени. 5 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 60 Хоча відомо, що Vaccinia viruse (VV) може зазнавати гомологічну рекомбінацію коротких гомологічних послідовностей, а відтак і видалення гомологічних послідовностей (Howley et al., [1996], Gene 172:233-237), винахід забезпечує рекомбінантний Vaccinia viruse, який включає гомологічні послідовності або гени, жорстко вставлені в його геном. Це відкриття є особливо непередбачуваним, оскільки згідно з Howely et al. вже тільки коротких послідовностей від 300 пар нуклеотидів (bр) було достатньо для того, щоб індукувати реконструкцію геному та делецію гомологічних послідовностей у Vaccinia viruse. Практикуючий фахівець повинен очікувати, що більш довгі послідовності індукуватимуть рекомбінаційні події навіть з вищою вірогідністю. Проте, згідно з даним винаходом, навіть послідовності, які містять повні гомологічні гени, можуть жорстко вставлятися у геном Vaccinia viruse. Одним - не лімітуючим - прикладом вірусу коров'ячої віспи є надзвичайно ослаблений і з обмеженим рядом хазяїв штам модифікованого Ankara Vaccinia вірусу (MVA) (Sutter, G. et al. [1994], Vaccine 12:1032-40). MVA був одержаний шляхом приблизно 570 серійних пасажів на фібробластах курячих ембріонів Ankara штаму коров'ячої віспи (CVA) (для ознайомлення дивись Mayr, A., et al. [1975], Infection 3, 6-14). Результатом цих тривалих пасажів CVA було видалення близько 31 кілобаз його геномної послідовності. Одержаний вірусний штам MVA було описано як надзвичайно обмежений відносно клітин-хазяїв (Meyer, H. et al., J. Gen. Virol. 72, 1031-1038 [1991]). Типовим штамом MVA є MVA 575, який задепонований в European Collection of Animal Cell Cultures під реєстраційним номером ЕСАСС V00120707. В іншому втіленні згідно з даним винаходом може використовуватися штам MVA-Vero або його похідні. Штам MVA-Vero задепоновано в European Collection of Animal Cell Cultures під реєстраційним номером ЕСАСС V99101431 та ЕСАСС 01021411. Безпечність MVA-Vero визначається біологічними, хімічними і фізичними особливостями, як це продемонстровано в описі міжнародної заявки на винахід РСТ/ЕР01/02703. В порівнянні з нормальним MVA, MVAVero має одну додаткову геномну делецію. Згідно з даним винаходом термін "похідні" вірусу застосовується до вірусного потомства, яке демонструє ті ж самі характерні риси, що й батьківський вірус, але виявляє відмінності в одній або більше частинах його геному. Ще в одному прикладі здійснення даного винаходу використовують MVA-BN. MVA-BN задепонований в European Collection of Animal Cell Cultures під реєстраційним номером ЕСАСС VO 0083008. Шляхом використання MVA-BN або його похідного була одержана специфічна безпечна вірусна вакцина, оскільки було показано, що вірус MVA-BN - це надзвичайно сильно ослаблений вірус, отриманий від модифікованого Анкара вірусу коров'ячої віспи. Таким чином, згідно з даним винаходом в переважному його втіленні MVA-BN або похідні від нього, які містять два або більше гомологічних гени, використовуються як вірусний вектор. Термін "похідна MVABN" описує вірус, який має ті ж самі функціональні особливості у порівняні з MVA-BN. Особливості MVA-BN. опис біологічних випробувань, які дозволяють визначити, чи MVA - це MVA-BN і його похідна, та методів, які дозволяють одержати MVA-BN або його похідні, описані в WO 02/42480 (включений сюди як посилання). Одним з легких шляхів визначення функціональних особливостей MVA-BN або його похідних є його виснаження і відсутність реплікації в людських клітинах HaCat. Згідно з даним винаходом в рекомбінантному поксвірусі експресія екзогенних послідовностей переважно контролюється поксвірусним транскрипційним контролюючим елементом, більш переважно MVA, вірусу сифілісу канарок, пташиного сифілісу або контролюючим транскрипційним елементом вірусу сифілісу пінгвіна, або краще всього промотором вірусу коров'ячої віспи. Згідно з даним винаходом поксвірусні транскрипційні контролюючі елементи включають, крім того, будь-який транскрипційний контролюючий елемент, який функціонує в поксвірусній системі. Згідно з даним винаходом вставка екзогенних послідовностей переважно здійснюється в несуттєву ділянку геному вірусу. Несуттєвими ділянками, наприклад, є локуси або відкриті рамки зчитування (ORF) поксвірусних генів, які не є важливими для життєвого циклу поксвірусу. Згідно з даним винаходом міжгеномні ділянки, описані як простір між двома ORF, також розглядаються як несуттєві ділянки. В іншому втіленні винаходу, екзогенні послідовності вставлені на місце природно утворених делецій геному MVA (розкрито в РСТ/ЕР96/02926 і наведено тут як посилання). Згідно з даним винаходом орієнтація вставленої ДНК не має впливу на функціональність або стабільність рекомбінантного вірусу. Оскільки рекомбінантний поксвірус згідно з винаходом є надзвичайно обмеженим в рості, а тому - надзвичайно ослабленим, то він є ідеальним кандидатом в агенти для лікування широкого кола ссавців, включаючи людей та навіть імунноскомпроментованих людей. Відтепер 6 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 60 даний винахід також забезпечує фармацевтичну композицію і вакцину для індукування імунної відповіді в живому тваринному організмі, включаючи людину. Фармацевтична композиція може загалом містити один або більше фармацевтично прийнятних та/або схвалених носіїв, добавок, антибіотиків, консервантів, ад'ювантів, розріджувачі та/або стабілізаторів. Такі допоміжні субстанції можуть бути водою, соляним розчином, гліцеролом, етанолом, змочувальним або емульгуючим агентом, рН буферним розчином або тому подібним. Придатні носії звичайно є великими, повільно метаболізованими молекулами, такими як протеїни, полісахариди, полімери молочної кислоти, полімери гліколевої кислоти, полімери амінокислот, співполімери амінокислот, ліпідні агрегати або тому подібне. Для приготування вакцин, рекомбінантний поксвірус, згідно з винаходом, переводять у фізіологічно прийнятну форму. Це може бути зроблено, базуючись на досвіді приготування поксвірусної вакцини, яку використовують для щеплення проти віспи (як описано Sfcickl, Н. et аl. [1974] Dtsch. med. Wschr. 99, 2386-2392). Наприклад, очищений вірус зберігається при -80 °C в 8 титрі 5×10 , ТCID50/ml в композиції з 10 mМ Tris, 140 mМ NaCI при рН 7,4. Наприклад, для 28 приготування дози вакцини 10 10 частин вірусу в 100 мл фосфат-буферної солі (PBS) в присутності 2 % пептону і 1 % людського альбуміну ліофілізують в ампулі, переважно скляній ампулі. Як альтернатива, доза вакцини може бути одержана сублімаційною сушкою з композиції, яка містить вірус. Ця композиція може містити додаткові компоненти, такі як, наприклад, манітол, декстран, цукор, гліцин, лактоза або полівінлпіролідон, або інші добавки, такі як антиоксиданти або інертний газ, стабілізатори або рекомбінантні протеїни (наприклад, сироватковий людський альбумін), придатні для застосування in vivo. Скляну ампулу потім запечатують і вона може зберігатися при між 4 °C і кімнатною температурою протягом декількох місяців. Проте, до тих пір, доки не виникне потреба, ампулу переважно зберігають при температурах нижчих за -20 °C. Для вакцинації ліофілізат може бути розчинений в 0,1-0,5 мілілітрах водного розчину, переважно фізіологічного розчину або Tris буферу, і застосовуватись або системно, або локально, тобто парентерально, внутрішньом'язово або застосовуватись будь-який іншим шляхом, відомим фахівцю. Спосіб застосування, доза і кількість введень можуть бути оптимізовані обізнаним спеціалістом у відомий спосіб. Проте в загальному, пацієнтові здійснюють повторне щеплення в період від близько одного місяця до шести тижнів після того, як було зроблено першу вакцинацію. Згідно з даним винаходом рекомбінантний вірус використовується для введення екзогенних кодуючих послідовностей в клітину-мішень. Введення екзогенної кодуючої послідовності в клітину-мішень може використовуватися для продукування in vitro протеїнів, поліпептидів, пептидів, антигенів та епітопів відповідно. До того ж, метод введення гомологічної або гетеро логічної послідовності в клітини може застосовуватися для in vitro та in vivo терапії. Для in vitro терапії ізольовані клітини, що попередньо були (ex vivo,) інфіковані рекомбінантним поксвірусом, згідно з винаходом, вводяться в живий тваринний організм для індукування імунної відповіді. Згідно з винаходом для in vivo терапії рекомбінантний поксвірус безпосередньо вводиться в живий тваринний організм для індукування імунної відповіді. В даному випадку, клітини, що оточують зону щеплення, безпосередньо заражаються in vivo вірусом або його рекомбінантом, згідно з винаходом. Після зараження, клітини синтезують протеїни, поліпептиди, пептиди або антигени, які закодовані в екзогенних кодуючих послідовностях і згодом вони самі або їх частини присутні на клітинній поверхні. Спеціалізовані клітини імунної системи розпізнають присутність таких чужорідних протеїнів, поліпептидів, пептидів, антигенів і епітопів і запускають специфічну імунну відповідь. Методи одержання рекомбінантних поксвірусів або введення екзогенних кодуючих послідовностей в поксвірусний геном добре відомі спеціалісту в даній галузі. Крім того, метод описаний в прикладах і також може бути взятий або поповнений з наступних посилань: - Molecular Cloning-, A laboratory Manual. Second Edition. By J. Sainbrook, E.F. Frifcsch and T. Maniatis. Cold Spring Harbor Laboratory Press. 198: описує методи і ноу-хау для стандартних методів молекулярної біології, таких як клонування ДНК, вестерн-блотінг аналізу, RT-PCR та PCR ампліфікаційних методів. - Virology Methods Manual, Edited by Brian WJ Mahy and Hillar 0 Kangro. Academic Press. 1996: описує методи обробкита маніпулювання вірусами. - Molecular Virology: A Practical Approach. Edited by AJ Davison and KM Elliott. The Practical Approach Series. IRL Press at Oxford University Press. Oxford 1993. Chapter 9: Експресія генів векторами вірусу коров'ячої віспи. - Current Protocols in Molecular Biology. Publisher: John Wiley and Son Inc. 1998. Chapter 16, section TV: Експресія протеїнів в клітинах ссавця з використанням вектору вірусу коров'ячої віспи: описує методи і ноу-хау для обробки, маніпулювання і генетичної інженерії MVA. 7 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для одержання рекомбінантних поксвірусів, згідно з даним винаходом, придатними можуть бути різні методи: вставлена у вірус послідовність ДНК може розміщуватися в плазмідній конструкції Е. соlі, ДНК якої є гомологічною до секції ДНК поксвірусу, що була вставлена. Крім того, вставлена ДНК з'єднана з промотором. Зчеплення промотор-ген розміщене в плазмідній конструкції таким чином, що вказане промотор-ген зчеплення з обох кінців граничить з ДНК послідовністю, гомологічною до послідовності ДНК, що фланкує ділянку покс-ДНК, яка містить несуттєвий локус. Результуючу плазмідну конструкцію ампліфікують в бактерії Е. Соlі та ізолюють. Ізольовану плазміду, яка містить вставлену ДНК послідовність гена, разом з поксвірусом трансфікують в клітинні культури, наприклад, в курячі ембріональні фібробласти (CEPs). Рекомбінація між гомологічною покс-ДНК в плазміді та вірусним геномом відповідно надає модифікований завдяки присутності чужорідної ДНК послідовності поксвірус. Згідно з найбільш переважним варіантом втілення винаходу клітина культури клітин, як, наприклад, клітини CEF, є інфікованою поксвірусом. Інфікована клітина згодом трансфікується першим плазмідним вектором, який містить чужорідний ген, переважно під транскрипційним контролем поксвірусного контролюючого експресію елемента. Як пояснено вище, плазмідний вектор також містить послідовності, здатні направляти вставку екзогенної послідовності у вибрану частину поксвірусного геному. Плазмідний вектор необов'язково включає також касету, що містить маркерний та/або селекційний ген, який оперативно зв'язаний з поксвірусним промотором. Придатним маркером або селективним геном є, наприклад, гени, які кодують зелений флуоресцентний протеїн, β-галактозидазу, неоміцин, фосфорибозилтрансферазу або інші маркери. Використання селекційних або маркерних касет спрощує ототожнення та видалення одержаного рекомбінантного поксвірусу. Крім того, рекомбінантний поксвірус також можна ідентифікувати, використовуючи PCR технологію. Згодом наступну клітину інфікують рекомбінантним поксвірусом, отриманим як описано вище, та трансфікують другим вектором, що містить ген, який є гомологічним до гена, включеного в перший вектор. Якщо цей ген повинен включатися в інший інсерційний сайт поксвірусного геному, то другий вектор також відрізняється за послідовністю, яка направляє інтеграцію гомологічного гена в геном поксвірусу. Після того, як гомологічна рекомбінація відбулася, рекомбінантний вірус, що містить два гомологічні гени, може бути ізольований. Для введення більш ніж двох гомологічних генів у рекомбінантний вірус, кроки інфікування та трансфікування повторюють, використовуючи рекомбінантний вірус, ізольований в попередніх кроках для інфікування, та за допомогою наступного вектора, який містить наступний гомологічний ген для трансфікування. Альтернативно, кроки зараження і трансфікування, як описано вище, є взаємозамінними, тобто, придатна клітина може спочатку бути трансфікованою плазмідним вектором, який містить чужорідний ген і потім бути інфікованою поксвірусом. Як подальша альтернатива, також є можливим ввести кожний гомологічний ген в різні віруси, співінфікувати клітину усіма одержаними рекомбінантними вірусами та відібрати рекомбінант, який містить всі гомологічні гени. Винахід, крім того, забезпечує набір, який містить дві або більше плазмідні векторні конструкції, здатні направляти включення експресійних гомологічних генів в геном поксвірусу. Поряд з придатним сайтом клонування такі плазмідні вектори містять послідовності, здатні направляти вставку екзогенної послідовності у вибрані частини поксвірусного геному. Необов'язково такі вектори містять селекційні або маркерні генні касети. Набір, крім того, містить засоби та інструкції для вибору вірусів, які є рекомбінантними для одного або декількох гомологічних генів і необов'язково селекційного або маркерного гена, вставленого у вказану векторну конструкцію. Згідно з ще іншим варіантом здійснення винахід включає послідовності ДНК або їх частини, гомологічні до рекомбінантного поксвірусу за даним винаходом. Такі послідовності містять принаймні частину екзогенної послідовності, яка містить принаймні фрагмент одного гомологічного гена згідно з даним винаходом та принаймні фрагмент геномної поксвірусної послідовності згідно з даним винаходом, вказана геномна поксвірусна послідовність переважно фланкує екзогенну послідовність. Такі ДНК послідовності можуть застосовуватись для ідентифікації та видалення вірусу або його похідних шляхом їх використання для одержання PCR-праймерів, гібридизаційних зондів або в інших технологіях. Короткий опис Фігур Фігура 1: Схематичне уявлення інсерційних сайтів чотирьох PrM (= рrе-membrane) генів (серотип 1-4) в геномі MVA за Прикладом 1. 8 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фігури 2-9 і 12-17: Вставки у плазмідній векторній конструкції вказують назву вектора, його розмір та локалізацію інтересуючих послідовностей, наприклад: AmpR = ген резистентності до ампіциліну, bfp = ген голубого флуоресцентного протеїну, dA = делеція A, dE = делеція Е, d2 = делеція 2, Ecogpt = ген гуанозинфосфорибозилтрансферази E.coli, EGFP = збільшений ген зеленого флуоресцентного протеїну, F1 = фланкуюча послідовність 1, F2 = фланкуюча послідовність 2, I4L = міжгенна ділянка I4L, IGR = міжгенна ділянка, МРТ II = ген резистентності до неоміцину, Р = поксвірусний промотор, pr 7.5 = Vaccinia промотор 7.5 (коров'ячої віспи), PrM = ген передмембрани вірусу тропічної лихоманки, число вказує на серотип, з якого він походить, rpt – повторення фланкуючої послідовності. Фігура 10: PCR-перевірка вектора, що кодує стратегії чотирьох різних інсерційних векторів (pBN49, pBN50, pBN40, pBN39). Кожна плазміда була протестована з 4 різними PCRпраймерними комбінаціями. Кожна комбінація є специфічною для однієї конкретної PrM послідовності, інтегрованої в один конкретний інсерційний сайт. Фігура 11: PCR-перевірка рекомбінантного поксвірусу, що включає чотири гомологічні PrM гени вірусу тропічної лихоманки (Приклад 1). Тоді як у верхній частині гелю показані різні PCRрезультати рекомбінантного вірусу, нижня частина надає результати тих самих PCR реакцій для вказаних контрольних плазмід. Плазміди, які містять гомологічні послідовності, названі pBN39, pBN49 або pBN50. PrM означає вставлені передмембранні гени вірусу тропічної лихоманки, число означає серотип, з якого вони походять. dA = делеція A, dE = делеція Е, d2 = делеція 2, I4L = міжгенетична ділянка I4L описує інсерційний сайт екзогенної ДНК. Фігура 18: Схематичне уявлення інсерційних сайтів трьох PrM генів (серотип 2-4) в MVAгеномі згідно з Прикладом 2. Фігура 19: PCR-перевірка рекомбінантного поксвірусу, який містить три гомологічних PrM гена вірусу тропічної лихоманки, вставлених в міжгенну ділянку (Приклад 2). Верхня панель показує результати PCR-реакцій, специфічних для PrM2; середня панель показує результати PCR-реакцій, специфічних для PrM3, і нижня панель показує результати PCR-реакцій, специфічних для PrM4. Полоса 8 показує ті ж самі PCR-реакції для контрольних плазмід. Полоса 2 показує холостий векторний контроль MVA. PrM означає вставлені передмембранні гени вірусу тропічної лихоманки, число означає серотип, з якого вони походять. М = маркер молекулярної ваги. Наступні приклади в подальшому ілюструють даний винахід. Для спеціаліста в даній галузі є добре зрозумілим те, що наведені приклади жодним чином не можуть інтерпретуватися як такі, що обмежують обсяг застосування наданих даним винаходом технологій лише цими прикладами. Приклад 1 Інсерційні вектори Інсерційний вектор для делеції А Для вставки екзогенних послідовностей в геном MVA в так звану делецію А або делецію 1 відповідно, що відповідає 7608-7609 геномній позиції, був сконструйований плазмідний вектор, який містить біля 600 bр фланкуючих послідовностей по сусідству з делеційним сайтом А. Для того, щоб виділити фланкуючі послідовності з геномних ДНК MVA-BN, придатні PCR-праймери можуть підбиратися за допомогою придатного комп'ютерного забезпечення (DNAsis, Hitashi software engeneering, San Bruno, USA). Такі праймери містять подовження з ензиморестрикційними сайтами, які використовуватимуться для того, щоб клонувати фланкуючі послідовності в плазмідний вектор. В ділянку між цими фланкуючими послідовностями введена селекційна генна касета, наприклад, NPT II ген (резистентність до неоміцину) під транскрипційним контролем поксвірусного промотору. Крім того, є сайт клонування для вставки додаткових генів або екзогенних послідовностей, який вставлений в делеційний сайт А. Одна така векторна конструкція згідно з даним винаходом розкрита на Фігурі 2 (pBNXIO). Інсерційний вектор для делеції Е Для вставки екзогенних послідовностей в геном MVA в так звану делецію Е або делецію 4 відповідно, що відповідає 170480-170451 геномній позиції, був сконструйований плазмідний вектор, який містить біля 600 bр фланкуючих послідовностей по сусідству з делеційним сайтом Е. Вектор спланований і сконструйований подібно до описаного вище. В ділянці між фланкуючими послідовностями розміщений EGFP ген (зелений флуоресцентний протеїн, Clonetech) під транскрипційним контролем поксвірусного промотору. Крім того, є сайт клонування для вставки додаткових генів або послідовностей, який вставлений в делеційний сайт А. Одна така векторна конструкція згідно з даним винаходом розкрита на Фігурі 3 (pBNX32). Інсерційний вектор для делеції 2 9 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 Для вставки екзогенних послідовностей в геном MVA в так звану делецію 2, що відповідає 20718-20719 геномній позиції, був сконструйований плазмідний вектор, який містить біля 600 bр фланкуючих послідовностей по сусідству з делеційним сайтом 2. Вектор спланований і сконструйований подібно до описаного вище. В ділянці між фланкуючими послідовностями розміщений hbfp ген (humanized blue fluorescing protein, Pavalkis GN et al.) під транскрипційним контролем поксвірусного промотору. Крім того, є сайт клонування для вставки додаткових генів або послідовностей, який вставлений в делеційний сайт 2. Одна така векторна конструкція згідно з даним винаходом розкрита на Фігурі 4 (pBNX36). Інсерційний вектор для міжгенної ділянки, I4L Для вставки екзогенних послідовностей в міжгенну ділянку, між ORF I3L та І4L, що відповідає 56760 геномній позиції, був сконструйований вектор, який вектор конструювався, який містить біля 600 bр фланкуючих послідовностей по сусідству з міжгенною ділянкою при I4L локусі. Вектор спланований і сконструйований подібно до описаного вище. В ділянці між фланкуючими послідовностями розміщений Ecogpt ген (або gpt означає ген фосфорибозилтрансферази, виділений з Е. соlі) під транскрипційним контролем поксвірусного промотору. Крім того, є сайт клонування для вставки додаткових генів або послідовностей, який вставлений в міжгенну ділянку I4L ORF. Одна така векторна конструкція згідно з даним винаходом розкрита на Фігурі 5 (pBNX39). Конструювання рекомбінантного поксвірусу, який містить декілька гомологічних генів, інтегрованих в його геном. Інсерційні вектори Для того, щоб вставити чотири PrM гени чотирьох серотипів вірусу тропічної лихоманки в MVA геном були використані чотири незалежні рекомбінаційні вектори. Як детально описано вище, ці вектори містять послідовності, гомологічні до MVA геному, для націлювання вставки шляхом гомологічної рекомбінації. Додатково кожний вектор містить касету селекційного гена або гена-репортера. PrM послідовності чотирьох серотипів вірусу тропічної лихоманки були одержані синтетично шляхом олігоанеляції та PCR-ампліфікації. PrM послідовності були даунстрім-клоновані по відношенню до поксвірусних промоторних елементів для того, щоб сформувати експресійну касету. Ця експресійна касета була тоді клонована в сайт клонування релевантних інсерційних векторних конструкцій. Як результат, інсерційна векторна конструкція для делеції А містить PrM ген серотипу 2 вірусу тропічної лихоманки (Фігура 6 - pBN39). Інсерційна векторна конструкція для делеції 2 містить PrM ген серотипу 1 вірусу тропічної лихоманки (Фігура 7 - pBN49). Інсерційна векторна конструкція для міжгенної ділянки I4L містить PrM ген серотипу 3 вірусу тропічної лихоманки (Фігура 8 - pBN50). Інсерційна векторна конструкція для делеції Е містить PrM ген серотипу 4 вірусу тропічної лихоманки (Фігура 9 - pBN40). PCR-перевірка інсерційних векторів Для перевірки стратегій клонування здійснювали PCR випробування. Для цих PCR випробувань були вибрані пари праймерів, які є комбінацією праймера, специфічно зв'язаного з специфічною фланкуючою послідовністю відносно інсерційного сайту, та другого праймера, який специфічно зв'язаний з одним із високогомологічних PrM генів вірусу тропічної лихоманки (Dengue virus). Інсерційний вектор для делеції А, який містить PrM ген другого серотипу вірусу тропічної лихоманки, був вибраний з праймерів oBN93 (CGCGGATCCATGCTGAACATCTTGAACAGGAGACGCAGA. SEQ ID NО: 1) та oBN477 (CATGATAAGAGATTGTATCAG. SEQ ID NO: 2). Інсерційний вектор для делеції 2, який містить PrM ген першого серотипу вірусу тропічної лихоманки, був вибраний з праймерів oBN194 (ATGTTGAACATAATGAACAGGAGGAAAAGATCTGTGACCATGCTCCTCAT GCTGCTGCCCACAGCCCTGGCGTTCCATCT. SEQ ID NO: 3) та oBN476 (GATTTTGCTATTCAGTGGACTGGATG. SEQ ID NO: 4). Інсерційний вектор для міжгенної ділянки I4L, який містить PrM ген третього серотипу вірусу тропічної лихоманки, був вибраний з праймерів oBN255 (CCTTAATCGAATTCTCATGTCATGGATGGGGTAACCAGCATTAATAGT. SEQ ID NО: 5) та oBN479 (GCTCCCATTCAATTCACATTGG. SEQ ID NO: 6). Інсерційний вектор для делеції Е, який містить PrM ген четвертого серотипу вірусу тропічної лихоманки, був вибраний з праймерів oBN210 (ATCCCATTCCTGAATGTGGTGTTAAAGCTACTGAGCGCTTCTCTCGTCTCCGT 10 UA 104993 C2 5 10 TCTCCGCTCTGGGTGCATGTCCCATAC SEQ ID NO: 7) та oBN478 (GTACATGGATGATATAGATATG. SEQ ID NO: 8). PCR-експерименти виконувались в термодинамічному циклізаторі (Thermal cycler) GeneAmp 9700 (Perkin Elmer), використовуючи набір Tag ДНК полімерази, який містить l0х PCR-буфер, MgCl2 буфер та Tag ДНК полімеразу (Roche, Cat.no. 201205) або еквівалент. Взагалі, PCRреакції були підготовлені із загальним реакційним об'ємом 50 l, який містить 45 l маточної суміші, зразком ДНК і ddH2O, як вимагається. Маточна суміш була приготована з 3,75 l DdH2O, 5 l 10х буфера, 1 l dNTP-суміші (10 mМ кожного), 2,5 l кожного праймера (5 pmol/ l), 3 l MgCl2 (25 mМ) і 0,25 l Taq-полімерази (5 U/l). Ампліфікація виконувалась, використовуючи наступну програму: 1) 2) 3) 4) 15 20 25 30 35 40 45 50 Денатурація 30 циклів: Денатурація Анеляція Елонгація Елонгація Зберігання 4 хв 94 °C 30 секунд 30 секунд 1-3 хв 7 хв 94 °C 55 °C 72 °C 72 °C 4 °C Виходячи з розміру вставленого гена, час елонгації повинен бути принаймні 1 хв/kb. Результати PCR, показані на Фігурі 10, демонструють специфічність праймерних комбінації, використаних для одиничних вставок. Праймерна комбінація oBN194/oBN476 є специфічною для делеції 2 і PrM1 як вставки. Очікуваний PCR-фрагмент для плазміди pBN49 має розмір 678 bр (показано на полосі 3 у верхній частині гелю). Праймерна комбінація oBN255/oBN479 є специфічною для міжгенної ділянки I4L і PrM3 як вставки. Очікуваний PCR фрагмент плазміди pBN50 має розмір 825 bр (показано на полосі 9 у верхній частині гелю). Праймерна комбінація oBN210/oBN478 є специфічною для делеції Е та PrM4 як вставки. Очікуваний PCR фрагмент плазміди pBN40 має розмір 607 bр (показано на полосі 5 в нижній частині гелю). Праймерна комбінація oBN93/oBN477 є специфічною для делеції та PrM2 як вставки. Очікуваний PCR фрагмент плазміди pBN39 має розмір 636 bр (показано на полосі 11 в нижній частині гелю). Утворення рекомбінантного MVA через гомологічну рекомбінацію Для експресії чужорідних генів рекомбінантним MVA ці гени доведеться вставити у вірусний геном за допомогою процесу, названого гомологічна рекомбінація. Для цієї мети, чужорідний ген, в якому зацікавлені, був клонований в інсерційний вуктор, як описано вище. Цей вектор буде трансфікований після інфікування клітин MVA-BN. Рекомбінація відбуватиметься в клітинній цитоплазмі інфікованих та трансфікованих клітин. З допомогою селекційної касети та/або касети-репортера, які також входять до складу інсерційного вектора, клітини, які містять рекомбінантні віруси, ідентифікуються та видаляються. Гомологічна рекомбінація Для гомологічної рекомбінації ВНК (Baby hamster kidney) клітинами або CEF (первинні фібробласти курячих ембріонів) клітинами засівають шестилункові пластинки, використовуючи DMEM (Dulbecco's Modified Eagles Medium, Gibco BRL) + 10 % ембріональної телячої сироватки (PCS) або VP-SFM (Gibco BRL) + 4 ммол/л L-Глутаміну для без сироваткового процесу виробництва. Клітини повинні витримуватись у фазі росту, і, таким чином, повинні досягти 60-80 % злиття на трансфекційний день. Перед посівом клітини були пораховані, оскільки кількість клітин має бути відомою для визначення кратності зараження (moi) для інфекції. Для інфікування вихідний MVA розводили DMEM/FCS або VP-SFM/L-глутаміном до такої міри, щоб 500 l розчину містило таку кількість вірусу, яка б давала mоі=0,01. Передбачається, що клітини після посіву будуть ділитися один раз. Середовище відділяли від клітин і клітини інфікували 500 l розведеного вірусу, погойдуючи протягом однієї години при кімнатній температурі. Інокулюм видаляли та промивали клітини DMEM/VP-SFM. Інфіковані клітини залишали в 1,6 мл DMEM/FCS та VP-SFM/L-глутаміну відповідно доти, доки встановлюється реакція трансфекції (Qiagen Effectene Kit). Для трансфекції використовується "Effectene" трансфекційний набір (Qiagen). Трансфекційну суміш готують з 1-5 г лінеаризованого інсерційного вектора (загальна кількість 11 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 60 для багаторазової трансфекції), додаючи буфер ЕС до кінцевого об'єму 150 l. Додають 8,0 l підсилюючого агента на г ДНК, струшують та інкубують при кімнатній температурі протягом 5 хвилин. Після струшування потім додають 25 l Effectene на г ДНК та розчин ретельно перемішують струшуванням при кімнатній температурі протягом 10 хвилин. Додають 600 l DMEM/FCS і VP-SFM/L-глутаміну відповідно, потім перемішують, всю трансфекційну суміш додають до клітин, які уже покриті середовищем. Обережно погойдують посудину щоб змішати трансфекційні реагенти. Інкубація відбувається при 37 °C з 5 % СO 2 протягом ночі. Назавтра середовище відділяють та заміняють свіжим DMEM/FCS або VP-SFM/L-глутаміном. Інкубація продовжується протягом 3 днів. Для збору урожаю, клітини зшкрябуються в середовище, потім клітинну суспензію переносять у відповідну пробірку та заморожують при -20 °C для короткострокового зберігання або при -80 °C для довгострокового зберігання. Вставка а PrM4 в MVA В першому раунді клітини були інфіковані MVA-BN згідно з описаним вище протоколом та додатково трансфіковані інсерційним вектором pBN40, який містить PrM ген четвертого серотипу вірусу тропічної лихоманки та ген EGFP як ген-репортер. Оскільки трансфікований вектор містить ген-репортер, EGFP, то синтезований протеїн в інфікованих рекомбінантним вірусом клітинах виявляється найпізніше через три дні. Одержані рекомбінантні віруси мають бути очищені методом бляшок. Для очистки методом бляшок інфіковані клітини (флуоресціюючі або забарвлені) були ізольовані за допомогою спеціальної піпетки, ресуспендовані та аспіровані в 200 l PBS або середовищі. Потім чашку зі свіжою культурою, яка містить близько 10Е6 клітин інфікують 100 l ресуспендованих бляшок. Після 48 годин клітини поміщають в 300 l PBS. ДНК екстрагують із суспензії та відбирають за допомогою PCR аналізу. Клон, який показує очікувані зони, відбирають і шестилункові пластинки інфікують різними кількостями цього вірусу. Для запобігання подальшого розповсюдження вірусу лунки покривають 1 % агарозою. Після 48 годин інфіковані клітини, які містять клон рекомбінантного вірусу, ізолюють. Ця процедура повторюється доти, поки в PCR аналізі перестає виявлятись дикий тип MVABN. Після чотирьох повторів процедури очистки рекомбінантних вірусів методом бляшок, MVAPrM4 були ідентифіковані за допомогою PCR аналізу, використовуючи праймерну пару, селективно ампліфікуючу очікувану вставку (oBN210 і oBN478, як викладено вище), та як контроль використовуючи праймерну пару, яка специфічно розпізнає інсерційний сайт делеції Е (oBN453: GTTGAAGGATTCACTTCCGTGGA, SEQ ID NO: 9 і oBN454: GCATTCACAGATTCTATTGTGAGTC, SEQ ID NO: 10) Вставка PrM2 в MVA-PrM4 Клітини були інфіковані MVA-PrM4 згідно з вищеописаним протоколом і були додатково трансфіковані інсерційним вектором pBN39, який містить PrM ген другого серотипу вірусу тропічної лихоманки (Dengue virus) та як селекційний ген - NPT II та ген резистентності до неоміцину. Для очистки рекомбінантного MVA, який експресує ген резистентності до антибіотика, рекомендується перед методом бляшок провести три раунди ампліфікації вірусу в селективних умовах. Для відбору неоміцинфосфотрансферази до середовища був доданий G418. G418 походить від неоміцину та пригнічує біосинтез протеїну шляхом втручанням в дію рибосом. Активність NPT гена інактивує G418 шляхом фосфорилування. Після 16 повторів процедури очистки методом бляшок при неоміцин-селекції рекомбінантних вірусів, MVA-PrM4/PrM2 були ідентифіковані шляхом PCR аналізів, використовуючи праймерну пару, селективно ампліфікуючу очікувану вставку (oBN93 і oBN477, як описано вище), та як контроль використовуючи праймерну пару, яка специфічно розпізнає інсерційний сайт делеції A (oBN477: як описано вище) та oBN452: GTTTCATCAGAAATGACTCCATGAAA, SEQ ID NO.: 11). Також вставка PrM4 у делецію Е була перевірена з праймерною парою: oBN210 - оBN478 та oBN453 - oBN454. Вставка PrMl в MVA В першому раунді клітини були інфіковані MVA-BN згідно з вищеописаним протоколом і додатково були трансфіковані інсерційним вектором pBN49, який містить PrM ген першого серотипу вірусу тропічної лихоманки, та як ген-репортер містить hbfp ген та ген гуманізуючого голубого флуоресціюючого протеїну. Синтезований hbfp протеїн в інфікованих рекомбінантним вірусом клітинах виявляється на третій день. Одержані рекомбінантні віруси були очищені методом бляшок. Після 10 повторів процедури очищення рекомбінантних вірусів методом бляшок MVA-PrMI були ідентифіковані шляхом PCR аналізів, використовуючи праймерну пару, селективно 12 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 ампліфікуючу очікувану вставку (oBN194 та oBN476, як описано вище), та як контроль використовуючи праймерну пару, яка специфічно розпізнає інсерційний сайт делеції 2 (oBN54: CGGGGTACCCGACGAACAAGGAACTGTAGCAGAGGCATC, SEQ ID NO.: 12 і oBN56: AACTGCAGTTGTTCGTATGTCATAAATTCTTTAATTAT, SEQ ID NO: 13). Вставка PrM3 в MVA В першому раунді клітини були інфіковані MVA-BN згідно з вищеописаним протоколом і були додатково трансфіковані інсерційним вектором pBN50, який містить PrM ген третього серотипу вірусу тропічної лихоманки і як ген-репортер містить ген Ecogpk (Ecogpt або скорочений до gpt для гена фосфорибозилтрансферази). Одержані рекомбінантні віруси були очищені в три раунди методом бляшок в умовах відбору фосфорибозилтрансферазного метаболізму шляхом додавання мікофенолової кислоти, ксантину та гіпоксантину. Мікофенолова кислота (МРА) пригнічує інозинмонофосфатдегідрогеназу і приводить до блокування пуринового синтезу та пригнічення вірусної реплікації в більшості клітинних ліній. Це блокування може бути подолане за допомогою експресії Ecogpt з конститутивного промотору та забезпечення субстратів ксантину і гіпоксантину. Одержані рекомбінантні віруси MVA-PrM3, були ідентифіковані за допомогою PCR аналізів, використовуючи праймерну пару, що вибірково ампліфікує очікувану вставку (оВМ255 і оBN479, як описано вище), та як контроль - праймерну пару, яка специфічно розпізнає інсерційний сайт I4L (oBN499: CAACTCTCTTCTTGATTACC, SEQ ID NO: 14 і oBN500: CGATCAAAGTCAATCTATG; SEQ ID NO: 15). Співінфікування MVA-PrMl ma MVA-PrM3 Клітини були інфіковані рівними кількостями MVA-PrMl та MVA-PrM3 згідно із згаданим вище протоколом. Після 3 раундів очистки методом бляшок в умовах відбору фосфорибозилтрансферазного метаболізму голубих флуоресціюючих клонів рекомбінантних вірусів були проведені PCR аналізи з використанням праймерних пар (oBN255 і oBN479. oBN499 і oBN500. oBN194 і oBN476. oBN54 і oBN56, як описано вище). Одержані рекомбінантні віруси були позначені MVA-PrMl/PrMЗ. Співінфікування MVA-PrMl/PrM і MVA-PrM2/PrM4 Клітини були інфіковані рівними кількостями MVA-PrMl/PrM3 та MVA-PrM2/PrM4 згідно зі згаданим вище протоколом. Очищення методом бляшок проводили в умовах фосфорибозилтрансферазного метаболізму та неоміцинового відбору. Рекомбінантні віруси, які індукують зелену та голубу флуоресценцію, були ізольовані і проаналізовані PCR з використанням праймерних пар (oBN255 і oBN479, oBN499 i oBN500, oBN194 i oBN476, oBN54 і oBN56, oBN93 і oBN477, oBN477 і oBN452, oBN210 і oBN478, oBN453 і oBN454, як описано вище). PCR аналіз рекомбінантного вірусу (Клон 20), який містить всі чотири PrM гени, показаний на Фігурі 11. Тоді як у верхній частині гелю показані різні PCR результати для рекомбінантного вірусу, більш низька частина забезпечує результати тих самих PCR реакцій для контрольної плазміди (як вказано). Полоси 1, 10 і 11 показують 1 kb та 100 bр молекулярного маркера. Праймерна комбінація oBN210/oBN478 є специфічною для делеції Е і PrM4 як вставки. Очікуваний фрагмент PCR рекомбінантного вірусу і плазміди pBN40 має розмір 607 bр (показаний полосою 2). Праймерна комбінація oBN453/oBN454 є специфічною для делеції Е. Очікуваний фрагмент PCR рекомбінантного вірусу складає 2,7 kb, очікувана зона вірусу дикого типу - 2,3 kb (показана полосою 3). Також у верхній частині гелю можна ідентифікувати специфічну для вірусу дикого типу зону. Це означає, що препарат рекомбінантного вірусу ще повністю не звільнений від вірусу дикого типу. Необхідне подальше очищення методом бляшок. Праймерна комбінація oBN93/oBN477 є специфічною для делеції А та PrM2 як вставки. Очікуваний фрагмент PCR рекомбінантного вірусу і плазміди pBN39 має розмір 636 bр (показана полосою 4). Праймерна комбінація oBN477/oBM452 є специфічною для делеції А. Очікуваний фрагмент PCR рекомбінантного вірусу складає 4,1 kb, очікувана зона для вірусу дикого типу - 2,7 kb (показана полосою 5). У верхній частині гелю може бути ідентифікована зона, специфічна для вірусу дикого типу. Праймерна комбінація oBN255/oBN479 є специфічною для міжгенної ділянки I4L і PrM3 як вставки. Очікуваний фрагмент PCR рекомбінантного вірусу і плазміди pBN50 має розмір 825 bр (показано полосою 6). 13 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 60 Праймерна комбінація oBN499/oBN500 є специфічною для міжгенної ділянки I4L. Очікуваний фрагмент PCR рекомбінантного вірусу складає 1,0 kb, очікувана зона вірусу дикого типу - 0,3 kb (показана полосою 7). Праймерна комбінація oBN194/oBN476 є специфічною для делеції 2 і PrMІ як вставки. Очікуваний фрагмент PCR рекомбінантного вірусу і плазміди pBN49 має розмір 678 bр (показано полосою 8). Праймерна комбінація oBN54/oBN56 є специфічною для делеції 2. Очікуваний фрагмент PCR рекомбінантного вірусу складає 1,6 kb, очікувана зона вірусу дикого типу - 0,9 kb (показано полосою 9). У верхній частині гелю можна ідентифікувати зону, специфічну для вірусу дикого типу. Альтернативно, один може продукувати 4 різні віруси, коінфікувати клітини всіма чотирма вірусами і відбирати рекомбінанти. Також можуть досягатися удосконалення з рекомбінаційним вектором, який містить наступні селекційні або резистентні маркери. Приклад 2 Інсерційні вектори Рекомбінантний вектор для міжгенної ділянки 136-137 (IGR 136-137) Для вставки екзогенних послідовностей в MVA геном в так звану міжгенну ділянку (IGR) 136137, яка відповідає геномній позиції 129.940, був сконструйований плазмідний вектор, який містить близько 600 bр фланкуючих послідовностей, сусідніх до інсерційного сайту. Для того, щоб виділити фланкуючі послідовності з геномної ДНК MVA-BN можуть бути розроблені придатні PCR праймери. Такі праймери містять подовження з ензиморестрикційними сайтами, які використовуватимуться для клонування фланкуючих послідовностей у векторну плазміду. Між цими фланкуючими послідовностями введена селекційна генна касета, наприклад, NPT II ген (резистентний до неоміцину) під транскрипційним контролем поксвірусного промотору (Р). Крім того, є клонуючий сайт для вставки додаткових генів або екзогенних послідовностей, вставлений в IGR 136-137 (РасI). Одна така векторна конструкція згідно з даним винаходом розкрита на Фігурі 12 (pBNX67). Рекомбінантний вектор для міжгенної ділянки 07-08 (IGR 07-08) Для вставки екзогенних послідовностей в MVA геном в так звану міжгенну ділянку (IGR) 0708, яка відповідає геномній позиції 12.800, був сконструйований плазмідний вектор, який містить близько 600 bр фланкуючих послідовностей, сусідніх до інсерційного сайту. Для того, щоб виділити фланкуючі послідовності з геномної ДНК MVA-BN можуть бути розроблені придатні PCR праймери. Такі праймери містять подовження з ензиморестрикційними сайтами, які використовуватимуться для клонування фланкуючих послідовностей у векторну плазміду. Між цими фланкуючими послідовностями введена селекційна генна касета, наприклад, Ecogpt ген (гуанінфосфорибозилтрансфераза) під транскрипційним контролем поксвірусного промотору (Р). Крім того, є клонуючий сайт для вставки додаткових генів або екзогенних послідовностей, вставлений в IGR 07-08 (РасI). Одна така векторна конструкція згідно з даним винаходом розкрита на Фігурі 13 (pBNX88). Рекомбінантний вектор для міжгенної ділянки 44-45 (IGR 44-45) Для вставки екзогенних послідовностей в MVA геном в так звану міжгенну ділянку (IGR) 4445, яка відповідає геномній позиції 37.330, був сконструйований плазмідний вектор, який містить близько 600 bр фланкуючих послідовностей, сусідніх до інсерційного сайту. Для того, щоб виділити фланкуючі послідовності з геномної ДНК MVA-BN можуть бути розроблені придатні PCR праймери. Такі праймери містять подовження з ензиморестрикційними сайтами, які використовуватимуться для клонування фланкуючих послідовностей у векторну плазміду. Між цими фланкуючими послідовностями введена селекційна генна касета, наприклад, NPT II ген (резистентний до неоміцину) під транскрипційним контролем поксвірусного промотору (Р). Крім того, є клонуючий сайт для вставки додаткових генів або екзогенних послідовностей, вставлений в IGR 44-45 (РасI). Одна така векторна конструкція згідно з даним винаходом розкрита на Фігурі 14 (pBNX87) Конструювання рекомбінантного поксвірусу, який містить декілька гомологічних генів, інтегрованих в його геном. Інсерційні вектори Для вставки трьох PrM генів серотипів 2, 3 і 4 вірусу тропічної лихоманки в MVA геном були одержані три незалежні рекомбінантні вектори. Ці вектори містять - як детально описано вище - послідовності, гомологічні до MVA геному, для направленої вставки шляхом гомологічної рекомбінації. Крім того, кожний вектор містить селекційну касету або касету гена-репортера. 14 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 PrM послідовності трьох серотипів вірусу тропічної лихоманки були синтетично одержані як описано в Прикладі 1. Як результат, інсерційна векторна конструкція для IGR 136-137 містила PrM четвертого серотипу вірусу тропічної лихоманки (Фіг. 15 - pBN27). Інсерційна векторна конструкція для IGR 07-08 містила PrM другого серотипу вірусу тропічної лихоманки (Фіг. 16 - pBN34) та інсерційна векторна конструкція для IGR 44-45 містила PrM третього серотипу вірусу тропічної лихоманки (Фіг. 17 - pBN47). Одержання рекомбінантного MVA через гомологічну рекомбінацію Одержання рекомбінантного MVA шляхом гомологічної рекомбінації виконувалася, як описано в Прикладі 1. Інсерційні сайти для PrM4, PrM3 і PrM 2 в MVA геномі зображені на Фігурі 18. Вставка PrM4 в MVA В першому раунді клітини були інфіковані MVA-BN згідно з описаним вище протоколом та додатково трансфіковані інсерційним вектором pBN27, який містить PrM ген четвертого серотипу вірусу тропічної лихоманки та ген EGFP як ген-репортер. Оскільки трансфікований вектор містить ген-репортер, EGFP, то синтезований протеїн в інфікованих рекомбінантним вірусом клітинах виявляється найпізніше через три дні. Одержані рекомбінантні віруси мають бути очищені методом бляшок, як описано в Прикладі 1. Після чотирьох повторів процедури очистки методом бляшок рекомбінантні віруси, MVA-PrM4, були ідентифіковані за допомогою PCR аналізу, використовуючи праймерну пару, селективно ампліфікуючу інсерційний сайт IGR136-137 (0BNIOO8: gataccgatcacgttcta. SEQ ID NO: 16; і oBN1009 ggatatgattatgtagag. SEQ ID NO: 17). Вставка PrM2 в MVA Клітини були інфіковані MVA-PrM4 згідно з описаним вище протоколом та додатково трансфіковані інсерційним вектором pBN34, який містить PrM ген другого серотипу вірусу тропічної лихоманки та ген BFP як ген-репортер. Оскільки трансфікований вектор містить генрепортер, BFP, то синтезований протеїн в інфікованих рекомбінантним вірусом клітинах виявляється найпізніше через три дні. Одержані рекомбінантні віруси мають бути очищені методом бляшок, як описано в Прикладі 1. Після шести повторів процедури очистки методом бляшок рекомбінантний вірус MVA-PrM4+PrM2 додатково пропассажували та ампліфікували і неочищений вихідний матеріал був готовий. Рекомбінант був ідентифікований шляхом PCR випробувань з використанням праймерних пар, селективно ампліфікуючих інсерційний сайт IGR07-08 (oBN903: cfcggataaatacgaggacgtg. SEQ ID NO:18; і OBN904: gacaattatccgacgcaccg; SEQ ID NO: 19). Вставка PrM3 в MVA Клітини буди інфіковані MVA-PrM2+4 згідно з описаним вище протоколом та додатково трансфіковані інсерційним вектором pBN47, який містить PrM ген третього серотипу вірусу тропічної лихоманки та ген EGFP як ген-репортер. Оскільки трансфікований вектор містить генрепортер, EGRP, то синтезований протеїн в інфікованих рекомбінантним вірусом клітинах виявляється найпізніше через три дні. Одержані рекомбінантні віруси мають бути очищені методом бляшок, як описано в Прикладі 1. Після трьох повторів процедури очистки методом бляшок рекомбінантні віруси, MVA-PrM4+3+2, були ідентифіковані за допомогою PCR аналізу, використовуючи праймерну пару, селективно ампліфікуючу інсерційний сайт IGR44-45 (oBN904: cgttagacaacacaccgacgatgg. SEQ ID NO: 20; і oBN905 cggatgaaaaatttttggaag. SEQ ID NO: 21). PCR аналіз рекомбінантного вірусу, який містить три PrM гени вірусу тропічної лихоманки, показаний на Фіг. 19. PCR експерименти виконувались, як описано в Прикладі 1. Праймерна комбінація OBN1008 і OBN1009 є специфічною для IGR 136-137, який містить PrM4 вставку (Фіг. 19, нижня панель). Очікуваний PCR фрагмент рекомбінантного вірусу має розмір 1 kb (показаний полосою 4, 5 і 6), як позитивний плазмідний контроль (полоса 8). Холостий векторний контроль, який не містить PrM 4, показує очікуваний фрагмент 190 bр (полоса 2). М полоса показує маркер молекулярної ваги та полоси 1, 3 і 7 є холостими. Праймерна комбінація oBN902 та оBN903 є специфічною для IGR07-08, який містить вставку PrM2 (Фіг. 19, верхня панель). Очікуваний фрагмент PCR рекомбінантного вірусу має розмір 960 bр (показано полосами 4-6), як позитивний плазмідний контроль (полоса 8). Холостий векторний контроль, позбавлений PrM 2, показує очікуваний фрагмент 190 bр (полоса 2). Праймерна комбінація оBN904 і oBN905 є специфічною для IGR44-45, який містить вставку PrMЗ (Фіг. 19, середня панель). Очікуваний фрагмент PCR рекомбінантного вірусу має розмір 932 bр (показано полосами 4-6), як позитивний плазмідний контроль (полоса 8). Холостий векторний контроль, позбавлений PrM 2, показує очікуваний фрагмент 185 bр (полоса 2) 60 15 UA 104993 C2 16 UA 104993 C2 17 UA 104993 C2 18 UA 104993 C2 ФОРМУЛА ВИНАХОДУ 5 1. Рекомбінантний модифікований вірус вакцинії Ankara (MVA), що містить щонайменше дві гомологічні чужорідні послідовності, крім чужорідних генів, з гомологією, яка становить 19 UA 104993 C2 5 10 15 20 25 30 35 40 45 50 55 60 щонайменше 50 %, в якому кожна з вказаних послідовностей вбудована в окремий сайт інсерції вірусного геному. 2. Рекомбінантний вірус MVA, що містить щонайменше дві гомологічні чужорідні послідовності, при цьому вказані послідовності мають гомологію, яка становить щонайменше 60 %. 3. Рекомбінантний вірус MVA за п. 1 або 2, в якому послідовності мають гомологію 65-75 %. 4. Рекомбінантний вірус MVA за п. 1 або 2, в якому чужорідні послідовності ідентичні. 5. Рекомбінантний вірус MVA за п. 4, в якому послідовності являють собою ранній/пізній промотор р7.5 вірусу вакцинії. 6. Рекомбінантний вірус MVA за будь-яким з пп. 1-5, де MVA є MVA-BN, депонованим у Європейській колекції культур клітин тварин (ЕСАСС) під номером V00083008. 7. Рекомбінантний вірус MVA за пп. 1-6, де вірус MVA є дефіцитним за реплікацією або некомпетентним за реплікацією в клітинах ссавців, включаючи клітини людини. 8. Рекомбінантний вірус MVA за пп. 1-7, в якому послідовності вбудовані у сайт, що зустрічається в природі, делеції, і/або у міжгенну ділянку геному вірусу MVA. 9. Рекомбінантний вірус MVA за пп. 1-8 як лікарський засіб або вакцина. 10. Вакцина для впливу на імунну відповідь, переважно на її індукування у тварини, включаючи людину, що містить рекомбінантний вірус MVA за будь-яким з пп. 1-8. 11. Фармацевтична композиція, що містить рекомбінантний вірус MVA за будь-яким з пп. 1-8 і фармацевтично прийнятний носій, розріджувач, ад'ювант і/або добавку. 12. Рекомбінантний вірус MVA за будь-яким з пп. 1-8, вакцина за п. 10 або композиція за п. 11 для впливу на імунну відповідь, переважно її індукування у тварини, включаючи людину. 13. Застосування рекомбінантного вірусу MVA за будь-яким з пп. 1-8 для приготування лікарського засобу. 14. Спосіб впливу на імунну відповідь, переважно її індукування у тварини, включаючи людину, який передбачає введення терапевтично ефективної кількості рекомбінантного вірусу MVA за будь-яким з пп. 1-8, вакцини за п. 10 або композиції за п. 11 тварині або людині, яка підлягає лікуванню. 15. Клітина, яка містить рекомбінантний вірус MVA за пп. 1-8. 16. Спосіб одержання рекомбінантного вірусу MVA за пп. 1-8, який передбачає стадії інфікування клітини вірусом MVA; трансфекції інфікованої клітини першою векторною конструкцією, що містить чужорідну послідовність, яка підлягає включенню у геном вірусу MVA, і геномну послідовність вірусу MVA, здатну направляти інтеграцію гетерологічної послідовності, яка підлягає інсерції у сайт інсерції геному вірусу MVA; ідентифікації, виділення і необов'язково очищення утвореного рекомбінантного вірусу MVA; повторення вказаних вище стадій з використанням рекомбінантного вірусу MVA, одержаного на попередніх стадіях, для інфекції клітини і додаткової векторної конструкції, яка містить наступну чужорідну послідовність, яка підлягає включенню у геном вірусу MVA, де вказана послідовність є гомологічною відносно послідовності першої векторної конструкції. 17. Набір, що містить дві або більше векторних конструкцій, причому кожна конструкція містить послідовність, де послідовності, включені у різні вектори, є гомологічними послідовностями з гомологією, яка становить щонайменше 50 %, і де кожна послідовність фланкована послідовністю ДНК вірусу MVA, здатною направляти інтеграцію гомологічних послідовностей у геном MVA, і засоби для ідентифікації і/або селекції рекомбінантних вірусів MVA, які включили вказані гомологічні послідовності у свій геном. 18. Набір за п. 17, де кожна гомологічна послідовність фланкована послідовністю ДНК вірусу MVA, здатною направляти інтеграцію вказаних гомологічних послідовностей кожної векторної конструкції в особливий сайт інсерції геному вірусу MVA. 19. Послідовність ДНК, одержана або гомологічна рекомбінантному MVA-вірусному геному рекомбінантного вірусу MVA за пп. 1-8, де вказана послідовність ДНК містить щонайменше дві гомологічних послідовності і щонайменше частину послідовностей геному вірусу MVA. 20. Спосіб реєстрації клітин, інфікованих рекомбінантним вірусом MVA за пп. 1-8, який передбачає введення послідовності ДНК за п. 19 у вказані клітини. 21. Спосіб ідентифікації рекомбінантного вірусу MVA за пп. 1-8, який передбачає введення послідовності ДНК за п. 19 у вказаний вірус. 22. Спосіб виявлення клітин, інфікованих рекомбінантним вірусом MVA за пп. 1-8, який передбачає контактування клітини з ДНК-праймерами, селективно ампліфікуючими гомологічні чужорідні послідовності і/або фланкуючими послідовність відносно сайтів інсерції чужорідних послідовностей. 20 UA 104993 C2 23. Спосіб ідентифікації рекомбінантного вірусу MVA за пп. 1-8, який передбачає контактування вірусу з ДНК-праймерами, селективно ампліфікуючими гомологічні чужорідні послідовності і/або фланкуючими послідовність відносно сайтів інсерції чужорідних послідовностей. 21 UA 104993 C2 22 UA 104993 C2 23 UA 104993 C2 24 UA 104993 C2 25 UA 104993 C2 26 UA 104993 C2 27 UA 104993 C2 28
ДивитисяДодаткова інформація
Автори англійськоюHowley Paul, Leirer Sonia
Автори російськоюХаули Пол, Лейрер Сонья
МПК / Мітки
МПК: C12N 15/863, A61P 31/00, A61K 39/275
Мітки: вставлені, поксвірус, гомологічні, гені, рекомбінантний, експресує, поксвірусний, геном
Код посилання
<a href="https://ua.patents.su/39-104993-rekombinantnijj-poksvirus-yakijj-ekspresueh-gomologichni-geni-vstavleni-v-poksvirusnijj-genom.html" target="_blank" rel="follow" title="База патентів України">Рекомбінантний поксвірус, який експресує гомологічні гени, вставлені в поксвірусний геном</a>
Попередній патент: Спосіб синтезу акрилонітрилу з гліцерину
Наступний патент: Придатна для розпилення композиція, що містить екстракт із листя червоного винограду
Випадковий патент: Ємнісний вимірювальний перетворювач