Ліпохітоолігосахариди, що стимулюють арбускулярно-мікоризний симбіоз
Номер патенту: 107448
Опубліковано: 12.01.2015
Автори: Жіроде Дельфіна, Майє Фаб'єн, Пуансо Верена, Ген'є Монік, Бекар Гійом, Андре Олів'є, Денар'є Жан, Ауї Александра, Кроме Лоранс
Формула / Реферат
1. Застосування ліпохітоолігосахаридів, які характеризуються наведеною нижче формулою (1):
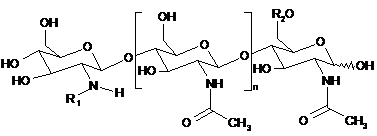 , (I)
, (I)
де n=0, 1, 2, 3, 4 або 5, R1 являє собою замісник ліпідів, що містить від 12 до 22 атомів вуглецю, a R2 являє собою Н або SO3H, для стимулювання мікоризації рослини.
2. Застосування ліпохітоолігосахаридів за формулою (І), як зазначено у п. 1, для стимулювання розвитку кореневої системи рослини.
3. Застосування ліпохітоолігосахаридів за формулою (І), як зазначено у п. 1, для покращення проростання насіння рослин.
4. Застосування ліпохітоолігосахаридів за формулою (І), як зазначено у п. 1, як добавки для приготування розчину арбускулярної мікоризи.
5. Застосування за будь-яким з пп. 1-4, яке відрізняється тим, що замісник ліпідів R1 є ланцюгом жирних кислот, що містить від 12 до 22 атомів вуглецю, що можуть бути насиченими або моно-, ди-, три-, тетра-, пента- або гексаненасиченими.
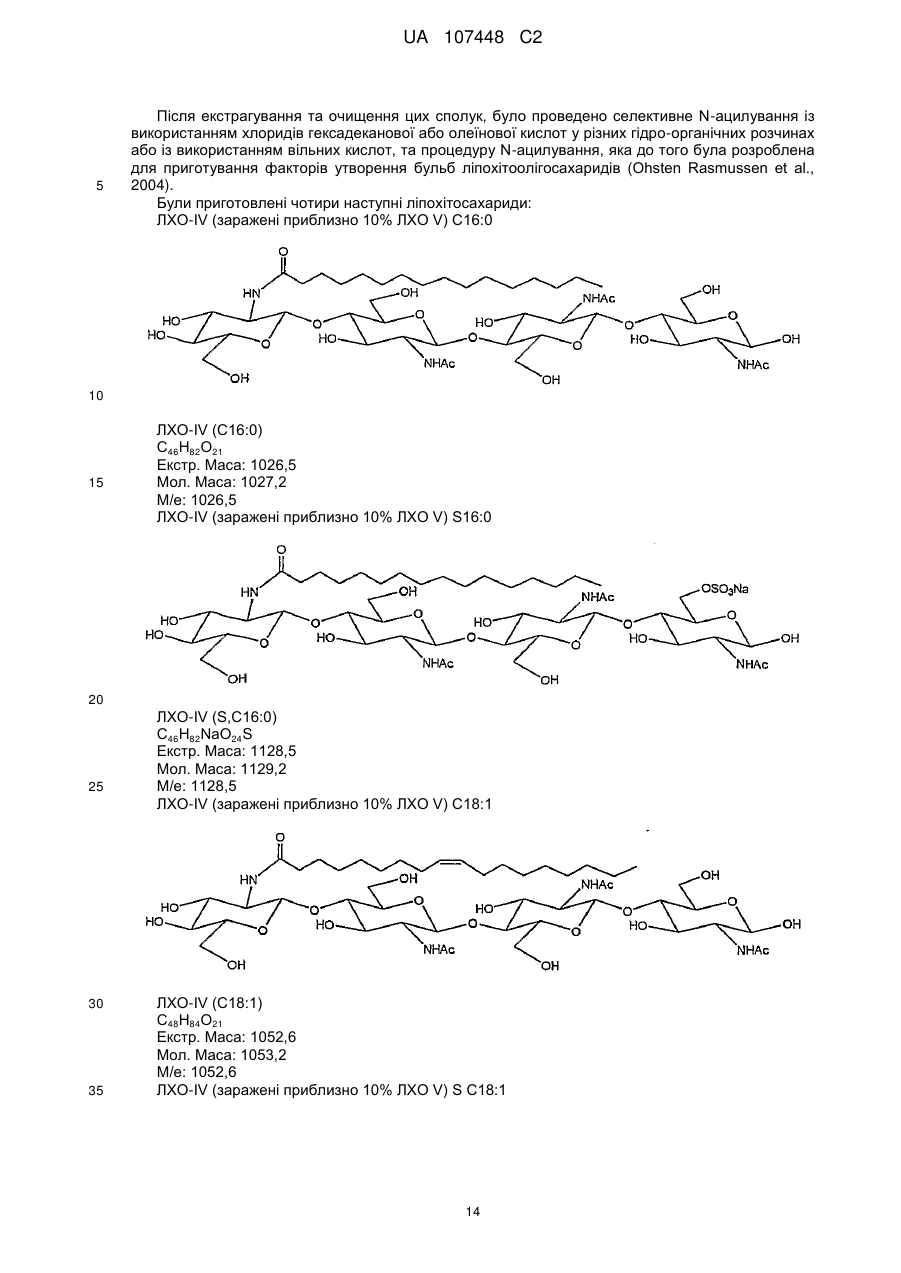
6. Застосування за п. 5, яке відрізняється тим, що зазначений ліпохітоолігосахарид за формулою (І) вибрано з:
- ліпохітоолігосахариду за формулою (І), де n=2 або 3, R1 являє собою ланцюг насиченої або мононенасиченої жирної кислоти, що має 16 атомів вуглецю, a R2 являє собою Н або SO3H.
- ліпохітоолігосахариду за формулою (І), де n=2 або 3, R1 являє собою ланцюг насиченої або мононенасиченої жирної кислоти, що має 18 атомів вуглецю, a R2 являє собою Н або SO3H.
7. Застосування за будь-яким з пп. 1-6, яке відрізняється тим, що використовується суміш ліпохітоолігосахариду за формулою (І), де R2 являє собою Н, із ліпохітоолігосахаридом за формулою (І), де R2 являє собою SO3H.
8. Застосування за будь-яким з пп. 1-7, яке відрізняється тим, що зазначений ліпохітоолігосахарид за формулою (І) використовується у концентрації від 10-5 до 10-12 М.
9. Застосування за п. 8, яке відрізняється тим, що зазначений ліпохітоолігосахарид за формулою (І) використовується у концентрації від 10-7 до 10-10 М.
10. Суміш ліпохітоолігосахаридів, що містить ліпохітоолігосахарид за формулою (І), де R2 являє собою Н, із ліпохітоолігосахаридом за формулою (І), де R2 являє собою SO3H.
Текст
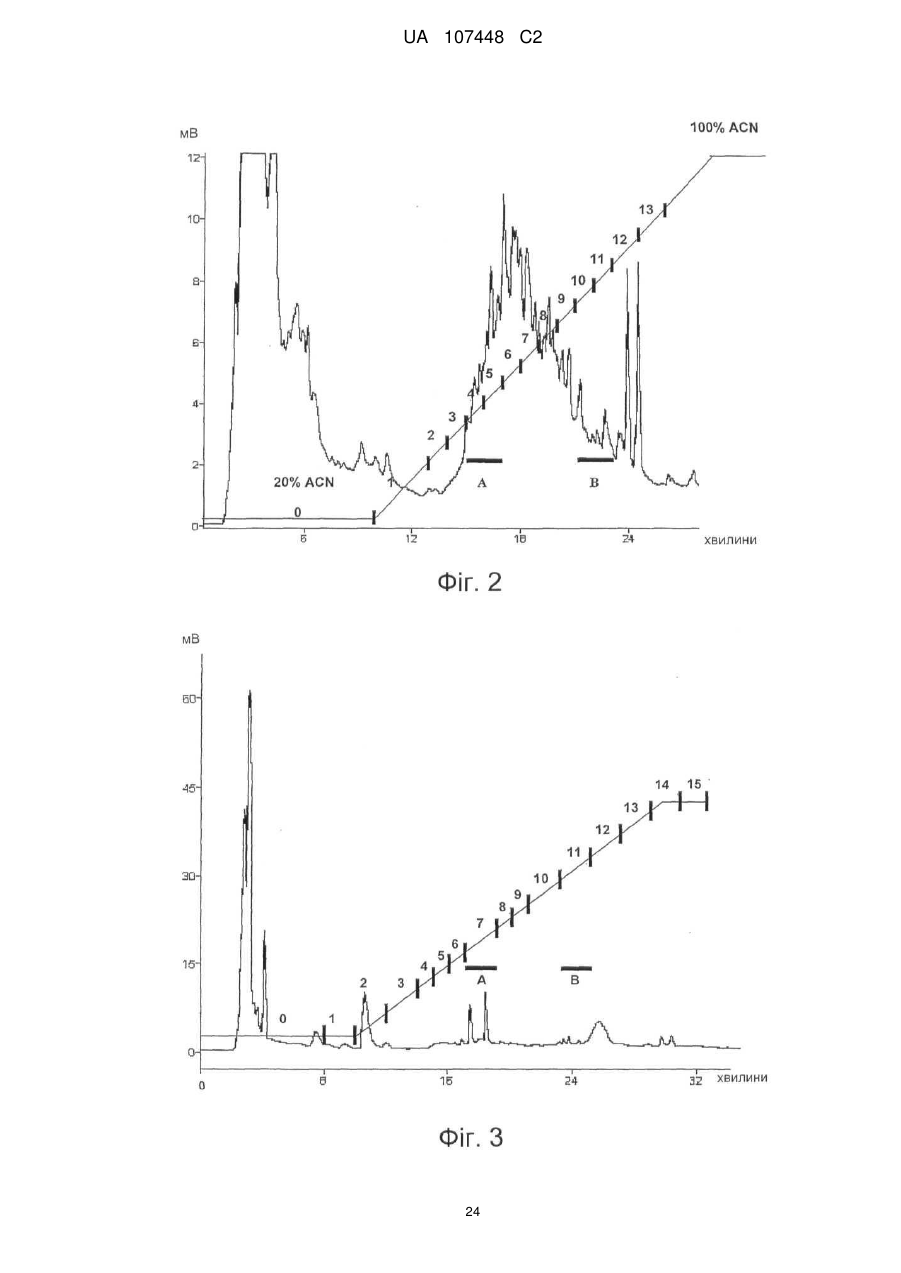
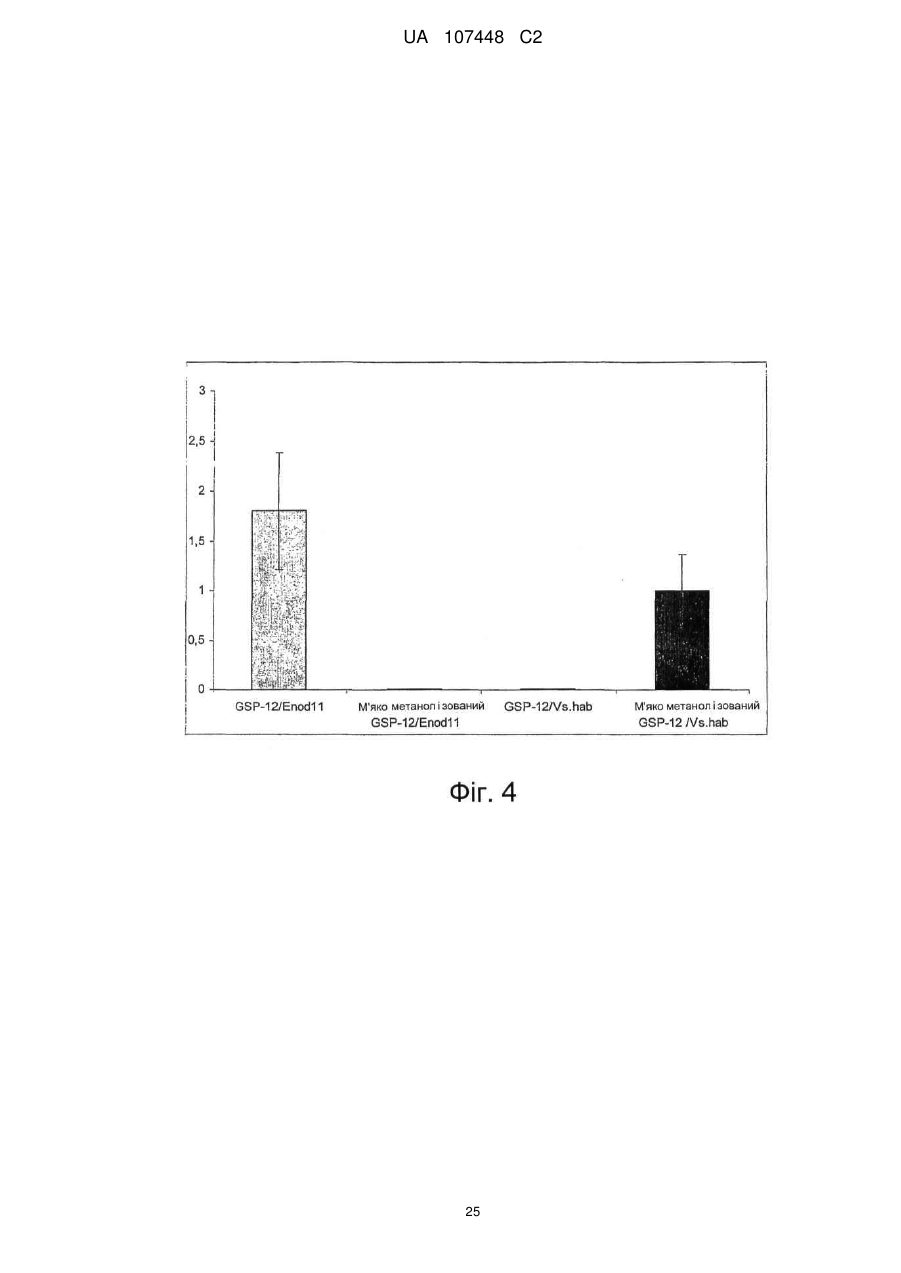
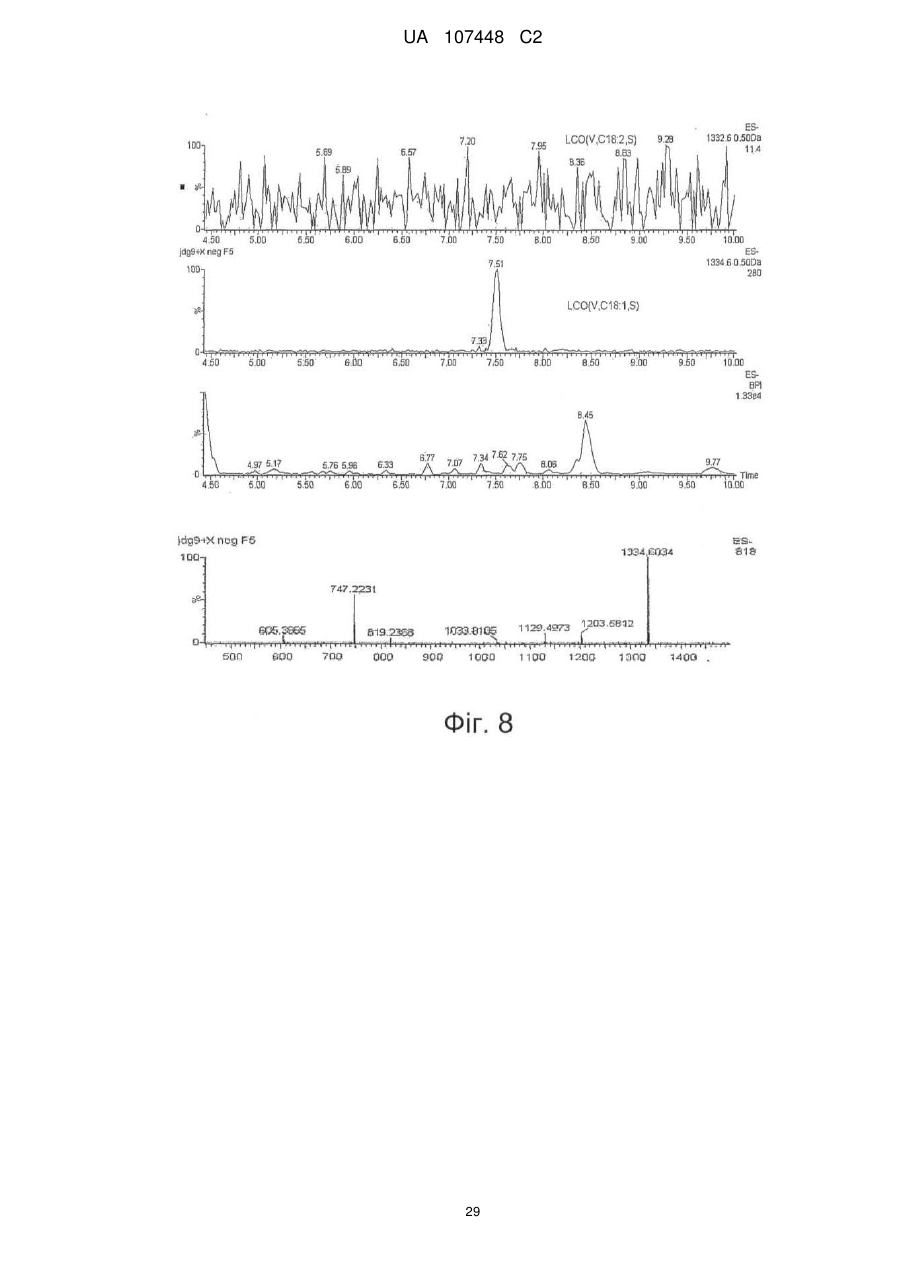
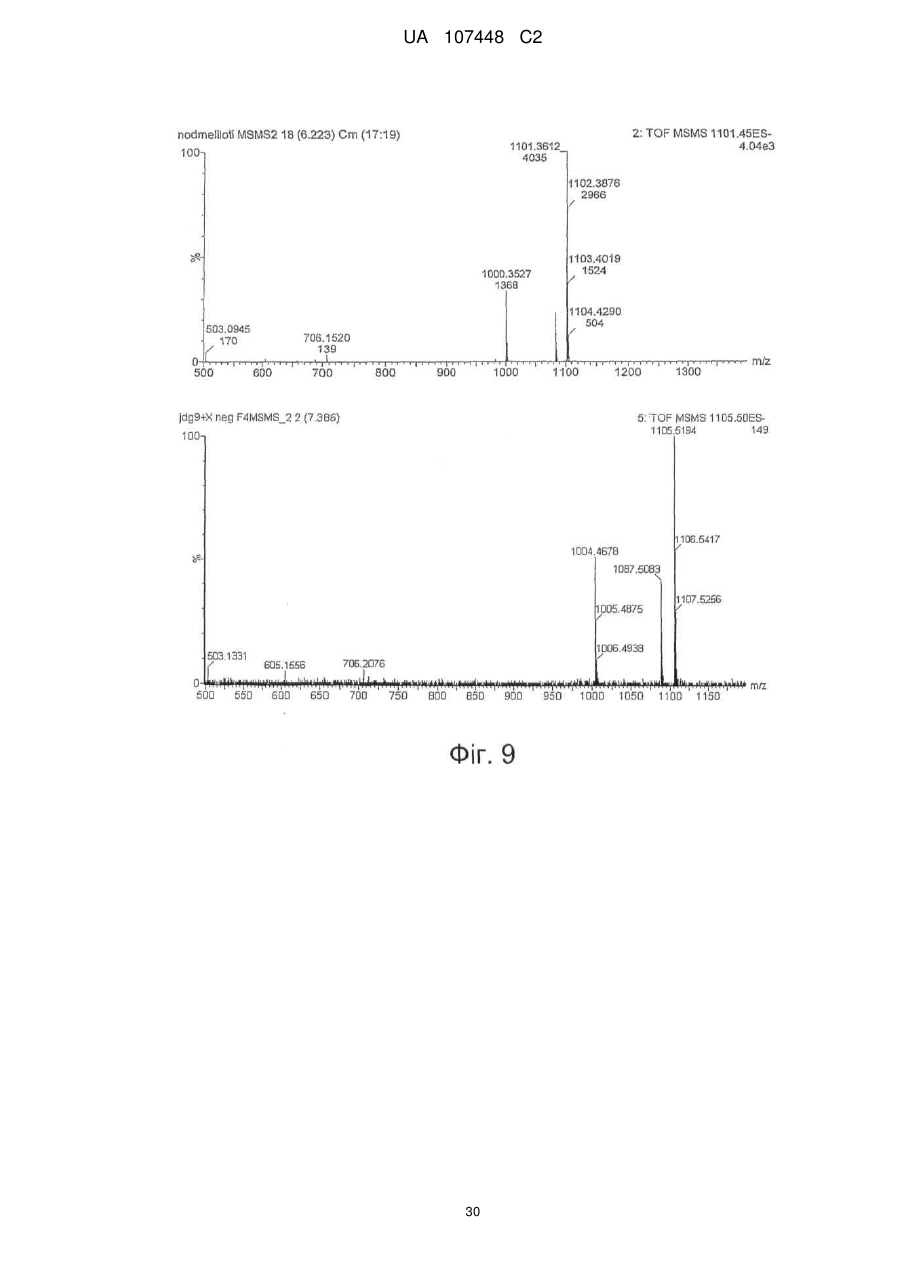
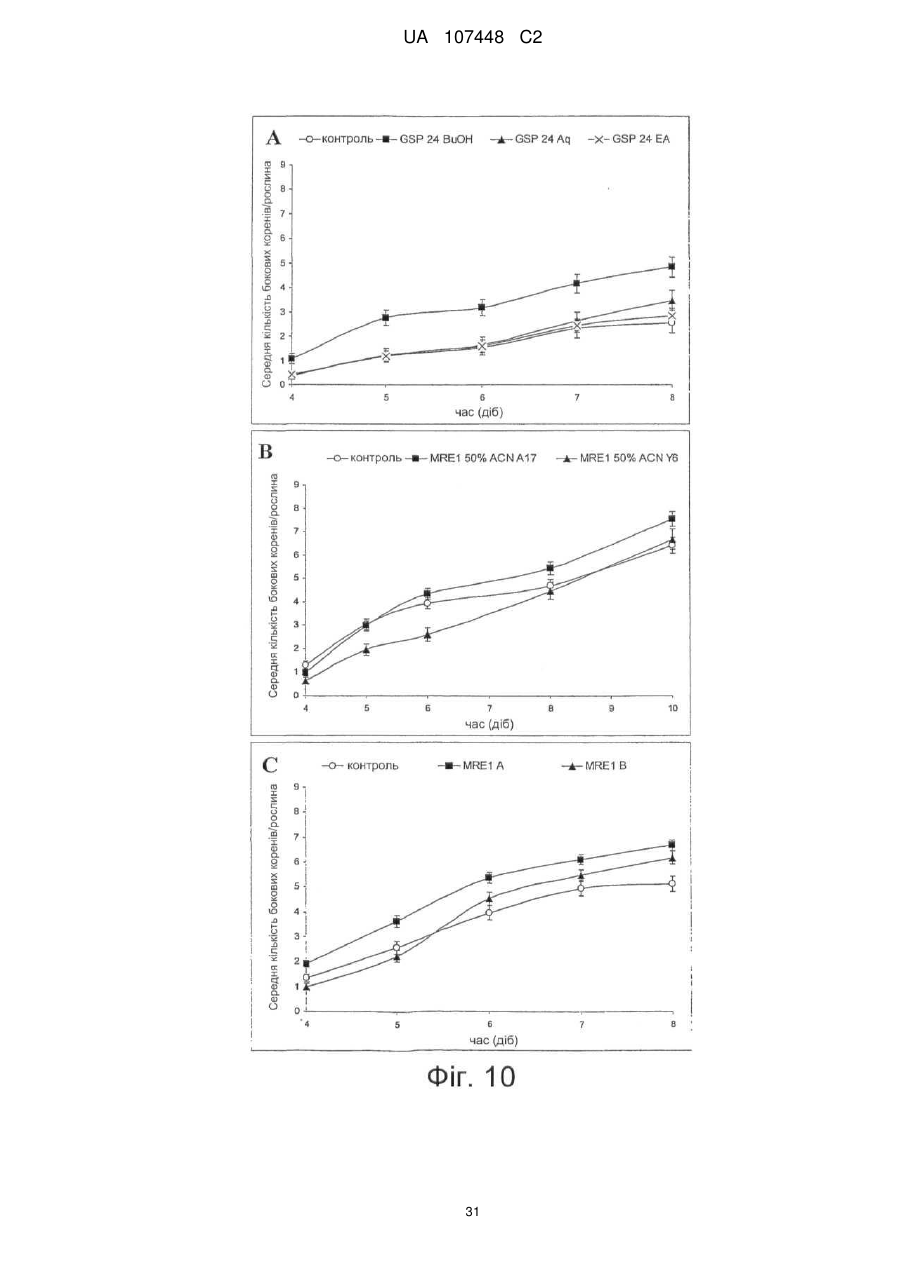
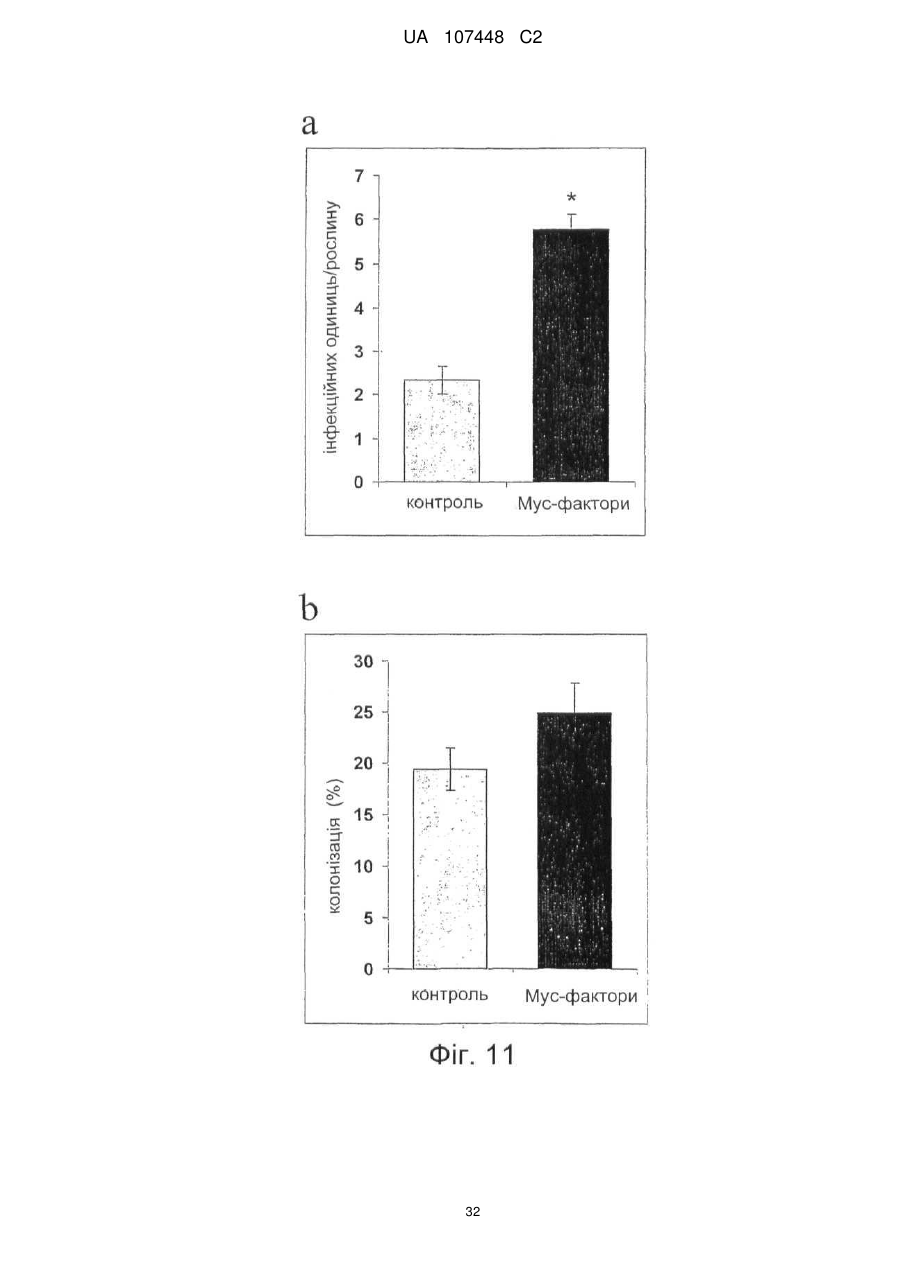
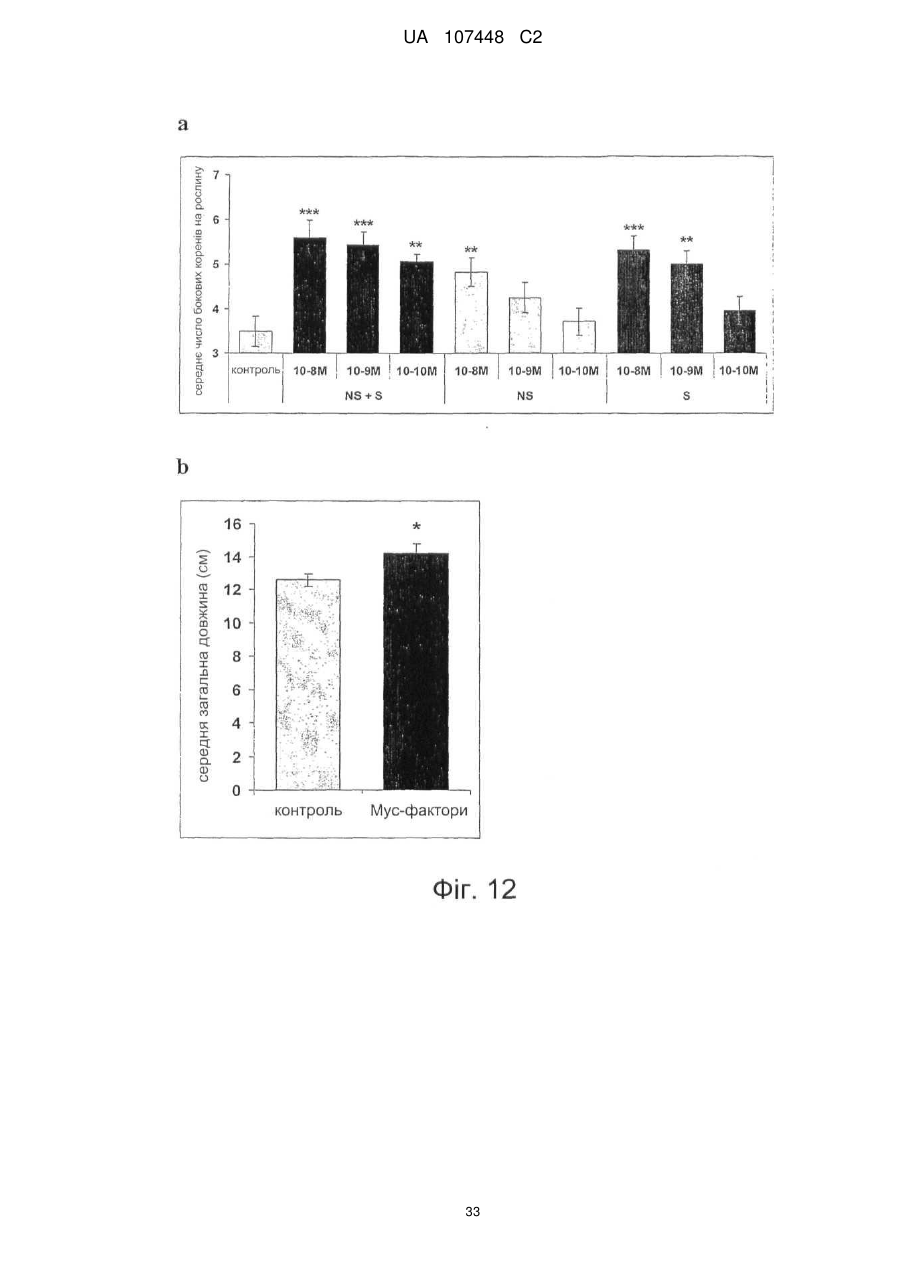
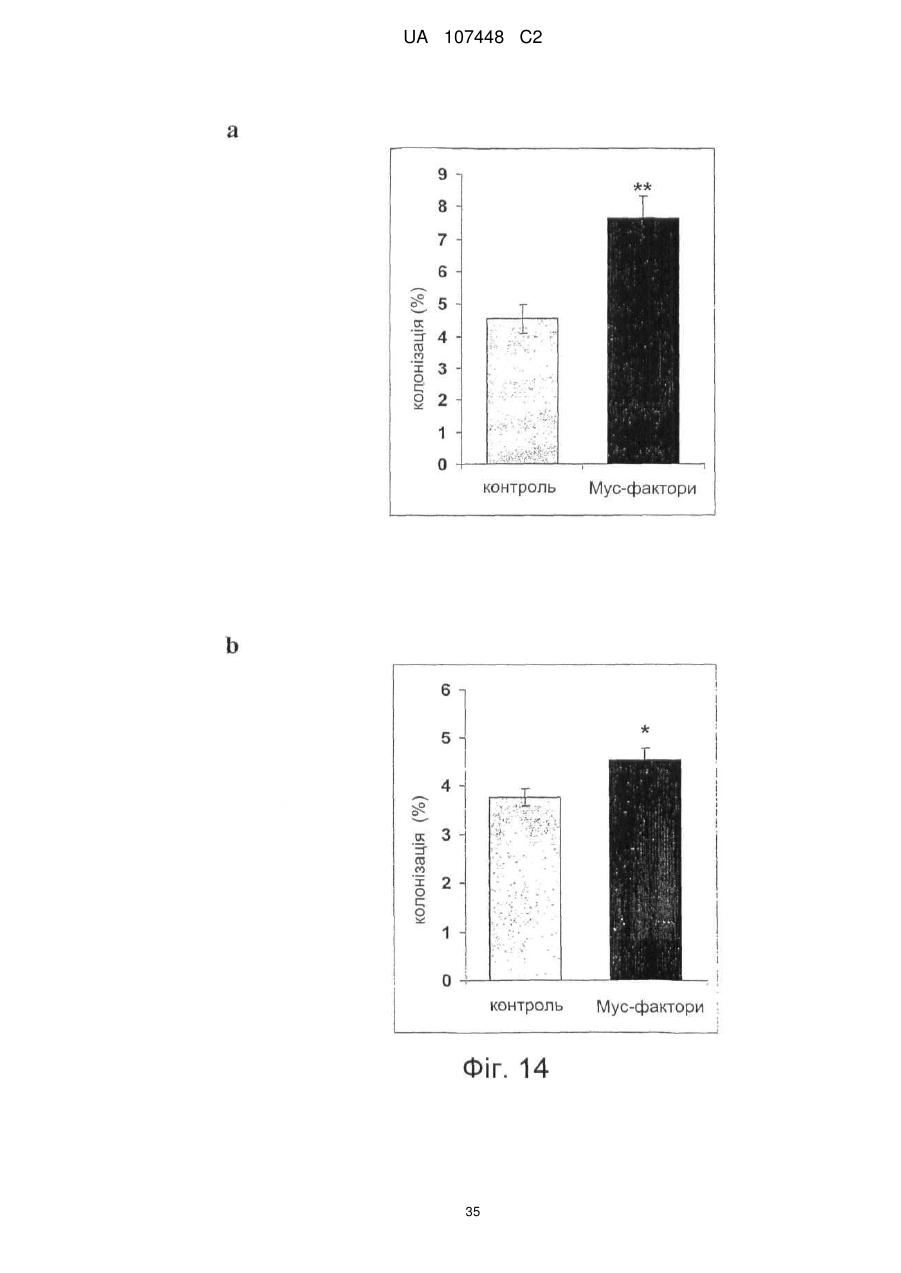
Реферат: Винахід стосується ліпохітоолігосахаридів, що отримують з грибів арбускулярної мікоризи, та які застосовуються для стимулювання мікоризного симбіозу та формування бічного коріння. UA 107448 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід стосується ліпохітоолігосахаридів, задіяних в арбускулярно-мікоризному симбіозі, та їх застосувань. Гриби арбускулярної мікоризи (AM) встановили симбіотичні зв'язки із корінням рослин більше 4 00 мільйонів років тому з появи найперших наземних рослин, що наводить на думку про роль грибів AM у колонізації землі рослинами (Remy et al., 1994 p.). Ця група грибів, яку нещодавно було перейменовано у гломероміцети (Glomeromycota), є одною з найбільш розповсюджених, а зв'язки AM широко розповсюджені у царстві рослин, в тому числі у покритонасінних, голонасінних, папоротникоподібних та деяких з мохоподібних (Smith and Read, 2008). Серед покритонасінних принаймні 80 % видів можуть утворювати AM взаємодії, єдине значне виключення становлять капустяні (Brassiceceae) та мареві (Chenopodiaceae). AM гриби можуть переносити мінеральні поживні речовини, що рідко або погано розчинюються, такі як фосфор, цинк та мідь, з ґрунту до рослини, яка в свою чергу постачає карбогідрати до грибів. Цей обмін поживними речовинами може мати критичне значення при низькій родючості ґрунту та наявності малих об'ємів води у ньому - умовах, що значно обмежують ведення сільського господарства у більшості частин світу (Smith and Read, 2008). Іншим відомим симбіотичним зв'язком між рослинами та мікроорганізмами ґрунту є ризобійний симбіоз. На відміну від арбускулярно-мікоризного симбіозу, широко розповсюдженого серед рослин, ризобійний симбіоз зустрічається тільки у бобових, та замість грибів в ньому приймають участь азотофіксуючі бактерії, які у сукупності називаються ризобії, що належать до кількох родів Rhizobium, Bradyrhizobium, Azorhizobium та Sinorhizobium. Ризобійний симбіоз приводить до утворення особливих структур, бульб, на корінні бобової рослини-господарі. Бульби утворюють підходяще середовище для ризобій, дозволяючи їм фіксувати молекули азоту та постачати з'єднаний азот до бобових рослин-господарів. Початок взаємозв'язку ризобій та бобових залежить від симбіотичних сигналів, що виробляються обома учасниками симбіозу. Сигнали, що надсилаються рослиною, зазвичай є флавоноїдами, які виробляються у виділеннях коріння. Ці флавоноїди взаємодіють із факторами транскрипції ризобій родини NodD, що активуються транскрипцію генів утворення бульб (nod), які приймають участь у виробленні молекул бактеріального сигналу і називаються Nod-факторами (Dénarié et al.,1996). Nod-фактори мають спільну основну структуру, що складається з хітинового скелету з чотирьох або п'яти бета-1,4-зв'язаних N-ацетилглюкозамінових залишків, N-ацилованих на невідновлюючому кінці з групою жирних кислот змінної довжини та ступеню насичення. Ця основна структура може потім бути N-метильована на невідновлюючому кінці та також може бути 0-насичена на невідновлюючому кінці та/або на відновлюючому кінці. Це різноманіття замісників утворює множину Nod-факторів із різними структурами (опис замісників різноманітних структур Nod-факторів див. у Dénarié et al.,1996; D'Haeze et al., 2002). Результатом цієї різноманітності є специфічність взаємодії бобових/ризобій (тобто, певний вид ризобій утворює бульби на певному виді бобових). Генетична диссекція шляху, задіяного у передачі сигналу Nod-фактору у коренях модельної бобової рослини Люцерни трункатули (Medicago truncatula), визначила число генів, залучених у цьому шляху (Stacey et al., 2006)… З'являється все більше доказів того, що рецептори Nodфактору є рецептороподібними кіназами з позаклітинними доменами LysM, що зв'язують цукор, як такі, що закодовані генами NPF та LYK3 М. truncatula. Взаємодія Nod-фактору із його рецептором призводить до виникнення низхідного сигнального каскаду, в тому числі швидкий приток іонів кальцію, кальцієвих спайок та експресію специфічних генів нодуліну. У цих низхідних каскадах приймають участь гени, що кодують білки, залучені у передачі сигналу кальцію, такі як DMI1, DMI2 та DMI3 рослини М. truncatula, що відповідно кодують катіонний 2+ канал, рецептороподібну кіназу лейцин-насиченого повтору та Са /кальмодулін-залежну протеїнкіназу та гени, що кодують білки, задіяні в експресії таких генів, як NSP1 та NSP2, що кодують фактори транскрипції. Хоча гриби AM є надто важливими для сільського господарства та екології, клітинних та молекулярних механізмів, що контролюють утворення мікоризного симбіозу, вони набагато менше відомі, ніж ті, що задіяні у ризобійному симбіозі. Відомо, що у М. truncatula програми утворення бульб та мікоризи мають три спільних компоненти (Catoira et al., 2000), а саме продукти генів DMI1, DMI2 та DMI3, залучені у передачі сигналу кальцію. Проте, процеси, що рухаються вгору або вниз за кальцієвим сигналом, мало охарактеризовані для арбусклуярно-мікоризного симбіозу, особливо ті процеси, що приймають участь у ранній передачі сигналу та призводять до розпізнання між рослинами та грибами, що приймають участь у симбіозі. Вивчення цих процесів утруднюється тим фактом, що грибиучасники симбіозу є обов'язковим симбіонтом, який не може бути вирощений у чистій культурі 1 UA 107448 C2 5 10 15 20 25 30 35 40 45 50 55 60 без наявності живих рослин та без генетичних засобів для цієї групи грибів (Harrison, 2005). Проте, недавно було виявлено, що сигнали, здатні на дифузію, обмінюються між симбіонтами щодо фізичної взаємодії. Стосовно рослин, сполуки родини апокаротеноїдів, стріголактонів можуть вироблятись у виділеннях коренів та стимулювати відгалуження у гіфи з проростаючих спор грибів AM, передаючи сигнал про фізіологічний перехід до активного пресимбіотичного росту грибів (Akiyama et al. 2005; Besserer et al., 2006). Стосовно грибів, також була зафіксована наявність сполук, що можуть передаватись дифузією, які виробляються грибами AM та можуть активувати відповіді рослин, пов'язані із ендомікоризними програмами (Kosuta et al.; 2003; Weidmann et al., 2004; Navazio et al. 2007). У більш вузькому значенні серія експериментів, проведених із М. truncatula, недавно виявила, що гриби AM виробляють сполуки, що можуть передаватись дифузією та здатні стимулювати вироблення різноманітних відповідей рослин. Три види Gigaspora та один вид Glomus можуть викликати через целофанову мембрану початок експресії симбіотичних генів MtENOD11 у корінні сіянців (Kosuta et al., 2003). Три патогени грибів не викликали такої ж відповіді, що підтримує гіпотезу про те, що ця відповідь викликається особливою сигнальною молекулою грибів AM. Аналогічно було доведено, що гриб AM, Glomus intraradices, активує через мембрану транскрипцію генів рослин, експресія яких залежить від симбіотичного гена DMI3 (Weidmann et al. 2004). До того ж було відкрито, що сигнал, який може передаватись дифузією від грибів AM, призводить до підвищення рівня цитозольного кальцію у культурах соєвих клітин та збільшення генів, що відносяться до DMI1, DMI2 та DMI3 (Navazio et al., 2007). Olah та співавтори (2005 p.) заявляють, що Nod-фактори з Sinorhizobium meliloti, ризобійний симбіонт М. truncatula, могли стимулювати мікоризацію та утворення бокового кореня у М. truncatula. Стимулювання утворення бокового кореня також спостерігалось із факторами, що здатні на дифузію, з грибів арбускулярної мікоризи (Мус-фактори), але не із Nod-факторами з видів ризобій (Sinorhizobium fredii та Rhizobium leguminosarum), що не можуть утворювати бульби у видів Medicago. Вони також заявили, що всі нещодавно визначені гени шляху передачі сигналу Nod-фактору, в тому числі ген NFP, що кодує можливий рецептор Nod фактору, а також гени DMI3 та NSP1 потребувались для стимуляції утворення бокового кореня Nod-факторами, але не Мус-факторами, які необхідні для генів DMI1 та DMI2. На підставі спостережень ці автори пропонували модель, що пояснює стимуляцію мікоризації та утворення бокового кореня у бобових Мус-факторами та Nod-факторами. Відповідно до цієї моделі Мус-фактори та Nodфактори, які розпізнавались різними рецепторами клітинної поверхні, активували загальний шлях передачі сигналу DMI1/DMI2/DMI3; для Мус-факторів, DMI1 та DMI2 було достатньо для стимуляції утворення бокового кореня, доки DMI3 було достатньо для стимуляції мікоризації. Olah та співавтори обговорювали можливу хімічну природу Мус-факторів. Вони висували гіпотезу, що вони навряд були ауксиноподібними сполуками, оскільки їхній вплив на розвиток коріння відрізняється від впливу, що спостерігається із цими сполуками. Вони також заявляли, що їх структура повинна бути не схожою на структуру Nod-факторів, оскільки виявляється, що вони дискримінуються рецептором NFP. Тому, виявляється, що хоча існування "Мус-факторів", що можуть передаватись дифузією, які виробляються грибами AM та можуть активувати відповіді рослин, і визнається у цій галузі, хімічний характер цих факторів не було визначено до цього моменту. Винахідникам вдалось очистити Мус-фактори з виділень з мікоризованого коріння та проростаючих спор гриба AM Glomus intradices. Вони також визначили їх хімічну структуру та показали, що вони ефективно стимулюють розвиток кореневою системи та колонізації коріння грибом AM. Мус-фактори, очищені винахідниками, є сумішшю сульфатованих та несульфатованих ліпохітоолігосахаридів (ЛХО); вони поділяють із Nod-факторами загальний основний хітиновий скелет з бета-1,4-зв'язаних N-ацетилглюкозамінових залишків, N-ацилованих на невідновлюючому кінці з групою жирних кислот. Проте Мус-фактори мають більш прості структури, ніж Nod-фактори. Єдиним О-заміщенням, що спостерігається у Мус-факторів, є Осульфатація на відновлюючому кінці молекули. Інших О-заміщень, як наприклад, О-карбамоїл на невідновлюючому кінці, або О-фукозил на відновлюючому кінці не було виявлено. Єдине Nзаміщення невідновлюючого кінця залишку GlcNAc для Мус-факторів, виділених з Glomus intradices, є ацилування загальними жирними кислотами, загальним чином олеїновою (С18:1) та пальмітиновою (С16:0) кислотами. N-заміщення Nod-факторів навпаки є більш складним. Воно часто є подвійним заміщенням N-метилової та N-ацилової групи (часто - вакценова кислота), як у штамів ризобій, що формують бульби у більшості тропічних бобових рослин та бобових Мимозійної підродини. N-метилування визначається розповсюдженим геном ризобій nodS (Dénarié et al., 1996). І навпаки, N-ацилування специфічною полі-ненасиченою жирною кислотою 2 UA 107448 C2 5 10 15 20 25 30 35 40 45 50 постійно зустрічається серед ризобій, що утворюють бульби у бобових помірної зони Galeloid clade (Dénarié et al., 1996). Насправді, ЛХО із структурою такою ж простою, що і у Мус-факторів, характеризованих винахідниками, не було знайдено серед Nod-факторів, синтезованих різними штамами ризобій, які до цього часу були вивчені (Dénarié et al., 1996; D'Haeze et al., 2002). Цей винахід пропонує процес отримання Мус-факторів з гриба з групи Гломеромікоти, при чому зазначений процес включає в себе отримання виділення з рослинного коріння, мікоризованого зазначеним грибом, або з проростаючих спор зазначеного гриба, екстрагування вказаних виділень бутанолом та відновлення екстракту бутанолу, що містить зазначені ліпохітоолігосахариди. Відповідно до оптимального втілення зазначений процес складається з наступних етапів піддавання екстракту бутанолу твердофазній екстракції на зворотній фазі С18 із подальшими промивками із 20 %, 50 % та 100 % ацетонітрилом та відновлення фракції, вилученої із 50 % ацетонітрилом, що містить зазначені Мус-фактори. Згідно із більш оптимальним втіленням зазначений процес складається з наступних етапів піддавання вказаною фракції, виділеної із 50 % ацетонітрилом, зворотно фазовій високоефективній рідкісній хроматографії на колонці із зворотною фазою С18 із використанням лінійного градієнту 20 %-100 % ацетонітрилу та відновлення фракції, вилученої із 30-48 % ацетонітрилу, яка містить сульфатовані ліпохітоолігосахариди, та/або фракції, вилученої із 6472 % ацетонітрилу, яка містить несульфатовані ліпохітоолігосахариди. Відповідно до певного втілення цього винаходу зазначений гриб із групи Гломеромікотів є Glomus intraradices. Мус-фактори грибів можуть бути екстраговані з інших видів Гломеромікотів, що виробляють їх, із застосуванням етапів, описаних вище, або їх варіантів. "Мус-фактор" зазначений у цій заявці як ліпохітоолігосахарид, представлений формулою (І), наведеною нижче: де n= 0, 1, 2, 3, 4 або 5, оптимально 2 або 3, R1 являє собою замісник ліпідів, що містить від 12 до 22, оптимально від 14 до 2 0 атомів вуглецю, що можуть бути насиченими або моно-, ді-, три-, тетра-, пента- або гексаненасичені, a R2 являє собою Η або SO3H. Замісник ліпідів R1 бажано є ланцюгом жирних кислот. R1 також може бути ароматичним аналогом ланцюгів жирних кислот, як в аналогах Nod-факторів, описаних, наприклад, у Grenouillat та співавторів (2004) або у патентній заявці РСТ WO/2005/063784. Переважно R1 є ланцюгом жирної кислоти, що синтезується грибами арбускулярної мікоризи, зокрема, ланцюг жирної кислоти С16 або С18, насиченої або моно- або діненасиченої. Оптимально, коли ми кажемо, що зазначений ланцюг жирної кислоти є ненасиченим, ми маємо на увазі, що він містить принаймні одне цис-ненасичення (наприклад, С18:1 олеїнова кислота). Серед прикладів, якими не обмежується цей винахід, оптимальних ланцюгів жирних кислот можна навести С16:0, С18:0, С16:1ω5, С16:1ω7, С18:1ω5, С18:1ω9, 18:2ω6,9 С20:0 iso, C20:1ω9 та С20:4ω6,9,12,15. Мус-фактори також можуть характеризуватись та відрізнятись від ліпохітоолігосахаридів схожої структури, як, наприклад, Nod-факторів, своїми біологічними властивостями. Ці біологічні властивості можна перевірити за допомогою біоаналізів. Зокрема, можна використовувати біоаналізи, що ґрунтуються на здатності Мус-факторів стимулювати утворення бокового кореня у модельних бобових рослин М. truncatula. Більш конкретно, разом із тим, що Мус-фактори, як і Nod-фактори, мають здатність стимулювати утворення бокового кореня у рослинах дикого типу, але не у мутантів dmi1, dmi2 та dmi3, дефектних у симбіозі, Мус-фактори також можуть, на відміну від Nod-факторів, стимулювати утворення бокового кореня у мутанту nsp1, дефектного у симбіозі. 3 UA 107448 C2 5 10 15 20 25 30 35 40 45 50 55 60 При бажанні можна провести біоаналізи для розрізнення несульфатованих Мус-факторів від сульфатованих Мус-факторів (наприклад, якщо ви бажаєте відокремити у грибному екстракті фракції, що містять несульфатовані Мус-фактори, від фракцій, що містять сульфатовані Мусфактори): наприклад, сульфатовані Мус-фактори можуть викликати експресію гену MtENOD11 у коріння, що росте, рослини М. truncatula, коли несульфатовані Мус-фактори можуть викликати розгалуження кореневих волосків у горошку. Мус-фактори можуть бути виділені з грибів за описаним вище способом. Вони також можуть бути отримані хімічним синтезом та/або вироблені генетично-створеними бактерійними клітинами. Наприклад, хітоолігосахаридний скелет, як сульфатований, так і несульфатований, може бути синтезований у рекобінантній бактерії, згідно із описом синтезу прекурсорів Nodфакторів, наприклад, у Samain та співавторів (1997, 1999), і далі ацетильовані на вільній аміногрупі невідоновлюючого кінця цукру, як описано, наприклад у Ohsten Rasmussen та співавторів (2004). Також можна використовувати мутантний штам бактерії Rhizobiaceae, що виробляє Мус-фактори, а не Nod-фактори, наприклад, штам генетично модифікованого з метою експресії, поміж структурних генів Nod-біосинтетичного шляху, тільки тих генів, що беруть участь у синтезі хітоолігосахаридного скелету, та тих генів, що беруть участь у N-ацилуванні невідновлюючого термінального кінцю глюкозаміну відповідною С16 або С18 жирною кислотою, та іноді тих генів, що беруть участь в О-сульфатації відновлюючого термінального кінцю глюкозаміну, як описано, наприклад, у Ardourel та співавторів (1994), або Lugtenberg та співавторів (1995). Цей винахід також охоплює поєднання різних Мус-факторів за формулою (І) та зокрема поєднання сульфатованих не сульфатованих Мус-факторів, що містять один або кілька ліпохітоолігосахаридів за формулою (І), де R2 є Η та один або кілька ліпохітоолігосахаридів за формулою (І), де R2 є SO3H. Ліпохітоолігосахариди зазначеної суміші можуть також відрізнятись між собою за кількістю N-ацетилглюкозамінових залишків та/або характером замісника R1 (наприклад, довжиною та/або ступенем ненасиченості ланцюга жирних кислот). Суміші Мус-факторів за цим винаходом можуть бути отримані, наприклад, за допомогою екстрагування Мус-факторів з грибів арбускулярної мікоризи за вищеописаним методом та відновлення грибного екстракту. Їх також можна отримати, окремо виробивши різні Мус-фактори та змішавши їх. Очищені або синтетичні ліпохітоолігосахариди, більш конкретно, очищені або синтетичні Мус-фактори за формулою (І) або їх суміші, описані у цій заявці, можуть використовуватись для стимуляції мікоризації і таким чином, мати широке різноманіття застосувань в сільському господарстві, садівництві та лісівництві, для рослин, що найбільше культивуються та які можуть встановлювати мікоризацію і таким чином мають рецептори Мус-факторів. На додаток до їх застосування для стимуляції арбускулярно-мікоризного симбіозу, очищені або синтетичні Мус-фактори або їх суміші можуть використовуватись: - для стимуляції пророщування насіння, що може бути корисним для обробки насіння із великою кількістю застосувань в сільському господарстві, садівництві та лісівництві; - для стимулювання розвитку кореневої системи, що є корисним для покращення живлення водою та мінералами. Вони можуть застосовуватись, наприклад, для обробки насіння або додаватись до бактеріальних розчинів, що містять гриби арбускулярної мікоризи, або додаватись до ґрунту або речовини культури рослини. Очищені або синтетичні Мус-фактори за цим винаходом можуть використовуватись для будь-якої рослини, зокрема для рослин, що встановлюють мікоризацію, в тому числі бобових або небобових рослин, а також для дводольних та однодольних рослин, таких як, злаки. Їх можна використовувати для рослин, що ростуть у вегетаційній камері, теплиці а також у польових умовах. Вони також можуть застосовуватись для стимулювання мікоризної колонізації у виробленні мікоризних бактеріальних розчинів (тобто спори або гіфи грибів AM, або фрагменти мікоризованого коріння) у якості добавок до поживних середовищ, що використовуються для виготовлення цих бактеріальних розчинів рослинами, що ростуть на ґрунті або у гідропонних та аеропонних умовах, або сумісною культивацією мікоризних грибів із підрізаним корінням. Цей винахід також охоплює сполуки, що містять очищені або синтетичні Мус-фактори або їх суміші та носій, прийнятний для сільського господарства. Сполуки за цим винаходом можуть також містити мутанті штами бактерій Rhizobiaceae, генетично модифікованих для вироблення Мус-факторів, а не Nod-факторів, згідно із зазначеним вище способом. Бажані сполуки також повинні містити суміш сульфатованих та несульфатованих Мус-факторів. Мус-фактори також іноді можуть бути поєднані із іншими активними елементами, такими як флавоноїди, апокаротеноїди, стріголактони, або жасмонати, які є рослинними сполуками, що 4 UA 107448 C2 5 10 15 20 25 30 35 40 45 50 55 діють, як було зазначено, у якості симбіотичних сигналів (Harrison, 2005; Akiyama et al., 2005; Besserer et al., 2006). Склад цих сполук залежить від запланованого виду використання, (наприклад, дражування насіння, додання до поживного середовища для виготовлення мікоризних бактеріальних розчинів, оброблення рослин на цьому ґрунті). Вони можуть, наприклад, формуватись у вигляді вододиспергованих або водорозчинних твердих речовин, таких як, порошок, гранули, драже або плівки, у вигляді рідких водних розчинів, суспензій, емульсій або гелів. Відповідно до оптимального втілення, ці сполуки пов'язані із грибним та/або рослинним матеріалом, наприклад, із бактеріальним розчином грибів арбускулярної мікоризи, або із насінням рослини, що може створювати мікоризацію; переважно, зазначене насіння дражують сполукою. -5 -12 Переважно, у сполуці використовуються Мус-фактори в концентраціях від 10 Μ до 10 М. При доданні до поживного середовища для отримання спор грибів AM, їх можна -5 -10 використовувати у середовищі у концентраціях від 10 Μ до 10 М, переважно у концентраціях -7 -9 від 10 до 10 М. При застосуванні для протравлення насіння або для стимулювання розвитку -6 -10 кореневої системи, їх можна використовувати в концентраціях від 10 до 10 М, бажано - у -7 -9 концентраціях від 10 до 10 М. При застосуванні суміші сульфатованих та несульфатованих -8 -10 Мус-факторів, концентрація може бути від 10 до 10 М. Цей винахід можна зрозуміти чіткіше за допомогою додаткового описання наведених нижче прикладів та доданих креслень. Потрібно чітко розуміти, однак, що ці приклади та креслення наведено лише з метою зображення об'єкту цього винаходу, та вони ніяким чином не обмежують його. ПОЯСНЕННЯ ДО КРЕСЛЕНЬ Фіг. 1. Біоаналізи для виявлення симбіотичних сигналів грибів AM a. Аналіз MtENOD11. Коріння трансгенних сіянців М. truncatula Jemalog A17, що несуть конструкцію-репортер pMtENOD11-GUS. GUS активність визначається гістохімічним фарбуванням 5-бромо-4-хлоро-3-інодил-b-гюкуроновою кислотою. (1) Контролювання коріння, що оброблюється ацетонітрилом 2,5 %. (2) Фракція після твердофазної екстракції та елюювання 50 % ацетонітрилом, розчиненим 40 разів. (3) Та ж фракція із подальшим десятикратним розчиненням. b. Аналіз V.s.Hab. Кореневі волоски горошку (Vicia sativa замісн. nigra) спостерігають під оптичним мікроскопом після фарбування метиленовим синім. (1) Кореневі волоски, що оброблюються неактивною фракцією, рівні. (2) Кореневі волоски, що оброблюються активними фракціями, чітко розгалужені. Фіг. 2. Профіль напівпрепаративного високоефективного рідкісного хроматографу (ВЕРХ) із зворотною фазою С18 екстрактів з виділень мікоризованого коріння. Початкова ізократична фаза із використанням 20 % ацетонітрилом тривала 10 хвилин, за нею проводилась обробка 20-100 % ацетонітрил-градієнтом протягом 20 хв. На цьому профілі видно надлишок отруйного матеріалу, присутнього у виділеннях мікоризованого коріння. Фракції збирались кожні дві хвилини та перевірялись на біологічну активність при MtNOD11 та VsHab. Горизонтальні риски позначають час утримання сполук у фракції А, що є активними при MtNOD11, та сполук у фракції В, більш гідрофобній, що є активними на VsHab. Фіг. 3. Профіль напівпрепаративного ВЕРХ із зворотною фазою С18 екстрактів з виділень проростаючих спор. Хроматографічні умови є такими ж, що і на Фіг. 2. На профілі видно, що виділення зі спор містять набагато менше домішаного матеріалу, ніж виділення мікоризованого коріння. Фракції збирались кожні дві хвилини та перевірялись на біологічну активність при MtNOD11 та VsHab. Горизонтальні риски позначають час утримання сполук у фракції А, що є активними при MtNOD11, та сполук у фракції В, більш гідрофобній, що є активними у VsHab. Фіг. 4. Вплив м'якого метанольного гідролізу на біологічну активність на фракції А. Було доведено, що м'який метанольний гідроліз видаляє сульфатну складову сульфатованих ЛХО, не змінюючи інші структурні особливості цих молекул. Фракцію А, зібрану під час напівпрепаративного ВЕРХ виділень проростаючих спор, було піддано м'якому гідролізу та перевірено на біологічну активність аналізами MtNOD11 та VsHab. Біологічну активність зображено вертикальними рисками. При чому, негідролізована фракція А є активною при MtNOD11 та неактивною при VsHab, a гідролізована фракція втратила свою активність при MtNOD11 та набула активності при VsHab. Ці дані вказують на те, що фракція А є біологічно активною при аналізі MtNOD11 завдяки наявності сульфатованих ЛХО. Фіг. 5. Тетрамерні сульфатовані ЛХО, N-ацильовані жирними кислотами С16. 5 UA 107448 C2 5 10 15 20 25 30 35 40 45 50 55 Сліди надефективної рідкісної хроматографії (НЕРХ)/мас-спектрометрії (MC), у негативному режимі, фракції 4, ізольованої після напівпрепаративного ВЕРХ С18. Подані екстраговані іонні струми, що відповідають сульфатованим тетрамерам, та відповідні спектри. На цьому кресленні видно, що сполуки, що реагують при 110.5, 1103.5 та 1105.5 маса/заряд, ефективно присутні у зразках. Ці співвідношення маса/заряд відповідають сульфатованим тетрамерним ЛХО, Nацільованим кислотами С16:2, С16:1 та С16:0 відповідно. Стосовно відносної інтенсивності цих трьох речовин, 1105.5 (ЛХО-IV-С16:0) є найбільш надлишковою, за нею іде 1103.5 (ЛХО-IVС16:1). Фіг. 6. Тетрамерні сульфатовані ЛХО, N-ацильовані жирною кислотою С18:1. Сліди НЕРХ/МС, у негативному режимі фракції 5, ізольованої після напівпрепаративного С18 ВЕРХ, вказуючи на те, що найбільш надлишковою сполукою (м/з 1135.5) є N-ацильована жирною кислотою С18:1. Цей профіль також вказує на те, що у цій фракції (м/з 1133.5) присутній ЛХО, що містить жирну кислоту С18:0, оскільки цей іон є лише ізотопом +2 ЛХО, що містить ланцюг С18:1. Як видно на другому мас-спектрі, діненасичений С18-ЛХО є дуже незначною сполукою. Фіг. 7. Пентамерні сульфатовані ЛХО, N-ацильовані жирною кислотою С18:1. На цьому профілі показано, що ліпохітопентамери також присутні, але у порівнянні із відповідними тетрамерами (див. Фіг. 5), вони приблизно в 30 разів менш надлишкові. Можна виявити ЛХО-У-С18:1. Фіг. 8. Аналіз на наявність або відсутність вказаної сполуки. Якщо потрібна маса не відповідає іонам, присутнім у зразку, замість одного піку на профілі з'являється велика кількість фонових піків. Сам отриманий комплексний профіль із іонним струмом з відношенням маса/заряд 1332.6 вказує на відсутність С18:2 хітопентамеру у зразку. І навпаки, чіткий одинарний пік, що спостерігається із іонним струмом з відношенням маса/заряд 1334.6, чітко вказує на наявність С18:1 хітопентамеру. Фіг. 9. Порівняння характеру фрагментації за допомогою МС/МС основного сульфатованого Мус-фактора та Nod-фактора бактерії S.meliloti. Виявлення присутності сполук із адекватною масою при очікуваному часі утримання у ВЕРХ не достатньо для підтвердження їх структури. Тому ми виконали МС/МС аналіз основної сульфатованої Мус-сполуки. Цей показник позначає порівняння сульфатованого тетрамірного Nod-фактора бактерії S.meliloti, N-ацильованого С16:2, у негативному режимі МС/МС із показником головного тетрамерного "Мус-фактора", присутнього у зразку. Характерні іони відновлюючого кінця при м/з 503 (Y2), 605 та 706 (Y3) чітко визначаються в обох випадках, як і характерна втрата 101 о.а.м. у нейтральному положенні (внутрішньоциклічний розрив), починаючи з молекулярного іону. Ідеальна відповідність двох характерів фрагментації вказує на структурний зв'язок двох молекул. Фіг. 10. Вплив фракції Мус-екстракту на формування бокового кореня у М. truncatula (A) Сигнал грибів AM, що стимулює формування бокового кореня (ФБК) амфіфільним. Порівняння впливу водного (Aq), бутанольного (ВuОН) екстрактів та екстракту етилацетатом (ЕА) виділень з проростаючих спор (GSPЗ24) на М. truncatula A17. Бутанольний екстракт стимулює ФБК починаючи з 5-го дня (у значній мірі при Р
ДивитисяДодаткова інформація
Назва патенту англійськоюLipochito-oligosaccharides stivulating arbuscular mycorrhizal symbiosis
Автори російськоюDenarie, Jean, Maillet, Fabienne, Poinsot, Verena, Andre, Olivier, Becard, Guillaume, Gueunier, Monique, Cromer, Laurence, Haouy, Alexandra, Giraudet, Delphine
МПК / Мітки
МПК: A01N 63/04, C12N 15/82, A01H 3/00, A01H 17/00
Мітки: ліпохітоолігосахариди, арбускулярно-мікоризний, симбіоз, стимулюють
Код посилання
<a href="https://ua.patents.su/39-107448-lipokhitooligosakharidi-shho-stimulyuyut-arbuskulyarno-mikoriznijj-simbioz.html" target="_blank" rel="follow" title="База патентів України">Ліпохітоолігосахариди, що стимулюють арбускулярно-мікоризний симбіоз</a>
Наступний патент: Спосіб плавки в доменній печі та шахта доменної печі
Випадковий патент: Лінійний електропривод