Склади, що містять пептиди, які стимулюють рецептор еритропоетину та їхнє застосування
Номер патенту: 92497
Опубліковано: 10.11.2010
Автори: Дулідж Анна-Марі, Вудбьорн Кесрін, Насо Роберт Барнет, Льойтер Керстін, Стед Річард
Формула / Реферат
1. Спосіб лікування пацієнта, що має розлад, який характеризується недостатністю еритропоетину або низьким чи недостатнім рівнем червоних кров'яних клітин, який включає призначення зазначеному пацієнтові один раз у кожні 3-4 тижні терапевтично ефективної кількості сполуки, що зв'язується з рецептором еритропоетину (EPO-R) і активує його, при цьому терапевтично ефективна кількість являє собою дозу від 0,025 до 0,5 міліграмів сполуки на 1 кілограм ваги тіла пацієнта, причому зазначена сполука відрізняється тим, що містить:
(a) димерну пептидну субодиницю, що включає перший пептидний мономер і другий пептидний мономер, які відрізняються тим, що зазначені перший і другий нептидні мономери містять амінокислотну послідовність (Ac)GLYACHMGPIT( l-nal)VCQPLR;
(b) лінкер, що ковалентно зв'язує вищевказані пептидні мономери;
(c) принаймні один залишок поліетиленгликолю (ПЕГ), який включає лінійний, нерозгалужений ПЕГ, що має молекулярну масу від 10000 до 60000 Дальтон; і
(d) спейсер, що ковалентно зв'язує вищевказаний принаймні один залишок ПЕГ з вищезазначеним лінкером.
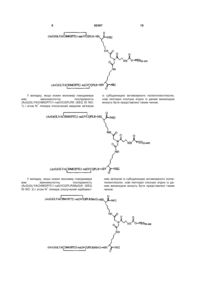
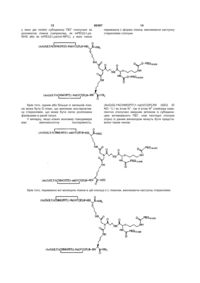
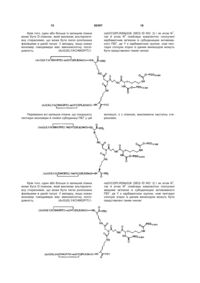
2. Спосіб за п. 1, який відрізняється тим, що зазначений спейсер має формулу, вибрану із групи, що включає:
 ,
,  ,
,
де R4 вибраний із групи, що складається з NH, NHCO, CO, COO, і NHCOO.
3. Спосіб за п. 1, який відрізняється тим, що зазначений спейсер має формулу, вибрану
із групи, що включає:
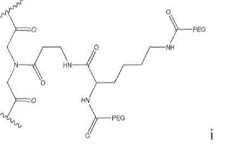
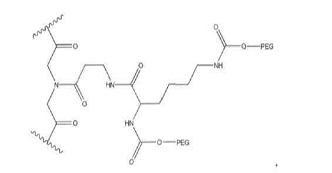
4. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що зазначена амінокислотна послідовність додатково містить (Me), К, або (Ме)К.
5. Спосіб за п. 4, який відрізняється тим, що зазначена амінокислотна послідовність являє собою послідовність (Ac)GLYACHMGPIT( l-nal)VCOPLRK.
6. Спосіб за п. 4, який відрізняється тим, що зазначена амінокислотна послідовність являє собою послідовність (Ac)GLYACHMGPIT( l-nal)VCQPLR(Me).
7. Спосіб за п. 4, який відрізняється тим, що амінокислотна послідовність являє собою послідовність (Ac)GLYACHMGPIT( l-nal)VCQPLR(Me)K.
8. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що спейсер являє собою імінодіацетатний лінкер.
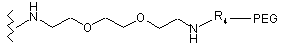
9. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що спейсер являє собою Ten-atom-ПЕГ (2,2'-(етилендіокси-(біс-(етиламін)).
10. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що лінкер являє собою лізин.
11. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що ПЕГ має молекулярну масу від 10000 до 60000 Дальтон.
12. Спосіб за п. 11, який відрізняється тим, що ПЕГ має молекулярну масу від 20000 до 40000 Дальтон.
13. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що сполуку вводять разом з фармацевтично прийнятним носієм.
14. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що зазначений розлад являє собою ниркову недостатність або діаліз.
15. Спосіб за п. 14, який відрізняється тим, що терапевтично ефективна кількість являє собою дозу від 0,025 до 0,2 міліграмів сполуки на 1 кілограм ваги тіла пацієнта.
16. Спосіб за п. 15, який відрізняється тим, що зазначена доза становить від 0,05 до 0,1 міліграмів сполуки на 1 кілограм ваги тіла пацієнта.
17. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що зазначений розлад являє собою анемію, пов'язану зі злоякісною пухлиною.
18. Спосіб за п. 17, який відрізняється тим, що терапевтично ефективна кількість являє собою дозу від 0,075 до 05 міліграмів сполуки на 1 кілограм ваги тіла пацієнта.
19. Спосіб за п. 18, який відрізняється тим, що зазначена доза становить від 0,2 до 0,4 міліграмів сполуки на 1 кілограм ваги тіла пацієнта.
20. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що зазначений розлад являє собою еритроцитарну аплазію, обумовлену антитілами (ЕА).
21. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що зазначений лінкер являє собою лінкер третинний амід.
22. Спосіб за будь-яким з пп. 3, 4, 7, 8, або 10-21, який відрізняється тим, що сполука являє собою
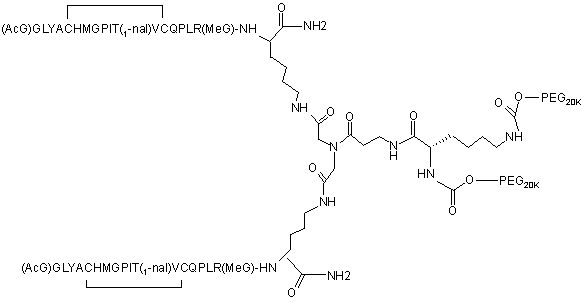 .
.
Текст
1. Спосіб лікування пацієнта, що має розлад, який характеризується недостатністю еритропоетину або низьким чи недостатнім рівнем червоних кров'яних клітин, який включає призначення зазначеному пацієнтові один раз у кожні 3-4 тижні терапевтично ефективної кількості сполуки, що зв'язується з рецептором еритропоетину (EPO-R) і активує його, при цьому терапевтично ефективна кількість являє собою дозу від 0,025 до 0,5 міліграмів сполуки на 1 кілограм ваги тіла пацієнта, причому зазначена сполука відрізняється тим, що містить: (a) димерну пептидну субодиницю, що включає перший пептидний мономер і другий пептидний мономер, які відрізняються тим, що зазначені перший і другий нептидні мономери містять амінокислотну послідовність (Ac)GLYACHMGPIT( lnal)VCQPLR; (b) лінкер, що ковалентно зв'язує вищевказані пептидні мономери; (c) принаймні один залишок поліетиленгликолю (ПЕГ), який включає лінійний, нерозгалужений ПЕГ, що має молекулярну масу від 10000 до 60000 Дальтон; і (d) спейсер, що ковалентно зв'язує вищевказаний принаймні один залишок ПЕГ з вищезазначеним лінкером. 2. Спосіб за п. 1, який відрізняється тим, що зазначений спейсер має формулу, вибрану із групи, що включає: 2 4. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що зазначена амінокислотна 3 92497 4 послідовність додатково містить (Me), К, або 14. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що зазначений розлад являє (Ме)К. 5. Спосіб за п. 4, який відрізняється тим, що засобою ниркову недостатність або діаліз. 15. Спосіб за п. 14, який відрізняється тим, що значена амінокислотна послідовність являє собою послідовність (Ac)GLYACHMGPIT( l-nal)VCOPLRK. терапевтично ефективна кількість являє собою 6. Спосіб за п. 4, який відрізняється тим, що задозу від 0,025 до 0,2 міліграмів сполуки на 1 кілозначена амінокислотна послідовність являє собою грам ваги тіла пацієнта. 16. Спосіб за п. 15, який відрізняється тим, що послідовність (Ac)GLYACHMGPIT( lnal)VCQPLR(Me). зазначена доза становить від 0,05 до 0,1 мілігра7. Спосіб за п. 4, який відрізняється тим, що амімів сполуки на 1 кілограм ваги тіла пацієнта. нокислотна послідовність являє собою послідов17. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що зазначений розлад являє ність (Ac)GLYACHMGPIT( l-nal)VCQPLR(Me)K. 8. Спосіб за будь-яким з попередніх пунктів, який собою анемію, пов'язану зі злоякісною пухлиною. відрізняється тим, що спейсер являє собою імі18. Спосіб за п. 17, який відрізняється тим, що нодіацетатний лінкер. терапевтично ефективна кількість являє собою 9. Спосіб за будь-яким з попередніх пунктів, який дозу від 0,075 до 05 міліграмів сполуки на 1 кіловідрізняється тим, що спейсер являє собою Tenграм ваги тіла пацієнта. 19. Спосіб за п. 18, який відрізняється тим, що atom-ПЕГ (2,2'-(етилендіокси-(біс-(етиламін)). 10. Спосіб за будь-яким з попередніх пунктів, який зазначена доза становить від 0,2 до 0,4 міліграмів відрізняється тим, що лінкер являє собою лізин. сполуки на 1 кілограм ваги тіла пацієнта. 11. Спосіб за будь-яким з попередніх пунктів, який 20. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що ПЕГ має молекулярну масу відрізняється тим, що зазначений розлад являє від 10000 до 60000 Дальтон. собою еритроцитарну аплазію, обумовлену анти12. Спосіб за п. 11, який відрізняється тим, що тілами (ЕА). 21. Спосіб за будь-яким з пп. 1-3, який відрізняПЕГ має молекулярну масу від 20000 до 40000 ється тим, що зазначений лінкер являє собою Дальтон. 13. Спосіб за будь-яким з попередніх пунктів, який лінкер третинний амід. відрізняється тим, що сполуку вводять разом з 22. Спосіб за будь-яким з пп. 3, 4, 7, 8, або 10-21, який відрізняється тим, що сполука являє собою фармацевтично прийнятним носієм. O NH2 (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)-NH NH O O N O PEG20K NH N H HN NH (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)-HN O O O O PEG20K O NH2 O . Дана заявка подається як пріоритетна на підставі заявки U.S. № 60/687655, поданої 3 червня 2005 р. Зміст цієї пріоритетної заявки включено в дану заявку у повному обсязі за допомогою посилання. Галузь техніки Даний винахід відноситься до сполук пептидної природи, що є агоністами рецептора еритропоетину (EPO-R). Винахід також відноситься до способів терапії, у яких такі пептидні сполуки використовуються з метою лікування розладів, пов'я заних з недостатністю або дефектами кровотворення. Винахід також поширюється на фармацевтичні склади, що містять такі пептидні сполуки. Попередній рівень техніки Еритропоетин (ЕРО) являє собою глікопротеідний гормон, що складається з 165 амінокислот з молекулярною масою близько 34 кілодальтон (кДа) і переважними сайтами глікозілірування в амінокислотних положеннях 24, 38, 83 й 126. Спочатку синтезується у виді білка попередника із сигнальним пептидом з 23 амінокислот. ЕРО може 5 92497 6 Physiol. 52:178-182]; гостре недокрів'я [див. Miller, існувати в трьох формах: , , і несиалованій фоet al. (1982) Brit. J. Haematol. 52:545-590]; старіння рмі, і форми трохи відрізняються своєю вугле[див. Udupa, et al. (1984) J. Lab. Clin. Med. 103:574водною компонентою, але мають однакову сілу, 580 й 581-588 and Lipschitz, et al. (1983) Blood біологічну активність і молекулярну масу. Несиа63:502-509]; різні новоутворення, що супроводжулована форма є або формою, у якій вилучений ються порушеннями еритропоезу [див. Dainiak, et кінцевий вуглевод (сиалова кислота). Послідовноal. (1983) Cancer 5:1101-1106 й Schwartz, et al. сті ДНК, що кодують ЕРО, описані в [U.S. Pat. № (1983) Otolaryngol. 109:269-272]; і ниркову недо4703008 to Lin]. статність [див. Eschbach. et al. (1987) N. Eng. J. ЕРО стимулює митотичне ділення і диференMed. 316:73-78]. ціювання клітин-попередників еритроцитів й таким Очищений гомогенний ЕРО був описаний в чином забезпечує утворення еритроцитів. Синте[U.S. Pat. № 4677195 to Hewick]. Послідовність зується в нирці у випадку переважання умов гіпокDNA, що кодує ЕРО була очищена, клонована, і сії. Протягом диференціювання клітинекспресіювалася для одержання рекомбінантного попередників еритроцитів, викликаного ЕРО, індубілка з тими ж біохімічними й імунологічними власціюється синтез глобіну; стимулюється складний тивостями, що й нативний ЕРО. Також були отрисинтез гема й зростає число феритинових рецепмані молекули рекомбінантного ЕРО з олігосахаторів. Ці зміни дозволяють клітині одержати більридами, ідентичним олігосахаридам нативного ше заліза й синтезувати функціональний гемоглоЕРО [див. Sasaki, et al. (1987) J. Biol. Chem. бін, що зв'язує кисень у зрілих еритроцитах. Таким 262:12059-12076]. чином, еритроцити і їхній гемоглобін відіграють Біологічний ефект ЕРО частково виявився ключову роль у забезпеченні тіла киснем. Ці зміни обумовленим взаємодією з зв'язувальним рецеппочинаються із взаємодії ЕРО з підходящим рецетором на мембрані клітини. У початкових досліптором на клітинній поверхні клітин-попередників дженнях з використанням незрілих клітин еритроіеритроцитів [Див. н.р. Graber and Krantz (1978) дного ряду, виділених із селезінки миші, було Ann. Rev. Med. 29.51-66]. показано, що поверхневі білки ЕРО-зв'язувальних ЕРО є присутнім у плазмі крові в дуже низькій клітин включають два поліпептиди, що мають приконцентрації, коли тіло перебуває в здоровому близну молекулярну масу 85000 Дальтон й 100000 стані, при цьому тканини одержують достатнє посДальтон, відповідно [Sawyer, et al. (1987) Proc. тачання киснем від існуючої кількості еритроцитів. Natl. Acad. Sci. США 84:3690-3694]. Число ЕРОЦя нормальна низька концентрація достатня для зв'язувальних сайтів на поверхню однієї клітини того, щоб стимулювати заміну червоних клітин було оцінено в середньому від 800 до 1000. Із чискрові, які в нормі старіють і гинуть. ла цих зв'язувальних сайтів приблизно 300 зв'язуКількість ЕРО у крові підвищується в умовах ють ЕРО з Kd приблизно 90 пМ (пікомоль), тоді як гіпоксії, коли зменшується транспорт кисню циркуінші зв'язують ЕРО зі зменшеною афінністю приблюючими клітинами крові. Гіпоксія може бути вилизно 570 пМ [Sawyer, et al. (1987) J. Biol. Chem. кликана, наприклад, істотною крововтратою через 262:5554-5562]. Незалежний аналіз показав, що кровотечу, руйнуванням червоних кров'яних клітин ЕРО-чутливі еритробласти селезінки, виділені з під дією випромінювання, зменшенням надхомишей, яким зробили ін'єкцію вірусу лейкемії дження кисню через велику висоту або тривале Friend (FVA), що викликає анемію, містили в підбезпам'ятство, або різних форм анемії. У відповідь сумку приблизно 400 зв'язувальних ЕРО сайтів на такий гіпоксичний стрес підвищення рівня ЕРО високої й низької афінності зі значеннями Kd прибзбільшує утворення червоних кров'яних клітин за лизно 100 пМ й 800 пМ, відповідно [Landschulz, et рахунок стимуляції проліферації клітинal. (1989) Blood 73:1476-1486]. попередників еритроідного ряду. Якщо кількість Подальша робота показувала, що дві форми циркулюючих червоних кров'яних клітин більше, рецептора ЕРО (EPO-R), кодуються єдиним геном. ніж це необхідно для потреб у кисні нормальної Цей ген клонували [Див., н.р., Jones, et al. (1990) тканини, рівень ЕРО у крові зменшується. Blood 76, 31-35; Noguchi, et al. (1991) Blood Оскільки ЕРО є суттєвим у процесі утворення 78:2548-2556; Maouche, et al. (1991) Blood 78:2557червоних кров'яних клітин, цей гормон має потен2563]. Наприклад, послідовності ДНК і кодовані ційно корисний додаток, як у діагностиці, так й у ними послідовності білка EPO-R миші й людини лікуванні гематологічних захворювань, що харакописані в РСТ Pub. № WO 90/08822 to D'Andrea, et теризуються низьким або порушеним формуванal. Сучасні моделі пропонують, що сполучення ням червоних кров'яних клітин. Дослідження ЕРО з EPO-R призведе до димеризації й активації останніх років надали основу для прогнозу ефекдвох молекул EPO-R, що запускає подальші етапи тивності терапії ЕРО по ряду станів хвороб, розсигнальної трансдукції [див., н.р., Watowich, et al. ладів і порушень кровоносної системи, включаючи: (1992) Proc. Natl. Acad. Sci. USA 89:2140-2144]. бета-таласемію [див. Vedovato, et al. (1984) Acta. Доступність клонування генів EPO-R полегшує Haematol. 71:211-213]; кістозний фіброз [див. пошук агоністів й антагоністів цього важливого Vichinsky, et al. (1984) J. Pediatric 105:15-21]; вагітрецептора. Доступність рекомбінантного білка реність і порушення менструального циклу [див. цептора дозволяє вивчати взаємодії рецепторCotes, et al. (193) Brit. J. Ostet. Gyneacol. 90:304ліганд у ряді систем випадкової й напів-випадкової 311]; ранню підліткову анемію [див. Haga, et al. генерації розмаїтості пептидів. Такі системи міс(1983) Acta Pediatr. Scand. 72; 827-831]; ушкотять у собі систему "пептиди на плазміді" [описана дження спинного мозку [див. Claus-Walker, et al. в U.S. Pat. № 6270170]; систему "пептиди на бак(1984) Arch. Phys. Med. Rehabil. 65:370-374]; космітеріофагу" [описана в U.S. Pat. № 5432018 й чний політ [див. Dunn, et al. (1984) Eur. J. Appl. 7 92497 8 Cwirla, et al. (1990) Proc. Natl. Acad. Sci. USA посиланням є "передуючим винаходом" для дано87:6378-6382]; систему "синтетична бібліотека, що го винаходу. кодує, " ("encoded synthetic library", ESL ) [описана Короткий опис винаходу в патентному додатку США Ser. № 946239, подано Даний винахід являє собою нові пептидні спо16 вересня 1992 p.]; і систему "широкомасштабнолуки, які є агоністами EPO-R істотно збільшеної го синтезу імобілізованих полімерів" [описана в сили й активності. Ці пептидні сполуки є гомодиU.S. Pat. № 5143854; РСТ Pub. № 90/15070; Fodor, мерами мономерів пептиду, що має амінокислотну et al. (1991) Science 251:767-773; Dower and Fodor послідовність (AcG)GLYACHMGPIT(1(1991) Ann. Rep. Med. Chem. 26:271-180; і U.S. Pat. nal)VCQPLRK (SEQ ID NO: 1), або гомодимерами № 5424186]. мономерів пептиду, що має амінокислотну посліПептиди, які взаємодіють хоча б частиною довність (AcG)GLYACHMGPIT(1своєї протяжності з EPO-R, були ідентифіковані й nal)VCQPLR(MeG)K (SEQ ID NO: 2), гомодимераописані, наприклад, у патентах U.S. Pat. №-№ ми мономерів пептиду, що має амінокислотну пос5773569; 5830851; і 5986047 to Wrighton, et al.; лідовність (AcG)GLYACHMGPIT(1РСТ Pub. № WO 96/40749 to Wrighton, et al.; U.S. nal)VCQPLR(MeG) (SEQ ID NO: 3); де кожна аміноPat. № 5767078 й РСТ Pub. № 96/40772 to Johnson кислота позначена стандартним однобуквеним and Zivin; PCT Pub. № WO 01/38342 to Balu; і № скороченням, "(AcG)" позначає N-ацетилгліцин, WO 01/91780 to Smith-Swintosky, et al. "(1-nal)" позначає 1-нафтілаланін, і "(MeG)" познаЗокрема, була виявлена група пептидів, що чає N-метилгліцин, також відомий як саркозин. містять особливий мотив, учасники якої зв'язуютьКожен пептидний мономер димеру містить внутріся з EPO-R і стимулюють ЕРО-залежну клітинну шньомолекулярний дисульфідний зв'язок між запроліферацію. Ідентифіковані до теперішнього лишками цистеїну мономера. часу пептиди містять мотив, що стимулює ЕРОПептидні мономери можуть димеризуватися за залежну проліферацію клітин in vitro з величиною рахунок лінкера, ковалентно приєднаного третинЕС50 від близько 20 наномолей/л (нМ) до близько ного розгалужуючого аміду. Лінкер третинний амід 250 нМ. Таким чином, концентрація пептиду від 20 може бути зображений як: нМ до 250 нМ необхідна для стимуляції 50% від максимальної клітинної проліферації, стимульова-С1О-СН2-Х-СН2-С2Oної ЕРО. Всі інші пептиди й конструкції, які зв'язуються з рецептором ЕРО, описані в тимчасових де: X є NCO-(CH2)2-N1H-; атом С1 лінкера додатках U.S. Serial №-№ 60/470244, 60/470245, і утворює амідний зв'язок з -аміногрупою С60/469993, усі подані 12 травня 2003 p.; тимчасокінцевого залишку лізина першого пептидного мо2 вих додатках U.S. Serial №-№ 60/627432 й номера; атом С лінкера утворює амідний зв'язок з 60/627433, обидва подані 11 листопада 2004 p.; -аміногрупою С-кінцевого залишку лізина другого постійному додатку U.S. Serial № 310/844968, попептидного мономера; і атом Ν1 угрупування X дано 12 травня 2004 p.; і Міжнародні додатки Serial сполучений за допомогою карбаматного або амід№-№ PCT/US2004/14886 й PCT/US2004/014889, ного зв'язку із субодиницею активованого поліетиподані 12 травня 2004 p., опубліковані як WO ленгліколю (polyethylene glycol, PEG, ПЕГ), де ПЕГ 2004/101611 й WO 2004/101606, відповідно. Кожмає молекулярну масу приблизно від 20000 до ний із цих додатків включається тут у повному об40000 Дальтон (слово "приблизно" означає, що сязі посиланням. після одержання ПЕГ деякі його молекули важать Збільшення сили агоністів EPO-R, як для досбільше, а деякі менше, ніж встановлена молекуляліджень важливих біологічних активностей, опосерна маса). редкованих цим рецептором, так і для лікування У випадку, якщо кожен мономер гомодимера хвороб, залишає необхідність у виявленні пептимає амінокислотну послідовність да-агоніста EPO-R підвищеної сили й активності. (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: Даний винахід містить у собі такі сполуки. 1) і атом Ν1 лінкера сполучений карбаматним зв'яЦитування й/або обговорення наведених у зком із субодиницею активованого поліетиленгліцьому розділі й протягом усього даного тексту поколю (ПЕГ), нові пептидні сполуки згідно із даним силань запропоновано лише для того, щоб роз'ясвинаходом можуть бути представлені таким чинити опис даного винаходу, але не допускає тракном: тування, що який-небудь винахід з подібним 9 92497 10 У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1) і атом Ν1 лінкера сполучений амідним зв'язком із субодиницею активованого поліетиленгліколю, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2) і атом Ν1 лінкера сполучений карбамат ним зв'язком із субодиницею активованого поліетиленгліколю, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: 11 92497 12 У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2) і атом Ν1 лінкера сполучений амідним зв'язком із субодиницею активованого поліетиленгліколю, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: Пептидні мономери також можуть димеризуватися за рахунок лінкера, ковалентно приєднаного третинного розгалужуючого аміду. Лінкер третинний амід може бути зображений як: амідного зв'язку із субодиницею активованого поліетиленгліколю; і атом Ν2 спейсера сполучений за допомогою карбаматного або амідного зв'язку із субодиницею активованого поліетиленгліколю, де ПЕГ має молекулярну масу приблизно від 10000 до 50000 Дальтон (слово "приблизно" означає, що після одержання ПЕГ деякі його молекули важать більше, а деякі менше, ніж встановлена молекулярна маса). Кожна субодиниця ПЕГ може мати молекулярну масу, відповідно, 10000 Дальтон (10кДа), 20кДа, 30кДа, 40кДа, або 50кДа. У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1) і як Ν1 так й Ν2 атоми спейсера ковалентно сполучені карбаматним зв'язком із субодиницею активованого ПЕГ, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: -С1О-СН2-Х-СН2-С2Oде: X є NCO-(CH2)2-NH-C3O-; атом С1 лінкера утворює амідний зв'язок з -аміногрупою Скінцевого залишку лізина першого пептидного мономера; атом С лінкера утворює амідний зв'язок з -аміногрупою С-кінцевого залишку лізина другого пептидного мономера. Пептидний димер згідно із даним винаходом далі містить спейсерну ділянку наступної структури: -N1H-(CH2)4-C4H-N2Hде: атом С4 спейсера ковалентно пов'язаний з С угрупованням X; атом Ν1 спейсера ковалентно сполучений за допомогою карбаматного або 3 У переважних реалізаціях даного винаходу Скінцевий лізин двох пептидних мономерів є L лізином. Фахівцям у даній галузі з вищевказаних хімічних структур також будуть розпізнаватися ті, 13 92497 14 у яких дві лінійні субодиниці ПЕГ сполучені за переважна L-форма лізина, викликаючи наступну допомогою лізина (наприклад, як mPEG2-Lysстереохімію сполуки. NHS або як mPEG2-Lysinol-NPC), у яких також Крім того, одним або більше із залишків лізина може бути D-лізин, що викликає альтернативну стереохімію, що може бути легко розпізнана фахівцями в даній галузі. У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність, (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1) і як атом N1, так й атом N2 спейсера ковалентно сполучені амідним зв'язком із субодиницею активованого ПЕГ, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: Крім того, переважно всі молекули лізина в цій сполуці є L-лізином, викликаючи наступну стереохімію. 15 92497 16 Крім того, один або більше із залишків лізина може бути D-лізином, який викликає альтернативну стереохімію, що може бути легко розпізнана фахівцями в даній галузі. У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність, (AcG)GLYACHMGPIT(1 nal)VCQPLR(MeG)K (SEQ ID NO: 2) і як атом N1, так й атом N2 спейсера ковалентно сполучені карбаматним зв'язком із субодиницею активованого ПЕГ, де Υ є карбаматною групою, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: Переважно всі залишки лізина, що поєднують пептидні мономери й лінійні субодиниці ПЕГ у цій молекулі, є L-лізином, викликаючи наступну стереохімію. Крім того, один або більше із залишків лізина може бути D-лізином, який викликає альтернативну стереохімію, що може бути легко розпізнана фахівцями в даній галузі. У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність, (AcG)GLYACHMGPIT(1 nal)VCQPLR(MeG)K (SEQ ID NO: 2) і як атом N1, так й атом N2 спейсера ковалентно сполучені амідним зв'язком із субодиницею активованого ПЕГ, де Υ є карбаматною групою, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: 17 92497 18 Переважно всі залишки лізина, що поєднують пептидні мономери й лінійні субодиниці ПЕГ у цій молекулі, є L-лізином, викликаючи наступну стереохімію. В іншій реалізації даного винаходу, один або більше із залишків лізина може бути D-лізином, який викликає альтернативну стереохімію, що може бути легко розпізнана фахівцями в даній галузі. Пептидні мономери також можуть димеризуватися додаванням лізинового лінкера за допомогою чого один мономер пептиду сполучений своїм С-кінцем з -аміногрупою лізина й другий пептидний мономер сполучений своїм С-кінцем з -аміногрупою лізина. Пептидний димер згідно із даним винаходом далі має спейсерну ділянку наступної структури: -N1H-(CH2)2-O-(CH2)2-O-(CH2)2-N2H На одному кінці спейсера атом Ν1 сполучений амідним зв'язком з карбонільним вуглецем лізинового лінкера. На протилежному кінці спейсера атом Ν2 сполучений карбаматим або амідним зв'язком із субодиницею активованого поліетиленгліколю, де ПЕГ має молекулярну масу приблизно від 20000 до 40000 Дальтон (слово "приблизно" означає, що після одержання ПЕГ деякі його молекули важать більше, а деякі менше, ніж встановлена молекулярна маса). Спейсер сполучений карбаматним зв'язком із субодиницею активованого поліетиленгліколю (ПЕГ), нові пептидні сполуки згідно із даним винаходом (SEQ ID NO: 3) можуть бути представлені таким чином: Спейсер сполучений амідним зв'язком із субодиницею активованого ПЕГ, нові пептидні спо луки згідно із даним винаходом (SEQ ID NO: 3) можуть бути представлені таким чином: Винахід містить у собі способи лікування різних медичних станів з використанням подібних пептидних речовин. Способи включають лікування пацієнта, що має розлади, які характеризуються недоліком еритропоетина або низьким чи недостатнім рівнем червоних кров'яних клітин шляхом призначення пацієнтові терапевтично ефективної кількості одних з вищевказаних речовин. У певних реалізаціях даного винаходу, розлад являє собою кінцеву стадію ниркової недостатності або діалізу; пов'язану зі СНІДом анемію, аутоімунні захворювання або злоякісну пухлину; 19 92497 20 бета-таласемію; кістозний фіброз; ранню підлітлотних залишків. Найбільш переважна довжина кову анемію; анемію, пов'язану із хронічним завід 17 до 40 амінокислотних залишків. Поліпеппальним захворюванням; ушкодження спинного тид, у порівнянні з пептидом, може включити мозку; гостре недокрів'я; старіння; або стану пухбудь-яку кількість амінокислотних залишків. Отлинних захворювань, що супроводжуються поруже, термін «поліпептид» містить у собі пептиди, а шеннями кровотворення. Крім того, у деяких реатакож більше довгі амінокислотні послідовності. лізаціях даного винаходу, розлад являє собою Використовувана в даному тексті, характериниркову недостатність або діаліз, і терапевтично стика "фармацевтично прийнятний" відноситься ефективна кількість відповідає дозуванню від до речовин і складів, які "зазвичай вважаються 0,025 до 0,2 міліграмів речовини на 1 кілограм безпечними", наприклад, тим, що є фізіологічно ваги тіла пацієнта. В інших реалізаціях даного прийнятними й зазвичай при призначенні їх лювинаходу, розлад являє собою ниркову недостадині не викликають алергійних або аналогічних тність або діаліз, і терапевтично ефективна кільнебажаних реакцій, таких як розлад шлунка, закість відповідає дозуванню від 0,05 до 0,1 мілігпаморочення тощо. Термін "фармацевтично прирамів речовини на 1 кілограм ваги тіла пацієнта. йнятний" у даному тексті переважно означає У деяких реалізаціях даного винаходу, розлад є схвалення повноважним агентством Федеральноанемією, пов'язаною із злоякісною пухлиною, і го уряду або уряду штату США, або знаходження терапевтично ефективна кількість відповідає доречовини або складу в U.S. Pharmacopeia, або зуванню від 0,075 до 0,5 міліграмів речовини на 1 іншої загальновизнаної фармакопеї, що дозволяє кілограм ваги тіла пацієнта. В інших реалізаціях їхнє використання на тваринах, і особливо на даного винаходу, розлад є анемією, зв'язаною зі людях. Термін "носій" відноситься до розчинника, злоякісною пухлиною, і терапевтично ефективна ад'юванта, наповнювача, або транспортера, ракількість відповідає дозуванню від 0,2 до 0,4 мілізом з яким призначається склад. Таким фармаграмів речовини на 1 кілограм ваги тіла пацієнта. цевтичним носієм можуть бути стерильні рідини, Терапевтично ефективне дозування може призтакі як вода й масло, включаючи масла нафтовоначатися один раз у период від 3 до 4 тижнів. го, тваринного, рослинного або синтетичного поВинахід також містить у собі фармацевтичні ходження, такі як арахісове масло, соєве масло, склади, що містять подібні пептидні речовини. У мінеральне масло, кунжутне масло тощо. Як носії деяких реалізаціях даного винаходу ПЕГ має мопереважно застосовані вода або водні розчини, лекулярну масу близько 20000 Дальтон. В інших сольові розчини й водні розчини декстрози й гліреалізаціях даного винаходу, фармацевтичний церину, особливо в розчинах для ін'єкцій. Придасклад включає кожне з вищезгаданих речовин і тні фармацевтичні носії описані в "Remington's фармацевтично прийнятний носій. Pharmaceutical Sciences" за редакцією E.W. Докладний опис винаходу Martin. Визначення: У даному тексті термін "агоніст" відноситься Амінокислотні залишки в пептидах скорочені до біологічно активного ліганду, що сполучається таким чином: фенілаланін - Phe або F; лейцин зі своїм відповідним біологічно активним рецепLeu або L; ізолейцин - IIе або І; метіонін - або М; тором й активує останній, викликаючи біологічну валін - Val або V; серин - Ser або S; пролін - Pro відповідь рецептора, або підвищуючи попередню або Р; треонін - Thr або Т; аланін - Ala або А; тибіологічну активність рецептора. розин - Туr або Y; гістидин - His або Н; глутамін Нові пептиди, що ε агоністами EPO-R Gln або Q; аспарагін - Asn або N; лізин - Lys або Даний винахід являє собою нові пептидні K; аспарагінова кислота - Asp або D; глутамінова сполуки, які є агоністами EPO-R істотно збільшекислота - Glu або Е; цистеїн - Cys або С; триптоної сили й активності. Ці пептидні сполуки є гофан - Тrр або W; аргінін - Arg або R; і гліцин - Gly модимерами мономерів пептиду, що має аміноабо G. Неканонічні амінокислоти в пептидах скокислотну послідовність (AcG)GLYACHMGPIT(1рочені таким чином: 1-нафтілаланін - 1-nal або nal)VCQPLRK (SEQ ID NO: 1), або гомодимерами Np; N-метилгліцин (так званий саркозин), - MeG мономерів пептиду, що має амінокислотну посліабо Sc; і ацетильований гліцин (N-ацетилгліцин) довність (AcG)GLYACHMGPIT(1AcG. nal)VCQPLR(MeG)K (SEQ ID NO: 2), гомодимеВикористовувані в даному тексті, терміни рами мономерів пептиду, що має амінокислотну "поліпептид" або "білок" відносяться до полімеру, послідовність (AcG)GLYACHMGPIT(1що складається з амінокислотних мономерів, у nal)VCQPLR(MeG) (SEQ ID NO: 3); де кожна аміякому альфа амінокислоти сполучені разом за нокислота позначена стандартним однобуквеним допомогою пептидного зв'язку. Отже, поліпептиди скороченням, "(AcG)" позначає N-ацетилгліцин, мають у довжину, щонайменше, два амінокисло"(1-nal)" позначає 1-нафтілаланін, і "(MeG)" позтних залишки, але зазвичай більш довгі. Зазвиначає N-метилгліцин, також відомий як саркозин. чай, термін "пептид" відноситься до поліпептиду, Кожен пептидний мономер димера містить внутщо має у довжину тільки кілька амінокислотних рішньомолекулярний дисульфідний зв'язок між залишків. Нові пептиди агоністи EPO-R, що відзалишками цистеіна мономера. Такі мономери носяться до даного винаходу, мають у довжину можуть бути схематично зображені таким чином: переважно не більш ніж приблизно 50 амінокис 21 Пептидні мономери димеризовані, що забезпечує пептидному димеру підвищену активність як агоніста EPO-R. Лінкерна ділянка (LK) являє собою розгалужуючий третинний амід, що сполучає С-кінці двох мономерів, одночасно приєднуючись до С-кінцевих залишків лізина кожного мономера. Лінкерний третинний амід може бути зображений як -С1О-СН2-Х-СН2-С2Oде: X є NCO-(CH2)2-N1H-; атом С1 лінкера утворює амідний зв'язок з -аміногрупою Скінцевого залишку лізина першого пептидного мономера; атом С2 лінкера утворює амідний зв'язок з -аміногрупою С-кінцевого залишку лізина другого пептидного мономера; і атом Ν1 угрупування X сполучений за допомогою карбаматного або амідного зв'язку із субодиницею активованого поліетиленгліколю (polyethylene glycol, ПЕГ), де ПЕГ має молекулярну масу приблизно від 20000 до 40000 Дальтон (слово "приблизно" означає, що після одержання ПЕГ деякі його молекули важать більше, а деякі менше, ніж встановлена молекулярна маса). Лінкерний третинний амід також може бути зображений як: -С1О-СН2-Х-СН2-С2Oде: X є NCO-(CH2)2-NH-C3O-; атом С1 лінкера утворює амідний зв'язок з -аміногрупою Скінцевого залишку лізина першого пептидного мономера; атом С2 лінкера утворює амідний зв'язок з -аміногрупою С-кінцевого залишку лізина другого пептидного мономера. Пептидний димер згідно із даним винаходом далі містить спейсерну ділянку наступної структури: -N1H-(CH2)4-C4H-N2Hде: атом С4 спейсера ковалентно пов'язаний з С угрупування X; атом N1 спейсера ковалентно сполучений за допомогою карбаматного або амідного зв'язку із субодиницею активованого поліетиленгліколю; і атом N2 спейсера сполучений за допомогою карбаматного або амідного зв'язку із субодиницею активованого поліетиленгліколю, де ПЕГ має молекулярну масу приблизно від 10000 до 60000 Дальтон (слово "приблизно" означає, що після одержання ПЕГ деякі його молекули важать більше, а деякі менше, ніж встановлена молекулярна маса). Таким чином, нові пептиди згідно із даним винаходом також можуть містити субодиницю ПЕГ, що ковалентно сполучена карбаматним або амідним зв'язком із третинноамідним лінкером пептидного димера. ПЕГ є фармацевтично прийнятним водорозчинним полімером. ПЕГ, викори3 92497 22 стовуваний у даному винаході, може бути лінійним, нерозгалуженим поліетиленгліколем, що має молекулярну масу від приблизно 20 кілодальтон (20кДа), до приблизно 60кДа (слово "приблизно" означає, що після одержання ПЕГ деякі його молекули важать більше, а деякі менше, ніж встановлена молекулярна маса). Найбільш переважно ПЕГ має молекулярну масу в інтервалі від 30кДа до 40кДа. Фахівець у даній галузі може вибрати бажаний розмір полімеру, ґрунтуючись на таких міркуваннях, як бажане дозування; час циркуляції в крові; стійкість до протеолізу; ефективність, якщо вона є, біологічна активність; простота в застосуванні; ступінь або відсутність антигенності; і інші відомі ефекти впливу ПЕГ на терапевтичний пептид. Пептиди, димери пептидів й інші молекули, що ґрунтуються на пептидах даного винаходу можуть бути пришиті до водорозчинних полімерів (наприклад, ПЕГ) з використанням кожної з ряду хімічних реакцій, що дозволяють сполучити водорозчинний полімер(и) з рецепторзв'язуючою частиною молекули (наприклад, пептид+спейсер). У типовій реалізації даного винаходу застосовують єдину зшивку для ковалентної сполуки водорозчинного полімера(ів) з рецепторзв'язуючою частиною молекули, однак в альтернативних реалізаціях винаходу можуть бути використані множинні зшивки, включаючи подальші варіанти, в яких інший вид водорозчинного полімеру(ів) сполучений з рецепторзв'язуючою частиною іншими зшивками, які можуть включати ковалентні зв'язки зі спейсером й/або, з однією або обома пептидними ланцюгами. У деяких реалізаціях даного винаходу, димер або мультимер більш високого порядку містить різні види пептидних ланцюгів (тобто, гетеродимер або гетеромультимер). Винятково як приклад, але не обмеження, димер може включати перший пептидний ланцюг, до якого приєднаний ПЕГ і другий пептидний ланцюг, у якого можуть бути відсутні сполуки з ПЕГ або використовується інший спосіб зв'язку, ніж на першому пептидному ланцюзі, і в деяких варіантах реалізації винаходу спейсер може або містити, або не мати сполуки з ПЕГ, і вищезгаданий спейсер, у випадку зв'язку з поліетиленгліколем, може використати інший тип зв'язку, ніж спосіб зв'язку першого й/або другого пептидного ланцюга. Альтернативна реалізація даного винаходу припускає ПЕГ, що сполучений зі спейсерною частиною рецепторзв'язуючої частини й інший водорозчинний полімер (наприклад, вуглевод), сполучений з бічним ланцюгом однієї з амінокислот пептидної частини молекули. Широкий ряд видів поліетиленгліколю може бути використаний для навішування ПЕГ на рецепторзв'язуючу частину (пептиди+спейсер). Власне кажучи, може бути використаний будь 23 92497 24 який придатний реакційноздатний реагент ПЕГ. У лентно сполучені карбаматними або амідними переважних реалізаціях даного винаходу, викозв'язками зі спейсерною субодиницею, що сполуристання реакційноздатного реагенту ПЕГ призчена із третинноамідним лінкером пептидного водить до утворення карбаматного або амідного димера. Кожна із двох субодиниць ПЕГ, що викозв'язку з рецепторозв'язуючою частиною молекуристовується у подібних реалізаціях даного винали. Придатні реакційноздатні види ПЕГ включаходу, може бути лінійною, вони можуть бути споють, але не обмежуються, комерційно доступні лучені разом у єдиній крапці прикріплення. Кожна види по каталогах Drug Delivery Systems catalog субодиниця ПЕГ, що використовується в даному (2003) корпорації NOF (Yebisu Garden Place винаході, має бажану молекулярну масу від приTower, 20-3 Ebisu 4-chome, Shibuya-ku, Tokyo близно 10 кілодальтон (20кДа), до приблизно 150-6019) і Molecular Engineering catalog (2003) 60кДа (слово "приблизно" означає, що після одевід Nektar Therapeutics (490 Discovery Drive, ржання ПЕГ деякі його молекули важать більше, Huntsville, Alabama 35806). Для прикладу, але не а деякі менше, ніж встановлена молекулярна для обмеження, наведені подальші реактиви помаса). Особливо переважні лінійні субодиниці ліетиленгліколю, що часто є переважними в різПЕГ. Найбільш бажано, щоб кожна із двох субоних реалізаціях даного винаходу: mPEG2-NHS, диниць ПЕГ мала молекулярну масу в інтервалі mPEG2-ALD, multi-Arm PEG, mPEG(MAL)2, від 20кДа до 40кДа, а ще більш бажано - в інтерmPEG2(MAL), mPEG-NH2, mPEG-SPA, mПЕГвалі від 30кДа до 40кДа. Фахівець у даній галузі SBA, mПЕГ-тиоефіри, mPEG-подвійні ефіри, може вибрати бажаний розмір полімеру, ґрунтуmPEG-BTC, mPEG-ButyrALD, mPEG-ACET, гетеючись на таких міркуваннях, як бажане дозуванрофункціональні поліетиленгліколі (NH2-PEGня; час циркуляції в крові; стійкість до протеолізу; COOH, Boc-PEG-NHS, Fmoc-PEG-NHS, NHSефективність, якщо вона є, біологічна активність; PEG-VS, NHS-PEG-MAL), акрілати поліетиленгліпростота в застосуванні; ступінь або відсутність колю (ACRL-PEG-NHS), ПЕГ-фосфоліпіди (наантигенності; і інші відомі ефекти впливу ПЕГ на приклад, mPEG-DSPE), багатофункціональні хітерапевтичний пептид. мічно активовані, на вибір фахівців у даній галузі, Даний винахід також включає пептидиполіетиленгліколі серії SUNBRITE, включаючи агоністи, які є гомодимерами пептидних мономесерію GL, що ґрунтується на гліцерині, кожної з рів, що мають амінокислотну послідовність активованих поліетиленгліколей SUNBRITE (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) (SEQ (включаючи, але не обмежуючись, карбоксилID NO: 3); де кожна амінокислота позначена стаПЕГ, p-ΝΡ-ΠΕΓ, трезіл-ПЕГ, альдегід-ПЕГ, ацендартним однобуквеним скороченням, "(AcG)" таль-ПЕГ, аміно-ПЕГ, тіол-ПЕГ, малеімідо-ПЕГ, позначає N-ацетилгліцин, "(1-nal)" позначає 1гідроксил-ПЕГ-амін, аміно-ПЕГ-СООН, гідроксилнафтілаланін, і "(MeG)" позначає N-метилгліцин, ПЕГ-альдегід, ПЕГ типу кислотного ангідриду, також відомий як саркозин. Кожен пептидний мофункціональні ПЕГ-фосфоліпіди, і інші аналогічні номер димера містить внутрішньомолекулярний й/або придатні реактиви ПЕГ, які можуть бути дисульфідний зв'язок між залишками цистеіна обрані фахівцями в даній галузі для їхнього конкмономера. Такі мономери можуть бути схематичретного застосування й використання. но представлені таким чином: Нові пептиди згідно із даним винаходом також можуть містити дві субодиниці ПЕГ, які кова Ці мономерні пептиди сполучені таким чином, що утворять пептидний димер з підвищеною активністю як агоніста EPO-R. Лінкерна субодиниця (LK) являє собою залишок лізина, що сполучає Скінці двох пептидних мономерів, одночасно зв'язуючись із С-кінцевими амінокислотами кожного мономера. Перший пептидний мономер сполуче ний своїм С-кінцем з -аміногрупою лізина й другий пептидний мономер також сполучений своїм С-кінцем з -аміногрупою лізина. Наприклад, подібний димер може бути відбитий структурною формулою І і схематично - формулою II: 25 У формулах І й II, N означає атом азоту аміногрупи лізина й N1 означає атом азоту аміногрупи лізина. Пептидний димер згідно із даним винаходом далі містить спейсерну ділянку наступної структури: -N1H-(CH2)2-O-(CH2)2-O-(CH2)2-N2HНа одному кінці атом N1 спейсера ковалентно сполучений за допомогою карбаматного або амідного зв'язку із субодиницею активованого поліетиленгліколю; На протилежному кінці атом N2 спейсера сполучений за допомогою карбаматного або амідного зв'язку із субодиницею активованого поліетиленгліколю, де ПЕГ має молекулярну масу приблизно від 10000 до 60000 Дальтон (слово "приблизно" означає, що після одержання ПЕГ деякі його молекули важать більше, а деякі менше, ніж встановлена молекулярна маса). Переважно ПЕГ має молекулярну масу від 20000 до 40000 Дальтон. Таким чином, пептиди, що відносяться до даного винаходу містять ПЕГ-субодиницю, що ковалентно пов'язана з пептидним димером. ПЕГ є фармацевтично прийнятним водорозчинним по У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1) і атом Ν1 лінкера ковалентно сполучений 92497 26 лімером. ПЕГ, що використовується у даному винаході, може бути лінійним, нерозгалуженим поліетиленгліколем, що має молекулярну масу від приблизно 20 кілодальтон (20кДа), до приблизно 60кДа (слово "приблизно" означає, що після одержання ПЕГ деякі його молекули важать більше, а деякі менше, ніж встановлена молекулярна маса). Найбільш бажано, щоб ПЕГ мав молекулярну масу в інтервалі від 20кДа до 40кДа, а ще більш бажано, щоб ПЕГ мав молекулярну масу в інтервалі від 30кДа до 40кДа. Фахівець у даній галузі може вибрати бажаний розмір полімеру, ґрунтуючись на таких міркуваннях, як бажане дозування; час циркуляції в крові; стійкість до протеолізу; ефективність, якщо вона є, біологічна активність; простота в застосуванні; ступінь або відсутність антигенності; і інші відомі ефекти впливу ПЕГ на терапевтичний пептид. У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1) і атом Ν1 лінкера ковалентно сполучений карбаматним зв'язком із субодиницею активованого ПЕГ, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: амідним зв'язком із субодиницею активованого ПЕГ, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: 27 92497 28 У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2) і атом Ν1 лінкера ковалентно сполуче ний карбаматним зв'язком із субодиницею активованого ПЕГ, нові пептидні сполуки згідно із даним винаходом можуть бути представлені в таким чином: У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2) і атом Ν1 лінкера ковалентно сполуче ний амідним зв'язком із субодиницею активованого ПЕГ, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: 29 92497 30 Переважні пептидні димери відповідно до даного винаходу включають, але не обмежуються: 31 92497 32 33 92497 34 35 У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1) і як Ν1, так й Ν2 атоми спейсера ковалент 92497 36 но сполучені карбаматним зв'язком із субодиницею активованого ПЕГ, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: 37 92497 38 У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1) і як Ν1, так й Ν2 атоми спейсера ковалент но сполучені амідним зв'язком із субодиницею активованого ПЕГ, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2) і як Ν1, так й Ν2 атоми спейсера ковале нтно сполучені карбаматним зв'язком із субодиницею активованого ПЕГ, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: У випадку, якщо кожен мономер гомодимера має амінокислотну послідовність (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2) і як Ν1, так й Ν2 атоми спейсера ковале нтно сполучені амідним зв'язком із субодиницею активованого ПЕГ, нові пептидні сполуки згідно із даним винаходом можуть бути представлені таким чином: 39 92497 40 Переважні пептидні димери відповідно до даного винаходу включають, але не обмежуються: 41 92497 42 43 92497 44 45 92497 46 47 92497 48 49 92497 50 51 92497 52 Спейсер сполучений карбаматним зв'язком із субодиницею активованого поліетиленгліколю (ПЕГ), нові пептидні сполуки згідно із даним ви находом (SEQ ID NO: 3) можуть бути представлені таким чином: Спейсер сполучений амідним зв'язком із субодиницею активованого поліетиленгліколю (ПЕГ), нові пептидні сполуки згідно із даним ви находом (SEQ ID NO: 3) можуть бути представлені таким чином: Така структура димера може бути записана [Ac-пептид, дисульфідний місток]2Lys-спейсер ПЕГ20-40кД, де позначені ацетильовані на N-кінці пептиди, пов'язані з обома, і і -аміногрупами 53 92497 54 лізина відповідно, що містять внутрішньомолекулізина й субодиницею ПЕГ, що має молекулярну лярні дисульфідні зв'язки, і молекула спейсера, масу приблизно від 20000 до 40000 Дальтон. що утворює ковалентний зв'язок між С-кінцем Переважні пептидні димери зі складу даного винаходу включають, але не обмежуються: Стереоізомери двадцяти стандартних амінокислот (наприклад, D-амінокислоти), що не зустрічаються в природі амінокислоти, такі як , двузаміщені амінокислоти, N-алкілиамінокислоти, молочна кислота, і інші неканонічні амінокислоти також можуть бути придатними компонентами сполук, що відносяться до даного винаходу. Приклади неканонічних амінокислот включають, але не обмежуються: -аланін, 3піридилаланін, 4-гідроксипролін, О-фосфосерин, N-метилгліцин, N-ацетилсерин, Nформілметионін, 3-метилгістидин, 5гідроксилізин, nor-лейцин, і інші аналогічні амінокислоти й імінокислоти. Також можливі інші мо 55 92497 56 дифікації, включаючи модифікації N- і С-кінців, В іншій реалізації даного винаходу два пепзаміна однієї або більше із природних генетично тидних мономери можуть бути синтезовані безкодованих амінокислот на неканонічні амінокиспосередньо на двох реакційноздатних азотомістлоти, модифікації бічного ланцюга одного або ких групах лінкерної субодиниці LK з варіацією більше амінокислотних залишків, фосфорилутехніки твердофазного синтезу. Такий синтез вання пептиду, тощо. може бути послідовним або одночасним. У цій Послідовності пептидів зі складу даного виреалізації даного винаходу лізинова субодиниця находу являють собою тільки зазначені послідовлінкера (LK) має дві аміногрупи, здатні служити ності або їхні аналоги, доповнені пептидами на Nсайтами ініціації для синтезу пептиду й третю кінці й/або на С-кінці. Подібними доповненнями функціональну групу (наприклад, карбоксильну можуть служити послідовності, що кодують пригрупу лізина; або аміногрупу аміду лізина, карбородні пептиди, додатково розширені послідовноксильна група залишку лізина в якому перетвостями неприродного походження або в значній рена в амідогрупу CONH2), що здатна сполучатимірі без таких; доповнення можуть включити ся з іншою молекулярною субодиницею (яка, будь-які вставки, делеції, точкові мутації або інші наприклад, може бути присутньою на поверхні модифікації послідовності або їхньої комбінації за твердого носія). бажанням фахівця в даній галузі. Для прикладу, У випадку якщо провадиться послідовний сиале не для обмеження, природно виниклі послінтез ланцюгів пептидного димера на лінкері, дві довності можуть бути повнорозмірними або частфункціональні аміногрупи в молекулі лінкера закової довжини й можуть включати амінокислотні хищають двома іншими незалежно видаляємими заміни, що забезпечують сайти приєднання вугамінозахисними групами. Захищений лінкер полеводів, ПЕГ, інших полімерів, або тому подібнов'язаний із твердим носієм за допомогою третьої го за допомогою сполуки з бічним ланцюгом. Як функціональної групи лінкера. Першу амінозахиваріант, амінокислотні заміни приводять до гумасну групу видаляє і синтезує перший пептид динізованої послідовності, що є сумісною з людсьмера на першій реакційноздатній аміногрупі. Покою імунною системою. Передбачено злиті білки тім видаляють другу амінозахисну групу й всіх типів, включаючи послідовності імуноглобусинтезують другий пептид димера на другій реалінів, що лежать безпосередньо близько до EPOкційноздатній аміногрупі. Наприклад, перша аміR активуючої послідовності даного винаходу або ногрупа лінкера може бути захищена групою Alloc суміжні з нею за участю або без послідовності (алілоксикарбоніл), а друга - захищена групою неімуноглобулінового спейсера. Одним з типів Fmoc (флуоренілметилоксикарбоніл). У цьому реалізації даного винаходу є імуноглобуліновий випадку, група Fmoc (але не група АНос), може ланцюг, що має EPO-R активуючу послідовність бути вилучена обробкою м'якою основою [напризамість варіабельного регіону (V) важкого й/або клад, 20% пиперидином у диметилформаміді легкого ланцюга. (DMF)], після чого синтезують перший пептидний Одержання пептидів, що відносяться до даланцюг. Потім за допомогою придатних реагентів ного винаходу: [наприклад, Рd(РРh3)/4-метил морфолін і хлороСинтез пептидів форм] можна видалити групу Аllос і синтезувати Пептиди, що відносяться до даного винаходу, другий пептидний ланцюг. Слід зазначити, що можуть бути отримані за допомогою класичних для цистеіна повинні бути використані різні тіолспособів, відомих у даній галузі. Ці стандартні захисні групи, щоб керувати утворенням дисульметоди включають повністю твердофазний синфідних зв'язків (як обговорюється нижче), дана тез, способи частково твердофазного синтезу, технологія повинна використовуватися, навіть конденсацію фрагментів, класичний синтез у розякщо кінцеві амінокислотні послідовності пептидчині, і технологію рекомбінантних ДНК [див., наних ланцюгів димера ідентичні. У випадку, якщо приклад, Merrifield J. Am. Chem. Soc. 1963 провадиться одночасний синтез ланцюгів пепти85:2149]. дного димера на лінкері, дві функціональні аміноВ одній реалізації даного винаходу пептидні групи в молекулі лінкера захищають двома однамономери димера синтезуються окремо й димеково видаляємими амінозахсниими групами. ризуються після завершення синтезу. Захищений лінкер пов'язаний із твердим носієм В іншій реалізації даного винаходу пептидні за допомогою третьої функціональної групи лінмономери димера сполучені через їхні С-кінці за кера. У цьому випадку одночасно знімається задопомогою лінкерної субодиниці LK третинного хист із двох захищених функціональних груп морозгалужуючого аміду, що має дві функціональні лекули лінкера, і два пептидні ланцюги групи, здатні сайтами ініціації для синтезу пептиодночасно синтезують на реакційноздатних груду, і третю функціональну групу (наприклад, карпах. Слід зазначити, що, застосовуючи даний боксильну групу або аміногрупу), що здатна споспосіб, одержують ідентичні послідовності пептилучатися з іншою молекулярною субодиницею дних ланцюгів димера, і використовують однакові (яка, наприклад, може бути присутньою на поветіолзахисні групи для залишків цистеіна. рхні твердого носія). У цьому випадку, два пептиПереважний спосіб пептидного синтезу - тведних мономери можна синтезувати безпосередрдофазний синтез. Процедура твердофазного ньо на двох реакційноздатних азотомістких синтезу добре відома в даній галузі техніки [див., групах лінкерної субодиниці LK з варіацією техніки наприклад, Stewart Solid Phase Peptide Syntheses твердофазного синтезу. Такий синтез може бути (Freeman and Co.: San Francisco) 1969; 2002/2003 послідовним або одночасним. General Catalog from Novabiochem Corp, San Diego, USA; Goodman Synthesis of Peptides and 57 92497 58 Peptidomimetics (Houben-Weyl, Stuttgart) 2002]. У (Pbf), 4-метокси-2,3,6-триметил-бензензульфоніл твердофазному синтезі, синтез зазвичай почи(Mtr) або Вос. Захисні групи для бічного ланцюга лізина включають Cbz, 2нають із С-кінця пептиду з використанням хлоробензилоксикарбоніл (2-Cl-Cbz), 2амінозахисної смоли. Придатний вихідний матебромобензилоксикарбоніл (2-Br-Cbz), Tos або ріал може бути підготовлений, наприклад, приєдВос. нуючи необхідну -амінокислоту до хлорметилоПісля видалення захисту з -аміногрупи, інші ваної смоли, гідроксиметилованої смоли, захищені амінокислоти покроково додають у баполістирольної смоли, бензидріламінової смоли, жаному порядку. Кожну захищену амінокислоту або тому подібне. Одна така хлорметильована зазвичай вводять у реакцію приблизно в трикратсмола продається під фірмовою назвою ΒΙΟному надлишку, використовуючи підходящий акBEADS SX-1 від Віо Rad Laboratories (Richmond, тиватор карбоксильної групи, як, наприклад, 2CA). Підготовка гідрокиметилованої смоли опи(1Н-бензотриазол-1-іл)-1,1,3,3 тетраметилсечосана в [Bodonszky, et al. (1966) Chem. Ind. London вини гексафлуорофосфат 2-(1H-benzotriazol-1-yl)38:1597]. Бензидріламінова смола (ВНА) описана l, 1,3,3 tetramethyluronium hexafluorophosphate в [Pietta and Marshall (1970) Chem. Commun. 650], (HBTU) або дициклогексилкарбодиімід її гідрохлоридна форма комерційно доступна в (dicyclohexylcarbodimide, DCC) розчинений, наBeckman Instruments, Inc. (Palo Alto, CA). Наприприклад, у метиленхлориді (СН2Сl2), N-метил клад, амінозахищена -амінокислота може бути піролідоні, диметилформаміді (dimethyl пов'язана із хлорметилованою смолою за допоformamide, DMF), або їхньої суміші. Після того, як могою каталізатора бікарбонату цезію, відповідно синтез бажаної амінокислотної послідовності будо методу, описаного Gisin (1973) Helv. Chim. де завершений, бажаний пептид звільняють від Acta 56:1467. несучої смоли після обробки відповідним реагенПісля утворення початкового зв'язку, з том, таким як трифтороцтова кислота або фтороаміногрупи видаляють захист, наприклад, виководень HF, які не тільки відокремлюють пептид ристовуючи розчини в органічних розчинниках від смоли, але також знімають інші захисні групи трифтороцтової кислоти (trifluoroacetic acid, TFA) з бічних ланцюгів. У випадку використання хлорабо хлороводневої кислоти (НСІ) при кімнатній метилованої смоли, обробка фтороводнем призтемпературі. Відповідно до цього, амінокислоти із водить до утворення вільного пептиду у формі захищеною, -аміногрупою послідовно приєднукислоти. У випадку використання бензидріламіють до пов'язаного з носієм зростаючого пептиднової смоли обробка фтороводнем призводить ного ланцюга. Захисні групи для -аміногруп є до утворення вільного пептиду у формі аміду. будь-якими, які можуть бути використані в галузі Навпаки, у випадку використання хлорметиловапокрокового синтезу пептидів, включаючи: захисної смоли пептид із захищеними групами бічних ні групи ацильного типу (наприклад, форміл, ланцюгів можна зняти за допомогою обробки трифторацетил, ацетил), захисні групи типу аросмоли аміаком, і таким чином одержати бажаний матичних уретанів [наприклад, бензилоксикарбіамід із захищеними бічними ланцюгами, або алнол (Cbz) і заміщені Cbz], захисні групи типу алікіламіном, таким чином одержати алкіламіди або фатичних уретанів [наприклад, третдиалкіламіди із захищеними бічними ланцюгами. бутилоксикарбоніл (Вос), ізопропілоксикарбоніл, Захист із бічних ланцюгів потім видаляють звициклогексилоксикарбоніл], і захисні групи алкільчайним способом за допомогою фтороводню, ного типу (наприклад, бензил, трифенілметил), одержуючи вільні аміди, алкіламіди, або диалкіфлуоренілметилоксикарбоніл (Fmoc), алілоксиламіди. карбоніл (Alloc), і 1-(4,4-диметил-2,6При одержанні складних ефірів відповідно до диокоциклогекс-1-іліден)етил (Dde). даного винаходу, застосовують смолу для одерГрупи, що захищають бічний ланцюг, (зазвижання пептиду у формі кислоти, і пептид із захичай прості й складні ефіри, тритил, РМС, тощо), щеними бічними ланцюгами відщеплюють за дозалишаються інтактними протягом утворення помогою підстави й підходящого спирту зв'язку й не відщеплюються ні в процесі зняття (наприклад, метанолу). Захисні групи бічних ланзахисту з амінокінцевої групи, ні під час утворенцюгів потім видаляють звичайним способом, обня зв'язку. Захисна група для бічного ланцюга робкою фтороводнем, і одержують бажаний повинна бути відщеплюючою після завершення складний ефір. синтезу кінцевого пептиду й при умовах реакції, Ці процедури також можуть бути використані які не впливають на одержуваний пептид. Захисні для того, щоб синтезувати пептиди, у яких присугрупи для бічного ланцюга тирозину включають тні інші амінокислоти, крім двадцяти природного тетрагідропіраніл, трет-бутил, тритил, бензил, походження, у них в одному, двох або більше Cbz, Z-Br-Cbz, і 2,5-дихлорбензил. Захисні групи положеннях будь-якої із сполук даного винаходу для бічного ланцюга аспарагінової кислоти вклюзамінені генетично кодуємі амінокислоти. Синтечають бензил, 2,6-дихлорбензил, метил, етил і тичні амінокислоти, які можуть входити до складу циклогексил. Захисні групи для бічного ланцюга пептидів даного винаходу включають, але не обсерина й треоніна включають ацетил, бензоіл, межуються, N-метил, L-гідроксипроліл, L-3, 4тритил, тетрагідропіраніл, бензил, 2,6дигідроксифенілаланіл, -амінокислоти, такі як Lдихлорбензил й Cbz. Захисні групи для бічного -гідроксилізил й D- -метилаланіл, Lланцюга аргініну включають нітрогрупу, тозіл метилаланін, -амінокислоти й ізохиноліл. D(Tos), Cbz, адамантілоксикарбоніл, мезитоілсуамінокислоти й синтетичні амінокислоти неприльфаніл (Mts), 2,2,4,6,7пентаметилдигідробензофуран-5-сульфоніл 59 92497 60 родного походження також можуть бути включені окислюванням залишків цистеіна кожного пептив пептиди даного винаходу. дного мономера. Модифікації пептидів В одній реалізації даного винаходу контроль Кінцеві аміногрупи й/або карбоксильні групи утворення міжцистеінових зв'язків здійснюють пептидних речовин даного винаходу також можна вибором типу агента, що окислює, і його ефектимодифікувати для того, щоб одержати інші речовної концентрації, щоб оптимізувати утворення вини зі складу даного винаходу. Наприклад, кінбажаного ізомеру. Наприклад, окислювання пепцеву аміногрупу можна ацетилювати оцтовою тидного димера, у якому утворюються два внуткислотою або її галогенпохідними, такими як нарішньомолекулярні дисульфідні зв'язки (по одному в кожному пептидному ланцюзі), переважно приклад, -хлороцтова кислота, -бромоцтова досягається (стосовно утворення міжмолекуляркислота, або -йодоцтова кислота). них дисульфідних зв'язків), коли окислюючим Бічні ланцюги 20 природні генетично кодоваагентом є DMSO або йод (І2). них амінокислот (або стереоізомери D амінокисВ інших реалізаціях даного винаходу утволот) можна замінити іншими бічними ланцюгами, рення міжцистеінових зв'язків контролюють занаприклад, з такими групами, як алкіли, нижчі вдяки виборчому використанню тіол-захисних алкіли, циклічні 4-, 5-, 6-, і 7- членні алкіли, аміди груп протягом синтезу пептиду. Наприклад, у винижчих алкілів, диаміди (нижчих алкілів), алкоксипадку коли бажаним є димер із двома внутріш, гідрокси-, карбоксипохідні нижчих алкілів й їхні ньомолекулярними дисульфідними зв'язками, складні ефіри, 4-, 5-, 6-, 7-членні гетероцикли. перший пептидний ланцюг мономера синтезують Зокрема, можуть бути застосовані аналоги пролііз двома залишками цистеіна основної послідовна, у яких розмір циклічного залишку проліна заності, захищеними першою тіол-захисною групою мінений з 5 учасників на 4, 6, або 7 учасників. [наприклад, тритил (Trt), алкілоксикарбоніл Циклічні групи можуть бути насиченими або не(Alloc), і 1-(4,4-диметил-2,6-диоксоциклогекс-1насиченими, у випадку якщо вони ненасичені, то іліден)етил (Dde) або тому подібне], потім синтеможуть бути ароматичними або не ароматичнизують другий пептидний мономер, два залишки ми. Гетероциклічні групи переважно містять один цистеіна основної послідовності якого захищені або більше гетероатом азоту, кисню, і/або сірки. другою тіол-захисною групою, відмінною від перПриклади таких груп включають фуразаніл, фушої групи [наприклад, ацетамідометил (Асm), ріл, імідазолиніл, імідазоліл, імідозолиніл, ізотиатрет-бутил (tBu), або тому подібне]. Відповідно до золіл, ізооксазоліл, морфолініл (наприклад, морцього, першу тіол-захисну групу видаляють, робфоліногрупа), оксазоліл, піперазиніл (наприклад, лячи бісульфідну циклізацію першого мономера, 1-піперазиніл), піперидил (наприклад, 1а потім видаляють другу тіол-захисну групу, робпипередил, піперидиногрупа), піраніл, піразиніл, лячи бісульфідну циклізацію другого мономера. піразолидиніл, піразолиніл, піразоліл, піридазиІнші реалізації даного винаходу передбачаніл, піридил, пірімідиніл, піролідиніл (наприклад, ють як аналоги пептидів їх дисульфідні похідні у 1-піролідиніл), піролініл, піроліл, тиадиазоліл, яких один з атомів сірки замінений СН2 групою тиазоліл, тиеніл, тиоморфолініл (наприклад, тиоабо іншою аналогічною групою для сірки. Такі морфоліногрупа), і триазоліл. Ці гетероциклічні аналоги можуть бути отримані із сполук даного групи можуть бути заміщеними або незаміщенивинаходу, у яких кожен пептидний мономер місми. У випадку якщо група є заміщеною, замісник тить принаймні один залишок цистеіна або гомоможе бути алкілом, простим ефіром, галогеном, цистеіна й -аміно- -масляну кислоту замість киснем, або заміщеним або незаміщеним фенідругого залишку цистеіна, за допомогою внутрішлом. ньомолекулярного або міжмолекулярного заміМожна також легко модифікувати пептиди щення, з використанням способів, відомих у даній шляхом фосфорилювання й іншими методами галузі [див., наприклад, Barker, et al. (1992) J. [наприклад, як описано в Hruby, et al. (1990) Med. Chem. 35:2040-2048 й Or, et al. (1991) J. Org. Biochem J. 268:249-262]. Chem. 56:3146-3149]. Фахівець у даній галузі легПептидні сполуки даного винаходу також ко зрозуміє, що таке заміщення можна також зрослужать як структурні моделі для непептидних сполук із аналогічною біологічною активністю. бити з використанням інших гомологів -аміно- Фахівці в даній галузі визнають, що для створенмасляної кислоти й гомоцистеіна. ня сполук із тією ж або аналогічно бажаною біоДодатково до попередньої стратегії циклізації логічною активністю, такий же, як у зазначеного можуть бути застосовані інші стратегії циклізації пептиду, але з більш бажаними властивостями, пептидів без участі дисульфідних зв'язків. Такі ніж у зазначеного пептиду, відносно розчинності, альтернативні стратегії циклізації включають, стабільності й стійкості до гідролізу й протеолізу, наприклад, амідну стратегію циклізації, а також доступний ряд способів [див. Morgan and Gainor утворення тиоефірних зв'язків. Таким чином, спо(1989) Ann. Rep. Med. Chem. 24:243-252]. Ці мелуки даного винаходу можуть існувати в циклічній тоди включають заміщення остову пептиду остоформі із внутрішньомолекулярними амідними або вом, сформованим фосфонатами, амідатами, тиоефірними зв'язками. Наприклад, може бути карбаматами, сульфонамідами, вторинними амісинтезований пептид, у якому один цистеїн оснонами й N-метиламінокислотами. вної послідовності замінений на лізин і другий Утворення дисульфідних зв'язків цистеїн замінений на глутамінову кислоту. ВідпоСполуки зі складу даного винаходу містять відно до цього циклічний мономер може бути два внутрішньомолекулярні дисульфідні зв'язки. отриманий за допомогою амідного зв'язку між Такі дисульфідні зв'язки можуть бути отримані бічними ланцюгами цих двох залишків. Крім того,
ДивитисяДодаткова інформація
Назва патенту англійськоюErythropoietin receptor peptide formulations and uses
Автори англійськоюDuliege Anne-Marie, Stead Richard, Leuther Kerstin, Woodburn Kathryn, Naso Robert Barnett
Назва патенту російськоюСоставы, которые содержат пептиды, стимулирующие рецептор эритропоэтина, и их применение
Автори російськоюДулидж Анна-Мари, Стед Ричард, Льойтер Керстин, Вудбьорн Кесрин, Насо Роберт Барнет
МПК / Мітки
МПК: A61K 38/16, A61P 7/00
Мітки: пептиди, їхнє, містять, застосування, еритропоетину, стимулюють, складі, рецептор
Код посилання
<a href="https://ua.patents.su/80-92497-skladi-shho-mistyat-peptidi-yaki-stimulyuyut-receptor-eritropoetinu-ta-khneh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Склади, що містять пептиди, які стимулюють рецептор еритропоетину та їхнє застосування</a>
Попередній патент: Похідні оксадіазолу та їх застосування як позитивних алостеричних модуляторів метаботропних глутаматних рецепторів
Наступний патент: Канабіноїдно активний фармацевтичний інгредієнт для поліпшених дозованих форм
Випадковий патент: Спосіб визначення температурної залежності ширини оптичної псевдощілини твердих тіл