Сірковмісні ліпіди для застосування як харчових добавок або медикаментів
Номер патенту: 109252
Опубліковано: 10.08.2015
Автори: Хольмейде Анне Крістін, Бреннванг Мортен, Ховланн Рагнар
Формула / Реферат
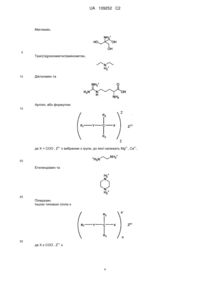
1. Ліпідна сполука формули (I):
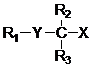 , (I)
, (I)
у якій
R1 вибраний з C10-C22-алкенільної групи, що має 3-6 перерваних метиленом подвійних зв’язків у Z-конфігурації;
R2 та R3 є однаковими або різними та кожен незалежно вибраний з атома водню, C1-C6-алкільної групи або C6-C10-арильної групи, за умови, що R2 та R3 одночасно не являють собою атом водню; або
R2 та R3 з’єднані для утворення С3-С6-циклоалкану;
Y є вибраним з-поміж сірки, сульфоксиду та сульфону;
X являє собою карбонову кислоту або естер карбонової кислоти;
або її фармацевтично прийнятна сіль,
за умови, що сполука формули (І) не являє собою (2)-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутанову кислоту.
2. Ліпідна сполука за п. 1, у якій R2 та R3 кожен незалежно вибраний з атома водню, C1-C6-алкільної групи або C6-C10-арильної групи; або R2 та R3 з’єднані для утворення С3-С6-циклоалкану.
3. Ліпідна сполука за п. 2, у якій R2 та R3 кожен незалежно вибраний з атома водню, етильної групи або фенільної групи; або R2 та R3 з’єднані для утворення циклобутанової групи.
4. Ліпідна сполука за п. 1, у якій один з R2 та R3 являє собою атом водню, а інший вибраний з C1-C6-алкільної групи або C6-C10-арильної групи.
5. Ліпідна сполука за п. 1, у якій R2 та R3 є однаковими або різними і кожен незалежно вибраний з C1-C6-алкільної групи або C6-C10-арильної групи.
6. Ліпідна сполука за п. 5, у якій R2 та R3 являють собою C1-C6-алкільні групи.
7. Ліпідна сполука за п. 6, у якій R2 та R3 є однаковими або різними та кожен незалежно вибраний з метильної групи або етильної групи.
8. Ліпідна сполука за п. 6, у якій R2 та R3 являють собою етильні групи.
9. Ліпідна сполука за п. 1, у якій R1 являє собою С14-C22-алкенільну групу, що має 3-6 перерваних метиленом подвійних зв’язків у Z-конфігурації, що має перший подвійний зв’язок у третьому вуглець-вуглецевому зв’язку з омега (ω) кінця вуглецевого ланцюга.
10. Ліпідна сполука за п. 9, у якій R1 являє собою C14-C22-алкеніл, що має 5-6 подвійних зв’язків.
11. Ліпідна сполука за будь-яким з пп. 1-10, у якій Y є сіркою.
12. Ліпідна сполука за будь-яким з пп. 1-10, у якій Y є сульфоксидом.
13. Ліпідна сполука за будь-яким з пп. 1-10, у якій Y є сульфоном.
14. Ліпідна сполука за будь-яким з пп. 1-13, у якій X являє собою карбонову кислоту або естер карбонової кислоти.
15. Ліпідна сполука за п. 14, у якій X являє собою карбонову кислоту.
16. Ліпідна сполука за будь-яким з пп. 1-15 у суміші діастереомерних ізомерів або у рацемічній формі.
17. Ліпідна сполука за п. 1 у формі діастереомеру або енантіомера.
18. Ліпідна сполука за п. 16 у формі її R-стереоізомера.
19. Ліпідна сполука за п. 16 у формі її S-стереоізомера.
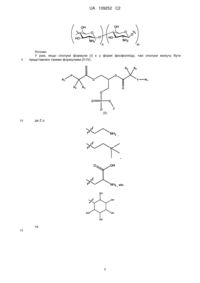
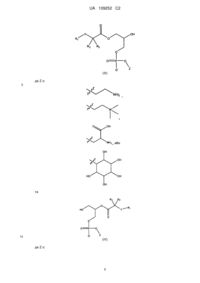
20. Ліпідна сполука за п. 1, вибрана з групи, що включає:
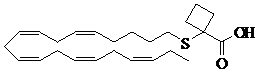
1-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)циклобутанкарбонову кислоту;

2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутанову кислоту;
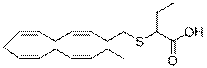
2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілтіо)бутанову кислоту;
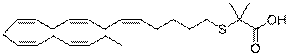
2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)-2-метилпропанову кислоту;
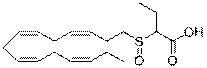
2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілсульфініл)бутанову кислоту;
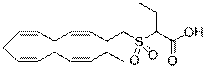
2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілсульфоніл)бутанову кислоту;

2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілсульфініл)бутанову кислоту або

2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілсульфоніл)бутанову кислоту.
21. Ліпідна сполука за п. 20, яка відрізняється тим, що являє собою

2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутанову кислоту.
22. Ліпідна сполука за п. 1, у якій
X являє собою карбонову кислоту або естер карбонової кислоти; і
Y являє собою сірку.
23. Ліпідна сполука за п. 1, у якій
R1 являє собою C10-C22-алкенільну групу, що має 3-6 перерваних метиленом подвійних зв’язків у Z-конфігурації, причому ліпідна сполука походить з поліненасиченої жирної кислоти;
X являє собою карбонову кислоту або естер карбонової кислоти; і
Y являє собою сірку.
24. Ліпідна сполука за п. 1, у якій С3-С6-циклоалкан вибраний з циклопропану, циклобутану, циклопентану або циклогексану.
25. Композиція харчової добавки, яка містить ліпідну сполуку за будь-яким з пп. 1-24.
26. Фармацевтична композиція, яка містить ліпідну сполуку за будь-яким з пп. 1-24, та фармацевтично прийнятний носій, ексципієнт, розріджувач або будь-яку їх комбінацію.
27. Фармацевтична композиція за п. 26, яка рецептована для перорального введення.
28. Фармацевтична композиція за п. 26 або п. 27, яка рецептована для забезпечення денної дози в діапазоні від 1 мг до 10 г ліпідної сполуки.
29. Фармацевтична композиція за п. 28, яка рецептована для забезпечення денної дози в діапазоні від 50 мг до 1 г ліпідної сполуки.
30. Фармацевтична композиція за п. 29, яка рецептована для забезпечення денної дози в діапазоні від 50 мг до 200 мг ліпідної сполуки.
31. Ліпідна композиція, яка містить ліпідну сполуку за будь-яким з пп. 1-24 та принаймні один прийнятний носій, ексципієнт, розріджувач або будь-яку їх комбінацію.
32. Ліпідна композиція за п. 31, де принаймні 60 % за масою ліпідної композиції складається з ліпідної сполуки.
33. Ліпідна композиція за п. 32, де принаймні 80 % за масою ліпідної композиції складається з ліпідної сполуки.
34. Ліпідна композиція за будь-яким з пп. 31-33 для застосування як медикаменту.
35. Ліпідна сполука за будь-яким з пп. 1-24 для застосування при активації або модуляції α, γ або δ ізоформ людського рецептора, який активується проліфератором пероксисом (PPAR).
36. Ліпідна сполука за п. 35, яка є пан-агоністом або модулятором.
37. Ліпідна сполука за будь-яким з пп. 1-24 для застосування у профілактиці та/або лікуванні дисліпідемічного стану.
38. Ліпідна сполука за п. 37, де дисліпідемічним станом є гіпертригліцеридемія (HTG).
39. Ліпідна сполука за будь-яким з пп. 1-24 для застосування у профілактиці та/або лікуванні підвищеного рівня тригліцеридів, рівня холестерину ліпопротеїнів низької густини та/або рівня холестерину ліпопротеїнів дуже низької густини.
40. Ліпідна сполука за будь-яким з пп. 1-24 для застосування у лікуванні та/або профілактиці ожиріння або надмірної ваги.
41. Ліпідна сполука за будь-яким з пп. 1-24 для застосування у зниженні маси тіла та/або профілактиці набирання маси тіла.
42. Ліпідна сполука за будь-яким з пп. 1-24 для застосування у лікуванні та/або профілактиці жирової хвороби печінки.
43. Ліпідна сполука за п. 42 де жирова хвороба печінки являє собою неалкогольну жирову хворобу печінки (NAFLD).
44. Ліпідна сполука за будь-яким з пп. 1-24 для застосування у лікуванні та/або профілактиці атеросклерозу.
45. Ліпідна сполука за будь-яким з пп. 1-24 для застосування у профілактиці інфаркту міокарда.
46. Ліпідна сполука за будь-яким з пп. 1-24 для застосування у лікуванні та/або профілактиці периферичної резистентності до інсуліну та/або діабетичного стану.
47. Ліпідна сполука за будь-яким з пп. 1-24 для застосування у лікуванні та/або профілактиці діабету 2-го типу.
48. Ліпідна сполука за будь-яким з пп. 1-24 для застосування у зниженні інсуліну плазми, глюкози крові та/або тригліцеридів сироватки.
49. Ліпідна сполука за будь-яким з пп. 1-24 для застосування у лікуванні та/або профілактиці запальної хвороби або стану.
50. Спосіб лікування у ссавця станів, пов’язаних з активацією або модуляцією ізоформи людського рецептора, який активується проліфератором пероксисом (PPAR), вибраної з α, γ або δ, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
51. Спосіб за п. 50, у якому сполука є PPAR пан-агоністом або модулятором.
52. Спосіб профілактики та/або лікування дисліпідемічного стану у ссавця, який цього потребує, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
53. Спосіб за п. 52, у якому дисліпідемічним станом є гіпертригліцеридемія (HTG).
54. Спосіб профілактики та/або лікування підвищеного рівня тригліцеридів, рівня холестерину ліпопротеїнів низької густини та/або рівня холестерину ліпопротеїнів дуже низької густини, у ссавця, який цього потребує, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
55. Спосіб лікування та/або профілактики ожиріння або надмірної ваги у ссавця, який цього потребує, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
56. Спосіб зниження маси тіла та/або профілактики набирання маси тіла у ссавця, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
57. Спосіб лікування та/або профілактики жирової хвороби печінки у ссавця, який цього потребує, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
58. Спосіб за п. 0, у якому жирова хвороба печінки являє собою неалкогольну жирову хворобу печінки (NAFLD).
59. Спосіб лікування та/або профілактики атеросклерозу у ссавця, який цього потребує, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
60. Спосіб профілактики інфаркту міокарда у ссавця, який цього потребує, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
61. Спосіб лікування та/або профілактики периферичної резистентності до інсуліну та/або діабетичного стану у ссавця, який цього потребує, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
62. Спосіб лікування та/або профілактики діабету 2-го типу у ссавця, який цього потребує, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
63. Спосіб зниження інсуліну плазми, глюкози крові та/або тригліцеридів сироватки у ссавця, який цього потребує, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
64. Спосіб лікування та/або профілактики запальної хвороби або стану у ссавця, який цього потребує, у якому ссавцеві вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-24.
65. Композиція, що містить ліпідну сполуку за п. 21 та принаймні один прийнятний носій, ексципієнт, розріджувач або будь-яку їх комбінацію.
66. Композиція за п. 65, яка являє собою фармацевтичну композицію.
67. Спосіб одержання ліпідної сполуки за будь-яким з пп. 1-24, у якому здійснюють етапи відповідно до наступної схеми:
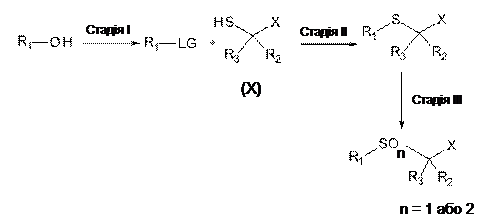 ,
,
де R1, R2, R3 та X приймають значення, як визначені у будь-якому з пп. 1-24, та LG представляє групу, що відщеплюється, таку як мезилат, тозилат або прийнятний галоген, причому
на Стадії І, спирт перетворюють, із застосуванням взаємного перетворення функціональних груп, на сполуку, у якій кінцева гідроксигрупа була перетворена на відповідну групу, що відщеплюється (LG);
на Стадії ІІ, відповідну сполуку з групою, що відщеплюється, далі піддають реакції заміщення з відповідним чином заміщеною похідною тіооцтової кислоти (X), у присутності основи, з отриманням тіоетеру (Y = S); та
на Стадії ІІІ, відповідний сульфоксид або сульфон (Y = SO або SO2) отримують шляхом окиснення тіоетеру (Y = S) прийнятним окиснювальним агентом.
68. Спосіб за п. 67, у якому вихідний матеріал використовують з джерела рослинного, мікробіологічного та/або тваринного походження.
69. Спосіб за п. 68, у якому джерело тваринного походження являє собою масло морських риб або масло криля.
70. Спосіб одержання ліпідної сполуки за будь-яким з пп. 1-24, у якому здійснюють стадії відповідно до наступної схеми:
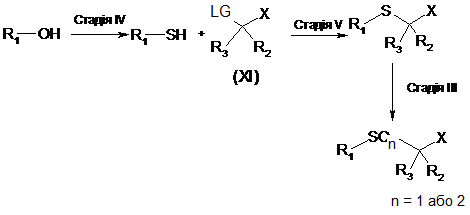 ,
,
де R1, R2, R3 та X приймають значення, як визначені у будь-якому з пп. 1-24,
на Стадії ІV, спирт перетворюють на відповідний тіол;
на Стадії V, зазначений тіол піддають подальшій реакції заміщення зі сполукою формули (XI), у присутності основи у прийнятній системі розчинників з отриманням тіоетеру (Y = S); та
на Стадії ІІІ, відповідний сульфоксид або сульфон (Y = SO або SO2) отримують шляхом окиснення тіоетеру (Y = S) прийнятним окиснювальним агентом.
Текст
Реферат: Даний винахід стосується ліпідних сполук загальної формули (І): R2 R1 Y C X R3 , (І) де R1 є вибраним з-поміж С10-С22-алкілу, С10-С22-алкенілу, що має 1-6 подвійних зв'язків, та С10С22-алкінілу, що має 1-6 потрійних зв'язків; R2 та R3 є однаковими або різними і можуть бути вибраними з групи різних замісників; Y є вибраним з-поміж сірки, сульфоксиду та сульфону; і X представляє карбонову кислоту або її похідну, естер карбонової кислоти, ангідрид карбонової кислоти або карбоксамід; або їх фармацевтично прийнятних солей, комплексів або сольватів. Винахід також стосується фармацевтичних композицій та ліпідних композицій, які містять такі сполуки, та таких сполук для застосування як медикаментів або для застосування у терапії, зокрема, для лікування хвороб, пов'язаних з серцево-судинною системою, обміном речовин та запаленнями. UA 109252 C2 Галузь винаходу Даний винахід стосується ліпідних сполук загальної формули (I): 5 10 15 20 25 30 35 (I) де - R1 є вибраним з-поміж C10-C22 алкілу, C10-C22 алкенілу, що має 1-6 подвійних зв’язків, та C10-C22 алкінілу, що має 1-6 потрійних зв’язків; - R2 та R3 є однаковими або різними і можуть бути вибраними з групи замісників, які складаються з атома водню, гідроксигрупи, алкільної групи, атома галогену, алкоксигрупи, ацилоксигрупи, ацильної групи, алкенільної групи, алкінільної групи, арильної групи, алкілтіогрупи, алкоксикарбонільної групи, карбоксигрупи, алкілсульфінільної групи, алкілсульфонільної групи, аміногрупи та алкіламіногрупи, за умови, що R2 та R3 не можуть бути атомом водню; або - R2 та R3 можуть бути з’єднані з метою утворення циклолалкану, такого, як циклопропан, циклобутан, циклопентан або циклогексан; - Y є вибраним з-поміж сірки, сульфоксиду та сульфону; - X представляє карбонову кислоту або її похідну, естер карбонової кислоти або карбоксамід; або їх фармацевтично прийнятних солей, сольватів, сольватів таких солей або їх проліків. У випадках, коли R2 та R3 є різними, сполуки формули (I) можуть існувати у стереоізомерних формах. Слід розуміти, що винахід охоплює всі оптичні ізомери сполук формули (I) та їх суміші. Винахід також стосується фармацевтичних композицій та ліпідних композицій, які включають такі сполуки, та таких сполук для застосування як медикаментів або для застосування у терапії, зокрема, для лікування хвороб, пов’язаних серцево-судинною системою, обміном речовин та запаленнями. Рівень техніки На даний час здійснюється безліч досліджень аналогів жирних кислот та впливу на різні фізіологічні процеси, які впливають на нормальне здоров’я та хронічні хвороби. Наприклад, було виявлено, що харчові поліненасичені жирні кислоти (PUFA) регулюють рівень ліпідів у плазмі, серцево-судинні та імунні функції, дію інсуліну та розвиток нейронів і функцію зору. Тетрадецилтіооцтова кислота (TTA) є модифікованою жирною кислотою, яка має багато сильних ефектів, які виявляються як in-vivo, так і in-vitro. TTA має властивості, дуже подібні до властивостей природних жирних кислот, і головна відмінність полягає у тому, що вона не може окиснюватися шляхом мітохондріального βокиснення, але значною мірою підвищує окиснення інших жирних кислот. Незважаючи на те, що TTA не може зазнавати β-окиснення, вона метаболізується найчастіше як нормальна насичена жирна кислота. 40 45 50 55 TTA впливає на окиснювальний статус на різних рівнях, маючи потенціал зміни антиоксидантної захисної системи, крім того, що сама є антиоксидантом через її здатність до захоплення вільних радикалів. Додавання TTA може запобігати окиснювальній модифікації частинок ліпопротеїну низької густини (LDL) у плазмі і знижувати утворення ліпідних пероксидів. Було одержано кілька похідних поліненасичених жирних кислот з сіркою у 3-й позиції (Flock et al, Acta Chemica Scand., 1999, 53, 436). Метил (all-Z)-3-тіа-6,9,12,15-октадекатетраноат випробували на моделі щура Wistar, і його вплив порівнювали з впливом TTA. Результати вказують, що як насичені, так і ненасичені жирні кислоти знижують тригліцериди плазми подібною мірою (Willumsen et al, J. Lipid Mediators Cell Signalling, 1997, 17, 115). Несподівано було виявлено, що нові похідні жирних кислот, представлені загальною формулою (I), мають вищу афінність до рецепторів PPARα та PPARγ порівняно з TTA та (all-Z)3-тіа-6,9,12,15-октадекатетраеновою кислотою. Похідні жирних кислот, представлені загальною формулою (I), також знижують рівень тригліцеридів, холестерину та вільних жирних кислот у 1 UA 109252 C2 5 моделі мишей з дисліпідемією більшою мірою, ніж TTA та (all-Z)-3-тіа-6,9,12,15октадекатетраенова кислота. Короткий опис винаходу Мета даного винаходу полягає у забезпеченні ліпідних сполук, які мають поліпшену біологічну активність порівняно з 3-тіа жирними кислотами. Ця мета досягається завдяки ліпідній сполуці формули (I) (I) 10 15 20 25 30 35 40 45 50 55 Зокрема, даний винахід стосується сполук формули (I), де: - R1 є вибраним з-поміж a C10-C22 алкілу, C10-C22 алкенілу, що має 1-6 подвійних зв’язків, та C10-C22 алкінілу, що має 1-6 потрійних зв’язків; - R2 та R3 є однаковими або різними і можуть бути вибраними з групи замісників, які складаються з атома водню, гідроксигрупи, алкільної групи, атома галогену, алкоксигрупи, ацилоксигрупи, ацильної групи, алкенільної групи, алкінільної групи, арильної групи, алкілтіогрупи, алкоксикарбонільної групи, карбоксигрупи, алкілсульфінільної групи, алкілсульфонільної групи, аміногрупи та алкіламіногрупи, за умови, що R2 та R3 не можуть бути атомом водню; або - R2 та R3 можуть бути з’єднані з метою утворення циклолалкану, такого, як циклопропан, циклобутан, циклопентан або циклогексан; - Y є вибраним з-поміж сірки, сульфоксиду та сульфону; - X представляє карбонову кислоту або її похідну, естер карбонової кислоти або карбоксамід; або їх фармацевтично прийнятних солей, сольватів, сольватів таких солей або їх проліків. У сполуці згідно з винаходом вищезгадана алкільна група може бути вибрана з групи, до якої належать метил, етил, n-пропіл, ізопропіл, n-бутил, втор-бутил та n-гексил; вищезгадана алкенільна група може бути вибрана з групи, до якої належать аліл, 2-бутеніл та 3-гексеніл; вищезгадана алкінільна група може бути вибрана з групи, до якої належать пропаргіл, 2-бутиніл та 3-гексиніл; вищезгаданий атом галогену може бути вибраний з групи, до якої належать фтор, хлор, бром та йод; вищезгадана алкоксигрупа може бути вибрана з групи, до якої належать метокси, етокси, пропокси, ізопропокси, втор-бутокси, фенокси, бензилокси, OCH2CF3 та OCH2CH2OCH3; вищезгадана ацилоксигрупа може бути вибрана з-поміж ацетокси, пропіонокси та бутирокси; вищезгадана арильна група є фенільною групою; вищезгадана алкілтіо-група може бути вибрана з групи, до якої належать метилтіо, етилтіо, ізопропілтіо та фенілтіо; вищезгадана алкоксикарбонільна група може бути вибрана з групи, до якої належать метоксикарбоніл, етоксикарбоніл, пропоксикарбоніл та бутоксикарбоніл; вищезгадана алкілсульфінільна група може бути вибрана з групи, до якої належать метансульфініл, етансульфініл та ізопропансульфініл; вищезгадана алкілсульфонільна група може бути вибрана з групи, до якої належать метансульфоніл, етансульфоніл та ізопропансульфоніл; вищезгадана алкіламіногрупа може бути вибрана з групи, до якої належать метиламіно, диметиламіно, етиламіно та діетиламіно; вищезгадана карбоксилатна група може бути вибрана з групи, до якої належать етилкарбоксилат, метилкарбоксилат, n-пропілкарбоксилат, ізопропілкарбоксилат, nбутилкарбоксилат, втор-бутилкарбоксилат та n-гексилкарбоксилат; вищезгадана карбоксамідна група може бути вибрана з групи, до якої належать карбоксамід, такий, як N-метилкарбоксамід, N,N-диметилкарбоксамід, N-етилкарбоксамід та N,N-діетилкарбоксамід. В одному варіанті втілення винаходу одним із замісників R2 та R3 сполуки формули (I) є водень, а інший є вибраним з групи замісників, до якої належать гідроксигрупа, алкільна група, атом галогену, алкоксигрупа, ацилоксигрупа, ацильна група, алкенільна група, алкінільна група, арильна група, алкілтіо-група, алкоксикарбонільна група, карбоксигрупа, алкілсульфінільна група, алкілсульфонільна група, аміногрупа та алкіламіногрупа. В оптимальному варіанті втілення R2 та R3 є незалежно вибраними з-поміж атома водню, алкільної групи, алкоксигрупи або арильної групи; або R2 та R3 можуть бути з’єднані з метою утворення циклолалкану. В іншому оптимальному варіанті втілення R2 та R3 є незалежно вибраними з-поміж атома водню, алкільної групи або метоксигрупи або етоксигрупи. 2 UA 109252 C2 5 10 15 20 25 30 35 40 45 У ще одному оптимальному варіанті втілення R2 та R3 є незалежно вибраними з-поміж атома водню, етилу, метокси- або етоксигрупи, фенілу; або R2 та R3 є з’єднаними для утворення циклобутанової групи. В іншому варіанті втілення винаходу замісники R2 та R3 сполуки формули (I) є однаковими або різними і можуть бути вибраними з групи замісників, до якої належать гідроксигрупа, алкільна група, атом галогену, алкоксигрупа, ацилоксигрупа, ацильна група, алкенільна група, алкінільна група, арильна група, алкілтіо-група, алкоксикарбонільна група, карбоксигрупа, алкілсульфінільна група, алкілсульфонільна група, аміногрупа. В оптимальному варіанті R 2 та R3 є алкільними групами, вибраними з-поміж метилу, етилу, n-пропілу або ізопропілу, у ще кращому варіанті – вибраними з-поміж метилу або етилу, у найкращому варіанті – R2 та R3 є етилом. В одному варіанті втілення винаходу замісник R1 сполуки формули (I) є C10-C22 алкілом, і вищезгадана сполука походить від насиченої жирної кислоти. В оптимальному варіанті замісники R2 та R3 сполуки формули (I) є однаковими або різними і можуть бути вибраними з групи замісників, як згадано вище, а замісник R 1 є C10-C22 алкілом, і вищезгадана сполука походить від насиченої жирної кислоти. У разі походження від поліненасиченої жирної кислоти R 1 зазвичай є C10-C22 алкенілом з 2-6 подвійними зв’язками, наприклад, 3-6 подвійними зв’язками, наприклад, 3-6 перерваних метиленом подвійних зв’язків у Z-конфігурації. Наприклад, R1 є: - C15 алкенілом з 4 перерваними метиленом подвійними зв’язками у Z-конфігурації - C18 алкенілом з 3-5 подвійними зв’язками, наприклад, C18 алкенілом з 5 перерваними метиленом подвійними зв’язками у Z-конфігурації - C14-C22 алкенільною групою з принаймні одним подвійним зв’язком, яка має Z конфігурацію и має перший подвійний зв’язок у третьому вуглець-вуглецевому зв’язку з омега (ω) кінця вуглецевого ланцюга - C20 алкенілом з 5 перерваними метиленом подвійними зв’язками у Z-конфігурації - C22 алкенілом з 6 перерваними метиленом подвійними зв’язками у Z-конфігурації. Крім того, R1 може бути C10-C22 алкінілом, наприклад, C16-C22 алкінілом з 1-6 потрійними зв’язками. В одному варіанті втілення винаходу замісник Y сполуки формули (I) є сіркою. В іншому варіанті втілення винаходу замісник Y сполуки формули (I) є сульфоксидом. У ще одному варіанті втілення винаходу замісник Y сполуки формули (I) є сульфоном. В одному варіанті втілення винаходу замісник X сполуки формули (I) є карбоновою кислотою у формі естеру, вільної кислоти, тригліцериду або фосфоліпіду. В оптимальному варіанті замісник X є карбоновою кислотою у формі естеру або вільною кислотою, у ще кращому варіанті X є карбоновою кислотою у формі вільної кислоти. В іншому варіанті втілення винаходу замісник R1 є C10-C22 алкілом, і ліпідна сполука походить від насиченої жирної кислоти; R2 та R3 є однаковими або різними і можуть бути вибраними з групи замісників, до якої належать гідроксигрупа, алкільна група, атом галогену, алкоксигрупа, ацилоксигрупа, ацильна група, алкенільна група, алкінільна група, арильна група, алкілтіо-група, алкоксикарбонільна група, карбоксигрупа, алкілсульфінільна група, алкілсульфонільна група, аміногрупа; в оптимальному варіанті R 2 та R3 є алкільними групами; і X є карбоновою кислотою у формі вільної кислоти. Винахід також стосується солей сполуки формули (I). Такі солі можуть бути представлені формулою 50 де X є COO , + + + + + Z є вибраним з групи, до якої належать Li , Na , K , NH4 , 3 UA 109252 C2 Меглюмін, 5 Трис(гідроксиметил)амінометан, 10 Діетиламін та Аргінін; або формулою 15 де X = COO , Z 2+ 2+ 20 Етилендіамін та 25 Піперазин. Іншою типовою сіллю є 30 де X є COO , Z n+ 2+ є вибраним з групи, до якої належать Mg , Ca , є 4 UA 109252 C2 5 Хітозан У разі, якщо сполуки формули (I) є у формі фосфоліпіду, такі сполуки можуть бути представлені такими формулами (II-IV), (II) 10 де Z є: та 15 5 UA 109252 C2 (III) де Z є: 5 та 10 (IV) де Z є: 6 UA 109252 C2 5 Сполуки формули (I), де X є карбоновою кислотою у формі тригліцериду, 1,2-дигліцериду, 1,3 дигліцериду, 1-моногліцериду та 2-моногліцериду, також охоплюються обсягом даного винаходу. Вони є представленими нижче формулами (V), (VI), (VII), (VIII) та (IX), відповідно. (V) 10 (VI) 7 UA 109252 C2 (VII) (VIII) 5 (IX) 10 15 20 25 Сполуки формули (I) можуть існувати у стереоізомерних формах. Слід розуміти, що винахід охоплює всі оптичні ізомери сполук формули (I) та їх суміші. Отже, включаються сполуки формули (I), які є присутніми як діастереомери, рацемати та енантіомери. В оптимальному варіанті втілення винаходу сполука формули (I) являє собою етил 2-((5Z,8Z, 11Z, 14Z, 17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутаноат. В іншому оптимальному варіанті втілення винаходу сполука формули (I) являє собою етил 1-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)-циклобутанкарбоксилат. Даний винахід також стосується ліпідної сполуки згідно з формулою (I) для застосування як медикаменту. У ще одному аспекті даний винахід забезпечує харчову добавку, кормову добавку або нутрицевтичну композицію, яка включає ліпідну сполуку формули (I). Така харчова добавка може вироблятися для введення будь-яким шляхом введення. Наприклад, харчова добавка може вводитись як рідкий харчовий продукт або напій. Харчова добавка може бути у формі капсули, наприклад, желатинової капсули, і капсула може бути ароматизованою. 8 UA 109252 C2 5 10 15 20 25 30 35 40 45 50 55 У ще одному аспекті даний винахід забезпечує фармацевтичну композицію, яка включає сполуку формули (I), в оптимальному варіанті – разом з одним або кількома фармацевтично прийнятними носіями або формоутворювачами. Нові ліпідні сполуки та композиції згідно з винаходом можуть бути рецептовані у традиційних формах для перорального введення, наприклад, у формі таблеток, вкритих оболонкою таблеток, капсул, порошків, гранулятів, розчинів, дисперсій, суспензій, сиропів, емульсій, аерозолів і т. ін., з застосуванням традиційних формоутворювачів, наприклад, розчинників, розріджувачів, зв’язувальних речовин, підсолоджувачів, ароматизаторів, модифікаторів pH, модифікаторів в’язкості, антиоксидантів, кукурудзяного крохмалю, лактози, глюкози, мікрокристалічної целюлози, стеарату магнію, полівінілпіролідону, лимонної кислоти, винної кислоти, води, етанолу, гліцерину, сорбіту, поліетиленгліколю, пропіленгліколю, цетилстеарилового спирту, карбоксиметилцелюлози або жирних речовин, таких, як твердий жир, або їх прийнятних сумішей і т. ін. Можуть застосовуватися традиційні способи рецептування, добре відомі спеціалістам у даній галузі. Композиції так само можуть вводитись традиційними шляхами введення, тобто, перорально. Особливу перевагу віддають застосуванню композицій для перорального введення, наприклад, таблеток, вкритих оболонкою таблеток, капсул, сиропів і т. ін. Прийнятна денна доза сполуки згідно з формулою (I) становить від 1 мг до 10 г вищезгаданої сполуки; від 50 мг до 1 г вищезгаданої сполуки або від 50 мг до 200 мг вищезгаданої сполуки. Фармацевтична композиція згідно з винаходом може застосовуватись як медикамент. Даний винахід також стосується ліпідної композиції, яка включає ліпідну сполуку згідно з формулою (I). У прийнятному варіанті принаймні 60 % за масою або принаймні 80 % за масою ліпідної композиції складається з вищезгаданої сполуки. Ліпідна композиція також може включати фармацевтично прийнятний антиоксидант, наприклад, токоферол. Крім того, даний винахід стосується ліпідної композиції для застосування як медикаменту. Крім того, даний винахід стосується застосування ліпідної сполуки згідно з формулою (I) для застосування при: - активації або модуляції принаймні однієї з ізоформ людського рецептора, який активується проліфератором пероксисом (PPAR), α, γ або δ, причому вищезгадана сполука наприклад, є пан-агоністом або модулятором - профілактиці та/або лікуванні дисліпідемічного стану, наприклад, гіпертригліцеридемії (HTG) - профілактиці та/або лікуванні підвищеного рівня тригліцеридів, рівня холестерину ліпопротеїнів низької густини та/або рівня холестерину ліпопротеїнів дуже низької густини - лікуванні та/або профілактиці ожиріння або надмірної ваги - зниженні маси тіла та/або профілактиці набирання маси тіла - лікуванні та/або профілактиці жирового метаморфозу печінки, наприклад, неалкогольного жирового метаморфозу печінки (NAFLD). - лікуванні та/або профілактиці атеросклерозу - профілактиці інфаркту міокарда - лікуванні та/або профілактиці периферичної резистентності до інсуліну та/або діабетичного стану - лікуванні та/або профілактиці діабету 2-го типу - зниження інсуліну плазми, глюкози крові та/або тригліцеридів сироватки - лікуванні та/або профілактиці запальної хвороби або стану. Винахід також стосується ліпідних сполук згідно з формулою (I) для лікування вищезгаданих станів та способів лікування та/або профілактики перелічених вище станів, включаючи введення ссавцеві, який цього потребує, фармацевтично активної кількості сполуки згідно з формулою (I). Крім того, даний винахід охоплює способи виробництва ліпідних сполук згідно з формулою (I). Сировина може бути взята, наприклад, з рослинного, мікробного та/або тваринного джерела, такого, як жир морських риб. В оптимальному варіанті застосовують олію морських риб або олію криля. Детальний опис винаходу Авторами даного винаходу було виявлено, що сполуки формули (I), представлені вище, мають чудову фармацевтичну активність. 9 UA 109252 C2 5 10 15 20 25 30 35 40 Вжитий авторами термін "ліпідна сполука" стосується аналогів жирних кислот, одержаних, наприклад, з насичених жирних кислот, мононенасичених жирних кислот, поліненасичених жирних кислот та ліпідів, які включають 1-6 потрійних зв’язків. "Фармацевтично активна кількість" означає кількість, яка забезпечує потрібний фармакологічний та/або терапевтичний ефект, тобто, кількість комбінованого продукту, яка є ефективною для досягнення передбаченої мети. Хоча потреби окремих пацієнтів можуть бути різними, визначенняоптимальних меж ефективної кількості комбінованого продукту здійснюється на розсуд спеціаліста у даній галузі. Як правило, режим дозування для лікування стану з застосуванням комбінованого продукту згідно з цим винаходом вибирають з врахуванням різних чинників, включаючи тип, вік, масу, стать, режим харчування та стан здоров’я пацієнта. Під "фармацевтичною композицією" слід розуміти ліпідну сполуку згідно з винаходом у будьякій формі, прийнятній для застосування з медичною метою. "Лікування" означає будь-яке терапевтичне застосування, яке може йти на користь людині або іншій тварині. Обсяг даного винаходу охоплює лікування як людей, так і тварин. Лікування може бути спрямоване на існуючий стан або може бути профілактичним. Номенклатура та термінологія Жирні кислоти є лінійними вуглеводнями, які мають карбоксильну (COOH) групу на одному кінці (α) та (зазвичай) метильну групу на іншому (ω) кінці. У хімії нумерація атомів вуглецю починається з α-кінця. α-вуглець означає перший вуглець після вуглецю, який приєднується до функціональної групи, а другий вуглець є β-вуглецем. Вжитий авторами вираз "перервані метиленом подвійні зв’язки" стосується випадків, коли метиленова група розташовується посередині для розривання подвійних зв’язків у вуглецевому ланцюгу ліпідної сполуки. Детальний опис винаходу Авторами винаходу несподівано було виявлено, що особливо оптимальними є ліпідні сполуки, показані у категоріях A-E. Категорія A - походить від насичених жирних кислот - R1 є C10-C22 алкілом - X представляє карбонову кислоту або її похідну, естер карбонової кислоти або карбоксамід Приклад i: R1 = C14, Y = S Категорія B - походить від мононенасичених жирних кислот - R1 є C10-C22 алкенілом, який має 1 подвійний зв’язок - X представляє карбонову кислоту або її похідну, естер карбонової кислоти або карбоксамід Приклад ii: R1 = C18, Y = S 45 Приклад iii: R1 = C14, Y = S 50 Категорія C - походить від поліненасичених жирних кислот 10 UA 109252 C2 - R1 є C10-C22 алкенілом, який має 2-6 подвійних зв’язків - X представляє карбонову кислоту або її похідну, естер карбонової кислоти або карбоксамід Приклад iv: R1 = C20 з 5 перерваними метиленом подвійними зв’язками у Z-конфігурації, Y = S 5 Приклад v: R1 = C22 з 6 перерваними метиленом подвійними зв’язками у Z-конфігурації, Y = S 10 Приклад vi: R1 = C18 з 3 перерваними метиленом подвійними зв’язками у Z-конфігурації, Y = S 15 Приклад vii: R1 = C15 з 4 перерваними метиленом подвійними зв’язками у Z-конфігурації, Y = S 20 25 30 35 40 Приклад viii: R1 = C15 з 3 перерваними метиленом подвійними зв’язками у Z-конфігурації та 1 подвійним зв’язком у E-конфігурації, Y = S Приклад ix: R1 = C18 з 5 перерваними метиленом подвійними зв’язками у Z-конфігурації, Y = S Приклад x: R1 = C18 з 4 перерваними метиленом подвійними зв’язками у Z-конфігурації та 1 подвійним зв’язком у E-конфігурації, Y = S Категорія D - походить від ліпідів, які містять 1-6 потрійних зв’язків - R1 є C10-C22 алкінілом - X представляє карбонову кислоту або її похідну, естер карбонової кислоти або карбоксамід 11 UA 109252 C2 Приклад xi: R1 = C14 з 1 потрійним зв’язком, Y = S 5 10 Категорія E - R1 є вибраним з-поміж C10-C22 алкілу, C10-C22 алкенілу, що має 1-6 подвійних зв’язків, та C10-C22 алкінілу, що має 1-6 потрійних зв’язків - X представляє карбонову кислоту або її похідну, естер карбонової кислоти або карбоксамід - Y є сульфоксидом або сульфоном Приклад xii: R1 = C15 з 4 перерваними метиленом подвійними зв’язками у Z-конфігурації, Y = SO 15 Приклад xiii: R1 = C15 з 4 перерваними метиленом подвійними зв’язками у Z-конфігурації, Y = SO2 20 Конкретними прикладами оптимальних ліпідних сполук згідно з винаходом є: Категорія A - Насичені жирні кислоти: 25 2-(тетрадецилтіо)бутанова кислота (1) R1 = C14H29, R2 = етил, R3 = атом водню, Y = S та X = COOH 30 2-метокси-2-(тетрадецилтіо)оцтова кислота (2) R1 = C14H29, R2 = метокси, R3 = атом водню, Y = S та X = COOH 35 2-(ікозилтіо)бутанова кислота (3) R1 = C20H41, R2 = етил, R3 = атом водню, Y = S та X = COOH 40 12 UA 109252 C2 2-етил-2-(тетрадецилтіо)бутанова кислота (4) R1 = C14H29, R2 = R3 = етил, Y = S та X = COOH Категорія B - Мононенасичені жирні кислоти: 5 2-етил-3-тіа-12Z-генейкозанова кислота (5) R1 = C18H35, R2 = етил, R3 = атом водню, Y = S та X = COOH 10 (Z)-2-етил-2-(октадец-9-енілтіо)бутанова кислота (6) R1 = C18H35, R2 = R3 = етил, Y = S та X = COOH Категорія C – Похідні поліненасичених жирних кислот: 15 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілтіо)бутанова кислота (7) R1 = C15H23, R2 = етил, R3 = атом водню, Y = S та X = COOH 20 2-етил-2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілтіо)бутанова кислота (8) R1 = C15H23, R2 = R3 = етил, Y = S та X = COOH 25 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)пропанова кислота (9) R1 = C20H31, R2 = метил, R3 = атом водню, Y = S та X = COOH 30 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутанова кислота (10) R1 = C20H31, R2 = етил, R3 = атом водню, Y = S та X = COOH 35 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)-2-метилпропанова кислота (11) R1 = C20H31, R2 = метил, R3 = метил, Y = S та X = COOH 13 UA 109252 C2 5 2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутанова кислота (12) R1 = C20H31, R2 = R3 = етил, Y = S та X = COOH 10 1-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)циклобутанкарбонова кислота (13) R1 = C20H31, R2 та R3 у комбінації утворюють циклобутанове кільце, Y = S та X = COOH 15 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)-2-фенілоцтова кислота (14) R1 = C20H31, R2 = феніл, R3 = атом водню, Y = S та X = COOH 20 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)-2-метоксіоцтова кислота (15) R1 = C20H31, R2 = метокси, R3 = атом водню, Y = S та X = COOH 25 2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаенілтіо)бутанова кислота (16) R1 = C22H33, R2 = етил, R3 = атом водню, Y = S та X = COOH 30 35 2-((4Z, 7Z, 10Z, 13Z, 16Z, 19Z)-докоза-4,7,10,13,16,19-гексаенілтіо)-2-етилбутанова кислота (17) R1 = C22H33, R2 = R3 = етил, Y = S та X = COOH 2-((9Z,12Z,15Z)-октадека-9,12,15-триенілтіо)бутанова кислота (18) 14 UA 109252 C2 R1 = C18H31, R2 = етил, R3 = атом водню, Y = S та X = COOH 5 10 2-етил-2-((9Z,12Z,15Z)-октадека-9,12,15-триенілтіо)бутанова кислота (19) R1 = C18H31, R2 = R3 = етил, Y = S та X = COOH пропан-1,2,3-триїл трис(2-((5Z, 8Z, 11Z, 14Z, 17Z)-ікоса-5, 8, 11, 14, 17пентаенілтіо)бутаноат) (20) R1 = C20H31, R2 = етил, R3 = атом водню, Y = S та X = карбонова кислота у формі тригліцериду Категорія D - Жирні кислоти, які містять потрійні зв’язки: 15 2-(тетрадец-12-инілтіо)бутанова кислота (21) R1 = C14H25, R2 = етил, R3 = атом водню, Y = S та X = COOH 20 2-етил-2-(тетрадец-12-инілтіо)бутанова кислота (22) R1 = C14H25, R2 = R3 = етил, Y = S та X = COOH 25 30 2-метокси-2-(тетрадец-12-инілтіо)оцтова кислота (23) R1 = C14H25, R2 = метокси, R3 = атом водню, Y = S та X = COOH Категорія E – Сульфони та сульфоксиди: 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілсульфініл)бутанова кислота (24) 15 UA 109252 C2 R1 = C15H23, R2 = етил, R3 = атом водню, Y = SO та X = COOH 5 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілсульфоніл)бутанова кислота (25) R1 = C15H23, R2 = етил, R3 = атом водню, Y = SO2 та X = COOH 10 2-((5Z,8Z, 11Z, 14Z, 17Z)-ікоса-5,8,11,14,17-пентаенілсульфініл)бутанова кислота (26) R1 = C20H31, R2 = етил, R3 = атом водню, Y = SO та X = COOH 15 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілсульфоніл)бутанова кислота (27) R1 = C20H31, R2 = етил, R3 = атом водню, Y = SO2 та X = COOH 20 2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілсульфініл)бутанова кислота (28) R1 = C20H31, R2 = R3 = етил, Y = SO та X = COOH 25 30 2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілсульфоніл)бутанова кислота (29) R1 = C20H31, R2 = R3 = етил, Y = SO2 та X = COOH Наведені вище сполуки категорій A-E, де R2 та R3 є різними, можуть існувати у стереоізомерних формах, тобто, охоплюються всі оптичні ізомери сполук та їх суміші. Отже, вищезгадані сполуки можуть бути присутніми як діастереомери, рацемати та енантіомери. Загальні способи синтезу для описаних сполук Сполуки загальної формули (I) можуть бути одержані з застосуванням таких загальних процедур: 16 UA 109252 C2 Спосіб I 5 10 15 20 25 30 Спосіб II Спирти, описані для способів I та II, можуть бути одержані безпосередньо з естерів карбонових кислот, наприклад, природних жирних кислот; наприклад, альфа-ліноленової кислоти, кон’югованої лінолевої кислоти, ейкозапентаенової кислоти (EPA) і т. ін., шляхом відновлення відновним агентом, таким, як алюмогідрид літію або діізобутилалюмінійгідрид при температурі від -10 до 0 °C. Спирти також можуть бути одержані шляхом розщеплення поліненасичених жирних кислот EPA та DHA, як описано у публікації Holmeide et al. (J.Chem. Soc, Perkin Trans. 1, 2000, 2271). У цьому разі можна почати з очищених EPA або DHA, але також можна починати й з риб’ячого жиру, що містить EPA та DHA у суміші. Сполуки формули (X) та (XI) виробляються промисловістю або є відомими з літератури, або ж приготовляються з застосуванням стандартних способів, відомих спеціалістам у даній галузі. Відщеплюваною групою (LG), присутньою у сполуках формули (XI), може бути, наприклад, мезилат, тозилат або прийнятний галоген, такий, як бром. За допомогою способу I одержані в результаті спирти можуть бути перетворені з застосуванням взаємного перетворення функціональних груп способами, відомими спеціалістам у даній галузі (етап I), на сполуки, у яких кінцеву гідроксигрупу було перетворено на відповідну відщеплювану групу (LG). До прийнятних відщеплюваних груп належать бром, мезилат та тозилат. Ці сполуки можуть далі піддаватися (етап II) реакції заміщення з відповідним чином заміщеними похідними тіооцтової кислоти (X) у присутності основи. З застосуванням способу II спирти можуть перетворюватися на відповідні тіоли (етап IV) способами, відомими спеціалістам у даній галузі. Тіоли можуть піддаватися подальшій реакції (етап V) у реакції заміщення зі сполуками формули (XI) у присутності основи у відповідній системі розчинників. Відповідні сульфоксиди та сульфони (Y = SO або SO 2) можуть бути одержані шляхом окиснення тіоетерів(Y = S) прийнятним окиснювальним агентом (етап III). Прикладами 17 UA 109252 C2 5 10 15 20 25 30 35 40 окиснювальних агентів є m-хлоро-пербензойна кислота (MCPBA), пероксид водню (H2O2) та оксон (пероксимоносульфат калію). При використанні 1 еквівалента або менше окиснювального агента головним продуктом є сульфоксид. При використанні надлишкової кількості окиснювального агента головним продуктом є сульфон. Якщо використовуваними похідними кислот є естери карбонових кислот, застосовують гідроліз для одержання вільних жирних кислот. Естерифікуюча група, така, як метильна або етильна група, може видалятися, наприклад, шляхом лужного гідролізу з застосуванням основи, такої, як гідроксид лужного металу, наприклад LiOH, NaOH або KOH, або шляхом застосування органічної основи, наприклад Et3N, разом з неорганічною сіллю, наприклад LiCl, у відповідній системі розчинників. Трет-бутильна група може видалятися, наприклад, шляхом обробки кислотою, наприклад органічною кислотою, такою, як трифторооцтова кислота або мурашина кислота, у відповідній системі розчинників. Арилметильна група, така, як бензильна група, може видалятися, наприклад, шляхом гідрогенізації над каталізатором, таким, як паладій на вугіллі, у відповідній системі розчинників. Одержання сполук формули I згідно зі способом I або II в результаті може давати суміші стереоізомерів. Якщо необхідно, ці ізомери можуть бути відокремлені за допомогою хіральних розщеплювальних агентів та/або за допомогою хіральної колонкової хроматографії з застосуванням способів, відомих спеціалістам у даній галузі. Спосіб III Сполуки формули (I), де X є карбоновою кислотою, у формі фосфоліпіду можуть бути одержані представленими нижче способами. Ацилування sn-гліцеро-3-фосфохоліну (GPC) активованою жирною кислотою, такою, як імідазоліди жирних кислот, є стандартною процедурою при синтезі фосфатидилхоліну. Його зазвичай здійснюють у присутності аніона DMSO з DMSO як розчинником (Hermetter; Chemistry and Physics of lipids, 1981, 28, 111). Sn-Гліцеро-3-фосфохолін, як адукт кадмію (II), також може піддаватися реакції з активованою імідазолідом жирною кислотою у присутності DBU (1,8діазабіцикло[5.4.0]ундец-7-ену) для одержання фосфатидилхоліну відповідної жирної кислоти (міжнародна заявка за номером PCT/GB2003/002582). Ферментне трансфосфатидилування може впливати на трансформацію фосфатидилхоліну до фосфатидилетаноламіну (Wang et al, J. Am. Chem. Soc, 1993, 115, 10487). Фосфоліпіди також можуть бути одержані шляхом ферментної естерифікації та трансестерифікації фосфоліпідів або ферментного трансфосфатидилування фосфоліпідів. (Hosokawa, J. Am. Oil Chem.Soc. 1995, 1287, Lilja-Hallberg, Biocatalysis, 1994, 195). Спосіб IV Сполуки формули (I), де X є карбоновою кислотою у формі тригліцериду, можуть бути одержані з застосуванням представленого нижче способу. Надлишкову кількість жирної кислоти з’єднують з гліцерином, застосовуючи диметиламінопіридин (DMAP) та 2-(1H-бензотриазол-1іл)-N,N,N',N'-тетраметилуронійгексафторофосфат (HBTU). 18 UA 109252 C2 5 Спосіб V Сполуки формули (I), де X є карбоновою кислотою у формі дигліцериду, можуть бути одержані шляхом реакції жирної кислоти (2 еквіваленти) з гліцерином (1 еквівалент) у присутності 1,3-дициклогексилкарбодиіміду (DCC) та 4-диметиламінопіридину (DMAP). Спосіб VI Сполуки формули (I), де X є карбоновою кислотою у формі моногліцериду, можуть бути одержані представленими нижче способами. 10 15 20 25 30 35 Ацилування 1,2-O-ізопропіліден-sn-гліцерину жирною кислотою з застосуванням DCC та DMAP у хлороформі забезпечує монодієноїлгліцерин. Видалення захисної ізопропіліденової групи здійснюють шляхом обробки захищеного гліцерину кислотою (HCl, оцтовою кислотою і т. ін.) (O'Brian, J.Org.Chem., 1996, 5914). Існує кілька способів синтезу для одержання моногліцеридів з жирною кислотою у 2-й позиції. Один спосіб передбачає естерифікацію жирної кислоти гліцидним спиртом у присутності 1-(3-диметиламінопропіл)-3-етилкарбодиімідгідрохлориду (EDC) та 4-диметиламінопіридину (DMAP) для одержання гліцидилової похідної. Обробка гліцидилової похідної трифторооцтовим ангідридом (TFAA) перед трансестерифікацією забезпечує моногліцерид (Parkkari et al, Bioorg. Med.Chem.Lett. 2006, 2437). Інші способи одержання моно-, ди- та тригліцеридів похідних жирних кислот описуються у міжнародній патентній заявці PCT/FR02/02831. Також існує можливість застосування ферментних процесів (ліпазних реакцій) для трансформації жирної кислоти до моно-, ди-, три-гліцериду. 1,3-регіоспецифічна ліпаза з грибка Mucor miehei може застосовуватися для одержання тригліцеридів або дигліцеридів з поліненасичених жирних кислот та гліцерину. Інша ліпаза, нерегіоспецифічна дріжджова ліпаза з Candida antartica, є високоефективною для утворення тригліцеридів з поліненасичених жирних кислот (Haraldsson, Pharmazie, 2000, 3). Одержання, характеризація та біологічні випробування конкретних похідних жирних кислот формули (I) Далі винахід описується на представлених нижче необмежувальних прикладах, у яких у відповідних випадках застосовуються способи, відомі спеціалістам у галузі хімії, та способи, аналогічні описаним у цих прикладах. Якщо не вказується іншого: - випарювання здійснювали шляхом роторного випарювання in vacuo; - усі реакції здійснювали при кімнатній температурі, як правило, у межах 18-25 °C, з розчинниками, які відповідали вимогам для HPLC, у безводних умовах; 19 UA 109252 C2 5 10 15 - колонкову хроматографію здійснювали за допомогою флеш-процедури на силікагелі 40-63 мкм (Merck) або Armen Spotflash з застосуванням попередньо набитих колонок з силікагелем "MiniVarioFlash", "SuperVarioFlash", "SuperVarioPrep" або "EasyVarioPrep" (Merck); - кількість виходу вказується лише для пояснення і не обов’язкового означає максимально можливу кількість; - значення зсуву ядерного магнітного резонансу (ЯМР) записували за допомогою спектрометра Bruker Avance DPX 200 або 300, і пікові значення кратності показано таким чином: s – синглет; d – дублет; dd – подвійний дублет; t – триплет; q – квартет; p – пентет; m – мультиплет; br – широкий; - мас-спектри записували за допомогою спектрометра LC/MS. Відокремлення здійснювали з застосуванням модуля Agilent 1100 на колонці з градієнтним елююванням Eclipse XDB-C18 2.1 x 150 мм. Як елюент застосовували градієнт 5-95 % ацетонітрилу у буферах, які містили 0,01 % трифторооцтової кислоти або 0,005 % формату натрію. Мас-спектри записували за допомогою мас-спектрометра G 1956 A (електророзпилення, 3000 В) з перемиканням між позитивним та негативним режимами іонізації. Одержання проміжних сполук Приклад 1: Одержання S-(3Z, 6Z, 9Z, 12Z)-пентадека-3,6,9,12-тетраеніл етантіоату. 20 25 30 35 40 45 50 Трифенілфосфін (PPh3) (41,7 г, 159 ммоль) розчиняли у сухому тетрагідрофурані (THF) (250 мл) при 0 °C в інертній атмосфері і додавали діізопропіл азодикарбоксилат (DIAD) (30,8 мл, 159 ммоль). Суміш перемішували при 0 °C протягом 40 хвилин, а потім по краплях додавали розчин (all-Z)-3,6,9,12-пентадекатетраенолу (17,5 г, 79,4 ммоль) та тіооцтової кислоти (11,4 мл, 159 ммоль) у сухому THF (150 мл). Утворену в результаті каламутну суміш перемішували при 0 °C протягом 40 хвилин, потім при навколишній температурі протягом двох годин. Додавали гептан (300 мл), суміш перемішували протягом десяти хвилин і осаджену білу тверду речовину видаляли шляхом фільтрації. Цю процедуру повторювали двічі і, нарешті, залишок після концентрування перемішували у гептані (100 мл) протягом 16 годин. Фільтрація та очищення залишку шляхом флеш-хроматографії (1 % EtOAc у гептані) забезпечували 13,7 г (62 %-й вихід) названої сполуки у вигляді олії. 1 H-ЯМР (200 MГц, CDCl3): δ 0,96 (t, 3H), 2,05 (m, 2H), 2,31 (s+m, 5H), 2,76-2,92 (m, 8H), 5,325,45 (m, 8H). Приклад 2: Одержання (3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраен-1-тіолу. LiAlH4 (2,05 г, 54,1 ммоль) суспендували у сухому діетиловому етері (100 мл) при 0 °C в інертній атмосфері. До цієї суспензії по краплях додавали розчин S-(3Z,6Z,9Z,12Z)-пентадека3,6,9,12-тетраеніл етантіоату (13,7 г, 49,2 ммоль) у сухому діетиловому етері (50 мл) і утворену в результаті сіру суміш перемішували при 0 °C протягом десяти хвилин, а потім при навколишній температурі протягом 30 хвилин. Суміш охолоджували до ~5 °C, додавали 1M HCl до pH=2 і фільтрували крізь короткий фільтр з целіту. Фільтр промивали водою та діетиловим етером, фази розділяли і водну фазу двічі екстрагували діетиловим етером (по 100 мл). Комбіновані органічні екстракти висушували (Na2SO4), фільтрували й концентрували під зниженим тиском для одержання 7,8 г (67 %-й вихід) названої сполуки у вигляді олії. 1 H-ЯМР (200 MГц, CDCl3): δ 0,96 (t, 3H), 2,06 (m, 2H), 2,39 (m, 2H), 2,51 (m, 2H), 2,81 (m, 6H), 5,28-5,54 (m, 8H); MS (ESI): 235 [M-H]. Приклад 3: Одержання S-(5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаеніл етантіоату. 20 UA 109252 C2 5 10 15 20 25 30 35 Трифенілфосфін (21,0 г, 80 ммоль) розчиняли у сухому THF (170 мл) при 0 °C в інертній атмосфері і по краплях додавали DIAD (15,8 мл, 80 ммоль). Після 40 хвилин при 0 °C білу суспензію по краплях додавали до розчину (5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаен-1-олу (11,5 г, 40 ммоль) та тіооцтової кислоти (5.7 мл, 80 ммоль) у сухому THF (50 мл) протягом 15 хвилин. Утворену в результаті каламутну суміш перемішували при 0 °C протягом 30 хвилин, а потім при навколишній температурі протягом 1,5 години. Додавали гептан (200 мл), суміш перемішували протягом десяти хвилин і осаджену білу тверду речовину видаляли шляхом фільтрації і промивали гептаном (150 мл). Залишок концентрували для видалення більшості THF і перемішували при навколишній температурі протягом 18 годин. Суміш фільтрували, концентрували і додавали гептан (200 мл). Утворену в результаті суміш перемішували протягом 2 годин, фільтрували й випарювали. Залишок очищали шляхом флеш-хроматографії на силікагелі, застосовуючи EtOAc:гептан (2:98), потім EtOAc:гептан (4:96) і, нарешті, EtOAc:гептан (5:95). Концентрування відповідних фракцій забезпечувало 11,0 г (79 %-й вихід) названої сполуки у вигляді олії. 1 H-ЯМР (300 MГц, CDCl3): δ 0,95 (t, 3H, J=7,5 Hz), 1,40 (m, 2H), 1,58 (m, 2H), 2,06 (m, 4H), + 2,29 (s, 3H), 2,77 - 2,87 (m, 10H), 5,25 - 5,42 (m, 10H); MS (Cl (CH4)): 387 [M+C3H5] , 375 + + + + [M+C2H5] , 347 [M+H] , 333 [M-CH2] , 305 [R-SH] . Приклад 4: Одержання (5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаен-1-тіолу. S-(5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаеніл етантіоат (7,00 г, 20,2 ммоль) розчиняли у MeOH (100 мл) шляхом перемішування протягом 10 хвилин до розчинення крапельок олії, перед додаванням безводного карбонату калію, K2CO3 (2,79 г, 20,2 ммоль) однією порцією. Суміш перемішували протягом 1 години 20 хвилин при навколишній температурі і гасили шляхом додавання 1 M HCl (50 мл) та води (150 мл). Додавали білу каламутну суміш Et 2O (250 мл) і фази розділяли. Водну фазу екстрагували Et 2O (2x250 мл). Комбіновані органічні фази промивали сольовим розчином (250 мл) і висушували (MgSO 4). Фільтрація та випарювання забезпечували названу сполуку у вигляді олії (5,99 г, 97 %-й вихід), яку застосовували без подальшого очищення. 1 H-ЯМР (300 MГц, CDCl3): δ 0,96 (t, 3H, J=7,5 Hz), 1,31 (t, 1H, J=7,8 Hz), 1,44 (m, 2H), 1,61 (m, 2H), 2,06 (m, 4H), 2,51 (m, 2H), 2,77 - 2,85 (m, 8H), 5,28 -5,41 (m, 10H); MS (Cl (CH4)): 345 + + + + [M+C3H5] , 333 [M+C2H5] , 305 [M+H] 271 [M-SH] . Приклад 5: Одержання (5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаеніл метансульфонату 40 45 50 Et3N (1,50 мл, 10,8 ммоль) та метансульфоніл хлорид (402 мкл, 5,20 ммоль) додавали до розчину (5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаен-1-олу (1,15 г, 4,0 ммоль) у CH2CI2 (40 мл), який тримали при 0 °C в атмосфері азоту. Суміш перемішували при 0 °C протягом однієї години і виливали у крижану воду (100 г) і водну фазу екстрагували Et 2O (50 мл). До комбінованих органічних екстрактів додавали 0,5 M H2SO4 (35 мл), органічну фазу промивали NaHCO3 (насичен. водн.) (25 мл) перед висушуванням (Mg2SO4, 10 г). Фільтрація та концентрування in vacuo забезпечували 1,24 г необробленої олії. Очищення на колонці Armen, SVP D26, набитою 30 г 15-40 мкм силікагелю Merck, з потоком 20 мл/хв, УФ 210 нм, зі збиранням фракції 15 мл, здійснювали з застосуванням градієнтного елюювання: (спочатку гептан: EtOAc (100:0) зі збільшенням протягом 10 хв до 10 % EtOAc, з наступним збільшенням протягом 5 хв до 20 % EtOAc (утримання 10 хв), з наступним збільшенням протягом 5 хв до 21 UA 109252 C2 5 40 % EtOAc (утримання 0 хв). Фракції 6-14 забезпечували 1,16 г (79 %-й вихід) названої сполуки у вигляді олії. 1 H-ЯМР (300 MГц, CDCl3): δ 0,97 (t, 3H), 1,50 (m, 2H), 1,75 (m, 2H), 2,03-2,15 (m, 4H), 2,762,86 (m, 8H), 2,99 (s, 3H), 4,22 (t, 2H), 5,27-5,40 (m, 10H); MS (електророзпилення): 389,2 + [M+Na] . Приклад 6: Одержання (4S,5R)-3-((S)-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутаноїл)-4метил-5-фенілоксазолідин-2-ону та (4S,5R)-3-((R)-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17пентаенілтіо)бутаноїл)-4-метил-5-фенілоксазолідин-2-ону 10 15 20 25 30 35 До суміші 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутанової кислоти (3,0 г, 7,9 ммоль) у сухому дихлорометані (40 мл), яку тримали при 0 °C в атмосфері азоту, додавали DMAP (1,0 г, 9,5 ммоль) та 1,3-дициклогексилкарбодиімід (DCC) (1,8 г, 8,7 ммоль). Утворену в результаті суміш перемішували при 0 °C протягом 20 хвилин, додавали (4S,5R)-4-метил-5феніл-2-оксазолідинон (1,7 г, 9,5 ммоль) і утворену в результаті каламутну суміш перемішували при навколишній температурі протягом 24 годин. Суміш фільтрували й концентрували під зниженим тиском для одержання необробленого продукту, який містив потрібний продукт як суміш двох діастереомерів. Залишок очищали шляхом флеш-хроматографії за допомогою пристрою Armen Spotflash на силікагелі з застосуванням 2 % етилацетату у гептані як елюента. Два діастереомери розділяли і відповідні фракції концентрували. (4S,5R)-3-((R)-2((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутаноїл)-4-метил-5-фенілоксазолідин-2-он елюювали першим і одержували у кількості 0,95 г (47 %-й вихід) у вигляді олії. 1,47 г (67 %-й вихід) (4S,5R)-3-((S)-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутаноїл)-4-метил-5фенілоксазолідин-2-ону одержували у вигляді олії. (4S,5R)-3-((R)-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутаноїл)-4-метил-5фенілоксазолідин-2-он (E1): 1 H-ЯМР (300 MГц, CDCl3): δ 0,93-1,06 (m, 9H), 1,45-1,60 (m, 4H), 1,75-1,85 (m, 1H), 2,05-2,15 (m, 5H), 2,55-2,70 (m, 2H), 2,87 (m, 8H), 4,69 (t, 1H), 4,79 (p, 1H), 5,30-5,45 (m, 10H), 5,72 (d, 1H), 7,32 (m, 2H), 7,43 (m, 3H). (4S,5R)-3-((S)-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутаноїл)-4-метил-5фенілоксазолідин-2-он: 1 H-ЯМР (300 MГц, CDCl3): δ 0,93 (d, 3H), 0,99 (t, 3H), 1,05 (t, 3H), 1,40-1,56 (m, 4H), 1,50-1,75 (m, 1H), 2,00-2,15 (m, 5H), 2,47-2,65 (m, 2H), 2,83 (m, 8H), 4,62 (t, 1H), 4,85 (p, 1H), 5,25-5,45 (m, 10H), 5,70 (d, 1H), 7,32 (m, 2H), 7,43 (m, 3H). Одержання молекул-мішеней Приклад 7: Одержання етил 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілтіо)бутаноату (30) 40 45 50 До розчину 3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраен-1-тіолу (9,80 г, 41,5 ммоль) у сухому диметилформаміді (DMF) (70 мл) при 0 °C в інертній атмосфері додавали NaH (60 % у мінеральній олії, 1,82 г, 45,6 ммоль) і перемішували при цій температурі протягом десяти хвилин. Додавали етилбромобутират (6,39 мл, 43,5 ммоль) і суміш перемішували при навколишній температурі протягом 30 хвилин. Суміш розподіляли між насиченим NH 4Cl (150 мл) та гептаном (150 мл). Водний шар двічі екстрагували гептаном (по 100 мл) і комбінований органічний екстракт промивали водою (100 мл) та сольовим розчином (100 мл). Органічний шар висушували (Na2SO4), фільтрували й концентрували. Залишок очищали шляхом флешхроматографії на силікагелі (гептан : EtOAc 99:1, потім 95:5). Концентрування відповідних фракцій забезпечувало 14,1 г (97 %-й вихід) названої сполуки у вигляді олії. 22 UA 109252 C2 1 5 10 15 20 H-ЯМР (200 MГц, CDCl3): δ 0,92-1,01 (2 x t, 6H), 1,27 (t, 3H), 1,60-1,80 (m,1H), 1,80-1,95 (m,1H), 2,00-2,15 (m, 2H) 2,25-2,45 (m, 2H), 2,60-2,75 (m, 2H), 2,80 (m, 6H), 3,15 (t, 1H), 4,17 (q, + 2H), 5,31-5,43 (m, 8H); MS (ESI): 373 [M+Na] . Приклад 8: Одержання етил 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілсульфоніл)бутаноату (31). Етил 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілтіо)бутаноат (2,7 г, 7,7 ммоль) розчиняли у сухому CHCl3 (40 мл) і розчин охолоджували до -20 °C в інертній атмосфері. По краплях додавали мета-хХлоропероксибензойну кислоту (mCPBA) (~77 %, 4,0 г, 18 ммоль), розчинену в сухому CHCl3 (10 мл) і одержаний в результаті розчин перемішували при -20 °C протягом 30 хвилин, залишали до поступового досягнення навколишньої температури, а потім перемішували до наступного дня. Розчинники випарювали in vacuo, до залишку додавали гептан (30 мл) і утворений в результаті білий осад видаляли шляхом фільтрації. Фільтрат концентрували in vacuo і до залишку додавали гептан (10 мл). Утворений в результаті білий осад знову видаляли шляхом фільтрації. Фільтрат концентрували in vacuo і залишок очищали шляхом флеш-хроматографії на силікагелі (гептан : EtOAc 4:1). Концентрування відповідних фракцій забезпечувало 0,37 г (13 %-й вихід) названої сполуки у вигляді олії. 1 H ЯМР (300 MГц, CDCl3): δ 0,96 (t, 3H), 1,03 (t, 3H), 1,31 (t, 3H), 2,02-2,15 (m, 4H), 2,62 (m, 2H), 2,82 (m, 6H), 3,05 (m, 1H), 3,20 (m, 1H), 3,70 (dd, J=10,3 Hz, J=4,7 Hz, 1H), 4,28 (q, 2H), 5,26+ 5,41 (m, 7H), 5,46-5,52 (m, 1H); MS (електророзпилення): 405.2 [M+Na] Приклад 9: Одержання 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілтіо)бутанової кислоти (7). 25 30 35 Етил 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілтіо)бутаноат (14,1 г, 40,2 ммоль) розчиняли в етанолі (200 мл) і додавали розчин LiOH x H 2O (13,5 г, 322 ммоль) у воді (50 мл). Утворений в результаті каламутний розчин перемішували при 70 °C в інертній атмосфері протягом 90 хвилин, охолоджували, додавали воду (100 мл) та 3M HCl до pH=2. Суміш тричі екстрагували гептаном (по 100 мл). Комбіновані органічні екстракти висушували (Na 2SO4), фільтрували й концентрували під зниженим тиском для одержання 11,8 г (91 %-й вихід) названої сполуки у вигляді олії. 1 H-ЯМР (200 MГц, CDCl3): δ 0,91-1,06 (2 x t, J=7,2 Hz, J=7,5 Hz, 6H), 1,60-1,80 (m, 1H), 1,801,95 (m, 1H), 2,05 (p, J=7,2 Hz, 2H), 2,35 (m, 2H), 2,60-2,75 (m, 2H), 2,75-2,90 (m, 6H), 3,14 (t, J=7,1 Hz, 1H), 5,31-5,47 (m, 8H); MS (ESI): 321 [M-H] . Приклад 10: Одержання 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілсульфініл)бутанової кислоти (24) 40 45 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілтіо)бутанову кислоту (0,20 г, 0,62 ммоль) розчиняли у сухому CHCl3 (10 мл) і розчин охолоджували до -20 °C в інертній атмосфері. По краплях додавали mCPBA (~77 %, 0,15 г, 0,68 ммоль), розчинений у сухому CHCl3 (2 мл), і одержаний в результаті розчин перемішували при -20 °C протягом 35 хвилин. Розчинники випарювали in vacuo, до залишку додавали гептан (10 мл) і утворений в результаті білий осад видаляли шляхом фільтрації. Фільтрат концентрували in vacuo і до залишку додавали гептан (10 мл). Утворений в результаті білий осад знову видаляли шляхом фільтрації. Фільтрат 23 UA 109252 C2 5 концентрували in vacuo і залишок очищали шляхом флеш-хроматографії на силікагелі w (гептан:EtOAc + /1 % HCOOH 4:1 - 1:1). Концентрування відповідних фракцій забезпечувало 100 мг (48 %-й вихід) названої сполуки у вигляді олії. 1 H ЯМР (200 MГц, CDCl3): δ 0,95 (t, 3H), 1,10 (2 x q, 3H), 1,70-1,80 (m, 1H), 2,05 (m, 3,5H), 2,20-2-40 (m, 0,5H), 2,60 (m, 2H), 2,81 (m, 7H), 2,90-3,00 (m, 0,5H), 3,10-3,25 (m, 1H), 3,70 (dd, 0,5H), 5,25-5,55 (m, 8H); MS (електророзпилення): 337,1 [M-H] Приклад 11: Одержання 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілсульфоніл)бутанової кислоти (25) 10 15 20 Етил 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілсульфоніл)бутаноат (370 мг, 0,97 ммоль) розчиняли в етанолі (10 мл) і додавали розчин LiOH в H 2O (1 M, 3,9 мл, 3,9 ммоль). Утворену в результаті суміш перемішували при 60 °C протягом трьох годин, охолоджували, додавали 0,1 M HCl до pH=2 і двічі екстрагували діетиловим етером (по 15 мл). Комбінований органічний шар промивали сольовим розчином (15 мл), висушували, фільтрували, концентрували in vacuo і очищали шляхом флеш-хроматографії на силікагелі (гептан : EtOAc w /5 % HCOOH 4:1). Концентрування відповідних фракцій забезпечувало 250 мг (73 %-й вихід) названої сполуки у вигляді олії. 1 H ЯМР (300 MГц, CDCl3): δ 0,96 (t, 3H), 1,09 (t, 3H), 2,02-2,25 (m, 4H), 2,65 (m, 2H), 2,82 (m, 6H), 3,10 (m, 1H), 3,20 (m, 1H), Приклад 12: Одержання етил 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)пропаноату (32). 25 30 35 40 (5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаен-1-тіол (305 мг, 1.00 ммоль) додавали до розчину NaH (60 % у мінеральній олії, 44 мг, 1,10 ммоль) у сухому DMF (10 мл), який тримали при 0 °C в інертній атмосфері. Через десять хвилин додавали етилбромопропіонат (136 мкл, 1,05 ммоль) і суміш перемішували протягом 1,5 години при 0 °C. До реакційної суміші додавали насичен. водн. NH4Cl (20 мл) та гептан (50 мл). Фази розділяли і водну фазу екстрагували гептаном (2x25 мл). Комбіновані органічні фази промивали сольовим розчином (25 мл), висушували (MgSO4), фільтрували й випарювали для одержання 376 мг названої сполуки у вигляді необробленої олії. Очищення шляхом флеш-хроматографії на силікагелі з застосуванням градієнтного елюювання (починаючи з чистого гептану і з поступовим підвищенням до гептану:EtOAc 95:5) забезпечувало 318 мг (79 %-й вихід) названої сполуки у вигляді олії. 1 H-ЯМР (300 MГц, CDCl3): δ 0,95 (t, 3H), 1,25 (t, 3H), 1,41 (d, 3H), 1,44 (m, 2H), 1,58 (m, 2H), 2,06 (m, 4H), 2,60 (m, 2H), 2,71 -2,85 (m, 8H), 3,36 (d, 1H), 4,17 (m, 2H), 5,25- 5,40 (m, 10H); MS (Cl + + + + + .+ (CH4)): 445 [M+C3H5] , 433 [M+C2H5] , 405 [M+H] , 359 [M-OEt] , 331 [M-CO2Et] , 303 [R-S] . Приклад 13: Одержання етил 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутаноату (33). 45 50 До розчину (5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаен-1-тіолу (305 мг, 1,00 ммоль) у сухому DMF (10 мл) при 0 °C в інертній атмосфері додавали NaH (60 % у мінеральній олії, 44 мг, 1,1 ммоль). Через п’ятнадцять хвилин додавали етилбромобутират (154 мкл, 1,05 ммоль). Суміш перемішували протягом 1 години при 0 °C. Насичен. водн. NH4Cl (20 мл), воду (20 мл) і гептан (50 мл) додавали. Фази розділяли і водну фазу екстрагували гептаном (2x25 мл). 24 UA 109252 C2 5 10 Комбіновані органічні фази промивали водою (25 мл) та сольовим розчином (25 мл), висушували (MgSO4), фільтрували й випарювали для одержання 379 мг названої сполуки у вигляді необробленої олії. Очищення шляхом флеш-хроматографії на силікагелі з застосуванням градієнтного елюювання (починаючи з чистого гептану і з поступовим підвищенням до гептану:EtOAc 95:5) забезпечувало 345 мг (82 %-й вихід) названої сполуки у вигляді олії. 1 H-ЯМР (300 MГц, CDCl3): δ 0,93 - 1,00 (m, 6H), 1,25 (t, 3H), 1,44 (m, 2H), 1,59 (m, 2H), 1,68 (m, 1H), 1,87 (m, 1H), 2,07 (m, 4H), 2,57 (m, 2H), 2,73 - 2,88 (m, 8H), 3,12 (m, 1H), 4,17 (m, 2H), + + + + 5,27- 5,46 (m, 10H); MS (Cl (CH4)): 459 [M+C3H5] , 447 [M+C2H5] , 419 [M+H] , 373 [M-OEt] , 345 + .+ [M-CO2Et] , 303 [R-S] . Приклад 14: Одержання 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутанової кислоти (10) 15 20 25 30 35 40 45 50 Етил 2-((5Z,8Z, 11Z, 14Z, 17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутаноат (209 мг, 0,50 ммоль) розчиняли в етанолі (2,5 мл) і додавали до розчину LiOH x H 2O (168 мг, 4,0 ммоль) у воді (2.5 мл). Утворений в результаті каламутний розчин перемішували при 70 °C в інертній атмосфері протягом 2 годин, охолоджували і додавали воду (10 мл) та 1 M HCl (5 мл) до pH = 1-2. Суміш екстрагували гептаном (2 x 20 мл) та діетиловим етером (20 мл). Комбіновані органічні екстракти висушували (MgSO4), фільтрували й концентрували під зниженим тиском для одержання 154 мг названої сполуки у вигляді необробленої олії. Очищення шляхом флешхроматографії на силікагелі з застосуванням градієнтного елюювання (починаючи з чистого гептану і з поступовим підвищенням до гептану:EtOAc (з 5 % HOAc) 80:20) забезпечувало 151 мг (77 %-й вихід) названої сполуки у вигляді олії. 1 H-ЯМР (300 MГц, CDCl3): δ 0,95 (t, 3H), 1,02 (t, 3H), 1,46 (m, 2H), 1,52 -1,78 (m, 3H), 1,90 (m, 1H), 2,05 (m, 4H), 2,63 (m, 2H), 2,75 - 2,90 (m, 8H), 3,14 (t, 1H)(m, 1H), 4,17 (m,2H), 5,27- 5,46 (m, 10H). Приклад 15: Одержання (S)-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутанової кислоти (34). Пероксид водню (30 % у воді, 0,71 мл, 6,91 ммоль) та моногідрат гідроксиду літію (0,15 г, 3,46 ммоль) додавали до розчину (4S,5R)-3-((S)-2-((5Z,8Z, 11Z, 14Z, 17Z)-ікоса-5,8,11,14,17пентаенілтіо)бутаноїл)-4-метил-5-фенілоксазолідин-2-ону (0,95 г, 1,73 ммоль) у тетрагідрофурані (12 мл) та воді (4 мл), який тримали при 0 °C в атмосфері азоту. Реакційну суміш перемішували при 0 °C протягом 30 хвилин. Додавали 10 % Na2SO3(aq) (30 мл), pH доводили до ~2 за допомогою 5M HCl і суміш двічі екстрагували гептаном (30 мл). Комбінований органічний екстракт висушували (Na2SO4), фільтрували й концентрували. Залишок піддавали флеш-хроматографії на силікагелі з застосуванням сумішей гептану та етилацетату (98:8 -> 1:1) зі збільшуваною полярністю як елюента. Концентрування відповідних фракцій забезпечувало 0,15 г (17 %-й вихід) названого продукту у вигляді олії. 1 H-ЯМР (300 MГц, CDCl3): δ 1,00 (t, 3H), 1,07 (t, 3H), 1,46 (m, 2H), 1,60-1,75 (m, 3H), 1,85 (m, 1H), 2,10 (m, 4H), 2,66 (m, 2H), 2,80-2,90 (m, 8H), 3,21 (t, 1H), 5,35-5,45 (m, 10H); MS (електророзпилення): 389,3 [M-H] ; [α]D-49° (c=0,12, етанол). Приклад 16: Одержання (R)-2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутанової кислоти (35). 25 UA 109252 C2 5 10 15 20 25 30 35 40 45 50 Пероксид водню (30 % у воді, 1,04 мл, 10,2 ммоль) та моногідрат гідроксиду літію (0,21 г, 5,09 ммоль) додавали до розчину (4S,5R)-3-((R)-2-((5Z,8Z, 11Z, 14Z,17Z)-ікоса-5,8,11,14,17пентаенілтіо)бутаноїл)-4-метил-5-фенілоксазолідин-2-ону (1,40 г, 2,55 ммоль) у тетрагідрофурані (15 мл) та воді (5 мл), який тримали при 0 °C в атмосфері азоту. Реакційну суміш перемішували при 0 °C протягом 45 хвилин. Додавали 10 % Na2SO3 (aq) (35 мл), pH доводили до ~2 за допомогою 5M HCl і суміш двічі екстрагували гептаном (35 мл). Комбінований органічний екстракт висушували (Na2SO4), фільтрували й концентрували. Залишок піддавали флеш-хроматографії на силікагелі з застосуванням сумішей гептану та етилацетату (98:8 -> 1:1) зі збільшуваною полярністю як елюента. Концентрування відповідних фракцій забезпечувало 1 0,17 г (22 %-й вихід) названого продукту у вигляді олії. H-ЯМР (300 MГц, CDCl3): δ 1,00 (t, 3H), 1,07 (t, 3H), 1,46 (m, 2H), 1,60-1,75 (m, 3H), 1,85 (m, 1H), 2,10 (m, 4H), 2,66 (m, 2H), 2,80-2,90 (m, 8H), 3,21 (t, 1H), 5,35-5,45 (m, 10H); MS (електророзпилення): 389,3 [M-H] ; [α]D+50° (c=0,14, етанол). Приклад 17: Одержання етил 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)-2-метилпропаноату (36) До розчину (5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаен-1-тіолу (305 мг, 1,00 ммоль) у сухому DMF (10 мл) при 0 °C в інертній атмосфері додавали NaH (60 % у мінеральній олії, 44 мг, 1,1 ммоль). Через п’ятнадцять хвилин додавали етил 2-бромо-2-метилбутират (154 мкл, 1,05 ммоль) і суміш перемішували протягом 1,5 години при 0 °C. Реакційну суміш гасили шляхом додавання насиченого водного NH4Cl (20 мл). Додавали воду (20 мл) та гептан (50 мл) і фази розділяли. Водну фазу екстрагували гептаном (2x25 мл). Комбіновані органічні фази промивали водою (25 мл) та сольовим розчином (2 x 25 мл), висушували (MgSO 4, фільтрували й випарювали для одержання 377 мг названої сполуки у вигляді необробленої олії. Очищення шляхом флеш-хроматографії на силікагелі з застосуванням ізократичного елюювання (гептан:EtOAc 98:2) забезпечувало 307 мг (77 %-й вихід) названої сполуки у вигляді олії. 1 H-ЯМР (300 MГц, CDCl3): δ 0,95 (t, 3H), 1,28 (t, 3H), 1,42 (m, 2H), 1,48 (s, 6H), 1,54 (m, 2H), 2,06 (m, 4H), 2,58 (m, 2H), 2,71 - 2,85 (m, 8H), 4,15 (m, 2H), 5,22- 5,48 (m, 10H); MS (Cl (CH4)): 459 + + + + + .+ [M+C3H5] , 447 [M+C2H5] , 419 [M+H] , 373 [M-OEt] , 345 [M-CO2Et] , 303 [R-S] . Приклад 18: Одержання 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)-2-метилпропанової кислоти (11) Етил 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)-2-метилпропаноат (209 мг, 0,50 ммоль) розчиняли в етанолі (2.5 мл) і додавали до розчину LiOH x H 2O (168 мг, 4,0 ммоль) у воді (2,5 мл). Утворений в результаті каламутний розчин перемішували при 70 °C в інертній атмосфері протягом 2 годин, охолоджували і додавали воду (10 мл) та 1 M HCl (5 мл) до pH = 12. Суміш тричі екстрагували гептаном (3 x 20 мл). Комбіновані органічні екстракти висушували (MgSO4), фільтрували й концентрували під зниженим тиском для одержання 101 мг названої сполуки у вигляді необробленої олії. Очищення шляхом флеш-хроматографії на силікагелі з застосуванням градієнтного елюювання (починаючи з чистого гептану і з поступовим підвищенням до гептану:EtOAc (з 5 % HOAc) 80:20) забезпечувало 78 мг (40 %) названої сполуки у вигляді олії. 1 H-ЯМР (300 MГц, CDCl3): δ 0,95 (t, 3H), 1,35 - 1,66 (m, 4H), 1,50 (s, 6H), 2,07 (m, 4H), 2,63 (t, 3H), 2,70 - 2,92 (m, 8H), 5,13 - 5,50 (m, 10H). Приклад 19: Одержання етил 1-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17пентаенілтіо)циклобутанкарбоксилату (37). 26 UA 109252 C2 5 10 15 До розчину (5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаен-1-тіолу (305 мг, 1,00 ммоль) у сухому DMF (10 мл) при 0 °C в інертній атмосфері додавали NaH (60 % у мінеральній олії, 44 мг, 1,1 ммоль). Через п’ятнадцять хвилин додавали етил 2-бромо-циклобутан карбоксилат (170 мкл, 1,05 ммоль) і суміш перемішували протягом 1,5 години при 0 °C. Реакцію гасили шляхом додавання насиченого водного NH4Cl (20 мл). Додавали гептан (50 мл) і фази розділяли. Водну фазу екстрагували гептаном (2x25 мл). Комбіновані органічні фази промивали водою (25 мл) та сольовим розчином (25 мл), висушували (MgSO 4), фільтрували й випарювали для одержання 409 мг названої сполуки у вигляді необробленої олії. Очищення шляхом флеш-хроматографії на силікагелі з застосуванням ізократичного елюювання (гептан:ацетон 98:2) забезпечувало 243 мг (56 %-й вихід) названої сполуки у вигляді олії. 1 H-ЯМР (300 MГц, CDCl3): δ 0,95 (t, 3H), 1,27 (t, 3H), 1,42 (d, 3H), 1,54 (m, 2H), 1,84 (m, 1H), 1,96 - 2,23 (m, 7H), 2,51 (m, 2H), 2,60 (m, 2H), 2,73 - 2,90 (m, 8H), 4,18 (m, 2H), 5,23- 5,43 (m, 10H); + + + + + .+ MS (Cl (CH4)): 471 [M+C3H5] , 459 [M+C2H5] , 431 [M+H] , 385 [M-OEt] , 357 [M-CO2Et] , 303 [R-S] . Приклад 20: Одержання 2-етил-2-((5Z,8Z, 11Z, 14Z, 17Z)-ікоса-5,8,11,14,17-пентаенілтіо)бутанової кислоти (12). 20 25 30 35 NaOEt (21 мас. % в EtOH, 0,37 мл, 0,98 ммоль) по краплях додавали до розчину 2меркапто-2-етилмасляної кислоти (0,08 г, 0,49 ммоль) у сухому EtOH (7 мл), який тримали при 0 °C в інертній атмосфері. Утворену в результаті суміш перемішували при 0 °C протягом 30 хвилин, перш, ніж по краплях додавати розчин (5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17пентаенілметансульфонату (0,15 г, 0,41 ммоль) у сухому EtOH (3 мл). Утворену в результаті каламутну суміш перемішували при навколишній температурі протягом 24 годин, виливали у NH4Cl (насичен.)(водн.) (15 мл), додавали 3M HCl до pH ~2 перед дворазовим екстрагуванням EtOAc (2x20 мл). Комбіновані органічні екстракти промивали сольовим розчином (10 мл), висушували (MgSO4), фільтрували й випарювали in vacuo. Залишок очищали шляхом флешхроматографії на силікагелі з застосуванням градієнта 10-25 % етилацетату у гептані як елюента. Концентрування відповідних фракцій забезпечувало 0,12 г (70 %-й вихід) названої сполуки у вигляді олії. 1H-ЯМР (300 MГц, CDCl3): δ 0,88-1,02 (m, 9H), 1,45-1,58 (2xm, 4H), 1,72 (m, 2H), 1,82 (m, 2H) 2,09 (m, 4H), 2,53 (t, 2H), 2,76-2,86 (m, 8H), 5,29-5,39 (m, 10H, MS (електророзпилення): 417,3 [MH] ; Приклад 21: Одержання етил етил 2-((5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаенілтіо)-2фенілацетату (38). 40 45 До розчину (5Z,8Z,11Z,14Z,17Z)-ікоса-5,8,11,14,17-пентаен-1-тіолу (305 мг, 1,00 ммоль) у сухому DMF (10 мл) при 0 °C в інертній атмосфері додавали NaH (60 % у мінеральній олії, 44 мг, 1,1 ммоль). Через п’ятнадцять хвилин додавали етил 2-бромо-2-фенілацетат (255 мг, 1,05 ммоль) і суміш перемішували протягом 1,5 години при 0 °C. Реакційну суміш гасили шляхом додавання насиченого водного NH4Cl (25 мл). Додавали гептан (50 мл) і фази розділяли. Водну фазу екстрагували гептаном (2x25 мл). Комбіновані органічні фази промивали водою (25 мл) та сольовим розчином (25 мл), висушували (MgSO 4), фільтрували й випарювали для одержання 27 UA 109252 C2 5 10 15 20 453 мг названої сполуки у вигляді необробленої олії. Очищення шляхом флеш-хроматографії на силікагелі з застосуванням ізократичного елюювання (гептан:EtOAc 98:2) забезпечувало 177 мг (38 %-й вихід) названої сполуки у вигляді олії. 1 H-ЯМР (300 MГц, CDCl3): δ 0,95 (t, 3H), 1,24 (t, 3H), 1,41 (m, 2H), 1,56 (m, 2H), 2,05 (m, 2H), 2,51 (m, 2H), 2,60 (m, 2H), 2,67 - 2,92 (m, 8H), 4,17 (m, 2H), 4,53 (s, 1H), 5,21 - 5,46 (m, 10H), 7,27 + + + 7,35 (m, 3H), 7,43 - 7,46 (m, 2H); MS (Cl (CH4)): 507 [M+C3H5] , 495 [M+C2H5] , 467 [M+H] , 421 [M+ + .+ OEt] , 393 [M-CO2Et] , 303 [R-S] . Біологічні випробування Приклад 22: Оцінка активації PPAR in-vitro Аналіз здійснювали in-vitro у трьох стійких лініях клітин-репортерів, PPARα, PPARδ або PPARγ, які експресують, відповідно, химерний білок, який містить ліганд-зв’язувальний домен (LBD) людського PPARα, людського PPARδ або людського PPARγ, злитий з ДНК-зв’язувальним доменом (DBD) трансактиватора дріжджів GAL4. Ген-репортер люциферази (Luc) активується пентамером послідовності розпізнавання GAL4 перед промотором β-глобіну. Застосування химерних рецепторів GAL4-PPARα, GAL4-PPARδ та GAL4-PPARγ дозволяє усувати фонову активність ендогенних рецепторів і кількісно визначати відносну активність трьох підтипів PPAR з однаковим геном-репортером. Дві незаміщені контрольні речовини, Контроль 1 та 2, і п’ять випробуваних речовин, (7), (10), (11), (24) та (25), випробували у концентрації 10 мкM. Структурні формули випробуваних речовин є такими, як показано нижче: Контроль 1 25 30 35 Контроль 2 Селективність речовин до PPAR визначали шляхом порівняння з відомими контрольними медикаментами (1 мкM GW7647 для PPARα, 1 мкM L-165041 для PPARδ і 1 мкM BRL49653 для PPARγ), визначеними як такі, що мають 100 % активність. Результати представлено на Фігурі 1. Приклад 23: Оцінка активації PPARα in-vitro (дані концентрація-ефект) Аналіз здійснювали in-vitro, застосовуючи проби mammalian-one-hybrid (M1H), що включають злиті послідовності GAL4-ДНК-зв’язувальний домен-PPARα-LBD, з’єднані з активованою 5xGAL4-сайтами послідовністю репортера люциферази Photinus pyralis у тимчасово трансфікованих клітинах HEK293. Сполуку (12) та позитивний контроль (GW7647) випробували у різних концентраціях. Результати представлено у Таблиці 1. Таблиця 1 PPARα Сполука GW7647 (12) EC50 (нM) 0,45 286 28 Ефективність (%) 100 84
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel sulphur containing lipids for use as food supplement or as medicament
Автори російськоюHolmeide, Anne, Kristin, Hovland, Ragnar, Braendvang, Morten
МПК / Мітки
МПК: C07C 317/12, A61K 31/10, A23L 1/29, A61K 31/22, A61P 3/04, C07C 321/00, C07C 317/04, A61P 9/10, C07C 317/06
Мітки: застосування, ліпіди, медикаментів, харчових, сірковмісні, добавок
Код посилання
<a href="https://ua.patents.su/39-109252-sirkovmisni-lipidi-dlya-zastosuvannya-yak-kharchovikh-dobavok-abo-medikamentiv.html" target="_blank" rel="follow" title="База патентів України">Сірковмісні ліпіди для застосування як харчових добавок або медикаментів</a>
Попередній патент: Спосіб перекриття витоку нафти чи газу з дна водоймищ та пристрій для його реалізації
Наступний патент: Асептичний пакет з отвором
Випадковий патент: Спосіб отримання квашеної капусти