Вакцинний вектор і спосіб посилення імунної відповіді
Номер патенту: 110024
Опубліковано: 10.11.2015
Автори: Бергман Люк, Боттдж Уолтер, Лейтон Шеррілл, Харджис Біллі
Формула / Реферат
1. Вакцинний вектор, що включає антигенний поліпептид і поліпептид HMGB1, в якому принаймні частина антигенного поліпептиду і принаймні частина поліпептиду HMGB1 присутні на поверхні вакцинного вектора.
2. Вакцинний вектор за п. 1, в якому антигенним поліпептидом є специфічний для вірусу грипу поліпептид.
3. Вакцинний вектор за п. 2, в якому антигенним поліпептидом є поліпептид М2e, HА або NP вірусу грипу.
4. Вакцинний вектор за п. 3, в якому антигенний поліпептид вибирають з групи, що складається з SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 і SEQ ID NO: 10.
5. Вакцинний вектор за будь-яким з пп. 1-4, в якому поліпептид HMGB1 вибирають з SEQ ID NO: 18, SEQ ID NO: 29 і SEQ ID NO: 30.
6. Вакцинний вектор за будь-яким з пп. 1-5, який є бактерією.
7. Вакцинний вектор за п. 6, де бактерією є Bacillus spp.
8. Вакцинний вектор за будь-яким з пп. 1-7, в якому антигенний поліпептид і/або поліпептид HMGB1 включений в трансмембранний білок.
9. Вакцинний вектор за п. 8, в якому антигенний поліпептид і/або поліпептид HMGB1 знаходиться в поверхневій петльовій ділянці трансмембранного білка.
10. Вакцинний вектор за п. 8 або 9, де трансмембранним білком є cotB.
11. Вакцинний вектор за будь-яким з пп. 1-10, в якому антигенний поліпептид і поліпептид HMGBl утворюють гібридний білок.
12. Композиція, що включає вакцинний вектор за будь-яким з пп. 1-11 і фармацевтично прийнятний носій.
13. Композиція за п. 12, в якій фармацевтично прийнятний носій є прийнятним для орального або інтраназального введення.
14. Композиція за п. 12 або 13, в якій вакцинний вектор не здатний до реплікації, є інактивованим або убитим.
15. Спосіб посилення імунної відповіді у суб'єкта, що включає введення суб'єкту вакцинного вектора за будь-яким з пп. 1-11 або композиції за будь-яким з пп. 12-14 в кількості, ефективній для посилення імунної відповіді у суб'єкта проти антигенного поліпептиду.
16. Спосіб за п. 15, в якому вакцинний вектор вводять орально або інтраназально.
17. Спосіб за п. 16, в якому імунною відповіддю є продукція антитіл класу IgA проти антигенного поліпептиду.
18. Спосіб за будь-яким з пп. 15-17, в якому вакцинний вектор не здатний до реплікації в організмі суб'єкта або є інактивованим або убитим перед введенням суб'єкту.
19. Вакцинний вектор Bacillus spp., що включає першу полінуклеотидну послідовність, що кодує антигенний поліпептид, присутній на поверхні вакцинного вектора, і другу полінуклеотидну послідовність, що кодує імуностимулюючий поліпептид, в якому антигенний поліпептид і імуностимулюючий поліпептид присутні на поверхні вакцинного вектора, причому антигенним поліпептидом є поліпептид вірусу грипу, а імуностимулюючим поліпептидом є поліпептид HMGB1.
20. Вакцинний вектор за п. 19, в якому перший полінуклеотид і другий полінуклеотид вбудовані в третю полінуклеотидну послідовність, що кодує поверхневу частину трансмембранного білка.
21. Вакцинний вектор за п. 20, в якому трансмембранним білком є cotB.
22. Вакцинний вектор за будь-яким з пп. 19-21, в якому антигенним поліпептидом є поліпептид М2е вірусу грипу, поліпептид НА вірусу грипу або поліпептид NP вірусу грипу.
23. Вакцинний вектор за п. 22, в якому антигенний поліпептид вибирають з групи, що складається з SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 і SEQ ID NO: 10.
24. Вакцинний вектор за будь-яким з пп. 19-23, в якому поліпептид HMGB1 вибирають з SEQ ID NO: 18, SEQ ID NO: 29 і SEQ ID NO: 30.
25. Спосіб посилення імунної відповіді у суб'єкта, що включає введення суб'єкту вакцинного вектора Bacillus spp. за будь-яким з пп. 19-24 в кількості, ефективній для посилення імунної відповіді у суб'єкта проти антигенного поліпептиду.
26. Спосіб за п. 25, в якому вакцинний вектор вводять орально або інтраназально.
27. Спосіб за п. 26, в якому імунною відповіддю є продукція антитіл класу IgA проти антигенного поліпептиду.
28. Спосіб за будь-яким з пп. 25-27, в якому вакцинний вектор не здатний до реплікації в організмі суб'єкта або є інактивованим або убитим перед введенням суб'єкту.
29. Спосіб зниження пов'язаної з вірусом грипу А захворюваності у суб'єкта, що включає введення суб'єкту вакцинного вектора за будь-яким з пп. 1-11 і 19-24 або композиції за будь-яким з пп. 12-14 в кількості, ефективній для зниження пов'язаної з вірусом грипу А захворюваності у суб'єкта.
Текст
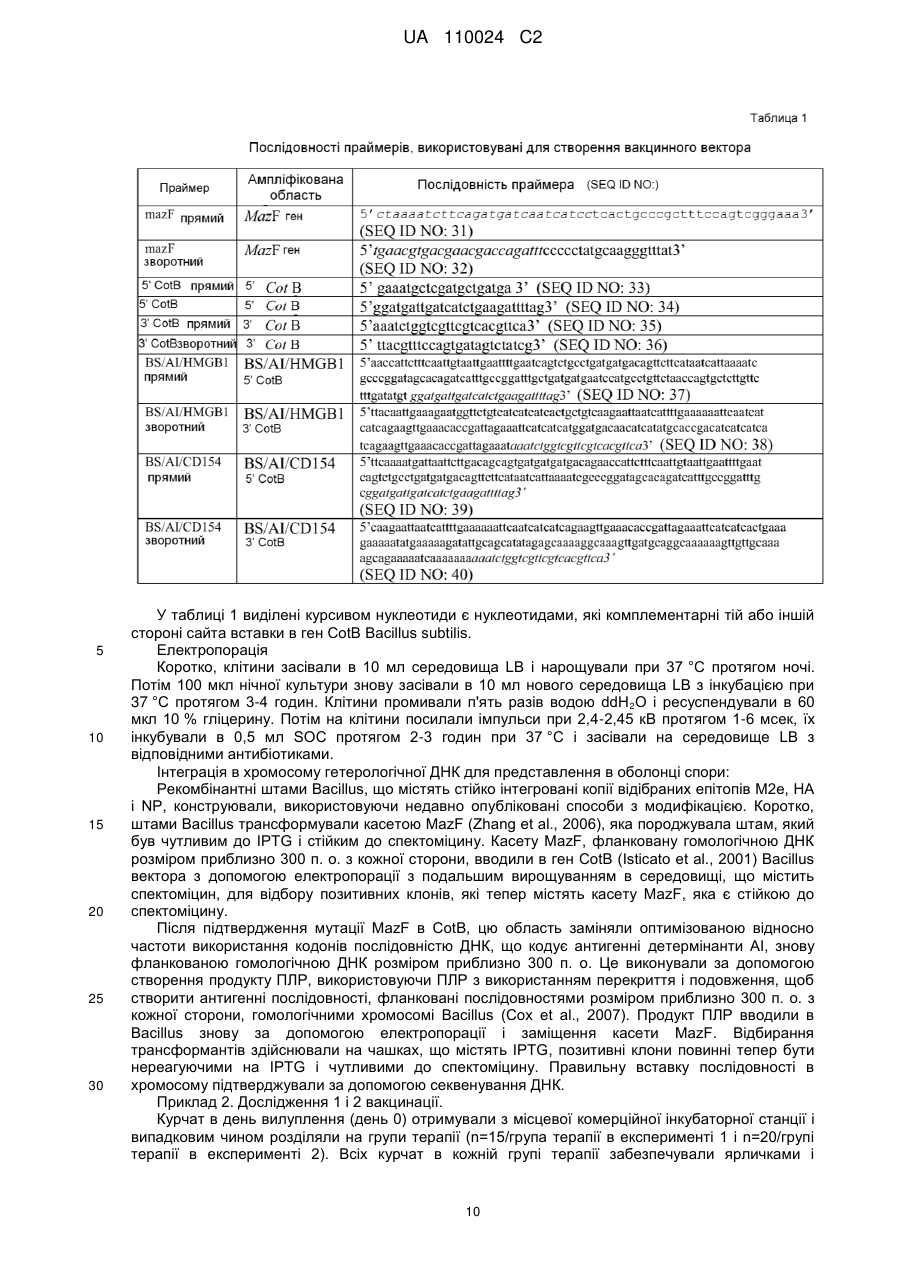
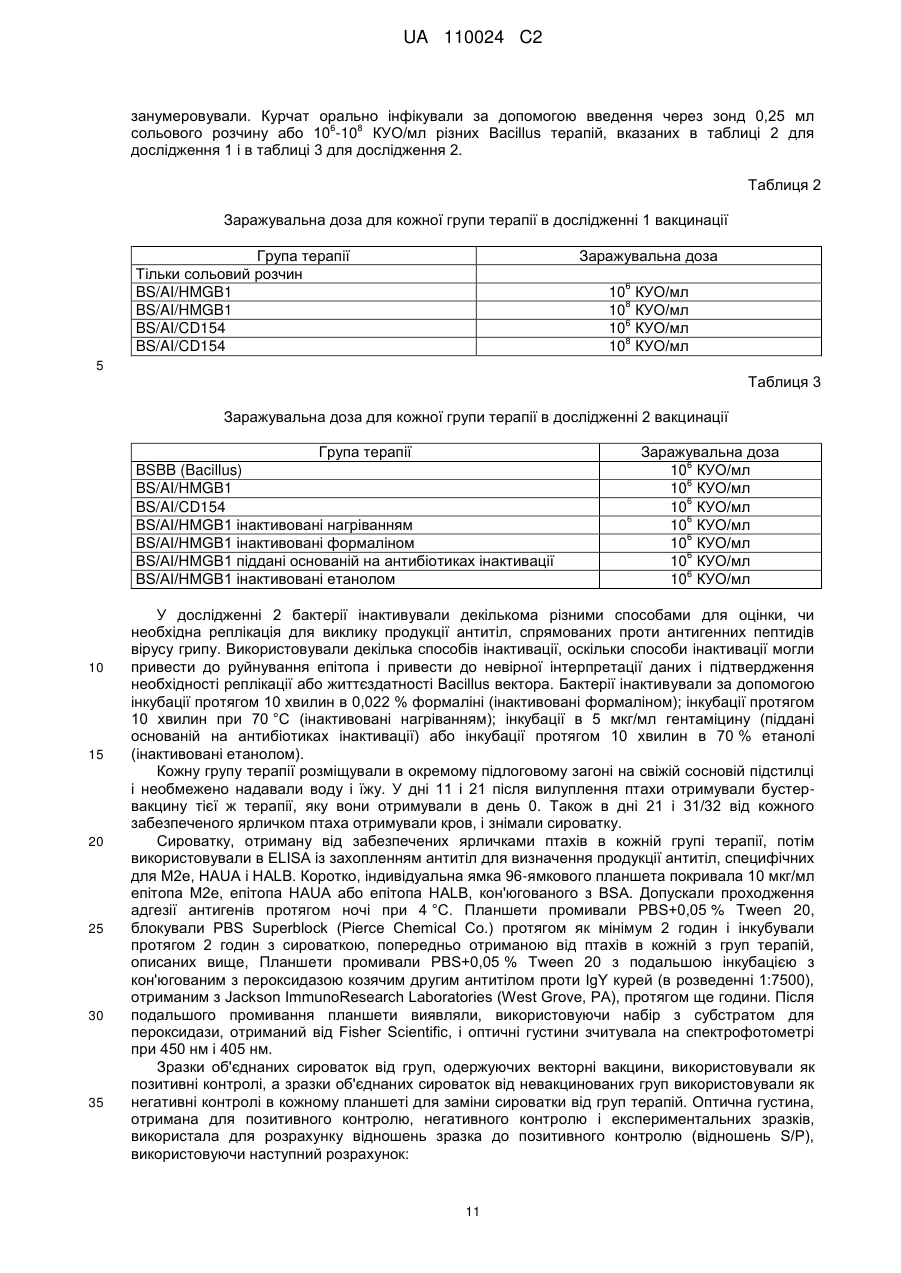
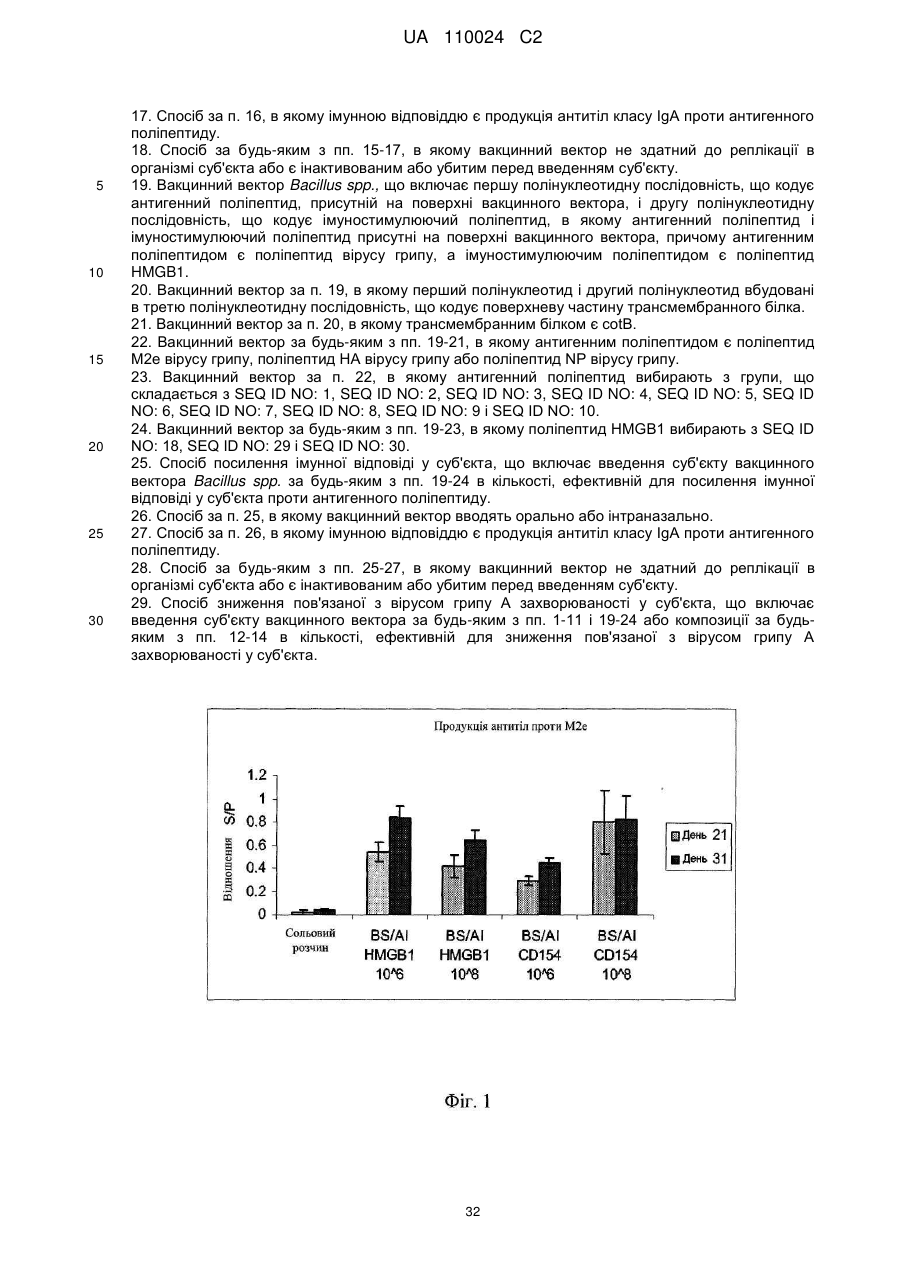
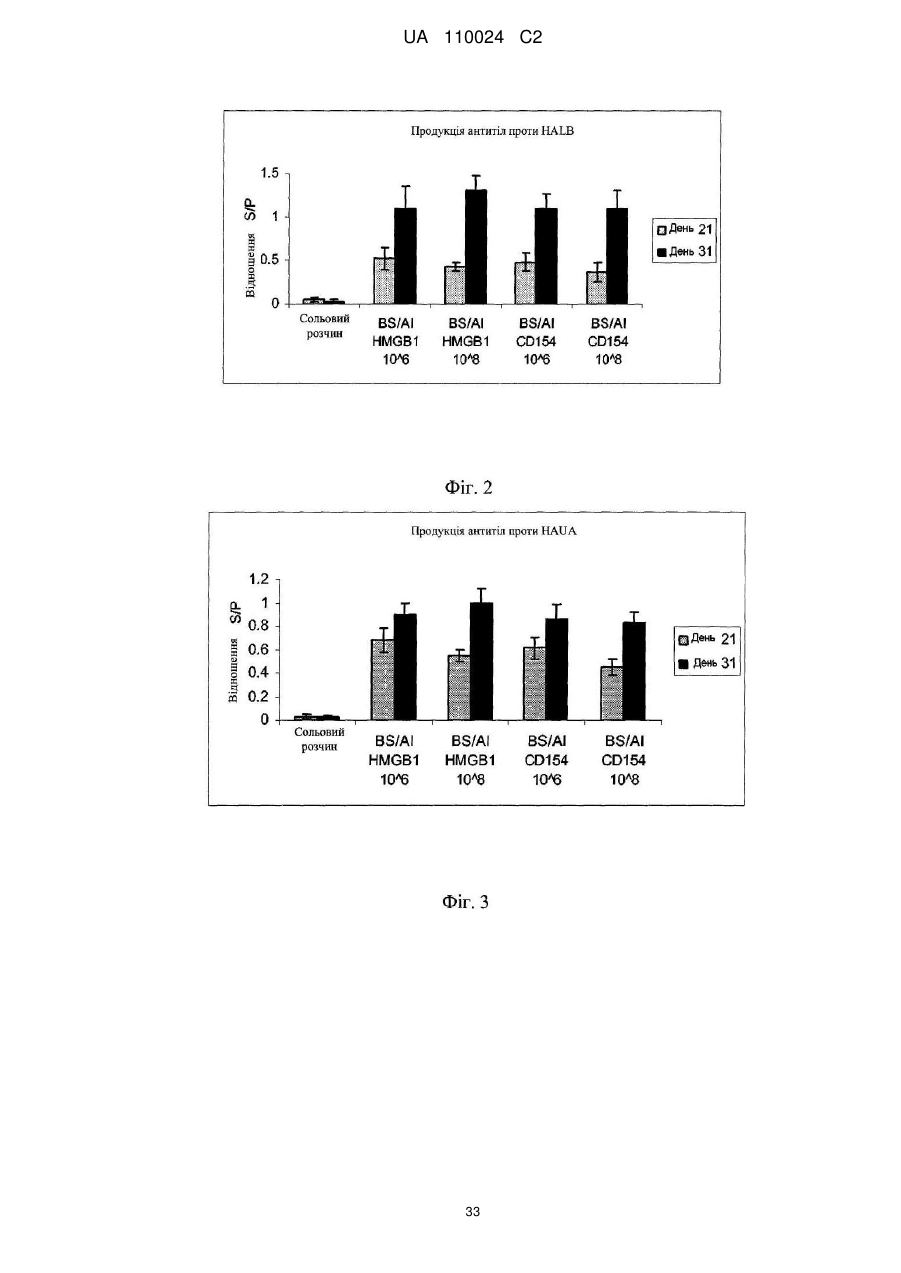
Реферат: Винахід належить до вакцинного вектора, що включає антигенний поліпептид і поліпептид HMGB1, які присутні на поверхні вакцинного вектора, а також до композиції, що включає вакцинний вектор та фармацевтично прийнятний носій для орального або інтраназального введення. Винахід також належить до способу посилення імунної відповіді, зокрема, гуморальної імунної відповіді і відповідно продукції IgA, шляхом введення суб'єкту вказаних вакцинного вектора або композиції. UA 110024 C2 (12) UA 110024 C2 UA 110024 C2 5 10 15 20 25 30 35 40 45 50 55 60 ПЕРЕХРЕСНЕ ПОСИЛАННЯ НА СПОРІДНЕНІ ЗАЯВКИ Ця заявка на патент вимагає пріоритет попередньої заявки на патент США з № 61/297098, поданої 21 січня 2010 р., яка включена сюди за допомогою посилання в її повному об'ємі. ВСТУП Вакцини використовуються для виклику адаптивної імунної відповіді проти антигенів, зокрема, антигенів патогенів, пухлинних клітин або т. п., для зменшення інтенсивності або запобігання захворюванню. Синтетичні пептиди або вакцини на основі убитих або атенуйованих мікроорганізмів є часто ефективними в стимулюванні сильної імунної відповіді, яка є повністю протективною. У деяких випадках ці вакцини не є протективними або є лише частково протективними, і інші стратегії повинні застосовуватися для розробки протективних вакцин. Вакцини на основі атенуйованих мікроорганізмів також пов'язані з ризиками перенесення генів або виправлення мутацій і можуть представляти ризик для індивідуумів з послабленим імунітетом. Необхідна розробка нових вакцин, які є безпечними і ефективними в стимулюванні тривалих протективних імунних відповідей. Інфікування вірусом грипу, зокрема, вірусом пташиного грипу H5N1, являє собою зростаючу проблему в галузі охорони здоров'я і економіки. Факти явно вказують на те, що H5N1 продовжує циркулювати між чутливими птахами і свинями в областях всього світу, що розширяються. Багато вчених вважають, що у випадку залишення без заборони існуючий сьогодні вірус пташиного грипу H5N1 мутує з створенням можливості для передачі від людини до людини і викликом всесвітньої пандемії. При коефіцієнті смертності, що перевищує 50 %, така поява епідемії буде страхітливою. Незалежно від здатності вірусу до виклику захворювання у людини вірус пташиного грипу H5N1 вже загрожує великим ударом по економіці внаслідок знищення зграй домашньої птиці в уражених областях. Тому необхідна розробка вакцини для захисту людей, домашньої птиці, свиней і інших одомашнених тварин від вірусу грипу H5N1. Вакцина проти грипу, яка здатна захистити від H5N1, а також від інших вірусів грипу, таких як H1N1, буде оптимальною. КОРОТКИЙ ВИКЛАД СУТІ ВИНАХОДУ Тут надаються вакцинні вектори, і способи стимулювання імунної відповіді і способи зниження захворюваності, пов'язаної з інфікуванням вірусом грипу. У одному аспекті надається вакцинний вектор, що включає антигенний поліпептид і поліпептид HMGB1 або його функціональний фрагмент. Принаймні частина антигенного поліпептиду і принаймні поліпептиду HMGB1 присутні на поверхні вакцинного вектора. Вакцинний вектор може включати перший полінуклеотид, що кодує антигенний поліпептид, і другий полінуклеотид, що кодує поліпептид HMGB1. Поліпептид HMGB1 і антигенний поліпептид можуть бути пов'язані, наприклад, в гібридному білку. Як поліпептид HMGB1, так і антигенний поліпептид можуть бути вставлені в поверхневу петльову ділянку трансмембранного білка. У іншому аспекті надається композиція, що включає вакцинний вектор і фармацевтично прийнятний носій. Фармацевтично прийнятний носій може бути прийнятним для оральний або інтраназального застосування. Вакцинний вектор може бути не здатний до реплікації. У ще одному аспекті надається вакцинний вектор Bacillus spp. Вакцинний вектор включає першу полінуклеотидну послідовність, що кодує антигенний поліпептид, що представляється на поверхні вакцинного вектора, і другу полінуклеотидну послідовність, яка кодує імуностимулюючий поліпептид, що представляється на поверхні вакцинного вектора. Антигенним поліпептидом може бути поліпептид M2e вірусу грипу, поліпептид HA вірусу грипу або поліпептид NP вірусу грипу або їх комбінація. Імуностимулюючим поліпептидом може бути поліпептид CD154 або поліпептид HMGB1 або їх комбінація. Імуностимулюючий поліпептид і антигенний поліпептид можуть бути пов'язані, наприклад, в гібридному білку, і можуть бути включені в поверхневу петльову ділянку трансмембранного білка. Тим не менше, в іншому аспекті надаються способи посилення імунної відповіді у суб'єкта. У цьому способі тут вакцинні вектори, що надаються, або композиції вводять суб'єкту в кількості, ефективній для посилення імунної відповіді у суб'єкта проти антигенного поліпептиду. Відповідно, коли вакцинний вектор вводять оральний або інтраназально. У подальшому аспекті надаються способи посилення імунної відповіді у суб'єкта за допомогою введення вакцинного вектора Bacillus spp., що описується тут. Вакцинний вектор включає першу полінуклеотидну послідовність, що кодує антигенний поліпептид, що представляється на поверхні вакцинного вектора, і другу полінуклеотидну послідовність, що кодує імуностимулюючий поліпептид, що представляється на поверхні вакцинного вектора. Антигенним поліпептидом може бути поліпептид M2e вірусу грипу, поліпептид HA вірусу грипу, поліпептид NP вірусу грипу або їх комбінація. Імуностимулюючим поліпептидом може бути поліпептид CD154, поліпептид HMGB1 або їх комбінація. 1 UA 110024 C2 5 10 15 20 25 30 35 40 45 50 55 60 Тим не менше, в подальшому аспекті надаються способи зниження пов'язаної з вірусом грипу захворюваності у суб'єкта. У цих способах введення розкритих тут вакцинних векторів або композицій знижує захворюваність, пов'язану з подальшим інфікуванням вірусом грипу. КОРОТКИЙ ОПИС КРЕСЛЕНЬ Фіг. 1 являє собою діаграму, на якій представлені відношення S/Р (зразка до позитивного контролю), отримані в ELISA для продукції специфічних для M2e антитіл курчатами після орального введення через зонд вказаної дози вакцинного вектора Bacillus subtilis, що експресує епітопи білків вірусу грипу А і або HMGB1, або CD154, в порівнянні з курчатами, вакцинованими сольовим розчином. Фіг. 2 являє собою діаграму, на якій представлені відношення S/Р, отримані в ELISA для продукції специфічних для HALB антитіл курчатами після орального введення через зонд вказаної дози вакцинного вектора Bacillus subtilis, що експресує епітопи білків вірусу грипу А і або HMGB1, або CD154, в порівнянні з курчатами, вакцинованими сольовим розчином. Фіг. 3 являє собою діаграму, на якій представлені відношення S/Р, отримані в ELISA для продукції специфічних для HAUA антитіл курчатами після орального введення через зонд вказаної дози вакцинного вектора Bacillus subtilis, що експресує епітопи білків вірусу грипу А і або HMGB1, або CD154, в порівнянні з курчатами, вакцинованими сольовим розчином. Фіг. 4 являє собою діаграму, на якій представлені відношення S/Р, отримані в ELISA для продукції специфічних для M2e антитіл курчатами після орального введення через зонд вказаної дози живих або різних чином інактивованих вакцинних векторів Bacillus subtilis, що експресують епітопи білків вірусу грипу А і або HMGB1, або CD154, в порівнянні з курчатами, вакцинованими лише Bacillus вектором (BSBB). Фіг. 5 являє собою діаграму, на якій представлені відношення S/Р, отримані в ELISA для продукції специфічних для HALB антитіл курчатами після орального введення через зонд вказаної дози живих або різних чином інактивованих вакцинних векторів Bacillus subtilis, що експресують епітопи білків вірусу грипу А і або HMGB1, або CD154, в порівнянні з курчатами, вакцинованими лише Bacillus вектором (BSBB). Фіг. 6 являє собою діаграму, на якій представлені відношення S/Р, отримані в ELISA для продукції специфічних для HAUA антитіл курчатами після орального введення через зонд вказаної дози живих або різних чином інактивованих вакцинних векторів Bacillus subtilis, що експресують епітопи білків вірусу грипу А і або HMGB1, або CD154, в порівнянні з курчатами, вакцинованими лише Bacillus вектором (BSBB). Фіг. 7 являє собою діаграму, на якій представлені відношення S/Р, отримані в ELISA для продукції специфічних для M2e антитіл класу IgG курчатами після орального введення через 6 зонд або 10 живих, або різних вказаних доз інактивованих формаліном вакцинних векторів Bacillus subtilis, що експресують епітопи білків вірусу грипу А і HMGB1, в порівнянні з курчатами, вакцинованими лише Bacillus вектором (BSBB). Фіг. 8 являє собою діаграму, на якій представлені відношення S/Р, отримані в ELISA для продукції специфічних для M2e антитіл класу IgA курчатами, вакцинованими, або орально, або 6 підшкірно, 10 живих, інактивованих формаліном або інактивованих формаліном і ліофілізованих вакцинних векторів Bacillus subtilis, що експресують епітопи білків вірусу грипу А і HMGB1, в порівнянні з курчатами, вакцинованими лише Bacillus вектором (BSBB). Фіг. 9 являє собою діаграму, на якій представлені відношення S/Р, отримані в ELISA для продукції специфічних для M2e антитіл класу IgA курчатами, вакцинованими, або орально, або 6 підшкірно, 10 живих, інактивованих формаліном або інактивованих формаліном і ліофілізованих вакцинних векторів Bacillus subtilis, що експресують епітопи білків вірусу грипу А і HMGB1, в порівнянні з курчатами, вакцинованими лише Bacillus вектором (BSBB). ДОКЛАДНИЙ ОПИС ДАНОГО ВИНАХОДУ Технології рекомбінантних ДНК забезпечують можливість для відносно легкої маніпуляції багатьма бактеріальними і вірусними видами. Деякі бактерії і віруси або є за своєю природою малопатогенними або непатогенними, але залишаються здатними до виклику сильної імунної відповіді, або їх можна піддати відбору на таку властивість або створити такими. Ці бактерії і віруси породжують привабливі вакцинні вектори для виклику імунної відповіді проти гетерологічних або чужорідних антигенів. Бактеріальні або вірусні вакцинні вектори можуть імітувати природну інфекцію і викликати сильний і імунітет, що тривало зберігається. Часто виробництво і введення вакцинних векторів є відносно недорогими. Крім того, такі вектори можуть часто містити більше ніж один антиген і можуть забезпечити захист від множини інфекційних агентів. Вакцинні вектори у вигляді живих бактерій або вірусів можуть, проте, представляти ризик для індивідуумів з послабленим імунітетом, і в їх випадку потрібний додатковий регулятивний 2 UA 110024 C2 5 10 15 20 25 30 35 40 45 50 55 60 розгляд. Тому бажаним є застосування векторів, які є убитими або інактивованими або кваліфікуються як організми, які звичайно вважаються безпечними (GRAS), Управлінням по контролю за продуктами і ліками (FDA). Проблемою є виклик сильної імунної відповіді, використовуючи такі вектори. Як продемонстровано в прикладах, за допомогою розміщення поліпептидів HMGB1 (амфотеринів, білків В1 з групи білків з високою рухливістю) на поверхні вакцинного вектора автори даного винаходу можуть викликати сильну імунну відповідь проти антигенних поліпептидів, використовуючи вектор Bacillus spp. Насправді, в прикладах демонструється, що цей вектор можна піддати інактивації, так що він не може реплікуватися, використовуючи множину способів, і, проте, може викликати сильну імунну відповідь після введення. Тут надаються вакцинні вектори, що включають антигенний поліпептид і поліпептид HMGB1 або його функціональний фрагмент. Принаймні частина антигенного поліпептиду і принаймні частина поліпептиду HMGB1 або його функціонального фрагмента присутні на поверхні вакцинного вектора. Вакцинний вектор може включати перший полінуклеотид, що кодує антигенний поліпептид, і другий полінуклеотид, що кодує поліпептид HMGB1. Поліпептид HMGB1 і антигенний поліпептид можуть бути пов'язані, наприклад, в гібридному білку, або можуть експресуватися окремо. Як поліпептид HMGB1, так і антигенний поліпептид можуть бути включені в поверхневу петльову ділянку трансмембранного білка. Вакцинні вектори можуть бути бактеріальними, вірусними векторами або векторами на основі ліпосом. Потенційні вакцинні вектори включають, але без обмеження, Bacillus (Bacillus subtilis), Salmonella (Salmonella enteritidis), Shigella, Escherichia (E. coli), Yersinia, Bordetella, Lactococcus, Streptococcus, Vibrio (Vibrio cholerae), Listeria, аденовірус, поксвірус, вірус герпесу, альфавірус і аденоасоційований вірус. Відповідно, коли вакцинним вектором є GRAS організм. Вакцинний вектор може бути інактивованим або убитим, так що він не здатний до реплікації. Способи інактивації або убивання бактеріальних або вірусних вакцинних векторів відомі кваліфікованим в даній галузі техніки фахівцям і включають, але без обмеження, такі способи, як ті, які приведені в прикладах, тобто інактивацію формаліном, основану на антибіотиках інактивацію, термічну обробку і обробку етанолом. Антигенним поліпептидом є поліпептид, який може специфічно розпізнати адаптивну імунну систему. Антигенний поліпептид включає будь-який поліпептид, який є імуногенним. Антигенні поліпептиди включають, але без обмеження, антигенні, які стосуються патогенів, стосуються алергенів, стосуються пухлин або пов'язані із захворюванням. Патогени включають вірусні, паразитичні, грибкові і бактеріальні патогени, а також білки-патогени, такі як пріони. Антигенними поліпептидами можуть бути повнорозмірні білки або їх частини. Добре відомо, що розпізнавання імунною системою багатьох білків засноване на відносно невеликому числі амінокислот, що часто називається епітопом. Епітопи можуть являти собою лише 8-10 амінокислот. Таким чином, тут антигенні поліпептиди, що описуються можуть являти собою повнорозмірниі білки, епітопи довжиною 8 амінокислот або будь-яка ділянка між цими межами. Насправді, антигенні поліпептиди можуть включати більше ніж один епітоп одиночного патогена або білка. У вакцинний вектор можуть бути включена множина піків одного і того ж епітопа або множини епітопів різних білків. Передбачається, що декілька епітопів або антигенів, пов'язані з одним і тим же патогеном або захворюванням або різними патогенами або захворюваннями, можуть вводитися разом в одному вакцинному векторі для виклику посиленої імунної відповіді проти множини антигенів. Рекомбінантні вакцинні вектори можуть кодувати антигенні множини патогенних мікроорганізмів, вірусів або пухлинноспецифічних антигенів. Введення вакцинних векторів, здатні експресувати множину антигенів, сприяє виклику імунітету до двох або більше захворювань в один і той же час. Антигенним поліпептидом може бути поліпептид вірусу грипу, відповідно, коли ним є поліпептид вірусу грипу штаму H5N1 або поліпептид, що асоціюється з множиною штамів вірусу грипу, такий як поліпептид білка M2 вірусу грипу. Ектодомен білка М2 вірусу грипу А, відомий як M2e, випинається з поверхні вірусу. M2e-частина білка M2 містить приблизно 24 амінокислоти. Поліпептид M2e трохи варіюють від одного ізоляту до іншого ізоляту вірусу грипу. Насправді, лише декілька мутацій, що зустрічаються в природі, в M2e було виявлено в ізолятах від інфікованих людей з моменту епідемії грипу в 1918. Крім того, віруси грип, виділений з організмів-носіїв, що є птахами і свинями, мають різні, однак консервативні, послідовності M2e. Для перегляду послідовностей поліпептидів M2e, виділених з організмів-носіїв, що є людьми, птахами і свинями, дивіться Liu et al., Microbes and Infection 7: 171-177 (2005) і Reid et al, J. Virol. 76: 10717-10723 (2002), кожний з яких включений сюди за допомогою посилання в його повному об'ємі. Дивіться також SEQ ID NO: 1-4. 3 UA 110024 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно, коли весь поліпептид M2e включають у вакцинний вектор, або може використовувати лише частину. У прикладах поліпептид з восьми амінокислот (LM2, що має амінокислотну послідовність EVETPIRN, SEQ ID NO: 5, або його варіант M2eA, що має амінокислотну послідовність EVETPTRN, SEQ ID NO: 6) був включений у вакцинний вектор і, як показано, викликав гуморальну імунну відповідь після введення курчатам. Відповідно, коли частина поліпептиду M2e, включена у вакцинний вектор, є імуногенною. Імуногенним фрагментом є пептид або поліпептид, здатний до виклику клітинних або гуморальних імунних відповідей. Відповідно імуногенним фрагментом M2e може бути повнорозмірний поліпептид М2e, або відповідно він може являти собою 20 або більше амінокислот, 15 або більше амінокислот, 10 або більше амінокислот або 8 або більше амінокислот повної послідовності. Інші епітопи, прийнятні для включення у вакцинний вектор проти вірусу грипу А, включають, але без обмеження, поліпептиди гемаглютиніну (HA) або ядерного білка (NP) вірусу грипу A. Наприклад, пептиди SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9 або SEQ ID NO: 10 можуть бути включені у вакцинний вектор. У прикладах SEQ ID NO: 7 (HAUA) і SEQ ID NO: 8 (HALB) були включені у вакцинний вектор і, як показано, викликали гуморальний імунну відповідь після введення курчатам. Дивіться Фіг. 2-3 і 5-6. Крім того, епітопи NP-SEQ ID NO: 9 (NP54) і SEQ ID NO: 10 (NP147) були включені у вакцинний вектор в прикладах. Кваліфікованому в даній галузі техніки фахівцеві буде зрозуміло, що будь-яка з цих послідовностей може використовуватися в комбінації з будь-яким іншим епітопом, в тому числі з епітопами, що походять з інших патогенів або антигенів. Білок HMGB1 (амфотерин, білок В1 з групи білків з високою рухливістю) був спочатку ідентифікований як ДНК-зв'язувальний білок, важливий для структури і стабільності ДНК. Він є повсюдно експресованим ядерним білком, який зв'язується з ДНК без специфічності відносно її послідовності. Цей білок є висококонсервативним і виявляється в рослинах аж до ссавців. Амінокислотні послідовності HMGB1 даніо, курчати і людини представлені в SEQ ID NO: 30, SEQ ID NO: 18 і SEQ ID NO: 29, відповідно. Послідовність для всіх ссавців є висококонсервативною, при цьому ідентичність послідовностей становить 98 %, і амінокислотні заміни є консервативними. Тому білок HMGB1 одного вигляду може, ймовірно, функціонально заміняти білок іншого виду. Повнорозмірний білок HMGB1 або його частина можуть використовуватися як поліпептид HMGB1 в тут вакцинних векторах, що описуються. HMGB1 має дві ДНК-зв'язувальні області, що називаються блоком А, представленим в SEQ ID NO: 23 і 24, і блоком В, представленим в SEQ ID NO: 25 і 26. Дивіться Andersson and Tracey, Annu. Rev. Immunol. 2011, 29: 139-162, який включений сюди за допомогою посилання в його повному об'ємі. HMGB1 є медіатором запалення і виконує функцію сигналу ядерного пошкодження, наприклад, від некротичних клітин. HMGB1 може також активно секретируватися клітинами моноцитарної/макрофагальної лінії диференціювання в ході процесу, для якого необхідні ацетилювання білка, пересування через ядро і секреція. Екстраклітинний HMGB1 функціонує як сильний медіатор запалення за допомогою передачі сигналів через рецептор для кінцевих продуктів посиленого глікозилування (RAGE) і через члени сімейства Toll-подібних рецепторів (TLR), зокрема, TLR4. Активність зв'язування з RAGE була ідентифікована, і для неї потрібно поліпептид SEQ ID NO: 27. Для зв'язування з TLR4 потрібно цистеїн в положенні 106 SEQ ID NO: 18, який виявляється в області блока В HMGB1. Для запальної активності HMGB1 не потрібно повнорозмірний білок, і були ідентифіковані функціональні фрагменти. Встановлено, що блок В достатній, щоб опосередкувати прозапальні ефекти HMGB1, і тому SEQ ID NO: 25 і 26 є поліпептидами HMGB1 або його функціональними фрагментами в контексті даного винаходу. Крім того, сайт зв'язування з RAGE і прозапальна цитокінова активність були картовані в SEQ ID NO: 27 і SEQ ID NO: 28, відповідно. Таким чином, ці поліпептиди є функціональними фрагментами поліпептидів HMGB1 в контексті даного винаходу. Кваліфікована в даній галузі техніки фахівці можуть ідентифікувати поліпептиди HMGB1 і їх фрагменти, здатна до стимулювання прозапальної цитокінової активності, використовуючи такі способи, як ті, які описані в публікації міжнародної заявки з № WO02/092004, яка включена сюди за допомогою посилання в її повному об'ємі. Відповідно, коли поліпептид HMGB1 включає RAGE-зв'язувальний домен в положеннях 150-183 амінокислот SEQ ID NO: 18 (SEQ ID NO: 27 або його гомолог) і домен прозапальної цитокінової активності між амінокислотами 89-109 SEQ ID NO: 18 (SEQ ID NO: 28 або його гомолог). Зокрема, поліпептиди HMGB1 і їх функціональні фрагменти або гомологи включають поліпептиди, ідентичні або ідентичні на принаймні 99 %, принаймні 98 %, принаймні 95 %, принаймні 90 %, принаймні 85 % або принаймні 80 % поліпептидам HMGB1 з SEQ ID NO: 18 або 23-30. 4 UA 110024 C2 5 10 15 20 25 30 35 40 45 50 55 60 Принаймні частина антигенного поліпептиду і принаймні частина поліпептиду HMGB1 присутні на поверхні вакцинного вектора. Присутні на поверхні вакцинного вектора поліпептиди включають поліпептиди, які включені в трансмембранний білок, взаємодіють з, ковалентно або хімічно зшиті з трансмембранним білком, мембранним ліпідом або прикріпленим до мембрани вуглеводом. Поліпептид можна включити в трансмембранний білок, зв'язавши амінокислоти, що включають поліпептид, через пептидний зв'язок з N-кінцем, С-кінцем трансмембранного білка або де-небудь в ньому (тобто включивши між двома амінокислотами трансмембранного білка або замість однієї або більше амінокислот трансмембранного білка (тобто за допомогою делеції-вставки). Відповідно поліпептиди можна включити в поверхневу петльову ділянку трансмембранного білка. Відповідними трансмембранними білками є cotB і lamB, але кваліфікованим в даній галузі техніки фахівцям буде зрозуміло, що в наявності є множина відповідних трансмембранних білків. Альтернативно, поліпептиди можна ковалентно або хімічно зв'язати з білками, ліпідами або вуглеводами в мембрані, або капсидом у випадку використання вірусного вектора, за допомогою способів, що є в розпорядженні кваліфікованих в даній галузі техніки фахівців. Наприклад, дисульфідні зв'язки або перехресне зшиття біотину з авідином можна було б використовувати для уявлення антигенного поліпептиду і поліпептиду HMGB1 на поверхні вакцинного вектора. Відповідно, коли антигенний поліпептид і поліпептид HMGB1 є частиною гібридного білка. Два поліпептиду можна безпосередньо з'єднати через пептидний зв'язок, або вони можуть бути розділені лінкером або областю третього білка, в який їх включають. Полінуклеотиди, що кодують антигенний поліпептид або поліпептид HMGB1, можна ввести у вакцинний вектор і експресувати зі створенням антигенного поліпептиду і поліпептиду HMGB1. Полінуклеотиди можна вбудовувати в хромосому вакцинного вектора, або вони можуть кодуватися на плазмідах або іншій екстрахромосомній ДНК. Відповідно полінуклеотиди, що кодують антигенний поліпептид і/або поліпептид HMGB1, можуть експресуватися незалежно, або вони вбудовані в полінуклеотид вакцинного вектора, який експресується. Відповідно, коли полінуклеотид вакцинного вектора кодує поліпептид, що представляється на поверхні вакцинного вектора, такій як трансмембранний білок. Полінуклеотид, що кодує антигенний поліпептид і/або поліпептид HMGB1, можна вбудувати в полінуклеотидну послідовність вакцинного вектора, щоб зробити можливим уявлення антигенного поліпептиду і/або поліпептиду HMGB1 на поверхні вектора. Наприклад, полінуклеотид, що кодує антигенний поліпептид і поліпептид HMGB1, можна вбудовувати в рамці зчитування в бактеріальний полінуклеотид в області, яка кодує поверхневу петльову ділянку трансмембранного білка, за умови, щоб бактеріальна полінуклеотидна послідовність залишалася в рамці зчитування. Дивіться приклад 1. Альтернативно, полінуклеотид, що кодує антигенний поліпептид і/або поліпептид HMGB1, можна вбудовувати в полінуклеотид секретованого поліпептиду, який представляється на поверхні вакцинного вектора завдяки зв'язку з білком, ліпідом або вуглеводом на поверхні вакцинного вектора. Кваліфікованим в даній галузі техніки фахівцям буде зрозуміло, що полінуклеотид, який кодує антигенний поліпептид і/або поліпептид HMGB1, можна було б вбудовувати в широкий ряд полінуклеотидів вакцинного вектора для забезпечення експресії і уявлення антигенного поліпептиду і/або поліпептиду HMGB1 на імуноцитах суб'єкта, що піддається вакцинотерапії. У прикладах декілька епітопів білків вірусу грипу, включаючих епітоп M2e, епітоп HA і епітоп NP, були експресовані з плазміди для експресії у вегетативних клітинах в Bacillus subtilis. Результуючі рекомбінантні бактерії експресують включені епітопи, що показано за допомогою імунної відповіді, представленої на Фіг. 1-6. У прикладах вакцинні вектори містять антигенні поліпептиди (поліпептиди M2e, HA і NP) і імуностимулюючий поліпептид (або CD154, або HMGB1), що кодуються одним і тим полінуклеотидом і в рамці зчитування один з одним. У альтернативних варіантах здійснення імуностимулюючий поліпептид і антигенному поліпептид можуть кодуватися окремими полінуклеотидами. Кваліфікованим в даній галузі техніки фахівцям буде зрозуміло, що множина способів може використовуватися для досягнення представленості антигенного поліпептиду і поліпептиду HMGB1 на поверхні вакцинного вектора. Такі способи відомі кваліфікованим в даній галузі техніки фахівцям. Також надаються композиції, що включають вакцинний вектор і фармацевтично прийнятного носія. Фармацевтично прийнятним носієм є будь-ким носій, прийнятний для in vivo введення. Відповідно, коли фармацевтично прийнятний носій є прийнятним для оральної, інтраназальної доставки або доставки через слизову оболонку. Фармацевтично прийнятний носій може включати воду, забуферені розчини, розчини глюкози або рідкі середовища для культивування бактерій. Додаткові компоненти композицій можуть відповідно включати наповнювачі, таку як 5 UA 110024 C2 5 10 15 20 25 30 35 40 45 50 55 60 стабілізатори, консерванти, розріджувачі, емульгатори і змазки. Приклади фармацевтично прийнятних носіїв або розріджувачів включають стабілізатори, такі як вуглеводи (наприклад, сорбіт, маніт, крохмаль, сахароза, глюкоза, декстран), білки, такі як альбумін або казеїн, білковмісні агенти, такі як бичача сироватка або зняте молоко, і буфери (наприклад, фосфатний буфер). Особливо у випадку додавання таких стабілізаторів до композицій композиція підходить для сушіння сублімацією або сушіння розпиленням. Вакцинний вектор в композиціях може бути нездатний до реплікації, відповідно, коли вакцинний вектор інактивують або вбивають до додавання в композицію. Композиції, що описуються тут, можуть використовуватися для посилення імунної відповіді, такої як продукція антитіл проти антигенного поліпептиду. Композиції, що містять поліпептиди вірусу грипу, можуть також використовуватися для зниження захворюваності, пов'язаної з подальшим інфікуванням вірусом грипу. Композиції можуть запобігати виклику вірусом грипу захворювання або будь-якої пов'язаної захворюваності у суб'єкта, якому введені композиції або вакцинні вектори, що описуються тут. Композиції і вакцинні вектори, що описуються тут, можуть зменшувати тяжкість подальшого захворювання в результаті зменшення тривалості захворювання, зниження коефіцієнта захворюваності або смертності, пов'язаної із захворюванням, або зменшення імовірності зараження. Захворюваність і смертність, пов'язана із захворюванням, після введення тут вакцинних векторів, що описуються, можуть знизитися на 25 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 % або навіть 100 % в порівнянні з подібними суб'єктами, яким не наданий вакцинний вектор. Також надаються способи посилення імунних відповідей у суб'єкта за допомогою введення вакцинного вектора. Вакцинний вектор може містити поліпептид HMGB1, здатний до стимулювання імунної відповіді проти вакцинного вектора і пов'язаного з ним антигенного поліпептиду. Вакцинний вектор, що включає поліпептид HMGB1, вводять суб'єкту в кількості, ефективній для посилення імунної відповіді у суб'єкта проти вакцини і, зокрема, антигенного поліпептиду. Відповідно, коли вакцинний вектор містить полінуклеотид, що кодує поліпептид, який включає амінокислоти 150-183 і 89-109 поліпептиду HMGB1 (SEQ ID NO: 18), або його гомолог. У прикладах використовується поліпептид з 190 амінокислот HMGB1. Відповідно, коли полінуклеотид кодує поліпептид HMGB1 виду, однакового з видом суб'єкта. Гетерологічні комбінації поліпептидів HMGB1 і суб'єктів (тобто поліпептид HMGB1 людини для застосування у вакцині для курчат) можуть застосовуватися в способах даного винаходу, оскільки HMGB1 є висококонсервативним для широко ряду видів. Поліпептид HMGB1 може використовуватися для посилення імунної відповіді у суб'єкта, спрямованого на будь-якого чужорідний антиген або антигенний поліпептид, присутній у вакцинному векторі або на ньому. Кваліфікованому в даній галузі техніки фахівцеві буде зрозуміло, що поліпептид HMGB1 міг би використовуватися для посилення імунної відповіді проти більше ніж одного антигенного поліпептиду, присутнього у вакцинному векторі. Поліпептид з HMGB1 стимулює імунну відповідь принаймні частково в результаті активації дендритних клітин і макрофагів і, отже, стимулювання продукції цитокінів, таких як IL-1, IL-6, IFN-γ і TNF-α. У прикладах поліпептид HMGB1 представлений на поверхні вакцинного вектора. Крім того, розкриваються способи посилення імунної відповіді проти вірусу грипу А і способи зниження захворюваності, пов'язаної з подальшим інфікуванням вірусом грипу A. Коротко, способи включають введення суб'єкту вакцинного вектора, що включає епітоп білка вірусу грипу А (антигенний поліпептид вірусу грипу), здатний до виклику імунної відповіді, в кількості, ефективній для виклику імунної відповіді. Епітопом білка вірусу грипу А може бути поліпептид M2e, поліпептид HA або поліпептид NP, або інший поліпептид вірусу грипу, що обговорювався вище. Включення антигенних поліпептидів у вакцинний вектор можна виконати множиною способів, відомих кваліфікованим в даній галузі техніки фахівцям, що включають, але без обмеження, систему сайт-спрямованого мутагенезу, що не залишає глибоких слідів, описаного в публікації міжнародної заявки на патент з № WO 2008/036675. Можна також створити бактерію, яка експресує поліпептиди вірусу грипу, в поєднанні з полінуклеотидами, здатними до посилення імунної відповіді, що обговорювалися вище. Зокрема, поліпептид CD154 або HMGB1 може експресуватися вакцинним вектором для посилення імунної відповіді у суб'єкта проти поліпептидів вірусу грипу. У прикладах демонструється виклик рясної продукції IgA і IgG на вакцинацію у курчат. Автори даного винаходу передбачають, що така сильна відповідь буде оберігати від захворюваності, пов'язаної з подальшим інфікуванням або зараженням джерелом антигенного поліпептиду (вірусом грипу в прикладах), або принаймні знижувати її. Композиції можна вводити множиною способів, в тому числі, але без обмеження, орально, інтраназально або через слизову оболонку. Наприклад, доставку композицій або вакцинних векторів можна здійснити з використанням аерозолю, за допомогою розпилення, за допомогою 6 UA 110024 C2 5 10 15 20 25 30 35 40 45 50 55 60 додавання в харчові продукти або воду, за допомогою орального введення через зонд або через очні краплі. У деяких варіантах здійснення композиції вводять за допомогою ін'єкції, наприклад, внутрішньошкірно, парентерально, підшкірно, внутрьоочеревинно, внутрішньовенно, інтракраніально або внутрішньом'язово. У випадку курчат або іншої домашньої птиці композиції можна вводити в яйце. Суб'єкти включають, але без обмеження, хребетних, відповідно ссавців, відповідно людини, корів, кішок, собак, свиней, або птахів, відповідно домашньої птиці, такої як курчата. Можуть також використовуватися інші моделі інфекційного захворювання на тваринах. Посилення імунної відповіді включає, але без обмеження, виклик терапевтичного або профілактичного ефекту, що опосередковується імунною системою суб'єкта. Зокрема, посилення імунної відповіді може включати збільшену продукцію антитіл, наприклад, продемонстровану на Фіг. 13, збільшене перемикання класу - перемикання синтезу важких ланцюгів антитіл, наприклад, продукцію IgA, продемонстровану на Фіг. 8, дозрівання антигенпрезентуючих клітин, стимуляцію Т-клітин-хелперів, стимуляцію цитолітичних Т-клітин або індукцію Т- і В-клітинної імунологічний пам'яті. Дози, застосовні для ведення, будуть варіювати залежно від віку, ваги і виду суб'єкта, способу і шляху введення і типу патогена або захворювання, проти якого потрібна імунна відповідь. Композицію можна вводити в будь-якій дозі вакцинного вектора, достатній для 3 10 виклику імунної відповіді. Передбачається, що прийняьтними є дози в діапазоні від 10 до 10 4 9 піків вектора (тобто бляшкоутворювальних або колонієутворювальних одиниць), від 10 до 10 5 7 піків вектора або від 10 до 10 піків вектора. Композицію можна вводити тільки один раз, або її можна вводити два або більше разів для збільшення імунної відповіді. Наприклад, композицію можна вводити два або більше разів з інтервалами, що складають один тиждень, два тижні або три тижні, один місяць, два місяці, три місяці, шість місяців або більше. Бактерії можуть бути життєздатними перед введенням, але в деяких варіантах здійснення бактерії можуть бути убитими або інактивованими перед введенням. У деяких варіантах здійснення бактерії можуть бути здатними до реплікації в організмі суб'єкта, в той час як в інших варіантах здійснення бактерії можуть бути нездатними до реплікації в організмі суб'єкта. Як продемонстровано в прикладах, бактеріальні вакцинні вектори можна інактивувати до введення, використовуючи формалін, етанол, нагрівання або антибіотики. Кваліфікованому в даній галузі техніки фахівцеві буде зрозуміло, що інші способи інактивації вакцинних векторів могли б також використовуватися. Тут також надається вакцинний вектор Bacillus spp. Bacillus вакцинний вектор включає першу полінуклеотидну послідовність, що кодує антигенний поліпептид, і другу полінуклеотидну послідовність, що кодує імуностимулюючий поліпептид. Антигенний поліпептид і імуностимулюючий поліпептид присутні на поверхні Bacillus вакцинного вектора, описаного вище. Антигенним поліпептидом є поліпептид вірусу грипу, описаний вище, а імуностимулюючим поліпептидом є поліпептид HMGB1, описаний вище, або поліпептид CD154. Полінуклеотиди, що кодують імуностимулюючі поліпептиди, які гомологічні білкам суб'єкта і здатні до стимулювання відповіді імунної системи на антигенний поліпептид, можуть бути також введені у вакцинний вектор. Як описано детальніше в прикладах, вакцинний вектор може включати поліпептид CD154, який здатний до зв'язування CD40 у суб'єкта і стимулювання відповіді суб'єкта на вакцинний вектор і пов'язаний з ним антигенний поліпептид, подібно HMGB1, описаному вище. Bacillus вакцинний вектор може включати поліпептид HMGB1, поліпептид CD154 або їх комбінацію. Як описано вище, полінуклеотиди, що кодують ці поліпептиди, можуть бути вбудовані в хромосому вакцинного вектора або зберігатися поза хромосомою. Кваліфікованому в даній галузі техніки фахівцеві буде зрозуміло, що ці поліпептиди можуть бути включені в ряд поліпептидів вакцинного вектора і представлені в різних частинах вакцинного вектора або можуть секретуватися. Полінуклеотид, що кодує імуностимулюючий поліпептид, здатний до посилення імунної відповіді проти антигенного поліпептиду, може також кодувати антигенний поліпептид. Полінуклеотид, що кодує імуностимулюючий поліпептид, може бути пов'язаний з полінуклеотидом, що кодує антигенний поліпептид, наприклад, у вакцинному векторі імуностимулюючий поліпептид і антигенний поліпептид кодуються одним і тим же полінуклеотидом. У прикладах полінуклеотид, що кодує поліпептид CD154, який здатний до зв'язування CD40, або HMGB1, також кодує епітоп M2e, епітоп HA і епітоп NP вірусу грипу A. Дивіться SEQ ID NO: 19-22. В прикладах як полінуклеотид, що кодує епітопи білків вірусу грипу, так і полінуклеотид, що кодує імуностимулюючий поліпептид, експресуються з плазміди для експресії у вегетативних клітинах. У деяких варіантах здійснення полінуклеотиди вбудовані в ген cotB або інший ген, що кодує білок, який представляється на поверхні спор. Кваліфікованим 7 UA 110024 C2 5 10 15 20 25 30 35 40 45 50 55 60 в даній галузі техніки фахівцям буде зрозуміло, що бактеріальні полінуклеотиди, які кодують інші трансмембранні білки, можуть також використовуватися. Як обговорювалося вище, полінуклеотид, що кодує імуностимулюючий поліпептид, гомологічний білку у суб'єкта, який здатний до посилення імунної відповіді проти епітопа, може бути включений у вакцинний вектор. У прикладах Bacillus вакцинний вектор, що включає полінуклеотид, який кодує або поліпептид CD154, здатний до зв'язування з CD40, або поліпептид HMGB1, як показано, посилював імунну відповідь проти епітопа M2e і два відмінні епітопа HA, що визначено по збільшенню продукції антитіл у відповідь на вакцинацію. Відповідно, коли довжина поліпептиду CD154 складає менше ніж 50 амінокислот, ще більш відповідно менше ніж 40, менше ніж 30 або менше ніж 20 амінокислот. Довжина поліпептиду може складати від 10 до 15 амінокислот, від 10 до 20 амінокислот або від 10 до 25 амінокислот. Серед різних видів послідовність CD154 і CD40-зв'язувальна область не є у високій мірі консервативними. Послідовності CD154 курки і людини представлені в SEQ ID NO: 11 і SEQ ID NO: 12, відповідно. CD40-зв'язувальні області CD154 були визначені для ряду видів, в тому числі людини, курки, качки, миші і великої рогатої худоби, і представлені в SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, відповідно. Хоча існують варіабельність послідовностей в CD40-зв'язувальній області між видами, в представлених нижче прикладах показано, що поліпептид CD154 людини здатний до посилення імунної відповіді у курчат. Отже, даний винахід можна здійснити на практиці, використовуючи видоспецифічні поліпептиди CD154 або гетерологічний поліпептид CD154. Зокрема, поліпептиди CD154 і їх функціональні фрагменти або гомологи включають поліпептиди, ідентичні або ідентичні на принаймні 99 %, принаймні 98 %, принаймні 95 %, принаймні 90 %, принаймні 85 % або принаймні 80 % поліпептидам CD154 з SEQ ID NO: 11-17. Bacillus вакцинний вектор, що описується тут, може використовуватися в способах посилення імунної відповіді і способах зниження захворюваності грипом у суб'єкта, описаних вище. Bacillus вакцинний вектор може використовуватися для виготовлення композицій для введення суб'єктам, таким як ті, які також описані вище. Гетерологічні полінуклеотиди, що кодують антигенні поліпептиди, можуть бути вбудовані в бактеріальний геном в будь-якому неістотному місці, або альтернативно їх можна перемістити на плазміду, використовуючи добре відомі в даній галузі техніки способи. Одне місце, прийнятне для вбудовування полінуклеотидів, знаходиться всередині поверхневих частин трансмембранних білків або пов'язані з послідовностями, які орієнтують гетерологічний полінуклеотид на шляху секреції. Прикладами гена трансмембранного білка, прийнятного для вставки полінуклеотидів, є ген cotB Bacillus і ген lamb Salmonella. Гетерологічні полінуклеотиди включають, але без обмеження, полінуклеотиди, що кодують антигени, які відбираються з патогенних мікроорганізмів або вірусів, відмінних від вакцинного вектора. Такі полінуклеотиди можуть походити від патогенних вірусів, таких як вірус грипу (наприклад, M2e, гемаглютинін або нейрамінідаза), віруси герпесу (наприклад, гени, коліруючі структурні білки вірусів герпесу), ретровіруси (наприклад, оболонковий білок gpl60), аденовіруси, параміксовіруси, коронавіруси і т. п. Можна також отримати гетерологічні полінуклеотиди з патогенних бактерій, наприклад, гени, що кодують бактеріальні білки, такі як токсини або білки зовнішньої мембрани. Крім того, гетерологічні полінуклеотиди з паразитів, таких як Eimeria, є привабливими кандидатами на застосування у векторній вакцині. Додаткові імуностимулюючі поліпептиди, залучені до приведення в дію імунної системи, можуть бути також включені у вакцинні вектори, що описуються тут. Полінуклеотиди можуть кодувати молекули імунної системи, відомі відносно їх стимулюючих ефектів, такі як інтерлейкін, фактор некрозу пухлин або інтерферон, або інший поліпептид, залучених до імунорегуляції. Наступні приклади, як мається на увазі, є виключно ілюстративними і не маються на увазі як обмеження об'єму даного винаходу або прикладеної формули винаходу. ПРИКЛАДИ Приклад 1. Конструювання HA/NP/M2e/cCD154 і HA/NP/M2e/HMGB1 Bacillus векторів. Штами і умови культивування Всі плазміди спочатку зберігали в клітинах Е. coli TOP10 (Invitrogen, Carlsbad, CA, США), крім особливо обумовлених випадків. Bacillus spp. використовували для введення мутацій (штам Bacillus subtilis, Poultry Health Laboratory, названий NP122). Бактерії, що містять плазміду pDGIEF і pHT10, нарощували при 37 °C. Середу Лурія-Бертані (LB) використовували для звичайного нарощування клітин, а середовище SOC (Invitrogen, Carlsbad, CA, США) використовували для фенотипічного вираження після електропорації. По мірі доцільності в середовище додавали наступне: 8 UA 110024 C2 5 10 15 20 25 30 35 40 ізопропіл-β-D-тіогалактопіранозид (IPTG) в концентрації 1 мМ, ампіцилін (Amp) в концентрації 100 мкг/мл, спектиноміцин (SP) в концентрації 100 мкг/мл і хлорамфенікол (Cm) в концентрації 5 мкг/мл. Плазміди Плазміди pDGIEF (Bacillus Genetic Stock Center, Columbus, OH) і pHT10, використані в даному дослідженні, були описані раніше (Zhang et al., Nuc. Acids Research 2006, 34 (9): 1-8 і Nguyen et al., Curr. Micro. 2007, 55: 89-93). Плазміда pDGIEF виконувала функцію матриці для ампліфікації гена mazF, який використовувався як проміжний селектований маркер під час маніпулювання хромосомою Bacillus. Плазміду pHT10 використовували для кодування і продукування гетерологічних послідовностей епітопів білків вірусу пташиного грипу в Bacillus spp. Ця плазміда містить ген стійкості до CM, її індукцію здійснюють, додаючи 1 мМ IPTG, і її зберігають в Bacillus при 37 °C. Продукція гетерологічних білків для експресії у вегетативних клітинах: Плазміду pHT10, куплену у MoBioTec/Boca Scientific, Boca Raton, FL (Nguyen et al., 2007), перетворювали в сайт множинного клонування при додаванні вставкової послідовності з оптимізацією частоти використання кодонів для Bacillus subtilis. Проводили секвенування ДНК для підтвердження правильної вставки послідовності. По-новому модифіковану плазміду потім трансформували в Bacillus. Коротко, культури Bacillus нарощували протягом ночі при 37 °C в середовищі HS (середовищі Спіцайзена, доповненої 0,5 % глюкози, 50 мкг/мл DL-триптофану, 50 мкг/мл урацилу, 0,02 % гідролізату казеїну, 0,1 % дріжджового екстракту, 8 мкг/мл аргініну, 0,1 мкг/мл гістидину, 1 мМ MgSО4). Нічну культуру (1 мл) використовували для засівання в 20 мл середовища (середовища Спіцайзена, доповненого 0,5 % глюкози, 5 мкг/мл DL-триптофану, 5 мкг/мл урацилу, 0,01 % гідролізату казеїну, 0,1 % дріжджового екстракти, 1 мМ MgSО4, 2,5 мМ MgCl2, 0,5 мМ CaCl2), і інкубацію проводили при струшуванні протягом 3-4 годин при 30 °C. До 1 мл результуючої культури LS додавали 10 мкл 0,1 M EGTA, і інкубацію проводили при кімнатній температурі протягом 5 хвилин. Потім додавали 1-2 мкг плазмідної ДНК, здійснювали струшування протягом 2 годин при 37 °C, і здійснювали засівання на чашки з LB з селективними антибіотиками. Ці трансформовані Bacillus spp. Тепер продукують гетерологічні послідовності епітопів з AI після індукції 1 мМ IPTG.) ПЛР Всі праймери, використані для ПЛР, перераховані в таблиці 1. Типові умови для ПЛР складалися з приблизно 0,1 мкг очищеної геномної, плазмідної або утвореної в ході ПЛР ДНК (Qiagen, Valencia, CA, США), 1x буфера для полімерази Pfu, 5 Е полімерази Pfu (Stratagene La Jolla, CA, США), 1 мМ dNTP (GE Healthcare Bio-Sciences Corp., Piscataway, NJ), 1,2 мкМ кожного праймера в загальному об'ємі, що дорівнює 50 мкл. Термоциклер - прилад для ампліфікації ДНК (Bio-Rad, Hercules, CA, США) застосовували з наступними умовами ампліфікації: 94 °C протягом 2 хвилин; 30 циклів, кожен з яких складався з 94 °C протягом 30 сек, 58 °C протягом 60 сек, 72 °C протягом 90 сек для кожної 1 т. о.; і 72 °C протягом 10 хвилин для кінцевого подовження. Кожний продукт ПЛР піддавали очищенню з гелю (Qiagen, Valencia, CA, США) і елююванню або в 25 мкл буфера EB для приготування матриць, що використовуються в ПЛР з використанням перекриття і подовження, або в 50 мкл буфера ЕВ, осаджували етанолом і суспендували в 5 мкл ddH2О для електропорації в Bacillus spp. 9 UA 110024 C2 5 10 15 20 25 30 У таблиці 1 виділені курсивом нуклеотиди є нуклеотидами, які комплементарні тій або іншій стороні сайта вставки в ген CotB Bacillus subtilis. Електропорація Коротко, клітини засівали в 10 мл середовища LB і нарощували при 37 °C протягом ночі. Потім 100 мкл нічної культури знову засівали в 10 мл нового середовища LB з інкубацією при 37 °C протягом 3-4 годин. Клітини промивали п'ять разів водою ddH 2O і ресуспендували в 60 мкл 10 % гліцерину. Потім на клітини посилали імпульси при 2,4-2,45 кВ протягом 1-6 мсек, їх інкубували в 0,5 мл SOC протягом 2-3 годин при 37 °C і засівали на середовище LB з відповідними антибіотиками. Інтеграція в хромосому гетерологічної ДНК для представлення в оболонці спори: Рекомбінантні штами Bacillus, що містять стійко інтегровані копії відібраних епітопів M2e, HA і NP, конструювали, використовуючи недавно опубліковані способи з модифікацією. Коротко, штами Bacillus трансформували касетою MazF (Zhang et al., 2006), яка породжувала штам, який був чутливим до IPTG і стійким до спектоміцину. Касету MazF, фланковану гомологічною ДНК розміром приблизно 300 п. о. з кожної сторони, вводили в ген CotB (Isticato et al., 2001) Bacillus вектора з допомогою електропорації з подальшим вирощуванням в середовищі, що містить спектоміцин, для відбору позитивних клонів, які тепер містять касету MazF, яка є стійкою до спектоміцину. Після підтвердження мутації MazF в CotB, цю область заміняли оптимізованою відносно частоти використання кодонів послідовністю ДНК, що кодує антигенні детермінанти AI, знову фланкованою гомологічною ДНК розміром приблизно 300 п. о. Це виконували за допомогою створення продукту ПЛР, використовуючи ПЛР з використанням перекриття і подовження, щоб створити антигенні послідовності, фланковані послідовностями розміром приблизно 300 п. о. з кожної сторони, гомологічними хромосомі Bacillus (Cox et al., 2007). Продукт ПЛР вводили в Bacillus знову за допомогою електропорації і заміщення касети MazF. Відбирання трансформантів здійснювали на чашках, що містять IPTG, позитивні клони повинні тепер бути нереагуючими на IPTG і чутливими до спектоміцину. Правильну вставку послідовності в хромосому підтверджували за допомогою секвенування ДНК. Приклад 2. Дослідження 1 і 2 вакцинації. Курчат в день вилуплення (день 0) отримували з місцевої комерційної інкубаторної станції і випадковим чином розділяли на групи терапії (n=15/група терапії в експерименті 1 і n=20/групі терапії в експерименті 2). Всіх курчат в кожній групі терапії забезпечували ярличками і 10 UA 110024 C2 занумеровували. Курчат орально інфікували за допомогою введення через зонд 0,25 мл 6 8 сольового розчину або 10 -10 КУО/мл різних Bacillus терапій, вказаних в таблиці 2 для дослідження 1 і в таблиці 3 для дослідження 2. Таблиця 2 Заражувальна доза для кожної групи терапії в дослідженні 1 вакцинації Група терапії Тільки сольовий розчин BS/AI/HMGB1 BS/AI/HMGB1 BS/AI/CD154 BS/AI/CD154 Заражувальна доза 6 10 КУО/мл 8 10 КУО/мл 6 10 КУО/мл 8 10 КУО/мл 5 Таблиця 3 Заражувальна доза для кожної групи терапії в дослідженні 2 вакцинації Група терапії BSBB (Bacillus) BS/AI/HMGB1 BS/AI/CD154 BS/AI/HMGB1 інактивовані нагріванням BS/AI/HMGB1 інактивовані формаліном BS/AI/HMGB1 піддані основаній на антибіотиках інактивації BS/AI/HMGB1 інактивовані етанолом 10 15 20 25 30 35 Заражувальна доза 6 10 КУО/мл 6 10 КУО/мл 6 10 КУО/мл 6 10 КУО/мл 6 10 КУО/мл 6 10 КУО/мл 6 10 КУО/мл У дослідженні 2 бактерії інактивували декількома різними способами для оцінки, чи необхідна реплікація для виклику продукції антитіл, спрямованих проти антигенних пептидів вірусу грипу. Використовували декілька способів інактивації, оскільки способи інактивації могли привести до руйнування епітопа і привести до невірної інтерпретації даних і підтвердження необхідності реплікації або життєздатності Bacillus вектора. Бактерії інактивували за допомогою інкубації протягом 10 хвилин в 0,022 % формаліні (інактивовані формаліном); інкубації протягом 10 хвилин при 70 °C (інактивовані нагріванням); інкубації в 5 мкг/мл гентаміцину (піддані основаній на антибіотиках інактивації) або інкубації протягом 10 хвилин в 70 % етанолі (інактивовані етанолом). Кожну групу терапії розміщували в окремому підлоговому загоні на свіжій сосновій підстилці і необмежено надавали воду і їжу. У дні 11 і 21 після вилуплення птахи отримували бустервакцину тієї ж терапії, яку вони отримували в день 0. Також в дні 21 і 31/32 від кожного забезпеченого ярличком птаха отримували кров, і знімали сироватку. Сироватку, отриману від забезпечених ярличками птахів в кожній групі терапії, потім використовували в ELISA із захопленням антитіл для визначення продукції антитіл, специфічних для M2e, HAUA і HALB. Коротко, індивідуальна ямка 96-ямкового планшета покривала 10 мкг/мл епітопа M2e, епітопа HAUA або епітопа HALB, кон'югованого з BSA. Допускали проходження адгезії антигенів протягом ночі при 4 °C. Планшети промивали PBS+0,05 % Tween 20, блокували PBS Superblock (Pierce Chemical Co.) протягом як мінімум 2 годин і інкубували протягом 2 годин з сироваткою, попередньо отриманою від птахів в кожній з груп терапій, описаних вище, Планшети промивали PBS+0,05 % Tween 20 з подальшою інкубацією з кон'югованим з пероксидазою козячим другим антитілом проти IgY курей (в розведенні 1:7500), отриманим з Jackson ImmunoResearch Laboratories (West Grove, PA), протягом ще години. Після подальшого промивання планшети виявляли, використовуючи набір з субстратом для пероксидази, отриманий від Fisher Scientific, і оптичні густини зчитувала на спектрофотометрі при 450 нм і 405 нм. Зразки об'єднаних сироваток від груп, одержуючих векторні вакцини, використовували як позитивні контролі, а зразки об'єднаних сироваток від невакцинованих груп використовували як негативні контролі в кожному планшеті для заміни сироватки від груп терапій. Оптична густина, отримана для позитивного контролю, негативного контролю і експериментальних зразків, використала для розрахунку відношень зразка до позитивного контролю (відношень S/Р), використовуючи наступний розрахунок: 11 UA 110024 C2 Розрахунок відношення S/P: 5 10 15 20 25 30 35 40 45 середнє значення для зразка – середнє значення для негативного контролю середнє значення для позитивного контроля – середнє значення для негативного контролю Розраховані відношення S/Р для кожного дослідження представлені на Фіг. 1-6. На Фіг. 1-3 представлені сумарні титри антитіл проти M2e, HALB і HAUA для дослідження 1, відповідно, в дні 21 і 31 після вилуплення. Результати доводять, що сильні імунні відповіді проти кожного з цих антигенів були викликані після орального введення Bacillus, що експресує кожний з цих епітопів разом або з CD154, або HMGB1 як імуностимулюючого пептиду. На Фіг. 4-6 представлені сумарні титри антитіл проти M2e, HALB і HAUA для дослідження 2, відповідно, в дні 21 і 32 після вилуплення. Результати доводять, що сильні імунні відповіді проти кожного з цих епітопів були викликані після орального введення живий Bacillus, що експресує епітоп і імуностимулюючий пептид. На Фіг. 4-6 також показано, що схожі рівні специфічних антитіл були також породжені, коли вектор (Bacillus) був інактивований до введення. Приклад 3. Дослідження 3 вакцинації Курчат в день вилуплення (день 0) отримували з місцевої комерційної інкубаторної станції і випадковим чином розділяли на групи терапії (n=20/група терапії). Всіх курчат в кожній групі терапії забезпечували ярличками і занумеровували. Курчат оральний інфікували за допомогою 5 8 введення через зонд 0,25 мл сольового розчину або 10 -10 КУО/мл Bacillus вектора (BSBB), Bacillus вектора, що експресує епітопи білків пташиного грипу і HMGB1 (BS/AI/HMGB1), або різних кількостей BS/AI/HMGB1 вектора після інактивації формаліном (як описано вище). У день 10 після вилуплення птахи отримували бустер-вакцину тієї ж терапії, яку вони отримували в день 0. Також в дні 21 і 32 від кожного забезпеченого ярличком птаха отримували кров, і знімали сироватку. Рівні специфічних для M2e антитіл класу IgG в сироватці визначали, використовуючи описаний вище спосіб з використанням міченого пероксидазою другого антитіла, специфічного для IgG курей (Jackson ImmunoResearch Laboratories, West Grove, PA). Представлені на Фіг. 7 результати доводять, що так само як живі бактерій інактивовані формаліном бактерії були здатні до стимулювання продукції специфічних для M2e антитіл класу IgG. Цей результат був несподіваним, оскільки звичайно вважають, що тільки живі бактерії можуть стимулювати сильну імунну відповідь після орального введення. Приклад 4. Дослідження 4 вакцинації Курчат в день вилуплення (день 0) отримували з місцевої комерційної інкубаторної станції і випадковим чином розділяли на групи терапії (n=20-35/групу терапії). Всіх курчат в кожній групі терапії забезпечували ярличками і занумеровували. Курчат інфікували за допомогою орального 6 введення через зонд або підшкірної ін'єкції 0,25 мл сольового розчину або 10 КУО/мл Bacillus вектори (BSBB), Bacillus вектора, що експресує епітопи білків пташиного грипу і HMGB1 (BSAI), або BSAI вектора після інактивації формаліном (як описано вище) або після інактивації формаліном з подальшої ліофілізацією (сольового розчину, що відтворюється з використанням безпосередньо перед введенням). У день 10 після вилуплення деякі птахи отримували бустервакцину тієї ж терапії, яку вони отримували в день 0. В дні 11, 14 і 21 від кожного забезпеченого ярличком птаха отримували кров, і знімали сироватку. Рівні специфічних для M2e антитіл класів IgA і IgG в сироватці визначали, використовуючи описаний вище спосіб з використанням міченого пероксидазою антитіла проти IgA курей (GenTex) або міченого пероксидазою другого антитіла проти IgG курей (Jackson ImmunoResearch Laboratories, West Grove, PA). Представлені на Фіг. 8 результати доводять, що приблизно так само як живі бактерії інактивовані формаліном бактерії були здатні до стимулювання продукції специфічних для M2e антитіл класу IgA після орального введення. Навпаки, у випадку підшкірного введення інактивований BSAI вектор не був настільки ж ефективний в стимулюванні продукції антитіл класу IgA, і ліофілізовані бактерії не стимулювали продукцію IgA. Представлені на Фіг. 9 результати доводять, що кожний з протоколів введення BSAI підтримував рясне утворення IgG. 12 UA 110024 C2 13 UA 110024 C2 14 UA 110024 C2 15 UA 110024 C2 16 UA 110024 C2 17 UA 110024 C2 18 UA 110024 C2 19 UA 110024 C2 20 UA 110024 C2 21 UA 110024 C2 22 UA 110024 C2 23 UA 110024 C2 24 UA 110024 C2 25 UA 110024 C2 26 UA 110024 C2 27 UA 110024 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюVaccine vector and method for enhancing immune response
Автори англійськоюBerghman, Luc, Bottje, Walter, Hargis, Billy, Layton, Sherryll
Назва патенту російськоюВакцинный вектор и способ усиления иммунного ответа
Автори російськоюБергман Люк, Боттдж Уолтер, Харджис Билли, Лейтон Шеррилл
МПК / Мітки
МПК: A61K 39/145
Мітки: імунної, вектор, посилення, вакцинний, відповіді, спосіб
Код посилання
<a href="https://ua.patents.su/39-110024-vakcinnijj-vektor-i-sposib-posilennya-imunno-vidpovidi.html" target="_blank" rel="follow" title="База патентів України">Вакцинний вектор і спосіб посилення імунної відповіді</a>
Попередній патент: Система збору даних
Наступний патент: Піразоли як антагоністи crth2
Випадковий патент: Гомеопатичний лікарський засіб та спосіб лікування еректильних дисфункцій