Заміщені в положенні 6 індолінонові похідні
Номер патенту: 79625
Опубліковано: 10.07.2007
Автори: Тонч-Грунт Ульріке, Клей Йорг, Хекель Армін, Хільберг Франк, Леманн-Лінтц Торстен, ван Меел Якобус (Жак) С.А., Рот Геральд Юрген
Формула / Реферат
1. Сполуки загальної формули
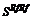 , (I)
, (I)
у якій
Х означає атом кисню,
R1 означає атом водню,
R2 означає атом фтору, хлору або брому або ціаногрупу,
R3 означає фенільну групу або однозаміщену атомом фтору, хлору, брому або йоду або С1-С3алкоксигрупою фенільну групу, при цьому вказані незаміщені, а також однозаміщені фенільні групи додатково можуть бути заміщені в положенні 3 або 4 ідентичними або різними замісниками, вибраними з групи, яка включає атом фтору, атом хлору, атом брому, ціаногрупу, С1-С3алкоксигрупу, С1-С2алкілкарбоніламіногрупу, ціано-С1-С3алкіл, карбоксі-С1-С3алкіл, карбоксі-С1-С4алкоксигрупу, карбоксі-С1-С3алкіламіногрупу, карбоксі-С1-С3алкіл-N-(С1-С3алкіл)аміногрупу, С1-С4алкоксикарбоніл-С1-С3алкіл, С1-С4алкоксикарбоніл-С1-С3алкоксигрупу, С1-С4алкоксикарбоніл-С1-С3алкіламіногрупу, С1-С4алкоксикарбоніл-С1-С3алкіл-N-(С1-С3алкіл)аміногрупу, аміно-С1-С3алкіл, амінокарбоніл-С1-С3алкіл, (С1-С2алкіламіно)карбоніл-С1-С3алкіл, ді(С1-С2алкіл)амінокарбоніл-С1-С3алкіл, (С1-С2алкілкарбоніл)аміно-С1-С3алкіл, (С1-С4алкоксикарбоніл)аміно-С1-С3алкіл, (С3-С6алкілкарбоніл)аміно-С1-С3алкіл, (фенілкарбоніл)аміно-С1-С3алкіл, (С3-С6циклоалкілкарбоніл)аміно-С1-С3алкіл, (С3-С6циклоалкіл-С1-С3алкілкарбоніл)аміно-С1-С3алкіл, (фенілкарбоніл)аміно-С1-С3алкіл, (тіофен-2-ілкарбоніл)аміно-С1-С3алкіл, (фуран-2-ілкарбоніл)аміно-С1-С3алкіл, (феніл-С1-С3алкілкарбоніл)аміно-С1-С3алкіл, (2-(С1-С4алкокси)бензоїлкарбоніл)аміно-С1-С3алкіл, (піридин-2-ілкарбоніл)аміно-С1-С3алкіл, (піридин-3-ілкарбоніл)аміно-С1-С3алкіл, (піридин-4-ілкарбоніл)аміно-С1-С3алкіл, С1-С3алкілпіперазин-1-ілкарбоніл-С1-С3алкіл, карбоксі-С2-С3алкеніл, амінокарбоніл-С2-С3алкеніл, (С1-С3алкіламіно)карбоніл-С2-С3алкеніл, ді(С1-С3алкіл)амінокарбоніл-С2-С3алкеніл і С1-С4алкоксикарбоніл-С2-С3алкеніл,
R4 означає фенільну групу або фенільну групу, монозаміщену заміщеною в кінцевому положенні аміногрупою, гуанідиногрупою, моно- або ді(С1-С2алкіл)аміногрупою, N-[![]() -ді(С1-С3алкіл)аміно-С2-С3алкіл]-N-(С1-С3алкіл)аміногрупою, N-метил-(С3-С4алкіл)аміногрупою, N-(С1-С3алкіл)-N-бензиламіногрупою, N-(С1-С4алкоксикарбоніл)аміногрупою, N-(C1-С4алкоксикарбоніл)-С1-С4алкіламіногрупою, 4-(С1-С3алкіл)піперазин-1-ілом, імідазол-1-ілом, піролідин-1-ілом, азетидин-1-ілом, морфолін-4-ілом, піперазин-1-ілом, тіоморфолін-4-ілом, С1-С3алкільною групою або монозаміщену ди(С1-С3алкіл)аміно-(С1-С3алкіл)сульфонілом, 2-[ді(С1-С3алкіл)аміно]етоксигрупою, 4-(С1-С3алкіл)піперазин-1-ілкарбонілом, {
-ді(С1-С3алкіл)аміно-С2-С3алкіл]-N-(С1-С3алкіл)аміногрупою, N-метил-(С3-С4алкіл)аміногрупою, N-(С1-С3алкіл)-N-бензиламіногрупою, N-(С1-С4алкоксикарбоніл)аміногрупою, N-(C1-С4алкоксикарбоніл)-С1-С4алкіламіногрупою, 4-(С1-С3алкіл)піперазин-1-ілом, імідазол-1-ілом, піролідин-1-ілом, азетидин-1-ілом, морфолін-4-ілом, піперазин-1-ілом, тіоморфолін-4-ілом, С1-С3алкільною групою або монозаміщену ди(С1-С3алкіл)аміно-(С1-С3алкіл)сульфонілом, 2-[ді(С1-С3алкіл)аміно]етоксигрупою, 4-(С1-С3алкіл)піперазин-1-ілкарбонілом, {![]() -[ді(С1-С3алкіл)аміно]-(С2-С3алкіл)}-N-(С1-С3алкіл)амінокарбонілом, 1-(С1-С3алкіл)імідазол-2-ілом, (С1-С3алкіл)сульфонілом або групою формули
-[ді(С1-С3алкіл)аміно]-(С2-С3алкіл)}-N-(С1-С3алкіл)амінокарбонілом, 1-(С1-С3алкіл)імідазол-2-ілом, (С1-С3алкіл)сульфонілом або групою формули
 ,
,
у якій
R7 являє собою С1-С2алкіл, С1-С2алкілкарбоніл, ді(С1-С2алкіл)амінокарбоніл-С1-С3алкіл або С1-С3алкілсульфоніл, і
R8 являє собою С1-С3алкіл, ![]() -[ді(С1-С2алкіл)аміно]-С2-С3алкіл,
-[ді(С1-С2алкіл)аміно]-С2-С3алкіл, ![]() -[моно(С1-С2алкіл)аміно]-С2-С3алкіл або заміщену в кінцевому положенні ді(С1-С2алкіл)аміногрупою, піперазин-1-ілом або 4-(С1-С3алкіл)піперазин-1-ілом (С1-С3алкіл)карбонільну, (С4-С6алкіл)карбонільну або карбоніл(С1-С3алкільну) групу,
-[моно(С1-С2алкіл)аміно]-С2-С3алкіл або заміщену в кінцевому положенні ді(С1-С2алкіл)аміногрупою, піперазин-1-ілом або 4-(С1-С3алкіл)піперазин-1-ілом (С1-С3алкіл)карбонільну, (С4-С6алкіл)карбонільну або карбоніл(С1-С3алкільну) групу,
при цьому всі присутні в залишку R4 діалкіламіногрупи можуть бути також представлені в кватернізованій формі, наприклад у вигляді N-мeтил-(N,N-діалкіл)амонієвої групи, де протиіон переважно вибраний з йодиду, хлориду, броміду, метилсульфонату, пара-толуолсульфонату і трифторацетату,
R5 означає атом водню, і
R6 означає атом водню,
при цьому під вищевказаними алкільними групами маються на увазі лінійні і розгалужені алкільні групи, у яких від одного до трьох атомів водню додатково можуть бути замінені на атом(и) фтору, і крім цього присутня карбокси-, аміно- або іміногрупа може бути заміщена залишком, який відщеплюється in vivo, відповідно може бути представлена у вигляді пролікарського залишку, наприклад у вигляді групи, яка перетворюється in vivo у карбоксигрупу, або у вигляді групи, яка перетворюється in vivo у іміно- або аміногрупу,
їх таутомери, енантіомери, діастереомери, їх суміші і їх солі.
2. Сполуки загальної формули І за п. 1, у яких X, R1, R2, R4, R5 і R6 мають вказані в п. 1 значення, а R3 означає фенільну групу, заміщену С1-С2алкілкарбоніламіногрупою, карбоксі-С1-С3алкілом, карбоксі-С1-С4алкоксигрупою, С1-С4алкоксикарбоніл-С1-С3алкілом, С1-С4алкоксикарбоніл-С1-С3алкоксигрупою, амінокарбоніл-С1-С3алкілом, (С1-С2алкіламіно)карбоніл-С1-С3алкілом, ді(С1-С2алкіл)амінокарбоніл-С1-С3алкілом, (С1-С2алкілкарбоніл)аміно-С1-С3алкілом, (С1-С4алкоксикарбоніл)аміно-С1-С3алкілом, (фенілкарбоніл)аміно-С1-С3алкілом, (С3-С6-циклоалкілкарбоніл)аміно-С1-С3алкілом, (С3-С6-циклоалкіл-С1-С3алкілкарбоніл)аміно-С1-С3алкілом, (фенілкарбоніл)аміно-С1-С3алкілом, (тіофен-2-ілкарбоніл)аміно-С1-С3алкілом, (фуран-2-ілкарбоніл)аміно-С1-С3алкілом, (феніл-С1-С3алкілкарбоніл)аміно-С1-С3алкілом, (2-(С1-С4алкокси)бензоїлкарбоніл)аміно-С1-С3алкілом, (піридин-2-ілкарбоніл)аміно-С1-С3алкілом, (піридин-3-ілкарбоніл)аміно-С1-С3алкілом, (піридин-4-ілкарбоніл)аміно-С1-С3алкілом, С1-С3алкілпіперазин-1-ілкарбоніл-С1-С3алкілом, амінокарбоніл-С2-С3алкенілом, (С1-С3алкіламіно)карбоніл-С2-С3алкенілом, ді(С1-С3алкіл)амінокарбоніл-С2-С3алкенілом або С1-С4алкоксикарбоніл-С2-С3алкенілом.
3. Сполуки загальної формули І за п. 1, у яких X, R1, R2, R4, R5 і R6 мають вказані в п. 1 значення, а R3 означає фенільну групу, заміщену карбоксі-С1-С3алкілом або С1-С4алкоксикарбоніл-С1-С3алкілом.
4. Сполуки загальної формули І за будь-яким з пп. 1-3, у яких X, R1, R3, R4, R5 і R6 мають вказані в пп. 1-3 значення, а R2 означає атом фтору або хлору.
5. Сполуки загальної формули І за п. 1, вибрані з групи, яка включає
(а) 3-Z-[1-(4-диметиламінометиланіліно)-1-(3-(2-карбоксіетил)феніл)метилен]-6-хлор-2-індолінон,
(б) 3-Z-[1-(4-диметиламінометиланіліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-фтор-2-індолінон,
(в) 3-Z-[1-(4-диметиламінометиланіліно)-1-(3-(2-карбоксіетил)феніл)метилен]-6-фтор-2-індолінон,
(г) 3-Z-[1-(4-(N-(4-метилпіперазин-1-ілметилкарбоніл)-N-метиламіно)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-фтор-2-індолінон,
(д) 3-Z-[1-(4-(N-(2-диметиламіноетил)-N-метилсульфоніламіно)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-фтор-2-індолінон,
(е) 3-Z-[1-(4-(N-(3-диметиламінопропіл)-N-ацетиламіно)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-фтор-2-індолінон,
(ж) 3-Z-[1-(4-(1-метилімідазол-2-іл)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-фтор-2-індолінон,
(з) 3-Z-[1-(4-(N-(диметиламінометилкарбоніл)-N-метиламіно)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-фтор-2-індолінон,
(й) 3-Z-[1-(4-(N-(2-диметиламіноетилкарбоніл)-N-метиламіно)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-фтор-2-індолінон,
(к) 3-Z-[1-(4-(піролідин-1-ілметил)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-фтор-2-індолінон,
(л) 3-Z-[1-(4-(діетиламінометил)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-фтор-2-індолінон,
(м) 3-Z-[1-(4-(2-диметиламіноетил)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-хлор-2-індолінон,
(н) 3-Z-[1-(4-диметиламінометиланіліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-хлор-2-індолінон,
(о) 3-Z-[1-(4-(піролідин-1-ілметил)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-хлор-2-індолінон,
(п) 3-Z-[1-(4-(піролідин-1-ілметил)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-бром-2-індолінон,
(р) 3-Z-[1-(4-(диметиламінометил)аніліно)-1-(4-(2-карбоксіетил)феніл)метилен]-6-бром-2-індолінон,
(с) 3-Z-[1-(4-(діетиламінометил)аніліно)-1-(4-(2-карбоксіетил)метилен]-6-бром-2-індолінон,
(т) 3-Z-[1-(4-(диметиламінометиланіліно)-1-(4-(2-етоксикарбонілетил)феніл)метилен]-6-фтор-2-індолінон, а також їх солі.
6. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що являє собою фізіологічно сумісну сіль.
Текст
1. Сполуки загальної формули 2 (13) 1 C2 (54) ЗАМІЩЕНІ В ПОЛОЖЕННІ 6 ІНДОЛІНОНОВІ ПОХІДНІ (19) ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 79625 С4алкоксикарбоніл-С 1-С3алкіл, С1С4алкоксикарбоніл-С 1-С3алкоксигрупу, С1С4алкоксикарбоніл-С 1-С3алкіламіногрупу, С1С4алкоксикарбоніл-С 1-С3алкіл-N-(С1С3алкіл)аміногрупу, аміно-С1-С3алкіл, амінокарбоніл-С1-С3алкіл, (С1-С2алкіламіно)карбоніл-С1С3алкіл, ді(С1-С2алкіл)амінокарбоніл-С 1-С3алкіл, (С1-С2алкілкарбоніл)аміно-С 1-С3алкіл, (С1С4алкоксикарбоніл)аміно-С 1-С3алкіл, (С3С6алкілкарбоніл)аміно-С 1-С3алкіл, (фенілкарбоніл)аміно-С 1-С3алкіл, (С3С6циклоалкілкарбоніл)аміно-С1-С3алкіл, (С3С6циклоалкіл-С 1-С3алкілкарбоніл)аміно-С 1-С3алкіл, (фенілкарбоніл)аміно-С 1-С3алкіл, (тіофен-2ілкарбоніл)аміно-С 1-С3алкіл, (фуран-2ілкарбоніл)аміно-С 1-С3алкіл, (феніл-С 1С3алкілкарбоніл)аміно-С 1-С3алкіл, (2-(С1С4алкокси)бензоїлкарбоніл)аміно-С1-С3алкіл, (піридин-2-ілкарбоніл)аміно-С1-С3алкіл, (піридин-3ілкарбоніл)аміно-С 1-С3алкіл, (піридин-4ілкарбоніл)аміно-С 1-С3алкіл, С1-С3алкілпіперазин1-ілкарбоніл-С 1-С3алкіл, карбоксі-С 2-С3алкеніл, амінокарбоніл-С2-С3алкеніл, (С1С3алкіламіно)карбоніл-С2-С3алкеніл, ді(С1С3алкіл)амінокарбоніл-С 2-С3алкеніл і С1С4алкоксикарбоніл-С 2-С3алкеніл, R4 означає фенільну груп у або фенільну гр упу, монозаміщену заміщеною в кінцевому положенні аміногрупою, гуанідиногрупою, моно- або ді(С1С2алкіл)аміногрупою, N-[ w -ді(С1-С3алкіл)аміно-С 2С3алкіл]-N-(С1-С3алкіл)аміногрупою, N-метил-(С3С4алкіл)аміногрупою, N-(С1-С3алкіл)-Nбензиламіногрупою, N-(С1С4алкоксикарбоніл)аміногрупою, N-(C1С4алкоксикарбоніл)-С1-С4алкіламіногрупою, 4-(С1С3алкіл)піперазин-1-ілом, імідазол-1-ілом, піролідин-1-ілом, азетидин-1-ілом, морфолін-4-ілом, піперазин-1-ілом, тіоморфолін-4-ілом, С1С3алкільною групою або монозаміщену ди(С 1С3алкіл)аміно-(С1-С3алкіл)сульфонілом, 2-[ді(С1С3алкіл)аміно]етоксигрупою, 4-(С1С3алкіл)піперазин-1-ілкарбонілом, { w -[ді(С1С3алкіл)аміно]-(С2-С3алкіл)}-N-(С1С3алкіл)амінокарбонілом, 1-(С1-С3алкіл)імідазол-2ілом, (С1-С3алкіл)сульфонілом або групою формули R8 N R7 , у якій R7 являє собою С1-С2алкіл, С1-С2алкілкарбоніл, ді(С1-С2алкіл)амінокарбоніл-С 1-С3алкіл або С1С3алкілсульфоніл, і R8 являє собою С1-С3алкіл, w -[ді(С1С2алкіл)аміно]-С2-С3алкіл, w -[моно(С 1С2алкіл)аміно]-С2-С3алкіл або заміщену в кінцевому положенні ді(С 1-С2алкіл)аміногрупою, піперазин-1-ілом або 4-(С1-С3алкіл)піперазин-1-ілом (С1С3алкіл)карбонільну, (С4-С6алкіл)карбонільну або карбоніл(С 1-С3алкільну) гр упу, при цьому всі присутні в залишку R4 діалкіламіногрупи можуть бути також представлені в кватерні 4 зованій формі, наприклад у вигляді N-мeтил-(N,Nдіалкіл)амонієвої групи, де протиіон переважно вибраний з йодиду, хлориду, броміду, метилсульфонату, пара-толуолсульфонату і трифторацетату, R5 означає атом водню, і R6 означає атом водню, при цьому під вищевказаними алкільними групами маються на увазі лінійні і розгалужені алкільні групи, у яких від одного до трьох атомів водню додатково можуть бути замінені на атом(и) фтору, і крім цього присутня карбокси-, аміно- або іміногрупа може бути заміщена залишком, який відщеплюється in vivo, відповідно може бути представлена у вигляді пролікарського залишку, наприклад у вигляді групи, яка перетворюється in vivo у карбоксигруп у, або у вигляді групи, яка перетворюється in vi vo у іміно- або аміногрупу, їх та утомери, енантіомери, діастереомери, їх суміші і їх солі. 2. Сполуки загальної формули І за п. 1, у яких X, R1, R2, R4 , R5 і R6 мають вказані в п. 1 значення, а R3 означає фенільну групу, заміщену С 1С2алкілкарбоніламіногрупою, карбоксі-С1С3алкілом, карбоксі-С1-С4алкоксигрупою, С1С4алкоксикарбоніл-С 1-С3алкілом, С1С4алкоксикарбоніл-С 1-С3алкоксигрупою, амінокарбоніл-С 1-С3алкілом, (С1-С2алкіламіно)карбоніл-С1С3алкілом, ді(С1-С2алкіл)амінокарбоніл-С 1С3алкілом, (С1-С2алкілкарбоніл)аміно-С1С3алкілом, (С1-С4алкоксикарбоніл)аміно-С 1С3алкілом, (фенілкарбоніл)аміно-С1-С3алкілом, (С3-С6-циклоалкілкарбоніл)аміно-С 1-С3алкілом, (С3-С6-циклоалкіл-С 1-С3алкілкарбоніл)аміно-С1С3алкілом, (фенілкарбоніл)аміно-С1-С3алкілом, (тіофен-2-ілкарбоніл)аміно-С1-С3алкілом, (фуран2-ілкарбоніл)аміно-С1-С3алкілом, (феніл-С 1С3алкілкарбоніл)аміно-С 1-С3алкілом, (2-(С1С4алкокси)бензоїлкарбоніл)аміно-С1-С3алкілом, (піридин-2-ілкарбоніл)аміно-С1-С3алкілом, (піридин-3-ілкарбоніл)аміно-С 1-С3алкілом, (піридин-4ілкарбоніл)аміно-С 1-С3алкілом, С1С3алкілпіперазин-1-ілкарбоніл-С 1-С3алкілом, амінокарбоніл-С2-С3алкенілом, (С1С3алкіламіно)карбоніл-С2-С3алкенілом, ді(С1С3алкіл)амінокарбоніл-С 2-С3алкенілом або С 1С4алкоксикарбоніл-С 2-С3алкенілом. 3. Сполуки загальної формули І за п. 1, у яких X, R1, R2, R4 , R5 і R6 мають вказані в п. 1 значення, а R3 означає фенільну групу, заміщену карбоксі-С 1С3алкілом або С1-С4алкоксикарбоніл-С1-С3алкілом. 4. Сполуки загальної формули І за будь-яким з пп. 1-3, у яких X, R1, R3, R4 , R5 і R6 мають вказані в пп. 1-3 значення, а R2 означає атом фтору або хлор у. 5. Сполуки загальної формули І за п. 1, вибрані з групи, яка включає (а) 3-Z-[1-(4-диметиламінометиланіліно)-1-(3-(2карбоксіетил)феніл)метилен]-6-хлор-2-індолінон, (б) 3-Z-[1-(4-диметиламінометиланіліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (в) 3-Z-[1-(4-диметиламінометиланіліно)-1-(3-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (г) 3-Z-[1-(4-(N-(4-метилпіперазин-1ілметилкарбоніл)-N-метиламіно)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, 5 79625 6 (д) 3-Z-[1-(4-(N-(2-диметиламіноетил)-Nметилсульфоніламіно)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (е) 3-Z-[1-(4-(N-(3-диметиламінопропіл)-Nацетиламіно)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (ж) 3-Z-[1-(4-(1-метилімідазол-2-іл)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (з) 3-Z-[1-(4-(N-(диметиламінометилкарбоніл)-Nметиламіно)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (й) 3-Z-[1-(4-(N-(2-диметиламіноетилкарбоніл)-Nметиламіно)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (к) 3-Z-[1-(4-(піролідин-1-ілметил)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (л) 3-Z-[1-(4-(діетиламінометил)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (м) 3-Z-[1-(4-(2-диметиламіноетил)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-хлор-2-індолінон, (н) 3-Z-[1-(4-диметиламінометиланіліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-хлор-2-індолінон, (о) 3-Z-[1-(4-(піролідин-1-ілметил)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-хлор-2-індолінон, (п) 3-Z-[1-(4-(піролідин-1-ілметил)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-бром-2-індолінон, (р) 3-Z-[1-(4-(диметиламінометил)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-бром-2-індолінон, (с) 3-Z-[1-(4-(діетиламінометил)аніліно)-1-(4-(2карбоксіетил)метилен]-6-бром-2-індолінон, (т) 3-Z-[1-(4-(диметиламінометиланіліно)-1-(4-(2етоксикарбонілетил)феніл)метилен]-6-фтор-2індолінон, а також їх солі. 6. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що являє собою фізіологічно сумісну сіль. Даний винахід стосується нових заміщених у положенні 6 індолінонових похідних загальної формули лікування надлишкової або аномальної проліферації клітин. Об'єктом даного винаходу є далі способи одержання лікарських засобів, які відрізняються насамперед тим, що запропоновані у винаході сполуки або їх фізіологічно сумісної солі об'єднують з одним або декількома інертними носіями і/або розріджувачами. І. У наведеній вище загальній формулі І X означає атом кисню, R1 означає атом водню, R2 означає атом фтору, хлору або брому або ціаногрупу, R3 означає фенільну груп у або однозаміщену атомом фтору, хлор у, брому або йоду або С 1С3алкоксигрупою фенільну групу, при цьому вказані незаміщені, а також однозаміщені фенільні групи додатково можуть бути заміщені в положенні 3 або 4 ідентичними або різними замісниками, вибраними з групи, яка включає атом фтору, атом хлору, атом брому, ціаногрупу, С1-С3алкоксигрупу, С1-С2алкілкарбоніламіногрупу, ціано-С1-С3алкіл, карбокси-С 1-С3алкіл, карбокси-С1-С4алкоксигрупу, карбокси-С 1-С3алкіламіногрупу, карбокси-С1С3алкіл-N-(С1-С3алкіл)аміногрупу, С1С4алкоксикарбоніл-С 1-С3алкіл, С1С4алкоксикарбоніл-С 1-С3алкоксигрупу, С1С4алкоксикарбоніл-С 1-С3алкіламіногрупу, С1С4алкоксикарбоніл-С 1-С3алкіл-N-(С1С3алкіл)аміногрупу, аміно-С1-С3алкіл, амінокарбоніл-С1-С3алкіл, (С1-С2алкіламіно)карбоніл-С1С3алкіл, ди(С1-С2алкіл)амінокарбоніл-С 1-С3алкіл, (С1-С2алкілкарбоніл)аміно-С 1-С3алкіл, (С1С4алкоксикарбоніл)аміно-С 1-С3алкіл, (С3С6алкілкарбоніл)аміно-С 1-С3алкіл, (фенілкарбоніл)аміно-С 1-С3алкіл, (С3С6циклоалкілкарбоніл)аміно-С1-С3алкіл, (С3С6циклоалкіл-С 1-С3алкілкарбоніл)аміно-С 1-С3алкіл, (фенілкарбоніл)аміно-С 1-С3алкіл, (тіофен-2ілкарбоніл)аміно-С 1-С3алкіл, (фуран-2ілкарбоніл)аміно-С 1-С3алкіл, (феніл-С 1С3алкілкарбоніл)аміно-С 1-С3алкіл, (2-(С1 їх та утомерів, енантіомерів, діастереомерів, їх сумішей і їх солей, насамперед їх фізіологічно сумісних солей, які мають цінні фармакологічні властивості, лікарських засобів, які містять ці сполуки, їх застосування і способу їх одержання. Вищевказані сполуки загальної формули І мають цінні фармакологічні властивості, насамперед інгібуючу дію на різні кінази, головним чином рецепторні тирозинкінази, такі як VEGFR1, VEGFR2, VEGFR3, PDGFRa, PDGFRb, FGFR1, FGFR3, EGFR, HER2, c-Kit, IGF1R, HGFR і Flt-3, а також на проліферацію культивованих клітин людини, насамперед ендотеліальних клітин, наприклад при ангіогенезі (розвитку кровоносних судин), і на проліферацію інших клітин, насамперед пухлинних клітин. Відповідно до цього об'єктом даного винаходу є представлені вище сполуки загальної формули І, які мають цінні фармакологічні властивості, а також лікарські засоби, які містять ці фармакологічно активні сполуки, застосування цих сполук та спосіб їх одержання. Об'єктом даного винаходу є, крім того, фізіологічно сумісні солі запропонованих у винаході сполук, лікарські засоби, які містять ці сполуки, які додатково необов'язково містять один або декілька інертних носіїв і/або розріджувачів, а також застосування подібних сполук для одержання лікарського засобу, придатного насамперед для 7 79625 С4алкокси)бензоїлкарбоніл)аміно-С1-С3алкіл, (піридин-2-ілкарбоніл)аміно-С1-С3алкіл, (піридин-3ілкарбоніл)аміно-С 1-С3алкіл, (піридин-4ілкарбоніл)аміно-С 1-С3алкіл, С1-С3алкілпіперазин1-ілкарбоніл-С 1-С3алкіл, карбокси-С 2-С3алкеніл, амінокарбоніл-С2-С3алкеніл, (С1С3алкіламіно)карбоніл-С2-С3алкеніл, ди(С1С3алкіл)амінокарбоніл-С 2-С3алкеніл і С1С4алкоксикарбоніл-С 2-С3алкеніл, R4 означає фенільну гр упу або фенільну гр упу, монозаміщену заміщеною в кінцевому положенні аміногрупою, гуанідиногрупою, моно- або ди(С1С2алкіл)аміногрупою, N-[w-ди(С1-С3алкіл)аміно-С 2С3алкіл] -N-(С1-С3алкіл)аміногрупою, N-метил-(С3С4алкіл)аміногрупою, N-(С1-С3алкіл)-Nбензиламіногрупою, N-(С1С4алкоксикарбоніл)аміногрупою, N-(С1С4алкоксикарбоніл)-С1-С4алкіламіногрупою, 4-(С1С3алкіл)піперазин-1-ілом, імідазол-1-ілом, піролідин-1-ілом, азетидин-1-ілом, морфолін-4-ілом, піперазин-1-ілом, тіоморфолін-4-ілом С1С3алкільною групою або монозаміщену ди(С 1С3алкіл)аміно-(С1-С3алкіл)сульфонілом, 2-[ди(С1С3алкіл)аміно]етоксигрупою, 4-(С1С3алкіл)піперазин-1-ілкарбонілом, {w-[ди(С1С3алкіл)аміно]-(С2-С3алкіл)}-N-(С1Сзалкіл)амінокарбонілом, 1-(С1-С3алкіл)імідазол-2ілом, (С1-С3алкіл)сульфонілом або групою формули у якій R7 являє собою С1-С2алкіл, С1С2алкілкарбоніл, ди(С1-С2алкіл)амінокарбоніл-С 1С3алкіл або С1-С3алкілсульфоніл і R8 являє собою С 1-С3алкіл, w-[ди(С1С2алкiл)аміно]-С2-С3алкіл, w-[моно(С 1С2алкіл)аміно]-С2-С3алкіл або заміщену в кінцевому положенні ди(С 1-С2алкіл)аміногрупою, піперазин-1-ілом або 4-(С1-С3алкіл)піперазин-1-ілом (С1С3алкіл)карбонільну, (С4-С6алкіл)карбонільну або карбоніл(С 1-С3алкільну) гр упу, при цьому всі присутні в залишку R4 діалкіламіногрупи можуть бути також представлені в кватернізованій формі, наприклад у вигляді N-метил(N,N-діалкіл)амонієвої групи, де протиіон переважно вибраний з йодиду, хлориду, броміду, метилсульфонату, пара-толуолсульфонату і трифторацетату, R5 означає атом водню і R6 означає атом водню, при цьому під вищевказаними алкільними групами маються на увазі лінійні і розгалужені алкільні групи, у яких від одного до трьох атомів водню додатково можуть бути замінені на атом(-и) фтору, і крім цього присутня карбокси-, аміно-або іміногрупа може бути заміщена залишком, який відщеплюється in vivo, відповідно може бути представлена у вигляді пролікарського залишку, наприклад у вигляді групи, яка перетворюється in vivo у карбоксигрупу, або у вигляді гр упи, яка перетворюється 8 in vivo у іміно- або аміногрупу, при цьому до сполук формули І належать також їх та утомери, енантіомери, діастереомери, їх суміші і їх солі. II. До особливо переважних сполук наведеної вище загальної формули І належать сполуки, у яких X, R 1, R5 і R6 мають вказані вище в п.І значення й у якій далі ll.і. R2 і R4 мають вказані вище в п.І значення, а R3 означає фенільну груп у або однозаміщену атомом фтору, хлору, брому або йоду або СрСзалкоксигрупою фенільну груп у, при цьому вказані незаміщені, а також однозаміщені фенільні групи додатково можуть бути заміщені в положенні 3 або 4 ідентичними або різними замісниками, вибраними з групи, яка включає атом фтору, атом хлору, атом брому, ціаногрупу, С1-С3алкоксигрупу, С1С2алкілкарбоніламіногрупу, ціано-С1-С3алкіл, карбокси-С 1-С3алкіл, карбокси-С 1-С4алкоксигрупу, карбокси-С 1-С3алкіламіногрупу, карбокси-С1С3алкіл-N-(С1-С3алкіл)аміногрупу, С1С4алкоксикарбоніл-С 1-С3алкіл, С1С4алкоксикарбоніл-С 1-С3алкоксигрупу, С1С4алкоксикарбоніл-С 1-С3алкіламіногрупу, С1С4алкоксикарбоніл-С 1-С3алкіл-N-(С1С3алкіл)аміногрупу, аміно-С1-С3алкіл, амінокарбоніл-С1-С3алкіл, (С1-С2алкіламіно)карбоніл-С1С3алкіл, ди-(С1-С2алкіл)амінокарбоніл-С 1-С3алкіл, (С1-С2алкілкарбоніл)аміно-С 1-С3алкіл, (С1С4алкоксикарбоніл)аміно-С 1-С3алкіл, (С3С6алкілкарбоніл)аміно-С 1-С3алкіл, (фенілкарбоніл)аміно-С 1-С3алкіл, (С3-С6циклоалкілкарбоніл)аміно-С і -С3алкіл, (СзСбциклоалкіл-С ι -С3алкілкарбоніл)аміно-С і С3алкіл, (фенілкарбоніл)аміно-С 1-С3алкіл, (тіофен2-ілкарбоніл)аміно-С1-С3алкіл, (фуран-2ілкарбоніл)аміно-С 1-С3алкіл, (феніл-С 1С3алкілкарбоніл)аміно-С 1-С3алкіл, (2-(С1С4алкокси)бензоїлкарбоніл)аміно-С1-С3алкіл, (піридин-2-ілкарбоніл)аміно-С1-С3алкіл, (піридин-3ілкарбоніл)аміно-С 1-С3алкіл, (піридин-4ілкарбоніл)аміно-С 1-С3алкіл, С1-С3алкілпіперазин1-ілкарбоніл-С 1-С3алкіл, карбокси-С 1-С3алкеніл, амінокарбоніл-С2-С3алкеніл, (С1С3алкіламіно)карбоніл-С2-С3алкеніл, ди-(С1С3алкіл)амінокарбоніл-С 2-С3алкеніл і С1С4алкоксикарбоніл-С 2-С3алкенiл, Il.ii. R 2 і R4 мають вказані вище в п.I значення, а R3 означає фенільну групу, заміщену С 1С2алкілкарбоніламіногрупою, карбокси-С1С3алкілом, карбокси-С1-С4алкоксигрупою, С1С4алкоксикарбоніл-С 1-С3алкілом, С1С4алкоксикарбоніл-С 1-С3алкоксигрупою, амінокарбоніл-С 1-С3алкілом, (С1-С2алкіламіно)карбоніл-С1С3алкілом, ди-(С1-С2алкіл)амінокарбоніл-С С 1-С3 алкілом, (С1-С2алкілкарбоніл)аміно-С1-С3алкілом, (С1-С4алкоксикарбоніл)аміно-С 1-С3алкілом, (фенілкарбоніл)аміно-С 1-С3алкілом, (С3С6циклоалкілкарбоніл)аміно-С1-С3алкілом, (С3С6циклоалкіл-С 1-С3алкілкарбоніл)аміно-С 1С3алкілом, (фенілкарбоніл)аміно-С1-С3алкілом, (тіофен-2-ілкарбоніл)міно-С 1-С3алкілом, (фуран-2ілкарбоніл)аміно-С 1-С3алкілом, (феніл-С 1С3алкілкарбоніл)аміно-С 1-С3алкілом, (2-(С1С4алкокси)бензоїлкарбоніл)аміно-С1-С3алкілом, 9 79625 10 (піридин-2-ілкарбоніл)аміно-С1-С3алкілом, (піридин-3-ілкарбоніл)аміно-С 1-С3алкілом, (піридин-4ілкарбоніл)аміно-С 1-С3алкілом, С1С3алкілпіперазин-1-ілкарбоніл-С 1-С3алкілом, амінокарбоніл-С2-С3алкенілом, (С1С3алкіламіно)карбоніл-С2-С3алкенілом, ди-(С1С3алкіл)амінокарбоніл-С 2-С3алкенілом або С 1С4алкоксикарбоніл-С 2-С3алкенілом, ІІ.ііі. R2 і R4 мають вказані вище в п.І значення, а R3 означає заміщену карбокси-С 1-С3алкілом або С1-С4алкоксикарбоніл-С1-С3алкілом фенільну груп у, Il.iv. R3 і R4 мають вказані вище в п.І значення, а R2 означає атом фтор у або хлор у, II.v. R2 і R3 мають вказані вище в п.І значення, а R4 означає фенільну гр упу або фенільну гр упу, монозаміщену заміщеною в кінцевому положенні аміногрупою, гуанідиногрупою, моно- або ди-(С1С2алкіл)аміногрупою, Ν-[w-ди-(С1-С3алкіл)аміноС2-С3алкіл] -Ν-(С1-С3алкіл)аміногрупою, N-метил(С3-С4алкіл)аміногрупою, N-(С1-С3алкіл)-Nбензиламіногрупою, N-(С1С4алкоксикарбоніл)аміногрупою, N-(С1С4алкоксикарбоніл)-С1-С4алкіламіногрупою, 4-(С1С3алкіл)піперазин-1-ілом, імідазол-1-ілом, піролідин-1-ілом, азетидин-1-ілом, морфолін-4-ілом, піперазин-1-ілом, тіоморфолін-4-ілом С1С3алкільною групою або монозаміщену ди-(С1С3алкіл)аміно-(С1-С3алкіл)сульфонілом, 2-[ди-(С1С3алкіл)аміно]етоксигрупою, 4-(С1С3алкіл)піперазин-1-ілкарбонілом, {w-[ди-(С1С3алкіл)aміно]-(С2-С3алкіл)}-N-(С1С3алкіл)амінокарбонілом, 1-(С1-С3алкіл)імідазол-2ілом, (С1-С3алкіл)сульфонілом або групою формули III.i. X, R 1 , R2 , R5 і R6 мають вказані вище в п.І значення, R3 має вказані вище в п.ll.і значення, a R4 має вказані вище в п.ll.ν значення, lll.іі. X, R1, R2, R5 і R6 мають вказані вище в п. І значення, R3 має вказані вище в п.ll.іі значення, a R4 має вказані вище в п.ll.ν значення, lll.ііі. X, R1 , R2, R5 і R6 мають вказані вище в п.I значення, R3 має вказані вище в п.ll.іі. значення, a R4 має вказані вище в п.ll.ν значення, Ill.iv. X, R 1 , R5 і R6 мають вказані вище в п.І значення, R2 має вказані вище в п.Il.i v значення, R3 має вказані вище в п.ll.і, П.іі або ll.ііі значення, a R4 має вказані вище в п.ll.ν значення. Іншу переважну групу переважних сполук наведеної вище загальної формули І утворюють сполуки, у яких X означає атом кисню, R1 означає атом водню, R означає атом фтору, хлору або брому або ціаногрупу, R3 означає фенільну груп у або однозаміщену атомом фтору, хлор у, брому або йоду або С 1С3алкоксигрупою фенільну групу, при цьому вказані незаміщені, а також однозаміщені фенільні групи додатково можуть бути заміщені в положенні 3 або 4 ідентичними або різними замісниками, вибраними з групи, яка включає атом фтору, атом хлору, атом брому, С1-С3алкоксигрупу, С1С2алкілкарбоніламіногрупу, карбокси-С1-С3алкіл, амінокарбоніл-С1-С3алкіл, (С1С2алкіламіно)карбоніл-С1-С3алкіл, ди-(С1С2алкіл)амінокарбоніл-С 1-С3алкіл, (С1С2алкілкарбоніл)аміно-С 1-С3алкіл і (фенілкарбоніл)аміно-С 1-С3алкіл, R4 означає фенільну груп у, заміщену заміщеною в кінцевому положенні ди-(С1С2алкіл)аміногрупою С1-С3алкільною групою або групою формули у якій R7 являє собою С1-С2алкіл, С1С2алкілкарбоніл, ди-(С1-С2алкіліамінокарбоніл-С 1С3алкіл або С1-С3алкілсульфоніл і R8 являє собою С1-С3алкіл, w-[ди-(С1С2aлкiл)aмiнo]-C2-C3алкiл, w-[моно-(С1С2алкіл)аміно]-С2-С3алкіл або заміщену в кінцевому положенні ди-(С1-С2алкіл)аміногрупою, піперазин-1-ілом або 4-(С1-С3алкіл)піперазин-1-ілом (С1С3алкіл)карбонільну, (С4-С6алкіл)карбонільну або карбоніл-(С1-С3алкільну гр упу, при цьому всі присутні в залишку R4 діалкіламіногрупи можуть бути також представлені в кватернізованій формі, наприклад у вигляді Ν-метил(N,N-діалкіл)амонієвої групи, де протиіон переважно вибраний з йодиду, хлориду, броміду, метилсульфонату, пара-толуолсульфонату і трифторацетату. III. Серед особливо переважних сполук наведеної вище загальної формули І особливо слід виділити підгрупу сполук, у яких: у якій R7 являє собою С1-С2алкіл, С1С2алкілкарбоніл, ди-(С1-С2алкіл)амінокарбоніл-С 1С3алкіл або С1-С3алкілсульфоніл, а R8 являє собою С1-С3алкіл або w-[ди-(С1С2алкіл)амiно]-С2-С3алкіл або заміщену в кінцевому положенні ди-(С1-С2алкіл)аміногрупою, піперазиногрупою або 4-(С1-С3алкіл)піперазин-1-ілом С1С3алкілкарбонільну груп у, R5 означає атом водню і R6 означає атом водню, при цьому під вищевказаними алкільними групами маються на увазі лінійні і розгалужені алкільні групи, у яких від одного до трьох атомів водню додатково можуть бути замінені на атом(-и) фтору, і крім цього присутня карбокси-, аміно-або іміногрупа може бути заміщена залишком, який відщеплюється in vivo, їх та утомери, енантіомери, діастереомери, їх суміші і їх солі. Найбільш переважні наступні сполуки загальної формули І: 11 79625 (а) 3-Z-[1-(4-диметиламінометиланіліно)-1-(3(2-карбоксіетил)феніл)метилен]-6-хлор-2індолінон, (б) 3-Z-[1-(4-диметиламінометиланіліно)-1-(4(2-карбоксіетил)феніл)метилен]-6-фтор-2індолінон, (в) 3 -Z-[1-(4-диметиламінометиланіліно)-1-(3(2-карбоксіетил)феніл)метилен]-6-фтор-2індолінон, (г) 3-Z-[1-(4-(N-(4-метилпіперазин-1ілметилкарбоніл)-N-метиламіно)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (д) 3-Z-[1-(4-(N-(2-диметиламіноетил)-Nметилсульфоніламіно)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (e) 3-Z-[1-(4-(N-(3-диметиламінопропіл)-Nацетиламіно)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (ж) 3-Z-[1-(4-(1-метилімідазол-2-іл)аніліно)-1(4-(2-карбоксіетил)феніл)метилен]-6-фтор-2індолінон, (з) 3-Z-[1-(4-(N-(диметиламінометилкарбоніл)N-метиламіно)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (и) 3-Z-[1-(4-(N-(2-диметиламіноетилкарбоніл)N-метиламіно)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (κ) 3-Ζ-[1-(4-(піролідин-1-ілметил)аніліно)-1-(4(2-карбоксіетил)феніл)метилен]-6-фтор-2індолінон, (л) 3-Z-[1-(4-(діетиламінометил)аніліно)-1-(4-(2карбоксіетил)феніл)метилен]-6-фтор-2-індолінон, (м) 3-Ζ-[1-(4-(2-диметиламіноетил)аніліно)-1(4-(2-карбоксіетил)феніл)метилен]-6-хлор-2індолінон, (н) 3-Ζ-[1-(4-диметиламінометиланіліно)-1-(4(2-карбоксіетил)феніл)метилен]-6-хлор-2індолінон, (ο) 3-Ζ-[1-(4-(піролідин-1-ілметил)аніліно)-1-(4(2-карбоксіетил)феніл)метилен]-6-хлор-2індолінон, (п) 3-Ζ-[1-(4-(піролідин-1-ілметил)аніліно)-1-(4(2-карбоксіетил)феніл)метилен]-6-бром-2індолінон, (р) 3-Ζ-[1-(4-(диметиламінометил)аніліно)-1-(4(2-карбоксіетил)феніл)метилен]-6-бром-2індоліноні (с) 3-Ζ-[1-(4-(діетиламінометил)аніліно)-1-(4-(2карбоксіетил)метилен] -6-бром-2-індолінон, при цьому, крім того, присутня карбокси-, аміно- або іміногрупа може бути заміщена залишком, який відщеплюється in vivo, відповідно може бути представлена у вигляді пролікарського залишку, наприклад у вигляді групи, яка перетворюється in vi vo у карбоксигрупу, або у вигляді групи, яка перетворюється in vivo у іміно- або аміногрупу, а також їх солі. Під групою, яка перетворюється in vivo у карбоксигрупу, мається на увазі, наприклад, гідроксиметильна група або етерифікована спиртом карбоксигрупа, у якій спиртовий фрагмент переважно являє собою С 1-С6алканол, феніл-С 1-С3алканол, С3-С9циклоалканол, при цьому С 5-С8циклоалканол додатково може бути заміщений однією або двома С1-С3алкільними групами, С5-С8циклоалканол, у 12 якому метиленова група в положенні 3 або 4 замінена на атом кисню або на необов'язково заміщену С1-С3алкілом, феніл-С 1-С3алкілом, феніл-С 1С3алкоксикарбонілом або С1-С6алкілкарбонілом іміногрупу, а циклоалканольний фрагмент додатково може бути заміщений однією або двома С 1С3алкільними групами, С4-С7циклоалкенол, С3С5алкенол, феніл-С 3-С5алкенол, С3-С5алкінол або феніл-С 3-С5алкінол за умови, що з атомом кисню не зв'язаний атом вуглецю, який несе подвійний або потрійний зв'язок, С3-С8циклоалкіл-С 1С3алканол, біциклоалканол, який містить загалом від 8 до 10 атомів вуглецю і який у біциклоалкільному фрагменті додатково може бути заміщений однією або двома С 1-С3алкільними групами, 1,3дигідро-3-оксо-1-ізобензфуранол або спирт формули Ra-CO-O-(RbCRc)-OH, у якій Ra означає С 1-С8алкіл, С5-С7циклоалкіл, феніл або феніл-С1-С3алкіл, Rb означає атом водню, С1-С3алкіл, С5С7циклоалкіл або феніл і Rc означає атом водню або С1-С3алкіл, а під залишком, який відщеплюється in vivo від іміно- або аміногрупи, мається на увазі, наприклад, гідроксигрупа, ацильна група, така як бензоїл або піридиноїл, або С1-С16алкілкарбонільна група, така як форміл, ацетил, пропіоніл, бутаноїл, пентаноїл або гексаноїл, алілоксикарбонільна група, С1С16алкоксикарбонільна група, така як метоксикарбоніл, етоксикарбоніл, пропоксикарбоніл, ізопропоксикарбоніл, бутоксикарбоніл, третбутоксикарбоніл, пентоксикарбоніл, гексилоксикарбоніл, октилоксикарбоніл, нонілоксикарбоніл, децилоксикарбоніл, ундецилоксикарбоніл, додецилоксикарбоніл або гексадецилоксикарбоніл, феніл-С 1-С6алкоксикарбонільна група, така як бензилоксикарбоніл, фенілетоксикарбоніл або фенілпропоксикарбоніл, С1-С3алкілсульфоніл-С 2група, С1-С3алкокси-С 24алкоксикарбонільна 4алкокси-С 2-4алкоксикарбонільна група або група RaCO-O-(RbCRc)-O-CO, у якій Ra означає С 1С8алкіл, С5-С7циклоалкіл, феніл або феніл-С1С3алкіл, Rb означає атом водню, С1-С3алкіл, С5С7циклоалкіл або феніл і Rс означає атом водню, С1-С3алкіл або групу RaCO-O-(RbCRc)-O, у якій RaRc мають вказані вище значення, і у випадку залишку, який відщеплюється in vivo від аміногрупи, додатково мається на увазі також фталімідогрупа, при цьому вищевказані складноефірні залишки також можуть використовуватися як група, яка перетворюється in vivo у карбоксигрупу. Переважними пролікарськими залишками, у вигляді яких може бути представлена карбоксигрупа, є С1С6алкоксикарбонільна група, така як метоксикарбоніл, етоксикарбоніл, н-пропілоксилкарбоніл, ізопропілоксикарбоніл, н-бутилоксикарбоніл, нпентилоксикарбоніл, н-гексилоксикарбоніл або циклогексилоксикарбоніл, або феніл-С1С3алкоксикарбонільна група, така як бензилоксикарбоніл, а пролікарськими залишками, у вигляді яких може бути представлена іміно- або аміногрупа, є С1-С9алкоксикарбонільна група, така як метоксикарбоніл, етоксикарбоніл, н 13 79625 пропілоксикарбоніл, ізопропілоксикарбоніл, нбутилоксикарбоніл, н-пентилоксикарбоніл, нгексилоксикарбоніл, циклогексилоксикарбоніл, нгептилоксикарбоніл, н-октилоксикарбоніл або ннонілоксикарбоніл, феніл-С1С3алкоксикарбонільна група, така як бензилоксикарбоніл, необов'язково заміщена С 1-С3алкільною групою фенілкарбонільна група, така як бензоїл або 4-етилбензоїл, піридиноїльна група, така як нікотиноїл, С1-С3алкілсульфоніл-н-С 2С3алкоксикарбонільна група або С 1-С3алкокси-С 2С3алкокси-С 1-С4алкоксикарбонільна група, така як 2-метилсульфонілетоксикарбоніл або 2-(2етокси)етоксикарбоніл. Нові сполуки одержують відповідно до винаходу, наприклад, такими методами, які у принципі відомі з літератури. а) У цьому варіанті сполуку загальної формули у якій залишки Ζ1 і R3 необов'язково можуть мінятися положеннями, X, R2, R3 і R6 мають вказані вище значення, R1' має вказані вище для R1 значення або означає захисну груп у для атома азоту лактамової групи, при цьому R1 може також являти собою необов'язково утворений спейсером зв'язок із твердою фазою, і Ζ1 означає атом галогену, гідрокси- , алкокси- або арилалкоксигрупу, наприклад атом хлору або брому, метокси-, етокси- або бензилоксигрупу, піддають взаємодії з аміном загальної формули у якій R4 і R5 мають вищевказані значення, і потім при необхідності відщеплюють захисну групу, яка використовувалася для атома азоту лактамової групи або отриману таким шляхом сполуку від твердої фази. Як приклад захисної групи для атома азоту лактамової групи можна назвати ацетильну, бензоїльну, етоксикарбонільну, третбутилоксикарбонільну або бензилоксикарбонільну груп у, а як приклад твердої фази можна назвати смолу, таку як 4-(2',4'диметоксифеніламінометил)феноксисмола, зв'язок з якою переважно утворений аміногрупою, або смолу, яка представляє собою nбензилоксибензиловий спирт, зв'язок з якою переважно утворений проміжним членом, таким як 2,5диметокси-4-гідроксибензильне похідне. Описану вище взаємодію доцільно проводити в розчиннику, такому як диметилформамід, толуол, ацетонітрил, тетрагідрофуран, диметилсульфоксид, метиленхлорид або їх суміші, необов'яз 14 ково в присутності інертної основи, такої як триетиламін, N-етилдіізопропіламін або гідрокарбонат натрію, при температурі від 20 до 175°С, при цьому в результаті переамідування одночасно може відбуватися відщеплення використовуваної захисної групи. Якщо в сполуці загальної формули V Z1 означає атом галогену, то в цьому випадку взаємодію переважно проводити в присутності інертної основи при температурі від 20 до 120°С. Якщо ж у сполуці загальної формули V Z1 означає гідрокси-, алкокси- або арилалкоксигрупу, то в цьому випадку взаємодію переважно проводити при температурі від 20 до 200°С. Необхідне за певних умов наступне відщеплення використовуваної захисної групи доцільно здійснювати або гідролітичним шляхом у водному або спиртовому розчиннику, наприклад у метанолі/воді, етанолі/воді, ізопропанолі/воді, тетрагідрофурані/воді, діоксані/воді, диметилформаміді/воді, метанолі або етанолі, у присутності гідроксиду лужного металу, такого як гідроксид літію, гідроксид натрію або гідроксид калію, при температурі від 0 до 100°С, переважно від 10 до 50°С, або, що переважно, шляхом переамідування за допомогою органічної основи, такої як аміак, бутиламін, диметиламін або піперидин, у розчиннику, такому як метанол, етанол, диметилформамід і їх суміші, або в надлишковій кількості використовуваного аміну при температурі від 0 до 100°С, переважно від 10 до 50°С. Відщеплювати отриману сполуку від використовуваної твердої фази переважно за допомогою трифтороцтової кислоти і води при температурі від 0 до 35°С, переважно при кімнатній температурі. б) У цьому варіанті для одержання сполуки загальної формули І, у якій R3 означає заміщену карбокси-С 2-С3алкенілом, амінокарбоніл-С2С3алкенілом, (С1-С3алкіламіно)карбоніл-С2С3алкенілом, ди(С1-С3алкіламіно)карбоніл-С2С3алкенілом або С 1-С4алкоксикарбоніл-С 2С3алкенілом фенільну або нафтильну групу, сполуку загальної формули у якій R2, R4, R5, R6 і X мають вказані вище значення, R1 має вказані вище для R1 значення або означає захисну гр уп у для атома азоту лактамової групи, при цьому R1 може також являти собою необов'язково утворений спейсером зв'язок із твердою фазою, і Z3 означає групу, яка вилучається, наприклад атом галогену або алкільну або арилсульфонілоксигрупу, зокрема атом хлору, брому або йоду або метилсульфонілокси-, етилсульфонілокси-, n-толуолсульфонілокси- або три 15 79625 фторметансульфонілоксигрупу, піддають взаємодії з алкеном загальної формули у якій R3' означає аміно-, (С1-С3алкіламіно)-, ди(С1-С3алкіламіно)- або С1-С4алкоксигрупу, а n означає число 0 або 1. Подібну взаємодію доцільно проводити при каталізі паладієм з використанням, наприклад, ацетату паладію(ll), хлориду паладію(ll), ацетату біс(трифенілфосфін)паладію(ll), хлориду біс(трифенілфосфін)паладію(ll), паладію на активованому вугіллі, біс[1,2біс(дифенілфосфіно)етан]паладію(0), дихлор( 1,2біс(дифенілфосфіно)етан)паладію(ІІ), тетракістрифенілфосфінпаладію(0), трис(дибензиліденацетон)дипаладію(0), 1,1'біс(дифетлфосфіно)фероцендихлорпаладію(ll) або аддукту трис(дибензиліденацетон)дипаладію(0) і хлороформу, у присутності основи, такої як триетиламін, діізопропілетиламін, карбонат літію, карбонат калію, карбонат натрію, карбонат цезію, і ліганду, такого як трифенілфосфін, три-ортотолілфосфін або три(тpет-бутил)фосфін, у розчинниках, таких як ацетонітрил, Nметилпіролідинон, діоксан або диметилформамід і їх суміші. Процес необхідного за певних умов наступного відщеплення використовуваної захисної групи для атома азоту лактамової групи або отриманої сполуки від твердої фази аналогічний до описаного вище для варіанта (а). в) У цьому варіанті для одержання сполуки загальної формули І, у якій R3 означає заміщену карбокси-С 1-С3алкілом, С1-С4алкоксикарбоніл-С 1С3алкілом, амінокарбоніл-С1-С3алкілом, (С1С3алкіламіно)карбоніл-С1-С3алкілом або ди(С 1С3алкіл)амінокарбоніл-С 1-С3алкілом фенільну або нафтильну гр упу, сполуку загальної формули у якій R2, R4, R5, R6 і X мають вказані вище значення, R1' має вказані вище для R1 значення або означає захисну гр уп у для атома азоту лактамової групи, при цьому R1' може також являти собою необов'язково утворений спейсером зв'язок із твердою фазою, А означає С 2-С3алкеніл і R3' означає гідрокси-, С1-С4алкокси-, аміно-, (С1С3алкіламіно)- або ди-(С1-С3алкіл)аміногрупу, піддають гідруванню. 16 Подібне гідрування доцільно проводити шляхом каталітичного гідрування воднем у присутності каталізатора, такого як паладій на вугіллі або платина, у розчиннику, такому як метанол, етанол, етилацетат, диметилформамід, диметилформамід/ацетон або льодяна оцтова кислота, необов'язково з додаванням кислоти, такої як соляна кислота, при температурі від 0 до 50°С, переважно, однак, при кімнатній температурі, і при тиску водню від 1 до 7бар, переважно, однак, від 3 до 5бар. Процес необхідного за певних умов наступного відщеплення використовуваної захисної групи для атома азоту лактамової групи або отриманої сполуки від твердої фази аналогічний до описаного вище для варіанта (а). Якщо відповідно до винаходу одержують сполуку загальної формули І, яка містить алкоксикарбонільну групу, то цю сполуку можна перевести шляхом гідролізу у відповідну карбоксисполуку, або одержують сполуку загальної формули І, яка містить аміно- або алкіламіногрупу, то таку сполуку можна перевести шляхом гідроалкілування у відповідну алкіламіно- або діалкіламіносполуку, або одержують сполуку загальної формули І, яка містить діалкіламіногрупу, то цю сполук у можна перевести шляхом алкілування у відповідну триалкіламонієву сполуку, або одержують сполуку загальної формули І, яка містить аміно- або алкіламіногрупу, то цю сполуку можна перевести шляхом ацилювання або сульфонілування у відповідну ацильну або сульфонільну сполуку, або одержують сполуку загальної формули І, яка містить карбоксигрупу, то таку сполуку можна перевести шля хом етерифікації або амідування у відповідний складний ефір або відповідну амінокарбонільну сполуку, або одержують сполуку загальної формули І, яка містить нітрогрупу, то цю сполуку можна перевести шляхом відновлення у відповідну аміносполуку, або одержують сполуку загальної формули І, яка містить ціаногрупу, то цю сполуку можна перевести шляхом відновлення у відповідну амінометильну сполуку, або одержують сполуку загальної формули І, яка містить арилалкілоксигрупу, то таку сполук у можна перевести шляхом обробки кислотою у відповідну гідроксисполуку, або одержують сполуку загальної формули І, яка містить алкоксикарбонільну групу, то цю сполуку можна перевести шляхом омилення у відповідну карбоксисполуку, або одержують сполуку загальної формули І, у якому R являє собою заміщену аміногрупою, алкіламіногрупою, аміноалкілом або аміноалкільною групою фенільну групу, то цю сполуку можна перевести шляхом наступної взаємодії з відповідним ціанатом, ізоціанатом або карбамоїлгалогендом у відповідну сечовинну сполуку загальної формули І, або одержують сполуку загальної формули І, у якій R4 являє собою заміщену аміногрупою, алкіламіногрупою, аміноалкілом або аміноалкільною групою фенільну групу, то цю сполуку можна перевести шляхом наступної взаємодії з відповідною сполукою, яка передає амідиногрупу, або взаємодії з відповідним нітрилом у відповідну гуанідиносполуку загальної формули І. 17 79625 Наступний гідроліз переважно проводити у водному розчиннику, наприклад у воді, метанолі/воді, етанолі/воді, ізопропанолі/воді, тетрагідрофурані/воді або діоксане/воді, у присутності кислоти, такої як трифтороцтова кислота, соляна кислота або сірчана кислота, або в присутності гідроксиду лужного металу, такого як гідроксид літію, гідроксид натрію або гідроксид калію, при температурі від 0 до 100°С, переважно від 10 до 50°С. Наступне гідроалкілування переважно проводити в придатному для цієї мети розчиннику, такому як метанол, метанол/вода, метанол/вода/аміак, етанол, простий ефір, тетрагідрофуран, діоксан або диметилформамід, необов'язково з додаванням кислоти, такої як соляна кислота, у присутності каталітично активованого водню, наприклад водню в присутності нікелю Ренея, платини або паладію на вугіллі, або в присутності гідриду металу, такого як боргідрид натрію, боргідрид літію, ціаноборгідрид натрію або алюмогідрид літію, при температурі від 0 до 100°С, переважно від 20 до 80°С. Наступне алкілування переважно проводити в придатному для цієї мети розчиннику, такому як простий ефір, тетрагідрофуран, діоксан, дихлорметан, ацетон або ацетонітрил, у присутності алкілувальних агентів, таких як алкілйодиди, алкілброміди, алкілхлориди, ефіри алкілметансульфонових кислот, ефіри алкіллй/одг-толуолсульфонових кислот або алкілтрифторацетати, при температурі від 0 до 100°С, переважно від 20 до 60°С. Наступне ацилювання або сульфонілування доцільно проводити з використанням відповідної вільної кислоти або відповідної реакційноздатної сполуки, такої як її ангідрид, ефір, імідазолід або галогенангідрид, переважно в розчиннику, такому як метиленхлорид, діетиловий ефір, тетрагідрофуран, толуол, діоксан, ацетонітрил, диметилсульфоксид або диметилформамід, необов'язково в присутності неорганічної або третинної органічної основи при температурі від -20 до 200°С, переважно від 20°С до температури кипіння використовуваного розчинника. Взаємодію з вільною кислотою при необхідності можна проводити в присутності активатора кислоти або зневоднювального агента, наприклад у присутності ізобутилового ефіру хлормурашиної кислоти, тетраетилового ефіру ортовугільної кислоти, триметилового ефіру ортооцтової кислоти, 2,2-диметоксипропану, тетраметоксисилану, тіонілхлориду, триметилхлорсилану, трихлориду фосфору, пентоксиду фосфору, Ν,Ν'-дициклогексилкарбодііміду, N,N'дициклогексилкарбодііміду/N-гідроксисукциніміду, Ν,Ν'-дициклогексилкарбодііміду/1гідроксибензотриазолу, тетра фторборату 2-(1Нбензотриазол-1-іл)-1,1,3,3-тетраметилуронію, тетрафторборату 2-(1Н-бензотриазол-1-іл)-1,1,3,3 -тетраметилуронію/1-гідроксибензотриазолу, Ν,Ν'карбонілдіімідазолу або трифенілфосфіну/чотирихлористого вуглецю, і при необхідності з додаванням основи, такої як піридин, 4диметиламінопіридин, N-метилморфолін або триетиламін, переважно при температурі від 0 до 18 150°С, переважно від 0 до 100°С. Взаємодію з відповідною реакційноздатною сполукою можна при необхідності проводити в присутності третинної органічної основи, такої як триетиламін, Nетилдіізопропіламін, N-метилморфолін або піридин, або з використанням ангідриду в присутності відповідної кислоти при температурі від 0 до 150°С, переважно від 50 до 100°С. Наступну етерифікацію або наступне амідування доцільно проводити шляхом взаємодії відповідного реакційноздатного похідного карбонової кислоти з відповідним спиртом або аміном, як це описано вище. Етерифікацію або амідування переважно проводити в розчиннику, такому як метиленхлорид, діетиловий ефір, тетрагідрофуран, толуол, діоксан, ацетонітрил, диметилсульфоксид або диметилформамід, необов'язково в присутності неорганічної або третинної органічної основи, переважно при температурі від 20°С до температури кипіння використовуваного розчинника. При цьому взаємодію з відповідною кислотою переважно проводити в присутності зневоднювального агента, наприклад у присутності ізобутилового ефіру хлормурашиної кислоти, тетраетилового ефіру ортовугільної кислоти, триметилового ефіру ортооцтової кислоти, 2,2-диметоксипропану, тетраметоксисилану, тіонілхлориду, триметилхлорсилану, трихлориду фосфору, пентоксиду фосфору, Ν,Ν'дициклогексилкарбодііміду, Ν,Ν'дициклогексилкарбодііміду/N-гідроксисукциніміду, Ν,Ν'-дициклогексилкарбодііміду/1гідроксибензотриазолу, тетра фторборату 2-(1Нбензотриазол-1-іл)-1,1,3,3-тетраметилуронію, тетрафторборату 2-(1Н-бензотриазол-1-іл)-1,1,3,3тетраметилуронію/1-гідроксибензотриазолу, Ν,Ν'карбонілдіімідазолу або трифенілфосфіну/чотирихлористого вуглецю, і при необхідності з додаванням основи, такої як піридин, 4диметиламінопіридин, N-метилморфолін або триетиламін, переважно при температурі від 0 до 150°С, переважно від 0 до 100°С, а ацилювання переважно проводити шляхом взаємодії з відповідною реакційноздатною сполукою, такою як ангідрид, ефір, імідазолід або галогенангідрид вказаної кислоти, необов'язково в присутності третинної органічної основи, такої як триетиламін, Nетилдіізопропіламін, Ν-метилморфолін або піридин, при температурі від 0 до 150°С, переважно від 50 до 100°С. Наступне відновлення нітрогрупи переважно здійснювати шляхом гідрогенолізу, наприклад, під дією водню в присутності каталізатора, такого як паладій на вугіллі або нікель Ренея, у розчиннику, такому як метанол, етанол, етилацетат, диметилформамід, диметилформамід/ацетон або льодяна оцтова кислота, необов'язково з додаванням кислоти, такої як соляна кислота або льодяна оцтова кислота, при температурі від 0 до 50°С, переважно, однак, при кімнатній температурі, і при тиску водню від 1 до 7бар, переважно, однак, від 3 до 5бар. Наступне гідрування ціаногрупи переважно здійснювати шляхом гідрогенолізу, наприклад, під дією водню в присутності каталізатора, такого як 19 79625 паладій на вугіллі або нікель Ренея, у розчиннику, такому як метанол, етанол, етилацетат, метиленхлорид, диметилформамід, диметилформамід/ацетон або льодяна оцтова кислота, необов'язково з додаванням кислоти, такої як соляна кислота або льодяна оцтова кислота, при температурі від 0 до 50°С, переважно, однак, при кімнатній температурі, і при тиску водню від 1 до 7бар, переважно, однак, від 3 до 5бар. Наступний процес одержання відповідної гуанідиносполуки загальної формули І доцільно здійснювати взаємодією із сполукою, яка передає амідиногрупу, такою як амідин 3,5-диметилпіразол-1карбонової кислоти, переважно в розчиннику, такому як диметилформамід, і необов'язково в присутності третинної органічної основи, такої як триетиламін, при температурі від 0 до 50°С, переважно при кімнатній температурі. При проведенні описаних вище реакцій присутні за певних умов реакційноздатні групи, такі як карбокси-, гідрокси-, аміно-, алкіламіно- або іміногрупи, можна захищати на період здійснення реакції звичайними захисними групами і знову відщеплювати їх після завершення реакції. Як приклад захисної групи для карбоксигрупи можна назвати триметилсилільну, метальну, етильну, трет-бутильну, бензильну або тетрагідропіранільну групу, як приклад захисної групи для гідрокси-, аміно-, алкіламіно- або іміногрупи можна назвати ацетильну, трифторацетильну, бензоїльну, етоксикарбонільну, трет-бутоксикарбонільну, бензилоксикарбонільну, бензильну, метоксибензильну або 2,4-диметоксибензильну групу, а для аміногрупи - додатково фталільну груп у. За необхідності наступне відщеплення використовуваної захисної групи можна здійснювати, наприклад, гідролітичним шляхом у водному розчиннику, наприклад у воді, ізопропанолі/воді, тетрагідрофурані/воді або діоксані/воді, у присутності кислоти, такої як трифтороцтова кислота, соляна кислота або сірчана кислота, або в присутності гідроксиду лужного металу, такого як гідроксид літію, гідроксид або натрію гідроксид калію, при температурі від 0 до 100°С, переважно від 10 до 50°С. Однак відщеплення бензильної, метоксибензильної або бензилоксикарбонільної групи здійснюють, наприклад, шляхом гідрогенолізу, зокрема під дією водню в присутності каталізатора, такого як паладій на вугіллі, у розчиннику, такому як метанол, етанол, етилацетат, диметилформамід, диметилформамід/ацетон або льодяна оцтова кислота, необов'язково з додаванням кислоти, такої як соляна кислота або льодяна оцтова кислота, при температурі від 0 до 50°С, але переважно при кімнатній температурі, і при тиску водню від 1 до 7бар, більш переважно від 3 до 5бар. Метоксибензильну гр упу можна відщеплювати також у присутності окисника, такого як амонійнітрат церію(ІV), у розчиннику, такому як метиленхлорид, ацетонітрил або ацетонітрил/вода, при температурі від 0 до 50°С, переважно, однак, при кімнатній температурі. 20 2,4-диметоксибензильну групу переважно, однак, відщеплювати у трифтороцтовій кислоті в присутності анізолу. трет-Бутипьну або трет-бутилоксикарбонільну груп у переважно відщеплювати обробкою кислотою, такою як трифтороцтова кислота або соляна кислота, необов'язково з використанням розчинника, такого як метиленхлорид, діоксан, етилацетат або простий ефір. Фталільну групу переважно відщеплювати у присутності гідразину або первинного аміну, такого як метиламін, етиламін або н-бутиламін, у розчиннику, такому як метанол, етанол, ізопропанол, толуол/вода або діоксан, при температурі від 20 до 50°С. Крім того, отримані хіральні сполуки загальної формули І можна розділяти на їх енантіомери і/або діастереомери. Так, наприклад, отримані сполуки загальної формули І, які утворюються у вигляді рацематів, можна розділяти за відомими методами [див. Allinger N.L. і Eliel E.L., "Topics in Stereochemistry", т.6, вид-во Wiley Interscience, 1971] на їх оптичні антиподи, а сполуки загальної формули І принаймні з 2 асиметричними атомами вуглецю можна розділяти на основі відмінностей їх фізико-хімічних властивостей за відомими методами, наприклад хроматографією і/або фракціонованою кристалізацією, на їх діастереомери, які при їх утворенні в рацемічній формі в наступному можна розділяти, як це описано вище, на енантіомери. Розділення на енантіомери переважно здійснювати шляхом колонкового розділення на хіральних фазах або шля хом перекристалізації з оптично активного розчинника або взаємодією з оптично активною речовиною, яка утворює з рацемічною сполукою солі або похідні, такі як складні ефіри або аміди, насамперед з кислотами і їх активованими похідними або спиртами, і розділенням отриманої в результаті суміші діастереомерних солей або похідних, наприклад на основі відмінностей у їх розчинності, при цьому з чистих діастереомерних солей або похідних можна вивільняти вільні антиподи впливом придатного для цієї мети засобу. Як приклад оптично активних кислот, які найбільш часто використовуються для цього, можна назвати D- і L-форми винної кислоти, дибензоїлвинної кислоти, ди-о-толілвинної кислоти, яблучної кислоти, мигдалевої кислоти, камфорсульфонової кислоти, глутамінової кислоти, N-ацетилглутамінової кислоти, аспарагінової кислоти, N-ацетиласпарагінової кислоти або хінної кислоти. Прикладом оптично активного спирту служить (+)- або (-)-ментол, а як приклад оптично активного ацильного фрагмента в амідах можна назвати (+)- або (-)- ментилоксикарбонільний залишок. Крім цього отримані сполуки формули І можна перетворювати в їх солі, насамперед у їх придатні для фармацевтичного застосування фізіологічно сумісні солі з неорганічними або органічними кислотами. Як приклад придатних для цієї мети кислот можна назвати соляну кислоту, бромистоводневу кислоту, сірчану кислоту, фосфорну кислоту, фумарову кислоту, янтарну кислоту, молочну кис 21 79625 лоту, лимонну кислоту, винну кислоту, малеїнову кислоту, метансульфонову кислоту, етансульфонову кислоту, пара-толуолсульфонову кислоту, фенілсульфонову кислоту або L-(+)-мигдалеву кислоту. Крім того, отримані таким шляхом нові сполуки формули І, якщо вони містять карбоксигрупу, у наступному при необхідності можна переводити в їх солі з неорганічними або органічними основами, насамперед у їх придатні для фармацевтичного застосування фізіологічно прийнятні солі. Як приклад придатних для цієї мети основ можна назвати гідроксид натрію, гідроксид калію, циклогексиламін, етаноламін, діетаноламін і триетаноламін. Сполуки загальної формули І, які містять дві або більше кислотні або основні групи, можуть бути також представлені у вигляді солей із двома або більше неорганічними або органічними основами або кислотами (у вигляді так званих подвійних солей і т.д.). Використовувані як вихідні продукти сполуки загальних формул V-XI частково відомі з літератури, або їх одержують за відомими з літератури методам або їх можна одержувати за методами, описаними вище й у наступних прикладах. Так, наприклад, сполуки загальної формули IX описані в [заявці DE 19844003]. Як уже зазначалося вище, нові сполуки загальної формули І мають цінні фармакологічні властивості, насамперед інгібуючу дію на різні кінази, головним чином на рецепторні тирозинкінази, такі як VEGFR1, VEGFR2, VEGFR3, PDGFRa, PDGFRb, FGFR1, FGFR3, EGFR, HER2, c-Kit, IGF1R, HGFR і Flt-3, a також на проліферацію культивованих клітин людини, насамперед ендотеліальних клітин, наприклад при ангіогенезі, і на проліферацію інших клітин, насамперед пухлинних клітин. Біологічні властивості нових сполук досліджували стандартним методом описаним нижче шляхом. Ендотеліальні клітини пуповини людини (HUVEC) культивували в середовищі IMDM (фірма Gibco BRL), доповненим 10% фетальною телячою сироватки (ФТС) (фірма Sigma), 50мкМ bмеркаптоетанолом (фірма Fluka), стандартними антибіотиками, фактором росту ендотеліальних клітин у концентрації 15мкг/мл (ECGS, фірма Collaborative Biomedical Products) і гепарином у концентрації 100мкг/мл (фірма Sigma), у покритих желатином культуральних чашках (0,2% желатину, фірма Sigma) при температурі 37°С і 5%-ному вмісті СО2 у насиченій водяною парою атмосфері. Для дослідження інгібувальної активності запропонованих у винаході сполук клітини протягом 16год витримували "на голодному пайку", тобто в культуральному середовищу без факторів росту (ECGS+гепаринів). Далі клітини відокремлювали від культуральних чашок за допомогою трипсину/ЕДТК і однократно промивали в середовищі, яке містить сироватку. Після цього клітини висівали на планшети в кількості 2,5´103 клітин на лунку. Проліферацію клітин стимулювали за допомогою VEGF 165 (васкулярний ендотеліальний фактор росту ("vascular endothelial growth factor"), H. 22 Weich, GBF Braunschweig) у концентрації 5нг/мл і гепарином у концентрації 10мкг/мл. По 6 лунок кожного планшета використовували як контроль, не стимулюючи клітини, які знаходяться в них. Запропоновані у винаході сполуки розчиняли в 100%-ному диметилсульфоксиді й у різних розведеннях у трьох повторах додавали в культури клітин, при цьому максимальна концентрація диметилсульфоксиду складала 0,3%. Клітини інкубували протягом 76год при 37°С, після чого для виявлення синтезу ДНК протягом 3 наступних 16год додавали Н-тимідин (0,1мкКі/лунку, фірма Amersham). Потім радіоактивно мічені клітини іммобілізували на фільтрувальних полотнах і за допомогою лічильника bвипромінювання визначали зв'язану (вбудовану) радіоактивність. Для визначення інгібуючої активності запропонованих у винаході сполук отримане для не стимульованих клітин середнє значення віднімали із середнього значення, отриманого для стимульованих фактором клітин (у присутності або за відсутності запропонованих у винаході сполук). Відносну проліферацію клітин розраховували в процентному відношенні до контролю (HUVECклітини без інгібітора) і визначали концентрацію діючої речовини, при якій досягається 50%-не інгібування проліферації клітин (ІС50). Значення ІС50 У запропонованих у винаході сполук загальної формули І становить від 50мкМ до 1нМ. Сполуки загальної формули І завдяки їх інгібуючій дії на проліферацію клітин, насамперед ендотеліальних і пухлинних клітин, придатні для лікування захворювань, при яких певну роль відіграє проліферація клітин, насамперед ендотеліальних клітин. Так, наприклад, проліферація ендотеліальних клітин і зв'язана з нею утворення нових судин є вирішальними факторами при прогресуванні пухлин [Folkman J. і ін., Nature 339, 1989, стор. 58-61; Hanahan D. і Folkman J, Cell 86, 1996, стор.353365]. Крім того, проліферація ендотеліальних клітин має особливе значення і при гемангіомах, при метастазуванні, при ревматичному артриті, псоріазі і при утворенні нових очних судин [Folkman J., Nature Med. 1, 1995, стор.27-31; Carmeliet P. і Rakeh J., Nature 407, 2000, стор.249-257]. Терапевтична ефективність інгібіторів проліферації ендотеліальних клітин була підтверджена при моделюванні на тварин, наприклад, [O'Reilly й ін., а також Parangi і ін. (O'Reilly M.S. і ін., Cell 88, 1997, стор.277-285; Parangi S. і ін., Ргос. Natl. Acad. Sci. USA 93, 1996, стор. 2002-2007)]. Відповідно до цього сполуки загальної формули І, їх таутомери, їх стереоізомери або їх фізіологічно прийнятні солі придатні, наприклад, для лікування пухлин (зокрема плоскоклітинного раку, астроцитоми, саркоми Капоші, гліобластоми, раку легені, раку сечового міхура, раку потиличної і шийної ділянок, раку стравоходу, меланоми, раку яєчника, раку передміхурової залози, раку молочної залози, дрібноклітинного раку легені, гліоми, раку товстої кишки, раку підшлункової залози, раку сечостатевої системи і раку шлунково-кишкового тракту, а також ракових захворювань крові (таких 23 79625 як множинна мієлома і гострий мієлоїдний лейкоз), псоріазу, артриту (наприклад ревматоїдного артриту), гемангіоми, ангіофіброми, очних захворювань (наприклад діабетичної ретинопатії), неоваскулярної глаукоми, захворювань нирок (наприклад гломерулонефриту), діабетичної нефропатії, злоякісного нефросклерозу, синдрому тромботичної микроангіопатії, відторгнення трансплантата і гломерулопатії, фіброзних захворювань (наприклад цирозу печінки), зв'язаних із проліферацією клітин мезангія захворювань, артеріосклерозу, уражень нервової тканини і для пригнічення повторної оклюзії судин після лікування з використанням балонного катетера, при протезуванні судин або після застосування, відповідно введення механічних пристосувань для підтримання прохідності судин (наприклад стентів) або інших захворювань, при яких певну роль відіграють проліферація клітин або ангіогенез. Запропоновані у винаході сполуки завдяки їх біологічним властивостям можуть застосовуватися індивідуально або в сполученні з іншими фармакологічно активними сполуками, наприклад, для терапевтичного лікування пухлин при монотерапії 24 або в сполученні з іншими протипухлинними лікувальними засобами, наприклад у сполученні з інгібіторами топоізомерази (наприклад етопозидом), з антимітотичними засобами (наприклад вінбластином, таксолом), із сполуками, які взаємодіють з нуклеїновими кислотами (наприклад цисплатином, циклофосфамідом, адріаміцином), з антагоністами гормонів (наприклад тамоксифеном), із стероїдами та їх аналогами (наприклад дексаметазоном), з інгібіторами метаболічних процесів (наприклад 5-FU і т.д.), з цитокінами (наприклад інтерферонами), з інгібіторами кіназ (наприклад інгібіторами EGFR-кінази, такими як іресса, Gleevec), із інгібіторами рецепторної тирозинкінази, які мають алостеричну дію, з антитілами (наприклад герцептином), з інгібіторами СОХ-2, або ж у сполученні з променевою терапією і т.д. У подібних сполученнях діючі речовини можна вводити або одночасно, або послідовно, відповідно використовувати діючі речовини в сполученні з немедикаментознами типами терапії одночасно або послідовно. Нижче винахід проілюстрований на прикладах. 25 79625 26 27 79625 28 29 79625 30 У наступних прикладах використовуються наступні скорочення: ГОБТ 1-гідрокси-1Н-бензотриазол ТБТУ тетрафторборат О-бензотриазол-1-ілN,N,N',N'-тетраметилуронію Одержання вихідних сполук Приклад І Диметиловий ефір 2-(4-фтор-2нітрофеніл)малонової кислоти 31 79625 До розчину 188мл диметилового ефіру малонової кислоти в 970мл N-метилпіролідону при охолодженні льодом додають 185г трет-бутилату калію і потім суміш перемішують протягом 2год. До утвореної густої суспензії протягом 30хв по краплях додають 150мл 2,5-дифторнітробензолу і потім перемішують протягом 6год при 85°С. Після цього суміш зливають у 4л суміші води з льодом і 250мл концентрованої соляної кислоти й екстрагують 2л етилацетату. Органічну фазу сушать над сульфатом натрію і концентрують. Маслянистий залишок двічі екстрагують шляхом розмішування з водою і потім розчиняють у 600мл етилацетату. Отриманий розчин сушать над сульфатом натрію і концентрують досуха. Викристалізований сирий продукт перекристалізовують з 600мл суміші етилацетат/гексан у співвідношенні 2:8 і сушать. Вихід: 222г (59% від теорії). Значення Rf: 0,40 (силікагель, циклогексан/етилацетат у співвідношенні 5:1). C11H10FNO 6. Мас-спектр: m/z = 270 [М-Н]-. Аналогічно до прикладу І одержують наступні сполуки: (1.1) діетиловий ефір 2-(4-бром-2нітрофеніл)малонової кислоти: вказану сполуку одержують з 2,5дибромнітробензолу і діетилового ефіру малонової кислоти, значення Rf: 0,40 (силікагель, петролейний ефір/етилацетат у співвідношенні 5:1), C13H14BrNO 6, мас-спектр: m/z = 359/361 [М]+; (1.2) диметиловий ефір 2-(4-ціано-2нітрофеніл)малонової кислоти: вказану сполуку одержують з 4-хлор-3нітробензонітрилу і диметилового ефіру малонової кислоти, значення Rf: 0,50 (силікагель, метиленхлорид/метанол у співвідношенні 50:1), C12H10N2 O6, мас-спектр: m/z = 277 [М-Н]-. Приклад II Метиловий ефір 4-ціано-2-нітрофенілоцтової кислоти 14,2г диметилового ефіру 2-(4-ціано-2нітрофеніл)малонової кислоти (едукт I.2) розчиняють у 200мл диметилсульфоксиду і додають 4,5г хлориду літію і 1,0мл води. Потім розчин перемішують протягом 3,5год при 100°С, після чого змішують з 300 мл суміші води з льодом і залишають стояти на 12год. Осад, що випав, відокремлюють вакуум-фільтрацією, розчиняють у метиленхлориді і промивають водою. Органічну фазу сушать над сульфатом натрію, упарюють на роторному випарнику і сушать. Вихід: 7,7г (68% від теорії). Значення Rf: 0,40 (силікагель, метиленхлорид/метанол у співвідношенні 50:1). C10H8N2O 4. Мас-спектр: m/z = 219 [М-Н]-. Приклад III 4-фтор-2-нітрофенілоцтова кислота 50,0г диметилового ефіру 2-(4-фтор-2нітрофеніл)малонової кислоти (едукт І) протягом 32 20год перемішують при 100°С у 400мл 6-молярної соляної кислоти, після чого змішують з 400мл води і охолоджують до 0°С. Осад, що випав, відокремлюють вакуум-фільтрацією, промивають водою і 100мл петролейного ефіру і сушать. Вихід: 34,5г (94% від теорії). Значення Rf: 0,30 (силікагель, циклогексан/етилацетат у співвідношенні 5:2). C8H6FNO4. Мас-спектр: m/z = 154 [М-СОО-Н]-. Приклад IV 6-фтор-2-індолінон 119г 4-фтор-2-нітрофенілоцтової кислоти (едукт III) гідрують у 600мл оцтової кислоти з додаванням 20г паладію на активованому вугіллі (10%-ного) при тиску водню 50фунтів/кв.дюйм. Після цього каталізатор відокремлюють вакуумфільтрацією і відганяють розчинник. Сирий продукт екстрагують шляхом розмішування з 500мл петролейного ефіру, відокремлюють вакуумфільтрацією, промивають водою і сушать. Вихід: 82,5г (91% від теорії). Значення Rf: 0,30 (силікагель, петролейний ефір/етилацетат у співвідношенні 1:1). C8H6FNO. Мас-спектр: m/z =150 [М-Н]-. Аналогічно до прикладу IV одержують наступні сполуки: (IV.1) 6-бром-2-індолінон: вказану сполуку одержують з діетилового ефіру 2-(4-бром-2-нітрофеніл)малонової кислоти (едукт 1.1) у присутності нікелю Ренея як каталізатора гідрування, значення Rf: 0,45 (силікагель, петролейний ефір/етилацетат у співвідношенні 1:1), C8H6BrNO, мас-спектр: m/z = 210/212 [М-Н]-; (IV.2) 6-ціано-2-індолінон: вказану сполуку одержують з метилового ефіру 4-піано-2-нітрофенілоцтової кислоти (едукт II) у присутності паладію на карбонаті кальцію як каталізатора гідрування, значення Rf: 0,45 (силікагель, метиленхлорид/метанол у співвідношенні 9:1), C9H6N2O, мас-спектр: m/z =157 [М-Н]-. Приклад V 1-ацетил-6-фтор-2-індолінон 82,5г 6-фтор-2-індолінону (едукт IV) протягом 3год перемішують при 130°С у 180мл оцтового ангідриду. Після охолодження до кімнатної температури осад відокремлюють вакуум-фільтрацією, промивають 100мл петролейного ефіру і сушать. Вихід: 64,8г (61% від теорії). Значення Rf: 0,75 (силікагель, петролейний ефір/етилацетат у співвідношенні 1:1). C10H8FNO2 . Мас-спектр: m/z =192 [М-Н]-. Аналогічно до прикладу V одержують наступні сполуки: (V.1) 1 -ацетил-6-хлор-2-індолінон: вказану сполуку одержують з 6-хлор-2індолінону й оцтового ангідриду, значення Rf: 0,55 (силікагель, петролейний ефір/етилацетат у співвідношенні 2:3), 33 79625 С11Н10СINO 6, мас-спектр: m/z = 208/210 [М-Н]-; (V.2) 1-ацетил-6-бром-2-індолінон: вказану сполуку одержують з 6-бром-2індолінону (едукт IV. 1) і оцтового ангідриду, значення Rf: 0,60 (силікагель, петролейний ефір/етилацетат у співвідношенні 2:1), C10H8BrNO2, мас-спектр: m/z = 253/255 [М]+; (V.3) 1-ацетил-6-ціано-2-індолінон: вказану сполуку одержують з 6-ціано-2індолінону (едукт IV.2) і оцтово го ангідриду, значення Rf: 0,60 (силікагель, метиленхлорид/метанол у співвідношенні 50:1), C11H8N2O 2, мас-спектр: m/z =199 [М-Н]-. Приклад VI 1-ацетил-3-[1-гідрокси-1-[3йодфеніл)метилен]-6-хлор-2-індолінон 10,5г 1-ацетил-6-хлор-2-індолінону (едукт V.1), 13,6г 3-йодбензойної кислоти і 17,7г ТБТУ додають до 100мл диметилформаміду, після чого додають 35мл триетиламіну і суміш перемішують протягом 12год при кімнатній температурі. Після закінчення цього проміжку часу відганяють розчинник, залишок змішують з водою, піддають вакуумфільтрації, промивають невеликою кількістю води, метанолу і простого ефіру і сушать у вакуумі при 100°С. Вихід: 12,9г (59% від теорії). Значення Rf: 0,80 (силікагель, метиленхлорид/метанол у співвідношенні 9:1). С17Н1СIINО3 . Мас-спектр: m/z = 438/440 [М-Н]-. Аналогічно до прикладу VI одержують наступні сполуки: (VI.1)1-ацетил-3-[1-гідрокси-1-(4метоксикарбонілметилфеніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і метилового ефіру (4карбоксифеніл)оцтової кислоти [метод одержання якого описаний у Tetrahedron, 53, 1997, стор.73357340]; (VI.2) 1-ацетил-3-[1-гідрокси-1-(4хлорфеніл)метилен]-6-хлор-2-індолінон: вказану сполуку одержують з 1-ацетил-6-хлор2-індолінону (едукт V.1) і 4-хлорбензойної кислоти; (VI.3) 1-ацетил-3-[1-гідрокси-1-(3,4диметоксифеніл)метилен]-6-хлор-2-індолінон: вказану сполуку одержують з 1-ацетил-6-хлор2-індолінону (едукт V.1) і 3,4-диметоксибензойної кислоти; (VI.4) 1-ацетил-3-[1-гідрокси-1-(3,4диметоксифеніл)метилен]-6-ціано-2-індолінон: вказану сполуку одержують з 1-ацетил-6ціано-2-індолінону (едукт V.3) і 3,4диметоксибензойної кислоти; (VI.5) 1-ацетил-3-[1-гідрокси-1-(3фтор феніл)метилен]-6-фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 3-фторбензойної кислоти; 34 (VI.6) 1-ацетил-3-[1-гідрокси-1-(4-(2ацетиламіноетил)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 4-(2ацетиламіноетил)бензойної кислоти [метод одержання якої описаний у J. Am. Chem. Soc, 65, 1943, с.2377]; (VI.7) 1-ацетил-3-[1-гідрокси-1-(3метоксикарбонілметилфеніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і -метилового ефіру (3карбоксифеніл)оцтової кислоти [метод одержання якого аналогічний до описаного в Tetrahedron, 53, 1997, стор.7335-7340]; (VI.8) 1-ацетил-3-[1-гідрокси-1-(3-(N-третбутоксикарбоніламінометил)феніл)метилен]-6фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 3-(N-третбутоксикарбоніламінометил)бензойної кислоти [метод одержання якої описаний у Tetrahedron, 53, 1997, стор.7335-7340]; (VI.9) 1-ацетил-3-[1-гідрокси-1-(3ціанометилфеніл)метилен]-6-фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і (3карбоксифеніл)ацетонітрилу [метод одержання якого описаний у J. Prakt. Chem., 340, 1998, стор.367-374]; (VI.10) 1-ацетил-3-[1-гідрокси-1-(4-(N-третбутоксикарбоніламінометил)феніл)метилен]-6фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 4-(N-третбутоксикарбоніламінометил)бензойної кислоти [метод одержання якої описаний у Bioorg. Med. Chem. Lett., 10, 2000, стор.553-557]; (VI.11) 1-ацетил-3-[1-гідрокси-1-(4йодфеніл)метилен]-6-фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 4-йодбензойної кислоти; (VI.12) 1-ацетил-3-[1-гідрокси-1-(4йодфеніл)метилен]-6-хлор-2-індолінон: вказану сполуку одержують з 1-ацетил-6-хлор2-індолінону (едукт V. 1) і 4-йодбензойної кислоти; (VI.13) 1-ацетил-3-[1-гідрокси-1-(3йодфеніл)метилен]-6-фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 3-йодбензойної кислоти; (VI.14) 1-ацетил-3-[1-гідрокси-1-(4-(2метоксикарбонілетил)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 4-(2метоксикарбонілетил)бензойної кислоти [метод одержання якої описаний у Tetrahedron, 53, 1997, стор.7335-7340]; (VI.15) 1-ацетил-3-[1-гідрокси-1-(3-(2метоксикарбонілетил)феніл)метилен]-6-фтор-2індолінон: 35 79625 вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 3-(2метоксикарбонілетил)бензойної кислоти [метод одержання якої аналогічний до описаного в Tetrahedron, 53, 1997, стор.7335-7340]; (VI.16) 1-ацетил-3-[1-гідрокси-1-(3-(N-третбутоксикарбоніл-2-аміноетил)феніл)метилен]-6фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 3-(N-тpетбутоксикарбоніл-2-аміноетил)бензойної кислоти [метод одержання якої описаний у Bioorg. Med. Chem. Lett., 10, 2000, стор.553-557]; (VI.17) 1-ацетил-3-[1-гідрокси-1-(4-(N-третбутоксикарбоніл-2-аміноетил)феніл)метилен]-6фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 4-(N-третбутоксикарбоніл-2-аміноетил)бензойної кислоти [метод одержання якої аналогічний до описаного в Bioorg. Med. Chem. Lett. 10, 2000, стор.553-557]; (VI.18) 1-ацетил-3-[1-гідрокси-1-(4ціанофеніл)метилен]-6-хлор-2-індолінон: вказану сполуку одержують з 1-ацетил-6-хлор2-індолінону (едукт V. 1) і 4-ціанобензойної кислоти; (VI.19) 1-ацетил-3-[1-гідрокси-1-(3ацетиламінометилфеніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 3ацетиламінометилбензойної кислоти [отриманої згідно із J. Med. Chem., 40, 1997, стор.4030-4052]; (VI.20) 1-ацетил-3-[1-гідрокси-1 -(3-(2етоксикарбонілетил)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 3-(2етоксикарбонілетил)бензойної кислоти [метод одержання якої аналогічний до описаного в Tetrahedron, 53, 1997, сс.7335-7340]; (VI.21) 1-ацетил-3-[1-гідрокси-1-(4-(2метоксикарбонілетил)феніл)метилен]-6-хлор-2індолінон: вказану сполуку одержують з 1-ацетил-6-хлор2-індолінону (едукт V.1) і 4-(2метоксикарбонілетил)бензойної кислоти [метод одержання якої аналогічний до описаного в Tetrahedron, 53, 1997, стор.7335-7340]; (VI.22) 1-ацетил-3-[1-гідрокси-1-(4-(2етоксикарбонілетил)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 4-(2етоксикарбонілетил)бензойної кислоти [метод одержання якої аналогічний до описаного в Tetrahedron, 53, 1997, стор.7335-7340]; (VI.23) 1-ацетил-3-[1-гідрокси-1-(3метоксикарбонілметилоксифеніл)метилен]-6фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 3метоксикарбонілметилоксибензойної кислоти [метод одержання якої описаний у Tetrahedron Letters, 39, 1998, стор.8563-8566]; 36 (VI.24) 1-ацетил-3-[1-гідрокси-1-(4метоксикарбонілметилоксифеніл)метилен]-6фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 4метоксикарбонілметилоксибензойної кислоти [метод одержання якої аналогічний до описаного в Tetrahedron Letters, 39, 1998, стор.8563-8566]; (VI.25) 1-ацетил-3-[1-гідрокси-1-(3-(2етоксикарбонілетилокси)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 3-(2етоксикарбонілетилокси)бензойної кислоти [метод одержання якої описаний у WO 96/20173, с.60]; (VI.26) 1-ацетил-3-[1-гідрокси-1-(4-(2етоксикарбонілетилокси)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-6фтор-2-індолінону (едукт V) і 4-(2етоксикарбонілетилокси)бензойної кислоти [метод одержання якої описаний у WO 96/20173, с.58]; (VI.27) 1-ацетил-3-[1-гідрокси-1-(4-(2метоксикарбонілетил)феніл)метилен]-6-бром-2індолінон: вказану сполуку одержують з 1-ацетил-6-бром2-індолінону (едукт V.2) і 4-(2метоксикарбонілетил)бензойної кислоти [метод одержання якої аналогічний до описаного в Tetrahedron, 53, 1997, стор.7335-7340]. Приклад VII 1-ацетил-3-[1-метокси-1-(3йодфеніл)метилен]-6-хлор-2-індолінон Розчин 3,52г 1-ацетил-3-[1-гідрокси-1-(3йодфеніл)метилен]-6-хлор-2-індолінону (едукт VI) і 2,72мл етилдіізопропіламіну в 80мл дихлорметану порціями змішують з 2,36г тетрафторборату триметилоксонію і перемішують протягом години при кімнатній температурі. Після цього знову додають 1,4мл етилдіізопропіламіну і 1,2г тетрафторборату триметилоксонію і перемішують ще протягом наступних дво х годин при кімнатній температурі. Потім екстрагують водою, органічну фазу сушать над сульфатом магнію і концентрують досуха. Залишок перекристалізовують із простого ефіру і сушать у вакуумі при 80°С. Вихід: 2,40г (66% від теорії). Значення Rf: 0,60 (силікагель, петролейний ефір/дихлорметан/етилацетат у співвідношенні 5:4:1). C18H13CIINO 3. Мас-спектр: m/z = 438/440 [М-Н]-. tпл 185-187°С. Аналогічно до прикладу VII одержують наступні сполуки: (VII.1) 1-ацетил-3-[1-метокси-1-(4метоксикарбонілметилфеніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4метоксикарбонілметилфеніл)метилен]-6-фтор-2індолінону (едукт VI.1); (VII.2) 1-ацетил-3-[1-метокси-1-(4хлорфеніл)метилен]-6-хлор-2-індолінон: 37 79625 вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4-хлорфеніл)метилен]-6-хлор-2індолінону (едукт VI.2); (VII.3) 1-ацетил-3-[1-метокси-1-(3,4диметоксифеніл)метилен]-6-хлор-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3,4-диметоксифеніл)метилен]-6-хлор-2індолінону (едукт VI.3); (VII.4) 1-ацетил-3-[1-метокси-1-(3,4диметоксифеніл)метилен]-6-ціано-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3,4-диметоксифеніл)метилен]-6-ціано2-індолінону (едукт VI.4); (VII.5) 1-ацетил-3-[1-метокси-1-(3фтор феніл)метилен]-6-фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3-фторфеніл)метилен]-6-фтор-2індолінону (едукт VI.5); (VII.6) 1-ацетил-3-[1-метокси-1-(4-(2ацетиламіноетил)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4-(2-ацетиламіноетил)феніл)метилен]6-фтор-2-індолінону (едукт VI.6); (VII.7) 1-ацетил-3-[1-метокси-1-(3 метоксикарбонілметилфеніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3метоксикарбонілметилфеніл)метилен]-6-фтор-2індолінону (едукт VI.7); (VII.8) 1-ацетил-3-[1-метокси-1-(3-(N-третбутоксикарбоніламінометил)феніл)метилен]-6фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3-(N-третбутоксикарбоніламінометил)феніл)метилен]-6фтор-2-індолінону (едукт VI.8); (VII.9) 1-ацетил-3-[1-метокси-1-(3ціанометилфеніл)метилен]-6-фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3-ціанометилфеніл)метилен]-6-фтор-2індолінону (едукт VI.9); (VII.10) 1-ацетил-3-[1-метокси-1-(4-(N-третбутоксикарбоніламінометил)феніл)метилен]-6фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4-(N-третбутоксикарбоніламінометил)феніл)метилен]-6фтор-2-індолінону (едукт VI.10); (VII.11) 1-ацетил-3-[1-метокси-1-(4йодфеніл)метилен]-6-фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4-йодфеніл)метилен]-6-фтор-2індолінону (едукт VI.11); (VII.12) 1-ацетил-3-[1-метокси-1-(4йодфеніл)метилен]-6-хлор-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4-йодфеніл)метилен]-6-хлор-2індолінону (едукт VI.12); (VII.13) 1-ацетил-3-[1-метокси-1-(3йодфеніл)метилен]-6-фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3-йодфеніл)метилен]-6-фтор-2індолінону (едукт VI.13); 38 (VII.14) 1-ацетил-3-[1-метокси-1-(3-(2метоксикарбонілетил)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3-(2метоксикарбонілетил)феніл)метилен]-6-фтор-2індолінону (едукт VI.14); (VII.15) 1-ацетил-3-[1-метокси-1-(4-(2метоксикарбонілетил)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4-(2метоксикарбонілетил)феніл)метилен]-6-фтор-2індолінону (едукт VI.15); (VII.16) 1-ацетил-3-[1-метокси-1-(4-(N-третбутоксикарбоніл-2-аміноетил)феніл)метилен]-6фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4-(N-трет-бутоксикарбоніл-2аміноетил)феніл)метилен]-6-фтор-2-індолінону (едукт VI.17); (VII.17) 1-ацетил-3-[1-метокси-1-(3-(N-третбутоксикарбоніл-2-аміноетил)феніл)метилен]-6фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3-(N-трет-бутоксикарбоніл-2аміноетил)феніл)метилен]-6-фтор-2-індолінону (едукт VI.16); (VII.18) 1-ацетил-3-[1-метокси-1-(3ацетиламінометилфеніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3-ацетиламінометилфеніл)метилен]-6фтор-2-індолінону (едукт VI.19); (VII.19) 1-ацетил-3-[1-метокси-1-(3-(2етоксикарбонілетил)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3-(2етоксикарбонілетил)феніл)метилен]-6-фтор-2індолінону (едукт VI.20); (VII.20) 1-ацетил-3-[1-метокси-1-(4-(2метоксикарбонілетил)феніл)метилен]-6-хлор-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4-(2метоксикарбонілетил)феніл)метилен]-6-хлор-2індолінону (едукт VI.21); (VII.21) 1-ацетил-3-[1-метокси-1-(4-(2етоксикарбонілетил)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4-(2етоксикарбонілетил)феніл)метилен]-6-фтор-2шдолінону (едукт VI.22); (VII.22) 1-ацетил-3-[1-метокси-1-(4метоксикарбонілметилоксифеніл)метилен]-6фтор-2-індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4метоксикарбонілметилоксифеніл)метилен]-6фтор-2-індолінону (едукт VI.23); (VII.23) 1-ацетил-3-[1-метокси-1-(3метоксикарбонілметилоксифеніл)метилен]-6фтор-2-індолінон: 39 79625 вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3метоксикарбонілметилоксифеніл)метилен]-6фтор-2-індолінону (едукт VI.24); (VII.24) 1-ацетил-3-[1-метокси-1-(3-(2етоксикарбонілетилокси)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(3-(2етоксикарбонілетилокси)феніл)метилен]-6-фтор-2індолінону (едукт VI.25); (VII.25) 1-ацетил-3-[1-метокси-1-(4-(2етоксикарбонілетилокси)феніл)метилен]-6-фтор-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4-(2етоксикарбонілетилокси)феніл)метилен]-6-фтор-2індолінону (едукт VI.26); (VII.26) 1-ацетил-3-[1-метокси-1-(4-(2метоксикарбонілетил)феніл)метилен]-6-бром-2індолінон: вказану сполуку одержують з 1-ацетил-3-[1гідрокси-1-(4-(2метоксикарбонілетил)феніл)метилен]-6-бром-2індолінону (едукт VI.27). Приклад VIII 1-ацетил-3-[1-хлор-1-(4-ціанофеніл)метилен]6-хлор-2-індолінон Суспензію 7,0г 1-ацетил-3-[1-хлор-1-(4ціанометил)феніл)метилен]-6-хлор-2-індолінону (едукт VI.18) і 6,39г пентахлориду фосфору в 150мл діоксану протягом 6год перемішують при 100°С. Після додаткового додавання 1,0г пентахлориду фосфору перемішують ще протягом наступних 4год при 110°С. На завершення відганяють розчинник і залишок промивають етилацетатом. Вихід: 4,5г (61% від теорії). Значення Rf: 0,70 (силікагель, метиленхлорид/метанол у співвідношенні 50:1). C18H10CI 2N2O 2. Приклад IX Методи синтезу перерахованих нижче сполук вже описані в [WO 01/27081]: (IX.1) 4-(діетиламінометил)анілін, (ІХ.2) N-(2-диметиламіноетил)-Nметилсульфоніл-n-фенілендіамін, (ІХ.3) 3-(диметиламінометил)анілін, (ІХ.4) 4-(диметиламінометил)анілін, (ІХ.5) 4-(2-диметиламіноетил)анілін, (ІХ.6) 4-[N-(2-диметиламіноетил)-Nацетиламіно]анілін, (ІХ.7) 4-[N-(3-диметиламінопропіл)-Nацетиламіно]анілін, (ІХ.8) 4-[(N-диметиламінокарбонілметил-Nметилсульфоніл)аміно]анілін, (ІХ.9) N-(4-амінофеніл)-Nметилметансульфонамід, (IX.10) N-(диметиламінометилкарбоніл)-Nметил-n-фенілендіамін, (IX.11) N-[(2-диметиламіноетил)-карбоніл]-Nметил-n-фенілендіамін, (IX.12) 4-(N-тpетбутоксикарбоніламінометил)анілін, 40 (IX.13) 4-(N-етил-N-тpетбутоксикарбоніламінометил)анілін, (IX.14) 4-[(4-метилпіперазин-1-іл)метил] анілін, (IX.15) 4-(імідазол-1-ілметил)анілін, (IX.16) 4-(1-метилімідазол-2-іл)анілін, (IX.17) 4-[(N-(2-диметиламіноетил)-Nметиламіно)метил]анілін, (IX.18) 4-(N-метил-N-третбутоксикарбоніламінометил)анілін, (IX.19) N-[(4-метилпіперазин-1іл)метилкарбоніл]-N-метил-n-фенілендіамін, (ІХ.20) 4-(4-трет-бутоксикарбонілпіперазин-1ілметил)анілін, (ІХ.21) 4-(тіоморфолін-4-ілметил)анілін, (ІХ.22) 4-(піролідин-1-ілметил)анілін, (ІХ.23) 4-(морфолін-4-ілметил)анілін, (ІХ.24) 4-(N-бензил-N-метиламінометил)анілін, (ІХ.25) 4-(N-етил-N-метиламінометил)анілін, (ІХ.26) 4-(N-(2-диметиламіноетил)-Nметиламіно]анілін, (ІХ.27) 4-[(N-пропіл-Nметиламіно)метил]анілін. Аналогічно до прикладу IX одержують наступні сполуки: (ІХ.28) 4-[N-(2-(N-бензил-N-метиламіно)етил)N-ацетиламіно]анілін, (ІХ.29) 4-аміно-N-(2-диметиламіноетил)-Nметилбензамід, (ІХ.30) 4-(4-метилпіперазин-1ілкарбоніл)анілін, (ІХ.31) 4-(2-диметиламіноетокси)анілін, (ІХ.32) N-(4-диметиламінобутилкарбоніл)-Nметил-n-фенілендіамін, (ІХ.33) N-[(3-диметиламінопропіл)карбоніл]-Nметил-n-фенілендіамін. Одержання кінцевих сполук Приклад 1.0 З-Z-[1-(4-(N-метил-Nметилсульфоніламіно)аніліно)-1-(3йодфеніл)метилен]-6-хлор-2-індолінон 0,9г 1-ацетил-3-(1-метокси-1-(3йодфеніл)метилен)-6-хлор-2-індолінону (едукт VII) і 0,5г N-метил-N-метилсульфоніл-n-фенілендіаміну (едукт ІХ.9) розчиняють у 10мл диметилформаміду і перемішують протягом 3год при 120°С. Після охолодження до реакційної суміші додають 1,5мл піперидину і перемішують ще протягом години при кімнатній температурі. Далі додають воду, осад, що випав, відокремлюють вакуум-фільтрацією, промивають його невеликою кількістю води, метанолу і простого ефіру й на завершення суша ть у вакуумі при 100°С. Вихід: 0,9г (74% від теорії). Значення Rf: 0,6 (силікагель, метиленхлорид/метанол у співвідношенні 9:1). tпл 292-294°C. С2зН19СllN3О3S. Мас-спектр: m/z = 578/580 [М-Н]-. Аналогічно до прикладу 1.0 одержують наступні сполуки загальної формули I-1: 41 79625 42 VII.11) і 1,6г 4-(диметиламінометил)аніліну (едукт ІХ.4) розчиняють у 30мл диметилформаміду і перемішують протягом 2год при 120°С. Після охолодження відганяють розчинник, а залишок розчиняють у 30мл метанолу і двічі на кінчику шпателя додають метилат натрію. Після утворення жовтого осаду його відокремлюють від розчинника вакуумфільтрацією, залишок промивають невеликою кількістю метанолу і простого ефіру й на завершення сушать у вакуумі при 100°С. Вихід: 1,9г (46% від теорії). Значення Rf: 0,3 (силікагель, метиленхлорид/метанол у співвідношенні 9:1). tпл 243-246°C. C24H21FIN3O. Мас-спектр: m/z = 514 [М+Н]+. Аналогічно до прикладу 3.0 одержують наступні сполуки загальної формули І-3а: * Системи розчинників: (А): силікагель, метиленхлорид/метанол у співвідношенні 9:1, (Б): силікагель, метиленхлорид/етанол у співвідношенні 10:1, (В): силікагель, метиленхлорид/метанол у співвідношенні 4:1. Приклад 2.0 3-Z-[1-(4-(диметиламінометил)аніліно)-1-(4ціанофеніл)метилен]-6-хлор-2-індолінон 1,07г 1-ацетил-3-[1-хлор-1-(4ціанофеніл)метилен]-6-хлор-2-індолінону (едукт VII) і 0,54г 4-(диметиламінометил)аніліну (едукт ІХ.4) розчиняють у 10мл диметилформаміду і перемішують протягом 3год при 80°С. Після охолодження до реакційної суміші додають 1мл 6н. розчину натрового щолоку і перемішують протягом 30хв при кімнатній температурі. Після цього додають воду і тричі екстрагують метиленхлоридом. Об'єднані органічні фази двічі промивають водою, сушать над сульфатом натрію, упарюють на роторному випарнику і продукт перекристалізовують з діетилового ефіру. Вихід: 0,92г (72% від теорії). Значення Rf: 0,1 (силікагель, метиленхлорид/метанол у співвідношенні 9:1). C25H21ClN4O. Мас-спектр: m/z = 427/429 [М-Н]-. Приклад 3.0 3-Z-[1-(4-(диметиламінометил)аніліно)-1-(4йодфеніл)метилен]-6-фтор-2-індолінон 3,5г 1-ацетил-3-(1-метокси-1-(4йодфеніл)метилен)-6-фтор-2-індолінону (едукт 43 79625 44 45 79625 46 47 79625 48 *Системи розчинників: (А): силікагель, метиленхлорид/метанол у співвідношенні 9:1, (Б): силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,1. *Системи розчинників: (А): силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,1, (Б): силікагель, метиленхлорид/метанол у співвідношенні 9:1, (В): силікагель, метиленхлорид/метанол/аміак у співвідношенні 8:1:0,1, (Г): силікагель, метиленхлорид/метанол/аміак у співвідношенні 10:1:0,1, (Д): силікагель, метиленхлорид/метанол/аміак у співвідношенні 5:1:0,01, (Е): силікагель, етилацетат/метанол/аміак у співвідношенні 9:1:0,1, (Ж): оксид алюмінію, метиленхлорид/метанол у співвідношенні 19:1, (З): силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,01, (И): силікагель, метиленхлорид/метанол у співвідношенні 5:1, (К): оксид алюмінію, метиленхлорид/етанол у співвідношенні 20:1, (Л): силікагель, петролейний ефір/етилацетат у співвідношенні 1:1, (М): силікагель, петролейний ефір/етилацетат у співвідношенні 1:2. Аналогічно до прикладу 3.0 одержують наступні сполуки загальної формули І-3b: Приклад 4.0 3-Z-[1-(4-(диметиламінометил)аніліно)-1-(3,4диметоксифеніл)метилен]-6-ціано-2-індолінон 130мг 1-ацетил-3-(1-метокси-1-(3,4диметоксифеніл)метилен)-6-ціано-2-індолінону (едукт VII.4) і 58мг 4-(диметиламінометил)аніліну (едукт ІХ.4) розчиняють у 5мл диметилформаміду і перемішують протягом 2год при 80°С. Після охолодження розчинник відганяють і залишок очищають на силікагелевій колонці з використанням як елюенту суміші метиленхлорид/метанол у співвідношенні 9:1. Вихід: 21мг (12% від теорії). Значення Rf: 0,35 (силікагель, метиленхлорид/метанол у співвідношенні 9:1). tпл 265°C. C27H26N4 O3. Приклад 5.0 3-Z-[1-(4-(NІ-метил-Nметилсульфоніламіно)аніліно)-1-(3-(2метоксикарбонілвініл)феніл)метилен]-6-хлор-2індолінон 580мг 3-2-[1-(4-(N-метил-Nметилсульфоніламіно)аніліно)-1-(3йодфеніл)метилен]-6-хлор-2-індолінону (едукт 1.0) і 140мл метилового ефіру акрилової кислоти розчиняють у 20мл ацетонітрилу і 11мл диметилформаміду і додають 11мг ацетату паладію(II), 2мл триетиламіну і 30мг три-орто-толілфосфіну. Розчин протягом 10год перемішують при 90°С в атмосфері азоту як захисного газу. Після охолодження фільтрують через целіт, відганяють розчинник і залишок очищають на силікагелевій колонці з використанням як елюенту суміші метиленхлорид/метанол у співвідношенні 20:1. Вихід: 450мг (84% від теорії). Значення Rf: 0,30 (силікагель, толуол/етилацетат у співвідношенні 1:1). tпл 228-232°C. C27H24CIN3 O5S. Мас-спектр: m/z = 537/539 [М]+. Аналогічно до прикладу 5.0 одержують наступні сполуки загальної формули I-5: 49 79625 50 * Системи розчинників: (А): силікагель, метиленхлорид/метанол у співвідношенні 9:1, (Б): силікагель, метиленхлорид/метанол/аміак у співвідношенні 5:1:0,01. *Системи розчинників: (А): силікагель, метиленхлорид/метанол у співвідношенні 5:1, (Б): силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,01. Приклад 6.0 3-Z-[1-[4-диметиламінометиланіліно)-1-(3-(2метоксикарбонілетил)феніл)метилен]-6-хлор-2індолінон 1,0г 3-Z-[1-(4-(диметиламінометил)аніліно)-1(3-(2-метоксикарбонілвініл)феніл)метилен]-6-хлор2-індолінону (едукт 5.1) розчиняють у 100мл метанолу і додають 200мг 10%-ного паладію на вугіллі як каталізатор. Після цього протягом 6год гідрують при кімнатній температурі і тиску водню 50фунтів/кв.дюйм. Після завершення реакції відфільтровують каталізатор, відганяють розчинник і залишок суша ть у вакуумі при 100°С. Вихід: 900мг (90% від теорії). Значення Rf: 0,40 (силікагель, метиленхлорид/метанол у співвідношенні 9:1). tпл 160°С. C28H28CIN3 O3. Мас-спектр: m/z = 490/492 [М+Н]+. Аналогічно до прикладу 6.0 одержують наступні сполуки загальної формули I-6: Приклад 7.0 3-Ζ-[1-(4-диметиламінометиланіліно)-1-(4амінометилфеніл)метилен]-6-хлор-2-індолінон 900мг 3-Z-[1-(4-диметиламінометиланіліно)-1(4-ціанофеніл)метилен]-6-хлор-2-індолінону (едукт 2.0) розчиняють у 20мл метиленхлориду, після чого додають 30мл метанольного аміаку, а потім 200мг нікелю Ренея як каталізатора. Далі гідрують протягом 2год 15хв при кімнатній температурі і тиску водню 50фунтів/кв.дюйм. Після завершення реакції відфільтровують каталізатор, відганяють розчинник і залишок промивають невеликою кількістю метанолу і діетилового ефіру. Для виділення основи залишок розчиняють у 1н. розчині натрового щолоку і чотири рази екстрагують сумішшю метиленхлорид/метанол у співвідношенні 9:1. Об'єднані органічні фази промивають водою і сушать над сульфатом натрію. Продукт промивають невеликою кількістю діетилового ефіру і сушать у вакуумі. Вихід: 680мг (75% від теорії). Значення Rf: 0,60 (силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,1). tпл 211-214°C. С25Н25СIN4 О. Мас-спектр: m/z = 433/435 [М+Н]+. Приклад 8.0 3-2-[1-(4-(NІ-((4-метилпіперазин-1іл)метилкарбоніл)-N-метиламіно)аніліно)-1-(4амінометилфеніл)метилен]-6-хлор-2-індолінон 1,39г 1-ацетил-3-Z-[1-(4-(N-((4-метилпіперазин1-іл)метилкарбоніл)-N-метиламіно)аніліно)-1-(4ціанофеніл)метилен]-6-хлор-2-індолінону розчиняють у 20мл метиленхлориду, після чого додають 30мл метанольного аміаку, а потім 200мг нікелю Ренея як каталізатора. Далі гідрують протягом 2год при кімнатній температурі і тиску водню 50фунтів/кв.дюйм. Після завершення реакції відфільтровують каталізатор, відганяють розчинник і залишок промивають невеликою кількістю метанолу і діетилового ефіру. Для виділення основи залишок розчиняють у розчині 1н. натрового щолоку і чотири рази екстрагують сумішшю метиленхлорид/метанол у співвідношенні 9:1. Об'єднані органічні фази промивають водою і сушать над сульфатом натрію. Продукт очищають на силікагелевій колонці з використанням градієнта метиленхлориду і суміші метиленхлорид/метанол/аміак у співвідношенні 8:1:0,1 як елюенту. Продукт промивають невеликою кількістю діетилового ефіру і сушать у вакуумі. Вихід: 700мг (54% від теорії). Значення Rf: 0,15 (силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,1). tпл 232-235°С. С30Н33СIN6 О2. Мас-спектр: m/z = 544/546 [М]+. 51 79625 Приклад 9.0 3-Z-[1-(4-(диметиламінометил)аніліно)-1-(3амінометилфеніл)метилен]-6-фтор-2-індолінон 2,72г 3-Z-[1-(4-(диметиламінометил)аніліно)-1(3-(N-тpетбутоксикарбоніламінометил)феніл)метилен]-6фтор-2-індолінону (едукт 3.10) розчиняють у 50мл метиленхлориду і додають 10мл трифтороцтової кислоти. Суміш перемішують протягом 3год при кімнатній температурі. Після закінчення цього проміжку часу практично цілком відганяють розчинник, залишок розчиняють у етилацетаті і двічі промивають 1н. розчином натрового щолоку. Органічну фазу сушать над сульфатом натрію, розчинник випарюють на роторному випарнику і залишок очищають на силікагелевій колонці з використанням як елюенту суміші метиленхлорид/метанол/аміак у співвідношенні 9:1:0,1. Продукт промивають невеликою кількістю діетилового ефіру і сушать у вакуумі. Вихід: 1,77г (81% від теорії). Значення Rf: 0,25 (силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,1)· tпл 168-175°C. C25H25FN 4O. Мас-спектр: m/z = 415 [М-Н]-. Аналогічно до прикладу 9.0 одержують наступні сполуки загальної формули l-9: *Системи розчинників: 52 (А): силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,1, (Б): силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,01, (В): силікагель, метиленхлорид/метанол/аміак у співвідношенні 8:2:0,2, (Г): обернена фаза RP8, метанол/розчин кухонної солі (5%-ний) у співвідношенні 3:2. Приклад 10.0 3-Z-[1-(4-диметиламінометиланіліно)-1-(3-[2карбоксіетил)феніл)метилен]-6-хлор-2-індолінон 900мг 3-2-[1-(4-диметиламінометиланіліно)-1(3-(2-метоксикарбонілетил)феніл)метилен]-6-хлор2-індолінону (едукт 6.0) розчиняють у 10мл етанолу і додають 5мл 1н. розчину натрового щолоку. Суміш перемішують протягом 5год при кімнатній температурі. Після охолодження додають 5мл 1н. соляної кислоти. Осад, що випав, відокремлюють вакуум-фільтрацією і потім промивають водою. Вихід: 830мг (95% від теорії). Значення Rf: 0,50 (обернена фаза RP8, метанол/розчин кухонної солі (5%-ний) у співвідношенні 4:1). tпл 210-215°C. C27H26CIN3 O3. Мас-спектр: m/z = 476/478 [М+Н]+. Аналогічно до прикладу 10.0 одержують наступні сполуки загальної формули І-10а: 53 79625 54 55 79625 56 *Системи розчинників: (А): обернена фаза RP8, метанол/розчин кухонної солі (5%-ний) у співвідношенні 4:1, (Б): силікагель, метиленхлорид/метанол у співвідношенні 8:2, (В): силікагель, метиленхлорид/метанол у співвідношенні 5:1, (Г): обернена фаза RP8, метанол/розчин кухонної солі (5%-ний) у співвідношенні 3:2, (Д): силікагель, метиленхлорид/метанол у співвідношенні 9:1, (Е): обернена фаза RP8, метанол/розчин кухонної солі (5%-ний) у співвідношенні 7:3, (Ж): силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,1, (З): оксид алюмінію, метиленхлорид/метанол у співвідношенні 19:1, (И): обернена фаза RP8, метанол/розчин кухонної солі (5%-ний) у співвідношенні 4:2, (К): силікагель, петролейний ефір/етилацетат у співвідношенні 1:1, (М): силікагель, метиленхлорид/метанол у співвідношенні 4:1. Аналогічно до прикладу 10.0 одержують наступні сполуки загальної формули 1-10b: * Системи розчинників: (А): силікагель, метиленхлорид/метанол у співвідношенні 5:1, (Б): силікагель, метиленхлорид/метанол у співвідношенні 9:1, (В): обернена фаза RP8, метанол/розчин кухонної солі (5%-ний) у співвідношенні 4:1. 57 79625 58 Приклад 11.0 3-Z-[1-(4-диметиламінометиланіліно)-1-(3-(2карбамоїлетил)феніл)метилен]-6-хлор-2-індолінон 480мг 3-Z-[1-(4-диметиламінометиланіліно)-1(3-(2-карбоксіетил)феніл)метилен]-6-хлор-2індолінону (едукт 10.0), 350мг ТБТУ, 150мг ГОБТ і 420мл триетиламіну розчиняють у 10 мл диметилформаміду і додають 620мг амонієвої солі Nгідроксисукциніміду. Суміш перемішують протягом 20год при кімнатній температурі. Після відгону розчинника залишок суспендують у невеликій кількості етилацетату і води, фільтрують і потім промивають водою. Далі залишок очищають на колонку з набивкою з оксиду алюмінію (активність 2-3) з використанням як елюенту суміші метиленхлорид/етанол у співвідношенні 20:1. Продукт перекристалізовують з діетилового ефіру і сушать у вакуумі при 100°С. Вихід: 370мг (78% від теорії). Значення Rf: 0,40 (оксид алюмінію, метиленхлорид/етанол у співвідношенні 20:1). tпл 222-225°C. С27Н27СIN4 О2. Мас-спектр: m/z = 475/477 [М+Н]+. Аналогічно до прикладу 11.0 одержують наступні сполуки загальної формули I-11: * Системи розчинників: (А): силікагель, метиленхлорид/метанол/аміаку співвідношенні 5:1:0,01, (Б): оксид алюмінію, метиленхлорид/етанол у співвідношенні 20:1, (В): силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,1, (Г): силікагель, метиленхлорид/метанол/аміак у співвідношенні 6:1:0,1, (Д): силікагель, метиленхлорид/метанол/аміак у співвідношенні 5:1:0,1, (Е): силікагель, метиленхлорид/метанол/аміак у співвідношенні 7:1:0,1, (Ж): силікагель, метиленхлорид/метанол у 59 79625 співвідношенні 9:1, **з метиламонійхлоридом як еквівалентом основи, ***з диметиламонійхлоридом як еквівалентом основи, ****з гідрохлоридом піперидину як еквівалентом основи. Приклад 12.0 3-Ζ-[1-(4-диметиламінометиланіліно)-1-(4ацетиламінометилфеніл)метилен]-6-хлор-2індолінон 100мг 3-2-[1-(4-диметиламінометиланіліно)-1(4-амінометилфеніл)метилен]-6-хлор-2-індолінону (едукт 7.0) розчиняють у 5мл метиленхлориду і 5мл піридину і при 0°С додають 20мкл ацетилхлориду. Суміш перемішують спочатку протягом 10хв при 0°С, а потім протягом наступних 4год при кімнатній температурі. Після цього додають ще 20мкл ацетилхлориду і суміш перемішують протягом 12год при кімнатній температурі. Після закінчення цього проміжку часу відганяють розчинник і залишок розчиняють у метиленхлориді і промивають водою. Водну фазу двічі екстрагують метиленхлоридом і об'єднані органічні фази сушать над сульфатом натрію. Після цього розчинник випарюють на роторному випарнику і залишок промивають простим ефіром. Вихід: 51мг (47% від теорії). Значення Rf: 0,30 (силікагель, силікагель, метиленхлорид/метанол/аміак у співвідношенні 9:1:0,01). tпл 219-220°С. C27H27CIN4 O2. Мас-спектр: m/z = 473/475 [М-Н]-. Аналогічно до прикладу 12.0 одержують наступні сполуки загальної формули I-12: 60
ДивитисяДодаткова інформація
Назва патенту англійськоюIndolinon derivatives substituted in the position 6
Автори англійськоюRoth Gerald Juergen, Hekkel Armin, Hilberg, Frank
Назва патенту російськоюЗамещенные в положении 6 индолиноновые производные
Автори російськоюРот Геральд Юрген, Хекель Армин, Хильберг Франк
МПК / Мітки
МПК: C07D 401/12, A61P 13/12, C07D 405/12, A61P 29/00, A61P 17/06, A61P 19/02, A61P 9/00, A61P 7/02, A61P 43/00, A61P 27/06, A61K 31/4439, C07D 209/34, A61P 35/02, A61K 31/404, A61P 3/10, C07D 403/12, C07D 409/12, A61P 37/06, A61P 9/10, A61P 27/02, A61P 35/00, A61P 1/16, A61K 31/496, A61P 25/00, A61K 31/4178
Мітки: похідні, положенні, заміщені, індолінонові
Код посилання
<a href="https://ua.patents.su/39-79625-zamishheni-v-polozhenni-6-indolinonovi-pokhidni.html" target="_blank" rel="follow" title="База патентів України">Заміщені в положенні 6 індолінонові похідні</a>
Попередній патент: Багатофракційний вібраційний сепаратор
Наступний патент: Антена крюка
Випадковий патент: Спосіб дренування запальних процесів верхнього середостіння












