Транс-каротиноїди, їх синтез, лікарська форма та застосування
Формула / Реферат
1. Фармацевтична композиція, яка містить
і) біполярну транс-каротиноїдну сіль, що має формулу:
YZ-TCRO-ZY,
де:
Y - катіон, який може бути однаковим або різним,
Z - полярна група, яка може бути однаковою або різною та яка є асоційованою з катіоном, та
TCRO - нерозгалужений транс-каротиноїдний каркас зі спряженими вуглець-вуглецевими подвійними та простими зв'язками, який має бічні групи X, де згадані бічні групи X, які можуть бути однаковими або різними, є нерозгалуженими чи розгалуженими вуглеводневими групами, які мають 10 або менше атомів вуглецю, або є галогенами,
та
іі) циклодекстрин.
2. Композиція за п. 1, яка відрізняється тим, що біполярною транс-каротиноїдною сіллю є літієва, калієва або натрієва сіль.
3. Композиція за п. 2, яка відрізняється тим, що транс-каротиноїдною сіллю є транс-кроцетинат натрію (ТКН), який має структуру
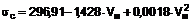 .
.
4. Композиція за п. 1, яка містить транс-кроцетинат натрію (ТКН), який має структуру
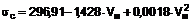 ,
,
та циклодекстрин, вибраний з групи, яку складають ![]() -циклодекстрин,
-циклодекстрин, ![]() -циклодекстрин, 2-гідроксипропіл-
-циклодекстрин, 2-гідроксипропіл-![]() -циклодекстрин, 2-гідроксипропіл-
-циклодекстрин, 2-гідроксипропіл-![]() -циклодекстрин та
-циклодекстрин та ![]() -циклодекстрин.
-циклодекстрин.
5. Композиція за п. 1, яка відрізняється тим, що біполярною транс-каротиноїдною сіллю є транс-кроцетинат натрію (ТКН), який має структуру
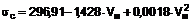 ,
,
та тим, що циклодекстрином є ![]() -циклодекстрин.
-циклодекстрин.
6. Композиція за п. 1, яка відрізняється тим, що циклодекстрином є ![]() -циклодекстрин.
-циклодекстрин.
7. Композиція за п. 1, яка відрізняється тим, що циклодекстрином є ![]() -циклодекстрин.
-циклодекстрин.
8. Композиція за п. 1, яка відрізняється тим, що циклодекстрином є 2-гідроксипропіл-![]() -циклодекстрин.
-циклодекстрин.
9. Композиція за п. 1, яка відрізняється тим, що циклодекстрином є ![]() -циклодекстрин.
-циклодекстрин.
10. Композиція за п. 1, яка відрізняється тим, що циклодекстрином є 2-гідроксипропіл-![]() -циклодекстрин.
-циклодекстрин.
11. Композиція за п. 1, яка додатково містить маніт.
12. Композиція за п. 1, яка додатково містить фізіологічний розчин.
13. Композиція за п. 1, яка додатково містить сполуку для регулювання рН.
14. Композиція за п. 13, яка відрізняється тим, що згадана сполука для регулювання рН вибрана з групи, яку складають оцтова кислота, лимонна кислота, бікарбонат або гліцин.
15. Композиція за п. 1, піддана ліофілізації.
16. Композиція за п. 1, яка відрізняється тим, що Y - однозарядний іон металу.
17. Композиція за п. 1, яка відрізняється тим, що Y - Na+, K+ або Li+.
18. Композиція за п. 1, яка відрізняється тим, що Y - органічний катіон.
19. Композиція за п. 18, яка відрізняється тим, що Y - органічна сполука, вибрана з групи, яку складають R4N+, R3S+, де R - Н або СnН2n+1, де n - 1-10.
20. Композиція за п. 1, яка відрізняється тим, що Z містить кінцевий атом вуглецю групи TCRO.
21. Композиція за п. 1, яка відрізняється тим, що Z вибраний з групи, яку складають карбоксильна (СОО-) група, СО група та гідроксильна група.
22. Композиція за п. 21, яка відрізняється тим, що згадана СО группа являє собою складноефірну, альдегідну або кетонну групу.
23. Композиція за п. 1, яка відрізняється тим, що Z вибраний з групи, яку складають сульфатна група (OSO3-), монофосфатна група (ОРО3-), (ОР(ОН)О2-), дифосфатна група та трифосфатна група.
24. Композиція за п. 1, яка відрізняється тим, що Z - складноефірна група CООR, де R - СnН2n+1.
25. Композиція за п. 1, яка відрізняється тим, що Y - Na+, Z - карбоксильна група, та бічні групи X є метильними групами.
26. Композиція за п. 1, яка відрізняється тим, що TCRO містить менше ніж 100 атомів вуглецю.
27. Композиція за п. 1, яка відрізняється тим, що TCRO є симетричним.
28. Композиція за п. 1, яка відрізняється тим, що бічними групами X є метильні групи.
29. Композиція за п. 1, яка відрізняється тим, що бічні групи X, які можуть бути однаковими або різними, є нерозгалуженими чи розгалуженими вуглеводневими групами, які мають 4 або менше атомів вуглецю.
30. Композиція за п. 1, яка відрізняється тим, що бічні групи X, які можуть бути однаковими або різними, вибрані з групи, яку складають метильні групи (СН3) та етильні групи (С2Н5).
31. Композиція за п. 1, яка відрізняється тим, що біполярною транс-каротиноїдною сіллю є літієва, калієва або натрїєва сіль кроцетину.
32. Спосіб лікування пухлини у ссавця, який включає введення в організм ссавця
і) біполярної транс-каротиноїдної солі, яка має формулу:
YZ-TCRO-ZY,
де:
Y - катіон, який може бути однаковим або різним,
Z - полярна група, яка може бути однаковою або різною та яка є асоційованою з катіоном, та
TCRO - нерозгалужений транс-каротиноїдний каркас зі спряженими вуглець-вуглецевими подвійними та простими зв'язками, який має бічні групи X, де згадані бічні групи X, які можуть бути однаковими або різними, є нерозгалуженими чи розгалуженими вуглеводневими групами, які мають 10 або менше атомів вуглецю, або є галогенами, і
іі) опромінення згаданої пухлини,
причому згадану біполярну транс-каротиноїдну сіль вводять перед, під час або після застосування згаданого опромінення.
33. Спосіб за п. 32, який відрізняється тим, що опромінення застосовують у дозі приблизно 6000-6500 сГр впродовж декількох тижнів.
34. Спосіб за п. 32, причому пухлина вибрана з групи, яка включає гліобластоми, плоскоклітинні карциноми, меланоми, лімфоми, саркоми, саркоїди, остеосаркоми, пухлини, пов'язані з раком шкіри, рак молочної залози, рак голови та шиї, гінекологічний рак, урологічний рак та рак чоловічих статевих органів, рак сечового міхура, рак передміхурової залози, рак кісток, рак ендокринних залоз, рак травного каналу, рак головних травних залоз/органів, рак ЦНС та рак легень.
35. Спосіб за п. 32, причому пухлиною є пухлина головного мозку.
36. Спосіб за п. 32, причому біполярною транс-каротиноїдною сіллю є транс-кроцетинат натрію (ТКН), який має структуру
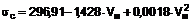 .
.
37. Спосіб за п. 36, який відрізняється тим, що ТКН вводять у дозі 0,02-2 мг/кг перед згаданим опроміненням.
38. Спосіб за п. 32, причому ссавцем є людина.
39. Спосіб за п. 36, причому ссавцем є людина, та ТКН вводять внутрішньовенно у дозі 0,02-2 мг/кг перед згаданим опроміненням.
40. Спосіб лікування раку у ссавця, який включає введення в організм ссавця
і) біполярної транс-каротиноїдної солі, яка має формулу:
YZ-TCRO-ZY,
де:
Y - катіон, який може бути однаковим або різним,
Z - полярна група, яка може бути однаковою або різною та яка є асоційованою з катіоном, та
TCRO - нерозгалужений транс-каротиноїдний каркас зі спряженими вуглець-вуглецевими подвійними та простими зв'язками, який має бічні групи X, де згадані бічні групи X, які можуть бути однаковими або різними, є нерозгалуженими чи розгалуженими вуглеводневими групами, які мають 10 або менше атомів вуглецю, або є галогенами, і
іі) хіміотерапію,
причому згадану біполярну транс-каротиноїдну сіль вводять перед, під час або після застосування згаданої хіміотерапії.
41. Спосіб за п. 40, причому рак вибраний з групи, яка включає гліобластоми, плоскоклітинні карциноми, меланоми, лімфоми, саркоми, саркоїди, остеосаркоми, рак шкіри, рак молочної залози, рак голови та шиї, гінекологічний рак, урологічний рак та рак чоловічих статевих органів, рак сечового міхура, рак передміхурової залози, рак кісток, рак ендокринних залоз, рак травного каналу, рак головних травних залоз/органів, рак ЦНС та рак легень.
42. Спосіб за п. 40, причому раком є рак головного мозку.
43. Спосіб за п. 40, причому біполярною транс-каротнноїдною сіллю є транс-кроцетинат натрію (ТКН), який має структуру
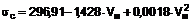 .
.
44. Спосіб за п. 43, який відрізняється тим, що ТКН вводять у дозі 0,02-2 мг/кг перед згаданою хіміотерапією.
45. Спосіб за п. 40, причому ссавцем є людина.
46. Спосіб за п. 43, причому ссавцем є людина, та ТКН вводять у дозі 0,02-2 мг/кг перед згаданою хіміотерапією.
47. Спосіб за п. 32 або п. 40, причому згадана біполярна транс-каротиноїдна сіль має форму суміші із циклодекстрином.
48. Спосіб за п. 32 або п. 40, причому Y - однозарядний іон металу.
49. Спосіб за п. 32 або п. 40, причому Y - Na+, K+ або Li+.
50. Спосіб за п. 32 або п. 40, причому Y - органічний катіон.
51. Спосіб за п. 32 або п. 40, причому Y - органічна сполука, вибрана з групи, яку складають R4N+, R3S+, де R - Н або СnН2n+1, де n - 1-10.
52. Спосіб за п. 32 або п. 40, причому Z містить кінцевий атом вуглецю групи TCRO.
53. Спосіб за п. 32 або п. 40, причому Z вибраний з групи, яку складають карбоксильна (СОО-) група, CO група та гідроксильна група.
54. Спосіб за п. 53, причому згадана CO група являє собою складноефірну, альдегідну або кетонну групу.
55. Спосіб за п. 32 або п. 40, причому Z вибраний з групи, яку складають сульфатна група (OSO3-), монофосфатна група (ОРО3-), (ОР(ОН)О2-), дифосфатна група та трифосфатна група.
56. Спосіб за п. 32 або п. 40, причому Z - складноефірна група COOR, де R - CnH2n+l.
57. Спосіб за п. 32 або п. 40, причому TCRO містить менше ніж 100 атомів вуглецю.
58. Спосіб за п. 32 або п. 40, причому TCRO є симетричним.
59. Спосіб за п. 32 або п. 40, причому бічними групами X є метильні групи.
60. Спосіб за п. 32 або п. 40, причому бічні групи X, які можуть бути однаковими або різними, є нерозгалуженими чи розгалуженими вуглеводневими групами, які мають 4 або менше атомів вуглецю.
61. Спосіб за п. 32 або п. 40, причому бічні групи X, які можуть бути однаковими або різними, вибрані з групи, яку складають метильні групи (СН3) та етильні групи (С2Н5).
Текст
1. Фармацевтична композиція, яка містить і) біполярну транс-каротиноїдну сіль, що має формулу: YZ-TCRO-ZY, де: Y - катіон, який може бути однаковим або різним, Z - полярна група, яка може бути однаковою або різною та яка є асоційованою з катіоном, та TCRO - нерозгалужений транс-каротиноїдний каркас зі спряженими вуглець-вуглецевими подвійними та простими зв'язками, який має бічні групи X, де згадані бічні групи X, які можуть бути однаковими або різними, є нерозгалуженими чи розгалуженими вуглеводневими групами, які мають 10 або менше атомів вуглецю, або є галогенами, та іі) циклодекстрин. 2. Композиція за п. 1, яка відрізняється тим, що біполярною транс-каротиноїдною сіллю є літієва, калієва або натрієва сіль. 3. Композиція за п. 2, яка відрізняється тим, що транс-каротиноїдною сіллю є транс-кроцетинат натрію (ТКН), який має структуру 3 17. Композиція за п. 1, яка відрізняється тим, що + + + Y - Na , K або Li . 18. Композиція за п. 1, яка відрізняється тим, що Y - органічний катіон. 19. Композиція за п. 18, яка відрізняється тим, що Y - органічна сполука, вибрана з групи, яку скла+ + дають R4N , R3S , де R - Н або СnН2n+1, де n - 1-10. 20. Композиція за п. 1, яка відрізняється тим, що Z містить кінцевий атом вуглецю групи TCRO. 21. Композиція за п. 1, яка відрізняється тим, що Z вибраний з групи, яку складають карбоксильна (СОО ) група, СО група та гідроксильна група. 22. Композиція за п. 21, яка відрізняється тим, що згадана СО група являє собою складноефірну, альдегідну або кетонну групу. 23. Композиція за п. 1, яка відрізняється тим, що Z вибраний з групи, яку складають сульфатна група (OSO3 ), монофосфатна група (ОРО3 ), (ОР(ОН)О2 ), дифосфатна група та трифосфатна група. 24. Композиція за п. 1, яка відрізняється тим, що Z - складноефірна група CООR, де R - СnН2n+1. 25. Композиція за п. 1, яка відрізняється тим, що + Y - Na , Z - карбоксильна група, та бічні групи X є метильними групами. 26. Композиція за п. 1, яка відрізняється тим, що TCRO містить менше ніж 100 атомів вуглецю. 27. Композиція за п. 1, яка відрізняється тим, що TCRO є симетричним. 28. Композиція за п. 1, яка відрізняється тим, що бічними групами X є метильні групи. 29. Композиція за п. 1, яка відрізняється тим, що бічні групи X, які можуть бути однаковими або різними, є нерозгалуженими чи розгалуженими вуглеводневими групами, які мають 4 або менше атомів вуглецю. 30. Композиція за п. 1, яка відрізняється тим, що бічні групи X, які можуть бути однаковими або різними, вибрані з групи, яку складають метильні групи (СН3) та етильні групи (С2Н5). 31. Композиція за п. 1, яка відрізняється тим, що біполярною транс-каротиноїдною сіллю є літієва, калієва або натрїєва сіль кроцетину. 32. Спосіб лікування пухлини у ссавця, який включає введення в організм ссавця і) біполярної транс-каротиноїдної солі, яка має формулу: YZ-TCRO-ZY, де: Y - катіон, який може бути однаковим або різним, Z - полярна група, яка може бути однаковою або різною та яка є асоційованою з катіоном, та TCRO - нерозгалужений транс-каротиноїдний каркас зі спряженими вуглець-вуглецевими подвійними та простими зв'язками, який має бічні групи X, де згадані бічні групи X, які можуть бути однаковими або різними, є нерозгалуженими чи розгалуженими вуглеводневими групами, які мають 10 або менше атомів вуглецю, або є галогенами, і іі) опромінення згаданої пухлини, причому згадану біполярну транс-каротиноїдну сіль вводять перед, під час або після застосування згаданого опромінення. 95903 4 33. Спосіб за п. 32, який відрізняється тим, що опромінення застосовують у дозі приблизно 60006500 сГр впродовж декількох тижнів. 34. Спосіб за п. 32, причому пухлина вибрана з групи, яка включає гліобластоми, плоскоклітинні карциноми, меланоми, лімфоми, саркоми, саркоїди, остеосаркоми, пухлини, пов'язані з раком шкіри, рак молочної залози, рак голови та шиї, гінекологічний рак, урологічний рак та рак чоловічих статевих органів, рак сечового міхура, рак передміхурової залози, рак кісток, рак ендокринних залоз, рак травного каналу, рак головних травних залоз/органів, рак ЦНС та рак легень. 35. Спосіб за п. 32, причому пухлиною є пухлина головного мозку. 36. Спосіб за п. 32, причому біполярною транскаротиноїдною сіллю є транс-кроцетинат натрію (ТКН), який має структуру NaO2C CO2Na . 37. Спосіб за п. 36, який відрізняється тим, що ТКН вводять у дозі 0,02-2 мг/кг перед згаданим опроміненням. 38. Спосіб за п. 32, причому ссавцем є людина. 39. Спосіб за п. 36, причому ссавцем є людина, та ТКН вводять внутрішньовенно у дозі 0,02-2 мг/кг перед згаданим опроміненням. 40. Спосіб лікування раку у ссавця, який включає введення в організм ссавця і) біполярної транс-каротиноїдної солі, яка має формулу: YZ-TCRO-ZY, де: Y - катіон, який може бути однаковим або різним, Z - полярна група, яка може бути однаковою або різною та яка є асоційованою з катіоном, та TCRO - нерозгалужений транс-каротиноїдний каркас зі спряженими вуглець-вуглецевими подвійними та простими зв'язками, який має бічні групи X, де згадані бічні групи X, які можуть бути однаковими або різними, є нерозгалуженими чи розгалуженими вуглеводневими групами, які мають 10 або менше атомів вуглецю, або є галогенами, і іі) хіміотерапію, причому згадану біполярну транс-каротиноїдну сіль вводять перед, під час або після застосування згаданої хіміотерапії. 41. Спосіб за п. 40, причому рак вибраний з групи, яка включає гліобластоми, плоскоклітинні карциноми, меланоми, лімфоми, саркоми, саркоїди, остеосаркоми, рак шкіри, рак молочної залози, рак голови та шиї, гінекологічний рак, урологічний рак та рак чоловічих статевих органів, рак сечового міхура, рак передміхурової залози, рак кісток, рак ендокринних залоз, рак травного каналу, рак головних травних залоз/органів, рак ЦНС та рак легень. 42. Спосіб за п. 40, причому раком є рак головного мозку. 43. Спосіб за п. 40, причому біполярною транскаротиноїдною сіллю є транс-кроцетинат натрію (ТКН), який має структуру 5 NaO2C 95903 CO2Na . 44. Спосіб за п. 43, який відрізняється тим, що ТКН вводять у дозі 0,02-2 мг/кг перед згаданою хіміотерапією. 45. Спосіб за п. 40, причому ссавцем є людина. 46. Спосіб за п. 43, причому ссавцем є людина, та ТКН вводять у дозі 0,02-2 мг/кг перед згаданою хіміотерапією. 47. Спосіб за п. 32 або п. 40, причому згадана біполярна транс-каротиноїдна сіль має форму суміші із циклодекстрином. 48. Спосіб за п. 32 або п. 40, причому Y - однозарядний іон металу. + + 49. Спосіб за п. 32 або п. 40, причому Y - Na , K + або Li . 50. Спосіб за п. 32 або п. 40, причому Y - органічний катіон. 51. Спосіб за п. 32 або п. 40, причому Y - органічна + сполука, вибрана з групи, яку складають R4N , + R3S , де R - Н або СnН2n+1, де n - 1-10. 52. Спосіб за п. 32 або п. 40, причому Z містить кінцевий атом вуглецю групи TCRO. Ця заявка претендує на пріоритет за попередньою заявкою №60/655,422, що була подана 24 лютого 2005 року, яку у повному обсязі включено до цієї заявки шляхом посилання. Цей винахід було зроблено за підтримки уряду за контрактом №N00014-04-C-0146, укладеним Науково-дослідним управлінням військовоморських сил СІЛА. Уряд має певні права на цей винахід. До цього винаходу включені поліпшені способи хімічного синтезу для одержання транскаротиноїдів, біполярних транс-каротиноїдів (БТК (ВТС)), у тому числі біполярних транскаротиноїдних солей (БТКС (BTCS)), наприклад, транс-кроцетинату натрію (ТКН (TSC)), самі сполуки, способи виготовлення їхніх лікарських форм, їх введення та способи їх застосування. Передумови створення винаходу Каротиноїди являють собою клас вуглеводнів, які складаються з ізопреноїдних одиниць, з'єднаних таким чином, що в центрі молекули розташування бічних замісників відносно основного ланцюга змінюється на протилежне. Остов (скелет) молекули складається зі спряжених вуглецьвуглецевих подвійних та простих зв'язків і може мати також бічні групи. Хоча раніше вважали, що скелет каротиноїду включає 40 атомів вуглецю, вже давно є визнаним, що каротиноїди можуть також мати вуглецеві скелети, що включають менш ніж 40 атомів вуглецю. Усі 4 прості зв'язки, що оточують вуглець-вуглецевий подвійний зв'язок, лежать у одній площині. У разі, якщо бічні групи знаходяться на одному боці вуглецьвутлецевого зв'язку, згадані групи позначаються як цис-; якщо ці групи знаходяться на протилежному боці вуглець-вуглецевого зв'язку, вони познача 6 53. Спосіб за п. 32 або п. 40, причому Z вибраний з групи, яку складають карбоксильна (СОО ) група, CO група та гідроксильна група. 54. Спосіб за п. 53, причому згадана CO група являє собою складноефірну, альдегідну або кетонну групу. 55. Спосіб за п. 32 або п. 40, причому Z вибраний з групи, яку складають сульфатна група (OSO3 ), монофосфатна група (ОРО3 ), (ОР(ОН)О2 ), дифосфатна група та трифосфатна група. 56. Спосіб за п. 32 або п. 40, причому Z - складноефірна група COOR, де R - CnH2n+l. 57. Спосіб за п. 32 або п. 40, причому TCRO містить менше ніж 100 атомів вуглецю. 58. Спосіб за п. 32 або п. 40, причому TCRO є симетричним. 59. Спосіб за п. 32 або п. 40, причому бічними групами X є метильні групи. 60. Спосіб за п. 32 або п. 40, причому бічні групи X, які можуть бути однаковими або різними, є нерозгалуженими чи розгалуженими вуглеводневими групами, які мають 4 або менше атомів вуглецю. 61. Спосіб за п. 32 або п. 40, причому бічні групи X, які можуть бути однаковими або різними, вибрані з групи, яку складають метильні групи (СН3) та етильні групи (С2Н5). ються як транс-. Завдяки великій кількості подвійних зв'язків існують великі можливості геометричної (цис/транс) ізомерії каротиноїдів, і ізомеризація легко відбувається у розчині. Нещодавно видана серія книжок є надзвичайно добрим довідником відносно багатьох властивостей тощо каротиноїдів ("Carotenoids", під редакцією Г. Бріттон (G. Britton), С. Ліен-Йєнсен (S. Liaaen-Jensen) та Г. Пфандер (Η. Pfander), Birkhauser Verlag, Basel, 1995, які включені до цього опису у повному обсязі шляхом посилання). Багато каротиноїдів є неполярними і, таким чином, нерозчинними у воді. Ці сполуки є надзвичайно гідрофобними, що ускладнює одержання їхніх лікарських форм для біологічного застосування, оскільки для їх розчинення необхідно вдаватись до застосування не водного, але органічного розчинника. Інші каротиноїди є монополярними, і мають характеристики поверхнево-активних речовин (гідрофобна частина і гідрофільна полярна група). Як такі, ці сполуки не розчиняються у загальному об'ємі рідини, а притягаються до поверхні водного розчину. Існує незначна кількість природних біполярних каротиноїдних сполук, і ці сполуки включають центральний гідрофобний фрагмент і дві полярні групи, по одній на кожному кінці молекули. Повідомлялось ("Carotenoids", том 1А, стор. 283) про те, що сульфати каротиноїдів мають "значну розчинність у воді до 0,4 мг/мл". Інші каротиноїди, які могли б вважатись біполярними, також є не дуже розчинними у воді. До них належать діальдегіди та дикетони. Повідомлялось також про дипіридинову сіль кроцетину, але її розчинність у воді при кімнатній температурі є нижчою за 1 мг/мл. Іншими прикладами біполярних каротиноїдів є кроцетин та кроцин (обидва знаходяться у 7 95903 8 пряно-смаковій речовині шафрані). Кроцетин, однак, є лише помірно розчинним у воді. Фактично, з усіх біполярних каротиноїдів лише кроцин демонструє значну розчинність у воді. Патенти США №4,176,179; №4,070,460; №4,046,880; №4,038,144; №4,009,270; №3,975,519; №3,965,261; №3,853,933 та №3,788,468 (кожен з яких у повному обсязі включено до цього опису шляхом посилання) мають відношення до різних варіантів застосування кроцетину. Патент США №6,060,511 має відношення до транс-кроцетинату натрію (ТКН) та варіантів його застосування. ТКН одержують шляхом реакції природного шафрану з гідроксидом натрію з подальшими екстрагуваннями. Патент США №6,060,511 розкриває спосіб екстрагування для одержання біполярної транс-каротиноїдної солі (транс-кроцетинату натрію), очищеної композиції, яку одержують шляхом екстрагування, та різні варіанти застосування згаданої композиції, наприклад, поліпшення коефіцієнта дифузії кисню та лікування геморагічного шоку. Заявка PCT/US03/05521 має відношення до способу хімічного синтезу для одержання біполярних транс-каротиноїдних солей та способів їх застосування. На наведеній нижче фігурі представлені декілька останніх стадій процесу хімічного синтезу для одержання ТКН, опис якого наведено у заявці PCT/US03/05521. Повна процедура синтезу для одержання ТКН, як описано у заявці РСТ, доходила до ключових проміжних хімічних сполук, "Сполуки А" і "Сполуки В", через багатостадійні процеси синтезу, представлені на двох наведених нижче фігурах: 9 Звичайною формою лікування злоякісних пухлин або раку є опромінення. Опромінення здійснюють у формі електромагнітних хвиль або заряджених чи незаряджених частинок. Електромагнітні хвилі представлені рентгенівським випроміненням або гамма-випроміненням. Заряджені частинки набувають форми електронів, протонів або важких іонів, у той час як нейтрони є прикладом нейтральних частинок. У процесі лікування випромінення може забезпечуватись зовнішнім джерелом, інтерстиціальним імплантатом або комбінацією двох згаданих способів. У разі опромінення, рад і Грей є звичайними одиницями виміру. Доза в один рад для випромінення будь-якого типу являє собою поглинання 100 ергів енергії на грам тканинимішені, а один Грей дорівнює 100 радам. Таким чином, один сантиГрей (сГр) дорівнює одному раду. Для більшості невеликих пухлин голови та шиї достатнім, як правило, виявляється курс радіотерапії, що складається з 6000-6500 сГр впродовж 6-6,5 тижнів. Дози від 6500 сГр до 7000 сГр впродовж 6,5-7,5 тижнів можуть бути необхідними для перешкоджання розвитку більших пухлин, у той час як для найбільших пухлин можуть потребуватись ще більші дози. Було показано, що доза у 5000 сГр впродовж 5 тижнів перешкоджає розвитку субклінічного захворювання у 90-95 % хворих. Життєздатною пухлинною клітиною є клітина, що має здатність до необмеженого поділу. Для того, щоб вважатись вбитою, пухлинна клітина повинна втратити цю репродуктивну здатність. Перешкоджання розвитку пухлин за допомогою променевої терапії забезпечується шляхом знищення усіх життєздатних клітин у межах пухлини, і наслідком кожного застосування певної дози випромінення буде загибель певної частини (незначної кількості) життєздатних клітин. Таким чином, чим більшим є об'єм пухлини, тим більшою є загальна доза випромінення, необхідна 95903 10 для перешкоджання розвитку пухлини. Пухлинна клітина, яка була стерилізована або вбита променевою терапією, не обов'язково зазнала морфологічних змін і, як правило, демонструє ознаки загибелі під час мітозу (поділу клітин). Важливо звернути увагу на те, що загибель клітини може не відбутись впродовж першого поділу клітини після опромінення. Може відбутись декілька клітинних циклів, що видаються успішними, перш ніж ознаки загибелі клітини стають очевидними, однак клітина вже не вважається життєздатною, оскільки вона вже втратила потенціал до необмеженої репродукції. На радіочутливість пухлинних клітин впливає багато факторів. Не так давно вважалось, що гістологія і місцезнаходження пухлини відіграють головну роль у потенціальному перешкоджанню розвитку пухлин шляхом променевої терапії. Немає сумніву у тому, що розвитку певних пухлин за допомогою променевої терапії перешкодити важче, але гістологія настільки важливою більше не вважається. Кількість життєздатних пухлинних клітин і частина гіпоксичних (яким не вистачає кисню) клітин у межах пухлини є головними факторами радіочутливості, і обидва залежать від розміру даної пухлини. Впродовж багатьох років очевидним було те, що кисень відіграє важливу роль у чутливості пухлини до променевої терапії. Добре встановленим фактом є те, що гіпоксичні пухлинні клітини є більш радіорезистентними. Незважаючи на те, що механізм цього явища не повністю зрозумілий, гадають, що присутність кисню фіксує променеве пошкодження клітини, яка є лабільною і, у противному разі, відновила б порушені функції. Максимальна зміна радіочутливості відбувається у межах 0-20 мм.рт.ст. (0-2,7 кПа), тобто при значенні, яке є набагато нижчим за парціальний тиск кисню у венозній крові. Значний рівень гіпоксії було продемонстровано на експериментальних солідних пухлинах, і значна кіль 11 кість непрямих фактів вказує також на існування гіпоксичних умов у межах людських пухлин. Гіпоксичні умови можуть розвиватись, оскільки пухлини часто переростають свій існуючий рівень постачання крові. Хіміотерапія є іншим способом, до якого вдаються для лікування раку. Вводять лікарські засоби, наприклад, кармустин (BCNU), темозоламід (TMZ), цисплатин, метотрексат тощо, і ці лікарські засоби спричинюють остаточну загибель або припинення росту пухлинних клітин. Помітили, що хіміотерапія, як і променева терапія, є менш успішною у разі гіпоксичних клітин, які часто зустрічаються у пухлинах. Високий кров'яний тиск або гіпертензія вражає приблизно одного з чотирьох американців. Цей потенційно загрозливий для життя стан може існувати фактично без симптомів. Кров'яний тиск характеризується двома показниками: систолічним кров'яним тиском і діастолічним кров'яним тиском. Гіпертензія, як правило, діагностується у разі систолічного тиску понад 140 мм.рт.ст. (18,7 кПа) або діастолічного тиску більшого за 90 мм.рт.ст. (12,0 кПа); ці визначення, однак, змінюються, і деякі лікарі вважають, що кров'яний тиск повинен залишатись на рівні 120/70 мм.рт.ст. (16,0-9,3 кПа) впродовж усього життя з підтримкою його або природним чином, або за допомогою гіпотензивних лікарських засобів. У деяких людей система, що регулює кров'яний тиск, виходить із ладу; артеріоли в усьому тілі стискаються, унаслідок чого підвищується тиск у більших кровоносних судинах. Постійний високий кров'яний тиск - на думку більшості експертів, вище 140/90 мм.рт.ст. (18,7-12,0 кПа) називають гіпертензією. Приблизно 90 % усіх людей з високим кров'яним тиском мають те, що зараз називають "есенційною" гіпертензією - це означає, що гіпертензія не має причини, що піддається визначенню. У 10 % випадків, що залишись, підвищений кров'яний тиск обумовлюється захворюванням нирок, діабетом або іншим розладом, який є першопричиною. Суть винаходу Цей винахід має відношення до різноманітних нових транс-каротиноїдних сполук, а також до багатьох композицій, що містять транс 95903 12 каротиноїдну сполуку, у тому числі композицій, що містять транс-каротиноїд та циклодекстрин. Цей винахід включає також спосіб синтезування каротиноїдних сполук, що мають формулу: де: Y=H або катіон, окрім Η Z=пoляpнa група, асоційована з Υ, і ТСRO=симетричний або асиметричний транс-каротиноїдний каркас, що включає стадії: сполучення діальдегіду, що містить спряжені вуглець-вуглецеві подвійні зв'язки, з агентом Віттіга і факультативно омилення продукту стадії сполучення. За іншими варіантами здійснення, цей винахід має відношення до способу лікування пухлини у ссавця, що включає введення ссавцю і) транскаротиноїду, і іі) застосування випромінення або хіміотерапії, а також способів лікування гіпертензії, фібриляції шлуночків, тахікардії або високого рівня ліпідів у ссавця, що включають введення ссавцю, який потребує лікування, ефективної кількості транс-каротиноїду. Докладний опис винаходу Цей винахід має відношення до поліпшеного способу хімічного синтезу для одержання транскаротиноїдів, біполярних транс-каротиноїдів (БТК (ВТС)), біполярних трдяс-каротиноїдних солей (БТКС (BTCS)), у тому числі транс-кроцетинату натрію (ТКН (TSC)), самих сполук, способів виготовлення їхніх лікарських форм та способів їх застосування. Термін "біполярна", що вживається у цьому описі, означає таку, що має дві полярні групи, по одній на кожному кінці молекули. Новий спосіб синтезу за цим винаходом, опис якого наведено, являє собою поліпшення процесу синтезу, опис якого було наведено вище, тобто у заявці США №10/647,132, яку у повному обсязі включено до цього опису шляхом посилання. У цьому винаході Сполуку В замінюють на Сполуку D. За цим процесом синтезу, кінцевий продукт (наприклад, транс-кроцетинат натрію) одержують із застосуванням нової передостанньої проміжної хімічної сполуки, Сполуки Ε (показано на наведеній нижче фігурі). 13 За новим, поліпшеним способом синтезу, Сполуку А (2,7-диметилокта-2,4,6-триєн-1,8-діал) об'єднують зі Сполукою D (2-(етоксикарбоніл)-2бутен-4-іл-трифенілфосфонійбромід), С5галогенідом складного ефіру Віттіга. Дві згадані сполуки реагують з одержанням діетилкроцетинату або Сполуки Ε (діетил-2,6,11,15тетраметилгексадека-2Е, 4Е, 6Е, 8Е, 10Е, 12Е, 14Е-гептен-1,16-діотат). Після цього Сполуку Ε омилюють (за допомогою гідроксиду натрію/етанолу) з одержанням кінцевого бажаного продукту, транс-кроцетинату натрію. Сполуки за цим винаходом Цей винахід має відношення до транскаротиноїдів, у тому числі складних діефірів, двохосновних спиртів, дикетонів та двохосновних кислот транс-каротиноїдів, біполярних транскаротиноїдів (БТК), біполярних транскаротиноїдних солей (БТКС), самих сполук та синтезу таких сполук, що мають структуру: де: Υ (який може бути однаковим або різним на двох кінцях)=Н або катіон, окрім Н, за варіантом, + + + якому віддається перевага, Na , K або Li . За варіантом, якому віддається перевага, Υ є однозарядним іоном металу. Υ може також бути орга+ + нічним катіоном, наприклад, R4N , R3S , де R - Η або СnН2n+1, де n - 1-10, за варіантом, якому віддається перевага, 1-6. Наприклад, R може бути метилом, етилом, пропілом або бутилом; Ζ (яка може бути однаковою або різною на двох кінцях)=полярна група, асоційована з Η або катіоном. У разі факультативного включення кінцевого атома вуглецю до складу каротиноїду (або каротиноїд-спорідненої сполуки), цією групою може бути карбоксильна (СОО) група або CO група (наприклад, складноефірна група, альдегідна або кетонна група) чи гідроксильна група. 95903 14 Цією групою може також бути сульфатна група (ОSО3 ), монофосфатна група (ОРО3 ), (ОР(ОН)О2 ), дифосфатна група, трифосфат або їх комбінації. Ця група може також бути складноефірною групою COOR, де R - СnН2n+1; ТСКО=транс-каротиноїдний або каротиноїдспоріднений каркас (за варіантом, якому віддається перевага, менше ніж 100 атомів вуглецю), який є нерозгалуженим, має бічні групи (які визначаються нижче), і, як правило, включає "спряжені" або переміжні вуглець-вуглецеві подвійні та прості зв'язки (за одним із варіантів здійснення, TCRO є не повністю спряженим, як у лікопені). Бічними групами (X) є, як правило, метильні групи, однак це можуть бути і інші групи, як обговорюється нижче. За варіантом здійснення, якому віддається перевага, структурні одиниці каркаса з'єднуються таким чином, що у центрі молекули вони є оберненими на 180°. Усі 4 прості зв'язки, що оточують вуглець-вуглецевий подвійний зв'язок, лежать у одній площині. У разі, якщо бічні групи знаходяться на одному боці вуглецьвуглецевого подвійного зв'язку, згадані групи позначаються як цис- (також відомі як "Ζ"); якщо ці групи знаходяться на протилежному боці вуглець-вуглецевого зв'язку, вони позначаються як транс- (також відомі як "Е"). У цьому описі ізомери будуть згадуватися як цис- або транс-. Сполуки за цим винаходом мають трансконфігурацію. Цис-ізомер, як правило, є шкідливою домішкою, що перешкоджає збільшенню коефіцієнта дифузії. За одним із варіантів здійснення, може застосовуватись цис-ізомер, причому каркас залишається нерозгалуженим. Бічні групи можуть займати симетричне положення відносно центральної точки молекули або можуть бути асиметричними, завдяки чому лівий бік молекули виглядає несхожим на правий бік молекули або з точки зору типу бічної групи, або їх просторового 15 95903 розміщення відносно центрального атома вуглецю. Бічними групами X (які можуть бути однаковими або різними) є атоми водню (Н) або вуглеводнева група з нерозгалуженим чи розгалуженим ланцюгом, що має 10 або менше атомів вуглецю, за варіантом, якому віддається перевага, 4 або менше атомів (факультативно включає галоген), або галоген. X може бути складноефірною групою (СОО-) або етоксильною/метоксильною групою. Прикладами X є метильна група (СН3), етильна група (С2Н5), фенільна або проста ароматична циклічна структура з бічними групами циклу або без них, галогенвмісна алкільна група (С1-С10), наприклад, СН2СІ, або галоген, наприклад, СІ чи Вr, або метоксильна (ОСН3) чи етоксильна (ОСН2СН3) група. Бічні групи можуть бути однаковими або різними, однак бічні групи, що застосовуються, повинні зберігати лінійну форму каркаса. Незважаючи на існування у природі багатьох каротиноїдів, каротиноїдних солей не існує. Патент США №6,060,511, що знаходиться у спільній власності, який у повному обсязі включено до цього опису шляхом посилання, має відношення до /яронс-кроцетинату натрію (ТКН). ТКН одержали шляхом реагування природного шафрану з гідроксидом натрію з подальшими екстрагуваннями, якими відбирали, головним чином, трансізомер. Присутність цис- та транс-ізомерів каротиноїду або каротиноїдної солі може визначатись шляхом дослідження в УФ-діапазоні спектра зразка каротиноїду, розчиненого у водному розчині. Приймаючи до уваги спектр, значення оптичної густини максимального піка, що реєструється у видимому діапазоні довжини хвиль спектра 380470 нм (значення залежить від застосовуваного розчинника і довжини ланцюга БТК або БТКС. Додання бічних груп або різна довжина ланцюгів будуть змінювати оптичну густину цього піка, але 16 фахівець у цій галузі техніки розпізнає існування піка оптичної густини у видимому діапазоні довжини хвиль, що відповідає спряженій каркасній структурі цих молекул), поділене на оптичну густину піка, що реєструється в УФ-діапазоні довжини хвиль 220-300 нм, може застосовуватись для визначення ступеня чистоти транс-ізомеру. У разі розчинення складного діефіру транс-каротиноїду (ДТК (TCD)) або БТКС у воді, максимальний пік у видимому діапазоні довжини хвиль спектра буде знаходитись у межах 380-470 нм (у залежності від точної хімічної структури, довжини каркаса і бічних груп), а пік в УФ-діапазоні довжини хвиль буде знаходитись у межах 220-300 нм. Результат обчислень, за повідомленням Μ. Кроу (Μ. Craw) та К. Ламберта (С. Lambert), Photochemistry and Photobiology, том 38 (2), 241-243 (1983), роботу яких у повному обсязі включено до цього опису шляхом посилання, (у цьому разі аналізували кроцетин), становив 3,1, який збільшився до 6,6 після очищення. У разі проведення аналізу солі транскроцетинату натрію за патентом США №6,060,511, що знаходиться у спільній власності (ТКН одержали шляхом реагування природного шафрану з гідроксидом натрію з подальшими екстрагуваннями, якими відбирали, головним чином, транс-ізомер), одержане значення дорівнювало у середньому приблизно 6,8. У разі піддання згаданому аналізу синтетичного ТКН за цим винаходом, це відношення є більшим за 7,0 (наприклад, від 7,0 до 8,5), за варіантом, якому віддається перевага, більшим за 7,5 (наприклад, 7,5-8,5), за варіантом, якому віддається найбільша перевага, більшим за 8. Синтезований матеріал є "чистішим" транс-ізомером або трансізомером високого ступеня чистоти. Асиметричні сполуки Деякими прикладами асиметричних сполук є (але без обмеження) наведені нижче: 1) З Прикладу 6 - Синтез Сполуки Ρ 17 95903 18 2) З Прикладу 8 - Синтез Сполуки U 3) З Прикладу 9 - Синтез Сполуки W Фахівцям у цій галузі зрозуміло, що асиметрії можна досягти шляхом просторового розміщення бічних груп по довжині ланцюга TCRO або шляхом зміни типу бічної групи на кожному боці молекули чи першим і другим способом. На додаток до цього, як і у разі симетричних транскаротиноїдних молекул, асиметричні трянскаротиноїдні молекули можуть мати різні катіони, полярні кінцеві групи і довжину ланцюга. Проміжні сполуки У разі одержання каротиноїдних сполук і їхніх солей, перед одержанням кінцевого продукту синтезують певні проміжні сполуки. Наприклад, у разі синтезу ТКН, ключові проміжні сполуки після сполучення Сполуки А і Сполуки D за способом цього винаходу представлені нижче. Першою сполукою є діетилкроцетинат. Діетилкроцетинат може бути замінений на диметилкроцетинат, а також на дипропіл і тому подібні форми згаданої сполуки. Структури деяких із цих проміжних сполук (для ряду молекул БТКС, представлених у прикладах, які наводяться у цьому описі) показані нижче: 19 95903 20 21 Синтез сполук за цим винаходом Один із варіантів здійснення цього винаходу має відношення до поліпшення декількох останніх стадій процесу, опис якого наведено у заявці PCT/S03/05521, що знаходиться у спільній власності, та заявці на патент США №10/647,132. За новим винаходом, С10-діал (представлений раніше як Сполука А) або С20-діал для синтезу каротиноїдів із довгим ланцюгом вводять у реакцію із сіллю Віттіга (С2, С3, С5, С10, С15 або іншою) за допомогою одно- або двостадійної реакції сполучення з одержанням однієї проміжної сполуки або двох проміжних сполук (одна з кожної стадії сполучення). Після цього кінцева проміжна сполука омилюється для одержання БТКС із бажаною довжиною ланцюга, симетрією або типом солі. Конкретно, у разі синтезу ТКН (докладний опис представлено у наведених у цьому описі Прикладі 1 і Прикладі 2), винахід має відношення до реакції сполучення, що залучає Сполуку А і Сполуку D (замість Сполуки В), з одержанням передостанньої проміжної сполуки, Сполуки Е. Після цього Сполуку Ε перетворюють на ТКН за допомогою реакції омилення гідроксидом натрію. За цим винаходом, ТКН одержують із більшим виходом і більш високим ступенем чистоти (структурної і ізомерної), аніж описано у попередній заявці, що знаходиться у загальній власності. Поліпшення синтезу каротиноїдів, наприклад, транс-кроцетинату натрію (ТКН). які забезпечують більш високий вихід і ступінь чистоти: 95903 22 1) Розчинник на основі бутиленоксиду для реакційної системи За цим винаходом, реакція сполучення Сполуки А і Сполуки D відбувається у системі розчинників на основі бутиленоксиду. Суміш бутиленоксиду/толуолу застосували як носій для реакції сполучення. Вихід на цій стадії становив, як правило, 55-60 %. Для порівняння, синтез, опис якого наведено у заявці PCT/US03/05521, із застосуванням бензолу як розчинника для аналогічної реакції сполучення (між Сполукою А і Сполукою В), давав на цій стадії вихід 33 %. У цій реакції сполучення бутиленоксид було застосовано як розчинник тому, що він являє собою систему розчинників із нейтральним рН для реакції Віттіга. Система із нейтральним рН є вигідною, оскільки 1) у середовищі з нейтральним рН не утворюється сіль, 2) інгібується або запобігається продукування різновидів спиртів і 3) інгібується осадження кінцевої сполуки. На додаток до цього, застосування бутиленоксиду і вихідних матеріалів дуже високого рівня чистоти (Сполука А і Сполука D) виключає необхідність проведення другої стадії реакції із застосуванням NaOH для перетворення іліду фосфору (опис якої наведено у заявці РСТ). Реакція сполучення за цим винаходом, таким чином, обмежується однією стадією, що підвищує загальний вихід продукту. Іншими розчинниками, які можуть застосовуватись на цій стадії, є метиленхлорид/гідроксид натрію, етилат натрію або метилат натрію. 2) Етанол на стадії омилення 23 95903 На другій стадії нового способу синтезу, омилення складного діефіру (Сполука Е) з одержанням ТКН здійснюють із застосуванням етанолу як розчинника. Наслідком застосування суміші етанолу/гідроксиду натрію як носія для реакційної суміші є вихід 92,0 % на цій стадії (без виправлення) і вихід 80 % із виправленням. Наведений вище вихід вказується після виділення. Спостерігалось повне перетворення реагентів. Діетиловий ефір (Сполука Е) погано розчиняється у воді і у такому розчиннику, наприклад, як тетрагідрофуран, що застосовувався у способі синтезу за Заявкою PCT/US03/05521. Таким чином, застосування етанолу за цим винаходом, який є більш прийнятним розчинником для діетилового ефіру, значно скоротило період прохо 24 дження реакції і, кінець-кінцем, забезпечило більш високі виходи. Іншим прийнятним альтернативним варіантом на цій стадії є ізопропанол або метанол. Результати змін, внесених до процесу синтезу, узагальнюються у наведеній нижче таблиці, яка показує різниці ступеня чистоти і виходу між способом за цим винаходом і способом за заявкою PCT/US03/05521 і заявкою на патент США №10/647,132. Важливо звернути увагу на те, що процес за цим винаходом на передостанній стадії проходить через діетилкроцетинат (Сполука Е), у той час як процес за заявкою PCT/US03/05521 на тій самій стадії проходить через диметилкроцетинат (Сполука С). Порівняння характеристик транс-кроцетинату натрію, синтезованого двома способами Матеріал за попереднім способом Параметр Матеріал за способом цього винаходу 94,21 % 97,56 % Ступінь чистоти за даними високоефективної рідинної хроматографії (HPLC) (визначається ступінь структурної чистоти) Температура плавлення (диференційна сканувальна калориметрія) УФ/візуальні дані Визначення ізомерної чистоти (0,001 Μ розчин карбонату натрію у деіонізованій/дистильованій воді з кінцевим рН розчину 8,0) Вміст води (за методом КарлаФішера) 3 ендотермічні явища (скоріше, втрата води, аніж плавлення) 22,0-131,3 °C (35,9 Дж/г) 134,1-161,5 °C (0,6 Дж/г) 188,1-227,1 °C (1,1 Дж/г) 421 нм: 1,9425 254 нм: 0,2387 Відношення (оптична густина при 421 нм/оптична густина при 254 нм): 8,14 27,3-136,7 °C (53,5 Дж/г) 141,8170,9 °C (1,8 Дж/г) 421 нм: 2,2111 254 нм: 0,2626 Відношення (оптична густина при 421 нм/оптична густина при 254 нм): 8,42 1,63 % (мас.) 1,89 % (мас.) Елементний аналіз С: 62,4 Н: 5,9 Na:11,8 О: 19,4 С: 61,5 Н: 6,2 Na:13,0 О: 19,8 Характерний склад Бімодальний Одномодальний гранулометричний Поліпшений гранулометричний склад Промивання етанолом У експериментах, у разі застосування стадії промивання етанолом, кінцевий вміст води у продукті був нижчим (тобто 0,5 % (мас.)), порівняно із застосуванням стадії промивання водою, коли вміст води у кінцевому продукті становив 1,8 % (мас). Застосування промивання етанолом зменшило мінливість гранулометричного складу у межах партії, роблячи розподіл одноріднішим. Гранулометричний склад ТКН, який одержали за способом заявки РСТ US03/05521, був бімодальним, у той час як цей винахід, замість цього, демонструє простий нормальний розподіл за розмірами. Це поліпшення є особливо важливим, оскільки розмір частинок може впливати на розчинність, а більш однорідний розподіл забезпечує можливість більш однорідної розчинності. Таким чином, цей винахід охоплює спосіб синтезування транс-каротиноїдної сполуки, що має формулу: де: Υ (який може бути однаковим або різним на двох кінцях)=Н або катіон, за варіантом, якому + + + віддається перевага, Na , K або Li . За варіантом, якому віддається перевага, Υ є однозарядним іоном металу. Υ може також бути органічним + + катіоном, наприклад, R4N , R3S , де R - Η або СnН2n+1, де n - 1-10, за варіантом, якому віддається перевага, 1-6. Наприклад, R може бути метилом, етилом, пропілом або бутилом; Ζ (яка може бути однаковою або різною на двох кінцях)=полярна група, асоційована з Η або катіоном. У разі факультативного включення кінцевого атома вуглецю до складу каротиноїду (або каротиноїд-спорідненої сполуки), цією групою може бути карбоксильна (СОО) група або CO група (наприклад, складноефірна група, альдегідна або кетонна група) чи гідроксильна група. Цією групою може також бути сульфатна група 25 95903 (ОSО3 ), монофосфатна група (ОРО3 ), (ОР(ОН)О2 ), дифосфатна група, трифосфат або їх комбінації. Ця група може також бути складноефірною групою COOR, де R - СnН2n+1; TCRO=транс-каротиноїдний або каротиноїдспоріднений каркас (за варіантом, якому віддається перевага, менше ніж 100 атомів вуглецю), який є нерозгалуженим, має бічні групи (які визначаються нижче), і, як правило, включає "спряжені" або переміжні вуглець-вуглецеві подвійні та прості зв'язки (за одним із варіантів здійснення, TCRO є не повністю спряженим, як у лікопені). Бічними групами є, як правило, метальні групи, однак це можуть бути і інші групи, як обговорюється нижче. За варіантом здійснення, якому віддається перевага, структурні одиниці каркаса з'єднуються таким чином, що у центрі молекули вони є оберненими на 180°. Усі 4 прості зв'язки, що оточують вуглець-вуглецевий подвійний зв'язок, лежать у одній площині. У разі, якщо бічні групи знаходяться на одному боці вуглецьвуглецевого подвійного зв'язку, згадані групи позначаються як цис-; якщо ці групи знаходяться на протилежному боці вуглець-вуглецевого зв'язку, вони позначаються як транс-. Сполуки за цим винаходом мають транс-конфігурацію. Цисізомер, як правило, є шкідливою домішкою, що перешкоджає збільшенню коефіцієнта дифузії. За одним із варіантів здійснення може застосовуватись цис-ізомер, причому каркас залишається нерозгалуженим. Бічні групи можуть займати симетричне положення відносно центральної точки молекули або можуть бути асиметричними, завдяки чому лівий бік молекули виглядає несхожим на правий бік молекули або з точки зору типу бічної групи, або їх просторового розміщення відносно центрального атома вуглецю. Згаданий спосіб включає сполучення симетричного діальдегіду, що містить спряжені вуглець-вуглецеві подвійні зв'язки, з агентом Віттіга, наприклад, трифенілфосфораном, наприклад, [3карбометокси-2-бутен-1іліден]трифенілфосфораном або бромідом трифенілфосфонію, наприклад, С5-галогенідом складного ефіру Віттіга, наприклад, 0-(2(етоксикарбоніл)-2-бутен-4-ілтрифенілфосфонійбромідом) або С2, С3 або С5 складним ефіром фосфонової кислоти, наприклад, трифенілфосфоноацетатом. Агентом Віттіга може також бути хлорид трифенілфосфонію або суміш бромідних і хлоридних сполук. У залежності від довжини бажаного ланцюга TCRO, необхідною є одно- або двостадійна реакція сполучення. Довший ланцюг потребує більше однієї реакції сполучення з тим самим або іншим агентом Віттіга на кожній стадії, як показано у прикладах, наведених у цьому описі. За варіантом, якому віддається перевага, реакцію сполучення здійснюють у системі розчинників із нейтральним рН, наприклад, у системі розчинників на основі бутиленоксиду, яка факультативно містить толуол або метиленхлорид/гідроксид натрію і етилат натрію або метилат натрію. 26 Після стадії сполучення йде стадія виділення бажаного продукту реакції сполучення. Після стадії сполучення здійснюють або другу стадію сполучення і продукт виділяють, як було описано вище, або виділений продукт із вищенаведеної стадії омилюють для одержання БТКС. У разі залучення другої реакції сполучення, продукт цієї другої стадії виділяють, після чого омилюють. Згаданий продукт може вмилюватись за допомогою розчину NaOH, LiOH, КОН і метанолу, етанолу або ізопропанолу як розчинника. Після стадії омилення бажаний продукт може промиватись етанолом або водою. У деяких випадках, придатним промивним розчинником є метанол або ізопропанол. Виготовлення лікарських форм і введення сполук фармацевтичної чистоти і композицій за цим винаходом При виготовленні лікарських форм транскаротиноїдів, у тому числі БТКС, наприклад, транс-кроцетинату натрію (ТКН), з іншими інгредієнтами (наповнювачами), перевага віддається: поліпшенню розчинності (підвищенню концентрації активного агента (наприклад, ТКН) у розчині), стабільності, біодоступності та ізотонічного балансу БТК, зниженню рН водного розчину та/або підвищенню осмотичного тиску водного розчину. Наповнювачі повинні відігравати роль домішок для запобігання самооб'єднанню мономерних одиниць БТК у розчині або запобігання передчасному осадженню БТК. Додання наповнювача повинно допомагати у щонайменше одному із цих аспектів. Лікарська форма може надаватись молекулам біполярного транс-каротиноїду (БТК) різноманітними способами. Основною лікарською формою є суміш БТК у стерильній воді, що вводиться внутрішньовенним шляхом. Ця лікарська форма може модифікуватись шляхом включення різноманітних фармацевтичних наповнювачів, у тому числі циклодекстринів. Ці лікарські форми також можуть вводитись внутрішньовенним шляхом. Будь-яка з вищеописаних різних рідких лікарських форм може піддаватись сублімаційному сушінню (ліофілізуватись) з одержанням сухого порошка з підвищеними характеристиками розчинності і стійкості. Такі порошкові лікарські форми після цього відновлюються для введення. Одним із способів є відновлення порошку у рідині, наприклад, фізіологічному розчині або стерильній воді для ін'єкцій, з подальшим введенням його внутрішньовенним шляхом. Цей спосіб може включати застосування багатокамерного шприца, що містить порошок у одній камері, а рідину у іншій камері. Подібним чином, згаданий продукт може розливатись у флакони, що мають перетинку, яка відокремлює порошок від рідини. Перед введенням згадану перетинку руйнують і компоненти змішують перед введенням внутрішньовенним шляхом. На додаток до введення внутрішньовенним шляхом, шляхи введення молекул транскаротиноїдів, яким надана спеціальна лікарська форма, включають введення внутрішньом'язовим 27 шляхом, доставку шляхом інгаляції, пероральне приймання та черезшкірне введення. Циклодекстрини Для введення деяких фармацевтичних препаратів необхідно додати іншу сполуку, яка допоможе підвищити всмоктування/розчинність/концентрацію активного фармацевтичного інгредієнта (АРІ). Такі сполуки називають наповнювачами, і циклодекстрини є прикладами наповнювачів. Циклодекстрини являють собою ланцюги циклічних вуглеводів, одержані з крохмалю. Вони відрізняються один від одного кількістю глюкопіранозних одиниць, що входять до їх складу. Вихідні циклодекстрини містять шість, сім і вісім глюкопіранозних одиниць, і їх називають, відповідно, альфа-, бета- і гамма-циклодекстринами. Циклодекстрини вперше були відкриті у 1891 році, і впродовж декількох років застосовувались як складова частина фармацевтичних препаратів. Циклодекстрини є циклічними (альфа-1,4)зв'язаними олігосахаридами альфа-Dглюкопіранози, що мають відносно гідрофобну центральну порожнину і гідрофільну зовнішню поверхню. У фармацевтичній промисловості циклодекстрини застосовувались, головним чином, як комплексоутворювальні агенти для підвищення розчинності лікарських речовин, які погано розчинялись у воді, а також для підвищення їх біодоступності та стійкості. На додаток до цього, циклодекстрини застосовуються для зниження або запобігання подразнення шлунковокишкового тракту або очей, зменшення або знищення неприємних запахів або смаків, запобігання взаємодії між лікарськими засобами або між лікарськими засобами і домішками або навіть для перетворення олій і рідких лікарських засобів на мікрокристалічні або аморфні порошки. Незважаючи на те, що сполуки ΒΤΚ є розчинними у воді, застосування циклодекстринів може ще більше підвищити розчинність, завдяки чому при даній дозі вводитись може менший об'єм лікарського розчину. Існує цілий ряд циклодекстринів, які можуть застосовуватись зі сполуками за цим винаходом. Дивись, наприклад, патент США №4,727,064, який у повному обсязі включено до цього опису шляхом посилання. Циклодекстринами, яким віддають перевагу, є -циклодекстрин, 2гідроксипропіл-у-циклодекстрин та 2гідроксипропіл--циклодекстрин або інші циклодекстрини, які підвищують розчинність БТК. Застосування гамма-циклодекстрину з ТКН підвищує розчинність ТКН у воді у 3-7 разів. Незважаючи на те, що цей коефіцієнт не є таким великим, як спостерігається у деяких інших випадках, він є важливим щодо підвищення розчинності активного агента циклодекстрином, оскільки забезпечує можливість парентерального введення людям (або тваринам) ТКН у менших об'ємних дозах. Наслідком застосування ТКН і гаммациклодекстрину було одержання водних розчинів, що містять 44 мг ТКН/мл розчину. Згадані розчини не повинні бути еквімолярними. Включення гамма-циклодекстрину забезпечує також всмок 95903 28 тування ТКН до кровотоку у разі введення внутрішньом'язовим шляхом. Всмоктування відбувається швидко, і швидко досягаються ефективні рівні ТКН у крові (як показано на пацюках). Лікарські форми циклодекстрину можуть застосовуватись з іншими транс-каротиноїдами та каротиноїдними солями. Цей винахід включає також нові композиції каротиноїдів, які не є солями (наприклад, кислотні форми, наприклад, кроцетин, кроцин або проміжні хімічні сполуки, які згадувались вище) і циклодекстрин. Іншими словами, транс-каротиноїди, які не є солями, можуть вводитись до складу лікарських форм із циклодекстрином. Маніт може додаватись для забезпечення осмотичного тиску, або суміш циклодекстрину і БТК може додаватись до ізотонічного фізіологічного розчину (дивись нижче). Застосованою кількістю циклодекстрину є така кількість, яка буде містити транс-каротиноїд, але не настільки велика, щоб не виділити згаданий транс-каротиноїд. Циклодекстрин-маніт Транс-каротиноід, наприклад, ТКН, може вводитись до складу лікарської форми із циклодекстрином, як згадувалось вище, і неметаболізованим цукром, наприклад, манітом (наприклад, d-манітом для регулювання осмотичного тиску таким чином, щоб він відповідав осмотичному тиску крові). Подібним чином можна одержати розчини, що містять більше 20 мг ТКН/мл розчину. Цей розчин може додаватись до ізотонічного фізіологічного розчину або до інших ізотонічних розчинів для його розбавлення і, разом із тим, збереження відповідного осмотичного тиску. Дивись Приклад 12. Маніт/оцтова кислота БТКС, наприклад, ТКН, може вводитись до складу лікарської форми з манітом, наприклад, dманітом, і слабкою кислотою, наприклад, оцтовою кислотою або лимонною кислотою, для регулювання рН. рН розчину повинен бути на рівні приблизно 8-8,5. Показники згаданого розчину повинні наближатись до показників ізотонічного розчину, і згаданий розчин як такий може вводитись безпосередньо до кровотоку. Дивись Приклад 13. Вода+фізіологічний розчин БТКС, наприклад, ТКН, можуть розчинятись у воді (за варіантом, якому віддається перевага, воді для ін'єкцій). Цей розчин у подальшому може розбавлятись водою, нормальним фізіологічним розчином, лактатним або фосфатним буфером Рінгера, і одержана суміш вводитись шляхом вливання або ін'єкції. Буфери Буфер, наприклад, гліциновий або бікарбонатний, може додаватись до лікарської форми у кількості приблизно 50 мМ для стабільності БТК, наприклад, ТКН. ТКН і гамма-циклодекстрин Співвідношення ТКН і циклодекстрину базується на даних розчинності ТКНщиклодекстрину. Наприклад, 20 мг/мл ТКН, 8 % гаммациклодекстрину, 50 мМ гліцину, 2,33 % маніту з рН 8,2+/-0,5 або 10 мг/мл ТКН і 4 % циклодекст 29 рину чи 5 мг/мл і 2 % циклодекстрину. Співвідношення цих інгредієнтів можуть дещо змінюватись, що є очевидним для фахівця у цій галузі техніки. Маніт може застосовуватись для регулювання осмотичного тиску, і його концентрація змінюється у залежності від концентрації інших інгредієнтів. Рівень гліцину підтримується постійним. ТКН є стійкішим при підвищених рН. рН приблизно 8,2+/-0,5 є необхідним для стабільності і фізіологічної сумісності. Застосування гліцину є сумісним із ліофілізацією. За альтернативним варіантом, ТКН і циклодекстрин вводитьсяч до складу лікарської форми із застосуванням 50 мМ бікарбонатного буфера замість гліцину. Видалення ендотоксинів із гаммациклодекстрину Вміст ендотоксинів у комерційно доступному циклодекстрині фармацевтичної чистоти є несумісним із введенням внутрішньовенним шляхом. Рівні ендотоксинів повинні бути зниженими для застосування циклодекстрину у лікарській формі БТК, призначеній для введення внутрішньовенним шляхом. Ліофілізація Для висушування лікарської форми БТК може застосовуватись ліофілізація, а також інші способи кристалізації. Сполукам за цим винаходом лікарська форма може надаватись за розділом одержання лікарських форм, наведеним у заявці на патент США №10/647,132. Легеневе введення Було показано, що ТКН всмоктується до кровотоку після легеневого введення. Включення циклодекстрину підсилює всмоктування ТКН до великого кола кровообігу - із загальним ефектом підвищення плазмового кліренсу. Окрім того, наслідком підвищення впорскуваного об'єму є посилене всмоктування ТКН впродовж тривалішого періоду часу. Таким чином, наслідком більшого впорскуваного об'єму при однаковій дозі є більша біодоступність. Було встановлено, що геморагічний шок у пацюків може успішно лікуватись шляхом легеневого введення ТКН. Циклодекстрини не є необхідними для легеневого всмоктування. Дослідження на легенях, які полягали у введенні ТКН у забуференій деіонізованій воді, продемонстрували успішне всмоктування до кровотоку. Внутрішньом'язове введення ТКН, у разі простого розчинення у деіонізованій воді, при введенні внутрішньом'язовим шляхом не всмоктується; однак додання циклодекстрину (як у готовій лікарській формі) забезпечує його всмоктування до кровотоку. Наслідком введення -циклодекстрину з ТКН є успішне всмоктування до великого кола кровообігу. Було встановлено, що геморагічний шок у пацюків може успішно лікуватись у разі введення ТКН внутрішньом'язовим шляхом. Виготовлення лікарської форми ТКН із полімерами пропіленгліколю, поліетиленгліколю (PEG) та іншими агентами також допомагає всмоктуванню до кровотоку у разі, коли ТКН вводять внутрішньом'язовим шляхом. Ці агенти можуть також застосовуватись з іншими 95903 30 біполярними транс-каротиноїдами для внутрішньом'язового введення. Черезшкірне введення На пацюках було показано, що ТКН всмоктується до кровотоку після черезшкірного введення у разі виготовлення лікарської форми із циклодекстринами. Виготовлення лікарської форми ТКН із полімерами пропіленгліколю, поліетиленгліколю (PEG), диметилсульфоксидом та іншими агентами також допомагає всмоктуванню до кровотоку у разі, коли ТКН вводять черезшкірним шляхом. Ці агенти можуть також застосовуватись з іншими біполярними транс-каротиноїдами для черезшкірного введення. Пероральне введення Було показано, що ТКН всмоктується до кровотоку після перорального приймання. Було встановлено, що включення циклодекстрину, наприклад, -циклодекстрину до лікарської форми БТК, наприклад, ТКН, підсилює всмоктування ТКН до великого кола кровообігу. Виготовлення лікарської форми ТКН із полімерами пропіленгліколю, поліетиленгліколю (PEG) та іншими агентами також допомагає всмоктуванню до кровотоку у разі перорального приймання. Застосування сполук і композицій за цим винаходом Сполуки і композиції за цим винаходом можуть застосовуватись для лікування різноманітних розладів у ссавців, у тому числі людей. Вищезгадані сполуки за цим винаходом, у тому числі проміжні сполуки, можуть застосовуватись за варіантами, наведеними нижче, а також за варіантами, наведеними у заявці на патент США №10/647,132. Транс-каротиноїди та опромінення злоякісних пухлин З метою подолання гіпоксії пухлинних клітин, наслідком якої є підвищення радіорезистентності, придатною є оксигенотерапія. Фактично, була визначена кількість, відома як коефіцієнт кисневого підсилення (OER). Його значення вказує на те, що доза іонізуючого випромінення, наслідком якої є данний рівень виживаності клітин, є більшою на постійний коефіцієнт за гіпоксичних умов, аніж коли клітини добре постачаються киснем. Для більшості клітин ссавців значення OER дорівнює 2,5-3. Іншими словами, для вбивання гіпоксичних клітин необхідною є доза іонізуючого випромінення, яка у 2,5-3 рази перевищує дозу, необхідну для вбивання клітин, які добре постачаються киснем. Таким чином, підвищення перенесення кисню до пухлин надає можливість застосування нижчих доз іонізуючого випромінення для "вбивання" злоякісних клітин. Це важливо для пухлин багатьох типів. Було показано, що застосування біполярної транс-каротиноїдної сполуки, наприклад, транскроцетинату натрію, підвищує кількість кисню, яка досягає гіпоксичних тканин; таким чином, це є дуже добрий радіосенсибілізатор. Він надає можливість зниження застосовуваних доз іонізуючого випромінення або підвищує ефективність опромінення і забезпечує можливість зворотного розвитку пухлини і видужування. Він є придатним 31 для раку будь-якого типу, для лікування якого зараз застосовують випромінення. Променевій терапії піддають приблизно 60 % ракових хворих і, як правило, застосовують дозу іонізуючого випромінення приблизно 6000-6500 сГр впродовж декількох тижнів. БТК або БТКС, наприклад, ТКН, може застосовуватись у поєднанні з іонізуючим випроміненням для підвищення показника ефективності лікування. За одним із варіантів здійснення, ТКН вводять у дозі 0,02-2 мг/кг, за варіантом, якому віддається перевага, 0,05-1 мг/кг перед кожною дозою іонізуючого випромінення. У разі іншої схеми застосування лікарського засобу, будуть застосовуватись більш високі дози (наприклад, більші у 3 рази, оскільки при інших шляхах введення ТКН всмоктується не у повному об'ємі). За одним із варіантів здійснення, для підвищення ефективності опромінення, на додаток до введення сполуки БТК, наприклад, ТКН, вдаються до іншого способу, наприклад, застосовують кисень під підвищеним тиском, вдихання чистого газоподібного кисню або введення іншої сполуки, наприклад, мізонідизолу (misonidizole). До цих додаткових способів можуть також вдаватись у поєднанні з іншими варіантами застосування, які обговорюються нижче (наприклад, хіміотерапія). Сполуки за цим винаходом разом із променевою терапією можуть застосовуватись для лікування пухлин багатьох типів, у тому числі: плоскоклітинних карцином, меланом, лімфом, сарком, саркоїдів, остеосарком, пухлин, пов'язаних із раком шкіри, раку молочної залози, раку голови та шиї, гінекологічного раку, урологічного раку та раку чоловічих статевих органів, раку сечового міхура, раку передміхурової залози, раку кісток, раків ендокринних залоз, раків травного каналу (наприклад, раку товстої кишки), раків головних травних залоз/органів (наприклад, шлунка, печінки, підшлункової залози), раку центральної нервової системи (ЦНС) (у тому числі раків головного мозку, наприклад, гліом) та раку легень. Транс-кроцетинат натрію (ТКН) успішно застосовували як радіосенсибілізатор у разі раку людей, трансплантованого мишам. Були проведені дослідження з висновком, що доза ТКН у межах від 0,07 мг/кг до 0,18 мг/кг буде підсилювати ефект опромінення у разі пухлин цих типів. Транс-каротиноїди і хіміотерапія Було показано, що транс-каротиноїдні сполуки, наприклад, транс-кроцетинат натрію, підвищує кількість кисню, яка досягає гіпоксичних тканин; це робить його придатним для застосування у комбінації з хіміотерапією раку. Він забезпечує підвищення ефективності хіміотерапії. Він придатний для раку будь-якого типу, для лікування якого зараз застосовують, хіміотерапію. Хіміотерапії піддають більшість ракових хворих із застосуванням агентів багатьох різних типів. БТК або БТКС, наприклад, ТКН, може застосовуватись у поєднанні з хіміотерапією для забезпечення зворотного розвитку пухлини і підвищення показника ефективності лікування. За одним із варіантів здійснення, ТКН вводять у дозі 0,02-2 мг/кг, за 95903 32 варіантом, якому віддається перевага, 0,05-1 мг/кг, перед, під час або після внутрішньовенного введення кожного хіміотерапевтичного агента. У разі введення іншим шляхом, доза повинна підвищуватись у 2-3 рази для компенсації зниження біодоступності. Сполуки за цим винаходом разом із хіміотерапією, можуть застосовуватись для лікування пухлин багатьох типів, у тому числі: плоскоклітинних карцином, меланом, лімфом, сарком, саркоїдів, остеосарком, пухлин, пов'язаних із раком шкіри, раку молочної залози, раку голови та шиї, гінекологічного раку, урологічного раку та раку чоловічих статевих органів, раку сечового міхура, раку передміхурової залози, раку кісток, раків ендокринних залоз, раків травного каналу (наприклад, раку товстої кишки), раків головних травних залоз/органів (наприклад, шлунка, печінки, підшлункової залози), раку ЦНС (у тому числі раків головного мозку, наприклад, гліом) та раку легень. Фібриляція шлуночків Серце скорочується у разі проходження через нього електричних сигналів. Фібриляція шлуночків ("V fib") є станом, при якому порушується електрична активність серця. Коли це трапляється, нижні (нагнітальні) порожнини серця скорочуються швидко і несинхронізовано. (Шлуночки скоріше "тріпотять", аніж скорочуються). Серце перекачує незначну кількість крові або зовсім її не перекачує. Фібриляція шлуночків є дуже серйозним станом. Колапс і раптова смерть від зупинки серця відбудуться впродовж лічених хвилин, якщо негайно не буде надана медична допомога. У разі своєчасного лікування, фібриляцію шлуночків і тахікардію (надзвичайно швидкі серцеві скорочення) можна ^ повернути до нормального ритму. Сучасний спосіб лікування цього стану потребує піддання серця контрольованому електричному розряду за допомогою пристрою, який називають дефібрилятором. Інший ефективний спосіб виправлення ритму, що становить загрозу для життя, полягає у застосуванні електронного пристрою, який називають вживлюваним кардіовертером-дефібрилятором. Цей пристрій піддає серце контрольованому електричному розряду для нормалізації серцевих скорочень у разі, коли власні електричні сигнали серця стають безладними. Як фібриляція шлуночків, так і тахікардія можуть також "виправлятись" за допомогою сполуки за цим винаходом, наприклад, т/шяс-кроцетинату натрію (ТКН). ТКН, у разі введення його внутрішньовенним шляхом під час передклінічного дослідження інфаркту міокарда, запобігав фібриляції шлуночків. На додаток до цього було показано, що ТКН знижував тахікардію у пацюків, які були піддані геморагічному шоку. У разі введення внутрішньовенним шляхом, доза ТКН, якій віддається перевага, становить 0,02-2 мг/кг, доза, якій віддається більша перевага, становить від 0,05 мг/кг до 1 мг/кг. У разі введення іншим шляхом, доза повинна підвищува 33 тись у 2-3 рази для компенсації зниження біодоступності. Гіпертензія Споживання кисню у людей знижується у міру старіння. На додаток до цього, кількість випадків гіпертензії з віком зростає. Не бажаючи обмежувати себе конкретною теорією, вважають, що ці два фактори є взаємопов'язаними, тобто після зниження споживання кисню тканинами, кров'яний тиск зростає для забезпечення тканин більшою кількістю кисню. Таким чином, якби більша кількість кисню постачалась якимось іншим способом, кров'яний тиск би знизився. У разі введення внутрішньовенним шляхом, доза ТКН, якій віддається перевага, становить 0,02-2 мг/кг, доза, якій віддається більша перевага, становить від 0,05 мг/кг до 1 мг/кг. У разі введення іншим шляхом, доза повинна підвищуватись у 2-3 рази для компенсації зниження біодоступності. Сполуки за цим винаходом, наприклад, ТКН, знижують як систолічний, так і діастолічний кров'яний тиск. Вони можуть також спричинювати зниження частоти серцевих скорочень і, тим самим, викликати зниження частоти пульсу, який часто є підвищеним у хворого на гіпертензію. Доза ТКН для лікування гіпертензії, якій віддається перевага, становить 0,02-2 мг/кг, доза, якій віддається більша перевага, становить від 0,05 мг/кг до 1 мг/кг. Високий рівень ліпідів Сполуки за цим винаходом, наприклад, ТКН, можуть знижувати рівні ліпідів у плазмі, у тому числі рівні тригліцеридів і холестерину. У разі введення внутрішньовенним шляхом, доза ТКН, якій віддається перевага, становить 0,02-2 мг/кг, доза, якій віддається більша перевага, становить від 0,05 мг/кг до 1 мг/кг. У разі введення іншим шляхом, доза повинна підвищуватись у 2-3 рази для компенсації зниження біодоступності. Застосування з недоношеними дітьми Сполуки за цим винаходом, наприклад, ТКН, можуть застосовуватись для лікування недоношених дітей для запобігання ослаблення розумових здібностей. У разі введення внутрішньовенним шляхом, доза ТКН, якій віддається перевага, становить 0,02-2 мг/кг, доза, якій віддається більша перевага, становить від 0,05 мг/кг до 1 мг/кг. У разі введення іншим шляхом, доза повинна підвищуватись у 2-3 рази для компенсації зниження біодоступності. Застосування під час пологів Сполуки за цим винаходом, наприклад, ТКН, можуть вводитись плоду або матері під час пологів для запобігання кисневого голодування плоду під час пологів. Наслідком кисневого голодування плоду під час пологів може бути пошкодження головного мозку або аутизм. У разі введення внутрішньовенним шляхом, доза ТКН, якій віддається перевага, становить 0,02-2 мг/кг, доза, якій віддається більша перевага, становить від 0,05 мг/кг до 1 мг/кг. У разі введення іншим шляхом, доза повинна підвищуватись у 2-3 рази для компенсації зниження біодоступності. Застосування після вдихання диму 95903 34 Сполуки за цим винаходом, наприклад, ТКН, можуть вводитись після вдихання значних об'ємів диму. У разі введення внутрішньовенним шляхом, доза ТКН, якій віддається перевага, становить 0,02-2 мг/кг, доза, якій віддається більша перевага, становить від 0,05 мг/кг до 1 мг/кг. У разі введення іншим шляхом, доза повинна підвищуватись у 2-3 рази для компенсації зниження біодоступності. Фіброміалгія Сполуки за цим винаходом, наприклад, ТКН, можуть застосовуватись для лікування фіброміалгії шляхом підвищення рівнів кисню у клітинах. У разі введення внутрішньовенним шляхом, доза ТКН, якій віддається перевага, становить 0,02-2 мг/кг, доза, якій віддається більша перевага, становить від 0,05 мг/кг до 1 мг/кг. У разі введення іншим шляхом, доза повинна підвищуватись у 2-3 рази для компенсації зниження біодоступності. Наведені нижче Приклади є ілюстративними, а не обмежувальними, щодо сполук, композицій і способів за цим винаходом. Інші придатні модифікації і адаптації різноманітних умов і параметрів, що зустрічаються за нормальних умов і які є очевидними для фахівців у цій галузі техніки, входять до суті та обсягу цього винаходу. Приклади Список скорочень для Прикладів а/а [%] - відносна чистота у % СОА - Акт про проведення аналізу DCM - дихлорметан DSC - диференційна сканувальна калориметрія E-No. - номер для кожної окремої сполуки екв. - еквіваленти EtOAc - етилацетат FW - формульна маса GMP - Правила вироблення доброякісної продукції год. - година Н-ЯМР - водневий ядерний магнітний резонанс HPLC - рідинна хроматографія високого тиску HV - процедура синтезу ІРС - контроль якості продукції у процесі виготовлення IT - внутрішня температура JT - температура оболонки LC-MS - рідинна хроматографія - масспектрометрія МеОН - метанол хв - хвилини ML - маточний розчин MOR - головні експлуатаційні дані пс - не виправлений О Ρ - органічний шар RT - кімнатна температура (приблизно 22 °C) темп. - температура TFA - трифтороцтова кислота ТРРО - трифенілфосфіноксид TLC - тонкошарова хроматографія TSC - транс-кроцетинат натрію (С-013229) УФ - УФ-спектроскопія Приклад 1 35 95903 Дрібносерійний синтез 165 г ТКН Загальний 36 огляд хімічної реакції Синтез Сполуки Ε (Діетил-2,6,11,15-тетраметилгексадека-2Е, 4Е, 6Е, 8Е, 10Е, 12Е, 14Е-гептен-1,16діотат) Позиція 1 2 3 4 5 6 7 8 9 10 11 1 Реактив Сполука А Сполука D Бутиленоксид Толуол Етанол Метилцикло-гексан Бутиленоксид Толуол Етанол Метилцикло-гексан Метанол Молекулярна маса 164,20 1 444,01 Еквівалент 1,0 3,0 Одиниця кількості 130 г 1052 г 0,64 л 1,27 л 0,15 л 0,79 л 0,20 л 0,50 л 0,10 л 0,40 л 1,00 л Застосований матеріал являв собою суміш солей, що містила 48 % броміду і 52 % хлориду за Актом про проведення аналізу постачальника. Таким чином, реальна маса відрізнялась від теоретичної маси, як показано на схематичній формулі. 37 95903 Методика 1) З колби відкачали газ і колбу продули азотом. 2) У колбу завантажили Сполуку А (1) і Сполуку D (2) при JT (температурі оболонки)=20 °C. 3) Бутиленоксид (3) і толуол (4) завантажили до колби при JT=20 °C. З колби відкачали газ і колбу двічі продули азотом. Реакційну суміш наІРС 1 №2 гріли до JT=100 °C. Одержали однорідний розчин. 4) Розчин перемішали при JT=100 °C впродовж 6,5 год. (IT (внутрішня температура) дорівнювали приблизно 93 °C). 5) Відібрали зразок для ІРС (контролю якості продукції у процесі виготовлення). 1 Сигналів альдегіду виявлено не було ( Н-ЯМР), дивись Примітку 1 6) Суміш повільно охолоджували до ІТ=20 °C (15 год.). 7) Одержали суспензію червоного кольору. Суспензію охолоджували до ІТ=1 °C впродовж 2 год. 8) Суспензію фільтрували за допомогою фільтра-осушника впродовж декількох хвилин. 9) Для промивання колби застосували холодний етанол (5) при температурі 2 °C. Промивний розчин перенесли до фільтра-осушника. 10) Відфільтрований осад промили метилциклогексаном (6) при температурі 22 °C. 11) Відфільтрований осад сушили на роторному випарнику впродовж 5 год. при температурі 55 °C. ІРС 2 №1 38 12) Одержали 139,6 г Сполуки Ε у вигляді твердої речовини червоного кольору. її природу 1 було підтверджено Н-ЯМР. Чистота, за результатами визначення засобами HPLC, дорівнювала 93,68 % а/а. На додаток до цього, спостерігалось також 2,90+3,00 % цис-ізомерів. Вихід (nс) дорівнював 45,9 %. 13) Маточний розчин (приблизно 3 л) концентрували до 40 % його об'єму (все ще залишався розчином червоного кольору) і перемішували при JT=100 °C впродовж 15 год. (IT дорівнювала приблизно 100 °C). 14) Одержали суспензію червоного кольору. Відібрали зразок для ІРС. Було виявлено незначну кількість або жодного цис-ізомеру (Ш-ЯМР) 15) Суміш розбавляли бутиленоксидом (7) і толуолом (8) (все ще суспензія) і охолоджували до ІТ=2,9 °C впродовж 3,5 год. 16) Суспензію фільтрували за допомогою фільтра-осушника впродовж 10 хв. 17) Для промивання колби застосували холодний етанол (9) при температурі приблизно 2 °C. Промивний розчин перенесли до фільтраосушника. 18) Відфільтрований осад промили метилциклогексаном (10) при температурі 18 °C. 19) Відфільтрований осад сушили на роторному випарнику впродовж 15 год. при температурі 50 °C. 20) Одержали 384,5 г неочищеного продукту у вигляді твердої речовини червоного кольору. 1 Н-ЯМР виявив присутність ТРРО на додаток до бажаного продукту. 21) Неочищений продукт обробляли метанолом (11) і перемішували впродовж 30 хв при JT=60 °C. 22) Суспензію охолоджували до JT=0 °C впродовж 60 хв. 23) Суспензію фільтрували за допомогою фільтра-осушника впродовж декількох хвилин. 24) Для промивання колби застосували метанол (11). Промивний розчин перенесли до фільтра-осушника. 25) Відфільтрований осад сушили на роторному випарнику впродовж 2 год. при температурі 55 °C. 26) Одержали 143,2 г неочищеного продукту у вигляді твердої речовини червоного кольору. її 1 природу було підтверджено Н-ЯМР. Чистота за результатами визначення засобами HPLC дорівнювала 96,99 % а/а. На додаток до цього, спостерігалось також 1,02+1,26 % цмс-ізомерів. Ви1 хід (пс) дорівнював 47,0 %. Н-ЯМР показав приблизно 11,5 % ТРРО. Примітки 1) Перший зразок для ІРС відібрали через 2,5 год. Він показав повне вичерпання альдегіду і додаткову кількість цис-ізомеру. Співвідношення ізомерів поліпшилось впродовж періоду проходження реакції. Одержання зразка Контроль якості продукції у процесі виго- Перетворення: Приблизно 0,5 мл реакційної суміші відбирали, 1 товлення (ІРС): випарювали і аналізували засобами Н-ЯМР або HPLC 6-7 мг продукту аналізували засобами HPLC; метод HPLC-TSCЧистота: M1.1 5-10 мг продукту розчиняли у 0,9 мл CDCI3 (внутрішній стан1 Н-ЯМР дарт: TMS (тетраметилсилан) для ЯМР-спектроскопії. 39 95903 40 Позиція Реактив Молекулярна маса Еквівалент 1 Сполука Ε 384,51 1,0 2 3 4 5 6 7 Етанол 30 % NaOH Вода Вода Вода Вода Одиниця кількості 139 г 2 +46 г 0,72 л 0,72 л 2,21л 1,92 л 1,92 л 1,92 л 2 Точна кількість вихідного матеріалу була дещо нижчою від вказаної, оскільки друга порція (46 г), за 1 даними Н-ЯМР, містила приблизно 11,5 % ТРРО. Методика 1) З колби відкачали газ і колбу продули азотом. 2) У колбу завантажили Сполуку Ε (1) при JT (температурі оболонки)=20 °C. 3) Етанол (2) і 30 % NaOH (3) завантажили до колби при ЛГ=20 °C. З колби відкачали газ і колбу двічі продули азотом. Реакційну суміш нагрівали ІРС 1 №1 до JT=90 °C. Одержали густу суспензію оранжевого кольору. 4) Суспензію перемішували при ЛГ=90 °C впродовж 47 год. (IT (внутрішня температура) дорівнювали приблизно 77 °C). 5) Суміш охолоджували до ІТ=21 °C впродовж 16 год. Відібрали зразок для ІРС (контролю якості продукції у процесі виготовлення). 98,2 % перетворення складного моноефіру на ТКН (HPLC); складного діефіру (Сполука Е) не виявлено 6) Суміш розбавляли водою (4). 7) Суспензію фільтрували за допомогою фільтра-осушника впродовж 50 хв. 8) Для промивання колби і відфільтрованого осаду застосували холодну воду (5) при температурі 3 °C. 9) Відфільтрований осад додатково промили холодною водою (6+7) при температурі 5 °C і 2 °C. 10) Відфільтрований осад сушили на роторному випарнику впродовж 20 год. при температурі 55 °C. 11) Одержали 164,9 г ТКН у вигляді твердої речовини оранжевого кольору. її природу було 1 підтверджено Н-ЯМР. Чистота, за результатами визначення засобами HPLC, дорівнювала 97,56 % а/а. Вихід (nс) дорівнював 92,0 %. Вміст води становив 1,89 % (мас), УФ-співвідношення 421 нм/254 нм дорівнювало 8,42. Аналітичне обчислення для C2oH2204Na2-0,5H20-0,2NaOH: С, 61,41; Η, 6,03;Na, 12,93; О, 19,63. Встановлено: С, 61,5; Η, 6,2;Na, 13,0; О, 19,8. Одержання зразка Контроль якості продукції у процесі виготов- Перетворення: Приблизно 0,5 мл реакційної суміші відбилення (ІРС): рали і аналізували засобами HPLC. 6-7 мг продукту аналізували засобами HPLC; метод HPLCЧистота: TSC-M1.1 5-10 мг продукту розчиняли у 0,9 мл D2O для ЯМР1 Н-ЯМР спектроскопії. 41 95903 42 Приклад 2 Одержання більшої кількості (2 кг) ТКН за умов cGMP Загальний огляд реакційної схеми Сировина Якість вихідних матеріалів (Сполуки А і Сполуки D) перевірили і результати перевірки наведені нижче: Партія № Е-027211-002 (UQ40112015; С10-діал; Сполука А) Е-027684-001 (UQ40112015; С10-діал; Сполука А) Е-027684-002 (UQ40112015; С10-діал; Сполука А) Е-027758-001 - Е-027758-003, Е-027685-001 - Е-027685-021 (UE00401004; С5 складний ефір Віттіга; Сполука D) Визначення чистоти засобами HPLC (% а/а) 95,22 94,70 94,60 97,88 Усі матеріали задовольняли наведеним специфікаціям (Сполука D: >97,0 %; Сполука А: >94,0 %). На додаток до цього, усі матеріали були одержані синтетичним шляхом без застосування жодних компонентів тваринного походження або жодних компонентів, одержаних із продуктів тваринного походження. Зовнішній вигляд Природа засобами IR Порошок жовтого коВідповідає льору Порошок жовтого коВідповідає льору Порошок жовтого коВідповідає льору Порошок білого кольоВідповідає ру С10-діал (Сполука А) являв собою кристалічний порошок жовтого кольору. Фосфоран, Сполука D, являв собою порошок із кольором від білого до жовтого. Природу було перевірено засобами 1 Н-ЯМР. Синтез Сполуки Ε 43 Позиція 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 95903 Реактив Сполука А Сполука D Бутиленоксид Толуол Бутиленоксид Етанол Метилцикло-гексан Метанол Бутиленоксид Толуол Бутиленоксид Толуол Метилцикло-гексан Метанол Метанол 44 Молекулярна маса 164,20 3 444,01 Еквівалент 1,0 3,0 Одиниця кількості 2,99 кг 24,04 кг 15 л 30 л 9л 4л 18 л 17,5 л 3л 11л 7л 10 л 7л 13 л 14 л 3 Застосований матеріал являв собою суміш солей, що містила 48 % броміду і 52 % хлориду за Актом про проведення аналізу постачальника. Таким чином, реальна маса відрізнялась від теоретичної маси, як показано на схематичній формулі. Методика 1) Із реактора місткістю 100 л відкачали газ, і реактор двічі продули азотом. 2) У реактор місткістю 100 л завантажили Сполуку А (1) і Сполуку D (2) при JT=20 °C. 3) Бутиленоксид (3) і толуол (4) завантажили до реактора при JT=20 °C. Із реактора місткістю 100 л відкачали газ, і реактор двічі продули азотом. Реакційну суміш нагрівали до JT=100 °C. Одержали однорідний розчин. ІРС 1 №1 4) Розчин перемішували при JT=100 °C впродовж 4 год. (IT дорівнювали приблизно 98 °C). 5) Розчин концентрували під незначним розрідженням при ЛГ=110 °C. Видалили 9,0 л розчинника. Суміш перемішували при JT=110 °C впродовж 13 год. (IT дорівнювали приблизно 105 °C). 6) Суміш розбавили бутиленоксидом (5) і охолоджували до ІТ=20 °C (2,75 год.). Одержали суспензію червоного кольору. 7) Відібрали зразок для ІРС. 1 Сигналів альдегіду виявлено не було ( Н-ЯМР), дивись Примітку 1 8) Суміш охолоджували до ІТ=0 °C (80 хв). 9) Суспензію фільтрували за допомогою фільтра-осушника впродовж 100 хв. 10) Для промивання 100 л peaicropf застосували холодний етанол (6). Промивний розчин перенесли до фільтра-осушника. 11) Відфільтрований осад промили метилциклогексаном (7). 12) Відфільтрований осад сушили на роторному випарнику впродовж 4,5 год. при температурі 55 °C. 13) Одержали 5,246 кг неочищеного продукту у вигляді твердої речовини червоного кольору. 1 Н-ЯМР спектр показав, на додаток до бажаного продукту, присутність значної кількості ТРРО (приблизно 25-30 %). 45 95903 14) Неочищений продукт переносили на фільтр-осушник і промивали метанолом (8). 15) Відфільтрований осад сушили на роторному випарнику впродовж 19 год. при температурі 55 °C. 16) Одержали 3,787 кг Сполуки Ε у вигляді твердої речовини червоного кольору (неочищений продукт 3 №1). її природу було підтверджено 1 Н-ЯМР. Чистота, за результатами визначення засобами HPLC, дорівнювала 93,70 % а/а. На додаток до цього, спостерігалось також ІРС 3 №1 46 3,17+2,54 % цис-ізомерів. Вихід (пс) дорівнював 54,1 %. 17) Маточний розчин (приблизно 81 л) концентрували під незначним розрідженням при JT=100 °C. Видалили 30 л розчинника. Суміш перемішували при JT=110 °C впродовж 12,5 год. (IT дорівнювали приблизно 105 °C). 18) Суміш розбавили бутиленоксидом (9) та толуолом (10) і охолоджували до ІТ=20 °C (2,75 год.). Одержали суспензію червоного кольору. 19) Відібрали зразок для ІРС; зразок охолодили до температури 0 °C і відфільтрували. У продукті все ще забагато ТРРО (Ш-ЯМР) 20) Суміш розбавляли бутиленоксидом (11) та толуолом (12), нагрівали до JT=60 °C і знову охолоджували до ПГ=20 °C. 21) Відбирали відфільтрований зразок і промивали метанолом. ІРС 3 №2 Вміст ТРРО у продукті значно знизився ^Н-ЯМР) 11) Суспензію охолоджували до температури 1 °C впродовж 60 хв і фільтрували за допомогою фільтра-осушника впродовж 60 хв. 23) Відфільтрований осад промивали метилциклогексаном (13). 24) Відфільтрований осад двічі промивали метанолом (14+15). 25) Відфільтрований осад сушили на роторному випарнику впродовж 4,5 год. при температурі 55 °C. 26) Одержали 705 г неочищеного продукту у вигляді твердої речовини червоного кольору (не очищений продукт 2 №1). її природу було підтве1 рджено Н-ЯМР. Чистота, за результатами визначення засобами HPLC, дорівнювала 90,01 % а/а. На додаток до цього, за даними HPLC, спостерігалось також 3,83+5,34 % цис-ізомерів. Вихід (nс) дорівнював 10,1 %. Загальний виправлений вихід становив 63,0 %. Примітки 1) Співвідношення ізомерів, за даними HPLC, становило приблизно 60:40 транс/цис. Одержання зразка Контроль якості продукції у процесі ви- Перетворення: Приблизно 0,5 мл реакційної суміші відбирали, ви1 готовлення (ІРС): парювали і аналізували засобами Н-ЯМР або HPLC. 6-7 мг продукту аналізували засобами HPLC; метод HPLC-TSCЧистота: M1.1 5-10 мг продукту розчиняли у 0,9 мл CDCI3 (внутрішній стандарт: 1 Н-ЯМР TMS (тетраметилсилан)) для ЯМР-спектроскопії. Синтез ТКН зі Сполуки Е 47 Позиція 1 2 3 4 5 6 7 8 9 Реактив Сполука Ε Етанол 30 % NaOH Вода Етанол Вода Вода Вода Етанол 95903 Молекулярна маса 384,51 Методика 1) Із реактора місткістю 100 л відкачали газ, і реактор двічі продули азотом. 2) У реактор місткістю 100 л завантажили Сполуку Ε (1) при JT=20 °C. 3) Етанол (2) і 30 % NaOH (3) завантажили у реактор місткістю 100 л при JT=20 °C. Із реактора місткістю 100 л відкачали газ, і реактор двічі проIPC 1 №1 48 Еквівалент 1,0 Одиниця кількості 3,70кг 15,7 л 15,0 л 45 л 3,5 л 39 л 39 л 38 л 39 л дули азотом. Реакційну суміш нагрівали до JT=90 °C. Одержали густу суспензію оранжевого кольору. 4) Суспензію перемішували при JT=90 °C впродовж 63 год. (IT дорівнювали 81 °C). 5) Суміш охолоджували до ІТ=21 °C впродовж 2 год. Відібрали зразок для ІРС. 98,7 % перетворення складного моноефіру на ТКН (HPLC); складного діефіру (Сполука Е) не виявлено 6) Суміш розбавляли водою (4). 7) Суспензію фільтрували за допомогою фільтра-осушника впродовж 15 год. 8) Для промивання реактора місткістю 100 л застосували етанол (5). 9) Відфільтрований осад тричі промивали холодною водою (6,7+8) при температурі у межах 0 °C-5 °C. 10) Відфільтрований осад промивали етанолом (9). 11) Відфільтрований осад сушили на роторному випарнику впродовж 5 год. при температурі 50 °C. 12) Одержали 2,186 кг ТКН у вигляді твердої речовини оранжевого кольору. Її природу було 1 підтверджено Н-ЯМР. Чистота, за результатами визначення засобами HPLC, дорівнювала 97,96 % а/а. Вихід (nс) дорівнював 61,2 %; дивись Примітку 1. Вміст води становив 1,58 % (мас), УФ-співвідношення 421 нм/254 нм дорівнювало 8,9. Аналітичне обчислення для C20H22О4Na2 0,34H2О: С, 63,47; Η, 6,04; Na, 12,15; О, 18,35. Встановлено: С, 63,81; Η, 5,64; Na, 12,21; О, 18,34. 13) 2,184 кг неочищеного продукту 1 №1 перемішували у мішалці впродовж 4 днів при кімнатній температурі. Шматки, що залишились, легко подрібнювались товкачиком. Одержали 2,183 кг неочищеного продукту 2 №1 (який відповідав АА013329-Партія-01-2004) у вигляді твердої речовини оранжевого кольору. Чистота, за результатами визначення засобами HPLC, дорівнювала 98,76 % а/а. При визначенні засобами DSC різниці не виявили. Примітки 1) Продукт розчинний у воді. Таким чином, тривала фільтрація, а також додаткове промивання водою могли обумовити низький вихід, що спостерігався у цій конкретній ситуації. Для приведення у відповідність бажаного вмісту натрію у продукті здійснили третє промивання. Одержання зразка Контроль якості продукції у процесі виготовлення Перетворення: Приблизно 0,5 мл реакційної суміші (ІРС): відбирали і аналізували засобами HPLC. 6-7 мг продукту аналізували засобами HPLC; метод Чистота: HPLC-TSC-M1.2 5-10 мг продукту розчиняли у 0,9 мл D2O для ЯМР1 Н-ЯМР спектроскопії. Аналітична частина HPLC методи Метод: Замінює метод: Метод придатний для: Хімікалії: HPLC-TSC-M.1.2. HPLC-TSC-M.1.1. С-009594, Сполуки А, ТКН, Сполуки D, Сполуки Ε Ацетонітрил, хроматографічна чистота (компанія J.T.Baker або еквівалент) Вода, хроматографічна чистота (очищена на системі Milli-Q або еквівалент) Трифтороцтова кислота (компанія Merck або еквівалент) Тетрагідрофуран, хроматографічна чистота, без стабілізатора (компанія Scharlau або еквівалент) МеОН, хроматографічна чистота (компанія Scharlau або еквівалент) 49 95903 Обладнання: 50 Система HP-1100 або еквівалент Колонка: YMC Pack Pro С18,100 × 4,6 мм, 3 мкм Одержання рухомої фази: Розчин А: Розчин В: Одержання зразків: Змішувальні розчинники: C-009594,C-013327: C-014679: 0,1 % TFA у H2O/ACN 90:10 % (у об'ємному відношенні) CAN (церійнітрат амонію) THF, МеОН, Н2О, ACN 6-7 мг (точно відважених) неочищеного матеріалу розчиняють у МеОН 6-7 мг (точно відважених) неочищеного матеріалу розчиняють у ACN і доповнюють водою до 100 мл 6-7 мг (точно відважених) неочищеного матеріалу розчиняють у 100 мл THF 6-7 мг (точно відважених) неочищеного матеріалу розчиняють у 10 мл Н2О і доповнюють THF до 100 мл C-014681: C-013329: Параметри HPLC: Колонка: Рухома фаза: YMC Pack Pro C18,100×4,6 мм, 3 мкм А: 0,1 % TFA у H2O/ACN 90:10 % (у об'ємному відношенні) В: ACN 0,00 хв 30 % В 12,00 хв 95 % В 16,00 хв 95 % В 16,10 хв 30 % В 20,00 хв 30 % В 1 мл/хв 20 °C 421 нм (якщо дозволяє детектор: 220 нм, 230 нм, 254 нм і 350 нм на додаток) 10 мкл Градієнт: Об'ємна швидкість потоку: Температура: Детектування: Об'єм введення: Інтеграційні параметри: Дані відсутні Ідентифікаційна таблиця для наведених нижче HPLC слідів: Час утримування* [хв] 3,54 4,47 4,99 6,90 14,30 Молекулярна маса [г/моль] 469 164 278 372 384 Запропоновані структури/номери С Сполука D Сполука А С-009594 ТКН Сполука Ε Відносний час утримування 0,51 0,65 0,72 1,00 2,07 *Типовий час утримування для G-1172 з колонкою LC-0402 УФ методи - Модифікований метод для цього синтезу: Метод: Замінює метод: Метод придатний для: Хімікалії: Обладнання: УФ параметри: Одержання зразків: Передісторія документу і методу: Приклад 3 Синтез транс-кроцетинату калію (дикалій2,6,11,15-тетраметилгексадека2Е,4Е,6Е,8Е,10Е,12Е,14Е-гептан-1,16-діотат) UV-TSC-M.2.1. ТКН Вода, хроматографічна чистота (очищена на системі Milli-Q або еквівалент) Система Lambda25 компанії Perkin Elmer або еквівалент Кювета: 1 см кварцеве скло Довжина хвилі: 421 нм; 350 нм; 254 нм; 10 мг (точно відважені) розчиняли у 50 мл води. Зразок піддавали ультразвуковій обробці впродовж 30 хв при температурі 45 °C-50 °C. 1 мл цього розчину розбавляли додатковими 49 мл води (із доведенням загального об'єму розчину до 50 мл). Одержання зразка за індивідуальним методом, модифікованим для забезпечення можливості здійснення вимірів у межах лінійного діапазону. Транс-кроцетинат калію нижче називають також ТРС або Сполукою F. Нижче наведена схема хімічного синтезу. 51 95903 52 Реакцію омилення (остання стадія синтезу) було здійснено у спосіб, подібний до процесу, який було застосовано у наведених вище Прикладі 1 і Прикладі 2. Діетиловий складний ефір, Сполуку Е, одержали, як було описано вище у Прикладі 1 і Прикладі 2. Для цього прикладу, Сполуку Ε обробляли 30 % розчином гідроксиду калію (КОН) (1,5 мл/ммоль) у етанолі (EtOH) (1,5 мл/ммоль) при температурі 90 °C впродовж 4 днів. Суміш розбавляли етанолом унаслідок деякої втрати розчинника під час проходження процесу. Продукт оранжевого кольору виділяли шляхом фільтрування при кімнатній температурі (22 °C) і промиванням 50 % розчином етанолу у воді (3×). Одержаний продукт сушили на роторному випарнику впро довж 5 год. при JT=60 °C. Вихід реакції становив 1 86 % (партія 12 г). Спектр Н-ЯМР і спектр LC-MS підтвердили те, що бажаний продукт являв собою тряис-кроцетинат калію. Чистота за даними HPLC становила 98,3 % із визначенням за методом HPLC, опис якого було наведено вище у Прикладі 2, при довжині хвилі детектування 421 нм. Приклад 4 Синтез транс-кроцетинату літію (дилітій2,6,11,15-тетраметилгексадека2Е,4Е,6Е,8Е,10Е,12Е,14Е-гептан-1,16-діотат) Транс-кроцетинат літію нижче називають також TLC або Сполукою G. Нижче наведена схема хімічного синтезу. Реакцію омилення було здійснено у спосіб, подібний до процесу, який було застосовано у Прикладах 1-3. У цьому разі, однак, гідроксид літію було застосовано як омилювальний агент. У цьому прикладі Сполуку Ε було знову синтезовано, як описано у Прикладі 1 і Прикладі 2. Сполуку 53 95903 54 Ε обробляли 10 % розчином гідроксиду літію (LiOH) (2,8 мл/ммоль) у етанолі (EtOH) (1,5 мл/ммоль) при температурі 90 °C впродовж 4 днів. Суспензію темно-оранжевого кольору фільтрували при кімнатній температурі (22 °C) і промивали 50 % розчином етанолу у воді (3×) та чистим етанолом. Тверду речовину темнооранжевого кольору сушили на роторному випарнику впродовж 5 год. при температурі оболонки (JT)=60 °C. Унаслідок цього одержали 9,5 г твердої речовини темно-оранжевого кольору. HPLC аналіз цієї сполуки показав, окрім бажаного продукту, залишок 38 % а/а вихідного матеріалу. Значна кількість вихідного матеріалу, що залишився, є, ймовірно, результатом застосування у цій реакції омилення основного розчину (LiOH) меншої концентрації. У цьому випадку, приймаючи до уваги обмежену розчинність LiOH у воді, було застосовано лише 10 % розчин LiOH у воді. У інших прикладах (1-3, опис яких наведено), було застосовано 30 % основний розчин у воді. Для поліпшення виходу реакції, виділений продукт попередньої стадії обробляли твердим LiOH (13 екв.) у 50 % розчині EtOH у воді (2,9 мл/ммоль) при температурі 95 °C впродовж 2 додаткових днів. Продукт оранжевого кольору, який одержали унаслідок другої згаданої обробки гідроксидом літію, виділяли шляхом фільтрування при кімнатній температурі і промиванням 50 % розчином EtOH у воді (3×) та чистим EtOH. Тверду речовину, яку одержали, сушили на роторному випарнику впродовж 3 год. при температурі оболонки=60 °C. Вихід продукту дорівнював 14 г. Оскільки це перевищувало теоретичний вихід, готували додаткову суспензію у воді (1,6 мл/ммоль) для видалення надлишку LiOH. Продукт оранжевого кольору виділяли шляхом філь трування при кімнатній температурі і промиванням 50 % розчином EtOH у воді (3×) та чистим EtOH. Продукт сушили на роторному випарнику впродовж 2 год. при температурі оболонки=60 °C. Вихід дорівнював 8,5 г, завдяки чому загальний вихід реакції становив 67 % (партія 12 г). 1 Спектри Н-ЯМР і LC-MS підтвердили, що одержали бажаний продукт, транс-кроцетинат літію. Чистота за даними HPLC становила 99,7 % із визначенням за аналітичною методикою, опис якої було наведено вище у Прикладі 1, при довжині хвилі детектування 421 нм. Приклад 5 Синтез С14 похідної ТКН (динатрій-4,9диметилдодека-2Е,4Е,6Е,8Е,10Е-пентан-1,12діотат) Синтез симетричних сполук із коротшим, аніж у ТКН, ланцюгом, потребує застосування різних агентів Віттіга, окрім Сполуки В, яку показано у Прикладах 1-4. Сполуки БТКС із коротшим ланцюгом синтезують із застосуванням Сполуки А, С10-діальдегіду, яку застосовували раніше. Сполуку А після цього перетворюють за допомогою реакції Хорнера-Еммонса або реакції сполучення Віттіга із застосуванням комерційно доступного С2-або С3-фосфонату чи броміду фосфонію (Сполука Н) з одержанням відповідних складних ефірів С14 і С16, відповідно. Гідроліз за допомогою NaOH/EtOH завершував реакцію, наслідком якої було одержання бажаних С14 або С16 похідних ТКН. Синтез С14 похідної ТКН, Сполуки J, завершували реакцією Сполуки А і Сполуки Η (етоксикарбонілметилтрифенілфосфонійбромід). Сполука А і Сполука Η реагували з утворенням кінцевої проміжної хімічної сполуки, Сполуки І, перед стадією омилення, наслідком якої є одержання Сполуки J, як показано нижче. Реакція сполучення для одержання Сполуки І Найкращий спосіб одержання Сполуки І полягав у застосуванні С2-фосфонійброміду (Спо лука Н). Цю реакцію сполучення здійснювали у суміші бутиленоксиду/толуолу 2:1 (0,7 мл+1,4 мл/ммоль), яку було застосовано у наведених 55 95903 56 1 вище Прикладах 1-4. Наслідком було добре утворення продукту з З екв. реактиву Віттіга при температурі оболонки=100 °C. Продукт жовтого кольору виділяли шляхом фільтрування при температурі 0 °C із подальшим промиванням (двічі) метилциклогексаном. Вихід цієї стадії дорівнював 56-61 % (партія 10 г). Ступінь чистоти, за визначенням засобами HPLC, дорівнював 83,4 % а/а транс-ізомеру при довжині хвилі детектування 369 нм (11,5 хв). У HPLC слідах, окрім Сполуки І, спостерігалась присутність трьох додаткових сполук, які, як вважають, були цис-ізомерами Сполуки І (1,0 % а/а, 10,5 хв; 13,4 % а/а, 11,2 хв; 2,0 % а/а, 11,9 хв). Реакція омилення для одержання кінцевого продукту (Сполуки J) Реакцію омилення для перетворення Сполуки І на Сполуку J було здійснено у спосіб, подібний до способу, опис якого було наведено у Прикладах 1-4. Діетиловий складний ефір, Сполуку І, обробляли 30 % розчином NaOH (2 мл/ммоль) у EtOH (4 мл/ммоль) при температурі 90 °C впродовж 3 днів. Продукт жовтого кольору виділяли шляхом фільтрування при кімнатній температурі і промиванням 50 % розчином EtOH у воді (5×) і чистим EtOH (3×). Вихід неочищеного продукту реакції омилення становив приблизно 100 %. Для підвищення ступеня чистоти суміш суспендували у 30 % розчині NaOH (0,5 мл/ммоль) у EtOH 912 мл/ммоль) при температурі 90 °C впродовж 4 год. Суспензію фільтрували при температурі 0 °C і промивали EtOH (3×) з одержанням продукту жовтого кольору, невиправлений вихід якого ста новив 79 % (10 г партія). Н-ЯМР підтвердив синтез бажаного продукту, Сполуки J, з чистотою 97,8 % (за даними HPLC), при довжині хвилі детектування 383 нм. Приклад 6 Синтез С15 похідної ТКН (динатрій-2,4,9триметилдодека-2Е,4Е,6Е,8Е,10Е-пентен-1,12діотат) Сполуку А вводили в реакцію зі Сполукою К (1-(етоксикарбоніл)етилтрифенілфосфонійбромід), С3 сіллю фосфонію/С3-бромідом складного ефіру Віттіга, для одержання першої проміжної сполуки у цій послідовності реакцій, Сполуки М. За альтернативним варіантом, на цій першій стадії такий самий результат можна одержати у разі реакції Сполуки А зі Сполукою L (триетил-2-фосфонопропіонатом), С3 складним ефіром фосфонової кислоти, з одержанням проміжної Сполуки М. У другій реакції сполучення, Сполуку Μ вводять у реакцію зі Сполукою Η (етоксикарбонілметилтрифенілфосфонійбромід) С2 сіллю фосфонію/С2-бромідом складного ефіру Віттіга, з одержанням передостанньої проміжної сполуки, Сполуки О. За альтернативним варіантом, Сполуку О можна одержати шляхом реакції між Сполукою Μ і Сполукою N (триетилфосфоноацетат), С2 складним ефіром фосфонової кислоти. На кінцевій стадії реакції Сполуку О піддають реакції омилення з одержанням С15, асиметричної похідної ТКН, Сполуки Р. Схему реакції показано на наведеній нижче фігурі. C15 похідна потребує послідовного застосування двох різних реакцій моносполучення; першої реакції з С3 складним ефіром фосфонової кислоти або фосфонію бромідом і другої реакції з С2-фосфонію бромідом. Унаслідок утворення деякої кількості С16-діетилового складного ефіру, неочищений продукт першої реакції моносполу чення очищали шляхом хроматографування на силікагелі. Перша реакція сполучення для одержання Сполуки Μ Сполуку А обробляли 1 екв. С3фосфонійброміду (Сполука К) при температурі 100 °C впродовж 1 дня. Цю реакцію сполучення здійснювали у суміші бутиленоксиду/толуолу 2:1 57 (0,7 мл+1,4 мл/ммоль), і вона продемонструвала добре утворення продукту. При охолодженні до кімнатної температурі і, у подальшому, до температури 0 °C, утворення осаду не спостерігалось. Після цього суміш оранжевого кольору фільтрували на силікагелі (0,33 г/ммоль). Відфільтрований осад промивали толуолом (1,7 мл/ммоль). Фільтрати об'єднували і випарювали досуха при JT=45 °C з одержанням неочищеного продукту, який виглядав як олія оранжевого кольору. Після цього реакційну суміш випарювали досуха. Залишок суспендували у МеОН з одержанням неочищеного продукту у твердій формі, після чого промивали МеОН (3×). Одержана кількість неочищеного продукту була незначною унаслідок присутності С16-діетилового складного ефіру, окрім бажаного С13 продукту реакції моносполучення, Сполуки М. Після цього здійснили стадію очищення на силікагелі із застосуванням розчину метилциклогексану/ЕtOАс (10:1). Неочищений продукт розчиняли у дихлорметані (0,3 мл/г неочищеного продукту). Першою сполукою, яка елюювалась, був С16-діетиловий складний ефір (приблизно 7 %). Після завершення цієї стадії вихід дорівнював 45 % (20 г партія). У разі більш дрібносерійного виробництва, виходи досягали 70 %. Було визначено, що продукт найвищого ступеня чистоти містив 98,1 % а/а транс-ізомеру при довжині хвилі детектування 383 нм (9,22 хв). Була присутня додаткова сполука (1,7 % а/а, 9,47 хв), якою, як гадають, був цис-ізомер Сполуки М. Друга реакція сполучення для одержання Сполуки О Сполуку Μ обробляли 1,5 екв. С2фосфонійброміду (Сполука Н) при температурі 100 °C. Цю реакцію сполучення здійснювали у суміші бутиленоксиду/толуолу 2:1 (0,5 мл + 1,0 мл/ммоль), і вона продемонструвала добре утворення продукту. Продукт жовтого кольору виділяли шляхом фільтрування при температурі 0 °C і подвійного промивання метилциклогексаном. Вихід на цій стадії дорівнював 36 %. Для підвищення виходу маточний розчин концентрували до приблизно половини його вихідного об'єму і охолоджували до температури 0 °C для одержання другого збору з виходом 27 %. Загальний вихід обох об'єднаних зборів дорівнював 63 % (партія 13 г). 95903 58 Було визначено, що продукт найвищого ступеня чистоти (Сполука О) містив 87,0 % а/а транс-ізомеру при довжині хвилі детектування 383 нм (12,4 хв). На додаток до цього, у HPLC сліді була виявлена друга сполука (11,3 % а/а, 11,8 хв), якою міг бути цис-ізомер Сполуки О. Реакція омилення для одержання кінцевого продукту (Сполуки F) Діетиловий складний ефір, Сполуку О, обробляли 30 % розчином NaOH (2 мл/ммоль) у EtOH (4 мл/ммоль) при температурі 90 °C впродовж 3 днів. Продукт зеленувато-жовтого кольору виділяли шляхом фільтрування при кімнатній температурі і промивання 50 % розчином EtOH у воді (5×) та EtOH (3×). Вихід реакції омилення дорівнював 83 % (партія 6 г). 1 Н-ЯМР спектр підтвердив природу бажаного продукту, Сполуки Р. Ступінь чистоти за даними HPLC становив 97,0 % Сполуки Ρ при довжині хвилі детектування 383 нм. На додаток до цього, були помічені інші можливі цис-ізомери, які відповідали 1,4 % а/а + 1,2 % а/а. Дані LC-MS підтвердили наведену структуру. Приклад 7 Синтез С16 похідної ТКН (динатрій-2,4,9,11тетраметилдодека-2Е,4Е,6Е,8Е,10Е-пентен-1.12діотат) Сполуку А вводили у реакцію зі Сполукою L (триетил-2-фосфонопропіонат), С3 складним ефіром фосфонової кислоти, для одержання критичної проміжної сполуки у цьому синтезі, Сполуки Q. За альтернативним варіантом, Сполуку Q можна одержати шляхом реакції між Сполукою А і Сполукою К (1(етоксикарбоніл)етилтрифенілфосфонійбромід), С3 сіллю фосфонію/С3-бромідом складного ефіру Віттіга. Незважаючи на те, що початкові реагенти (Сполука А, Сполука К та Сполука L) є такими самими, що і у Прикладі 6, застосовані у цьому разі умови реакції давали іншу, симетричну проміжну сполуку, Сполуку Q. На кінцевій стадії реакції, Сполуку Q вводять у реакцію омилення з гідроксидом натрію та етанолом з одержанням кінцевого продукту, Сполуки R. Сполука R (динатрій-2,4,9,11тетраметиддодека-2Е,4Е,6Е,8Е,10Е-пентен-1,12діотат) являє собою С16, симетричну похідну ТКН. Схему реакції показано на наведеній нижче фігурі. 59 Реакція сполучення для одержання Сполуки Q (із застосуванням Сполуки L як реагенту) Синтез С16 похідної (Сполука R) розпочинали у спосіб, подібний до наведеного у Прикладі 6 - реакція сполучення міжСполукою А і Сполукою L. Сполуку А обробляли Сполукою L при температурі 100 °C у суміші толуолу/бутиленоксиду 2:1. У цьому випадку хімічна реакція не відбувалась без додання основи; суміш охолоджували до температури 0 °C і додавали NaOMe (3 екв.). До реакційної суміші додавали другу порцію реагенту, який двічі одержали з розчину С3 складного ефіру фосфонової кислоти (2×1,5 екв.) та NaOMe у DCM. Суміш перемішували при JT=65 °C з одержанням більшого відсотка бажаних продуктів. Сліди HPLC вказали на залишок лише невеликого відсотка Сполуки А, що не прореагувала (2,3 % а/а). Реакційну суміш охолоджували водою, і органічну фазу промивали розчином, до складу якого входили: вода, насичений розчин NaНСО3 і 50 % насичений розчин NaCl. Після випарювання одержали 36,4 г Сполуки Q. Сполуку Q очищали на силікагелі із застосуванням суміші метилциклогексану/EtOAc 10:1. Одержали 0,26 г продукту світло-жовтого кольору (Сполука Q) і 4,0 г твердої речовини жовтого кольору (Сполука М). Продукт переестерифікації, Сполуку Q, (диметиловий складний ефір замість діетилового складного ефіру) виділили з виходом 32 % із застосуванням МеОН як розчинника. Для цієї реакції сполучення придатним був би також спиртовий розчинник. Взагалі, якість продукту цієї стадії була надзвичайно високою при чистоті 85,7 %. За результатами HPLC, більшістю домішків були цис-ізомери Сполуки Q. Реакція сполучення для одержання Сполуки Q (із застосування Сполуки К як реагенту) У другому експерименті із синтезу Сполуки Q, Сполуку L у реакції сполучення замінили на Сполуку К. Ця заміна забезпечила краще загальне перетворення реакційної суміші. Реакцію сполучення між Сполукою А і Сполукою К здійснювали у суміші бутиленоксиду/толуолу 2:1 (0,9 мл + 1,8 мл/ммоль), і спостерігали добре утворення про 95903 60 дукту з 3 екв. реактиву Віттіга при JT=100 °C (22 год.). Продукт жовтого кольору виділяли шляхом фільтрування при температурі 0 °C і подвійного промивання метилциклогексаном. Вихід дорівнював 61-62 % (10 г партія). Чистота Сполуки Q за результатами HPLC аналізу дорівнювала 85,2 % а/а транс-ізомеру при 369 нм (13,3 хв), де головною домішкою був цис-ізомер. Реакція омилення для одержання кінцевого продукту (Сполуки R) Реакцію омилення для одержання Сполуки R було здійснено у спосіб, подібний до способу, опис якого було наведено у Прикладі 5. Діетиловий складний ефір (Сполука Q) обробляли 30 % розчином NaOH (2 мл/ммоль) у EtOH (4 мл/ммоль) при температурі 90 °C впродовж 3 днів. Вихід реакції омилення дорівнював 85 % (12,5 г партія) після фільтрування при кімнатній температурі і промивання 50 % розчином EtOH у 1 воді (3×) та EtOH (3×). Н-ЯМР спектр підтвердив, що бажаним продуктом була Сполука R. Ступінь чистоти за даними HPLC становив 95,7 % при довжині хвилі детектування 383 нм. На додаток до цього, спостерігали 3,8 % цис-ізомеру. Дані LC-MS підтвердили наведену структуру. Приклад 8 Синтез С17 похідної ТКН (динатрій-2,6,11триметилтетрадека-2Е,4Е,6Е,8Е,10Е,12Е-гексен1,14-діотат) Одержання асиметричної похідної ТКН з довшим ланцюгом здійснювали із застосуванням Сполуки А і Сполуки D як вихідних матеріалів, як у Прикладах 1-2. У цьому разі, однак, умови реакції були змінені для сприяння утворенню першої проміжної сполуки реакції сполучення, Сполуки S. Після цього Сполука S реагувала у другій реакції сполучення зі Сполукою Η з одержанням Сполуки Т. На кінцевій стадії цієї послідовності реакцій, Сполуку Τ піддавали реакції омилення із застосуванням гідроксиду натрію та етанолу з одержанням кінцевого бажаного продукту, Сполуки U. Сполука U являє собою С17 похідну ТКН і є асиметричною за положенням бічних метальних груп довкола дієнового каркаса. Подробиці
ДивитисяДодаткова інформація
Назва патенту англійськоюTrans carotenoids, their synthesis, formulation and uses
Автори англійськоюGainer John L., Lanz Marc
Назва патенту російськоюТранс-каротиноиды, их синтез, лекарственная форма и применение
Автори російськоюГейнер Джон Л., Ланц Марк
МПК / Мітки
МПК: C07C 59/00
Мітки: лікарська, застосування, транс-каротиноїди, форма, синтез
Код посилання
<a href="https://ua.patents.su/39-95903-trans-karotinodi-kh-sintez-likarska-forma-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Транс-каротиноїди, їх синтез, лікарська форма та застосування</a>
Попередній патент: Спосіб збільшення часу розвитку захворювання або виживаності у ракових пацієнтів
Наступний патент: Спосіб та пристрій для очищення топкового газу з агломераційних установок
Випадковий патент: Спосіб виділення та підрахунку формених елементів на електронних мікрофотографіях циркулюючої крові (мазків крові)












