Заміщені піразоли, композиція, що їх містить, спосіб їх одержання і застосування
Номер патенту: 97965
Опубліковано: 10.04.2012
Автори: Додсон Марк, Може Жак, Наір Аніл, Патек Марсель, Табар Мішель, Б'єргард Кірстен
Формула / Реферат
1. Сполука загальної формули (І):
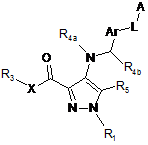 , (I)
, (I)
в якій:
А і Аr незалежно вибирають з групи, яка складається з: арилу, гетероарилу, заміщеного арилу, заміщеного гетероарилу;
L вибирають з групи, що складається з: NH-CO-NH і O-CO-NH;
R1 вибирають з групи, що складається з: Н, R6, COR6, SO2R6, де R6 вибирають з Н, OR7, NR8R9, алкілу, циклоалкілу, гетероциклілу, заміщеного гетероциклілу, арилу, заміщеного арилу, гетероарилу, заміщеного гетероарилу, де R7 вибирають з Н, фенілу, алкілу і де R8 і R9 незалежно вибирають з групи, що складається з: Н, алкілу, циклоалкілу, гетероциклілу, заміщеного гетероциклілу, арилу, заміщеного арилу, гетероарилу, заміщеного гетероарилу, або ж R8 і R9 зв'язані між собою, утворюючи насичений 5-8-членний цикл, що містить від 0 до 3 гетероатомів, вибраних з О, S і N;
X вибирають з групи, що складається з: О і NH;
R3 вибирають з групи, що складається з: Н, алкілу, заміщеного алкілу, циклоалкілу, заміщеного циклоалкілу;
R4a вибирають з групи, що складається з: Н або (С1-С4)алкілу;
R4b вибирають з групи, що складається з: Н або (С1-С4)алкілу;
R5 вибирають з групи, що складається з: Н, галогену, R10, CN, O(R10), OC(O)(R10), OC(O)N(R10)(R11), OS(O2)(R10), N(R10)(R11), N=C(R10)(R11), N(R10)C(O)(R11), N(R10)C(O)O(R11), N(R12)C(O)N(R10)(R11), N(R12)C(S)N(R10)(R11), N(R10)S(O2)(R11), C(O)(R10), C(O)O(R10), C(O)N(R10)(R11), C(=N(R11))(R10), C(=N(OR11))(R10), S(R10), S(O)(R10), S(O2)(R10), S(O2)O(R10), S(O2)N(R10)(R11); де кожний з R10, R11, R12 незалежно вибирають з групи, що складається з Н, алкілу, алкілену, алкінілу, арилу, гетероарилу, циклоалкілу, гетероциклілу, заміщеного алкілу, заміщеного алкілену, заміщеного алкінілу, заміщеного арилу, заміщеного гетероарилу, заміщеного циклоалкілу, заміщеного гетероциклілу.
2. Сполука за п. 1, яка відрізняється тим, що R4a і R4b означають Н.
3. Сполука за п. 1, яка відрізняється тим, що R4a означає Н і R4b означає (С1-С4)алкіл.
4. Сполука за п. 1, яка відрізняється тим, що R4a означає (С1-С4)алкіл і R4b означає Н.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що R1 означає Н.
6. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що R3 означає Н і X означає NH.
7. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що R3 означає метил і X означає О.
8. Сполука за будь-яким з пп. 1-7, яка відрізняється тим, що R5 означає Н.
9. Сполука за будь-яким з пп. 1-8, яка відрізняється тим, що L означає NHCONH.
10. Сполука за будь-яким з пп. 1-9, яка відрізняється тим, що Ar-L-A означає:
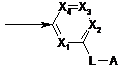 ,
,
де кожну групу Х1, Х2, Х3 і Х4 незалежно вибирають з N і C-R'5, де R'5 має те ж значення, що і R5.
11. Сполука за п. 10, яка відрізняється тим, що R'5 вибирають з групи, яка складається з Н, F, Сl, метилу, NH2, OCF3 і CONH2.
12. Сполука за п. 9, яка відрізняється тим, що А вибирають з фенілу, піразолілу і ізоксазолілу; можливо, заміщеного.
13. Сполука за будь-яким з пп. 1-12, яка відрізняється тим, що А заміщують одним або декількома замісниками, вибраними з групи, що складається з: Н, F, Сl, Br, I, OH, SH, SO3M, СООМ, СОО-алкілу, CON(R14)(R15), CN, NO2, N(R14)CO(R15), N(R14)(R15), алкілу, галогенвмісного алкілу, алкіл-ОН, aлкіл-N(R14)(R15), алкіл-(R16), алкіл-СООМ, алкіл-SО3М, циклоалкілу, алкілену, алкінілу, арилу, гетероарилу, О-алкілу, О-арилу, О-гетероарилу, S-алкілу, S-арилу і S-гетероарилу, причому, кожна група, можливо, заміщена замісником, вибраним з алкілу, галогену, О-алкілу, N(R14)(R15); де R14 і R15 незалежно вибирають з Н, алкілу, алкіл-ОН, галогенвмісного алкілу, алкіл-NH2, алкіл-СООМ, алкіл-SО3М; причому, коли R14 і R15 одночасно відмінні від Н, вони можуть бути зв'язані між собою, утворюючи 5-7-членний цикл, що містить від 0 до 3 гетероатомів, вибраних з О, N і S; де М означає Н або катіон лужного металу, вибраного з Li, Na і K; і де R16 означає Н або неароматичний гетероцикл, можливо, заміщений, який містить 2-7 атомів вуглецю і від 1 до 3 гетероатомів, вибраних з N, О і S; коли група А є дизаміщеною, обидва замісники можуть бути зв'язані між собою, утворюючи 5-7-членний цикл, що містить від 0 до 3 гетероатомів, вибраних з N, О і S.
14. Сполука за п. 13, яка відрізняється тим, що група А заміщена одним або декількома замісниками, вибраними з групи, доповненої SiMe3, S-CHF3 і SF5.
15. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що вона вибрана з групи:
трифторацетат 4-{[({[3-феніл]карбамоїл}окси)бензил]аміно}-1Н-піразол-3-карбоксаміду;
хлоргідрат 4-{[3-({[2-фтор-5-(трифторметил)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(2-фторфеніл)карбамоїл]аміно}бензил)аміно]-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(2-метоксифеніл)карбамоїл]аміно}бензил)аміно]-1H-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[2-фтор-3-(трифторметил)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(3-метоксифеніл)карбамоїл]аміно}бензил)аміно]-1H-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[3-фтор-5-(трифторметил)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[4-(трифторметокси)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат метил-3-{[(3-{(3-карбамоїл-1Н-піразол-4-іл)[аміно]метил}феніл)карбамоїл]аміно}бензоату;
трифторацетат 4-{[3-({[4-(трифторметил)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[3-(трифторметил)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[2-(трифторметил)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(3,5-диметоксифеніл)карбамоїл]аміно}бензил)аміно]-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(3-метилфеніл)карбамоїл]аміно}бензил)аміно]-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(4-метоксифеніл)карбамоїл]аміно}бензил)аміно]-1H-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(4-фторфеніл)карбамоїл]аміно}бензил)аміно]-1Н-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[4-хлор-3-(трифторметил)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[4-(дифторметокси)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[2-хлор-4-(трифторметил)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[({3-{(4-метилфеніл)карбамоїл}аміно}бензил)аміно]-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(2,5-диметилфеніл)карбамоїл]аміно}бензил)аміно]-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(3,4-диметилфеніл)карбамоїл]аміно}бензил)аміно]-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(2-метилфеніл)карбамоїл]аміно}бензил)аміно]-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(3-етилфеніл)карбамоїл]аміно}бензил)аміно]-1H-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[3,5-біс(трифторметил)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(3-фторфеніл)карбамоїл]аміно}бензил)аміно]-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(2-метокси-5-метилфеніл)карбамоїл]аміно}бензил)аміно]-1H-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(2,5-диметоксифеніл)карбамоїл]аміно}бензил)аміно]-1H-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[3-хлор-4-(дифторметокси)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-[(3-{[(2,5-дифторфеніл)карбамоїл]аміно}бензил)аміно]-1Н-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[4-метил-3-(трифторметил)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду;
трифторацетат 4-{[3-({[2-фтор-5-(трифторметил)феніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-метилкарбоксилату.
16. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що вона являє собою:
трифторацетат 4-(1-{3-[3-(2-фтор-5-трифторметилфеніл)уреїдо]фенілетиламіно}-1Н-піразол-3-карбоксаміду;
4-({3-[3-(2-фтор-5-трифторметилфеніл)уреїдо]бензил}метиламіно)-1Н-піразол-3-карбоксамід;
4-(етил-{3-[3-(2-фтор-5-трифторметилфеніл)уреїдо]бензил}аміно)-1Н-піразол-3-карбоксамід;
4-({3-[3-(2-хлор-5-трифторметилфеніл)уреїдо]бензил}метиламіно)-1H-піразол-3-карбоксамід;
4-{3-[3-(4-трифторметилпіридин-2-іл)уреїдо]бензиламіно}-1Н-піразол-3-карбоксамід;
4-{3-[3-(4-метоксипіридин-2-іл)уреїдо]бензиламіно}-1Н-піразол-3-карбоксамід;
4-{[3-({[3-хлор-4-фторфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[3,4-дихлорфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[3-хлор-5-трифторметилфеніл]карбамоїл}аміно)бензил]аміно}-1H-піразол-3-карбоксамід;
4-{[3-({[3-триметилсиліл-4-фторфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[3-трифторметоксифеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[3-трифторметил-4-хлорфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[2-хлор-5-трифторметилфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[3-трифторметилсульфанілфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[3-ізопропілфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[3-ізопропіл-4-фторфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[3-пентафторсульфанілфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[2-метокси-5-третізобутилфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[4-ізопропілфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[2-хлор-4-ізопропілфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[2-фтор-5-метилфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[2-фтор-4-трифторметилфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[2-фтор-4-метилфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
4-{[3-({[2-хлор-4-метилфеніл]карбамоїл}аміно)бензил]аміно}-1H-піразол-3-карбоксамід;
4-{[3-({[2-хлор-5-метилфеніл]карбамоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксамід;
(RS)-4-(1-{3-[3-(2-хлор-4-трифторметилфеніл)уреїдо]феніл}етиламіно)-1Н-піразол-3-карбоксамід.
17. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що вона знаходиться в формі:
1) нехіральній, або
2) рацемічній, або
3) збагаченій енантіомером;
і що вона, можливо, перетворена в сіль.
18. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-17 в комбінації з фармацевтично прийнятним ексципієнтом.
19. Застосування сполуки за будь-яким з пп. 1-17 як агента, який інгібує одну або декілька реакцій, що каталізуються кіназою.
20. Застосування сполуки за п. 19, при якому кіназу вибирають з KDR і Тіе2.
21. Застосування сполуки за будь-яким з пп. 1-17 у виробництві лікарського засобу, придатного для лікування патологічного стану.
22. Застосування за п. 21, яке відрізняється тим, що патологічним станом є рак.
23. Спосіб одержання сполуки загальної формули (Іb):
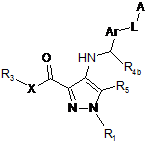 , (Ib)
, (Ib)
в якій R1, R3, R4b, R5, X, Ar, L і А мають значення, визначені в пункті 1, і R4a означає Н, який відрізняється тим, що сполуку загальної формули (II):
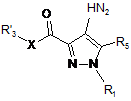 , (II)
, (II)
в якій R'3 означає R3 або попередник R3, і X, R1, R3 і R5 мають значення, визначені в п. 1, піддають взаємодії зі сполукою формули (III):
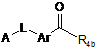 , (III)
, (III)
в якій R4b, Ar, L і А мають значення, визначені в п. 1,
з одержанням сполуки загальної формули (Іb).
24. Спосіб одержання сполуки загальної формули (І):
 , (I)
, (I)
в якій R1, R3, R4a, R4b, R5, X, Ar і А мають значення, визначені в п. 1, і L означає NHCONH, який відрізняється тим, що сполуку загальної формули (VIII):
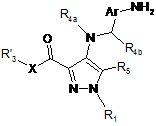 , (VIII)
, (VIII)
в якій R'3 означає R3 або попередник R3, і X, Ar, R1, R3, R4a, R4b і R5 мають значення, визначені в п. 1,
піддають взаємодії зі сполукою наступної загальної формули (VII):
![]() , (VII)
, (VII)
в якій А має значення, визначене в п. 1,
з одержанням сполуки загальної формули (I')
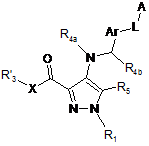 , (I')
, (I')
в якій попередник R'3 перетворюється в R3,
з одержанням сполуки загальної формули (І).
25. Сполука загальної формули (VIII) як проміжний продукт, де Аr, R'3, X, R1, R4a, R4b і R5 мають значення, визначені в п. 24.
Текст
Реферат: Даний винахід стосується хімічних сполук, особливо заміщених піразолів, композицій, що їх містить, і їх застосування як лікарських засобів. UA 97965 C2 UA 97965 C2 5 10 15 20 25 30 35 40 45 Даний винахід стосується особливо нових хімічних сполук, зокрема, заміщених піразолів, композицій, що їх містять, і їх застосування як лікарських засобів. Більш конкретно і згідно з першим аспектом даний винахід стосується нових специфічних заміщених піразолів, що мають протиракову активність через модуляцію активності протеїнів, зокрема протешу кіназ. Протеїни кіназ входять в сімейство ензимів, що каталізують фосфорилування гідроксильних груп специфічних залишків протеїнів, таких як залишки тирозину, серину або треоніну. Такі реакції фосфорилування можуть в широкому значенні модифікувати функцію протеїнів; так, протеїни кіназ відіграють важливу роль в регулюванні великої різноманітності клітинних процесів, що включають, зокрема, метаболізм, клітинну проліферацію, диференціацію клітин, міграцію клітин або виживаність клітин. Серед різних клітинних функцій, в які залучена активність протеїну кінази, деякі процеси представляються привабливими для лікування ракових захворювань, а також інших хвороб. Таким чином, одним з об'єктів даного винаходу є пропозиція композицій, що мають протиракову активність, особливо, при впливі на кінази. Серед кіназ, відносно яких досліджується модуляція активності, можна назвати KDR, Тіе2, VEGFR-1, PDGFR, FGFR, FLT1. Кінази KDR і Тіе2 є переважними. Згадані продукти відповідають наступній загальній формулі (І): Формула (І), в якій: 1) А і Аr незалежно вибирають з групи, що складається з: арилу, гетероарилу, заміщеного арилу, заміщеного гетероарилу; 2) L вибирають з групи, що складається з: NH-CO-NH і O-CO-NH; 3) R1 вибирають з групи, що складається з: Н, R6, COR6, SO2R6, де R6 вибирають з Η, OR7, NR8R9, алкілу, циклоалкілу, гетероциклілу, заміщеного гетероциклілу, арилу, заміщеного арилу, гетероарилу, заміщеного гетероарилу, де R7 вибирають з Н, фенілу, алкілу і де R8 і R9 незалежно вибирають з групи, що складається з: Н, алкілу, циклоалкілу, гетероциклілу, заміщеного гетероциклілу, арилу, заміщеного арилу, гетероарилу, заміщеного гетероарилу або R8 і R9 зв'язані між собою, утворюючи насичений 5-8-членний цикл, що містить від 0 до 3 гетероатомів, вибраних з О, S і N; 4) X вибирають з групи, що складається з: О і NH; 5) R3 вибирають з групи, що складається з: Н, алкілу, заміщеного алкілу, циклоалкілу, заміщеного циклоалкілу; 6) R4a вибирають з групи, що складається з: Η або (С1-С4)алкілу; 7) R4b вибирають з групи, що складається з: Η або (С1-С4)алкілу; 8) R5 вибирають з групи, що складається з: Н, галогену, R10, CN, O(R10), OC(O)(R10), OC(O)N(R10)(R11), OS(O2)(R10), N(R10)(R11), N=C(R10)(R11), N(R10)C(O)(R11), N(R10)C(O)O(R11), N(R12)C(O)N(R10)(R11), N(R12)C(S)N(R10)(R11), N(R10)S(O2)(R11), C(O)(R10), C(O)O(R10), C(O)N(R10)(R11), C(=N(R11))(R10), C(=N(OR11))(R10), S(R10), S(O)(R10), S(O2)(R10), S(O2)O(R10), S(O2)N(R10)(R11); де кожну групу R10, R11, R12 незалежно вибирають з групи, що складається з Н, алкілу, алкілену, алкінілу, арилу, гетероарилу, циклоалкілу, гетероциклілу, заміщеного алкілу, заміщеного алкілену, заміщеного алкінілу, заміщеного арилу, заміщеного гетероарилу, заміщеного циклоалкілу, заміщеного гетероциклілу. Коли R1 являє собою Н, дві таутомерні форми, представлені нижче, належать до даного винаходу: 1 UA 97965 C2 5 У продуктах формули (І) R1 переважно означає Н. У продуктах формули (І) R3 переважно означає Η і X переважно означає ΝΗ, або R3 переважно означає метил і X переважно означає О. У продуктах формули (І) R5 переважно являє собою Н. Замісник Аr згідно з винаходом може бути вибраний з фенілу, піридилу, тієнілу, фурилу і піролілу, заміщеного R'5, де R'5 має те ж значення, що і R5. У продуктах формули (І) Ar-L-A переважно являє собою: де кожна з груп Х1, Х2, Х3 і Х4 незалежно вибрана з N і C-R'5, де R'5 має те ж значення, що і 10 15 20 25 30 35 40 45 50 55 R5. Більш конкретно, група R'5 може бути вибрана з групи, що складається з Н, F, СІ, метилу, NH2, OCF3 і CONH2. Замісник Аr переважно означає феніл, де R'5 є Н. Замісник А за винаходом може бути вибраний з групи, що складається з фенілу, піридилу, тієнілу, фурилу, піролілу, оксазолілу, тіазолілу, ізоксазолілу, ізотіазолілу, піразолілу, імідазолілу, індолілу, індазолілу, бензимідазолілу, бензоксазолілу і бензотіазолілу; можливо, заміщеного. Більш конкретно, замісник А згідно з винаходом може бути вибраний з групи, що складається з фенілу, піразолілу і ізоксазолілу; можливо, заміщеного. Замісник А переважно означає феніл, можливо заміщений. З продуктів формули (І), об'єктів даного винаходу, можна назвати, зокрема, першу групу продуктів, для яких Rja і R4b являють собою Н, і А, Аr, L, R1, X, R3 і R5 мають значення, визначене вище. З продуктів першої групи можна, зокрема, назвати першу підгрупу продуктів, для яких: 1) А і Аr означають феноли, можливо, заміщені; 2) L вибирають з групи, що складається з: NH-CO-NH і O-CO-NH; 3) X означає NH і R3 означає Н, або X означає О і R3 означає метил; 4) R1, R4a, R4b і R5 означають Н. З цієї першої підгрупи можна також назвати підгрупу продуктів, для яких: 1) А і Аr означають феніли, можливо, заміщені; 2) L означає NH-CO-ΝΗ; 3) X означає ΝΗ і R3 означає Η; 4) R1, R4a, R4b і R5 означають Н. З продуктів першої групи можна, зокрема, назвати другу підгрупу продуктів, для яких: 1) А означає феніл, можливо, заміщений, і Аr означає піридин, можливо, заміщений; 2) L вибирають з групи, що складається з: NH-CO-ΝΗ і O-CO-NH; 3) X означає ΝΗ і R3 означає Н, або X означає О і R3 означає метил; 4) R1, R1a, R1b і R5 означають Η; З цієї другої підгрупи можна, зокрема, виділити підгрупу продуктів, для яких: 1) А означає феніл, можливо, заміщений, і Аr означає піридин, можливо, заміщений; 2) L означає NH-CO-NH; 3) X означає ΝΗ і R3 означає Н; 4) R1, R4a, R1b і R5 означають Η; З продуктів формули (І), об'єктів даного винаходу, можна, зокрема, назвати другу групу продуктів, для яких R4a означає Н, R4b означає (С1-С4)алкіл, і А, Аr, L, R1, X, R3 і R5 мають значення, визначені вище. З продуктів другої групи можна, зокрема, назвати першу підгрупу продуктів, для яких: 1) А і Аr означають феніли, можливо, заміщені; 2) L означає NH-CO-NH; 3) X означає NH і R3 означає Н; 4) R1, R4a і R5 означають Н; 5) R4b означає метил. З продуктів формули (І), об'єктів даного винаходу, можна, зокрема, назвати третю групу продуктів, для яких R4a означає (С1-С4)алкіл, R4b означає Н, і А, Аr, L, R1, X, R3 і R5 мають значення, визначені вище. З продуктів третьої групи можна, зокрема, назвати першу підгрупу продуктів, для яких: 1) А і Аr означають феніли, можливо, заміщені; 2) L означає NH-CO-NH; 3) X означає NH і R3 означає Н; 2 UA 97965 C2 5 10 15 20 25 30 35 40 45 50 55 60 4) R1, R4b і R-5 означають Н; 5) R4a означає метил. З продуктів третьої групи можна, зокрема, назвати другу підгрупу продуктів, для яких: 1) А і Аr означають собою феніли, можливо, заміщені; 2) L означає NH-CO-NH; 3) X означає NH і R3 означає Н; 4) R1, R4b, і R5 означають Η; 5) R4a означає етил. Група А може бути заміщена одним або декількома замісниками, вибраними з групи, що складається з: Н, F, СІ, Br, I, OH, SH, SO3M, COOM, СОО-алкілу, CON(R14)(R15), CN, NO2, N(R14)CO(R15), N(R14)(R15), алкілу, галогенвмісного алкілу, алкіл-ОН, алкіл-N(R14)(R15), aлкіл(R16), алкіл-СООМ, алкіл-8О3М, циклоалкілу, алкілену, алкінілу, арилу, гетероарилу, О-алкілу, Оарилу, О-гетероарилу, S-алкілу, S-арилу і S-гетероарилу, причому кожна група, можливо, заміщена замісником, вибраним з алкілу, галогену, О-алкілу, N(R14)(R15); де R14 і R15 незалежно вибирають з Н, алкілу, алкіл-ОН, галогенвмісного алкілу, алкіл-ΝΗ2, алкіл-СООМ, алкіл-SO3M; причому, коли R14 і R15 одночасно відмінні від Н, вони можуть бути зв'язані між собою, утворюючи 5-7-членний цикл, що містить від 0 до 3 гетероатомів, вибраних з О, N і S; де Μ означає Η або катіон лужного металу, вибраного з Li, Na і K; і де R16 означає Η або неароматичний гетероцикл, можливо, заміщений, що містить 2-7 атомів вуглецю, і 1-3 гетероатоми, вибраних з Ν, Ο і S. Коли група А є дизаміщеною, обидва замісники можуть бути зв'язані між собою, утворюючи 5-7-членний цикл, що містить від 0 до 3 гетероатомів, вибраних з Ν, Ο і S. Група А може бути також заміщена одним або декількома замісниками, вибраними з вищенаведеної групи, доповненої SiMe3, S-CHF3, SF5. Більш конкретно, група А може бути вибрана з фенілу, піразолілу або ізоксазолілу, заміщеного щонайменше однією групою, вибраною з Н, галогену, алкілу, галогенвмісного алкілу, О-алкілу, СОО-алкілу, О-галогенвмісного алкілу. Замісник А переважно вибирають з групи, що складається з: фенілу, 2-фтор-5-(трифторметил)фенілу, 2-фторфенілу, 2метоксифенілу, 2-фтор-3-(трифторметил)фенілу, 3-метоксифенілу, 3-фтор-5(трифторметил)фенілу, 4-(трифторметокси)фенілу, 3-метоксикарбонілфенілу, 4(трифторметил)фенілу, 3-(трифторметил)фенілу, 2-(трифторметил)фенілу, 3,5диметоксифенілу, 3-метилфенілу, 4-метоксифенілу, 4-фторфенілу, 4-хлор-3(трифторметил)фенілу, 4-(дифторметокси)фенілу, 2-хлор-4-(трифторметил)фенілу, 4метилфенілу, 2,5-диметилфенілу, 3,4-диметилфенілу, 2-метилфенілу, 3-етилфенілу, 3,5біс(трифторметил)фенілу, 3-фторфенілу, 2-метокси-5-метилфенілу, 2,5-диметоксифенілу, 3хлор-4-(дифторметокси)фенілу, 2,5-дифторфенілу і 4-метил-3-(трифторметил)фенілу. Замісник А може бути також переважно вибраний з групи, що складається з: 2-хлор-5трифторметилфенілу, 3-хлор-4-фторфенілу, 3,4-дихлорфенілу, 3-хлор-5-трифторметилфенілу, 3-триметилсиліл-4-фторфенілу, 3-трифторметоксифенілу, 4-трифторметилпіридин-2-ілу, 4метоксипіридин-2-ілу, 3-трифторметил-4-хлорфенілу, 2-хлор-5-трифторметилфенілу, 3трифторметилсульфанілфенілу, 3-ізопропілфенілу, 3-ізопропіл-4-фторфенілу, 3пентафторсульфанілфенілу, 2-метокси-5-третбутил-фенілу, 4-ізопропілфенілу, 2-хлор-4ізопропілфенілу, 2-фтор-5-метилфенілу, 2-фтор-4-трифторметилфенілу, 2-фтор-4-метилфенілу, 2-хлор-4-метилфенілу і 2-хлор-5-метилфенілу. Даний винахід містить також об'єкти, які відповідають комбінаціям вищеназваних підгруп. Продукти за винаходом можуть бути в формі: 1) нехіральній або 2) рацемічній або 3) збагаченій стереоізомером або 4) збагаченій енантіомером; і бути, можливо, в формі солі. Даний винахід стосується також фармацевтичних композицій, що містять продукт за винаходом, в поєднанні з фармацевтично прийнятним ексципієнтом відповідно до вибраного способу введення. Фармацевтична композиція може бути представлена в твердому, рідкому вигляді або у вигляді ліпосом. Серед твердих композицій можна назвати порошки, желатинові капсули, таблетки. До оральних форм можна також додати тверді форми, захищені від кислого середовища шлунка. Основи, що використовуються для твердих форм, складаються, зокрема, з мінеральних основ, таких як фосфати, карбонати, або органічних основ, таких як лактоза, целюлоза, амідон або полімери. Рідкі форми складаються з розчинів, суспензій або дисперсій. Як диспергуюча основа 3 UA 97965 C2 5 10 15 20 25 30 35 40 45 50 55 60 вони містять воду або органічний розчинник (етанол, NMP або інші), або суміші поверхневоактивних речовин і розчинників або комплексоутворювальних речовин і розчинників. Рідкі форми, переважно, придатні для ін'єкції і тому мають рецептурний склад, придатний для такого застосування. Придатні способи введення шляхом ін'єкції включають внутрішньовенний, внутрішньочеревинний, внутрішньом'язовий і підшкірний способи, причому, внутрішньовенний спосіб є переважним. Дози речовин, що вводяться, згідно з винаходом підбирає лікар в залежності від способу введення пацієнту і від стану останнього. Продукти за винаходом застосовні як інгібітори однієї або декількох реакцій, що каталізуються кіназою. KDR і/або Тіе2 є кіназами, для яких продукти за винаходом особливо придатні як інгібітори. Причини, за якими вибирають вказані кінази, наведені нижче: KDR Рецептор KDR (Kinase insert Domain Receptor), що іменується також VEGRF-R2 (Vascular Endothelial Growth Factor Receptor 2), в основному, виражений в ендотеліальних клітинах. Цей рецептор зв'язує про-ангіогенний фактор VEGF і служить, таким чином, медіатором трансдукційного сигналу через активацію міжклітинного домену кінази. Пряме інгібування активності кінази VEGF-R2 дозволяє послабити явище ангіогенезу в присутності екзогенного фактора VEGF (Vascular Endothelial Growth Factor: судинний ендотеліальний фактор pocтy)(Strawn et al., Cancer Research, 1996, vol. 56, p. 3540-3545). Даний механізм був підтверджений за допомогою мутантів VEGF-R2 (Millauer et al., Cancer Research, 1996, vol. 56, p. 1615-1620). Мабуть, рецептор VEGF-R2 не має іншої функції у дорослих, ніж та, яка пов'язана з ангіогенною активністю VEGF. Недавно одержані результати привели до думки про те, що, крім цієї основної функції в динамічному ангіогенному процесі експресія VEGF сприяє виживанню пухлинних клітин після хіміо- і радіотерапії, при цьому підкреслюється потенційна синергія інгібіторів KDR з іншими агентами (Lee et al. Cancer Research, 2000, vol. 60, p. 5565-5570). Tie2 Tie2 (ТЕK) є членом сімейства рецепторів тирозин-кінази, специфічного для ендотеліальних клітин. Тіе2 є першим рецептором з активністю тирозин-кінази, яка відома одночасно як агоніст (ангіопоетин 1 або Angl), який стимулює самофосфорилування рецептора і клітинну сигналізацію [S. Davis et al. (1996) Cell 87, 1161-1169] і як антагоніст (ангіопоетин 2 або Ang2)[P.C. Maisonpierre et al. (1997) Science 277, 55-60]. Ангіопоетин 1 може виявляти синергічний ефект з VEGF на останніх стадіях нео-ангіогенезу [Asahara Т. Circ. Res. (1998) 233240]. Досліди knock-out і трансгенні роботи з експресією Тіе2 або Angl проводилися на тваринах з пошкодженнями судин [D.J. Dumont et al (1994) Genes Dev. 8, 1897-1909 et С Suri (1996) Cell 87, 1171-1180]. Зв'язок Angl зі своїм рецептором приводить до самофосфорилування домену кінази Тіе2, що суттєво для неоваскуляризації, а також для рекрутування і взаємодії судин з перицитами і гладком'язовими клітинами; ці явища сприяють дозріванню і стабільності судин, що знову утворилися [Р.С. Maisonpierre et al (1997) Science 277, 55-60]. Lin et al. (1997) J. Clin. Invest. 100, 8; 2072-2078 і Lin P. (1998) PNAS 95, 8829-8834, продемонстрували інгібування росту і пухлинну васкуляризацію, так само як зменшення метастаз легенів при аденовірусному зараженні або впорскуваннях позаклітинного домену Тіе2 (Тек) в моделі ксенотрансплантатів пухлини грудей і меланоми. З нижченаведених причин інгібітори Тіе2 можуть бути використані в ситуаціях, коли неоваскуляризація або ангіогенез відбувається невідповідним чином, тобто, як правило, в злоякісних пухлинах, а також у особливих випадках раку, такого як саркома Капоші або рання гемоангімома, ревматоїдний артрит, остеоартрит і/або асоційовані болі при хворобах запального характеру кишечнику, таких як геморогічний ректоколіт або хвороба Крона, при патологіях ока, таких як вікова макулодистрофія, діабетичні ретинопатії, при хронічному запаленні, псоріазі. Ангіогенез є процесом зародження нових капілярних судин з вже існуючих. Пухлинний ангіогенез (утворення нових кровоносних судин), які відповідають за ріст пухлини, є також одним з суттєвих факторів метастатичної дисемінації (Oncongene. 2003 May 19; 22(20):3172-9; Nat Med. 1995 Jan; 1(1):27-31.). Така неоваскуляризація відбувається за рахунок міграції, потім проліферації і диференціації ендотеліальних клітин під дією ангіогенних факторів, що секретуються раковими клітинами і клітинами строми (Recent Prog Horm Res. 2000; 55;15-35;35-6). Система ангіопоетин 1/рецептор Тіе2 відіграє вирішальну роль в дозріванні судин, допускаючи рекрутування пері-ендотеліальних клітин для стабілізації судини (Cell. 1996 Dec 27; 4 UA 97965 C2 5 10 15 20 25 30 35 40 45 50 55 87(7):1161-9, Recent Prog Horm Res. 2004; 59:51-71). Таким чином, було показано, що введення рекомбінантної розчинної форми позаклітинного домену рецептора Тіе2 (exTek) інгібує пухлинний ангіогенез в муринових пухлинних моделях, а також метастатичний розвиток (Proc Nati Acad Sci USA. 1998 Jul 21; 95(15);8829-34; Cancer immunol Immunother. 2004 Jul; 53(7):6008). В культурі ендотеліальних клітин стимуляція Тіе2 активує шлях РІЗ кінази, р42/р44 шляхи, що беруть участь в проліферації і клітинній міграції; синтез PAF (Cell Signal. 2006 Apr 14; ahead of print) шлях, включений в прозапальну активність. Стимуляція Тіе2 посилює шлях Akt і інгібує апоптоз (Ехр Cell Res. 2004 Aug 1; 298(1): 167-77) шлях трансдукції, відомий своїм значенням для клітинної виживаності. Додання Extek (розчинний рецептор Тіе2) інгібує утворення псевдоканальців ендотеліальних клітин на Matrigel (Cancer immunol Immunother. 2004 Jul; 53(7):600-8). Дані дослідження вказують на те, що система Тіе2/ангіопоетин необхідна на перших стадіях утворення васкулярних нирок в зрілих тканинах і що функція рецептора Тіе2 полягає в збільшенні виживаності ендотеліальних клітин в процесі утворення кровоносних судин. Крім того, ангіопоетин-1 стимулює проліферацію лімфатичних ендотеліальних клітин, так само як лімфангіогенез (розвиток лімфатичних неосудин) особливо придатний шлях для метастатичного розвитку (Blood. 2005 Jun 15; 105(12):4649-56). Процеси ангіогенезу відіграють, таким чином, вирішальну роль в рості численних солідних пухлин. Крім того, було показано, що імовірність появи метастаз дуже сильно збільшується при збільшенні васкуляризації первинної пухлини (Вr J Cancer. 2002 May 20; 86(10): 1566-77. У більш ранніх роботах була також встановлена потенційна роль про-ангіогенних агентів в лейкемії і лімфомах. Дійсно, в загальному вигляді було повідомлено, що клітинні клони в цих патологіях можуть бути або зруйновані природним чином імунною системою, або переведені в ангіогенний фенотип, який сприяє їх виживаності і потім їх проліферації. Така зміна фенотипу викликана експресією ангіогенних факторів, зокрема, макрофагами і/або мобілізацією цих факторів з позаклітинної матриці (Thomas DA, Giles FJ, Cortes J, Albitar M, Kantarjian HM., Acta Haematol, (2001), vol 207, pp 106-190.) Існує зв'язок між процесом ангіогенезу кісткового мозку і «екстрамедулярною хворобою» в CML (chronic myelomonocytic leukemia). У різних дослідницьких роботах показано, що інгібування ангіогенезу могло б бути представлено як краще лікування проти цієї патології (Leuk Res. 2006 Jan; 30(1): 54-9; Histol Histopathol. 2004 oct.; 19(4): 1245-60. Крім того, переконливо показано, що активація системи Тіе2/ангіопоетин залучена до розвитку ангіогенезу кісткового мозку у пацієнтів, уражених множинною мієломою (Blood. 2003 Jul 15; 102(2): 638-45. Ревматоїдний артрит (RA) є хворобою з невідомою етіологією. При тому, що він зачіпає багато органів, найбільш важкою формою RA є прогресивне синовіальне запалення суглобів, яке призводить до деструкції. Мабуть, ангіогенез сильно впливає на розвиток цієї патології. Таким чином, було показано, що активація Тіе2 регулює ангіогенез в синовіальних тканинах, сприяючи розвитку ревматоїдного артриту. (Arthritis Rheum. 2003 Sep; 48(9); 2461-71). Була також показана експресія ангіопоетину 1 і Тіе2 в синовіальних тканинах пацієнтів, уражених остеоартритом, пов'язаним з активною неоваскуляризацією (Shahrara S et al Arthritis Res. 2002;4(3)). Таким чином, показано, що блокуючи активацію Тіе2 шляхом використання аденовірусу, що виробляється ехТЕК (розчинний рецептор Тіе2), домагаються інгібування ангіогенезу, розвитку артрозу і захисту від руйнування кісток в моделі миші, у якої артроз викликався колагеном (Arthritis Rheum. 2005 May; 52(5): 1346-8). ЗЗК °Сапальне захворювання кишечнику) IBD має дві форми хронічних запальних захворювань кишечнику: виразковий коліт UC (ulcerative colitis) і хвороба Крона (CD). ЗЗК характеризуються імунітетною дисфункцією, яка виражається у виробленні що невідповідних цитокінів, що спричиняють запалення, стимулюючих утворення локальної мікроваскулярної системи. Наслідком такого ангіогенезу запального характеру є інтестинальна ішемія, викликана звуженням судин (Inflamm Bowel Dis. 2006 Jun; 12(6):515-23). Патології ока в зв'язки з явищами неоваскуляризації, такі як вікова макулярна дегенерація, є основною причиною більшості випадків сліпоти в індустріально розвинених країнах. Сигнали молекул, контролюючих явища неоваскуляризації в оці, таких як VEGF або ангіопоетини, є кращою мішенню в таких патологіях (Campochiaro PA. Expert Opin Biol Ther. 2004 Sep;4(9)). Таким чином, показано, що блокуючи активацію Тіе2 шляхом використання аденовірусу, що виробляє ехТЕК (розчинний рецептор Тіе2), інгібували ретинальну хороїдну неоваскуляризацію, яка частіше за все є причиною втрати зору (Hum Gene Ther.2001 Jul 1; 12(10): 1311-21). Продукт за винаходом можна використовувати для виробництва лікарського засобу, придатного для лікування патологічного стану, зокрема, раку. 5 UA 97965 C2 5 10 15 20 25 30 35 40 45 50 55 Завдяки слабкій токсичності і фармакологічним і біологічним властивостям сполуки згідно з даним винаходом знаходять своє застосування для лікування будь-якої карциноми зі значною мірою васкуляризації або індукуючої метастази або, нарешті, для лікування патологій типу лімфоми і лейкемії. Згадані сполуки надають лікування на вибір або окремо, або в поєднанні з відповідною хіміотерапією або радіотерапією і/або в поєднанні з іншими сполуками, що мають протиангіогенну активність, такими як інгібітори VEGF або FGF. Так, продукти загальної формули (І) особливо придатні для лікування і запобігання патологічному стану, який відрізняється тим, що продукт вводять окремо або в поєднанні з іншими діючими речовинами, а саме протираковими, такими як цитотоксичні, цитостатичні, протиангіогенні або протиметастазні речовини. Так, сполуки за даним винаходом можуть бути введені окремо або в суміші з іншими протираковими сполуками. Серед можливих сполук можна назвати: - алкілуючі агенти і, зокрема, циклофосфамід, мелфалан, іфосфамід, хлорамбуцил, бусулфан, тіотепа, преднімустин, кармустин, ломустин, семустин, стептозотоцин, декарбазин, темозоломід, прокарбазин і гексаметилмеламін; - похідні платини, такі як, зокрема, цисплатин, карбоплатин або оксаліплатин; - антибіотики, такі як, зокрема, блеоміцин, мітоміцин, діактиноміцин; - агенти для руйнування мікроканальців, такі як, зокрема, вінбластин, вінкристин, віндезин, вінорелбін, таксоїди (паклітаксел і доцетаксел); - антрацикліни, такі як, зокрема, доксорубіцин, даунорубіцин, ідарубіцин, епірубіцин, мітоксантрон, лозоксантрон; - інгібітори топоізомераз груп І і II, такі як етопозид, теніпозид, амсакрин, іринотекан, топотекан і томудекс; -фторпіримідини, такі як 5-фторурацил, UFT, флоксуридин; - аналоги цитидину, такі як 5-азацитидин, цитарабін, гемцитарадін, 6-меркаптопурин, 6тіогуанін; - аналоги аденозину, такі як пентостатин, цитарабін або флударабіну фосфат; - метотрексат і фолінова кислота; - ензими і різні сполуки, такі як L-аспарагіназа, гідроксисечовина, транс-ретиноєва кислота, сурамін, дексразоксан, аміфостин, герцептин, а також естрогенні і андрогенні гормони; - антиваскулярні агенти, такі як похідні комбретастатину, наприклад, СА4Р, халкони або колфіцин, наприклад, ZD6126 і їх пролікарські сполуки; - антіангіогенні агенти, такі як бевацизумаб, сорафеніб або сунітинібу малат; - терапевтичні агенти інгібування інших тирозинкіназ, такі як іматиніб, гефітиніб і ерлотиніб. Якщо сполуки за даним винаходом застосовуються в поєднанні з іншим лікуванням або з лікуванням радіацією, то такі види лікування можуть здійснюватися одночасно, роздільно, послідовно. Лікування буде вибрано лікарем-фахівцем в залежності від хвороби. Визначення Термін «галоген» стосується елемента, вибраного з F, СІ, Вr і І. Термін «алкіл» стосується насиченого вуглеводневого замісника, лінійного або розгалуженого, що містить від 1 до 6 атомів вуглецю. Замісники метил, етил, пропіл, 1метилетил, бутил, 1-метилпропіл, 2-метилпропіл, 1,1-диметилетил, пентил, 1-метилбутил, 2метилбутил, 3-метилбутил, 1,1-диметилпропіл, 1,2-диметилпропіл, 2,2-диметилпропіл, 1етилпропіл, гексил, 1-метилпентил, 2-метил пентил, 1-етил бутил, 2-етил бутил, 3,3диметилбутил є прикладами алкільного замісника. Термін «алкілен» стосується вуглеводневого замісника, лінійного або розгалуженого, з одним або декількома ненасиченими зв'язками, що містить від 2 до 6 атомів вуглецю. Замісники етиленіл, 1 -метилетиленіл, проп-1-еніл, проп-2-еніл, Z-1-метилпроп-1-еніл, Е-1-метилпроп-1еніл, Z-1,2-диметилпроп-1-еніл, Ε-1,2-диметилпроп-1-еніл, бут-1,3-дієніл, 1-метиліденілпроп-2еніл, Z-2-метилбут-1,3-дієніл, Е-2-метилбут-1,3-дієніл, 2-метил-1-метиліденілпроп-2-еніл є прикладами алкіленового замісника. Термін «алкініл» стосується вуглеводневого замісника, лінійного або розгалуженого, що має щонайменше два ненасичених зв'язки від пари віцинальних атомів вуглецю, що містять від 2 до 6 атомів вуглецю. Замісники етиніл; проп-1-ініл; проп-2-ініл і бут-1-иніл є прикладами алкінільного замісника. Термін «арил» стосується ароматичного моно- або поліциклічного замісника, що містить від 6 до 14 атомів вуглецю. Замісники феніл; нафт-1-ил; нафт-2-ил; антрацен-9-іл; 1,2,3,4тетрагідронафт-5-ил і 1,2,3,4-тетрагідронафт-6-ил є прикладами арильного замісника. 6 UA 97965 C2 5 10 15 20 25 Термін «гетероарил» стосується гетероароматичного моно- або поліциклічного замісника, що містить від 1 до 13 атомів вуглецю і від 1 до 4 гетероатомів. Замісники пірол-1-іл; піро-2-іл; пірол-3-іл; фурил; тієніл; імідазоліл; оксазоліл; тіазоліл; ізоксазоліл; ізотіазоліл; 1,2,4-триазоліл; оксадіазоліл; тіадіазоліл; тетразоліл; піридил; піримідил; піразиніл; 1,3,5-триазиніл; індоліл; бензо[b]фурил; бензо[b]тієніл; індазоліл; бензимідазоліл; азаіндоліл; хінолеїл; ізохінолеїл; карбазоліл і акридил є прикладами гетероарильних замісників. Термін «гетероатом» стосується в цьому випадку атома щонайменше двовалентного, відмінного від вуглецю. N; О; S і Se є прикладами гетероатома. Термін «циклоалкіл» стосується циклічного вуглеводню, насиченого або частково ненасиченого замісника, що містить від 3 до 12 атомів вуглецю. Замісники циклопропіл; циклобутил; циклопентил; циклопентенил; циклопентадієніл; циклогексил; циклогексеніл; циклогептил; біцикло[2.2.1]гептил; циклооктил; біцикло[2.2.2]октил; адамантил і пергідронафтил є прикладами циклоалкільного замісника. Термін «гетероцикліл» стосується циклічного вуглеводневого замісника, насиченого або частково ненасиченого, що містить від 1 до 13 атомів вуглецю і від 1 до 4 гетероатомів. Переважно, щоб циклічний вуглеводневий замісник, насичений або частково ненасичений, був моноциклічним і містив 4 або 5 атомів вуглецю і від 1 до 3 гетероатомів. Термін «заміщений» стосується одного або декількох різних замісників Н, наприклад, галоген; алкіл; арил; гетероарил; циклоалкіл; гетероцикліл; алкілен; алкініл; ОН; О-алкіл; Оалкілен; О-арил; О-гетероарил; NH2; NH-алкіл; NH-арил; NH-гетероарил; N-алкілалкіл', де алкіл' і алкіл є двома алкілами, ідентичними або різними; SH; S-алкіл; S-арил; S(O2)H; S(О2)-алкіл; S(O2)-apmi; SO3H; SО3-алкіл; SO2-арил; СНО; С(О)-алкіл; С(О)-арил; С(О)ОН; С(О)О-алкіл; С(О)О-арил; ОС(О)-алкіл; ОС(О)-арил; C(O)NH2; С(О)NH-алкіл; С(О)NH-арил; NHCHO; NHC(O)алкіл; NНС(О)-арил; NH-циклоалкіл; NH-гетероцикліл. Об'єктом даного винаходу є одержання продуктів наступної загальної формули (І): в якій R1, R3, R4b, R5, X, Ar, L і А мають значення, визначені вище, яке відрізняються тим, що продукт наступної загальної формули (II): 30 35 40 в якій R'3 означає R3 або попередник R3, і X, R1, R3 і R5 мають значення, визначені вище, взаємодіє з продуктом наступної загальної формули (III): в якій R4b, Ar, L і А мають значення, визначені вище, для одержання продукту загальної формули (І). Крім того, об'єктом даного винаходу є продукти загальної формули (II) як проміжні продукти, для яких R'3, X, R1 і R5 мають значення, визначені вище, а також продукти загальної формули (III), для яких Аr, L і А мають значення, визначені вище. Об'єктом даного винаходу є також спосіб одержання проміжних продуктів наступної загальної формули (II): в якій R'3, X, R1 і R5 мають значення, визначені вище, яке відрізняється тим, що продукт наступної загальної формули (ΙV): 7 UA 97965 C2 в якій R1 і R5 мають значення, визначені вище, взаємодіє з продуктом наступної загальної формули (V): 5 в якій Gp означає захисну групу, X і R'3 мають значення, визначені вище, для одержання продукту загальної формули (II). Об'єктом даного винаходу є також спосіб одержання проміжних продуктів наступної загальної формули (III): 10 в якій R4b, Ar і А мають значення, визначені вище, і L означає NH-CO-NH, який відрізняється тим, що продукт наступної загальної формули (VI): в якій R4b і Аr мають значення, визначені вище, взаємодіє з продуктом наступної загальної формули (VII): 15 20 в якій А має значення, визначене вище, для одержання продукту загальної формули (III). Об'єктом даного винаходу є також одержання продуктів загальної формули (І): в якій R1, R3, R4a, R4b R5, X, Аr і А мають значення, визначені вище, і L означає NHCONH, яке відрізняється тим, що продукт наступної загальної формули (VIII): в якій R'3 означає R3 або попередник R3, і X, Rb R3, R4a, R4b і R5 мають значення, визначені вище, взаємодіє з продуктом наступної формули (VII): 25 в якій А мають значення, визначені вище, для одержання продукту наступної загальної формули (I'): 8 UA 97965 C2 в якій попередник R'3 перетворюється в R3 для одержання продукту загальної формули (І). Об'єктом даного винаходу є також спосіб одержання проміжних продуктів загальної формули (VIII): 5 10 в якій R'3 означає R3 або попередник R3, і Аr, X, R1, R3, R4a, R4b і R5 мають значення, визначені вище, який відрізняється тим, що продукт наступної загальної формули (IX): зазнає відновлення для одержання продукту загальної формули (VΙII). Об'єктом даного винаходу є також спосіб одержання проміжних продуктів загальної формули (ІХа): 15 в якій R'3 означає R3 або попередник R3, R4a означає (С1-С4)алкіл і R4b означає Η, і X, R1, R3 і R5 мають значення, визначені вище, який відрізняється тим, що продукт наступної загальної формули (ІХс): 20 в якій R'3 означає R3 або попередник R3, R4a і R4b означають Η, і X, R1, R3 і R5 мають значення, визначені вище, для одержання продукту вищенаведеної загальної формули (ІХа). Об'єктом даного винаходу є також спосіб одержання проміжних продуктів загальної формули (ІХс): 9 UA 97965 C2 в якій R'3 означає R3 або попередник R3, R(a і Rib означають Η, і Аr, X, Rb R3 і R5 мають значення, визначені вище, який відрізняється тим, що продукт наступної загальної формули (II): 5 в якій R'3, X, R1 і R5 мають значення, визначені вище, взаємодіє з продуктом наступної загальної формули (Хс): 10 в якій R4b означає Н і Аr мають значення, визначені вище, для одержання продукту вищенаведеної загальної формули (ІХс). Об'єктом даного винаходу є також спосіб одержання проміжних продуктів загальної формули (ІХb): в якій R'3 означає R3 або попередник R3, R4a означає Н, і R4b означає (С1-С4)алкіл, і Аr, X, R1, R3 і R5 мають значення, визначені вище, який відрізняється тим, що продукт наступної загальної формули (II): 15 20 25 30 в якій R'3, X, R1 і R5 мають значення, визначені вище, взаємодіє з продуктом наступної загальної формули (Хb): в якій R4b означає (С1-С4)алкіл і Аr мають значення, визначені вище, зазнає потім відновлення для одержання продукту вищенаведеної загальної формули (ІХb). Використовувані вихідні продукти комерційно доступні або виходять способами, відомими фахівцеві в даній галузі. Під захисною групою Gp мається на увазі група, що дозволяє, з одного боку, захистити таку реакційноздатну функцію, як ОН або амін під час синтезу і, з іншого боку, регенерувати реакційноздатну функцію в кінці синтезу. Приклади захисних грyп, а також способи захисту і відновлення наведені в «Protective Groups in Organic Synthesis», Green et al., 2nd Edition (John Wiley & Sons, Inc., New York). Під попередником R3 мається на увазі група, що дозволяє в кінці реакції або синтезу одержати групу R3. Мова йде, наприклад, про групу –СН2-смола Рінка, коли X означає NH, або ж про групу 2,4-диметоксибензил. Продукти за винаходом можуть бути одержані класичними способами органічної хімії. Нижченаведена схема 1 ілюструє спосіб, що використовується для одержання прикладів 1-31. Тому вона не обмежує рамки даного винаходу відносно способів одержання сполук, що заявляються. 35 10 UA 97965 C2 5 10 15 20 25 30 35 40 45 1. Одержання проміжної смоли (іі) Смола Rink (ν) набухає в ДМФ. ДМФ відфільтровують, потім замінюють на 50%-ий розчин піперидину в ДМФ. Через ½ часу перемішування при кімнатній температурі суміш фільтрують, потім смолу послідовно промивають ДМФ, метанолом і ДМФ. Потім розчин 3 еквівалентів 4-нітро-3-піразолкарбонової кислоти (iv), 3 еквівалентів HOBt (гідроксибензотриазол) і 3 еквіваленти діізопропілкарбодіїміду (DIC) в ДМФ додають в смолу. Суміш перемішують протягом однієї ночі при кімнатній температурі, потім реакційну суміш відділяють фільтрацією. Смолу промивають 3 рази ДМФ, 2 рази метанолом і 5 разів ДМФ. Потім смолу обробляють молярним розчином хлориду олова (SnCl2) протягом однієї ночі при кімнатній температурі. Реакційну суміш відділяють фільтрацією. Смолу промивають 5 разів ДМФ, 2 рази метанолом і 3 рази ДХМ (дихлорметан) і два рази ефіром, потім сушать у вакуумі, одержують смолу (іі). 2. Одержання продуктів (і') відновлювальним амінуванням Смола (іі) набухає в дихлоретані (ДХЕ) в ємності. З еквівалента розчину альдегіду (ііі) в ДМФ додають до 5 еквівалентів ціанборгідриду натрію в метанолі, що містить 10% оцтової кислоти. Суміш нагрівають при 80°С протягом 2 годин. Після охолоджування реакційне середовище фільтрують і смолу послідовно промивають 2 рази метанолом, 3 рази ДХМ (дихлорметан), 2 рази метанолом і 3 рази ДХМ. Кінцеві продукти одержують розділенням розчином трифтороцтова кислота/ДХМ (50/50) при кімнатній температурі протягом 2 годин. Продукт відділяють фільтрацією і випарюванням розчинника. Продукт (і') очищають або нормальнофазовою рідинною хроматографією, або за допомогою препаративного LC/MS аналізу. Обладнання і методи Аналітичний LC/MS метод А: Аналіз здійснюють на мас-спектометрі Waters моделі ZQ, в режимі розпилення з позитивною і негативною іонізацією (діапазон від 10 до 1200 а.о.м.), зв'язаному з рідинним хроматографом HPLC Agilent HP 1100. Розділення відбувається на колонці Waters Xbridge C18 (3 × 50 мм, 2,5 мкм діаметр частинок), з температурою, що підтримується, яка дорівнює 60°С, з використанням градієнтного елюювання сумішшю ацетонітрил/вода, що містить 0,1% (об./об.) мурашиної кислоти, витрата 1,1 мл/хв. Прохід через градієнт від 5 до 100% ацетонітрилу здійснюється за 5 хвилин, градієнт утримується при 100% ½ хвилини, потім доходить до 5% за 1 хвилину. Загальна тривалість розділення становить 7 хвилин. Крім аналізу методом мас-спектроскопії здійснюють детектування УФ (діодна матриця) при довжинах хвиль від 210 до 400 нм, а також вимірювання із застосуванням детектора по світлорозсіянню випарованого зразка ELSD (evaporative light scattering) за допомогою приладу Sedere Sedex 85. Аналітичний LC/MS метод В: Аналіз здійснюють на мас-спектометрі Waters, модель ZQ, методом розпилення з позитивною і негативною іонізацією (діапазон від 10 до 1200 а.о.м.), зв'язаному з приладом Waters Alliance HT. Розділення відбувається на колонці Waters Atlantis dC18 (2,1 × 50 мм, 5 мкм діаметр частинок), з температурою, що підтримується, яка дорівнює 25°С, з використанням градієнтного елюювання сумішшю ацетонітрил/вода, що містить 0,1% (об./об.) трифтороцтової кислоти, витрата 0,5 мл/хв. Прохід через градієнт від 5 до 85% ацетонітрилу здійснюється за 5 хвилин, потім градієнт утримується при 09% протягом 1 хвилини. Загальна тривалість розділення становить 7 хвилин. Крім аналізу методом мас-спектроскопії здійснюють детектування УФ (діодна матриця) при довжинах хвиль від 210 до 400 нМ. Препаративний LC/MS метод С: Продукти очищають за допомогою препаративного методу LC/MS з використанням системи Waters FractionLynx, що складається з насоса Waters моделі 600 для градієнтного елюювання, 11 UA 97965 C2 5 10 15 20 25 30 35 40 45 50 насоса Waters моделі 515 для регенерації, насоса Waters Reagent Manager, автоінжектора моделі 2700, 2 переривників Theodyne моделі LabPro, детектора Waters з діодною матрицею, мас-спектрометра Waters моделі ZMD і колектора фракцій моделі 204. Прилад керується системою програмного забезпечення Waters FractionLynx. На виході з розділювальної колонки 1/1000 потоку відводиться роздільником LC Paking Accurate; даний потік змішується з 3 метанолом (витрата 0,5 мл/хв) і відправляється до детекторів: Л відправляється на діодну матрицю і ½ на мас-спектрометр; інша частина потоку (999/1000) відправляється на колектор фракцій. Продукт збирається, якщо спостерігається пік маси на FractionLynx, в іншому випадку потік безпосередньо виводиться. Молекулярні формули продуктів вводяться в систему програмного забезпечення FractionLynx і продукт збирається, коли вловлюються піки маси + + [М+Н] і [M+Na] . Фракції збирають в ємності, упарюють в ротаційному випарнику Jouan modele RC10.10. Масу одержаного продукту визначають, вимірюючи масу ємності після випарювання розчинника. Інформація про колонки і градієнти, що використовуються, дана для кожного прикладу в наступній частині. Аналітичний LC/MS метод D: Аналіз здійснюють на мас-спектометрі Waters SQD методом розпилення з позитивною і негативною іонізацією (діапазон від 10 до 1200 а.о.м.), зв'язаному з приладом Waters Alliance НТ. Розділення відбувається на колонці ВЕН (2,1×50 мм, 1,7 мкм діаметр частинок), з температурою, що підтримується, яка дорівнює 25°С, з використанням градієнтного елюювання сумішшю ацетонітрил/вода, що містить 0,1% (об./об.) трифтороцтової кислоти, витрата 1 мл/хв. Прохід через градієнт від 5 до 100% ацетонітрилу здійснюється за 2 хвилини. Крім аналізу методом мас-спектроскопії здійснюють детектування УФ (діодна матриця) при довжинах хвиль від 210 до 400 нм. Приклад 1: Трифторацетат 4-{[3-феніл]карбомоїл}окси)бензил]аміно}-1Н-піразол-3-карбоксаміду Одержання смоли (іі): 30 г смоли Рінка (PolymerLab; 0,99 ммоль/г) набухає в 150 мл ДМФ. Через 10 хвилин перемішування ДМФ відфільтровують і замінюють на 150 мл розчини піперидину в ДМФ (50/50 об./об.). Суміш витримують протягом 1 години при перемішуванні, потім фільтрують. Смолу послідовно промивають 5 разів 150 мл ДМФ, 2 рази 150 мл метанолу і 3 рази 150 мл ДМФ. Далі розчин 14,1 г 4-нітро-3-піразолкарбонової кислоти (90 ммоль, 3 еквів.) і 13,8 г HOBt (90 ммоль, 3 еквів.) в 150 мл ДМФ додають до смоли, після чого відразу ж додають 13,8 мл DIC (90 ммоль, 3 еквів.). Суміш витримують протягом 16 годин при перемішуванні при кімнатній температурі. Розчин фільтрують, смолу послідовно промивають 5 разів 150 мл ДМФ, 2 рази 150 мл метанолу і 3 рази 150 мл ДМФ, потім 150 мл розчину 1М SnCl2 (33 г в 150 мл). Перемішування при кімнатній температурі підтримують протягом 24 годин, потім суміш фільтрують і смолу промивають 5 разів 150 мл ДМФ, 2 рази 150 мл метанолу, 3 рази 150 мл ДХМ і 2 рази 150 мл етиловим ефіром. Після сушіння у вакуумі відділяють 31г проміжної смоли (іі). Одержання прикладу 1: 100 мг смоли (іі) набухає в 0,3 мл ДХЕ, потім додають розчин 72 мг фенілкарбамік-3формілфенілового ефіру (0,3 ммоль; ~3 еквів.) в 0,2 мл ДМФ і 33 мг ціанборгідриду натрію (0,5 ммоль; ~5 еквів.). Суміш нагрівають при 80°С протягом 1 години, потім фільтрують після охолоджування до кімнатної температури. Смолу потім послідовно промивають 2 рази 1 мл МеОН, 5 разів 1 мл ДМФ, 3 рази 1 мл МеОН і 5 разів 1 мл ДХМ. Продукт розщеплюють шляхом обробки смоли 1 мл розчину ТФО/ДХМ в співвідношенні 50/50. Розчин упарюють, і одержаний сирий продукт безпосередньо очищають препаративною ВЕРХ. Одержують 2,4 мг очікуваного + продукту 1 (вихід=5%). ([М+Н] :352). RT=2,49 хв (метод А). Приклад 2а: Трифторацетат 4-{[3-({[2-фтор-5-(3-фторметил)феніл] карбомоїл}аміно)бензил]аміно}-1Н-піразол-3-карбоксаміду і Приклад 2b: Хлоргідрат 4-{[3-({[2-фтор-5-(3-фторметил)феніл]карбомоїл}аміно)бензил]аміно}-1Н-піразол3-карбоксаміду 55 12 UA 97965 C2 5 10 15 20 25 30 35 40 Одержання 1-(2-фтор-5-трифторметилфеніл)-3-(3-формілфеніл) сечовини: Суміш 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 290 мкл 2-фтор-5трифторметилфенілізоціанату в 4 мл ДХЕ обробляють в мікрохвильовій печі СЕМ Discover при 100°С протягом 10 хвилин (потужність 90). Після охолоджування суміш вносять в 100 мл насиченого розчину гідрогеносульфату калію і екстрагують двічі 50 мл етилацетату. Сполучені органічні фази промивають водою, сушать над сульфатом натрію і упарюють. Відділяють 740 мг очікуваних альдегідів (вихід 57%) з чистотою LC/MS 82%. Сирий продукт безпосередньо + використовують на наступних стадіях. ([М+Н] ): 327. RT=4,28 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 2а: Приклад 2а одержують способом, описаним для прикладу 1, виходячи з 1 г смоли (іі), 520 мг 1-(2-фтор-5-трифторметилфеніл-3-(3-формілфеніл)сечовини (1,6 ммоль; 2 еквів.) і 264 мг ціанборгідриду натрію (4 ммоль; ~5 еквів.). Після очищення препаративною ВЕРХ одержують + продукт 2а. (EIMS ([М+Н] ): 437. RT=3,45 хв (метод А). Одержання прикладу 2b: Приклад 2b одержують способом, описаним для прикладу 1, виходячи з 1 г смоли (іі), 520 мг 1-(2-фтор-5-трифторметилфеніл-3-(3-формілфеніл)сечовини (1,6 ммоль; 2 еквів.) і 264 мг ціанборгідриду натрію (4 ммоль; ~5 еквів.). Після фільтрації і упарювання виділяють 301 мг сирого продукту (чистота LC/MS 83%). Сирий продукт очищають на колонці з силікагелем, використовуючи як елюаєт суміш ДХМ/МеОН (90/10). Виділяють 151 мг блідо-жовтої твердої речовини (вихід 43%). Продукт розчиняють в 2 мл МеОН і перетворюють його в сіль хлоргідрату доданням розчину 4N НСI в діоксані. Після упарювання виділяють продукт 2b у вигляді блідо+ 1 жовтої твердої речовини. (EIMS ([М+Н] ): 437. RT=3,45 хв (метод А). Н ЯМР (D6-MeOD) (600 МГц): 4,62 (с, 2Н); 7,19 (д, 1Н); 7,36 (2с, 2Н); 7,40 (м, 1Н); 7,49 (м, 1H); 7,76 (с, 1Н); 7,78 (с, 1Н); 8,62 (м, 1H). Приклад 3: Трифторацетат 4-{[3-{(2-фторфеніл])(карбомоїл}аміно}бензил)[аміно]}-[1Н-піразол-3карбоксаміду] Одержання 1-(2-фторфеніл)-3-(3-формілфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 548 мг 2-фторфенілізоціанату в 4 мл ДХЕ. Після охолоджування суміш вносять в 100 мл насиченого розчину гідрогеносульфату калію і екстрагують двічі 50 мл етилацетату. Сполучені органічні фази промивають водою, сушать над сульфатом натрію і упарюють. Виділяють 864 мг очікуваного альдегіду в формі камеді з чистотою LC/MS 77%. Кристалічну фракцію одержують після розтирання в етиловому ефірі. + Виділяють 165 мг твердих речовини ([М+Н] ): 259. RT=4,28 хв (градієнтне елюювання ацетонітрил/вода 5/85% - метод В). Одержання прикладу 3: Приклад 3 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 104 мг 1-(2-фторфеніл)-3-(3-формілфеніл)сечовини (0,4 ммоль, 2 еквів.) і 66 мг ціанборгідриду 13 UA 97965 C2 5 10 15 20 25 30 35 натрію (1 ммоль; ~5 еквів.). Після очищення препаративною ВЕРХ виділяють 33 мг продукту 3 + (вихід=43%). EIMS ([М+Н] ): 369. RT=3,70 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод А). Приклад 4: Трифторацетат 4-[(3-{(2-метоксифеніл)карбомоїл]аміно}бензил)аміно]-1H-піразол-3карбоксаміду Одержання 1-(2-метоксифеніл)-3-(3-формілфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 597 мг 2-метоксифенілізоціанату (4 ммоль) в 4 мл ДХЕ. 300 мг очікуваного сирого альдегіду виділяють і безпосередньо використовують на наступній стадії. + ([М+Н] ): 271. RT=5,14 хв (градієнтне елюювання ацетонітрил/вода від 3 до 90% - метод В). Одержання прикладу 4: Приклад 4 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 162 мг 1-(2-метоксифеніл)-3-(3-формілфеніл)сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після очищення препаративною ВЕРХ виділяють 10,4 мг продукту 4 + (вихід=11%). EIMS ([М+Н] ): 381. RT=3,84 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод А). Приклад 5: Трифторацетат 4-{[3-({[2-фтор-3-фторметил)феніл]карбомоїл}аміно)бензил]аміно}-1Нпіразол-3-карбоксаміду Одержання 1-(2-фтор-3-трифторметилфеніл)-3-(3-формілфеніл) сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 820 мг 2-фтор-3-трифторметилфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 300 мг очікуваного сирого альдегіду і безпосередньо використовують на + наступній стадії. ([М+Н] ): 327. RT=4,21 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 5: Приклад 5 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 195 мг 1-(2-фтор-3-трифторметилфеніл)-3-(3-формілфеніл)сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після очищення препаративною ВЕРХ виділяють + 31,4 мг продукту 5 (вихід=29%). EIMS ([М+Н] ): 437. RT=3,33 хв (градієнтне елюювання ацетонітрил/вода від 5 до 100% -метод А). Приклад 6: Трифторацетат 4-{[3-{(3-метоксифеніл)карбомоїл]аміно}бензиламіно]-1Н-піразол-3карбоксаміду 14 UA 97965 C2 5 10 15 20 25 30 Одержання 1-(3-метоксифеніл)-3-(3-формілфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 597 мг 3-триметоксифенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 598 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 271. RT=5,05 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 6: Приклад 6 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 162 мг 1-(3-метоксифеніл)-3-(3-формілфеніл)сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після очищення препаративною ВЕРХ виділяють 17 мг продукту 6 + (вихід=17%). EIMS ([М+Н] ): 381. RT=2,47 хв (градієнтне елюювання ацетонітрил/вода від 5 до 100% - метод А). Приклад 7: Трифторацетат 4-{[3-({[3-фтор-5-(трифторметил)феніл]карбомоїл}аміно)бензил]аміно}-1Hпіразол-3-карбоксаміду Одержання 1-(3-фтор-5-трифторметилфеніл)-3-(3-формілфеніл) сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 597 мг 3-фтор-5-трифторметилфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 924 мг очікуваного сирого альдегіду і безпосередньо використовують на + наступній стадії. ([М+Н] ): 327. RT=4,48 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання продукту прикладу 7: Продукт прикладу 7 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 196 мг 1-(3-фтор-5-триформетилфеніл)-3-(3-формілфеніл)сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після очищення препаративною ВЕРХ + виділяють 33,6 мг продукту 7 (вихід=31%). EIMS ([М+Н] ): 437. RT=3,55 хв (градієнтне елюювання ацетонітрил/вода від 5 до 100% - метод А). Приклад 8: Трифторацетат 4-{[3-({[4-(трифторметокси)феніл]карбомоїл}аміно)бензил]аміно}-1Н-піразол3-карбоксаміду 15 UA 97965 C2 5 10 15 20 25 30 Одержання 1-(4-трифторметоксифеніл)-3-(3-формілфеніл) сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 812 мг 3-фторметоксифенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 558 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 325. RT=4,13 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 8: Продукт прикладу 8 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 195 мг 1-(4-трифторметоксифеніл)-3-(3-формілфеніл)сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після очищення препаративною ВЕРХ + виділяють 26,3 мг продукту 8 (вихід=24%). EIMS ([М+Н] ): 435. RT=3,34 хв (градієнтне елюювання ацетонітрил/вода від 5 до 100% - метод А). Приклад 9: Трифторацетат 3-{(3-{(3-карбомоїл-1H-піразол-4іл)[аміно]метил}феніл}карбомоїл])(аміно}метилбензоату) Одержання 1-(3-метоксикарбоніл)-3-(3-формілфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 812 мг складного метилового ефіру 3-ізоціанбензойної кислоти (4 ммоль) в 4 мл ДХЕ. Виділяють 695 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 299. RT=2,94 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 9: Продукт прикладу 9 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 180 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після очищення препаративною ВЕРХ виділяють 25,3 мг продукту 9 (вихід=24%). EIMS + ([М+Н] ): 409. RT=2,67 хв (градієнтне елюювання ацетонітрил/вода від 5 до 100% - метод А). Приклад 10: Трифторацетат 4-{[3-({[4-(трифторметил)феніл]карбомоїл}аміно)бензил]аміно}-1Н-піразол-3карбоксаміду 16 UA 97965 C2 5 10 15 20 25 30 Одержання 1-(3-формілфеніл)-3-(4-трифторметилфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімер изована форма) і 748 мг 4-фторметилфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 896 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 309. RT=4,14 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 10: Приклад 10 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 185 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 20,9 мг продукту 10 (вихід=19%). EIMS ([М+Н] ): 419. RT=3,33 хв (градієнтне елюювання ацетонітрил/вода від 5 до 100% - метод А). Приклад 11: Трифторацетат 4-{[3-({[3-(трифторметил)феніл]карбомоїл}аміно)бензил]аміно}-1H-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(3-трифторметил феніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 748 мг 3-фторметилфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 744 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 309. RT=4,04 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 11: Приклад 11 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 185 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 25,9 мг продукту 11 (вихід=24%). EIMS ([М+Н] ): 419. RT=3,25 хв (градієнтне елюювання ацетонітрил/вода від 5 до 100% - метод А). Приклад 12: Трифторацетат 4-{[3-({[2-(трифторметил)феніл]карбомоїл}аміно)бензил]аміно}-1Н-піразол-3карбоксаміду 17 UA 97965 C2 5 10 15 20 25 30 35 40 Одержання 1-(3-формілфеніл)-3-(2-трифторметилфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 748 мг 2-трифторметилфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 744 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 309. RT=5,51 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% -метод В). Одержання прикладу 12: Приклад 12 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 185 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 17,5 мг продукту 12 (вихід=16%). EIMS ([М+Н] ): 419. RT=2,64 хв (градієнтне елюювання ацетонітрил/вода від 5 до 100% - метод А). Приклад 13: Трифторацетат 4-{[3-{(3,5-(диметоксифеніл)карбомоїл]аміно}бензил]аміно]-1Н-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(3,5-диметоксифеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 717 мг 3,5-диметоксифенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 893 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 301. RT=2,99 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 13: Приклад 13 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 180 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 14,9 мг продукту 13 (вихід=14%). EIMS ([М+Н] ): 411. RT=4,61 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод А). Приклад 14: Трифторацетат 4-{[3-{(3-метилфеніл)карбомоїл]аміно}бензил)][аміно]-1Н-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(3-толіл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 533 мг 3-толілізоціанату (4 ммоль) в 4мл ДХЕ. Виділяють 629 + мг очікуваного сирого альдегіду і безпосередньо використовують на наступній стадії. ([М+Н] ): 255. RT=3,27 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 14: Приклад 14 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 153 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 17 мг продукту 14 (вихід=18%). EIMS ([М+Н] ): 365. RT=4,66 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод А). Приклад 15: Трифторацетат 4-{[3-{(4-метоксифеніл)карбомоїл]аміно}бензил)][аміно]-1Н-піразол-3карбоксаміду 18 UA 97965 C2 5 10 15 20 25 30 35 40 Одержання 1-(3-формілфеніл)-3-(4-метоксифеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 597 мг 3-метоксифенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 747 мг очікуваного + сирого альдегіду і безпосередньо використовують на наступній стадії. ([М+Н] ): 271. RT=2,53 хв (градієнтне елюювання ацетонітрил/вода від 3 до 90% - метод В). Одержання прикладу 15: Приклад 15 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 162 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 2,6 мг продукту 15 (вихід=3%). EIMS ([М+Н] ): 381. RT=4,3 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 16: Трифторацетат 4-{[3-{(4-фторфеніл)карбомоїл]аміно}бензил)][аміно]-1H-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(4-фторфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 548 мг 4-фторфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 760 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 259. RT=2,86 хв (градієнтне елюювання ацетонітрил/вода 30-90% - метод В). Одержання прикладу 16: Приклад 16 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 155 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 0,6 мг продукту 16 (вихід=1%). EIMS ([М+Н] ): 369. ΚΤ=4,44 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 17: Трифторацетат 4-{[3-({[4-хлор-3-(трифторметил)феніл]карбомоїл}аміно)бензил]аміно-1Hпіразол-3-карбоксаміду Одержання 1-(3-формілфеніл)-3-(3-трифтор-4-хлорфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 886 мг 4-хлор-3-трифторфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 117 мг очікуваного сирого альдегіду і безпосередньо використовують на + наступній стадії. ([М+Н] ): 343. RT=4,66 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 17: Приклад 17 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 206 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 7,3 мг продукту 17 (вихід=6%). EIMS ([М+Н] ): 453. RT=5,38 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 18: 19 UA 97965 C2 Трифторацетат піразол-3-карбоксаміду 5 10 15 20 25 30 35 40 4-{[3-({[4-(дифторметокси)][)феніл]карбомоїл}аміно)бензил]аміно}-1Н Одержання 1-(3-формілфеніл)-3-(4-дифторметоксифеніл) сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 741 мг 4-дифторметоксифенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 840 мг + очікуваного сирого альдегіду і безпосередньо використовують на наступній стадії. ([М+Н] ): 307. RT=3,39 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 18: Приклад 18 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 184 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 28,5 мг продукту 18 (вихід=27%). EIMS ([М+Н] ): 417. RT=4,9 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 19: Трифторацетат 4-{[3-({[2-хлор-4-(трифторметил)феніл]карбомоїл}аміно)бензил]аміно}-1Нпіразол-3-карбоксаміду Одержання 1-(3-формілфеніл)-3-(2-хлор-4-трифторметилфеніл) сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 886 мг 2-хлор-4-трифторметилфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 1 мг очікуваного сирого альдегіду і безпосередньо використовують на + наступній стадії. ([М+Н] ): 343. RT=4,66 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 19: Приклад 19 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 206 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 24,3 мг продукту 19 (вихід=22%). EIMS ([М+Н] ): 453. RT=5,36 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 20: Трифторацетат 4-{[3-{(4-метилфеніл)карбомоїл]аміно}бензил)][аміно]-1H-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(4-толіл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 533 мг 4-толілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 683 + мг очікуваного сирого альдегіду і безпосередньо використовують на наступній стадії. ([М+Н] ): 255. RT=3,16 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 20: Приклад 20 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 153 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після 20 UA 97965 C2 + 5 10 15 20 25 30 35 40 очищення препаративною ВЕРХ виділяють 15,3 мг продукту 20 (вихід=16%). EIMS ([М+Н] ): 365. RT=4,58 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 21: Трифторацетат 4-{[3-{(2,5-диметилфеніл)карбомоїл]аміно}бензил)][аміно]-1Н-піразол-3карбоксаміду Одержання 1-(3~формілфеніл)-3-(2,5-диметилфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 589 мг 2,5-диметилфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 660 мг + очікуваного сирого альдегіду і безпосередньо використовують на наступній стадії. ([М+Н] ): 269. RT=3,39 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 21: Приклад 21 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 161 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 26,7 мг продукту 21 (вихід=27%). EIMS ([М+Н] ): 379. RT=4,68 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 22: Трифторацетат 4-{[3-{(3,4-диметилфеніл)карбомоїл]аміно}бензил)][аміно]-1Н-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(3,4-диметилфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 589 мг 3,4-диметилфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 621 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній стадії. ([М+Н] ): 269. RT=3,55 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 22: Приклад 22 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 161 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 32 мг продукту 22 (вихід=32%). EIMS ([М+Н] ): 379. RT=4,8 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 23: Трифторацетат 4-[(3-{(2-метилфеніл)карбомоїл]аміно}бензил)аміно]-1H-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(2-толіл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 533 мг 2-толілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 621 + мг очікуваного сирого альдегіду і безпосередньо використовують на наступній стадії. ([М+Н] ): 255. RT=5,14 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 23: 21 UA 97965 C2 5 10 15 20 25 30 35 40 Приклад 23 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 153 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 16,7 мг продукту 23 (вихід=17%). EIMS ([М+Н] ): 365. RT=4,5 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 24: Трифторацетат 4-[(3-{(3-етилфеніл)карбомоїл]аміно}бензил)аміно]-1H-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(3-етилфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 589 мг 3-етилфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 732 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 255. RT=5,51 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 24: Приклад 24 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 160 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 12,2 мг продукту 24 (вихід=12%). EIMS ([М+Н] ): 365. RT=4,5 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 25: Трифторацетат 4-[(3-({[3,5-біс(трифторметил)феніл]карбомоїл}аміно)бензил]аміно)-1Нпіразол-3-карбоксаміду Одержання 1-(3-формілфеніл)-3-(3,5-біс-трифторметилфеніл) сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 1,02 г 3,5-біс-трифторметилфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 489 мг очікуваного сирого альдегіду і безпосередньо використовують на + наступній стадії. ([М+Н] ): 377. RT=5,05 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 25: Приклад 25 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 225 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 3,3 мг продукту 25 (вихід=4%). EIMS ([М+Н] ): 365. RT=4,5 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 26: Трифторацетат 4-[(3-{(3-фторфеніл)карбомоїл]аміно)бензил)аміно]-1H-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(3-фторфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 548 мг 3-фторфенілізоціанату (4 ммоль) в 4 мл ДХЕ. 22 UA 97965 C2 5 10 15 20 25 30 35 40 Виділяють 723 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 259. RT=4,04 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 26: Приклад 26 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 155 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 23,5 мг продукту 26 (вихід=25%). EIMS ([М+Н] ): 369. RT=4,7 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 27: Трифторацетат 4-[(3-{(2-метокси-5-метилфеніл)карбомоїл]аміно}бензил)аміно]-1H-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(2-метокси-5-метилфеніл) сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 653 мг 2-метокси-5-метилфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 797 мг + очікуваного сирого альдегіду і безпосередньо використовують на наступній стадії. ([М+Н] ): 285. RT=2,94 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 27: Приклад 27 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 170 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 20 мг продукту 27 (вихід=25%). EIMS ([М+Н] ): 395. RT=5 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 28: Трифторацетат 4-[(3-{(2,5-диметоксифеніл)карбомоїл]аміно}бензил)аміно]-1H-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(2,5-диметоксифеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 717 мг 2,5-диметоксифенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 853 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 301. RT=4,14 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 28: Приклад 28 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 170 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 11,8 мг продукту 28 (вихід=12%). EIMS ([М+Н] ): 411. RT=4,72 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 29: Трифторацетат 4-[(3-({[3-хлор-4-(дифторметоксифеніл]карбомоїл}аміно)бензил]аміно}-1Нпіразол-3-карбоксаміду 23 UA 97965 C2 5 10 15 20 25 30 35 Одержання 1-(3-формілфеніл)-3-(3-хлор-4-дифторметоксифеніл) сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 878 мг З-хлор-4-дифторметоксифенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 936 мг очікуваного сирого альдегіду і безпосередньо використовують на + наступній стадії. ([М+Н] ): 341. RT=4,21 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% -метод В). Одержання прикладу 29: Приклад 29 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 204 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 8,3 мг продукту 29 (вихід=7%). EIMS ([М+Н] ): 451. RT=5,36 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 30: Трифторацетат 4-[(3-{(2,5-дифторфеніл)карбомоїл]аміно}бензил)аміно]-1Н-піразол-3карбоксаміду Одержання 1-(3-формілфеніл)-3-(2,5-дифторфеніл)сечовини: Продукт одержують так, як описано в прикладі 2, виходячи з 484 мг 3-амінобензальдегіду (4 ммоль) (полімеризована форма) і 620 мг2,5-дифторфенілізоціанату (4 ммоль) в 4 мл ДХЕ. Виділяють 952 мг очікуваного сирого альдегіду і безпосередньо використовують на наступній + стадії. ([М+Н] ): 277. RT=4,13 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 30: Приклад 30 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 167 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 14,1 мг продукту 30 (вихід=14%). EIMS ([М+Н] ): 387. RT=4,82 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 31: Трифторацетат 4-[(3-({[4-метил-3-(трифторметил)феніл]карбомоїл}аміно)бензил]аміно}-1Hпіразол-3-карбоксаміду Одержання 1-(3-формілфеніл)-3-(4-метил-3-трифторметметилфеніл)сечовини: Сечовину одержують таким чином: 3 г 3-нітробензальдегіду (20 ммоль), 3,4 мл етиленгліколю (60 ммоль) і розчин 0,3 г паратолуолсульфонової кислоти в 250 мл толуолу 24 UA 97965 C2 5 10 15 20 25 30 35 40 45 кип'ятять протягом 4 годин, потім суміш виливають в 100 мл насиченого розчину бікарбонату натрію і екстрагують два рази 50 мл етилацетату. Об'єднані органічні фази промивають водою, сушать над сульфатом натрію і упарюють у вакуумі. Сирий продукт безпосередньо гідрують в 20 мл ТГФ в присутності 160 мг оксиду платини в апараті фірми Parr. Через 4 години гідрування при кімнатній температурі реакційну суміш фільтрують через целіт. Щоб уникнути повного розкладання одержаний анілін залишають в розчині в ТГФ в концентрації 10 ммоль/20 мл і використовують таким чином для утворення сечовини. 2 мл розчину аніліну (1 ммоль) обробляють 200 мг 4-метил-3-трифторметилфенілізоціанату протягом 4 годин при кімнатній температурі. Суміш виливають в 100 мл розчини НСI (10%) і екстрагують два рази 50 мл етилацетату. Об'єднані органічні фази промивають водою, сушать над сульфатом натрію і упарюють у вакуумі. Виділяють 320 мг очікуваного продукту у вигляді + твердої речовини (вихід кількісний). EIMS ([М+Н] ): 323. RT=4,37 хв (градієнтне елюювання ацетонітрил/вода від 30 до 90% - метод В). Одержання прикладу 31: Приклад 31 одержують способом, описаним для прикладу 1, виходячи з 200 мг смоли (іі), 193 мг сечовини (0,6 ммоль, 3 еквів.) і 66 мг ціанборгідриду натрію (1 ммоль; ~5 еквів.). Після + очищення препаративною ВЕРХ виділяють 36,7 мг продукту 31 (вихід=34%). EIMS ([М+Н] ): 433. RT=4,64 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - метод В). Приклад 32: Трифторацетат 4-[(3-({[2-фтор-5-(трифторметил)феніл]карбомоїл}аміно)бензил]аміно}-1Нпіразол-3-карбоксаміду метилу Сполуку 32 одержують прямим відновлювальним амінуванням метилового ефіру 4-аміно-3піразолкарбонової кислоти. Розчин 44 мг метилового ефіру 4-аміно-3-піразолкарбонової кислоти (0,31 ммоль) і 100 мг 1-(2-фтор-5-трифторметилфеніл)-3-(3-формілфеніл)сечовини (див. приклад 2) в суміші 0,6 мл ДХЕ і 0,5 мл ДМФ обробляють розчином 59 мг ціанборгідриду натрію в 0,5 мл метанолу і 0,05 мл оцтової кислоти. Суміш перемішують протягом 2 годин при 80°С, потім охолоджують і виливають в 20 мл води. Суміш екстрагують два рази 20 мл етилацетату. Об'єднані органічні фази промивають водою, сушать над сульфатом натрію і упарюють у вакуумі. Після очищення препаративною ВЕРХ виділяють 20,8 мг продукту 32 + (вихід=12%). EIMS ([М+Н] ): 452. RT=5,52 хв (градієнтне елюювання ацетонітрил/вода від 5 до 85% - спосіб В). Приклад 33: Трифторацетат 4-1-{3-[3-(2-фтор-5-трифторметилфеніл)уреїдо]фенілетиламіно}-1H-піразол3-карбоксаміду (1:1) Одержання 1-(3-ацетилфеніл)-3-(2-фтор-5-трифторметилфеніл) сечовини: Суміш 181 мг 3-аміноацетофенону (1,34 ммоль) і 275 мг 2-фтор-5трифторметилфенілізоціанату (1,34 ммоль) в 1 мл ТГФ залишають при перемішуванні при кімнатній температурі на 1 годину, потім упарюють. Тверду речовину витягують ефіром і фільтрують. Виділяють 307 мг очікуваного кетону (вихід=69%) з чистотою LC/MS 87%. Сирий + продукт безпосередньо використовують на наступній стадії. ([М+Н] ): 341. RT=6,06 хв (метод А). Одержання прикладу 33: 450 мг смоли І (0,45 ммоль) набухає в 2 мл ДХЕ, потім додають розчин 307 мг 1-(3ацетилфеніл)-3-(2-фтор-5-трифторметилфеніл)сечовини (0,9 ммоль; 2 еквів.) в 2 мл ДМФ і потім 149 мг ціанборгідриду натрію (2,25 ммоль; 5 еквів.). Суміш обробляють в мікрохвильовій печі СЕМ Discover при 100°С протягом 10 хвилин (потужність 90). Смолу далі послідовно промивають два рази 2 мл МеОН, З рази 2 мл дихлорметану, 2 рази 2 мл МеОН і 3 рази 2 мл 25 UA 97965 C2 5 10 15 20 25 30 35 40 45 50 дихлорметану. Продукт розділяють шляхом обробки смоли 4 мл розчину трифтороцтова кислота/дихлорметан в співвідношенні 50/50. Розчин упарюють і одержаний сирий продукт безпосередньо очищають препаративною ВЕРХ. Після ліофілізації одержують 13,5 мг + очікуваного продукту (біла тверда речовина, вихід=5%). ([М+Н] ): 451. RT=4,77 хв (метод А). Приклад 34: 4-({3-[3-(2-фтор-5-трифторметилфеніл)уреїдо]бензил}метиламіно)-1H-піразол-3-карбоксамід До розчину 0,25 г 4-[(3-амінобензил}метиламіно]-1Н-піразол-3-карбоксаміду в 25 мл безводного ТГФ додають при 20°С розчин 0,14 мл 1-фтор-2-ізоціанато-4-трифторметилбензолу. Реакційну суміш перемішують протягом 12 годин при 20°С, потім розбавляють 100 мл етилацетату. Органічну фазу промивають 50 мл дистильованої води, потім декантують, сушать над сульфатом магнію і упарюють досуха при зниженому тиску. Одержаний осад хроматографують на колонці з силікагелем (15 г силікагелевого патрона Merck з розміром частинок від 15 до 45 мкм, діаметр колонки 2,2 см, фракції 5 мл, витрата 10 мл/хв, елюант дихлорметан 95 метанол 5 - по об'єму). Фракції від 35 до 95 об'єднують, упарюють досуха при зниженому тиску. Одержують 0,02 г 4-({3-[3-(2-фтор-5трифторметилфешл)уреїдо]бензил}метиламіно)-1Н-піразол-3-карбоксаміду у вигляді твердої + речовини. ([М+Н] ): 451. RT=3,55 хв (метод А). 4-[(3-амінобензил}метиламіно]-1Н-піразол-3-карбоксамід одержують таким чином: До розчину 1,26 г 4-[метил-(3-нітробензил)аміно]-1Н-піразол-3-карбоксаміду в 90 мл абсолютного етанолу додають малими порціями 3,6 г хлориду олова дигідрату при 20°С. Реакційну суміш перемішують протягом 15 годин при 20°С, упарюють досуха при зниженому тиску. Осад витягують 500 мл суміші метиленхлорид 90/метанол 10 (по об'єму) і 500 мл водного насиченого розчину гідрогенокарбонату калію. Це середовище перемішують при 20°С протягом 2 годин, потім фільтрують. Одержану тверду речовину після фільтрації екстрагують двічі сумішшю 100 мл метиленхлориду 90 метанол 10 (по об'єму), рідкі фази об'єднують, декантують. Водну фазу екстрагують два рази 200 мл метиленхлориду, органічні фази об'єднують, промивають 300 мл водного насиченого розчину хлориду натрію, сушать над сульфатом натрію, фільтрують і упарюють досуха при зниженому тиску. Одержують 0,6 г 4-[(3+ амінобензил}метиламіно]-1H-піразол-3-карбоксаміду у вигляді крему безе. ([M+H] ): 246. RT=0,3 хв (метод А). 4-[метил-(3-нітробензил}аміно]-1Н-піразол-3-карбоксамід одержують таким чином: До розчину 2,49 г 2,4-диметоксибензиламіду 4-[метил-(3-нітробензил)аміно]-1Н-піразол-3карбонової кислоти в 30 мл толуолу додають 4,45 г моногідрату паратолуолсульфонової кислоти, потім реакційне середовище нагрівають при температурі утворення флегми толуолу протягом 17 годин. Після охолоджування реакційного середовища до кімнатної температури додають 15 мл метанолу, потім 700 мл етилацетату, і, нарешті, 300 мл дистильованої води. Доводять рН цього середовища до значення, яке дорівнює 11, шляхом додання 100 мл водного розчину IN гідроксиду натрію. Даний розчин фільтрують, тверду речовину екстрагують двічі 30 мл етилацетату, рідкі фази об'єднують, потім декантують. Водну фазу екстрагують двічі 200 мл метиленхлориду, органічні фази об'єднують, промивають 300 мл водного насиченого розчину хлориду натрію, сушать над сульфатом магнію, фільтрують і упарюють досуха при зниженому тиску. Одержують 1,41 г 4-[метил-(3-нітробензил}аміно]-1Н-піразол-3-карбоксаміду у вигляді + твердої бежевої речовини, яка плавиться при 166°С. ([М+Н] ): 276. RT=2,61 хв (метод А). 2,4-диметоксибензиламід 4-[метил-(3-нітробензил)аміно]-1Н-піразол-3-карбонової кислоти одержують таким чином: Розчин 1,61 г 2,4-диметоксибензиламід 4-(3-нітробензиламіно)-1Н-піразол-3-карбонової кислоти, 1,25 г параформальдегіду і 0,94 г безводного сульфату магнію в 70 мл крижаної оцтової кислоти перемішують при кімнатній температурі протягом 4 годин. Далі до даного розчину додають невеликими порціями 1,23 г ціанборгідриду натрію. Реакційне середовище перемішують протягом 2 годин при кімнатній температурі, потім виливають на 300 мл водного розчину натрію 5N і 120 г подрібненого льоду, доводять значення рН до 11. Далі додають 300 мл насиченого розчину хлориду натрію. Даний розчин фільтрують, тверду речовину промивають три рази 60 мл дистильованої води. Зібраний таким чином осад сушать на повітрі. 26 UA 97965 C2 5 10 15 20 25 30 35 40 45 50 55 Одержують 1,51 г 2,4-диметоксибензиламід 4-[метил-(3-нітробензил)аміно]-1Н-піразол-3+ карбонової кислоти у вигляді блідо-жовтої твердої речовини. ([М+Н] ): 426. RT=3,87 (метод А). 2,4-диметоксибензиламід 4-(3-нітробензиламіно)-1Н-піразол-3-карбонової кислоти одержують таким чином: До розчину 15,43 г 2,4-диметоксибензиламіду 4-аміно-1H-піразол-3-карбонової кислоти хлоргідрату і 7,01 г діізопропілетиламіну в 490 мл безводного тетрагідрофурану додають 8,2 г 3нітробензальдегіду і 5,9 г безводного сульфату магнію. Реакційне середовище кип'ятять із зворотним холодильником протягом 1 год 30 хв, залишають доти, поки температура не знизиться до 20°С, потім охолоджують до 5°С за допомогою водно-крижаної бані. До одержаної суспензії у вигляді крему невеликими порціями додають 15,5 г ціанборгідриду натрію. Реакційну суміш перемішують 5 хвилин при 5°С, потім залишають доти, поки температура не підвищиться до кімнатної. Залишають при перемішуванні при кімнатній температурі протягом 20 годин. Одержаний каламутний розчин оранжево-каштанового кольору виливають в 1500 мл дистильованої води. До одержаного прозорого розчину молочно-каштанового кольору додають 1000 мл дихлорметану. Після перемішування і декантації хлорметиленової фази водну фазу знов екстрагують двічі 500 мл дихлорметану. Органічні фази об'єднують, потім промивають 500 мл водного насиченого розчину хлориду натрію, сушать над сульфатом магнію, фільтрують через паперовий фільтр, потім сушать досуха в ротаційному випарнику (температура 40°С, Р: 15 мбар). Одержують 27,19 г клейких твердих речовини жовто-каштанового кольору, яку перекристалізовують з 360 мл ацетонітрилу при кип'ятінні із зворотним холодильником. Одержують першу порцію масою 7,7 г 2,4-диметоксибензиламіду 4-(3-нітробензиламіно)-1Hпіразол-3-карбонової кислоти у вигляді жовтої твердої речовини. Ацетонітрильний фільтрат виділяють, потім сушать досуха в ротаційному випарнику (температура 40°С, Р: 15 мбар). Одержують 19,7 г клейкої маси кольору охри, яку розтирають при 20°С в 50 мл ацетонітрилу протягом 1 години. Одержану суспензію фільтрують на фільтрі 0 VF n 3, промивають двічі 15 мл ацетонітрилу. Після сушіння на повітрі, а потім в сушильній шафі Heraeus (температура 40°С, Р: 0,2 мбар) одержують другу порцію масою 6,59 г 2,4диметоксибензиламіду 4-(3-нітробензиламіно)-1Н-піразол-3-карбонової кислоти у вигляді + твердої жовтої речовини. ([М+Н] ): 412. RT-3,93 хв (метод А). 2,4-диметоксибензиламід 4-аміно-1H-піразол-3-карбонової кислоти одержують таким чином: До суспензії 10,72 г 2,4-диметоксибензиламіду 4-нітро-1H-піразол-3-карбонової кислоти в 600 мл абсолютного етанолу додають невеликими порціями 27,64 г хлориду олова дигідрату. Реакційну суміш перемішують протягом 48 годин при 20°С. Одержаний прозорий розчин каштанового кольору сушать досуха в ротаційному випарнику. Одержаний світлий крем каштанового кольору витягують 700 мл суміші 90/10 по об'єму метиленхлорид/метанол. До одержаного коричневого розчину додають 700 мл водного насиченого розчину гідрогенокарбоната натрію. Одержану суспензію у вигляді крему перемішують протягом 1 години при кімнатній температурі. До суспензії додають 30 г Clarcel Flo, потім залишають перемішуватися на 10 хвилин при кімнатній температурі. Фільтрують, осад на фільтрі промивають двічі 250 мл суміші 90/10 по об'єму метиленхлорид/метанол. Тверду речовину віджимають, фільтрат витягують, потім переливають його в ємність для декантації. Хлорметиленову фазу декантують, потім водну фазу знову екстрагують двічі 250 мл дихлорметану. Органічні фази об'єднують, потім сушать над сульфатом магнію, фільтрують через паперовий фільтр, потім сушать досуха в ротаційному випарнику. Одержують 8,53 г 2,4диметоксибензиламід 4-аміно-1Н-піразол-3-карбонової кислоти у вигляді блідо-рожевої твердої + речовини. ([М+Н] ): 277). RT=2,36 хв (метод А). 2,4-диметоксибензиламід 4-нітро-1Н-піразол-3-карбонової кислоти одержують таким чином: До розчину 28,76 г 1-(3-диметиламінопропіл-3-етилкарбодіїміду хлоргідрату і 20,27 г 1гідроксибензотриазолу в 100 мл диметилформаміду додають 23 г 2,4-диметоксибензиламіну, потім 20,04 г 4-нітро-3-піразолкарбонової кислоти (98%). Реакційну суміш перемішують при кімнатній температурі протягом 20 годин. Потім одержаний жовтий прозорий розчин виливають в 1000 мл дистильованої води. Одержують білу суспензію, яку залишають на 1 годину при кімнатній температурі. Суспензію фільтрують, осад на фільтрі промивають 3 рази 250 мл дистильованої води. Одержаний твердий осад віджимають, сушать на повітрі, а потім в сушильній шафі Heraeus під вакуумом (температура 40°С, Р: 0,2 мбар). Одержують 40,65 г білої твердої речовини, яку розтирають в 750 мл ізопропанолу при кип'ятінні із зворотному холодильником протягом 20 хвилин. Одержану суспензію охолоджують на бані вода+лід протягом 2 годин, потім фільтрують. Осад на фільтрі промивають 2 рази 100 мл ізопропанолу, потім 2 рази 100 мл ізопропілового ефіру. Одержану тверду речовину сушать на повітрі, потім в 27 UA 97965 C2 сушильній шафі Heraeus (температура 40°С, Р: 0,2 мбар). Одержують 32,16 г 2,4+ диметоксибензиламіду 4-нітро-1Н-піразол-3-карбонової кислоти ([М+Н] ): 307). RT=3,12 хв. Приклад 35: 4-(етил{3-[3-(2-фтор-5-трифторметилфеніл)уреїдо]бензил}аміно)-1Н-піразол-3-карбоксамід 5 10 15 20 25 30 35 4-(етил{3-[3-(2-фтор-5-трифторметилфеніл)уреїдо]бензил}аміно)-1Н-піразол-3-карбоксамід одержують конденсацією 1-фтор-2-ізоціанато-4-трифторметилбензолу з 4-[(3амінобензил)етиламіно]- 1Н-піразол-3-карбоксамід згідно з методикою, описаною в прикладі 34, причому вказане похідне одержують з 4-[(3-нітробензил)етиламіно]-1H-піразол-3-карбоксаміду згідно з методикою, описаною також в прикладі 34. 4-[(3-нітробензил)етиламіно]-1Н-піразол-3-карбоксамід одержують таким чином: Розчин 2,2 г 2,4-диметоксибензиламіду 4-аміно-1Н-піразол-3-карбонової кислоти хлоргідрату, 1,3 мл діізопропілетиламіну в 70 мл ТГФ перемішують протягом 5 хвилин, потім до даного розчину додають 1,2 г 3-нітробензальдегіду і 0,85 г сульфати магнію. Реакційну суміш кип'ятять із зворотним холодильником протягом 1 години, потім після охолоджування до 45°С невеликими порціями додають 7,4 г триацетоксиборгідриду натрію, потім знов кип'ятять із зворотним холодильником протягом трьох годин. Поки весь вихідний продукт не зникне, після охолоджування до 45 °С, невеликими порціями додають 7,4 г триацетоксиборгідриду натрію, потім знов кип'ятять із зворотним холодильником протягом двох годин. Після охолоджування реакційної суміші до кімнатної температури її виливають в 350 мл дистильованої води. рН молочного блідо-жовтого розчину, одержаного таким чином, доводять до значення 8-9 шляхом додання 60 мл водного розчину гідроксиду натрію 2N. Додають 250 мл дихлорметану, потім після декантації, екстракції водної фази два рази 150 мл дихлорметану органічні фази об'єднують, промивають 250 мл водного насиченого розчину хлориду натрію, сушать над сульфатом магнію, фільтрують і сушать досуха при зниженому тиску. Одержують 3,19 г клейкого масла, яке хроматографують на колонці з силікагелем (90 г силікагелевого патрона Merck з розміром частинок від 15 до 45 мкм, діаметр колонки 4,7 см, фракції 15 мл, витрата 18 мл/хв, елюант етилацетат 70 циклогексан 30 по об'єму). Фракції 34-110 об'єднують, упарюють досуха при зниженому тиску. Одержують 2,22 г 4-[(3-нітробензил)етиламіно]-1H-піразол-3+ карбоксаміду у вигляді крему безе жовтого кольору. ([М+Н] ): 453). RT=4,02 хв. (метод А) Приклад 36: 4-({3-[3-(2-хлор-5-трифторметилфеніл)уреїдо]бензил}метиламіно)-1Н-піразол-3-карбоксамід 4-({3-[3-(2-хлор-5-трифторметилфеніл)уреїдо]бензил}метиламіно)-1Н-піразол-3-карбоксамїд одержують конденсацією 1-хлор-2-ізоціанато-4-трифторметилбензолу з 4-[(3амінобензил)метиламіно]-1Нпіразол-3-карбоксамідом згідно з методикою, описаною в прикладі + 34. ([М+Н] ): 467). RT=3,81 хв. (метод А). Приклад 37: 4-({3-[3-(4-трифторметилпіридин-2-іл)уреїдо]бензиламіно}-1Н-піразол-3-карбоксамід 40 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted pyrazoles, compositions containing these, method of production and use thereof
Автори англійськоюBjergarde, Kirsten, Dodson Mark, Mauger, Jacques, Nair Anil, Patek Marcel, Tabart Michel
Назва патенту російськоюЗамещенные пиразолы, содержащая их композиция, способ их получения и применения
Автори російськоюБьергард Кирстен, Додсон Марк, Може Жак, Наир Анил, Патек Марсель, Табар Мишель
МПК / Мітки
МПК: A61K 31/415, A61P 35/00, C07D 231/38
Мітки: композиція, заміщені, одержання, спосіб, застосування, містить, піразоли
Код посилання
<a href="https://ua.patents.su/39-97965-zamishheni-pirazoli-kompoziciya-shho-kh-mistit-sposib-kh-oderzhannya-i-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Заміщені піразоли, композиція, що їх містить, спосіб їх одержання і застосування</a>
Наступний патент: Механічне зчеплення панелей підлоги вертикальним складанням
Випадковий патент: Генератор імпульсів тиску диференціальної дії












