Заміщені n-(індолін-2-он-3-іл)-5-(2-гідроксіарил)-3-арил-2н-піразоли і спосіб їх одержання
Номер патенту: 93718
Опубліковано: 10.03.2011
Автори: Десенко Сергій Михайлович, Афанасіаді Людмила Михайлівна, Черненко Віталій Миколайович
Формула / Реферат
1. Заміщені N-(індолін-2-он-3-іл)-5-(2-гідроксіарил)-3-арил-2Н-піразоли загальної формули І
 ,
,
де R=H, Cl;
R1=H, Br, CH3;
Ar=C6H5, 4-CH3O-C6H4.
2. Спосіб одержання сполук формули І
 ,
,
де R=H, Cl;
R1=H, Br, CH3;
Ar=C6H5, 4-CH3O-C6H4;
який відрізняється тим, що конденсують рівномолярні кількості 3-арил-5-(2-гідроксіарил)-1Н-піразоліну і карбонільної сполуки в органічному розчиннику при нагріванні, причому як 3-арил-5-(2-гідроксіарил)-1Н-піразолін використовують 3-арил-5-(2-гідроксіарил)-1Н-піразоліни формули
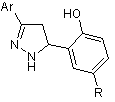 ,
,
як карбонільну сполуку - заміщені ізатини формули
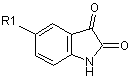 , а як органічний розчинник - диметилсульфоксид, реакцію конденсації проводять при температурі 135-145 °С і цільовий продукт виділяють етиловим спиртом.
, а як органічний розчинник - диметилсульфоксид, реакцію конденсації проводять при температурі 135-145 °С і цільовий продукт виділяють етиловим спиртом.
Текст
1. Заміщені N-(індолін-2-он-3-іл)-5-(2гідроксіарил)-3-арил-2Н-піразоли загальної формули І 2 HO N N O R1 N H I R де R=H, Cl; R1=H, Br, CH3; Ar=C6H5, 4-CH3O-C6H4; 3 93718 Сполуки формули І складаються із піразольного і індолінонового циклів, що обумовлює їх високу реакційну здатність до хімічних реакцій. Наявність декількох реакційних центрів у молекулах сполук формули І дозволяє функціналізувати структуру сполук (за СН-, NH- і ОН-групами), що дає можливість значно розширити асортимент важливих фізіологічно активних речовин. Наявність фармакофорного піразольного фрагмента у молекулах сполук, що заявляються, дозволяє використовувати їх у якості лікарських препаратів - інгібіторів САМР-фосфодіестирази [W.E. Kirpatrick, J.Med.Chem., 20, 386(1987)]; жарознижуючих препаратів [M. Elnagdi, Tetrahedron, 30, 2791(1974)]; речовин з протипухлинною активністю [M. Elnagdi, Tetrahedron, 31, 63(1975)]; снотворних засобів [Ger. Pat. 2131790, C07D 487/00, 487/04]; як терапевтичних засобів при ішемічних процесах, при ревматичному артриті, астмі, запаленні кишечнику [Пат. РФ 2266901, C07D239/54; А61К 31/513]; деякі з відомих сполук мають високу біологічну активність як кардіопротектори, фібрінолітки і т. ін. [S. Chabrial et al., Egypt J.Parm. Sci., 37, 375(1996); G. Yang et al., Chin. J. Chem. 18, 435(2000)]. З другого боку, відомо, що похідні індолінону являються основною субстанцією багатьох лікарських препаратів, які з успіхом використовуються для лікування таких хвороб, як рак і саркома [J.Natural.Product, 60, №4, 356(1997)]; мають виражену антигипоксичну (кисненасичення) активність [Химико-Фармацевтический Журнал, 19, №8, 960(1985)]; слабку антигрибкову і антибактеріальну активності [ХимикоФармацевтический Журнал, 18, №12, 1462(1984)]. Залежність біологічної дії таких складних гетероциклічних сполук від їх структури лежить в основі цілеспрямованого синтезу молекул з не обхідним комплексом біологічних властивостей і потребує підвищення ступеня простоти і доступності синтезу цих речовин. Відомий структурний аналог сполук, що заявляються, - 1-метил-5-(2-гідроксифенил)-3-фенил2Н-піразол формули II і спосіб його одержання [J. Nawrot-Moolnanka, К. Kostka, Polish J. Chem., 63, №1-3, 103(1989)] Ph HO N N CH3 II Недоліком структури формули II є неможливість варіації замісників в 3- і 5-положенні піразольного циклу. Авторами описаний лише NCH3-заміщений піразол, який є хімічно інертним і не піддається подальшим хімічним перетворенням. Спосіб одержання відомої сполуки формули II складається із 3-ох стадій і здійснюється за схемою: O OCOC6H5 OH COCH3 Ph H3C 4 C6H5COCl COCH3 C5H5N Ph HO N + N HO N глицерин O С6H5 NH2NHCH3 C2H5OH N CH3 II На першій стадії змішують 2гидроксиацетофенон з хлористим бензоїлом у сухому піридині, який заздалегідь сушать над гідроксидом натрію і переганяють, використовуючи ректифікаційну колонку. Виникає мимовільне підвищення температури. Коли виділення тепла зупиниться, суміш виливають на льод з соляною кислотою. Одержують 2-бензоїлоксиацетофенон, який після перекристалізації із метанолу має т. пл. 87-88°С, вихід 80%. Час проходження реакції на першій стадії (з урахуванням сушіння речовини при кімнатній температурі у повітрі) складає приблизно 16-17 годин. На другій стадії нагрівають 2бензоїлоксиацетофенон в свіжоперегнаному без водному гліцерині (гліцерин двічі піддають вакуумній перегонці і відразу використовують у реакції) у току азоту, який заздалегідь висушують пропущенням через промивну склянку з сірчаною кислотою. Суміш нагрівають до 260°С і піддержують цю температуру протягом 2-х годин при енергійному перемішуванні. Потім охолоджують до 100°С, виливають у воду і додають NaOH до слабо лужної реакції. Масу перемішують ще 15 хвилин, охолоджують і залишають на 48 годин при 0°С. Продукт відфільтровують, сушать при 50°С. Флавон, що утворився, очищають із петролейного ефіру, багатократно упарюючи і охолоджуючи, вихід складає приблизно 45%, т. пл. 96-97°С. Час реакції на другій стадії 69-72 години. 5 93718 6 кінцевого продукту у вигляді двох ізомерів, які потрібно розділяти на індивідуальні речовини. У зв'язку з викладеним, технічне рішення має дуже обмежене застосування, головним чином для наукових досліджень, де необхідні продукти у незначних кількостях. Серед заміщених 2-гідроксифенилпіразолів відомі 1-(R-бензил)-5-(2-гідроксифенил)-3фенилпіразоли загальної формули III На третій стадії конденсують 2-фенил-бензопірон (флавон) з моно-метилгідразіном в етанолі упродовж 48 годин при –5С. Одержують кінцевий продукт у вигляді суміші двох регіоізомерів, які розділяють фракціонуванням у вакуумі з виходом 1-метил-5-(2-гідроксифенил)-3фенил-2Н-піразолу 48%. Перекристалізовують із етанолу, т. пл. 91-93°С. Загальний час синтезу аналога складає приблизно 135-140 годин (з урахуваннямфракціонування у вакуумі для виділення окремих ізомерів). До недоліків способу одержання відомого аналога формули II можна віднести багатостадійність і тривалість процесу. Крім того, синтез проходить у середовищі газоподібного азоту, в процесі використовуються сухі розчинники, що значно ускладнює і здорожує спосіб одержання. На всіх технологічних стадіях необхідні перекристалізації і фракціонування у вакуумі, сушка розчинників над безводними сушниками. До недоліків способу відноситься також використання сильного лакриматора -бензоїлхлориду, який подразнює слизові оболонки дихальних шляхів, очей і шкіру; легких і вогненебезпечних розчинників (петролейний ефір, піридин); застосування низьких температур у процесі синтезу і сушіння реактивів; використання дуже гігроскопічного метилгідразину - небезпечного при проникненні через шкіру. Одним з головних недоліків відомого способу одержання аналога формули II є виділення Ph HO N де R=C6H5, 4-Cl-C6H4, 4-CH3O-C6H4, 4-NO2-C6H4; N CH2R III і спосіб їх одержання [С.М. Десенко, В.Н. Черненко, и др. Химия Гетеро-цикл. Соед.,№10, 1427(2001)]. Сполуки формули III розчиняються у спиртах, у полярних і неполярних розчинниках, у оцтовій кислоті, не розчиняються у воді, ефірі. Недоліком структури сполук формули III є неможливість варіювання замісників як у піразольному, так і 2-гідроксифенильному фрагментах молекул цієї структури. Авторами описано лише 4 сполуки з варіацією замісників у бензильному фрагменті. Спосіб одержання сполук формули III складається із 2-х стадій і реалізується за схемою: С6H5 С6H5 Ph HO N R-CHO N H N CH3OH R KON N O ДМФА ДМСО HO N N CH2R ІІІ На першій стадії суміш рівномолярних кількостей 3-фенил-5-(2-гідроксифенил)-1Нпіразоліну і відповідного свіжоперегнаного ароматичного альдегіду у метанолі кип'ятять 5-10 хвилин у присутності декількох крапель піперидину. При охолодженні виділяють 5-фенил-2-арил-1,10bдигідро-5Н-піразоло[1,5-с]1,3-бензоксазини з виходами 60-90%. На другій стадії розчин 5-фенил-2-арил-1,10bдигідро-5Н-піразоло[1,5-с]1,3-бензоксазину у суміші диметилформаміду і диметилсульфоксиду (5:1) в присутності 0,1 г гідроксиду калію кип'ятять до зникнення червоного забарвлення (1-1,5 години). Реакційну масу фільтрують, фільтрат виливають у воду, нейтралізують соляною кислотою до рН 7. Продукт, що випав, відфільтровують, сушать і перекристалізовують із октану. Загальний час реакції складає приблизно 1012 годин. До недоліків відомого способу слід віднести тривалість процесу, використання вогненебезпеч них і токсичних розчинників для синтезу і перекристалізації (метанол, октан). Враховуючи, що варіація замісників обмежена лише тільки у бензильному фрагменті, цей спосіб не дозволяє одержувати великий асортимент гетероциклічних сполук даної структури з корисними фармацевтичними і медичними властивостями. Необхідність очищення цільових продуктів не тільки зменшує вихід продуктів, але і збільшує енергетичні і матеріальні витрати. В основу винаходу поставлено задачу розробки нових сполук у низці N-(індоліл-2-он-3-іл)-5-(2гідроксиарил)-3-арил-2Н-піразолів з широкою варіацією замісників в усіх фрагментах молекули, а також більш простого і доступного способу їх одержання, що дозволяє підвищити вихід і якість кінцевих продуктів. Рішення поставленої задачі забезпечується розробкою заміщених N-(індоліл-2-он-3-іл)-5-(2гідроксиарил)-3-арил-2Н-піразолів сполук загальної формули І 7 Ar 93718 піразольному фрагменті за метиновою групою можлива реакція формілювання. Така функціоналізація структури молекул сполук, що заявляються, розширяє можливості створення нових складних гетероциклічних речовин з корисними можливостями. Цьому також сприяє вдалий вибір карбонільних сполук формули HO N N R1 де R=H, Cl; R1=H, Br, CH3; Ar=C6H5, 4-CH3O-C6H4; R O N H I O Рішення поставленої задачі забезпечується також тим, що у способі одержання сполук загальної формули І, згідно винаходу, конденсують рівно молярні кількості 3-арил-5-(2гідроксиарил)-1Н-піразоліну і карбонільної сполуки в органічному розчиннику при нагріванні, причому в якості 3-арил-5-(2-гідроксиарил)-1Н-піразоліну використовують 3-арил-5-(2-гідроксиарил)-1НAr піразоліни формули N , в N H індоліноновому фрагменті. Вибір указаних компонентів і проведення реакції у диметилсульфоксиді при температурі 135-145 °С дозволяє одержувати сполуки формули І достатньо чистими без додаткових перекристалізацій, що забезпечує високу швидкість протікання реакції з високими виходами (реакція проходить в одну стадію). У випадку проведення реакції при температурі нижче 135°С конденсація проходить не повністю. В процесі реакції виділяється вода, яку необхідно постійно виводити із сфери реакції для підвищення оптимального виходу кінцевого продукту. Підвищення температури реакції вище 145°С приводить до утворення смолистих побічних продуктів, що зменшують вихід цільових речовин, а також при тривалому кип'ятінні при високій температурі спостерігається частковий термічний розклад розчинника. Вибір диметилсульфоксиду в якості розчинника обумовлений тим, що реакція проходить без наявності лугу, яка здатна потенційно руйнувати індоліноновий фрагмент при високій температурі і тривалому кип'ятінні. Розчинність сполук формули І у високополярному розчиннику - диметилсульфоксиді при температурі нижче 135-145°С висока, тому для одержання чистого цільового продукту з максимальним виходом необхідне осадження етиловим спиртом. У таблиці представлено характеристики сполук формули І, що заявляються, і їх спектральні дані за способом, що заявляється. Спосіб, що заявляється здійснюється за схемою: якості R карбонільної сполуки - заміщені ізатини формули R1 O O , а в якості органічного розчинни N H ка - диметилсульфоксид, реакцію конденсації проводять при температурі 135-145°С і цільовий продукт виділяють етиловим спиртом. Можливість модифікації хімічної структури сполук формули І шляхом варіювання замісників R, R1 і арильного радикала, безпосередньо зв'язаного з піразольним фрагментом, дозволяє одержувати більш великий набір нових перспективних біологічно активних речовин у низці індолінопіразолів. Наявність декількох реакційних центрів у структурі сполук, що заявляються, передбачує можливість використання цих речовин в хімічних реакціях в якості поліфункціональних компонентів у синтезі складних гетероциклічних сполук, що грають найважливішу роль у процесах життєдіяльності живих організмів. Так, вільна іміногрупа в індоліноновому фрагменті здатна алкілуватися і ацілуватися, 2гідроксигрупа передбачає утворення простих і складних ефірів у реакціях алкілування і ацілування, у лужних середовищах утворює солі. У Ar O R1 N Ar O HO + N H N H R з варіацією замісників R1 в O R1 HO N H 8 ДМСО HO N N O R1 R N H I Суміш, що складається із рівномолярних кількостей 3-арил-5-(2-гідроксиарил)-1Н-піразоліну і відповідного заміщеного ізатину у 3мл диметилсульфоксиду нагрівають при 135-145°С протягом 2-3 годин. Після охолодження у реакційну масу додають 20мл етанолу, відфільтровують осад цільового продукту. 9 93718 Нижче наведено приклад конкретного виконання. Приклад. Одержання N-(індоліл-2-он-3-іл)-5-(2гідроксифенил)-3-фенил-2Н-піразолу. Суміш 0,48г (2ммоль) 3-фенил-5-(2гідроксифенил)-1Н-піразоліну і 0,3г (2ммоль) ізатину розчиняють у 3 мл диметилсульфоксиду, нагрівають на масляній бані, не доводячи до кипіння, при температурі 140°С протягом 2 годин. До реакційної маси додають 20мл етилового спирту. Осад, що випадає при охолодженні, відфільтровують і сушать. Вихід 0,6г (79%), т. пл. 203-205°С. Структуру N-[-(індоліл-2-он-3-іл)-5-(2гідроксифенил)-3-фенил-2Н-піразолу підтверджено спектральними даними. Спектри ядерного магнитного резонансу (ЯМР Н1) виміряно на спектрометрі VARIAN Mercury VX200 (200 МГц) у розчинах дейтеродиметилсульфоксиду (ДМСО-d6), внутрішній стандарт - тетраметилсилан; (м.ч.): 5,82 (1Н, с, (СН (інд.)), 6,73 (1Н, с, СН (пір.)), 10,11 (1Н, у. с, (ОН)), 10,76 (1Н, у. с, (NH)). Решту прикладів наведено у таблиці. 10 Як видно із тексту матеріалів, що заявляються, та даних таблиць технічне рішення має наступні переваги: - структура, що заявляється, дозволяє широко варіювати арильні радикали у піразольному фрагменті і замісники у індоліноновому і гідроксифенільному залишках, що забезпечує створення широкого асортименту індолінонпіразолів; - спосіб одержання сполук формули І дозволяє зменшити тривалість технологічного процесу та підвищити вихід та якість кінцевих продуктів без додаткових перекристалізацій. Поєднання в одній молекулі формули І індолінонового і піразольного фрагментів (з урахуванням їх потенційних фармацевтичних і медичних застосувань) дозволяє розширити асортимент нових лікарських препаратів і фізіологічно активних речовин з новими особливостями і практичними застосуваннями. Спосіб одержання сполук формули І простий у технологічному плані, здійснюється в одну стадію і може легко відтворюватися як у лабораторних, так і у виробничих умовах. Таблиця Сполуки І R Т.пл, °С H 203-205 79 H СН3 185-187 76 C6H5 H Вr 221-222 81 4 C6H5 Сl H 219-221 90 5 C6H5 Сl СН3 199-201 85 6 C6H5 Сl Вr 218-222 92 7 4-СН3О-С6Н4 Н H 193-194 83 8 4-СН3О-С6Н4 Н СН3 200-201 80 9 4-СН3О-С6Н4 Н Вr 223-225 89 10 4-СН3О-С6Н4 СІ Н 218-222 93 11 4-СН3О-С6Н4- Сl СН3 201-203 82 12 4-СН3О-С6Н4 Вr 222-223 91 ЯМР Н1, 6 (м.ч.)* Вихід, % NN Аr 1 C6H5 H 2 C6H5 3 Сl R1 5,82 (1Н, с, (СН (інд.)), 6,73 (1Н, с, СН (пір.)), 10,11 (1Н, у.с. (ОН)), 10,76 (1H,y.c., (NH)) 2,41 (3Н, с, СН3), 5,80 (1Н, с, (СН (інд.)), 6,70 (1Н, с, СН (пір.)), 10,13 (1Н, у. с, (ОН)), 10,79 (1Н, у. с, (NH)) 5,85 (1H, с, (СН (інд.)), 6,76 (1Н, с, СН (пір.)), 10,09 (1H, у.с. (ОН)), 10,80 (1H, y.c., (NH)) 5,84 (1Н, с, (СН (інд.)), 6,75 (1H, с, СН (пір.)), 10,10 (1H, у.с.,(ОН)), 10,77 (1H,y.c.,(NH)) 5,83 (1Н, с, (СН (інд.)), 6,75 (1H, с, СН (пір.)), 10,12 (1Н, у.с. (ОН)), 10,78 (1H, у. c., (NH)) 5,82 (1Н, с, (СН (інд.)), 6,70 (1Н, с, СН (пір.)), 10,10 (1Н, у.с. (ОН)), 10,75 (1H, y.c., (NH)) 3,82 (3Н, с, СН3О), 5,85 (1Н, с, (СН (інд.)), 6,71 (1Н, с, СН (пір.)), 10,13 (1Н, у. с, (ОН)), 10,79 (1Н, у. с, (NH)) 2,45 (3Н, с, СН3), 3,86 (3Н, с, СН3О), 5,87 (1H, с, (СН (інд.)), 6,72 (1Н, с, СН (пір.)), 10,09 (1Н, у. с, (ОН)), 10,71 (1H,y.c.,(NH)) 3,83 (3Н, с, СН3О), 5,80 (1Н, с, (СН (інд.)), 6,69 (1Н, с, СН (пір.)), 10,11 (1Н, у. с, (ОН)), 10,70 (1Н, у. с, (NH)) 3,90 (3Н, с, СН3О) 5,87 (1H, с, (СН (інд.)), 6,68 (1Н, с, СН (пір.)), 10,13 (1Н, у. с, (ОН)), 10,69 (1Н, у. с, (NH)) 2,43 (3Н, с, СН3), 3,85 (3Н, с, СН3О), 5,79 (1Н, с, (СН (інд.)), 6,70 (1Н, с, СН (пір.)), 10,10 (1Н, у. с, (ОН)), 10,70 (1H,y.c., (NH)) 3,84 (3Н, с, СН3О), 5,82 (1Н, с, (СН (інд.)), 6,76 (1Н, с, СН (пір.)), 10,12 (1H, у. с, (ОН)), 10,72 (1Н, у. с, (NH)) *Ароматичні протони резонують в області 6,7-8,1 м.ч. 11 Комп’ютерна верстка Н. Лиcенко 93718 Підписне 12 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted n-(indoline-2-one-3-yl)-5-(2-hydroxyaryl)-3-aryl-2h-pyrazoles and a process for the preparation thereof
Автори англійськоюChernenko Vitalii Mykolaiovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюЗамещенные n-(индолин-2-oh-3-ил)-5-(2-гидроксиарил)-3-арил-2h-пиразолы и способ их получения
Автори російськоюЧерненко Виталий Николаевич, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 231/00, C07D 209/12
Мітки: n-(індолін-2-он-3-іл)-5-(2-гідроксіарил)-3-арил-2н-піразоли, одержання, спосіб, заміщені
Код посилання
<a href="https://ua.patents.su/6-93718-zamishheni-n-indolin-2-on-3-il-5-2-gidroksiaril-3-aril-2n-pirazoli-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Заміщені n-(індолін-2-он-3-іл)-5-(2-гідроксіарил)-3-арил-2н-піразоли і спосіб їх одержання</a>
Наступний патент: Спосіб одержання палива з волокнистих матеріалів (варіанти)
Випадковий патент: Спосіб контролю обводнення світлих нафтопродуктів










