Спосіб отримання ізольованих гепатоцитів
Номер патенту: 14519
Опубліковано: 09.01.1997
Автори: Воловельска Єлизавета Леонідівна, Дворцевой Володимир Костянтинович, Коптьолов Віталій Олександрович, Дворцевой Володимир Володимирович
Формула / Реферат
Способ получения изолированных гепатоцитов, включающий перфузию печени сахарозной средой, содержащей ЭДТА, с последующей дезагрегацией ткани и выделением целевого продукта, отличающийся тем, что перфузию проводят в течение 5-6 минут, причем в перфузионную среду дополнительно вводят 0,25%-ный раствор трипсина, а ЭДТА берут в концентрации 1,0-1,2 мМ при следующем соотношении компонентов:
Сахароза 70-100 г/л
Хлористый калий 0,010-0,022 г/л
Хлористый натрий 0,009-0,030 г/л
ЭДТА 0,5-0,8 г/л
Трипсин 0,5-1,0 мл
Вода бидистилированная до 1 л.
Текст
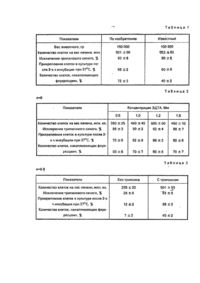
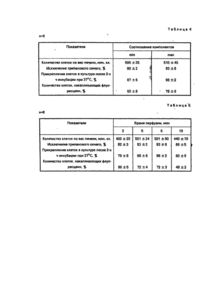
Изобретение относится к биотехнологии и может быть использовано в клеточной биологии и экспериментальной медицине. Известен способ получения изолированных гепатоцитов, включающий двухэтапную перфузию органа раствором Локка, содержащим 3 мМ ЭДТА, и дезагрегацию в сахарозной среде [1]. Недостатками способа являются трудоемкость, длительность и низкий выход жизнеспособных клеток. Наиболее близким к заявляемому по своей сущности и достигаемому эффекту является.способ получения изолированных гепатоцитов [2], включающий перфузию печени в течение 15-20 мин сахарозным раствором, содержащим ЭДТА в концентрации 3,5-4,5 мМ, при следующем соотношении компонентов, г/л (рН 7,4): После перфузии печень гюдвергают дезагрегации с помощью вибрационного устройства и отделяют жизнеспособные гепатоциты. Недостатком способа является низкий уровень структурно-функциональной сохранности изолированных гепатоцитов Задачей изобретения является создание такого способа получения изолированных гепатоцитов, в котором путем изменения состава перфузионной среды и времени перфузии можно было бы снизить повреждающее действие этих двух факторов и тем самым повысить структурно-функциональную сохранность гепатоцитов Эта задача решается тем, что в способе получения изолированных гепатоцитов, включающем перфузию печени сахарозной средой, содержащей ЭДТА, с последующей дезагрегацией ткани и выделением целевого продукта, перфузию проводят в течение 5-6 мин, в перфузионную среду дополнительно вводят 0,25%-ный раствор трипсина, а ЭДТА берут в концентрации 1,0-1,2 мМ при следующем соотношении компонентов (рН 8,0): Способ получения изолированных гепатоцитов иллюстрируется следующими примерами. Примар 1. Анестезированным животным весом 150-300 гр вскрывали брюшную полость, вводили инъекционную иглу в воротную вену и закрепляли лигатурой. Нижнюю полую вену надсекали для оттока перфузата. Перфузию проводили через систему переливания крови с использованием перистальтического насоса сахарозным раствором следующего состава (рН 8,0): Трипсин использовали 25%-ный, выпускаемый в фасовке по 500 мл Томским НИИ вакцин и сывороток. Нагретый до 37°С раствор пропускали через орган в течение б мин (объем перфузата 100 мл). После окончания перфузии печень извлекали из брюшной полости, измельчали ножницами и подвергали дезагрегации с помощью вибрационного устройства. Полученную суспензию фильтровали через нейлоновый фильтр. Отделение жизнеспособных гепатоцитов от поврежденных проводили путем центрифугирования первичной суспензии гепатоцитов в течение 3 мин при 1000 об/мин. После отделения клетки промывали средой 199, содержащей 5%-ную сыворотку эмбриона человека. Уровень структурно-функциональной сохранности, предполагающий более тонкую корреляцию и координацию процессов со стороны различных систем клетки, оценивали по прикреплению клеток в культуре [3] и по включению в клетку флуоресцеиндиацетата [4]. В табл. 1 представлены результаты исследования гепатоцитов, выделенных предлагаемым и известным способами. Из табл. 1 видно, что предлагаемый способ позволяет получить гепатоциты с более высоким уровнем структурно-функциональной сохранности, чем прототип. Пример 2. Способ осуществляли аналогично примеру 1, но с различными концентрациями ЭДТА в перфузионном растворе. Результаты приведены в табл. 2. Из табл. 2 видно, что оптимальная концентрация ЭДТА в перфузионной среде 1,0-1,2 мМ. При концентрациях выше или ниже заявляемых снижается выход жизнеспособных клеток. Пример 3. Способ осуществляли аналогично примеру 1, но в среду перфузии не вводили трипсин. Результаты представлены в табл. 3. Как видно из табл. 3, отсутствие трипсина в перфузионной среде приводит к резкому снижению показателей структурно-функциональной сохранности гепатоцитов. Пример 4. Способ осуществляли аналогично примеру 1, но перфузию проводили средами, одна из которых содержала минимально допустимые, а другая - максимально допустимые количества компонентов (рН 8,0): Результаты приведены в табл. 4 Из табл. 4 следует, что перфузия печени средами, содержащими минимальные и максимальные количества компонентов, обеспечивает возможность получения клеток с высоким уровнем структурно-функциональной сохранности. Пример 5. Способ осуществляли аналогично примеру 1, но изменяли время п-9-12 перфузии печени. Результаты представлены в таблице 5. Из табл. 5 видно, что оптимальное время перфузии 5-6 мин. Таким образом, из проведенных экспериментов следует, что предлагаемый способ позволяет повысить структурно-Функциональную сохранность изолированных гепатоцитов в 1,5-2 раза.
ДивитисяДодаткова інформація
Автори англійськоюDvortsevoi Volodymyr Kostiantynovych, Volovelska Yelizaveta Leonidivna, Koptiolov Vitalii Oleksandrovych, Dvortsevoi Volodymyr Volodymyrovych
Автори російськоюДворцевой Владимир Костянтинович, Воловельская Елизавета Леонидовна, Коптелов Виталий Александрович, Дворцевой Владимир Владимирович
МПК / Мітки
Мітки: отримання, ізольованих, гепатоцитів, спосіб
Код посилання
<a href="https://ua.patents.su/4-14519-sposib-otrimannya-izolovanikh-gepatocitiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання ізольованих гепатоцитів</a>
Попередній патент: Спосіб приготування сорбенту для визначення забруднювачів повітря
Наступний патент: Спосіб отримання епоксидних смол
Випадковий патент: Струмознімач