Спосіб консервування тканин фетоплацентарного комплексу
Номер патенту: 30808
Опубліковано: 15.12.2000
Автори: Прокопюк Володимир Юрійович, Козлова Віра Пилипівна, Прокопюк Ольга Степанівна, Грищенко Валентин Іванович, Строна Віра Іванівна, Юрченко Тетяна Миколаївна
Формула / Реферат
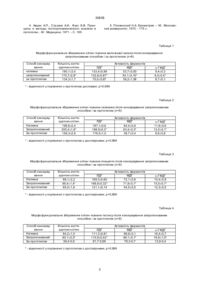
Спосіб консервування тканин фетоплацентарного комплексу шляхом заморожування до -196°С у консервуючому середовищі, яке містить 10% диметилсульфоксида, який відрізняється тим, що середовище додатково містить 10% поліетиленоксиду молекулярної маси 400, а заморожування здійснюють спочатку зі швидкістю 1 – 2 /хв до 0°С, потім зі швидкістю 5 - 6°/хв до -10°С, далі витримують при -10°С 1,5 - Згод, після чого занурюють у рідкий азот.
Текст
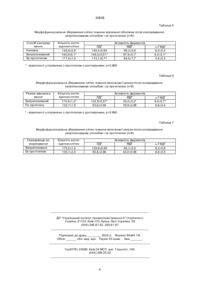
Спосіб консервування тканин фетоплацентарного комплексу шляхом заморожування до -196°С у консервуючому середовищі, яке містить 10% диметилсульфоксида, який відрізняється тим, що середовище додатково містить 10% поліетиленоксиду молекулярної маси 400, а заморожування здійснюють спочатку зі швидкістю 1-2°/хв до 0°С, потім зі швидкістю 5-6°/хв до -10°С, далі витримують при -10°C 1,5-2 год, після чого занурюють у рідкий азот. (19) (21) 98062927 (22) 05.06.1998 (24) 15.12.2000 (33) UA (46) 15.12.2000, Бюл. № 7, 2000 р. (72) Грищенко Валентин Іванович, Юрченко Тетяна Миколаївна, Прокопюк Ольга Степанівна, Строна Віра Іванівна, Козлова Віра Пилипівна, Прокопюк Володимир Юрійович (73) ІНСТИТУТ ПРОБЛЕМ КРІОБІОЛОГІЇ І КРІОМЕДИЦИНИ НАН УКРАЇНИ 30808 клітин на 46% вища, активність ЛДГ, МДГ, a-ГФДГ - на 80%, 25% і 22%, відповідно, вища ніж у прототипі і не відрізняється від показників нативних клітин. Приклад 5. Хоріальну оболонку плоду 1820 тижнів розвитку відмивали у фіз. розчині, фрагментували на шматочки розміром 3´5 см та інкубували 30 хв у середовищі 199, що містить 10% ДМСО і 10% ПЕО-400. Потім переносили до контейнера об'ємом 15 см 3, наповнений тим же середовищем і заморожували від кімнатної температури до 0°С зі швидкістю 1-2°/хв, потім до -10°С зі швидкістю 5-6°/хв, а після 1,5-2,0 годинної витримки занурювали у рідкий азот, де зберігали при -196°С протягом 1 місяця. Результати представлені в табл. 5 у порівнянні з даними, отриманими після консервування хоріальної оболонки за прототипом. 3 табл. 5 видно, що після консервування запропонованим способом кількість життєздатних клітин на 23% вища, а активність ЛДГ, МДГ і aГФДГ на 28%, 53% і 45%, відповідно, вища, ніж за прототипом і не відрізняється від нативних. Приклад 6. Вилочкову залозу після виділення обполіскували фізіологічним розчином кімнатної температури і занурювали на 30 хв у середовище 199, яке містить 10% ДМСО і 10% ПЕО-400. Потім переносили до пластикового контейнера об'ємом 15 см 3, наповненого таким же середовищем, і після 20 хвилин інкубації при 0°С заморожували зі швидкістю 5-7°/хв до -196°С. Розморожування здійснювали на водяній бані при 40-42°С. Результати представлені в табл. 6. З табл. 6 видно, що після заморожування залози в запропонованому середовищі, але за режимом прототипу, показники морфофункціонального збереження клітин є нижчими, ніж після заморожування за запропонованим режимом: кількість життєздатних клітин на 32%, активність ЛДГ - на 42%, МДГ на 38% і a-ГФДГ на 90%. Приклад 7. Вилочкову залозу після виділення обполіскували фізіологічним розчином кімнатної температури і занурювали на 30 хв у середовище Хенкса, що містить 10% ДМСО. Після цього її переносили до контейнера, наповненого таким же розчином, і охолоджували до 0°С зі швидкістю 12°/хв, потім до -10°С із швидкістю 5-6°/хв, витримували 1,5-2 год і занурювали у рідкий азот. Результати представлені в табл. 7. 3 табл. 7 видно, що після заморожування за запропонованим режимом, але в середовищі зa прототипом збереження клітин зменшується на 30%, активність ЛДГ - на 52%, МДГ - на 40%, aГФДГ - на 6%. Приклади 6, 7 свідчать про те, що тільки запропоноване сполучення середовища та режиму заморожування забезпечує досягнення високого морфофункціонального збереження тканин фетоплацентарного комплексу. Джерела інформації 1. Пат. України № 7862, А01N1/02, 1995. 2. Пушкарь Н.С., Белоус А.М., Цуцаева А.А. и др. Низкотемпературное консервирование костного мозга. – К.: Наук. думка, 1976. - С. 177. 3. Лилли Р. Патолистологическая техника и практическая гистология. - М.: Мир, 1969. - С. 354. нянні з даними, отриманими після консервування вилочкової залози за прототипом. З табл. 1 видно, що після консервування запропонованим способом кількість життєздатних клітин на 31% вища, активність ЛДГ, МДГ, a-ГФДГ на 77%, 42%, 7%, відповідно є вищою, ніж за прототипом, і не відрізняється від показників нативних клітин. Приклад 2. Селезінку отримували з плоду людини 18-20 тижнів розвитку, обполіскували фізіологічним розчином кімнатної температури, розсікали на 2 частини і після 30 хв експозиції в середовищі 199, що містить 10% ПЕО-400 і 10% ДМСО, вміщували до пластикового контейнера об'ємом 15 см 3, наповненого тим же середовищем. Заморожування здійснювали від кімнатної температури до 0°С із швидкістю 1-2°/хв, від 0°С до -10°С зі швидкістю 5-6°/хв, витримували при -10°С 1,52 год і потім занурювали в рідкий азот, де зберігали при -196°С протягом 1 місяця. Розморожування проводили на водяній бані при 40-42°С. Результати представлені в табл. 2 у порівнянні з даними, отриманими після консервування селезінки за прототипом. З табл. 2 видно, що після консервування запропонованим способом кількість життєздатнихклітин на 31% є вищою, а активність ЛДГ, МДГ і aГФДГ на 8%, 34% і 40%, відповідно, є вищою, ніж за прототипом і не відрізняється від показників нативних клітин. Приклад 3. Плаценту людини перфузували через пупкову вену фізіологічним розчином протягом 10 хв. Після цього її відмивали від елементів крові, готували фрагменти розміром 3´2 см, уміщували на 30 хв у середовище 199, що містить 10% ДМСО і 10% ПЕО-400, потім переносили до контейнера об'ємом 15 см 3, наповненого тим же середовищем. Заморожування здійснювали від кімнатної температури до 0°С зі швидкістю 1-2°/хв, потім до -10°С зі швидкістю 5-6°/хв і після 1,5-2 годинної витримки занурювали у рідкий азот, де зберігали при -196°С протягом 1 місяця. Результати представлені в табл. 3. у порівнянні з даними, отриманими після консервування плаценти за прототипом. З табл. 3 видно, що після консервування запропонованим способом кількість життєздатних клітин на 32% вища, а активність ЛДГ, МДГ і aГФДГ на 39%, 32% і 26%, відповідно, вища ніж за прототипом і не відрізняється від показників нативних клітин. Приклад 4. Тестис плоду 18-20 тижнів розвитку після виділення з оточуючи х тканин обполіскували у фізіологічному розчині, наносили 3-4 насічки на капсулу і 30 хв інкубували у середовищі 199, що містить 10% ДМСО і 10% ПЕО-400. Потім вміщували у контейнер об'ємом 15 см 3, наповнений тим же середовищем і після 30 хвилин витримки при кімнатній температурі, заморожували до 0°С зі швидкістю 1-2°/хв, потім до -10°С зі швидкістю 56°/хв, тримали при -10°С протягом 1,5-2 год і занурювали у рідкий азот, де зберігали при -196°С протягом 1 міс. Результати представлені в табл. 4 у порівнянні з даними, отриманими після консервування тестисів за прототипом. З табл. 4 видно, що після консервування запропонованим способом кількість життєздатних 2 30808 4. Авцин А.П., Струхов А.И., Фукс Б.В. Принципы и методы гистоцитохимического анализа в патологии. - М.: Медицина, 1971. - С. 185. 5. Плохинский Н.А. Биометрия. – М.: Московский университет, 1970. - 175 с. Таблиця 1 Морфо функціональне збереження клітин тканини вилочкової залози після консервування запропонованим способом і за прототипом (п=8) Спосіб консервування нативна запропонований за прототипом Кількість життєздатних клітин 180,1±3,4 175,7±2,8* 134,3±1,7 ЛДГ 133,4±0,99 132,8±0,87* 75,0±0,67 Активність ферментів МДГ 53,7±0,83 54,1±0,15* 38,2±1,06 a-ГФДГ 9,4±0,3 9,3±0,4* 8,7±0,1 * - відмінності у порівнянні з прототипом достовірні, р>0,999 Таблиця 2 Морфо функціональне збереження клітин тканини селезінки після консервування запропонованим способом і за прототипом (п=8) Спосіб консервування Нативна Запропонований За прототипом Кількість життєздатних клітин 196,6±2,4 205,4±1,8* 156,3±2,9 ЛДГ 187,1±0,6 186,9±0,3* 176,5±1,0 Активність ферментів МДГ 64,4±0,9 63,4±0,3* 38,7±0,4 a-ГФДГ 11,8±0,6 12,0±0,1* 8,6±0,8 * - відмінності у порівнянні з прототипом є достовірними, р>0,999 Таблиця 3 Морфо функціональне збереження клітин тканини плаценти після консервування запропонованим способом і за прототипом (п=8) Спосіб консервування Нативна Запропонований За прототипом Кількість життєздатних клітин 88,1±2,2 86,4±1,4* 65,5±1,8 ЛДГ 169,3±0,60 168,9±0,32* 121,1±0,14 Активність ферментів МДГ 72,1±0,8 71,9±0,1* 54,5±0,5 a-ГФДГ 15,4±0,9 15,5±0,1* 12,3±0,5 * - відмінності у порівнянні з прототипом є достовірними, р>0,999 Таблиця 4 Морфо функціональне збереження клітин тканини тестису після консервування запропонованим способом і за прототипом (п=8) Спосіб консервування Нативна Запропонований За прототипом Кількість життєздатних клітин 84,2±1,0 85,1±0,3* 58,4-0,9 ЛДГ 111,3±0,81 110,9±0,42* 61,7-0,66 Активність ферментів МДГ 98,9±0,1 99,1±0,1* 79,3-0,7 * - відмінності у порівнянні з прототипом є достовірними, р>0,999 3 a-ГФДГ 16,4±0,7 16,9±1,0* 13,9-0,4 30808 Таблиця 5 Морфо функціональне збереження клітин тканини хоріальної оболонки після консервування запропонованим способом і за прототипом (п=8) Спосіб консервування Нативна Запропонований За прототипом Кількість життєздатних клітин 145,6±0,9 144,9±0,1* 117,4±1,0 ЛДГ 145,4±0,64 145,0±0,51* 113,1±0,71 Активність ферментів МДГ 98,3±0,6 97,9±0,1* 64,0±1,7 a-ГФДГ 6,5±0,4 6,4±0,1* 4,4±0,3 * - відмінності у порівнянні з прототипом є достовірними, р>0,999 Таблиця 6 Морфо функціональне збереження клітин тканини вилочкової залози після консервування запропонованим способом і за прототипом (п=8) Режим заморожування Запропонований По прототипу Кількість життєздатних клітин 174,9±1,2* 132,7±1,9 ЛДГ 132,9±0,57* 93,6±0,59 Активність ферментів МДГ 55,0±0,2* 39,9±0,88 a-ГФДГ 9,4±0,7* 8,6±0,4 * - відмінності у порівнянні з прототипом є достовірними, р>0,999 Таблиця 7 Морфо функціональне збереження клітин тканини вилочкової залози після консервування запропонованим способом і за прототипом (п=8) Середовище заморожування Запропонована За прототипом Кількість життєздатних клітин 175,0±1,5 135,1±2,0 ЛДГ 129,9±0,99 85,6±0,88 Активність ферментів МДГ 56,1±0,5 40,0±0,56 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 4 a-ГФДГ 9,3±0,8 8,8±0,5
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod to preserve tissues of fetoplacental complex
Автори англійськоюHryschenko Valentyn Ivanovych, Yurchenko Tetiana Mykolaivna, Prokoliuk Olha Stepanivna, Strona Vira Ivanivna, Kozlova Vira Vasylivna, Prokopiuk Volodymyr Yuriiovych
Назва патенту російськоюСпособ консервирования тканей фетоплацентарного комплекса
Автори російськоюГрищенко Валентин Иванович, Юрченко Татьяна Николаевна, Прокопюк Ольга Степановна, Строна Вера Ивановна, Козлова Вера Филипповна, Прокопюк Владимир Юрьевич
МПК / Мітки
МПК: A01N 1/02
Мітки: консервування, фетоплацентарного, тканин, комплексу, спосіб
Код посилання
<a href="https://ua.patents.su/4-30808-sposib-konservuvannya-tkanin-fetoplacentarnogo-kompleksu.html" target="_blank" rel="follow" title="База патентів України">Спосіб консервування тканин фетоплацентарного комплексу</a>
Попередній патент: Прямий стоматологічний наконечник
Наступний патент: Спосіб лікування атопічного кератокон’юнктивіту
Випадковий патент: Пиляльний вузол горизонтального стрічкопиляльного верстата для поздовжнього розпилювання деревини