Діалкіламіноалкілбензімідазо[1,2-с]хіназоліни як противірусні агенти та індуктори інтерферону
Номер патенту: 32159
Опубліковано: 12.05.2008
Автори: Погосова Юлія Олексіївна, Ляхов Сергій Анатолійович, Жолобак Надія Михайлівна, Співак Микола Якович, Андронаті Сергій Андрійович, Ляхова Олена Анатоліївна
Формула / Реферат
Діалкіламіноалкілбензімідазо[1,2-с]хіназоліни загальної формули
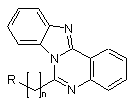 ,
,
де n=1, R - піперидин-1-іл або 2-метилпіперидин-1-іл, або 4-метилпіперидин-1-іл, або морфолін-4-іл, або 4-метилпіперазин-1-іл;
n=2, R - піперидин-1-іл, або 2-метилпіперидин-1-іл, або 4-метилпіперидин-1-іл, або морфолін-4-іл, або 4-метилпіперазин-1-іл,
як противірусні агенти та індуктори інтерферону.
Текст
Корисна модель відноситься до біоорганічної хімії, зокрема до синтезу противірусних агентів та індукторів інтерферону, і може бути використана для створення нових противірусних та імунокорегуючих засобів. Пошук нових противірусних засобів обумовлений розповсюдженістю вірусних інфекцій, можливістю мутацій та виникненням нових вірусів, що є збудниками небезпечних для людини захворювань. За даними ВООЗ [Доклад о состоянии здравохранения в мире, 2007г. http://whqlibdoc.who.int/whr/2007/WHR07_overview_rus.pdf], в останній чверті XX століття знову з'явилися холера, жовта лихоманка й епідемічні менінгококові захворювання, вимагаючи поновлення зусиль з епіднагляду, профілактиці й боротьбі з ними. Важкий гострий респіраторний синдром (ВГРС) і пташиний грип у людини викликали серйозну стурбованість міжнародного співтовариства, поставили нові питання перед наукою, заподіяли людям серйозні страждання й викликали величезний економічний збиток. Інші вірусні захворювання, наприклад лихоманка Эбола, Марбургська геморагічна лихоманка й вірус Ніпах, створюють погрозу для глобальної безпеки в області охорони здоров'я й також вимагають локалізації джерел у зв'язку з їхнім гострим характером і високою смертністю. Тому створення ефективних та безпечних противірусних препаратів та імунокоректорів є вкрай актуальним. До найбільш ефективних імунокоректорів відносяться індуктори інтерферону (ІФН) [Ершов Ф.И., Новохатский А.С. Индукторы интерферона. - М.: Медицина, 1982, 180с.]. В Україні впроваджені в клінічну практику такі індуктори інтерферону как амізон [Frolov V.M., Vinnikova L.M., Ter'oshyn V.O., Klokol D.I. Efficacy of amizon in the treatment of chronic toxic hepatitis and its immunocorrective action // Lik. Sprava 2001. -№3. -С.135 -138.], арбідол [Boriskin Y.S., Pecheur E.I., Polyak S.J. Arbidol: a broad-spectrum antiviral that inhibits acute and chronic HCV infection // Virol. J. - 2006. - Vol.3. - P.56.], циклоферон [Zarubaev V.V., Slita A.V., Krivitskaya V.Z., Sirotkin A.K., Kovalenko A.L., Chatterjee N.K. Direct antiviral effect ofcycloferon (10-carboxymethyl-9acridanone) against adeno virus type 6 in vitro // Antiviral Res. - 2003. - Vol.58, №2. - P.131 - 137.] й аміксин [Litvinova L., Ptiashko A. Amixin IC, antiviral medicine and oral inductor of endogenic interferon // Science and Innovation. - 2007. Vol.3, №4. - P.75.]. Але перерахованим індукторам інтерферону притаманна перехресна гіпореактивність та обмежений спектр дії, що зумовлює актуальність пошуку нових малотоксичних індукторів ІФН. Найближчим аналогом корисної моделі, що заявляється, виходячи з структури є бензо[4,5]імідазо[1,2с]хіназолін-6-ілметилдиметиламін, здатний до інтеркаляції у ДНК та інгібування саркоми людини в концентрації IC50 = 19.2mМ на культурі клітин MG-63 [Brana M.F., Castellano J.M., Keilhauer G., Machuca A., Martin Y., Redondo C., Schlick E, Walker N. Benzimidazo[1,2-c]quinazolines: a new class of antitumor compounds. // Anticancer Drug Des. 1994 - Vol.9 №6 - P.527- 538]. N N N N CH3 H3 C Бензо[4,5]імідазо[1,2-с]хіназолін-6-ілметилдиметиламін Відомості про противірусну активність та індукцію інтерферону сполукою-аналогом відсутні. В основу корисної моделі поставлено задачу пошуку нових противірусних агентів серед похідних бензо[4,5]імідазо[1,2-с]хіназоліну та розширення спектру індукторів інтерферону. Поставлена задача вирішена синтезом сполук, що заявляються, загальної формули: N N R N n де n=1 R = піперидин-1-іл (1); 2-метилпіперидин-1-іл (2); 4-метилпіперидин-1-іл (3) морфолін-4-іл (4); 4метилпіперазин-1-іл (5); n=2 R = піперидин-1-іл (6); 2-метилпіперидин-1-іл (7); 4-метилпіперидин-1-іл (8) морфолін-4-іл (9); 4метилпіперазин-1-іл (10); Сполуки 1-10 одержують за двостадийною схемою. Вихідні сполуки 12 та 13 одержують взаємодією аміна 11 з хлорацетилхлоридом та хлорпропіонілхлоридом, відповідно, нагріванням в крижаної оцтової кислоті при 60°С [Богатский А.В., Иванов Э.И., Вострова Л.Н., Гренадерова М.В., Караван Л.Д., Гервега С.А. Синтез и исследование свойств некоторых производных оаминофенил-бензимидазола // Укр. хим. журн. - 1979. - Т.45, №3. - С.225 - 230.]. Сполуки 1-5 отримують обробкою сполуки 12 вторинними амінами в ДМФА при кімнатній температурі протягом 24год. Кип'ятіння вихідного 13 в метанолі з триразовими надлишками вторинних амінів дозволяє одержувати цільові продукти 6 - 10 з високими виходами. N N N H Cl(CH 2)nCOCl AcOH, 60 °C. H 2N 11 N Cl n N N HR N 12 n = 1 13 n = 2 R n N 1- 5 n = 1 6 -10 n = 2 Чистоту синтезованих сполук контролювали методом тонкошарової хроматографії на пластинках Silufol UV254 з використанням елюентів різного складу. Будову синтезованих сполук підтверджено набором спектральних методів: спектроскопією ПМР, ІЧ- спектроскопією і мас-спектрометрією. Первинне дослідження препаратів проводили за схемою і за умов, що враховували адекватність тест-моделі можливому механізму інтерфероногенної активності, що передбачався на підставі аналізу структури хімічної сполуки, яка вивчалась [Вильнер Л.М. Актуальные вопросы скрининга и последующего изучения противовирусных препаратов типа интерфероногенов / В сб.: Методические вопросы научной разработки противовирусных средств. - Минск, 1977. - С.134 - 136]. Противірусну та інтерфероніндукуючу активність синтезованих сполук вивчали як описано [Доклінічні дослідження лікарських засобів. Методичні рекомендації./ За ред. чл.-кор. АМН України О.В. Стефанова. - К: МОЗ, України. ДФЦ, 2001. - 392с.] Отримання сполук, що заявляються, та їх противірусної та інтерфероніндукуючої активностей підтверджено наступними прикладами. Приклад 1. 6-Піперидин-1-ілметилбензо[4,5]імідазо[1,2-с]хіназолін (1). До розчину 7г (0.035 моль) 2-(1Н-бензоімідазол-2-іл)феніламіну (11) в 100см3 крижаної оцтової кислоти додають по краплях 4.4см3 (6.2г, 0.055моль) хлорацетилхлориду. Розчин нагрівають на водяній бані (не вище 60°С) 15хв, охолоджують і виливають в холодну воду. Осад відфільтровують, промивають на фільтрі водой до нейтральной реакції і висушують. Після перекристалізації із ацетону одержують 6.3г (68%) 6хлорметилбензо[4,5]імідазо[1,2-с]хіназоліну (12). C15H10CIN3. M.W. 267.72. Т.пл. 237 - 238°С. Rf = 0.33 (елюент хлороформ). ІЧ спектр: 2970 - 2990см-1 (СlСН2Аr); 1595, 1665см-1 (коливання аром. системи); 690см-1(СlСН2Аr). Мас-спектр (БША), m/z(%): 268 (100) [М+Н]+. Мас-спектр (електроний удар), m/z (%): 267 (100) [М]+, 232 (55). Спектр ПМР: розчинник - DMSO-d6, аліфатичні протони: с. 5.49 м.ч. (2Н). Ароматичні протони: м. 7.55 - 7.66 м.ч. (2Н); м. 7.77 - 7.83 м.ч. (1Н); м. 7.87 - 7.93 м.ч. (1Н); м. 7.97 - 8.02 м.ч. (2Н); д. 8.25 м.ч. (1Н); д. 8.60 м.ч. (1Н). Суспендують при кімнатній температурі 0.54г (0.002моль) 6-хлорметил-бензо[4,5]імідазо[1,2-с]хіназоліну (12) в 10см3 ДМФА та додають 0.60см3 (0.51г, 0.006моль) піперидину, при цьому суспензія переходить до розчину. Реакційну суміш залишають при кімнатній температурі на добу, після чого виливають до 100см3 води дистильованої. Осад, що випав відфільтровують, промивають на фільтрі водою дистильованою до нейтрального рН, висушують в ексикаторі над лугом протягом ночі й перекристалізовують з гептану. Вихід 0.58мг (61%). C20H20N4. M.W. 316.41. Т.пл. = 145 -146°С. Rf = 0.27 (хлороформ : ацетон (10 : 1)), Rf = 0.52 (бензол : триетиламін (10 : 1)). Мас-спектр (БША), m/z(%): 317 (100) [M+H]+. Спектр ПМР: розчинник - DMSO-d6, аліфатичні протони: м. 1.43 - 1.45 м.ч., (6Н); н/р. м. 2.59 м.ч. (4Н); с. 4.15 м.ч. (2Н, ArCH2N). Ароматичні протони: скл.м. 7.48 - 7.60 м.ч. (2Н); м. 7.71 - 7.77 м.ч. (1Н); м. 7.82 - 7.88 м.ч. (1Н); м. 7.93 - 7.96 м.ч. (2Н); д. 8.09 м.ч. (1Н); д. 8.57 м.ч. (1Н). Приклад 2. 6-(2-Метилпіперидин-1-ілметил)бензо[4,5]імідазо(1,2-с]хіназолін (2). Синтез проводили як описано у прикладі 1, виходячи із 0.54г (0.002моль) 6-хлорметилбензо[4,5]імідазо[1,2с]хіназоліну (12) та 0.71см3 (0.60г, 0.006моль) 2-метилпіперидину. Отриману сполуку перекристалізовують з ізопропанолу. Вихід 0.41г (62%). C21H22N4. M.W. 330.44. Т.пл. = 134 - 135°С. Rf = 0.41 (хлороформ : ацетон (10 : 1)), Rf = 0.52 (бензол : триетиламін (10 : 1)). Мас-спектр (БША), m/z(%): 331 (100) [M+H]+ Спектр ПМР: розчинник DMSO-d6, аліфатичні протони: д. 1.20 м.ч. (3Н, -Н(СН2СН2)2СНСН3); н/р. м. 1.37 м.ч. (4Н); н/р. м. 1.58 м.ч. (2Н); м. 2.46 - 2.56 м.ч. (1Н); м. 2.65 - 2.71 м.ч. (1Н); н/р. м. 2.85 м.ч. (1Н); д. 4.09 м.ч., 15.0Гц (1Н, ArCH2N); д. 4.54 м.ч., 15.0Гц (1Н, ArCH2N). Ароматичні протони: скл.м. 7.47 - 7.60 м.ч. (2Н); м. 7.70 - 7.76 м.ч. (1Н); м. 7.81 - 7.87 м.ч. (1Н); м. 7.91 - 7.95 м.ч. (2Н); д. 8.32 м.ч. (1Н); д. 8.57 м.ч. (1Н). Приклад 3. 6-(4-Метилпіперидин-1-ілметил)бензо[4,5]імідазо[1,2-с]хіназолін (3). Синтез проводили як описано у прикладі 1, виходячи із 0.54г (0.002моль) 6-хлорметилбензо[4,5]імідазо[1,2с]хіназоліну (12) та 0.71см3 (0.60г, 0.006моль) 4-метилпіперидину. Отриману сполуку перекристалізовують з ізопропанолу. Вихід 0.45г (68%). C21H22N4. M.W. 330.44. Т.пл. = 142 - 144°С. Rf = 0.52 (хлороформ : ацетон (10 : 1)), Rf = 0.52 (бензол : триэтиламин (10 : 1). Мас-спектр (БША), m/z (%): 331 (100) [M+H]+, 259, 233, 219, 112. Масспектр (електронний удар), m/z(%): 233 (100), 98 (25). Спектр ПМР: розчинник - DMSO-d6, аліфатичні протони: д. 0.81 м.ч., (3Н, N(CH2CH2)2CHCH3); м. 0.98 -1.06 м.ч. (2Н); н/р. м. 1.36 м.ч. (1Н, Н(СН2СН2)2СНСН3); д. 1.56 м.ч. (2Н); т. 2.17 м.ч. (2Н); д. 2.95 м.ч. (2Н); с. 4.16 м.ч. (2Н, COCH2N). Ароматичні протони: м. 7.47 - 7.58 м.ч. (2Н); м. 7.70 - 7.76 м.ч. (1Н); м. 7.81 - 7.89 м.ч. (1Н); м. 7.92 - 7.95 м.ч. (2Н); д. 8.07 м.ч. (1Н); д.д. 8.57 м.ч. (1Н). Приклад 4. 6-Морфолін-1-ілметилбензо[4,5]імідазо[1,2-с]хіназолін (4). Синтез проводили як описано у прикладі 1, виходячи із 0.54г (0.002моль) 6-хлорметилбензо[4,5]імідазо[1,2с]хіназоліну (12) та 0.53см3 (0.52г, 0.006моль) морфоліну. Отриману сполуку перекристалізовують з ізопропанолу. Вихід 0.52г (82%). C19H18N4О. M.W. 318.38. Т.пл. = 191 - 192°С. Rf = 0.38 (хлороформ : ацетон (10 : 1)), Rf = 0.40 (бензол : триетиламін (10 : 1). 14 спектр: 2770 - 2990см-1 (аліфатич. фрагмент піперидину); 1600, 1665см-1 (коливання аром. системи). Мас-спектр (БША), m/z(%): 319 (100) [М+Н]+, 233, 100. Мас-спектр (електронний удар), m/z (%): 233 (98), 83 (100). Спектр ПМР: розчинник - DMSO-d6, аліфатичні протони: т. 2.63 м.ч. (4Н, O(CH2CH2)2N): т. 3.52 м.ч. (4Н, O(CH2CH2)2N); с. 4.22 м.ч. (2Н, COCHIN). Ароматичні протони: м. 7.48 - 7.60 м.ч. (2Н); м. 7.71 7.76 м.ч. (1Н); м. 7.81 - 7.87 м.ч. (1Н); м. 7.93 - 7.97 м.ч. (2Н); д. 8.10 м.ч. (1Н); д. 8.56 м.ч. (1Н). Приклад 5. 6-(4-Метилпіперазин-1-ілметил)бензо[4,5]імідазо[1,2-с]хіназолін (5). Синтез проводили як описано у прикладі 1, виходячи із 0.54г (0.002моль) 6-хлор-метилбензо[4,5]імідазо[1,2с]хіназоліну (12) та 0.67см3 (0.60г, 0.006моль) 4-метил-піперазину. Отриману сполуку перекристалізовують з гептану. Вихід 0.36г (54%). C20H21N5. M.W. 331.42. Т.пл. = 164 - 165°С. Rf = 0.01 (хлороформ : ацетон (10 : 1)), Rf = 0.15 (бензол : триетиламін (10 : 1)). Мас-спектр (БША), m/z(%): 332 (100) [М+H]+, 289, 261, 233, 220. Спектр ПМР: розчинник - DMSO-d6, аліфатичні протони: с. 2.08 м.ч., (3Н, N(CH2CH2)2NCH3 ); н/р м. 2.25 м.ч. (4Н, N(CH2CH2)2 NCH3); н/р м. 2.62 м.ч. (4Н, N(CH2CH2)2NCH3); с. 4.17 м.ч. (2Н, COCH2N). Ароматичні протони: м. 7.47 7.58 м.ч. (2Н); м. 7.70 - 7.75 м.ч. (1Н); м. 7.80 - 7.85 м.ч. (1Н); м. 7.92 - 7.94 м.ч. (2Н); д. 8.05 м.ч. (1Н); д. 8.55 м.ч. (1Н). Приклад 6. 6-(2-Піперидин-1-ілетил)-бензо[4,5]імідазо[1,2-с]хіназолін (6). Отримують 6-(2-хлоретил)бензо[4,5]імідазо[1,2-с]хіназолін (13) як описано у першей частині прикладу 1, виходячи із 7.32г (0.035моль) 2-(1Н-бензоімідазол-2-іл)феніламіну (11) та 5.30см3 (7.00г, 0.055моль) хлорпропіонілхлориду. Продукт 13 перекристалізовують з ацетону. Вихід 9.52г (97%). С16Н12СlN3. M.W. 281.75. Т.пл. = 165 - 166°С (с розкл). Rf = 0.69 (хлороформ : ацетон (10 : 1)), Rf = 0.80 (бензол : триетиламін (10 : 1). Масспектр (БША), m/z (%): 282 (100) [М+Н]+. Спектр ПМР: розчинник – CDCl3, аліфатичні протони: т. 3.77 м.ч. (2Н); т. 4.20 м.ч. (2Н). Ароматичні протони: м. 7.38 - 7.42 м.ч. (1Н); м. 7.47 - 7.51 м.ч. (1Н); м. 7.57 - 7.63 м.ч. (1Н); м. 7.70 7.74 м.ч. (1Н); м. 7.80 -7.83 м.ч. (1Н); м. 7.88 - 7.95 м.ч. (2Н); д. 8.62 м.ч. (1Н). Розчиняють при нагріванні 0.56г (0.002моль) 6-(2-хлоретил)бензо[4,5]імідазо[1,2-с]хіназоліну 13 в 50см3 метанолу, і додають 0.6см3 (0.006моль) піперидину. Реакційну суміш кип'ятять 30-40хв, випарюють при зниженому тиску до об'єму 10см3 і виливають в 100см3 води дистильованої. Осад, що випав, відфільтровують, промивають на фільтрі водой дистильованою до нейтрального рН і перекристалізовують із ізопропанолу. Вихід 0.49мг (74%). C21H22N4. M.W. 330.44. Т.пл. = 119 -120 °С. Rf = 0.01 (хлороформ : ацетон (10 : 1)), Rf = 0.48 (бензол : триетиламін (10 : 1)). Мас-спектр (БША), m/z(%): 331 (100) [М+Н]+ 307, 246, 220, 98. Спектр ПМР: розчинник DMSO-d6, аліфатичні протони: м. 1.41 - 1.43 м.ч., (2Н); м. 1.53 - 1.59 м.ч., (4Н); н/р. м. 2.50 м.ч. (4Н); т. 2.93 м.ч. (2Н, Ar2CH2N); т. 3.57 м.ч. (2Н, ArCH2C2N). Ароматичні протони: м. 7.46 - 7.57 м.ч. (2Н); м. 7.63 - 7.68 м.ч. (1Н); м. 7.76 - 7.86 м.ч. (2Н); д. 7.92 м.ч. (1Н); д. 8.14 м.ч. (1Н); д. 8.50 м.ч. (1Н). Приклад 7. 6-[2-(2-Метилпіперидин-1-іл)-етил]-бензо[4,5]імідазо[1,2-с]хіназолін(7). Синтез проводили як описано у прикладі 6, виходячи із 0.56г (0.002моль) 6-(2-хлоретил)бензо[4,5]імідазо[1,2с]хіназоліну (13) та 0.71см3 (0.60г, 0.006моль) 2-метилпіперидину. Отриману сполуку перекристалізовують з ізопропанолу. Вихід 0.44г (64%). C22H24N4. M.W. 344.46. Т.пл. = 162 - 163°С. Rf = 0.06 (хлороформ : ацетон (10 : 1)), Rf = 0.48 (бензол : триетиламін (10 : 1)). Мас-спектр (БША), m/z(%): 345 [М+Н]+, 113 (100). Мас-спектр (електроний удар), m/z(%): 344 (0.3) [M]+ 244 (16), 112 (100). Спектр ПМР: розчинник - DMSO-d6, аліфатичні протони: д. 1.00 (3H, -N(CH2CH2)2CHCH3): н/р. м. 1.16 - 1.35 м.ч. (2Н); н/р. м. 1.44 - 1.49 м.ч. (1Н); м. 1.56 - 1.63 м.ч. (3Н); м. 2.28 - 2.37 м.ч. (1Н); м. 2.41 - 2.45 м.ч. (1Н); м. 2.93 - 3.01 м.ч. (2Н, ArCH2CH2N); м. 3.34 - 3.40 м.ч. (1Н); м. 3.56 - 3.62 м.ч. (2Н, ArCH2CH2N). Ароматичні протони: м. 7.48 - 7.60 м.ч. (2Н); м. 7.65 -7.71 м.ч. (1Н); м. 7.78 - 7.88 м.ч. (2Н); д. 7.94 м.ч. (1Н); д. 8.18 м.ч. (1Н); д. 8.53 м.ч. (1Н). Приклад 8. 6-[2-(4-Метилпіперидин-1-іл)-етил1-бензо[4,5]імідазо[1,2-с]хіназолін (8). Синтез проводили як описано у прикладі 6, виходячи із 0.56г (0.002моль) 6-(2-хлоретил)бензо[4,5]імідазо[1,2с]хіназоліну (13) та 0.71см3 (0.60г, 0.006моль) 4-метилпіперидину. Отриману сполуку перекристалізовують з метанолу. Вихід 0.47г (68%). C22H24N4. M.W. 344.46. Т.пл. =108-110°С. Rf = 0.07 (хлороформ : ацетон (10 : 1)), Rf = 0.48 (бензол : триэтиламин (10 : 1)). Мас-спектр (БША), m/z(%): 345 [М+Н]+, 112 (100). Мас-спектр (електроний удар), m/z(%): 344 (0.5) [M]+, 244 (9), 112 (100). Спектр ПМР: розчинник - DMSO-d6 аліфатичні протони: д. 0.91 м.ч, (3Н, N(СН2СН2)2СНСН3 ): м. 1.16-1.29 м.ч. (2Н); н/р. м. 1.38 м.ч. (1Н, N(CH2CH2)2CHCH3); м. 1.62 - 1.66 м.ч. (2Н); м. 2.06 -2.13 м.ч. (2Н); м. 3.00 - 3.04 м.ч. (4Н); т. 3.60 м.ч. (2Н). Ароматичні протони: м. 7.45 - 7.57 м.ч. (2Н); м. 7.62 7.67 м.ч. (1Н); м. 7.75 - 7.80 м.ч. (1Н); д. 7.83 м.ч. (1Н); д. 7.91 м.ч. (1Н); д. 8.16 м.ч. (1Н); д. 8.53 м.ч. (1Н). Приклад 9. 6-(2-Морфолін-4-ілетил)-бензо [4,5] імідазо [1,2-с] хіназолін (9). Синтез проводили як описано у прикладі 6, виходячи із 0.56г (0.002моль) 6-(2-хлоретил)бензо[4,5]імідазо[1,2с]хіназоліну (13) та 0.53 см3 (0.52г, 0.006моль) морфоліну. Отриману сполуку перекристалізовують з метанолу. Вихід 0.54г 81%. C20H20N4О. M.W. 332.41. Т.пл. = 190 - 191°С. Rf = 0.12 (хлороформ : ацетон (10 : 1)), Rf = 0.31 (бензол : триэтиламин (10 : 1)). Мас-спектр (БША), m/z(%): 333 (100) [M+H]+. Мас-спектр (електроний удар), m/z(%): 332 (0.9) [М]+, 314 (1.5), 245 (7), 233 (1.4), 100 (100). Спектр ПМР: розчинник - DMSO-d6, аліфатичні протони: т. 2.56 м.ч. (4Н); т. 3.00 м.ч. (2Н); м. 3.61 -3.65 м.ч. (6Н). Ароматичні протони: м. 7.46 - 7.56 м.ч. (2Н); м. 7.64 - 7.70 м.ч. (1Н); м. 7.77 -7.87 м.ч. (2Н); д. 7.93 м.ч. (1Н); д. 8.17 м.ч. (1Н); д. 8.51 м.ч. (1Н). Приклад 10. 6-[2-(4-Метилпіперазин-1-іл)етил)1бензо[4,5]імідазо[1,2-с]хіназолін (10). Синтез проводили як описано у прикладі 6, виходячи із 0.56г (0.002моль) 6-(2-хлоретил)бензо[4,5]імідазо[1,2с]хіназоліну (13) та 0.67см3 (0.60г, 0.006моль) морфоліну. Отриману сполуку перекристалізовують з ізопропанолу. Вихід 0.54г (78%). C21H23N5. M.W. 345.45. Т.пл. = 97-98 °С. Rf = 0 (хлороформ : ацетон (10 : 1)), Rf = 0.13 (бензол : триэтиламин (10 : 1)). Мас-спектр (БША), m/z(%): 346 [М+Н]+ 275, 246, 113 (100). Мас-спектр (електроний удар), m/z(%): 345 (2) [М]4', 303 (12), 289 (5), 275 (22), 244 (20), 233 (8), 113 (81), 70 (100). Спектр ПМР: розчинник DMSO-d6, аліфатичні протони: с. 2.18 м.ч., (3Н, N(CH2CH2)2NCH3 ); н/р м. 2.37 м.ч. (4Н, N(СН2СН2 )2NСН3); н/р м. 2.58 м.ч. (4Н, N(CH2СН2)2NСН3); т. 3.00 м.ч. (2Н, ArCH2CH2N); т. 3.60 м.ч. (2Н, ArCH2CH2N). Ароматичні протони: м. 7.47 - 7.59 м.ч. (2Н); м. 7.66 - 7.71 м.ч. (1Н); м. 7.78 - 7.88 м.ч. (2Н); м. 7.94 м.ч. (1Н); д. 8.17 м.ч. (1Н); д. 8.52 м.ч. (1Н). Приклад 11. Визначення цитотоксичності препаратів в умовах т vitro клітин L929 за пригніченням їх життєздатності. Параметром, за яким оцінювали токсичність доз препаратів було пригнічення їх життєздатності. [Методы испытания и оценки противовирусной активности химических соединений в отношении вируса гриппа. Методические указания. Сост. проф. В.И. Ильенко. - Л. - 1977. - 35с.]. Підрахунок клітин та визначення їх життєздатності через 24 та 48 годин інкубації проводили після фарбування клітин водним розчином вітального фарбника трипанового синього. При відсутності токсичного ефекту клітини засвоювали вітальний барвник. Забарвлення контрольних культур приймали за 100%. Розведення препарату, що викликало засвоєння фарбника на 50% вважали токсичним. Приклад 12. Вивчення інтерфероніндукуючих властивостей. Інтерфероніндукуючу активність синтезованих сполук вивчали як описано [Доклінічні дослідження лікарських засобів. Методичні рекомендації. За редакцією член-кореспондента АМН України О.В. Стефанова. / Міністерство охорони здоров'я України. Державний фармакологічний центр., Київ, 2001. С.392]. Інтерфероніндукуючу активність препаратів в умовах in vitro вивчали в культурі клітин ПТП. Препарати в різних дозах (30-250мкг/см3) додавали до сформованого моношару клітин і культивували при 37°С на протязі 24 та 48год, після чого надосадову рідину збирали і в ній визначали активність інтерферону за раніше опублікованою методикою. [Доклінічні дослідження лікарських засобів. Методичні рекомендації. За редакцією член-кореспондента АМН України О.В. Стефанова. / Міністерство охорони здоров'я України. Державний фармакологічний центр., Київ, 2001. С.392] (пригнічення цитопатогенної дії вірусу везикулярного стоматиту). Визначення активності інтерферону здійснювали через 24 - 48год, коли доза внесеного вірусу везикулярного стоматиту (ВВС) 100 ТЦД50 викликає повну дегенерацію клітин у контролі вірусу (KB) за відсутністю дегенерації у неінфікованій культурі. За титр інтерферону в одиницях дії (ОД) приймали величину, зворотну розведенню препарату, при якому культура клітин в 50% лунок була повністю захищена від цитопатогенної дії індикаторного вірусу. Титр індукованого інтерферону (максимальне розведення супернатанту, при якому в 50% лунок цілком запобігалася дегенерація клітинного моношару) визначали в трьох паралельних експериментах. Виявлено, що в умовах in vitro досліджені речовини спричиняють утворення інтерферону (дані - діапазон значень, що отримані у трьох паралельних експериментах -наведені в таблиці). Приклад 13. Вивчення противірусної активності на культурі клітин L929. Вплив сполук на противірусну резистентність культур клітин L929 вивчали за допомогою мікрометоду скринінгу противірусних сполук [Первичное изучение антивирусных свойств синтетических и природных соединений: Метод, рекомендации / Вотяков В.И., Бореко Е.И., Владыко Г.В. и др. - Минск. - 1986.]. В 96-лункові пластикові панелі вносили суспензію клітин в концентрації, необхідній для формування суцільного шару клітин. На 2-3-й день (в залежності від активності росту культури) середовище зливали, моношар промивали середовищем для культур клітин без сироватки і вносили досліджувані препарати в серійних розведеннях в вертикальних рядах. На кожне розведення відводили 3 лунки для визначення противірусної активності, одну - для контролю токсичності. Враховували також контроль клітин та вірусу. Клітини інкубували з препаратами 24год при 37°С, після чого середовище вилучали з лунок. В лунки для визначення контролю клітин та токсичності вносили середовище для підтримання росту клітин, у всі інші - вірусну суспензію ВВС. Для визначення ефективності захисту клітин проводили досліди із застосуванням ВВС в різних дозах: 10, 100, 1000ЦТД50. Мікропанелі інкубували в термостаті з постійним рівнем СO2 при 37°С та вологості 98% до настання 100% цитопатичного ефекту (ЦПЕ) в лунках контролю вірусу. Потім визначали ступінь інгібування вірусоспецифічного ЦПЕ. Аналіз пригнічення вірусної реплікації проводили через 24год. Противірусну активність препаратів МК оцінювали за цитопатичним ефектом в формі некрозу (визначення проценту клітин, що загинули за допомогою прямого підрахунку під мікроскопом). Визначали: ІД50 - дозу (мкг/мл), що затримує ЦПЕ вірусу на 50%. Дані про цитотоксичність, інтерфероніндукуючу та противірусну активність сполук 1-10 наведені в таблиці. Як видно з наведених даних, сполуки, що заявляються, є ефективними індукторами інтерферону і противірусними агентами, причому противірусна активність сполук 3,4,6-10 при профілактичному введенні набагато вища, ніж при одночасному, что свідчить на користь інтерферон-опосередкованого механізму противірусної дії. Таблиця Цитотоксичність, інтерфероніндукуюча та противірусна активність сполук, що заявляються Сполука Цитотоксичність Інтерфероніндукуюча активність ІД100 1 2 3 4 5 6 7 8 9 10 А С,mМ Титр 52.1 52.1 13.0 104.2 208.3 189.14 181.44 11.35 47.00 180.92 300 1.93 3.69 1.85 0.96 1.47 0.05 0.04 0.09 0.73 0.09 25 8 12 8-16 16-32 16 8-16 8-16 8-16 16 8-16 32 Примітка: А - аміксин, "-" - активність відсутня Противірусна активність При одночасному При профілактичному введенні введенні % живих % живих клітин С,mМ C, mМ клітин 50 20.6 80 9.85 25 0.185 80 19.7 99 0.023 80 81.8 99 0.024 95 78.6 93 0.05 100 0.012 91 0.35 100 0.011 100 0.04 100 0.011 83 11.76 100 0.012 83 5.64 100 0.023 75 25 50 15
ДивитисяДодаткова інформація
Назва патенту англійськоюDialkylaminoalkylbenzimidazo[1,2-c]quinazolines as antiviral agents and interferon inducers
Автори англійськоюLiakhova Olena Anatoliivna, Pohosova Yulia Oleksiivna, Liakhov Serhii Anatoliiovych, Zholobak Nadia Mykhailivna, Spivak Mykola Yakovych, Andronati Serhii Andriiovych
Назва патенту російськоюДиалкиламиноалкилбензимидазо[1,2-с]хиназолины как противовирусные агенты и индукторы интерферона
Автори російськоюЛяхова Елена Анатольевна, Погосова Юлия Алексеевна, Ляхов Сергей Анатольевич, Жолобак Надежда Михайловна, Спивак Николай Яковлевич, Андронати Сергей Андреевич
МПК / Мітки
МПК: C07D 239/00, C07D 235/00
Мітки: агенти, діалкіламіноалкілбензімідазо[1,2-с]хіназоліни, противірусні, інтерферону, індуктори
Код посилання
<a href="https://ua.patents.su/4-32159-dialkilaminoalkilbenzimidazo12-skhinazolini-yak-protivirusni-agenti-ta-induktori-interferonu.html" target="_blank" rel="follow" title="База патентів України">Діалкіламіноалкілбензімідазо[1,2-с]хіназоліни як противірусні агенти та індуктори інтерферону</a>
Попередній патент: Спосіб абсорбції окислів азоту із нітрозного газу
Наступний патент: Спосіб відбору баранчиків-валушків м’ясо-вовняних порід овець на підвищення м’ясної продуктивності
Випадковий патент: N-стеароїлетаноламін як лікарський засіб в супроводжуючій протипухлинній терапії