Похідні нафталімідокарбонових кислот як інтеркалюючі у днк низькотоксичні інтерфероніндукуючі противірусні агенти
Номер патенту: 29314
Опубліковано: 10.01.2008
Автори: Жолобак Надія Михайлівна, Нехорошкова Юлія Владиславівна, Олевінська Зоя Мечиславівна, Доровських Ірина Вікторівна, Співак Микола Якович, Карпенко Олександр Сергійович, Ляхов Сергій Анатолійович, Шафран Леонід Мойсейович
Формула / Реферат
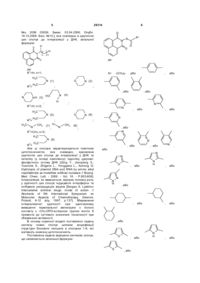
Похідні нафталімідокарбонових кислот загальної формули:
 ,
,
де:
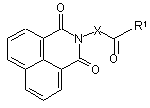
Х= -(СН2)k- або  , або
, або  , або
, або 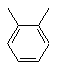 , або
, або
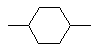 , або
, або 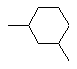 , або
, або 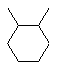 , або
, або
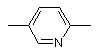 , або
, або 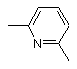 , або
, або 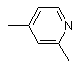 , або
, або
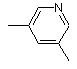 , або
, або 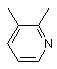 , або
, або 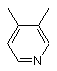 , або
, або
![]() , або
, або 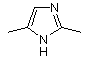 , або
, або 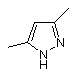 , або
, або
![]() , або
, або 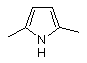 , або
, або ![]() , або
, або
![]() , або
, або ![]() , або
, або ![]() ,
,
k=1-5;
R1=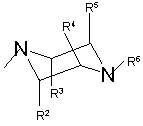 або
або 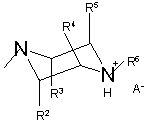 ,
,
де:
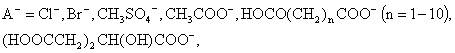
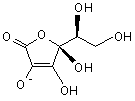 ,
,
![]() або
або
![]() ,
,
де:
![]() ;
;![]() ,
,
де:
![]() ,
,
![]()
де:
![]() ,
,
![]() ,
,
де:
![]() ;
;
або
R1=
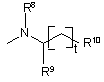 ,
,
де:
t=1-5;
![]()
де:
![]() ,
,
де:
![]() ,
,
![]() ,
,
![]() ,
,
де:
![]() ,
,
R10=
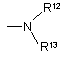 ,
, 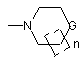 ,
,
де:
![]() ,
,
n =0-5,
![]() ,
,
де
![]() ;
;
як інтеркалюючі у ДНК низькотоксичні інтерфероніндукуючі противірусні агенти.
Текст
Похідні нафталімідокарбонових кислот загальної формули: O R1 X N N , або , S , або або або , або N , , або 29314 UA , або N k=1-5; , N H N S (11) , N або або , або O або , N S N , N H або U , або , або , або N (13) O O , або N , або N N H , або , або O або , N , -(СН2) k або N де: Х= , (19) O N N 3 29314 4 де: R5 R 8 = Cs H 2s+1 (s = 0 - 5) ; R4 N N або R1= R6 R8 R3 N R2 1 R= R5 R9 R4 R 8 , R 9 = Cq H 2q+1 (q = 0 - 5 ), Ar , + R6 N H R3 де: A R2 Ar = C 6H 5- n B1 n (n = 1 - 5); C5H 4-n X n N (n = 1 - 4);C 4H 3 X n Y ( n = 1 - 3) , де: A - = Cl- , Br - , CH 3SO4 - , CH 3COO - , HOCO (CH 2 ) n COO - ( n = 1 - 10), B1 = C u H 2u +1 (u = 0 - 5 ) , , OH O , де: X = F, Cl, Br, I , NO 2 , NR 11 2 , OH , OR 11, SO p R11 ( p1 = 0 - 2 ), CO 2R 11 ( HOOCCH 2 ) 2 CH( OH )COO - , O , де: t=1-5; N O 10 t R або Y = O, S, NR11 , де: OH R 11 = C n H 2n+1 (n = 0 - 5) , OH OH R10= R12 , R 2 - R 6 = C lH 2l+1 (l = 0 - 5) або R 2 - R 5 = H , R 6 = (CH 2 )m Ar , де: m = 1 - 3, Ar = C6 H 5- n Bn (n = 1 - 5) ; C 5H 4- n X n N (n = 1 - 4 ); C 4H 3X n Y (n = 1 - 3) , де: B = C r H 2 r+1 (r = 0 - 5) , X = F, Cl, Br, I , NO2 , NR 7 2 , OH, OR 7 , SO p R 7 (p = 0 - 2 ), CO2 R 7 , де: N N R13 G n , , де: R 12 , R13 = Cw H 2w +1 ( w = 0 - 5) , n =0-5, G = CH 2O, S, NR14 , де R 14 = C z H 2z +1 (z = 0 - 5) ; як інтеркалюючі інтерфероніндукуючі у ДНК низькотоксичні противірусні агенти. R 7 = C q H2 q+1 (q = 0 - 5) , Y = O, S, NH, NR 8 , Корисна модель відноситься до біоорганічної хімії, зокрема до синтезу індукторів інтерферону та противірусних агентів, і може бути використана для створення нових потенційних лікарських засобів. Різноманітність інфекційних хвороб, порушень імунного статусу та онкологічних захворювань роблять пошук ефективних та безпечних імунокоректорів вкрай актуальним. До найбільш ефективних імунокоректорів відносяться індуктори інтерферону (ІФН) [Ершо в Ф. И., Новохатский А. С. Индукторы интерферона. - М.: Медицина, 1982, 180 с]. Незважаючи на наявність деяких клінічних індукторів (аміксин, циклоферон) цю проблему ще не можна вважати вирішеною. Найближчим аналогом корисної моделі, що заявляється, виходячи з біологічної активності та структури, є аміноалкілнафталіміди 1-9, які проявляють виражену інтерфероніндукуючу та противірусну активність [Карпенко О. С, Доровских І. В., Ля хов С. А., Андронаті С. А., Співак Н. Я., Жолобак Н. М., Олевінська З. М. Похідні аміноалкілнафталімідів як інтеркалюючі у ДНК індуктори інтерферону та противірусні агенти. Деклараційний патент на корисну модель України 17734, МПК C07D 213/00, С07С 209/00. - Заявка 5 29314 6 №u 2006 03556; Заявл. 03.04.2006; Опубл. 16.10.2006. Бюл. №10.], яка пов'язана із здатністю цих сполук до інтеркаляції у ДНК, загальної формули: O R1 O O R2 n N де: R1=H; n=1; Х= H 3C R= O де: O 2 R1 X N N (1) H 3C O -(СН2)k ,або , ; R1=H; n=2; H 3C 2 R= H 3C H 3C N CH3 1 R =СH3; n=3; H 3C 2 , або N (4) H ; або ; HO N H (3) , N (2) , або N або ; N N O N (5) ; H (7) N ; N (6) (8) або N ; CH3 , , або N ; N (9) N H 3C R= . Але ці сполуки характеризуються помітною цитотоксичністю, яка очевидно, зумовлена здатністю цих сполук до інтеркаляції у ДНК та каталізу (у складі комплексу) гідролізу цукровофосфа тного остову ДНК [Qing Y., Jianqiang X., Yuanshe S., Zhigana L., Yonggana L., Xuhong Q. Hydrolysis of plasmid DNA and RNA by amino alkyl naphtalimide as metalfree artificial nuclease // Bioorg. Med. Chem. Lett. - 2006. - Vol. 16. - P.803-806]. Інтеркаляція, як вважається, відіграє головну роль у здатності цих сполук індукува ти інтерферон та інгібувати репродукцію вірусів [Sergey A. Lyakhov Intercalative antiviral drugs: mode of action. // Abstracts of 6th International Symposium on Molecular Aspects of Chemotherapy, Gdansk, Poland, 9-12 July, 1997, p.137]. Збереження інтеркалюючої здатності при одночасному виведенні термінальної аміногрупи з тісного контакту з -СН2-ОРО-естерною групою могло б привести до суттєвого зниження токсичності при збереженні активності. В основу корисної моделі поставлено задачу синтезу нових сполук шляхом модифікації структури бокового ланцюга в сполуках 1-9, які матимуть знижену цитотоксичність. Поставлена задача вирішена синтезом сполук, що заявляються загальної формули: , або N , або , або N N O N H , або N H , або , або , або N , або , або , або O S , , або або N H 7 N 29314 N N O , R8 N S або 8 , N або N R8, R9 = CqH2 q+1(q = 0 - 5), Ar ; де: R5 R4 Ar = C 6H5 -nB1n (n = 1 - 5 ); C5H4- nXnN(n = 1 - 4 ); C4H3 Xn Y(n = 1 - 3 ) N , R6 N де: B1 = CuH2u+1(r = 0 - 5) R3 R2 1 R= , або R5 R11 = CnH2n +1(n = 0 - 5) + R6 N A H R3 R12 = Cl , Br , CH3SO4 , CH3COO , HOCO= 1 - 10), A (CH2 )n COO (n (HOOCCH2 )2 CH(OH)COO , , G = CH2O, S, NR14 OH OH 6 , або R2 - R5 = H, R6 = (CH2 )m Ar , де: m = 1- 3, Ar = C6H5 -nBn (n = 1- 5) ; C5H4 -n XnN(n = 1- 4); C4H3 Xn Y(n = 1- 3) де: B = CrH2r +1(r = 0 - 5) , X = F, Cl , Br ,I, NO 2, NR 72, OH, OR7, SOpR7(p = 0 - 2), CO 2R7; де: R7 = CqH2 q+1(q = 0 - 5) , Y = O, S, NH, NR 8 , де: R8 = CsH2 s+1(s = 0 - 5) або ; ; R14 = CzH2 z+1(z = 0 - 5) = ClH2l+1(l 0 - 5 ) R -R = 2 де OH O R13 ; R10= де: R12 , R13 = CwH2 w+1(w = 0 - 5) G n n =0-5; OH O ; N N R2 де: O ; 11 N ; X = F, Cl, Br, I, NO 2 ,NR 112 , OH, OR11, SOpR11 (p1 = 0 - 2), CO 2R11 Y = O, S, NR , де: R4 R9 R1= де: t=1-5; S k=1-5; 10 t R ; , а саме: N-(2-діетиламіноетил)-2-(1,3-діоксо-1Н,3Нбензо[dе]ізохінолін-2-іл)-ацетамід (10), 2-(1,3-діоксо-1Н,3Н-бензо[(dе]ізохінолін-2-іл)-N-(2морфолін-4-іл-етил)ацетамід (11), N-(3-диметиламінопропіл)-2-(1,3-діоксо-1Н,3Нбензо[dе]ізохінолін-2-іл)-ацетамід (12), N-(3діетиламінопропіл)-2-(1,3-діоксо-1Н,3Нбензо[dе]ізохінолін-2-іл)-ацетамід (13), (2-(1,3діоксо-1Н,3Н-бензо-[dе]ізохінолін-2-іл)-N-(3морфолін-4-іл-пропіл)-ацетамід (14), N-(2діетиламіноетил)-4-(1,3-діоксо-1Н,3Нбензо[dе]ізохінолін-2-іл)-бутирамід (15), 4-(1,3діоксо-1Н,3Н-бензо[dе]ізохінолін-2-іл)-N-(2морфолін-4-іл-етил)-бутирамід (16), N-(3діетиламінопропіл)-4-(1,3-діоксо-1H,3Нбензо[dе]ізохінолін-2-іл)-бутирамід (17), 4-(1,3діоксо-1Н,3Н-бензо[de]ізохінолін-2-іл)-N-(3морфолін-4-іл-пропіл)-бутирамід (18), N-(2діетиламіноетил)-6-(1,3-діоксо-1Н,3Н-бензо[dе]ізохінолін-2-іл)-гексаноіламід (19), 6-(1,3-діоксо1Н,3Н-бензо[(dе]ізохінолін-2-іл)-N-(3діметиламінопропіл)гексаноіламід (20), N-(3діетиламінопропіл)-2-(1,3-діоксо-1Н,3Н-бензо[de]ізохінолін-2-іл)-гексаноіламід (21), 4-(1,3-діоксо1Н,3Н-бензо[dе]ізохінолін-2-іл)-N-(3-морфолін-4-ілпропіл)-гексаноіламід (22). Причинно-наслідковий взаємозв'язок між структурою об'єктів, що заявляються, і їхньою біологічною дією полягає, очевидно, у здатності 9 29314 наявного в їх стр уктурі амідного зв'язку до гідролізу у фізіологічних умовах і, як наслідок, скорочення часу дії протонованого ліганду ДНК у клітині, при збереженні нафталімідного фрагменту, який забезпечує інтеркаляцію в ДНК, противірусну та інтерфероніндукуючу активності. Обробкою w -нафталімідокарбонових кислот (23-25) надлишком хлористого тіонілу були отримані відповідні хлороангідриди (26-28) Сполуки 10-22 одержували конденсацією хлороангідридів нафталімідокарбонових кислот (26-28) з діалкіламіноалкіламінами, яку здійснювали змішуванням еквімольної кількості відповідного аміну із розчином хлорангідриду у безводному 1,4-діоксані з наступним виділенням та очисткою цільового продукту. Чистота цільових сполук 10-22 підтверджена тонкошаровою хроматографією, будова - даними мас-спектрометрії та спектроскопії 1Н-ЯМР. O OH X O N X O O SOCl2 23-25 R1 O N 26-28 Cl O X R 1 -H O N O O 10-22 Первинне дослідження препаратів проводили за схемою і за умов, що враховували адекватність тест-моделі можливому механізму інтерфероногенної активності, що передбачався на підставі аналізу структури хімічної сполуки, яка вивчалась [Вильнер Л. М. Актуальные вопросы скрининга и последующего из учения противовирусных препаратов типа интерфероногенов /В сб.: Методические вопросы научной разработки противовирусных средств. Минск, 1977. - С.134-136]. Цитотоксичність та інтерфероніндукуючу активність синтезованих сполук вивчали як описано [Доклінічні дослідження лікарських засобів. Методичні рекомендації./ За ред. чл.- кор. АМН України О. В. Стефанова. - К: МОЗ, України. ДФЦ, 2001. - 392с.] Отримання сполук, що заявляються, підтверджено наступними прикладами. Приклад 1. Отримання нафталімідоотової кислоти (23). Розчин 20.81г (0.105моль) нафталевого ангідриду та 7.51г (0.1моль) a - амінооцтової кислоти в 50см 3 ДМФА кип'ятили із зворотнім холодильником 2 години, замінювали зворотній холодильник насадкою Вюрца, приєднаною до прямого холодильника. Відганяли дистилят до досягнення температури пари 153°С. Реакційну суміш о холоджували. Осад, що випав, відфільтровували, промивали водою та висушували. Маточний розчин нагрівали до 100°С й додавали гарячу воду до замутнення та відфільтровували. Осад, що випав при охолодженні, відфільтровували та об'єднували із першим осадом, висушували та перекристалізовували з чотирихлористого вуглецю. Вихід 19.80г (74%). C 14H9NO4. M.W. 10 255.23. Мас-спектр (ЕВ) [М+] = [255]. Т пл. =245278°С. Приклад 2. Отримання нафталімідобутанової кислоти (24) Синтез проводили як описано у прикладі 1, виходячи 20.81г (0.105моль) нафталевого g -амінобутанової ангідриду та 10.30г (0.1моль) кислоти. Вихід 25.78г (91%). C16H13NO4. M.W. 283.37. Мас-спектр (БША), m/z (%): 284 (100) [М+Н]+. Т пл. =180-183°С. Приклад 3. Отримання нафталімідогексанової кислоти (25). Синтез проводили як описано у прикладі 1, виходячи 20.81г (0.105моль) нафталевого ангідриду та 10.30г (0.1моль) g -амінобутанової кислоти. Вихід: 92%. M.W. 311.34. Т пл. =144146°С. Мас-спектр (БША), m/z (%): 312 (100) [М+Н]+. Приклад 4. Отримання хлороангідриду нафталімідооцтової кислоти (26). Суміш 2.55г (0.01моль) нафталімідооцтової кислоти та 3.3см 3 (0.03моль) хлористого тіонілу кип'ятили зі зворотним холодильником до повного розчинення осаду, випаровували у вакуумі досуха. Додавали безводний бензол (5см 3) і знову випаровували у вакуумі. Операцію повторювали тричі. Сухий залишок висушують у вакуумі та використовують без додаткового очищення. Вихід: 89% (сирого продукту). C16H12CINO 3. M.W. 273.68. Приклад 5. Отримання хлороангідриду нафталімідобутанової кислоти (27) Синтез проводили як описано у прикладі 6, виходячи 2.83г (0.010 моль) нафталімідобутанової кислоти та 3.3см 3 (0.03 моль) хлористого тіонілу. Вихід 2.78г (92%). C16H12ClNO3. M.W. 301.73. Приклад 6. Отримання хлороангідриду нафталімідогексанової кислоти (28). Синтез проводили як описано у прикладі 6, виходячи 3.11г (0.01 моль)нафталімідогексанової кислоти та 3.3см 3 (0.03моль) хлористого тіонілу. Вихід: 92% (сирого продукту). С18Н16С1NO3. M.W. 329.79. Приклад 7. Отримання N-(2-Діетиламіноетил)2-(нафталімідо)ацетаміду (10) У 30см 3 безводного діоксану при перемішуванні розчиняють 2.73г (0.01моль) хлороангідриду нафталімідооцтової кислоти та 1.2см 3 (0.01моль) діетиламіноетиламіну. Продовжують перемішування при 70°С протягом 4-5год (контроль за ТШХ). Випарюють реакційну суміш до об'єму 2-3см 3 і виливають в 250см 3 води. Додають розчин карбонату натрію до рН =9, екстрагують хлороформом (3 х 50см 3). Органічний екстракт підсушують і випарюють досуха. С ухий залишок екстрагують гептаном (5 х 30см 3). При охолодженні випадають кристали цільового продукту. Осад відфільтровують і промивають на фільтрі охолодженим гептаном. Вихід: 2.43г (69%). M.W. 353.42. Т пл. =196-198°С. Мас-спектр (БША), m/z (%): 354 (100) [М+Н]+. Спектр ПМР: 0.915 т (6Н, -N(CH2CH3)2, 7.2), 2.434-2.482 т (4Н, - N(CH2CH3)2, 7.2), 2.506-2.540 т (2Н, -CH2.N(CH2CH3)2), 3.3023.359 к (2Н, -CONHCH2-, 6.0), 4.866 с (2Н, -СH2СО), 7.725-7.777 д д (2Н, H b , 7.8 и 7.5), 8.211-8.243 д 11 29314 д (2Н, H g , 6.9), 8.6 д д (2Н, Н a , 8.1). Приклад 8. Отримання 2-(нафталімідо)-N-(2морфолін-4-іл-етил)ацетаміду (11). Синтез проводили як описано у прикладі 10, виходячи 2.74г (0.01моль) хлороангідриду нафталімідогексанової кислоти та 1.3см 3 (0.01моль) етиламіноморфоліну. Ви хід: 48%. C20H21N3 O4. M.W. 367.41. Т пл. =215-216°С. Масспектр (БША), m/z (%): 368 (100) [М+Н]+. Спектр ПМР (ДМФА-СІ7): 2.399-2.458 м (6Н, СН2N(CH2CH2)2O), 3.340 к (2Н, -CONHCH 2-, 5.6), 3.620 м (4Н, -N(СН2СH2)2О), 4.840 с (2Н, -СH2СО-), 7.960 д д (2Н, Н b , 6.9 и 7.2), 8.539-8.600 д д (4Н, Н g , Н a ). Приклад 9. Отримання N-(3Диметиламінопропіл)-2-(нафталімідо)ацетаміду (12). Синтез проводили як описано у прикладі 10, виходячи із 2.73г (0.01моль) хлороангидриду нафталімідооцтової кислоти та 1.04см 3 (0.01моль) 3-(диметиламіно)пропіламіну. Вихід: 1.49г (44%). C19H21N3 O3. M.W. 339.40. Мас-спектр (БША), m/z (%): 340 (100) [М+Н]+. Т пл. =191-192°С. Спектр ПМР: 1.568 м (2Н, -CONHCH2CH2-), 1-802 с (6Н, N(CH3)2), 2.284 т (2Н, -СH2N(CH3)2, 6.0), 3.2753.333 к (2Н, -CONHCH2-, 6.0), 4.747 с (2Н, -СН2СО), 7.725-7.777 д д (2Н, Н g , 7.8 и 7.5), 8.1488 д д (2Н, Н g , 7.8), 8.480 д д (2Н, Н a , 8.1). Приклад 10. Отримання N-(2диетиламінопропіл)-2-нафталімідоацетаміду (13). Синтез проводили як описано у прикладі 10, виходячи із 2.73г (0.01моль) хлороангідриду нафталімідооцтової кислоти та 1.42см 3 (0.01моль) 2-(диетиламіно)пропіламіну. Вихід: 1.39г (38%). C21H25N3 O3. M.W. 367.45. Мас-спектр (БША), m/z (%): 368 (100) [М+Н]+. Т пл. (гідрохлорид) =255258°С. Спектр ПМР: 0.940 т (6Н, -N(СН2СН3)2, 7.2), 1.652 м (2Н, -СН2СН2, -N(CH2CH3)2), 2.4 т (4Н, N(CH2CH3)2, 7.2), 2.524 т (2Н, -CH2N(CH 2CH3)2, 5.7), 3.390 к (2Н, -CONHCH 2-, 6.0), 4.314 с (2Н, СH2СО-), 7.725-7.777 д д (2Н, Н g , 7.8 и 7.5), 8.2118.243 д д (2Н, Н g , 7.5), 8.6 д д (2Н, Н a , 8.1). Приклад 11. Отримання N-(2-(морфолін-4іл)пропіл)-2-нафталімідоацетаміду (14). Синтез проводили як описано у прикладі 10, виходячи із 2.73г (0.01моль) хлороангідриду нафталімідооцтової кислоти та 1.44см 3 (0.01моль) 3-(морфолін-4-іл)пропіламіну. Вихід: 1.75г (46%). C21H23N3 O4. M.W. 381.44. Мас-спектр (БША), m/z (%): 382 (100) [М+Н]+. Т пл. =208-209°С. Спектр ПМР: 1.687-1.771 м (2Н, -CONHCH2CH2-), 2.4942.537 м (6Н, -CH2N(CH 2CH2)2O), 3.390 к (2Н, CONHCH2- 5.4), 3.695 т (4Н, -N(CH2CH2)2O, 2.4), 4.810 с (2H, -СH2СО- ), 7.726 д д (2Н, Н b , 7.2 и 6.9), 8.2 д д (2Н, Н g , 7.2), 8.560 д д(2Н, Н a , 7.3). Приклад 12. Отримання N-(2Діетиламіноетил)-4-(нафталімідо)бутираміду (15). Синтез проводили як описано у прикладі 10, виходячи із 3.01г (0.01моль) хлороангідриду нафталімідобутанової кислоти та 1.2см 3 (0.01 моль) діетиламіноетиламіну. Вихід: 54%. C22H27N3 O3. M.W. 381.57. Т пл. =127-130°С. Мас 12 спектр (БША), m/z (%): 382 (100) [М+Н]+. Приклад 13. Отримання 4-(нафталімідо)-N-(2морфолін-4-іл-етил)бутираміду (16). Синтез проводили як описано у прикладі 10, виходячи із 3.01г (0.01моль) хлороангідриду нафталімідобутанової кислоти та 1.3см 3 (0.01 моль) етиламіноморфоліну. Вихід: 3.33г (81%). C23H27N3 O4. M.W. 409.49. Мас-спектр (БША), m/z (%): 410 (100) [М+Н]+. Т пл. =169-170°С. Приклад 14. Отримання N-(3Діетиламінопропіл)-4-(нафталімідо)бутираміду (17). Синтез проводили як описано у прикладі 10, виходячи із 3.01г (0.01моль) хлороангідриду нафталімідобутанової кислоти та 1.42см 3 (0.01 моль) 2-(диетиламіно)пропіламіну. Вихід: 48%. C23H29N3 O3. M.W. 395.60. Т пл. =255-258°С. Масспектр (БША), m/z (%): 396(100)[М+Н]+. Приклад 15. Отримання 4-(нафталімідо)-N-(3морфолін-4-іл-пропіл)бутираміду (18). Синтез проводили як описано у прикладі 10, виходячи із 3.01г (0.01моль) хлороангідриду нафталімідобутанової кислоти та 1.44см 3 (0.01 моль) 3-(морфолін-4-іл)пропіламіну. Вихід: 60%. C23H27N3 O4. M.W. 409.76. T пл. =208-210°С. Масспектр (БША), m/z (%): 410 (100) [М+Н]+. Приклад 16. Отримання N-(2Діетиламіноетил)-6-(нафталімідо)гексаноіламіду (19). Синтез проводили як описано у прикладі 10, виходячи із виходячи із 3.30г (0.01моль) хлороангідриду нафталімідобутанової кислоти та 1.2см 3 (0.01моль) діетиламіноетиламіну. Вихід: 29%. C24H31N3O 3. M.W. 409.53. Т пл. =127.0127.5°С. Мас-спектр (БША), m/z (%): 410 (100) [М+Н]+. Спектр ПМР: 0.896 т (6Н, -Н(СН 2СН3)2, 7.2), 1.304 м (2Н, -СН2СH2СН2-, 1.481-1.674 м (4Н, СH2СН2СН2-), 2.050 т (2Н, -CH2-N(CH2CH3)2, 6.2), 2.327-2.440 м (6Н, -СH2СО-, -N(CH2CH3)2), 3.040 к (2Н, -CONHCH2-, 6.0), 4.023 т (2Н, -Napом CH2-, 7.8), 7.860 д д (2Н, Н b , 7.5), 8.430-8.493 м (4Н, Н g , Н a ). Приклад 17. Отримання 6-(нафталімідо)-N-(3діметиламінопропіл)гексаноіламіду (20). Синтез проводили як описано у прикладі 10, виходячи із виходячи із 3.30г (0.01моль) хлороангідриду нафталімідобутанової кислоти та 1.55см 3 (0.01моль) 3-(діетиламіно)пропіламіну. Вихід: 32%. C23H 29N3O 3. M.W. 395.51. Т пл. =110112°С. Мас-спектр (БША), m/z (%): 396 (100) [М+Н]+. Приклад 18. Отримання N-(3Діетиламінопропіл)-6-(нафталімідо)гексаноіламід (21). Синтез проводили як описано у прикладі 10, виходячи із виходячи із 3.30г (0.01 моль) хлороангідриду нафталімідобутанової кислоти та 1.42см 3 (0.01 моль) 2-(диетиламіно)пропіламіну. Вихід: 25%. C25H 33N3O 3. M.W. 423.56. Т пл. =111112°С. Мас-спектр (БША), m/z (%): 424 (100) [М+Н]+. Спектр ПМР: 0.996 т (6Н, -N(CH2CH3)2-, 7.2), 1.384 м (2Н, -СН2СН2СН2-), 1.559-1.787 м (6Н, -СН2СН2СН2-, -CONHСН2СН2-), 2.137 т (2Н, CH2N(CH2CH3)2, 6.2), 2.444-2.514 м (6Н, -СН2СО- N(CH2CH3)2), 3.290 к (2Н, -CONHCH2-, 4.8 и 5.7), 13 29314 4.141 т (2Н, -Napoм CH2- 7.5), 7.160 д д (2Н, Н b , 7.5), 8.170 д д (2Н, H g , 7.2), 8.550 д д (2Н, Н a , 8.1). Приклад 19. Отримання 4-(1,3-діоксо-1Н,3Нбензо[dе]ізохінолін-2-іл)-N-(3-морфолін-4-ілпропіл)-гексаноіламід (22) Синтез проводили як описано у прикладі 10, виходячи із виходячи із 3.30г (0.01моль) хлороангідриду нафталімідобутанової кислоти та 1.44см 3 (0.01моль) 3-(морфолін-4-іл)пропіламіну. Вихід: 66%. C25H 31N3O 4. M.W. 437.54. Т пл. =144146°С. Мас-спектр (БША), m/z (%): 438 (100) [М+Н]+. Приклад 20. Вивчення афінітету до ДНК. Приготування вихідних концентрованих розчинів Розчиняють 0.014г ДНК селезінки великої рогатої худоби у 100см 3 води (одержують р-н " a "). Розчиняють 2.18г NaCl у 100см 3 води (одержують р-н " b "). Розчиняють 0.144г ЕДТА у 100см 3 води (одержують р-н " d "). Розчиняють 0.02г етидію броміду у 100см 3 води; одержують розчин з концентрацією 2.536x10-4 М (р-н " e "). Приготування концентрованого буферного розчину (р-н " x ") Розчиняють у склянці на 50см 3 1.64г безводного ацетату натрію в 20см 3 води і додають по краплях розведену водою (1:3) оцтову кислоту до рН =5 (контролюють рН за допомогою повіреного й відкаліброваного рН-метру). Вміст склянки кількісно переносять у мірну колбу на 1000см 3 і доводять водою до відмітини. Приготування концентрованого робочого розчину "В'" Вносять у мірну колбу на 500см 3 50см 3 розчину a , 50см 3 розчину b 50см 3 розчину e , 50см 3 розчину d та 200см 3 розчину x . Доводять водою до відмітини. Приготування розведеного робочого розчину "В" До мірної колби об'ємом 100см 3 додають 50см 3 розчину В’ та доводять водою до відмітини. Приготування розчину ліганду У склянку об'ємом 25см 3 додають розраховану кількість ліганду та розчиняють у 10см 3 води. Приготування робочих розчинів ліганду У 13 пробірок (№№1-13) додають 3см 3 розчину В. У пробірку №14 додають 3см 3 розчину В' та 3см 3 розчину ліганду. Проведення вимірів У кювету спектрофлуориметру поміщають 2см 3 досліджуваного розчину, кювету поміщають у кюветоутримувач і записують спектр флуоресценції в інтервалі довжин хвиль 520630нм. Виділяють пік, що відповідає етидію (lmax = 595 ± 2нм) і з'єднують прямою броміду мінімуми (базис). З вершини піка опускають перпендикуляр, відзначають точку його перетинання із базисом і вимірюють довжину отриманого відрізку. Процедуру повторюють для розчинів №№1-14. Інтенсивність флуоресценції розчинів №№1-14 виражають у відсотках щодо інтенсивності флуоресценції розчину "В". Відсоток 14 витиснення етидію броміду визначають за формулою: з комплексу D% = І% G - I%Н % % На графіку відкладають величини D , І G і I%Н як функції від концентрації. Проводять пряму D% = 50% і з точки її перетину із графіком D % = F(3) опускають перпендикуляр. Отримане значення концентрації приймають за C50- Якщо % величина І Н не перевищує 5-10%, то будують % lg CL залежність І G від . Отримані значення апроксимують сигмоїдою. Точку, що відповідає lg CL визначають як точку перегину, а її довірчий інтервал - як ширину коридору помилок при 50% витисненні Приклад 21. Визначення цитотоксичності препаратів в умовах in vitro клітин за дією на моношар клітин та пригніченням їх життєздатності. Перещеплювану культур у клітин фібробластів свиней - перевивних тестикул поросяти (ПТП) вирощували у 96-лункових мікроплатах (в атмосфері, що містить 5% СО2). Через 24год з лунок, де сформувався суцільний моношар клітин видаляли середовище росту і вносили підтримуюче середовище та розчинені препарати в діапазоні концентрацій від 5 до 500мкг/см 3 (на одне розведення не менше 4 лунок). Контроль лунки, в які було внесене тільки середовище для підтримання росту. Плати поміщали в термостат. Через 24 та 48год після інкубації плат при 36°С в умовах 5% СО2 клітини проглядали за допомогою інвертованого мікроскопу при малому збільшенні з метою виявлення цитопатичної дії (ЦПД) препаратів, яку оцінювали за порушенням цілісності моношару, появою осередків дегенерованих клітин та визначали за чотириплюсовою системою. Визначали: ТЦД100 тканинну цитотоксичну дозу (мкг/см 3), що викликає повну деструкцію клітин, ТЦД50 - тканинну цитотоксичну дозу (мкг/см 3), що викликає зміну 50% моношару клітин; МВК - максимально витримувану концентрацію - максимальну із досліджених доз речовини (мкг/см 3), що не викликає незворотніх змін у морфології та життєздатності клітин у порівнянні з контролем (фактично вона відповідає ТЦД0). Розрахунок ТЦД50 проводили за методом Ріда і Менча за формулами: log2 ТЦД50 = log 2 A - (50 - b)- log 2d / (а - b) чи log2 ТЦЦ50 = log 2 В + (a - 50)- log 2d / (a - b), де log2 А і log2 В - логарифми концентрацій за основою 2, що викликали ефекти відповідно більше чи менше 50%, але найближчі до 50%: а і b - ефект, викликаний концентраціями А і В, %: log2d - логарифм за основою 2 співвідношення між досліджуваними концентраціями. Другим параметром, за яким оцінювали токсичність доз препаратів було пригнічення їх життєздатності. [Методы испытания и оценки противовирусной активности химических соединений в отношении вируса гриппа. Методические указания. Сост. проф. В. И. 15 29314 Ильенко. - Л. - 1977. - 35 с]. Підрахунок клітин та визначення їх життєздатності через 24 та 48 годин інкубації проводили після фарбування клітин водним розчином вітального фарбника трипанового синього. При відсутності токсичного ефекту клітини засвоювали вітальний барвник. Забарвлення контрольних культур приймали за 100%. Розведення препарату, що викликало засвоєння фарбника на 50% вважали токсичним. Приклад 22. Вивчення інтерфероніндукуючи х властивостей. Інтерфероніндукуючу активність синтезованих сполук вивчали як описано [Доклінічні дослідження лікарських засобів. Методичні рекомендації. За редакцією член-кореспондента АМН України О. В. Стефанова. / Міністерство охорони здоров'я України. Державний фармакологічний центр., Київ, 2001. С.392]. Інтерфероніндукуючу активність препаратів в умовах in vitro вивчали в культурі клітин ПТП. Препарати в різних дозах (30-250мкг/см 3) додавали до сформованого моношару клітин і культивували при 37°С на протязі 24 та 48год, після чого надосадову рідину збирали і в ній визначали активність інтерферону за раніше опублікованою методикою. [Доклінічні дослідження лікарських засобів. Методичні рекомендації. За редакцією член-кореспондента АМН України О. В. Стефанова. / Міністерство охорони здоров'я України. Державний фармакологічний центр., Київ, 2001. С.392] (пригнічення цитопатогенної дії вірусу везикулярного стоматиту). Визначення активності інтерферону здійснювали через 24-48год, коли доза внесеного вірусу везикулярного стоматиту (ВВС) 100 ТЦД50 викликає повну дегенерацію клітин у контролі вірусу (KB) за відсутністю дегенерації у неінфікованій культурі. За титр інтерферону в одиницях дії (ОД) приймали величину, зворотну розведенню препарату, при якому культура клітин в 50% лунок була повністю захи щена від цитопатогенної дії індикаторного вірусу. Титр індукованого інтерферону (максимальне розведення супернатанту, при якому в 50% лунок цілком запобігалася дегенерація клітинного моношару) визначали в трьох паралельних експериментах. Виявлено, що в умовах in vitro досліджені речовини спричиняють утворення інтерферону (дані - діапазон значень, що отримані у трьох паралельних експериментах - наведені в таблиці). Дані про цитотоксичність, противірусну та інтерфероніндукуючу активність, інтеркалюючу здатність сполук 10-22 наведені в таблиці. 16 10 11 12 13 14 15 16 17 18 19 20 21 22 Аміксин 5.54 5.66 5.68 5.31 5.46 6.13 5.83 6.10 6.02 6.00 3.29 3.17 3.58 3.31 3.63 3.75
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of naphthalimidocarboxylic acids as dna intercalating low-toxic interferon-inducing antiviral agents
Автори англійськоюKarpenko Oleksandr Serhiiovych, Liakhov Serhii Anatoliiovych, Zholobak Nadia Mykhailivna, Olevinska Zoia Mechyslavivna, Spivak Mykola Yakovych, Nekhoroshkova Yuliia Vladyslavivna, Shafran Leonid Moiseiovych
Назва патенту російськоюПроизводные нафталимидокарбоновых кислот как интеркалирующие в днк низкотоксичные интерферонирующие противовирусные агенты
Автори російськоюКарпенко Александр Сергеевич, Ляхов Сергей Анатольевич, Жолобак Надежда Михайловна, Олевинская Зоя Мечиславовна, Олевинская Зоя Мечиславивна, Спивак Николай Яковлевич, Нехорошкова Юлия Владиславовна, Шафран Леонид Моисеевич
МПК / Мітки
МПК: C07C 209/00, C07D 213/00
Мітки: днк, нафталімідокарбонових, інтеркалюючі, агенти, інтерфероніндукуючі, противірусні, похідні, низькотоксичні, кислот
Код посилання
<a href="https://ua.patents.su/8-29314-pokhidni-naftalimidokarbonovikh-kislot-yak-interkalyuyuchi-u-dnk-nizkotoksichni-interferonindukuyuchi-protivirusni-agenti.html" target="_blank" rel="follow" title="База патентів України">Похідні нафталімідокарбонових кислот як інтеркалюючі у днк низькотоксичні інтерфероніндукуючі противірусні агенти</a>
Попередній патент: Магнітна система аплікатора для концентрації магнітних матеріалів у локальній області всередині біологічного об’єкта
Наступний патент: Медичний апарат для термічного лікування онкологічних захворювань
Випадковий патент: Спосіб підготовки зерна круп'яних культур для переробки в крупу