Похідні аміноалкілнафталімідів як інтеркалюючі у днк індуктори інтерферону та противірусні агенти
Номер патенту: 17734
Опубліковано: 16.10.2006
Автори: Олевінська Зоя Мечиславівна, Жолобак Надія Михайлівна, Ляхов Сергій Анатолійович, Доровських Ірина Вікторівна, Карпенко Олександр Сергійович, Співак Микола Якович, Андронаті Сергій Андрійович
Формула / Реферат
Похідні аміноалкілнафталімідів загальної формули

де:
R1=Η; n=1;
R2=
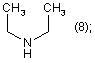
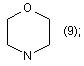
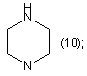
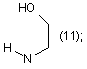
R1=Η; n=2;
R2=
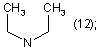
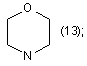
![]()
![]()
R1=СН3; n=3;
R2=
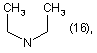
як інтеркалюючі у ДНК індуктори інтерферону та противірусні агенти.
Текст
Похідні аміноалкілнафталімідів загальної формули (13) (21) u200603556 (22) 03.04.2006 (24) 16.10.2006 (46) 16.10.2006, Бюл. № 10, 2006 р. (72) Карпенко Олександр Сергійович, Доровских Ірина Вікторівна, Ляхов Сергій Анатолійович, Андронаті Сергій Андрійович, Співак Микола Якович, Жолобак Надія Михайлівна, Олевінська Зоя Мечиславівна (73) ФІЗИКО-ХІМІЧНИЙ ІНСТИТУТ ІМ. О.В.БОГАТСЬКОГО НАЦІОНАЛЬНОЇ АКАДЕМІЇ НАУК УКРАЇНИ 3 17734 213/00, C07C209/00. - Заявка №20041008236; Заявл. 11.10.2004; Опубл. 15.08.2005. Бюл. №8.]. В основу корисної моделі поставлено задачу розширення спектру індукторів ІФН за рахунок створення нових синтетичних малотоксичних низькомолекулярних індукторів - похідних нафталіміду. Поставлена задача вирішена синтезом сполук, що заявляються загальної формули: R1 O R N R O NH O N 4 NH N 1-7 8-16 H N (8); R2= (9); N H , а саме: R1=Η; n=1 O CH3 R2 O Основними недоліками, притаманними сполукам 1-7, як і іншим індукторам інтерферону є перехресна гіпореактивність та обмежений спектр дії [Stringfellow D.A. Production of the interferon protein: hyporesponsiveness. // Тех. Rep. Biol. Med. - 1977. Vol. 35. - P.126-131], що зумовлює актуальність пошуку нових малотоксичних індукторів ІФН. CH3 n HO (10); N H N (11); N 1 R =Η; n=2 CH3 CH3 R2= O (12); (13); N CH3 CH3 (14); H N Раніше було припущено, що індукція ІФН аміксином реалізується за рахунок дерепресії генів ІФН, що є наслідком інтеркаляції молекули аміксину до ДНК [Ляхов С.А., Литвинова Л.А. О взаимодействии аминоалкоксифлуоренонов с нуклеиновыми кислотами и олигонуклеотидами. // Физикохимический институт АН УССР. - Одесса, 1989. 13с. - Рус. - Деп. в ВИНИТИ 03.10.89г., №6264В89.; Sergey A. Lyakhov Intercalative antiviral drugs: mode of action. // Abstracts of 6th International Symposium on Molecular Aspects of Chemotherapy, Gdansk, Poland, 9-12 July, 1997, p.137]. Для сполук 8-16 здатність до інтеркаляції очікувана тому, що в їх структурі є три конденсовані плоскі цикли з декіO CH3 (15); R1 O R1 R2 H2N R2 N n n 18-26 17 N лькома подвійними зв'язками, а саме ця структурна особливість є достатньою для інтеркаляційної здатності сполук [Lerman L.S. Structural consideration in the interaction of DNA and acridines. // J. Моl. Biol. - 1961. - Vol.3. - P.18-30]. Причинно-наслідковий зв'язок між структурою об'єктів, що заявляються, і їхньою біологічною дією полягає, очевидно, у здатності сполук 8-16 до інтеркаляції в ДНК, що повинна призводити до дерепресії гена, його транскрипції і до наступного синтезу ІФН. Сполуки, що заявляються, одержували конденсацією нафталевого ангідриду (17) з відповідними первинними амінами (18-26) з наступним виділенням та очисткою цільового продукту. Чистота цільових сполук 8-16 підтверджена тонкошаровою хроматографією, будова - даними мас-спектрометрїї та спектроскопії 1Н-ЯМР. CH3 (16). R2= O N N R1=СН3; n=3 O H3C >100C, -H2O O 8-16 5 Інтеркалюючу здатність сполук якісно підтверджено за позитивними результатами тестів: - збільшення характеристичної в'язкості розчинів ДНК у присутності ліганду (при сталості рН, іонної сили і температури) [Geller К., Reinert K.E., Schulze W. Interaction of DNA with tilorone derivatives: viscometric investigations // Biomed. Biochim. Acta. - 1985 - Vol.44, №7-8. - P.1095-1103]; - батохромний зсув в електронних спектрах довгохвильових смуг хромофору при одночасному гіпохромізмі [Sturm J, Schreiber L, Daune M. Binding of ligands to a one-dimensional heterogeneous lattice. II. Intercalation of tilorone with DNA and polynucleotides // Biopolymers. - 1981. - Vol.20, №4. - P.765-785; Waring M.J. Drugs and DNA: uncoiling of the DNA double helix as evidence of intercalation // Humangenetik. - 1970. - Vol.9, №3. - P.234-236.]; - зменшення інтенсивності флуоресценції інтеркалюючих лігандів (етідію броміду, акридинового жовтогарячого, профлавину і т.д.) [Baguley B.C., Denny W.A., Atwell G.J., Cain B.F. Potential antitumor agents. 34. Quantitative relationships between DNA binding and molecular structure for 9anilinoacridines substituted in the anilino ring. // J. Med. Chem. - 1981. - Vol.24, №2. - P.170-177]. Константи асоціації сполук отримано методом конкуренції з етідієм бромідом за описаною методикою [Antonini І., Polucci P., Kelland L.R., Menta Ε., Pescalli Ν., Martelli S. 2,3-Dihydro-1H,7Hpyrimido[5,6,1-de]acridine-1,3,7-trione derivatives, a class of cytotoxic agents active on multidrug-resistant cell lines: synthesis, biological evaluation, and structure-activity relationships // J. Med. Chem. 1999. - Vol. 42, №14. - P.2535-2541]. Первинне дослідження препаратів проводили за схемою і за умов, що враховували адекватність тест-моделі можливому механізму інтерфероногенної активності, що передбачався на підставі аналізу структури хімічної сполуки, яка вивчалась [Вильнер Л.М. Актуальные вопросы скрининга и последующего изучения противовирусных препаратов типа интерфероногенов / В сб.: Методические вопросы научной разработки противовирусных средств. - Минск, 1977. - С.134-136]. Цитотоксичність та інтерфероніндукуючу активність синтезованих сполук вивчали як описано [Доклінічні дослідження лікарських засобів. Методичні рекомендації. / За ред. чл.-кор. АМН України О.В. Стефанова. - К: МОЗ, України. ДФЦ, 2001. - 392с.] Отримання сполук, що заявляються, підтверджено наступними прикладами. Приклад 1. 2-(2-Діетиламіноетил)бензо[dе]ізохінолін-1,3-діон (8). Суміш 1.98г (0.01моль) нафталевого ангідриду (17) та 1.162г (0.01моль, 1.42см3) 2(діетиламіно)етиламіну (18) при переміщуванні нагрівають до 110 С і витримують при цій температурі 2-3год. Реакційну суміш екстрагують кипля3 чим бензолом (4 30см ). Бензол випарюють. Сухий залишок екстрагують киплячим гептаном (5 25см3), екстракт охолоджують до -18 С, осад відфільтровують і промивають на фільтрі 5см3 охолодженого до -18 С гептану. Вихід: 2.27г (77%). C18H20N2O2. M.W. 296.37. Т пл. (гідрохлорид)>250 С. Мас-спектр (БША), m/z (%): 297 (100) 17734 6 [M+H]+. ЯМР-спектр (ДМФА-d7): 1.164т (6Н, ( CH3 СН2)2N, 7.2), 2.752к (4Н, (СН3 CH2 )2N, 7.2), 3.380с (2Н, COCH2N), 7.946 д д (2Н, Н5, 8.1 и 7.2), 8.566 д д (2Н, Н6, 8.1 и 0.8), 8.601 д д (2Н, Н4,6.9 и 0.9). Аналогічно одержують сполуки 9-16. Приклад 2. 2-(2-Морфолін-4-іл-етил)-бензо[de] ізохінолін-1,3-діон (9). Синтез проводили як описано у прикладі 1, виходячи із 1.98г (0.01моль) нафталевого ангідриду (17) та 1.16г (0.01моль) 2-(морфолин-4іл)етиламіну (19). Вихід: 2.02г (65%). C18H18N2O3. M.W. 310.33. Т пл.=156.0-157.5 С. Мас-спектр (БША), m/z (%): 311 (100) [М+Н]+. ЯМР-спектр (ДМФА-d7): 1.418-1.498м (2Н, O(CH2CH2)2N, 5.1), 1.622-1.696м (4Η, O( CH2 CH2)2N, 5.1), 2.7232.735м (4Н, O(CH2 CH2 )2N, 5.1), 3.274с (2Н, CO CH2 N), 7.952 д д. (2Н, Н5, 8.1 и 7.2), 8.573 д д (2Н, Н6, 8.3 и 0.9), 8.601 д д (2Н, Н4,7.5 и 0.9). Приклад 3. 2-(2-Піперазин-1-іл-етил)бензо[dе]ізохінолін-1,3-діон (10). Синтез проводили як описано у прикладі 1, виходячи із 1.98г (0.01моль) нафталевого ангідриду (17) та 1.14г (0.01моль) 2-(пиперазин-1іл)етиламіну (20). Вихід: 1.73г (56%). C18H19N3O2. M.W. 309.37. Т пл. (гідрохлорид)=240-244 С (із розкладанням та возгонкою). Мас-спектр (БША), m/z (%): 310 (100) [М+Н +. ЯМР-спектр (ДМФА-d7): 2.737-2.785м (4Η, N(CH2 CH2 )2N, 5.4), 3.358с (2Н, C CH2 N), 3.755т (4Н, N( CH2 CH2)2N, 5.4), 7.950 д д (2Н Н5, 8.1 и 7.2), 8.571 д д (2Н Н6, 8.3 и 0.9), 8.606 д д (2Н, Н4, 7.5 и 0.9). Приклад 4. 2-[2-(2-Гідроксіетиламино)-етил]бензо[dе]ізохінолін-1,3-діон (11). Синтез проводили як описано у прикладі 1, виходячи із 1.98г (0.01моль) нафталевого ангідриду (17) та 1.04г (0.01моль) 2-(2-аминоетиламіно)етанолу (21). Вихід: 1.44г (51%). С16Н16N2O3. M.W. 284.32. Т пл.=103-105 С. Масспектр (БША), m/z (%): 285 (100) [M+H]+. ЯМРспектр (ДМФА-d7): 1.615т (4Н, HO CH2 CH2N, 3.3), 2.757-2.809м (4Н, HOCH2 CH2 N), 3.451с (2Н, C CH2 N), 7.948 д д (2Н, Н5, 8.7 и 7.8), 8.568 д д (2Н, Н6, 8.4 и 0.9), 8.607 д д (2Н, Н4, 7.2 и 0.6). Приклад 5. 2-(3-Діетиламінопропіл)бензо[dе]ізохінолін-1,3-діон (12). Синтез проводили як описано у прикладі 1, виходячи із 1.98г (0.01моль) нафталевого ангідриду (17) та 1.30г (0.01моль) 3-(діетиламіно)пропіламіну (22). Вихід: 2.23г (72%). С19Н22N2O2. M.W. 310.40. Т пл.=53-55 С. Мас-спектр (БША), m/z (%): 311 (100) [M+H]+. ЯМР-спектр (ДМФА-d7): 1.926 д (6Н, ( CH3 СН2)2Н 5.7), 1.263-1.367м (3Н), 1.650-1.682м (2Н), 2.189т (2Н, 12.9), 3.179-3.217м (2Н), 3.287с (2Н, (СН3 CH2 )2N), 7.958 д д (2Н. Н5, 8.1 и 7.2), 8.581 д д (2Н, Н6, 9.6 и 0.9), 8.613 д д (2Н, Н4,7.5 и 0.9). 7 17734 Приклад 6. 2-(3-(Морфолін-4-іл)пропіл)бензо[dе]ізохінолін-1,3-діон (13). Синтез проводили як описано у прикладі 1, виходячи із 1.98г (0.01моль) нафталевого ангідриду (17) та 1.44г (0.01моль) 3-(морфолін-4іл)пропіламіну (23). Вихід: 2.14г (66%). C19H20N2O3. M.W. 324.38. Т пл.=137-138 С. Мас-спектр (БША), m/z (%): 325 (100) [М+Н +. ЯМР-спектр (ДМФА-d7): 1.624-1.663м (4Н, O( CH2 CH2)2N), 1.673-1.810м (4Н, O(CH2 CH2 )2N), 2.871-2.909м (4Н, O(CH2 CH2 )2N), 3.470с (2Н, CO CH2 N), 7.972 д д (2Н, Н5, 7.8), 8.568 д д (2Н, Н6, 8.1), 8.599 д д (2Н, Н4, 8.4). Приклад 7. 2-(3-Диметиламінопропіл)бензо[dе ізохінолін-1,3-діон (14). Синтез проводили як описано у прикладі 1, виходячи із 1.98г (0.01моль) нафталевого ангідриду (17) та 1.02г (0.01моль) 3(диметиламіно)пропіламіну (24). Вихід: 1.97г (70%). C17H18N2O2. M.W. 282.35. Т пл.=116.0117.5 С. Мас-спектр (БША), m/z (%): 283 (100) [M+H]+. ЯМР-спектр (ДМФА-d7): 2.229с (3Н, CH3 N(CH2CH2)2N), 2.463м (4Н, CH3N( CH2 CH2)2N), 2.756м (4Н, СН3N(СН2 CH2 )2N), 3.330с (2Н, CO CH2 N), 7.957 д д (2Н, Н5, 8.4 и 7.5), 8.582 д д (2Н, Н6, 8.1 и 0.6), 8.613 д д (2Н, Н4, 7.8 и 0.6). Приклад 8. 2-(3-Метиламінопропіл)бензо[dе]ізохінолін-1,3-діон (15). Синтез проводили як описано у прикладі 1, виходячи із 1.98г (0.01моль) нафталевого ангідриду (17) та 0.88г (0.01моль) 3-(метиламіно)пропіламіну (25). Вихід: 12.9г (67%). C16H16N2O2. M.W. 268.32. Т пл.=111.0-112.5 С. Мас-спектр (БША), m/z (%): 269 (100) [М+Н]+. ЯМР-спектр (ДМФА-d7): 2.926с (3Н, ( CH3 )2N, 5.7), 1.263-1.367м (3Н), 1.650-1.682м (2Н), 2.189т (2Н, 12.9), 3.179-3.217м (2Н), 3.287с (2Н, C CH2 N), 7.958 д д (2Н. Н5, 8.1 и 7.2), 8.581 д д (2Н, Н6, 9.6 и 0.9), 8.613 д д (2Н, Н4, 7.5 и 0.9). Приклад 9. 2-(4-Діетиламіно-1-метилбутіл)бензо[dе]ізохінолін-1,3-діон (16). Синтез проводили як описано у прикладі 1, виходячи із 1.98г (0.01моль) нафталевого ангідриду (17) та 0.88г (0.01моль) 4-(діетиламіно)-1(метил)бутіламіну (26). Вихід: 1.39г (47%). С19Н20N4O3. M.W. 296.37. Τ пл. (гідрохлорид)=158159 С. Мас-спектр (БША), m/z (%): 339 (100) [М+Н]+. ЯМР-спектр (ДМФА-d7): 1.624-1.663м (4Н, (CH2CH2 CH2 )2N), 1.673-1.810м (4Н, (СН2 CH2 СН2)2N), 2.871-2.909м (4Н, (CH2CH2 CH2 )2N), 3.470с (2Н, CO CH2 N), 7.972 д д (2Н, Н5,7.8), 8.568 д д (2Н, Н6, 8.1), 8.599 д д (2Н, Н4, 8.4). Приклад 10. Вивчення афінітету до ДНК. Приготування вихідних концентрованих розчинів 8 70мг ДНК розчиняли у 100см3 води (одержали розчин " "). 545мг NaCl розчиняли у 100см3 води (одержали розчин " "). 36мг етилендіамінотетраацетату натрію розчиняли у 100см3 води (одержали розчин " "). 52.2мг етидію броміду розчиняли у 100см3 води; одержали розчин з концентрацією 1.324 10-3М (розчин " "). Приготування концентрованого буферного розчину (розчин " ") Розчиняли у склянці на 50см3 164мг безводного ацетату натрію в 20см3 води і додавали по краплях розведену водою (1:3) оцтову кислоту до рН=5 (контролювали рН за допомогою повіреного й відкаліброваного рН-метру). Вміст склянки кількісно перенесли у мірну колбу на 100см3 і додали воду до мітки. Приготування контрольного розчину для "гасіння" Внесли у мірну колбу на 50см3 4см3 розчину , 3 5см розчину , 5см3 розчину , 5см3 розчину і 0.151(0.150-0.152)см3 розчину . Додали воду до мітки (одержали розчин А). Приготування контрольного розчину для "витиснення" Внесли у мірну колбу на 50см3 0.1см3 розчину , 5см3 розчину , 5см3 розчину , 5см3 розчину і 0.096(0.09-0.100)см3 розчину . Додали воду до мітки (одержали розчин В). Приготування буфера розведення Внесли у мірну колбу на 50см3 10см3 розчину , 10см3 розчину , 10см3 розчину . Додали воду до мітки (одержали розчин С). Приготування концентрованого розчину ліганду Розрахункову кількість ліганду розчиняли у 100см3 дистильованої води, прагнучи одержати розчин з концентрацією у 20-30 разів більшою, ніж очікуване значення С50 (одержали розчин D). Приготування вихідних розчину ліганду Додали у 8 мірних колб на 25см3 0.5, 0.9, 1.3, 2.5, 4.0, 7.5, 10.0, 15.0, см3 розчину D. Додали воду до мітки. Як розчин Е9 використовували розчин D (одержали розчини E1-Е9). Приготування робочих розчинів ліганду У 9 пробірках змішували по 1см3 розчинів Е1Е9 з 1см3 розчину С (одержали розчини F1-F9). Приготування розчинів ліганду для вивчення гасіння У 9 пробірок, що містять по 2см3 розчинів F1F9 додавали по 2см3 розчину А (для вивчення гасіння), одержуючи розчини G1-G9 (одержали розчини G1-G9). Додатково готували розчин G10 змішуючи 2см3 розчину А, 1см3 води і 1см3 розчину С. Приготування розчинів ліганду для вивчення витиснення У 9 пробірок, що містять по 2см3 розчинів F1F9 додавали по 2см3 розчину В (для вивчення витиснення), одержуючи розчини Н1-Н9. Додатково готували розчин Η10 змішуючи 2см3 розчину В, 1см3 води і 1см3 розчина С. Проведення вимірів У кювету спектрофлуориметру додали 2.5см3 досліджуваного розчину, кювету встановили у кю 9 ветоутримувач і записували спектр флуоресценції в інтервалі довжин хвиль 520-630нм. Виділяли пік, що відповідає етидію броміду ( max=595 2нм) і з'єднували мінімуми прямою (базис). З вершини піка опускали перпендикуляр, відзначали точку його перетинання з базисом і вимірювали довжину отриманого відрізку. Процедуру повторювали для розчинів G1-G10 і Н1-Н10. Інтенсивність флуоресценції розчинів G1-G9 і Н1-Н9 виражали у відсотках щодо інтенсивності флуоресценції розчинів G10 і Н10 відповідно. Відсоток витиснення етидію броміду з комплексу визначали за формулою: D%=I%G-I%H На графіку відкладали величини D%, Ι%G і I%H як функції від концентрації. Проводили пряму D%=50% і з точки її перетину з графіком D%=F(З) опускали перпендикуляр. Отримане значення концентрації приймали за С50. Якщо величина Ι%Ή не перевищує 5-10%, то будували залежність Ι%G від lgCL. Отримані значення апроксимували сигмоїдою. Точку, що відповідає lgCL визначали як точку перегину, а її довірчий інтервал - як ширину коридору помилок при 50% витисненні. Логарифм константи асоціації ліганду з ДНК визначали за формулою: lgKa=lgCE-lgC50+7 Приклад 11. Визначення цитотоксичності препаратів в умовах in vitro клітин за дією на моношар клітин та пригніченням їх життєздатності. Перещеплювану культуру клітин фібробластів свиней - перевивних тестикул поросяти (ПТП) вирощували у 96-лункових мікро платах (в атмосфері, що містить 5% СО2). Через 24год. з лунок, де сформувався суцільний моношар клітин видаляли середовище росту і вносили підтримуюче середовище та розчинені препарати в діапазоні концентрацій від 5 до 500мкг/см3 (на одне розведення не менше 4 лунок). Контроль - лунки, в які було внесене тільки середовище для підтримання росту. Плати поміщали в термостат. Через 24 та 48год. після інкубації плат при 36°С в умовах 5% СО2 клітини проглядали за допомогою інвертованого мікроскопу при малому збільшенні з метою виявлення цитопатичної дії (ЦПД) препаратів, яку оцінювали за порушенням цілісності моношару, появою осередків дегенерованих клітин та визначали за чотирьохплюсовою системою. Визначали: ТЦД100 - тканинну цитотоксичну дозу (мкг/см3), що викликає повну деструкцію клітин, ТЦД50 - тканинну цитотоксичну дозу (мкг/см3), що викликає зміну 50% моношару клітин; МВК - максимально витримувану концентрацію - максимальну із досліджених доз речовини (мкг/см3), що не викликає незворотних змін у морфології та життєздатності клітин у порівнянні з контролем (фактично вона відповідає ТЦД0). Розрахунок ТЦД50 проводили за методом Ріда і Менча за формулами: log2 ТЦД50=log2A-(50-b) log2d/(a-b), чи log2ТЦД50=log2В+(a-50) log2d/(a-b), де log2А і log2В - логарифми концентрацій за основою 2, що викликали ефекти відповідно більше чи менше 50%, але найближчі до 50%: а і b ефект, викликаний концентраціями А і В, %: log2d 17734 10 логарифм за основою 2 співвідношення між досліджуваними концентраціями. Другим параметром, за яким оцінювали токсичність доз препаратів було пригнічення життєздатності клітин. [Методы испытания и оценки противовирусной активности химических соединений в отношении вируса гриппа. Методические указания. Сост. проф. В.И. Ильенко. - Л. - 1977. - 35с.]. Підрахунок клітин та визначення їх життєздатності через 24 та 48 годин інкубації проводили після фарбування клітин водним розчином вітального фарбника трипанового синього. При відсутності токсичного ефекту клітини засвоювали вітальний барвник. Забарвлення контрольних культур приймали за 100%. Розведення препарату, що викликало засвоєння фарбника на 50% вважали токсичним. В результаті 11 із 14 досліджених сполук в концентрації 250мкг/см3 виявились нетоксичними для перевивних клітин ПТП. Сполука 8 у вказаній концентрації викликала 50% деструкцію моношару клітин та пригнічення їх життєздатності, 30% клітин загинуло при застосуванні вказаної концентрації сполуки 11. Концентрація сполуки 14-100мкг/см3 становила для клітин ТЦД100, а МВК склала 60мкг/см3. Отримані дані свідчать про низьку токсичність (за виключенням трьох вказаних сполук) переважної більшості досліджених речовин. Приклад 12. Вивчення інтерфероніндукуючих властивостей. Інтерфероніндукуючу активність синтезованих сполук вивчали як описано [Доклінічні дослідження лікарських засобів. Методичні рекомендації. За редакцією член-кореспондента АМН України О.В. Стефанова. / Міністерство охорони здоров'я України. Державний фармакологічний центр., Київ, 2001. С.392] Інтерфероніндукуючу активність препаратів в умовах in vitro вивчали в культурі клітин ПТП. Препарати в різних дозах (30-250мкг/см3) додавали до сформованого моношару клітин і культивували при 37°С протягом 24 та 48год., після чого надосадову рідину збирали і в ній визначали активність інтерферону за раніше опублікованою методикою. [Доклінічні дослідження лікарських засобів. Методичні рекомендації. За редакцією членкореспондента АМН України О.В. Стефанова. / Міністерство охорони здоров'я України. Державний фармакологічний центр., Київ, 2001. С.392] (пригнічення цитопатогенної дії вірусу везикулярного стоматиту). Визначення активності інтерферону здійснювали через 24-48год., коли доза внесеного вірусу везикулярного стоматиту (ВВС) 100 ТЦД50 викликає повну дегенерацію клітин у контролі вірусу (KB) за відсутністю дегенерації у неінфікованій культурі. За титр інтерферону в одиницях дії (ОД) приймали величину, зворотну розведенню препарату, при якому культура клітин в 50% лунок була повністю захищена від цитопатогенної дії індикаторного вірусу. Титр індукованого інтерферону (максимальне розведення супернатанту, при якому в 50% лунок цілком запобігалася дегенерація клітинного моно 11 17734 шару) визначали в трьох паралельних експериментах. Виявлено, що в умовах in vitro досліджені речовини спричиняють утворення інтерферону (дані 12 - діапазон значень, що отримані у трьох паралельних експериментах - наведені в таблиці). Дані про цитотоксичність та інтерфероніндукуючу активність сполук 8-16 наведені в таблиці. Таблиця Інтеркалююча здатність, цитотоксичність та інтерфероніндукуюча активність сполук, що заявляються Сполука IgKa токсичність, lgLC50 8 9 10 11 12 13 15 16 6.99 5.38 5.29 5.57 6.56 6.93 5.57 5.50 4.42 3.54 3.89 4.40 4.44 3.87 4.38 3.58 Противірусна активність, (% живих клітин) 30.5 72.2 44.4 16.6 16.6 30.5 2.8 100 Як видно з наведених даних, сполуки, що заявляються, є інтеркаляторами помірної сили та індукторами інтерферону, причому за своєю актив Комп’ютерна верстка М. Ломалова Інтерфероніндукуюча активність L929 ΠΤΠ (2.5 Μ) (11 Μ) (2.5 Μ) (11 Μ) 3 5 1 1 2.4 4.5 0.5 5 7 2 4 4.5 7 2 2 4 6 3 4 4.5 7 3.5 4 4 6.5 2 3 5 7 0 0 ністю деякі з них не поступаються аміксину. Водночас, цитотоксична концентрація їх набагато вища за ЦТК аміксину, що вказує на їх вкрай низьку токсичність. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of aminoalkylnaphtalimides as intercalated in dna inductors of interferon and antiviral agents.
Автори англійськоюKarpenko Oleksandr Serhiiovych, Dorovskykh Iryna Viktorivna, Liakhov Serhii Anatoliiovych, Andronati Serhii Andriiovych, Spivak Mykola Yakovych, Zholobak Nadia Mykhailivna, Olevinska Zoia Mechyslavivna
Назва патенту російськоюПроизводные аминоалкилнафталимидов как интеркалирующие в днк индукторы интерферона и противовирусные агенты.
Автори російськоюКарпенко Александр Сергеевич, Доровских Ирина Викторовна, Ляхов Сергей Анатольевич, Андронати Сергей Андреевич, Спивак Николай Яковлевич, Жолобак Надежда Михайловна, Олевинская Зоя Мечиславовна, Олевинская Зоя Мечиславивна
МПК / Мітки
МПК: C07C 209/00, C07D 213/00
Мітки: противірусні, аміноалкілнафталімідів, похідні, індуктори, інтерферону, агенти, днк, інтеркалюючі
Код посилання
<a href="https://ua.patents.su/6-17734-pokhidni-aminoalkilnaftalimidiv-yak-interkalyuyuchi-u-dnk-induktori-interferonu-ta-protivirusni-agenti.html" target="_blank" rel="follow" title="База патентів України">Похідні аміноалкілнафталімідів як інтеркалюючі у днк індуктори інтерферону та противірусні агенти</a>
Попередній патент: Спосіб іммобілізації пероксидази
Наступний патент: Аерозольутворюючий твердопаливний склад для гасіння пожежі (варіанти)
Випадковий патент: Пристрій визначення стану нативного хлорофілу










