Спосіб одержання очищеного і розчинного рекомбінантного білка rexhcd34, синтезованого штамом-продуцентом е.coli bl21hcd34
Номер патенту: 44816
Опубліковано: 12.10.2009
Автори: Кордюм Віталій Арнольдович, Іродов Дмитро Михайлович, Фляк Андрій Ігорович, Ніколаєв Юліан Сергійович, Гільчук Юлія Миколаївна, Гільчук Павло Володимирович, Горбатюк Оксана Борисівна
Формула / Реферат
Спосіб одержання очищеного і розчинного рекомбінантного білка rExhCD34, синтезованого штамом-продуцентом Е. coli BL21hCD34, що включає осадження бактеріальних клітин після завершення біосинтезу центрифугуванням, руйнування бактеріальних клітин і хромосомної ДНК у присутності лізоциму та ДНК-ази, осадження фракції тілець, включення центрифугуванням, промивання тілець включення розчинами, що містять неіонні детергенти шляхом суспендування осаду з наступним осадженням центрифугуванням, солюбілізацію тілець включення у присутності сечовини або гуанідин гідрохлориду, очищення солюбілізованого білка металафінною хроматографією на колонці у присутності сечовини або гуанідин гідрохлориду, ренатурацію білка на хроматографічній колонці шляхом контрольованого видалення сечовини або гуанідин гідрохлориду, елюції розчинного і очищеного рекомбінантного білка з хроматографічної колонки у нативних умовах.
Текст
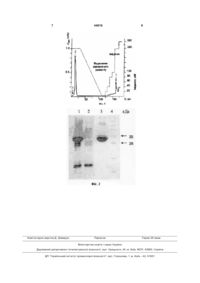
Спосіб одержання очищеного і розчинного рекомбінантного білка rExhCD34, синтезованого штамом-продуцентом Е. coli BL21hCD34, що включає осадження бактеріальних клітин після завершення біосинтезу центрифугуванням, руйну 3 Jun; 15(3): p. 305-13.). Вищезазначені маніпуляції можливі завдяки специфічним моноклональним антитілам, які одержують шляхом імунізації мишей екстрактами клітин, що містять CD34 антиген, і наступним злиттям плазматичних клітин імунізованих тварин з лінією мієлобластоїдних клітин для створення продуцентів моноклональних антитіл гібридом (Kohler G., Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity // Nature. - 1975. - Vol. 256, № 5517. - P. 495497). Одержання і відбір гібридом, що синтезують моноклональні антитіла необхідної специфічності, є довготривалим процесом, а продукування та очищення моноклональних антитіл потребує високих затрат на середовища та реактиви. Альтернативним способом є одержання специфічних поліклональних антитіл шляхом імунізації тварин, який, у свою чергу, є значно дешевшим, однак потребує наявності великої кількості високо очищеного білка CD34, що є неможливим у разі використання екстрактів CD34+ клітин як єдиного джерела даного антигену. Відомий СD34-антиген людини Г.І. походження, продукований трансфікованою лінією клітин ссавців COS під контролем промотору плазміди CDM8. Плазміда для синтезу рекомбінантного CD34 містить в собі кДНК послідовність гена CD34 із лінії клітин KG1 розміром 2615.П.Н. Білок CD34 синтезується культурою клітин еукаріотів на поверхні плазматичної мембрани у вигляді продукту ПО кДа (Simmons, D.L., Satterthwaite, A.B., Tenen, D.G. and Seed В., Molecular cloning of a cDNA encoding CD34, a sialomucin of human hematopoietic stem cells. J Immunol, 1992. 148(1): p. 267-71.). Зазначений спосіб одержання антигену CD34 має суттєві недоліки, серед яких можна вказати низький рівень його синтезу клітинами еукаріотів, довготривалість культивування та нестабільність трансфікованої клітинної лінії, високу вартість поживних середовищ, неможливість одержання препаративної кількості антигену в умовах лабораторії і складність процедури його очищення. Також гетерогенний характер приєднання глікозидьних залишків до поліпептидного ланцюгу CD34 у разі його синтезу трансфікованою лінією еукаріотичних клітин змінює антигенні властивості CD34, що, в свою чергу, ускладнює його використання у процедурах одержання універсальних специфічних полі- і моноклональних антитіл проти білкових детермінант. У той же час генно-інженерні технології дозволяють клонувати гени еукаріотів і забезпечувати їх високоефективну експресію в бактеріях Е. coli (T. Маніатіс "Молекулярне клонування - Лабораторна збірка методик", Колд Спрінг Харбор Лабораторі, Колд Спрінг Харбор, том 1-3. 1989 p.). Потім білок може бути виділений з бактеріальних клітин і очищений за відомими методиками. У таких спосіб рекомбінантний антиген CD34 може бути одержано у кількостях, необхідних для імунізації тварин, продукування специфічних поліклональних антитіл та їхнього очищення. Створення технології одержання рекомбінантного антигену CD34 людини потребує вирішення таких завдань, як ідентифікація у складі повнорозмірного антигену CD34 імунологічно значущої антигенної детермінанти, ди 44816 4 зайн послідовності рекомбінантного антигену для експресії в бактеріях, виділення та клонування ДНК імунологічно значущої антигенної детермінанти CD34, конструювання вектора експресії, одержання штаму-продуценту рекомбінантного антигену, розробка способу суперпродукції рекомбінантного антигену в бактеріях, розробка ефективного та дешевого способу виділення рекомбінантного антигену з бактеріальних клітин в очищеному і розчинному стані. Технології клонування ДНК дозволяють створювати рекомбінантні білки, які генетично злиті з послідовностями певних пептидів - афінних «міток», що значно спрощує виділення таких білків за допомогою методик очищення та фракціонування на колонках, відомих спеціалістам даної галузі. Однією з таких міток є послідовність олігогістидину, що дозволяє проводити очищення рекомбінантних білків методом металафінної хроматографії. Однак у низці випадків при експресії гетерологічних генів у клітинах Е. coli спостерігається агрегація синтезованих білків, що призводить до накопичення цільового білка у вигляді нерозчинних і неактивних цитоплазматичних агрегатів - тілець включення. Використання такого продуценту як джерела активного рекомбінантного білка створює певні складнощі, пов'язані з необхідністю застосовувати крім етапу очищення цільового білка, етап його виділення у функціональній і розчинній формі (ренатурація) для можливості подальшого практичного застосування. Методи ренатурації білків відомі і включають виділення бактеріальних тілець включення, їх солюбілізацію у розчинах, що містять хаотропні реагенти, і спосіб видалення зазначених реагентів для відновлення біологічно активної структури білкових молекул. У той же час, кожен індивідуальний білок потребує емпіричного пошуку адаптованих схем його одержання у розчинному, очищеному і функціональному стані. Ще однією проблемою одержання білків у такий спосіб є досягнення високого виходу розчинного і активного білка із фракції тілець включення а також технологічність схеми його одержання. У випадку складних білків, прикладом яких є антиген CD34, який містять декілька доменів і три дисульфідні містки, задача ренатурації ускладнюється також необхідністю відновлення нативної структури кожного домену та коректним паруванням SH-груп цистеїнових залишків. В основу пропонованої корисної моделі поставлено задачу розробити більш технологічний та ефективний спосіб одержання очищеного і розчинного рекомбінантного білка rExhCD34 з клітин штаму-продуценту Е. coli BL21hCD34, із збереженням притаманних нативному поверхневому маркеру CD34 антигенних детермінант. Поставлена задача вирішується пропонованим способом одержання очищеного і розчинного рекомбінантного білка rExhCD34, синтезованого штамом-продуцентом Е. coli BL21hCD34, що включає осадження бактеріальних клітин після завершення біосинтезу центрифугуванням, руйнування бактеріальних клітин і хромосомної ДНК у присутності лізоциму та ДНК-ази, осадження фракції тілець, включення центрифугуванням, проми 5 вання тілець включення розчинами, що містять неіонні детергенти шляхом суспендування осаду з наступним осадженням центрифугуванням, солюбілізацію тілець включення у присутності сечовини або гуанідин гідрохлориду, очищення солюбілізованого білка металафінною хроматографією на колонці у присутності сечовини або гуанідин гідрохлориду, ренатурацію білка на хроматографічній колонці шляхом контрольованого видалення сечовини або гуанідин гідрохлориду, елюції розчинного і очищеного рекомбінантного білка з хроматографічної колонки у нативних умовах. Авторами було показано, що при вищезазначених умовах культивування штаму-продуценту і суперсинтезі рекомбінантний білок rExhCD34 накопичується у фракції тілець включення. В даному аспекті пропонована корисна модель вирішує проблеми відомого рівня техніки і забезпечує спосіб виділення рекомбінантного білка rExhCD34 з бактеріальних клітин, за допомогою якого останній може бути одержаний в одну стадію із збереженням властивих нативному білку антигенних детермінант, з високим ступенем чистоти і у розчинній формі. Спосіб виділення рекомбінантного білка rExhCD34 з бактеріальних клітин буде легко оцінений спеціалістами даної галузі на основі опису і прикладів. Процес ренатурації і очищення автоматизується у разі використання хроматографічної системи, що програмується (Фіг. 1). Відповідно до пропозиції вихід розчинного білка rExhCD34 виділеного ренатурацією із тілець включення Е. соlі складав більше 85 %, відсоток мономерної форми rExhCD34, визначений розділенням очищеного ренатурованого білка в поліакриламідному гелі за відсутності 2-меркаптотанолу, складав більше 50. При внесенні 5 мкг і наступному розділені в 12 %му поліакриламідному гелі у присутності додецилсулфату натрію очищений і ренатурований білок виявлявся як дискретна полоса з молекулярною масою близько 30 кДа (Фіг. 2). Чистота розчинного продукту, розраховувалася методом денситометрії електрофореграм, складала більше 95 %, концентрація у пробі після ренатурації - 0,8-1,5 мг/мл. Ізоелектрична точка рекомбінантного білка РІ=6,06, коефіцієнт поглинання при 280 нм - 1. Ренатурований білок був стабільним і не агрегував у разі зберігання у розчині на +4°С протягом декількох місяців. Очищений білок rExhCD34, виділений ренатурацією з бактеріальних тілець включення, зберігав активні антигені детермінанти нативного поверхневого антигену CD34 людини, що проявляється у здатності рекомбінантного антигену індукувати при імунізації тварин вироблення специфічних поліклональних антитіл, що здатні розпізнавати нативний антиген на поверхні культури CD34+ клітин людини у разі використання стандартних імунохімічних методів аналізу. Суть корисної моделі пояснюється графічними матеріалами, де: на фіг. 1 - хроматограма ренатурації і очищення білка rExhCD34 із тілець включення на мета 44816 6 лафінному сорбенті. 1 - солюбілізований із тілець включення білок, який наносився на колонку. 2 білки, які не зв'язалися із сорбентом. 3 - очищений і розчинний білок, одержаний елюцією з колонки у присутності імідазолу. на фіг. 2 - електрофоретичний аналіз фракцій білків. 1 - солюбілізований із тілець включення білок, який наносився на металафінний сорбент. 2 - білки, які не зв'язалися із сорбентом. 3 - очищений і розчинний білок, одержаний елюцією з колонки у присутності імідазолу. 4 - маркери молекулярної маси білків. Приклад виділення рекомбінантного білка rExhCD34 в очищеному та розчинному стані. Для одержання очищеного і розчинного білка осад тілець включення суспендували в фосфатносольовому буфері ФСБ (0,14 М NaCl; 2,7 мМ КС1; 10 мМ Na2HPO4; 1,8 мМ КН2РО4, рН 7,4), який містив 8 М сечовину або 6 М гуанідин-гідрохлорид та 10 мМ 2-меркаптоетанол (1 мл буферу на 10 мг осаду тілець включення), фільтрували через 0,2 мкм мембранний фільтр і наносили на хроматографічну колонку з Ni-NTA сефарозою об'ємом 5-20 мл, що урівноважена тим самим буфером. Колонку промивали урівноважуючим буфером (5 об'ємів колонки) за допомогою перистальтичного насосу з наступною промивкою буфером ФСБ (10 об'ємів колонки). Очищений і ренатурований рекомбінантний білок одержували елюцією з колонки у присутності буферу ФСБ, який містив 0,3 М імідазол. На фіг. 1 представлено типову хроматограму процесу рефолдінгу та очищення білка rExhCD34 у разі використання автоматизованої хроматографічної системи типу FPLC. Моніторинг фракцій, що містять білок, проводили спектрофотометрично при 280 нм за допомогою UV-монітору. Одержані елюцією фракції білків аналізували електрофорезом. Електрофорез білків проводили за методом U. Laemmli (Westermeier R. Electrophoresis in practice: a guide to methods and applications of DNA and protein separations. - Weinheim: VCH, 1997. - P. 331), використовуючи для їхнього розділення 12-15 %-й поліакриламідний гель з 0,1 %-м додецилсульфату натрію. Кількість сумарного білка у різних фракціях клітин визначали методом М. Bradford (Дарбре А. Практическая химия белка: Пер. с англ. - М: Мир, 1989. - 623 с., с. 297-298). Чистоту та концентрацію rExhCD34 визначали за допомогою сканування і денситометрії електрофореграм використовуючи як стандарт БСА з відомою концентрацією для одержання калібрувальної кривої. На фіг. 2 показано чистоту різних фракцій білків, одержаних при проведенні процесу рефолдінгу та очищення білка rExhCD34 методом металафінної хроматографії. Кінцевий продукт - рекомбінантний білок, мав молекулярну масу 28,8 кДа, і був гомогенним при електрофорезі в ПААГ. При імунізації тварин білок rExhCD34 індукує вироблення поліклональних антитіл, які специфічно виявляють нативний антиген CD34 людини на поверхні клітин тестової культури KG1 у разі використання стандартних імунохімічних методик. 7 Комп’ютерна верстка Д. Шеверун 44816 8 Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of purified and soluble recombinant protein rexhcd34, synthesized by the producer strain е.coli bl21hcd34
Автори англійськоюKordium Vitalii Arnoldovych, Hilchyk Pavlo Volodymyrovych, Irodov Dmytro Mykhailovych, Fliak Andrii Ihorovych, Horbatiuk Oksana Borysivna, Nikolaiev Yulian Serhiiovych, Hilchuk Yuliia Mykolaivna
Назва патенту російськоюСпособ получения очищенного и растворимого рекомбинантного белка rexhcd34, синтезиванного штаммом-продуцентом е.coli bl21hcd34
Автори російськоюКордюм Виталий Арнольдович, Гильчук Павел Владимирович, Иродов Дмитрий Михайлович, Фляк Андрей Игоревич, Горбатюк Оксана Борисовна, Николаев Юлиан Сергеевич, Гильчук Юлия Николаевна
МПК / Мітки
МПК: C12N 15/00
Мітки: білка, розчинного, rexhcd34, спосіб, штамом-продуцентом, bl21hcd34, рекомбінантного, одержання, e.coli, синтезованого, очищеного
Код посилання
<a href="https://ua.patents.su/4-44816-sposib-oderzhannya-ochishhenogo-i-rozchinnogo-rekombinantnogo-bilka-rexhcd34-sintezovanogo-shtamom-producentom-ecoli-bl21hcd34.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання очищеного і розчинного рекомбінантного білка rexhcd34, синтезованого штамом-продуцентом е.coli bl21hcd34</a>
Попередній патент: Модифікований генно-інженерний рекомбінантний білок rexhcd34, продукований бактеріями e. coli
Наступний патент: Механізм приводу платформ
Випадковий патент: Спосіб проведення температурних досліджень об'єкта в термостаті