Сполука n-(n’-o-трифторметилфенілсукцинімідо-3)-n-фторанілін з потенційними біологічними властивостями
Номер патенту: 48767
Опубліковано: 25.03.2010
Автори: Драпайло Андрій Богданович, Вельчинська Олена Василівна, Губський Юрій Іванович, Вільчинська Валерія Валеріївна
Формула / Реферат
Сполука N-(N'-о-трифторметилфенілсукцинімідо-3)-n-фторанілін з потенційними біологічними властивостями загальної формули:
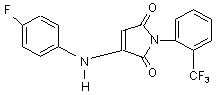 .
.
Текст
Сполука N-(N'-отрифторметилфенілсукцинімідо-3)-n-фторанілін з потенційними біологічними властивостями загальної формули: O F Корисна модель відноситься до хімії гетероциклічних сполук, а саме, до сполуки N-(N'-отрифторметилфенілсукцинімідо-3)-n-фторанілін (далі, сполука І) з потенційними біологічними властивостями та високою реакційною здатністю, які можуть проявлятися за рахунок наявності в будові молекули спряженої системи між ароматичними ядрами та фрагментом молекули циклічного іміду. Велика кількість похідних малеїнімідів на даний момент є відомими лікарськими засобами, що активно застосовуються в медицині завдяки їх високій фізіологічній активності [1, 2, 3]. Етосуксімід слугує препаратом першого ряду при малих та моноклонічних приступах епілепсії. Для усіх препаратів цієї групи характерні такі побічні прояви: порушення функції ШКТ (біль, розлади травлення), ЦНС (у вигляді дискенизії), алергічні реакції з еозинофілією та іншими порушеннями крові, а також червона вовчанка. Препарати цієї групи пригнічують моторні центри кори великого мозку і підвищують судомний поріг. Впливу на концентрацію ГАМК в мозку вони в терапевтичних дозах не мають [3]. Іміди бурштинової кислоти (2,5-піролідиндіони) здатні відновлювати обмінні процеси в центрах кори головного мозку і особливо в підкоркових ядрах, нормалізувати їх функції. Необхідно зазначити, що сумісне використання цих двох препаратів призводить до збільшення рівня сукцимідів у крові. Останнім часом окрім антиконвульсивної дії у імідів ненасичених карбонових кислот було ви явлено психотропну активність (слабкий стимулюючий ефект), α-заміщенні амінокротонові ефіри характеризуються слабким ефектом типу антидепресантів. Армянські вчені для сполук загального вигляду, (схема 1): H3C2OOC O O H3C N N O CF3 H U (13) 48767 , Схема 1. виявили стійкий антидепресантний ефект [4]. Описано [5], що N-алкілмалеїніміди можуть виконувати роль інгібіторів нітрифікації амонійних сполук із сечі, а N-етилмалеїніміди мають потенційну здатність контролювати процес розвитку зубного карієсу [6]. N(арилалкіл)-малеїніміди були отримані в реакції малеїнового ангідриду і N(арилалкіл)-амінів. Була досліджена їх антимікробна активність. N(арилалкіл)-малеїніміди проявляли антибактеріальну активність по відношенню до грампозитивних бактерій таких як: Bacillus subtilis і Staphylococcus aureus. Майже всі виявляли антибактеріальну активність до грамнегативних бактерій таких як: Escherichia coli, але були неактивні до Pseudomonas acriginosa. Всі N-(арилалкіл)-малеїніміди проявляли активність на дріжджях та міцелійних гри (11) R O UA N (19) R1 NH . 3 48767 бах [7]. Антиалергічна дія та імунотерапевтична активність описана для похідних малеїнімідів біс(індоліл)малеїнімідів, (схема 2) [8, 9]: R4 O N O R3 R5 R6 N R2 На відмінність від імідів насичених дикарбонових кислот іміди ненасичених дикарбонових кислот мають у складі молекули активований двома карбонільними групами подвійний зв'язок, який здатен при певних умовах приєднувати нуклеофільні реагенти з утворенням похідних сукциніміду. В результаті спряження карбонільних груп з гетероатомом азоту електрофільна активність карбонільних груп малеїніміду знижена і саме на атомах вуглецю етиленового зв'язку знаходиться значний за величиною позитивний заряд, (схема 5): + + R1 , Схема 2. Антимікробна активність знайдена у N(діалкілфеніл)-малеїнімідів та N-(аріл/алкіл)малеїнімідів [7, 10]. Авторами роботи [11] описана фізіологічна дія похідних малеїнімідів - 1,3-діоксо4-фешлпіроло-(3,4-е)карбазолів загальної формули, (схема 3): H N O O R O N O O W COOH N 2 O W COOH Схема 4. Раніше нами були отримані інші нові гетероциклічні похідні сукцинімідів з потенційними фізіологічними властивостями шляхом нуклеофільного приєднання по подвійному зв'язку молекули вихідного малеїніміду [14, 15]. Структурні аналоги вищевказаного продукту реакції між N-o-трифторметилфеніл-малеїнімідом та n-фтораніліном з потенційними фізіологічними властивостями насьогодні не відомі (літературний опис відсутній). Сполука І синтезована з метою отримання нового поліфункціонального циклічного синтону для подальшого вивчення її фізико-хімічних та біологічних властивостей, а також вивчення можливості проходження хімічних реакцій між ароматичними сполуками з та N-заміщеними малеїнімідами. В основу корисної моделі поставлено хімічну будову молекули сполуки N-(N'-oтрифторметилфенілсукцинімідо-3)-n-фторанілін (далі, сполука І) з потенційними біологічними властивостями шляхом взаємодії N-oтрифторметилфенілмалеїніміду та n-фтораніліну у молярному співвідношенні 1:1. O R , Схема 5. Типовим прикладом нуклеофільного приєднання по подвійному зв'язку є взаємодія Nзаміщеного малеїніміду з n-фтораніліном. Реакції проводилися у системі розчинників (бензол-піридин) при температурі 60-80 °С та перемішуванні реакційної суміші 3 години з обробкою продукту реакції розчином етилового спирту у воді (1:1) та безводним бензолом, фільтруванням, сушкою у вакуумі водострумного насосу, (схема 6). NH2 , Схема 3. як кардіоваскулярних агентів. Крім того, деякі з них потенціюють інгібіторів протеїнкінази. В роботах [12, 13] представлено нові похідні малеїнімідів, які мають противиразкову та антиішемічну активність, (схема 4): S N O N H [sod] 4 + F N O O F O PhCF3(o-) to, C6H6 Py N N PhCF3(o-) O H I Схема 6. Позитивними рисами описаного методу синтезу є легкість його проведення та простота обробки кінцевого продукту. Варіювання умов проведення реакцій та внесення змін до методики синтезу, а саме: обробка продукту реакції розчином етилового спирту у воді (1:1) та безводним бензолом, дозволили збільшити практичний вихід сполуки І до 56 %. УФ-спектр сполуки І характеризується наявністю λmax при 245 нм. В той час, як УФ-спектр стандартної речовини (сукциніміду) відрізняється наявністю інтенсивної смуги при 207 нм і малоінтенсивної смуги при 243 нм (за рахунок спряження груп С=О, ρ-електронів гетероатому азоту). -1 В ІЧ-спектрі сполуки І в області 600-900 см спостерігаються інтенсивні смуги непласких деформаційних коливань С-Н ароматичних кілець, в той час як валентні коливання С-С зв'язків бензольних -1 -1 ядер при 1585-1600 см та 1400-1500 см ідентифікувати неможливо, так як дані області спектру близькі до коливань зв'язку С=С, >N-H групи. В ІЧспектрі стандартної речовини (сукцинімід) деформаційні коливання С–Н ароматичного кільця в об-1 ласті 600-900 см відсутні. В ІЧ-спектрі сполуки І смуги δN-H спостерігаються в області 1456, 1475 -1 см , а смуги vCF при бензольному кільці - в області -1 730-1400 см . Валентні коливання карбонільних груп С=О сполуки І проявляються високоінтенсив-1 ним максимумом в області 1680-1750 см (дві смуги) і є найбільш характеристичними, так як інші смуги в даній області практично відсутні. 5 48767 I ЯМР Н спектр сполуки І має сигнали у вигляді дублетів дублетів при 7,24-7,69 м.д., що відповідає протонам ароматичних кілець, сигнал у вигляді дублету при 2,86-2,94 м.д., що відповідає двом протонам молекули сукциніміду в четвертому положенні, сигнал у вигляді триплету при 3,38-4,13 м.д., який відповідає протону молекули сукциніміду в третьому положенні. Таким чином, можна зробити висновок, що сполука І з потенційними біологічними властивостями може бути перспективною у розробці нових лікарських засобів з проти-судомною активністю, з анксіолітичним типом дії; що впливають на постсинаптичні рецептори, психотропних агентів та з іншими типами дії. Ознаки способу. Методика синтезу сполуки N(N'-о-трифторметилфенілсукцинімідо-3)-пфторанілін (І)До розчину 0,57 г (0,0024 моль) Nортотрифторметилфенілмалеїніміду в 10 мл бензолу безводного додають 0,26 г (0,0024 моль) парафтораніліну в 10 мл піридину безводного, витримують реакційну суміш при температурі 60-80 °С та перемішуванні 3 години. Осад, що утворився, відфільтровують, промивають розчином етилового спирту у воді (1:1), безводним бензолом, фільтрують, сушать у вакуумі водострумного насосу. Залишок - осад кремового забарвлення промивають під час фільтрування в вакуумі сухим гексаном, сушать на повітрі. Практичний вихід 0,46 г (56 %). Ттопл. 167-170 °С. Індивідуальність сполуки І контролювали методом тонкошарової хроматографії, склад підтверджували даними елементного аналізу. ТШХ виконували на пластинах Silufol-254. ГРХ проводили на газорідинному хроматографі "Perkin Е1тег"з УФдетектором (виробник "Perkin", Germany). УФ-спектр сполуки І записували на спектрофотометрі Mel Temp II (USA). ІЧ-спектр записували на спектрофотометрі UR-20 (виробник "Charles Ceise Hena", Germany). 6 ! Спектри ЯМР Н сполуки І записували на приладах "Bruker WP-200" (виробник "Bruker", Switzerland) або "Varian Т-60" (виробник "Varian", USA) з робочою частотою 200-132 МГц у виді розчину ДМСО-Бб (внутрішній стандарт ГМДС). I Хроматограма, УФ, 14, ЯМР Н спектри сполуки І ідентифікували у порівнянні з хроматограмами, I УФ, 14, ЯМР Н спектрами вихідних сполук. Синтезована сполука І - це кристалічний порошок кремового забарвлення. Дані елементного аналізу на С, Н, N сполуки І відповідають обчисленим значенням. В УФ-спектрі сполуки І ідентифіковано значення λmax при 245 нм. В ІЧ-спектрі сполуки І смуги непласких деформаційних коливань С-Н ароматичних кілець спо-1 стерігаються в області 600-900 см , в той час як валентні коливання С-С зв'язків бензольних ядер -1 -1 при1585-1600 см та 1 400-1500 см ідентифікувати неможливо, так як дані області спектру близькі до коливань зв'язку С=С, >N-H групи. В ІЧспектрі сполуки І ідентифіковано смуги δN-H в об-1 ласті 1456, 1475 см , смуги vCF при бензольному -1 кільці - в області 730-1400 см . Валентні коливання карбонільних груп С=О сполуки І ідентифіковано як високоінтенсивний максимум в області 1680-1 1750 см (дві смуги) і є найбільш характеристичними, так як інші смуги в даній області практично відсутні. Співвідношення інтегральних інтенсивностей I сигналів в ЯМР Н спектрі сполуки І підтверджує наявність протонів ароматичних кілець у вигляді дублетів дублетів при 7,24-7,69 м.д., двох протонів молекули сукциніміду в четвертому положенні та протону молекули сукциніміду в третьому положенні у вигляді дублету при 2,86-2,94 м.д. та триплету при 3,38-4,13 м.д. відповідно. Віднесення I сигналів в 14 та ЯМР Н спектрах сполуки І наведено в таблиці 1. Таблиця 1 I Віднесення сигналів в 14, ЯМР Н спектрах, дані елементного аналізу сполуки І. Знайдено, у % С Н 57,93; 3,41; N 7,88 Брутто-формула C17H12N2O2F4 Обчислено, у % С Н 57,96; 3,43; N 7,95 ІЧ-спектр -1 (КВr),см ,γ I СпектрЯМР Н (ДМСОD6),∂, м.д. (J, Гц) 600-900 2,86-2,94 (д., Suc, (С-Н, Ph); 2Н (4 position)); 730-1400 3,38-4,13 (т., Suc, (C-F); 1Н (3 position)); 1456, 1475 7,24-7,69 (д.д., д.д., (N-H); 2 Ph, 8H). 1680-1750 (С=О). 7 48767 Таким чином, можна зробити висновок, що сполука І з потенційними біологічними властивостями за рахунок наявності в молекулі фармакофорних угрупувань може бути перспективною у створенні нових лікарських засобів. На основі літературних даних, шляхом порівняння хімічної будови сполуки І із сполуками описаними в літературі, можна передбачити, що наявність в її молекули ароматичних фрагментів та сукциніміду одночасно можуть наділити її анксіолітичними властивостями. Завданням винаходу є опис хімічної будови нової сполуки І з потенційними біологічними властивостями та високою реакційною здатністю, які можуть проявлятися за рахунок наявності в будові молекули спряженої системи між ароматичними ядрами та фрагментом молекули циклічного іміду. ЛІТЕРАТУРА. 1. Фармакотерапия эпилепсии у детей и клиническая фармакология противоэпилептических средств. - Л. - 1988. - 20с. 2. Эди М.Ж., Тайрер Дж.Х. Противосудорожная терапия. - М.: Медицина, 1983. - С. 143-163. 3. Машковський Д.С. Засоби, які впливають на центральну нервову систему. - К.: Наукова думка, 1991. - С.43-44. 4. Лулукян К.К., Агбалян С.Г. //Армянский химический журнал. - 1981. - т. 34, № 3. - С. 232-235. 5. Shimizu Toshio, Tech. Res. Lob., Asahi Chem. Ynd., Co., Ltd, Fuji, Japan 416. Soil Sci. Plant Nutr. (Токіо), 1986, 32(2). //Chem. Abstr. - 1986. - Vol. 105, 132862d, P. 585-592. 6. Nakamuza Y., (Sch. Dent., Nippon Dent. Univ., Nirgata , Japan, 951) Shigaku 1986, 74(4), 751-62 (Japan) //Chem. Abstr. - 1987. - Vol. 106. – 67 p. Комп’ютерна верстка Д. Шеверун 8 7. Watanabe S., Igarashi Y., Yagami K. //Chem. Abstr. - 1992. - Vol. 116, 190904 g. 8. Schultz, Michael, Tsaklakidis, Christos and all. Ger. Offen. De 4,005,970 (C1.C07D403/04), 29 Aug. 1991. //Chem. Abstr. -1991. - Vol. 115. - P. 848. 9. Tsaklakidis Christos, Schultz Michael and all. Ger.Offen. De 4,005,969 (C1.C07D403/14), 29 Aug. 1991. //Chem. Abstr. -1991. - Vol. 115. - P. 931. 10. Watanabe S., Jgarashi Y. and all. (Fac. Eng., Chiba Unir., Chiba, Japan, 260) Ynt. Y. Mater. Prod. Technol. 1990, 5(4), 387-91 (Eng) //Chem. Abstr. 1991. - Vol. 115, 45931 р. 11. Kleinschorth Y., Hartenstein Y. and all. U.S. US4,912,107 (Cl.514-232,5; A61k31/40); 27. Mar. 1990, DE Appl. 3,833,008, 29. Sep. 1988. //Chem. Abstr. - 1990. - Vol. 113, 191154 n. 12. Jnove Massayasu, Jwao Ebashi, Tetsuo Tkigawo Eur. Pat. Appl. Ep 507,348 - (C1.C12N9/02), 07.Oct.1992, Jp. Appl. 91/102,023,05. Apr. 1991.//Chem. Abstr. - 1993. - Vol. 118, 55129 j. 13. Ebata Y., Takigawa T. and all. (Kuraruy Co., Ltd) Jpn. Kokai Tokkyo Koho JP 04,308,567 [92,308,567] (C1.C07D207/452), 30. Oct. 1992. //Chem. Abstr. - 1993. - Vol. 118, 254741 c. 14. Ошовский Г.В., Толмачев Ф.Ф., Меркулов A.C., Пинчук A.M. Тиадиазолилфосфины с азотсодержащими заместителями. //ХГС - 1997. - № 10, С. 1422 - 1424. 15. Вельчинська О.В., Кузьменко І.Й., Драпайло А.Б. Синтез нових похідних заміщених малеїнімідів як потенційних фізіологічно активних агентів. Тези. доп. XVIII-ої Укр.конф.з орг.хімії. 1998. Дніпропетровськ, с. 369. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCompound n-(n'-o-trifluoromethylphenylsuccinimido-3)-n-fluoroaniline with potential biological properties
Автори англійськоюHubskyi Yurii Ivanovych, Velchynska Olena Vasylivna, Drapailo Andrii Bohdanovych, Vilchynska Valeria Valeriivna
Назва патенту російськоюСоединение n-(n'-о-трифторметилфенилсукцинимидо-3)-n-фторанилин с потенциальными биологическими свойствами
Автори російськоюГубский Юрий Иванович, Вельчинская Елена Васильевна, Драпайло Андрей Богданович, Вильчинская Валерия Валериевна
МПК / Мітки
МПК: C07C 21/00, A61K 33/16, C07D 239/553
Мітки: n-(n'-o-трифторметилфенілсукцинімідо-3)-n-фторанілін, потенційними, біологічними, сполука, властивостями
Код посилання
<a href="https://ua.patents.su/4-48767-spoluka-n-n-o-triftormetilfenilsukcinimido-3-n-ftoranilin-z-potencijjnimi-biologichnimi-vlastivostyami.html" target="_blank" rel="follow" title="База патентів України">Сполука n-(n’-o-трифторметилфенілсукцинімідо-3)-n-фторанілін з потенційними біологічними властивостями</a>
Попередній патент: Спосіб прогнозування виживаності хворих на серозний рак яєчника за допомогою маркера проліферації кі-67
Наступний патент: Сполука n-(n’-o-трифторметилфенілсукцинімідо-3)-n-фторанілін, яка має потенційну фізіологічну активність
Випадковий патент: Датчик для вимірювання температури і магнітного поля








