Спосіб одержання 1-заміщених 5-арилтіо-6-фенілпіперидин-2-онів
Номер патенту: 56404
Опубліковано: 10.01.2011
Автори: Вовк Михайло Володимирович, Васькевич Алла Іржіївна, Цизорик Назар Михайлович, Станінець Василь Іванович
Формула / Реферат
Спосіб одержання 1-заміщених 5-арилтіо-6-фенілпіперидин-2-онів загальної формули :
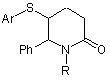 ,
,
де ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
,
який відрізняється тим, що аміди цинамілоцтових кислот піддають взаємодії з арилсульфенілхлоридами в оцтовій кислоті при кімнатній температурі в присутності перхлорату літію з подальшим виділенням цільових продуктів звичайними методами.
Текст
Спосіб одержання 1-заміщених 5-арилтіо-6фенілпіперидин-2-онів загальної формули: 3 56404 дійними (6-7 стадій), передбачають використання важкодоступних вихідних сполук (етил глутарилхлорид [1], N-[(1-феніл-2-ацилокси)етил]глутарамід [2], 3-метил-3-фенілсульфанілбутан-2-он [3]) дорогих металоорганічних основ (ізо-Pr2NLi, втop-BuLi) та відновників (LiBHEt3, NaBH4, LiAІH4), а також у деяких випадках [2] високотоксичного метилмеркаптану. Деякі стадії характеризуються препаративною складністю, оскільки здійснюються при низьких температурах. При цьому очистка як проміжних, так і цільових продуктів, як правило, проводиться за допомогою колонкової хроматографії, що значно обмежує їх препаративні масштаби. Задачею корисної моделі є спосіб отримання нових 5-арилтіопіперидин-2-онів загальної формули: NHR Ph + ArSCl 4 S Ar Ph N O R де R н Bu,PhCH2,Ph, 4MeOC6H4; Ar Ph, 4MeC6H4, 4C6H4NO2. Спосіб одержання сполук, які заявляються, полягає в тому, що препаративно доступні аміди цинамілоцтових кислот [4, 5] піддають взаємодії з арилсульфенілхлоридами в оцтовій кислоті при кімнатній температурі в присутності перхлорату літію. Цільові продукти виділяють стандартними методами. їх виходи сягають 61-97%. LiCIO4 Ar S Ph O N O R де R н Bu,PhCH2 ,Ph, 4MeOC6H4 ; Ar Ph, 4MeC6H4 , 4C6H4NO 2 . Запропонований синтетичний варіант є втіленням принципу внутрішньомолекулярної електрофільної циклізації похідних -алкенілкарбонових кислот і відкриває ефективний шлях до сполук, які можуть знайти практичне застосування як потенційні фармацевтичні препарати, а також, завдяки наявності в піперидиновому циклі схильної до відновлення карбонільної групи та схильної до окиснення арилсульфанільної групи, як базові сполуки для одержання нових аналогів біоактивних алкалоїдів піперидинового ряду. Отриманий результат не був заздалегідь передбачуваним, оскільки, понижена електрофільність арилсульфенілхлоридів не виключала можливості утворення продуктів їх адитивного приєднання до С=С зв'язку. Враховуючи амбідентний характер амідної групи та закономірності електрофільної циклізації амідів ненасичених карбонових кислот [6] вірогідними видавались процеси, які б також могли приводити до продуктів лактамної або -лактонової структури. Ph ArS N R O , ArS O O Ph Насправді ж знайдена реакція характеризується високою регіо- та стереоселективністю, причому цільові 5-арилтіопіперидин-2-они утворюються з високими виходами і виключно у вигляді одного діастереомера. Такий результат спричинений використанням перхлорату літію в ролі «допінг-добавки» [7, 8], сольовий ефект якої контролює продуктовизначальну стадію процесу. Будова та склад всіх отриманих сполук доведені даними елементного аналізу, ІЧ-спектрів, спектрів ЯМР 1Н та 13С, хроматомаспектрів, а на прикладі 1,6-дифеніл-5-(4-толілтіо)піперидин-2-ону рентгеноструктурним дослідженням. Корисна модель ілюструється загальним методом одержання 1-заміщених-5-арилтіо-6фенілпіперидин-2-онів та фізико-хімічними характеристиками всіх синтезованих сполук. Структура 1,6-дифеніл-5-(4-метилфенілтіо)-піперидин-2-ону також однозначно встановлена методом рентгеноструктурного аналізу. 5 Загальний спосіб одержання 1-заміщених 5арилтіо-6-феніл-піперидин-2-онів. До розчину 2.2ммоль відповідного аміду цинамілоцтової кислоти в 10мл оцтової кислоти додавали розчин 0.23г (2.2ммоль) перхлорату літію в 5мл оцтової кислоти, а потім при перемішуванні по краплях розчин 2.2ммоль арилсульфенілхлориду в 3мл оцтової кислоти. Реакційну суміш перемішували при кімнатній температурі 4год. розчинник відганяли у вакуумі водоструминного насосу, залишок обробляли 20мл води, органічну фазу екстрагували хлороформом (2×20мл), екстракт сушили над безводним сульфатом магнію, фільтрували і упарювали. Твердий залишок кристалізували із етанолу. Приклад 1 1-Бутил-6-феніл-5-фенілтіопіперидин-2-он. Вихід 96%, т.топл. 54°С. ІЧ спектр, см-1: 1650, 1470, 1355. Спектр ЯМР 1Н, , м.ч.: 0.81 т (3Н, СН3), 1.12-1.41м (4Н, 2СН2), 1.59-1.72м (1Н, СН), 1.86-2.01м (1Н, СН), 2.18-2.30м (1Н, СН), 2.372.56м (2Н, СН2), 3.79-3.83м (1Н, СН, J 4.2Гц), 3.853.90м (1Н, СН), 4.61 д (1Н, СН, J 3.3Гц), 7.18 д (2HAr, J 6.9Гц), 7.31-7.45м (6НАг), 7.54 д (2НAr, J 7.5Гц). Спектр ЯМР 13С, , м.ч.: 13.39 (СН3), 19.42 (СН2), 20.59 (СН2), 27.77 (СН2), 28.80 (СН2), 44.72 (СН2), 47.92 (С5), 63.41 (С6), 126.41, 127.21, 127.61, 128.57, 129.18, 131.37, 133.49, 140.04 (СAr,), 167.84 (С2).3найдено, %: С 74.28; Н 7.51; N 4.29; S 9.42. + М 340. C21H25NOS. Вирахувано, %: С 74.45; Н 7.42; N 4.13; S 9.30. М 339.5. Приклад 2 1-Бутил-5-(4-метилфенілтіо)-6фенілпіперидин-2-он. Вихід 97%, т.топл. 63 °С. ІЧ спектр, см-1: 1650, 1470. Спектр ЯМР 1Н, , м.ч.: 0.81 т (3Н, СН3, J 7.8Гц), 1.10-1.47м (4Н, 2СН2), 56404 6 1.54-1.66м (1Н, СН), 1.82-1.96м (1Н, СН), 2.172.25м (1Н, СН), 2.32 с (3Н, СН3), 2.40-2.55м (2Н, СН2), 3.73-3.75м (1Н, СН), 3.80-3.90м (1Н, СН), 4.57 д (1Н, СН, J 3.1Гц), 7.15 д (2HAr, J 7.5Гц), 7.23 д (2НAr, J 7.8Гц), 7.32-7.46м (5НAr). Спектр ЯМР 13 С, , м.ч.: 13.60 (СН3), 19.45 (СН2), 20.54 (СН3), 20.55 (СН2), 27.77 (СН2), 28.82 (СН2), 44.74 (СН2), 48.39 (С5), 63.44 (С6), 126.50, 127.60, 128.69, 129.73, 129.85, 131.97, 137.14, 140.14 (Саг), 167.91 (С2). Знайдено, %: С 74.53; Н 7.59; N 3.84; S 8. 93. М+ 354. C22H27NOS. Вирахувано, %: С 74.75; Н 7.70; N 3.96; S 9.07. М 353.5. Приклад 3 1-(Бензилфеніл)-5-(4-метилфенілтіо)-6фенілпіперидин-2-он. Вихід 81%, т.топл. 104°С. ІЧ спектр, см-1: 1660, 1410, 1330, 1250, 1165 Спектр ЯМР 1Н, , м.ч.: 1.60-1.73м (1Н, СН), 2.01-2.09м (1Н, СН), 2.27 с (3С, СН3), 2.55-2.61м (2Н, СН2), 3.25 д (1H, СН, J 9Гц), 3.55-3.63м (1Н, СН), 4.40 д (1Н, СН, J 3.1Гц), 5.38 д (1H, СН, J 9Гц), 7.06-7.19м (8НAr), 7.29-7.42м (6НАr). Спектр ЯМР 13С, , м.ч.: 20.54 (СН3), 20.63 (СН2), 27.86 (СН2), 47.38 (СН2), 49.08 (С5), 62.88 (СН3), 126.42, 127.05, 127.76, 127.89, 128.25, 128.80, 129.21, 129.76, 132.62, 136.88, 137.30, 139.63 (СAr), 168.39 (С2). Знайдено, %: С 77.69; Н 6.34; N 3.27; S 8.46. М+ 387. C25H25NOS. Вирахувано, %: С 77.49; Н 6.50; N 3.61; S 8.28. М 387.5. Приклад 4 1-(Бензилфеніл)-6-феніл-5(фенілтіо)піперидин-2-он. Вихід 80%, т.топл. 68°С. ІЧ спектр, см-1: 1645, 1450, 1410, 1350, 1330, 1245, 1170. Спектр ЯМР 1Н, , м.ч.: 1.65-1.78м (1Н, СН), 1.96-2.13м (1H, СН), 2.44-2.61м (2Н, СН2), 3.24 д (1Н, СН, J 10Гц), 3.66-3.75м (1Н, СН), 4.40 д (1Н, СН, J 3Гц), 5.35 д (1Н, СН, J 9Гц), 7.07 д (2HAr, J 7 9Гц), 7.25-7.44м (11НАr). Спектр ЯМР 13С, , м.ч.: 20.67 (СН2), 27.89 (СН2), 47.40 (СН2), 48.46 (С5), 63.30 (СН3), 126.52, 127.05, 127.52, 127.84, 12791, 128.32, 128.82, 129.16, 132.02, 132.94, 136.85, 2 139.55 (СAr), 168.41 (С ). Знайдено, %: С 77.39; Н + 5.96; N 3.91; S 8.81. М 374. C24H23NOS. Вирахувано, %: С 77.17; Н 6.21; N 3.75; S 8.58. М 373.5. Приклад 5 1,6-Дифеніл-5-фенілтіопіперидин-2-он. Вихід 61%, т.топл. 100°С. ІЧ спектр, см-1: 1660, 1400, 1335, 1280, 1155. Спектр ЯМР 1Н, , м.ч.: 1.761.93м (1Н, СН), 2.04-2.20м (1H, СН), 2.56-2.75м (2Н, СН2), 3.90-3.98м (1Н, СН), 4.92 д (1Н, СН, J 3Гц), 7.06 д (2НAr, J 7.2Гц), 7.14-7.41м (11НAr), 7.60 д (2НAr, J 6Гц). Спектр ЯМР 13С, , м.ч.: 21.16 (СН2), 28.43 (СН2), 48.38 (С5), 67.78 (С6), 126.42, 126.85, 127.27, 127.42, 127.66, 128.53, 128.57, 129.35, 131.45, 133.36, 139.66, 142.52 (СAr), 168.37 (С2).3найдено, %: С 76.83; Н 5.88; N 4.06; S 9.07. М+ 360. C23H21NOS. Вирахувано, %: С 76.67; Н 5.97; N 3.90; S 8.92. М 359.5. Приклад 6 1,6-Дифеніл-5-(4-метилфенілтіо)піперидин-2он. Вихід 71%, т.топл. 135°С. ІЧ спектр, см-1: 1655, 1495, 1405, 1335. Спектр ЯМР 1Н, , м.ч.: 1.741.87м (1Н, СН), 2.04-2.14м (1Н, СН), 2.31 с (3Н, СН3), 2.57-2.67м (2Н, СН2), 3.80-3.87м (1H, СН), 4.89 д (1Н, СН, J 3.3Гц), 7.06 д (2HAr, J 7.5Гц), 7.147.38м (10НAr), 7.49 д (2НAr, J 7.8Гц). Спектр ЯМР 13 С, , м.ч.: 20.49 (СН3), 21.07 (СН2), 28.39 (СН2), 48.84 (С5), 67.62 (С6), 126.37, 126.84, 127.26, 127.58, 128.48, 128.57, 129.57, 129.95, 132.08, 137.27, 139.74, 142.54 (CAr), 168.35 (С2).3найдено, %: С 77.36; Н 6.03; N 3.73; S 8.56. М+ 374. C24H23NOS. Вирахувано, %: С 77.18; Н 6.21; N 3.60; S 8.71. М 373.5. Приклад 7 1,6-Дифеніл-5-(4-нітрофенілтіо)піперидин-2он. Вихід 74%, т.топл. 203°С. ІЧ спектр, см-1: 1655, 1500, 1400, 1335. Спектр ЯМР 1Н, , м.ч.: 1.932.05м (1Н, СН), 2.14-2.30м (1Н, СН), 2.58-2.60м (2Н, СН2), 4.26-4.33м (1Н, СН), 5.08 д (1Н, СН, J 3.6Гц), 7.07-7.43м (10НAr), 7.75 д (2HAr, J 9Гц), 8.20 д (2HAr, J 8.7Гц). Спектр ЯМР 13С, , м.ч.: 21.59 (СН2), 28.60 (СН2), 46.67 (С5), 67.78 (С6), 123.96, 126.37, 127.09, 127.26, 127.78, 128.49, 128.57, 128.74, 139.19, 142.24, 144.31, 145.24 (СAr), 168.16 (С2). Знайдено, %: С 68.52; Н 4.97; N 7.14; S 7.91. М+ 405. C23H20N2O3S. Вирахувано, %: С 68.30; Н 4.81; N 6.93; S 7.74. М 404.5. Приклад 8 1-(4-Метоксифеніл)-5-фенілтіо-6фенілпіперидин-2-он. Вихід 92%, т.топл. 114°С. ІЧ спектр, см-1: 1665, 1520, 1450, 1400, 1280, 1240. Спектр ЯМР 1Н, , м.ч.: 1.76-1.92м (1H, СН), 2.042.21м (1Н, СН), 2.56-2.73м (2Н, СН2), 3.674 с (3Н, СН3), 3.89-3.95м (1Н, СН), 4.85 д (1Н, СН, J 2.1Гц), 6.80 д (2НAr, J 9Гц), 6.96 д (2НAr, J 8.7Гц), 7.247.45м (8НAr), 7.59 д (2HAr, J 7.8Гц). Знайдено, %: С Комп’ютерна верстка О. Рябко 56404 8 73.99; Н 5.94; N 3.46; S 8.04. М+ 390. C24H23NO2S. Вирахувано, %: С 74.15; Н 5.68; N 3.60; S 8.23. М 389.5. Приклад 9 1-(4-Метоксифеніл)-5-(4-метилфенілтіо)-6фенілпіперидин-2-он. Вихід 89%, т.топл. 122123°С. ІЧ спектр, см-1: 1655, 1610, 1515, 1460, 1405, 1335, 1245, 1165. Спектр ЯМР 1Н, , м.ч.: 1.71-1.85м (1H, СН), 2.31 с (3Н, СН3), 2.54-2.63м (2Н, СН2), 3.66 с (3Н, СН3), 3.79-3.83м (1Н, СН), 4.82 д (1Н, СН, J 3Гц), 6.80 д (2НAr, J 9.3Гц), 6.96 д (2HAr, J 8.7Гц), 7.22-7.38м (7НАr), 7.49 д (2HAr, J 8.4 Гц). Спектр ЯМР 13С, , м.ч.: 20.52 (СН3), 21.04 (СН2), 28.36 (СН2), 48.74 (С5), 54.84 (СН3), 67.94 (С6), 113.66, 126.87, 127.62, 128.41, 128.51, 129.64, 130.00, 132.08, 135.29, 137.27, 139.86, 157.41 (САr), 168.44 (С2). Знайдено, %: С 74.27, Н 6.51, N 3.68; S 7.93. М+ 404. C25H25NO2S. Вирахувано, %: С 74.41; Н 6.24; N 3.47; S 8.15. М 403.5. Джерела інформації: 1. Pat. ЕР 1447401А1. 18. August. Takahashi К., Yamamoto S., Naka M. Piperidine-2-one derivatives compounds and drugs containing these compound as the active ingredient / Ono Pharmaceutical Co., Ltd. 2. Rodrigues R., Estiarte M.A., Diez A., Rubiralta M., Colell A., Garsia-Ruiz C, Fernander-Checa J.C. Conformationally restricted analogues of Methionine: synthesis of chiral 3-amino-5-methylthio-2piperidones // Tetrahedron. - 1996. - Vol.52, №22. P.7727-7736. 3. Fox D.J., Morley T.J., Taylor S., Warren S. Selective five- and six-membered cyclic amine syntheses via carpute of episulfonium ions // Org. Biomol. Chem. - 2005. - Vol.3. - P.1369-1371. 4. Frederick L.D., Reddy G.D., Scneider S., Gahr. Photophysical and photochemical behavior of intramolecular styree-amine exiplexes // J. Amer. Chem. Soc. - 1991. - Vol.113, №9. - P.3498-3506. 5. Brendon M., Tsanaktsidis J. Cyclization of Nbutyl-4-pentenylaminyl: implication for the cyclization of alkenylaminyl radicals // J. Amer. Chem. Soc. 1996. - Vol.118, №18. - P.4276-4283. 6. Robin S., Rousseau G. Electrophilic cyclization of unsatureted amides // Tetrahedron. - 1998. Vol.54. - №13681-13736. 7. Зефиров Н.С., Смит В.А., Бодриков И.В., Кример М.З. Механизм присоединения сульфенилгалогенидов к олефинам и свойства стабильных ионов эписульфония. Роль ковалентных интермедиатов и ионных пар для разных условий проведения реакций // ДАН СССР. - 1978. - Т.240, №4. С.858-861. 8. Кример М.З., Смит В.А., Шамшурин А.А. Двустадийная схема присоединения серосодержащих электрофилов. Реакция метилсульфенилборфторида с циклогексеном // ДАН СССР. - 1973. - Т.208, №4. - С.864-867. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for the preparation of 1-substituted 5-arylthio-6-phenylpiperidin-2-ones
Автори англійськоюVovk Mykhailo Volodymyrovych, Vaskevych Alla Irzhiivna, Tsyzoryk Nazar Mykhailovych, Stanynets Vasyl Ivanovych
Назва патенту російськоюСпособ получения 1-замещенных 5-арилтио-6-фенилпиперидин-2-онов
Автори російськоюВовк Михаил Владимирович, Васькевич Алла Иржиивна, Цизорик Назар Михайлович, Станинец Василий Иванович
МПК / Мітки
МПК: C07D 211/00
Мітки: 1-заміщених, одержання, 5-арилтіо-6-фенілпіперидин-2-онів, спосіб
Код посилання
<a href="https://ua.patents.su/4-56404-sposib-oderzhannya-1-zamishhenikh-5-ariltio-6-fenilpiperidin-2-oniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 1-заміщених 5-арилтіо-6-фенілпіперидин-2-онів</a>
Попередній патент: Спосіб лікування гастроезофагеальної рефлюксної хвороби з супутньою залізодефіцитною анемією в осіб молодого віку
Наступний патент: Тренажер забєліна
Випадковий патент: Спосіб профілактики та лікування радіаційних уражень організму








