7′-заміщені-1-(4-хлорофеніл)-3′,7′-дигідро-2н,2’н,5н-спіро[піролідин-3,6′-тіопірано[2,3-d][1,3]тіазол]-2,2′,5-тріони, що виявляють антитрипаносомну активність
Номер патенту: 62458
Опубліковано: 25.08.2011
Автори: Зіменковський Борис Семенович, Лесик Роман Богданович, Філіп Грельє, Зеліско Наталія Іванівна
Формула / Реферат
7'-Заміщені-1-(4-хлорофеніл)-3',7'-дигідро-2H,2'H,5H-спіро[піролідин-3,6'-тіопірано[2,3-d][1,3]тіазол]-2,2',5-тріони формул:
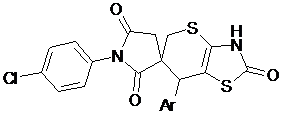 ,
,
Ar=3,4-(OMe)2-C6H3, (1)
4-NMe2-C6H4, (2)
4-Net2-C2H4, (3)
що виявляють антитрипаносомну активність.
Текст
7'-Заміщені-1-(4-хлорофеніл)-3',7'-дигідро2H,2'H,5H-спіро[піролідин-3,6'-тіопірано[2,3d][1,3]тіазол]-2,2',5-тріони формул: Ar=3,4-(OMe)2-C6H3, (1) S N Cl O H N S Ar 4-NMe2-C6H4, (2) O 4-Net2-C2H4, (3) , (11) UA кісткового мозку, анемія, лейкопенія, діарея, алопеція тощо. Дослідження останніх років дозволили виділити серед 2-гідразоно-4-тіазолідонів сполуки з активністю проти Trypanosoma cruzi та Toxoplasma gondii [Claudio Luis Donnici, Maria Helena Araujo, Henrique S. Oliveira, Diogo Rodrigo Magalhaes Moreira, Valeria R. Alves Pereira, Marina de Assis Souza, Maria Carolina Accioly Brelaz de Castro and Ana Cristina Lima Leite. Ruthenium complexes endowed with potent anti-Trypanosoma cruzi activity: Synthesis, biological characterization and structureactivity relationships // Bioorganic & Medicinal Chemistry.-2009, V. 17(14). - P. 5038-5043; Romulo P. Tenorio, Cristiane S. Carvalho, Carla S. Pessanha, Jose G. de Lima, Antonio R. de Faria, Antonio J. Alves, Edesio J.T. de Melo and Alexandre J.S. Goes. Synthesis of thiosemicarbazone and 4-thiazolidinone derivatives and their in vitro anti-Toxoplasma gondii activity // Bioorganic & Medicinal Chemistry Letters.2005, V 15 (10). - P. 2575-2578], що підтверджує актуальність пошуку нових синтетичних антипротозойних, зокрема антитрипаносомних засобів серед похідних 2-тіоксо-4-тіазолідону. (19) Корисна модель стосується синтезу нових гетероциклічних сполук і фармації, зокрема одержання біологічно активних сполук, що виявляють антитрипаносомну активність, і можуть бути використані в клінічній медицині як антипротозойні лікарські засоби. Відомі лікарські засоби з антитрипаносомною активністю, наприклад, ефлорнітин [Pepin J., Milord F., Guern С, Schechter PJ. Difluoromethylornithine for arseno-resistant Trypanosoma brucei gambiense sleeping sickness // The Lancet.-1987, V. 330 (8573). P. 1431-1433]. Ефлорнітин (дифлуорометилорнітин) - синтетичний препарат з групи фторовмісних α-амінокислот. Лікарський засіб ефективний при сонній хворобі (африканському трипаносомозі), викликаній Trypanosoma brucei gambiense (як на гемолітичній, так і на менінгоенцефалічній стадії), однак Trypanosoma brucei rhodesiense помірно стійка до ефлорнітину. Цей лікарський засіб менш токсичний, ніж пентамідин, сурамін, меларсопрол. Препарат незворотньо інгібує орнітиндекарбоксилазу збудника, має необхідні лікувальні властивості, проте при застосуванні можливі значні побічні ефекти: судоми, ураження 62458 (13) U що виявляють антитрипаносомну активність. 3 62458 В основу корисної моделі поставлена задача створення ефективного антитрипаносомного засобу з меншими побічними ефектами. 4 Поставлена задача вирішується тим, що синтезовані 7'-заміщені-1-(4-хлорофеніл)-3',7'-дигідро2H,2'H,5H-спіро[піролідин-3,6'-тіопірано[2,3d][1,3]тіазол]-2,2',5-тріони формул: O S N Cl O H N S Ar=3,4-(OMe)2-C6H3, (1) 4-NMe2-C6H4, (2) 4-Net2-C2H4, (3) O Ar , що виявляють антитрипаносомну активність. Синтезовані сполуки є білими кристалічними порошками, розчинними у ДМСО і ДМФА, малорозчинними в оцтовій кислоті, спиртах, ацетонітрилі, нерозчинні у воді, бензолі та толуолі. Для доказу складу і структури синтезованих сполук були використані відомі фізико-хімічні методи, зокрема спектроскопія ПМР, хромато-масспектрометрія та елементний аналіз. Одержані результати свідчать про відповідність синтезованих сполук заявленим. Заявлені сполуки одержують взаємодією 1-(4хлорофеніл)-3-метиленпіролідин-2,5-діону та 5ариліден-4-тіоксо-2-тіазолідонів в умовах реакції гетеро-Дільса-Альдера. Реакцію проводять у се редовищі оцтової кислоти в присутності слідів гідрохінону. Для синтезованих 7'-заміщених-1-(4хлорофеніл)-3',7'-дигідро-2H,2'H,5Hспіро[піролідин-3,6'-тіопірано[2,3-d][1,3]тіазол]2,2',5-тріонів проведено попередню оцінку фармакологічного потенціалу. Речовини досліджувалися in vitro у концентраціях 10 мкг/мл та 1 мкг/мл у середовищі НМІ9 на мікропластинах з 96-лунок на Trypanosoma brucei brucei (bloodstream form), в результаті визначали відсотки інгібування росту паразитів за рівнем флуоресценції барвника Alamar Blue (Табл. 1) у порівнянні з контролем (негативний контроль - розчин DMCO). Таблиця 1 Антипротозойна активність синтезованих сполук в концентрації 10 мкг/мл та 1 мкг/мл на Trypanosoma brucei brucei Досліджувані сполуки 1 2 3 Відсоток інгібування росту паразитів, % При концентрації 10 мкг/мл При концентрації 1 мкг/мл 93,62 80,42 98,19 36,77 98,23 21,11 На основі одержаних результатів прескринінгу проведено ґрунтовні in vitro дослідження, які полягали у визначенні інгібуючої концентрації ІС50 досліджуваних речовин на клітинах Trypanosoma brucei gambiense TBG та Trypanosoma brucei brucei 5 TBB, що додавалися в концентрації 10 клітин/мл. [Raz В., Iten M., Grether-Buhler Y., Kaminsky R., Brun R. The Alamar Blue asssay to determine drug sensitivity of African trypanosomes (T. b. rhodesiense, T. b. gambiense) in vitro // Acta Trop.1997, V. 68. - P. 139-147]. Дослідження проводилося на мікропластинах з 96 лунок у середовищі НМІ9*для серії двократних розведень від 10 мкг/мл до 4,88 нг/мл. За негативний контроль вибрано лунки з розчином DMCO, середовищем та клітинами паразитів. Мікропластини інкубувалися при 37 °C та 5 % CO2 атмосфері протягом 24 год. з наступним додаванням 20 мкл барвника Alamar Blue. Після 4-годинного інкубування вимірювали флуоресценцію. Відсотки росту паразитів визначалися за рівнем флуоресценції барвника Alamar Blue, a IC50 - за дозозалежною кривою відсоткового росту паразитів від концентрації досліджуваних сполук. Результати дослідження наведені у таблиці 2. Таблиця 2 ІС50 синтезованих сполук на Trypanosoma brucei brucei та Trypanosoma brucei gambiense Досліджувані сполуки 1 2 TBG Стандартне відIC50, мкг/мл хилення, мкг/мл 0,1321 0,0071 0,6108 0,1571 TBB Стандартне відхиІС50, мкг/мл лення, мкг/мл 0,2128 0,0787 0,7149 0,0426 TBG/TBB 0,62 0,85 5 3 62458 1,233 0,2115 6 1,8604 0,4755 0,66 7 Таким чином, в умовах експерименту встановлено, що сполуки, які заявляються, проявляють високу антитрипаносомну активність і є перспективними антипротозойними засобами. Для розуміння запропонованої корисної моделі нижче наведено приклад одержання 7'заміщених-1-(4-хлорофеніл)-3',7'-дигідро2H,2'H,5H-спіро[піролідин-3,6'-тіопірано[2,3d][1,3]тіазол]-2,2',5-тріонів. Сполуки синтезують наступним чином. Синтез 7'-заміщених-1-(4-хлорфеніл)-3',7'дигідро-2H,2'H,5H-спіро[піролідин-3,6'тіопірано[2,3-d][1,3]тіазол]-2,2',5-тріонів. Суміш 0,005 моль відповідного 5-ариліден-4-тіоксо-2тіазолідону, 0,0055 моль 1-(4-хлорфеніл)-3метиленпіролідин-2,5-діону, декілька кристалів гідрохінону в 10 мл оцтової кислоти нагрівають протягом 8 год. в колбі із зворотним холодильником. Осад, який утворюється після повного охолодження реакційної суміші, відфільтровують, промивають оцтовою кислотою, водою, етанолом та ефіром. Перекристалізовують з ацетонітрилу (1), етанолу (2) та суміші ДМФА-етанол (1:2) (3). Сполука 1. Вихід - 34 %, Т.топл. 258-260 °C. Знайдено, %: N - 5,80, S - 12,84. C23H19ClN2O5S2. Вирахувано, %: N - 5,57, S - 12,75. ЯМР'Н, , м.ч.: Комп’ютерна верстка А. Крижанівський 62458 8 2,96д (1Н, СН2СО, J = 18,1 Гц), 3,03д (1Н, СН2СО, J= 18,1 Гц), 3,50д (1H, CH2S, J= 12,8 Гц), 3,63с (3Н, ОСН3), 3,70д (1Н, CH2S, J= 12,8 Гц), 3,74с (3Н, ОСН3), 4,35с (1Н, СН), 6,74шс (1Н, аром), 6,80д (3Н, аром.), 6,93д (1Н, аром.), 7,52д (2Н, аром., J = 8,5Гц), 11,56с (1H, NH). LC-MS + + (m/z):503 (М ), 504 (М +1). Сполука 2. Вихід - 32 %, Т.топл. 240-242 °C. Знайдено, %: N - 8,58, S - 13,33. С2зН20СlN3О3S2. 1 Вирахувано, %: N - 8,65, S - 13,19. ЯМР Н, , м.ч.: 2,86с (6Н, 2*СН3), 2,93д (1Н, СН2СО, J= 18,5 Гц), 2,95д (1Н, СН2СО, J= 18,5 Гц), 3,48д (1Н, CH2S, J= 12,8 Гц), 3,65д (1Н, CH2S, J= 12,8 Гц), 4,26с (1Н, СН), 6,80д (2H, аром., J= 8,1 Гц), 6,85д (2H, аром., J= 8,4 Гц), 7,01шс (2Н, аром.), 7,49д (2Н, аром., J= + 8,4 Гц), 11,51с (1H, NH). LC-MS (m/z):486 (M ), 487 + (M +l). Сполука 3. Вихід - 34 %, Т.топл. 242-244 °C. Знайдено, %: N - 8,00, S - 12,32. С25Н24СlN3O3S2. Вирахувано, %: N - 8,17, S - 12,47. ЯМР'Н, , м.ч.: 1,04т (6Н, 2*СН3), 2,93д (1Н, СН2СО, J = 18,4Гц), 2,95д (1H, СН2СО, J = 18,4Гц), 3,28-3,30м (4Н, 2*СН2СН3), 3,44д (1H, CH2S, J= 12,8Гц), 3,66д (1Н, CH2S, J= 12,6Гц), 4,22с (1Н, СН), 6,55д (2Н, аром., J = 8,2 Гц), 6,82д (2Н, аром., J= 8,4 Гц), 6,96шс (2Н, аром.), 7,44д (2Н, аром., J= 8,4 Гц), 11,49с (1Н, + + NH). LC-MS (m/z):514 (М ), 515 (М +1). Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською7'-substituted-1-(4-chlorophenyl)-3',7'-dihydro-2h,2'h,5h-spiro[pyrrolidine-3,6'-thiopyrano[2,3-d][1.3]thiazol]-2,2',5-triones, exhibiting antitrypanosomal activity
Автори англійськоюZelisko Natalia Ivanivna, Zimenkovskyi Borys Semenovych, Lesyk Roman Bohdanovych, Philippe Grellier
Назва патенту російською7'-замещенные-1-(4-хлорофенил)-3',7'-дигидро-2h,2'н,5н-спиро[пирролидин-3,6'-тиопирано[2,3-d][1,3]тиазол]-2,2',5-трионы, проявляющие антитрипаносомную активность
Автори російськоюЗелиско Наталья Ивановна, Зименковский Борис Семенович, Лесик Роман Богданович, Филипп Грелье
МПК / Мітки
МПК: C01D 7/00
Мітки: активність, 7'-заміщені-1-(4-хлорофеніл)-3',7'-дигідро-2н,2'н,5н-спіро[піролідин-3,6'-тіопірано[2,3-d][1,3]тіазол]-2,2',5-тріони, виявляють, антитрипаносомну
Код посилання
<a href="https://ua.patents.su/4-62458-7-zamishheni-1-4-khlorofenil-37-digidro-2n2n5n-spiropirolidin-36-tiopirano23-d13tiazol-225-trioni-shho-viyavlyayut-antitripanosomnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">7′-заміщені-1-(4-хлорофеніл)-3′,7′-дигідро-2н,2’н,5н-спіро[піролідин-3,6′-тіопірано[2,3-d][1,3]тіазол]-2,2′,5-тріони, що виявляють антитрипаносомну активність</a>








