Спосіб одержання дигідроксіефірів і їх похідних
Номер патенту: 73774
Опубліковано: 15.09.2005
Автори: Рів Крістофер Девід, Холт Роберт Ентоні, Блекер Ендрю Джон
Формула / Реферат
1. Спосіб одержання сполуки формули (1)
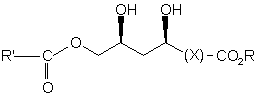 , (1)
, (1)
де Х являє собою необов'язково заміщену вуглеводневу зв'язуючу групу,
R являє собою необов'язково заміщену вуглеводневу групу, а
R' являє собою необов'язково заміщену вуглеводневу, переважно необов'язково заміщену алкіл групу,
в якому:
а) сполуку формули (2)
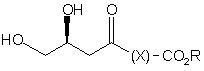 (2)
(2)
піддають стереоселективному відновленню з одержанням сполуки формули (3)
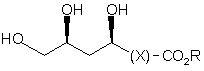 , (3)
, (3)
і
b) сполуку формули (3) етерифікують у присутності сполуки формули R"-O-COR', де R" являє собою необов’язково заміщену вуглеводневу групу, і ферменту ліпази або гідролази; або
c) сполуку формули (2) етерифікують у присутності сполуки формули R"-O-COR' і ферменту ліпази або гідролази з одержанням сполуки формули (4)
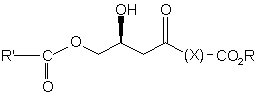 , (4)
, (4)
і
d) сполуку формули (4) піддають стереоселективному відновленню.
2. Спосіб за п. 1, в якому Х - група -СН2-.
3. Спосіб за будь-яким з попередніх пунктів, в якому R" - вініл- або ізопропенілгрупа.
4. Спосіб за будь-яким з попередніх пунктів, в якому R' - заміщена або незаміщена С1-6алкілгрупа.
5. Спосіб за п. 4, в якому R' - метилгрупа.
6. Спосіб за будь-яким з попередніх пунктів, в якому сполуки формул (2) або (4) відновлюють внаслідок контакту з організмом, що має властивості мікроорганізму, вибраного з родів Beauveria, Pichia, Candida, Kluyveromyces або Torulaspora, або екстрагованим з нього ферментом.
7. Спосіб за п. 6, в якому сполуки формул (2) або (4) відновлюють внаслідок контакту з організмом, вибраним з групи, що включає Pichia angusta, Pichia pastoris, Candida guillermondii, Saccharomyces carlsbergensis, Pichia trehalophila, Kluyveromyces drosopliarum і Torulospora hansenii, або екстрагованим з нього ферментом.
8. Спосіб за будь-яким з пп. 6 або 7, в якому використовують цілі клітини.
9. Спосіб за будь-яким з пп. 6, 7 або 8, в якому сполуки формул (2) або (4) відновлюють при рН, що складає від 4 до 5.
10. Спосіб за будь-яким з попередніх пунктів, в якому сполуки формул (2) або (3) етерифікують у присутності ферменту, вибраного з групи, що включає ліпазу з підшлункової залози свині, ліпазу Candida cylindracea, ліпазу Pseudomonas fluorescens, Candida antarctica, фракція В, а також ліпазу з Humicola lanuginosa.
11. Спосіб за будь-яким з попередніх пунктів, в якому сполука формули R"-О-COR' являє собою вінілацетат.
12. Спосіб одержання сполуки формули (5)
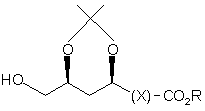 (5)
(5)
при якому проводять:
a) одержання сполуки формули (1) способом за будь-яким з попередніх пунктів;
b) взаємодію сполуки формули (1) з 2,2-диметоксипропаном з одержанням ацетоніду; і
с) видалення групи R'-(C=О)-;
в якій
Х являє собою необов'язково заміщену вуглеводневу зв'язуючу групу,
R являє собою необов'язково заміщену вуглеводневу групу, а
R' являє собою необов'язково заміщену вуглеводневу, переважно необов'язково заміщену алкілгрупу.
13. Спосіб за п. 12, в якому R'-(C=О)- видаляють обробкою основним спиртовим розчином.
14. Сполука формули (1):
 , (1)
, (1)
в якій R' - СН3, R - необов'язково заміщений вуглеводень, Х - -(СН2)n-, а n дорівнює від 1 до 4.
15. Сполука за п. 14, в якій R - трет-бутил, а Х - -СН2-.
16. Спосіб одержання сполуки формули (1)
 , (1)
, (1)
в якому проводять етерифікацію сполуки формули (3)
 (3)
(3)
у присутності сполуки формули R"-O-COR' і ферменту ліпази або гідролази з одержанням сполуки формули (1),
в якій
Х являє собою необов'язково заміщену вуглеводневу зв'язуючу групу,
кожний з R і R" незалежно являє собою необов'язково заміщену вуглеводневу групу, а
R' являє собою необов'язково заміщену вуглеводневу, переважно необов'язково заміщену алкілгрупу.
17. Спосіб одержання сполуки формули (4)
 , (4)
, (4)
в якому проводять етерифікацію сполуки формули (2)
 (2)
(2)
у присутності сполуки формули R"-O-COR' і ферменту ліпази або гідролази з одержанням сполуки формули (4),
де
Х являє собою необов'язково заміщену вуглеводневу зв'язуючу групу,
кожний з R і R" незалежно являє собою необов'язково заміщену вуглеводневу групу, а
R' являє собою необов'язково заміщену вуглеводневу, переважно необов'язково заміщену алкілгрупу.
18. Спосіб за будь-яким з пп. 16 або 17, в якому R' - СН3, R - трет-бутил, а Х - –СН2-.
19. Спосіб за будь-яким з пп. 16, 17 або 18, в якому R" - вініл- або ізопропенілгрупа.
20. Спосіб за будь-яким з пп. 16-19, в якому фермент вибраний з групи, що включає ліпазу підшлункової залози свині, ліпазу Candida cylindracea, ліпазу Pseudomonas fluorescens, Candida antarctica, фракція В, а також ліпазу з Humicola lanuginosa.
Текст
Даний винахід відноситься до стереоселективного способу одержання дигідроксіефірів і їх похідних. Відповідно до першого аспекту даного винаходу розроблений спосіб одержання сполуки формули (1) що включає а) стереоселективне відновлення сполуки формули (2) для одержання сполуки формули (3), і b) етерифікацію сполуки формули (3) у присутності сполуки формули R''-O-COR' і ферменту ліпази або гідролази для одержання сполуки формули (1); або c) етерифікацію сполуки формули (2) у присутності сполуки формули R''-O-COR' і ферменту ліпази або гідролази для одержання сполуки формули (4), і d) стереоселективне відновлення сполуки формули (4) для одержання сполуки формули (І), де X представляє необов'язково заміщену вуглеводневу зв'язуючу групу, кожний з R і R'' незалежно представляє необов'язково заміщену вуглеводневу групу, а R' представляє необов'язково заміщену вуглеводневу групу, переважно, необов'язково заміщену алкільну групу. Вуглеводневі групи, представлені X, R, R’ або R'', можуть бути заміщені одним або кількома замісниками, а також можуть бути пер-заміщені, наприклад пергалогеновані. Приклади замісників включають галоген, особливо фтор і хлор, алкокси такий як С1-4алкокси, та оксо. Переважно X представляє групу формули -(СН2)n-, в якій n дорівнює від 1 до 4, а, найбільш переважно, X представляє групу -СН2-. R'' може представляти алкілгрупу, таку як С1-6алкілгрупа, або алкілкарбонілгрупу, таку як С16алкілкарбонілгрупа, наприклад СН3(С=0)- або СF 3(С=0)- група. R'' найбільш переважно представляє вінілабо ізопропенілгрупу. R переважно представляє С1-6алкілгрупу, яка може бути лінійною або розгалуженою і заміщена одним або кількома замісниками. Найбільш переважно, R представляє трет-бутилгрупу. R' може представляти заміщений алкіл, часто С1-6алкілгрупу, таку як CF3- або CF3CH2-групу, однак він переважно представляє незаміщену С1-6алкілгрупу, особливо метилгрупу. Стереоселективне відновлення сполук формул (2) або (4) переважно включає способи хімічного або мікробіологічного відновлення, такі як гідрування, гідрування з перенесенням, відновлення гідриду металу або дегідрогенази. Приклади відповідного способу гідрування, наприклад, описаного в Helv. Chim. Acta 69, 803, 1986 (приведений тут як посилання), включають застосування від 0,01 до 10% (мас./мас.) каталізаторів, таких як платина, паладій або родій на гетерогенних основах, таких як вуглець, окис алюмінію, діоксид кремнію, із застосуванням молекулярного водню під тиском від 1 до 10 бар, у розчиннику, такому як метанол, етанол, трет-бутанол, диметилформамід, трет-бутилметилефір, толуол або гексан. Альтернативно можуть бути використані гомогенні каталізатори гідрування, наприклад, описані в ЕР0583171 (приведений тут як посилання). Приклади відповідних хімічних - способів гідрування з перенесенням включають способи, описані Zassinovich, Mestroni and Gladiali in Chem. Rev. 1992, 92, 1051 (приведений тут як посилання) або Fuji et al. in J. Am. Chem. Soc. 118, 2521, 1996 (приведений тут як посилання). Переважні хімічні способи гідрування з перенесенням включають хіральні ліговані комплекси перехідних металів, таких як рутеній або родій, особливо хіральні, ліговані діаміном, нейтральні, ароматичні комплекси рутенію. Таке хімічне гідрування з перенесенням переважно включає кислоту, особливо форміат, такий як форміат триетиламонію, як джерело водню. Можуть бути використані реагенти з гідриду металу, наприклад описані в Tet. 1993, 1997, Tet. Asymm. 1990, 1, 307 (приведений тут як посилання) або J. Am. Chem. Soc. 1998, 110. 3560 (приведений тут як посилання). Приклади відповідного мікробіологічного відновлення включають взаємодію сполуки формул (2) або (4) з організмом, що має властивості мікроорганізму і вибраний з Beauveria, переважно, Beauveria bassiana; Pichia, переважно, Pichia angusta або Pichia pastoris, trehalophila, haplophila або membranefaciens; Candida, переважно, Candida humicola, solani, guillermondii, diddenssiae або friedrichii; Kluyveromyces, переважно, Kluyveromyces drosophilarum, або Torulaspora, переважно, Torulaspora hansenii. Відновлення може бути здійснене шляхом контакту сполук формул (2) або (4) з ферментом, екстрагованим з перерахованих вище мікроорганізмів. Найбільш переважно, сполуки формул (2) або (4) піддають взаємодії з мікроорганізмом, вибраним з Pichia angusta, Pichia pastoris, Candida guillermondii, Saccharomyces carlsbergensis, Pichia trehalophila, Kluyveromyces drosopliarum і Torulospora hansenii, або екстрактом з перерахованих вище організмів. Даний винахід переважно включає одержання сполуки формули (3) шляхом селективного відновлення сполуки формули (2) із застосуванням цілих клітин або екстрактів з перерахованих вище мікроорганізмів, переважно, Pichia angusta, Pichia pastoris, Candida guillermondii, Saccharomyces carlsbergensis, Pichia trehalophila, Kluyveromyces drosopliarum і Torulospora hansenii. Даний винахід найбільш переважно втілюють, застосовуючи цілі клітини організмів, оскільки це усуває необхідність відділення потрібного ферменту і забезпечує кофактори для взаємодії. Можливе застосування будь-якого з вищезгаданих видів, однак було встановлено, що у багатьох варіантах втілення даного винаходу високий рівень перетворення і висока селективність можуть бути досягнуті внаслідок застосування ферменту або цілих клітин Pichia angusta. Загалом, кофактор, звичайно NAD(P)H (нікотинамідаденіндинуклеотид або нікотинамідаденіндинуклеотидфосфат) і систему для регенерації кофактора, наприклад глюкози і дегідрогенази глюкози, застосовують з ферментами для направлення реакції. Оскільки відповідні кофактори і механізми відновлення присутні у цілих клітинах, то переважним є застосування цілих клітин у поживному середовищі, що переважно містить відповідне джерело вуглецю, яке може включати одну або декілька з наступних сполук: цукор, наприклад мальтоза, сахароза або, переважно, глюкоза; поліол, наприклад гліцерин або сорбіт; лимонна кислота або нижчий спирт, наприклад метанол або етанол. Якщо під час реакції передбачається ріст цілих клітин, то у середовищі повинні бути присутніми джерела фосфору і азоту, а також мікроелементи. Це можуть бути мікроелементи, що звичайно застосовуються для культивування організму. Спосіб може бути здійснений шляхом додання сполуки формул (2) або (4) до культури організму, що росте, у середовищі, яке здатне підтримувати ріст, або до суспензії живих клітин у середовищі, що переважно містить джерело вуглецю, але не включає одну або декілька поживних речовин, необхідних для росту. Також можуть бути використані неживі клітини при наявності необхідних ферментів і кофакторів; при необхідності, вони можуть бути додані до неживих клітин. За бажанням, клітини можуть бути іммобілізовані на основі, що піддається взаємодії із сполукою формули (2) або (4), переважно, у присутності відповідного описаного вище джерела вуглецю. Відповідна величина рН складає від 3,5 до 9, наприклад від 4 до 9, переважно, максимум 6,5, і, більш переважно, максимум 5,5. Найбільш відповідною є величина рН, що складає від 4 до 5. Доцільне здійснення способу при температурі, що складає від 10 до 50°С, переважно, від 20 до 40°С, і, більш переважно, від 25 до 35°С. При наявності живих цілих клітин вищезгаданих організмів переважно здійснення способу в аеробних умовах. Доцільне застосування швидкості аерації, еквівалентне величині; яка складає від 0,01 до 1,0 об'ємів повітря, що вимірюється при звичайній температурі і тиску, на об'єм культурного середовища за хвилину при вищезгаданих значеннях рН і температури, однак потрібно зазначити, що можливі істотні відхилення. Вказані рН, температура та умови аерації можуть застосовуватися під час росту організмів, що здійснюється окремо від способу. Очищені ферменти можуть бути виділені відомими способами, такими як центрифугування суспензії клітин, що розпалися, і відділення прозорого розчину від дебрису, відділення потрібних ферментів від розчину, наприклад, шляхом іонообмінної хроматографії, переважно, з елююванням з колонки рідиною з наростаючою іонною силою, і/або селективним осадженням внаслідок додання іонного матеріалу, наприклад сульфату амонію. Такі дії можуть бути повторені багато разів при необхідності покращення чистоти. Особливо переважним є мікробне відновлення сполук формул (2) або (4), яке складає другий аспект даного винаходу. Етерифікацію сполук формул (2) або (3) переважно здійснюють, застосовуючи інший складний ефір, який присутній щонайменше у молярно-еквівалентній кількості по відношенню до спирту і, переважно, являє собою вініловий ефір (як побічний продукт, ацетальдегід не бере участі у зворотній реакції). Можливе альтернативне застосування ангідриду, такого як оцтовий або трифтороцтовий ангідрид, або складного ефіру, такого як етилацетат або фторований ефір, такий як трифторетилацетат. Переважно здійснення ділянкоспецифичної етерифікації в органічному розчиннику, що містить менше 1% (мас./мас.) води, такому як ацетонітрил, етилацетат, тетрагідрофуран, трет-бутилметилефір, толуол, бутанон, пентанон або гексанон, при температурі, що складає переважно від 20 до 75°С, більш переважно, від 25 до 50°С. Складний ефір переважно являє собою складний ефір нижчих алканових кислот, які мають від 2 до 8 атомів вуглецю, або їх заміщені похідні. Може бути необов'язково використана інертна атмосфера, наприклад, через розчин може бути пропущений потік азоту. Ферменти можуть бути присутніми як такі абоу вигляді цілих клітин, що їх включають. Переважна їх іммобілізація таким чином, щоб полегшити їх відділення від продукту і, за бажанням, забезпечити їх повторне використання. Переважні ферменти включають ліпази, такі як ліпаза підшлункової залози свині, ліпаза Candida cylindracea, ліпаза Pseudomonas fluorescens, Candida antarctica, фракція В, наприклад, що випускається під товарним знаком "Chirazyme L2", ліпаза з Humicola lanuginosa, наприклад, що продається під товарним знаком "Lipolase", або ліпаза з Pseudomonas, наприклад ліпаза, що продається під товарним знаком "SAM II", і, більш переважно, ліпази з Candida antarctica, наприклад, що продаються під товарним знаком "Chirazyme". Сполуки формули (1), в яких R' представляє СН3, R представляє необов'язково заміщений гідрокарбіл, X представляє -(CH2)n -, a n дорівнює величині від 1 до 4, складають третій аспект даного винаходу. R переважно представляє трет-бутил, а X найбільш переважно представляє -СН2-. Сполуки формули (1) являють собою проміжні сполуки, які застосовуються для одержання фармацевтичних сполук. Звичайно їх піддають взаємодії з захисною групою для залишків 1,3-дигідроксилу, таких як 2,2-диметоксипропан, з метою одержання ацетоніду відповідно до опису, приведеного у Synthesis 1998, 1713. Потім група R'-(C=O)- може бути селективно видалена обробкою слабоосновним спиртовим розчином, наприклад К2СО3, відповідно до опису, приведеного у патенті США 5278313, або ліпазою у водному або органічному розчині, що містить достатню кількість води для підтримки гідролізу, з одержанням сполуки формули (5): Даний спосіб одержання сполук формули (5) складає четвертий аспект даного винаходу. Приклад 1 Одержання (3R,5S) трет-бутил 3,5,6-тригідроксигексаноату У 250-мл круглодонну колбу при перемішуванні вміщують 20мл ацетонітрилу, 0,405г (0,662ммол) диmu-хлорбіс[(п-цимол)хлоррутеній (П)] і 0,492г (1,34ммол) ((1S,2S)-(+)-N-(4-толуолсульфоніл)-1,2дифенілетилендіаміну. Знекиснений розчин 26г (0,119мол) оптично чистого (5S) трет-бутил 3-кето-5,6дигідроксигексаноату в 15мл ацетонітрилу вміщують у реактор і перемішують при температурі навколишнього середовища протягом 20 хвилин. Потім протягом понад 10 хвилин додають 65мл 5:2 (мол/мол) суміші дистильованої мурашиної кислоти і триетиламіну і реакційну суміш перемішують при температурі навколишнього середовища протягом 48 годин. До одержаного розчину повільно додають 80мл дихлорметану і 120мл насиченого бікарбонату натрію. До водного шару додають 70г хлориду амонію і органічний шар відділяють. Водний шар промивають ще тричі 90мл етилацетату, органічні фракції об'єднують, сушать над сульфатом натрію, а розчинник видаляють, одержуючи 21,1г сирого масла, яке в основному містить (3R,5S) трет-бутил 3,5,6-тригідроксигексаноату. Результати 13С ЯМР показують, що співвідношення діастереомерів складає 5,2:1 (3R,5S):(3S:5S). При подальшій взаємодії матеріал використовують у сирому вигляді, однак він може бути очищений колонковою хроматографією. Одержання (3R,5S) трет-бутил 6-ацетокси-3,5-дигідроксигексаноату У літрову, круглодонну колбу при перемішуванні вміщують 700мл тетрагідрофурану і 70,7г (0,32мол) (3R,5S) трет-бутил 3,5,6-тригідроксигексаноату, 41мл (0,46мол) вінілацетату і 6,3г ліпази на основі Chirazyme L2Ô. Після 3-х годин перемішування при температурі навколишнього середовища ліпазу видаляють скринінгом, а летючі речовини видаляють дистиляцією у вакуумі. Маса сирого масла складає 78,7г, а основним компонентом є (3R,5S) трет-бутил 6-ацетокси-3,5-дигідроксигексаноат. Одержаний матеріал застосовують безпосередньо на наступній стадії. Одержання (4R,6S)-6-[(ацетилокси)метил1-2,2-диметил-1,3-діоксан-4-оцтової кислоти, 1,1диметилетилефір У літрову, круглодонну колбу при перемішуванні вміщують 78,7г (3R,5S) трет-бутил 6-ацетокси-3,5дигідроксигексаноату, 800мл 2,2-диметоксипропану і 5,7г п-толуолсульфонової кислоти. Через 35 хвилин реакційну масу концентрують до половини її об'єму і додають 300мл дихлорметану і 300мл 1М бікарбонату натрію. Органічний шар відділяють, а водний шар промивають ще тричі, застосовуючи 150мл етилацетату. Органічні фракції об'єднують, сушать над сульфатом натрію, а летючі речовини видаляють дистиляцією у вакуумі. Отримують 92г сирого масла. Його очищують, спочатку пропускаючи через невисоку колонку з флеш-окису кремнію та елююючи гексаном, а потім гексаном етилацетатом 85:15 (об./об.), після чого кристалізують матеріал 3 рази з гексану, одержуючи 22,17г (4R,6S)-6-[(ацетилокси)метил]-2,2-диметил-1,3діоксан-4-оцтової кислоти, 1,1-диметилетилефір, що має, за результатами газової хроматографії, 99,9%de. Одержання (4R,6S)-6-(гідроксиметил)-2,2-диметил-1,3-діоксан-4-оцтової кислоти, 1,1-диметилефір У круглодонну колбу ємністю 500мл при перемішуванні вміщують 22,17г (4R,6S)-6-[(ацетокси)метил]2,2-диметил-1,3-діоксан-4-оцтової кислоти, 1,1-диметилетилефір, 250мл метанолу і 5,05г дробленого карбонату калію. Реакційну суміш перемішують протягом 35 хвилин до завершення гідролізу, потім карбонат калію видаляють скринінгом, реакційну масу концентрують і додають до неї 150мл 5% (мас./мас.) сольового розчину і 150мл толуолу. Органічний шар відділяють, а водний шар промивають ще двічі, застосовуючи 250мл толуолу. Органічні шари об'єднують, промивають три рази 15% (мас./мас.) сольовим розчином, а розчинник видаляють вакуумною дистиляцією, одержуючи 17,78г прозорого масла, результати аналізу якого показують, що воно містить >99% (4R,6S)-6-(гідроксиметил)-2,2-диметил-1,3-діоксан-4-оцтової кислоти, 1,1-диметилетилефір. Приклад 2 Одержання (5S) трет-бутил 6-ацетокси-5-гідрокси-3-кетогексаноату У 250-мл круглодонну колбу при перемішуванні вміщують 2,32г (0,0106мол) (5S) трет-бутил 5,6дигідрокси-3-кетогексаноату, 40мл тетрагідрофурану, 0,98мл (0,0106мол) вінілацетату і 0,22г ліпази на основі Chirazyme L2Ô. Через 20 хвилин ліпазу видаляють скринінгом, а летючі речовини видаляють дистиляцією у вакуумі, одержуючи 2,96г сирого масла, яке визначають за допомогою ЯМР як (5S) третбутил 6-ацетоки-5-гідрокси-3-кетогексаноат. Приклад 3 Одержання (3R,5S) трет-бутил 3,5,6-тригідроксигексаноату Piehia angusta NCYC R230 (розміщена відповідно до Будапештського договору 18 травня, 1995 року) вирощують у мультиферментерній системі Brown Biostat Q у наступному середовищі (на літр): глюкоза 40г; MgSO4 1,2г; K2SO4 0,21г; КН2РО4 0,69г; Н3РО4 (концентрований) 1мл; дріжджовий екстракт (Oxoid) 2г; FeSO4·7H2O 0,05г; піногасник (ЕЕА 142 Foaimaster), розчин мікроелементів 1мл (даний розчин містить на літр CuSO4·5H2O 0,02г; MnSO4·4H2O 0,1г; ZnSO4·7H2O 0,1г; СаСО3 1,8г). У кожний з 4-х ферментерів вміщують по 250мл середовища і стерилізують автоклавуванням. рН доводять до 4,5, застосовуючи 7-молярний розчин гідроксиду амонію, температуру встановлюють на рівні 28°С, швидкість потоку повітря встановлюють на рівні 300мл/хв., а швидкість змішувача - 1200об./хв. Ферментери інокулюють клітинами, взятими з чашок з агаром (2% агару), які містять таке ж середовище, як описано вище, за винятком того, що концентрація глюкози становить 20г/л. Через 22 години росту у ферментерах починають реакцію біовідновлення, додаючи (5S) трет-бутил 3-кето-5,6-дигідроксигексаноат; у два ферментера вміщують по 3,75мл, а в інші два - по 5мл. Реакцію продовжують ще протягом 78 годин, до 100% конверсії субстрату. Протягом даного періоду часу до культури додають 50% розчин глюкози з швидкістю, що становить 1-3г глюкози/літр культури/годин, для підтримки життєздатності клітин і забезпечення джерела відновлювальної сили. Реакції припиняють, видаляючи клітини центрифугуванням. До відновленої, вільної від клітин надосадової рідини додають хлорид натрію до кінцевої концентрації, яка складає 20% мас./об., і суміш екстрагують три рази рівними об'ємами ацетонітрилу. Об'єднані екстракти ацетонітрилу сушать безводним сульфатом натрію, а розчинник видаляють при зниженому тиску у роторному випарнику (температура водяної бані становить 45°С), одержуючи в'язке, блідо-жовте масло. Аналізи підтверджують, що продуктом кожної реакції є (3R,5S) трет-бутил 3,5,6-тригідроксигексаноат, а діастереомерний надлишок кожного зразка вказаний у приведеній нижче таблиці. Експеримент 1 2 3 4 Діастереомерний надлишок (%) 99,6 99,6 99,4 99,6 Приклад 4 Одержання (3R,5S) трет-бутил 3,5,6-тригідроксигексаноату Pichia angusta NCYC R230 (розміщена відповідно до Будапештського договору 18 травня, 1995 року) вирощують у мультиферментерній системі Brown Biostat Q у наступному середовищі (що містить на літр): глюкоза 20г; сульфат амонію 10г; дріжджовий екстракт (Oxoid) 2г; MgSO4·7H2O 1,2г; КН2РО4 0,69г; К2SO4 0,21г; FeSO4·7H2O 0,05г; Н3РО4 (концентрований) 1мл; "піногасник ЕЕА 142 foammaster" 0,5мл; розчин мікроелементів 1мл (даний розчин містить на літр Са(СН3СО2)2 2,85г; ZnSO4·7H2O 0,1г; MnSO4·H2O 0,075г; CuSO4·5H2O 0,02г; сірчана кислота (концентрована) 1мл. В один з ферментерів вміщують 250мл середовища і стерилізують автоклавуванням. рН доводять до 5,0, застосовуючи 2-молярний розчин гідроксиду натрію. Температуру встановлюють на рівні 28°С, швидкість потоку повітря встановлюють на рівні 250мл хв.-1, а швидкість змішувача - 1200об./хв. Ферментер інокулюють 2,5мл суспензії клітин у стерильній деіонізованій воді, яка одержана з чашки з агаром, що містить Pichia angusta NCYC R320. Через 17 годин росту починають біовідновлення, додаючи 6,36г (5S) трет-бутил 3-кето-5,6-дигідроксигексаноату у вигляді водного розчину. Одночасно починають подачу глюкози у ферментер з швидкістю, що складає 2г глюкози л-1 год-1. Реакцію продовжують ще протягом 78 годин, при цьому конверсія субстрату досягає 96%. Вихідний матеріал і продукт піддають аналізу за допомогою ВЕРХ (колонка Hichrom S5 CN-250A, температура 35°С, рухома фаза: водна ТФО (0,1%):ацетонітрил 95:5, швидкість потоку 1мл хв. -1, об'єм уприскування - 5мл, детектор з показником заломлення). Реакцію припиняють, видаляючи клітини центрифугуванням при 4000´г протягом 20 хвилин. рН відновленої, вільної від клітин надосадової рідини доводять до 7,5, застосовуючи 2М NaOH. MgSO4·1,6H2O (15%мас/об, від безводного) розчиняють у вільній від клітин надосадовій рідині, а одержаний розчин екстрагують двічі рівним об'ємом 2-пентанону. Фази з розчинником збирають, а розчинник видаляють при зниженому тиску у роторному випарнику при 45°С, одержуючи оранжеве, в'язке масло. Його знову розчиняють у 50мл сухого, дистильованого 2-пентанону, а розчинник випаровують роторним випаровуванням, одержуючи трет-бутил 3,5,6-тригідроксигексаноат (5,08г, 80% виділений вихід). Діастереомерний надлишок визначають таким чином: зразок трет-бутил 3,5,6тригідроксигексаноату (30мг) піддають дериватизації взаємодією протягом щонайменше 10 хвилин при кімнатній температурі у надлишку трифтороцтового ангідриду, надлишковий ангідрид видаляють у потоці сухого азоту, а масло, що залишилося, розбавляють дихлорметаном (1мл). Зразок аналізують, застосовуючи колону Chiralcel Dex CB (25м) при температурі 140°С (ізотермальна). Діастереомери елююють через 14,4 хвилин (3R,5S діастереомер) і 15,7 хвилин (3S,5S діастереомер). Даним способом встановлено, що діастереомерний надлишок зразка становить 99,7%.
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for the preparation of dihydroxy esters and derivatives thereof
Назва патенту російськоюСпособ получения дигидроксиэфиров и их производных
МПК / Мітки
МПК: C07D 319/00, C12P 17/02, C07C 69/675, C12P 7/62
Мітки: одержання, дигідроксіефірів, спосіб, похідних
Код посилання
<a href="https://ua.patents.su/4-73774-sposib-oderzhannya-digidroksiefiriv-i-kh-pokhidnikh.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання дигідроксіефірів і їх похідних</a>
Попередній патент: Нові поліциклічні сполуки і їх застосування
Наступний патент: Спосіб виготовлення штапельного волокна із розплавів термопластичних матеріалів та пристрій для його здійснення
Випадковий патент: Спосіб оцінювання азотфіксувальної здатності бобових культур








