Поліненасичені жирні кислоти для лікування захворювань, які належать до ряду серцево-судинних, метаболічних та запальних захворювань
Номер патенту: 109528
Опубліковано: 10.09.2015
Автори: Бреннванг Мортен, Ховланн Рагнар, Хольмейде Анне Крістін, Ск'єрет Туре
Формула / Реферат
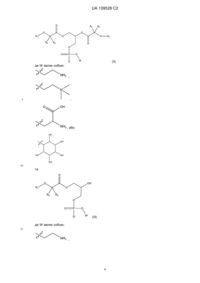
1. Ліпідна сполука формули (I):
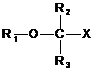 , (I)
, (I)
у якій R1 являє собою C10-C22алкенільну групу, що має 3-6 подвійних зв’язків;
R2 та R3 є однаковими або різними та вибрані з таких як: атом водню та алкільна група, за умови, що R2 та R3 обидва не являють собою атом водню; та
X являє собою карбонову кислоту або її похідну, причому похідна являє собою складний ефір карбонової кислоти, карбоксамід, моногліцерид, дигліцерид або тригліцерид,
або її фармацевтично прийнятна сіль.
2. Ліпідна сполука за п. 1, у якій подвійні зв’язки являють собою перервані метиленом подвійні зв’язки у Z-конфігурації.
3. Ліпідна сполука за п. 1, у якій R1 являє собою C14-C22алкенільну групу, що має щонайменше один подвійний зв’язок, що має Z-конфігурацію, та має перший подвійний зв’язок у третьому зв’язку вуглець-вуглець з омега (ω) кінця вуглецевого ланцюга.
4. Ліпідна сполука за п. 1, у якій R1 вибирають з C18-, C20- або C22алкенільної групи, що має 3, 4, 5 або 6 подвійних зв’язків.
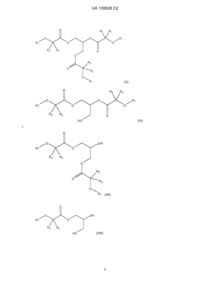
5. Ліпідна сполука за п. 1 формули:
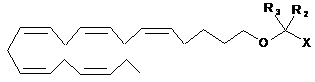 .
.
6. Ліпідна сполука за п. 1 формули:
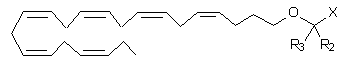 .
.
7. Ліпідна сполука за п. 1, у якій R2 являє собою атом водню, R3 являє собою алкільну групу, та X являє собою карбонову кислоту.
8. Ліпідна сполука за п. 7, у якій алкільна група являє собою етильну групу.
9. Ліпідна сполука за п. 1 формули:
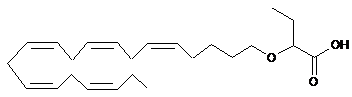 .
.
10. Ліпідна сполука за п. 9, де сполука присутня у формі її R-енантіомера.
11. Ліпідна сполука за п. 9, де сполука присутня у формі її S-енантіомера.
12. Ліпідна сполука за п. 1 формули:
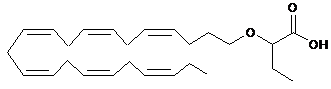 .
.
13. Ліпідна сполука за п. 1 формули:
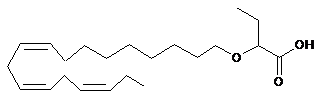 .
.
14. Ліпідна сполука за п. 1 формули:
 .
.
15. Ліпідна сполука за п. 1 формули:
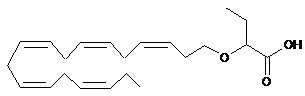 .
.
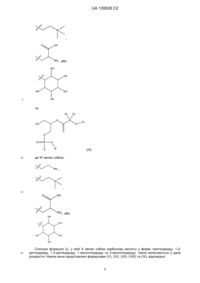
16. Ліпідна сполука за п. 1, де сіль сполуки формули (I) вибирають з
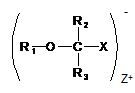 ,
,
де X являє собою COO-, та Z+ вибирають з Li+, Na+, K+ або NH4+;
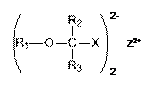 ,
,
де X являє собою COO-, та Z2+ вибирають з Mg2+ або Ca2+.
17. Ліпідна сполука за будь-яким з попередніх пунктів, де R2 та R3 незалежно вибирають з таких як: атом водню та алкільна група.
18. Ліпідна сполука за п. 17, у якій алкільна група являє собою метильну групу або етильну групу.
19. Ліпідна сполука за п. 1, у якій один з R2 та R3 являє собою атом водню, а інший з R2 та R3являє собою алкільну групу.
20. Ліпідна сполука за п. 1, у якій R2 та R3 є однаковими або різними та вибрані з алкільної групи.
21. Ліпідна сполука за п. 20, у якій R2 являє собою метильну групу та R3 являє собою етильну групу.
22. Ліпідна сполука за п. 20, у якій R2 та R3 є однаковими та вибраними з таких як: метильна група або етильна група.
23. Ліпідна сполука за п. 19, у якій R1 являє собою C14-C22алкенільну групу з щонайменше одним подвійним зв’язком, що має Z-конфігурацію, та має перший подвійний зв’язок на третьому зв’язку вуглець-вуглець з омега (ω) кінця вуглецевого ланцюга.
24. Ліпідна сполука за п. 1, де X являє собою карбонову кислоту або її похідну у формі складного ефіру, моногліцериду, 2-моногліцериду, дигліцериду або тригліцериду.
25. Ліпідна сполука за п. 24, у якій X являє собою похідну карбонової кислоти у формі етилового складного ефіру.
26. Ліпідна сполука за п. 24, у якій R2 та R3 являють собою етильну групу та атом водню, та X являє собою похідну карбонової кислоти у формі 2-моногліцериду.
27. Ліпідна сполука за п. 24, у якій X являє собою карбонову кислоту.
28. Ліпідна сполука за п. 1 у суміші діастереомерів, енантіомерів або у рацемічній формі.
29. Ліпідна сполука за п. 1, у якій сполуку вибирають з таких як:
(A) ліпідна сполука, що походить з поліненасичених жирних кислот, де R1 являє собою C20алкенільну групу, що має 5 подвійних зв’язків;
(B) ліпідна сполука, що походить з поліненасичених жирних кислот, де R1 являє собою C22алкенільну групу, що має 6 подвійних зв’язків;
(C) ліпідна сполука, що походить з поліненасичених жирних кислот, де R1 являє собою C18алкенільну групу, що має 3 подвійних зв’язки;
(D) ліпідна сполука, що походить з поліненасичених жирних кислот, де R1 являє собою C15алкенільну групу, що має 4 подвійних зв’язки;
(E) ліпідна сполука, що походить з поліненасичених жирних кислот, де R1 являє собою C18алкенільну групу, що має 5 подвійних зв’язків;
(F) ліпідна сполука, у якій X являє собою карбонову кислоту у формі тригліцериду; або
(G) ліпідна сполука, у якій X являє собою карбоксилатну сіль.
30. Ліпідна сполука за п. 24, де сполука присутня у формі її R-енантіомера на атомі вуглецю, прикріпленому до -OR1, R2, R3 та X.
31. Ліпідна сполука за п. 24, де сполука присутня у формі її S-енантіомера на атомі вуглецю, прикріпленому до -OR1, R2, R3 та X.
32. Ліпідна сполука за п. 1, де сполука вибрана з групи, що включає:
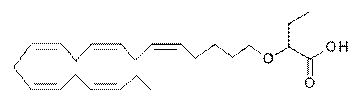
2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєнілокси)бутанову кислоту;
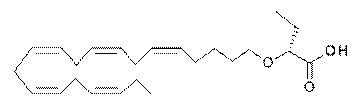
(R)-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєнілокси)бутанову кислоту;
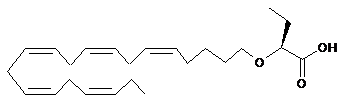
(S)-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєнілокси)бутанову кислоту;
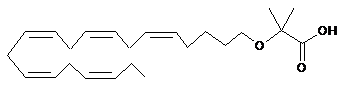
2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєнілокси)-2-метилпропанову кислоту;

2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраєнілокси)бутанову кислоту;

2-((9Z,12Z,15Z)-октадека-9,12,15-триєнілокси)бутанову кислоту або
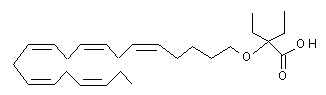
2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєнілокси)бутанову кислоту.
33. Фармацевтична композиція, що містить ліпідну сполуку за будь-яким з пп. 1-32 та фармацевтично прийнятний носій, наповнювач або розріджувач, або будь-яку їх комбінацію.
34. Фармацевтична композиція за п. 33, сформульована для перорального введення.
35. Фармацевтична композиція за будь-яким з пп. 33-34, у якій щонайменше одну ліпідну сполуку вводять у щоденній дозі, що коливається від 1 мг до 3 г.
36. Фармацевтична композиція за п. 35, у якій щоденна доза коливається від 50 мг до 1 г.
37. Фармацевтична композиція за п. 35, у якій щоденна доза коливається від 50 мг до 500 мг.
38. Фармацевтична композиція за п. 35, у якій щоденна доза коливається від 10 мг до 2 г.
39. Фармацевтична композиція за п. 35, у якій щоденна доза коливається від 100 мг до 1 г.
40. Фармацевтична композиція за п. 35, у якій щоденна доза коливається від 100 мг до 500 мг.
41. Фармацевтична композиція за п. 35, у якій щоденна доза коливається від 100 мг до 250 мг.
42. Фармацевтична композиція за будь-яким з пп. 33-41 для застосування як лікарського засобу.
43. Ліпідна композиція, що містить щонайменше одну ліпідну сполуку за будь-яким з пп. 1-32.
44. Ліпідна композиція за п. 43 для застосування як лікарського засобу.
45. Ліпідна сполука за будь-яким з пп. 1-32 для застосування як лікарського засобу.
46. Спосіб профілактики або лікування запалення, у якому суб’єкту, що цього потребує, вводять щонайменше одну сполуку за будь-яким з пп. 1-32.
47. Спосіб профілактики або лікування ревматоїдного артриту, у якому суб’єкту, що цього потребує, вводять щонайменше одну сполуку за будь-яким з пп. 1-32.
48. Спосіб профілактики або лікування запальної хвороби кишок (IBD), у якому суб’єкту, що цього потребує, вводять щонайменше одну сполуку за будь-яким з пп. 1-32.
49. Спосіб профілактики або лікування атеросклерозу, у якому суб’єкту, що цього потребує, вводять щонайменше одну сполуку за будь-яким з пп. 1-32.
50. Спосіб профілактики або лікування діабету, у якому суб’єкту, що цього потребує, вводять щонайменше одну сполуку за будь-яким з пп. 1-32.
51. Спосіб за п. 50, у якому діабет являє собою діабет типу II.
52. Спосіб профілактики або лікування периферичної резистентності до інсуліну, у якому суб’єкту, що цього потребує, вводять щонайменше одну сполуку за будь-яким з пп. 1-32.
53. Спосіб профілактики або лікування дисліпідемії або змішаної дисліпідемії, у якому суб’єкту, що цього потребує, вводять щонайменше одну сполуку за будь-яким з пп. 1-32.
54. Спосіб за п. 53, у якому дисліпідемія являє собою гіпертригліцеридемію.
55. Спосіб профілактики або лікування метаболічного синдрому, у якому суб’єкту, що цього потребує, вводять щонайменше одну сполуку за будь-яким з пп. 1-32.
56. Спосіб зниження кількості холестерину, у якому суб’єкту, що цього потребує, вводять щонайменше одну сполуку за будь-яким з пп. 1-32.
57. Спосіб за п. 56, у якому холестерин являє собою не-ЛПВГ холестерин.
58. Спосіб за п. 56, у якому холестерин являє собою ЛПНГ холестерин та/або ЛПДНГ холестерин.
59. Спосіб збільшення ЛПВГ холестерину, у якому суб’єкту, що цього потребує, вводять щонайменше одну сполуку за будь-яким з пп. 1-32.
60. Застосування щонайменше однієї сполуки за будь-яким з пп. 1-32 для профілактики або лікування запалення.
61. Застосування щонайменше однієї сполуки за будь-яким з пп. 1-32 для профілактики або лікування запальної хвороби кишок (IBD).
62. Застосування щонайменше однієї сполуки за будь-яким з пп. 1-32 для профілактики або лікування ревматоїдного артриту.
63. Застосування щонайменше однієї сполуки за будь-яким з пп. 1-32 для профілактики або лікування атеросклерозу.
64. Застосування щонайменше однієї сполуки за будь-яким з пп. 1-32 для профілактики або лікування діабету.
65. Застосування за п. 64, у якому діабет являє собою діабет типу II.
66. Застосування щонайменше однієї сполуки за будь-яким з пп. 1-32 для профілактики або лікування периферичної резистентності до інсуліну.
67. Застосування щонайменше однієї сполуки за будь-яким з пп. 1-32 для профілактики або лікування дисліпідемії або змішаної дисліпідемії.
68. Застосування за п. 67, у якому дисліпідемія являє собою гіпертригліцеридемію.
69. Застосування щонайменше однієї сполуки за будь-яким з пп. 1-32 для профілактики або лікування метаболічного синдрому.
70. Застосування щонайменше однієї сполуки за будь-яким з пп. 1-32 для зниження кількості холестерину.
71. Застосування за п. 70, у якому холестерин являє собою не-ЛПВГ холестерин.
72. Застосування за п. 70, у якому холестерин являє собою ЛПНГ холестерин та/або ЛПДНГ холестерин.
73. Застосування щонайменше однієї сполуки за будь-яким з пп. 1-32 для збільшення кількості ЛПВГ холестерину.
74. Застосування щонайменше однієї сполуки за будь-яким з пп. 1-32 для зниження маси тіла.
75. Спосіб одержання ліпідної сполуки за п. 1, у якому
а) вводять у реакцію R1-OH з ![]() , за умов реакції заміщення у присутності гідроксиду лужного металу у двофазній суміші, що включає толуол і воду, де LG являє собою відхідну групу, вибрану з мезилатної групи, тозилатної групи та атома галогену; та
, за умов реакції заміщення у присутності гідроксиду лужного металу у двофазній суміші, що включає толуол і воду, де LG являє собою відхідну групу, вибрану з мезилатної групи, тозилатної групи та атома галогену; та
b) виділяють ліпідну сполуку.
76. Спосіб за п. 75, у якому додатково передбачено стадії захищення та зняття захисту.
77. Спосіб за п. 75, у якому основа являє собою гідроксид натрію.
78. Спосіб одержання ліпідної сполуки за п. 1, у якому
а) вводять у реакцію R1-OH з ![]() у реакції заміщення в присутності основи та розчинника за умов реакції Мітсунобу, де LG являє собою відхідну групу, вибрану з мезилатної групи, тозилатної групи та атома галогену; та
у реакції заміщення в присутності основи та розчинника за умов реакції Мітсунобу, де LG являє собою відхідну групу, вибрану з мезилатної групи, тозилатної групи та атома галогену; та
b) виділяють ліпідну сполуку.
79. Спосіб одержання ліпідної сполуки за п. 1, у якому
а) перетворюють R1-OH на R1-LG, застосовуючи взаємоперетворення функціональної групи;
b) вводять у реакцію R1-LG з 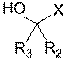 , за умов реакції заміщення у присутності основи та розчинника, де основа являє собою гідроксид лужного металу, та де LG являє собою відхідну групу, вибрану з мезилатної групи, тозилатної групи або атома галогену; та
, за умов реакції заміщення у присутності основи та розчинника, де основа являє собою гідроксид лужного металу, та де LG являє собою відхідну групу, вибрану з мезилатної групи, тозилатної групи або атома галогену; та
с) виділяють ліпідну сполуку.
80. Спосіб одержання 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєнілокси)бутанової кислоти, у якому
a) вводять у реакцію (5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєн-1-ол з трет-бутил-2-бромбутиратом у присутності основи і розчинника, де основа являє собою гідроксид натрію, та де розчинник являє собою толуол;
b) перетворюють складний ефір, одержаний на стадії a), у карбонову кислоту за допомогою додавання кислоти; та
c) виділяють зазначену 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєнілокси)бутанову кислоту.
81. Фармацевтична композиція, що містить ліпідну сполуку формули (I):
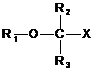 , (I)
, (I)
у якій
R1 являє собою C10-C22алкенільну групу, що має 3-6 подвійних зв’язків;
R2 та R3 є однаковими або різними та вибрані з таких як: атом водню та алкільна група, за умови, що R2 та R3 обидва не являють собою атом водню; та
X являє собою карбонову кислоту або її похідну, де похідна являє собою складний ефір карбонової кислоти, карбоксамід, моногліцерид, дигліцерид або тригліцерид,
або її фармацевтично прийнятну сіль;
та жирову речовину.
82. Фармацевтична композиція, що містить ліпід, вибраний з групи, що складається з
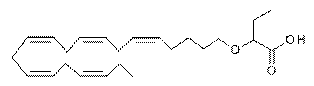
2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєнілокси)бутанової кислоти;
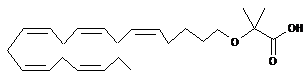
2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєнілокси)-2-метилпропанової кислоти;
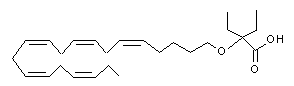
2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєнілокси)бутанової кислоти;
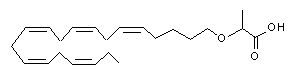
2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєнілокси)пропанової кислоти;
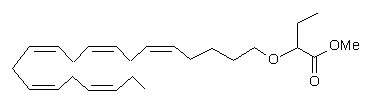
метил-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєн-1-ілокси)бутаноату або
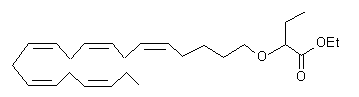
етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаєн-1-ілокси)бутаноату;
та жирову речовину.
83. Ліпідна сполука за п. 0, у якій похідна карбонової кислоти являє собою карбоксамід.
84. Ліпідна сполука за п. 83, у якій карбоксамід вибраний з N-метилкарбоксаміду, N,N-диметилкарбоксаміду, N-етилкарбоксаміду та N,N-діетилкарбоксаміду.
85. Ліпідна сполука за п. 9, де сполука представлена у вигляді рацемату.
86. Спосіб зменшення маси тіла та/або попередження збільшення маси тіла, у якому ссавцю, що цього потребує, вводять фармацевтично активну кількість ліпідної сполуки за будь-яким з пп. 1-32.
87. Ліпідна сполука за п. 32, де ліпідна сполука вибрана з групи, що включає:
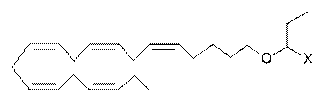 ;
;
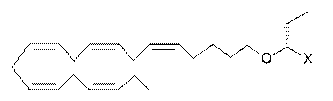 або
або
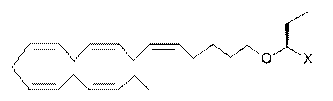 ,
,
де X є похідною карбонової кислоти, що являє собою карбоксамід.
88. Ліпідна сполука за п. 87, у якій карбоксамід вибраний з N-метилкарбоксаміду, N,N-диметилкарбоксаміду та N-етилкарбоксаміду.
89. Ліпідна сполука за будь-яким з пп. 1-32 для застосування у профілактиці або лікуванні жирової дистрофії печінки, що передбачає введення суб’єкту, який цього потребує, принаймні однієї сполуки за будь-яким з пп. 1-32.
90. Ліпідна сполука за п. 89, де жирова дистрофія печінки являє собою неалкогольну жирову дистрофію печінки (NAFLD).
91. Ліпідна сполука за будь-яким з пп. 1-32 для застосування у профілактиці або лікуванні ожиріння або стану надмірної маси тіла, що передбачає введення суб’єкту, який цього потребує, принаймні однієї сполуки за будь-яким з пп. 1-32.
92. Фармацевтична композиція, що містить ліпідну сполуку за будь-яким з пп. 1-32, для застосування у профілактиці або лікуванні жирової дистрофії печінки, що передбачає введення суб’єкту, який цього потребує, принаймні однієї сполуки за будь-яким з пп. 1-32.
93. Фармацевтична композиція за п. 92, де жирова дистрофія печінки являє собою неалкогольну жирову дистрофію печінки (NAFLD).
94. Фармацевтична композиція, що містить ліпідну сполуку за будь-яким з пп. 1-32, для застосування у профілактиці або лікуванні ожиріння або стану надмірної маси тіла, що передбачає введення суб’єкту, який цього потребує, принаймні однієї сполуки за будь-яким з пп. 1-32.
Текст
Реферат: Даний винахід стосується ліпідних сполук загальної формули (І): R1-O-C(R2)(R3)-X, (I) де R1 являє собою С10-С22алкільну групу, С10-С22алкенільну групу, що має 1-6 подвійних зв'язків, або С10-С22алкінільну групу, що має 1-6 потрійних зв'язків; R2 та R3 є однаковими або різними та можуть бути вибрані з різних замісників; та X являє собою карбонову кислоту або її похідну, таку як складний ефір карбонової кислоти, ангідрид карбонової кислоти, фосфоліпід, тригліцерид або карбоксамід; або їх фармацевтично прийнятної солі, сольвату, сольвату такої солі або проліків. Дане розкриття також стосується фармацевтичних композицій та ліпідних композицій, що включають щонайменше одну сполуку відповідно до даного розкриття, та застосування таких сполук як лікарських засобів у терапії, зокрема для лікування хвороб, пов'язаних з серцево UA 109528 C2 (12) UA 109528 C2 судинними, метаболічними та запальними розладами системи. UA 109528 C2 5 Пріоритет Дана заявка заявляє пріоритет до Попередньої патентної заявки США № 61/176,503, поданої 8 травня 2009 року, зміст якої включено у даний опис шляхом посилання. Галузь винаходу Даний винахід відноситься до ліпідних сполук загальної формули (I): R2 R1 O C X R3 10 15 20 25 30 35 40 45 50 55 (I) у якій R1 являє собою C10-C22 алкільну групу, C10-C22 алкенільну групу, що має 1-6 подвійних зв’язків, або C10-C22 алкінільну групу, що має 1-6 потрійних зв’язків; R2 та R3 є однаковими або різними та можуть бути вибрані з таких як: атом водню, гідрокси група, алкільна група, атом галогену, алкокси група, ацилокси група, ацильна група, алкенільна група, алкінільна група, арильна група, алкілтіо група, алкоксикарбонільна група, карбокси група, алкілсульфінільна група, алкілсульфонільна група, аміно група, та алкіламіно група, за умови, що R2 та R3 обидва не можуть бути атомом водню; або R2 та R3 разом утворюють циклоалкільну групу, таку як циклопропан, циклобутан, циклопентан або циклогексан; X являє собою карбонову кислоту або її похідну, таку як складний ефір карбонової кислоти, ангідрид карбонової кислоти, карбоксамід, фосфоліпід, моногліцерид, дигліцерид або тригліцерид; або їх фармацевтично прийнятної солі, сольвату, сольвату такої солі або проліків. У варіантах втілення, коли R2 та R3 є різними, сполуки формули (I) здатні існувати у стереоізомерних формах. Зрозуміло, що даний винахід охоплює всі оптичні ізомери сполук формули (I) та їх суміші. Дане розкриття також відноситься до фармацевтичних композицій та ліпідних композицій, що включають щонайменше одну сполуку формули (I). Крім того, дане розкриття включає сполуки формули (I) для застосування як лікарські засоби або для застосування у терапії, наприклад, для лікування хвороб, пов’язаних з серцево-судинними, метаболічними та запальними хворобливими областями. Передумови створення винаходу Харчові поліненасичені жирні кислоти (PUFA) впливають на різні фізіологічні процеси, роблячи вплив на нормальне здоров’я та хронічні хвороби, такий як регулювання рівнів ліпідів у плазмі, серцево-судинних та імунних функцій, дія інсуліну, нейрональний розвиток та зорова функція. Завдяки їх обмеженій стабільності in vivo та їх недостатності біологічної специфічності, PUFA кислоти не досягли широко розповсюдженого застосування як терапевтичні засоби. Хімічні модифікації n-3 поліненасичених жирних кислот зроблені декількома дослідницькими групами для того, щоб змінити або підвищити їх вплив. Наприклад, гіполіпідемічні ефекти (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаенової кислоти (DHA) посилюються введенням заміснику у α-положення (4Z,7Z,10Z,13Z,16Z,19Z)-етил-докоза-4,7,10,13,16,19-гексаеноату (DHA EE). (WO 2006/117664) Повідомлялося, що у хворих на ожиріння мишей, яких годували їжею з високим вмістом жиру, яких лікували альфа-заміщеними DHA похідними, запобігали появі та обертали ожиріння та непереносимість глюкози. (Rossmeisl, M., et al., Obesity (Silver Spring) 2009 Jan 15.) Декілька дослідницьких груп одержали ненасичені жирні кислоти з киснем, включеним у βположення (Flock, S. et al., Acta Chemica Scandinavica, (1999) 53: 436 та Pitt, MJ, et al., Synthesis, (1997) 1240-42). Розроблена нова група похідних жирних кислот, що об’єднують атом кисню у β-положенні з α-замісником, представлена загальною формулою (I). Ці нові жирні кислоти знижують рівні ліпідів у моделі дисліпідемічних мишей до більшого ступеня, ніж поліненасичені жирні кислоти природного походження. Опис Фігур Фігура 1: Холестеринові та тригліцеридні рівні у APOE*3Leiden мишей після введення одного варіанту втілення даного розкриття та Omacor™. Фігура 2: Холестеринові та тригліцеридні рівні у APOE*3Leiden.CETP мишей після введення 1 UA 109528 C2 5 одного варіанту втілення даного розкриття та фенофібрату. Фігура 3: Рівні ЛПВГ (ліпопротеїнів високої густини) у APOE*3Leiden.CETP мишей після введення одного варіанту втілення даного розкриття та фенофібрату. Короткий опис винаходу Одна ціль даного розкриття забезпечує ліпідні сполуки, що мають покращену біологічну активність у порівнянні з поліненасиченими жирними кислотами природного походження. Ця ціль може бути досягнута за допомогою ліпідної сполуки формули (I) R2 R1 O C X R3 10 15 20 25 30 35 40 45 50 55 (I). Наприклад, дане розкриття відноситься до сполук формули (I), у якій: R1 являє собою C10-C22 алкільну групу, C10-C22 алкенільну групу, що має 1-6 подвійних зв’язків, або C10-C22 алкінільну групу, що має 1-6 потрійних зв’язків; R2 та R3 є однаковими або різними та можуть бути вибрані з таких як: атом водню, гідрокси група, алкільна група, атом галогену, алкокси група, ацилокси група, ацильна група, алкенільна група, алкінільна група, арильна група, алкілтіо група, алкоксикарбонільна група, карбокси група, алкілсульфінільна група, алкілсульфонільна група, аміно група, та алкіламіно група, за умови, що R2 та R3 обидва не можуть бути атомом водню; або R2 та R3 разом можуть утворювати циклоалкільну групу, таку як циклопропан, циклобутан, циклопентан або циклогексан; X являє собою карбонову кислоту або її похідну, таку як складний ефір карбонової кислоти, ангідрид карбонової кислоти, карбоксамід, фосфоліпід або тригліцерид; або їх фармацевтично прийнятної солі, сольвату, сольвату такої солі або проліків. У щонайменше одному варіанті втілення, алкільна група може бути вибрана з таких як: метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил, та н-гексил. Алкенільна група може бути вибрана з таких як: аліл, 2-бутеніл, та 3-гексеніл. Алкінільна група може бути вибрана з таких як: пропаргіл, 2-бутиніл, та 3-гексиніл. Атом галогену може бути вибраний з таких як: фтор, хлор, бром та йод. Алкокси група може бути вибрана з таких як: метокси, етокси, пропокси, ізопропокси, втор-бутокси, фенокси, бензилокси, OCH2CF3, та OCH2CH2OCH3. Ацилокси група може бути вибрана з таких як: ацетокси, пропіонокси та бутирокси. Арильна група являє собою фенільну групу. Алкілтіо група може бути вибрана з таких як: метилтіо, етилтіо, ізопропілтіо та фенілтіо. Алкоксикарбонільна група може бути вибрана з таких як: метоксикарбоніл, етоксикарбоніл, пропоксикарбоніл та бутоксикарбоніл. Алкілсульфінільна група може бути вибрана з таких як: метансульфініл, етансульфініл та ізопропансульфініл. Алкілсульфонільна група може бути вибрана з таких як: метансульфоніл, етансульфоніл, та ізопропансульфоніл. Алкіламіно група може бути вибрана з таких як: метиламіно, диметиламіно, етиламіно, та діетиламіно група. Карбоксильна група може бути вибрана з таких як: етил-карбоксилат, метилкарбоксилат, н-пропіл-карбоксилат, ізопропіл- карбоксилат, н-бутил-карбоксилат, втор-бутилкарбоксилат, та н-гексил-карбоксилат. Карбоксамідна група може бути вибрана з таких як: карбоксаміди, такі як N-метил-карбоксамід, N,N-диметил-карбоксамід, N-етил-карбоксамід та N,N-діетил-карбоксамід. У щонайменше одному варіанті втілення даного винаходу, один із замісників R2 та R3 сполуки формули (I) являє собою водень та інший вибирають з таких як: гідрокси група, алкільна група, атом галогену, алкокси група, ацилокси група, ацильна група, алкенільна група, алкінільна група, арильна група, алкілтіо група, алкоксикарбонільна група, карбокси група, алкілсульфінільна група, алкілсульфонільна група, аміно група, та алкіламіно група. У іншому варіанті втілення даного винаходу, замісники R2 та R3 сполуки формули (I) є однаковими або різними та можуть бути вибрані з таких як: гідрокси група, алкільна група, атом галогену, алкокси група, ацилокси група, ацильна група, алкенільна група, алкінільна група, арильна група, алкілтіо група, алкоксикарбонільна група, карбокси група, алкілсульфінільна група, алкілсульфонільна група, аміно група. Наприклад, R2 та R3 можуть бути вибрані з таких як: метил, етил, н-пропіл або ізопропіл. Коли походить з або отримують з поліненасиченої жирної кислоти, R1 являє собою, як правило, C10-C22 алкенільну групу з 3-6 подвійними зв’язками, наприклад, 3-6 перерваними метиленом подвійними зв’язками у Z конфігурації. Наприклад, R1 можуть бути вибрані з таких як: C15 алкеніл з 4 перерваними метиленом подвійними зв’язками у Z-конфігурації, C18 алкеніл з 3-5 подвійними зв’язками, наприклад, C18 алкеніл з 5 перерваними 2 UA 109528 C2 5 метиленом подвійними зв’язками у Z конфігурації, C20 алкеніл з 5 перерваними метиленом подвійними зв’язками у Z конфігурації, або C22 алкеніл з 6 перерваними метиленом подвійними зв’язками у Z конфігурації. Більше того, R1 може являти собою C10-C22 алкінільну групу, наприклад, C16-C22 алкініл з 1-6 потрійними зв’язками. Дане розкриття також відноситься до солей сполуки формули (I). Такі солі можуть бути представлені за допомогою , 10 + + + + де X являє собою COO , та Z може являти собою NH4 , металічний іон, такий як Li , Na або K , протонований первинний амін, такий як трет-бутил-амоній, (3s,5s,7s)-адамантан-1-амоній, 1,3-дигідрокси-2-(гідроксиметил)пропан-2-амоній, або протонований амінопіридин (наприклад, піридин-2-амоній), протонований вторинний амін, такий як діетиламоній, 2,3,4,5,6-пентагідроксиN-метилгексан-1-амоній, N-етилнафталін-1-амоній, протонований третинний амін, такий як 4метилморфолін-4-іум, протонований гуанідин, такий як аміно((4-аміно-4карбоксибутил)аміно)метанімініум або протонований гетероцикл, такий як 1H-імідазол-3-іум, або за допомогою + 15 20 2+ де X = COO , та Z може являти собою Mg етан-1,2-діамоній або піперазин-1,4-дііум. Інша типова сіль являє собою 2+ 2+ або Ca , або дипротонований діамін, такий як 25 де X являє собою COO , та Z n+ являє собою протонований хітозан: 30 Більше того, дане розкриття відноситься до сполук формули (I), у яких X являє собою карбонову кислоту у формі фосфоліпіду. Такі сполуки можуть бути представлені наступними формулами (II-IV), 3 UA 109528 C2 (II) де W являє собою: , , 5 , або 10 та (III) де W являє собою: 15 , 4 UA 109528 C2 , , або 5 та (IV) 10 де W являє собою: , , 15 , або 20 Сполуки формули (I), у якій X являє собою карбонову кислоту у формі тригліцериду, 1,2дигліцериду, 1,3-дигліцериду, 1-моногліцериду та 2-моногліцериду, також включаються у дане розкриття. Нижче вони представлені формулами (V), (VI), (VII), (VIII) та (IX), відповідно. 5 UA 109528 C2 O R3 O R2 O R1 R1 O R2 O R3 O O R3 O R2 O R1 (V) O R3 O R2 O R1 R1 O R2 O R3 O HO (VI) 5 O O OH R1 O R2 R3 O R3 O R2 O R1 (VII) O O OH R1 O R2 R3 HO (VIII) 6 UA 109528 C2 OH O O OH R1 O R2 5 10 15 20 25 30 35 40 45 50 R3 (IX) Сполуки формули (I) здатні існувати у стереоізомерних формах. Зрозуміло, що даний винахід охоплює всі оптичні ізомери сполук формули (I) та їх суміші. Отже, сполуки формули (I), які існують як діастереомери, рацемати та енантіомери, включаються у обсяг даного розкриття. Дане розкриття також відноситься щонайменше до однієї ліпідної сполуки відповідно до формули (I) для застосування як лікарський засіб. У додатковому варіанті втілення, дане розкриття забезпечує біологічно активну добавку, харчову добавку або нутрицевтик, що містить ліпідну сполуку формули (I). Така біологічно активна добавка може бути одержана для введення будь-яким шляхом введення. Наприклад, біологічно активна добавка може бути введена як рідкий нутрицевтик або як напій. Біологічно активна добавка може бути у формі капсули, наприклад, желатинової капсули, та ця капсула може бути ароматизованою. У ще одному додатковому варіанті втілення, дане розкриття забезпечує фармацевтичну композицію, що містить щонайменше одну сполуку формули (I), необов’язково разом з одним або більшою кількістю фармацевтично прийнятних носіїв або наповнювачів. Нові ліпідні сполуки та композиції даного розкриття можуть бути сформульовані у зручних пероральних формах введення, наприклад, таких як таблетки, покриті таблетки, капсули, порошки, гранули, розчини, дисперсії, суспензії, сиропи, емульсії та спреї, використовуючи звичайно застосовувані наповнювачі, наприклад, такі як розчини, розріджувачі, зв’язуючі речовини, підсолоджувачі, ароматизатори, модифікатори pH, модифікатори в’язкості, антиоксиданти, кукурудзяний крохмаль, лактоза, глюкоза, мікрокристалічна целюлоза, стеарат магнію, полівінілпіролідон, лимонна кислота, винна кислота, вода, етанол, гліцерин, сорбіт, поліетиленгліколь, пропілен-гліколь, цетилстеариловий спирт, карбоксиметилцелюлоза, або жирні речовини, такі як твердий жир, або їх підходящі суміші. Звичайні технологій формулювання, добре відомі у даній галузі техніки, можуть бути використані для формулювання ліпідних сполук відповідно до даного розкриття. Композиції можуть бути введені за допомогою звичайно використовуваних шляхів введення, наприклад, перорально. Застосування композицій, що можуть бути введені перорально, наприклад, таких як таблетки, покриті таблетки, капсули або сиропи, включаються у обсяг даного розкриття. Наприклад, у деяких варіантах втілення, композиція може бути у формі желатинової капсули, таблетки або саше. Підходяща щоденна доза щонайменше однієї сполуки у відповідності із формулою (I) може коливатися у інтервалі від приблизно 1 мг до приблизно 3 г. Наприклад, у деяких варіантах втілення, щоденна доза коливається у інтервалі від приблизно 1 мг до приблизно 10 г, від приблизно 50 мг до приблизно 1 г, від приблизно 10 мг до приблизно 2 г, від приблизно 50 мг до приблизно 500 мг, від приблизно 50 мг до приблизно 200 мг, від приблизно 100 мг до приблизно 1 г, від приблизно 100 мг до приблизно 500 мг, або від приблизно 100 мг до приблизно 250 мг. Фармацевтична композиція відповідно до даного розкриття може бути використана як лікарський засіб. Дане розкриття також відноситься до ліпідних композицій, що включають щонайменше одну ліпідну сполуку відповідно до формули (I). Відповідно, ліпідна композиція може включати щонайменше 60% за масою, або щонайменше 80% за масою щонайменше однієї сполуки формули (I). Ліпідна композиція може додатково включати фармацевтично прийнятний антиоксидант, наприклад, токоферол або 3-BHA. Далі, дане розкриття відноситься до ліпідної композиції для застосування як лікарський засіб. Додатково, дане розкриття відноситься до використання ліпідної сполуки відповідно до формули (I) для застосування у: активації або модуляції щонайменше однієї з ізоформ α, γ або δ людського рецептору, що активується проліфератором пероксисом (PPAR), де зазначена сполука, наприклад, являє 7 UA 109528 C2 5 10 15 20 25 30 35 40 45 50 собою пан-агоніст або модулятор, профілактиці або лікуванні запального стану, профілактиці або лікуванні ревматоїдного артриту, профілактиці або лікуванні запальної хвороби кишок, профілактиці або лікуванні метаболічного синдрому, профілактиці та/або лікуванні дисліпідемічного стану, наприклад, гіпертригліцеридемії (HTG), профілактиці та/або лікуванні підвищених тригліцеридних рівнів, ЛПНГ (ліпопропеїн низької густини) холестеринових рівнів, та/або ЛПДНГ (ліпопропеїн дуже низької густини) холестеринових рівнів, лікуванні та/або профілактиці ожиріння або стану надмірної маси тіла, зниженні маси тіла та/або для профілактики набирання маси тіла, лікуванні та/або профілактиці жирової дистрофії печінки, наприклад, неалкогольної жирової дистрофії печінки (NAFLD), лікуванні та/або профілактиці запальної хвороби або стану, лікуванні та/або профілактиці атеросклерозу, лікуванні та/або профілактиці периферичної резистентності до інсуліну та/або діабетичного стану, лікуванні та/або профілактиці діабету типу 2, або зниженні інсуліну у плазмі, глюкози у крові та/або тригліцеридів у сироватці. Дане розкриття також відноситься до ліпідних сполук відповідно до формули (I) для лікування описаних вище станів, та до способів для лікування та/або профілактики станів, перерахованих вище, що включають введення ссавцю, якому це необхідно, фармацевтично ефективної кількості сполуки відповідно до формули (I). Крім того, дане розкриття охоплює способи виробництва ліпідних сполук формули (I). Вихідний матеріал, наприклад, може походити з овочевого, мікробного та/або тваринного джерела, такого як масло морської риби. У щонайменше одному варіанті втілення використовують масло морської риби або масло криля. Детальний опис Дані винахідники знайшли, що сполуки формули (I) мають помітно гарну фармацевтичну активність. Як використано у цьому описі, термін “ліпідна сполука” відноситься до аналогів жирної кислоти, що походять, наприклад, з насичених жирних кислот, мононенасичених жирних кислот, поліненасичених жирних кислот та ліпідів, що включають 1-6 потрійних зв’язків. Слід розуміти, що “походить з” включає одержання сполук формули (I) з жирних кислот, таких як насичені жирні кислоти, мононенасичені жирні кислоти, поліненасичені жирні кислоти та ліпіди, що включають 1-6 потрійних зв’язків. Такі жирні кислоти можуть бути природними або синтетичними. "Фармацевтично ефективна кількість" відноситься до кількості, яка буде вести до бажаних фармакологічних та/або терапевтичних ефектів, тобто кількості розкритого продукту, яка є ефективною для досягнення її наміченої цілі. В той час як потреби окремих пацієнтів можуть змінюватися, визначення оптимальних інтервалів для ефективних кількостей розкритого продукту знаходиться у межах даного рівня техніки. В основному, дозовий режим для лікування стану розкритим продуктом даного винаходу вибирають у відповідності з цілим рядом факторів, включаючи тип, вік, масу, стать, дієту та медичний стан пацієнта. Під “фармацевтичною композицією” розуміють ліпідну сполуку відповідно до даного розкриття у будь-якій формі, придатній для використання для медичної цілі. “Лікування” включає будь-яке терапевтичне застосування, яке може бути корисним для людини або нелюдського ссавця. Як медицина для людей, так і ветеринарні лікування, знаходяться у межах даного розкриття. Лікування може бути у відношенні існуючого стану або воно може бути профілактичним, наприклад, попереджуючим. Жирні кислоти являють собою лінійно-ланцюгові вуглеводні, що мають карбоксильну (COOH) групу на одному кінці (α) та (як правило) метильну групу на іншому (ω) кінці. У хімії, нумерація атомів вуглецю починається з α кінця. 55 8 UA 109528 C2 5 10 α вуглець відноситься до першого атому вуглецю після атому вуглецю, який прикріплений до функціональної групи, та другий атом вуглецю являє собою β вуглець. Як використано у цьому описі, вираз “перервані метиленом подвійні зв’язки” відноситься до випадку, коли метиленова група (-CH2-) розташована між двома подвійними зв’язками у вуглецевому ланцюзі ліпідної сполуки. Більш переважно, винахідники неочікувано виявили, що наступні ліпідні сполуки категорій AD є особливо кращими. Категорія A походить з насичених жирних кислот R1 являє собою C10-C22 алкіл Приклад i: R1 = C14 15 Категорія B походить з мононенасичених жирних кислот R1 являє собою C10-C22 алкеніл, що має 1 подвійний зв’язок 20 Приклад ii: R1 = C18 25 Приклад iii: R1 = C14 30 Категорія C: походить з поліненасичених жирних кислот R1 являє собою C20 алкеніл, що має 5 подвійних зв’язків 35 Приклад iv: R1 = C20 з 5 перерваними метиленом подвійними зв’язками у Z-конфігурації 40 Категорія D: походить з поліненасичених жирних кислот R1 являє собою C22 алкеніл, що має 6 подвійних зв’язків Приклад v: R1 = C22 з 6 перерваними метиленом подвійними зв’язками у Z-конфігурації 45 Категорія E: походить з поліненасичених жирних кислот 9 UA 109528 C2 R1 являє собою C18 алкеніл, що має 3 подвійних зв’язки Приклад vi: R1 = C18 з 3 перерваними метиленом подвійними зв’язками у Z-конфігурації 5 10 Категорія F: походить з поліненасичених жирних кислот R1 являє собою C15 алкеніл, що має 4 подвійних зв’язки Приклад vii: R1 = C15 з 4 перерваними метиленом подвійними зв’язками у Z-конфігурації 15 Категорія G: походить з поліненасичених жирних кислот R1 являє собою C18 алкеніл, що має 5 подвійних зв’язків 20 Приклад viii: R1 = C18 з 5 перерваними метиленом подвійними зв’язками у Z-конфігурації 25 Категорія H: X являє собою карбонову кислоту у формі тригліцериду, дигліцериду, моногліцериду або фосфоліпіду 30 Приклад ix: X = карбонова кислота у формі тригліцериду 35 Приклад x: X = карбонова кислота у формі 2-моногліцериду 10 UA 109528 C2 Категорія I X являє собою карбоксилатну сіль Приклад xi: 5 10 n = 1 або 2 Категорія J походить з ліпідів, що включають 1-6 потрійних зв’язків R1 являє собою C10-C22 алкініл Приклад xii: R1 = C14 з 1 потрійним зв’язком 15 20 25 30 35 Сполуки категорій A-J, представлених вище, де R2 та R3 є різними, здатні існувати у стереоізомерних формах, тобто охоплюються всі оптичні ізомери сполук та їх суміші. Отже, зазначені сполуки можуть бути присутніми як діастереомери, рацемати та енантіомери. Специфічні приклади кращих ліпідних сполук відповідно до даного розкриття включають такі як: Категорія A: 2-(Тетрадецилокси)бутанова кислота (1) R1 = C14H29, R2 = етил, R3 = H та X = COOH 2-етил-2-(тетрадецилокси)бутанова кислота (2) R1 = C14H29, R2 = R3 = етил та X = COOH 2-(тетрадецилокси)пропанова кислота (3) R1 = C14H29, R2 = метил, R3 = H та X = COOH 2-метил-2-(тетрадецилокси)пропанова кислота (4) R1 = C14H29, R2 = R3 = метил та X = COOH 11 UA 109528 C2 5 2-метокси-2-(тетрадецилокси)оцтова кислота (5) R1 = C14H29, R2 = метокси, R3 = H та X = COOH 2-етокси-2-(тетрадецилокси)оцтова кислота (6) R1 = C14H29, R2 = етокси, R3 = H та X = COOH 10 Категорія B: 15 (Z)-2-(тетрадец-6-ен-1-ілокси)бутанова кислота (7) R1 = C14H27, R2 = етил, R3 = H та X = COOH (Z)-2-етил-2-(тетрадец-6-ен-1-ілокси)бутанова кислота (8) R1 = C14H27, R2 = R3 = етил та X = COOH 20 (Z)-2-(тетрадец-6-ен-1-ілокси)пропанова кислота (9) R1 = C14H27, R2 = метил, R3 = H та X = COOH 25 30 (Z)-2-метил-2-(тетрадец-6-ен-1-ілокси)пропанова кислота (10) R1 = C14H27, R2 = R3 = метил та X = COOH (Z)-2-метокси-2-(тетрадец-6-ен-1-ілокси)оцтова кислота (11) R1 = C14H27, R2 = метокси, R3 = H та X = COOH 12 UA 109528 C2 (Z)-2-етокси-2-(тетрадец-6-ен-1-ілокси)оцтова кислота (12) R1 = C14H27, R2 = етокси, R3 = H та X = COOH 5 Категорія C: 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутанова кислота (13) R1 = C20H31, R2 = етил, R3 = H та X = COOH 10 2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутанова кислота (14) R1 = C20H31, R2 = R3 = етил та X = COOH 15 20 25 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)пропанова кислота (15) R1 = C20H31, R2 = метил, R3 = H та X = COOH 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)-2-метилпропанова кислота (16) R1 = C20H31, R2 = R3 = метил та X = COOH 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)-2-метоксиоцтова кислота (17) R1 = C20H31, R2 = метокси, R3 = H та X = COOH 2-етокси-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)оцтова кислота (18) R1 = C20H31, R2 = етокси, R3 = H та X = COOH 30 Категорія D: 13 UA 109528 C2 2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаен-1-ілокси)бутанова кислота (19) R1 = C22H33, R2 = етил, R3 = H та X = COOH 5 10 2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаен-1-ілокси)-2-етилбутанова кислота (20) R1 = C22H33, R2 = R3 = етил та X = COOH 2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаен-1-ілокси)пропанова кислота (21) R1 = C22H33, R2 = метил, R3 = H та X = COOH 15 2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаен-1-ілокси)-2-метилпропанова кислота (22) R1 = C22H33, R2 = R3 = метил та X = COOH 20 2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаен-1-ілокси)-2-метоксиоцтова кислота (23) R1 = C22H33, R2 = метокси, R3 = H та X = COOH 25 2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаен-1-ілокси)-2-етоксиоцтова кислота (24) R1 = C22H33, R2 = етокси, R3 = H та X = COOH Категорія E: 30 2-((9Z,12Z,15Z)-октадека-9,12,15-триен-1-ілокси)бутанова кислота (25) R1 = C18H31, R2 = етил, R3 = H та X = COOH 14 UA 109528 C2 2-етил-2-((9Z,12Z,15Z)-октадека-9,12,15-триен-1-ілокси)бутанова кислота (26) R1 = C18H31, R2 = R3 = етил та X = COOH 5 10 15 2-((9Z,12Z,15Z)-октадека-9,12,15-триен-1-ілокси)пропанова кислота (27) R1 = C18H31, R2 = метил, R3 = H та X = COOH 2-метил-2-((9Z,12Z,15Z)-октадека-9,12,15-триен-1-ілокси)пропанова кислота (28) R1 = C18H31, R2 = R3 = метил та X = COOH 2-метокси-2-((9Z,12Z,15Z)-октадека-9,12,15-триен-1-ілокси)оцтова кислота (29) R1 = C18H31, R2 = метокси, R3 = H та X = COOH 2-етокси-2-((9Z,12Z,15Z)-октадека-9,12,15-триен-1-ілокси)оцтова кислота (30) R1 = C18H31, R2 = етокси, R3 = H та X = COOH 20 Категорія F: 25 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраен-1-ілокси)бутанова кислота (31) R1 = C15H23, R2 = етил, R3 = H та X = COOH 2-етил-2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраен-1-ілокси)бутанова кислота (32) R1 = C15H23, R2 = R3 = етил та X = COOH 30 15 UA 109528 C2 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраен-1-ілокси)пропанова кислота (33) R1 = C15H23, R2 = метил, R3 = H та X = COOH 5 10 2-метил-2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраен-1-ілокси)пропанова кислота (34) R1 = C15H23, R2 = R3 = метил та X = COOH 2-метокси-2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраен-1-ілокси)оцтова кислота (35) R1 = C15H23, R2 = метокси, R3 = H та X = COOH 2-етокси-2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраен-1-ілокси)оцтова кислота (36) R1 = C15H23, R2 = етокси, R3 = H та X = COOH 15 Категорія G: 20 2-((3Z,6Z,9Z,12Z,15Z)-октадека-3,6,9,12,15-пентаен-1-ілокси)бутанова кислота (37) R1 = C18H27, R2 = етил, R3 = H та X = COOH 2-етил-2-((3Z,6Z,9Z,12Z,15Z)-октадека-3,6,9,12,15-пентаен-1-ілокси)бутанова кислота (38) R1 = C18H27, R2 = R3 = етил та X = COOH 25 2-((3Z,6Z,9Z,12Z,15Z)-октадека-3,6,9,12,15-пентаен-1-ілокси)пропанова кислота (39) R1 = C18H27, R2 = метил, R3 = H та X = COOH 30 2-метил-2-((3Z,6Z,9Z,12Z,15Z)-октадека-3,6,9,12,15-пентаен-1-ілокси)пропанова кислота (40) R1 = C18H27, R2 = R3 = метил та X = COOH 16 UA 109528 C2 2-метокси-2-((3Z,6Z,9Z,12Z,15Z)-октадека-3,6,9,12,15-пентаен-1-ілокси)оцтова кислота (41) R1 = C18H27, R2 = метокси, R3 = H та X = COOH 5 2-етокси-2-((3Z,6Z,9Z,12Z,15Z)-октадека-3,6,9,12,15-пентаен-1-ілокси)оцтова кислота (42) R1 = C18H27, R2 = етокси, R3 = H та X = COOH Категорія H: 10 пропан-1,2,3-триіл тріс(2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноат) (43) R1 = C20H31, R2 = етил, R3 = H та X = карбонова кислота у формі тригліцериду 15 1,3-дигідроксипропан-2-іл 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1ілокси)бутаноат (44) R1 = C20H31, R2 = етил, R3 = H та X = карбонова кислота у формі 2-моногліцериду 20 Категорія I: 25 натрію 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноат (45) + + R1 = C18H31, R2 = етил, R3 = H, X = COO та Z являє собою Na . калію 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноат (46). + + R1 = C18H31, R2 = етил, R3 = H, X = COO та Z являє собою K . 30 17 UA 109528 C2 амонію 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноат (47) + + R1 = C18H31, R2 = етил, R3 = H, X = COO та Z являє собою NH4 . 5 10 15 20 трет-бутил-амонію 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноат (48). + R1 = C18H31, R2 = етил, R3 = H, X = COO та Z являє собою трет-бутил-амоній. 1,3-дигідрокси-2-(гідроксиметил)пропан-2-амоніуму 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17пентаен-1-ілокси)бутаноат (49). + R1 = C18H31, R2 = етил, R3 = H, X = COO та Z являє собою 1,3-дигідрокси-2(гідроксиметил)пропан-2-амоній. магнію 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноат (50). 2+ 2+ R1 = C18H31, R2 = етил, R3 = H, X = COO та Z являє собою Mg . кальцію 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноат (51). 2+ 2+ R1 = C18H31, R2 = етил, R3 = H, X = COO та Z являє собою Ca . Категорія J: 25 2-(тетрадец-12-инілокси)бутанова кислота (52) R1 = C14H25, R2 = етил, R3 = H та X = COOH 18 UA 109528 C2 2-етил-2-(тетрадец-12-ин-1-ілокси)бутанова кислота (53) R1 = C14H25, R2 = R3 = етил та X = COOH 5 2-(тетрадец-12-ин-1-ілокси)пропанова кислота (54) R1 = C14H25, R2 = метил, R3 = H та X = COOH 10 15 20 2-метил-2-(тетрадец-12-ин-1-ілокси)пропанова кислота (55) R1 = C14H25, R2 = R3 = метил та X = COOH 2-метокси-2-(тетрадец-12-инілокси)оцтова кислота (56) R1 = C14H25, R2 = метокси, R3 = H та X = COOH 2-етокси-2-(тетрадец-12-ин-1-ілокси)оцтова кислота (57) R1 = C14H25, R2 = етокси, R3 = H та X = COOH Специфічні варіанти втілення сполук відповідно до даного розкриття включають наступні. 25 Загальні способи синтезу для сполук, розкритих у цьому описі. Сполуки загальної формули (I) можуть бути одержані за наступними загальними процедурами: Спосіб I: 30 Спосіб II: 19 UA 109528 C2 Спосіб III: 5 10 15 20 25 30 35 40 45 50 55 Спирти формули (X), описані у способі I, II та III, можуть бути одержані безпосередньо зі складних ефірів карбонових кислот, наприклад, жирних кислот природного походження; наприклад, таких як альфа-ліноленова кислота, кон’югована лінолева кислота, або ейкозапентаенова кислота (EPA), шляхом відновлення відновлюючим агентом, таким як o o алюмогідрид літію (LAH) або діізобутил алюмогідрид (DIBAL-H) при -10 C - 0 C. Спирти також можуть бути одержані шляхом розкладання поліненасичених жирних кислот, таких як EPA та DHA, як описано Holmeide et al. (J.Chem. Soc., Perkin Trans. 1 (2000) 2271.) У цьому випадку, можна почати з очищених EPA або DHA, або також можна почати з риб’ячого жиру, що містить EPA та DHA. Сполуки формули (XI) та (XII) є комерційно доступними, або вони є відомими у літературі, або їх одержують за стандартними способами, відомими у даній галузі техніки. Відхідна група (LG), присутня у сполуках формули (XI), наприклад, може являти собою мезилат, тозилат або підходящий галоген, такий як бром. Інші відхідні групи будуть зрозумілі кваліфікованому у даній галузі техніки спеціалісту. Використовуючи спосіб I, спирти формули (X) можуть взаємодіяти у реакції заміщення зі сполукою формули (XI) у присутності основи, такої як гідроксид лужного металу, наприклад, NaOH у відповідній системі розчинників. Підходящі системи розчинників включають двофазну суміш толуолу та води. У тих випадках, коли R2 та/або R3, присутні у сполуці формули (XI), являють собою водень, стадія алкілування може бути додана до послідовності (Стадія II) для того, щоб замінити один або обидва з цих галогенів на алкільну групу. Таке алкілування може бути здійснене шляхом обробки продукту зі Стадії I алкільною групою, що несе підходящу відхідну групу, наприклад, галоген, такий як бром або йод, або інші відхідні групи, які будуть очевидні спеціалісту, ординарно кваліфікованому у даній галузі техніки, у присутності основи, такої як LDA у відповідній системі розчинників. Використовуючи спосіб II, спирти формули (X) можуть бути перетворені, використовуючи взаємоперетворення функціональної групи, за способами, відомими спеціалістам, кваліфікованим у даній галузі техніки, до сполук, у яких кінцеву гідрокси групу перетворюють у підходящу відхідну групу (LG). Підходящі відхідні групи включають бром, мезилат та тозилат, або інші, які будуть очевидні спеціалісту, ординарно кваліфікованому у даній галузі техніки. Ці сполуки можуть бути додатково введені (стадія IV) у реакцію заміщення з відповідно заміщеними похідними гідрокси-оцтової кислоти (сполуки формули XII), у присутності основи у відповідній системі розчинників. Використовуючи спосіб III, спирт формули (X) може бути введений у реакцію з відповідно заміщеними похідними гідрокси-оцтової кислоти (сполуки формули XII), за класичних або некласичних умов Мітсунобі, використовуючи способи, відомі спеціалістам, кваліфікованим у даній галузі техніки. Якщо використовувані похідні кислоти являють собою складні ефіри карбонової кислоти, гідроліз може бути проведений для одержання вільних жирних кислот. Естерифікуюча група, така як метильна або етильна група, може бути видалена, наприклад, шляхом лужного гідролізу, використовуючи основу, таку як гідроксид лужного металу, наприклад, LiOH, NaOH або KOH або шляхом використання органічної основи, наприклад, Et3N, разом з неорганічною сіллю, наприклад, такою як LiCl, у відповідній системі розчинників. Трет-бутильна група може бути видалена, наприклад, шляхом обробки кислотою, наприклад, органічною кислотою, такою як трифтороцтова кислота або мурашина кислота у відповідній системі розчинників. Підходящі системи розчинників включають дихлорметан. Арилметиленова група, така як бензильна група, може бути видалена, наприклад, шляхом гідрогенування над каталізатором, таким як паладійна-вугіллі у відповідній системі розчинників. Солеутворення карбонової кислоти формули (I) може бути проведене шляхом обробки її підходящою основою у відповідній системі розчинників. Видалення розчиннику буде забезпечувати одержання кінцевої солі. Одержання сполук формули (I), відповідно до способів I, II або III, може забезпечувати суміші стереоізомерів. Якщо необхідно, ці ізомери можуть бути розділені за допомогою 20 UA 109528 C2 5 хіральних розділюючих агентів та/або за допомогою хіральної колонкової хроматографії через способи, відомі спеціалісту, кваліфікованому у даній галузі техніки. Спосіб IV. Сполуки формули (I), у якій X являє собою похідну карбонової кислоти у формі фосфоліпіду, можуть бути одержані за допомогою наступних способів. R1 O R2 R3 HO O O OH R1 O R2 HO AG R3 O O P O O N GPC O R1 O R2 R2 R1 O R3O R3 O O 10 15 20 25 O O P O O N Ацилювання sn-гліцеро-3-фосфохоліну (GPC) з активованою жирною кислотою, такою як імідазоліди жирної кислоти, являє собою стандартну процедуру у синтезі фосфатидилхоліну. Її звичайно виконують у присутності ДМСО аніону з ДМСО як розчинником. (Hermetter; Chemistry and Physics of lipids, (1981) 28, 111.) Sn-Гліцеро-3-фосфохолін, як адукт кадмію (II), також може бути введений у реакцію з активованою імідазолідом жирною кислотою у присутності DBU (1,8діазабіцикло[5,4,0]ундец-7-ен) з одержанням фосфатидилхоліну відповідної жирної кислоти. (Міжнародна заявка номер PCT/GB2003/002582.) Ферментативне трансфосфатидилювання може впливати на перетворення фосфатидилхоліну у фосфатидилетаноламін. (Wang et al, J. Am. Chem. Soc., (1993) 115, 10487.) Фосфоліпіди також можуть бути одержані за допомогою ферментативної естерифікації та трансестерифікації фосфоліпідів або ферментативного трансфосфатидилювання фосфоліпідів. (Hosokawa, J.Am. Oil Chem.Soc. 1995, 1287, Lilja-Hallberg, Biocatalysis, (1994) 195.) Спосіб V Сполуки формули (I), у якій X являє собою похідну карбонової кислоти у формі тригліцериду, можуть бути одержані за допомогою наступного способу. Надлишок жирної кислоти може бути сполучений з гліцерином, використовуючи диметиламінопіридин (DMAP) та 2-(1H-бензотриазол-1-іл)-N,N,N’,N’-тетраметилуроніум гексафторфосфат (HBTU). 30 Спосіб VI Сполуки формули (I), у якій X являє собою похідну карбонової кислоти у формі дигліцериду, можуть бути одержані шляхом реакції жирної кислоти (2 еквіваленти) з гліцерином (1 еквівалент) у присутності 1,3-дициклогексилкарбодііміду (DCC) та 4-диметиламінопіридину (DMAP). 35 Спосіб VII Сполуки формули (I), у якій X являє собою похідну карбонової кислоти у формі моногліцериду, можуть бути одержані за допомогою наступних способів. 21 UA 109528 C2 5 10 15 20 25 30 35 40 Ацилювання 1,2-O-ізопропіліден-sn-гліцерину жирною кислотою, використовуючи DCC та DMAP у хлороформі, забезпечує одержання монодіеноїлгліцерину. Зняття захисту ізопропіліденової групи може бути зроблене шляхом обробки захищеного гліцерину кислотою (HCl, оцтова кислота тощо). (O’Brian, J.Org.Chem., (1996) 5914.) Існує декілька способів синтезу для одержання моногліцеридів з жирною кислотою у 2положенні. Один спосіб використовує естерифікацію жирної кислоти з гліцидним спиртом у присутності 1-(3-диметиламінопропіл)-3-етилкарбо-діімідгідрохлориду (EDC) та 4диметиламінопіридину (DMAP) з одержанням гліцидилової похідної. Обробка гліцидилової похідної трифтороцтовим ангідридом (TFAA) перед транс-естерифікацією приводить до одержання моногліцериду (Parkkari et al, Bioorg. Med.Chem.Lett. (2006) 2437.) Додаткові способи одержання моно-, ди- та три-гліцеридів похідних жирної кислоти описані у міжнародній заявці No. PCT/FR02/02831. Також можна використовувати ферментативні способи (ліпазні реакції) для трансформування жирної кислоти до моно-, ди-, три-гліцериду. 1,3-регіоспецифічна ліпаза з грибу Mucor miehei може бути використана для одержання тригліцеридів або дигліцеридів з поліненасичених жирних кислот та гліцерину. Інша ліпаза, нерегіоспецифічна дріжджова ліпаза з Candida antartica є високо продуктивною у створенні тригліцеридів з поліненасичених жирних кислот. (Haraldsson, Pharmazie, (2000) 3.) Одержання, характеризування та біологічне дослідження специфічних похідних жирних кислот формули (I) Приклади Розкриття буде додатково описане наступними необмежуючими прикладами, у яких стандартні технології, відомі кваліфікованому хіміку, та технології, аналогічні тим, що описані у цих прикладах, можуть бути використані, якщо прийнятно. Поки не зазначено інше: випарювання проводять шляхом роторного випаровування у вакуумі; всі реакції проводять при кімнатній температурі, як правило у інтервалі між 18-25°C, з розчинниками рівня очищення для ВЕРХ за безводних умов; колонкову хроматографію виконують за допомогою флеш процедури на силікагелі 40-63 мкм (Merck) або за допомогою Armen Spotflash, використовуючи попередньо наповнені силікагелеві колонки “MiniVarioFlash”, “SuperVarioFlash”, “SuperVarioPrep” або “EasyVarioPrep” (Merck); виходи даються тільки для ілюстрації та не є обов’язково максимально отримуваними; значення зсувів ядерного магнітного резонансу (ЯМР) записують на Bruker Avance DPX 200 або 300 приладі, та мультиплетності піків показана наступними позначеннями: s, синглет; d, дублет; dd, дублет дублетів; t, триплет; q, квартет; p, пентет; m, мультиплет; br, широкий; мас-спектри записують на РХ/МС спектрометрі. Розділення здійснюють, використовуючи блок серії Agilent 1100 на Eclipse XDB-C18 2,1 x 150 мм колонці з градієнтом елюювання. Як елюент використовують градієнт 5-95 % ацетонітрилу у буферах, що містять 0,01% 22 UA 109528 C2 5 10 15 20 25 30 35 40 45 50 трифтороцтової кислоти або 0,005% форміату натрію. Мас-спектри записують на G 1956 A масспектрометрі (електророзпилення, 3000 В), переключаючи на позитивний та негативний модуль іонізації. Приклад 1: Одержання трет-бутил 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноату: Тетрабутиламонію хлорид (0,55 г, 1,98 ммоль) додають до розчину (5Z,8Z,11Z,14Z,17Z)ікоза-5,8,11,14,17-пентаен-1-олу, (3,50 г, 12,1 ммоль) у толуолі (35 мл) при кімнатній температурі у атмосфері азоту. Водний розчин гідроксиду натрію (50% (мас./мас.), 11,7 мл) додають при енергійному перемішуванні при кімнатній температурі, що супроводжують третo бутил 2-бромбутиратом (5,41 г, 24,3 ммоль). Отриману суміш нагрівають до 50 C та додаткову кількість трет-бутил 2-бромбутирату додають через 1,5 години (2,70 г, 12,1 ммоль), 3,5 години (2,70 г, 12,1 ммоль) та 4,5 години (2,70 г, 12,1 ммоль) та перемішують впродовж всього 12 годин. Після охолодження до кімнатної температури додають льодяну воду (25 мл) та отримані дві фази розділяють. Органічну фазу промивають сумішшю NaOH (5%) та сольового розчину, сушать (MgSO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану та етилацетату (100:0 95:5) як елюент. Концентрування відповідних фракцій дозволяє одержати 1,87 г (36% 1 вихід) заголовної сполуки у вигляді масла. H ЯМР (300 МГц, CDCl3): δ 0,85–1,10 (m, 6H), 1,35– 1,54 (m, 11H), 1,53–1,87 (m, 4H), 1,96–2,26 (m, 4H), 2,70–3,02 (m, 8H), 3,31 (dt, 1H), 3,51–3,67 (m, 2H), 5,10–5,58 (m, 10H). Приклад 2: Одержання 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)-бутанової кислоти: трет-Бутил 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноат (19,6 г, 45,5 ммоль) розчиняють у дихлорметані (200 мл) та поміщають у атмосферу азоту. Додають трифтороцтову кислоту (50 мл) та реакційну суміш перемішують при кімнатній температурі впродовж однієї години. Додають воду та водну фазу екстрагують двічі дихлорметаном. Об’єднаний органічний екстракт промивають сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок піддають флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану, етилацетату та мурашиної кислоти (90:10:1 80:20:1) як елюент. Концентрування відповідних фракцій дозволяє одержати 12,1 г (71% вихід) заголовної 1 сполуки у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,90-1,00 (m, 6H), 1,50 (m, 2H), 1,70 (m, 2H), 1,80 (m, 2H), 2,10 (m, 4H), 2,80-2,90 (m, 8H), 3,50 (m, 1H), 3,60 (m, 1H), 3,75 (t, 1H), 5,30-5,50 (m, 10H); MS (електроспрей): 373,2 [M-H] . Приклад 3: Одержання (4S,5R)-3-((S)-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)бутаноїл)-4-метил-5-фенілоксазолідин-2-ону та (4S,5R)-3-((R)-2-((5Z,8Z,11Z,14Z,17Z)-ікоза5,8,11,14,17-пентаенілокси)бутаноїл)-4-метил-5-фенілоксазолідин-2-ону: DMAP (1,10 г, 8,90 ммоль) та DCC (1,90 г, 9,30 ммоль) додають до суміші 2((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)бутанової кислоти (3,20 г, 8,50 ммоль) у o сухому дихлорметані (100 мл), що тримають при 0 C у атмосфері азоту. Отриману суміш o перемішують при 0 C впродовж 20 хвилин. Додають (4S,5R)-4-метил-5-фенілоксазолідин-2-он (1,50 г, 8,50 ммоль) та отриману мутну суміш перемішують при кімнатній температурі впродовж п’яти днів. Цю суміш фільтрують та концентрують при зниженому тиску з одержанням сирого продукту, що містить бажаний продукт у вигляді суміші двох діастереомерів. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи 15% етилацетату у гептані як елюент. Два діастереомери розділяють та відповідні фракції концентрують. (4S,5R)-3-((S)-2((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)бутаноїл)-4-метил-5-фенілоксазолідин-2он елююють першим та отримують у кількості 1,1 г (40% вихід) у вигляді масла. (4S,5R)-3-((R)-2((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)бутаноїл)-4-метил-5-фенілоксазолідин-2он отримують у кількості 0,95 г (34% вихід) у вигляді масла. 23 UA 109528 C2 5 10 15 20 25 30 35 40 45 50 (4S,5R)-3-((S)-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)-бутаноїл)-4-метил-5фенілоксазолідин-2-он (E1): 1 H-ЯМР (300 МГц, CDCl3): δ 0,90 (d, 3H), 1,00 (t, 3H), 1,07 (t, 3H), 1,45-1,57 (m, 2H), 1,62-1,76 (m, 3H), 1,85-1,95 (m, 1H), 2,05-2,15 (m, 4H), 2,87 (m, 8H), 3,39 (m, 1H), 3,57 (m, 1H), 4,85-4,92 (m, 2H), 5,30-5,45 (m, 10H), 5,75 (d, 1H), 7,32 (m, 2H), 7,43 (m, 3H). (4S,5R)-3-((R)-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)-бутаноїл)-4-метил-5фенілоксазолідин-2-он (E2): 1 H-ЯМР (300 МГц, CDCl3): δ 0,98 (d, 3H), 0,99 (t, 3H), 1,08 (t, 3H), 1,40-1,52 (m, 2H), 1,55-1,75 (m, 3H), 1,80-1,90 (m, 1H), 2,05-2,15 (m, 4H), 2,84 (m, 8H), 3,39 (m, 1H), 3,56 (m, 1H), 4,79 (пент., 1H), 4,97 (dd, 1H), 5,30-5,45 (m, 10H), 5,71 (d, 1H), 7,33 (m, 2H), 7,43 (m, 3H). Приклад 4: Одержання (S)-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)-бутанової кислоти: Пероксид водню (35% у воді, 0,75 мл, 8,54 ммоль) та гідроксид літію моногідрат (0,18 г, 4,27 ммоль) додають до розчину (4S,5R)-3-((S)-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17пентаенілокси)бутаноїл)-4-метил-5-фенілоксазолідин-2-ону (1,10 г, 2,13 ммоль) у o тетрагідрофурані (12 мл) та воді (4 мл), що утримують при 0 C у атмосфері азоту. Реакційну o суміш перемішують при 0 C впродовж 30 хвилин. 10% Na2SO3 (водн.) (30 мл) додають, pH доводять до ~2 за допомогою 2M HCl та цю суміш екстрагують двічі гептаном (30 мл). Об’єднаний органічний екстракт сушать (Na2SO4), фільтрують та концентрують. Залишок піддають флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану та етилацетату (98:8 1:1) як елюент. Концентрування відповідних фракцій дозволяє одержати 1 0,48 г (60 % вихід) заголовної сполуки у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,90-1,00 (m, 6H), 1,48 (m, 2H), 1,65 (m, 2H), 1,85 (m, 2H), 2,10 (m, 4H), 2,80-2,90 (m, 8H), 3,55 (m, 1H), 3,60 (m, o 1H), 3,88 (t, 1H), 5,35-5,45 (m, 10H); MS (електроспрей): 373,3 [M-H] ; [α]D +37 (c=0,104, етанол) Приклад 5: Одержання (R)-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)-бутанової кислоти: Пероксид водню (35% у воді, 0,65 мл, 7,37 ммоль) та гідроксид літію моногідрат (0,15 г, 3,69 ммоль) додають до розчину (4S,5R)-3-((R)-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17пентаенілокси)бутаноїл)-4-метил-5-фенілоксазолідин-2-ону (0,95 г, 1,84 ммоль) у o тетрагідрофурані (12 мл) та воді (4 мл), що тримають при 0 C у атмосфері азоту. Реакційну o суміш перемішують при 0 C впродовж 30 хвилин. 10% Na2SO3 (водн.) (30 мл) додають, pH доводять до ~2 за допомогою 2M HCl та цю суміш екстрагують двічі гептаном (30 мл). Об’єднаний органічний екстракт сушать (Na2SO4), фільтрують та концентрують. Залишок піддають флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану та етилацетату (98:8 50:50) як елюент. Концентрування відповідних фракцій дозволяє 1 одержати 0,19 г (29% вихід) заголовної сполуки у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,90-1,00 (m, 6H), 1,48 (m, 2H), 1,65 (m, 2H), 1,85 (m, 2H), 2,10 (m, 4H), 2,80-2,90 (m, 8H), 3,55 (m, o 1H), 3,60 (m, 1H), 3,88 (t, 1H), 5,35-5,45 (m, 10H); MS (електроспрей): 373,3 [M-H] ; [α]D -31 (c=0,088, етанол) Приклад 6: Одержання трет-бутил 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаеніл-окси)пропаноату: Суміш (5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-олу, (1,00 г, 3,47 ммоль), тетрабутиламоній хлориду (0,24 г, 0,87 ммоль) та трет-бутил α-бром пропіонату (3,62 г, 17,3 ммоль) розчиняють у толуолі (36 мл) та поміщають у атмосферу азоту. Водний розчин гідроксиду натрію (50%, 8 мл) повільно додають при енергійному перемішуванні та отриману суміш перемішують при кімнатній температурі впродовж двадцяти годин. Додають воду та суміш екстрагують три рази ефіром. Об’єднаний органічний екстракт промивають сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок очищують за допомогою 24 UA 109528 C2 5 10 15 20 25 30 35 40 45 50 55 флеш хроматографії на силікагелі, використовуючи 2% етилацетату у гептані як елюент. Концентрування відповідних фракцій дозволяє одержати 1,40 г (90% вихід) заголовної сполуки у 1 вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,95 (t, 3H), 1,41 (d, 3H), 1,48 (s, 9H), 1,48-1,66 (m, 4H), 2,05 (m, 4H), 2,83 (m, 8H), 3,35 (m, 1H), 3,55 (m, 1H), 3,79 (q, 1H), 5,32-5,44 (m, 10H). Приклад 7: Одержання 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)-пропанової кислоти: Трифтороцтову кислоту (2 мл) додають до розчину 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17пентаенілокси)пропаноату (1,40 г, 3,36 ммоль) у дихлорметані (10 мл), що тримають у атмосфері азоту, та реакційну суміш перемішують при кімнатній температурі впродовж трьох годин. Додають діетиловий ефір (50 мл) та органічну фазу промивають водою (30 мл), сушать (Na2SO4) та концентрують. Залишок піддають флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану, етилацетату та мурашиної кислоти (95:5:0,25 80:20:1) як елюент. Концентрування відповідних фракцій дозволяє одержати 0,67 г злегка забрудненого продукту. Цей матеріал розчиняють у гептані (15 мл), промивають три рази водою (5 мл), сушать (Na2SO4), фільтрують та концентрують, що забезпечує одержання 0,50 г (41% 1 вихід) заголовної сполуки у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,99 (t, 3H), 1,40-1,48 (m, 5H), 1,67 (m, 2H), 2,09 (m, 4H), 2,80-2,60 (m, 8H), 3,53 (m, 2H), 4,01 (q, 1H), 5,31-5,47 (m, 10H); MS (електроспрей): 359,2 [M-H] . Приклад 8: Одержання трет-бутил 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)-2метилпропаноату: Суміш (5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-олу, (0,83 г, 3,14 ммоль), тетрабутиламоній хлориду (0,24 г, 0,85 ммоль) та трет-бутил α-бром ізобутирату (3,50 г, 15,7 ммоль) розчиняють у толуолі (15 мл) та поміщають у атмосферу азоту. Водний розчин гідроксиду натрію (50%, 5 мл) додають повільно при енергійному перемішуванні при кімнатній o температурі. Отриману суміш нагрівають до 60 C та перемішують впродовж шести годин. Цю суміш охолоджують, додають воду та екстрагують три рази ефіром. Об’єднаний органічний екстракт промивають сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи градієнт 5-10% етилацетату у гептані як елюент. Концентрування відповідних фракцій дозволяє одержати 0,60 г (44% вихід) заголовної сполуки у вигляді масла. MS (електроспрей): 453,3 + [M+Na] . Приклад 9: Одержання 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаенілокси)-2-метил-пропанової кислоти: Трифтороцтову кислоту (5 мл) додають до розчину трет-бутил 2-((5Z,8Z,11Z,14Z,17Z)-ікоза5,8,11,14,17-пентаенілокси)-2-метилпропаноату (600 мг, 1,39 ммоль) у дихлорметані (20 мл) у атмосфері азоту та реакційну суміш перемішують при кімнатній температурі впродовж двох годин. Додають воду та водну фазу екстрагують двічі дихлорметаном. Об’єднаний органічний екстракт промивають сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш гептану, етилацетату та мурашиної кислоти (80:20:1) як елюент. Відповідні фракції концентрують та залишок (135 мг) очищують додатково за допомогою флеш хроматографії на силікагелі, використовуючи градієнт 5-10% суміші етилацетату та мурашиної кислоти (95:5) у гептані як елюент. Концентрування відповідних фракцій дозволяє одержати 80 мг злегка забрудненого продукту. Цей матеріал розчиняють у гептані (5 мл), промивають двічі водою (5 мл), сушать (Na2SO4), фільтрують та концентрують, що дозволяє одержати 40 мг (8% вихід) 1 заголовної сполуки у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,99 (t, 3H), 1,47 (s, 6H), 1,64 (m, 2H), 2,07 (m, 4H), 2,81-2,88 (m, 8H), 3,46 (t, 2H), 5,29-5,44 (m, 10H); MS (електроспрей): 373,3 [M-H] Приклад 10: Одержання 2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенілокси)бутанової кислоти: 25 UA 109528 C2 5 10 15 20 25 30 35 40 45 50 Суміш (3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраен-1-олу (S. Flock, Acta Chemica Scandinavica, (1999) 53, 436-445) (0,22 г, 1,00 ммоль), тетрабутил-амоній хлориду (0,10 г, 0,33 ммоль) та третбутил 2-бромбутирату (1,11 г, 5,00 ммоль) розчиняють у толуолі (10 мл) та поміщають у атмосферу азоту. Водний розчин гідроксиду натрію (50%, 4 мл) додають повільно при o енергійному перемішуванні при кімнатній температурі. Отриману суміш нагрівають до 50 C та перемішують впродовж двох годин та потім при кімнатній температурі впродовж ночі. Після охолодження до кімнатної температури, додають воду та водну фазу екстрагують три рази ефіром. Об’єднаний органічний екстракт промивають водою та сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи 5% етилацетату у гептані як елюент. Концентрування відповідних фракцій дозволяє одержати 0,30 г трет-бутилового складного ефіру у вигляді масла. Залишок розчиняють у дихлорметані (10 мл) та поміщають у атмосферу азоту. Додають трифтороцтову кислоту (2 мл) та реакційну суміш перемішують при кімнатній температурі впродовж однієї години. Додають воду та водну фазу екстрагують двічі дихлорметаном. Об’єднаний органічний екстракт промивають сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш гептану, етилацетату та мурашиної кислоти (80:20:1) як елюент. Концентрування відповідних 1 фракцій дозволяє одержати 0,18 г (59% вихід) бажаного продукту у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,90-1,05 (m, 6H), 1,75-1,90 (m, 2H), 2,05-2,15 (m, 2H), 2,30-2,50 (m, 2H), 2,85 (m, 6H), 3,60 (m, 2H), 3,85 (t, 1H), 5,25-5,60 (m, 8H). Приклад 11: Одержання 2-((9Z,12Z,15Z)-октадека-9,12,15-триенілокси)бутанової кислоти: Суміш (9Z,12Z,15Z)-октадека-9,12,15-триен-1-олу (1,26 г, 4,76 ммоль), тетра-бутил-амоній хлориду (0,36 г, 1,28 ммоль) та трет-бутил 2-бромбутирату (2,86 г, 12,82 моль) розчиняють у толуолі (15 мл) та поміщають у атмосферу азоту. Водний розчин гідроксиду натрію (50%, 6 мл) додають повільно при енергійному перемішуванні при кімнатній температурі. Отриману суміш o нагрівають до 60 C та перемішують впродовж п’яти годин. Після охолодження до кімнатної температури, додають воду та водну фазу екстрагують три рази ефіром. Об’єднаний органічний екстракт промивають водою та сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи градієнт 2,5-5% етилацетату у гептані як елюент. Концентрування відповідних фракцій дозволяє одержати 1,36 г трет-бутилового складного ефіру у вигляді масла. Залишок розчиняють у дихлорметані (20 мл) та поміщають у атмосферу азоту. Додають трифтороцтову кислоту (5 мл) та реакційну суміш перемішують при кімнатній температурі впродовж однієї години. Додають воду та водну фазу екстрагують двічі дихлорметаном. Об’єднаний органічний екстракт промивають сольовим розчином, сушать (Na2SO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи суміш гептану, етилацетату та мурашиної кислоти (80:20:1) як елюент. Концентрування відповідних 1 фракцій дозволяє одержати 0,38 г (23% вихід) бажаного продукту у вигляді масла. H-ЯМР (300 МГц, CDCl3): δ 0,95-1,00 (m, 6H), 1,30-1,45 (m, 10H), 1,65 (m, 2H), 1,80 (m, 2H), 2,10 (m, 4H), 2,80 (m, 4H), 3,50 (m, 1H), 3,60 (m, 1H), 3,85 (t, 1H), 5,30-5,50 (m, 6H); MS (електроспрей): 349,2 [M-H]. Приклад 12: Одержання трет-бутил 2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1ілокси)бутаноату: трет-Бутил 2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутаноат (480 мг, 1,11 ммоль) додають краплинним способом впродовж 30 хвилин до розчину діізопропіламіну літію (LDA) (2,0 M, 750 мкл, 1,50 ммоль) у сухому тетрагідрофурані (10 мл), що тримають при -70°C у атмосфері азоту. Реакційну суміш перемішують впродовж 30 хвилин. Етилйодид (312 мг, 2,00 ммоль) додають однією частиною та отриману суміш нагрівають до кімнатної температури 26 UA 109528 C2 5 10 15 20 25 30 35 40 впродовж 1 години. Реакційну суміш перемішують при кімнатній температурі впродовж 17 годин. Цю суміш виливають у насичений NH 4Cl (водн.) розчин (50 мл) та екстрагують гептаном (2 × 50 мл). Об’єднані органічні фази промивають послідовно сольовим розчином (50 мл), 0,25 M HCl (50 мл) та сольовим розчином (50 мл), сушать (MgSO4), фільтрують та концентрують. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану та етилацетату (100:0 95:5) як елюент. Концентрування відповідних фракцій 1 дозволяє одержати 343 мг (67% вихід) заголовної сполуки у вигляді масла. H ЯМР (300 МГц, CDCl3): δ 0,84 (t, 6H), 0,99 (td, 3H), 1,35–1,55 (m, 11H), 1,54–1,69 (m, 2H), 1,68–1,87 (m, 4H), 1,99– 2,24 (m, 4H), 2,74–2,99 (m, 8H), 3,31 (t, 2H), 5,23–5,52 (m, 10H); MS (електроспрей): 401,3 [M-1] Приклад 13: Одержання 2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-ілокси)бутанової кислоти: Суміш мурашиної кислоти (5 мл) та трет-бутил 2-етил-2-((5Z,8Z,11Z,14Z,17Z)-ікоза5,8,11,14,17-пентаен-1-ілокси)бутаноату (250 мг, 0,55 ммоль) енергійно перемішують у атмосфері азоту при кімнатній температурі впродовж 4,5 годин. Мурашину кислоту видаляють у вакуумі. Залишок очищують за допомогою флеш хроматографії на силікагелі, використовуючи зростаючі полярні суміші гептану та етилацетату (100:0 80:20) як елюент. Концентрування відповідних фракцій дозволяє одержати 163 мг (74% вихід) заголовної сполуки у вигляді масла. 1 H ЯМР (300 МГц, CDCl3): δ 0,86 (t, 6H), 0,99 (t, 3H), 1,36 – 1,57 (m, 2H), 1,68 (dd, 2H), 1,73 – 1,98 (m, 4H), 2,11 (tt, 4H), 2,70 – 3,01 (m, 8H), 3,39 (t, 2H), 5,20 – 5,56 (m, 10H). MS (електроспрей): + 481,4 [M+Na] . Приклад 14: Одержання трет-бутил 2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаен-1ілокси)бутаноату: Водний розчин гідроксиду натрію (50 % (мас./мас.), 6 мл) додають частинами до суміші (5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17-пентаен-1-олу (2,01 г, 6,39 ммоль), трет-бутил-2бромбутирату (2,85 г, 12,8 ммоль) та тетрабутиламоній бісульфату (0,65 г, 1,91 ммоль) у толуолі (12 мл). Реакційну суміш енергійно перемішують у N 2-атмосфері та нагрівають до 50°C. Реакційну суміш перемішують при 50°C впродовж всього 22 годин. Додатковий трет-бутил-2бромбутират (1,43 г, 6,39 ммоль) та (1,44 г, 6,44 ммоль) додають після 1 ½ години та 3 годин відповідно. Цю суміш охолоджують та додають льодяну воду (~50 мл) та гептан (50 мл), фази розділяють та органічну фазу концентрують при зниженому тиску. Флеш хроматографія на силікагелі (30 г), елююючи сумішшю гептан-гептан/EtOAc (99:1), приводить до одержання 2,12 г 1 заголовної сполуки у вигляді рідини. H ЯМР (300 МГц, CDCl3) δ 0,94-1,04 (m, 6H), 1,47 (s, 9H), 1,68-1,85 (m, 4H), 1,93-2,20 (m, 4H), 2,80-2,86 (m, 10H), 3,28-3,36 (m, 1H), 3,55-3,63 (m, 2H), 5,275,43 (m, 12H). Приклад 15: Одержання 2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаен-1-ілокси)-бутанової кислоти: 45 50 Суміш трет-бутил 2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаен-1ілокси)пропаноату (2,09 г, 4,58 ммоль) у HCOOH (9 мл) перемішують при 40°C у N2-атмосфері впродовж 6 годин. Реакційну суміш розбавляють діетиловим ефіром (100 мл), промивають водою (30 мл), сушать (MgSO4), фільтрують та випарюють при зниженому тиску. «Dry-flash» (колонкова хроматографія з елююванням з відсмоктуванням) на силікагелі (50 г), елююючи сумішшю толуол – толуол (85:15), що приводить до одержання 1,44 г сирої заголовної сполуки. Флеш хроматографія на силікагелі (30 г), елююючи сумішшю гептан – гептан/(EtOAc мас./5% 27 UA 109528 C2 5 10 15 20 HCCOH) 98:2-95:5-80:20, приводить до одержання 1,07 г (58% вихід) заголовної сполуки у 1 вигляді рідини. H ЯМР (200 МГц, CDCl3) δ 0,97 (t, 3H), 0,99 (t, 3H), 1,64-1,91 (m, 4H), 2,00-2,23 (m, 4H), 2,78-2,87 (m, 10H), 3,42-3,66 (m, 2H), 3,85 (dd, 1H), 5,26-5,46 (m, 12H). MS (електроспрей) (нег.): 399 (M-H) . Приклад 16: Одержання трет-бутил 2-((3Z,6Z,9Z,12Z,15Z)-октадека-3,6,9,12,15-пентаен-1ілокси)бутаноату: Водний розчин гідроксиду натрію (50 % (мас./мас.), 6 мл) додають частинами до суміші (3Z,6Z,9Z,12Z,15Z)-октадека-3,6,9,12,15-пентаен-1-олу (1,66 г, 6,37 ммоль), трет-бутил-2бромбутирату (2,86 г, 12,8 ммоль) та тетрабутиламоній бісульфату (0,65 г, 1,91 ммоль) у толуолі (12 мл). Реакційну суміш енергійно перемішують у N 2-атмосфері та нагрівають до 50°C. Реакційну суміш перемішують при 50°C впродовж всього 25 годин. Додаткові кількості третбутил-2-бромбутирату (1,43 г, 6,41 ммоль) та (1,42 г, 6,38 ммоль) додають через 1 ½ години та 3 години, відповідно. Цю суміш охолоджують до кімнатної температури та додають воду (30 мл) та гептан (50 мл), отримані дві фази розділяють та органічну фазу сушать (Na 2SO4), фільтрують та випарюють при зниженому тиску. Флеш хроматографія на силікагелі (30 г), елююючи сумішшю гептан-гептан/EtOAc (99:1), приводить до одержання 1,55 г заголовної сполуки у 1 вигляді рідини. H ЯМР (300 МГц, CDCl3) δ 0,96 (t, 3H), 0,97 (t, 3H), 1,48 (s, 9H), 1,64-1,86 (m, 2H), 2,03-2,12 (m, 2H), 2,39 (dd, J = 12,1, 6,7 Гц, 2H), 2,79-2,86 (m, 8H), 3,29-3,37 (m, 1H), 3,57-3,66 (m, 2H), 5,27-5,49 (m, 10 H). Приклад 17: Одержання 2-((3Z,6Z,9Z,12Z,15Z)-октадека-3,6,9,12,15-пентаен-1-ілокси)бутанової кислоти: 25 30 35 40 45 50 Суміш трет-бутил 2-((3Z,6Z,9Z,12Z,15Z)-октадека-3,6,9,12,15-пентаен-1-ілокси)бутаноату (2,09 г, 4,58 ммоль) у HCOOH (9 мл) перемішують при 40°C у N 2-атмосфері впродовж 6 годин. Реакційну суміш розбавляють діетиловим ефіром (100 мл), промивають водою (30 мл), сушать (MgSO4), фільтрують та випарюють при зниженому тиску. «Dry-flash» колонкова хроматографія на силікагелі (50 г), елююючи сумішшю толуол – толуол/EtOAc (85:15), приводить до одержання 1,44 г сирої заголовної речовини. Флеш хроматографія на силікагелі (30 г), елююючи сумішшю гептан – гептан/(EtOAc мас./5 % HCCOH) 98:2-95:5-80:20, приводить до одержання 1,07 г (58% 1 вихід) заголовної сполуки у вигляді рідини. H ЯМР (200 МГц, CDCl3) δ 0,97 (t, 3H), 0,99 (t, 3H), 1,75-1,91 (m, 2H), 2,00-2,15 (m, 2H), 2,35-2,48 (m, 2H), 2,78-2,87 (m, 8H), 3,47-3,62 (m, 2H), 3,86 (dd, 1H), 5,25-5,55 (m, 10H). MS (електроспрей) (нег.): 345 (M-H) . Біологічні дослідження Приклад 18: Оцінка активації PPAR in vitro Аналізи проводили in vitro, використовуючи зразки для аналізу ссавець-один-гібрид (М1Н), що містять складені структури GАL4-ДНК єднальний домен-РРАR-LВD в комбінації зі складеною структурою-репортером на основі люциферази Photinus pyralis, що несеться 5xGAL 4-сайтами, у випадково трансфектованих клітинах НЕК293. До додавання сполук, клітини трансфектували 4-6 годин та ростили протягом ночі. Інкубація зі сполукою тривала 16-20 годин. Брунькоподібна люцифераза Renilla, що несеться конститутивним промотором, була введена як внутрішній контроль для покращення точності експерименту. Сполуки (A-C) та позитивний контроль тестували при шести різних концентраціях у двох повторах. Позитивні контролі являли собою GW7647 (PPARα), GW501516 (PPARδ) та росиглітазон (PPARγ). Ефективність контролів була встановлена як 100%. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPolyunsaturated fatty acids for the treatment of diseases related to cardiovascular, metabolic and inflammatory disease areas
Автори російськоюHovland, Ragnar, Holmeide, Anne, Kristin, Skjeret, Tore, Braendvang, Morten
МПК / Мітки
МПК: A61K 31/22, A61P 3/10, C07C 57/03, A61P 9/10, A61P 19/02, C07C 69/587, A61K 31/19, A61P 29/00
Мітки: захворювань, поліненасичені, жирні, метаболічних, лікування, ряду, серцево-судинних, кислоти, запальних, належать
Код посилання
<a href="https://ua.patents.su/40-109528-polinenasicheni-zhirni-kisloti-dlya-likuvannya-zakhvoryuvan-yaki-nalezhat-do-ryadu-sercevo-sudinnikh-metabolichnikh-ta-zapalnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Поліненасичені жирні кислоти для лікування захворювань, які належать до ряду серцево-судинних, метаболічних та запальних захворювань</a>
Попередній патент: Зберігальний балон і пристрій для зберігання зрідженого нафтового газу
Наступний патент: Композиції для респіраторної доставки активних агентів та пов’язані способи і системи
Випадковий патент: Спосіб діагностики розвитку атеросклерозу