Заміщені похідні оксиндолу та їх застосування як лігандів рецептора вазопресину
Номер патенту: 96785
Опубліковано: 12.12.2011
Автори: ЛУБІШ Вільфрід, Вернет Вольфганг, УНГЕР Ліліане, Брайє Вільфрід Мартін, Женест Ерве, Хорнбергер Вільфрід, Нетц Астрід, Оост Торстен
Формула / Реферат
1. Сполука загальної формули (І)
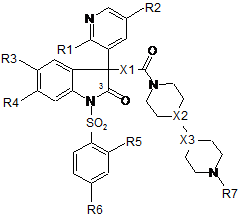 (І),
(І),
де
R1 являє собою етоксигрупу;
R2 являє собою водень;
R3 являє собою ціаногрупу;
R4 являє собою водень;
R5 являє собою водень, метоксигрупу або етоксигрупу;
R6 являє собою водень або метоксигрупу;
R7 являє собою водень, метил, етил, н-пропіл або ізопропіл;
X1 являє собою -NH-;
Х2 являє собою N або СН;
Х3 являє собою N або СН;
де Х2 і Х3 не є одночасно N;
або її фармацевтично прийнятна сіль, таутомерна форма, проліки.
2. Сполука за п. 1, де R5 являє собою водень або метоксигрупу.
3. Сполука за п. 1, де R7 являє собою водень, метил або етил.
4. Сполука за будь-яким із пп. 1-3, де
R5 являє собою водень або метоксигрупу;
R7 являє собою водень, метил або етил;
X1 являє собою -NH-;
X2 являє собою N;
Х3 являє собою СН.
5. Сполука за будь-яким із пп. 1-3, де
R5 являє собою водень або метоксигрупу;
R7 являє собою водень, метил або етил;
X1 являє собою -NH-;
Х2 являє собою СН;
Х3 являє собою N.
6. Сполука за будь-яким із пп. 1-3, де
R5 являє собою метоксигрупу;
R6 являє собою метоксигрупу;
R7 являє собою метил або етил;
X1 являє собою -NH-;
Х2 являє собою СН, Х3 являє собою N, або
Х2 являє собою N, Х3 являє собою СН.
7. Сполука за будь-яким із пп. 1-3, де
R5 являє собою метоксигрупу;
R6 являє собою метоксигрупу;
R7 являє собою метил;
X1 являє собою -NH-;
Х2 являє собою N;
Х3 являє собою СН.
8. Сполука за будь-яким із пп. 1-3, де
R5 являє собою метоксигрупу;
R6 являє собою метоксигрупу;
R7 являє собою метил;
X1 являє собою -NH-;
Х2 являє собою СН;
Х3 являє собою N.
9. Сполука за будь-яким із пп. 1-3, де
R5 являє собою метоксигрупу;
R6 являє собою метоксигрупу;
R7 являє собою етил;
X1 являє собою -NH-;
Х2 являє собою СН;
Х3 являє собою N.
10. Сполука загальної формули (І) за будь-яким із пп. 1-9, яка відрізняється тим, що вона знаходиться в оптично активній формі і являє собою (лівообертаючий) (-)-енантіомер, який обертає площину поляризації лінійно поляризованого світла ліворуч, зазначеної сполуки загальної формули (І), у вигляді вільної основи, або її фармацевтично прийнятна сіль, таутомерна форма або проліки.
11. Сполука загальної формули (І) за будь-яким із пп. 1-9, яка відрізняється тим, що вона знаходиться в оптично активній формі, в якій абсолютна конфігурація хірального С-3 атома вуглецю кільця відповідає абсолютній конфігурації біля С-3 (лівообертаючого) (-)-енантіомера, який обертає площину поляризації лінійно поляризованого світла ліворуч, сполука формули (Ia) у вигляді вільної основи
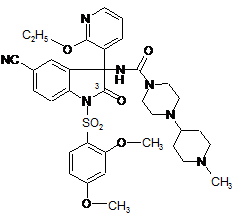 , (Іа)
, (Іа)
або її фармацевтично прийнятна сіль, таутомерна форма, проліки.
12. Сполука загальної формули (І) за п. 10 в оптично активній формі, яка відрізняється тим, що відповідний лівообертаючий (-)-енантіомер присутній з оптичною чистотою (енантіомерний надлишок), більшою від 50 %, або її фармацевтично прийнятна сіль, таутомерна форма, проліки.
13. Сполука загальної формули (І) за п. 11 в оптично активній формі, яка відрізняється тим, що енантіомер, що має переважну абсолютну конфігурацію біля С-3 атома вуглецю кільця, присутній з оптичною чистотою (енантіомерний надлишок), більшою від 50 %, або її фармацевтично прийнятна сіль, таутомерна форма, проліки.
14. Сполука загальної формули (І) за п. 10 в оптично активній формі, яка відрізняється тим, що відповідний лівообертаючий (-)-енантіомер присутній з оптичною чистотою (енантіомерний надлишок), більшою від 90 %, або її фармацевтично прийнятна сіль, таутомерна форма, проліки.
15. Сполука загальної формули (І) за п. 11 в оптично активній формі, яка відрізняється тим, що енантіомер, що має переважну абсолютну конфігурацію біля С-3 атома вуглецю кільця, присутній з оптичною чистотою (енантіомерний надлишок), більшою від 90 %, або її фармацевтично прийнятна сіль, таутомерна форма, проліки.
16. Сполука загальної формули (І) за будь-яким із пп. 1-9 у вигляді рацемату або фармацевтично прийнятна сіль, таутомерна форма, проліки рацемату сполук загальної формули (І).
17. Сполука за будь-яким з попередніх пунктів, вибрана з групи, що включає:
N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(1-метилпіперидин-4-іл)піперазин-1-карбоксамід;
(+)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1H-індол-3-іл]-4-(1-метилпіперидин-4-іл)піперазин-1-карбоксамід;
(-)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(1-метилпіперидин-4-іл)піперазин-1-карбоксамід;
N-{5-ціано-3-(2-етоксипіридин-3-іл)-1-[(4-метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Н-індол-3-іл}-4-(1-метилпіперидин-4-іл)піперазин-1-карбоксамід;
N-{5-ціано-3-(2-етоксипіридин-3-іл)-1-[(2-метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Н-індол-3-іл}-4-(1-метилпіперидин-4-іл)піперазин-1-карбоксамід;
трифторацетат N-[5-ціано-1-[(2-етоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(1-метилпіперидин-4-іл)піперазин-1-карбоксаміду;
N-[5-ціано-3-(2-етоксипіридин-3-іл)-2-оксо-1-(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(1-метилпіперидин-4-іл)піперазин-1-карбоксамід;
N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1-карбоксамід;
(+)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1-карбоксамід;
(-)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1-карбоксамід;
N-[5-ціано-3-(2-етоксипіридин-3-іл)-1-[(2-метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1-карбоксамід;
трифторацетат N-[5-ціано-1-[(2-етоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1-карбоксаміду;
N-[5-ціано-3-(2-етоксипіридин-3-іл)-2-оксо-1-(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1-карбоксамід;
трифторацетат N-[5-ціано-3-(2-етоксипіридин-3-іл)-1-[(4-метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1-карбоксаміду;
N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-етилпіперазин-1-іл)піперидин-1-карбоксамід;
(+)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-етилпіперазин-1-іл)піперидин-1-карбоксамід;
(-)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-етилпіперазин-1-іл)піперидин-1-карбоксамід;
N-[5-ціано-3-(2-етоксипіридин-3-іл)-2-оксо-1-(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(4-етилпіперазин-1-іл)піперидин-1-карбоксамід;
(-)-N-[5-ціано-3-(2-етоксипіридин-3-іл)-2-оксо-1-(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(4-етилпіперазин-1-іл)піперидин-1-карбоксамід;
N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4-пропілпіперазин-1-іл)піперидин-1-карбоксамід;
N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-піперазин-1-ілпіперидин-1-карбоксамід;
біс(трифторацетат) N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-піперидин-4-ілпіперазин-1-карбоксаміду;
біс(трифторацетат) N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4,4'-біпіперидин-1-карбоксаміду;
N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-1'-метил-4,4'-біпіперидин-1-карбоксамід;
трифторацетат (-)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1H-індол-3-іл]-1'-метил-4,4'-біпіперидин-1-карбоксаміду;
трифторацетат N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-1'-етил-4,4'-біпіперидин-1-карбоксаміду;
трифторацетат (-)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-1'-етил-4,4'-біпіперидин-і-карбоксаміду;
трифторацетат (-)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1H-індол-3-іл]-4-(1-етилпіперидин-4-іл)піперазин-1-карбоксаміду;
або щонайменше однієї її фармацевтично прийнятної солі або однієї таутомерної форми.
18. Лікарський засіб, який містить щонайменше одну сполуку загальної формули (І) за будь-яким із пп. 1-17 або щонайменше одну її фармацевтично прийнятну сіль, одну її таутомерну форму або одні її проліки.
19. Сполука загальної формули (І) за будь-яким із пп. 1-17 або щонайменше одна її фармацевтично прийнятна сіль, одна її таутомерна форма або одні її проліки для застосування як лікарський засіб.
20. Застосування щонайменше однієї сполуки загальної формули (І) за будь-яким із пп. 1-17 або щонайменше однієї її фармацевтично прийнятної солі, однієї її таутомерної форми або одних її проліків для лікування і/або профілактики щонайменше одного вазопресинзалежного захворювання.
21. Застосування щонайменше однієї сполуки загальної формули (І) за будь-яким з пп. 1-17 або щонайменше однієї її фармацевтично прийнятної солі, однієї її таутомерної форми або її проліків для лікування і/або профілактики щонайменше одного порушення, вибраного з групи, яка складається з:
діабету, резистентності до інсуліну, нічного нетримання сечі, нетримання, захворювань, при яких виникають порушення згортання крові;
гіпертензії, легеневої гіпертензії, серцевої недостатності, інфаркту міокарда, коронарного спазму, нестабільної стенокардії, РТСА (черезшкірна транслюмінальна коронарна ангіопластика), ішемічної хвороби серця, розладів ниркової системи, набряку, ниркового вазоспазму, некрозу коркової речовини нирки, гіпонатріємії, гіпокаліємії, синдрому Шварца-Бартера, порушень шлунково-кишкового тракту, гастритного вазоспазму, цирозу печінки, виразки шлунка і кишечнику, блювання, блювання, що виникає у процесі хіміотерапії, блювання при захитуванні;
афективних розладів;
тривожних розладів;
порушень пам'яті і/або хвороби Альцгеймера;
психозів і/або психотичних розладів; синдрому Кушинга або інших стресзалежних захворювань;
порушень сну; депресивних розладів, таких як розлади настрою, що починаються в дитинстві;
вазомоторних симптомів і/або дисфункцій терморегуляції, таких як, наприклад, симптом приливу крові;
наркотичних залежностей, лікарських залежностей і/або залежностей, опосередкорваних іншими факторами, для лікування і/або профілактики стресу,
викликаного видаленням одного або більше факторів, що опосередкують залежність, і/або для лікування і/або профілактики викликаних стресом рецидивів наркотичних залежностей, лікарських залежностей і/або залежностей, опосередкованих іншими факторами;
шизофренії і/або психозу
і/або уповільненого сечовипускання.
22. Спосіб лікування і/або профілактики щонайменше одного порушення, вибраного з групи, яка складається з:
діабету, резистентності до інсуліну, нічного нетримання сечі, нетримання, захворювань, при яких виникають порушення згортання крові;
гіпертензії, легеневої гіпертензії, серцевої недостатності, інфаркту міокарда, коронарного спазму, нестабільної стенокардії, РТСА (черезшкірна транслюмінальна коронарна ангіопластика), ішемічної хвороби серця, розладів ниркової системи, набряку, ниркового вазоспазму, некрозу коркової речовини нирки, гіпонатріємії, гіпокаліємії, синдрому Шварца-Бартера, порушень шлунково-кишкового тракту, гастритного вазоспазму, цирозу печінки, виразки шлунка і кишечнику, блювання, блювання, що виникає в процесі хіміотерапії, і блювання при захитуванні;
афективних розладів;
тривожних розладів і/або стресзалежних тривожних розладів;
порушень пам'яті і/або хвороби Альцгеймера;
психозів і/або психотичних розладів;
синдрому Кушинга;
порушень сну;
депресивних розладів, таких як розлади настрою, що починаються в дитинстві;
вазомоторних симптомів і/або дисфункцій терморегуляції, таких як, наприклад, симптом приливу крові;
наркотичних залежностей, лікарських залежностей і/або залежностей, опосередкованих іншими факторами, лікування і/або профілактики стресу, викликаного видаленням одного або більше факторів, що опосередкують залежність, і/або лікування і/або профілактики викликаних стресом рецидивів наркотичних залежностей, лікарських залежностей і/або залежностей, опосередкованих іншими факторами;
шизофренії і/або психозу;
і уповільненого сечовипускання у пацієнта, який відрізняється тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) за будь-яким з пп. 1-17 або щонайменше однієї її фармацевтично прийнятної солі, однієї її таутомерної форми або одних її проліків.
23. Спосіб за п. 22, який відрізняється тим, що пацієнтом є ссавець, переважно людина, або трансгенний ссавець, який не є людиною.
Текст
1. Сполука загальної формули (І) C2 2 (19) 1 3 96785 R7 являє собою метил; X1 являє собою -NH-; Х2 являє собою N; Х3 являє собою СН. 8. Сполука за будь-яким із пп. 1-3, де R5 являє собою метоксигрупу; R6 являє собою метоксигрупу; R7 являє собою метил; X1 являє собою -NH-; Х2 являє собою СН; Х3 являє собою N. 9. Сполука за будь-яким із пп. 1-3, де R5 являє собою метоксигрупу; R6 являє собою метоксигрупу; R7 являє собою етил; X1 являє собою -NH-; Х2 являє собою СН; Х3 являє собою N. 10. Сполука загальної формули (І) за будь-яким із пп. 1-9, яка відрізняється тим, що вона знаходиться в оптично активній формі і являє собою (лівообертаючий) (-)-енантіомер, який обертає площину поляризації лінійно поляризованого світла ліворуч, зазначеної сполуки загальної формули (І), у вигляді вільної основи, або її фармацевтично прийнятна сіль, таутомерна форма або проліки. 11. Сполука загальної формули (І) за будь-яким із пп. 1-9, яка відрізняється тим, що вона знаходиться в оптично активній формі, в якій абсолютна конфігурація хірального С-3 атома вуглецю кільця відповідає абсолютній конфігурації біля С-3 (лівообертаючого) (-)-енантіомера, який обертає площину поляризації лінійно поляризованого світла ліворуч, сполука формули (Ia) у вигляді вільної основи N C2H5 NC O O 3 N N H N O N SO2 O CH3 N CH3 O CH3 , (Іа) або її фармацевтично прийнятна сіль, таутомерна форма, проліки. 12. Сполука загальної формули (І) за п. 10 в оптично активній формі, яка відрізняється тим, що відповідний лівообертаючий (-)-енантіомер присутній з оптичною чистотою (енантіомерний надлишок), більшою від 50 %, або її фармацевтично прийнятна сіль, таутомерна форма, проліки. 13. Сполука загальної формули (І) за п. 11 в оптично активній формі, яка відрізняється тим, що енантіомер, що має переважну абсолютну конфігурацію біля С-3 атома вуглецю кільця, присутній з оптичною чистотою (енантіомерний надлишок), 4 більшою від 50 %, або її фармацевтично прийнятна сіль, таутомерна форма, проліки. 14. Сполука загальної формули (І) за п. 10 в оптично активній формі, яка відрізняється тим, що відповідний лівообертаючий (-)-енантіомер присутній з оптичною чистотою (енантіомерний надлишок), більшою від 90 %, або її фармацевтично прийнятна сіль, таутомерна форма, проліки. 15. Сполука загальної формули (І) за п. 11 в оптично активній формі, яка відрізняється тим, що енантіомер, що має переважну абсолютну конфігурацію біля С-3 атома вуглецю кільця, присутній з оптичною чистотою (енантіомерний надлишок), більшою від 90 %, або її фармацевтично прийнятна сіль, таутомерна форма, проліки. 16. Сполука загальної формули (І) за будь-яким із пп. 1-9 у вигляді рацемату або фармацевтично прийнятна сіль, таутомерна форма, проліки рацемату сполук загальної формули (І). 17. Сполука за будь-яким з попередніх пунктів, вибрана з групи, що включає: N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-(1-метилпіперидин-4-іл)піперазин-1карбоксамід; (+)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Hіндол-3-іл]-4-(1-метилпіперидин-4-іл)піперазин-1карбоксамід; (-)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол3-іл]-4-(1-метилпіперидин-4-іл)піперазин-1карбоксамід; N-{5-ціано-3-(2-етоксипіридин-3-іл)-1-[(4метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Ніндол-3-іл}-4-(1-метилпіперидин-4-іл)піперазин-1карбоксамід; N-{5-ціано-3-(2-етоксипіридин-3-іл)-1-[(2метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Ніндол-3-іл}-4-(1-метилпіперидин-4-іл)піперазин-1карбоксамід; трифторацетат N-[5-ціано-1-[(2етоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2оксо-2,3-дигідро-1Н-індол-3-іл]-4-(1метилпіперидин-4-іл)піперазин-1-карбоксаміду; N-[5-ціано-3-(2-етоксипіридин-3-іл)-2-оксо-1(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(1метилпіперидин-4-іл)піперазин-1-карбоксамід; N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-(4-метилпіперазин-1-іл)піперидин-1карбоксамід; (+)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1карбоксамід; (-)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1карбоксамід; N-[5-ціано-3-(2-етоксипіридин-3-іл)-1-[(2метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1карбоксамід; 5 трифторацетат N-[5-ціано-1-[(2етоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4метилпіперазин-1-іл)піперидин-1-карбоксаміду; N-[5-ціано-3-(2-етоксипіридин-3-іл)-2-оксо-1(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(4метилпіперазин-1-іл)піперидин-1-карбоксамід; трифторацетат N-[5-ціано-3-(2-етоксипіридин-3-іл)1-[(4-метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро1Н-індол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин1-карбоксаміду; N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-(4-етилпіперазин-1-іл)піперидин-1карбоксамід; (+)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-(4-етилпіперазин-1-іл)піперидин-1карбоксамід; (-)-N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол3-іл]-4-(4-етилпіперазин-1-іл)піперидин-1карбоксамід; N-[5-ціано-3-(2-етоксипіридин-3-іл)-2-оксо-1(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(4етилпіперазин-1-іл)піперидин-1-карбоксамід; (-)-N-[5-ціано-3-(2-етоксипіридин-3-іл)-2-оксо-1(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(4етилпіперазин-1-іл)піперидин-1-карбоксамід; N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-(4-пропілпіперазин-1-іл)піперидин-1карбоксамід; N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-піперазин-1-ілпіперидин-1-карбоксамід; біс(трифторацетат) N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-піперидин-4ілпіперазин-1-карбоксаміду; біс(трифторацетат) N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4,4'біпіперидин-1-карбоксаміду; N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-1'-метил-4,4'-біпіперидин-1-карбоксамід; трифторацетат (-)-N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1H-індол-3-іл]-1'-метил-4,4'біпіперидин-1-карбоксаміду; трифторацетат N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-1'-етил-4,4'біпіперидин-1-карбоксаміду; трифторацетат (-)-N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-1'-етил-4,4'біпіперидин-і-карбоксаміду; трифторацетат (-)-N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1H-індол-3-іл]-4-(1етилпіперидин-4-іл)піперазин-1-карбоксаміду; або щонайменше однієї її фармацевтично прийнятної солі або однієї таутомерної форми. 96785 6 18. Лікарський засіб, який містить щонайменше одну сполуку загальної формули (І) за будь-яким із пп. 1-17 або щонайменше одну її фармацевтично прийнятну сіль, одну її таутомерну форму або одні її проліки. 19. Сполука загальної формули (І) за будь-яким із пп. 1-17 або щонайменше одна її фармацевтично прийнятна сіль, одна її таутомерна форма або одні її проліки для застосування як лікарський засіб. 20. Застосування щонайменше однієї сполуки загальної формули (І) за будь-яким із пп. 1-17 або щонайменше однієї її фармацевтично прийнятної солі, однієї її таутомерної форми або одних її проліків для лікування і/або профілактики щонайменше одного вазопресинзалежного захворювання. 21. Застосування щонайменше однієї сполуки загальної формули (І) за будь-яким з пп. 1-17 або щонайменше однієї її фармацевтично прийнятної солі, однієї її таутомерної форми або її проліків для лікування і/або профілактики щонайменше одного порушення, вибраного з групи, яка складається з: діабету, резистентності до інсуліну, нічного нетримання сечі, нетримання, захворювань, при яких виникають порушення згортання крові; гіпертензії, легеневої гіпертензії, серцевої недостатності, інфаркту міокарда, коронарного спазму, нестабільної стенокардії, РТСА (черезшкірна транслюмінальна коронарна ангіопластика), ішемічної хвороби серця, розладів ниркової системи, набряку, ниркового вазоспазму, некрозу коркової речовини нирки, гіпонатріємії, гіпокаліємії, синдрому Шварца-Бартера, порушень шлунково-кишкового тракту, гастритного вазоспазму, цирозу печінки, виразки шлунка і кишечнику, блювання, блювання, що виникає у процесі хіміотерапії, блювання при захитуванні; афективних розладів; тривожних розладів; порушень пам'яті і/або хвороби Альцгеймера; психозів і/або психотичних розладів; синдрому Кушинга або інших стресзалежних захворювань; порушень сну; депресивних розладів, таких як розлади настрою, що починаються в дитинстві; вазомоторних симптомів і/або дисфункцій терморегуляції, таких як, наприклад, симптом приливу крові; наркотичних залежностей, лікарських залежностей і/або залежностей, опосередкорваних іншими факторами, для лікування і/або профілактики стресу, викликаного видаленням одного або більше факторів, що опосередкують залежність, і/або для лікування і/або профілактики викликаних стресом рецидивів наркотичних залежностей, лікарських залежностей і/або залежностей, опосередкованих іншими факторами; шизофренії і/або психозу і/або уповільненого сечовипускання. 22. Спосіб лікування і/або профілактики щонайменше одного порушення, вибраного з групи, яка складається з: діабету, резистентності до інсуліну, нічного нетримання сечі, нетримання, захворювань, при яких виникають порушення згортання крові; 7 96785 8 гіпертензії, легеневої гіпертензії, серцевої недостатності, інфаркту міокарда, коронарного спазму, нестабільної стенокардії, РТСА (черезшкірна транслюмінальна коронарна ангіопластика), ішемічної хвороби серця, розладів ниркової системи, набряку, ниркового вазоспазму, некрозу коркової речовини нирки, гіпонатріємії, гіпокаліємії, синдрому Шварца-Бартера, порушень шлунково-кишкового тракту, гастритного вазоспазму, цирозу печінки, виразки шлунка і кишечнику, блювання, блювання, що виникає в процесі хіміотерапії, і блювання при захитуванні; афективних розладів; тривожних розладів і/або стресзалежних тривожних розладів; порушень пам'яті і/або хвороби Альцгеймера; психозів і/або психотичних розладів; синдрому Кушинга; порушень сну; депресивних розладів, таких як розлади настрою, що починаються в дитинстві; вазомоторних симптомів і/або дисфункцій терморегуляції, таких як, наприклад, симптом приливу крові; наркотичних залежностей, лікарських залежностей і/або залежностей, опосередкованих іншими факторами, лікування і/або профілактики стресу, викликаного видаленням одного або більше факторів, що опосередкують залежність, і/або лікування і/або профілактики викликаних стресом рецидивів наркотичних залежностей, лікарських залежностей і/або залежностей, опосередкованих іншими факторами; шизофренії і/або психозу; і уповільненого сечовипускання у пацієнта, який відрізняється тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) за будь-яким з пп. 1-17 або щонайменше однієї її фармацевтично прийнятної солі, однієї її таутомерної форми або одних її проліків. 23. Спосіб за п. 22, який відрізняється тим, що пацієнтом є ссавець, переважно людина, або трансгенний ссавець, який не є людиною. Даний винахід стосується нових заміщених похідних оксиндолу, лікарських засобів, що містять їх, та їх застосування для лікування захворювань. Вазопресин являє собою ендогенний гормон, який виявляє широко різноманітні ефекти на органи і тканини. Передбачають, що система вазопресину стосується різних патологічних станів, таких як, наприклад, серцева недостатність і високий кров'яний тиск. На сьогоднішній день відомі три рецептори (V1a, V1b або V3 і V2), за допомогою яких вазопресин опосередковує свої численні ефекти. Отже, антагоністи даних рецепторів досліджуються як нові можливі терапевтичні підходи до лікування захворювань (М. Thibonnier, Exp. Opin. Invest. Drugs 1998, 7(5), 729-740). У даному описі описані нові заміщені оксиндоли, що несуть арилсульфонільну групу в положенні 1. Раніше як ліганди рецепторів вазопресину були описані 1-фенілсульфоніл-1,3-дигідро-2Ніндол-2-они. У WO9315051, WO9518105, WO9825901, WO0155130, WO0155134, WO0164668 і WO0198295 описуються похідні, одержані з оксиндольного кістяка і які несуть арилсульфонільні групи в положенні 1. Зазначені сполуки відрізняються по суті заміщенням у положенні 3. Зокрема, у WO9315051 і WO9825901 описані 1-фенілсульфоніл-1,3-дигідро-2Н-індол-2-они, де оксиндольна структура заміщена в положенні 3 двома алкільними радикалами, які можуть також утворювати разом циклоалкільний радикал (спірозв'язок) у ролі лігандів рецепторів вазопресину. Альтернативно, спірокільце може містити гетероатоми, такі як кисень і азот (необов'язково із замісниками). У WO9518105 описані 1-фенілсульфоніл-1,3дигідро-2Н-індол-2-они, що несуть атом азоту в положенні 3, у ролі лігандів рецепторів вазопреси ну. Крім того, у положенні 3 приєднані радикали, які вибирають із групи, що складається з алкілу, циклоалкілу, фенілу і бензилу (у кожному випадку необов'язково із замісниками). У WO03008407 описані 1фенілсульфонілоксиндоли, де піридилпіперазини приєднані до оксиндолу в положенні 3 через оксикарбонільну групу. У WO2005030755 описана як приклад 108, карбаматна сполука, 5-ціано-1-(2,4диметоксифенілсульфоніл)-3-(2-метоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іловий ефір 4-(1метилпіперидин-4-іл)піперазин-1-карбонової кислоти (згідно з номенклатурою IUРАС: 5-ціано-1[(2,4-диметоксифеніл)сульфоніл]-3-(2метоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол3-іл-4-(1-метилпіперидин-4-іл)піперазин-1карбоксилат). У WO06005609 описані сполуки 2етоксифенілсечовини, N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксифеніл)-2оксо-2,3-дигідро-1Н-індол-3-іл]-4-(1метилпіперидин-4-іл)піперазин-1-карбоксамід (як приклад 119) і N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксифеніл)-2оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4метилпіперазин-1-іл)піперидин-1-карбоксамід (як приклад 128). Крім афінності зв'язування з рецептором вазопресину V1b, для лікування і/aбо профілактики вазопресин-залежних порушень можуть бути корисними додаткові властивості, такі як, наприклад: 1.) селективність стосовно рецептора вазопресину V1b порівняно з рецептором вазопресину V1a, тобто відношення афінності зв'язування з рецептором V1a (Ki(V1a) (визначеного в "наномолярних (нМ)" одиницях) і афінності зв'язування з рецептором V1b (Ki(V1b)) (визначеного в "наномо 9 лярних (нМ)" одиницях). Чим більше співвідношення Ki(V1a)/Ki(V1b), тим вище V1b селективність; 2.) селективність стосовно рецептора вазопресину V1b у порівнянні з рецепторрм вазопресину V2, тобто відношення афінності зв'язування з рецептором V2 (Ki(V2) (визначеного в "наномолярних (нМ)" одиницях) і афінності зв'язування з рецептором V1b (Ki(V1b)) (визначеного в "наномолярних (нМ)" одиницях). Чим більше відношення Ki(V2)/Ki(V1b), тим вище V1b селективність; 3.) селективність стосовно рецептора вазопресину V1b в порівнянні з рецептором окситоцину ОТ, тобто відношення афінності зв'язування з рецептором ОТ (Ki(ОТ) (визначеного в "наномолярних (нМ)" одиницях) і афінності зв'язування з рецептором V1b (Ki(V1b)) (визначеного в "наномолярних (нМ)" одиницях). Чим більше відношення Ki(OT)/Ki(V1b), тим вище V1b селективність; 4.) метаболічна стабільність, визначена, наприклад, із застосуванням періоду напіввиведення, визначеного in vitro в мікросомах печінки різних видів (наприклад, щура або людини); 5.) лише незначне, якщо взагалі є, інгібування ферментів цитохрому Р450 (CYP): цитохром Р450 (CYP) являє собою назву суперсімейства гемвмісних білків, що мають ферментативну активність (оксидаз). Вони також особливо важливі для розкладання (метаболізму) чужорідних речовин, таких як фармацевтичні засоби або ксенобіотики, в організмах ссавців. Самими важливими представниками типів і підтипів CYP в організмі людини є: CYP 1А2, CYP 2С9, CYP 2D6 і CYP 3A4. При одночасному введенні CYP 3A4 інгібіторів (наприклад, сік грейпфрута, циметидин, еритроміцин) і лікарських засобів, які розкладаються під впливом даної ферментативної системи, і які, таким чином, конкурують за один і той же сайт зв'язування на ферменті, розкладання їх може сповільнитися, і дії і побічні ефекти введеного лікарського засобу можуть посилитися небажаним чином; 6.) придатна розчинність у воді (в мг/мл); 7.) придатна фармакокінетика (часовий профіль концентрації сполуки згідно з даним винаходом у плазмі або в тканинах, наприклад, у мозку). Фармакокінетику можна описати наступними параметрами: період напіввиведення, об'єм розподілу, плазмовий кліренс, AUC ("площа під кривою", площа під кривою концентрація-час), біодоступність при оральному введенні, співвідношення концентрації речовини в мозку/плазмі; 8.) певна частка активної речовини присутня у зв'язаному з білками плазми стані (величина зв'язування ліки/білок плазми (РРВ)); 9.) тільки незначне блокування каналу hERG або відсутність блокування зовсім: сполуки, які блокують канал hERG, можуть збільшувати інтервал QT, що призводить, таким чином, до серйозних порушень пульсу (наприклад, "піруетна шлуночкова тахікардія"). Застосовуючи описаний у літературі замісний аналіз із радіоактивно міченим дофетилідом (G.J. Diaz et al., Journal of Pharmacological and Toxicological Methods, 50 (2004), 187-199), можна визначити здатність спо 96785 10 лук блокувати калієві канали hERG. Чим нижчий ІС50 за результатами "дофетилідного аналізу", тим більше є вірогідним сильне блокування hERG. Крім того, ступінь блокування каналу hERG можна оцінити за допомогою електрофізичних експериментів, застосовуючи клітини, трансфековані каналом hERG, за допомогою способу "фіксації потенціалу цілої клітини" (G.J. Diaz et al., Journal of Pharmacological and Toxicological Methods, 50 (2004), 187-199). Метою даного винаходу є забезпечення сполуки з високою і селективною активністю, переважно, зокрема, стосовно рецептора вазопресину V1b, для лікування або профілактики різних вазопресин-залежних захворювань. Крім того, речовина відповідно до винаходу повинна мати одну або більше з наведених вище переваг 1.)-9.), зокрема, відповідну селективність стосовно рецептора V1b у порівнянні рецептором V1a. Дана мета досягається сполуками загальної формули (І) дe R1 являє собою етоксигрупу; R2 являє собою водень; R3 являє собою ціаногрупу; R4 являє собою водень; R5 являє собою водень, метоксигрупу або етоксигрупу; R6 являє собою водень або метоксигрупу; R7 являє собою водень, метил, етил,н-пропіл або ізопропіл; X1 являє собою -NH-; Х2 являє собою N або СН; X3 являє собою N або СН; де Х2 і X3 не є одночасно N (інакше кажучи, атомом азоту); та їхніми фармацевтично прийнятними солями, таутомерними формами і проліками. Відповідно, даний винахід стосується сполук загальної формули (І) (також "сполуки (І)" нижче), включаючи їх таутомерні форми і фармацевтично прийнятні солі сполук (І), і проліків сполук (І). Переважним об'єктом даного винаходу є сполуки загальної формули (І), де R1 являє собою етоксигрупу; R2 являє собою водень; R3 являє собою ціаногрупу; R4 являє собою водень; 11 96785 R5 являє собою водень або метоксигрупу, особливо метоксигрупу; R6 являє собою водень або метоксигрупу, особливо метоксигрупу; R7 являє собою водень, метил, етил, н-пропіл або ізопропіл; X1 являє собою -ΝΗ-; Х2 являє собою N або СН; X3 являє собою N або СН; де Х2 і X3 не є одночасно атомом азоту; і їх фармацевтично прийнятні солі, таутомерні форми і проліки. Особливо переважним об'єктом даного винаходу є сполуки загальної формули (І), де R1 являє собою етоксигрупу; R2 являє собою водень; R3 являє собою ціаногрупу; R4 являє собою водень; R5 являє собою водень або метоксигрупу, особливо метоксигрупу; R6 являє собою водень або метоксигрупу, особливо метоксигрупу, зокрема, метил або етил; R7 являє собою водень, метил або етил; X1 являє собою -ΝΗ-; Х2 являє собою Ν; X3 являє собою СН; та їх фармацевтично прийнятні солі, таутомерні форми і проліки. Додатковим особливо переважним об'єктом даного винаходу є сполуки загальної формули (І), де R1 являє собою етоксигрупу; R2 являє собою водень; R3 являє собою ціаногрупу; R4 являє собою водень; R5 являє собою водень або метоксигрупу, особливо метоксигрупу; R6 являє собою водень або метоксигрупу, особливо метоксигрупу; R7 являє собою водень, метил або етил, особливо метил або етил; X1 являє собою -NH-; Х2 являє собою СН; X3 являє собою N; та їх фармацевтично прийнятні солі, таутомерні форми і проліки. 12 Додатковим особливо переважним об'єктом даного винаходу є сполуки загальної формули (І), де R1 являє собою етоксигрупу; R2 являє собою водень; R3 являє собою ціаногрупу; R4 являє собою водень; R5 являє собою водень або метоксигрупу, особливо метоксигрупу; R6 являє собою водень або метоксигрупу, особливо метоксигрупу; R7 являє собою водень, метил або етил, особливо метил або етил; X1 являє собою -NH-; Х2 являє собою СН; X3 являє собою СН; та їх фармацевтично прийнятні солі, таутомерні форми і проліки. Додатковим особливо переважним об'єктом даного винаходу є сполука загальної формули (І), де R1 являє собою етоксигрупу; R2 являє собою водень; R3 являє собою ціаногрупу; R4 являє собою водень; R5 являє собою метоксигрупу; R6 являє собою метоксигрупу; R7 являє собою метил або етил; X1 являє собою -NH-; Х2 являє собою СН, і X3 являє собою N; або Х2 являє собою N, і X3 являє собою СН; та їх фармацевтично прийнятні солі, таутомерні форми і проліки. Прикладами переважних варіантів здійснення даного винаходу є сполука відповідно до загальної формули (І) та їх фармацевтично прийнятні солі, таутомерні форми і перелік де R1 являє собою етоксигрупу, R2 являє собою водень, R3 являє собою ціаногрупу, R4 являє собою водень, X1 являє собою NH, і де радикали Х2, X3, R5, R6 і R7 мають у кожному випадку значення, перераховані в одному із рядів таблиці 1 нижче. Таблиця 1 Приклад № 1 2 3 4 5 6 7 8 9 10 11 12 13 Х2 N N N N N N N N N N N N N X3 СН СН СН СН СН СН СН СН СН СН СН СН СН R5 метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа R6 метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа R7 метил метил метил метил метил метил етил етил етил етил етил етил н-пропіл 13 96785 14 Продовження таблиці 1 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 N N N N N Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН CH СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν Ν СН СН СН СН СН СН СН СН СН СН метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η н-пропіл н-пропіл н-пропіл н-пропіл н-пропіл ізопропіл ізопропіл ізопропіл ізопропіл ізопропіл ізопропіл Η Η Η Η Η Η метил метил метил метил метил метил етил етил етил етил етил етил н-пропіл н-пропіл н-пропіл н-пропіл н-пропіл н-пропіл ізопропіл ізопропіл ізопропіл ізопропіл ізопропіл ізопропіл Η Η Η Η Η Η метил метил метил метил метил метил етил етил етил етил 15 96785 16 Продовження таблиці 1 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа метоксигрупа метоксигрупа етоксигрупа Η Η етоксигрупа Зокрема, даний винахід стосується наступної сполуки формули Іа (яка відповідає сполуці прикладу 1 таблиці 1) а також фармацевтично прийнятних солей, таутомерних форм і проліків Іа. Зокрема, даний винахід також стосується сполуки прикладу 7 таблиці 1, а також її фармацевтично прийнятних солей, таутомерних форм і проліків. Зокрема, даний винахід також стосується сполуки прикладу 31 таблиці 1, а також її фармацевтично прийнятних солей, таутомерних форм і проліків. Зокрема, даний винахід також стосується сполуки прикладу 37 таблиці 1, а також її фармацевтично прийнятних солей, таутомерних форм і проліків. Сполуки (І) або (Іа) даного винаходу мають хіральний центр у положенні 3 2-оксиндольного кільця. Відповідно до даного винаходу сполуки загальної формули (І) або (Іа) можуть являти собою, отже, суміш енантіомерів 1:1 (рацемат) або нерацемічну суміш енантіомерів, в якій один із двох енантіомерів, тобто або (лівообертальний) енантіомер, який обертає площину поляризації лінійно метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа метоксигрупа Η Η Η метоксигрупа метоксигрупа етил етил н-пропіл н-пропіл н-пропіл н-пропіл н-пропіл н-пропіл ізопропіл ізопропіл ізопропіл ізопропіл ізопропіл ізопропіл Η Η Η Η Η Η поляризованого світла ліворуч ((-)-енантіомер нижче), або (правообертальний) енантіомер, який обертає площину поляризації лінійно поляризованого світла праворуч ((+)-енантіомер нижче), є збагаченим, або по суті енантіомерно чисті сполуки (енантіомерний надлишок ее >90%), тобто по суті енантіомерно чистий (-)-енантіомер або (+)енантіомер. Переважно, сполуки являють собою по суті енантіомерно чисті сполуки. Особлива перевага віддається сполукам, які по суті є енантіомерно чистими (ее >90%). Даний винахід, отже, забезпечує чисті енантіомери, а також їх суміші, наприклад, суміші, в яких один енантіомер присутній у збагаченій формі, а також рацемати. Даний винахід також забезпечує фармацевтично прийнятні солі, таутомери і проліки чистих енантіомерів (І) або (Іа), і енантіомерні суміші у вигляді фармацевтично прийнятних солей, таутомеріє і проліків сполуки (І) або (Іа). Переважними варіантами здійснення даного винаходу є сполуки загальної формули (І) або (Іа), як визначено вище, які характеризуються тим, що вони знаходяться в оптично активній формі і, у кожному окремому випадку, являють собою енантіомер, який обертає площину поляризації поляризованого світла ліворуч, (тобто лівообертальний енантіомер) сполуки загальної формули (І), про яку йде мова, у вигляді вільної основи, або їхня фармацевтично прийнятна сіль, таутомерна форма або проліки. Лівообертальні енантіомери сполук (І) або (Іа) також називаються нижче (-)енантіомерами. Переважними варіантами здійснення даного винаходу є такі сполуки загальної формули (І) або (Іа), як визначено вище, які характеризуються тим, що вони знаходяться в оптично активній формі, причому абсолютна конфігурація хірального атома вуглецю кільця С-3 таких сполук відповідає абсолютній конфігурації при С-3 (-)-енантіомера сполуки формули (Іа) у вигляді вільної основи. Така конфігурація нижче також називається "переваж 17 ною конфігурацією". Рентгено-структурні аналізи показали, що (-)-енантіомер сполук формули (Іа) має S конфігурацію стосовно центра асиметрії біля атома вуглецю положення З оксиндольного кільця. Відповідно до даного винаходу віддається перевага сполукам загальної формули (І) або (Іа), їхнім таутомерам, їхнім фармацевтично прийнятним солям і їхнім пролікам, як визначено вище, в яких відповідний (-)-енантіомер представлений при оптичній чистоті (енантіомерний надлишок, ее) більше 50%. Відповідно до даного винаходу віддається перевага сполукам загальної формули (І) або (Іа), їхнім таутомерам, їхнім фармацевтично прийнятним солям і їхнім пролікам, як визначено вище, в яких енантіомер, що має переважну абсолютну конфігурацію біля атома вуглецю кільця С-3 представлений при оптичній чистоті (енантіомерний надлишок, ее) більше 50%. Відповідно до даного винаходу віддається перевага сполукам загальної формули (І) або (Іа), їхнім таутомерам, їхнім фармацевтично прийнятним солям і їхнім пролікам, як визначено вище, в яких відповідний (-)-енантіомер представлений при оптичній чистоті (енантіомерний надлишок, ее) більше за 90%. Відповідно до даного винаходу віддається перевага сполукам загальної формули (І) або (Іа), їхнім таутомерам, їхнім фармацевтично прийнятним солям і їхнім пролікам, як визначено вище, в яких енантіомер, що має переважну абсолютну конфігурацію біля атома вуглецю кільця С-3, представлений при оптичній чистоті (енантіомерний надлишок, ее) більше 90%. Аналогічно, переважними варіантами здійснення даного винаходу є сполуки загальної формули (І) або (Іа), як визначено вище, які характеризуються тим, що вони знаходяться в оптично неактивній формі, інакше кажучи, у вигляді рацемату, або у вигляді фармацевтично прийнятної солі, таутомерної форми або проліків рацемату. Додатковий об'єкт даного винаходу стосується лікарських засобів, що містять щонайменше одну сполуку загальної формули (І) або (Іа) і/або її фармацевтично прийнятну сіль або проліки, як визначено вище. Додатковий об'єкт даного винаходу стосується сполук загальної формули (І) або (Іа) і/або їхньої фармацевтично прийнятної солі або їхніх проліків, як визначено вище, для застосування як лікарський засіб. Додатковий об'єкт даного винаходу стосується сполук загальної формули (І) або (Іа) і/або їхньої фармацевтично прийнятної солі або їхніх проліків, як визначено вище, для застосування в терапії або профілактиці захворювання, зокрема, вазопресинзалежного захворювання або захворювання, наведеного в контексті даного опису. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або її проліків, як визначено вище, для лікування і/або профілактики щонайменше одного вазопресин-залежного захворювання і/або 96785 18 для виробництва лікарського засобу для лікування і/або профілактики щонайменше одного вазопресин-залежного захворювання. Вазопресинзалежними захворюваннями є такі захворювання, при яких розвиток захворювання залежить щонайменше частково від вазопресину, тобто захворювання, при яких рівень вазопресину, який може прямо або непрямо впливати на картину захворювання, підвищується. Даний винахід також стосується застосування сполук (І) або (Іа) відповідно до даного винаходу і/або їхньої фармацевтично прийнятної солі або проліків для лікування і/або профілактики захворювання, при якому розвиток захворювання залежить щонайменше частково від вазопресину, тобто захворювання, при яких рівень вазопресину, який може прямо або непрямо впливати на картину захворювання, підвищується. Даний винахід також стосується застосування сполук (І) або (Іа) відповідно до винаходу і/або їхньої фармацевтично прийнятної солі або проліків для одержання лікарського засобу для лікування і/або профілактики подібного захворювання. Даний винахід стосується, зокрема, застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування і/або профілактики щонайменше одного порушення, вибраного з групи, що складається з діабету, зокрема, нецукрового діабету, резистентності до інсуліну, нічного нетримання сечі, нетримання, захворювань, при яких відбуваються порушення згортання крові, і/або уповільненого сечовипускання і застосування їх для виробництва лікарського засобу для лікування і/або профілактики щонайменше одного з наведених вище захворювань. Даний винахід стосується, зокрема, застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування і/або профілактики щонайменше одного порушення, вибраного з групи, що складається з гіпертензії, легеневої гіпертензії, серцевої недостатності, інфаркту міокарда, коронарного спазму, нестабільної стенокардії, ЧТКА (РТСА, черезшкірна транслюмінальна коронарна ангіопластика), ішемічної хвороби серця, порушень ниркової системи, набряку, ниркового вазоспазму, некрозу коркової речовини нирки, гіпонатріємії, гіпокаліємії, синдрому Шварца-Бартеру, порушень шлунково-кишкового тракту, гастритного вазоспазму, цирозу печінки, виразки шлунка і кишечнику, блювання, блювання, що виникає в процесі хіміотерапії, і блювання при захитуванні, і застосування їх для виробництва лікарського засобу для лікування і/або профілактики щонайменше одного з перерахованих вище захворювань. Сполуки (І) або (Іа) даного винаходу, їх солі, їх таутомери та їх проліки також можуть застосовуватися для лікування різних вазопресин-залежних захворювань, які виявляються центральними нервовими факторами або порушеннями в НРА-осі (гіпоталамо-гіпофізарно-наднирникової осі), наприклад, для афективних розладів, таких як депресивні розлади і біполярні розлади. Вони вклю 19 чають, наприклад, дистимічні розлади, фобію, посттравматичні стресові розлади, синдроми генералізованої тривоги, панічні розлади, сезонні депресії і порушення сну. Сполуки (І) або (Іа) даного винаходу, їх солі, їх таутомери та їх проліки можуть аналогічно застосовуватися для лікування у випадках тривожних розладів і стресозалежних тривожних розладів, таких як, наприклад, генералізовані тривожні розлади, фобія, посттравматичні тривожні розлади, панічні тривожні розлади, обсесивно-компульсивні тривожні розлади, гострі стресозалежні тривожні розлади і соціофобія. Сполуки даного винаходу можуть, крім того, застосовуватися також для лікування порушень пам'яті, хвороби Альцгеймера, психозів, психотичних розладів, порушень сну і/або синдрому Кушинга, і всіх стресозалежних захворювань. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування афективних розладів і/або для виробництва лікарського засобу для лікування афективних розладів. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування тривожних розладів і/або стресозалежних тривожних розладів і/або для виробництва лікарського засобу для лікування тривожних розладів і/або стресозалежних тривожних розладів. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування порушень пам'яті і/або хвороби Альцгеймера і/або для виробництва лікарського засобу для лікування порушень пам'яті і/або хвороби Альцгеймера. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування психозів і/або психотичних розладів і/або для виробництва лікарського засобу для лікування психозів і/або психотичних розладів. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування синдрому Кушинга або інших стресозалежних захворювань і/або для виробництва лікарського засобу для лікування синдрому Кушинга або інших стресозалежних захворювань. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування порушень сну і/або для виробництва лікарського засобу для лікування порушень сну. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично 96785 20 прийнятної солі або проліків, як визначено вище, для лікування депресивних розладів і/або для виробництва лікарського засобу для лікування депресивних розладів. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування розладів настрою, що починаються в дитинствіі/або для виробництва лікарського засобу для лікування розладів настрою, що починаються в дитинстві. Мається на увазі, що термін "розлади настрою, які починаються в дитинстві" означає розлади настрою і депресії, які починають виявлятися ще в дитячому віці. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування вазомоторних симптомів і/або дисфункцій терморегуляції, таких як, наприклад, симптом припливу крові. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування і/або профілактики припливу і/або залежностей, опосередкованих іншими факторами, для лікування і/або профілактики стресу, викликаного видаленням одного або більше факторів, опосередковуючих залежність, і/або для лікування і/або профілактики викликаних стресом рецидивів припливу і/або залежностей, опосередкованих іншими факторами. Додатковий об'єкт даного винаходу стосується застосування щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків, як визначено вище, для лікування і/або профілактики шизофренії і/або психозу. Додатковий об'єкт даного винаходу стосується способу лікування і/або профілактики щонайменше одного розладу, вибраного з групи, що складається з діабету, зокрема, нецукрового діабету, резистентності до інсуліну, нічного нетримання сечі, нетримання, захворювань, при яких відбуваються порушення згортання крові, і для сповільненого сечовипускання у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу лікування і/або профілактики щонайменше одного розладу, вибраного з групи, що складається з гіпертензії, легеневої гіпертензії, серцевої недостатності, інфаркту міокарда, коронарного спазму, нестабільної стенокардії, РТСА (черезшкірна транслюмінальна коронарна ангіопластика), ішемічної хвороби серця, розладів ниркової системи, набряку, ниркового вазоспазму, некрозу коркової речовини нирки, гіпонатріємії, гіпокаліємії, синдрому Шварца-Бартеру, порушень шлунковокишкового тракту, гастритного вазоспазму, цирозу печінки, виразки шлунка і кишечнику, блювання, 21 блювання, що виникає в процесі хіміотерапії, і блювання при захитуванні у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу лікування і/або профілактики афективних розладів у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу лікування тривожних розладів і/або стресозалежних тривожних розладів у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу лікування порушень пам'яті і/або хвороби Альцгеймера у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу лікування психозів і/або психотичних розладів у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу лікування синдрому Кушинга у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу лікування порушень сну у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу лікування депресивних розладів у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу лікування і/або профілактики вазомоторних симптомів і/або дисфункцій терморегуляції, такого як, наприклад, симптом припливу крові, у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу лікування і/або профілактики наркотичних залежностей, лікарських залежностей і/або залежностей, опосередкованих іншими факторами, лікування і/або профілактики стресу, викликаного видаленням одного або більше факторів, що опосередковують залежність, і/або лікування і/або 96785 22 профілактики викликаних стресом рецидивів наркотичних залежностей, лікарських залежностей і/або залежностей, опосередкованих іншими факторами у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу лікування і/або профілактики шизофренії і/або психозу у пацієнта, що характеризується тим, що пацієнту вводять ефективну кількість щонайменше однієї сполуки загальної формули (І) або (Іа) і/або її фармацевтично прийнятної солі або проліків. Додатковий об'єкт даного винаходу стосується способу, як визначений вище, який характеризується тим, що пацієнтом є ссавець, переважно людина або ссавець, або трансгенний ссавець, що не є людиною. Сполуки загальної формули (І) або (Іа), їх фармацевтично прийнятні солі і проліки, як визначено вище, можуть бути одержані фахівцем, що знає технічні основи даного винаходу, при проведенні і/або при аналогічному проведенні стадій способу, відомих самих по собі. Додатковий переважний варіант здійснення стосується сполук загальної формули (І) або (Іа), їхніх таутомерів, їхніх проліків та їхніх фармацевтично прийнятних солей, як описано вище, які характеризуються тим, що вони є селективними стосовно рецептора вазопресину підтипу V1b у порівнянні з щонайменше одним із близькоспоріднених підтипів рецептора вазопресину/о кситоцину (наприклад, вазопресин V1a, вазопресин V2 і/або окситоцин). Додатковий переважний варіант здійснення стосується сполук загальної формули (І) або (Іа), їхніх таутомерів, їхніх проліків і їхніх фармацевтично прийнятних солей, як описано вище, які характеризуються тим, що вони мають поліпшену метаболічну стабільність. Метаболічну стабільність сполуки можна визначити, наприклад, за допомогою інкубування розчину даної сполуки з мікросомами печінки з певних видів (наприклад, щура, собаки або людини) і визначення періоду напіввиведення сполуки в даних умовах (RS Obach, Curr Opin Drug Discov Devel. 2001, 4, 36-44). По більш тривалому періоді напіввиведення, що спостерігається, можна зробити висновок про те, що метаболічна стабільність даної сполуки поліпшується. Стабільність у присутності людських мікросом печінки представляє особливий інтерес, оскільки вона дає можливість передбачити метаболічне розкладання даної сполуки в печінці людини. Отже, сполуки з підвищеною метаболічною стабільністю (визначеною за результатами тесту мікросом печінки), можливо, також розкладаються повільніше в печінці. Повільніше метаболічне розкладання в печінці може привести до вищих і/або тривало діючих концентрацій (ефективних рівнів) сполуки в організмі таким чином, що період напіввиведення сполук відповідно до даного винаходу збільшується. Підвищені і/або тривало діючі ефективні рівні можуть призвести до вищої ефективності даної сполуки при лікуванні 23 або профілактиці різних вазопресин-залежних захворювань. Поліпшена метаболічна стабільність може, крім того, призвести до підвищеної біодоступності при оральному введенні, оскільки сполука, будучи абсорбованою в кишечнику, у меншій мірі зазнає метаболічного розкладання в печінці (так званий ефект першого проходження). Підвищена оральна біодоступність може, оскільки концентрація (ефективний рівень) сполуки підвищена, призвести до вищої ефективності даної сполуки при оральному введенні. Додатковий переважний варіант здійснення стосується сполук загальної формули (І), як описано вище, що характеризується тим, що у пацієнтів або відповідних моделей тварин, які дозволяють робити прогнози з приводу терапевтичного застосування, вони мають поліпшену фармакологічну активність у порівнянні з оксиндольними сполуками, відомими на попередньому рівні техніки. Кожне із заявлених переважних значень замісника можна комбінувати з будь-якими значеннями інших замісників. Даний винахід стосується, зокрема, сполук загальної формули (І), які вибирають з групи, що складається зі сполук прикладів, перерахованих нижче, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89 и 90, а також їхніх таутомерних форм, їхніх проліків і особливо їхніх фізіологічно прийнятних солей, та їхніх несольових форм, таких як гідрати і/або сольвати. Особлива перевага віддається забезпеченню зазначених вище сполук у вигляді вільної основи або у вигляді кислотноадитивних солей. Даний винахід, зокрема, також стосується (-)енантіомерів сполук прикладів 1-90 відповідно до загальної формули (І), вибраних зі сполук прикладів, перерахованих нижче, 1B, 2В, 3B, 4В, 5В, 6В, 7В, 8В, 9В, 10В, 11В, 12В, 13В, 14В, 15В, 16В, 17В, 18В, 19В, 20В, 21В, 22В, 23В, 24В, 25В, 26В, 27В, 28В, 29В, 30В, 31B, 32В, 33В, 34В, 35В, 36В, 37В, 38В, 39В, 40В, 41В, 42В, 43В, 44В, 45В, 46В, 47В, 48В, 49В, 50В, 51В, 52В, 53В, 54В, 55В, 56В, 57В, 58В, 59В, 60В, 61В, 62В, 63В, 64В, 65В, 66В, 67В, 68В, 69В, 70В, 71В, 72В, 73В, 74В, 75В, 76В, 77В, 78В, 79В, 80В, 81В, 82В, 83В, 84В, 85В, 86В, 87В, 88В, 89В і 90В, а також таутомерних форм, проліків і особливо їхніх фізіологічно прийнятних солей, і несольових форм, таких як гідрати і/або сольвати сполук формули (І). Особлива перевага віддається забезпеченню зазначених вище сполук у вигляді вільної основи або у вигляді кислотно-адитивних солей. Мається на увазі, що термін "проліки" означає такі сполуки, які метаболізуються in vivo у сполуки відповідно до даного винаходу. Конкретні приклади проліків описані в C.G. Wermeth (Ed.): The Practice of Medicinal Chemistry, Academic Press, San Diego, 1996, pages 671-715. Вони включають, наприклад, фосфати, карбамати або амінокислоти, складні ефіри та інші. У даному винаході при 96785 24 датними проліками сполук формули І є сполуки формули І, де атом азоту, який несе R7, являє собою частину амідної/пептидної групи, тобто азот несе ацильну групу, таку як С1-С4алкілкарбонільна група, наприклад, ацетильна, пропіонільна, н-бутирильна (н-пропілкарбонільна), ізобутирильна, н-бутилкарбонільна або третбутилкарбонільна (півалоїл), бензоїльна, СО зв'язаний радикал, одержаний з амінокислоти, такої як СО зв'язаний радикал, одержаний із гліцину, аланіну, серину, фенілаланіну і т.д. Придатні проліки також включають алкілкарбонілоксіалкілкарбамат, де радикал R7 у формулі І являє собою функціоa b нальну групу формули -C(=O)-O-CHR -O-C(=O)-R , a b де R і R , незалежне один від одного, вибирають із С1-С4алкільних груп. Подібні карбамати були широко описані J. Alexander, R. Cargill, S.R. Michelson, H. Schwam, J. Medicinal Chem. 1988, 31(2), 318-322. Дані групи відщеплюються в метаболічних умовах, даючи сполуку формули І, де R7 являє собою водень. Даний винахід, крім того, стосується фармацевтично прийнятних солей сполук формули І, які також називаються фізіологічно прийнятними солями. Дані солі в основному одержують шляхом взаємодії вільної основи сполук (І) відповідно до даного винаходу з придатною кислотою. Придатні кислоти перераховані, наприклад, у "Fortschritte der Arzneimittelforschung" [Advances in Drug Research], 1966, Birkhauser Verlag, Vol. 10, pp. 224285. Вони включають, наприклад, хлористоводневу кислоту, лимонну кислоту, винну кислоту, молочну кислоту, фосфорну кислоту, метансульфонову кислоту, оцтову кислоту, мурашину кислоту, малеїнову кислоту і фумарову кислоту. Сполуки даного винаходу є ефективними при введенні різними способами. Введення, наприклад, можна провести внутрішньовенно, внутрішньом'язово, підшкірно, місцево, внутрішньотрахеально, інтраназально, трансдермально, вагінально, ректально, сублінгвально, букально або орально, і часто його проводять внутрішньовенно, внутрішньом'язово або особливо орально. Даний винахід також стосується фармацевтичних композицій, які містять сполуку (І) даного винаходу і/або її таутомер, і/або її фармацевтично прийнятну сіль, і/або її проліки і придатні фармацевтичні носії (носії лікарських засобів). Кількість сполуки І у фармацевтичній композиції може залежати від типу формулювання композиції і може лежати, наприклад, у діапазоні від 0,0001 мг/г до 1 г/г, зокрема, від 0,001 мг/г до 0,5 г/г композиції. Такі носії лікарських засобів вибирають відповідно до форми фармацевтичного засобу і бажаного типу введення. Сполуки даного винаходу загальної формули (І) або, за необхідності, придатні солі даних сполук можна використати при виробництві фармацевтичних композицій для орального, сублінгвального, букального, підшкірного, внутрішньом'язового, внутрішньовенного, місцевого, внутрішньотрахеального, інтраназального, трансдермального, вагінального або ректального введення, і можна вводити тваринам або людям у вигляді окремих дозованих форм, змішаних із загальноприйнятими 25 фармацевтичними носіями, для профілактики або лікування зазначених вище порушень або захворювань. Придатні стандартні форми для введення (окремі дозовані форми) включають форми для орального введення, такі як таблетки, желатинові капсули, порошки, гранули, розчини або суспензії для орального введення, форми для сублінгвального, букального, внутрішньотрахеального або інтраназального введення, аерозолі, імплантати, форми для підшкірного, внутрішньом'язового або внутрішньовенного введення і форми для ректального введення. Сполуки даного винаходу можна застосовувати у вигляді кремів, мазей або лосьйонів для місцевого введення. Для досягнення бажаного профілактичного або терапевтичного ефекту, доза активної сполуки може варіюватися від 0,01 до 50 мг на кг масу тіла і на день. Кожна окрема доза може містити від 0,05 до 5000 мг, переважно від 1 до 1000 мг, активної сполуки в комбінації з фармацевтичним носієм. Таку окрему дозу можна вводити від 1 до 5 разів на день, таким чином, щоб вводилася добова доза від 0,5 від 25000 мг, переважно від 1 до 5000 мг. Коли одержують тверду композицію у вигляді таблетки, активну сполуку змішують із фармацевтичним носієм, таким як желатин, крохмаль, лактоза, стеарат магнію, тальк, діоксид кремнію або тощо. Таблетки можуть бути покриті сахарозою, похідним целюлози або іншою придатною речовиною, або можуть бути оброблені іншим способом, для того щоб виявляти пролонговану або відстрочену активність і вивільняти заздалегідь визначену кількість активної сполуки безперервно. Препарат у вигляді желатинових капсул одержують шляхом перемішування активної сполуки з наповнювачем і вміщення одержаної суміші в м'які або тверді желатинові капсули. Препарат у вигляді сиропу або еліксиру або для введення у вигляді крапель може містити активні сполуки разом з підсолоджувачем, який переважно не є калорійним, метилпарабеном або пропілпарабеном у ролі антисептиків, ароматизатором і придатним барвником. Дисперговані у воді порошки або гранули можуть містити активні сполуки в суміші з диспергуючими речовинами, змочувальними реагентами або суспендувальними речовинами, такими як полівінілпіролідони, і підсолоджувачами або покращувачами смаку. Ректальне або вагінальне введення досягається застосуванням супозиторіїв, які одержують за допомогою зв'язувальних речовин, які плавляться при ректальній температурі, наприклад, олія какао або поліетиленгліколі. Парентеральне введення здійснюється за допомогою застосування водних суспензій, ізотонічних сольових розчинів або стерильних розчинів і розчинів, що вводять шляхом ін'єкції, які містять фармакологічно придатні диспергуючі речовини і/або змочувальні реагенти, наприклад, пропіленгліколь або поліетиленгліколь. 96785 26 Активна сполука також може бути сформульована у вигляді мікрокапсул або центросом, якщо необхідно з одним або більше носіями або добавками. Крім сполук загальної формули (І) або їхніх фармацевтично прийнятних солей або проліків, композиції даного винаходу можуть містити додаткові активні сполуки, які можуть бути корисними для лікування уражень або порушень, визначених вище. Крім того, даний винахід, отже, стосується фармацевтичних композицій, які містять безліч активних сполук, де щонайменше одна з них являє собою сполуку (І) відповідно до даного винаходу, її таутомер, сіль або проліки. Одержання сполук даного винаходу Приклади синтетичних підходів одержання похідних оксиндолу даного винаходу описані нижче. Одержання оксиндолів відповідно до даного винаходу можна здійснити різними шляхами, як показано на схемах синтезу 1 і 2. На даних схемах синтезу замісники мають значення, як визначено в загальній формулі (І). 3-Гідрокси-1,3-дигідроіндол-2-они IV можна одержати шляхом додавання металованих гетероциклів III до 3-кетогрупи ізатинів II. Металовані гетероцикли, такі як, наприклад, відповідний реактив Гріньяра (Mg) або органолітієва сполука, можна одержати стандартним способом із галогену або вуглеводневих сполук. Конкретні методики можна знайти в Houben-Weyl, Methoden der Organischen Chemie [Methods of organic chemistry], Vol. 13, 1-2, Chap. Mg and Li compounds. Ізатини II або були комерційно доступними, або були одержані аналогічно до способів, описаних у літературі (Advances in Heterocyclic Chemistry, A.R. Katritzky and AJ. Boulton, Academic Press, New York, 1975, 18, 2-58; J. Brazil. Chem. Soc. 12, 273-324, 2001). Використовуючи KCN або Zn(CN)2 із Pd(0) каталізом у розчинниках, таких як диметилформамід або тетрагідрофуран, якщо необхідно, також із додаванням основ, таких як K2СО3 або інших карбонатів і амінів, при підвищеній температурі можна перетворити 3-гідроксіоксиндоли IV, які в 6членному ароматичному кільці містять, наприклад, 3 4 як радикали R або R , йодний замісник, в аналогічні ціановмісні 3-гідроксіоксиндоли IV. Придатними для використання як солі Pd(0) є, наприклад, комплекси перехідних металів, одержані in situ з PdCl 2 або PdOAc2 шляхом додавання фосфінів, таких як трис(ортотоліл)фосфін. Також можна використати комерційні комплекси паладію, такі як, наприклад, каталізатор тетракис(трифенілфосфін)паладій(0) і/або додаткові фосфінові ліганди. 3-Гідроксіоксиндоли IV можна перетворити в сполуки V, які несуть групу LG', що йде, у положенні 3, причому групою LG', що йде, може бути звичайна група, що йде, така як, наприклад, галогенід, мезилат або тозилат. Проміжна сполука V, де LG', наприклад, означає хлор, можна одержати, обробляючи спирт IV тіонілхлоридом у присутності основи, такої як, наприклад, піридин. Альтернативно, можна одержати спирти IV шляхом перетворення в мезилат, використовуючи метансульфонілхлорид у присутності основи, такої як, наприклад, 27 триетиламін. Далі сполуку V піддають взаємодії з амінами, такими як, наприклад, аміак, що дає аналогічні аміни VI внаслідок реакцій заміщення. Потім після депротонування сильною основою, такою як, наприклад, трет-бутоксид калію або гідрид натрію, у ДМФА, сполуки, такі як сполука VI, можна перетворити в продукт VIII шляхом обробки сульфонілхлоридами VII. Сульфонілхлориди VII, що використовуються, або комерційно доступні, або вони можуть бути одержані способом, аналогічно до відомих методик (див., наприклад, J. Med. Chem. 40, 1149 (1997)). Сполуку VIII перетворюють у сполуку IX за реакцією з реагентами для одержання аміногруп, такими як, наприклад, хлорформіати, ізоціанати або карбамоїлхлориди, в основному застосовуючи стандартні способи (див. J. March, Advanced Organic Chemistry, 1992, 4th edition., Wiley, New York, pages 417-421; 499; 903). Наприклад, LG як 96785 28 група, що йде, може бути О-феніл у сполуці IX, яку одержують взаємодією сполуки VIII з фенілхлорформіатом у присутності основи, такої як, наприклад, піридин. Подальша реакція з амінами X, якщо необхідно при підвищеній температурі і з додаванням допоміжних основ, таких як, наприклад, триетиламін або діізопропілетиламін, дає сполуку відповідно до даного винаходу загальної формули (І). Аміни X або комерційно доступні, або вони можуть бути одержані способами, відомими в літературі. Ще одним альтернативним способом одержання аміну X є взаємодія амінів з альдегідами або кетонами в присутності відновників, таких як, наприклад, ціаноборгідрид натрію або ацетоксиборгідрид натрію, за механізмом відновного амінування (J. March, Advanced Organic Chemistry, 1992, 4th edition., Wiley, New York, pages 411; 898). 29 96785 30 Стадії синтезу для одержання сполук І відповідно до даного винаходу можуть бути переставлені в іншому порядку, як описано на схемі синтезу 2, аналогічно до схеми синтезу 1, представленій вище. Таким чином, спочатку одержують аміногрупу в сполуці VI, використовуючи, наприклад, фенілхлорформіат, внаслідок чого одержують сполуку ХІа і/або ХІb. При надлишку аміну X або ще при сприянні допоміжної основи одержують похідні сечовини XII, які можна перетворити в ході подальшої реакції в інших стандартних умовах шляхом депротонування у сполук XII, використовуючи сильну основу, таку як, наприклад, гідрид натрію або трет-бутоксид калію, і подальшої обробки сульфонілхлоридами VII у ДМФА, у сполуку І відповідно до даного винаходу. Нижче даний винахід ілюструється детальніше з наведенням прикладів, при цьому мається на увазі, що приклади не обмежують даний винахід. Сполуку відповідно до даного винаходу можна одержати за допомогою різних синтетичних підходів. Вище наведені методики, описані відповідно на схемах синтезу 1 і 2. описані детальніше лише як приклад на основі зазначених вище прикладів, при цьому вони не обмежуються виключно синтетичними підходами 1 або 2 або аналогічними наведеними вище методиками. Експериментальна частина Приклад 1 N-[5-Ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-(1-метилпіперидин-4-іл)піперазин-1карбоксамід 1а) 3-(2-Етоксипіридин-3-іл)-3-гідрокси-5-йод1,3-дигідро-2Н-індол-2-он При охолодженні на льодяній бані 20,86 г (76,40 ммоль) 5-йодоізатину перемішували в 400 мл безводного тетрагідрофурану (ТГФ) і додавали невеликими порціями 3,22 г (80,50 ммоль, 60% w/w) гідриду натрію, при цьому температуру підтримували між 0-10°С. При охолодженні на льодяній бані суспензію перемішували протягом однієї години, одержуючи в результаті піридиновий реактив Гріньяра. При кімнатній температурі розчиняли 20 г (80,30 ммоль) 2-етокси-3-йодопіридину в 400 мл безводного ТГФ і протягом 5-10 хвилин додавали до даного розчину 95,6 мл (1М розчин у ТГФ, 95,60 ммоль) етилмагнійброміду при охолодженні, при температурі від 22 до 15°С. Даний розчин перемішували протягом 20 хвилин, протягом цього часу колір змінився від безбарвного до слабо жовтуватого. Потім одержаний розчин піридинових реактивів Гріньяра протягом 5-10 хвилин додавали до охолодженого на льодяній бані розчину натрієвої солі 5-йодоізатину, при цьому температура коливалася від 5 до 18°С. Після закінчення додавання реактиву Гріньяра льодяну баню видаляли і реакційну суміш перемішували при кімнатній температурі протягом ще 2 годин. Додавали наднасичений розчин хлориду амонію, потім етилацетат і одержану суміш перемішували протягом ще 5 хвилин. 31 Водну фазу відділяли та екстрагували етилацетатом (2х). Об'єднані органічні фази промивали водою (2х) і видаляли розчинник при зниженому тиску. Спочатку 5-йодоізатин, що не прореагував, випадав в осад із кубового розведеного розчину, його видаляли, і після додаткової концентрації продукт також викристалізовувався з розчину. Суспензію витримували в холодильнику при 5°С протягом двох годин, потім відфільтровували слабо жовтувату тверду речовину і промивали невеликою кількістю етилацетату. Після сушіння при 40°С виділяли бажаний 3-(2-етоксипіридин-3-іл)-3гідрокси-5-йод-1,3-дигідро-2Н-індол-2-он (17,1 г, 43,16 ммоль, 57%). + ESI-MC [М+Н ]=397,05, обчислено для С15Н13IN2О3=396,19. 1b) 5-Ціано-3-гідрокси-3-(2-етоксипіридин-3-іл)1,3-дигідроіндол-2-он 7,1 г (17,92 ммоль) 3-(2-етоксипіридин-3-іл)-3гідрокси-5-йод-1,3-дигідро-2Н-індол-2-ону перемішували в атмосфері азоту в 100 мл безводного ТГФ при кімнатній температурі. Додавали 2,1 г (17,92 ммоль) ціаніду цинку і потім 0,51 г (0,45 ммоль) тетракис(трифенілфосфін)паладію(0). Реакційну суміш переносили безпосередньо на попередньо нагріту масляну баню при температурі 100°С. Дану суміш перемішували при 100°С (температура масляної бані) і через 30 хвилин додавали ще 0,51 г (0,45 ммоль) каталізатору. Загалом, суміш перемішували протягом 2 годин. Реакційну суміш охолоджували до кімнатної температури і додавали надлишок води. Дану суміш екстрагували етилацетатом (3), і об'єднані органічні фази промивали водою (3). Розчинник випарювали досуха при зниженому тиску і залишок суспендували в невеликих об'ємах етилацетату. Слабо жовтувату тверду речовину відділяли фільтруванням, промивали етилацетатом і сушили у вакуумній сушильній шафі. Можна було виділити 3,7 г (12,44 ммоль, 69,4%) бажаного продукту 5ціано-3-гідрокси-3-(2-етоксипіридин-3-іл)-1,3дигідроіндол-2-он. + ESI-MC [М+Н ]=296,05, обчислено для C16Η13Ν3Ο3=295,30. 1с) 3-Хлор-3-(2-етоксипіридин-3-іл)-2оксоіндолін-5-карбонітрил 6,00 г (20,32 ммоль) 5-ціано-3-гідрокси-3-(2етоксипіридин-3-іл)-1,3-дигідроіндол-2-ону суспендували в атмосфері азоту в 60 мл безводного дихлорметану (висушеного за допомогою молекулярних сит). Потім додавали 2,30 мл (28,45 ммоль) піридину. Реакційну суміш охолоджували до температури 0°С і потім по краплях додавали 2,06 мл (28,45 ммоль) чистого тіонілхлориду (екзотермічна реакція). Дану суміш перемішували при кімнатній температурі протягом однієї години. Спостерігали утворення жовтої суспензії. Протікання реакції відстежували тонкошаровою хроматографією (ТШХ) (силікагель, дихлорметан/метанол у співвідношенні 95:5). Реакційну суміш обережно виливали в льодяну воду. Після 15 хвилин перемішування, відділяли органічну фазу. Водну фазу екстрагували дихлорметаном (2). Всі органічні фази об'єднували, сушили над сульфатом магнію, фільтрували і видаляли розчинник при зниженому 96785 32 тиску. Продукт дав 5,70 г (18,17 ммоль, 89%) 3хлор-3-(2-етоксипіридин-3-іл)-2-оксоіндолін-5карбонітрилу у вигляді аморфної твердої речовини, яку використали для подальшої реакції без додаткового очищення. + ESI-MC [М+Н ]=314,1, обчислено для С1бН12СIN3О2=313,75. 1d) 3-Аміно-3-(2-етоксипіридин-3-іл)-2оксоіндолін-5-карбонітрил 5,70 г (18,17 ммоль) 3-хлор-3-(2етоксипіридин-3-іл)-2-оксоіндолін-5-карбонітрилу розчиняли в 50 мл дихлорметану. До охолодженого реакційного розчину повільно по краплях в атмосфері азоту додавали 14 мл (98,11 ммоль) 7н. метанольного аміачного розчину. Колір розчину змінився на ясно-жовтий, і даний розчин перемішували при кімнатній температурі протягом ночі, і протягом цього часу продукт повільно викристалізовувався з розчину. Протікання реакції відстежували тонкошаровою хроматографією ТШХ (силікагель, дихлорметан/метанол у співвідношенні 9:1). Розчинник видаляли при зниженому тиску, залишок знову збирали і розчиняли в дихлорметані. Потім суміш екстрагували водою. Фази розділяли і жирну фазу, яка утворювалася між фазами, додавали до водної фази. Водну фазу екстрагували етилацетатом доти, поки жирна фаза не переходила в розчин. Всі одержані органічні фази об'єднували і видаляли розчинник при зниженому тиску. Залишок розтирали з діетиловим ефіром, що призводило до утворення твердої речовини, яку відфільтровували і сушили у вакуумній сушильній шафі при помірній температурі (35°С). Це давало 4,54 г (15,43 ммоль, 85%) 3-аміно-3-(2етоксипіридин-3-іл)-2-оксоіндолін-5-карбонітрилу у вигляді твердої речовини. + ESI-MS [М+Н ]=295,3, обчислено для C16H14N4O2=294,32. 1е) 3-Аміно-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксоіндолін-5-карбонітрил 3,54 г (12,03 ммоль) 3-аміно-3-(2етоксипіридин-3-іл)-2-оксоіндолін-5-карбонітрилу розчиняли у 80 мл безводного диметилформаміду (висушеного за допомогою молекулярних сит). В атмосфері азоту і при охолодженні, використовуючи льодяну баню, невеликими порціями додавали 1,49 г (13,23 ммоль) трет-бутоксиду калію. Колір реакційної суміші змінився, і коричневий розчин перемішували при 0°С протягом ще години, щоб депротонування пройшло до кінця. При зниженій температурі додавали 3,16 г (13,23 ммоль) 2,4диметоксибензолсульфонілхлориду і дану суміш перемішували при 0°С протягом ще двох годин. Протікання реакції відстежували тонкошаровою хроматографією ТШХ (силікагель, дихлорметан/метанол у співвідношенні 9:1). Реакційну суміш виливали в льодяну воду і потім екстрагували етилацетатом. Органічну фазу промивали насиченим розчином хлориду натрію, сушили над сульфатом магнію і розчинник випарювали. Залишок суспендували в діетиловому ефірі і перемішували доти, поки продукт не випадав в осад у вигляді твердої речовини і його стало можливо відділити фільтруванням. Після видалення розчинника, ма 33 точний розчин знов обробляли діетиловим ефіром (2), поки, зрештою, після сушіння не одержували 4,67 г (9,44 ммоль, 79%) бажаного 3-аміно-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксоіндолін-5-карбонітрилу у вигляді твердої речовини. + ESI-MC [М+Н ]=495,15, обчислено для C24H22N4O6S=494,53. 1f) Феніл[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]карбамат 4,67 г (9,44 ммоль) 3-аміно-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксоіндолін-5-карбонітрилу розчиняли в 120 мл піридину та охолоджували до 0°С, використовуючи льодяну баню. Додавали 1,30 мл (10,39 ммоль) чистого фенілхлорформіату і перемішували реакційну суміш при 0°С протягом 2 годин. Протікання реакції відстежували тонкошаровою хроматографією ТШХ (силікагель, дихлорметан/метанол у співвідношенні 95:5). Розчинник і особливо піридин видаляли при зниженому тиску, залишок розводили водою та екстрагували етилацетатом (3). Об'єднані органічні фази промивали насиченим розчином хлориду натрію, сушили над сульфатом магнію, фільтрували і розчинник видаляли при зниженому тиску. Слідові кількості піридину видаляли повторним додаванням толуолу і випарюванням на роторному випарнику. До відділеного залишку додавали діетиловий ефір, і тверда речовина кристалізувалась протягом ночі, одержуючи внаслідок 5,62 г (9,14 ммоль, 97%) бажаного продукту феніл [5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]карбамату. + ESI-MC [М+Н ]=615,15, обчислено для C31H26N4O8S=614,64. 1g) N-[5-Ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(1метилпіперидин-4-іл)піперазин-1-карбоксамід Змішували 1,00 г (1,63 ммоль) феніл[5-ціано-1[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]карбамату, 596 мг (3,25 ммоль) 1-(1метилпіперидин-4-іл)піперазину і 8 мл висушеного ТГФ і суміш перемішували при кімнатній температурі протягом 24 годин. Закінчення реакції детектували за допомогою аналітичної ВЕРХ (ОФ, елюенти ацетонітрил/вода, 0,01% ТФОК). Розчинник видаляли і залишок очищали препаративною ВЕРХ, використовуючи дихлорметан і 6% метанол у ролі елюентів на колонці Chromolith (із прямою фазою, компанії Merck). Після повторної колонкової хроматографії стало можливим виділити 230 мг (0,33 ммоль, 21%) N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(1метилпіперидин-4-іл)піперазин-1-карбоксаміду. Альтернативно, обробку та очищення після завершення реакції можна провести, як зазначено нижче: видаляли розчинник. Неочищену речовину розчиняли в етилацетаті та екстрагували 1н. НCl. Домішки виявляли в органічній фазі, при цьому продукт знаходився в кислій водній фазі. Відповід 96785 34 но, водну фазу нейтралізували розчином 2н. NaOH і екстрагували етилацетатом. Після сушіння над сульфатом магнію, фільтрування і видалення етилацетату при зниженому тиску, можна було кристалізувати продукт діетиловим ефіром. N-[5ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-(1-метилпіперидин-4-іл)піперазин-1карбоксамід одержували з виходом >50%. + ESI-MC [М+Н ]=704,2, обчислено для C35H41N7O7S=703,82. 1 Н-ЯМР ([D6]-ДМСО, 400 МГц) [м.д.] = 8,12 (д, 1Н, J=4,8 Гц), 7,88 (д, 1Н, J=8,8 Гц), 7,87 (д, 1Н, J=8,7 Гц), 7,81 (д, 1Н, J=8,5 Гц), 7,72 (д, 1Н, J=7,6 Гц), 7,67 (с, 1Н), 7,64 (с, 1Н), 7,02 (дд, 1H, J=5,0 Гц, J=7,5 Гц), 6,69 (д, 1Н, J=8,9 Гц), 6,65 (с, 1H), 4,15 (м, 2Н), 3,85 (с, 3H), 3,44 (с, 3H), 3,20 (м, 4Н), 2,76 (м, 2Н, J=11,1 Гц), 2,34 (м, 4Н), 2,11 (м, 4Н), 1,81 (м, 2Н, J=11,3 Гц), 1,64 (м, 2Н, J=10,7 Гц), 1,37 (м, 2Н), 1,06 (т, 1Н, J=7,0 Гц). Приклад 5 N-[5-Ціано-3-(2-етоксипіридин-3-іл)-1-[(4метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Ніндол-3-іл}-4-(1-метилпіперидин-4-іл)піперазин-1карбоксамід 5а) Феніл-5-ціано-3-(2-етоксипіридин-3-іл)-2оксо-3-[(феноксикарбоніл)аміно]індолін-2карбоксилат 2,78 г (9,43 ммоль) 3-аміно-3-(2-етоксипіридин3-іл)-2-оксоіндолін-5-карбонітрилу (одержаного згідно з прикладом 1, стадією 1а)-1с)) суспендували у 25 мл дихлорметану та охолоджували на льодяній бані до 0°С. Додавали 7,63 мл (94,34 ммоль) піридину і потім повільно по краплях додавали 2,37 мл (18,87 ммоль) фенілхлорформіату таким чином, щоб температура не перевищувала 5-10°С. Після танення льодяної бані реакційну суміш перемішували при кімнатній температурі протягом ночі, і слабо забарвлена тверда речовина випадала з розчину в осад. Реакційну суміш розводили дихлорметаном, і після додавання води, тверда речовина поверталася назад у розчин. Фази розділяли і водну фазу знов екстрагували дихлорметаном (1). Об'єднані органічні фази промивали спочатку водою (3) і потім насиченим розчином хлориду натрію (1). Після сушіння над сульфатом магнію, фільтрування і випаровування розчинника при зниженому тиску, залишок знов розчиняли в діетиловому ефірі, додавали в 10 раз більшу кількість пентану. Утворювався білий осад, і його відфільтровували за допомогою вакуумного відсмоктувача, промивали пентаном і сушили у вакуумній сушильній шафі при 40°С. Після фракціонованої кристалізації, було виділено всього 4,46 г (8,35 ммоль, 89%) феніл-5-ціано-3-(2етоксипіридин-3-іл)-2-оксо-3[(фенілоксикарбоніл)аміно]індолін-1-карбоксилату. + ESI-MC [М+Н ]=535,15, обчислено для C30H22N4O6=534,53. 5b) N-[5-Ціано-3-(2-етоксипіридин-3-іл)-2-оксо2,3-дигідро-1Н-індол-3-іл]-4-(1-метилпіперидин-4іл)піперазин-1-карбоксамід Спочатку 760 мг (1,42 ммоль) феніл-5-ціано-3(2-етоксипіридин-3-іл)-2-оксо-3[(феноксикарбоніл)аміно]індолін-1-карбоксилату 35 засипали в 5 мл ТГФ і додавали 1,42 г (5,69 ммоль) 1-(1-метилпіперидин-4-іл)піперазину, нерозчинного при кімнатній температурі. Реакційну суміш перемішували протягом ночі і реакцію контролювали ТШХ (силікагель, дихлорметан/метанол 15:5), щоб визначити ступінь протікання реакція. Реакцію розводили етилацетатом і промивали водою (1) і насиченим розчином хлориду натрію (1). Органічну фазу сушили над сульфатом магнію, фільтрували і видаляли при зниженому тиску розчинник. Залишок розчиняли в невеликій кількості діетилового ефіру і додавали в 6 раз більшу кількість циклогексану. В осад випадала безбарвна тверда речовина, що містить 615 мг (1,22 ммоль, 86%) чистого N-[5-ціано-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-(1-метилпіперидин-4-іл)піперазин-1карбоксаміду. + ESI-MC [М+Н ]=504,25, обчислено для С27Н33N7О3=503,61. 5с) N-[5-Ціано-3-(2-етоксипіридин-3-іл)-1-[(4метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-(1-метилпіперидин-4-іл)піперазин-1карбоксамід 80,0 мг (0,16 ммоль) N-[5-ціано-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-(1-метилпіперидин-4-іл)піперазин-1карбоксаміду розчиняли в диметилформаміді і додавали 7,63 мг (0,19 ммоль, 60% w/w) гідриду натрію при 0°С. У ході депротонування у похідної 1,3-дигідро-2Н-індол-2-ону, суміш перемішували протягом 10 хвилин і потім додавали 39,4 мг (0,19 ммоль) 4-метоксибензолсульфонілхлориду. Потім суміш нагріли до кімнатної температури і перемішували протягом 30 хвилин. Ступінь протікання реакції відстежували ТШХ (силікагель, дихлорметан/метанол 1:1). До реакційної суміші додавали насичений розчин бікарбонату натрію та етилацетат і потім розділяли фази. Водну фазу повторно екстрагували етилацетатом (1). Об'єднану органічну фазу промивали водою (1) і насиченим розчином хлориду натрію (1), сушили над сульфатом магнію, фільтрували і видаляли розчинник при зниженому тиску. Залишок очищали препаративною рідинною хроматографією середнього тиску РХСТ (ISCO Companion, 4 г NP картридж), використовуючи як рухомі фази суміш дихлорметан/метанол (5-20%). Виділяли 27,3 мг (0,04 ммоль, 23% вихід, 90% чистота) N-[5-ціано-3-(2етоксипіридин-3-іл)-1-[(4метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-(1-метилпіперидин-4-іл)піперазин-1карбоксаміду. + ESI-MC [М+Н ]=674,2, обчислено для C34H39N7O6S=673,80. Альтернативні способи очищення до кристалізації неочищених сумішей включають загальноприйняту колонкову хроматографію з прямою фазою (NP-SiO2 картридж, Chromabond) із використанням як рухомі фази суміші дихлорметан/метанол і препаративну ВЕРХ (ОФ, рухома фаза суміш ацетонітрил/вода, 0,01% ТФОК або 0,01% оцтова кислота). 96785 36 Приклади 2-4 і 6-30 Сполуку згідно з прикладами 2-4 і 6-30 можна одержати способом, аналогічним до методик одержання відповідно до прикладу 1 і/або прикладу 5 з використанням придатних вихідних речовин. Приклад 2 N-{5-Ціано-3-(2-етоксипіридин-3-іл)-1-[(2метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Ніндол-3-іл}-4-(1-метилпіперидин-4-іл)піперазин-1карбоксамід + ESI-MC [М+Н ]=674,05, обчислено для C34H39N7O6S=673,80. Приклад 3 Трифторацетат N-[5-ціано-1-[(2етоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2оксо-2,3-дигідро-1Н-індол-3-іл]-4-(1метилпіперидин-4-іл)піперазин-1-карбоксаміду + ESI-MC [М+Н ]=688,3, обчислено для C35H41N7O6S=687,82. Приклад 4 N-[5-Ціано-3-(2-етоксипіридин-3-іл)-2-оксо-1(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(1метилпіперидин-4-іл)піперазин-1-карбоксамід + ESI-MC [М+Н ]=644,2, обчислено для C33H37N7O5S=643,77. Приклад 31 N-[5-Ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1карбоксамід Спочатку 100 мг (0,16 ммоль) феніл[5-ціано-1[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]карбамату (одержаного згідно з прикладом 1, стадією 1a)-1f)) засипали у 8 мл безводного тетрагідрофурану (висушеного за допомогою молекулярних сит) і додавали 44,7 мг (0,24 ммоль) 1-метил4-(піперидин-4-іл)піперазину. Реакційну суміш перемішували при кімнатній температурі протягом ночі. Протікання реакції відстежували ТШХ (силікагель, дихлорметан/метанол у співвідношенні 9:1) і РХМС (ОФ, ацетонітрил/вода у ролі елюентів і 0,01% ТФОК). Розчинник видаляли при зниженому тиску, залишок вміщували в дихлорметан і екстрагували розчином 2н. гідроксиду натрію (1). Об'єднані органічні фази сушили над сульфатом магнію, фільтрували і розчинник видаляли при зниженому тиску. Неочищену суміш очищали двічі колонковою хроматографією (5 г NP-SiO2 картридж: Chromabond), використовуючи суміш дихлорметан/метанол у співвідношенні від 99:1 до 80:20 у ролі елюенту. Виділяли 53,8 мг (0,08 ммоль, 47%) чистого N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4метилпіперазин-1-іл)піперидин-1-карбоксаміду. + ESI-MC [М+Н ]=704,25, обчислено для C35H41N7O7S=703,82. 1 Н-ЯМР ([D6]-ДМСО, 400 МГц) [м.д.] = 8,13 (дд, 1Н, J=1,4 Гц, J=4,8 Гц), 7,88 (д, 1Н, J=8,5 Гц), 7,87 (д, 1Н, J=8,8 Гц), 7,81 (дд, 1Н, J=1,6 Гц, J=8,6 Гц), 7,71 (дд, 1Н, J=1,4 Гц, J=7,6 Гц), 7,68 (д, 1Н, J=1,3 Гц), 7,65 (с, 1Н), 7,02 (дд, 1Н, J=4,9 Гц, J=7,6 Гц), 6,68 (д, 1Н, J=8,9 Гц), 6,65 (с, 1Н), 4,17 (м, 2Н), 3,85 (с, 3H), 3,80 (м, 2Н), 3,44 (с, 3H), 2,62 (м, 2Н), 37 2,41-2,12 (м, 9Н), 2,12 (с, 3H), 1,61 (м, 2Н), 1,16 (м, 2Н), 1,09 (т, 3H, J=7,0 Гц). Приклади 32-36 Сполуку відповідно до прикладів 32-36 можна одержати способом, аналогічним до методик одержання згідно з прикладом 1, 5 і/або 31 із використанням придатних вихідних речовин. Приклад 32 N-[5-Ціано-3-(2-етоксипіридин-3-іл)-1-[(2метоксифеніл)сульфоніл]-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1карбоксамід + ESI-MC [М+Н ]=674,8, обчислено для C34H39N7O6S=673,80. Приклад 33 Трифторацетат N-[5-ціано-1-[(2етоксифеніл)сульфоніл]-3-(2-етоксипіридин-3-іл)-2оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4метилпіперазин-1-іл)піперидин-1-карбоксаміду + ESI-MC [M+H ]=688,2, обчислено для C35H41N7O6S=687,82. Приклад 34 N-[5-Ціано-3-(2-етоксипіридин-3-іл)-2-оксо-1(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(4метилпіперазин-1-іл)піперидин-1-карбоксамід + ESI-MC [М+Н ]=644,7, обчислено для C33H37N7O5S=643,77. Приклад 35 Трифторацетат N-[5-ціано-3-(2-етоксипіридин3-іл)-1-[(4-метоксифеніл)сульфоніл]-2-оксо-2,3дигідро-1Н-індол-3-іл]-4-(4-метилпіперазин-1іл)піперидин-1-карбоксаміду + ESI-MC [М+Н ]=674,2, обчислено для C34H39N7O6S=673,80. Приклад 37 N-[5-Ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-(4-етилпіперазин-1-іл)піперидин-1карбоксамід Спочатку завантажували 100 мг (0,16 ммоль) феніл[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Ніндол-3-іл]карбамату (одержаного згідно з прикладом 1, стадією 1a)-1f)), розчиненого у 8 мл безводного тетрагідрофурану (висушеного за допомогою молекулярних сит). Потім додавали разом 74,9 мг (0,24 ммоль) 1-етил-4-піперидин-4ілпіперазину і 0,07 мл триетиламіну до даної реакційної суміші, яку потім перемішували при кімнатній температурі протягом ночі. Щоб прискорити реакцію і досягнути повного перетворення, суміш знов нагрівали до 50°С. Протікання реакції відстежували ТШХ (силікагель, дихлорметан/метанол у співвідношенні 9:1) і РХМС (ОФ, ацетонітрил/вода у ролі елюентів і 0,01% ТФОК). Розчинник видаляли при зниженому тиску, залишок вміщували в дихлорметан і екстрагували розчином 2н. гідроксиду натрію (1). Об'єднані органічні фази сушили над сульфатом магнію, фільтрували і розчинник видаляли при зниженому тиску. Неочищену суміш очищали спочатку колонковою хроматографією на силікагелі (колонка 20200 мм), використовуючи дихлорметан і 2% метанол у ролі елюентів. Об'єднані, ще трохи забруднені, фракції продукту знов очищали препаративною ВЕРХ на колонці 96785 38 Chromolith (пряма фаза, з компанії Merck), використовуючи у ролі елюентів дихлорметан і метанол (градієнт 0 10% за об'ємом метанолу протягом 15 хв). Це давало 20 мг (0,03 ммоль, 17%) бажаного N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-(4-етилпіперазин-1-іл)піперидин-1карбоксаміду. + ESI-MC [М+Н ]=718,25, обчислено для C36H43N7O7S=717,85. 1 Н-ЯМР ([D6]-ДМСО, 400 МГц) [м.д.] = 8,13 (дд, 1Н, J=1,2 Гц, J=4,6 Гц), 7,88 (д, 1Н, J=8,2 Гц), 7,87 (д, 1Н, J=8,7 Гц), 7,81 (дд, 1Н, J=1,4 Гц, J=8,6 Гц), 7,72 (дд, 1Н, J=1,3 Гц, J=7,6 Гц), 7,68 (д, 1Н, J=1,1 Гц), 7,66 (с, 1Н), 7,02 (дд, 1Н, J=4,9 Гц, J=7,6 Гц), 6,68 (дд, 1Н, J=2,0 Гц, J=8,8 Гц), 6,65 (д, 1Н, J=2,2 Гц), 4,17 (м, 2Н), 3,85 (с, 3H), 3,81 (м, 2Н), 3,44 (с, 3H), 2,62 (м, 2Н), 2,43-2,29 (м, 11H), 1,61 (м, 2Н), 1,15 (м, 2Н), 1,09 (т, 3H, J=7,0 Гц), 0,97 (т, 3H, J=7,1 Гц). Приклади 38-90 Сполуку відповідно до прикладів 38-90 можна одержати способом, аналогічним до методик одержання згідно з прикладами 1, 5, 31, 37, 55, 61 і/або 67 із використанням придатних вихідних речовин. Приклад 40 N-[5-Ціано-3-(2-етоксипіридиіі-3-іл)-2-оксо-1(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(4етилпіперазин-1-іл)піперидин-1-карбоксамід + ESI-MC [М+Н ]=658,25, обчислено для C34H39N7O5S=657,79. Приклад 43 N-[5-Ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-(4-пропілпіперазин-1-іл)піперидин-1карбоксамід + ESI-MC [M+H ]=732,3, обчислено для C37H45N7O7S=731,88. Приклад 55 N-[5-Ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Ніндол-3-іл]-4-піперазин-1-ілпіперидин-1карбоксамід 55а) трет-Бутил-4-[1-({[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]аміно}карбоніл)піперидин-4-іл]піперазин-1карбоксилат Спочатку 100 мг (0,16 ммоль) феніл [5-ціано-1[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)2-оксо-2,3-дигідро-1Н-індол-3іл]карбамату (одержаного згідно з прикладом 1, стадією 1a)-1f)) завантажували у 8 мл безводного тетрагідрофурану (висушеного за допомогою молекулярних сит) і додавали 65,8 мг (0,24 ммоль) трет-бутил-4-піперидин-4-ілпіперазин-1карбоксилату. Суміш потім перемішували при кімнатній температурі протягом ночі. Ступінь протікання реакції відстежували ТШХ (силікагель, СН2Сl2/MeOH 9:1) і РХМС (ОФ, рухомі фази ацетонітрил/вода і 0,01% ТФОК). Розчинник видаляли при зниженому тиску, залишок вміщували в дихлорметан і екстрагували розчином 2н. гідроксиду натрію (1). Об'єднані органічні фази сушили над 39 сульфатом магнію, фільтрували і розчинник видаляли при зниженому тиску. Неочищену суміш очищали колонковою хроматографією (5 г NP-SiO2 картридж Chromabond), використовуючи суміш дихлорметан/метанол у співвідношенні 98:2 як рухому фазу. Це давало 55,3 мг (0,07 ммоль, 43%) бажаного продукту, який безпосередньо використали на наступній реакційній стадії видалення захисної групи Вос. + ESI-MC [М+Н ]=790,30, обчислено для C39H47N7O9S=789,91. 55b) N-[5-Ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-піперазин-1ілпіперидин-1-карбоксамід Спочатку 55,3 мг (0,07 ммоль) трет-бутил-4-[1({[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3,-дигідро-1Н-індол-3іл]аміно}карбоніл)піперидин-4-іл]піперазин-1карбоксилату завантажували в 4 мл метанолу і додавали 1,0 мл 5-6М хлористоводневої кислоти в ізопропанолі. Суміш перемішували при кімнатній температурі. Ступінь протікання реакції відстежували ТШХ (силікагель, СН2Сl2/MeOH 9:1). Після повного перетворення видаляли залишки спиртового розчинника, залишок вміщували в дихлорметан і, використовуючи 1н. водний розчин гідроксиду натрію, доводили екстракцією до рН 9. Органічну фазу відділяли від водної фази і водну фазу повторно екстрагували дихлорметаном (2х). Об'єднану органічну фазу сушили над сульфатом магнію і видаляли розчинник при зниженому тиску. Залишок кристалізували з діетилового ефіру. Альтернативно, залишок можна також очищати або загальноприйнятою колонковою хроматографією з прямою фазою (NP-SiO2 картридж, Chromabond), використовуючи суміш дихлорметан/метанол як рухомі фази, або препаративною ВЕРХ (ОФ, рухомі фази ацетонітрил/вода, 0,01% ТФОК). Після кристалізації виділяли 15,9 мг (0,023 ммоль, 33%) N-[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-піперазин-1-ілпіперидин-1-карбоксаміду. + ESI-MC [М+Н ]=690,45, обчислено для C34H39N7O7S=689,80. Приклади 25-30, 56-60 і 85-90 Сполуку відповідно до прикладів 25-30, 56-60 і 85-90 також можна одержати способом, аналогічним до методик одержання згідно з прикладами 1, 5, 31, 37 і/або 55 із використанням придатних вихідних речовин. Приклад 25 Біс(трифторацетат) N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-піперидин-4ілпіперазин-1-карбоксаміду + ESI-MC [М+Н ]=690,15, обчислено для C34H39N7O7S=689,80. Приклад 85 Біс(трифторацетат) N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4,4'біпіперидин-1-карбоксаміду + ESI-MC [M+H ]=689,25, обчислено для C35H40N6O7S=688,81. 96785 40 У сполуках (І) відповідно до даного винаходу замісник R7, згідно зі схемою синтезу 1 або 2, можна також вводити послідовно шляхом відновного амінування, яке буде проілюстроване прикладами 61 і 67: Приклад 61 N-[5-Ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Ніндол-3-іл]-1'-метил-4,4'-біпіперидин-1-карбоксамід Спочатку вводили 100 мг (0,138 ммоль) 4-[1({[5-ціано-1-[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]аміно}карбоніл)піперидин-4іл]піперидинійхлориду (відповідає хлоридній солі сполуки прикладу 85) (одержаного згідно з прикладом 1, стадією 1a)-1f) і прикладом 55, стадії 55a)-55b)) у 10 мл дихлорметану. Додавали 20 мкл (0,207 ммоль) водного розчину формальдегіду (37% міцності) і перемішували реакційну суміш протягом 5 хвилин. Розчин став трохи каламутним. Додавали 98 мг (0,69 ммоль) сульфату натрію і 20 мкл (0,279 ммоль) льодяної оцтової кислоти і перемішували суміш протягом 1,5 годин. Невеликими порціями вводили 48,7 мг (0,207 ммоль) гідруючого реагента ацетоксиборгідриду натрію, через 15 хвилин реакційна суміш стала прозорою і потім незабаром знову каламутною. Суміш перемішували при кімнатній температурі протягом ночі і нагрівали до 40°С протягом ще години. Спочатку реакційну суміш розводили 30 мл дихлорметану і потім екстрагували насиченим розчином бікарбонату натрію (3). Об'єднані органічні фази сушили над сульфатом магнію, фільтрували і розчинник випарювали при зниженому тиску. Виділяли 75 мг неочищеного продукту, який очищали препаративною ВЕРХ на колонці Chromolith (PH-18e, із компанії Merck, рухомі фази ацетонітрил/вода, 0,01% оцтова кислота). Виділяли 5 мг (0,007 ммоль, 5%) бажаного N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-1'-метил-4,4'біпіперидин-1-карбоксаміду (пропорційно до присутнього у вигляді ацетатної солі). + ESI-MC [М+Н ]=703,2, обчислено для C36H42N6O7S=702,83. Приклад 67 Трифторацетат N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-1'-етил-4,4'біпіперидин-1-карбоксаміду + ESI-MC [М+Н ]=717,30, обчислено для C37H44N6O7S=716,86. Розділення рацемату рацемічних сполук відповідно до прикладів 1-90: Як приклад, використовуючи сполуку прикладу 1, показано розділення рацематів на їх енантіомери (приклад 1А і 1B) шляхом розділення на препаративній хіральній колонці: А.) Розділення рацемату рацемічних сполук прикладу 1: 100 мг (0,14 ммоль) рацемічного N-[5-ціано-1[(2,4-диметоксифеніл)сульфоніл]-3-(2етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Н-індол-3іл]-4-(1-метилпіперидин-4-іл)піперазин-1карбоксаміду (приклад 1) розділяли на хіральній 41 препаративній колонці (Chiralcell OD, швидкість потоку 55 мл/хв), використовуючи суміш нгептан/етанол (700:300) у ролі елюенту. Енантіомер, який елююється першим, що має позитивне оптичне обертання (приклад 1А), можна виділити з виходом 19 мг (0,03 ммоль, 19%), і енантіомер, який йде слідом, що має негативне оптичне обертання (приклад 1B), можна виділити з виходом 8 мг (0,01 ммоль, 8%). Приклад1А (+)-N-[5-Ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(1метилпіперидин-4-іл)піперазин-1-карбоксамід + ESI-MC [М+Н ]=704,25, обчислено для C35H41N7O7S=703,82. ВЕРХ (Chiralcell OD 0,46 см25 см; нгептан/етанол 7:3) Rf=9,04 хв. Оптичне обертання (22°С, 589 нм, СНСІ3, 1 мг/мл)=правообертальний. 1 Н-ЯМР ([D6]-ДМСО, 500 МГц) [м.д.] = 8,13 (дд, 1Н, J=1,6 Гц, J=4,9 Гц), 7,89 (д, 1Н, J=8,9 Гц), 7,88 (д, 1Н, J=8,6 Гц), 7,82 (дд, 1Н, J=1,7 Гц, J=8,6 Гц), 7,72 (дд, 1Н, J=1,5 Гц, J=7,7 Гц), 7,68 (д, 1Н, J=1,6 Гц), 7,65 (с, 1Н), 7,02 (дд, 1Н, J=4,9 Гц, J=7,6 Гц), 6,69 (дд, 1Н, J=2,2 Гц, J=8,9 Гц), 6,66 (д, 1Н, J=2,1 Гц), 4,17 (м, 2Н), 3,86 (с, 3H), 3,45 (с, 3H), 3,21 (м, 4Н), 2,77 (м, 2Н, J=11,0 Гц), 2,34 (м, 4Н), 2,12 (м, 4Н), 1,82 (м, 2Н, J=10,9 Гц), 1,64 (м, 2Н, J=10,8 Гц), 1,37 (м, 2Н), 1,08 (т, 3H, J=7,0 Гц). Приклад 1В (-)-N-[5-Ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(1метилпіперидин-4-іл)піперазин-1-карбоксамід + ESI-MC [M+H ]=704,25, обчислено для C35H41N7O7S=703,82. ВЕРХ (Chiralcell OD 0,46 см25 см; нгептан/етанол 7:3) Rf=25,73 хв. Оптичне обертання (22°С, 589 нм, СНСІ3, 1 мг/мл)=лівообертальний. 1 Н-ЯМР ([D6]-ДМСО, 500 МГц) [м.д.] = 8,13 (дд, 1Н, J=1,2 Гц, J=4,7 Гц), 7,88 (д, 1Н, J=8,9 Гц), 7,87 (д, 1Н, J=8,5 Гц), 7,81 (дд, 1Н, J=1,5 Гц, J=8,5 Гц), 7,72 (дд, 1Н, J=1,1 Гц, J=7,6 Гц), 7,68 (с, 1Н), 7,64 (с, 1Н), 7,01 (дд, 1Н, J=4,9 Гц, J=7,6 Гц), 6,69 (дд, 1Н, J=1,9 Гц, J=9,0 Гц), 6,66 (д, 1Н, J=1,9 Гц), 4,16 (м, 2Н), 3,85 (с, 3H), 3,45 (с, 3H), 3,20 (м, 4Н), 2,77 (м, 2Н, J=11,5 Гц), 2,34 (м, 4Н), 2,12 (м, 4Н), 1,82 (м, 2Н, J=11,3 Гц), 1,64 (м, 2Н, J=11,5 Гц), 1,37 (м, 2Н), 1,07 (т, 3H, J=7,0 Гц). В.) Розділення рацемату рацемічної сполуки згідно з прикладом 31: N-[5-Ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Hіндол-3-іл]-4-(4-метилпіперазин-1-іл)піперидин-1карбоксамід (приклад 31) розділяли на хіральній препаративній колонці (Chiralcell OD, швидкість потоку 55 мл/хв), використовуючи суміш нгептан/етанол (700:300) у ролі елюенту. Енантіомер, який елююється першим, мав позитивне оптичне обертання (приклад 31А), і енантіомер, який йде слідом, мав негативне оптичне обертання (приклад 31B). 96785 42 Приклад 31А (+)-N-[5-Ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4метилпіперазин-1-іл)піперидин-1-карбоксамід + ESI-MC [М+Н ]=704,80, обчислено для C35H41N7O7S=703,82. ВЕРХ (Chiralcell OD 0,46 см25 см; нгептан/етанол 7:3) Rf=9,60 хв. Оптичне обертання (22°С, 589 нм, СНСl3, 1 мг/мл)=правообертальний. 1 Н-ЯМР ([D6]-ДМСО, 500 МГц) [м.д.] = 8,12 (дд, 1Н, J=1,6 Гц, J=4,8 Гц), 7,87 (д, 1Н, J=8,5 Гц), 7,86 (д, 1Н, J=8,8 Гц), 7,81 (дд, 1Н, J=1,7 Гц, J=8,6 Гц), 7,73 (дд, 1Н, J=1,5 Гц, J=7,7 Гц), 7,69 (с, 1Н), 7,67 (д, 1Н, J=1,5 Гц), 7,02 (дд, 1Н, J=4,9 Гц, J=7,6 Гц), 6,67 (дд, 1Н, J=2,2 Гц, J=8,9 Гц), 6,65 (д, 1Н, J=2,1 Гц), 4,14 (м, 2Н), 3,83 (с, 3H), 3,80 (м, 2Н), 3,42 (с, 3H), 2,60 (м, 2Н), 2,39-2,10 (м, 9Н), 2,10 (с, 3H), 1,60 (м, 2Н), 1,12 (м, 2Н), 1,06 (т, 3H, J=7,0 Гц). Приклад 31В (-)-N-[5-Ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4метилпіперазин-1-іл)піперидин-1-карбоксамід + ESI-MC [M+H ]=704,80, обчислено для C35H41N7O7S=703,82. ВЕРХ (Chiralcell OD 0,46 см25 см; нгептан/етанол 7:3) Rf=34,31 хв. Оптичне обертання (22°С, 589 нм, СНСІ3, 1 мг/мл)=лівообертальний. 1 Н-ЯМР ([D6]-ДМСО, 500 МГц) [м.д.] = 8,12 (дд, 1Н, J=1,6 Гц, J=4,9 Гц), 7,86 (д, 1Н, J=8,7 Гц), 7,85 (д, 1Н, J=8,8 Гц), 7,81 (дд, 1Н, J=1,6 Гц, J=8,6 Гц), 7,72 (дд, 1Н, J=1,4 Гц, J=7,6 Гц), 7,69 (с, 1Н), 7,67 (д, 1Н, J=1,6 Гц), 7,02 (дд, 1Н, J=4,9 Гц, J=7,6 Гц), 6,67 (дд, 1Н, J=2,2 Гц, J=8,9 Гц), 6,64 (д, 1Н, J=2,0 Гц), 4,13 (м, 2Н), 3,83 (с, 3H), 3,80 (м, 2Н), 3,42 (с, 3H), 2,60 (м, 2Н), 2,42-2,10 (м, 9Н), 2,10 (с, 3H), 1,60 (м, 2Н), 1,12 (м, 2Н), 1,06 (т, 3H, J=7,0 Гц). С.) Розділення рацемату рацемічної сполуки згідно з прикладом 37: N-[5-Ціано-1-[(2,4-диметоксифеніл)сульфоніл]3-(2-етоксипіридин-3-іл)-2-оксо-2,3-дигідро-1Hіндол-3-іл]-4-(4-етилпіперазин-1-іл)піперидин-1карбоксамід (приклад 37) розділяли на хіральній препаративній колонці (Chiralcell OD, швидкість потоку 55 мл/хв), використовуючи суміш нгептан/етанол (700:300) у ролі елюенту. Енантіомер, який елююється першим, мав позитивне оптичне обертання (приклад 37А), і енантіомер, який йде слідом, мав негативне оптичне обертання (приклад 37В). Приклад 37А (+)-N-[5-Ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4етилпіперазин-1-іл)піперидин-1-карбоксамід + ESI-MC [М+Н ]=718,30, обчислено для C36H43F3N7O7S=717,85. ВЕРХ (Chiralcell OD 0,46 см25 см; нгептан/етанол 7:3) Rf=7,29 хв. 43 Оптичне обертання (22°С, 589 нм, СНCl3, 1 мг/мл)=правообертальний. 1 Н-ЯМР ([D6]-ДМСО, 500 МГц) [м.д.] = 8,13 (дд, 1Н, J=1,7 Гц, J=4,9 Гц), 7,89 (д, 1Н, J=8,6 Гц), 7,88 (д, 1Н, J=8,8 Гц), 7,82 (дд, 1Н, J=1,8 Гц, J=8,6 Гц), 7,72 (дд, 1Н, J=1,7 Гц, J=7,7 Гц), 7,69 (д, 1Н, J=1,7 Гц), 7,67 (с, 1Н), 7,02 (дд, 1Н, J=4,9 Гц, J=7,7 Гц), 6,69 (дд, 1Н, J=2,2 Гц, J=8,9 Гц), 6,66 (д, 1Н, J=2,2 Гц), 4,18 (м, 2Н), 3,85 (с, 3H), 3,81 (м, 2Н), 3,44 (с, 3H), 2,62 (м, 2Н), 2,42-2,24 (м, 11H), 1,62 (м, 2Н), 1,15 (м, 2Н), 1,09 (т, 3H, J=7,1 Гц), 0,96 (т, 3H, J=7,2 Гц). Приклад 37В (-)-N-[5-Ціано-1-[(2,4диметоксифеніл)сульфонїл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(4етилпіперазин-1-іл)піперидин-1-карбоксамід + ESI-MC [M+H ]=718,25, обчислено для C36H43F3N7O7S=717,85. ВЕРХ (Chiralcell OD 0,46 см25 см; нгептан/етанол 7:3) Rf=12,41 хв. Оптичне обертання (22°С, 589 нм, СНCl3, 1 мг/мл)=лівообертальний. 1 Н-ЯМР ([D6]-ДМСО, 500 МГц) [м.д.] = 8,12 (дд, 1Н, J=1,6 Гц, J=4,9 Гц), 7,88 (д, 1Н, J=8,5 Гц), 7,87 (д, 1Н, J=8,8 Гц), 7,80 (дд, 1Н, J=1,7 Гц, J=8,6 Гц), 7,71 (дд, 1Н, J=1,5 Гц, J=7,7 Гц), 7,68 (д, 1Н, J=1,5 Гц), 7,66 (с, 1Н), 7,00 (дд, 1Н, J=4,9 Гц, J=7,6 Гц), 6,67 (дд, 1Н, J=2,2 Гц, J=8,9 Гц), 6,65 (д, 1Н, J=2,1 Гц), 4,16 (м, 2Н), 3,84 (с, 3H), 3,80 (м, 2Н), 3,44 (с, 3H), 2,61 (м, 2Н), 2,41-2,23 (м, 11H), 1,60 (м, 2Н), 1,14 (м, 2Н), 1,08 (т, 3H, J=7,1 Гц), 0,95 (т, 3H, J=7,2 Гц). D.) Розділення рацемату рацемічних сполук 230, 21-36 і 38-90: Способом, аналогічним до розділення рацематів рацемічних сполук 1,31 і 37 можна провести розділення рацематів 2-30, 32-36 і 38-90, одержуючи в результаті відповідні (+)-енантіомери 2А, 3A, 4А, 5А, 6А, 7А, 8А, 9А, 10А, 11А, 12А, 13А, 14А, 15А, 16А, 17А, 18А, 19А, 20А, 21А, 22А, 23А, 24А, 25А, 26А, 27А, 28А, 29А, 30А і 32А, 33А, 34А, 35А і 38А, 39А, 40А, 41А, 42А, 43А, 44А, 45А, 46А, 47А, 48А, 49А, 50А, 51А, 52А, 53А, 54А, 55А, 56А, 57А, 58А, 59А, 60А, 61А, 62А, 63А, 64А, 65А, 66А, 67А, 68А, 69А, 70А, 71А, 72А, 73А, 74А, 75А, 76А, 77А, 78А, 79А, 80А, 81А, 82А, 83А, 84А, 85А, 86А, 87А, 88А, 89А і 90А і відповідні (-)-енантіомери 2В, 3B, 4В, 5В, 6В, 7В, 8В, 9В, 10В, 11В, 12В, 13В, 14В, 15В, 16В, 17В, 18В, 19В, 20В, 21В, 22В, 23В, 24В, 25В, 26В, 27В, 28В, 29В, 30В і 32В, 33В, 34В, 35В і 38В, 39В, 40В, 41В, 42В, 43В, 44В, 45В, 46В, 47В, 48В, 49В, 50В, 51В, 52В, 53В, 54В, 55В, 56В, 57В, 58В, 59В, 60В, 61В, 62В, 63В, 64В, 65В, 66В, 67В, 68В, 69В, 70В, 71В, 72В, 73В, 74В, 75В, 76В, 77В, 78В, 79В, 80В, 81В, 82В, 83В, 84В, 85В, 86В, 87В, 88В, 89В і 90В. Енантіомери А і В також можна одержати, використовуючи енантіомерно чисті попередники і проміжні сполуку, наприклад, аналогічно до схем синтезу 1 або 2, переважно за схемою синтезу 1. Розділення рацемічної суміші на (+)-енантіомери і (-)-енантіомери можна провести хіральною препаративною хроматографією, переважно через відповідний амінний структурний елемент VI. 96785 44 Приклад 7В Трифторацетат(-)-N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-4-(1етилпіперидин-4-іл)піперазин-1-карбоксаміду + ESI-MC [М+Н ]=718,25, обчислено для C36H43N7O7S=717,85. Приклад 40В (-)-N-[5-Ціано-3-(2-етоксипіридин-3-іл)-2-оксо1-(фенілсульфоніл)-2,3-дигідро-1Н-індол-3-іл]-4-(4етилпіперазин-1-іл)піперидин-1-карбоксамід + ESI-MC [М+Н ]=658,25, обчислено для C34H39N7O5S=657,79. Приклад 61В Трифторацетат(-)-N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл)-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-1'-метил-4,4'біпіперидин-1-карбоксаміду + ESI-MC [M+H ]=703,30, обчислено для C36H42N6O7S=702,83. 1 Н-ЯМР ([D6]-ДМСО, 500 МГц) [м.д.] = 9,26 (1Н, протонування ТФОК), 8,12 (дд, 1Н, J=1,7 Гц, J=4,9 Гц), 7,87 (дд, 2Н, J=1,3 Гц, J=8,7 Гц), 7,80 (дд, 1Н, J=1,8 Гц, J=8,5 Гц), 7,80 (м, 2Н), 7,66 (с, 1Н), 7,00 (дд, 1Н, J=4,9 Гц, J=7,6 Гц), 6,68 (дд, 1Н, J=2,2 Гц, J=8,9 Гц), 6,65 (д, 1Н, J=2,1 Гц), 4,16 (м, 2Н), 3,85 (с, 6Н), 3,44 3,41 (м, 5Н), 2,85 (м, 2Н), 2,73 (м, 2Н), 2,57 (м, 2Н), 1,81 (м, 2Н), 1,55 (м, 2Н), 1,34 1,22 (м, 4Н), 1,08 (т, 3H, J=7,0 Гц), 0,92 (м, 2Н). Приклад 67В Трифторацетат(-)-N-[5-ціано-1-[(2,4диметоксифеніл)сульфоніл]-3-(2-етоксипіридин-3іл)-2-оксо-2,3-дигідро-1Н-індол-3-іл]-1'-етил-4,4'біпіперидин-1-карбоксаміду + ESI-MC [M+H ]=717,35, обчислено для C37H44N6O7S=716,86. Аміни загальної формули X можна одержати згідно зі схемою синтезу 1 або 2 реакцією відновного амінування. Нижче в контексті даного опису показане застосування одержання амінної сполуки 1-етил-4-піперидин-4-ілпіперазину як приклад: Приклад 91 1-Етил-4-піперидин-4-ілпіперазин 91а) трет-Бутил-4-(4-етилпіперазин-1іл)піперидин-1-карбоксилат Спочатку у 800 мл етанолу завантажували 29,2 г (256 ммоль) N-етилпіперазину і 50,0 г (256 ммоль) трет-бутил-4-оксопіперидин-1карбоксилату (відповідає 1-Boc-4-піперидону) при охолодженні льодом і додавали 15,4 г (256 ммоль) льодяної оцтової кислоти. Потім до охолодженої реакційної суміші невеликими порціями додавали 16,1 г (256 ммоль) ацетоксиборгідриду натрію. Спочатку спостерігалося невелике утворення газу і, після додавання 2/3 відновника, спінення. Реакційну суміш перемішували при кімнатній температурі протягом ночі. При виділенні продукту реакції до реакційного розчину додавали при охолодженні 200 мл 2н. водного розчину гідроксиду натрію, розчинник етанол відганяли і реакційну суміш, що залишилася, розводили водою. Суміш екстрагували діетиловим ефіром (2х) і промивали насиченим розчином хлориду натрію (1), об'єднані органічні фази сушили над сульфатом магнію, фільтрували 45 і видаляли розчинник при зниженому тиску. Бажаний продукт одержували у вигляді жовтого масла, яке потім хроматографували на 4 л Nutsche фільтрі, заповненому силікагелем, використовуючи дихлорметан і 10% метанол у ролі елюентів. Це давало всього 40 г (135 ммоль, 53%) трет-бутил-4-(4етилпіперазин-1-іл)піперидин-1-карбоксилату. 91b) 1-Етил-4-піперидин-4-ілпіперазин у вигляді хлоридної солі: Спочатку, для видалення захисної групи, 40 г (135 ммоль) трет-бутил-4-(4-етилпіперазин-1іл)піперидин-1-карбоксилату завантажували в 200 мл метанолу і додавали 1,8 л дихлорметану і 100 мл 5-6М розчину НCl в ізопропанолі. Розчин став суспензією, і можна було спостерігати невелике утворення газу. Реакційну суміш перемішували при 40°С (температура водяної бані) протягом однієї години і при кімнатній температурі протягом вихідних. Для повного завершення видалення захисної групи з одержанням бажаного продукту, додавали ще 50 мл 5-6М розчину НCl в ізопропанолі і суміш перемішували при 40°С. Дихлорметан відганяли на роторному випарнику і додавали ще 96785 46 200 мл метанолу і 30 мл 5-6М розчину НCl в ізопропанолі. Після одного часу перемішування при температурі кипіння зі зворотним холодильником утворювалася біла суспензія із сильним виділенням газу. Згодом утворювалася суспензія з низькою в'язкістю, яку охолоджували до кімнатної температури. Осад відфільтровували за допомогою вакуумного відсмоктувача і промивали метанолом і діетиловим ефіром. Після сушіння виділяли 36 г (117 ммоль, 87%) 1-етил-4-піперидин-4ілпіперазину у вигляді хлоридної солі. 1 Н-ЯМР (D2O, 400 МГц) [м.д.] = 3,74 3,47 (м, 11Н), 3,28 (кв., 2Н, J=7,3 Гц), 3,06 (дт, 2Н, J=2,2 Гц, J=13,2 Гц), 2,38 (м, 2Н, J=13,6 Гц), 1,89 (дкв., 2Н, J=4,1 Гц, J=13,3 Гц), 1,30 (т, 3H, J=7,3 Гц). Хімічні структури сполук згідно з прикладами 1-90 (рацемат) і відповідних правообертальних (+)енантіомерів (приклади 1-90 з доданою буквою "А", такі як, наприклад, 1Α, 2Α, і т.д.) і відповідних лівообертальних (-)-енантіомерів (приклади 1-90 із доданою буквою "В", такі як, наприклад, 1B, 2B, і т.д.) показані в таблиці 2 нижче: Таблиця 2 47 96785 48 49 96785 50 51 96785 52 53 96785 54 55 96785 56 57 96785 58 59 96785 60
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted oxindole derivatives and use thereof as vasopressin receptor ligands
Автори англійськоюNetz, Astrid, Oost, Thorsten, Geneste, Herve, Braje, Wilfried Martin, Wernet, Wolfgang, Unger, Liliane, Hornberger, Wilfried, Lubisch, Wilfried
Назва патенту російськоюЗамещенные производные оксиндола и их применение как лигандов рецептора вазопрессина
Автори російськоюНетц Астрид, Оост Торстен, Женест Эрве, Брайе Вильфрид Мартин, Вернет Вольфганг, Унгер Лилиане, Хорнбергер Вильфрид, Лубиш Вильфрид
МПК / Мітки
МПК: A61P 7/00, C07D 401/14, A61K 31/444, A61P 25/00, A61P 9/00
Мітки: застосування, оксиндолу, похідні, лігандів, рецептора, заміщені, вазопресину
Код посилання
<a href="https://ua.patents.su/40-96785-zamishheni-pokhidni-oksindolu-ta-kh-zastosuvannya-yak-ligandiv-receptora-vazopresinu.html" target="_blank" rel="follow" title="База патентів України">Заміщені похідні оксиндолу та їх застосування як лігандів рецептора вазопресину</a>
Попередній патент: Суміш для комплексного очищення води
Наступний патент: Стелажна система
Випадковий патент: Фіксуюча рідина "фіксорин-флюо" для попередньої фіксації відділення слизових статевих шляхів для імунофлюоресцентних досліджень












