Похідні індолін-2-ону, спосіб їх виготовлення та використання як лігандів рецептора окситоцину
Номер патенту: 73163
Опубліковано: 15.06.2005
Автори: Гарсіа Жорж, ВАЛЕТТ Жерар, Фулон Лоік, Серрадель-ле Галь Клодін
Формула / Реферат
1. Сполуки у формі чистого енантіомера чи суміші енантіомерів формули
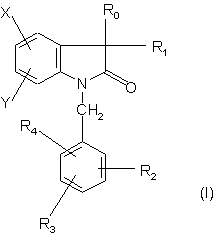 ,
,
де:
- R0 - група, вибрана з
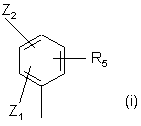 ;
;
де:
- Z1 - атом хлору, брому, йоду або флуору, або (С1-С4)алкіл, (С1-С4)алкоксил або трифлуорметил;
- Z2 - атом гідрогену, хлору, брому, йоду або флуору, або (С1-С4)алкіл, (С3-C5) циклоалкіл, (С1-С4)алкоксил, (С3-С5)циклоалкоксил або (С1-С4)поліфлуоралкіл;
- R5 - T1W, де Т1 є -(CH2)m-, причому m може дорівнювати 0 або 1, a W - атом гідрогену, або гідроксикарбоніл (або карбоксил), (С1-С4)алкоксикарбоніл, 1,3-діоксолан-2-іл, 1,3-діоксан-2-іл,
або ще W є –NR6R7, де R6 і R7, незалежно один від одного, - атом гідрогену, (С1-С4)алкіл, (С1-С4)алкілсульфоніл або фенілсульфоніл, де фенільна група може бути одно-, дво- або тризаміщеною Z5; або ще R6 і R7 утворюють разом з атомом нітрогену, до якого вони приєднані, морфолініл, як варіант, заміщений (С1-С4)алкілом або оксогрупою; або ще R6 і R7 утворюють разом з атомом нітрогену, до якого вони приєднані, піперазиніл, як варіант, заміщений в позиції 4 замісником Z3; або ще R6 і R7 утворюють разом з атомом нітрогену, до якого вони приєднані, піролідиніл або піперидил, причому зазначені піролідиніл і піперидил є, як варіант, заміщеними Z4;
або ще W є –NR8COR9-групою, де R8 - атом гідрогену або (С1-С4)алкіл, а R9 - атом гідрогену, (С1-С4)алкіл, бензил, піридин, феніл, причому зазначена фенільна група може бути одно-, дво- або тризаміщеною Z5; або ще R9 являє собою –NR10R11-групу, де R10 і R11, незалежно один від одного, - атом гідрогену або (С1-С4)алкіл, або ще R10 і R11 утворюють разом з атомом нітрогену, до якого вони приєднані, піролідиніл, піперидил або морфолініл, як варіант, заміщені (С1-С4)алкілом; або ще R9 є піролідин-2-іл або -3-іл, піперид-2-іл, -3-іл або -4-іл, причому зазначені піролідиніл і піперидил, як варіант, заміщені Z7 ; або ще R9 - -T2-R12 або –Т2-СОR12, де Т2 є -(CH2)n-, n може дорівнювати 1, 2, 3 і 4, a R12 - (С1-С4)алкоксил або –NR10R11, R10 і R11 визначено вище;
або ще W є –CONR13R14, де R13 - атом гідрогену, (С1-С4)алкіл, (С3-С7)циклоалкіл, моно- або поліфлуор(С1-С4)алкіл, a R14 - атом гідрогену, (С1-С4)алкіл, феніл, як варіант заміщений Z5, -T4-R15, де Т4 є -(CH2)q- з q, що дорівнює 1, 2, 3 або 4, a R15 - гідроксил, (С1-С4)алкоксил, (С1-С4)алкоксикарбоніл, (С1-С4)алкоксикарбоніламіногрупа, феніл, як варіант, моно- або дизаміщений Z5, пірид-2-іл, -3-іл або -4-іл, -NR16R17, де R16 і R17, незалежно один від одного, - атом гідрогену або (С1-С4)алкіл, або ще R16 і R17 утворюють разом з атомом нітрогену, до якого вони приєднані, морфолініл, як варіант, моно- або дизаміщений (С1-С4)алкілом, або ще R16 і R17 утворюють разом з атомом нітрогену, до якого вони приєднані, піперазиніл, як варіант заміщений в позиції 4 замісником Z3, або ще R16 і R17 утворюють разом з атомом нітрогену, до якого вони приєднані, піролідиніл або піперидил, причому зазначені піролідиніл і піперидил, як варіант, заміщені Z5, за умови, що коли q = 1, R15 є відмінним від гідроксилу, (С1-С4)алкоксилу, (С1-С4)алкоксикарбоніламіногрупи, -NR16R17; або ще R13 і R14 утворюють разом з атомом нітрогену, до якого вони приєднані, морфолініл, як варіант моно- або дизаміщений (С1-С4)алкілом, піперазинілом, як варіант, заміщеним в позиції 4 замісником Z3; або ще R13 і R14 утворюють разом з атомом нітрогену, до якого вони приєднані, азетидиніл, піролідиніл, піперидил, гексагідроазепініл, причому зазначені піролідиніл, піперидил та гексагідроазепініл є, як варіант, моно- або дизаміщеними Z8;
або ще W є OR18, де R18 - атом гідрогену, (С1-С4)алкіл, (С1-С4)алкоксі(С1-С4)алкіл або –Т3-R19, де Т3 є -(СН2)р-, р може дорівнювати 2 або 3, a R19 вибирають з гідроксилу, трифенілметоксилу, -NR20R21, де R20 - атом гідрогену або (С1-С4)алкіл, a R21 - атом гідрогену, (С1-С4)алкіл, тетрагідрофуранілметил або тетрагідропіранілметил, або ще R20 і R21 утворюють разом з атомом нітрогену, до якого вони приєднані, морфолініл, як варіант, моно- або дизаміщений (С1-С4)алкілом, піперазинілом, як варіант, заміщеним в позиції 4 замісником Z3, або ще R20 і R21 утворюють разом з атомом нітрогену, до якого вони приєднані, піролідиніл або піперидил, причому зазначені піролідиніл і піперидил, як варіант, заміщені Z5;
- Z3 - (С1-С4)алкіл, піридил або феніл, (С1-С4)алкілкарбоніл, (С1-С4)алкоксикарбоніл;
- Z4 - оксогрупа, атом флуору, гідроксил, (С1-С4)алкіл, бензил, аміногрупа, (С1-С4)алкіламіногрупа, ді(С1-С4)алкіламіногрупа, (С1-С4)алкоксил, (С1-С4)алкоксикарбоніл, (С1-С4)алкоксикарбоніламіногрупа;
- Z5 - атом хлору, брому, йоду або флуору, гідроксил, (С1-С4)алкіл або (С1-С4)алкоксил;
- Z7 - атом флуору, гідроксил, гідроксі(С1-С4)алкіл, (С1-С4)алкіл, (С1-С4) алкоксил або (С1-С4)алкілкарбоніл;
- Z8 - атом флуору, гідроксил, (С1-С4)алкіл, (С3-С6)циклоалкіл, бензил, аміногрупа, (С1-С4)алкіламіногрупа, ді(С1-С4)алкіламіногрупа, (С1-С4)алкоксикарбоніл, (С1-С4)алкоксикарбоніламіногрупа, (С3-С6)циклоалкоксил, гідроксикарбоніл, гідроксі(С1-С4)алкіл або (С1-С4)алкоксі(С1-С4)алкіл, (С1-С4)алкоксил, -СОNR23R24, де R23 і R24, незалежно один від одного, - атом гідрогену, (С1-С4)алкіл, моно- або поліфлуор(С1-С4)алкіл, або ще R23 і R24 утворюють разом з атомом нітрогену, до якого вони приєднані, піролідиніл або піперидил, причому зазначені піролідиніл або піперидил, як варіант, заміщені Z3 aбo дифлуорметиліденом;
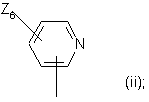
- Z6 - атом хлору або (С1-С4)алкіл, або (С1-С4)алкоксил;
- R1 - (С1-С4)алкіл, яка може, як варіант, мати один подвійний або один потрійний зв'язок, (С1-С4)алкоксикарбоніл, фенілоксикарбоніл або T1-R22, де Т1 визначено вище, а R22 - гідроксил або (С1-С4)алкоксил;
- R2 і R4, незалежно один від одного, - атом гідрогену, хлору або флуору, (С1-С4)алкіл або (С1-С4) алкоксил;
- R3 - атом хлору або флуору, (С1-С4)алкіл, (С1-С4)алкоксил, гідроксил, (С1-С4)карбамоїл, (С1-С4)алкілкарбоніламіногрупа, нітрогрупа, ціаногрупа, трифлуорметил, аміногрупа, (С3-С6)циклоалкіламіногрупа, (С1-С4)алкіламіногрупа, ді(С1-С4)алкіламіногрупа, три(С1-С4)алкіламоній, А-, причому А- - аніон, піролідин-1-іл, піперид-1-іл, піперазин-1-іл, морфолін-4-іл або гексагідроазепін-1-іл;
-X і Y, незалежно один від одного, - атом гідрогену, хлору, брому, йоду або флуору, або (С1-С4)алкоксил або трифлуорметоксил;
а також їх фармацевтично прийнятні солі, сольвати та гідрати.
2. Сполуки за п. 1, які відрізняються тим, що мають форму чистого енантіомера або суміші енантіомерів формули:
 ,
,
де:
R0 є
 ;
;
Z1, Z2, R1, R2, R3, R4, R5, Y і Х є такими, як визначено для формули (І), та їх фармацевтично прийнятні солі, сольвати та гідрати.
3. Сполуки за п. 2, які відрізняються тим, що мають формулу:
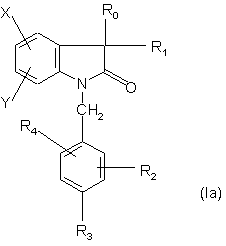 ,
,
де R1 - метил або гідроксил, a R0, R2, R3, R4, X і Y є такими, як визначено для формули (І), у формі чистого енантіомера або суміші енантіомерів, а також їх фармацевтично прийнятних солей, сольватів та гідратів.
4. Сполуки за п. 3, які відрізняються тим, що мають формулу:
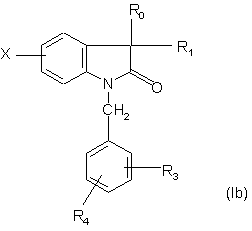 ,
,
де R1 - метил або гідроксил, a R0, R3, R4 і Х є такими, як визначено для формули (І), у формі чистого енантіомера або суміші енантіомерів, а також їх фармацевтично прийнятних солей, сольватів та гідратів.
5. Сполуки за п. 4, які відрізняються тим, що мають формулу:
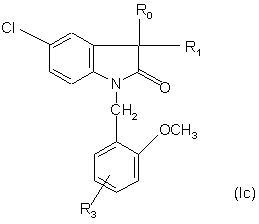 ,
,
де R1 - метил або гідроксил, a R0 і R3 є такими, як визначено для формули (І), у формі чистого енантіомера або суміші енантіомерів, а також їх фармацевтичнo прийнятних солей, сольватів та гідратів.
6. Сполуки за п. 5, які відрізняються тим, що мають формулу:
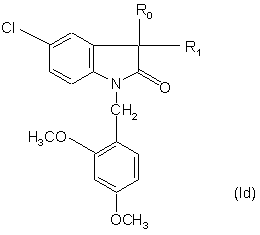 ,
,
де R1 - метил або гідроксил, a R0 є таким, як визначено для формули (І), у формі чистого енантіомера або суміші енантіомерів, а також їх фармацевтично прийнятних солей, сольватів та гідратів.
7. Сполуки за будь-яким з пп. 1 - 6, які відрізняються тим, що R0 є групою:
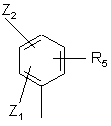 ,
,
де Z1, Z2 і R5 є такими, як визначено для формули (І).
8. Сполуки за п. 7, які відрізняються тим, що R0 є групою:
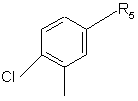 ,
,
R5 є таким, як визначено для формули (І).
9. Сполуки за будь-яким з пп.1 - 8, які відрізняються тим, що R1 є метилом.
10. Сполуки за п. 1, які відрізняються тим, що вибрані з:
5-хлор-3-(2-хлорфеніл)-1-(2,4-диметоксибензил)-3-метиліндолін-2-ону;
5-хлор-3-(2-хлорфеніл)-1-[4-(ізопропіламіно)-2-метоксибензил]-3-метиліндолін-2-ону;
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}ацетаміду;
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}-3-метилбутанаміду;
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}бензаміду;
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}нікотинаміду;
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}-2-метоксиацетаміду;
метил-3-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]анілін}-3-оксопропаноату;
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}-3-метоксипропанаміду;
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}-N-метилацетаміду;
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}-N-метилметансульфонаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N,N-діетилбензаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N,N,-диметилбензаміду;
5-хлор-3-[2-хлор-5-(1-піперидилкарбоніл)феніл]-1-(2,4-диметоксибензил)-3-метиліндолін-2-ону;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етилбензаміду;
5-хлор-3-(2-хлор-5-{[2-(метоксиметил)-1-піродиніл]карбоніл}феніл)-1-(2,4-диметоксибензил) -3-метиліндолін-2-ону;
5-хлор-3-{2-хлор-5-[(2-метил-1-піперидил)карбоніл]феніл}-1-(2,4-диметоксибензил)-
3-метиліндолін-2-ону;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-
метилбензаміду;
метил-1-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоїл}-2-піперидинкарбоксилату;
5-хлор-3-{2-хлор-5-[(4-гідрокси-1-піперидил)карбоніл]феніл}-1-(2,4-диметоксибензил)-3-метиліндолін-2-ону;
5-хлор-3-{2-хлор-5-[(2-метоксіетокси)метил]феніл}-1-(2,4-диметоксибензил)-3-метиліндолін-2-ону;
5-хлор-3-[2-хлор-5-(4-морфолінілметил)феніл]-1-(2,4-диметоксибензил)-3-метиліндолін-2-ону;
5-хлор-3-(2-хлор-5-{[2-(4-морфолініл)етокси]метил}феніл)-1-(2,4-диметоксибензил)-3-метиліндолін-2-ону;
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоїл]-3-гідроксипіперидину;
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоїл]-(R)-3-гідроксипіперидину;
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоїл]-4-метоксипіперидину;
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоїл-4-етоксипіперидину;
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоїл]-(R,S)-2,6-диметилпіперидину;
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоїл]-(R)-2-етоксикарбонілпіперидину;
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоїл]-(R)-2-N,N-диметиламінокарбонілпіперидину;
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоїл]-(R)-2-(N-метил-N-2,2, 2-трифлуоретиламінокарбоніл)піперидину;
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоїл]-(R)-2-піролідинокарбонілпіперидину;
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоїл]-(S)-2-метилпіперидину;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-фенілетил)бензаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(4-піридилметил)бензаміду гідрохлориду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(3-
піридилметил)бензаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-
піридилметил)бензаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-
метоксиетил)бензаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-
диметиламіноетил)бензаміду гідрохлориду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-морфоліноетил)бензаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-піролідиноетил)бензаміду гідрохлориду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-піперидинетил)бензаміду гідрохлориду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-гідроксиетил)бензаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-[2-(пірид-4-ил)етил]бензаміду гідрохлориду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2,2,2-трифлуоретил)бензаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-метил-N-(2,2,2-трифлуоретил)бензаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-ізопропілбензаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-(2-диметиламіноетил)-N-(2,2,2-трифлуоретил)бензаміду гідрохлориду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-циклогексилбензаміду;
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-[3-(пірид-4-іл)пропіл]бензаміду;
у формі чистого енантіомера або суміші енантіомерів, а також їх фармацевтично прийнятних солей, сольватів та гідратів.
11. Сполуки за будь-яким з пп. 1-10, які відрізняються тим, що їх використовують для виготовлення медикаменту для лікування окситоцинзалежних розладів.
12. Сполуки за будь-яким з пп. 1-10, які відрізняються тим, що їх використовують для виготовлення засобу для релаксації матки або токолітичного засобу.
13. Сполуки за будь-яким з пп. 1-10, які відрізняються тим, що їх використовують для виготовлення медикаментів, що сприяють загоюванню, для полегшення болю та тривожності, для надання допомоги у разі виникнення депресії, шизофренії, аутизму, синдрому нав'язливих станів, для покращення родинної та соціальної поведінки, для сприяння впізнаванню й сприйняттю матері дитиною, для надання допомоги у разі порушень пам'яті, для регулювання споживання їжі та питва, залежності від ліків, відлученні дитини від грудей та сексуальних спонукань, для лікування розладів в урогенітальній сфері в акушерстві та гінекології, для контролю за скороченнями матки перед закінченням строку вагітності, для контролю за передчасними пологами, для лікування дисменореї, для контролю за підготовкою з метою проведення кесаревого розтину, для вирішення проблем стерильності або фертильності, для контролю за народжуванням, для контролю за тічкою, порушеннями годування груддю, відлученні дитини від груді, або при пересадці та імплантації ембріонів, для лікування ендометріозів, утруднення сечовипускання або нетримання сечі, гіпертрофії простати при аденокарциномі, еректильних дисфункцій, гіпертензії, гіпонатріємії, серцевої недостатності, атеросклерозу або ангіогенезу, для регулювання накопичення жиру та для лікування раку грудей або простати.
14. Спосіб отримання сполук формули (І) за п. 1, який відрізняється тим, що сполуку формули:
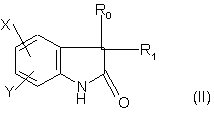 ,
,
в якій X, Y, R0 і R1 є такі, як визначено для формули (1), піддають реакції в присутності основи з галоїдом формули:
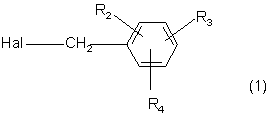 ,
,
де Hal - атом галогену, а R2, R3 і R4 є такими, як визначено для формули (І).
15. Спосіб отримання сполук формули (І) за п. 1, який відрізняється тим, що коли R1 - електрофільна група, сполуку формули:
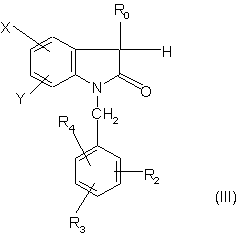 ,
,
в якій R0, R2, R3, R4, Х і Y є такими, як визначено для формули (І), перетворюють в присутності основи дією похідного R1-Z, де Z - відщеплювальна група.
16. Спосіб отримання сполук формули (І) за п. 1, який відрізняється тим, що коли R1 = ОН, похідне ізатину формули:
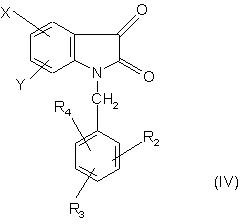 ,
,
в якій R2, R3, R4, X і Y є такими, як визначено для формули (І), піддають реакції з металоорганічним похідним R0-M або R0MgHal, R0 є таким, як визначено для формули (1), М - атом металу, a Hal -атом брому або йоду.
17. Спосіб отримання сполук формули (І) за п. 1, який відрізняється тим, що сполуку формули:
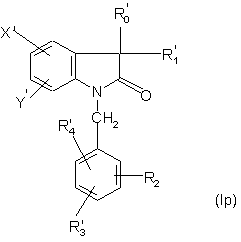 ,
,
в якій R'0, R'1f R'2, R'3, R'4, X' і Y' відповідно є або R0, R1, R2, R3 R4, X і Y, як визначено для формули (І), або попередньою до R0, R1, R2, R3, R4, X і Y групою, піддають наступній обробці, щоб перетворити будь-яку з груп R'0, R'1, R'2, R'3, R'4, X' і Y' у відповідно R0, R1, R2, R, R4, Х або Y, як визначено для формули (І).
18. Фармацевтична композиція, яка відрізняється тим, що містить, як активну основу, сполуку за будь-яким з пп. 1 - 10.
19. Фармацевтична композиція за п. 15, яка відрізняється тим, що містить антагоніст рецепторів окситоцину за будь-яким з пп. 1 - 10 у комбінації з антагоністом V1а-рецепторів вазопресину.
20. Медикамент, який відрізняється тим, що містить сполуку за будь-яким з пп. 1-10.
Текст
Даний винахід стосується нових похідних індолін-2-ону, способу їх отримання й фармацевтичних композицій, що їх містять. Ці нові похідні є потужними й селективними лігандами рецепторів окситоцину, і можуть таким чином використовуватися як активна основа фармацевтичних сполук, зокрема, в акушерській чи гінекологічній галузі. Окситоцин (ОТ) - це гормон, який виділяється нейрогіпофізом, з циклічною нонапептидною структурою, подібною до структури аргінінового вазопресину (AVP). Рецептори окситоцину знаходять в основному в гладенькому м'язі матки та на міоепітеліальних клітинах перси. Отже, окситоцин відіграє важливу роль у пологах, тому що він бере участь у скороченні м'язів матки й в лактації. Крім того, рецептори окситоцину також розташовані в інших периферійних тканинах і в центральній нервовій системі; окситоцин може, таким чином, впливати на серцево-судинну й ендокринну системи, нирки, або впливати на поведінку. Похідні індолін-2-ону були розкриті в деяких заявках наПатент як ліганди рецепторів вазопресину і можливо рецептори окситоцину; можна нагадати заявки наПатент WO 93/15051, ЕР 636 608, ЕР 636 609, WO 95/18105, WO 97/15556 і WO 98/25901. Досі не було розкрито ніяких похідних індолін-2-ону як потужних і селективних лігандівів рецепторів окситоцину. Зараз виявлено, що деякі похідні індолін-2-ону є потужними й селективними лігандами рецепторів окситоцину. Отже, згідно з одним з аспектів, цей винахід стосується нових похідних індолін-2-ону у вигляді чистого енантіомеру чи суміші енантіомерів формули: де: R0 є гр упа, вибрана з: де: -Z1 є атом хлору, брому, йоду чи флуору або (С1-С4)алкіл, (С1-С4)алкоксил чи трифторметил; -Z2 є атом гідрогену, хлору, брому, йоду чи флуор у, або (С1-С4)алкіл, (С3-С5)циклоалкіл, (С1-С4)алкоксил, (С3-С5)циклоалкоксил чи поліфлуор(С 1-С4)алкіл; -R5 є T 1W, де Т 1 є -(СН2)m-, причому т може дорівнювати 0 або 1, a W є атом гідрогену або гідроксикарбоніл (чи карбоксил), (С1-С4)алкоксикарбоніл, 1,3-диоксолан-2-іл чи 1,3-диоксан-2-іл, або ще W є -NR6R7- гpyпy, де R6 і R7 є, незалежно один від одного, атом гідрогену, (С1-С4)алкіл, (С1С4)алкілсульфоніл чи фенілсульфоніл, де фенільна група може бути одно-, дво- чи тризаміщеною Z5; або ще, R6 і R7 утворюють разом з атомом нітрогену, до якого вони приєднані, морфолініл, який, як варіант, може бути заміщений (С1-С4)алкілом чи оксогрупою; або ще R6 і R7 утворюють разом з атомом нітрогену, до якого вони приєднані, піперазиніл, як варіант заміщений в позіції 4 замісником Z3; або ще R6 і R7 утворюють разом з атомом нітрогену, до якого вони приєднані, піродиніл або піперидил, причому зазначені піродиніл та піперидил як варіант заміщені Z4; або ще W є -NR8COR9, де R8 є атом гідрогену або (С1-С4)алкіл, a R9 є атом гідрогену чи гр упу (С1С4)алкілу, бензилу, піридилу чи фенілу, причому указана фенільна група може бути одно-, дво- чи трьохзаміщеною Z5; або ще R9 є -NR10R11- груп у, де R10 і R11 є, незалежно один від одного, атом гідрогену або (С1-С4)алкіл, або ще, R10 і R11 утворюють разом з атомом нітрогену, до якого вони приєднані, піродиніл, піперидил чи морфолініл, як варіант заміщений (С1-С4) алкілом; або ще R9 є піролідин-2-іл чи -3-іл чи піперид2-іл, -3-іл чи -4-іл, причому зазначені піродиніл та піперидил як варіант заміщені Z7; або ще R9 є -T2-R12 або T2COR12, де Т2 є -(СН2)n-, причому можливо, щоб п дорівнювало 1, 2, 3 і 4, a R12 є (С1-С4)алкоксил чи –NR10R11, причому R10i R11 визначені вище; або ще, W є -CONR13R14, де R13 є атом гідрогену чи (С1-С4)алкіл, (С3-С7)циклоалкіл, монофлуор(С 1-С4) алкіл чи поліфлуор(С 1-С4) алкіл, a R14 є атом гідрогену, (С1-С4) алкіл, феніл, як варіант заміщений Z5, -T4-R15, де Т4 є -(CH2)q - при q, що дорівнює 1, 2, 3 чи 4, a R15 є гідроксил, (С1-С4)алкоксил, (С1-С4)алкоксикарбоніл, (С1С4)алкоксикарбоніламіногрупа, феніл, як варіант одно- чи двозаміщений Z5, пірид-2-іл,-3-іл чи -4-іл, абоNR16R17, в якій R16 і R17 є, незалежно один від одного, атом гідрогену або (С1-С4)алкіл, або ще R16 і R17 утворюють разом з атомом нітрогену, до якого вони приєднані, морфолініл, як варіант одно- чи двозаміщений (С1-С4)алкілом, або ще R16 і R17 утворюють разом з атомом нітрогену, до якого вони приєднані, піперазиніл, як варіант заміщений в позіції 4 замісником Z3, або ще R16 і R17 утворюють разом з атомом нітрогену, до якого вони приєднані, піродиніл чи піперидил, причому зазначені піродиніл та піперидил як варіант заміщені Z5, причому, коли q=1, R15 відмінна від гідроксилу, (С1-С4)алкоксилу, (С1-С4)алкоксикарбоніламіногрупи чи – NR16R17; або ще R13 і R14 утворюють разом з атомом нітрогену, до якого вони приєднані, морфолініл, як варіант одно- чи двозаміщений (С1-С4)алкілом, чи піперазиніл, як варіант заміщений Z3 в позіції 4; або ще R13 і R14 утворюють разом з атомом нітрогену, до якого вони приєднані,азетидиніл, піродиніл, піперидил чи гексагідроазепініл, причому зазначені піродиніл, піперидил та гексагідроазепініл можуть бути як варіант одночи двозаміщеними Z8; або ще, W є OR18- гpyпy, де R18 є атом гідрогену чи (С1-С4)алкіл, (С1-С4)алкокси(С 1-С4)алкіл, або -T3-R19груп у, де Т3 є -(СН2)р-, причому р може дорівнювати 2 чи 3, a R19 вибирають з гідроксильної групи, трифенілметоксгрупи чи -NR 2OR21 групи, де R21 є атом гідрогену чи (С1-С4)алкіл, a R21 є атом гідрогену чи (С1С4)алкіл, тетрагідрофуранілметил чи тетрагідропіранілметил, або ще R20 і R21 утворюють разом з атомом нітрогену, до якого вони приєднані, морфолініл, як варіант одно- чи двозаміщений (С1-С4)алкілом, або піперазиніл, як варіант заміщений в четвертий позіції замісником Z3, або ще R20 і R2i утворюють разом з атомом нітрогену, до якого вони приєднані, піродиніл чи піперидил, причому зазначені піродиніл та піперидил як варіант заміщені Z5; -Z3 є (С1-С4) алкіл, піридил, феніл, (С1-С4)ал кіл карбоніл чи (С1-С4)алкокси карбоніл; -Z4 є оксогрупа, атом флуору, гідроксил, (С1-С4)алкіл, бензил, аміногрупа, (С1-С4) алкіламіногрупа, ди(С1С4) алкіламіногрупа, (С1-С4) алкоксил, (С1-С4)алкоксикарбоніл чи (С1-С4)алкоксикарбоніламіногрупа; -Z5 є атом хлору, брому, йоду чи флуору, гідроксил, (С1-С4)алкіл чи (С1-С4) алкоксил; -Z7 є атом флуору, гідроксил, гідроксил, (С1-С4)алкіл, (С1-С4) алкіл, (С1-С4) алкоксил чи (С1С4)алкілкарбоніл; -Z8 є атом флуору чи гідроксил, (С1-С4) алкіл, (С3-С6) циклоалкіл, бензольна група, аміногрупа, (С1С4)алкіламіногрупа, ди(С1-С4)алкіламіногрупа, (С1-С4) алкоксикарбоніл, (С1-С4) алкоксикарбоніламіногрупа, (С3-С6)циклоалкоксил, гідроксикарбоніл, гідрокси(С 1-С4)алкіл, (С1-С4)алкокси(С 1-С4)алкіл, або (С1-С4) алкоксил чи -CONR23R24, де R23 і R24 є, незалежно один від одного, атом гідрогену, (С1-С4) алкіл, монофлуор(С 1-С4)алкіл чи поліфлуор (С1-С4)алкіл, або ще R23 і R24 утворюють разом з атомом нітрогену, до якого вони приєднані, піродиніл чи піперидил, причому зазначені піродиніл чи піперидил як варіант заміщені Z3 чи дифлуорметиліденом; -Z6 є атом хлору, або (С1-С4)алкільну чи (С1-С4)алкоксигрупу; -R1 є (С1-С4)алкіл, який може мати подвійний чи потрійний зв'язок, (С1-С4)алкоксикарбоніл, фенілоксикарбоніл чи T1-R22, де Т1 визначено вище, a R22 є гідроксил чи (С1-С4)алкоксил; -R2 і R4 є, незалежно один від одного, атом гідрогену, хлору або флуору.або (С1-С4)алкіл чи (С1С4)алкоксил; -R3 є атом хлору або флуору, чи гідроксил, (С1-С4)алкіл, (С1-С4)алкоксил, (С1-С4)карбамоїл, (С1С4)алкілкарбоніламіногрупа, нітрогрупа, ціаногрупа, трифторметил, аміногрупа, (С3-С6)циклоалкіламіногрупа, (СгС4)алкіламіногрупа, ди(С1-С4)алкіламіногрупа, три(С1-С4)алкіламоній А-, причому А- є аніонна група, піролідин-1-іл, піперид-1-іл, піперазин-1-іл, морфолін-4-іл чи гексагідроазепін-1-іл; -X і Y є, незалежно один від одного, атом гідрогену, хлор у, брому, йоду чи флуору або (С1-С4)алкоксил чи трифторметоксил; та іх фармацевтично прийнятні солі, сольвати та гідрати. Термін "алкіл" є насичений, лінійний чи розгалужений, одновалентний радикал вуглеводню. Термін "( С1-С4)алкіл" є алкільний радикал, який містить від 1 до 4 атомів карбону, такий, як метил, етил, нпропіл, ізопропіл, н-бутил, ізобутил, emop-бутил і mpem-бутил. Термін "алкілен" є насичений, лінійний чи розгалужений, двовалентний вуглеводневий радикал. Термін "алкокси" є n О-алкіл-радикал. Термін "аніон А-" є, наприклад, Сl-, Вl-, l- чи CH3SO4-. Термін "ди (С1-С4)алкіламіно" є н-амінорадикал, який заміщено двома алкільними радикалами, які можуть бути ідентичними чи різними. Так само у три(С 1-С4)амонія алкільні радикали можуть бути ідентичними чи різними. Солі сполук за цим винаходом виготовляють згідно зі способом, який є відомий фахівцям у цій галузі техніки. Солі сполук формули (І) згідно з цим винаходом містять сполуки з неорганічними чи органічними кислотами, що робить можливим відповідне розділення чи кристалізацію сполук формули (І), і фармацевтично прийнятних солей. Можна нагадати, що придатні, наприклад, такі кислоти: пікринова кислота, щавлева кислота чи оптично активна кислота, наприклад, винна кислота, дибензоїлвинна кислота, мигдальна кислота чи камфарсульфокислота, і кислоти, що утворюють фізіологічно прийнятні солі, такі, як гідрохлорид, гідробромід, сульфат, кислий сульфат, дигідрогенфосфат, малеинат, фумарат, нафталіндисульфонат чиПаратолуолсульфонат, причому гідрохлорид кращий. Коли сполука за цим винаходом виявляє один чи більше асиметричних атомів карбону, оптичні ізомери цієї сполуки утворюють невід'ємну частину цього винаходу. Коли сполука за цим винаходом виявляє стереоізомерію, наприклад, екваторіально-аксиальну чи типу Z-E, винахід охоплює всі стереоізомери цієї сполуки. Цей винахід охоплює сполуки за формулою (І) у вигляді чисти х ізомерів, але також у вигляді суміші ізомерів у будь-якій пропорції. Сполуки (І) виділяють у вигляді чисти х ізомерів за допомогою звичайного способу виділення: можна, наприклад, використати часткову рекристалізацію солі рацемату, за бажанням, активною кислотою чи лугом, принцип якої є добре відомим, або за допомогою звичайної хроматографії з хіральною чи нехіральною фазою. Сполуки за формулою (І) о хоплюють сполуки, в яких один чи більше атомів гідрогену, карбону чи галогену, зокрема, йоду, хлор у чи флуор у, заміщені їхніми радіоактивними ізотопами, наприклад, тритієм чи вуглецем 14. Таки помічені сполуки використовують як рецептор лігандів у дослідженнях, у вивченні метаболізму чи фармакокінетики, або в біохімічних аналізах. Функціональні групи, що можуть міститись в молекулах сполук формули (І) і в проміжних сполуках реакції, можна захистити, як в постійній, чи в тимчасовій формі, за допомогою захисних груп, які забезпечують однозначний синтез очікуваної сполуки. Захисні реакції й реакції відміни захисту виконують за способом, який відомий фахівцям у цій галузі те хніки. Термін "тимчасова захисна група для амінів або спиртів" є такі захисні групи, які описано в документі "Захисні групи в органічному синтезі" (Protective Groups in Organic Synthesis, Greene T.W. і Wuts Р.Г.М., опублікованій Wiley Intersciences, 1999), і в "Захисні гр упи" (Protecting Groups, Kocienski P.J., 1994, Georg Thieme Verlag). Можна нагадати, наприклад, про тимчасові захисні групи для амінів: бензили, карбамати (такі, як mpemбутилоксикарбоніл, котрий можна розщепити в кислотному середовищі, чи в бензилоксикарбонілі, який можна розщепити шляхом гідрогенолізу); для карбонових кислот: алкілові естери (такі, як метиловий, етиловий чи трет-бутиловий естери, що можуть гідролізуватись в лужному або кислотному середовищі) і бензилові естери, які можуть бути гідрогенізовані; для спиртів чи для фенолів, таких, як тетрагідропіраніл, метилоксиметил, метилетоксиметил, mpem-бутил і бензильни естери; чи для похідних карбонілу, таких, як лінійні чи циклічні ацеталі, як, наприклад, 1,3-діоксан-2-іл чи 1,3-діоксолан-2-іл; і можна послатись на відомі загальні способи, які описано в вищезгаданому "Protecting Groups". Фахівець у цій галузі техніки має вибрати придатні захисні групи. Сполуки формули (І) можуть містити попередні групи інших функціональних груп, що потім породжуються на одній чи більше інших стадіях. Одна група сполук згідно з цим винаходом складається з похідних індолін-2-ону у вигляді чистого енантіомеру чи суміші енантіомерів формули: в якій R0 є причому Z1, Z2 , R1 , R2, R 3, R4 , R5, Y і X є як визначено для формули (І), та їх фармацевтично прийнятних солей, сольватів та гідратів. Згідно з іншим з його аспектів, винахід стосується сполук формули: де RІ є метил чи гідроксил, a R0, R2, R3, R4, X і Y є як визначено для формули (І); у вигляді чистого енантіомеру чи суміші енантіомерів та їх фармацевтично прийнятних солей, сольватів та гідратів. Підгрупа сполук згідно з цим винаходом складається зі сполук формули: де RІ є метил чи гідроксил, a R0, R3, R4 і X є як визначено для формули (І); у вигляді чистого енантіомеру чи суміші енантіомерів та їх фармацевтично прийнятних солей, сольватів та гідратів. Інша підгрупа сполук згідно з цим винаходом складається зі сполук формули: де RІ є метил чи гідроксил, a R0 і R3 є як визначено для формули (І); у вигляді чистого енантіомеру чи суміші енантіомерів та їх фармацевтично прийнятних солей, сольватів та гідратів. Інша підгрупа сполук згідно з цим винаходом складається із сполук формули: в якій RІ є метил чи гідроксил, a R0 визначено вище для формули (І), у вигляді чистого енантіомеру чи суміші енантіомерів та їх фармацевтично прийнятних солей, сольватів та гідратів. Серед цих сполук формули (І), (Іа), (Іb), (Іс) і (Id) є сполуки, в яких R0 є група: зокрема, група: в якій R5 визначено вище для формули (І), складають інший аспект цього винаходу. Серед останніх сполук, ті, в яких RІ є метил, складають інший аспект цього винаходу. Згідно з іншім з його аспектів, цей винахід стосується сполук, які вибрано з групи, до складу якої входять: 5-хлор-3-(2-хлорфеніл)-1-(2,4-диметоксибензил)-3-метиліндолін-2-он (Приклад 1); 5-Хлор-3-(2-хлорфеніл)-1-[4-(ізопропіламіно)-2-метоксибензил]-3-метиліндолін-2-он (Приклад 56); N-{4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}ацетамід (Приклад 70); N-{4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}-3-метилбутанамід (Приклад 73); N-{4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}бензамід (Приклад 74); N-{4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}нікотинамід (Приклад 76); N-{4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}-2-метоксиацетамід (Приклад 77); Метил 3-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]анілін}-3-оксопропаноат (Приклад 78); N-{4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}-3-метоксипропанамід (Приклад 81); N-{4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}-N-метилацетамід (Приклад 87); N-{4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоїндолін-3-іл]феніл}-N-метилметансульфонамід (Приклад 97); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N,N-діетилбензамід (Приклад 102); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N,N-диметилбензамід (Приклад 109); 5-Хлор-3-[2-хлор-5-(1-піперидилкарбоніл)феніл]-1-(2,4-диметоксибензил)-3-метиліндолін-2-он (Приклад 112); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етилбензамід (Приклад 114); 5-Хлор-3-(2-хлор-5-{[2-(метоксиметил)-1-піродиніл]карбоніл}феніл)-1-(2,4-диметоксибензил)-3 метиліндолін-2-он (Приклад 119); 5-Хлор-3-{2-хлор-5-[(2-метил-1-піперидил)-карбоніл]феніл}-1-(2,4-диметоксибензил)-3-метил-індолін-2-он (Приклад 122); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-метилбензамід (Приклад 124); Метил-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоіл}-2-піперидинкарбоксилат (Приклад 131); 5-Хлор-3-{2-хлор-5-[(4-гідроксі-1-піперидил)-карбоніл]феніл}-1-(2,4-диметоксибензил)-3-метил-індолін-2-он (Приклад 134); 5-Хлор-3-{2-хлор-5-[(2-метоксиетоксі)метил]-феніл}-1-(2,4-диметоксибензил)-3-метиліндолін-2-он (Приклад 142); 5-Хлор-3-[2-хлор-5-(4-морфолінілметил)феніл]-1-(2,4-диметоксибензил)-3-метиліндолін-2-он (Приклад 148); 5-Хлор-3-(2-хлор-5-{[2-(4-морфолініл)етоксі]-метил}феніл)-1-(2,4-диметоксибензил)-3-метиліндолін-2-он (Приклад 152); 1-[4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоіл]-3-гідроксипіперидин (Приклад 194); 1-[4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоіл]-(R)-3-гідроксипіперидин (Приклад 195); 1-[4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоіл]-4-метоксипіперидин (Приклад 166); 1-[4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоіл-4-етоксипіперидин (Приклад 167); 1-[4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоіл]-(R,S)-2,6диметилпіперидин (Приклад 189); 1-[4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоіл]-(R)-2-етоксікарбонілпіперидин (Приклад 175); 1-[4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоіл]-(R)-2-N,N-диметиламінокарбонілпіперидин (Приклад 169); 1-[4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоіл]-(R)-2-(N-метил-N-2,2,2трифторетиламінокарбоніл)піперидин (Приклад 170); 1-[4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоіл]-(R)-2-піролідинкарбонілпіперидин (Приклад 168); 1-[4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]бензоіл]-(S)-2-метил-піперидин (Приклад 174); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-фенілетил)бензамід (Приклад 185); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(4піридилметил)бензаміду гідрохлорид (Приклад 188); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(3-піридилметил)бензамід (Приклад 201); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-піридилметил)бензамід (Приклад 200); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-метоксиетил)бензамід (Приклад 184); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-диметиламіноетил)бензаміду гідрохлорид (Приклад 177); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-морфоліноетил)бензамід (Приклад 178); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-піролідиноетил)бензаміду гідрохлорид (Приклад 182); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-піперидинетил)бензаміду гідрохлорид (Приклад 183); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2-гідроксіетил)бензамід (Приклад 198); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-[2-(пірид-4-іл)етил]бензаміду гідрохлорид (Приклад 179); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-(2,2,2-трифторетил)бензамід (Приклад 180); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-метил-N-(2,2,2-трифторетил)бензамід (Приклад 171); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-ізопропілбензамід (Приклад 187); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-(2-диметиламіноетил)-N-(2,2,2трифторетил)бензаміду гідрохлорид (Приклад 202);4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-циклогексилбензамід (Приклад 192); 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]-N-етил-N-[3-(пірид-4-іл) пропіл]бензамід (Приклад 204); у вигляді чистого енантіомеру чи суміші енантіомерів і їхніх фармацевтично прийнятних солей, їхніх сольватів та їхніх гідратів. Сполуки за формулою (І) можна виготовити за такою схемою 1: У цій схемі R0, R1, R2, R3, R4, X і Y такі, як визначено для формул (1) і (Ір), a R'0, R’1, R2, R'3, R'4, X' і Y', відповідно, є або R0, RІ, R2 , R3, R4, X і Y, як визначено для формули (І), чи попередня група для R0, RІ, R 3, R4 , X і Y, причому R’1 відмінна від гідрогену. Іншою метою цього винаходу є спосіб виготовлення сполуки за формулою (І), який відрізняється тим, що: а) сполука формули: де X, Y, R 0 і RІ -визначено для формули (І), реагує в присутності основи з галоїдом формули: в якій Hal є атом галогену, a R2, R3 і R4 -визначено для формули (І); б) або ще, коли RІ є злектрофільна група, де R0, R2, R3, R4, X і Y-визначено для (І), перетворюють дією похідного RІ -Z, де Z є відщеплювальна група в присутності основи; с) або ще, коли RІ=ОН, похідний ізатіну формули: де R2, R3, R4, X і Y - визначено для формули (І), реагує з металоорганічним похідним R0-M чи R0MgHal, причому R0 - визначено для формули (І), M - це атом металу, a Hal - це атом брому чи йоду; d) або ще, сполуку формули: де R'0, R’1, R' 2, R' 3, R’4, X' і Y' відповідно є або R0, RІ, R2, R 3, R4 , X і Y, як визначено для формули (І), або попередня група для R0, RІ, R2, R3, R4, X і Y, піддають наступній обробці, щоб перетворити будь-яку з груп R'0, R’1, R'2, R'3, R' 4, X’ і Y’ у відповідно R0, RІ, R2, R3, R4, X чи Y, як визначено для формули (І), згідно з реакціями, які відомі фахівцям у цій галузі те хніки. Реакцію, яку описано в а), краще проводити зі сполукою (1), в якій Hal=СІ чи Вr, використовуючи як луг металевий гідрид, як, наприклад, гідрид натрію чи лужний алкоголят металу, як, наприклад, mpem-бутоксид калію, в безводному розчиннику, наприклад, диметилформаміді чи тетрагідрофурані. В реакції, яку описано в b), термін "група, що легко відщеплюється," є, наприклад, атом галогену, приміром, хлор, бром чи йод, або альтернативно сульфонієву груп у естерів, наприклад,Паратолуолсульфонат. Сполука (III) краще реагує з галідом RI-Hal, причому RІ - визначено для формули (І), a Hal це атом галогена, переважно атом йоду, в присутності лугу; реакція буде йти, наприклад, у присутності лугу, приміром, лужного алкоголяту металу, наприклад, mpem-бутоксиду калію, в ефірному розчиннику, наприклад, тетрагідрофурані, чи альтернативно у присутності карбонату, приміром, натрію, калію чи карбонату цезія, в розчиннику наприклад, диметилформаміді чи ацетонітрилі. Переважно в реакції, яку описано в с), сполука за формулою (IV) реагує з похідним магнію R 0Mg-Hal, причому R0 - як визначено для формули (І) чи (Ір), a Hal - це бром чи переважно атом йоду, або альтернативно сполука (IV) реагує з похідним R0M, де M - переважно атом літію. Це похідне R0Li одержували або за допомогою прямого окислювання літію, наприклад, дією бутиллітію, або за допомогою реакції обміну диїзопропіламіду літію згідно з Heterocycles, 1993, 35(1), 151-169, або галоген-літію згідно з Organolithium Methods, Pergamon Press, New York, 1988 чи J. Am. Chem. Soc, 1956, 2217. Ці реакції проводять переважно в безводному розчиннику, наприклад, діетиловому етері чи тетрагідрофурані. Перетворення сполуки (Ір), попередних сполук (І), що описане в d), здійснювали згідно з загальновідомим способом. Крім того, сполуки (І) можна отримати від іншої сполуки (І) перетворенням однієї з заміщуючи х гр уп R0, RІ, R2, R3, R4, X чи Y, зокрема, R0, RІ чи R3. Наприклад, сполуки (І), в яких R 3=-NH2, можна отримати відновленням відповідної сполуки (І), в якій R3=-NO2, приміром, дією соляної кислоти у присутності олова в алкоголі, наприклад, етанолі; - сполуки (І), в яких R3 є (С1-С4)алкіламіно чи ди(С 1-С4)алкіламіногрупу, можна отримати з відповідних сполук (І), в яких R3=-NH2 реакцією відновного амінування. Можна послатись на J. Org. Chem., 1996, 61, 38493862, а реакцію можна здійснити дією альдегід (С1-С4)алкілу у присутності натрію триацетоксиборгідриду, чи альтернативно можна послатись на J. Am. Chem. Soc, 1974, 96(25), 7812, і реакцію можна здійснити дією (С1С4)алканової кислоти у присутності натрій гідроборату. Можна також використати загальновідомі реакції Nалкілювання, наприклад, здійснюючи реакцію аміногрупи з (С1-С4)галоїдним алкілом у присутності диметилформаміду та карбонату калію; - сполуки (І), в яких R3 є (С1-С4)алкоксил, можна отримати з відповідних сполук (Ір), де R'3=ОН , за допомогою звичайної реакції О-алкілювання, наприклад, дією (С1-С4)галоїдного алкілу у присутності диметилформаміду та карбонату цезію чи калію; - сполуки (І), де R3 є (С1-С4)алкілкарбоніламіногрупа, можна отримати з відповідної сполуки (І), де R3=-NH2, способом звичайного ацилювання, наприклад, дією хлориду (С1-С4)алканової кислоти в присутності основи, наприклад, триетиламіну в розчиннику, наприклад, -дихлорметані; - сполуки (І), де R3 є циклічний амін чи морфолін-4-іл, можна отримати з відповідної сполуки (І), де R 3=NH2, за способом, який описано в Teтpahedron, 1989, 45(3), 629-636. - сполуки за формулою (І), в яких R0 є група: можна отримати з відповідної сполуки за формулою (І) перетворенням групи R5 за допомогою стандартних реакцій, наприклад, реакцій алкилювання, ацилювання, окиснення, відновлення чи амінування, які відомі фа хівцям у цій галузі техніки. Сполуки (III) виготовляли за допомогою дегалогенування сполук за формулою: де R0, R2, R3, R4 , X і Y-як визначено для формули (І), a Hal є атом хлору, брому чи йоду, наприклад, дією загальмованого діалкіламіду літію, наприклад, діізопропіламіду літію (LDA), за аналогією зі способом, який описано Н. Ньюкемом та ін. (N. Newcom etal. в J. Am. Chem. Soc, 1990, 5186-5193). Сполуку (I’) отримують, наприклад, перетворенням відповідної сполуки (І), в який R1=ОН , дією галоїдзаміщеного похідного, наприклад, типу галоїдного ангідриду. Можна нагадати таке хлороване похідне, як SOCI2. Сполуку (IV) взагалі отримують за допомогою реакції сполуки (1) з похідним ізатину формули: де X і Y-як визначено для формули (І), за тих самих умов, як ті, які описано вище для приготування сполуки (І) зі сполуки (II). Похідні ізатину (2) - це сполуки, які є у продажу чи які виготовляли згідно зі способами, що описано в Teтpahedron Letters, 1998, 39, 7679-7682; TeTpahedron Letters, 1994, 35, 7303-7306; J. Org. Chem., 1977, 42, 1344-1348 і Advances в Heterocyclic Chemistry, A.R. Katritzky і A.J. Boulton, Academic Press, New York, 1975, 18, 2-58. Сполуки (II) можна синтезувати різними способами, які розкрито, зокрема, в Patent Applications EP 526 348 і WO 95/18105. Деякі напрямки виробництва сполук (II) проілюстровано на схемі 2: Термін "нуклеофильна R1“ є (С1-С4)алкоксигрупу. Сполуки (II), в яких R1 є електрофільна група, наприклад, (С1-С4)алкіл, можна виготовити зі сполуки формули: в який R0, X і Y-як визначено для формули (І), за допомогою реакції з похідним R1-Z, де Z є гр упа, що легко відщеплюється, за тих самих умов, як ті, що описано вище для перетворення сполуки (III) у сполуку (І). Сполуку (V) як правило, синтезують: * або за допомогою дегідроксилування відповідної сполуки (II), де RІ=ОН , дією хлориду олова в кислотному середовищі, згідно зі способом, який описано в Тетраhеdrоn, 1996, 52(20), 7003-7012, чи дією триетилсилану, згідно з Bioorganic and Medicinal Letters, 1997, 7(10), 1255-1260; * чи за допомогою реакції кільцевання в середовищі сильної кислоти, наприклад, сірчаної кислоти, сполуки за формулою: де R0, X і Y - визначено для формули (І), причому саму цю сполуку (VII) отримують за допомогою реакції конденсації між похідним a-оксіоцтової кислоти за формулою: причому R0 - визначено для формули (І), і амінобензолом формули: де X і Y - як визначено для формули (І). Сполуки (3) є у продажу, або їх синтезують звичайним способом. Сполуки за формулою (VIII) є у продажу чи їх синтезують згідно зі способами, які відомі фахівцям у цій галузі те хніки. Посилання, зокрема, можна зробити на J. Med. Chem., 1987, 30(8), 1447. До сполук (V) можуть також ввести інші реакції. Можна нагадати: - реакцію Брунера, яку описано в Teтpahedron, 1986, 42(15), 4267-4272: - реакцію циклізації у присутності мурашиної кислоти, що описана в J. Chem. Soc. Perkin Trans., 1986,1, 349-360: - наступні реакції циклізації: згідно з J. Am. Chem. Soc. , 1985, 107 (2), 435-443: згідно з Teтpahedron, 1996, 52(20), 7003-7012. Сполуки (II), в яких RІ є (С1-С4)алкоксигрупу, одержують зі сполуки за формулою в якій R0, X та Y-як визначено для формули (І), a Hal є атом галогену, наприклад, атом хлору, дією відповідного спирту R1H. Сполуку (VI) го тують з відповідної сполуки (II), в якій RІ=ОН , за допомогою реакції з тіонілхлоридом у присутності піридину в ди хлорметані. Сполуки (II), в яких RІ=ОН, як правило, готують з відповідного ізатину формули: де X і Y - як визначено для формули (І), згідно зі способом, який описано вище для приготування сполук (І), де RІ=ОН, зі сполуки (IV). Коли RІ не є гідроксильну гр упу, сполуки (II) можна також виготовити згідно зі схемою: На цій схемі 3 R0, RІ, X і Y-як визначено для формули (І), R1 не є гідроксильну груп у, а М є, наприклад, атом літію чи MgHal, де Hal - це атом галогену. Перетворення сполуки (X) в сполуку (IX) для отримання сполуки (II) здійснювали, зокрема, згідно зі способом, який описано в J. Chem. Soc, 1957, 1928. Галоїдні бензили (1) відомі, або їх виготовляють згідно з відомими способами. Можна нагадати, наприклад, J.V. Rajanbabu, J. Org. Chem., 1986, 51, 1704-1712 і публікації, цитовані в ЕР 636609. Взагалі, похідні галоїдного метилбензолу (1) можна виготовити за допомогою дії N-галосукцинамідів на відповідні похідні метилбензолу і згідно з ЕР 229566. Реакцію здійснювали у розчиннику, наприклад, тетрахлориді карбону, у присутності дибензоїлпероксиду. Похідне галоїдметилбензолу можна також виготовити з відповідних похідних гідроксіметилбензолу за допомогою реакції з трибромідом фосфору в діетиловому етері чи за допомогою реакції з тіонілхлоридом. На будь-якій стадії процесу, можна сформувати проміжну сполуку типу (IIр), (IIIр) чи (IVp), де принаймні одну з заміщуючи х гр уп змінено однією з її попередніх гр уп. Ці сполуки (ІІр), (IIIр) і (IVp) перетворюють за допомогою загальновідомих реакцій в (II), (III) і (IV), відповідно. Фахівець у цій галузі техніки може пристосувати ви щезгадані реакції до сполук (ІІр), (IIIр) і (IVp). Сполуки за цим винаходом становлять предмет біохімічних і фармакологічних досліджень. Спорідненість сполук за цим винаходом з рецепторами окситоцину установили in vitro тестуванням зв'язків, застосовуючи спосіб, який описано J. Elands et al. в Eur. Pharmacol., 1987, 147, 192-207. Цей спосіб полягає у вивченні in vitro переміщення поміченого радіоактивним йодом окситоцину на рецепторах окситоцину в мембраному препараті рецепторів окситоцину жіночої матки. Значення ІС50 (концентрація, що інгібує 50% зв'язків поміченого радіоактивним йодом окситоцину до його рецепторів) низькі й змінюються з 10 -10 до 10-6М в останньому тесті. Спорідненість сполук за цим винаходом для V1a-рецепторів вазопресину людини (спосіб, який описано М. Thibonnier et al. в J. Biol. Chem., 1994, 269, 3304-3310), рецепторів VIb (спосіб, який описано by Т. Sugimoto et al. в J. Biol. Chem., 1994, 269, 27088-27092) і рецепторів V2 (спосіб, який описав М. Birnbaumer та ін.. в Nature (Lond.), 1992, 357, 333-335) також досліджували. Сполуки, які вивчали, мали небагато, чи зовсім не мали спорідненості до рецепторів Via , Vib і V2. Приміром, укажемо, що, сполука з прикладу 1 виявляє значення ІС50 менші за 50нМ, причому значення IС50 для V1a,-Vib-і V2-рецепторів більші за 1мкМ. Агоністичну чи антагоністичну природу сполук визначали in vitro тестом, в якому вимірювали кількість внутриклітиного кальцію стосовно клітин, що відзеркалюють людські рецептори окситоцину, згідно зі звичайним способом, який описано в Am. J. Ph ysiol., 268 (Heart Circ. Physiol., 37), 1995, H404-H410, Коли сполуки за цим винаходом поводять себе як антагоністи, їхнє ІС50 знаходиться переважно між 0,5мкМ і 0,5нМ. Для з прикладу, правоповоротний енантіомер з прикладу 1 є антагоністом, який має ІС50, що дорівнює 3,2±1,9нМ. Сполуки за цим винаходом, сильні й селективні ліганди рецепторів окситоцину, особливо ефективні в профілактиці і/чи лікуванні окситоцин-залежних розладів. Сполуки згідно з цим винаходом можуть імітувати або заглушати е фекти окситоцину. Вони особливо ефективні в загоюванні, в знеболюванні і анксіолізисі (попередженні болю і страху), при депресії, шизофренії, аутізмі, синдромі нав’язливих станів, в поводженні дитини до матері (полегшення впізнавання і сприйняття дитиною матері) і соціальній поведінці,Пам'яті, регуляції прийому їжи та рідини, пристрасті до наркотиків, відлученні дитини від груді і сексуальній мотивації. їх можна використовува ти при розладах урогенітальної сфери, зокрема, в положницкий і гінекологічній галузях, зокрема, як релаксант матки, чи токолітичний засіб, або для контролю скорочень матки до настання нормальних пологів, для контролю допологової праці чи для контролю підготовки до пологорозтину, для вирішення проблем стерильності чи фертильності, контролю народжувань (зокрема, ветеринарного застосування), контролю тічки, порушень годування груддю, при відлученні дитини від груді, або при екстракорпоральному заплідненні та переносі ембриону; лікуванні ендометріозу, дисменореї й утр уднення сечовипускання чи ургентного нетримання, гіпертрофії простати при аденокарциномі, еректильних дисфункцій, гіпертензії, гіпонатріємії, серцевої недостатності, атеросклерозу чи ангіогенезу, і регуляції накопичення жиру. Крім того, враховуючи роль окситоцину у контролі лютеїнізуючого гормону (J.J. Evans, J. Endocrin., 1996, 151, 169-174), сполуки цього винаходу можна використати для контрацепції. Крім того, сполуки за цим винаходом можна використати завдяки їхнім протипухлинним ефектам при лікуванні секретуючих окситоцин пухлин, зокрема, раку гр уди й простати. Застосування сполук за цим винаходом для попередження і/чи лікування вищезгаданих станів і для виготовлення лікувальних препаратів, призначених для лікування цих станів, становить невід'ємну частину цього винаходу. Інший предмет цього винаходу становлять фармацевтичні композиції, які містять сполуки за цим винаходом чи фармацевтично прийнятну сіль, сольват чи гідрат останніх і відповідні наповнювачі. Зазначені наповнювачі для лікив вибирають згідно з фармацевтичною формою і бажаним способом призначення: всередину, сублінгвально, підшкірно, внутрішньом'язово, внутрішньовенно, місцево, інтратрахеально, інтраназально, черезшкірно, ректально чи внутрішньоочно. Фармацевтичні композиції виготовляють згідно зі способом, який є відомим фахівцям у цій галузі техніки. Для отримання бажаного профілактичного чи терапевтичного ефекту кожна разова доза може містити від 0,5 до 1000мг, переважно - від 1 до 500мг активних інгредієнтів в комбінації з наповнювачем ліків. Цю разову дозу можна призначати 1-5 разів на добу, таким способом призначаючи добову дозу від 0,5 до 5000мг, переважно 1-2500мг. Сполуки за цим винаходом можна також використати з метою виготовлення композицій для ветеринарного застосування, призначених для регулювання народжуваності. Сполуки за цим винаходом можна також використати для приготування косметичних композицій. Ці препарати призначені для контролю ліполизу, і їх можна постачати у вигляді крему для місцевого застосування. Композиції за цим винаходом можуть містити, на додаток до продуктів за вищенаведеною формулою (І) чи їхні х фармацевтично прийнятних солей, сольватів і гідратів, [пропускання в тексті] і, наприклад, активні групи, які можна використати в лікуванні хвороб чи станів, які зазначені вище. Отже, інший предмет цього винаходу становлять фармацевтичні композиції, що містять декілька активних компонентів в комбінації, які самі по собі чи ця суміш є сполуками за цим винаходом. Зокрема, цей винахід стосується фармацевтичних композиції, які містять сполуку за цим винаходом, антагоністичну до рецепторів окситоцину, зі сполукою-антагоністом до V1a. Композиції такого типу особливо придатні для використання в лікуванні дисменореї чи ендометріозів, або контролю допологової роботи і для контролю подготовчої роботи перед пологорозтином. Іншим предметом цього винаходу є продукт, який містить антагоніст рецепторів окситоцину за цим винаходом і антагоніст V1а-рецепторів вазопресину для одночасного, окремого чи послідовного використання в лікуванні окситоцин-залежних розладів, зокрема, для лікування дисменореї чи ендометріозів, для контролю допологової праці чи для контролю подготовчої роботи перед пологорозтином. Нижченаведені ОТРИМАННЯ і ПРИКЛАДИ ілюстр ують цей винахід, проте, без обмеження його обсягу. Якщо не указане інше, спектри ядерно-магнітного резонансу фіксували в дейтерованому хлороформі при 200мгц, при цьому хімічні зсуви виражені в частинах на мільйон. Нижче використані такі скорочення: s=синглет; m=мультиплет; d=дублет, t=триплет; q=квінтет. Всі сполуки за цим винаходом були об'єктом органічного елементного аналізу, який здійснювали спалюванням при 1000°С у присутності кисню, використовуючи баланс типу Supermicro S4 Sartorius і аналізатор елементного складу типу ЕА 1108. Отримані результати аналізу вмісту елементів карбону, гідрогену, нітрогену і сірки добре збігаються з очікуваними теоретичними результатами. ОТРИМАННЯ 1 N-(4-Хлорфеніл)-2-оксопропіонамід, сполука XI.1. 26,3г 4-хлорфеніламіну в 150мл дихлорметану і 35мл триетиламіну додавали при -60°С до 22г 2оксопропіоніл хлориду (приготованого згідно з "Synthesis", 1975, 163-164 з 2-оксопропіонової кислоти і етеру 1,1-дихлордиметилу) в 350мл дихлорметану. Реакційну суміш перемішували при -60°С протягом 2 годин, і потім додавали 200мл 0,15Н водного розчину соляної кислоти і 500мл дихлорметану при -30°С. Органічну фазу екстрагували, промивали 0,25Н водним розчином соляної кислоти і висушували над сульфа том натрію. Розчинники випаровували при зниженому тискові і отриманий осад кристалізували дихлорметаном; точка топлення=151°С. ОТРИМАННЯ 2 2-(2-Хлор-4-флуор феніл)-N-(4-хлорфеніл)-2-гідроксіпропіонамід, сполука ІХ.1. 0,18г магнію і 2,57г 2-хлор-4-флуор-1-йодбензолу перемішували при нагріванні в судині зі зворотним холодильником в 30мл діетилового етеру. Суміш, отриману таким способом, додали при -60°С до 0,99г сполуки XI.1 в 9мл тетрагідрофурану. Реакційну суміш перемішували при 20°С протягом 2 годин і потім додали насичений водний розчин NH4CI. Екстрагування здійснювали етилацетатом, органічну фазу висушували над Na2SO4 і розчинники випаровували при зниженому тискові. Отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з дихлорметанолом у співвідношенні 1/1 (за об'ємом), а потім сумішшю ди хлорметану з метанолом у співвідношенні 99/1 (за об'ємом). Сухий залишок, виділений таким способом, кристалізували з етеру діізопропілу. Точка топлення 167°С. Нижченаведені сполуки виготовляли такимож способом: N-(4-Хлорфеніл)-2-(2,5-диметоксифеніл)-2-гідроксіпропіонамід, сполука IX.2; точка топлення 145°С. N-(4-Хлорфеніл)-2-(2-хлор-4-метилфеніл)-2-гідроксіпропіонамід, сполука ІХ.3; точка топлення 116°С. N-(4-Хлорфеніл)-2-(2-хлор-5-метилфеніл)-2-гідроксіпропіонамід, сполука ІХ.4; точка топлення 147°С. N-(4-Хлорфеніл)-2-(2-хлор-5-флуорфеніл)-2-гідроксіпропіонамід, сполука ІХ.5; точка топлення 111°С. ОТРИМАННЯ 3 (2-Хлорфеніл)-N-(4-хлорфеніл)гідроксіацетамід, сполука VII.І. Суміш 60г (2-хлорфеніл) оксіоцетової кислоти і 41г 4-хлорфеніламіну в 300мл 1,2-дихлорбензолу нагрівали до 200°С. Установка містить апарат Дина і Старка (Dean and Stark apparatus), і таким чином утворювана вода вилучається під час реакції. Приблизно 150мл розчинника відганяли і очикувану сполуку піддавали кристалізації при 20°С. Отриманий сухий залишок промивали етером діізопропілу; точка топлення=120°С. Аналогічним способом з 4-метоксифеніламіну готують (2-хлорфеніл)-N-(4-метоксифеніл)гідроксіацетамід, сполуку VII.2; точка топлення=130°С. Аналогічним способом готують (2-хлор-4-флуорфеніл)-N-(4-хлорфеніл)гідроксіацетамід, сполуку VII,3, з (2хлор-4-флуорфеніл)оксіоцетової кислоти (синтезувати згідно з J. Med. Chem., 1987, 30 (8), 1447, з 2-хлор-4флуорбензальдегіду і бромоформу); точка топлення=136°С. ОТРИМАННЯ 4 5-Хлор-3-(2-хлорфеніл)індолін-2-он, сполука V.l. Розчин 263мл 95% сірчаної кислоти і 100мл 20% олеуму приготували при 10°С. Цей розчин перемішували з 74г сполуки VII.1 протягом 2 годин при 40°С. Реакційну суміш пізніше охолоджували, а потім виливали у льодяну воду. Отриманий осад відфільтровували і потім промивали 1000мл води. Сухий залишок розчиняли в дихлорметані й розчин, отриманий таким способом, промивали послідовно насиченим водним розчином гідрогенкарбонату натрию і водою, а потім висушували над Na2SO4. Розчинники випаровували при зниженому тискові й потім отриманий сухий залишок промивали діетиловим етером; точка топлення=201°С. Нижченаведену сполуку У,2 го тують таким самим способом: 5-Хлор-3-(2-хлор-4-флуор феніл)індолін-2-он, сполука V,2. Точка топлення=221°С ОТРИМАННЯ 5 5-Метоксі-3-(2-хлорфеніл)індолін-2-он, сполука V,3. 20,1г 2-(2-хлорфеніл)-N-(4-метоксі-феніл)-2-гідроксіацетаміду, сполука VII,2, додавали до суміші поліфосфорної кислоти, отриманої з 65мл 85% фосфорної кислоти і 130г двоп'ятиоксиду фосфору, при температурі 50°С, і потім реакційну суміш ви тримували при цій температурі протягом 6 годин. Після охолоджування, здійснювали обробку водним розчином гідрогенкарбонату натрію, поки не одержали pH=5. Екстрагування здійснювали етилацетатом. Органічну фазу промивали водою і потім висушували над безводним сульфатом натрію. Розчинник частково випаровували при зниженому тискові і цільовий продукт відфільтровували; точка топлення=179°С. ОТРИМАННЯ 6 5-Хлор-3-(2-хлорфеніл)-3-метиліндолін-2-он, сполука II.1. 18,2г mpem-бутоксиду калію додавали при -40°С до розчину 15г сполуки V.I в 240мл тетрагідрофурану. Реакційну суміш перемішували при 0°С протягом 5 хвилин і потім розчин 3,7мл метилйодиду в 80мл тетрагідрофурану додали при -60°С. Як тільки температура реакційної суміші повернулась до 0°С, додавали 100мл насиченого водного розчину хлориду амонію і здійснювали екстрагування етилацетатом. Органічну фазу промивали водою і потім висушували над безводним сульфатом натрію. Розчинники випаровували при зниженому тискові. Отриманий сухий залишок очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю етилацетату з циклогексаном у співвідношенні 1/9 (за об'ємом). Отриманий сухий залишок кристалізували з н-пентану; точка топлення=185°С. Сполуки 11,2-11,6, наведені нижче, виготовляли аналогічним способом. 5-Метоксі-3-(2-хлорфеніл)-3-метиліндолін-2-он, сполука 11.7, готують такимож способом з 5-метоксі-3-(2хлорфеніл)індолін-2-ону; точка топлення=176°С. ОТРИМАННЯ 7 5-Хлор-3-(2-хлор-4-флуор феніл)-3-метиліндолін-2-он, сполука II,6 Сполуку II. 6, яку описано вище, можна також виготовити нижченаведеним способом: 0,3г сполуки ІХ.1 і розчин, приготовлений заздалегідь, 5,3г двоп'ятиоксиду фосфору у 3мл 85% водного розчину фосфорної кислоти нагрівали до 150°С протягом 5 годин. Реакційну суміш виливали в лід, додали насичений водний розчин карбонату калію і здійснили екстрагування етилацетатом. Органічну фазу, отриману таким способом, висушували над безводним сульфатом натрію. Розчинники випаровували при зниженому тискові. Отриманий сухий залишок кристалізували з н-пентану; точка топлення=189°С. Сполуку 5-хлор-3-(2,5-диметоксифеніл)-3-метиліндолін-2-он, сполука II,8; готують аналогічним способом. Точка топлення=163°С. ОТРИМАННЯ 8 5-Хлор-3-[2-хлор-4-(4-метил-1-піперазинілу)феніл]-3-метиліndоІ-2-он, сполука ІІ,9. Суміш, яка містить 0,5г сполуки II,6, 2,5мл диметилсульфоксиду, 3,6мл N-метилпіперазину, 1г карбонта натрію і 0,1г йодиду міді нагрівали при 120°С на протязі 24 годин. Після повернення до кімнатної температури, солі відфільтровували через тальк і осад промивали диметилсульфоксидом і потім 60мл етилацетату. Фільтрат промивали 40мл води і органічну фазу висушували над безводним сульфатом натрію. Розчинники випаровували при зниженому тискові і осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали дихлорметаном. Цільовий продукт виділяли після вилучення сухого осаду в діізопропілетері з наступною фільтрацією; точка топлення=155°С. ОТРИМАННЯ 9 5-Хлор-3-(2-хлор-4-флуор феніл)-3-гідроксііндолін-2-он, сполука II.10. 0,44г 60% суспензії гідриду натрію в маслі додали при -40°С до охолодженої суспензії 2г of 5-хлоріндолін2,3-диону в 60мл тетрагідрофурану, і реакційну суміш перемішували при 0°С протягом 15 хвилин. 0,45г магнію і 4,23г 2-хлор-4-флуор-1-йодбензолу в 18мл діетилового етеру перемішували при нагріванні в судині зі зворотним холодильником протягом 3 годин. Розчин, отриманий таким способом, повільно додавали при 60°С до реакційної суміші. Реакційну суміш перемішували протягом 30 хвилин при 20°С і а насичений водним хлориду амонію розчин додали. Екстрагування здійснювали етилацетатом, органічну фазу висушували над безводним сульфатом натрію і розчинники випаровували при зниженому тискові. Отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали дихлорметаном і потім сумішшю ди хлорметану з метанолом у співвідношенні 95/5 (за об'ємом). Отриманий сухий залишок кристалізували з н-пентану; точка топлення=239°С. Аналогічним способом, 5-хлор-3-(2,5-диметоксифеніл)-3-гідроксііндолін-2-он, сполука II.11; готують з 1-бром-2,5-диметоксибензолом. Точка топлення=221°С. ОТРИМАННЯ 10 3,5-Дихлор-3-(2,5-диметоксифеніл)індолін-2-он, сполука VI.1. 0,8мл тіонілхлориду додали, при температурі менше за 20°С, до 3г сполуки II.11 у присутності 1,2мл піридину в 50мл дихлорметану і потім реакційну суміш перемішували протягом однієї години. Реакційну суміш промили водою і висушили над безводним сульфатом натрію. Розчинники випаровували при зниженому тискові, а потім осад піддавали хроматографії на колонці силікагелю, причому елюювання здійснювали дихлорметаном. Точка топлення=157°С. Нижченаведені сполуки виготовляли аналогічним способом: 3,5-Дихлор-3-(2-хлорфеніл)індолін-2-он, сполука VI.2. Точка топлення=190°С 3,5-Дихлор-3-(2-хлор-4-флуорфеніл)індолін-2-он, сполука VI,3. Точка топлення=87°С. ОТРИМАННЯ 11 5-Хлор-3-(2,5-диметоксифеніл)-3-метоксиіндолін-2-он, сполука II.11. 0,4г сполуки VI.1 у присутності 25мл метанолу в 50мл тетрагідрофурану витримували при нагріванні в судині зі зворотним холодильником протягом 3 годин. Розчинники випаровували при зниженому тискові. Точка топлення=180°С. Нижченаведені сполуки виготовляли аналогічним способом: 5-Хлор-3-(2-хлорфеніл)-3-метоксиіндолін-2-он, сполука 11.12. Точка топлення=179°С. 5-Хлор-3-(2-хлор-4-флуор феніл)-3-метоксиіндолін-2-он, сполука 11.13. Точка топлення=82°С. ОТРИМАННЯ 12 5-Хлор-1-(2,4-диметоксибензил)індолін-2,3-дион, сполука IV.1. (IV.1.): R 2=Н; R3=4-ОСН3; R 4=2-ОСН3; X=5-СІ; Y=Н a) 0,25мл триброміду фосфор у додали при -50°С до суспензії 1,45г 2,4-диметоксифеніл-метанолу в 25мл діетилового етеру. Розчин, отриманий таким способом, повертають до температури 0°С. b) 2г mpem-бутоксиду калію додавали при -60°С до суспензії 1,3г 5-хлоріндолін-2,3-диону в 50мл тетрагідрофурану. Реакційну суміш перемішували при 0°С протягом 5 хвилин і потім додали приготовлений в а) розчин при -60°С. Реакційну суміш перемішували при кімнатній температурі протягом 16 годин, а потім розчинники випаровували при зниженому тискові. Отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з дихлорметанолом у співвідношенні від 8/2 до 2/8 (за об'ємом). Отриманий сухий залишок викристалізовували з толуолу; точка топлення=175°С. Нижченаведені сполуки виготовляли аналогічним способом: 5-Хлор-1-(4-хлор-2-метоксибензил)індолін-2,3-дион, сполука IV.2. Точка топлення=136°С 5,7-Дихлор-1-(2,4-диметоксибензил)індолін-2,3-дион, сполука IV,3. Точка топлення=171°С 5-Флуор-І-(2,4-диметоксибензил)індолін-2,3-дион, сполука IV.4. Точка топлення=163°С 1-(2,4-Диметоксибензил)індолін-2,3-дион, сполука IV.5. Точка топлення=142°С. ПРИКЛАД 1 5-Хлор-3-(2-хлорфеніл)-1-(2,4-диметоксибензил)-3-метиліндолін-2-он. R3=4-ОСН3; R4=2-ОСН3; X=5-CI; Y=H a) 0,48мл триброміду фосфору додали при -50°С до суспензії 2,6г 2,4-диметоксифенілметанолу в 45мл діетилового етеру. Розчин, отриманий таким способом, повертали до температури 0°С. b) 1,2г mpem-бутоксиду калію додавали при -40°С до 3г сполуки II.1 в розчин 90мл тетрагідрофурану і потім реакційну суміш перемішували доти, покі температура не повернулась до 0°С. Реакційну суміш потім охолодили до -60°С і додали розчин, приготовлений в а). Реакційну суміш перемішували при 20°С протягом 2 годин, додали 50мл води і здійснили екстрагування за допомогою етилацетату. Органічні фази висушили над сульфатом натрію і розчинники випаровували при зниженому тискові. Отриманий сухий залишок кристалізували з етеру діізопропілу; точка топлення=179°С. Цю сполуку, у рацемічній формі, потім відокремлювали за допомогою хроматографії на колонці Chiralpakâ AD виробництва Dalcel, причому елюювання здійснювали сумішшю 2-метилпентану з етанолом у співвідношенні 98/2 (за об'ємом). Таким способом виділяли правоповоротний енантіомер: точка топлення=92°С; [a]235D=+39° (с=1, СН3ОН), і його антипод. ПРИКЛАД 2 5-Метоксі-3-(2-хлорфеніл)-1-(2,4-диметоксибензил)-3-метиліндолін-2-он. Сполуку з прикладу 2 готують згідно з таким же способом з 5-метоксі-3-(2-хлорфеніл)індолін-2-ону, сполука II.7; точка топлення=133°С. ПРИКЛАД 3 5-Хлор-3-(2-хлорфеніл)-1-[4-(1,1-диметилетокси)-2-метоксибензил]-3-метиліндолін-2-он. R3=4-ОС(СН 3)3; R4=2-OCH 3; X=5-Cl; Y=H а) Виготовлення [4-(1,1-диметилетокси)-2-метокси]фенілметанолу * Виготовлення метил 4-(1,1-диметилетокси)-2-метоксибензоату згідно з J. Org. Chem., 1986, 51, 111-113. 0,25мл трифторметансульфонової кислоти додали при -70°С до 6,2г метил 4-гідроксі-2-метоксибензоату (згідно з J. Med. Chem., 1985, 28, 717-727, з технічного метил 2,4-дигідроксібензоату) в 60мл дихлорметану і потім 25мл 2-метилпропілену, сконденсованого заздалегідь при -20°С і дегазованого природним зігріванням, додавали за допомогою гідравлічного затвору. Після помішування протягом 24 годин при температурі від -30 до -70°С, 0,5мл триетиламіну додали до реакційної суміші. Розчинники випаровували при зниженому тискові і осад вилучали в етилацетаті і промивали розведеним розчином бікарбонату натрію. Відокремлену органічну фазу висушували над безводним сульфатом натрію і розчинники випаровували при зниженому тискові. Цільовий продукт виділяли, причому очищення виконували за допомогою хроматографії на колонці силікагелю, а елюювання здійснювали циклогексаном. 1 Н NMR: 7,75 (d, 1H), 6,62-6,53 (m, 2H), 3,85 (s, 3H), 3,84 (s, 3H), 1,40 (s, 9H) * Згідно з J. Chem. Soc. Perkin Trans., 1991, 3291-3294. 15,90мл 2М розчину LіВН4 у тетрагідрофурані додавали до 2,5г попередньої сполуки, отриманої в а), в 25мл толуолу. Реакційну суміш нагрівали при 100°С протягом 45 хвилин. Приблизно за 20°С реакційну суміш виливали в водо-льодяну суміш і водяну фазу екстрагували етилацетатом. Після розділення в результаті відстоювання, водяну фазу екстрагували етилацетатом. Органічні фази з'єднували і висушували над безводним сульфатом натрію, а розчинники потім випаровували при зниженому тискові. 1 Н NMR: 7.10 (d, 1H), 6,59-6,50 (m, 2H), 4,61 (d, 2H), 3,81 (s, 3H), 2,20 (t, 1H), 1,34 (s, 9H). b) Сполуку з прикладу 3 готують таким самим способом як в наприкладі 1. Точка топлення=131°С. ПРИКЛАД 4 5-Хлор-3-(2-хлорфеніл)-1-[4-(1-метилетокси)-2-метоксибензил]-3-метил індол ін-2-он. R3=4-ОСН(СН3)2; R4=2-ОСН3; X=5-СІ; Y=Н а) Виготовлення 4-(1-метилетокси)-2-метоксі]феніл метанолу. * Виготовлення метил 4-1-метилетокси)-2-метоксибензоату згідно з журналом "Синтез", 1988,712. 2,86г карбонату цезія і потім 1,28мл 2-йодпропану додавали при 0°С до 0,8г метил 4-гідроксі-2метоксибензоату в 20мл диметилформаміду. Реакційну суміш перемішували при 20°С протягом 2 годин, потім додавали 50мл води і здійснювали екстрагування етилацетатом. Органічну фазу промивали водою і потім висушували над безводним сульфатом натрію. Розчинники випаровували при зниженому тискові. 1 Н NMR: 7,81 (d, 1Н), 6.47-6.42 (т, 2Н), 4,69-4,51 (т, 1Н), 3,85 (s, 3Н), 3,83 (s, 3Н), 1,33 (d, 6H). * [4-(1-Метилетокси)-2-метокси]фенілметанолу готували згідно зі способом, який описано вище в прикладі 3 для перетворення метил 4-(1,1-диметилетокси)-2-метоксибензоату в [4-(1,1-диметилетокси)-2метокси]фенілметанолі. b) Сполуку з прикладу 4 готують згідно зі способом, який описано для прикладу 1; Точка топлення=158°С. Приклади 5-17, які наводяться нижче, виготовляли згідно зі способом, який описано для прикладу 1. ПРИКЛАД 5 5-Хлор-3-(2-хлорфеніл)-1-(2-метоксі-4-нітробензил)-3-метиліндолін-2-он. R3=4-NO2; R4=2-ОСН3 ;X=5-CI; Y=H Точка топлення=179°С. ПРИКЛАД 6 5-Хлор-1-(2,4-диметоксибензил)-3-(2,5-диметоксифеніл)-3-метиліндолін-2-он. R3=4-ОСН3; R4=2-ОСН3; X=5-СІ; Y=Н Точка топлення=140°С (0,3 Н2О) ПРИКЛАД 18 5-Хлор-3-(2-хлор-4-флуор феніл)-1-(2,4-диметоксибензил)-3-гідроксііндолін-2-он. R3=4-ОСН3; R4=2-ОСН3; X=5-СІ; Y=Н Цю сполуку можна виготовити зі сполуки 11.10 згідно за таким самим способом, як в прикладі 1, або ще згідно зі способом, що наводимо нижче: 0,87мл 2-хлор-4-флуор-1-йодбензолу і 0,09г магнію в 15мл діетилового етеру перемішували при нагріванні в судині зі зворотним холодильником протягом 1 години. Додали 0,75г сполуки IV. 1 в частковому розчині 15мл тетрагідрофурану, при -40°С. Реакційну суміш перемішували протягом 2 годин при 20°С і потім додали насичений водний розчин хлориду амонію. Екстрагування здійснювали етилацетатом, органічну фазу висушували над безводним сульфатом натрію і потім розчинники випаровували при зниженому тискові. Отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з дихлорметанолом в співвідношенні 1/1 (за об'ємом). Отриманий сухий залишок кристалізували з циклогексану; точка топлення=177°С. Цю сполуку у рацемічній формі відокремлювали за допомогою хроматографії на колонці Chiralpakâ AD виробництва Daicel, причому елюювання здійснювали сумішю 2-метилпентану з етанолом у співвідношенні 9/1 (за об'ємом). Правоповоротний енантіомер: 20,5 [a]D= + 63 ° (с=1, СН3ОН), і таким чином виділяли його антипод. ПРИКЛАД 19 5-Хлор-3-(2-хлор-5-метоксиметоксиметилфеніл)-1-(2,4-диметоксибензил)-3-гідроксііндолін-2-он. СІ R3=4-ОСН3; R4=2-ОСН3; X=5-СІ; Y=Н а) Виготовлення 2-хлор-1-йод-5-гідроксіметилбензолу згідно з J. Org. Chem., 1991, 56, 5964-5965, з відповідної технічної бензойної кислоти. 5,02г натрію боргідриду додавали порціями і потім 14,6г йоду в розчині 50мл тетрагідрофурану, додавали дуже повільно до 25г 4-хлор-3-йодбензойної кислоти в розчинці 200мл тетрагідрофурану при 0°С. Реакційну суміш перемішували протягом 2 годин при кімнатній температурі і потім при 35°С - протягом 30 хвилин. Гідроліз здійснювали при 10°С з 0,5 Н розчином соляної кислоти, а екстрагування здійснювали етилацетатом. Органічну фазу відокремлювали в результаті відстоювання і потім обробляли водним розчином бісульфіту натрію, а потім - водою. Органічну фазу висушували над безводним сульфатом натрію і розчинники випаровували при зниженому тискові. Цільову сполуку одержували за допомогою дистиляції; Точка кипіння=109°С при 3Па. b) Виготовлення 2-хлор-1-йод-5-метоксиметоксиметилбензолу згідно з "Синтез", 1985, 74. 1,5мл моногідратуПара-толуолсульфонової кислоти і 1,4г броміду літія додавали до 24.45г попередньої сполуки в 100 диметоксиметану. Реакційну суміш перемішували при 35°С протягом 4 годин і потім протягом 2 годин при нагріванні в судині зі зворотним холодильником. Гідроліз здійснювали при кімнатній температурі розбавленим водним розчином бікарбонату натрію і здійснювали екстрагування з діетиловим етером. Органічну фазу промивали водою і висушували над безводним сульфатом натрію, а розчинники випаровували при зниженому тискові. Цільовий продукт одержували за допомогою дистиляції; Точка кипіння=108°С при 1,9Па. c) Сполуку з прикладу 19 готують згідно зі способом, котрий описано для прикладу 18; Точка топлення=142°С. ПРИКЛАД 20 Метил 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-гідроксі-2-оксоіндолін-3-іл]бензоат 45,2мл 1,6М розчину н-бутиллітію в гексані, розбавленого в 200мл тетрагідрофурану і о холодженого до 90°С, повільно додавали до 10,72г метил 4-хлор-3-йодбензоату (приготовленого етерифікацією відповідної технічної кислоти; точка топлення=56°С) в 200мл тетрагідрофурану, охолодженого до -100°С, Реакційну суміш перемішували при -95°С протягом 20 хвилин і потім додали розчин, охолодджений до -70°С, з 10г сполуки IV.1 в 600мл тетрагідрофурану. Після повернення до кімнатної температури, гідроліз здійснювали з розчином 200мл насиченого хлориду амонію, розчинники частково випаровували при зниженому тискові, екстрагування здійснювали етилацетатом, органічну фазу висушували над безводним сульфатом натрію і потім розчинники випаровували при зниженому тискові. Отриманий осад промивали діетиловим етером, відфільтровували і потім висушували при 50°С і зниженому тискові; точка топлення=236°С. ПРИКЛАД 21 3-(5-Аміно-2-хлорфеніл)-5-хлор-1-(2,4-диметоксибензил)-3-гідроксііндолін-2-он R3=4-ОСН3; R4=2-ОСН3; X=5-СІ; Y=Н a) Виготовлення 4-хлор-3-бром-N,N-(тетраметил-етилендисиліл)аніліну Суміш, яка утворена з 3,3г 3-бром-4-хлораніліну, 3,72г біс(диметиламінодиметил-силіл)етилену, отриманого згідно з "Teтpahedron Letters", 1984, 25 (12), 1253-1254, і 0,03г йодиду цинку, нагрівали при 140°С протягом 5 годин. Цільовий продукт дистілювали; точка кипіння=105°С при 37Па. b) Сполуку з прикладу 21 готували тим самим способом, що описано для прикладу 20, причому очищення виконували за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали з розчином дихлорметану й метанолу у співвідношенні 99/1 (за об'ємом); точка топлення=133°С. Сполуки у наведених нижче прикладах 22-31 виготовляли аналогічним способом, як в прикладі 18: ПРИКЛАД 32 5-Хлор-1-(2,4-диметоксибензил)-3-[5-(1,3-діоксолан-2-іл)-2-метоксифеніл]-3-гідроксііндолін-2-он a) Виготовлення 2-(3-бром-4-метоксифеніл)-1,3-діоксолану згідно з J. Med. Chem., 1990, 33(3), 972. Суміш, утворена з 5г 3-бром-пара-анісальдегіду, 5мл етиленгліколю, 0,088гПара-толуолсульфонової кислоти і 125мл толуолу нагрівали в судині зі зворотним холодильником протягом 1 години 30 хвилин в реакторі, який оснащений апаратом Dean і Stark. Реакційну суміш вилівали при кімнатній температурі в 50мл води, екстрагування здійснювали діетиловим етером і органічну фазу висушували над безводним сульфатом натрію. Розчинники випаровували при зниженому тискові. Отриману масло очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали з сумішшю циклогексану з етилацетатом у співвідношенні 8/2 (за об'ємом). Цільовий продукт одержували після дистиляції при зниженому тискові; Точка кипіння=128°С при 5Па. b) Сполуку з прикладу 32 готували з попередньої сполуки згідно зі способом, який описано для прикладу 18; точка топлення=140°С. ПРИКЛАД 33 5-Хлор-1-(2,4-диметоксибензил)-3-{5-[(диметиламіно)-метил]-2-метоксифеніл}-3-гідроксііндолін-2-он a) 3-[5-Хлор-1-(2,4-диметоксибензил)-3-гідроксі-2-оксоіндолін-3-іл]-4-метоксибензальдегід, отриманий зняттям захисту зі сполуки з прикладу 32 в кислотному середовищі згідно з J. Chem. Soc. Chem. Commun., 1987, 74 1351. Суміш, утворену з 0,55г сполуки з прикладу 32, 5мл ацетону, 2,5мл води і 0,22мл 1Н соляної кислоти, нагрівали до 30°С протягом 2 годин при помішуванні. Реакційну суміш нейтралізували при кімнатній температурі водним розчином бікарбонату натрію, а екстрагування здійснювали етилацетатом. Органічну фазу висушували над безводним сульфатом натрію, розчинники випаровували при зниженому тискові і цільову сполук у одержували фільтрацією осаду, отриманого в результаті випаровування, який вбирали в діетилетер; точка топлення=189°С. b) Відновлююче амінування згідно з J. Org. Chem., 1996, 51(11), 3849-3862. 0,015г диметиламіну в 1мл розчину 1,2-дихлоретану, і потім 0,072г натріютріацетоксиборгідриду додавали до суспензії 0,113г попередньої сполуки в 3мл 1,2-дихлоретану, отриманої в а). Після перемішування протягом 15 годин при кімнатній температурі, здійснювали гідроліз з 10мл води, а екстрагування здійснювали етилацетатом. Органічну фазу висушували над сульфатом натрію, розчинники випаровували при зниженому тискові і отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю ди хлорметану з метанолом у співвідношенні 95/5 (за об'ємом). Цільовий продукт одержували після кристалізації з ізопропілового етеру; точка топлення=162°С (0,4 Н2О) ПРИКЛАД 34 5-Хлор-3-(3-хлорпіридин-4-іл)-1-(2,4-диметоксі-бензил)-3-гідроксііндолін-2-он. Розчин 0,414мл 3-хлорпіридину в 5мл тетрагідрофурану додали по краплям до розчину 2,88мл 1,5М діїзопропіламіду літію в циклогексані, розбавленого в 7мл тетрагідрофурану і охолодженого до -75°С,. Після цього реакційну суміш перемішували при -75°С протягом 20 хвилин і потім додавали 1,2г сполуки IV.1 в 15мл тетрагідрофурану. Температуру реакційної суміші повільно нарощували до 0°С і потім здійснювали гідроліз з 30мл водного розчину хлориду амонію. Екстрагування здійснювали етилацетатом і органічну фазу висушували над суль фатом натрію. Розчинники випаровували при зниженому тискові і отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з етилацетатом у співвідношенні 75/25 (за об'ємом). Отриманий сухий залишок згодом викристалізовували з етилацетату; точка топлення=215°С. Сполуки нижченаведених прикладів 35 і 36 виготовляли аналогічним способом: ОТРИМАННЯ 13 5-Хлор-3-(2-хлорфеніл)-1-(2,4-диметоксибензил)індолін-2-он, сполука III.1. a) 3,5-Дихлор-3-(2-хлорфеніл)-1-(2,4-диметоксибензил)індолін-2-он, сполука I’.1. 0,98мл тіонілхлориду додали при -20°С до розчину 2г сполуки з прикладу 30 і 1,4мл піридину в 24мл дихлорметану. Реакційну суміш перемішували протягом 1 години 30 хвилин при кімнатній температурі і охолодили до 0°С, а потім додали 50мл води і 50мл дихлорметану. Розділення здійснювали в результаті відстоювання, органічну фазу промивали водним розчином NaHCO3 і висушували над безводним сульфатом натрію, а розчинник випаровували при зниженому тискові. Отриманий осад висушували при зниженому тискові протягом 2 годин і сполуку I’.1 виділяли у вигляді смоли, яку використовують безпосередньо на наступному етапі. b) Сполука III.1 6,53мл а 1,5М розчину діізопропіламіду літію в циклогексані, додатково розбавленого з 15мл тетрагідрофурану, додавали при -68°С до розчину сполуки I'.1, отриманої вище, в 24мл тетрагідрофурану. Реакційну суміш перемішували протягом 45 хвилин при -68°С і потім повільно додавали 5мл метанолу. Приблизно за 0°С, додали воду і здійснили екстрагування етилацетатом. Органічну фазу промивали водним розчином хлориду натрію і висушували над сульфатом натрію, а розчинник випаровували при зниженому тискові. Отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з етилацетатом у співвідношенні 85/15 (за об'ємом). Цільовий продукт виділяли після кристалізації з ізопропілового етеру; точка топлення=151°С. (0,2 Н2О). Нижченаведені сполуки III,2-III,8 виго товляли аналогічним способом: ПРИКЛАД 37 5-Хлор-3-(2-хлор-4-флуор феніл)-1-(2,4-диметоксибензил)-3-метиліндолін-2-он. 0,34г mpem-бутоксиду калію додали при -40°С до розчину 1,14г сполуки III.4 в 20мл тетрагідрофурану. Реакційну суміш перемішували при 0°С протягом 5 хвилин і потім додали 0,32мл метилйодиду при -40°С. Реакційну суміш перемішували протягом 2 годин при кімнатній температурі, потім додали 10мл насиченого водного розчину хлориду амонію і здійснили екстрагування етилацетатом. Органічну фазу висушили над безводним сульфатом натрію і потім розчинники випаровували при зниженому тискові. Отриманий осад кристалізували з діізопропілового етеру; точка топлення=166°С. Сполуки з нижченаведених прикладів 38-44 виготовляли аналогічним способом, як варіант очищуючи їх за допомогою хроматографії на кремнії: Рацемічну сполуку з прикладу 41 хроматогамували на хіральній колонці за умов прикладу 1, причому елюювання здійснювали сумішшю 2-метилпентану з 2-пропанолом у співвідношенні 90/10. Одержано правоповоротний енантіомер: точка топлення=120°С, [a]20D=+112°(с=1, етилацетат), і його антипод. ПРИКЛАД 45 Етиловий естер 5-хлор-3-(2-хлорфеніл)-1-(2,4-диметоксибензил)-2-оксоіндолін-3-ілкарбонової кислоти. R3=4-ОСН3; R4=2-ОСН3; X=5-CL; Y=Н 0,082г mpem-бутоксиду калію додали до 0,26г сполуки III.I в 7мл тетрагідрофурану, охолодженого до 40°С. Реакційну суміш перемішували протягом 15 хвилин при 0°С і потім повільно додали 0,086мл етил хлорформіату при -65°С. Після перемішування протягом 30 хвилин при 20°С, реакцію гідролізування проводили з 20мл, а 5% розчину хлориду амонію і здійснили екстрагування етилацетатом. Органічну фазу висушували над сульфатом натрію і потім розчинники випаровували при зниженому тискові. Цільовий продукт виділяли після кристалізації з ізопропанолу; точка топлення=112°С (0,3Н2О). ПРИКЛАД 46 Феніловий естер 5-хлор-3-(2-хлорфеніл)-1-(2,4-диметоксибензил)-2-оксоіндолін-3-ілкарбонової кислоти. R3=4-ОСН3; R4=2-ОСН3; X=5-СІ; Y=Н Сполуку з прикладу 46 одержували з фенілхлорфрміату таким самим способом, як в прикладі 45; точка топлення=126°С. ПРИКЛАД 47 5-Хлор-3-(2-хлорфеніл)-1-(2,4-диметоксибензил)-3-гідроксіметиліндолін-2-он. R3=4-OCH 3; R4=2-ОСН3; X=5-СІ ;Y=H 0,13г mpem-бутоксиду калію додали при -40°С до 0,3г сполуки III.I в 5мл тетрагідрофурану. 0,3г Параформальдегіду, який повільно деполімеризували нагріванням, барботували в реакційній суміші при 0°С. Реакційну суміш перемішували протягом 1 години при кімнатній температурі і потім гідролізували з 5% водним розчином NH4CI. Екстрагування здійснювали етилацетатом, а органічну фазу висушували над сульфатом натрію. Розчинники випаровували при зниженому тискові і отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з етилацетатом у співвідношенні 90/10 (за об'ємом). Цільовий продукт виділяли після кристалізації із суміші нпентану етилацетатом; точка топлення=165°С. ПРИКЛАД 48 1-(4-Аміно-2-метоксибензил)-5-хлор-3-(2-хлорфеніл)-3-метиліндолін-2-он. R4=2-ОСН3; X=5-СІ; Y=Н 2,83г порошку олова і потім 5,6мл концентрованої соляної кислоти додавали до 5,19г сполуки з прикладу 5 в 64мл етанолу. Реакційну суміш нагрівали при 50°С протягом 3 годин. Реакційну суміш фільтрували при кімнатній температурі крізь целіт, розчинник частково випаровували при зниженому тискові, осад вибирали в етилацетат і потім розчин обробляли водним розчином бікарбонату натрію. Органічну фазу висушували над безводним сульфатом натрію і потім розчинники випаровували при зниженому тискові. Отриманий осад поглинати в діізопропіловому етері, відфільтровували і висушували при зниженому тискові; точка топлення=232°С. ПРИКЛАД 49 5-Хлор-3-(2-хлорфеніл)-1-(2-метоксі-4-піролідин-1-ілбензил)-3-метиліндолін-2-он. 0,4г порошку бікарбонату натрію і 0,14мл 1,4-дибромбутану додали до 0,5г сполуки з прикладу 48 в 50мл гексаметил-фосфораміду. Реакційну суміш нагрівали при 115°С протягом 10 годин. Реакційну суміш гідролізували при кімнатній температурі і екстрагували етилацетатом. Органічну фазу промивали декілька разів водою і висушували над безводним сульфатом натрію, і потім розчинники випаровували при зниженому тискові. Отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали з сумішшю циклогексану з етилацетатом у співвідношенні 95/5 (за об'ємом). Отриману масло обробляли соляною кислотою в діетиловому етері; точка топлення=198°С (НСl*0,4Н2О). Сполуки з нижченаведених прикладів 50-52 виготовляли аналогічним способом: ПРИКЛАД 53 5-Хлор-3-(2-хлорфеніл)-1-[4-диметиламіно-2-метоксибензил]-3-метилиніндолін-2-он. R4=2-OCH 3; X=5-CI; Y=H 150мл метилйодиду додавали до 238мг сполуки з прикладу 48, в 4мл метанолу і 1мл диметилформаміду, і 100мг карбонату калію, а потім реакційну суміш нагрівали при 45°С протягом 24 годин. 10мл води додавали при кімнатній температурі і здійснювали екстрагування етилацетатом. Органічну фазу двічі промивали водою і висушували над безводним сульфатом натрію, розчинники випаровували при зниженому тискові і осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з етилацетатом у співвідношенні 90/10 (за об'ємом). Отриманий осад кристалізували з нпентану, відфільтровували і висушували при зниженому тискові протягом 4 годин; точка топлення=135°С. ПРИКЛАД 54 5-Хлор-3-(2-хлорфеніл)-1-(2-метоксі-4-метиламінобензил)-3-метиліндолін-2-он. R4=2-ОСН3; X=5-CI; Y=Н Сполуку з прикладу 54 отримують згідно зі способом, який описано для прикладу 53; точка топлення=226°С (Н2О). ПРИКЛАД 55 5-Хлор-3-(2-хлорфеніл)-1-(4-діізобутиламіно-2-метоксибензил)-3-метиліндол ін-2-он Отримано відновлюючим диамінуванням згідно з J. Org. Chem., 1996, 61(11), 3849-3862. 347мг натрію триацетоксиборгідриду додавали при 20°С до 0,25г сполуки з прикладу 48 в 6мл 1,2дихлоретану, 167мкл оцтової кислоти і 106мкл ізомасляного альдегіду. Після перемішування протягом 1 години при кімнатній температурі, реакційну суміш гідролізували з 20мл води, а екстрагування здійснювали етилацетатом. Органічну фазу висушували над безводним сульфатом натрію і потім розчинники випаровували при зниженому тискові. Осад піддавали хроматографії на колонці з силікагелем, причому елюювання здійснювали сумішшю циклогексану з етилацетатом у співвідношенні 97/3 (за об'ємом). Отриману масло поглинати в розчині соляної кислоти в діетиловому етері, здійснювали фільтрацію, а розчинники випаровували при зниженому тискові. Отриманий сухий залишок висушували при 45°С і зниженому тискові протягом 5 годин. Точка топлення=153°С (НСІ*0,5Н2О). ПРИКЛАД 56 5-Хлор-3-(2-хлорфеніл)-1-(4-ізопропіламіно-2-метоксибензил)-3-метиліндолін-2-он R4=2-ОСН3; X=5-СІ; Y=Н. Отримано відновлюючим амінуванням згідно з J. Org. Chem., 1996, 51(11), 3849-3862. 0,26мл оцтової кислоти, 0,14мл ацетону і потім 0,56г натрію триацетоксиборгідриду додавали до 0,40г сполуки з прикладу 48 в 10мл 1,2-дихлоретану при кімнатній температурі. Після перемішування протягом 2 годин при кімнатній температурі, реакційну суміш гідролізували з водним розчином гідрогенкарбонату натрия і екстрагували етилацетатом. Органічну фазу промивали водою і висушували над безводним сульфатом натрію і розчинники випаровували при зниженому тискові. Цільовий продукт одержували фільтрацією викристалізованого після випаровування осаду, всмоктаного в н-пентані; точка топлення=154°С. Цю сполуку, у рацемічній формі потім відокремлювали за допомогою хроматографії на хіральній колонці за тих самих умов, як в прикладі 1; таким способом виділяли правоповоротний енантіомер: точка топлення=137°С; [a]20D=+ 34,6°(с=1, СН3ОН), і його антипод. ПРИКЛАД 57 5-Хлор-3-(2-хлорфеніл)-1-[4-(ізопропілметиламіно)-2-метоксибензил]-3-метил індолін-2-он. R4=2-ОСН3; X=5-СІ; Y=Н Сполуку з прикладу 56 обробляли водним формальдегідом і боргідридом натрію. З отриманої сполуки одержували сіль з розчином соляної кислоти в діетиловому етері. Гідрохлорид потім відокремлювали після фільтрації і висушували при 45°С і зниженому тискові; точка топлення=156°С (НСl*1,5Н2О). ПРИКЛАД 58 {4-[5-Хлор-3-(2-хлорфеніл)-3-метил-2-оксоіндолін-1-ілметил]-3-метоксифеніл}ізопропілдиметиламонію йодид. 0,56г карбонату цезія і потім 0,27мл метилйодиду додавали до 0,4г сполуки з прикладу 56 в 10мл диметилформаміду. Реакційну суміш нагрівали з помішуванням при 40°С протягом 48 годин. Реакційну суміш обробляли при кімнатній температурі з 40мл води і екстрагували двічі діетиловим етером, а потім 3 рази дихлорметаном. Органічні фази хлорованого розчинника висушували над безводним сульфатом натрію і випаровували при зниженому тискові. Осад, отриманий таким способом, поглинати в діетиловому етері, відфільтровували і висушували при 50°С і зниженому тискові; точка топлення=146°С (1Н2О). ПРИКЛАД 59 5-Хлор-3-(2-хлорфеніл)-1-[4-(циклопропіламіно)-2-метоксибензил]-3-метиліндолін-2-он. Отримано зі сполуки з прикладу 48 згідно з T.L., 1995, 36(41), 7399-7402. 0,54мл оцтової кислоти, 0,4г 3Å молекулярного сита і 0,207мл (1-етоксициклопропіл)окситриметилсилану додавали до 0,4г сполуки з прикладу 48 в розчин в 10мл метанолу. Після перемішування протягом 30 хвилин при кімнатній температурі, додали 0,265г ціаноборгідриду натрію і потім суміш нагрівали в судині зі зворотним холодильником протягом 10 годин. Після охолоджування, здійснювали гідроліз з 20мл 2N гідроокису натрію розчин, здійснювали фільтрацію, крізь целіт і целіт промивали етилацетатом. Органічну фазу промивали 10% водним хлориду натрію розчин і висушували над сульфатом натрію і розчинники випаровували при зниженому тискові. Осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з дихлорметанолом у співвідношенні 50/50 (за об'ємом) і потім чистим дихлорметаном. Цільовий продукт виділяли після кристалізації з н-пентану; тока плавлення=185°C. ПРИКЛАД 60 5-Хлор-3-(2-хлорфеніл)-1-[4-діетиламіно-2-метоксибензил]-3-метиліндолін-2-он. R4=2-OCH 3; X=5-CI; Y=H Згідно з Gordon W. Gribble etal., J. Am. Chem. Soc. 1974, 96(25), 7812. 0,45г боргідриду натрію додали до 0,5г сполуки з прикладу 48 в 7мл оцтової кислоти. Реакційну суміш нагрівали до 60°С з перемішуванням протягом 4 годин, розчинники частково випаровували, реакційну суміш гідролізували з водним розчином бікарбонату натрію і здійснювали екстрагування етилацетатом. Органічну фазу висушували над безводним сульфатом натрію і концентрували при зниженому тискові. Отриману масло обробляли розчином соляної кислоти в діетиловому етері; точка топлення=198°С (НСІ) ПРИКЛАД 61 5-Хлор-3-(2-хлорфеніл)-1-[4-етиламіно-2-метоксибензил]-3-метиліндолін-2-он. R4=2-ОСН3; X=5-СІ; Y=Н Сполуку з прикладу 61 готують за таким самим способом, як в прикладі 60; точка топлення=167°С. ПРИКЛАД 62 N-{4-[5-Хлор-3-(2-хлорфеніл)-3-метил-2-оксоіндолін-1-іл]-3-метоксифеніл}ацетамід. 0,10мл ацетилхлориду повільно додавали при 0°С до 0,5г сполуки з прикладу 48 в 10мл дихлорметану і 0,5мл тріетиламіну. Реакційну суміш гідролізували при кімнатній температурі, додавали 20мл дихлорметану, органічну фазу висушували над Na2SO4 і розчинники випаровували при зниженому тискові. Отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з етилацетатом у співвідношенні 50/50 (за об'ємом); точка топлення=83°С. ПРИКЛАД 63 5-Хлор-3-(2-хлорфеніл)-1-(4-етоксі-2-метоксі-бензил)-3-метиліндолін-2-он. R3=4-ОСН2СН3; R4=2-ОСН3; X=5-СІ; Y=Н. a) 5-Хлор-3-(2-хлорфеніл)-1-(4-гідроксі-2-метоксі-бензил)-3-метиліндолін-2-он. 3мл трифлуорцтової кислоти додавали при 0°С до 1,14г сполуки з прикладу 3 в 20мл дихлорметану і 1мл метилфенілсульфіду. Після перемішування протягом 2 годин при кімнатній температурі, реакційну суміш гідролізували і здійснювали екстрагування етилацетатом. Органічну фазу промивали водним розчином бікарбонату натрію і висушували над безводним сульфатом натрію, а потім розчинники випаровували при зниженому тискові. Отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з етилацетатом у співвідношенні 80/20 (за об'ємом); точка топлення=200°С. b) 0,23г карбонату цезію і потім 0,112мл йодетану додавали при 0°С до 0,2г сполуки, отриманої в а), в 5мл диметил-формаміді. Після перемішування протягом 1 години при 28°С реакційну суміш гідролізували і здійснювали екстрагування етилацетатом. Органічну фазу висушували над безводним сульфатом натрію і розчинники випаровували при зниженому тискові. Отриману масло поглинати в н-пентаніі і отриманий осад відфільтровували і висушували при 50°С і зниженому тискові протягом 5 годин; точка топлення=124°С. ПРИКЛАД 64 5-Хлор-3-(2-хлорфеніл)-1-(2,4-диметоксибензил)-3-метоксиметиліндолін-2-он. R4=2-ОСН3; X=5-СІ; Y=Н. 0,1мл метилтрифторметансульфонату і потім 0,07мл 2,6-ди(трет-бутил)піридину додавали при -20°С до розчину 70мг сполуки, отриманої згідно з прикладом 47, в 1мл дихлорметану, і реакційну суміш витримували при + 5°С протягом одного тижня. Розчинник випаровували при зниженому тискові, додавали 5мл 0.1N соляної кислоти і здійснювали екстрагування етилацетатом. Органічну фазу висушували над безводним сульфатом натрію і розчинник випаровували при зниженому тискові. Отриманий осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з етилацетатом у співвідношенні 95/5 (за об'ємом). Отриману смолу поглинати в н-пентаніі. Отриманий сухий залишок відфільтровували і висушували протягом 5 годин при 50°С; точка топлення=125°С (0,4 Н2О). ПРИКЛАД 65 5-Хлор-3-(2-хлор-5-гідроксіметилфеніл)-1-(2,4-диметоксибензил)-3-гідроксііндолін-2-он. R4=2-ОСН3; X=5-СІ; Y=Н Суміш 0,307г сполуки з прикладу 19, 15мл метанолу і 1мл 10N-соляної кислоти нагрівали при 50°С протягом 2 годин. Розчинник випаровували при зниженому тискові і отриманий осад поглинати в дихлорметані і воді. Органічну фаз у двічі промивали водою і потім висушували над безводним сульфатом натрію. Розчинники випаровували при зниженому тискові. Цільовий продукт виділяли після твердіння в циклогексану, фільтрування і висушування при 30°С і зниженому тискові протягом 6 годин; точка топлення=107°С. ПРИКЛАД 66 5-Хлор-3-[2-хлор-5-(диметиламіно)феніл]-1-(2,4-диметоксибензил)-3-метиліндолін-2-он. X=5-СІ; Y=Н Отримано зі сполуки з прикладу 43 згідно зі способом, якого описано для прикладу 53. Цільовий продукт виділяли після кристалізації з ізопропілового етеру; точка топлення=149°С (0,7 Н2О). ПРИКЛАД 67 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]фенілформамід. Згідно з T.L., 1982, 23(33), 3315. X=5-СІ; Y=Н 0,216мл мурашкової кислоти додали до 0,44мл оцтового ангідриду, охолодили до 0°С і потім реакційну суміш нагрівали при 58°С протягом 1 години 30 хвилин. Після охолодження до 10°С, в розчин 4мл тетрагідрофурану додали 0,8мл тетрагідрофурану, слідом додали 0,80г сполуки з прикладу 43. Після перемішування протягом 2 годин при 20°С, розчинники випаровували при зниженому тискові. Отриманий осад поглинати в н-пентані й продукт відфільтровували; точка топлення=190°С. ПРИКЛАД 68 5-Хлор-3-[2-хлор-5-(метиламіно)феніл]-1-(2,4-диметоксибензил)-3-метиліндолін-2-он. X=5-Cl; Y=H; Отримано згідно з T.L. 1982, 23(33), 3315 0,56мл 2М розчину боран-диметилсульфіду у те трагідрофурані додали до розчину, охолодженого до 0°С, 0,4г сполуки з прикладу 67 в 1мл тетрагідрофурану. Після витримування протягом 1 години при 58°С і потім охолоджування до 0°С, 0,2мл 10N-соляної кислоти і 1мл метанолу додавали до реакційної суміші. Суміш нагрівали при 60°С протягом 1 години і охолоджували, і розчинники випаровували при зниженому тискові. Твердий осад обробляли 1мл розчину насиченого карбонату калію і декілька разів здійснювали екстрагування етилацетатом. Органічні фази висушували над безводним сульфатом натрію і розчинники випаровували при зниженому тискові. Очищення здійснювали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали сумішшю циклогексану з етилацетатом у співвідношенні 85/15 (за об'ємом). Цільовий продукт виділяли у вигляді гідрохлориду, обробляючи отриманий осад діетиловим етером, який містить хлористий гідроген, і потім здійснювали фільтрацію; точка топлення=121°С (0,5Н2О*1НСІ). ПРИКЛАД 69 5-Хлор-3-{2-хлор-5-[етил(метил)аміно]феніл}-1-(2,4-диметоксибензил)-3-метиліндолін-2-он. X=5-Cl; Y=H Отримані зі сполуки прикладу 68 таким самим способом, як в прикладі 60; точка топлення=145°С. ПРИКЛАД 70 N-{4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}ацетамід. X=5-CI; Y=H Отриманий за таким самим способом, як сполука з прикладу 62, зі сполуки з прикладу 43; точка топлення=117°С. Сполуки в наступних прикладах 71-80 одержують аналогічним способом: ПРИКЛАД 81 N-{4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоіндолін-3-іл]феніл}-3-метоксі-пропанамід. X=5-CI;Y=H 0,068мл 3-метоксипропіонової кислоти і 320мг гексафлуор фосфату бензотриазоліл-Nокситриздиметиламіно-фосфонію додавали до 0,3г сполуки з прикладу 43 в 10мл диметилформаміду. Після охолоджування до 0°С, додали 0,23мл тріетиламіну. Реакційну суміш перемішували при кімнатній температурі протягом 16 годин, додали 40мл води і здійснили екстрагування з 30мл етилацетату. Ор ганічну фазу обробляли 20мл водного розчину бікарбонату натрію, цю фазу відокремлювали в результаті відстоювання та висушували над безводним сульфатом натрію, і розчинники випаровували при зниженому тискові. Осад очищали за допомогою хроматографії на колонці силікагелю, причому елюювання здійснювали дихлорметаном. Цільовий продукт одержували після кристалізації з н-пентану; точка топлення=168°С (0,3 Н2О). Сполуки наступних прикладів 82-86 одержали аналогічним способом:
ДивитисяДодаткова інформація
Назва патенту англійськоюIndilyn-2-one derivatives, method for obtaining thereof and use as ligands of oxytocin receptor
Автори англійськоюValette Gerard
Назва патенту російськоюПроизводные индолин-2-она, способ их изготовления и использование как лигандов рецептора окситоцина
Автори російськоюВалетт Жерар
МПК / Мітки
МПК: C07D 209/34, A61K 31/4439, A61P 25/22, C07D 209/38, A61P 25/28, C07D 405/10, A61P 15/08, A61P 15/06, C07D 401/04, A61P 9/12, C07D 405/12, A61P 15/00, A61P 13/08, C07D 401/12, A61P 9/04, A61P 25/18, A61P 13/02, A61P 25/30, A61P 3/06, A61K 31/55, A61P 15/14, A61P 25/24, A61P 3/12, A61P 17/02, A61P 35/00, A61K 31/496, A61P 43/00, A61P 9/10, A61P 15/10, A61P 15/18, A61K 31/5377, A61P 25/02, C07D 401/10, A61P 15/02, A61P 5/10, A61P 3/04, A61K 45/00, C07D 403/12, A61K 31/404, A61K 31/454, C07D 403/10
Мітки: індолін-2-ону, лігандів, рецептора, окситоцину, спосіб, використання, виготовлення, похідні
Код посилання
<a href="https://ua.patents.su/49-73163-pokhidni-indolin-2-onu-sposib-kh-vigotovlennya-ta-vikoristannya-yak-ligandiv-receptora-oksitocinu.html" target="_blank" rel="follow" title="База патентів України">Похідні індолін-2-ону, спосіб їх виготовлення та використання як лігандів рецептора окситоцину</a>
Попередній патент: Пристрій для контролю ресурсу повітряних високовольтних вимикачів
Наступний патент: Пристрій для контролю ресурсу групи повітряних високовольтних вимикачів
Випадковий патент: Лазерна терапевтична установка












