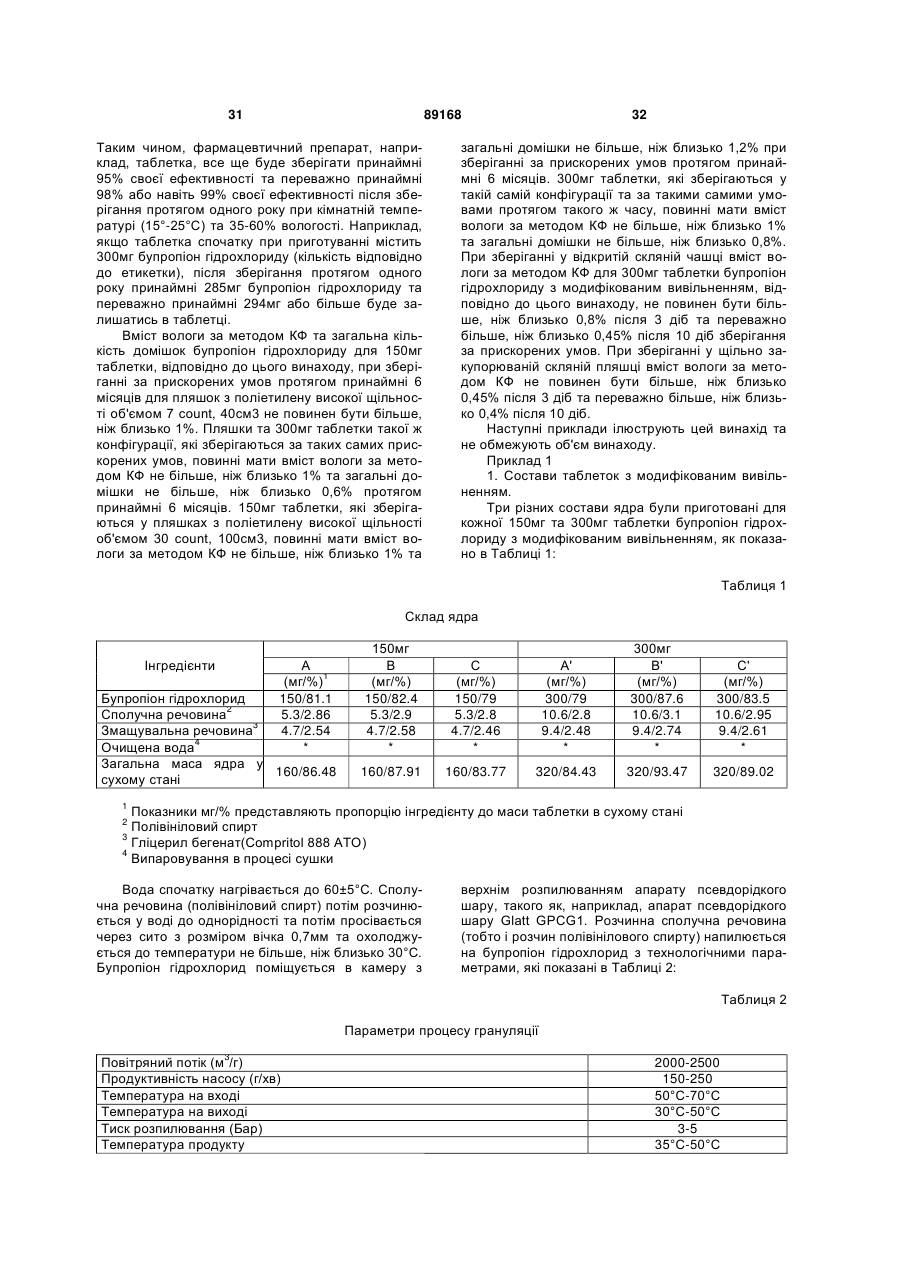
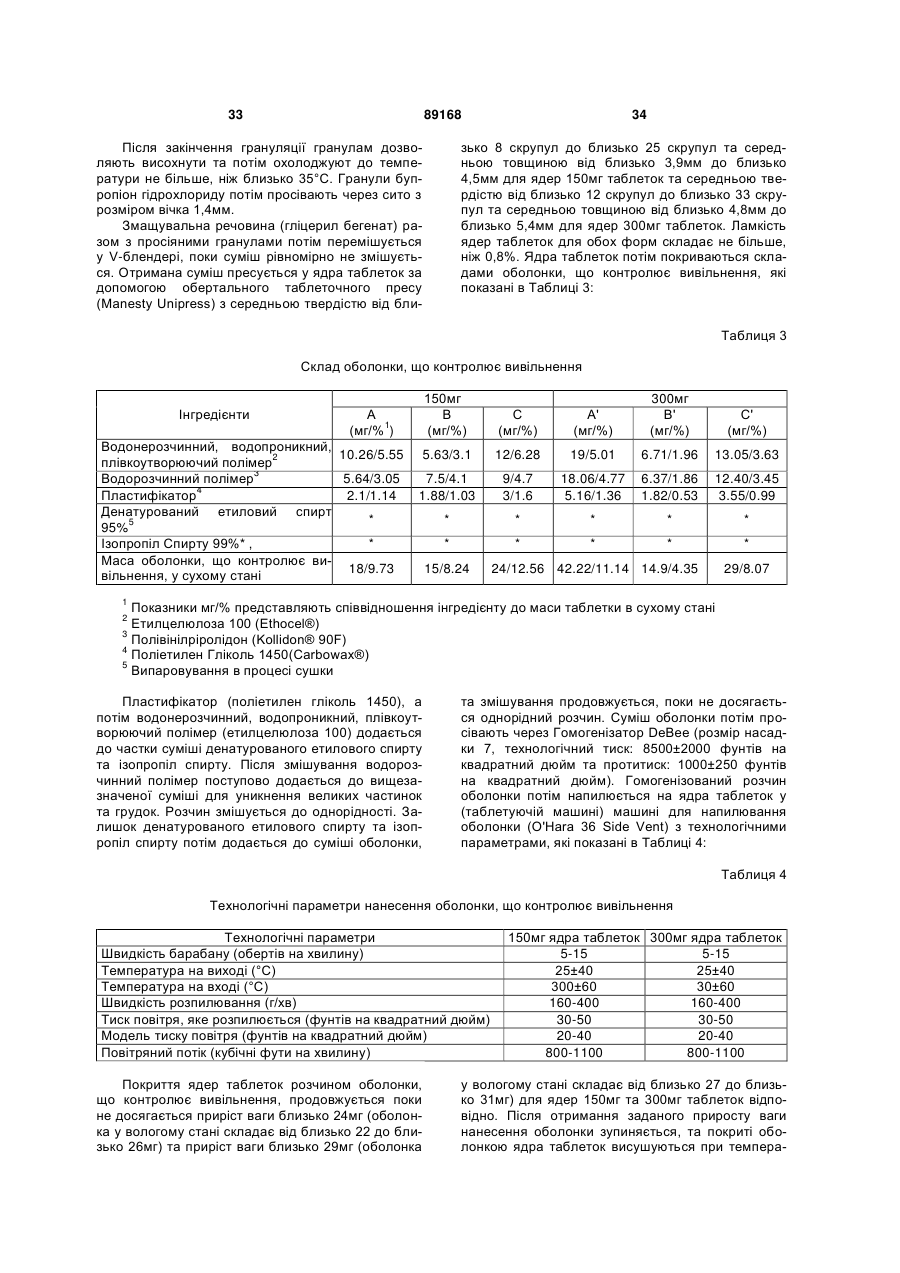
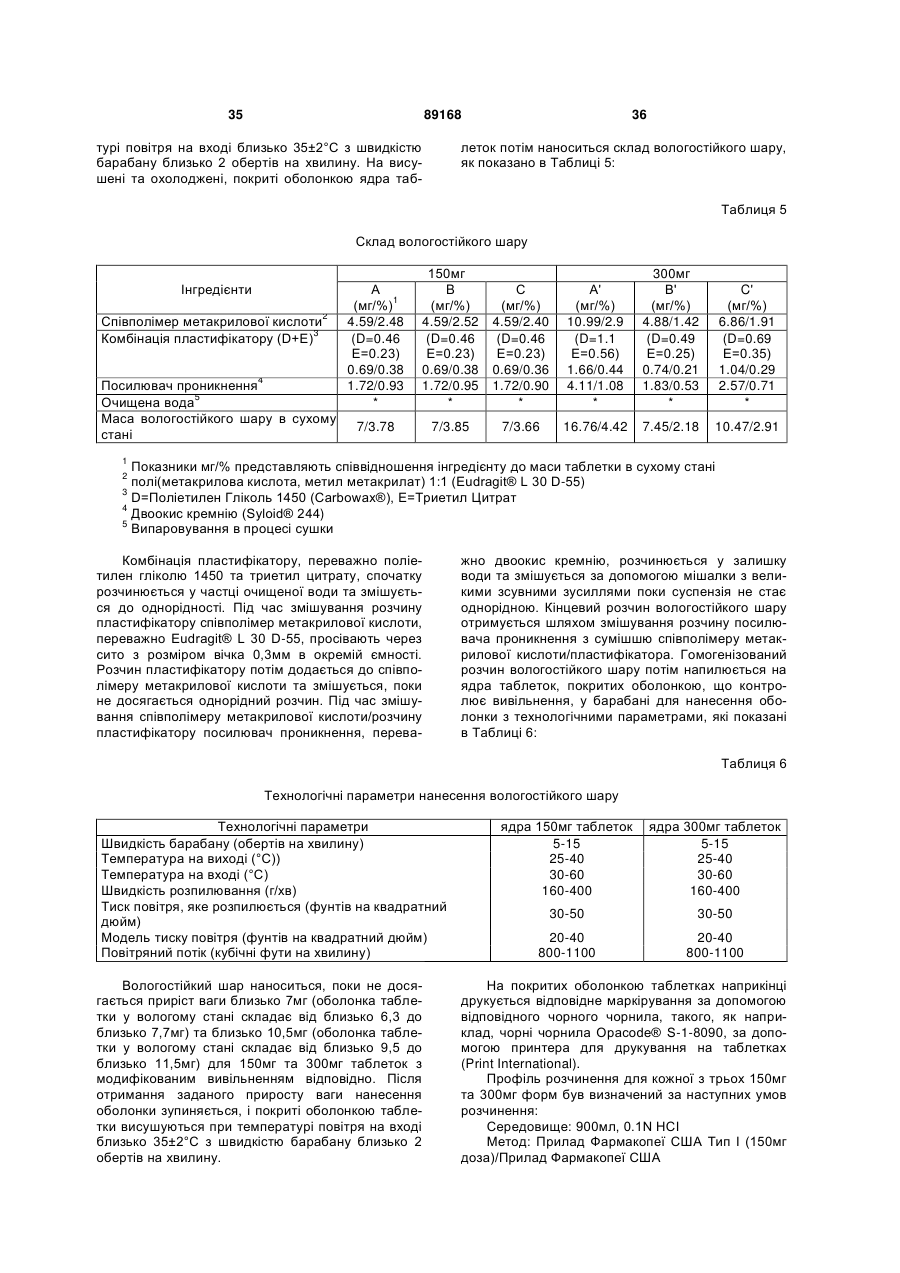
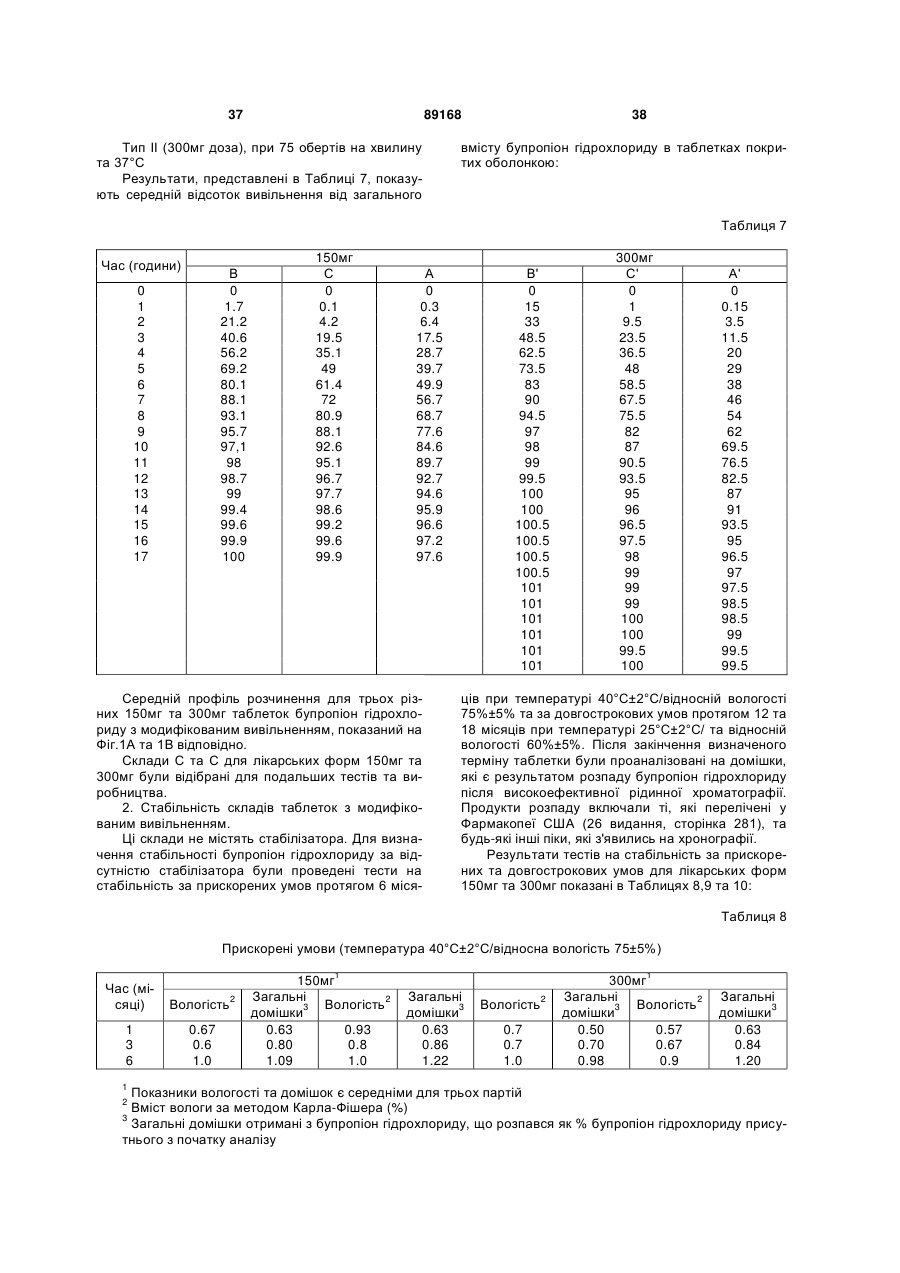
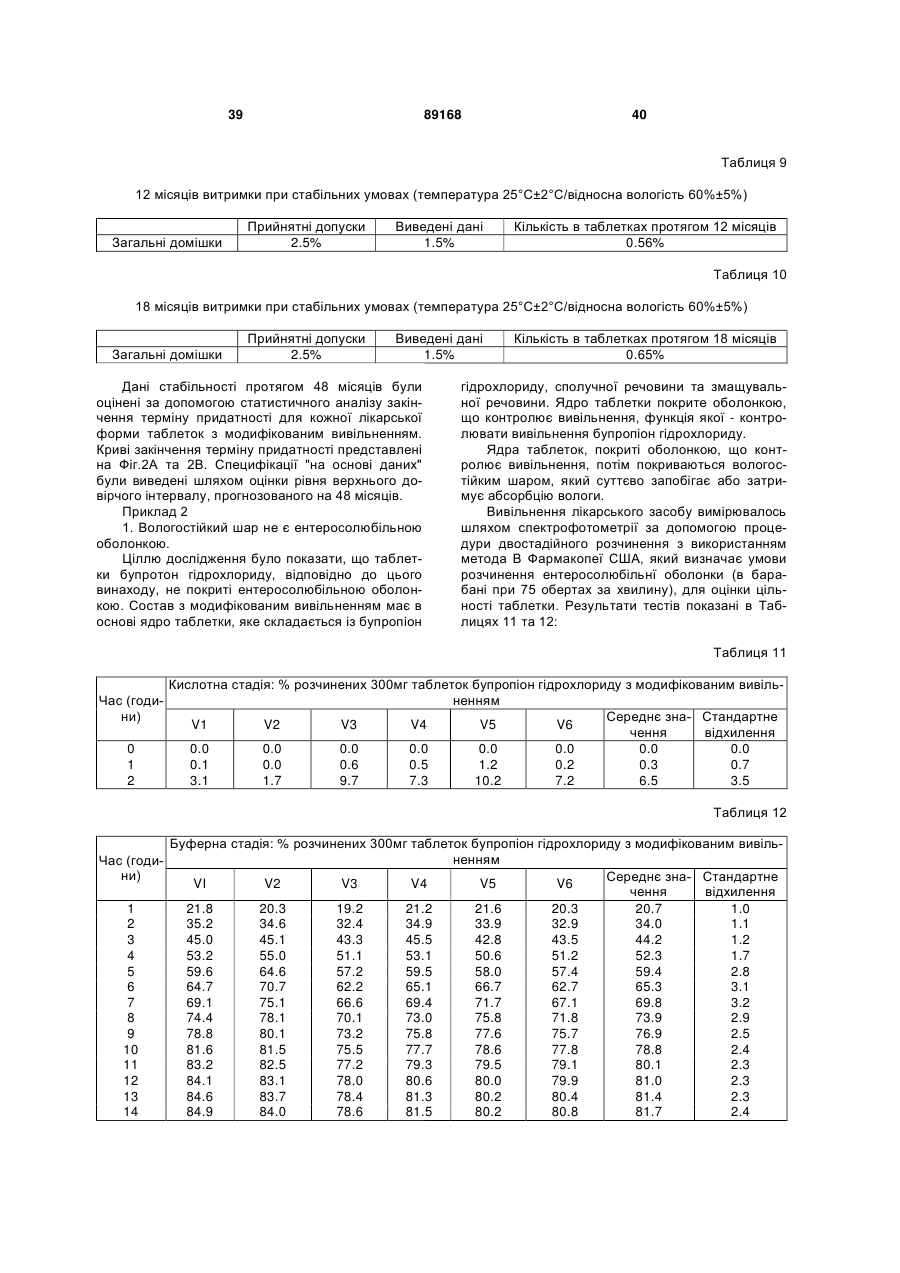
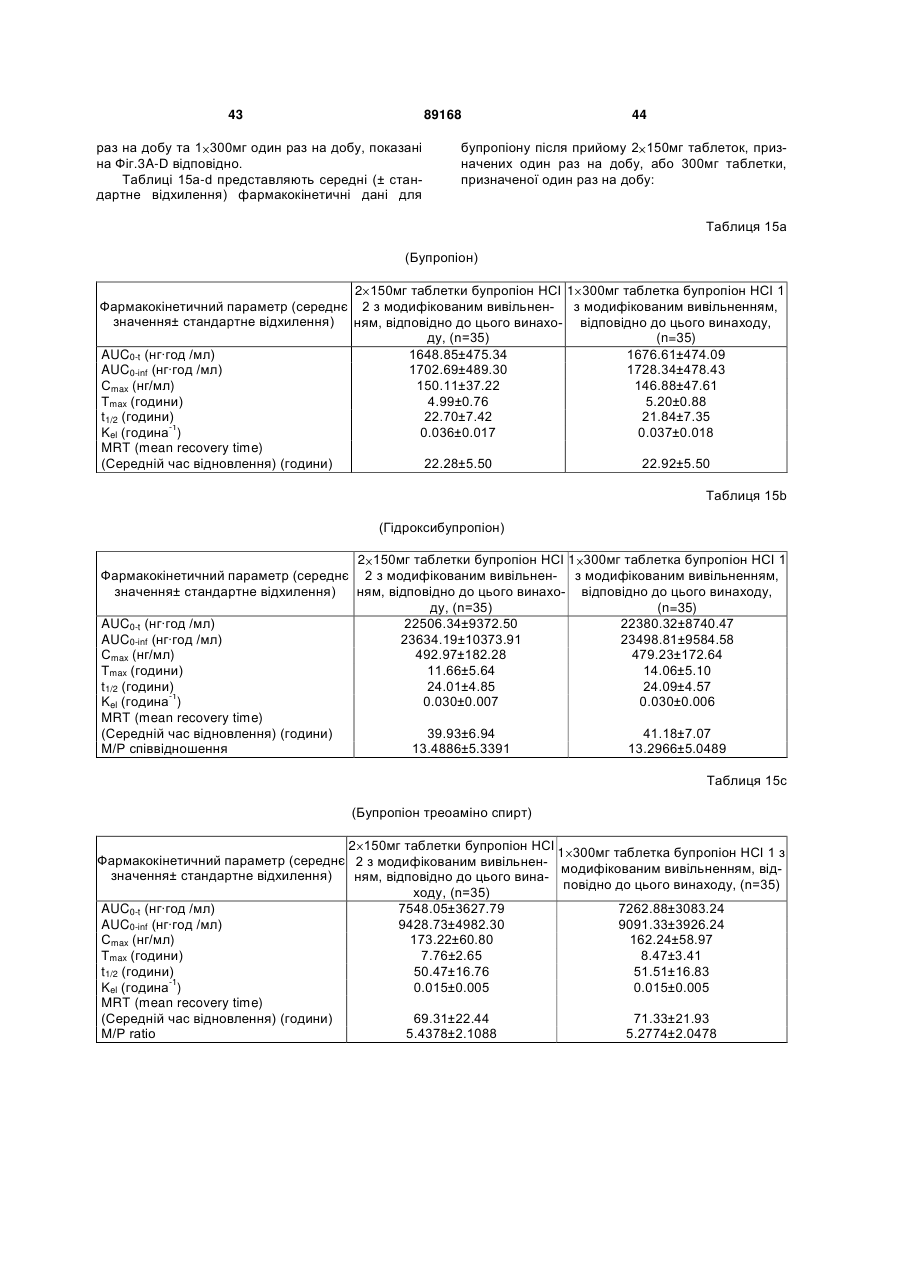
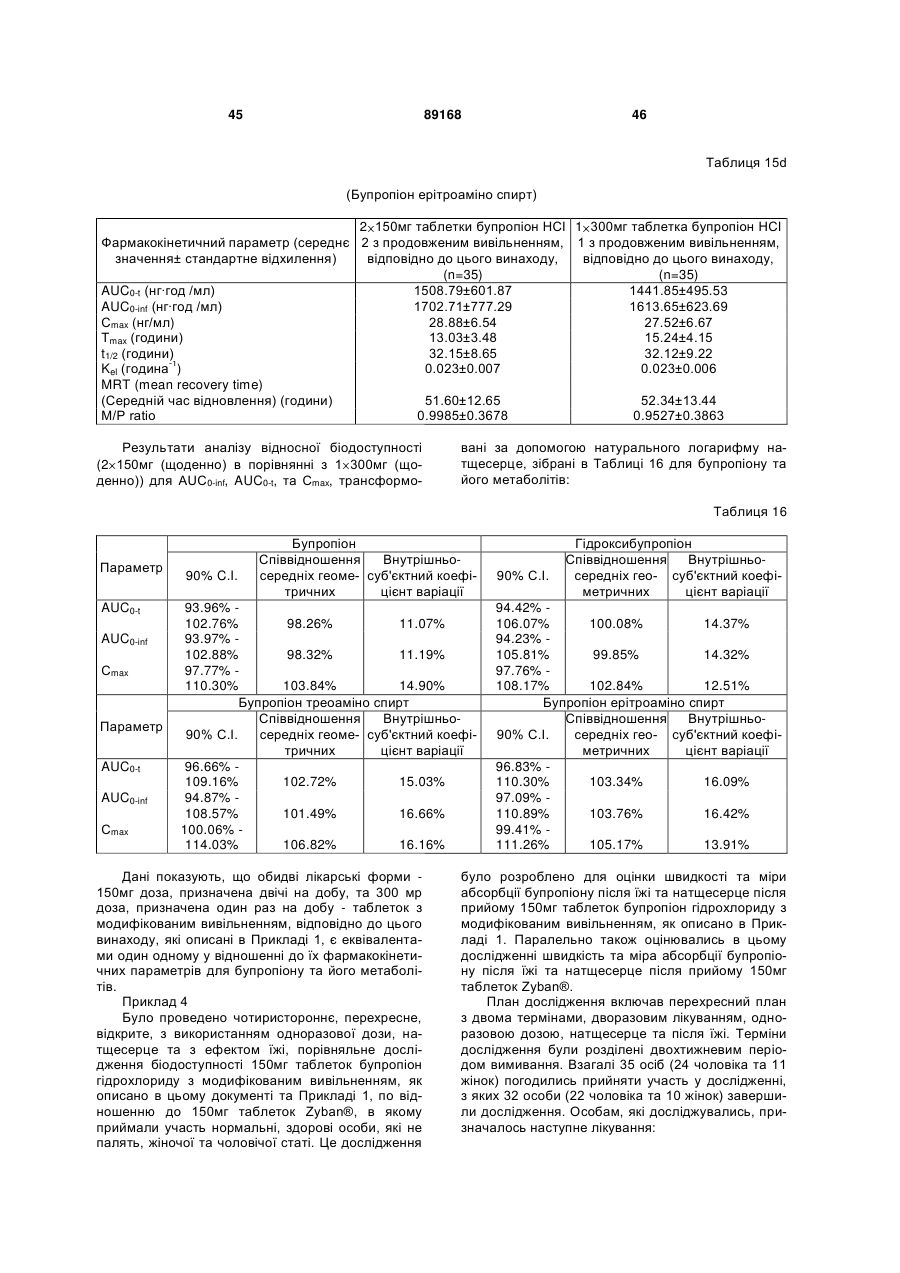
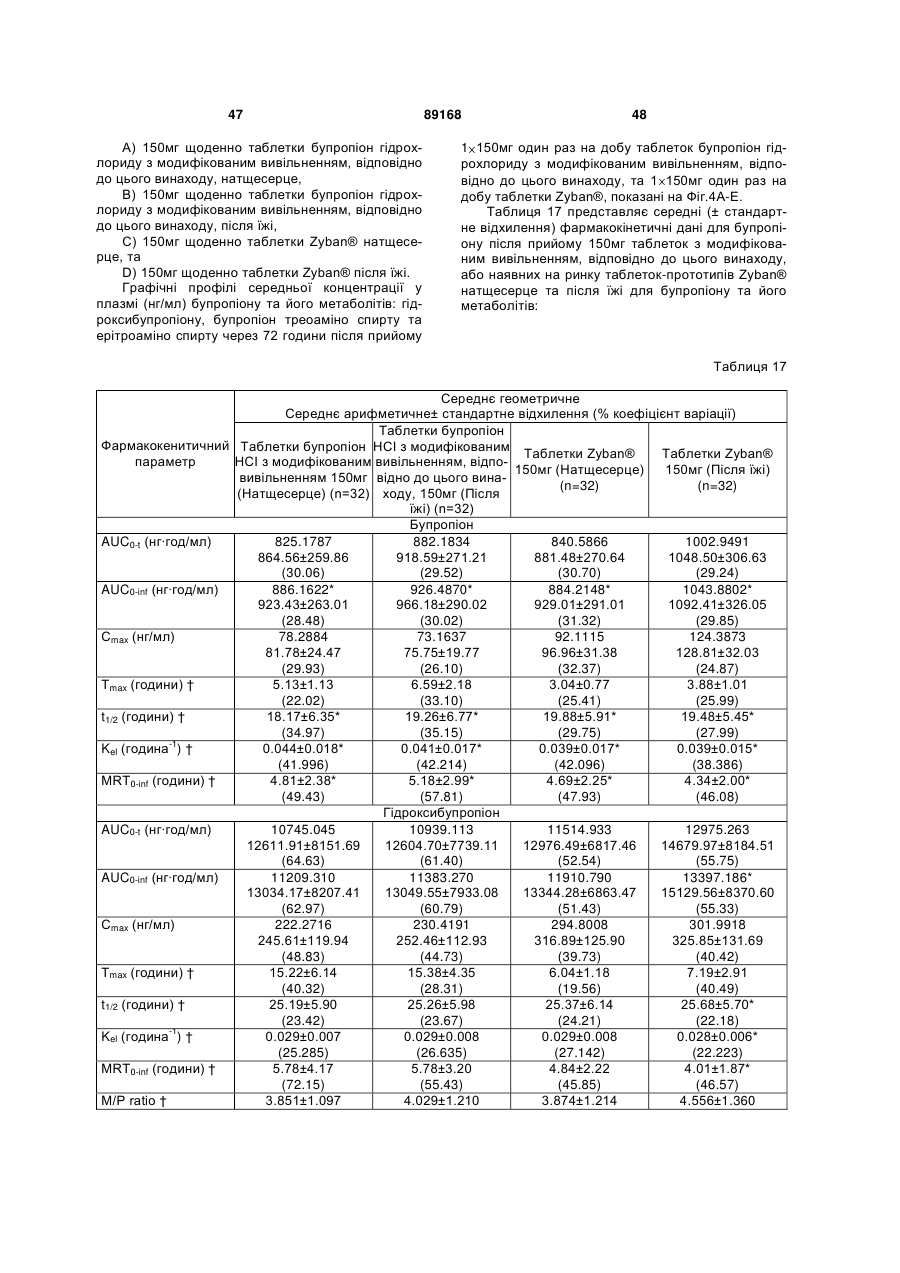
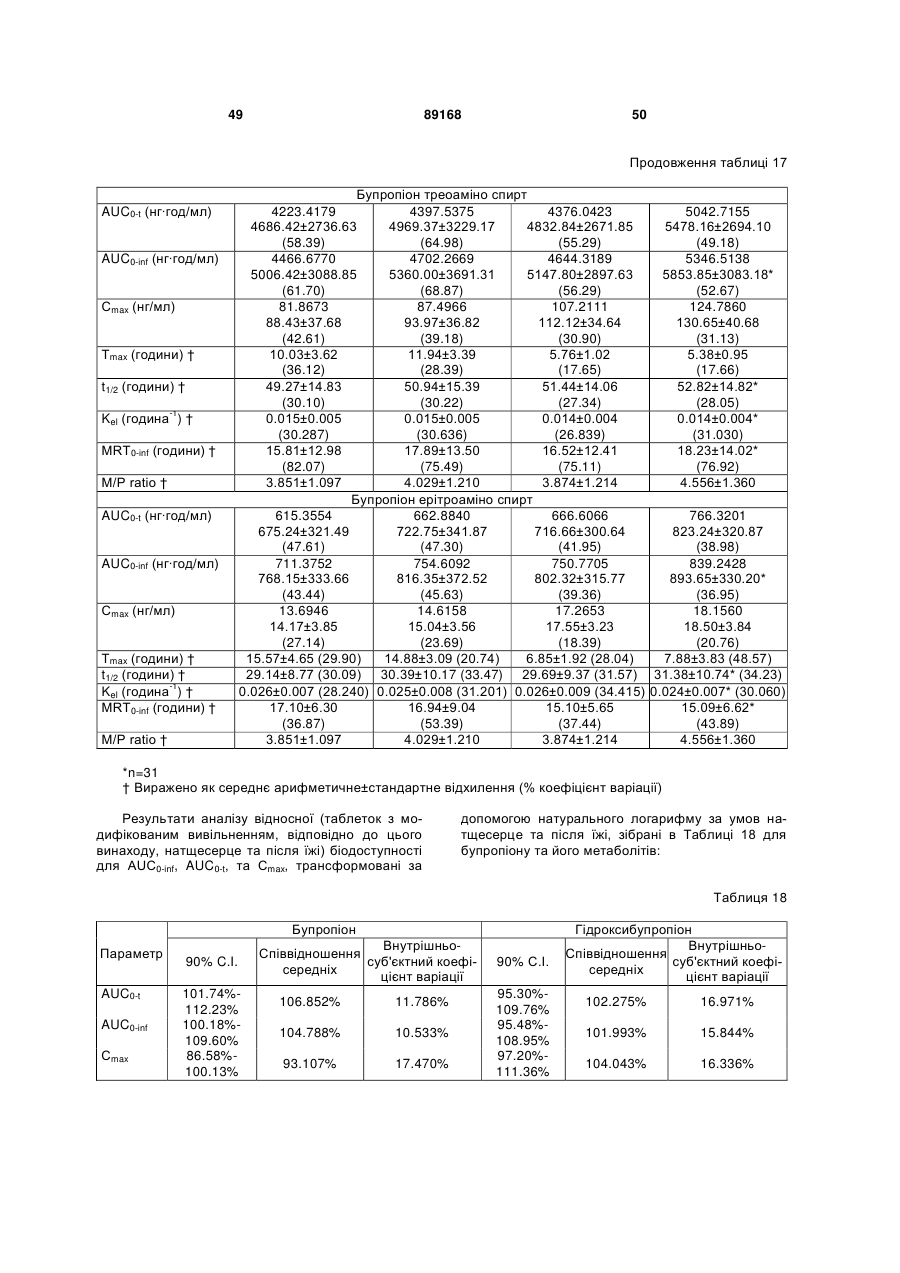
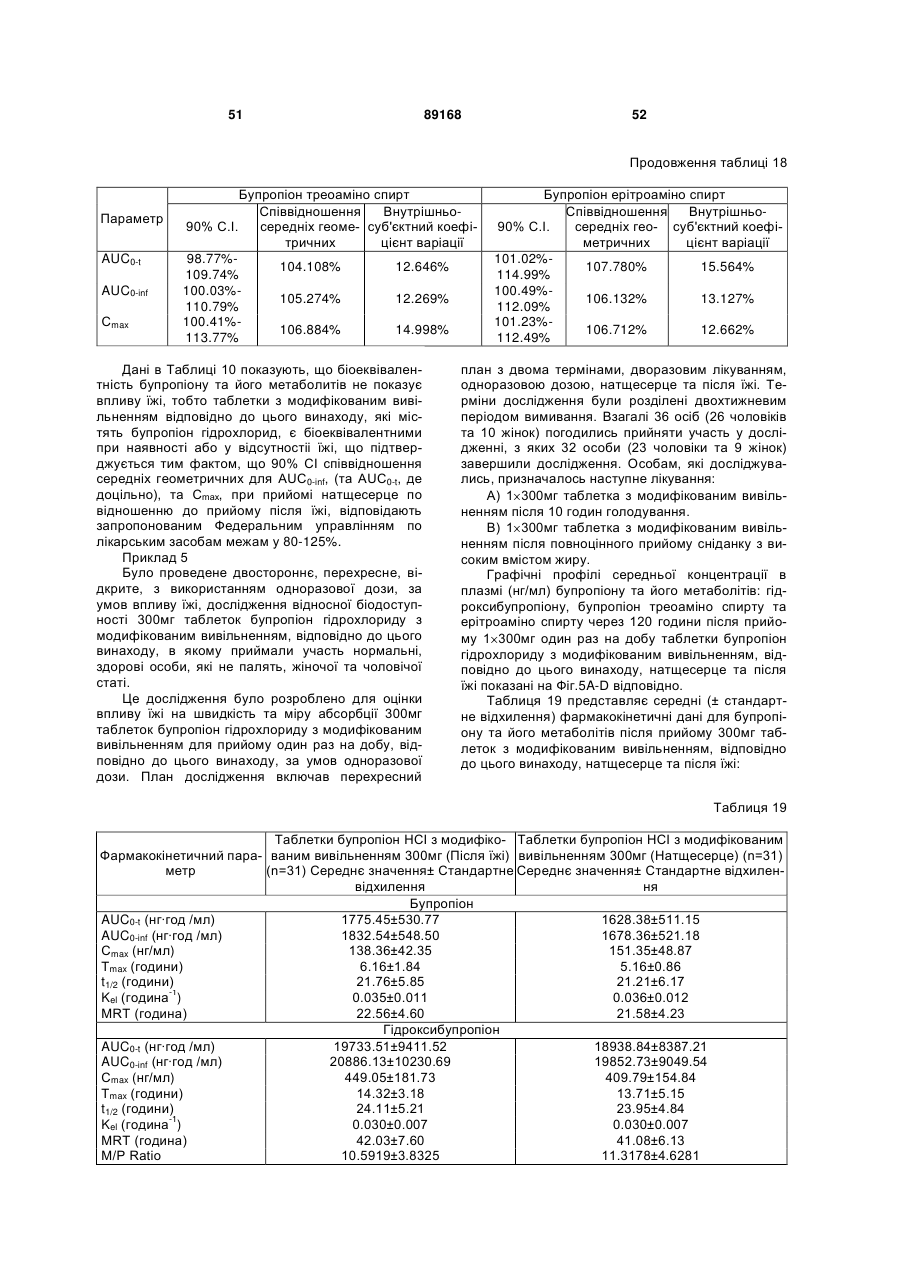
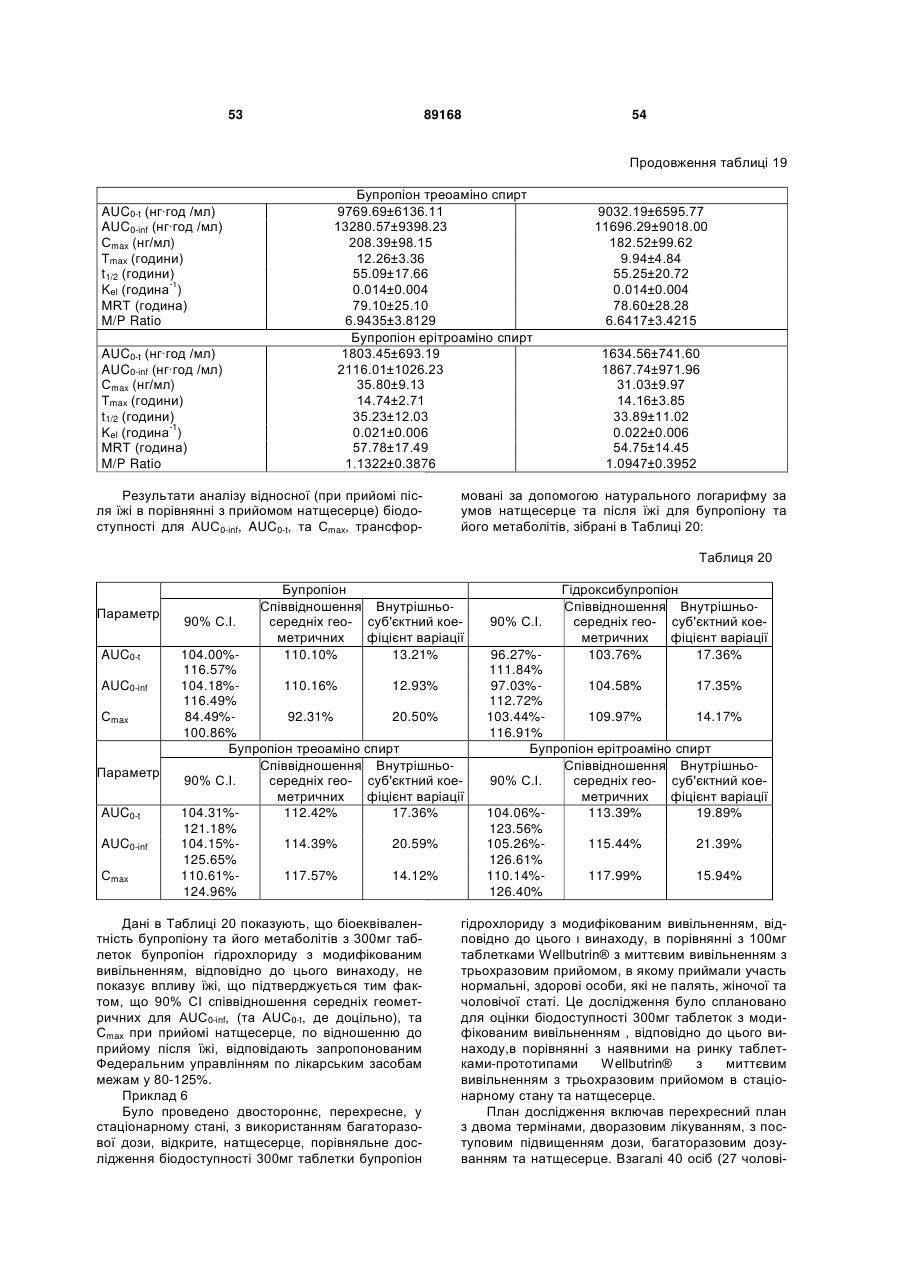
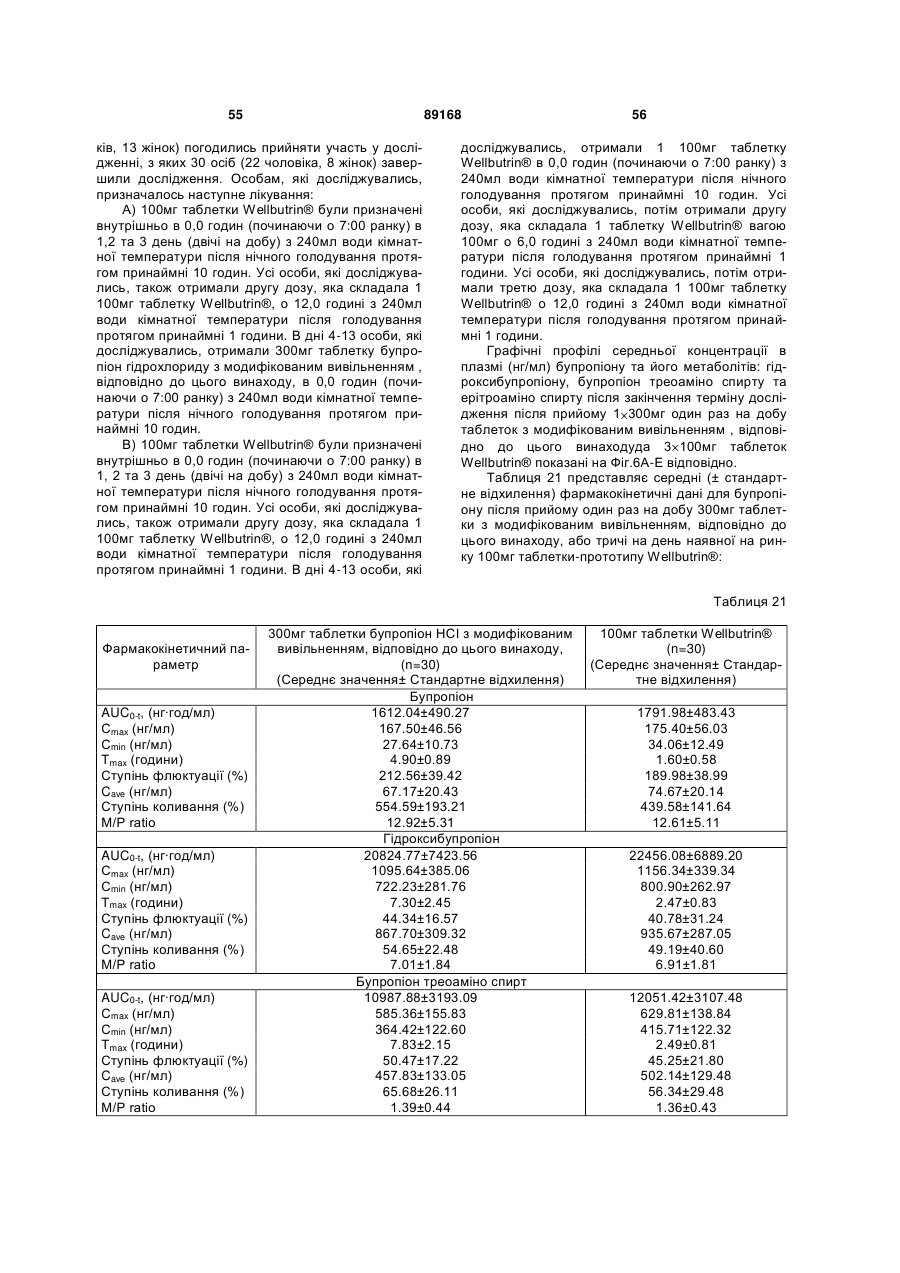
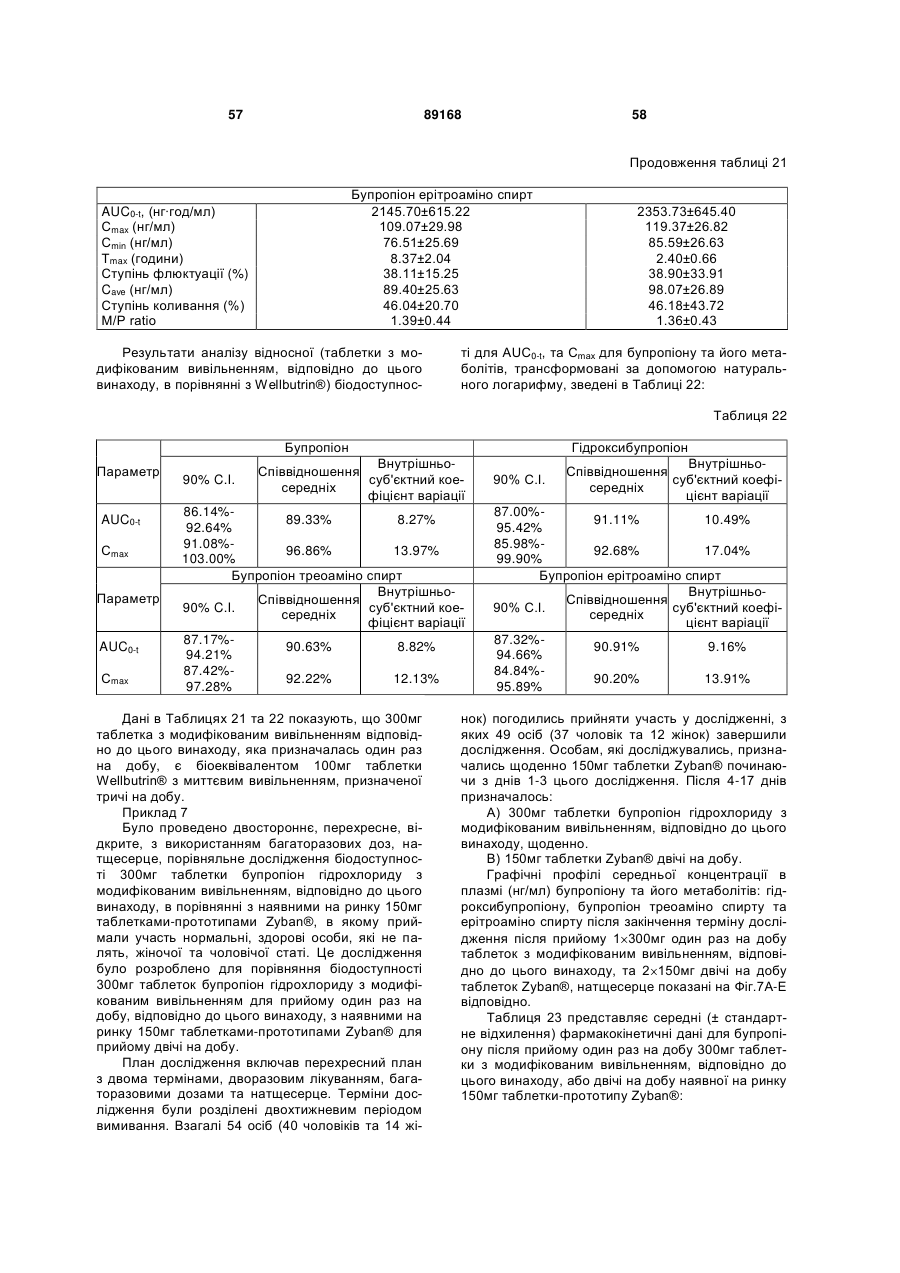
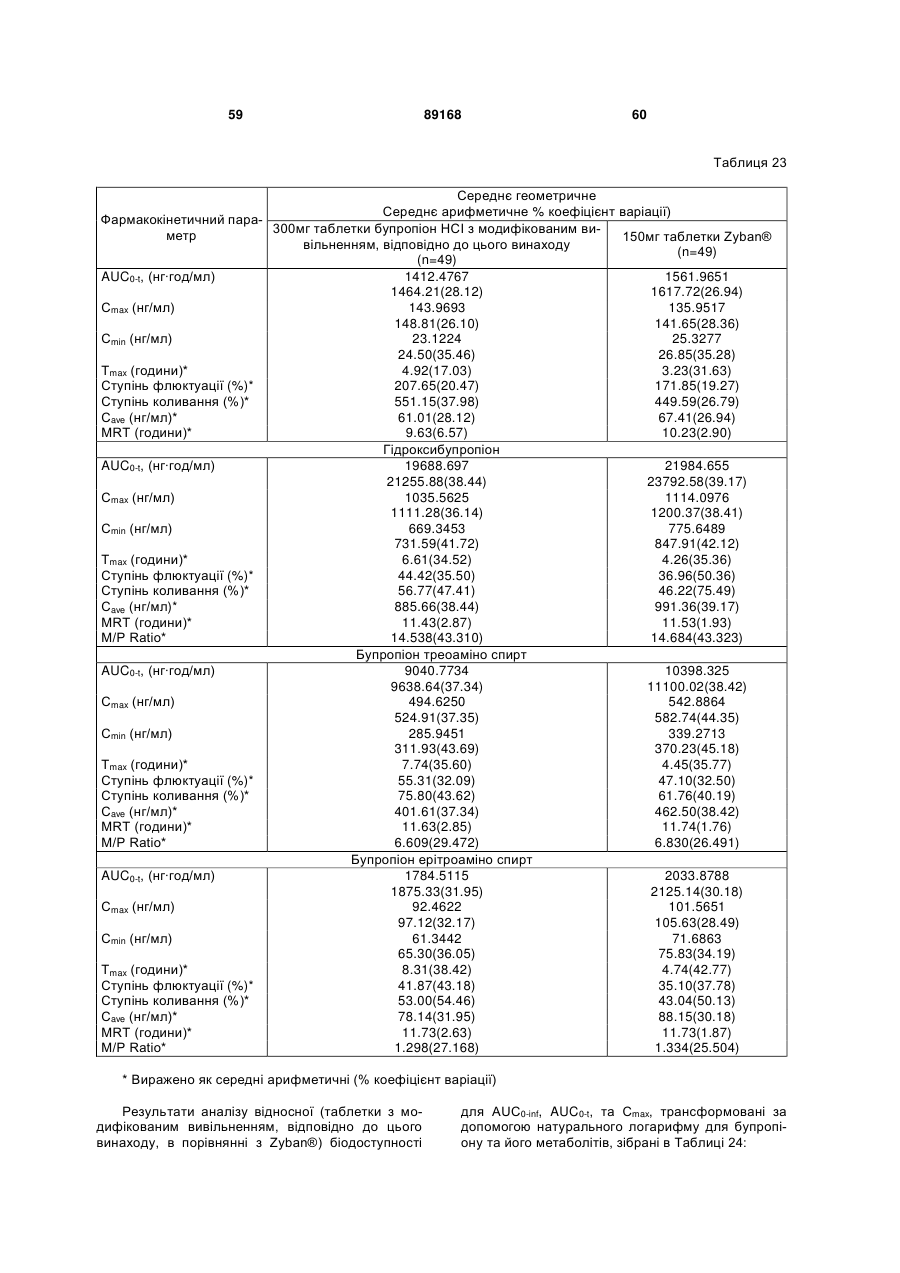
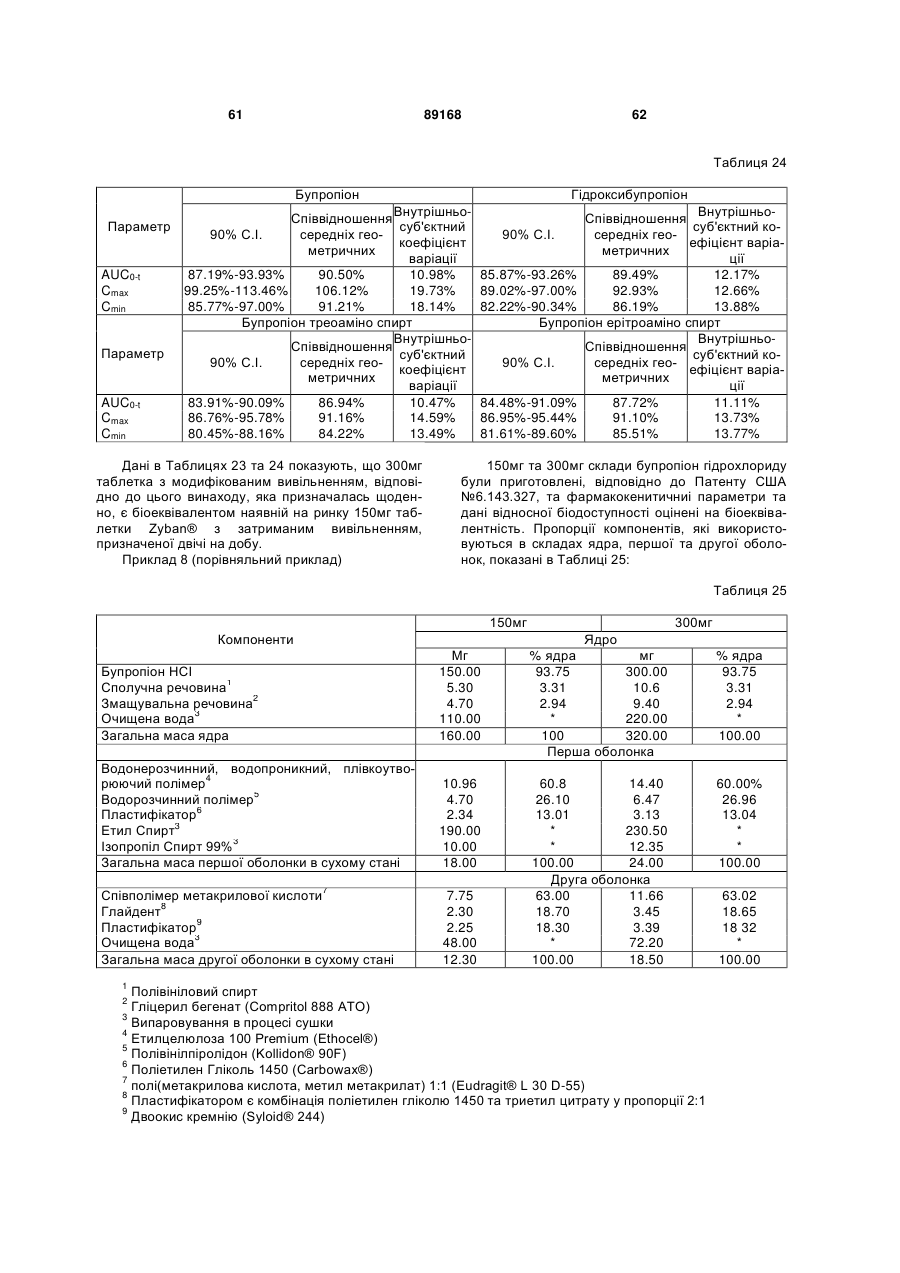
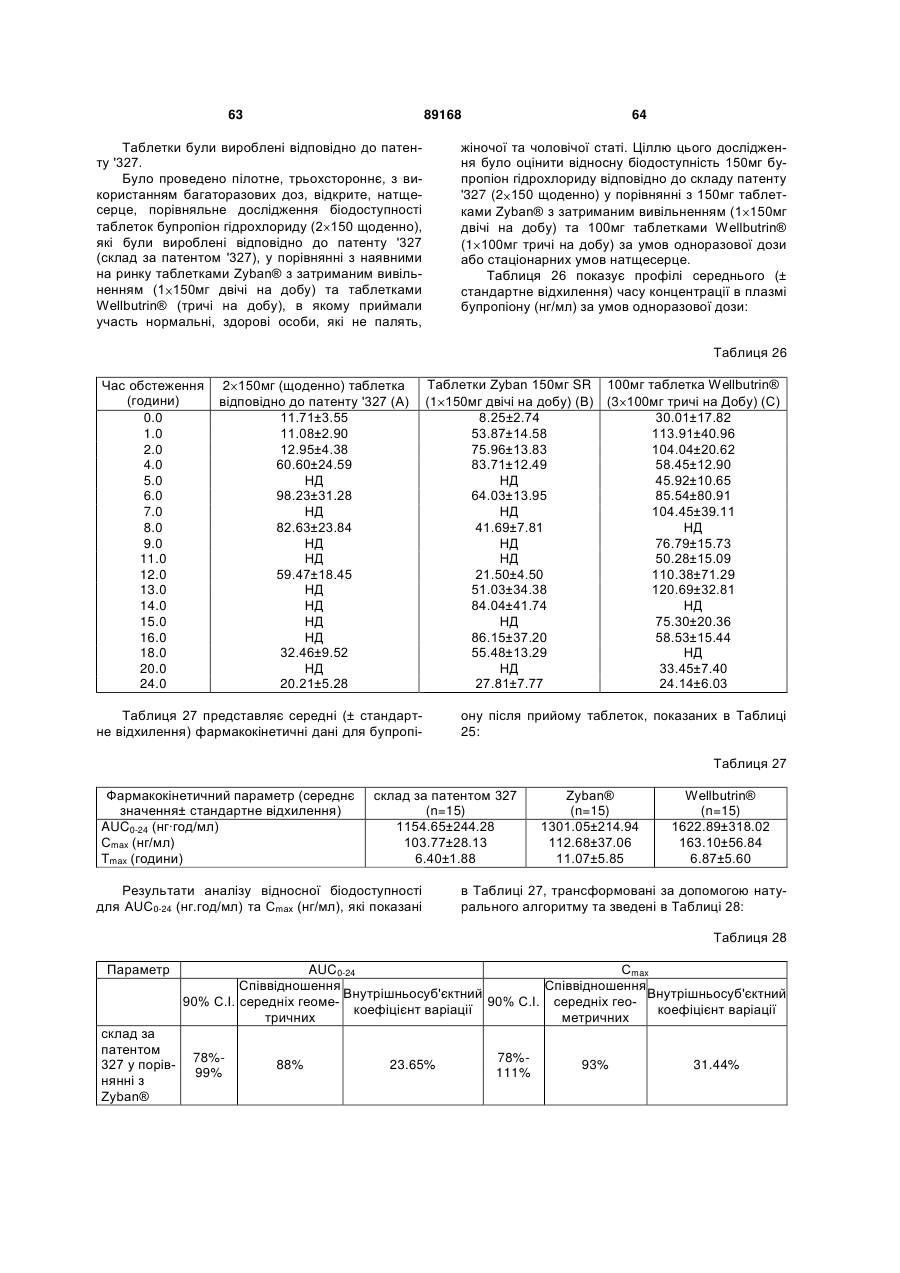
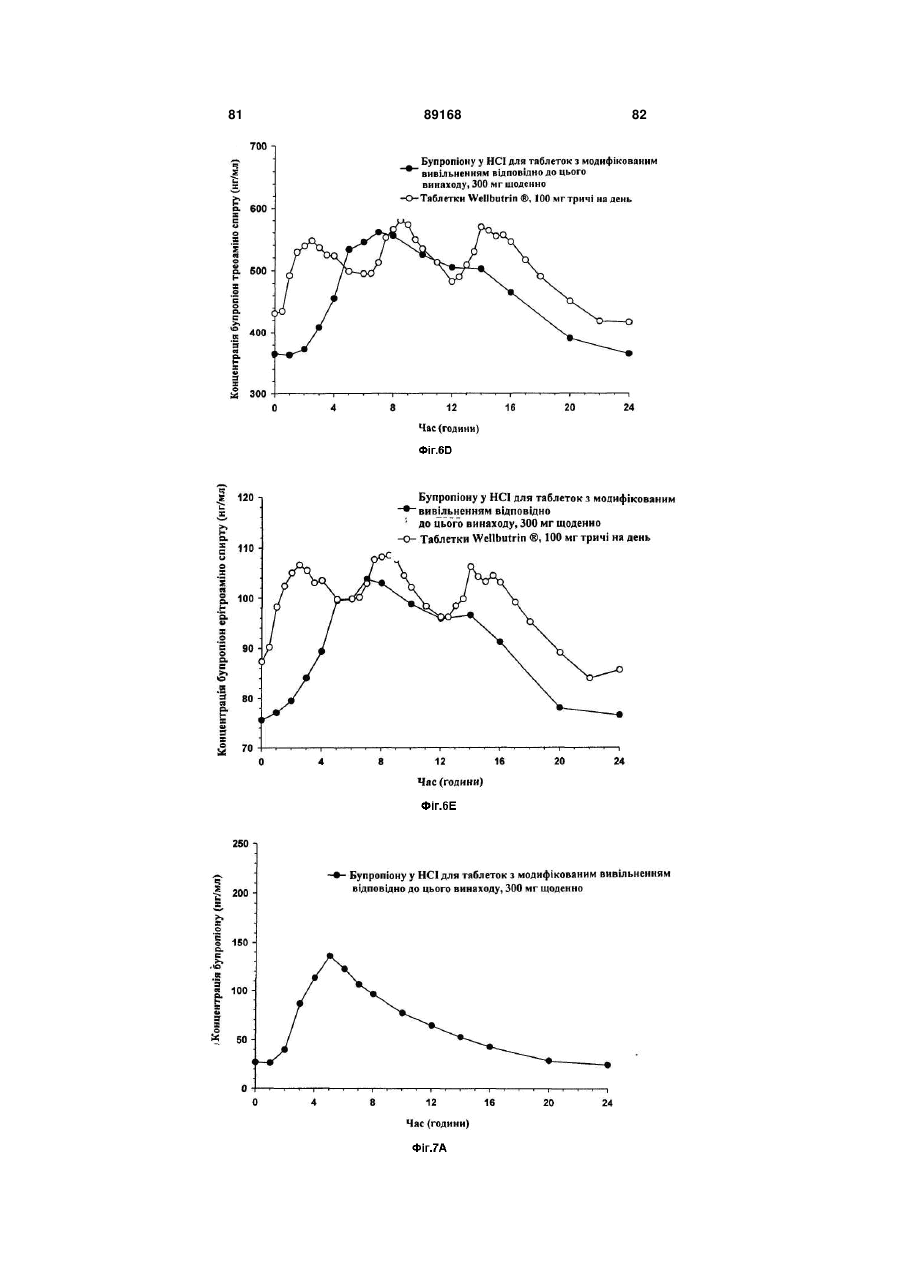
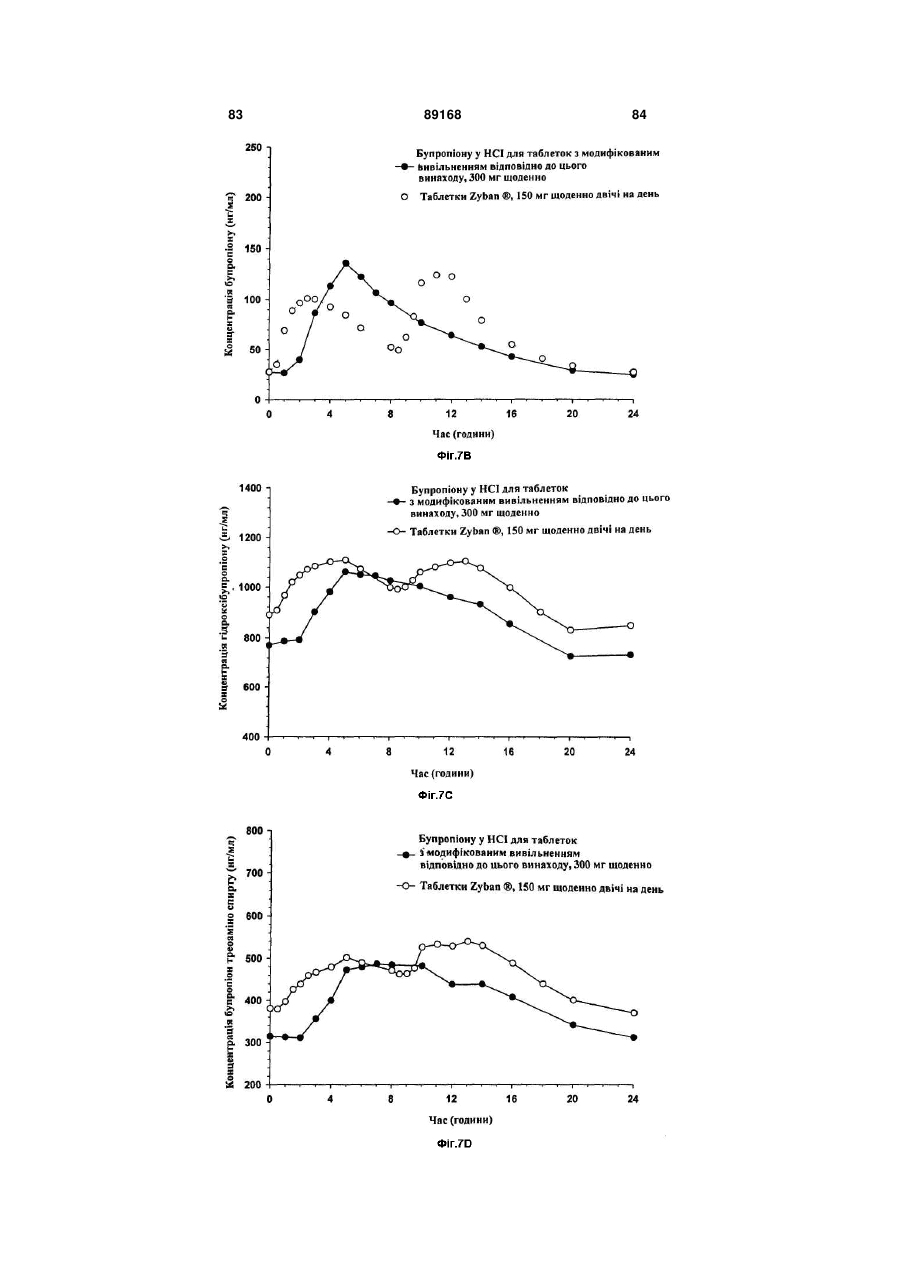
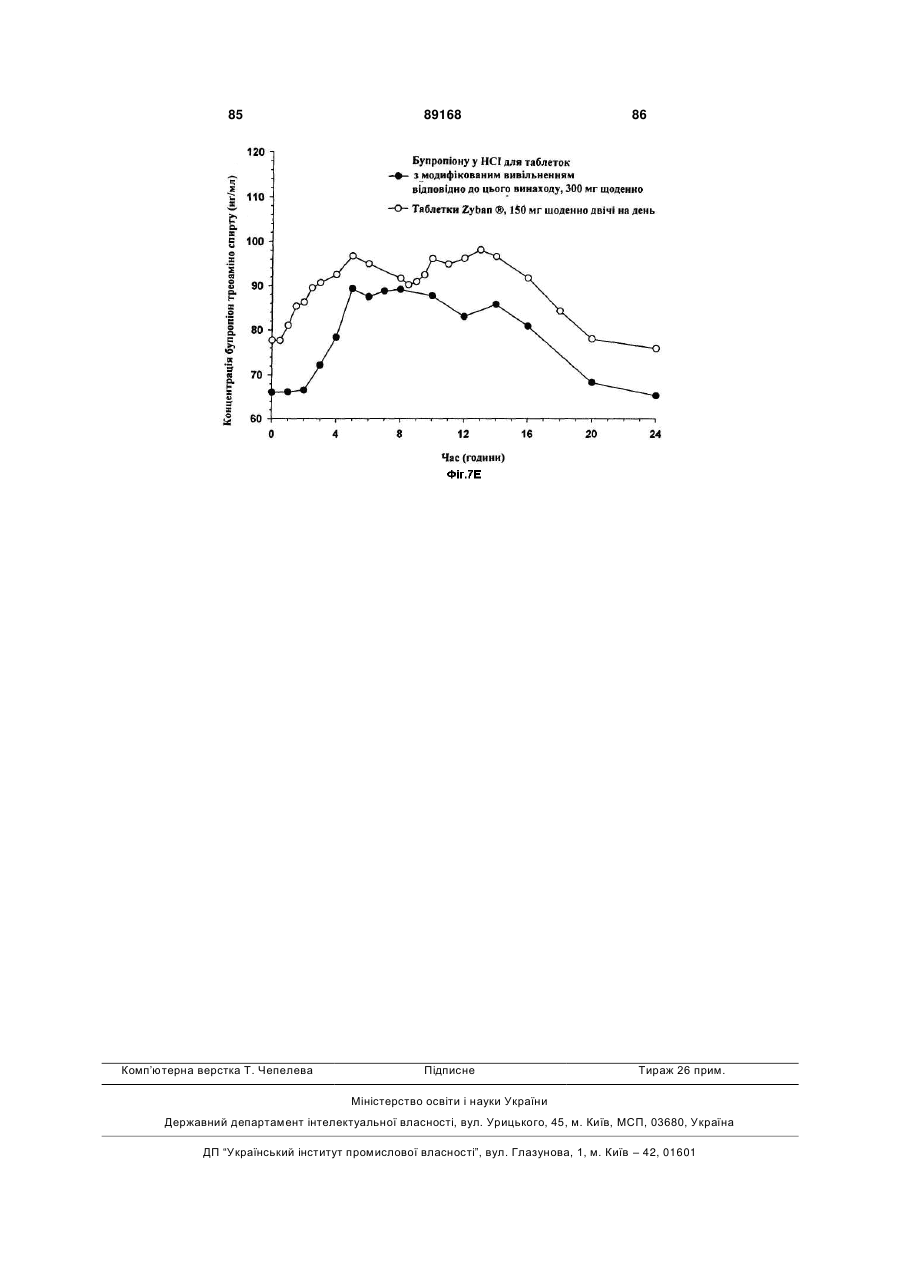
Таблетка бупропіону гідрохлориду з модифікованим вивільненням
Номер патенту: 89168
Опубліковано: 11.01.2010
Автори: Жоу Фанг, Ерадірі Окпо, Обереггер Вернер, Маес Пол
Формула / Реферат
. Таблетка з модифікованим вивільненням, яка складається з:
(i) ядра, яке складається з ефективної дози фармацевтично прийнятної солі бупропіону та звичайних допоміжних речовин;
(ii) першої оболонки, що контролює вивільнення та оточує вказане ядро, причому згадана оболонка, що контролює вивільнення, складається з водонерозчинного, водопроникного, плівкоутворюючого полімеру та водорозчинного полімеру, причому співвідношення водонерозчинного, водопроникного, плівкоутворюючого полімеру до водорозчинного полімеру становить від 3:4 до 5:3; та
(iii) вологостійкого шару, який оточує вказану першу оболонку, що контролює вивільнення, причому згаданий вологостійкий шар складається з ентеросолюбільного полімеру і посилювача проникнення, та може містити пластифікатор, та в якому посилювач проникнення складає від 20 % до 40 % вологостійкого шару в сухому стані;
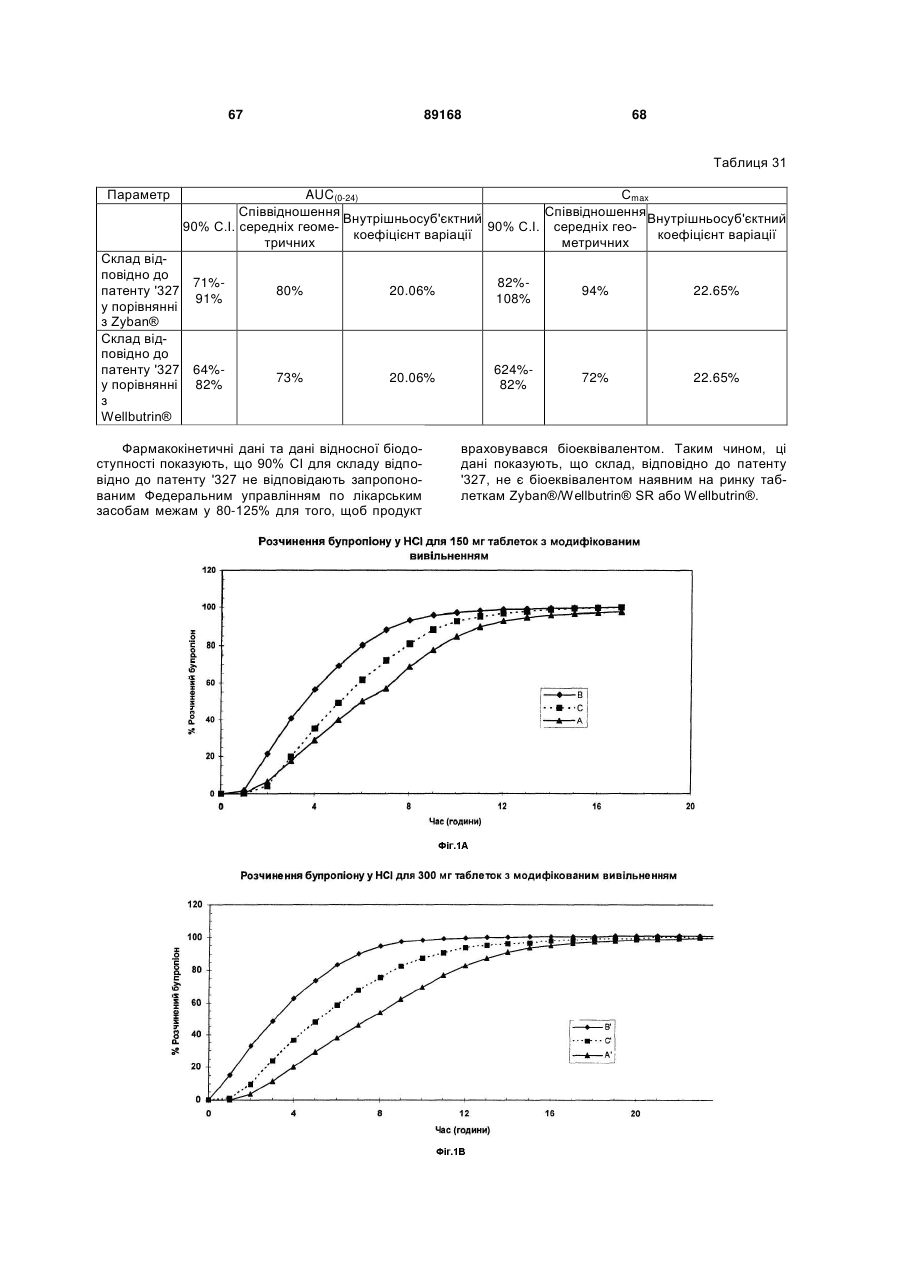
причому вказана таблетка з модифікованим вивільненням є біоеквівалентом таблеток Wellbutrin® чи Zyban®/Wellbutrin® SR на добу при прийомі однієї дози вказаної таблетки з модифікованим вивільненням пацієнтом, який потребує такого прийому.
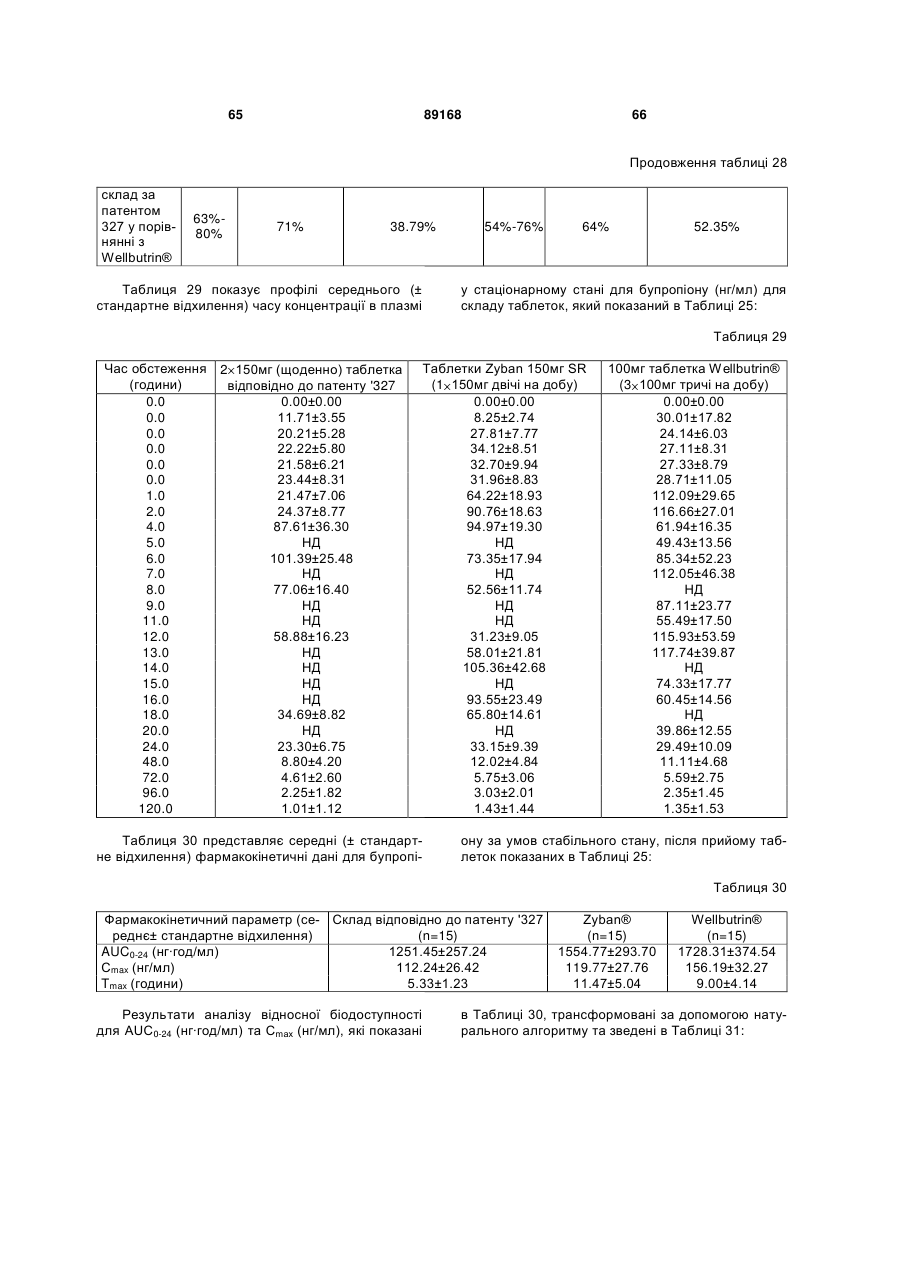
2. Таблетка з модифікованим вивільненням за пунктом 1, причому більше ніж 10 % фармацевтично прийнятної солі бупропіону вивільнюється протягом 2 годин у 0,1N розчині HCl при 75 об/хв. чи не менше ніж 75 % фармацевтично прийнятної солі бупропіону вивільнюється протягом 45 хвилин у буфері pH 6.8.3. Таблетка з модифікованим вивільненням за пунктом 1 чи 2, причому згадана таблетка з модифікованим вивільненням представляє такий розчинний профіль, що після близько 2 годин вивільнюється не більше ніж 20 % вмісту фармацевтично прийнятної солі бупропіону, після близько 4 годин вивільнюється від близько 15 % до близько 45 % вмісту фармацевтично прийнятної солі бупропіону, після близько 8 годин вивільнюється від близько 40 % до близько 90 % вмісту фармацевтично прийнятної солі бупропіону та після близько 16 годин вивільнюється не менше ніж близько 80 % вмісту фармацевтично прийнятної солі бупропіону.4. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-3, в якій вказаною фармацевтично прийнятною сіллю бупропіону є бупропіону гідрохлорид.5. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-4, в якій вміст бупропіону складає принаймні близько 94 вагових відсотків маси ядра в сухому стані.6. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-5, в якій ядро містить також сполучну речовину.7. Таблетка з модифікованим вивільненням за пунктом 6, в якій вказана сполучна речовина складає від близько 1 до близько 6 вагових відсотків ядра в сухому стані.8. Таблетка з модифікованим вивільненням за пунктом 6 чи 7, в якій сполучна речовина вибирається з групи, яка містить модифікований крохмаль, желатин, полівінілпіролідон, похідні целюлози, полівініловий спирт та будь-яку їх комбінацію.9. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-8, в якій ядро містить також змащувальну речовину.10. Таблетка з модифікованим вивільненням за пунктом 9, в якій вказана змащувальна речовина складає від близько 1 до близько 6 вагових відсотків ядра в сухому стані.11. Таблетка з модифікованим вивільненням за пунктом 9 чи 10, в якій вказана змащувальна речовина вибирається з групи, яка містить бегенат гліцерину, стеаринову кислоту, гідратовані рослинні олії та будь-яку їх комбінацію.12. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-11, в якій вказаний водонерозчинний, водопроникний, плівкоутворюючий полімер складає від близько 35 до близько 60 вагових відсотків маси вказаної оболонки, що контролює вивільнення, в сухому стані.13. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-12, в якій вказаний водонерозчинний, водопроникний, плівкоутворюючий полімер вибирається з групи, яка містить прості ефіри целюлози, складні ефіри целюлози, полівініловий спирт та будь-яку їх комбінацію.14. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-13, в якій вказаний пластифікатор складає від близько 6 до близько 30 вагових відсотків вказаної оболонки, що контролює вивільнення, в сухому стані.15. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-14, в якій вказаний пластифікатор вибирається з групи, яка містить поліоли, органічні складні ефіри, олії/гліцериди та будь-яку їх комбінацію.16. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-15, в якій вказаний водорозчинний полімер складає від близько 25 до близько 50 вагових відсотків вказаної оболонки, що контролює вивільнення, в сухому стані.17. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-16, в якій вказаний водорозчинний полімер вибирається з групи, яка містить полівінілпіролідон, гідроксипропілметилцелюлозу, гідроксипропілцелюлозу та будь-яку їх комбінацію.18. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-17, в якій співвідношення водонерозчинний, водопроникний, плівкоутворюючий полімер: пластифікатор: водорозчинний полімер становить від 3:1:4 до 5:1:3.19. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-17, в якій співвідношення водонерозчинний, водопроникний, плівкоутворюючий полімер: пластифікатор: водорозчинний полімер становить від 7:2:6 до 19:5:18.20. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-19, в якій приріст ваги після нанесення оболонки, що контролює вивільнення, складає від близько 3 % до близько 30 % ваги ядра в сухому стані.21. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-20, де кількість вказаного ентеросолюбільного полімеру складає від 30 % до 90 % маси вологостійкого шару в сухому стані. 22. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-21, яка складається з близько 150 мг вказаної фармацевтично прийнятної солі бупропіону, та кількість вказаного ентеросолюбільного полімеру коливається від 1 % до 3 % маси таблетки в сухому стані та складає від 55 % до 70 % маси вологостійкого шару в сухому стані.23. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-21, яка складається з близько 300 мг вказаної фармацевтично прийнятної солі бупропіону, та кількість вказаного ентеросолюбільного полімеру коливається від 1,5 % до 3,0 % маси таблетки в сухому стані та складає від 30 % до 90 % маси вологостійкого шару в сухому стані.24. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-23, в якій ентеросолюбільним полімером є акриловий полімер.25. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-24, в якій вказаний пластифікатор складає від близько 1 до близько 30 вагових відсотків маси вологостійкого шару в сухому стані.26. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-25, в якій вказаний посилювач проникнення складає близько 25 вагових відсотків маси вологостійкого шару в сухому стані.27. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-26, в якій вказаний посилювач проникнення вибирається з групи, яка містить двоокис кремнію, колоїдний силікон, лактозу, гідрофільні полімери, хлористий натрій, окис алюмінію, колоїдний окис алюмінію, окис кремнію, мікрокристалічну целюлозу та будь-яку їх комбінацію.28. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-27, яка складається із вказаних ентеросолюбільного полімеру, пластифікатора та посилювача проникнення, що співвідносяться як 13:2:5.29. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-28, в якій нанесення вологостійкого шару на таблетку приводить до загального приросту ваги не більше ніж близько 6 % у відношенні до маси таблетки у сухому стані.30. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-29, причому згадана таблетка з модифікованим вивільненням натщесерце забезпечує Cmax бупропіону у плазмі крові протягом від близько 3 годин до близько 8 годин (Tmax) після прийому таблетки з модифікованим вивільненням.31. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-30, причому вказана таблетка з модифікованим вивільненням забезпечує Cmax бупропіону від близько 60 нг/мл до близько 280 нг/мл у плазмі крові протягом близько 5 годин (Tmax) після прийому натщесерце один раз на добу 300 мг дози вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням або один раз на добу 2 х 150 мг дози вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням.32. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-31, причому вказана таблетка з модифікованим вивільненням натщесерце представляє AUC(0-t) для бупропіону від близько 840 нг·год./мл до близько 2850 нг·год./мл після прийому натщесерце один раз на добу 300 мг дози вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням або один раз на добу 2 х 150 мг дози вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням.33. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-32, причому вказана таблетка з модифікованим вивільненням представляє AUC(0-inf) для бупропіону від близько 840 нг.·год./мл до близько 3000 нг.·год./мл після прийому натщесерце один раз на добу 300 мг дози вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням або один раз на добу 2 х 150 мг дози вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням.34. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-33, яка при прийомі однієї дози бупропіону пацієнтом, який потребує такого прийому, забезпечує Cmax бупропіону від близько 60 нг/мл до близько 280 нг/мл протягом від близько 3 годин до близько 8 годин (Tmax) та AUC(0-t) для бупропіону коливається від близько 800 нг.·год./мл до 2850 нг.·год./мл.35. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-34, причому вказана таблетка з модифікованим вивільненням при прийомі 300 мг дози один раз на добу або 2 х 150 мг дози один раз на добу пацієнтом, який потребує такого прийому, натщесерце є біоеквівалентом таблеткам Wellbutrin® чи Zyban®/Wellbutrin® SR на добу.36. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-35, причому вказана таблетка з модифікованим вивільненням при прийомі 2 х 150 мг дози один раз на добу або 300 мг дози один раз на добу пацієнтом, який потребує такого прийому, є біоеквівалентом таблеткам Wellbutrin® чи Zyban®/Wellbutrin® SR на добу та не впливає на ефект їжі. 37. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-36, причому вказана таблетка з модифікованим вивільненням є біоеквівалентом таблеткам Wellbutrin® чи Zyban®/Wellbutrin® SR за добу, при одноразовій дозі вказаної таблетки з модифікованим вивільненням при прийомі пацієнтом, який потребує такого прийому, натщесерце та після їжі.38. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-37, причому вказана таблетка з модифікованим вивільненням при прийомі 300 мг дози один раз на добу пацієнтом, який потребує такого прийому, натщесерце є біоеквівалентом таблеткам Wellbutrin ®, які приймаються 1 х 300 мг тричі на добу у стаціонарному режимі.39. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-38, причому вказана таблетка з модифікованим вивільненням при прийомі 300 мг дози один раз на добу пацієнтом, який потребує такого прийому, натщесерце є біоеквівалентом таблеткам Zyban®, які приймаються 1 x 150 мг двічі на добу у стаціонарному режимі.40. Таблетка з модифікованим вивільненням за пунктами 1-39, причому вміст вологи складає не більше ніж близько 0,4 % у вказаній таблетці з модифікованим вивільненням після близько 10 діб зберігання у відкритій чашці при температурі 40 °C ± 2 °C та відносній вологості 75 % ± 5 %.41. Таблетка з модифікованим вивільненням за пунктами 1-40, причому вміст вологи вказаної таблетки з модифікованим вивільненням складає не більше ніж близько 1 % у вказаній таблетці після близько 6 місяців зберігання при температурі 40 °C ± 2 °C та відносній вологості 75 % ± 5 %.42. Таблетка з модифікованим вивільненням за пунктами 1-41, причому вказана таблетка містить принаймні близько 95 % бупропіону гідрохлориду номінальної якості після зберігання протягом 12 місяців при температурі 25 °C ± 2 °C та відносній вологості 60 % ± 5 %.43. Таблетка з модифікованим вивільненням за пунктами 1-42, причому вказана таблетка містить принаймні близько 95% бупропіону гідрохлориду номінальної якості після зберігання протягом 18 місяців при температурі 25 °C ± 2 °C та відносній вологості 60 % ± 5 %.44. Таблетка з модифікованим вивільненням за пунктами 1-43, причому вказана таблетка містить 150 мг бупропіону гідрохлориду.45. Таблетка з модифікованим вивільненням за пунктами 1-43, причому вказана таблетка містить 300 мг бупропіону гідрохлориду.46. Таблетка з модифікованим вивільненням за пунктами 1-45, яка не впливає на ефект їжі.47. Склад таблетки з модифікованим вивільненням за пунктом 1:(i) ядро, яке містить ефективну дозу бупропіону гідрохлориду, полівінілового спирту, гліцерилбегенату, причому вказаний бупропіон гідрохлорид складає принаймні близько 94 вагових відсотків маси ядра в сухому стані, вказаний полівініловий спирт складає близько 3 вагових відсотків маси ядра в сухому стані та вказаний гліцерилбегенат складає близько 3 вагових відсотків маси ядра в сухому стані;
(ii) оболонка, що контролює вивільнення та повністю щільно покриває вказане ядро, причому вказана оболонка, що контролює вивільнення, складається з етилцелюлози сорту PR 100, поліетиленгліколю 1450 та полівінілпіролідону, причому вказана етилцелюлоза сорту PR 100 складає від близько 45 до близько 50 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані, вказаний поліетиленгліколь 1450 складає близько 12 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані, та вказаний полівінілпіролідон складає від близько 25 до близько 50 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані, причому кількість нанесеної вказаної оболонки, що контролює вивільнення, складає від близько 9 до близько 15 вагових відсотків маси ядра таблетки в сухому стані; та
(iii) вологостійкий шар, який оточує вказану оболонку, що контролює вивільнення, причому вказаний вологостійкий шар складається з співполімеру метакрилової кислоти, поліетиленгліколю 1450, триетилцитрату та двоокису кремнію, причому вказаний співполімерметакрилової кислоти складає близько 66 вагових відсотків маси вологостійкого шару в сухому стані, вказані поліетиленгліколь 1450 та триетилцитрат складають близько 10 вагових відсотків маси вологостійкого шару в сухому стані у пропорції: 1 частина триетилцитрату до 2 частин поліетиленгліколю 1450, та вказаний двоокис кремнію складає близько 25 вагових відсотків маси вологостійкого шару в сухому стані, причому кількість нанесеного вказаного вологостійкого шару складає не більше ніж близько 2,5 % маси таблетки в сухому стані.
48. Склад таблетки з модифікованим вивільненням за пунктом 1:(i) ядро, яке містить ефективну дозу бупропіону гідрохлориду та звичайні допоміжні речовини;
(ii) оболонка, що контролює вивільнення та оточує вказане ядро, причому вказана оболонка, що контролює вивільнення, складається з водонерозчинного, водопроникного, плівкоутворюючого полімеру, пластифікатора та водорозчинного полімеру; та
(iii) вологостійкий шар, який оточує вказану оболонку, що контролює вивільнення, причому вказаний вологостійкий шар складається з співполімеру метакрилової кислоти, поліетиленгліколю 1450, триетилцитрату та двоокису кремнію, причому вказаний співполімер метакрилової кислоти складає близько 66 вагових відсотків маси вологостійкого шару в сухому стані, вказані поліетиленгліколь 1450 та триетилцитрат складають близько 10 вагових відсотків маси вологостійкого шару в сухому стані у пропорції: 1 частина триетилцитрату до 2 частин поліетиленгліколю 1450, та вказаний двоокис кремнію складає близько 25 вагових відсотків маси вологостійкого шару в сухому стані.
49. Склад таблетки з модифікованим вивільненням за пунктом 1:(i) ядро, яке містить близько 150 мг бупропіону гідрохлориду, близько 5,3 мг полівініловий спирту, близько 4,7 мг гліцерилбегенату;
(ii) оболонка, що контролює вивільнення та оточує вказане ядро, причому вказана оболонка, що контролює вивільнення, складається з близько 12 мг етилцелюлози сорту PR 100, близько 3 мг поліетиленгліколю 1450 та близько 9 мг полівінілпіролідону, причому близько 24 мг оболонки, що контролює вивільнення, наноситься на вказане ядро; та
(iii) вологостійкий шар, який оточує вказану оболонку, що контролює вивільнення, причому вказаний вологостійкий шар складається з близько 4,6 мг співполімеру метакрилової кислоти, близько 0,46 мг поліетиленгліколю 1450, близько 0,23 мг триетилцитрату та близько 1,72 мг двоокису кремнію, причому близько 7 мг вологостійкого шару наноситься на ядра, які покриті оболонкою, що контролює вивільнення, та
причому вказана таблетка з модифікованим вивільненням є біоеквівалентом таблеток Wellbutrin® чи Zyban®/Wellbutrin® SR на добу, при прийомі однієї дози вказаної таблетки з модифікованим вивільненням пацієнтом, який потребує такого прийому, та склад вказаної таблетки з модифікованим вивільненням представляє такий розчинний профіль, що після близько 2 годин вивільнюється близько 5 % вмісту бупропіону гідрохлориду, після близько 4 годин вивільнюється близько 32 % вмісту бупропіону гідрохлориду, після близько 8 годин вивільнюється близько 74 % вмісту бупропіону гідрохлориду та після близько 16 годин вивільнюється не менше ніж близько 99 % вмісту бупропіону, при 0,1N розчину HCl при 75 об/хв. та температурі 37 °C.
50. Склад таблетки з модифікованим вивільненням за пунктом 1:(i) ядро, яке містить близько 300 мг бупропіону гідрохлориду, близько 10,6 мг полівінілового спирту, близько 9,4 мг гліцерилбегенату;
(ii) оболонка, що контролює вивільнення та оточує вказане ядро, причому вказана оболонка, що контролює вивільнення, складається з близько 13,1 мг етилцелюлози сорту PR 100, близько 3,6 мг поліетиленгліколю 1450 та близько 12,4 мг полівінілпіролідону, причому близько 29 мг оболонки, що контролює вивільнення, наноситься на вказане ядро; та
(iii) вологостійкий шар, який оточує вказану оболонку, що контролює вивільнення, причому вказаний вологостійкий шар складається з близько 6,9 мг співполімеру метакрилової кислоти, близько 0,7 мг поліетиленгліколю 1450, близько 0,35 мг триетилцитрату та близько 2,6 мг двоокису кремнію, причому близько 10,5 мг вологостійкого шару наноситься на ядра, які покриті оболонкою, що контролює вивільнення, та
причому вказана таблетка з модифікованим вивільненням є біоеквівалентом таблеток Wellbutrin® чи Zyban®/Wellbutrin® SR на добу при прийомі однієї дози вказаної таблетки з модифікованим вивільненням пацієнтом, який потребує такого прийому, та склад вказаної таблетки з модифікованим вивільненням представляє такий розчинний профіль, що після близько 2 годин вивільнюється близько 5 % вмісту бупропіону гідрохлориду, після близько 4 годин вивільнюється близько 32 % вмісту бупропіону гідрохлориду, після близько 8 годин вивільнюється близько 74 % вмісту бупропіону гідрохлориду та після близько 16 годин вивільнюється не менше ніж близько 99 % вмісту бупропіону гідрохлориду у 900 мл 0,1N розчину HCl при 75 об/хв. та температурі 37 °C.
51. Спосіб лікування депресії у пацієнта, що потребує такого лікування, який включає призначення пацієнтові таблеток з модифікованим вивільненням за будь-яким пунктом з 1-50.52. Спосіб за п. 51, при якому вказана таблетка з модифікованим вивільненням містить дозу у 300 мг.53. Спосіб за п. 51, при якому вказана таблетка з модифікованим вивільненням містить дозу у 150 мг.Текст
1. Таблетка з модифікованим вивільненням, яка складається з: (i) ядра, яке складається з ефективної дози фармацевтично прийнятної солі бупропіону та звичайних допоміжних речовин; (ii) першої оболонки, що контролює вивільнення та оточує вказане ядро, причому згадана оболонка, що контролює вивільнення, складається з водонерозчинного, водопроникного, плівкоутворюючого полімеру та водорозчинного полімеру, причому співвідношення водонерозчинного, водопроникного, плівкоутворюючого полімеру до водорозчинного полімеру становить від 3:4 до 5:3; та (iii) вологостійкого шару, який оточує вказану першу оболонку, що контролює вивільнення, причому згаданий вологостійкий шар складається з ентеросолюбільного полімеру і посилювача проникнення, та може містити пластифікатор, та в якому посилювач проникнення складає від 20 % до 40 % вологостійкого шару в сухому стані; причому вказана таблетка з модифікованим вивільненням є біоеквівалентом таблеток Wellbutrin® чи Zyban®/Wellbutrin® SR на добу при прийомі однієї дози вказаної таблетки з модифікованим вивільненням пацієнтом, який потребує такого прийому. 2. Таблетка з модифікованим вивільненням за пунктом 1, причому більше ніж 10 % фармацевтично прийнятної солі бупропіону вивільнюється протягом 2 годин у 0,1N розчині HCl при 75 об/хв. чи не менше ніж 75 % фармацевтично прийнятної солі бупропіону вивільнюється протягом 45 хвилин у буфері pH 6.8. 3. Таблетка з модифікованим вивільненням за пунктом 1 чи 2, причому згадана таблетка з моди 2 (19) 1 3 розчинний, водопроникний, плівкоутворюючий полімер складає від близько 35 до близько 60 вагових відсотків маси вказаної оболонки, що контролює вивільнення, в сухому стані. 13. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-12, в якій вказаний водонерозчинний, водопроникний, плівкоутворюючий полімер вибирається з групи, яка містить прості ефіри целюлози, складні ефіри целюлози, полівініловий спирт та будь-яку їх комбінацію. 14. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-13, в якій вказаний пластифікатор складає від близько 6 до близько 30 вагових відсотків вказаної оболонки, що контролює вивільнення, в сухому стані. 15. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-14, в якій вказаний пластифікатор вибирається з групи, яка містить поліоли, органічні складні ефіри, олії/гліцериди та будь-яку їх комбінацію. 16. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-15, в якій вказаний водорозчинний полімер складає від близько 25 до близько 50 вагових відсотків вказаної оболонки, що контролює вивільнення, в сухому стані. 17. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-16, в якій вказаний водорозчинний полімер вибирається з групи, яка містить полівінілпіролідон, гідроксипропілметилцелюлозу, гідроксипропілцелюлозу та будь-яку їх комбінацію. 18. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-17, в якій співвідношення водонерозчинний, водопроникний, плівкоутворюючий полімер: пластифікатор: водорозчинний полімер становить від 3:1:4 до 5:1:3. 19. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-17, в якій співвідношення водонерозчинний, водопроникний, плівкоутворюючий полімер: пластифікатор: водорозчинний полімер становить від 7:2:6 до 19:5:18. 20. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-19, в якій приріст ваги після нанесення оболонки, що контролює вивільнення, складає від близько 3 % до близько 30 % ваги ядра в сухому стані. 21. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-20, де кількість вказаного ентеросолюбільного полімеру складає від 30 % до 90 % маси вологостійкого шару в сухому стані. 22. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-21, яка складається з близько 150 мг вказаної фармацевтично прийнятної солі бупропіону, та кількість вказаного ентеросолюбільного полімеру коливається від 1 % до 3 % маси таблетки в сухому стані та складає від 55 % до 70 % маси вологостійкого шару в сухому стані. 23. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-21, яка складається з близько 300 мг вказаної фармацевтично прийнятної солі бупропіону, та кількість вказаного ентеросолюбільного полімеру коливається від 1,5 % до 3,0 % маси таблетки в сухому стані та складає від 30 % до 90 % маси вологостійкого шару в сухому стані. 89168 4 24. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-23, в якій ентеросолюбільним полімером є акриловий полімер. 25. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-24, в якій вказаний пластифікатор складає від близько 1 до близько 30 вагових відсотків маси вологостійкого шару в сухому стані. 26. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-25, в якій вказаний посилювач проникнення складає близько 25 вагових відсотків маси вологостійкого шару в сухому стані. 27. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-26, в якій вказаний посилювач проникнення вибирається з групи, яка містить двоокис кремнію, колоїдний силікон, лактозу, гідрофільні полімери, хлористий натрій, окис алюмінію, колоїдний окис алюмінію, окис кремнію, мікрокристалічну целюлозу та будь-яку їх комбінацію. 28. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-27, яка складається із вказаних ентеросолюбільного полімеру, пластифікатора та посилювача проникнення, що співвідносяться як 13:2:5. 29. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-28, в якій нанесення вологостійкого шару на таблетку приводить до загального приросту ваги не більше ніж близько 6 % у відношенні до маси таблетки у сухому стані. 30. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-29, причому згадана таблетка з модифікованим вивільненням натщесерце забезпечує Cmax бупропіону у плазмі крові протягом від близько 3 годин до близько 8 годин (Tmax) після прийому таблетки з модифікованим вивільненням. 31. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-30, причому вказана таблетка з модифікованим вивільненням забезпечує Cmax бупропіону від близько 60 нг/мл до близько 280 нг/мл у плазмі крові протягом близько 5 годин (Tmax) після прийому натщесерце один раз на добу 300 мг дози вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням або один раз на добу 2 х 150 мг дози вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням. 32. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-31, причому вказана таблетка з модифікованим вивільненням натщесерце представляє AUC(0-t) для бупропіону від близько 840 нг·год./мл до близько 2850 нг·год./мл після прийому натщесерце один раз на добу 300 мг дози вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням або один раз на добу 2 х 150 мг дози вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням. 33. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-32, причому вказана таблетка з модифікованим вивільненням представляє AUC(0-inf) для бупропіону від близько 840 нг.·год./мл до близько 3000 нг.·год./мл після прийому натщесерце один раз на добу 300 мг дози вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням або один раз на добу 2 х 150 мг дози 5 вказаної таблетки бупропіону гідрохлориду з модифікованим вивільненням. 34. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-33, яка при прийомі однієї дози бупропіону пацієнтом, який потребує такого прийому, забезпечує Cmax бупропіону від близько 60 нг/мл до близько 280 нг/мл протягом від близько 3 годин до близько 8 годин (Tmax) та AUC(0-t) для бупропіону коливається від близько 800 нг.·год./мл до 2850 нг.·год./мл. 35. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-34, причому вказана таблетка з модифікованим вивільненням при прийомі 300 мг дози один раз на добу або 2 х 150 мг дози один раз на добу пацієнтом, який потребує такого прийому, натщесерце є біоеквівалентом таблеткам Wellbutrin® чи Zyban®/Wellbutrin® SR на добу. 36. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-35, причому вказана таблетка з модифікованим вивільненням при прийомі 2 х 150 мг дози один раз на добу або 300 мг дози один раз на добу пацієнтом, який потребує такого прийому, є біоеквівалентом таблеткам Wellbutrin® чи Zyban®/Wellbutrin® SR на добу та не впливає на ефект їжі. 37. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-36, причому вказана таблетка з модифікованим вивільненням є біоеквівалентом таблеткам Wellbutrin® чи Zyban®/Wellbutrin® SR за добу, при одноразовій дозі вказаної таблетки з модифікованим вивільненням при прийомі пацієнтом, який потребує такого прийому, натщесерце та після їжі. 38. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-37, причому вказана таблетка з модифікованим вивільненням при прийомі 300 мг дози один раз на добу пацієнтом, який потребує такого прийому, натщесерце є біоеквівалентом таблеткам Wellbutrin ®, які приймаються 1 х 300 мг тричі на добу у стаціонарному режимі. 39. Таблетка з модифікованим вивільненням за будь-яким пунктом з 1-38, причому вказана таблетка з модифікованим вивільненням при прийомі 300 мг дози один раз на добу пацієнтом, який потребує такого прийому, натщесерце є біоеквівалентом таблеткам Zyban®, які приймаються 1 x 150 мг двічі на добу у стаціонарному режимі. 40. Таблетка з модифікованим вивільненням за пунктами 1-39, причому вміст вологи складає не більше ніж близько 0,4 % у вказаній таблетці з модифікованим вивільненням після близько 10 діб зберігання у відкритій чашці при температурі 40 °C ± 2 °C та відносній вологості 75 % ± 5 %. 41. Таблетка з модифікованим вивільненням за пунктами 1-40, причому вміст вологи вказаної таблетки з модифікованим вивільненням складає не більше ніж близько 1 % у вказаній таблетці після близько 6 місяців зберігання при температурі 40 °C ± 2 °C та відносній вологості 75 % ± 5 %. 42. Таблетка з модифікованим вивільненням за пунктами 1-41, причому вказана таблетка містить принаймні близько 95 % бупропіону гідрохлориду номінальної якості після зберігання протягом 12 місяців при температурі 25 °C ± 2 °C та відносній вологості 60 % ± 5 %. 89168 6 43. Таблетка з модифікованим вивільненням за пунктами 1-42, причому вказана таблетка містить принаймні близько 95% бупропіону гідрохлориду номінальної якості після зберігання протягом 18 місяців при температурі 25 °C ± 2 °C та відносній вологості 60 % ± 5 %. 44. Таблетка з модифікованим вивільненням за пунктами 1-43, причому вказана таблетка містить 150 мг бупропіону гідрохлориду. 45. Таблетка з модифікованим вивільненням за пунктами 1-43, причому вказана таблетка містить 300 мг бупропіону гідрохлориду. 46. Таблетка з модифікованим вивільненням за пунктами 1-45, яка не впливає на ефект їжі. 47. Склад таблетки з модифікованим вивільненням за пунктом 1: (i) ядро, яке містить ефективну дозу бупропіону гідрохлориду, полівінілового спирту, гліцерилбегенату, причому вказаний бупропіон гідрохлорид складає принаймні близько 94 вагових відсотків маси ядра в сухому стані, вказаний полівініловий спирт складає близько 3 вагових відсотків маси ядра в сухому стані та вказаний гліцерилбегенат складає близько 3 вагових відсотків маси ядра в сухому стані; (ii) оболонка, що контролює вивільнення та повністю щільно покриває вказане ядро, причому вказана оболонка, що контролює вивільнення, складається з етилцелюлози сорту PR 100, поліетиленгліколю 1450 та полівінілпіролідону, причому вказана етилцелюлоза сорту PR 100 складає від близько 45 до близько 50 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані, вказаний поліетиленгліколь 1450 складає близько 12 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані, та вказаний полівінілпіролідон складає від близько 25 до близько 50 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані, причому кількість нанесеної вказаної оболонки, що контролює вивільнення, складає від близько 9 до близько 15 вагових відсотків маси ядра таблетки в сухому стані; та (iii) вологостійкий шар, який оточує вказану оболонку, що контролює вивільнення, причому вказаний вологостійкий шар складається з співполімеру метакрилової кислоти, поліетиленгліколю 1450, триетилцитрату та двоокису кремнію, причому вказаний співполімер метакрилової кислоти складає близько 66 вагових відсотків маси вологостійкого шару в сухому стані, вказані поліетиленгліколь 1450 та триетилцитрат складають близько 10 вагових відсотків маси вологостійкого шару в сухому стані у пропорції: 1 частина триетилцитрату до 2 частин поліетиленгліколю 1450, та вказаний двоокис кремнію складає близько 25 вагових відсотків маси вологостійкого шару в сухому стані, причому кількість нанесеного вказаного вологостійкого шару складає не більше ніж близько 2,5 % маси таблетки в сухому стані. 48. Склад таблетки з модифікованим вивільненням за пунктом 1: (i) ядро, яке містить ефективну дозу бупропіону гідрохлориду та звичайні допоміжні речовини; 7 89168 8 (ii) оболонка, що контролює вивільнення та оточує вказане ядро, причому вказана оболонка, що контролює вивільнення, складається з водонерозчинного, водопроникного, плівкоутворюючого полімеру, пластифікатора та водорозчинного полімеру; та (iii) вологостійкий шар, який оточує вказану оболонку, що контролює вивільнення, причому вказаний вологостійкий шар складається з співполімеру метакрилової кислоти, поліетиленгліколю 1450, триетилцитрату та двоокису кремнію, причому вказаний співполімер метакрилової кислоти складає близько 66 вагових відсотків маси вологостійкого шару в сухому стані, вказані поліетиленгліколь 1450 та триетилцитрат складають близько 10 вагових відсотків маси вологостійкого шару в сухому стані у пропорції: 1 частина триетилцитрату до 2 частин поліетиленгліколю 1450, та вказаний двоокис кремнію складає близько 25 вагових відсотків маси вологостійкого шару в сухому стані. 49. Склад таблетки з модифікованим вивільненням за пунктом 1: (i) ядро, яке містить близько 150 мг бупропіону гідрохлориду, близько 5,3 мг полівініловий спирту, близько 4,7 мг гліцерилбегенату; (ii) оболонка, що контролює вивільнення та оточує вказане ядро, причому вказана оболонка, що контролює вивільнення, складається з близько 12 мг етилцелюлози сорту PR 100, близько 3 мг поліетиленгліколю 1450 та близько 9 мг полівінілпіролідону, причому близько 24 мг оболонки, що контролює вивільнення, наноситься на вказане ядро; та (iii) вологостійкий шар, який оточує вказану оболонку, що контролює вивільнення, причому вказаний вологостійкий шар складається з близько 4,6 мг співполімеру метакрилової кислоти, близько 0,46 мг поліетиленгліколю 1450, близько 0,23 мг триетилцитрату та близько 1,72 мг двоокису кремнію, причому близько 7 мг вологостійкого шару наноситься на ядра, які покриті оболонкою, що контролює вивільнення, та причому вказана таблетка з модифікованим вивільненням є біоеквівалентом таблеток Wellbutrin® чи Zyban®/Wellbutrin® SR на добу, при прийомі однієї дози вказаної таблетки з модифікованим вивільненням пацієнтом, який потребує такого прийому, та склад вказаної таблетки з модифікованим вивільненням представляє такий розчинний профіль, що після близько 2 годин вивільнюється близько 5 % вмісту бупропіону гідрохлориду, після близько 4 годин вивільнюється близько 32 % вмісту бупропіону гідрохлориду, після близько 8 годин вивільнюється близько 74 % вмісту бупропіону гідрохлориду та після близько 16 годин вивільнюється не менше ніж близько 99 % вмісту бупропіону, при 0,1N розчину HCl при 75 об/хв. та температурі 37 °C. 50. Склад таблетки з модифікованим вивільненням за пунктом 1: (i) ядро, яке містить близько 300 мг бупропіону гідрохлориду, близько 10,6 мг полівінілового спирту, близько 9,4 мг гліцерилбегенату; (ii) оболонка, що контролює вивільнення та оточує вказане ядро, причому вказана оболонка, що контролює вивільнення, складається з близько 13,1 мг етилцелюлози сорту PR 100, близько 3,6 мг поліетиленгліколю 1450 та близько 12,4 мг полівінілпіролідону, причому близько 29 мг оболонки, що контролює вивільнення, наноситься на вказане ядро; та (iii) вологостійкий шар, який оточує вказану оболонку, що контролює вивільнення, причому вказаний вологостійкий шар складається з близько 6,9 мг співполімеру метакрилової кислоти, близько 0,7 мг поліетиленгліколю 1450, близько 0,35 мг триетилцитрату та близько 2,6 мг двоокису кремнію, причому близько 10,5 мг вологостійкого шару наноситься на ядра, які покриті оболонкою, що контролює вивільнення, та причому вказана таблетка з модифікованим вивільненням є біоеквівалентом таблеток Wellbutrin® чи Zyban®/Wellbutrin® SR на добу при прийомі однієї дози вказаної таблетки з модифікованим вивільненням пацієнтом, який потребує такого прийому, та склад вказаної таблетки з модифікованим вивільненням представляє такий розчинний профіль, що після близько 2 годин вивільнюється близько 5 % вмісту бупропіону гідрохлориду, після близько 4 годин вивільнюється близько 32 % вмісту бупропіону гідрохлориду, після близько 8 годин вивільнюється близько 74 % вмісту бупропіону гідрохлориду та після близько 16 годин вивільнюється не менше ніж близько 99 % вмісту бупропіону гідрохлориду у 900 мл 0,1N розчину HCl при 75 об/хв. та температурі 37 °C. 51. Спосіб лікування депресії у пацієнта, що потребує такого лікування, який включає призначення пацієнтові таблеток з модифікованим вивільненням за будь-яким пунктом з 1-50. 52. Спосіб за п. 51, при якому вказана таблетка з модифікованим вивільненням містить дозу у 300 мг. 53. Спосіб за п. 51, при якому вказана таблетка з модифікованим вивільненням містить дозу у 150 мг. Цей винахід відноситься до таблетки з модифікованим вивільненням, яка складаєтеся з фармацевтично прийнятних солей бупропіону, переважно бупропіон гідрохлориду. Бупропіон - це антидепресант, який є хімічно неспорідненим з трициклічними, чотирициклічними інгібіторами вибіркового поглинання серотоніну (ІВПС), або іншими відомими антидепресивними агентами. Цей лікарський засіб є подібним до психічного стимулятора з точки зору його нейрохімічного та поведінкового профілів в організмі, але він гарантовано не викликає стимулятивних ефектів у 9 людини в клінічно призначених дозах. Його структура дуже нагадує структуру діетілпропіону і відноситься до фенілетіламинів. Його визначено як (±)-1-(3-хлорофініл)-2-[(1,1-діметілетіл)аміно]-1пропанон гідрохлорид та має непатентоване найменування - амфебутамон гідрохлорид. Бупропіон гідрохлорид серійно виробляється у формі з миттєвим вивільненням (Wellbutrin®) та у формі з уповільненим вивільненням (Wellbutrin® SR та Zyban®). Wellbutrin® SR та Zyban® є хімічно та фармацевтично ідентичними. Нейрохімічний механізм антидепресантної дії бупропіону є не достатньо вивченим. Бупропіон не призупиняє моноаміноксидази. Бупропіон впливає на хімічні речовини всередині мозку, які нерви використовують для посилання повідомлень один одномуч Ці хімічні посильні називаються нейротрансмітерами. Нейротрансмітери, які виділяються нервами, знов поглинаються нервами, які випускають їх для повторного використання (надалі повторне поглинання). Вважається, що депресія спричиняється завдяки порушенню рівноваги між кількістю нейротрансмітерів, які випускаються. Вважається, що бупропіон працює шляхом призупинення повторного поглинання нейротрансмітерів допаміну, серотоніну та норадреналіну, що є дією, яка призводить до появлення більшої кількості допаміну, серотоніну та норадреналіну, які доступні для передачі повідомлень іншим нервам. Таким чином, бупропіон є унікальним в тому, що він головним чином діє на допамін, що є дією, яка не досягається ІВПС (наприклад, пароксетин (Paxil®), флюоксетин (Prozac®), сертралин (Zoloft®)) або трициклічними антидепресантами або ТЦА (наприклад, амітриптілін (Elavil®), іміпрамін (Tofranil®), дезипрамін (Norpramin®)). Wellbutrin® та Wellbutrin® SR використовуються для керування депресією. Zyban® був схвалений в якості допоміжного засобу тим пацієнтам, які хочуть кинути курити. Wellbutrin®, який є складом бупропіону з миттєвим вивільненням, призначається три рази на добу з проміжками переважно 6 або більше годин між дозами. Для пацієнтів, якім потрібно більше ніж 300мг бупропіону на день, кожна доза не повинна перевищувати 150мг. Це потребує прийому таблеток принаймні 4 рази на добу з проміжками принаймні 4 години між дозами. Склад з миттєвим вивільненням визначається тим, що більше ніж 75% бупропіону вивільнюється у розчинне середовище протягом 45 хвилин, а одним з головних побічних ефектів бупропіону є виникнення приступів пароксизму, який частково може бути тісно пов'язаним а миттєвим вивільненням бупропіону в систему. Таким чином, були розроблені препарати з уповільненим вивільненням для уникнення приступів пароксизму. Препарати з уповільненим вивільненням призначаються двічі на добу. Взагалі, контактність хворого є проблемою, коли потребується режим багаторазового прийому ліків, та особливо це є проблематичним з особами в депресивному стані. В той час коли склади з уповільненим вивільненням спростили режим прийому та підвищили контактність хворого, все ще залишається місце для подальшого спрощення 89168 10 режиму прийому та подальшого підвищення дотримування пацієнтом режиму прийому. Розробка схваленого стабільного складу бупропіону модифікованого вивільнення для одноразового прийому було б кроком вперед. Таблетки бупропіону з формою уповільненого вивільнення були описані раніше. Патент США №4.687.660 розкриває таблетку, яка включає ядро та оболонку, причому, ядро складається з бупропІон гідрохлориду разом з допоміжною(-ими) речовиною(-ами) та додатково, але необов'язково з речовиною, яка підвищує осмотичний тиск крові, а оболонка складається з водонерозчинного, водопроникного, плівкоутворюючого полімеру (такого як ацетат целюлози), пороутворюючої речовини (такої як невідчутна лактоза та карбонат натрію) та додатково, але необов'язково з так званого водопроникного посилюючого агенту (такого як поліетилен гліколь) та крім того, додатково, але необов'язково, з пластифікатору. Патенти США №№5.358.970 та 5.427.798 описують склад бупропіон гідрохлориду з уповільненим вивільненням на основі матричної технології. Термін матриця відноситься до таблетки, в якій лікарський засіб заливається у допоміжну речовину, що створює суцільне ядро, яке називається матрицею. Дифузія лікарського засобу відбувається через це ядро. Оскільки бупропіон гідрохлорид є нестабільним, продукт, описаний у двох попередніх патентах, потребує стабілізатора для забезпечення достатньої стабільності. Таким стабілізатором є кисле сполучення, переважно це цистеіновий гідрохлорид. Основним недоліком матричних систем є те, що вони зазвичай демонструють профіль вивільнення першого порядку. Тобто, спочатку будуть розчинятися часточки лікарського засобу, які знаходяться на поверхні таблетки, і лікарський засіб буде швидко вивільнюватись. Після цього часточки лікарського засобу, які знаходяться на відстанях, які поступово збільшуються від поверхні таблетки, будуть розчинятися та вивільнюватись шляхом дифузії у порах в напрямку зовнішньої поверхні таблетки. Таким чином, дифузійна довжина лікарського засобу буде збільшуватись по мірі продовження процесу вивільнення. Зазвичай, вважається за краще, якщо досягається профіль вивільнення нульового або близько нульового порядку ніж профіль вивільнення першого порядку. Система нульового порядку вивільнення забезпечує постійну швидкість вивільнення лікарського засобу протягом певного періоду часу. Головним чином вона використовується для лікарських засобів, які мають короткі полуперіоди, з тим щоб постійні рівні сполучень активних лікарських засобів у крові могли підтримуватись меншою кількістю доз. Патент США №6.589.553 та Міжнародна Публікація №WO 02/062299 цілеспрямовано описують склад капсули для одноразового прийому на добу з двома популяціями пігулок вкритих оболонкою, кожна з яких вивільнює бупропіон гідрохлорид при різних рівнях рН. Одна популяція пігулок покрита так, щоб лікарський засіб вивільнювався при рівні рН, який дорівнює приблизно 4,8 та менше. Вивільнення лікарського засобу з цієї популяції пігулок 11 очікується у верхньому шлунково-кишковому тракті. Інша популяція пігулок покрита оболонкою так, щоб лікарський засіб вивільнювався при рівні рН, який становить 7 та вище. Вивільнення бупропіону з цієї популяції очікується у нижньому шлунковокишковому тракті. В одному з показаних прикладів відносна біологічна засвоюваність бупропіону по відношенню до Zyban® складала тільки 40% коефіцієнту Сmах та тільки 80% коефіцієнту AUC0-inf. В іншому наведеному прикладі відносна біологічна засвоюваність бупропіону по відношенню до Zyban® складала тільки 48% та 59% коефіцієнтів Сmах та AUC0-inf. В цих документах додатково описується впровадження третьої популяції активних пігулок без оболонки, які цілеспрямовано призводять до подальшої модифікації та покращення вивільнення бупропіону. Виходячи з профілю середнього часу концентрації в плазмі, який показаний на Фіг.3 та 4 цих документів, не стає очевидним те, що впровадження активних пігулок без оболонки дозволило б отримати біоеквівалентний склад для одноразового прийому на добу (базовим продуктом є Zyban®). Також, жодний з цих двох документів не надає будь-яку інформацію щодо стабільності лікарського засобу. Патент США №6.033.686 описує таблетку з контрольованим вивільненням, без стабілізатора та без пороутворючої речовини, яка включає ядро, яке складається переважно з бупропіон гідрохлориду, сполучної речовини та змащувальної речовини; а також оболонку, яка складається з водонерозчинного, водопроникного, плівкоутворюючого полімеру, пластифікатора та водорозчинного полімера. Продукт, який отримано на основі патенту '686 є продуктом для дворазового прийому на добу. Патенти США №№6.096.341 та 6.143.327 обидва відносяться до складу з затриманим вивільненням бупропіон гідрохлориду. Патент '341 передбачає таблетку з контрольованим вивільненням, без стабілізатора та без пороутворючої речовини, яка включає ядро, яке складається переважно з бупропіон гідрохлориду, сполучну речовину та змащувальну речовину; а також оболонку, яка складається переважно з водонерозчинного, водопроникного, плівкоутворюючого полімеру, пластифікатору та водорозчинного полімеру. Патент '327 передбачає таблетку з контрольованим вивільненням, без стабілізатора та без пороутворючої речовини, яка включає ядро, яке складається переважно з бупропіон гідрохлориду, сполучної речовини та змащувальної речовини; та оболонку, що контролює вивільнення та складається переважно з водонерозчинного, водопроникного, плівкоутворюючого полімеру, пластифікатору та водорозчинного полімеру, та другої оболонки, яка включає переважно метакриловий 1 полімер та пластифікатор. Склад, який описано в патенті '327, проте не відповідає стандартам FDA (Federal Drug Administration)(Федерального управління по лікарським засобам) щодо біоеквівалентності (дивись Приклад 8 в цьому документі). Зараз немає жодної схваленої та наявної на ринку стабільної форми бупропіону для одноразового прийому на добу. Таким чином, є потреба у 89168 12 стабільному біоеквівалентному складі бупропіону для одноразового прийому на добу або його фармацевтично прийнятної солі. Визначення "Лікарські форми з модифікованим вивільненням" визначаються USP (United States Pharmacopoeia) (Фармакопея США) як ті, чиї характеристики часу та/або місця вивільнення лікарського засобу вибираються для того, щоб досягнути лікувальних або зручних цілей, яких не пропонують звичайні форми. Лікарська форма з продовженим вивільненням дозволяє вдвічі зменшити частість доз або покращити контактність хворого або лікувальний результат. Фармакопея США вважає, що терміни контрольоване вивільнення, пролонговане вивільнення та уповільнене вивільнення є взаємозамінними з продовженим вивільненням. Таким чином, терміни "модифіковане вивільнення", "контрольоване вивільнення", "пролонговане вивільнення", "продовжене вивільнення" та "уповільнене вивільнення" використовуються в цьому документі як взаємозамінні. Термін "фармацевтично прийнятна сіль бупропіону" включає солі, які є фізіологічно прийнятні для пацієнта. Такі солі зазвичай готуються з неорганічних кислот або основ та/або органічних кислот або основ. Приклади таких кислот та основ добре відомі спеціалістам. Пропонується використання бупропіон гідрохлориду, хоча використання інших фармацевтияно прийнятних солей є в межах та в обсягу винаходу. Термін "ефективна доза", який використано в цьому документі, означає "фармацевтично ефективну дозу". "Фармацевтично ефективна доза" - це доза або кількість фармацевтично прийнятної солі бупропіону, якої достатньо, щоб викликати відчутну біологічну реакцію при прийомі пацієнтом. Очевидно, що точна лікувальна доза буде залежати від віку та стану пацієнта, а також від причини стану, який потрібно лікувати, та буде визначатись виключно за розсудом лікаря. Термін "вологостійкій шар", який використано в цьому документі, - це такий шар, який запобігає або затримує абсорбцію вологи. Відомо, що бупропіон гідрохлорид є дуже гігроскопічним, і тому відносно нестабільним та схильним з часом до декомпозиції, особливо в умовах високої вологості. Пропорція компонентів вологостійкого шару та кількість вологостійкого шару, яка наноситься на оболонку, що контролює вивільнення, є такими, що цей вологостійкий шар не співпадає з визначенням та вимогами Фармакопеї США до ентеросолюбільної оболонки. Переважно вологостійкий шар складається з ентеросолюбільного та/або акрилового полімеру, переважно акрилового полімеру, додатково, але необов'язково пластифікатора та посилювача проникнення. Посилювач проникнення - це гідрофільна речовина, яка дозволяє воді проникати без фізичного розриву оболонки. Вологостійкий шар може додатково вміщувати інші звичайні інертні допоміжні речовини, які можуть покращити обробку складу з модифікованим вивільненням, який описано в цьому документі. Термін "сумарні домішки", використаний в цьому документі - це всі продукти розпаду, які ви 13 никають після розпаду бупропіон гідрохлориду. "Продукти розпаду" включають ті, що вказані на сторінці 281 26-го видання Фармакопеї США, та будь-які інші продукти розпаду, які можуть з'явитись як піки на хроматограмі під час аналізу. Таблетки з модифікованим вивільненням, відповідно до цього винаходу, є біоеквівалентами таблеток Wellbutrin® або Zyban®/Wellbutrin®SR. Термін "біоеквівалентний" означає відсутність значної різниці у швидкості та мірі, в якій активний інгредієнт або активна частина в фармацевтичних еквівалентах або фармацевтичних альтернативах вивільнюється в місці дії лікарського засобу при прийомі однакової молярної дози та за однакових умов проведення належним чином розробленого дослідження. Там де є суттєва різниця у швидкості (наприклад, в окремих лікарських формах з продовженим вивільненням), окремі фармацевтичні еквіваленти або альтернативи можуть вважатися біоеквівалентами, якщо немає значної різниці у мірі, в якій активний інгредієнт або частина ι від кожного продукту вивільнюється в місці дії лікарського засобу. Це прийнятно тільки, якщо різниця в швидкості, з якою активний інгредієнт або частина вивільнюється в місці дії лікарського засобу, є суттєвою та відображається на запропонованій етикетці, не є важливою щодо досягнення ефективних концентрацій лікарського засобу в організмі при довгостроковому прийомі та вважається незначною з медичної точки зору для цього лікарського засобу. Ціллю запропонованого винаходу є таблетка з модифікованим вивільненням, яка складається з фармацевтично прийнятної солі бупропіону, переважно бупропіон гідрохлориду. Перевагою таблеток з модифікованим вивільненням, відповідно до цього винаходу, яка не досягається наявними на ринку таблетками-прототипами Wellbutrin® або Zyban®/Wellbutrin® SR, є те, що таблетки з модифікованим вивільненням передбачають режим прийому один раз на добу, є біоеквівалентами наявним на ринку таблеткам-прототипам та не виявляють впливу їжі. Одним варіантом запропонованого винаходу є таблетка з модифікованим вивільненням, яка складається з (і) ядра, яке складається з ефективної дози фармацевтично прийнятної солі бупропіону, сполучної речовини та змащувальної речовини; та (іі) оболонки, що контролює вивільнення та оточує вказане ядро; та (ііі) вологостійкого шару, який оточує вказану оболонку, що контролює вивільнення; причому, таблетка з модифікованим вивільненням є біоеквівалентом та представляє такий розчинний профіль, що після близько 2 годин вивільнюється не більше, ніж 20%, переважно від близько 2% до близько 18%, більш переважно від близько 4% до близько 8% та у кращому варіанті близько 5% вмісту бупропіон гідрохлориду, після близько 4 годин вивільнюється від близько 15% до близько 45%, переважно від близько 21% до близько 37% більш переважно від близько 28% до близько 34% та у кращому варіанті близько 32% вмісту бупропіон гідрохлориду, після близько 8 годин вивільнюється від близько 40% до близько 90%, переважно від близько 60% до близько 85%, 89168 14 більш переважно від близько 68% до близько 74% та кращому випадку близько 74% вмісту бупропіон гідрохлориду, та після близько 16 годин вивільнюється не менше, ніж близько 80%, переважно не менше, ніж близько 93%, більш переважно не менше, ніж близько 96% та у кращому варіанті не менше, ніж близько 99% вмісту бупропіон гідрохлориду. В одному варіанті виконання винаходу вологостійкий шар не функціонує як ентеросолюбільна оболонка, як визначається тестом Фармакопеї США, який вимагає, щоб при поміщенні таблетки з шаром ентеросолюбільного покриття у 0.1N НСІ на одну годину загальна кількість лікарського засобу не перевищувала 10%, та не менше, ніж 75% лікарського засобу вивільнювалось протягом 45 хвилин у буферний розчин рН6.8. В одному варіанті виконання винаходу фармацевтично прийнятна сіль бупропіону складає принаймні близько 94 вагових відсотка маси ядра в сухому стані. Переважно, таблетка з модифікованим вивільненням, відповідно до цього винаходу, містить від близько 50мг до близько 450мг бупропіон гідрохлориду. У кращому варіанті, таблетки, відповідно до цього винаходу, містять близько 150мг або 300мг бупропіон гідрохлориду. В іншому варіанті виконання винаходу кількість сполучної речовини складає переважно від близько 1 до близько 6 та більш переважно близько 3 вагових відсотків маси ядра в сухому стані. Сполучна речовина - це переважно полівініловий спирт. В іншому варіанті виконання винаходу змащувальна речовина складає переважно від близько 1 до близько 6 та більш переважно близько 3 вагових відсотків маси ядра в сухому стані. Змащувальні речовини, придатні для таблеток, відповідно до цього винаходу, можуть вибиратись з групи, яка включає гліцерил бегенат, стеаринову кислоту, гідратовані рослинні олії та будь-яку їх комбінацію. В іншому варіанті виконання винаходу оболонка, що контролює вивільнення, складається головним чином з водонерозчинного, водопроникного, плівкоутворюючого полімеру, і його кількість може коливатись від близько 35 до близько 60 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані. Переважно, кількість водонерозчинного, водопроникного, плівкоутворюючого полімеру складає близько 50 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані для 150мг дози та близько 45 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані для 300мг дози. Водонерозчинний, водопроникний, плівкоутворюючий полімер може вибирайсь з групи, яка включає прості ефіри целюлози, складні ефіри целюлози, полівініловий спирт та будь-яку їх комбінацію. Найкращі водонерозчинні водопроникні плівкоутворюючі полімери це етилцелюлози, які можуть вибиратись з групи, яка включає етилцелфлозу сорту PR 100, етилцелюлозу сорту PR 20 та будь-яку їх комбінацію. Найкращим водонерозчйнним, водопроникним, плівкоутворюючим полімером є етилцелюлоза сорту PR 100. 15 В іншому варіанті виконання винаходу кількість пластифікатору складає від близько 6 до близько 30 та краще близько 12 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані. Пластифікатори, придатні для таблеток відповідно до цього винаходу, можуть вибиратись з групи, яка включає поліоли, органічні складні ефіри, олії/гліцериди та будь-яку їх комбінацію. Найкращим пластифікатором є полівініловий спирт 1450. В іншому варіанті виконання винаходу кількість водорозчинного полімеру може коливатись від близько 25 до близько 50 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані. Краще, якщо водорозчинний полімер складає близько 43 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані. Водорозчинний полімер може вибиратись з групи, яка включає полівінілпіролідон, гідроксипропіл метилцелюлозу, гідроксипропілцелюлозу та будьяку їх комбінацію. Найкращим водорозчинним полімером є полівінілпіролідон. В іншому варіанті виконання винаходу співвідношення між водонерозчинним, водопроникним, плівкоутворюючим полімером, пластифікатором та водорозчинним полімером для 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, може коливатись від близько 3:1:4 до близько 5:1:3, причому, найкращім співвідношенням є 4:1:3. В іншому варіанті виконання винаходу співвідношення між водонерозчинним, водопроникним, плівкоутворюючим полімером, пластифікатором та водорозчинним полімером для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, може коливатись від близько 7:2:6 до близько 19:5:18, причому, найкращим співвідношенням є 13:4:12. В іншому варіанті виконання винаходу приріст ваги після покриття ядра таблетки оболонкою, що контролює вивільнення, може коливатись від 3% до близько 30% ваги ядра таблетки в сухому стані. Для 150мг таблетки з модифікованим вивільненням, відповідно до цього винаходу, приріст ваги може коливатись від близько 13% до близько 16% ваги ядра таблетки в сухому стані, причому, найкращим приростом ваги є близько 15% ваги ядра таблетки в сухому стані. Для 300мг таблетки з модифікованим вивільненням, відповідно до цього винаходу, приріст ваги після нанесення оболонки, що контролює вивільнення, може коливатись від близько 8% до близько 10% ваги ядра таблетки в сухому стані, причому, найкращим приростом ваги є 9%. В іншому варіанті виконання винаходу вологостійкий шар складається з ентеросолюбільного та/або акрилового полімеру, пластифікатору та посилювача проникнення та має співвідношення близько 13:2:5. Ентеросолюбільний та/або акриловий полімер є переважно акриловим полімером, який в свою чергу є переважно співполімером метакрилової кислоти, який є наявним на ринку у вигляді Eudragit® L 30 D-55. Хоча кількість співполімеру метакрилової кислоти може коливатись від близько 30 до близько 90 вагових відсотків маси 89168 16 вологостійкого шару в сухому стані, найкраще, якщо кількість співполімеру метакрилової кислоти складає близько 66% маси вологостійкого шару в сухому стані. В іншому варіанті виконання винаходу пластифікатор може вибиратись з групи, яка включає поліоли, органічні складні ефіри, олії/гліцериди та будь-яку їх комбінацію. Найкращим пластифікатором для вологостійкого шару є комбінація поліолу та органічного складного ефіру. Найкращим поліолом в цієї комбінації є поліетиленгліколь 1450, причому, триетилцитрат є найкращим органічним складним ефіром. Співвідношення органічного складного ефіру до поліолу становить 1:2. Краще, якщо пластифікатор складає від близько 1 до близько 30 та найкраще близько 10 вагових відсотків маси вологостійкого шару в сухому стані. В іншому варіанті виконання винаходу посилювачем проникнення є гідрофільна речовина, яка може вибиратись з групи, яка включає двоокис кремнію, колоїдний силікон, лактозу, гідрофільні полімери, хлористий натрій, окис алюмінію, колоїдний окис алюмінію, окис кремнію, мікрокристалічну целюлозу та будь-яку їх комбінацію. Посилювачем проникнення є переважно двоокис кремнію, який складає від близько 20 до близько 40 та найкраще близько 25 вагових відсотків маси вологостійкого шару в сухому стані. В іншому варіанті виконання винаходу вологостійкий шар наноситься так, щоб приріст ваги після нанесення вологостійкого шару складав не більше, ніж близько 6% та ι краще не більше, Ніж близько 2,5% ваги таблетки в сухому стані як для 150мг так і для 300мг таблеток з модифікованим вивільненням відповідно до цього винаходу. В іншому варіанті виконання винаходу таблетка з модифікованим вивільненням, відповідно до цього винаходу, передбачає стабільний склад бупропіон гідрохлориду, такий, що принаймні близько 95% та переважно принаймні близько 97,5% та навіть 98,5% або навіть 99% бупропіон гідрохлориду залишається стабільним після близько 12 місяців зберігання при температурі 25°С±2°С/відносній вологості 60%±5%. В іншому варіанті виконання винаходу таблетка з модифікованим вивільненням, відповідно до цього винаходу, передбачає стабільний склад бупропіон гідрохлориду, такий, що принаймні близько 95% та переважно принаймні близько 97,5% та навіть 98,5% або навіть 99% бупропіон гідрохлориду залишається стабільним після 18 місяців зберігання при температурі 25°С±2°С/відносній вологості 60%±5%. В іншому варіанті виконання винаходу таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, є біоеквівалентами таблеткам Wellbutrin® або Zyban®/Wellbutrin® SR та їх ефективність не залежить від прийому їжі. В іншому варіанті виконання винаходу вологостійкий шар суттєво запобігає або затримує абсорбцію вологи всередину таблетки, таким чином підвищуючи стабільність бупропіон гідрохлориду. 17 Для більш повного розуміння винаходу нижче наводиться докладний опис з посиланням до доданих креслень, в яких: На Фіг.1А показаний графік, який зображує профіль розчинення 150мг таблеток бупропіон гідрохлориду з модифікованим вивільненням з трьома різними швидкостями вивільнення, відповідно до одного з варіантів виконання винаходу. Ha Фіг.1В показаний графік профілю розчинення 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням з трьома різними швидкостями вивільнення, відповідно до одного з варіантів виконання винаходу. На Фіг.2А показаний графік статистичного аналізу Факторів Відносного Впливу (Relative Response Factors (RRF)) скоригованого загального вмісту домішок у 150мг таблетках бупропіон гідрохлориду з модифікованим вивільненням, відповідно до одного із варіантів виконання винаходу, які зберігаються при температурі 25°С±2°С/відносній вологості 60%±5% у пляшках з поліетилену високої щільності (high-density polyethylene (HDPE)) (7ct, 40см3 та 30ct, 100см3). На Фіг.2В показаний графік статистичного аналізу Факторів Відносного Впливу (Relative Response Factors (RRF)) скоригованого загального вмісту домішок у 300мг таблетках бупропіон гідрохлориду з модифікованим вивільненням, відповідно до одного з варіантів виконання винаходу, які зберігаються при температурі 25°С±2°С/відносній вологості 60%±5% у пляшках з поліетилену високої щільності (high-density polyethylene (HDPE)) (7ct, 40см3 та 30ct, 100см3). На Фіг.3А показаний графік середніх концентрацій бупропіону в плазмі відповідно до дослідження еквівалентності активності дози після призначення 2 150мг (щоденно) та 1 300мг (щоденно) таблеток бупропіон гідрохлориду з модифікованим вивільненням, відповідно до одного з варіантів виконання винаходу. На Фіг.3В показаний графік середніх концентрацій гідроксибупропіону в плазмі відповідно до дослідження еквівалентності дозування після призначення 2 150мг (щоденно) та 1 300мг (щоденно) таблеток бупропіон гідрохлориду з модифікованим вивільненням, відповідно до одного з варіантів виконання винаходу. На Фіг.3С показаний графік середніх концентрацій бупропіон треоаміно спирту в плазмі відповідно до дослідження еквівалентності дозування після призначення 2 150мг (щоденно) та 1 300мг (щоденно) таблеток бупропіон гідрохлориду з модифікованим вивільненням, відповідно до одного з варіантів виконання винаходу. На Фіг.3D показаний графік середніх концентрацій бупропіон ерітроаміно спирту в Плазмі відповідно до дослідження еквівалентності активності дози після призначення 2 150мг (щоденно) та 1 300мг (щоденно) таблеток бупропіон гідрохлориду з модифікованим вивільненням, відповідно до одного з варіантів виконання винаходу. На Фіг.4А показаний графік впливу їжі на середні концентрації бупропіону в плазмі після призначення однієї 150мг таблетки бупропіон гідрохло 89168 18 риду з модифікованим вивільненням, відповідно до одного з варіантів виконання винаходу. На Фіг.4В показаний графік порівняння середніх концентрацій бупропіону в плазмі, які зображені на Фіг.4А, з середніми концентраціями бупропіону в плазмі після призначення однієї 150мг таблетки-прототипу Zyban®. На Фіг.4С показаний графік порівняння середніх концентрацій гідроксибупропіону в плазмі після призначення однієї 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до одного з варіантів виконання винаходу, з середніми концентраціями гідроксибупропіону в плазмі після призначення однієї 150мг таблеткипрототипу Zyban®. На Фіг.4D показаний графік порівняння середніх концентрацій бупропіон треоаміно спирту в плазмі після призначення одноразової дози 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до одного з варіантів виконання винаходу, з середніми концентраціями гідроксибупропіону в плазмі після призначення одноразової дози 150мг таблетки-прототипу Zyban®. На Фіг.4Е показаний графік порівняння середніх концентрацій бупропіон ерітроаміно спирту в плазмі після призначення одноразової дози 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до одного з варіантів виконання винаходу, з середніми концентраціями гідроксибупропіону в плазмі після призначення одноразової дози 150мг таблетки-прототипу Zyban®. На Фіг.5А показаний графік порівняння впливу їжі на середні концентрації бупропіону в плазмі для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням для одноразового прийому на добу, відповідно до одного з варіантів виконання винаходу. На Фіг.5В показаний графік порівняння впливу їжі на середні концентрації гідроксибупропіону в плазмі для 300мг таблетки бупропіон гідрохлориду з модифікованим і вивільненням для одноразового прийому на добу, відповідно до одного з варіантів виконання винаходу. На Фіг.5С показаний графік порівняння впливу їжі на середні концентрації бупропіон треоаміно спирту в плазмі для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням для одноразового прийому на добу, відповідно до одного з варіантів виконання винаходу. На Фіг.5D показаний графік порівняння впливу їжі на середні концентрації бупропіон треоаміно спирту в плазмі для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням для одноразового прийому на добу, відповідно до одного з варіантів виконання винаходу. На Фіг.6А показаний графік середніх концентрацій бупропіону в плазмі крові в стаціонарному стані після багаторазового прийому один раз на добу 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до одного з варіантів виконання винаходу, при прийомі пацієнтом натщесерце. 19 На Фіг.6В показаний графік порівняння середніх концентрацій бупропіону в плазмі крові в стаціонарному стані, як зображено на Фіг.5А, з середніми концентраціями бупропіону в плазмі в стаціонарному стані після багаторазового прийому таблетки-прототипу Wellbutrin® натщесерце. На Фіг.6С показаний графік порівняння середніх концентрацій гідроксибупропіону в плазмі крові в стаціонарному стані після багаторазового прийому 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням один раз на добу, відповідно до одного з варіантів виконання винаходу, при прийомі пацієнтом натщесерце, з середніми концентраціями гідроксибупропіону в плазмі в стаціонарному стані після багаторазового прийому таблетки-прототипу Wellbutrin® натщесерце. На Фіг.6D показаний графік порівняння середніх концентрацій бупропіон треоаміно спирту в плазмі крові в стаціонарному стані після багаторазового прийому 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням один раз на добу, відповідно до одного з варіантів виконання винаходу, при прийомі пацієнтом натщесерце, з середніми концентраціями бупропіон треоаміно спирту в плазмі в стаціонарному стані після багаторазового прийому таблетки-прототипу Wellbutrin® натщесерце. На Фіг.6Е показаний графік порівняння середніх концентрацій бупропіон ерітроаміно спирту в плазмі крові в стаціонарному стані після багаторазового прийому 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням один раз на добу, відповідно до одного з варіантів виконання винаходу, при прийомі пацієнтом натщесерце, з середніми концентраціями бупропіон ерітроаміно спирту в плазмі в стаціонарному стані після багаторазового прийому таблетки-прототипу Wellbutrin® натщесерце. На Фіг.7А показаний графік середніх концентрацій бупропіону в плазмі крові в стаціонарному стані після багаторазового прийому 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням один раз на добу, відповідно до одного з варіантів виконання винаходу, натщесерце. На Фіг.7В показаний графік порівняння середніх концентрацій бупропіону в плазмі крові в стаціонарному стані, як зображено на Фіг.7А, з середніми концентраціями бупропіону в плазмі крові в стаціонарному стані після багаторазового прийому 150мг (двічі на добу) таблеток-прототипів Zyban® натщесерце. На Фіг.7С показаний графік порівняння середніх концентрацій гідроксибупропіону в плазмі крові в стаціонарному стані після багаторазового прийому 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням один раз на добу, відповідно до одного з варіантів виконання винаходу, натщесерце, з середніми концентраціями гідроксибупропіону в плазмі крові в стаціонарному стані після багаторазового прийому 150мг (двічі на добу) таблеток-прототипів Zyban® натщесерце. На Фіг.7D показаний графік порівняння середніх концентрацій бупропіон треоаміно спирту в плазмі крові в стаціонарному стані після багаторазового прийому 300мг таблетки бупропіон гідрох 89168 20 лориду з модифікованим вивільненням один раз на добу, відповідно до одного з варіантів виконання винаходу, натщесерце, з середніми концентраціями бупропіон треоаміно спирту в плазмі крові в стаціонарному стані після багаторазового прийому 150мг (двічі на добу) таблеток-прототипів Zyban® натщесерце. На Фіг.7Е показаний графік порівняння середніх концентрацій бупропіон ерітроаміно спирту в плазмі крові в стаціонарному стані після багаторазового прийому 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням один раз на добу, відповідного одного з варіантів виконання винаходу, натщесерце, з середніми концентраціями бупропіон ерітроаміно спирту в плазмі крові в стаціонарному стані після багаторазового прийому 150мг (двічі на добу) таблеток-прототипів Zyban® натщесерце. Описаний винахід відноситься до таблетки з модифікованим вивільненням, яка має ядро, яке складається з фармацевтично прийнятної солі бупропіону та звичайних допоміжних речовин, що покриті оболонкою, що контролює вивільнення фармацевтично прийнятної солі бупропіону, а також вологостійкого шару, який обгортає оболонку, що контролює вивільнення. Таблетка з модифікованим вивільненням, відповідно до цього винаходу, є біоеквівалентом. 1. Ядро. Ядро таблетки з модифікованим вивільненням включає ефективну дозу фармацевтично прийнятної солі бупропіону, сполучну речовину та змащувальну речовину та може вміщувати звичайні інертні допоміжні речовини. Кількість активного лікарського засобу може коливатись від близько 50 до близько 90 вагових відсотків маси таблетки в сухому стані, та переважно від близько 70 до близько 90 вагових відсотків маси таблетки в сухому стані. Фармацевтично прийнятна сіль бупропіону це переважно бупропіон гідрохлорид. Таблетка складається з кількості бупропіон гідрохлориду, яка може коливатись від близько 50мг до близько 450мг. Краще, якщо таблетка складається з 150мг або 300мг бупропіон гідрохлориду. Для 150мг таблетки кількість бупропіон гідрохлориду складає близько 78 вагових відсотків маси таблетки в сухому стані. Для 300мг таблетки кількість бупропіон гідрохлориду складає близько 83 вагових відсотків маси таблетки в сухому стані. Для 150мг та 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням , відповідно до цього винаходу, кількість бупропіон гідрохлориду складає близько 94 вагових відсотків маси ядра в сухому стані для кожної з цих форм. Сполучна речовина (також іноді називається клейка речовина) додається до маси лікарського засобу та наповнювача для того, щоб забезпечити формування гранул та таблеток з потрібною механічною міцністю. Сполучні речовини можуть додаватись до складу різними шляхами: (1) як сухий порошок, який змішується з іншими інгредієнтами перед вологою агломерацією, (2) як розчин, який використовується як агломераційна рідина в процесі вологої агломерації, та називається розчинна сполучна речовина, та (3) як сухий порошок, який 21 змішується з іншими інгредієнтами перед ущільненням. В цій формі сполучна речовина називається суха сполучна речовина. Розчинні сполучні речовини взагалі вважаються найбільш ефективними, і, таким чином, є найбільш поширеним способом введення сполучної речовини в гранули. Сполучна речовина, яка використовується в цьому документі, має форму розчинної сполучної речовини. Приклади сполучних речовин, які придатні для ядра, включають (але не обмежуються ними) водорозчинні полімери, такі як модифікований крохмаль, полівінілпіролідон, похідні целюлози (такі як, наприклад, гідроксипропіл метилцелюлози (НРМС) та гідроксипропіл целюлози (НРС)) та полівініловий спирт). Кількість сполучної речовини може коливатись від близько 0,5 до близько 15 вагових відсотків маси таблетки в сухому стані, переважно від близько 1 до близько 6 вагових відсотків маси таблетки в сухому стані, та у кращому варіанті ι близько 3 вагових відсотків маси таблетки в сухому стані. Для 150мг та 300мг таблеток кількість сполучної речовини може бути переважно від близько 1 до близько 6 вагових відсотків маси кожної таблетки в сухому стані та у кращому варіанті близько 3 вагових відсотків маси кожної таблетки в сухому стані. Найкраща сполучна речовина - це полівініловий спирт. Змащувальні речовини додаються до лікувальних складів для забезпечення того, щоб формування та виштовхування таблетки здійснювалось з низьким коефіцієнтом тертя між твердою речовиною та стінкою прес-форми. Високий коефіцієнт тертя в процесі виготовлення таблеток може спричинити ряд проблем, включаючи невідповідну якість таблетки (руйнування пресованої порошкової заготівки або навіть роздрібнювання таблеток в процесі виштовхування та вертикальні подряпини на краях таблетки), та може навіть зупинити виробництво. Таким чином, змащувальні речовини додаються до майже усіх складів таблеток, включаючи склад таблетки бупропіон гідрохлориду, який описаний в цьому документі. Приклади змащувальних речовин, які придатні для ядра, включають (але не обмежуються ними) гліцерил бегенат, стеаринову кислоту, гідратовані рослинні олії (такі як гідратована бавовняна олія (Sterotex®), гідратована соєва олія (Sterotex® НМ) та гідратована соєва олія і гідратована касторова олія (Sterotex® K)), стеариновий спирт, лейцин та поліетилен гліколь (MW 4000 та вище). Змащувальна речовина - це переважно гліцерил бегенат. Кількість змащувальної речовини може коливатись від близько 1 до близько 5 вагових відсотків маси таблетки в сухому стані, краще від близько 2 до близько 3 вагових відсотків маси таблетки в сухому стані, та у кращому варіанті близько 2,5 вагових відсотків маси таблетки в сухому стані. Для 150мг та 300мг таблеток з модифікованим вивільненням, відповідна до цього винаходу, змащувальна речовина складає близько 2,5 вагових відсотків маси таблетки в сухому стані та краще від близько 1 до близько 6 вагових відсотків маси ядра в сухому стані, та у кращому варіанті близько 3 89168 22 вагових відсотків маси ядра в сухому стані для обох форм. На цьому етапі склад ядра - це склад з миттєвим вивільненням, який призводить до 100% розчинення бупропіон гідрохлориду протягом 1 години (дані не показані). В ідеальному варіанті ядро складається тільки з ефективної фармацевтичної кількості фармацевтично прийнятної солі бупропіону, сполучної речовини, краще полівінілового спирту, та змащувальної речовини, переважно гліцерил бегенату. Проте, якщо необхідно, додаткові інертні допоміжні речовини, які відповідають цілям винаходу, можуть додаватись до складу ядра. Додаткові інертні допоміжні речовини можуть додаватись для полегшення приготування та/або покращення сприйнятливості хворим останньої (кінцевої) лікарської форми бупропіон гідрохлориду з модифікованим вивільненням, як описано в цьому документі. Додаткові інертні допоміжні речовини добре відомі спеціалістам та можуть бути знайдені у відповідній літературі, наприклад, у Довіднику Лікарських Допоміжних речовин (Handbook of Pharmaceutical Excipients). Приклади таких допоміжних речовин включають (але не обмежуються ними) висушену розпилюванням лактозу, сорбіт, манніт та будь-які похідні целюлози. Найкраще, якщо гранули, які будуть стискатись для формування ядра таблетки з модифікованим вивільненням, відповідно до описаного винаходу, будуть виготовлятись за допомогою процесу мокрої грануляції. Головним чином, мокра грануляція включає перемішування порошку (активний лікарський засіб), як правило, в рідині (розчинній сполучній речовині), після якого слідує висушування. Для формування гранул, які зрештою будуть стиснуті у ядра таблеток, бупропіон гідрохлорид спочатку гранулюється, краще разом з розчинною сполучною речовиною у грануляторі, краще, але необов'язково, у грануляторі псевдорідкого шару, такому як, наприклад, гранулятор псевдорідкого шару виробництва Glatt (Німеччина) або Aeromatic (Швейцарія). Сполучна речовина, краще полівініловий спирт, спочатку розчиняється або розсіюється у придатному розчині, переважно у воді. Сполучна речовина потім напиляється зверху на лікарський засіб у грануляторі, переважно у грануляторі псевдорідкого шару. Як альтернативний варіант, грануляція може також виконуватись у звичайній мішалці або мішалці з великими зсувними зусиллями. Якщо необхідно, додаткові інертні допоміжні речовини, такі як, наприклад, наповнювач, можуть змішуватись з бупропіон гідрохлоридом перед стадією грануляції. Сформовані гранули потім висушуються та потім просіваються перед перемішуванням гранул зі змащувальною речовиною. Найкраще, якщо висушені гранули просіваються через сито з розміром вічка 1,4мм. Просіяні гранули потім перемішуються зі змащувальною речовиною та, якщо необхідно, з будь-якою іншою додатковою інертною допоміжною речовиною, яка може покращити обробку таблеток з модифікованим вивільненням, відповідно до цього винаходу. Перемішування гранул зі змащувальною речовиною та, якщо необхідно, з будь 23 якою іншою додатковою інертною речовиною, такою як, наприклад, глайдент, може виконуватись у V-блендері або будь-якому іншому придатному змішувальному пристрої. Глайденти покращують сипучість порошку. Це особливо важливо під час виготовлення таблеток при високих швидкостях виробництва та в процесі прямого стискування. Проте, через високу вимогу до відповідної сипучості, глайдент часто також додається-при грануляції перед виготовленням таблеток. Перемішані гранули потім впресовуються у таблетки і далі називаються ядра таблеток. Ядра таблеток можуть бути отримані шляхом використання стандартних технологій та обладнання, які добре відомі спеціалістам. В ідеальному варіанті, але необов'язково, ядра таблеток отримуються за допомогою роторного пресу (також називається багатостанційний прес), оснащеного придатними штампами. 2. Оболонки таблеток. Ядра таблеток покриваються оболонкою в два етапи. Оболонка, що контролює вивільнення, накладається безпосередньо на поверхню ядер таблеток та виконує функцію контролю вивільнення фармацевтично прийнятної солі бупропіону. Вологостійкий шар накладається безпосередньо на поверхню оболонки, що контролює вивільнення, для запобігання або затримування абсорбції вологи. 2.1 Оболонка, що контролює вивільнення. Оболонка, що контролює вивільнення - це напівпроникна оболонка, яка складається з водонерозчинного водопроникного, плівкоутворюючого полімеру, пластифікатору та водорозчинного полімеру. Приклади водонерозчинних, водопроникних, плівкоутворюючих полімерів, які використовуються для оболонки, що контролює вивільнення, включають (але не обмежуються ними) прості ефіри целюлози, складні ефіри целюлози, полівініловий спирт. Найкращі водонерозчинні водопроникні плівкоутворюючі полімери - це етилцелюлози, які можуть вибиратись із групи, яка включає етилцелюлозу сорту PR 100, етилцелюлозу сорту PR 20 та будь-яку їх комбінацію. Найкращим водонерозчинним, водопроникним, плівкоутворюючим полімером є етилцелюлоза сорту PR 100. Кількість водонерозчинного, водопроникного, плівкоутворюючого полімеру може коливатись від близько 1 до близько 8 вагових відсотків маси таблетки в сухому стані та краще від близько 2 до близько 6 вагових відсотків маси таблетки в сухому стані. Для 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до даного винаходу, кількість водонерозчинного, водопроникного, плівкоутворюючого полімеру може коливатись від близько 3 до близько 6 вагових відсотків маси таблетки в сухому стані. Переважно, кількість водонерозчинного, водопроникного, плівкоутворюючого полімеру складає близько 6,3 вагових відсотків маси таблетки в сухому стані. Стосовно самої оболонки, що контролює вивільнення, кількість водонерозчинного, водопроникного, плівкоутворюючого полімеру може коливатись від близько 35 до близько 60 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані. Пере 89168 24 важно, кількість водонерозчинного, водопроникного, плівкоутворюючого полімеру складає близько 50 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані. Для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, кількість водонерозчинного, водопроникного, плівкоутворюючого полімеру може коливатись від близько 2 ! до близько 5 вагових відсотків маси таблетки в сухому стані. Переважно, кількість водонерозчинного, водопроникного, плівкоутворюючого полімеру складає близько 3,6 вагових відсотків маси таблетки в сухому стані. Стосовно самої оболонки, що контролює вивільнення, кількість водонерозчинного, водопроникного, плівкоутворюючого полімеру складає близько 45 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані. Пластифікатори зазвичай додаються до складів плівкових оболонок для модифікації фізичних властивостей полімеру з метою зробити його більш придатним для використання. Кількість та вибір пластифікатору сприяють твердості таблетки та можуть навіть впливати на її характеристики розчинності або руйнування, а також її фізичну та хімічну стабільність. Однією з важливих властивостей пластифікаторів є їхня здатність робити оболонку еластичною та пружною, таким чином зменшуючи крихкість оболонки. Приклади пластифікаторів, які можуть використовуватись для оболонки, що контролює вивільнення та описана в цьому документі, включають (але не обмежуються ними) поліоли, такі як поліетилен гліколь різних молекулярних мас, органічні складні ефіри, такі як діетилфталат або триетил цитрат, та олії/гліцериди, такі як фракціонована кокосова олія або касторова олія. Кількість пластифікатору для оболонки, що контролює вивільнення, може коливатись від близько 0,5 до близько 2 вагових відсотків маси таблетки в сухому стані. Найкращим пластифікатором є поліетилен гліколь 1450. Для 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, кількість пластифікатору в оболонці, що контролює вивільнення, може коливатись від близько 1 до близько 1,5 вагових відсотків маси таблетки в сухому стані. Переважно, кількість пластифікатору складає близько 1,5 вагових відсотків маси таблетки в сухому стані. Для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, кількість пластифікатору може коливатись від близько 0,5 до близько 2 вагових відсотків маси таблетки в сухому стані. Для 150мг та 300мг лікарських форм пластифікатор складає переважно від близько 6 до близько 30 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані та, у кращому варіанті, близько 12 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані. Приклади водорозчинних полімерів, придатних для оболонки, що контролює вивільнення, включають (але не обмежуються ними) полівінілпіролідон, гідроксипропіл метилцелюлозу та гідроксипропілцелюлозу. Найкращим водорозчинним полімером є полівінілпіролідон, кількість якого може коливатись від близько 1,5 до близько 6 ваго 25 вих відсотків маси таблетки в сухому стані. Стосовно самої оболонки, що контролює вивільнення, кількість водорозчинного полімеру може коливатись від близько 25 до близько 55 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані. Для 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, кількість водорозчинного полімеру може коливатись від близько 3 до близько 5 вагових відсотків маси таблетки в сухому стані або від близько 25 до близько 50 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані. Для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, кількість водорозчинного полімеру може коливатись від близько 2 до близько 5 вагових відсотків маси таблетки в сухому стані та близько 43 вагових відсотків маси оболонки, що контролює вивільнення, в сухому стані. Співвідношення між водонерозчинним, водопроникним, плівкоутворюючим полімером, пластифікатором та водорозчинним полімером для 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до винаходу, описаного в цьому документі, може коливатись від близько 3:1:4 до близько 5:1:3. Найкращим співвідношенням є близько 4:1:3. Для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням відповідно до винаходу, описаного в цьому документі, співвідношення між водонерозчинним, водопроникним, плівкоутворюючим полімером, пластифікатором та водорозчинним полімером може коливатись від близько 7:2:6 до близько 19:5:18. Найкращим співвідношенням є близько 13:4:12. В загалі приготування та нанесення оболонки, що контролює вивільнення, здійснюється наступним чином. Водонерозчинний, водопроникний, плівкоутворюючий полімер, переважно етилцелюлоза, та пластифікатор, переважно поліетиленгліколь 1450, розчинюються у органічному розчині, такому як суміш етил спирту та ізопропіл спирту. Пластифікатор, переважно полівінілпіролідон, потім додається, поки не досягається однорідна суміш. Отриманий розчин оболонки, що контролює вивільнення, потім напилюється на ядра таблетки за допомогою машини для нанесення покриття на таблетку, гранулятора псевдорідкого шару або будь-якого іншого придатного обладнання для виготовлення Оболонки, яке добре відоме спеціалістам, поки не досягається бажаний приріст ваги. Ядра таблеток, покриті оболонкою, що контролює вивільнення, потім висушуються перед нанесенням вологостійкого шару. Спеціалістам зрозуміло, що контролюючи проникну здатність, можливо контролювати вивільнення бупропіон гидрохлориду та/або кількість оболонки, яка наноситься на ядра таблеток. Проникна здатність оболонки, що контролює вивільнення, може мінятись Шляхом змінювання співвідношення між водонерозчинним, водопроникним, плівкоутворюючим полімером, пластифікатором та водорозчинним полімером та/або розміру оболонки, яка наноситься на ядра таблеток. Більш продовжене вивільнення, як правило, досягається за допомогою більшої кількості водонерозчинного, 89168 26 водопроникного, плівкоутворюючого полімеру. Додавання інших допоміжних речовин до ядра таблетки також може змінити проникну здатність оболонки, що контролює вивільнення. Наприклад, якщо потрібно, щоб ядро таблетки додатково включало пороутворювач, кількість пластифікатору в оболонці, що контролює вивільнення, повинна бути збільшена для того, щоб зробити оболонку більш пластичною, тому що тиск, який зазнає менш пластична оболонка збоку пороутворювача, може розірвати оболонку. Крім того, співвідношення між водонерозчинним, водопроникним, плівкоутворюючим полімером та водорозчинним полімером можливо також буде необхідно змінювати в залежності від того, який - скоріший або повільніший - профіль розчинення та/або вивільнення потрібний. В залежності від заданого профілю розчинення або вивільнення в організмі приріст ваги після нанесення на ядро таблетки оболонки, що контролює вивільнення, може коливатись від близько З до близько 30 вагових відсотків маси ядра таблетки в сухому стані. Для 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, приріст ваги може коливатись від близько 13 до близько 16 вагових відсотків маси ядра таблетки в сухому стані. Найкращим є приріст ваги близько 15 вагових відсотків маси ядра таблетки в сухому стані. Для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, приріст ваги може коливатись від близько 8 до близько 10 вагових відсотків маси ядра таблетки в сухому стані. Найкращим є приріст ваги близько 9 вагових відсотків маси ядра таблетки в сухому стані. 2.2 Вологостійкий шар. Вологостійкий шар наноситься безпосередньо на оболонку, що контролює вивільнення, та складається з ентеросолюбільного та/або акрилового полімеру, посилювача проникнення та додатково, але необов'язково, пластифікатора. Ентеросолюбільним полімером є переважно акриловий полімер. Акриловим полімером є переважно співполімер метакрилової кислоти типу С [полі(метакрилова кислота, метилметакрилат) 1:1] наявний на ринку під торговою назвою Eudragit® (наприклад, Eudragit L 30 D-55). Співполімер метакрилової кислоти присутній в кількості, яка може коливатись від близько 1 до близько 3 вагових відсотків маси таблетки в сухому стані та від близько 55 до близько 70 вагових відсотків маси вологостійкого шару в сухому стані. Для 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, кількість співполімеру метакрилової кислоти може коливатись від близько 2 до близько 3 вагових відсотків маси таблетки в сухому стані. У кращому варіанті, кількість співполімеру метакрилової кислоти складає близько 2,5 вагових відсотки маси таблетки в сухому стані. Стосовно самого вологостійкого шару кількість співполімеру метакрилової кислоти переважно складає від близько 30 до близько 90 вагових відсотків маси вологостійкого шару в сухому стані та у кращому варіанті близько 66 27 вагових відсотків маси вологостійкого шару в сухому стані. Для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, кількість співполімеру метакрилової кислоти може коливатись від близько 1,5 до близько 3 вагових відсотків маси таблетки в сухому стані. Найкраще, якщо кількість співполімеру метакрилової кислоти складає близько 2 вагових відсотків маси таблетки в сухому стані. Стосовно самої оболонки кількість співполімеру метакрилової кислоти переважно складає від близько 30 до близько 90 вагових відсотків маси вологостійкого шару в сухому стані та у кращому варіанті близько 66 вагових відсотків маси вологостійкого шару в сухому стані для 300мг таблетки з модифікованим вивільненням, відповідно до цього винаходу. Спеціалістам відомо, що співполімери метакрилової кислоти мають тенденцію ставати крихкими і, таким чином, потребують пластифікатору. Приклади пластифікаторів, які придатні для оболонки, що контролює вивільнення, та описані в цьому документі, включають (але не обмежуються ними) поліоли, такі як поліетилен гліколь різних молекулярних мас, органічні складні ефіри, такі як діетил фталат або триетил цитрат, та олії/гліцериди, такі як фракціонована кокосова олія або касторова олія. Найкращий пластифікатор складається з комбінації триетил цитрату та полівінілового спирту 1450. Співвідношення між триетил цитратом та полівініловим спиртом 1450 складає близько 1:2. Пластифікатор присутній в кількості, яка може коливатись від близько 0,2 до близько 0,5 та переважно від близько 0,2 до близько 0,4 вагових відсотків маси таблетки в сухому стані. Пластифікатор складає близько 0,35 вагових відсотків маси 150мг таблетки в сухому стані та від близько 0,2 до близько 0,4 вагових відсотків маси 300мг таблетки в сухому стані. Стосовно самого вологостійкого шару пластифікатор переважно складає від близько 1 до близько 30 вагових відсотків маси вологостійкого шару в сухому стані та у кращому варіанті близько 10 вагових відсотків маси вологостійкого шару в сухому стані для 150мг та 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу. Спеціалістам добре відомо, що, в залежності від заданої головної функції, допоміжні речовини, які використовуються в таблетках, класифікуються за різними групами. Проте, одна допоміжна речовина може , впливати на властивості лікарського засобу або таблетки взагалі різними шляхами, і багато речовин, які використовуються в складах таблеток, таким чином, можуть описуватись як багатофункціональні. Таким чином, полівініловий спирт 1450, який використовується в комбінації пластифікатору для вологостійкого шару, служить не тільки для підвищення гідрофільності вологостійкого шару, а також діє як глайдент. Додатково до полівінілового спирту 1450 посилювач проникнення також діє як глайдент та також підвищує гідрофільність вологостійкого шару. Посилювач проникнення - це гідрофільна речовина та може вибиратись з групи, яка включає двоокис кремнію, колоїдний силікон, лактозу, гід 89168 28 рофільні полімери, хлористий натрій, окис алюмінію, колоїдний окис алюмінію, окис кремнію, мікрокристалічну целюлозу та будь-яку їх комбінацію. Двоокис кремнію є найкращим посилювачем проникнення. Кількість посилювача проникнення може коливатись від близько 0,5 до близько 1 вагових відсотків маси таблетки в сухому стані та складає близько 25 вагових відсотків маси вологостійкого шару в сухому стані. Для 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, кількість посилювача проникнення складає близько 0,9 вагових відсотків маси таблетки в сухому стані та від близько 20 до близько 40 та краще близько 25 вагових відсотків маси вологостійкого шару в сухому стані. Для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, кількість посилювача проникнення може коливатись від близько 0,5 до близько 1 вагових відсотків маси таблетки в сухому стані та складає переважно від близько 20 до близько 40 та переважно близько 25 вагових відсотків маси вологостійкого шару в сухому стані. Співвідношення між співполімером метакрилової кислоти, пластифікатором та посилювачем проникнення складає переважно близько 13:2:5. В загалі приготування та нанесення вологостійкого шару здійснюється наступним чином. Пластифікатор, переважно комбінація з полівінілового спирту 1450 та триетил цитрату, спочатку додається у воду, і ця суміш змішується до однорідності. Співполімер метакрилової кислоти, переважно Eudragit® L 30 D-55, потім просіюється та додається до суміші пластифікатору та змішується до однорідності. В окремій ємності посилювач проникнення, переважно двоокис кремнію, розчиняється у воді до досягнення однорідної суміші. Суміш пластифікатору та співполімеру метакрилової кислоти потім з'єднується з розчином посилювачу проникнення та змішується до однорідності. Отриманий розчин вологостійкого шару потім напилюється на ядра таблетки, які покриті оболонкою, що контролює вивільнення, за допомогою машини для нанесення покриття на таблетку, гранулятора псевдорідкого шару або будь-якого іншого придатного обладнання для виготовлення оболонки, яке добре відоме спеціалістам, доки не досягається бажаний приріст ваги. Таблетки, покриті вологостійким шаром, потім висушуються перед пакуванням. Вологостійкий шар наноситься на ядра таблеток покритих оболонкою, що контролює вивільнення, таким чином, що приріст ваги складає не більше, ніж близько 6 та переважно не більше, ніж близько 2,5 вагових відсотків маси таблетки в сухому стані для 150мг та 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу. Кількість нанесеного вологостійкого шару не робить таблетку бупропіон гідрохлориду з модифікованим вивільненням, яка описана в цьому документі, стійкою до шлункового соку та не має значного впливу на характеристики вивільнення лікарського засобу. Вологостійкий шар в цьому використанні не виконує функцію ентеросолюбільної оболонки. Хоча співполімер метакрилової кислоти, Eudragit® 29 L 30 D-55, вказується та використовується у складах ентеросолюбільної оболонки, його функціональність залежить від складу та кількості нанесеного матеріалу. Спеціалістам відомо, що ентеросолюбільна оболонка наноситься там, де лікарський засіб може бути зруйнований або дезактивований шлунковою рідиною, або там, де лікарський засіб може подразнювати слизову оболонку шлунку. Для того, щоб відповідати вимогам щодо ентеросолюбільної оболонки, тест, який описано у Фармакопеї США (метод А або В), обумовлює, що після 2 годин у кислому середовищі (0.1N НСІ) ніякі окремі показники, принаймні 6 експериментів, не перевищують 10% розчиненого активного лікарського засобу та не менше, ніж 75% розчиняється протягом 45 хвилин у рН6.8. Хоча кисле середовище не впливає негативно на бупропіон гідрохлорид, і він не подразнює слизову оболонку шлунку, вологостійкий шар не відповідає цій вимозі за наступними причинами: (1) для отримання ентеросолюбільної цілісності з плівкою, яка містить Eudragit® L 30 D-55, рекомендується, щоб приріст ваги складав від близько 6% до близько 8% за рахунок сухого полімеру на одиницю дози. Кількість твердої речовини Eudragit® L 30 D-55, нанесеної на ядра таблетки покритої оболонкою, що контролює вивільнення, складає не більше, ніж 6% та краще не більше, ніж 2,5%, (2) якщо б вимагалась ентеросолюбільна цілісність, тест на розчинність для готового продукту (тобто ядер таблетки покритих вологостійким шаром) через 2 години не обумовлював би обмеження - не більше, ніж 20%, та (3) аналітичні тести, проведені на кінцевому продукті з двома оболонками, показують, що продукт не відповідає всім вимогам тестування для продукту покритого ентеросолюбільною оболонкою, як визначено методами тестування Фармакопеї США. Оскільки вологостійкий шар наноситься безпосередньо на оболонку, що контролює вивільнення, проводились тести для визначення, чи буде вологостійкий шар, нанесений безпосередньо на ядра таблетки з миттєвим вивільненням, функціонувати як ентеросолюбільна оболонка. Тести показують, що через 1 годину більше, ніж 40% бупропіон гідрохлориду вивільнюється з ядер таблетки у 0.1N НСІ і, таким чином, не відповідає визначенню Фармакопеї США для ентеросолюбільної оболонки (дивись Приклад 2). Функціональність вологостійкого шару була також підтверджена шляхом визначення вмісту вологи за допомогою тесту Карла-Фішера (КФ) на окремо покритих оболонкою, що контролює вивільнення, та вологостійким шаром ядрах таблеток за прискорених умов (при температурі 40°С±2°С/відносній вологості 75%±5%) у відкритій скляній чашці протягом 10 діб (дивись Приклад 2). Результати показують, що вміст вологи для ядер таблеток, покритих оболонкою, що контролює вивільнення, вищий, ніж для ядер таблеток, покритих вологостійким шаром. Сумарно ці данні визначають функціональність вологостійкого шару як оболонки, яка суттєво запобігає або затримує абсорбцію вологи, та не як ι ентеросолюбільної оболонки за визначенням Фармакопеї США. 89168 30 Таблетка, відповідно до цього винаходу, передбачає пролонговане вивільнення бупропіон гідрохлориду, хоча у складі відсутня будь-яка пороутворююча речовина. Вищезгаданий склад також обумовлює стабільний склад бупропіон гідрохлориду, такий, що після близько 2 годин вивільнюється не більше, ніж 20%, краще від близько 2% до близько 18%, у кращому варіанті - від близько 4% до близько 8% та у найкращому варіанті близько 5% вмісту бупропіон гідрохлориду, після близько 4 годин вивільнюється від близько 20% до близько 45%, краще від близько 21% до близько 37%, ще краще від близько 28% до близько 34% та у найкращому варіанті близько 32% вмісту бупропіон гідрохлориду, після близько 8 годин вивільнюється від близько 40% до близько 90%, краще від близько 60% до близько 85%, ще краще від близько 68% до близько 74% та у найкращому варіанті близько 74% вмісту бупропіон гідрохлориду, та після близько 16 годин вивільнюється не менше, ніж близько 80%, краще не менше, ніж близько 93%, ще краще не менше, ніж близько 96% та у найкращому варіанті не менше, ніж близько 99% вмісту бупропіон гідрохлориду. Позитивний вплив на стабільність таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до складу, який описано в цьому документі, є очевидним у тестах, які виконувались для оцінки загальних домішок у 150мг або 300мг лікарських формах протягом 6 місяців за прискорених умов (при температурі 40°С±2°С/відносній вологості 75%±5%), а також протягом 12 місяців та 18 місяців довгострокової стабільності при температурі 25°C±2°C/відносній вологості 60%±5%. Тести на стабільність показали зменшені показники (відносно до Wellbutrin SR) загальних домішок в таблетках. У пляшках з поліетилену високої щільності об'ємом 7 ct, 40см3 та 30 ct, 100см3, для 150мг та 300мг таблеток з модифікованим вивільненням, відповідно до цього винаходу, наприклад, загальні домішки не повинні складати більше, ніж близько 2,5 вагових відсотка кількості бупропіон гідрохлориду в таблетці, краще не більше, ніж близько 1,5%, кращому випадку не більше, ніж близько 0,6% протягом принаймні 12 місяців довгострокової витримки при стабільних умовах: при температурі 25°С±2°С/відносній вологості 60%±5%. Протягом 18 місяців довгострокової стабільності при температурі 25°С±2°С/відносній вологості 60%±5% загальні домішки не повинні складати більше, ніж близько 2,5 вагових відсотка кількості бупропіон гідрохлориду в таблетці, переважно не більше, ніж близько 1,5, у кращому випадку не більше, ніж близько 0,7 вагових відсотків кількості бупропіон гідрохлориду в таблетці. Таким чином, таблетка бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу,містить принаймні близько 95% вагового співвідношення та більш переважно принаймні 98% або навіть принаймні 99% бупропіон гідрохлориду номінальної якості після зберігання протягом 12 або 18 місяців довгострокової стабільності за умов температури та вологості звичайних для аптек та шаф для ліків, тобто кімнатної температури та 35-60% вологості. 31 89168 Таким чином, фармацевтичний препарат, наприклад, таблетка, все ще буде зберігати принаймні 95% своєї ефективності та переважно принаймні 98% або навіть 99% своєї ефективності після зберігання протягом одного року при кімнатній температурі (15°-25°С) та 35-60% вологості. Наприклад, якщо таблетка спочатку при приготуванні містить 300мг бупропіон гідрохлориду (кількість відповідно до етикетки), після зберігання протягом одного року принаймні 285мг бупропіон гідрохлориду та переважно принаймні 294мг або більше буде залишатись в таблетці. Вміст вологи за методом КФ та загальна кількість домішок бупропіон гідрохлориду для 150мг таблетки, відповідно до цього винаходу, при зберіганні за прискорених умов протягом принаймні 6 місяців для пляшок з поліетилену високої щільності об'ємом 7 count, 40см3 не повинен бути більше, ніж близько 1%. Пляшки та 300мг таблетки такої ж конфігурації, які зберігаються за таких самих прискорених умов, повинні мати вміст вологи за методом КФ не більше, ніж близько 1% та загальні домішки не більше, ніж близько 0,6% протягом принаймні 6 місяців. 150мг таблетки, які зберігаються у пляшках з поліетилену високої щільності об'ємом 30 count, 100см3, повинні мати вміст вологи за методом КФ не більше, ніж близько 1% та 32 загальні домішки не більше, ніж близько 1,2% при зберіганні за прискорених умов протягом принаймні 6 місяців. 300мг таблетки, які зберігаються у такій самій конфігурації та за такими самими умовами протягом такого ж часу, повинні мати вміст вологи за методом КФ не більше, ніж близько 1% та загальні домішки не більше, ніж близько 0,8%. При зберіганні у відкритій скляній чашці вміст вологи за методом КФ для 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, не повинен бути більше, ніж близько 0,8% після 3 діб та переважно більше, ніж близько 0,45% після 10 діб зберігання за прискорених умов. При зберіганні у щільно закупорюваній скляній пляшці вміст вологи за методом КФ не повинен бути більше, ніж близько 0,45% після 3 діб та переважно більше, ніж близько 0,4% після 10 діб. Наступні приклади ілюструють цей винахід та не обмежують об'єм винаходу. Приклад 1 1. Состави таблеток з модифікованим вивільненням. Три різних состави ядра були приготовані для кожної 150мг та 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, як показано в Таблиці 1: Таблиця 1 Склад ядра Інгредієнти А (мг/%)1 150/81.1 5.3/2.86 4.7/2.54 * Бупропіон гідрохлорид Сполучна речовина2 Змащувальна речовина3 Очищена вода4 Загальна маса ядра у 160/86.48 сухому стані 150мг В (мг/%) 150/82.4 5.3/2.9 4.7/2.58 * С (мг/%) 150/79 5.3/2.8 4.7/2.46 * А' (мг/%) 300/79 10.6/2.8 9.4/2.48 * 300мг В' (мг/%) 300/87.6 10.6/3.1 9.4/2.74 * С' (мг/%) 300/83.5 10.6/2.95 9.4/2.61 * 160/87.91 160/83.77 320/84.43 320/93.47 320/89.02 1 Показники мг/% представляють пропорцію інгредієнту до маси таблетки в сухому стані Полівініловий спирт 3 Гліцерил бегенат(Compritol 888 АТО) 4 Випаровування в процесі сушки 2 Вода спочатку нагрівається до 60±5°С. Сполучна речовина (полівініловий спирт) потім розчинюється у воді до однорідності та потім просівається через сито з розміром вічка 0,7мм та охолоджується до температури не більше, ніж близько 30°С. Бупропіон гідрохлорид поміщується в камеру з верхнім розпилюванням апарату псевдорідкого шару, такого як, наприклад, апарат псевдорідкого шару Glatt GPCG1. Розчинна сполучна речовина (тобто і розчин полівінілового спирту) напилюється на бупропіон гідрохлорид з технологічними параметрами, які показані в Таблиці 2: Таблиця 2 Параметри процесу грануляції 3 Повітряний потік (м /г) Продуктивність насосу (г/хв) Температура на вході Температура на виході Тиск розпилювання (Бар) Температура продукту 2000-2500 150-250 50°С-70°С 30°С-50°С 3-5 35°С-50°С 33 89168 Після закінчення грануляції гранулам дозволяють висохнути та потім охолоджуют до температури не більше, ніж близько 35°С. Гранули бупропіон гідрохлориду потім просівають через сито з розміром вічка 1,4мм. Змащувальна речовина (гліцерил бегенат) разом з просіяними гранулами потім перемішується у V-блендері, поки суміш рівномірно не змішується. Отримана суміш пресується у ядра таблеток за допомогою обертального таблеточного пресу (Manesty Unipress) з середньою твердістю від бли 34 зько 8 скрупул до близько 25 скрупул та середньою товщиною від близько 3,9мм до близько 4,5мм для ядер 150мг таблеток та середньою твердістю від близько 12 скрупул до близько 33 скрупул та середньою товщиною від близько 4,8мм до близько 5,4мм для ядер 300мг таблеток. Ламкість ядер таблеток для обох форм складає не більше, ніж 0,8%. Ядра таблеток потім покриваються складами оболонки, що контролює вивільнення, які показані в Таблиці 3: Таблиця 3 Склад оболонки, що контролює вивільнення Інгредієнти 150мг В (мг/%) С (мг/%) А' (мг/%) 300мг В' (мг/%) С' (мг/%) 5.63/3.1 12/6.28 19/5.01 6.71/1.96 13.05/3.63 7.5/4.1 1.88/1.03 9/4.7 3/1.6 18.06/4.77 5.16/1.36 6.37/1.86 1.82/0.53 12.40/3.45 3.55/0.99 * * * * * * * * * * А 1 (мг/% ) Водонерозчинний, водопроникний, 10.26/5.55 2 плівкоутворюючий полімер 3 Водорозчинний полімер 5.64/3.05 Пластифікатор4 2.1/1.14 Денатурований етиловий спирт * 95%5 Ізопропіл Спирту 99%* , * Маса оболонки, що контролює ви18/9.73 вільнення, у сухому стані 15/8.24 24/12.56 42.22/11.14 14.9/4.35 29/8.07 1 Показники мг/% представляють співвідношення інгредієнту до маси таблетки в сухому стані Етилцелюлоза 100 (Ethocel®) 3 Полівінілріролідон (Kollidon® 90F) 4 Поліетилен Гліколь 1450(Carbowax®) 5 Випаровування в процесі сушки 2 Пластифікатор (поліетилен гліколь 1450), а потім водонерозчинний, водопроникний, плівкоутворюючий полімер (етилцелюлоза 100) додається до частки суміші денатурованого етилового спирту та ізопропіл спирту. Після змішування водорозчинний полімер поступово додається до вищезазначеної суміші для уникнення великих частинок та грудок. Розчин змішується до однорідності. Залишок денатурованого етилового спирту та ізопропіл спирту потім додається до суміші оболонки, та змішування продовжується, поки не досягається однорідний розчин. Суміш оболонки потім просівають через Гомогенізатор DeBee (розмір насадки 7, технологічний тиск: 8500±2000 фунтів на квадратний дюйм та протитиск: 1000±250 фунтів на квадратний дюйм). Гомогенізований розчин оболонки потім напилюється на ядра таблеток у (таблетуючій машині) машині для напилювання оболонки (О'Наrа 36 Side Vent) з технологічними параметрами, які показані в Таблиці 4: Таблиця 4 Технологічні параметри нанесення оболонки, що контролює вивільнення Технологічні параметри Швидкість барабану (обертів на хвилину) Температура на виході (°С) Температура на вході (°С) Швидкість розпилювання (г/хв) Тиск повітря, яке розпилюється (фунтів на квадратний дюйм) Модель тиску повітря (фунтів на квадратний дюйм) Повітряний потік (кубічні фути на хвилину) Покриття ядер таблеток розчином оболонки, що контролює вивільнення, продовжується поки не досягається приріст ваги близько 24мг (оболонка у вологому стані складає від близько 22 до близько 26мг) та приріст ваги близько 29мг (оболонка 150мг ядра таблеток 300мг ядра таблеток 5-15 5-15 25±40 25±40 300±60 30±60 160-400 160-400 30-50 30-50 20-40 20-40 800-1100 800-1100 у вологому стані складає від близько 27 до близько 31мг) для ядер 150мг та 300мг таблеток відповідно. Після отримання заданого приросту ваги нанесення оболонки зупиняється, та покриті оболонкою ядра таблеток висушуються при темпера 35 89168 турі повітря на вході близько 35±2°С з швидкістю барабану близько 2 обертів на хвилину. На висушені та охолоджені, покриті оболонкою ядра таб 36 леток потім наноситься склад вологостійкого шару, як показано в Таблиці 5: Таблиця 5 Склад вологостійкого шару Інгредієнти Співполімер метакрилової кислоти2 3 Комбінація пластифікатору (D+E) 4 Посилювач проникнення Очищена вода5 Маса вологостійкого шару в сухому стані А (мг/%)1 4.59/2.48 (D=0.46 Е=0.23) 0.69/0.38 1.72/0.93 * 150мг B С (мг/%) (мг/%) 4.59/2.52 4.59/2.40 (D=0.46 (D=0.46 Е=0.23) Е=0.23) 0.69/0.38 0.69/0.36 1.72/0.95 1.72/0.90 * * 7/3.78 7/3.85 7/3.66 А' (мг/%) 10.99/2.9 (D=1.1 Е=0.56) 1.66/0.44 4.11/1.08 * 300мг В' (мг/%) 4.88/1.42 (D=0.49 Е=0.25) 0.74/0.21 1.83/0.53 * C' (мг/%) 6.86/1.91 (D=0.69 Е=0.35) 1.04/0.29 2.57/0.71 * 16.76/4.42 7.45/2.18 10.47/2.91 1 Показники мг/% представляють співвідношення інгредієнту до маси таблетки в сухому стані полі(метакрилова кислота, метил метакрилат) 1:1 (Eudragit® L 30 D-55) 3 D=Поліетилен Гліколь 1450 (Carbowax®), Е=Триетил Цитрат 4 Двоокис кремнію (Syloid® 244) 5 Випаровування в процесі сушки 2 Комбінація пластифікатору, переважно поліетилен гліколю 1450 та триетил цитрату, спочатку розчинюється у частці очищеної води та змішується до однорідності. Під час змішування розчину пластифікатору співполімер метакрилової кислоти, переважно Eudragit® L 30 D-55, просівають через сито з розміром вічка 0,3мм в окремій ємності. Розчин пластифікатору потім додається до співполімеру метакрилової кислоти та змішується, поки не досягається однорідний розчин. Під час змішування співполімеру метакрилової кислоти/розчину пластифікатору посилювач проникнення, перева жно двоокис кремнію, розчинюється у залишку води та змішується за допомогою мішалки з великими зсувними зусиллями поки суспензія не стає однорідною. Кінцевий розчин вологостійкого шару отримується шляхом змішування розчину посилювача проникнення з сумішшю співполімеру метакрилової кислоти/пластифікатора. Гомогенізований розчин вологостійкого шару потім напилюється на ядра таблеток, покритих оболонкою, що контролює вивільнення, у барабані для нанесення оболонки з технологічними параметрами, які показані в Таблиці 6: Таблиця 6 Технологічні параметри нанесення вологостійкого шару Технологічні параметри Швидкість барабану (обертів на хвилину) Температура на виході (°С)) Температура на вході (°С) Швидкість розпилювання (г/хв) Тиск повітря, яке розпилюється (фунтів на квадратний дюйм) Модель тиску повітря (фунтів на квадратний дюйм) Повітряний потік (кубічні фути на хвилину) Вологостійкий шар наноситься, поки не досягається приріст ваги близько 7мг (оболонка таблетки у вологому стані складає від близько 6,3 до близько 7,7мг) та близько 10,5мг (оболонка таблетки у вологому стані складає від близько 9,5 до близько 11,5мг) для 150мг та 300мг таблеток з модифікованим вивільненням відповідно. Після отримання заданого приросту ваги нанесення оболонки зупиняється, і покриті оболонкою таблетки висушуються при температурі повітря на вході близько 35±2°С з швидкістю барабану близько 2 обертів на хвилину. ядра 150мг таблеток 5-15 25-40 30-60 160-400 ядра 300мг таблеток 5-15 25-40 30-60 160-400 30-50 30-50 20-40 800-1100 20-40 800-1100 На покритих оболонкою таблетках наприкінці друкується відповідне маркірування за допомогою відповідного чорного чорнила, такого, як наприклад, чорні чорнила Opacode® S-1-8090, за допомогою принтера для друкування на таблетках (Print International). Профіль розчинення для кожної з трьох 150мг та 300мг форм був визначений за наступних умов розчинення: Середовище: 900мл, 0.1N НСІ Метод: Прилад Фармакопеї США Тип І (150мг доза)/Прилад Фармакопеї США 37 89168 Тип II (300мг доза), при 75 обертів на хвилину та 37°С Результати, представлені в Таблиці 7, показують середній відсоток вивільнення від загального 38 вмісту бупропіон гідрохлориду в таблетках покритих оболонкою: Таблиця 7 Час (години) В 0 1.7 21.2 40.6 56.2 69.2 80.1 88.1 93.1 95.7 97,1 98 98.7 99 99.4 99.6 99.9 100 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 150мг С 0 0.1 4.2 19.5 35.1 49 61.4 72 80.9 88.1 92.6 95.1 96.7 97.7 98.6 99.2 99.6 99.9 А 0 0.3 6.4 17.5 28.7 39.7 49.9 56.7 68.7 77.6 84.6 89.7 92.7 94.6 95.9 96.6 97.2 97.6 Середній профіль розчинення для трьох різних 150мг та 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням, показаний на Фіг.1А та 1В відповідно. Склади С та С для лікарських форм 150мг та 300мг були відібрані для подальших тестів та виробництва. 2. Стабільність складів таблеток з модифікованим вивільненням. Ці склади не містять стабілізатора. Для визначення стабільності бупропіон гідрохлориду за відсутністю стабілізатора були проведені тести на стабільність за прискорених умов протягом 6 міся В' 0 15 33 48.5 62.5 73.5 83 90 94.5 97 98 99 99.5 100 100 100.5 100.5 100.5 100.5 101 101 101 101 101 101 300мг С' 0 1 9.5 23.5 36.5 48 58.5 67.5 75.5 82 87 90.5 93.5 95 96 96.5 97.5 98 99 99 99 100 100 99.5 100 А' 0 0.15 3.5 11.5 20 29 38 46 54 62 69.5 76.5 82.5 87 91 93.5 95 96.5 97 97.5 98.5 98.5 99 99.5 99.5 ців при температурі 40°С±2°С/відносній вологості 75%±5% та за довгострокових умов протягом 12 та 18 місяців при температурі 25°С±2°С/ та відносній вологості 60%±5%. Після закінчення визначеного терміну таблетки були проаналізовані на домішки, які є результатом розпаду бупропіон гідрохлориду після високоефективної рідинної хроматографії. Продукти розпаду включали ті, які перелічені у Фармакопеї США (26 видання, сторінка 281), та будь-які інші піки, які з'явились на хронографії. Результати тестів на стабільність за прискорених та довгострокових умов для лікарських форм 150мг та 300мг показані в Таблицях 8,9 та 10: Таблиця 8 Прискорені умови (температура 40°С±2°С/відносна вологість 75±5%) Час (місяці) Вологість 2 1 3 6 0.67 0.6 1.0 1 150мг1 Загальні Вологість 2 3 домішки 0.63 0.93 0.80 0.8 1.09 1.0 Загальні 3 домішки 0.63 0.86 1.22 Вологість 2 0.7 0.7 1.0 300мг1 Загальні Вологість 2 3 домішки 0.50 0.57 0.70 0.67 0.98 0.9 Загальні 3 домішки 0.63 0.84 1.20 Показники вологості та домішок є середніми для трьох партій Вміст вологи за методом Карла-Фішера (%) 3 Загальні домішки отримані з бупропіон гідрохлориду, що розпався як % бупропіон гідрохлориду присутнього з початку аналізу 2 39 89168 40 Таблиця 9 12 місяців витримки при стабільних умовах (температура 25°С±2°С/відносна вологість 60%±5%) Загальні домішки Прийнятні допуски 2.5% Виведені дані 1.5% Кількість в таблетках протягом 12 місяців 0.56% Таблиця 10 18 місяців витримки при стабільних умовах (температура 25°С±2°С/відносна вологість 60%±5%) Загальні домішки Прийнятні допуски 2.5% Виведені дані 1.5% Дані стабільності протягом 48 місяців були оцінені за допомогою статистичного аналізу закінчення терміну придатності для кожної лікарської форми таблеток з модифікованим вивільненням. Криві закінчення терміну придатності представлені на Фіг.2А та 2В. Специфікації "на основі даних" були виведені шляхом оцінки рівня верхнього довірчого інтервалу, прогнозованого на 48 місяців. Приклад 2 1. Вологостійкий шар не є ентеросолюбільною оболонкою. Ціллю дослідження було показати, що таблетки бупротон гідрохлориду, відповідно до цього винаходу, не покриті ентеросолюбільною оболонкою. Состав з модифікованим вивільненням має в основі ядро таблетки, яке складається із бупропіон Кількість в таблетках протягом 18 місяців 0.65% гідрохлориду, сполучної речовини та змащувальної речовини. Ядро таблетки покрите оболонкою, що контролює вивільнення, функція якої - контролювати вивільнення бупропіон гідрохлориду. Ядра таблеток, покриті оболонкою, що контролює вивільнення, потім покриваються вологостійким шаром, який суттєво запобігає або затримує абсорбцію вологи. Вивільнення лікарського засобу вимірювалось шляхом спектрофотометрії за допомогою процедури двостадійного розчинення з використанням метода В Фармакопеї США, який визначає умови розчинення ентеросолюбільнї оболонки (в барабані при 75 обертах за хвилину), для оцінки цільності таблетки. Результати тестів показані в Таблицях 11 та 12: Таблиця 11 Час (години) 0 1 2 Кислотна стадія: % розчинених 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням Середнє зна- Стандартне V1 V2 V3 V4 V5 V6 чення відхилення 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.1 0.0 0.6 0.5 1.2 0.2 0.3 0.7 3.1 1.7 9.7 7.3 10.2 7.2 6.5 3.5 Таблиця 12 Час (години) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Буферна стадія: % розчинених 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням Середнє зна- Стандартне VI V2 V3 V4 V5 V6 чення відхилення 21.8 20.3 19.2 21.2 21.6 20.3 20.7 1.0 35.2 34.6 32.4 34.9 33.9 32.9 34.0 1.1 45.0 45.1 43.3 45.5 42.8 43.5 44.2 1.2 53.2 55.0 51.1 53.1 50.6 51.2 52.3 1.7 59.6 64.6 57.2 59.5 58.0 57.4 59.4 2.8 64.7 70.7 62.2 65.1 66.7 62.7 65.3 3.1 69.1 75.1 66.6 69.4 71.7 67.1 69.8 3.2 74.4 78.1 70.1 73.0 75.8 71.8 73.9 2.9 78.8 80.1 73.2 75.8 77.6 75.7 76.9 2.5 81.6 81.5 75.5 77.7 78.6 77.8 78.8 2.4 83.2 82.5 77.2 79.3 79.5 79.1 80.1 2.3 84.1 83.1 78.0 80.6 80.0 79.9 81.0 2.3 84.6 83.7 78.4 81.3 80.2 80.4 81.4 2.3 84.9 84.0 78.6 81.5 80.2 80.8 81.7 2.4 41 89168 При кислому рН (0.1N НСІ) близько 7% бупропіон гідрохлориду вивільнюється протягом 2 годин, проте при рівні рН6.8 близько 21% бупропіон гідрохлориду вивільнюється протягом 1 години. Таким чином, таблетка з модифікованим вивільненням, відповідно до цього винаходу, не відповідає вимогам Фармакопеї США щодо таблетки покритої ентеросолюбільною оболонкою, тобто після 2 годин в кислому середовищі (0.1N НСІ) ніякі окремі показники не повинні перевищувати 10% розчиненого активного лікарського засобу та не менше, ніж 75% повинні розчинюватись протягом 45 хвилин у буфері рН6.8. 42 Функціональність вологостійкого шару як не ентеросолюбільної оболонки була додатково показана за допомогою безпосереднього нанесення на ядра 150мг таблеток вологостійкого шару. Таблиця 13 показує, що результати розчинення (перші 2 години в кислому середовищі) не відповідають вимогам Фармакопеї США щодо таблетки покритої ентеросолюбільною оболонкою. Середовище: 900мл, 0.1N HCІ Метод: Прилад Фармакопеї США Тип І при 75 обертів на хвилину та 37°С Таблиця 13 Час (години) V1 V2 V3 0 1 2 3 4 5 0.0 45.6 75.5 93.9 99.1 99.5 0.0 41.7 73.7 98.4 99.1 99.1 0.0 39.8 69.1 95.1 102.2 102.2 % розчиненого бупропіон гідрохлориду Середнє Стандартне V4 V5 V6 значення відхилення 0.0 0.0 0.0 0.0 0.0 46.5 42.4 50.1 44.3 3.8 76.4 71.3 84.6 75.1 5.4 93.4 89.4 100.9 95.2 4.0 102.0 99.0 102.5 100.6 1.7 103.5 101.7 102.5 101.4 1.8 Тестування у буферному розчині не проводився через високе вивільнення в кислому середовищі. 2. Вологостійкий шар виконує функцію суттєвого запобігання або затримання абсорбції вологи. Функціональність вологостійкого шару як оболонки, яка суттєво запобігає або затримує абсорбцію вологи, була підтверджена шляхом визначення вмісту вологи за методом Карла-Фішера як в ядрах таблеток покритих оболонкою, що контролює вивільнення, так і в ядрах таблеток покритих вологостійким шаром для ядер 300мг таблеток. Підготовка складів описана у Прикладі 1. Відповідні покриті таблетки були поміщені окремо за прискорених умов (при температурі 40°С±2°С/відносній вологості 75%±5%) у відкриту скляну чашку на 10 діб. Як показано в Таблиці 14, вміст вологи в ядрах таблеток покритих оболонкою, що контролює вивільнення, вищий ніж в ядрах таблеток покритих вологостійким шаром. Таблиця 14 Вміст вологи за методом Карла-Фішера, % Ядра таблеток покритих оболонкою Ядра таблеток покритих вологостійким шаром 0.7 0.45 Дані, представлені в Таблицях 13 та 14, демонструють, що вологостійкий шар не виконує функцію ентеросолюбільної оболонки, як визначено Фармакопеєю США. Навпаки, ці дані демонструють функціональність вологостійкого шару як оболонки, яка суттєво запобігає або затримує абсорбцію вологи. Приклад 3 Ціллю цього дослідження було з'ясувати еквівалентність ефективності лікарських форм за до Відносне стандартне відхилення, % 0.0 8.5 7.2 4.2 1.7 1.7 помогою наступного тесту для 150мг та 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням натщесерце. Було проведено двостороннє, перехресне, відкрите, з використанням одноразової дози та натщесерце дослідження еквівалентності ефективності лікарських форм (150мг та 300мг) таблеток бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу. Таблетки з модифікованим вивільненням, відповідно до цього винаходу, призначались один раз на добу нормальним, здоровим особам, які не палять, жіночої та чоловічої статі. План дослідження включав перехресний план з двома термінами, дворазовим лікуванням, одноразовою дозою та натщесерце. Терміни дослідження були розділені трьохтижневим періодом вимивання. Взагалі 36 осіб (19 чоловіків та 17 жінок) погодились прийняти участь у дослідженні, з яких 35 осіб (19 чоловіків та 16 жінок) завершили дослідження. Особам, які досліджувались, призначалось наступне лікування: А) 2 150мг таблетки бупропіон гідрохлориду з модифікованим вивільненням для прийому один раз на добу, відповідно до цього винаходу, призначалися внутрішньо з 240мл води кімнатної температури, після чого призначалось нічне голодування протягом принаймні 10 годин. В) 1 300мг таблетка бупропіон гідрохлориду з модифікованим вивільненням для прийому один раз на добу, відповідно до цього винаходу, призначалися внутрішньо з 240мл води кімнатної температури, після чого призначалось нічне голодування протягом, принаймні, 10 годин. Графічні профілі середньої концентрації в плазмі (нг/мл) бупропіону та його метаболітів: гідроксибупропіону, бупропіон треоаміно спирту та ерітроаміно спирту протягом 120 годин після прийому наступних лікарських форм: 2 150мг один 43 89168 раз на добу та 1 300мг один раз на добу, показані на Фіг.3A-D відповідно. Таблиці 15a-d представляють середні (± стандартне відхилення) фармакокінетичні дані для 44 бупропіону після прийому 2 150мг таблеток, призначених один раз на добу, або 300мг таблетки, призначеної один раз на добу: Таблиця 15а (Бупропіон) 2 150мг таблетки бупропіон НСІ 1 300мг таблетка бупропіон НСІ 1 Фармакокінетичний параметр (середнє 2 з модифікованим вивільнен- з модифікованим вивільненням, значення± стандартне відхилення) ням, відповідно до цього винахо- відповідно до цього винаходу, ду, (n=35) (n=35) AUC0-t (нг·год /мл) 1648.85±475.34 1676.61±474.09 AUC0-inf (нг·год /мл) 1702.69±489.30 1728.34±478.43 Сmax (нг/мл) 150.11±37.22 146.88±47.61 Тmax (години) 4.99±0.76 5.20±0.88 t1/2 (години) 22.70±7.42 21.84±7.35 -1 Kel (година ) 0.036±0.017 0.037±0.018 MRT (mean recovery time) (Середній час відновлення) (години) 22.28±5.50 22.92±5.50 Таблиця 15b (Гідроксибупропіон) 2 150мг таблетки бупропіон НСІ 1 300мг таблетка бупропіон НСІ 1 Фармакокінетичний параметр (середнє 2 з модифікованим вивільнен- з модифікованим вивільненням, значення± стандартне відхилення) ням, відповідно до цього винахо- відповідно до цього винаходу, ду, (n=35) (n=35) AUC0-t (нг·год /мл) 22506.34±9372.50 22380.32±8740.47 AUC0-inf (нг·год /мл) 23634.19±10373.91 23498.81±9584.58 Сmax (нг/мл) 492.97±182.28 479.23±172.64 Тmax (години) 11.66±5.64 14.06±5.10 t1/2 (години) 24.01±4.85 24.09±4.57 Kel (година-1) 0.030±0.007 0.030±0.006 MRT (mean recovery time) (Середній час відновлення) (години) 39.93±6.94 41.18±7.07 М/Р співвідношення 13.4886±5.3391 13.2966±5.0489 Таблиця 15с (Бупропіон треоаміно спирт) 2 150мг таблетки бупропіон НСІ 1 300мг таблетка бупропіон НСІ 1 з Фармакокінетичний параметр (середнє 2 з модифікованим вивільненмодифікованим вивільненням, відзначення± стандартне відхилення) ням, відповідно до цього винаповідно до цього винаходу, (n=35) ходу, (n=35) AUC0-t (нг·год /мл) 7548.05±3627.79 7262.88±3083.24 AUC0-inf (нг·год /мл) 9428.73±4982.30 9091.33±3926.24 Сmax (нг/мл) 173.22±60.80 162.24±58.97 Тmax (години) 7.76±2.65 8.47±3.41 t1/2 (години) 50.47±16.76 51.51±16.83 Kel (година-1) 0.015±0.005 0.015±0.005 MRT (mean recovery time) (Середній час відновлення) (години) 69.31±22.44 71.33±21.93 М/Р ratio 5.4378±2.1088 5.2774±2.0478 45 89168 46 Таблиця 15d (Бупропіон ерітроаміно спирт) 2 150мг таблетки бупропіон НСІ 1 300мг таблетка бупропіон НСІ Фармакокінетичний параметр (середнє 2 з продовженим вивільненням, 1 з продовженим вивільненням, значення± стандартне відхилення) відповідно до цього винаходу, відповідно до цього винаходу, (n=35) (n=35) AUC0-t (нг·год /мл) 1508.79±601.87 1441.85±495.53 AUC0-inf (нг·год /мл) 1702.71±777.29 1613.65±623.69 Сmax (нг/мл) 28.88±6.54 27.52±6.67 Тmax (години) 13.03±3.48 15.24±4.15 t1/2 (години) 32.15±8.65 32.12±9.22 -1 Kel (година ) 0.023±0.007 0.023±0.006 MRT (mean recovery time) (Середній час відновлення) (години) 51.60±12.65 52.34±13.44 М/Р ratio 0.9985±0.3678 0.9527±0.3863 Результати аналізу відносної біодоступності (2 150мг (щоденно) в порівнянні з 1 300мг (щоденно)) для AUC0-inf, AUC0-t, та Cmax, трансформо вані за допомогою натурального логарифму натщесерце, зібрані в Таблиці 16 для бупропіону та його метаболітів: Таблиця 16 Параметр AUC0-t AUC0-inf Сmax Параметр AUC0-t AUC0-inf Сmax 90% C.I. Бупропіон Співвідношення Внутрішньосередніх геоме- суб'єктний коефітричних цієнт варіації 93.96% 102.76% 98.26% 11.07% 93.97% 102.88% 98.32% 11.19% 97.77% 110.30% 103.84% 14.90% Бупропіон треоаміно спирт Співвідношення Внутрішньо90% С.І. середніх геоме- суб'єктний коефітричних цієнт варіації 96.66% 109.16% 102.72% 15.03% 94.87% 108.57% 101.49% 16.66% 100.06% 114.03% 106.82% 16.16% Дані показують, що обидві лікарські форми 150мг доза, призначена двічі на добу, та 300 мр доза, призначена один раз на добу - таблеток з модифікованим вивільненням, відповідно до цього винаходу, які описані в Прикладі 1, є еквівалентами один одному у відношенні до їх фармакокінетичних параметрів для бупропіону та його метаболітів. Приклад 4 Було проведено чотиристороннє, перехресне, відкрите, з використанням одноразової дози, натщесерце та з ефектом їжі, порівняльне дослідження біодоступності 150мг таблеток бупропіон гідрохлориду з модифікованим вивільненням, як описано в цьому документі та Прикладі 1, по відношенню до 150мг таблеток Zyban®, в якому приймали участь нормальні, здорові особи, які не палять, жіночої та чоловічої статі. Це дослідження 90% С.І. Гідроксибупропіон Співвідношення Внутрішньосередніх гео- суб'єктний коефіметричних цієнт варіації 94.42% 106.07% 100.08% 14.37% 94.23% 105.81% 99.85% 14.32% 97.76% 108.17% 102.84% 12.51% Бупропіон ерітроаміно спирт Співвідношення Внутрішньо90% С.І. середніх гео- суб'єктний коефіметричних цієнт варіації 96.83% 110.30% 103.34% 16.09% 97.09% 110.89% 103.76% 16.42% 99.41% 111.26% 105.17% 13.91% було розроблено для оцінки швидкості та міри абсорбції бупропіону після їжі та натщесерце після прийому 150мг таблеток бупропіон гідрохлориду з модифікованим вивільненням, як описано в Прикладі 1. Паралельно також оцінювались в цьому дослідженні швидкість та міра абсорбції бупропіону після їжі та натщесерце після прийому 150мг таблеток Zyban®. План дослідження включав перехресний план з двома термінами, дворазовим лікуванням, одноразовою дозою, натщесерце та після їжі. Терміни дослідження були розділені двохтижневим періодом вимивання. Взагалі 35 осіб (24 чоловіка та 11 жінок) погодились прийняти участь у дослідженні, з яких 32 особи (22 чоловіка та 10 жінок) завершили дослідження. Особам, які досліджувались, призначалось наступне лікування: 47 А) 150мг щоденно таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, натщесерце, В) 150мг щоденно таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, після їжі, С) 150мг щоденно таблетки Zyban® натщесерце, та D) 150мг щоденно таблетки Zyban® після їжі. Графічні профілі середньої концентрації у плазмі (нг/мл) бупропіону та його метаболітів: гідроксибупропіону, бупропіон треоаміно спирту та ерітроаміно спирту через 72 години після прийому 89168 48 1 150мг один раз на добу таблеток бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, та 1 150мг один раз на добу таблетки Zyban®, показані на Фіг.4А-Е. Таблиця 17 представляє середні (± стандартне відхилення) фармакокінетичні дані для бупропіону після прийому 150мг таблеток з модифікованим вивільненням, відповідно до цього винаходу, або наявних на ринку таблеток-прототипів Zyban® натщесерце та після їжі для бупропіону та його метаболітів: Таблиця 17 Середнє геометричне Середнє арифметичне± стандартне відхилення (% коефіцієнт варіації) Таблетки бупропіон Фармакокенитичний Таблетки бупропіон НСІ з модифікованим Таблетки Zyban® Таблетки Zyban® параметр НСІ з модифікованим вивільненням, відпо150мг (Натщесерце) 150мг (Після їжі) вивільненням 150мг відно до цього вина(n=32) (n=32) (Натщесерце) (n=32) ходу, 150мг (Після їжі) (n=32) Бупропіон AUC0-t (нг·год/мл) 825.1787 882.1834 840.5866 1002.9491 864.56±259.86 918.59±271.21 881.48±270.64 1048.50±306.63 (30.06) (29.52) (30.70) (29.24) AUC0-inf (нг·год/мл) 886.1622* 926.4870* 884.2148* 1043.8802* 923.43±263.01 966.18±290.02 929.01±291.01 1092.41±326.05 (28.48) (30.02) (31.32) (29.85) Сmax (нг/мл) 78.2884 73.1637 92.1115 124.3873 81.78±24.47 75.75±19.77 96.96±31.38 128.81±32.03 (29.93) (26.10) (32.37) (24.87) Тmax (години) † 5.13±1.13 6.59±2.18 3.04±0.77 3.88±1.01 (22.02) (33.10) (25.41) (25.99) t1/2 (години) † 18.17±6.35* 19.26±6.77* 19.88±5.91* 19.48±5.45* (34.97) (35.15) (29.75) (27.99) Kel (година-1) † 0.044±0.018* 0.041±0.017* 0.039±0.017* 0.039±0.015* (41.996) (42.214) (42.096) (38.386) ΜRT0-inf (години) † 4.81±2.38* 5.18±2.99* 4.69±2.25* 4.34±2.00* (49.43) (57.81) (47.93) (46.08) Гідроксибупропіон AUC0-t (нг·год/мл) 10745.045 10939.113 11514.933 12975.263 12611.91±8151.69 12604.70±7739.11 12976.49±6817.46 14679.97±8184.51 (64.63) (61.40) (52.54) (55.75) AUC0-inf (нг·год/мл) 11209.310 11383.270 11910.790 13397.186* 13034.17±8207.41 13049.55±7933.08 13344.28±6863.47 15129.56±8370.60 (62.97) (60.79) (51.43) (55.33) Сmax (нг/мл) 222.2716 230.4191 294.8008 301.9918 245.61±119.94 252.46±112.93 316.89±125.90 325.85±131.69 (48.83) (44.73) (39.73) (40.42) Тmax (години) † 15.22±6.14 15.38±4.35 6.04±1.18 7.19±2.91 (40.32) (28.31) (19.56) (40.49) t1/2 (години) † 25.19±5.90 25.26±5.98 25.37±6.14 25.68±5.70* (23.42) (23.67) (24.21) (22.18) -1 Kel (година ) † 0.029±0.007 0.029±0.008 0.029±0.008 0.028±0.006* (25.285) (26.635) (27.142) (22.223) ΜRT0-inf (години) † 5.78±4.17 5.78±3.20 4.84±2.22 4.01±1.87* (72.15) (55.43) (45.85) (46.57) M/P ratio † 3.851±1.097 4.029±1.210 3.874±1.214 4.556±1.360 49 89168 50 Продовження таблиці 17 AUC0-t (нг·год/мл) AUC0-inf (нг·год/мл) Сmax (нг/мл) Тmax (години) † t1/2 (години) † Kel (година-1) † ΜRT0-inf (години) † M/P ratio † AUC0-t (нг·год/мл) AUC0-inf (нг·год/мл) Сmax (нг/мл) Тmax (години) † t1/2 (години) † Kel (година-1) † ΜRT0-inf (години) † M/P ratio † Бупропіон треоаміно спирт 4223.4179 4397.5375 4376.0423 5042.7155 4686.42±2736.63 4969.37±3229.17 4832.84±2671.85 5478.16±2694.10 (58.39) (64.98) (55.29) (49.18) 4466.6770 4702.2669 4644.3189 5346.5138 5006.42±3088.85 5360.00±3691.31 5147.80±2897.63 5853.85±3083.18* (61.70) (68.87) (56.29) (52.67) 81.8673 87.4966 107.2111 124.7860 88.43±37.68 93.97±36.82 112.12±34.64 130.65±40.68 (42.61) (39.18) (30.90) (31.13) 10.03±3.62 11.94±3.39 5.76±1.02 5.38±0.95 (36.12) (28.39) (17.65) (17.66) 49.27±14.83 50.94±15.39 51.44±14.06 52.82±14.82* (30.10) (30.22) (27.34) (28.05) 0.015±0.005 0.015±0.005 0.014±0.004 0.014±0.004* (30.287) (30.636) (26.839) (31.030) 15.81±12.98 17.89±13.50 16.52±12.41 18.23±14.02* (82.07) (75.49) (75.11) (76.92) 3.851±1.097 4.029±1.210 3.874±1.214 4.556±1.360 Бупропіон ерітроаміно спирт 615.3554 662.8840 666.6066 766.3201 675.24±321.49 722.75±341.87 716.66±300.64 823.24±320.87 (47.61) (47.30) (41.95) (38.98) 711.3752 754.6092 750.7705 839.2428 768.15±333.66 816.35±372.52 802.32±315.77 893.65±330.20* (43.44) (45.63) (39.36) (36.95) 13.6946 14.6158 17.2653 18.1560 14.17±3.85 15.04±3.56 17.55±3.23 18.50±3.84 (27.14) (23.69) (18.39) (20.76) 15.57±4.65 (29.90) 14.88±3.09 (20.74) 6.85±1.92 (28.04) 7.88±3.83 (48.57) 29.14±8.77 (30.09) 30.39±10.17 (33.47) 29.69±9.37 (31.57) 31.38±10.74* (34.23) 0.026±0.007 (28.240) 0.025±0.008 (31.201) 0.026±0.009 (34.415) 0.024±0.007* (30.060) 17.10±6.30 16.94±9.04 15.10±5.65 15.09±6.62* (36.87) (53.39) (37.44) (43.89) 3.851±1.097 4.029±1.210 3.874±1.214 4.556±1.360 *n=31 † Виражено як середнє арифметичне±стандартне відхилення (% коефіцієнт варіації) Результати аналізу відносної (таблеток з модифікованим вивільненням, відповідно до цього винаходу, натщесерце та після їжі) біодоступності для AUC0-inf, AUC0-t, та Cmax, трансформовані за допомогою натурального логарифму за умов натщесерце та після їжі, зібрані в Таблиці 18 для бупропіону та його метаболітів: Таблиця 18 Бупропіон Параметр AUC0-t AUC0-inf Сmax 90% C.I. 101.74%112.23% 100.18%109.60% 86.58%100.13% ВнутрішньоСпіввідношення суб'єктний коефісередніх цієнт варіації 106.852% 11.786% 104.788% 10.533% 93.107% 17.470% 90% С.І. 95.30%109.76% 95.48%108.95% 97.20%111.36% Гідроксибупропіон ВнутрішньоСпіввідношення суб'єктний коефісередніх цієнт варіації 102.275% 16.971% 101.993% 15.844% 104.043% 16.336% 51 89168 52 Продовження таблиці 18 Параметр AUC0-t AUC0-inf Сmax Бупропіон треоаміно спирт Співвідношення Внутрішньо90% С.І. середніх геоме- суб'єктний коефітричних цієнт варіації 98.77%104.108% 12.646% 109.74% 100.03%105.274% 12.269% 110.79% 100.41%106.884% 14.998% 113.77% Дані в Таблиці 10 показують, що біоеквівалентність бупропіону та його метаболитів не показує впливу їжі, тобто таблетки з модифікованим вивільненням відповідно до цього винаходу, які містять бупропіон гідрохлорид, є біоеквівалентними при наявності або у відсутностіi їжі, що підтверджується тим фактом, що 90% СІ співвідношення середніх геометричних для AUC0-inf, (та AUC0-t, де доцільно), та Сmах, при прийомі натщесерце по відношенню до прийому після їжі, відповідають запропонованим Федеральним управлінням по лікарським засобам межам у 80-125%. Приклад 5 Було проведене двостороннє, перехресне, відкрите, з використанням одноразової дози, за умов впливу їжі, дослідження відносної біодоступності 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, в якому приймали участь нормальні, здорові особи, які не палять, жіночої та чоловічої статі. Це дослідження було розроблено для оцінки впливу їжі на швидкість та міру абсорбції 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням для прийому один раз на добу, відповідно до цього винаходу, за умов одноразової дози. План дослідження включав перехресний Бупропіон ерітроаміно спирт Співвідношення Внутрішньо90% С.І. середніх гео- суб'єктний коефіметричних цієнт варіації 101.02%107.780% 15.564% 114.99% 100.49%106.132% 13.127% 112.09% 101.23%106.712% 12.662% 112.49% план з двома термінами, дворазовим лікуванням, одноразовою дозою, натщесерце та після їжі. Терміни дослідження були розділені двохтижневим періодом вимивання. Взагалі 36 осіб (26 чоловіків та 10 жінок) погодились прийняти участь у дослідженні, з яких 32 особи (23 чоловіки та 9 жінок) завершили дослідження. Особам, які досліджувались, призначалось наступне лікування: А) 1 300мг таблетка з модифікованим вивільненням після 10 годин голодування. В) 1 300мг таблетка з модифікованим вивільненням після повноцінного прийому сніданку з високим вмістом жиру. Графічні профілі середньої концентрації в плазмі (нг/мл) бупропіону та його метаболітів: гідроксибупропіону, бупропіон треоаміно спирту та ерітроаміно спирту через 120 години після прийому 1 300мг один раз на добу таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, натщесерце та після їжі показані на Фіг.5A-D відповідно. Таблиця 19 представляє середні (± стандартне відхилення) фармакокінетичні дані для бупропіону та його метаболітів після прийому 300мг таблеток з модифікованим вивільненням, відповідно до цього винаходу, натщесерце та після їжі: Таблиця 19 Таблетки бупропіон НСІ з модифіко- Таблетки бупропіон НСІ з модифікованим Фармакокінетичний пара- ваним вивільненням 300мг (Після їжі) вивільненням 300мг (Натщесерце) (n=31) метр (n=31) Середнє значення± Стандартне Середнє значення± Стандартне відхиленвідхилення ня Бупропіон AUC0-t (нг·год /мл) 1775.45±530.77 1628.38±511.15 AUC0-inf (нг·год /мл) 1832.54±548.50 1678.36±521.18 Сmax (нг/мл) 138.36±42.35 151.35±48.87 Тmax (години) 6.16±1.84 5.16±0.86 t1/2 (години) 21.76±5.85 21.21±6.17 Kel (година-1) 0.035±0.011 0.036±0.012 MRT (година) 22.56±4.60 21.58±4.23 Гідроксибупропіон AUC0-t (нг·год /мл) 19733.51±9411.52 18938.84±8387.21 AUC0-inf (нг·год /мл) 20886.13±10230.69 19852.73±9049.54 Сmax (нг/мл) 449.05±181.73 409.79±154.84 Тmax (години) 14.32±3.18 13.71±5.15 t1/2 (години) 24.11±5.21 23.95±4.84 -1 Kel (година ) 0.030±0.007 0.030±0.007 MRT (година) 42.03±7.60 41.08±6.13 М/Р Ratio 10.5919±3.8325 11.3178±4.6281 53 89168 54 Продовження таблиці 19 AUC0-t (нг·год /мл) AUC0-inf (нг·год /мл) Сmax (нг/мл) Тmax (години) t1/2 (години) -1 Kel (година ) MRT (година) M/P Ratio AUC0-t (нг·год /мл) AUC0-inf (нг·год /мл) Сmax (нг/мл) Тmax (години) t1/2 (години) Kel (година-1) MRT (година) M/P Ratio Бупропіон треоаміно спирт 9769.69±6136.11 13280.57±9398.23 208.39±98.15 12.26±3.36 55.09±17.66 0.014±0.004 79.10±25.10 6.9435±3.8129 Бупропіон ерітроаміно спирт 1803.45±693.19 2116.01±1026.23 35.80±9.13 14.74±2.71 35.23±12.03 0.021±0.006 57.78±17.49 1.1322±0.3876 Результати аналізу відносної (при прийомі після їжі в порівнянні з прийомом натщесерце) біодоступності для AUC0-inf, AUC0-t, та Cmax, трансфор 9032.19±6595.77 11696.29±9018.00 182.52±99.62 9.94±4.84 55.25±20.72 0.014±0.004 78.60±28.28 6.6417±3.4215 1634.56±741.60 1867.74±971.96 31.03±9.97 14.16±3.85 33.89±11.02 0.022±0.006 54.75±14.45 1.0947±0.3952 мовані за допомогою натурального логарифму за умов натщесерце та після їжі для бупропіону та його метаболітів, зібрані в Таблиці 20: Таблиця 20 Параметр AUC0-t AUC0-inf Сmax Параметр AUC0-t AUC0-inf Сmax 90% С.І. Бупропіон Співвідношення Внутрішньосередніх гео- суб'єктний коеметричних фіцієнт варіації 110.10% 13.21% 104.00%116.57% 104.18%110.16% 12.93% 116.49% 84.49%92.31% 20.50% 100.86% Бупропіон треоаміно спирт Співвідношення Внутрішньо90% С.І. середніх гео- суб'єктний коеметричних фіцієнт варіації 104.31%112.42% 17.36% 121.18% 104.15%114.39% 20.59% 125.65% 110.61%117.57% 14.12% 124.96% Дані в Таблиці 20 показують, що біоеквівалентність бупропіону та його метаболітів з 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, не показує впливу їжі, що підтверджується тим фактом, що 90% СІ співвідношення середніх геометричних для AUC0-inf, (та AUC0-t, де доцільно), та Сmах при прийомі натщесерце, по відношенню до прийому після їжі, відповідають запропонованим Федеральним управлінням по лікарським засобам межам у 80-125%. Приклад 6 Було проведено двостороннє, перехресне, у стаціонарному стані, з використанням багаторазової дози, відкрите, натщесерце, порівняльне дослідження біодоступності 300мг таблетки бупропіон 90% С.І. Гідроксибупропіон Співвідношення Внутрішньосередніх гео- суб'єктний коеметричних фіцієнт варіації 103.76% 17.36% 96.27%111.84% 97.03%104.58% 17.35% 112.72% 103.44%109.97% 14.17% 116.91% Бупропіон ерітроаміно спирт Співвідношення Внутрішньо90% С.І. середніх гео- суб'єктний коеметричних фіцієнт варіації 104.06%113.39% 19.89% 123.56% 105.26%115.44% 21.39% 126.61% 110.14%117.99% 15.94% 126.40% гідрохлориду з модифікованим вивільненням, відповідно до цього ι винаходу, в порівнянні з 100мг таблетками Wellbutrin® з миттєвим вивільненням з трьохразовим прийомом, в якому приймали участь нормальні, здорові особи, які не палять, жіночої та чоловічої статі. Це дослідження було сплановано для оцінки біодоступності 300мг таблеток з модифікованим вивільненням , відповідно до цього винаходу,в порівнянні з наявними на ринку таблетками-прототипами Wellbutrin® з миттєвим вивільненням з трьохразовим прийомом в стаціонарному стану та натщесерце. План дослідження включав перехресний план з двома термінами, дворазовим лікуванням, з поступовим підвищенням дози, багаторазовим дозуванням та натщесерце. Взагалі 40 осіб (27 чолові 55 89168 ків, 13 жінок) погодились прийняти участь у дослідженні, з яких 30 осіб (22 чоловіка, 8 жінок) завершили дослідження. Особам, які досліджувались, призначалось наступне лікування: А) 100мг таблетки Wellbutrin® були призначені внутрішньо в 0,0 годин (починаючи о 7:00 ранку) в 1,2 та 3 день (двічі на добу) з 240мл води кімнатної температури після нічного голодування протягом принаймні 10 годин. Усі особи, які досліджувались, також отримали другу дозу, яка складала 1 100мг таблетку Wellbutrin®, о 12,0 годині з 240мл води кімнатної температури після голодування протягом принаймні 1 години. В дні 4-13 особи, які досліджувались, отримали 300мг таблетку бупропіон гідрохлориду з модифікованим вивільненням , відповідно до цього винаходу, в 0,0 годин (починаючи о 7:00 ранку) з 240мл води кімнатної температури після нічного голодування протягом принаймні 10 годин. В) 100мг таблетки Wellbutrin® були призначені внутрішньо в 0,0 годин (починаючи о 7:00 ранку) в 1, 2 та 3 день (двічі на добу) з 240мл води кімнатної температури після нічного голодування протягом принаймні 10 годин. Усі особи, які досліджувались, також отримали другу дозу, яка складала 1 100мг таблетку Wellbutrin®, о 12,0 годині з 240мл води кімнатної температури після голодування протягом принаймні 1 години. В дні 4-13 особи, які 56 досліджувались, отримали 1 100мг таблетку Wellbutrin® в 0,0 годин (починаючи о 7:00 ранку) з 240мл води кімнатної температури після нічного голодування протягом принаймні 10 годин. Усі особи, які досліджувались, потім отримали другу дозу, яка складала 1 таблетку Wellbutrin® вагою 100мг о 6,0 годині з 240мл води кімнатної температури після голодування протягом принаймні 1 години. Усі особи, які досліджувались, потім отримали третю дозу, яка складала 1 100мг таблетку Wellbutrin® о 12,0 годині з 240мл води кімнатної температури після голодування протягом принаймні 1 години. Графічні профілі середньої концентрації в плазмі (нг/мл) бупропіону та його метаболітів: гідроксибупропіону, бупропіон треоаміно спирту та ерітроаміно спирту після закінчення терміну дослідження після прийому 1 300мг один раз на добу таблеток з модифікованим вивільненням , відповідно до цього винаходуда 3 100мг таблеток Wellbutrin® показані на Фіг.6А-Е відповідно. Таблиця 21 представляє середні (± стандартне відхилення) фармакокінетичні дані для бупропіону після прийому один раз на добу 300мг таблетки з модифікованим вивільненням, відповідно до цього винаходу, або тричі на день наявної на ринку 100мг таблетки-прототипу Wellbutrin®: Таблиця 21 Фармакокінетичний параметр AUC0-t, (нг·год/мл) Сmax (нг/мл) Сmin (нг/мл) Тmax (години) Ступінь флюктуації (%) Cave (нг/мл) Ступінь коливання (%) М/Р ratio AUC0-t, (нг·год/мл) Сmax (нг/мл) Сmin (нг/мл) Тmax (години) Ступінь флюктуації (%) Cave (нг/мл) Ступінь коливання (%) М/Р ratio AUC0-t, (нг·год/мл) Сmax (нг/мл) Сmin (нг/мл) Тmax (години) Ступінь флюктуації (%) Cave (нг/мл) Ступінь коливання (%) М/Р ratio 300мг таблетки бупропіон НСІ з модифікованим вивільненням, відповідно до цього винаходу, (n=30) (Середнє значення± Стандартне відхилення) Бупропіон 1612.04±490.27 167.50±46.56 27.64±10.73 4.90±0.89 212.56±39.42 67.17±20.43 554.59±193.21 12.92±5.31 Гідроксибупропіон 20824.77±7423.56 1095.64±385.06 722.23±281.76 7.30±2.45 44.34±16.57 867.70±309.32 54.65±22.48 7.01±1.84 Бупропіон треоаміно спирт 10987.88±3193.09 585.36±155.83 364.42±122.60 7.83±2.15 50.47±17.22 457.83±133.05 65.68±26.11 1.39±0.44 100мг таблетки Wellbutrin® (n=30) (Середнє значення± Стандартне відхилення) 1791.98±483.43 175.40±56.03 34.06±12.49 1.60±0.58 189.98±38.99 74.67±20.14 439.58±141.64 12.61±5.11 22456.08±6889.20 1156.34±339.34 800.90±262.97 2.47±0.83 40.78±31.24 935.67±287.05 49.19±40.60 6.91±1.81 12051.42±3107.48 629.81±138.84 415.71±122.32 2.49±0.81 45.25±21.80 502.14±129.48 56.34±29.48 1.36±0.43 57 89168 58 Продовження таблиці 21 Бупропіон ерітроаміно спирт 2145.70±615.22 109.07±29.98 76.51±25.69 8.37±2.04 38.11±15.25 89.40±25.63 46.04±20.70 1.39±0.44 AUC0-t, (нг·год/мл) Сmax (нг/мл) Сmin (нг/мл) Тmax (години) Ступінь флюктуації (%) Cave (нг/мл) Ступінь коливання (%) М/Р ratio Результати аналізу відносної (таблетки з модифікованим вивільненням, відповідно до цього винаходу, в порівнянні з Wellbutrin®) біодоступнос 2353.73±645.40 119.37±26.82 85.59±26.63 2.40±0.66 38.90±33.91 98.07±26.89 46.18±43.72 1.36±0.43 ті для AUC0-t, та Сmах для бупропіону та його метаболітів, трансформовані за допомогою натурального логарифму, зведені в Таблиці 22: Таблиця 22 Бупропіон Параметр AUC0-t Сmax Параметр AUC0-t Сmax 90% C.I. Гідроксибупропіон ВнутрішньоСпіввідношення суб'єктний коесередніх фіцієнт варіації 86.14%89.33% 8.27% 92.64% 91.08%96.86% 13.97% 103.00% Бупропіон треоаміно спирт ВнутрішньоСпіввідношення 90% C.I. суб'єктний коесередніх фіцієнт варіації 87.17%90.63% 8.82% 94.21% 87.42%92.22% 12.13% 97.28% Дані в Таблицях 21 та 22 показують, що 300мг таблетка з модифікованим вивільненням відповідно до цього винаходу, яка призначалась один раз на добу, є біоеквівалентом 100мг таблетки Wellbutrin® з миттєвим вивільненням, призначеної тричі на добу. Приклад 7 Було проведено двостороннє, перехресне, відкрите, з використанням багаторазових доз, натщесерце, порівняльне дослідження біодоступності 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, в порівнянні з наявними на ринку 150мг таблетками-прототипами Zyban®, в якому приймали участь нормальні, здорові особи, які не палять, жіночої та чоловічої статі. Це дослідження було розроблено для порівняння біодоступності 300мг таблеток бупропіон гідрохлориду з модифікованим вивільненням для прийому один раз на добу, відповідно до цього винаходу, з наявними на ринку 150мг таблетками-прототипами Zyban® для прийому двічі на добу. План дослідження включав перехресний план з двома термінами, дворазовим лікуванням, багаторазовими дозами та натщесерце. Терміни дослідження були розділені двохтижневим періодом вимивання. Взагалі 54 осіб (40 чоловіків та 14 жі 90% С.І. ВнутрішньоСпіввідношення суб'єктний коефісередніх цієнт варіації 87.00%91.11% 10.49% 95.42% 85.98%92.68% 17.04% 99.90% Бупропіон ерітроаміно спирт ВнутрішньоСпіввідношення 90% С.І. суб'єктний коефісередніх цієнт варіації 87.32%90.91% 9.16% 94.66% 84.84%90.20% 13.91% 95.89% нок) погодились прийняти участь у дослідженні, з яких 49 осіб (37 чоловік та 12 жінок) завершили дослідження. Особам, які досліджувались, призначались щоденно 150мг таблетки Zyban® починаючи з днів 1-3 цього дослідження. Після 4-17 днів призначалось: А) 300мг таблетки бупропіон гідрохлориду з модифікованим вивільненням, відповідно до цього винаходу, щоденно. В) 150мг таблетки Zyban® двічі на добу. Графічні профілі середньої концентрації в плазмі (нг/мл) бупропіону та його метаболітів: гідроксибупропіону, бупропіон треоаміно спирту та ерітроаміно спирту після закінчення терміну дослідження після прийому 1 300мг один раз на добу таблеток з модифікованим вивільненням, відповідно до цього винаходу, та 2 150мг двічі на добу таблеток Zyban®, натщесерце показані на Фіг.7А-Е відповідно. Таблиця 23 представляє середні (± стандартне відхилення) фармакокінетичні дані для бупропіону після прийому один раз на добу 300мг таблетки з модифікованим вивільненням, відповідно до цього винаходу, або двічі на добу наявної на ринку 150мг таблетки-прототипу Zyban®: 59 89168 60 Таблиця 23 Середнє геометричне Середнє арифметичне % коефіцієнт варіації) Фармакокінетичний пара300мг таблетки бупропіон НСІ з модифікованим виметр 150мг таблетки Zyban® вільненням, відповідно до цього винаходу (n=49) (n=49) AUC0-t, (нг·год/мл) 1412.4767 1561.9651 1464.21(28.12) 1617.72(26.94) Сmax (нг/мл) 143.9693 135.9517 148.81(26.10) 141.65(28.36) Сmin (нг/мл) 23.1224 25.3277 24.50(35.46) 26.85(35.28) Тmax (години)* 4.92(17.03) 3.23(31.63) Ступінь флюктуації (%)* 207.65(20.47) 171.85(19.27) Ступінь коливання (%)* 551.15(37.98) 449.59(26.79) Сave (нг/мл)* 61.01(28.12) 67.41(26.94) MRT (години)* 9.63(6.57) 10.23(2.90) Гідроксибупропіон AUC0-t, (нг·год/мл) 19688.697 21984.655 21255.88(38.44) 23792.58(39.17) Сmax (нг/мл) 1035.5625 1114.0976 1111.28(36.14) 1200.37(38.41) Сmin (нг/мл) 669.3453 775.6489 731.59(41.72) 847.91(42.12) Тmax (години)* 6.61(34.52) 4.26(35.36) Ступінь флюктуації (%)* 44.42(35.50) 36.96(50.36) Ступінь коливання (%)* 56.77(47.41) 46.22(75.49) Сave (нг/мл)* 885.66(38.44) 991.36(39.17) MRT (години)* 11.43(2.87) 11.53(1.93) М/Р Ratio* 14.538(43.310) 14.684(43.323) Бупропіон треоаміно спирт AUC0-t, (нг·год/мл) 9040.7734 10398.325 9638.64(37.34) 11100.02(38.42) Сmax (нг/мл) 494.6250 542.8864 524.91(37.35) 582.74(44.35) Сmin (нг/мл) 285.9451 339.2713 311.93(43.69) 370.23(45.18) Тmax (години)* 7.74(35.60) 4.45(35.77) Ступінь флюктуації (%)* 55.31(32.09) 47.10(32.50) Ступінь коливання (%)* 75.80(43.62) 61.76(40.19) Сave (нг/мл)* 401.61(37.34) 462.50(38.42) MRT (години)* 11.63(2.85) 11.74(1.76) М/Р Ratio* 6.609(29.472) 6.830(26.491) Бупропіон ерітроаміно спирт AUC0-t, (нг·год/мл) 1784.5115 2033.8788 1875.33(31.95) 2125.14(30.18) Сmax (нг/мл) 92.4622 101.5651 97.12(32.17) 105.63(28.49) Сmin (нг/мл) 61.3442 71.6863 65.30(36.05) 75.83(34.19) Тmax (години)* 8.31(38.42) 4.74(42.77) Ступінь флюктуації (%)* 41.87(43.18) 35.10(37.78) Ступінь коливання (%)* 53.00(54.46) 43.04(50.13) Сave (нг/мл)* 78.14(31.95) 88.15(30.18) MRT (години)* 11.73(2.63) 11.73(1.87) М/Р Ratio* 1.298(27.168) 1.334(25.504) * Виражено як середні арифметичні (% коефіцієнт варіації) Результати аналізу відносної (таблетки з модифікованим вивільненням, відповідно до цього винаходу, в порівнянні з Zyban®) біодоступності для AUC0-inf, AUC0-t, та Cmax, трансформовані за допомогою натурального логарифму для бупропіону та його метаболітів, зібрані в Таблиці 24:
ДивитисяДодаткова інформація
Назва патенту англійськоюModified release tablet of bupropion hydrochloride
Автори англійськоюOberegger Werner, Eradiri Okpo, Zhou Fang, Maes Paul
Назва патенту російськоюТаблетка бупропиона гидрохлорида с модифицированным высвобождением
Автори російськоюОбереггер Вернер, Эрадири Окпо, Жоу Фанг, Маэс Поль
МПК / Мітки
МПК: A61K 9/24, A61K 31/137, A61P 25/24
Мітки: модифікованим, вивільненням, бупропіону, таблетка, гідрохлориду
Код посилання
<a href="https://ua.patents.su/43-89168-tabletka-bupropionu-gidrokhloridu-z-modifikovanim-vivilnennyam.html" target="_blank" rel="follow" title="База патентів України">Таблетка бупропіону гідрохлориду з модифікованим вивільненням</a>
Попередній патент: Машина для поздовжнього різання плоских заготовок для упаковок
Наступний патент: Фільтр для диму та курильний виріб, що його містить
Випадковий патент: Спосіб добування діфенілдісульфіда