Похідні піридинопіридинонів, спосіб їх одержання і застосування в терапії
Номер патенту: 102858
Опубліковано: 27.08.2013
Автори: Лассалль Жільбер, Мартен Валері, Белльверг Патріс, МакКорт Гарі, Волль-Шальє Сесіль, Саві П'єр
Формула / Реферат
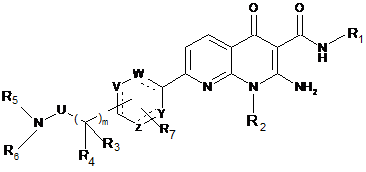
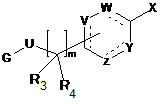
1. Сполука формули (І):
 , (I)
, (I)
у якій:
R1 означає (С1-С4)алкільну групу,
R2 означає -(СН2)n'-В, де n'=0, 1, 2, 3, 4, і В є (С3-С5)циклоалкільною групою або (С1-С4)алкільною групою, необов'язково заміщеною одним або декількома атомами фтору, (С1-С4)алкоксигрупою,
U означає карбонільну групу або групу -СН2-,
Y, Z, V і W позначають, незалежно один від іншого, групу -СН- або атом вуглецю, необов'язково заміщений групою R7, або гетероатом, такий як атом азоту або атом сірки, або атом кисню, або не містить його, причому цикл повинен бути ароматичним і містити від 5 до 6 ланок,
R3, R4 означають, незалежно один від іншого, атом водню або лінійну (С1-С4)алкільну групу, або R3 і R4 разом з атомом вуглецю, з яким вони зв'язані, утворюють (С3-С5)циклоалкільну групу,
m є цілим числом, що дорівнює 1, 2, 3, 4,
R5 означає атом водню або (С1-С4)алкільну групу,
R6 означає -(CH2)n-L, у якій n=0, 1, 2, 3, і L є групою, вибраною незалежно з наступних груп:
- (С1-С5)алкільної групи, необов'язково заміщеної (С1-С4)алкоксигрупою,
- (С3-С5)циклоалкільної групи,
- арильної групи, що містить 6 атомів вуглецю, необов'язково заміщеної одним або декількома атомами галогену,
- гетероарильної групи, що містить 5-6 ланок, у якій щонайменше один гетероатом, вибраний з атома азоту або сірки, необов'язково заміщений (С1-С4)алкільною групою,
- гетероциклічної насиченої групи, у якій вказаний гетероцикл містить 4-7 ланок, щонайменше один гетероатом якого вибраний з атома азоту, атома кисню, і необов'язково заміщеної в будь-якій позиції, у тому числі на атомі азоту, одним або декількома замісниками, вибраними з атома фтору, фтор(С1-С4)алкільної групи, (С1-С4)алкільної групи, лінійної або розгалуженої, (С3-С5)циклоалкільної групи або (С1-С4)алкілсульфонамідної групи, причому абсолютна конфігурація вуглецю, заміщеного на вказаному гетероциклі, може бути R- або S-конфігурацією або рацемічною,
R7 означає атом водню або (С1-С4)алкільну групу, або атом галогену,
у формі основи або адитивної солі з кислотою, у формі сольвату, а також її енантіомери і діастереоізомери, включаючи її суміші.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що
R1 означає (С1-С4)алкільну групу, і/або
R2 означає -(СН2)n'-В, де n'=0, 1, і В є (С3-С5)циклоалкільною групою або (С1-С4)алкільною групою, необов'язково заміщеною одним або декількома атомами фтору, (С1-С4)алкоксигрупою, і/або
U означає карбонільну групу або групу -СН2-, і/або
Y, Z, V і W позначають, незалежно один від іншого, групу -СН- або атом вуглецю, необов'язково заміщений групою R7, або гетероатом, такий як атом азоту або атом сірки, або не містить його, причому цикл повинний бути ароматичним і містити від 5 до 6 ланок, і/або
R3, R4 означають, незалежно один від іншого, атом водню або лінійну (С1-С4)алкільну групу, або R3 і R4 разом з атомом вуглецю, з яким вони зв'язані, утворюють (С3-С5)циклоалкільну групу, і/або
m є цілим числом, що дорівнює 1, 2, 3, 4, і/або
R5 означає атом водню або (С1-С4)алкільну групу, і/або
R6 означає -(CH2)n-L, у якій n=0, 1, 2, 3, і L є групою, вибраною незалежно з наступних груп:
- (С1-С5)алкільної групи, необов'язково заміщеної (С1-С4)алкоксигрупою,
- (С3-С5)циклоалкільної групи,
- арильної групи, що містить 6 атомів вуглецю, необов'язково заміщеної одним або декількома атомами галогену,
- гетероарильної групи, що містить 5-6 ланок, у якій щонайменше один гетероатом, вибраний з атома азоту або сірки, необов'язково заміщений (С1-С4)алкільної групою,
- гетероциклічної насиченої групи, у якій вказаний гетероцикл містить 5-7 ланок, щонайменше один гетероатом якого вибраний з атома азоту, атома кисню, і необов'язково заміщеної в будь-якій позиції, у тому числі на атомі азоту, одним або декількома замісниками, вибраними з атома фтору, фтор(С1-С4)алкільної групи, (С1-С4)алкільної групи, лінійної або розгалуженої, (С3-С5)циклоалкільної групи або (С1-С4)алкілсульфонамідної групи, причому абсолютна конфігурація вуглецю, заміщеного на вказаному гетероциклі, може бути R- або S-конфігурацією або рацемічною, і/або
R7 означає атом водню або (С1-С4)алкільну групу, або атом галогену,
у формі основи або адитивної солі з кислотою, у формі сольвату, а також її енантіомери і діастереоізомери, включаючи її суміші.
3. Сполука формули (І) за п. 1, яка відрізняється тим, що U означає карбонільну групу.
4. Сполука формули (І) за п. 1, яка відрізняється тим, що цикл, який містить Y, Z, V і W, вибраний з фенільної, піридинової, тіазольної, тіофенової групи.
5. Сполука формули (І) за п. 1, яка відрізняється тим, що R3 і/або R4, і/або R5 означають атом водню.
6. Сполука формули (І) за п. 1, яка відрізняється тим, що ланка -[C(R3)(R4)]m-U-N(R5)(R6) знаходиться в пара- або мета-положенні до циклу, з яким вона зв'язана.
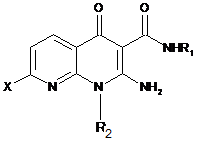
7. Сполука формули (І) за п. 1, яка відрізняється тим, що вона вибрана з групи сполук:
2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(феніламіно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-[4-(2-{[(1-етилпіролідин-2-іл)метил](метил)аміно}-2-оксоетил)феніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(піридин-3-іламіно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(піридин-2-іламіно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-(4-{2-[(2-хлорфеніл)аміно]-2-оксоетил}феніл)-1-eтил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-(4-{2-[(3,5-дифторфеніл)аміно]-2-оксоетил}феніл)-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-(4-{2-оксо-2-[(піридин-4-ілметил)аміно]етил}феніл)-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-(4-{2-оксо-2-[(піридин-2-ілметил)аміно]етил}феніл)-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-(4-{2-[(2-метоксіетил)аміно]-2-оксоетил}феніл)-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-{4-[2-(циклопропіламіно)-2-оксоетил]феніл}-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-7-(4-{2-[(1-метилетил)аміно]-2-оксоетил}феніл)-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-{4-[2-(циклопентиламіно)-2-оксоетил]феніл}-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(піразин-2-іламіно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-{4-[2-({[(2R)-1-етилпіролідин-2-іл]метил}аміно)-2-оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-{4-[2-({[(2S)-1-етилпіролідин-2-іл]метил}аміно)-2-оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(піримідин-4-іламіно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(піридин-4-іламіно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-7-(4-{2-[(2-морфолін-4-ілетил)аміно]-2-оксоетил}феніл)-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-{5-[2-оксо-2-(піридин-2-іламіно)етил]піридин-2-іл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-7-{4-[1-метил-2-оксо-2-(піридин-2-іламіно)етил]феніл}-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-{6-[2-оксо-2-(піридин-2-іламіно)етил]піридин-3-іл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-[4-(2-{[(4-етилморфолін-3-іл)метил]аміно}-2-оксоетил)феніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-[6-(2-{[(4-етилморфолін-3-іл)метил]аміно}-2-оксоетил)піридин-3-іл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-{4-[2-({[(2S)-1-етил-4,4-дифторпіролідин-2-іл]метил}аміно)-2-оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-[4-(2-{[(4-етилморфолін-3-іл)метил]аміно}-1-метил-2-оксоетил)феніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-{4-[2-({[(2S,4R)-1-етил-4-фторпіролідин-2-іл]метил}аміно)-2-оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-{4-[2-({[(2R)-1-(2-фторетил)піролідин-2-іл]метил}аміно)-2-оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-7-{4-[2-({[(2R)-1-(метилсульфоніл)піролідин-2-іл]метил}аміно)-2-оксоетил]феніл}-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-{5-[2-({[(2R)-1-(2-фторетил)піролідин-2-іл]метил}аміно)-2-оксоетил]піридин-2-іл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-aмiнo-1-eтил-N-мeтил-4-oкco-7-{4-[2-oкco-2-({[(2R)-1-(2,2,2-трифторетил)піролідин-2-іл]метил}аміно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-aмiнo-7-{4-[2-({[(2R)-1-(2,2-дифтopeтил)пipoлiдин-2-іл]мeтил}aмiнo)-2-оксоетил]феніл}-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-7-{4-[2-({[4-(1-метилетил)морфолін-3-іл]метил}аміно)-2-оксоетил]феніл}-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-[4-(2-{[(4-циклопропілморфолін-3-іл)метил]аміно}-2-оксоетил)феніл]-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-{5-[2-({[(2R)-1-(2,2-дифторетил)піролідин-2-іл]метил}аміно)-2-оксоетил]піридин-2-іл}-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(1,3-тіазол-2-іламіно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-7-[4-(2-{[(1-метил-1Н-імідазол-5-іл)метил]аміно}-2-оксоетил)феніл]-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-(4-{2-оксо-2-[(2-піридин-3-ілетил)аміно]етил}феніл)-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-7-(4-{2-[(3-морфолін-4-ілпропіл)аміно]-2-оксоетил}феніл)-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-(4-{2-оксо-2-[(2-піридин-2-ілетил)аміно]етил}феніл)-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-(4-{2-оксо-2-[(2-фенілетил)аміно]етил}феніл)-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-(4-{2-оксо-2-[(3-фенілпропіл)аміно]етил}феніл)-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-7-[4-(2-{[2-(1-метил-1Н-пірол-2-іл)етил]аміно}-2-оксоетил)феніл]-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)-1,3-тіазол-2-іл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-(3-метоксипропіл)-N-метил-4-оксо-7-{4-[2-оксо-2-(піридин-2-іламіно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-[4-(2-{[1-(2,2-дифторетил)піролідин-3-іл]аміно}-2-оксоетил)феніл]-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-[4-(3-{[(1-етилпіролідин-2-іл)метил]аміно}-3-оксопропіл)феніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-[4-(4-{[(1-етилпіролідин-2-іл)метил]аміно}-4-оксобутил)феніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-4-оксо-N-пропіл-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-N-метил-4-оксо-1-(2,2,2-трифторетил)-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-циклопентил-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-[4-(5-{[(1-етилпіролідин-2-іл)метил]аміно}-5-оксопентил)феніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
1-етил-7-[5-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)тіофен-2-іл]-N,2-диметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-{4-[2-({[(2R)-1-етилпіролідин-2-іл]метил}аміно)-2-оксоетил]феніл}-N-метил-1-(2-метилпропіл)-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-{4-[1-({[(2R)-1-етилпіролідин-2-іл]метил}карбамоїл)циклопропіл]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-{2-[2-({[(2R)-1-етилпіролідин-2-іл]метил}аміно)-2-оксоетил]-1,3-тіазол-4-іл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-{4-[2-({[(2R)-1-етилпіролідин-2-іл]метил}аміно)-2-оксоетил]-2-фторфеніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-[3-хлор-4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-[3-фтор-4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-7-[3-метил-4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-(циклопропілметил)-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)-2-метилфеніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-7-[3-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-{3-[2-оксо-2-(піридин-2-іламіно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-(піридин-2-іламіно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід,
у формі основи або адитивної солі з кислотою, у формі сольвату, а також її енантіомери і діастереоізомери, включаючи її суміші.
8. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-7, який відрізняється тим, що сполуку формули (XI):
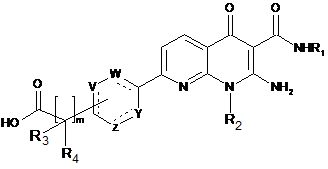 (XI)
(XI)
вводять у реакцію зі сполукою формули HNR5R6 у присутності агента сполучення і основи, причому R1, R2, R3, R4, R6, V, W, Y, Z, m мають значення, вказані в п. 1.
9. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-7, який відрізняється тим, що сполуку формули (VII):
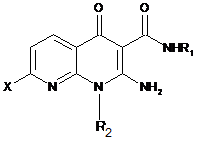 (VII)
(VII)
вводять у реакцію зі сполукою формули (ІХа):
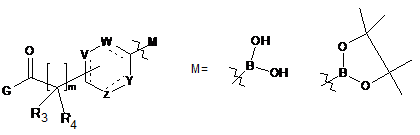 , (IXa)
, (IXa)
у якій X означає атом галогену,
G означає (С1-С4)алкоксигрупу або групу -NR5R6, і
R1, R2, R3, R4, R5, R6, V, W, Y, Z, m мають значення, вказані в п. 1.
10. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-7, який відрізняється тим, що сполуку формули (VII):
 (VII)
(VII)
вводять у реакцію зі сполукою формули (ІХb):
 , (ІХb)
, (ІХb)
у якій G означає (С1-С4)алкоксигрупу або групу -NR5R6, X означає атом галогену, і
R1, R2, R3, R4, R5, R6, V, W, Y, Z, m мають значення, вказані в п. 1.
11. Лікарський засіб, який відрізняється тим, що він містить сполуку формули (І) за будь-яким з пп. 1-7 або адитивну сіль цієї сполуки з фармацевтично прийнятною кислотою, або сольват сполуки формули (І).
12. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку формули (І) за будь-яким з пп. 1-7 або фармацевтично прийнятну сіль, сольват цієї сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт.
13. Застосування сполуки формули (І) за будь-яким з пп. 1-7 для одержання лікарського засобу, призначеного для лікування захворювань, пов'язаних з активністю протеїнкіназ.
14. Застосування сполуки формули (І) за будь-яким з пп. 1-7 для одержання лікарського засобу, призначеного для лікування проліферативних захворювань, таких як злоякісні пухлини в рідких середовищах, хронічні або гострі лейкози, лімфоцитарні лімфоми, хвороба Ходжкіна, мієлопроліферативні синдроми і мієлодиспластичні синдроми.
15. Застосування сполуки формули (І) за будь-яким з пп. 1-7 для одержання лікарського засобу, призначеного для лікування проліферативних захворювань, таких як злоякісні солідні пухлини, наприклад злоякісні пухлини легенів (NSCLC), кісток, підшлункової залози, шкіри, синдром Капоші, внутрішньоочні меланоми, злоякісні пухлини молочної залози, матки, шийки матки, яєчників, ендометрія, піхви, вульви, сечовипускального каналу, статевого члена, передміхурової залози, карцинома фаллопієвих труб, такі злоякісні пухлини, як GIST і анального каналу, прямої кишки, тонкого кишечнику, товстої кишки, шлунка, стравоходу, ендокринних залоз, щитовидної залози, паращитовидної залози або надниркової залози, саркоми м'яких тканин, саркоми Евінга, остеосаркоми, фібросаркоми шкіри, злоякісні пухлини сечового міхура або нирок, неоплазми центральної нервової системи, пухлини хребетного стовпа або десмоїди, гліоми стовбура головного мозку і гліобластоми, аденоми слизової оболонки носа і їх метастази.
16. Застосування сполуки формули (І) за будь-яким з пп. 1-7 для одержання лікарського засобу, призначеного для лікування незлоякісних проліферативних захворювань, таких як рестеноз, атеросклероз, тромбоз, серцева недостатність, гіпертрофія серця, артеріальна легенева гіпертензія, фіброз, діабетична нефропатія, гломерулонефрит, хронічний пієлонефрит, гемангіоми, аутоімунні захворювання, такі як псоріаз, склеродерматити, імуносупресії.
17. Сполука формули (І) за будь-яким з пп. 1-7 для одержання лікарського засобу, призначеного для лікування захворювань, пов'язаних з активністю протеїнкіназ.
18. Сполука формули (І) за будь-яким з пп. 1-7 для одержання лікарського засобу, призначеного для лікування проліферативних захворювань, таких як злоякісні пухлини в рідких середовищах, хронічні або гострі лейкози, лімфоцитарні лімфоми, хвороба Ходжкіна, мієлопроліферативні синдроми і мієлодиспластичні синдроми.
19. Сполука формули (І) за будь-яким з пп. 1-7 для одержання лікарського засобу, призначеного для лікування проліферативних захворювань, таких як злоякісні солідні пухлини, наприклад злоякісні пухлини легенів (NSCLC), кісток, підшлункової залози, шкіри, синдром Капоші, внутрішньочні меланоми, злоякісні пухлини молочної залози, матки, шийки матки, яєчників, ендометрія, піхви, вульви, сечовипускального каналу, статевого члена, передміхурової залози, карцинома фаллопієвих труб, такі злоякісні пухлини, як GIST і анального каналу, прямої кишки, тонкого кишечнику, товстої кишки, шлунка, стравоходу, ендокринних залоз, щитовидної залози, паращитовидної залози або надниркової залози, саркоми м'яких тканин, саркоми Евінга, остеосаркоми, фібросаркоми шкіри, злоякісні пухлини сечового міхура або нирок, неоплазми центральної нервової системи, пухлини хребетного стовпа або десмоїди, гліоми стовбура головного мозку і гліобластоми, аденоми слизової оболонки носа і їхні метастази.
20. Сполука формули (І) за будь-яким з пп. 1-7 для одержання лікарського засобу, призначеного для лікування незлоякісних проліферативних захворювань, таких як рестеноз, атеросклероз, тромбоз, серцева недостатність, гіпертрофія серця, артеріальна легенева гіпертензія, фіброз, діабетична нефропатія, гломерулонефрит, хронічний пієлонефрит, гемангіоми, аутоімунні захворювання, такі як псоріаз, склеродерматити, імуносупресії.
21. Комбінація щонайменше однієї сполуки формули (І) за будь-яким з пп. 1-7 щонайменше з одним хіміотерапевтичним агентом.
22. Сполука за одним з пп. 18-20, що має здатність інгібувати фосфорилування кіназного домену рецептора PDGF-R бета в клітинах НЕК.
Текст
Реферат: Винахід стосується похідних піридино-піридинонів загальної формули (І), в якій R1, R2, R3, R4, R5, R6, R7, V, W, Y, Z, m мають значення, вказані в описі. Винахід також стосується способу одержання сполук і застосування їх у терапії. UA 102858 C2 (12) UA 102858 C2 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід належить до похідних піридино-піридинонів, заміщених у положенні 7 арилом або гетероарилом, який сам відповідним чином заміщений ланкою типу -[C(R3)(R4)]m-UN(R5)(R6), до способу їх одержання і до застосування їх у терапії як інгібіторів кіназної активності рецепторів до лігандів PDGFs (Platelet derived growth factors) і, необов'язково, рецепторів до ліганду FLT3 (fms-like tyrosine kinase receptor). Рецептори FLT3 і PDGF-R є членами III класу сімейства тирозинкіназних рецепторів (RTK), у яке входять також рецептор фактора стовбурних клітин (c-kit) і рецептор фактора M-CSF (c-fms). Вони характеризуються позаклітинним доменом, що складається з 5 імуноглобулінподібних доменів, що містять ділянку зв'язування з лігандом, трансмембранний домен і внутрішньоклітинну частину, що складається з навколомембранного домену, кіназного домену, розділеного на дві частини інсерційним доменом (split domain)(Ullrich & Schlessinger, 1990). Зв'язування лігандів з рецепторами RTK індукує димеризацію рецепторів, активацію їх тирозинкіназної частини, що приводить до трансфосфорилування тирозинових залишків (Weiss & Schlessinger, 1998). Таким чином, ці фосфориловані залишки є місцем зв'язування з внутрішньоклітинними білками, що беруть участь у передачі сигналу, що in fine провокують різні клітинні відповіді: збереження, поділ, проліферацію, диференціювання або ж міграцію клітин (Claesson-Weish, 1994). Ген, що кодує FLT3, знаходиться на хромосомі 13q12 (Rosnet et al, 1992) і кодує білок FLT3 (антиген CD135), специфічно експресований гематопоетичними клітинами, більш точно, незрілими клітинами, такими як гематопоетичні клітинні лінії і прогеніторні мультипотентні клітини мієлоїдного і лімфоїдного ряду, і його експресія зникає в міру диференціювання гематопоетичних клітин. Його ліганд, ліганд FLT3, індукує димеризацію рецептора і наступне аутофосфорилування внутрішньоклітинної частини рецептора, що приводить до активації сигнального каскаду. Ефекти активації рецептора власним лігандом означають виживаність і збільшення числа прогеніторних мультипотентних клітин. Були виявлені дві ізоформи PDGFs-рецепторів: ланцюг PDGF-R-альфа і ланцюг PDGL-Rбета, що, у відповідь на зв'язування власних лігандів, гомо- або гетеродимеризуються і індукують внутрішньоклітинну сигналізацію. Рецептори до PDGF експресуються, головним чином, клітинами мезенхімного походження і виявлені, зокрема, на фібробластах, на гладком'язових клітинах, перицитах і в гліальних клітинах (Ross et coll. 1986, Heldin, 1992). Фактор росту тромбоцитів "Platelet Derived Growth Factor", PDGF, білок з молекулярною масою близько 30000 дальтон, секретується, головним чином, тромбоцитами, і, додатково, ендотелієм, гладком'язовими клітинами судин і моноцитами. Фактор росту тромбоцитів утворюється з двох поліпептидних ланцюгів, з'єднаних між собою сульфідними місточками, утворюючи або гомодимери, або гетеродимери. Чотири гени (7p22, 22q13, 4q31 і 11q22) описані як гени, здатні кодувати 4 різні поліпептидні ланцюги (A, B, C і D), що після димеризації утворюють п'ять біологічно активних лігандів PDGF-AA, BB, CC, DD і AB (як огляд див. Yu et al. 2003). Була виявлена їхня специфічність, зокрема, ліганд PDGF-AA специфічний для ізоформи альфа рецептора, ліганд PDGF-D специфічний для форми ВВ і ліганд PDGF-С специфічний для форми альфа й альфа/бета. Ліганди PDGFs є могутніми мітогенами, а також задіяні в явищах міграції, виживання, апоптозу і трансформації клітин. Інгібітори активності альфа, бета рецепторів PDGF і FLT3 використовуються в різних терапевтичних галузях. Серед фізіопатологічних станів, у яких можуть бути задіяні ці рецептори, можна назвати рак у рідких середовищах або лейкози, злоякісні солідні пухлини з метастазами або без, де мішенями служать пухлинні клітини і/або клітини навколопухлинної зони (судинні, фібробластові), а також фібрози і судинні захворювання. А. Рак у рідких середовищах Лейкози бувають різних типів і розвиваються або по мієлоїдному типу, або по лімфіодному типу. Експресія FLT3 у лейкозних клітинах, що утворюються при гострому мієлоїдному лейкозі (ГМЛ), складає близько 100 % у залежності від конкретного хворого, таким чином, FLT3 сприяє стимуляції виживання і проліферації лейкозних клітин (Carow et al, 1996; Drexler et al, 1996, Stacchini et al, 1996). Крім того, FLT3 є місцем локалізації активуючих мутацій, виявлених у 22-30 % дорослих хворих ГМЛ і в 11 % дітей. Найчастіше, мова йде про внутрішнє тандемне подвоєння (ITD), що спостерігається на трансмембранній ділянці рецептора (більш конкретно, між 14 і 15 екзонами). Ці мутації зберігають рамку зчитування, при цьому розмір мутацій може варіювати між 18 і 111 парами основ. Рідше, тобто, приблизно у 7 % хворих ГМЛ, виявлена точкова мутація по залишку D835, розташованому в кіназному домені. У більшості випадків, форми FLT3 ITD створюють більш високий ризик розвитку рецидиву хвороби і є прогностичними маркерами 1 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 60 низької виживаності хворих. Ці два типи мутацій приводили до конститутивної активації кіназного домену, що не залежить від стимуляції з боку ліганду, і показали себе як фактор, що трансформує гематопоетичні клітини in vitro і in vivo (Mizuki et al, 2000; Tse et al, 2000). Автори Kelly et coll. (2002) за допомогою тонкого експерименту на реконструкційній моделі кісткового мозку у мишей показали, що форма FLT3 ITD викликає мієлопроліферативний синдром. Інтерес до використання інгібіторів тирозинкіназної активності був підтверджений одночасно в тестах in vitro і in vivo декількома дослідницькими групами, а також дослідженнями FLT3 ITD недавнього часу на реконструкційній моделі кісткового мозку; цей інгібітор показав себе як продукт, здатний індукувати регресію пухлини і збільшувати тривалість життя тварин (Ofarrel, 2003). Більше того, останні дані показали інтерес використання комбінації таких інгібіторів з цитотоксичними препаратами, яким є, наприклад, даунорубіцин (Levis et al, 2004). Цікавим представляється і той факт, що бластичні клітини типу ГМЛ можуть також суперекспресувати інші рецептори з кіназною активністю, такі як c-kit або ж PDGF-R. Мієлопроліферативний/диспластичний синдроми Досить часто цитогенетичні аномалії, викликані хромосомними транслокаціями, зв'язують з мієлопроліферативними синдромами. Ці хромосомні перебудови приводять до генерування розрегульованих злитих білків з тирозинкіназною активністю, що беруть участь у проліферації мієлоїдних бластних клітин. Злиті білки з кіназною активністю рецептора PDGF-R бета Злиті білки з кіназною активністю рецептора PDGF-R бета складаються з внутрішньоклітинної частини рецептора PDGF-R бета і, з іншого боку, з N-кінцевого домену іншого білка (звичайно фактора транскрипції). Зокрема, вони мають відношення до хронічного мієломоноцитарного лейкозу (ХММЛ) і являють собою білки: Rab5/PDGF-R бета, H4-PDGF-R бета, HIР1-PDGF-RВ або ще Tel/PDGF-R бета. Найбільш показовий останній білок. Він утвориться при транслокації t(5;12)(q31;p12) і кодує злитий білок, що складається з N-кінцевої ділянки фактора транскрипції Tel і С-кінцевої ділянки рецептора PDGF-R бета. Олігомеризаційний домен, що знаходиться в зоні Tel, приводить до утворення димерної форми злитого білка і до конститутивної активації кіназного домену. Цей білок показав себе in vitro як сполуку, здатну трансформувати в кілька прийомів гематопоетичні клітини, зокрема, більш докладно про це описано в статті M.Carrol et coll. PNAS, 1996, 93, 14845-14850). In vivo цей злитий білок приводить до синдрому гіперпроліферації мієлоїдних клітин (Ritchie et coll. 1999). Крім того, у тварин і, як показали клінічні дослідження, у людини інгібітори тирозинкіназної активності інгібують проліферацію бластних клітин і дозволяють загальмувати процес лейкогенезу. Злиті білки з кіназною активністю рецептора PDGF-R альфа До двох злитих білок, до складу яких входить рецептор PDGF-R альфа, відносять білки: bcrPDGF-R альфа, присутній у клітинах атипічної хронічної мієлоїдної лейкемії (ХМЛ), і FIP1L1PDGF-R альфа, виявлений у субпопуляції лейкемічних клітин, причому джерелом походження LEC "еозинофільної лейкемії" є синдром гіпереозинофілії (Griffin et coll. 2003). Цей злитий білок має конститутивну активність кіназного домену в рецепторі PDGF-R альфа і є відповідальним за безладну проліферацію згаданих клітин. Інгібітори кіназної активності рецептора PDGF-R альфа показали себе ефективними відносно проліферації FIP1L1-PDGF-R альфа позитивних клітин, тому останнім часом сполука, що є інгібітором такого роду, була рекомендована для лікування HES/CEL (гіпереозинофільного синдрому/хронічної еозинофільної лейкемії). Таким чином, інгібування кіназної активності рецепторів PDGF-R альфа і бета й активності FLT3wt і FLT3ITD, як це показали сполуки відповідно до винаходу, становить терапевтичний інтерес для лікування ГМЛ. Крім ГМЛ і мієлопроліферативних синдромів інші види лейкозів також можуть становити інтерес як мішені для таких інгібіторів, у тому числі лейкози B-LAL і T-LAL (гострі лімфоїдні Тклітинні або В-клітинні лейкози), при яких також експресується FLT3. Крім того, у зв'язку з тим, що FLT3 у нормі експресований на клітинах гематопоетичних клітинних ліній, і тим, що експресія цього рецептора виявлена на клітинах лейкемічних клітинних ліній, інгібітори кіназної активності FLT3 можуть виявитися цікавими для лікування лейкозів будь-якого типу (у тому числі ХМЛ, хронічний мієлоїдний лейкоз), при яких клітини лейкемічних клітинних ліній задіяні в стійкості рецидиву захворювання. В. Солідні злоякісні пухлини Інгібітори тирозинкіназної активності альфа- і бета-рецепторів PDGF-R можуть бути цікаві для лікування солідних злоякісних пухлин, вибираючи як мішень або безпосередньо пухлинну 2 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 клітину, що завдяки аутокринному або паракринному механізму стає чутливою до інгібітору тирозинкіназної активності PDGF-R, або клітини, що оточують пухлину, у цьому випадку дестабілізується судинна мережа пухлини, що сприяє сполуці інгібітору з іншими терапевтичними агентами. Приклади солідних злоякісних пухлин, де як мішень вибрана пухлинна клітина * Рак м'яких тканин: саркома Евінга Саркома Евінга являє собою вид кісткового раку, що виникає головним чином у дітей і молодих людей (середній вік 13 років). Цей вид раку складає 10 % від числа примітивних кісткових пухлин і має високий ризик метастазування. Це пухлина, що рідко зустрічається, яка торкається 2-3 чоловік на мільйон жителів у рік. Пухлинні клітини характеризуються транслокацією хромосоми t(11;12), що кодує злитий білок EWS/FLI1. Відповідальними клітинами є клітини мезенхіми, що експресують рецептор PDGF-R бета, що індукує рухливість і ріст клітин саркоми Евінга при стимулюючій участі PDGF-BB (Uren et al. 2003). Крім того, Zwerner and May (2001) довели існування експресії PDGF-C клітинами саркоми Евінга. Ці ж клітини експресують також рецептор RTK c-kit і було показано, що інгібітор кіназної активності рецептора PDGF-R і c-kit здатний інгібувати пухлинний ріст клітин саркоми Еванса в мишачій моделі ксенотрансплантата (Merchant et coll., 2002). * Пухлина сполучної тканини (GIST, фібросаркома шкіри) - GIST (стромальні гастроінтестинальні пухлини) Група під керівництвом Fletcher (2004) зацікавилася тим, що в 15 % хворих GIST ген KIT не піддається мутації і не виявляє суперекспресію (KIT-wt). Дослідники спостерігали сильну гіперекспресію рецептора PDGF-R альфа. Ця ситуація спостерігалася приблизно в одній третині випадків захворювань GIST KIT-wt. Що стосується мутацій рецепторів PDGF-RA, то дослідники спостерігали ці мутації (що склали 35 %) у випадках, коли KIT експресувався в нормі. Мутації рецептора PDGF-RA збільшували тирозинкіназну і конститутивну активність і торкалися аспартамової кислоти в положенні 842 амінокислотної послідовності. Також як і у випадку саркоми Евінга, два інгібітори кіназної активності рецепторів c-kit і PDGF-R показали свою ефективність in vitro і in vivo відносно проліферації клітин мутованого PDGF-R альфа (Le Tourneau et coll. 2007; Cortess et coll., 2005). - фібросаркоми шкіри (Дар'є-Феррана або вибухаючі або DFSP) Фібросаркома шкіри Дар'є-Феррана (або DFSP) являє собою клітинну фузиформну пухлину шкіри з проміжним ступенем злоякісності, що характеризується повільним розвитком і високим ризиком рецидиву у випадку неповного видалення. Генетична аномалія, відзначена в 95 % випадків захворювання, відкрита в 1990 році, коли була виявлена, зокрема, транслокація хромосом 17 і 22 t(17-22)(q22;q13), що привела до злиття генів COL1A1 і PDGF B і великої кількості білка PDGFВ, гіперекспресуючого свій тирозинкіназний рецептор PDGFR. Інгібування кіназної активності рецептора PDGF-R є багатообіцяючою терапією, оскільки in vitro це приводить до зниження росту пухлини в моделях пухлинного трансплантата в імунодефіцитних мишей (Sjöblom T et coll., 2001). Крім того, клінічні дослідження показали ефективність (повна або часткова ремісія) такої молекули при захворюваннях DFSP (як огляд див. Mc Arthur, 2007). * Гліоми і гліобластоми Гліобластома є найбільш розповсюдженою і найбільш агресивною пухлиною головного мозку при середній тривалості життя хворого близько 1 року. PDGF і його рецептори (альфа і бета) найчастіше експресуються в гліомах. Існує припущення, що аутокринна/паракринна петля може сприяти патогенезу цих пухлин. Рецептор PDGF-R альфа експресується, переважно, в клітинах пухлини, тоді як рецептор PDGF-R бета експресується, переважно, в судинних ендотеліальних клітинах пухлини. Блокування кіназної активності рецептора PDGF-R показали свою ефективність: 1) in vitro шляхом зменшення числа колоній у м'якому агарі і інгібування проліферації клітинних ліній, 2) шляхом зниження пухлинного росту в моделях трансплантата в голих мишей, 3) у можливості поєднувати вказане блокування з опроміненням на моделі внутрішньочерепної трансплантації клітинних ліній гліобластом (Oerbel et al. 2006; Geng et coll., 2005, Strawn et coll., 1994 Chin et al., 1997). Таким чином, сполуки відповідно до винаходу становлять інтерес для лікування саркоми Еванса, GIST, фібросарком шкіри, а також демоїдних пухлин, гемангіом і інших фібросарком, при яких спостерігається експресія PDGF-R. С. PDGF-R рецептор як терапевтична мішень в навколопухлинній зоні Ангіогенез Клітини навколопухлинної зони складають невід'ємну частину розвитку раку незалежно від того, первинна пухлина або вторинна (метастази). Серед клітин цієї зони, що експресують 3 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 60 рецептор PDGF і відносно яких виявлена роль цього рецептора, зустрічаються клітини стінок судин, тобто, перицити, і гладком'язові клітини, а також активовані фібробласти. Ангіогенез є процесом генерування нових капілярів із попередніх кровоносних судин або ж шляхом мобілізації і диференціювання клітин кісткового мозку. Так, була відзначена в процесах неоваскуляризації пухлин одночасна неконтрольована проліферація ендотеліальних клітин і мобілізація ангіобластів з кісткового мозку. Було показано in vitro і in vivo, що багато факторів росту стимулюють ендотеліальну проліферацію, такі як, наприклад, фактори VEGF і FGF. Крім вказаних механізмів було також установлено, що клітини стінок, такі як перицити і гладком'язові клітини, беруть участь у стабілізації новоствореної мережі судин. Неправильна експресія рецептора PDGF-R бета є причиною дефіциту перицитів у мишей і приводить до смерті тварин наприкінці вагітності, викликаної мікрокрововиливами і набряками (Hellstrom et al, 1999, Hellstrom et al, 2001). Відповідно до тонкого експерименту з трансплантацією клітин експресія PDGF-R бета перицитами необхідна для залучення перицитів до судин пухлини шляхом утримування PDGF-B ендотеліальними клітинами, а також PDGF-B, що секретується пухлинними клітинами (Abramsson et al, 2003). На трансгенній моделі Rip1Tag2 раку підшлункової залози, описаної Song et coll., також була показана експресія PDGF-R бета на прогеніторних периваскулярних клітинах головного мозку, що походять з кісткового мозку, при цьому прогеніторні клітини диференціювалися в зрілі перицити навколо пухлини. Інтерес блокування активності рецептора PDGF-R на пухлинних перицитах був продемонстрований на прикладі використання інгібітору тирозинкіназної активності рецептора PDGF-R у тваринних моделях (трансгенна модель пухлини підшлункової залози і модель імплантованої гліоми) і виявилося, що вплив на ріст пухлини був значним при поєднанні з інгібітором кіназної активності рецептора VEGF-R (Bergers et coll., 2003). Літературні дані (Сao et al, 2002, Fons et coll., 2004) підтверджують також участь PDGF-R альфа і PDGF-С в ангіогенезі й у диференціюванні прогеніторних ендотеліальних клітин у перицити і гладком'язові клітини. Активовані фібробласти Рецептор PDGF-R знаходиться в надлишку в пухлинній стромі і виявляється на активованих фібробластах (міофібробласти). Було показано на прикладі двох дослідів, що асоціація інгібіторів або антагоністів рецептора PDGF-R з цитотоксичними агентами приводить до зниження мікрощільності судин ракових пухлин яєчників (Apte et coll., 2004) і ракових пухлин підшлункової кислоти (Hwang et coll., 2003). Рецептор PDGF-R бета регулює тиск у інтерстиційних тканинах пухлини (Heuchel et coll., 1999), а спільне використання інгібіторів PDGF-R і хіміотерапевтичних агентів поліпшує їхню доставку в пухлинні клітини й одночасно зменшує внутрішньопухлинний тиск (Griffon-Etienne, 1999). І, нарешті, на мишачій моделі продемонстровано, що введення інгібітору кіназної активності PDGF-R поліпшує засвоєння хіміотерапевтичних агентів пухлиною і, таким чином, збільшує їхню ефективність (GriffonEtienne, 1999; Pietras et coll., 2002; Pietras et coll., 2003). Ці ефекти безсумнівно є ефектом TAF (tumour associated fibroblastes, пухлина-асоційованих фібробластів), що називаються також CAF (carcinoma associated fibroblastes, карцина-асоційованими фібробластами), активованих фібробластів, що знаходяться навколо пухлини, що експресують PDGF-R, як це підтверджено недавніми роботами Hwang et coll., (2008), Kain et al (2008), Pietras et al (2008) на моделях vivo раку підшлункової залози і цервікального канцерогенезу. Стимуляція, викликана PDGFлігандом, що продукується пухлинними клітинами, стимулює фібробласти, що виробляють позаклітинний матрикс і, таким шляхом, збільшують інтерстиційний тиск. Крім того, зменшуючи цей тиск можна полегшити доставку лік до пухлини молочної залози і, таким чином, збільшити їхню ефективність. Це означає, що активовані фібробласти, що знаходяться в пухлинній стромі, представляють нову терапевтичну мішень в онкології (як огляд див. Bouzin & Feron, 2007). Метастази Багато робіт указують на те, що пари рецептор PDGFR і його PDGF-ліганд бере участь у розвитку метастазування, і стверджують, що вони впливають на ангіогенез і на метастазування через кров'яне русло, а також впливають на лімфангіогенез і, отже, на метастазування через лімфатичне русло. Зокрема, в одному науковому журналі документально підтверджується пряма участь PDGF-ВВ у лімфангіогенезі й у лімфатичному метастазуванні (Сао et coll., 2005). Але в більшості робіт говориться про експресію PDGF-R у тканини, оточуючої метастази, що сприяє виникненню і розвитку вторинних пухлин. Найчастіше як приклад посилаються на розвиток метастаз у кістці. * Приклад раку передміхурової залози Кіста часто є місцем виникнення метастаз. 85-100 % хворих, що помирають від раку передміхурової залози, мають метастази в кістах. Хіміотерапія поліпшує як показник виживаності без прогресії захворювання, так і загальний показник виживаності, однак через 4 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 60 дуже високу гетерогенність метастаз у кістці в того самого пацієнта хіміотерапія виявляється неефективною як лікувальний засіб. Було показано на моделі імунодефіцитної миші, що PDGFВВ відіграє важливу роль у розвитку остеобластичних метастаз кісткової тканини in vivo (Yu et coll., 2003). Що стосується PDGF-DD, те він прискорює ріст пухлинних клітин передміхурової залози і збільшує їхню взаємодію з клітинами строми. Експресія рецептора PDGF альфа і бета виявлена відповідно в 62-75 % випадків раку передміхурової залози. Крім того, імуногістохімічний аналіз показав, що пухлина передміхурової залози і її метастази експресували PDGF-R (Hwang et coll., 2003). Автори Kim et coll.,(2003) показали, що PDGF-R експресується в кісткових метастазах і ендотеліальних клітинах кровоносних судин, залежних від метастаз. Інгібітор тирозинкіназного PDGF-R, з'єднаний з цитотоксичним агентом, значно знижує кількість кісткових метастаз раку передміхурової залози в мишачій моделі (Uehara et coll., 2003). Крім того, ця ж сама асоціація приводить до апоптозу пухлинних клітин, епітеліальних клітин кровоносних судин і до інгібування росту пухлинних клітин у кістці. Блокування цих рецепторів і їхніх шляхів сигналізації в кістці являють собою нове терапевтичне рішення (Hwang et coll., 2003; Uehara et coll., 2003). Клінічні дослідження на людях показали перевагу, що дає асоціація інгібітору PDGF-R і цитотоксичного агента пацієнтам, що хворіють гормонорезистентним раком передміхурової залози з кістковими метастазами. Зменшення рівня маркера (передміхурова залоза-специфічний антиген) PSA > 50 % спостерігалося в 38 % пацієнтів. Середня тривалість відповіді PSA складала 8 місяців, а тривалість періоду виживання без прогресії захворювання складала 11 місяців. Виходячи з цих різних публікацій зрозуміло, що сполуки відповідно до винаходу становлять інтерес для лікування солідних ракових пухлин у зв'язку з їхнім ефектом, здійснюваним на клітини тканини, що оточує пухлину, і з ефектом, що досягається при використанні асоціації з іншими терапевтичними агентами, таким як цитотоксичні агенти, або інгібіторами ангіогенезу. D. Фібрози Причиною фіброзів часто є одна первинна подія, така як ракова пухлина, радіотерапія, гепатити, алкоголізм. Участь у них PDGF чітко доведено на прикладі фіброзу легенів (включаючи асбестоз), фіброзу нирок (гранулонефрит), фіброзу кісткового мозку (часто асоційованого з мегакаріоцитарним лейкозом), індукованого радіотерапією, а також на прикладі фіброзу печінки і підшлункової залози (зв'язаного з алкоголізмом або з гепатитами) (як огляд див. JC Bonner, 2004). Зокрема, була чітко показана суперекспресія PDGF, а також представлені зв'язані з нею результати дослідження, отримані на моделях in vivo з інгібіторами ТК-активності PDGF-R. Серед цих досліджень одне з них, здійснене дослідниками Einter et coll. (2002), довело, що PDGF-СС є могутнім індуктором ниркового фіброзу. Дослідники провели тест на ефективність нейтралізуючих антитіл у моделях з однобічним перев'язуванням уретри, при якому особливо швидко розвивається фіброз. Вони відзначили яскраво виражений антифіброзний ефект з одночасним зниженням скупчення міофібробластів, зниженням скупчення позаклітинного матриксу і зниженням шарів колагену IV типу. Інше дослідження, проведене на моделі фіброзу легень, індукованого блеоміцином у мишей, показало ефективність інгібітору ТК-активності PDGF-R відносно попередження фіброзу завдяки інгібуванню проліферації мезенхімальних клітин (Aono et coll., 2005). На моделі фіброзу, індукованого азбестом, інгібітор PDGF-R TK знизив прогресію фіброзу в легеневій паренхімі і зменшив колагеновий шар (Vuorinen K, Gao F, Oury TD, Kinnula VL, Myllarniemi M. Imatinib mesylate inhibits fibrogenesis in asbestos-induced interstitial pneumonia. Exp Lung Res. 2007 Sep; 33(7): 357-73). Багатьма дослідницькими групами була підтверджена участь PDGF-R у фіброзі печінки. Було чітко доведено, що PDGF ВВ і DD мають профіброгенну дію на печінкові зірчасті клітини (Rovida et coll., 2008; Borkham-Kamphorst et coll., 2007). У тесті in vivo інгібітор PDGF-R TK виявився здатним знизити фіброгенез на ранній стадії на моделі з перев'язаною жовчною протокою в щура (Neef et coll., 2006). Таким чином, на основі опублікованих у літературі даних, сполуки відповідно до винаходу становлять терапевтичний інтерес для лікування різних типів фіброзу. Е. Судинні захворювання: атеросклероз і рестеноз, артеріосклероз Проліферація і міграція гладком'язових клітин судин сприяють гіпертрофії інтими артерій і в такий спосіб відіграють домінуючу роль у формуванні атеросклерозу і рестенозу після ангіопластики і ендоартеректомії. Було чітко показано in vitro і in vivo на моделях тварин, що PDGF задіяний в вказаних явищах. Зокрема, in vivo було показано збільшення експресії PDGF у моделі "Vein graft" у свині. Крім того, було також показано, що інгібітор ТК-активності PDGF-R послідовно знижує розмір уражень торакальної і абдомінальної артерії в діабетичних мишей АроЕ-КО (тварини оброблені стрептозотоцином). Інше дослідження показало, що інгібування сигнальних шляхів, індуковане PDGF (ТК або антизначеннєвий PDGF-А) приводить до зниження 5 UA 102858 C2 5 10 15 20 утворення неоінтими в моделях "ballon injury" і "coronary artery restenosis" (Deguchi J., 1999, Ferns et coll. 1991, Sіrоіs et al, 1997, Lindner et coll. 1995). Таким чином, інгібітори тирозинкіназної активності PDGF-R, такі як сполуки відповідно до винаходу, являють собою терапію вибору, або в індивідуальному вигляді, або в сполученні з антагоністами інших факторів росту, задіяних у названих патологіях, таких як FGF, при лікуванні патологій, пов'язаних із проліферацією гладком'язових клітин судин, таких як атеросклероз, пост-ангіопластичний рестеноз, або наслідку встановлення ендоваскулярних протезів (стентів) або в процесі аортокоронарного шунтування. Сполуки відповідно до винаходу, що мають інгібуючу активність відносно ТК-активності PDGF-R, становлять інтерес для лікування вказаних судинних захворювань. F. Інші захворювання Сполуки відповідно до винаходу можуть бути показані для лікування інших патологій, зокрема, артеріальної легеневої гіпертензії (HTAP) у ідіопатичній формі. HTAP характеризується стійким підвищеним тиском у легеневій артерії, що приводить до недостатності правого шлуночка і, часто, до смерті пацієнта. Вона асоціюється з ростом проліферації і міграції гладком'язових клітин судин легень. Автори Schermuly et coll., (2005) показали, що інгібування тирозинкіназної активності рецепторів PDGF значно поліпшує перебіг хвороби. Для цього автори використовували серед іншого модель експериментальної легеневої артеріальної гіпертензії в щура, створеної введенням монокроталіну протягом 28 днів. Усі щури, оброблені лікарським засобом, вижили, а 50 % щурів з контрольної неопрацьованої групи померли. Даний винахід належить до сполук формули (I): 25 30 35 40 45 50 у якій: R1 означає (С1-С4)алкільну групу, R2 означає -(СН2)n'-В, де n'=0,1,2,3,4 і В є (С3-С5)циклоалкільною або групою (С1С4)алкільною групою, необов'язково заміщеною одним або декількома атомами фтору, (С1С4)алкоксигрупою, U означає карбонільну групу або групу -СН2-, Y, Z, V і W позначають, незалежно один від іншого, групу -СН- або атом вуглецю, необов'язково заміщений групою R7, або гетероатом, такий як атом азоту або атом або сірки атом кисню, або не містить його, причому цикл повинен бути ароматичним і містити від 5 до 6 ланок, R3, R4 означають, незалежно один від іншого, атом водню або лінійну (С1-С4)алкільну групу, або R3 і R4 разом з атомом вуглецю, з яким вони зв'язані, утворюють (С3-С5)циклоалкільну групу, m є цілим числом, що дорівнює 1, 2, 3, 4, R5 означає атом водню або (С1-С4)алкільну групу, R6 означає -(CH2)n-L, у якій n=0, 1, 2, 3 і L є групою, вибраною незалежно з наступних груп: - (С1-С5)алкільної групи, необов'язково заміщеної (С1-С4)алкоксигрупою, - (С3-С5)циклоалкільної групи, - арильної групи, що містить 6 атомів вуглецю, необов'язково заміщеної одним або декількома атомами галогену, - гетероарильної групи, що містить 5-6 ланок, у якій щонайменше один гетероатом, вибраний з атома азоту або сірки, необов'язково заміщений (С1-С4)алкільною групою, - гетероциклічної насиченої групи, у якій вказаний гетероцикл містить 4-7 ланок, щонайменше один гетероатом якого вибраний з атома азоту, атома кисню, і необов'язково заміщеної в будь-якій позиції, у тому числі на атомі азоту, одним або декількома замісниками, вибраними з атома фтору, фтор(С1-С4)алкільної групи, (С1-С4)алкільної групи, лінійної або розгалуженої, (С3-С5)циклоалкільної групи або (С1-С4)алкілсульфонамідної групи, 6 UA 102858 C2 R7 означає атом водню або (С1-С4)алкільну групу або атом галогену. Даний винахід належить до сполук формули (I): , 5 10 15 20 25 30 35 40 45 50 у якій: R1 означає (С1-С4)алкільну групу, R2 означає -(СН2)n'-В, де n'=0,1,2,3,4 і В є (С3-С5)циклоалкільною групою або (С1С4)алкільною групою, необов'язково заміщеною одним або декількома атомами фтору, (С1С4)алкоксигрупою, U означає карбонільну групу або групу -СН2-, Y, Z, V і W позначають, незалежно один від іншого, групу -СН- або атом вуглецю, необов'язково заміщений групою R7, або гетероатом, такий як атом азоту або атом або сірки атом кисню, або не містить його, причому цикл повинен бути ароматичним і містити від 5 до 6 ланок, R3, R4 означають, незалежно один від іншого, атом водню або лінійну (С1-С4)алкільну групу, або R3 і R4 разом з атомом вуглецю, з яким вони зв'язані, утворюють (С3-С5)циклоалкільну групу, m є цілим числом, що дорівнює 1, 2, 3, 4, R5 означає атом водню або (С1-С4)алкільну групу, R6 означає -(CH2)n-L, у якій n=0, 1, 2, 3 і L є групою, вибраною незалежно з наступних груп: - (С1-С5)алкільної групи, необов'язково заміщеної (С1-С4)алкоксигрупи, - (С3-С5)циклоалкільної групи, - арильної групи, що містить 6 атомів вуглецю, необов'язково заміщеної одним або декількома атомами галогену, - гетероарильної групи, що містить 5-6 ланок, у якій щонайменше один гетероатом, вибраний з атома азоту або сірки, необов'язково заміщений (С1-С4)алкільної групою, - гетероциклічної насиченої групи, у якій вказаний гетероцикл містить 5-7 ланок, щонайменше один гетероатом якого вибраний з атома азоту, атома кисню, і необов'язково заміщеної в будь-якій позиції, у тому числі на атомі азоту, одним або декількома замісниками, вибраними з атома фтору, фтор(С1-С4)алкільної групи, (С1-С4)алкільної групи, лінійної або розгалуженої, (С3-С5)циклоалкільної групи або (С1-С4)алкілсульфонамідної групи, R7 означає атом водню або (С1-С4)алкільну групу або атом галогену. Сполуки формули (I) можуть містити один або декілька асиметричних атомів вуглецю. Отже, вони можуть знаходитися у формі енантіомерів або діастереоізомерів. Ці енантіомери, діастереоізомери, а також їхні суміші, у тому числі рацемічні, становлять частину винаходу. Наприклад, коли L означає гетероциклічну групу, абсолютна конфігурація атома вуглецю, заміщеного на вказаному гетероциклі, може бути R або S. Сполуки формули (I) можуть знаходитися, зокрема, у вигляді основ або адитивних солей з кислотами. Такі адитивні солі становлять частину винаходу. Ці солі можна одержувати за допомогою фармацевтично прийнятних кислот, а також за допомогою інших кислот, корисних, наприклад, для очищення або виділення сполук формули (I), вони також становлять частину винаходу. Сполуки формули (I) можуть також існувати у формі сольватів, а саме, у формі асоціацій або комбінацій з однією або декількома молекулами розчинника. Такі сольвати також становлять частину винаходу. У рамках даного винаходу мають на увазі під: - алкільною групою: аліфатичну насичену групу, що містить 1-7 атомів вуглецю (переважно, 1-4 атома вуглецю), причому ланцюг є лінійним або, коли алкільний ланцюг містить не менше 3 атомів вуглецю, він може бути розгалуженим або циклічним (включаючи циклізацію тільки часткову). Як приклади можна назвати групи метильну, етильну, пропільну, ізопропільну, 7 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 бутильну, ізобутильну, трет-бутильну, метилциклопропільну, пентильну, 2,2-диметилпропільну, гексильну, гептильну групу і т. д., а також циклоалкільні групи, описані нижче; - циклоалкільною групою: циклічну алкільну групу, що містить 3-7 атомів вуглецю (переважно, 3-5 атомів вуглецю), всі атоми вуглецю якої зайняті в циклі. Можна назвати циклопропільну, циклобутильну, циклопентильну, циклогексильну і циклогептильну групи; - алкоксигрупою: -О-алкільну групу, у якій алкільна група має значення, описане вище; - атомом галогену: фтор, хлор, бром або йод; - галогеналкільною групою: групу, що містить алкільну групу, що визначена вище, у якій один або кілька атомів водню заміщені атомом галогену, що визначений вище; - гетероатомом: атом азоту, кисню або сірки; - арильною групою: ароматичну моноциклічну групу, що містить 6 ланок, наприклад, фенільну групу; - гетероарильною групою: ароматичну моноциклічну групу, що містить 5-7 ланок, у якій 1-3 гетероатома є такими, як вони визначені вище. Як приклад можна назвати піридинову, піразинову, піримідинову, імідазольну, пірольну, тіофенову, тіазольну групи; - гетероциклічною групою: алкільну циклічну групу, що містить 5-7 ланок, у якій один або декілька гетероатомів визначені вище. Як приклади можна назвати піролідинову, морфолінову, піперидинову, піперазинову групи. Серед сполук формули (I) відповідно до винаходу можна назвати групу сполук, що визначені як вказано нижче: R1 означає (С1-С4)алкільну групу, R2 означає -(СН2)n'-В, де n'=0,1 і В є (С3-С5)циклоалкільною групою або (С1-С4)алкільною групою, необов'язково заміщеною одним або декількома атомами фтору, (С1С4)алкоксигрупою, U означає карбонільну групу або групу -СН2-, Y, Z, V і W позначають, незалежно один від іншого, групу -СН- або атом вуглецю, необов'язково заміщений групою R7, або гетероатом, такий як атом азоту або атом сірки або атом кисню, або не містить його, причому цикл повинен бути ароматичним і містити від 5 до 6 ланок, R3, R4 означають, незалежно один від іншого, атом водню або лінійну (С1-С4)алкільну групу, або R3 і R4 разом з атомом вуглецю, з яким вони зв'язані, утворюють (С3-С5)циклоалкільну групу, m є цілим числом, що дорівнює 1, 2, 3, 4, R5 означає атом водню або (С1-С4)алкільну групу, R6 означає -(CH2)n-L, у якій n=0, 1, 2, 3 і L є групою, вибраною незалежно з наступних груп: - (С1-С5)алкільної групи, необов'язково заміщеної (С1-С4)алкоксигрупою, - (С3-С5)циклоалкільної групи, - арильної групи, що містить 6 атомів вуглецю, необов'язково заміщеної одним або декількома атомами галогену, - гетероарильної групи, що містить 5-6 ланок, у якій щонайменше один гетероатом, вибраний з атома азоту або сірки, необов'язково заміщений (С1-С4)алкільної групою, - гетероциклічної насиченої групи, у якій вказаний гетероцикл містить 5-7 ланок, щонайменше один гетероатом якого вибраний з атома азоту, атома кисню, і необов'язково заміщеної в будь-якій позиції, у тому числі на атомі азоту, одним або декількома замісниками, вибраними з атома фтору, фтор(С1-С4)алкільної групи, (С1-С4)алкільної групи, лінійної або розгалуженої, (С3-С5)циклоалкільної групи або (С1-С4)алкілсульфонамідної групи, R7 означає атом водню або (С1-С4)алкільну групу або атом галогену. Серед сполук формули (I) відповідно до винаходу першу підгрупу сполук складають сполуки, у яких U означає карбонільну групу. Серед сполук формули (I) відповідно до винаходу другу підгрупу сполук складають сполуки, у яких U означає -СН2-групу. Серед сполук формули (I) відповідно до винаходу третю підгрупу сполук складають сполуки, у яких цикл, що включає Y, Z, V і W, вибраний з фенільної, піридинової, тіазольної, тіофенової групи. Серед сполук формули (I) відповідно до винаходу четверту підгрупу сполук складають сполуки, у яких R3 означає атом водню. Серед сполук формули (I) відповідно до винаходу п'яту підгрупу сполук складають сполуки, у яких R4 означає атом водню. 8 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 60 Серед сполук формули (I) відповідно до винаходу шосту підгрупу сполук складають сполуки, у яких R5 означає атом водню. Серед сполук формули (I) відповідно до винаходу сьому підгрупу сполук складають сполуки, у яких L означає (С1-С5)алкільну групу, необов'язково заміщену (С1-С4)алкоксигрупою. Серед сполук формули (I) відповідно до винаходу восьму підгрупу сполук складають сполуки, у яких L означає (С3-С5)циклоалкільну групу. Серед сполук формули (I) відповідно до винаходу дев'яту підгрупу сполук складають сполуки, у яких L означає гетероарильну групу, що містить 5-6 ланок, щонайменше один гетероатом якої вибраний з атома азоту або сірки, необов'язково заміщеного (С1-С4)алкільною групою. Переважно, гетероарильна група вибрана з піридинової, піразинової, піримідинової, імідазольної, пірольної, тіазольної групи. Серед сполук формули (I) відповідно до винаходу десяту підгрупу сполук складають сполуки, у яких L означає гетероциклічну насичену групу, у якій вказаний гетероцикл містить 5-7 ланок, щонайменше один гетероатом якого вибраний з атома азоту, атома кисню, і необов'язково заміщену в якому-небудь положенні, включаючи атом азоту, одним або декількома замісниками, вибраними атома фтору, фтор(С1-С4)алкільної групи, лінійної або розгалуженої (С1-С4)алкільної групи, (С3-С5)циклоалкільної групи або (С1С4)алкілсульфонамідної групи. Переважно, вказана гетероциклічна група вибрана з піролідинової, морфолінової групи. Серед сполук формули (I) відповідно до винаходу одинадцяту підгрупу сполук складають сполуки, у яких m дорівнює 1. Серед сполук формули (I) відповідно до винаходу дванадцяту підгрупу сполук складають сполуки, у яких ланцюг -[C(R3R4)]m-U-N(R5)(R6) знаходиться в пара-положенні стосовно циклу, з яким вона зв'язана. Серед сполук формули (I) відповідно до винаходу тринадцяту підгрупу сполук складають сполуки, у яких ланцюг -[C(R3R4)]m-U-N(R5)(R6) знаходиться в мета-положенні стосовно циклу, з яким вона зв'язана. Усі групи і підгрупи можуть бути незалежно один від одного використані у вигляді комбінацій для одержання сполук відповідно до винаходу. Серед комбінацій груп і підгруп, що відповідають сполукам відповідно до винаходу, можна назвати першу комбінацію, що відповідає сполукам, у яких: U означає карбонільну групу, R3, R4 означають атом водню, R5 означає атом водню, R7 означає атом водню, m дорівнює 1, і R1, R2, Y, Z, V, W, R6, n мають значення, що визначені вище. Можна назвати другу комбінацію, що відповідає сполукам відповідно до винаходу, у яких: R1 означає (С1-С4)алкільну групу, R2 означає -(СН2)n'-В, де n'=0 або 1 і В є (С3-С5)циклоалкільною групою або (С1С4)алкільною групою, U означає карбонільну групу, Y, Z, V, W означають, незалежно один від іншого, гетероатом, атом вуглецю, заміщений групою R7, або групу -СН-, R7 означає атом водню або галогену або (С1-С4)алкільну групу, R3 означає атом водню, R4 означає атом водню або (С1-С4)алкільну групу, R5 означає атом водню, R6 означає -(СН2)n-L, де L означає групу, вибрану з наступних груп: - арильної групи, що містить 6 атомів вуглецю, необов'язково заміщеної одним або декількома атомами галогену, - гетероарильної групи, що містить 5-6 ланок, щонайменше один гетероатом якої вибраний з атома азоту або сірки, - насиченої гетероциклічною групи, у якій вказаний гетероцикл містить 5-6 ланок, щонайменше один гетероатом якого вибраний з атома азоту, атома кисню, і необов'язково заміщеної в якому-небудь положенні, включаючи атом азоту, одним або декількома замісниками, вибраними з атома фтору, фтор(С1-С4)алкільної групи, (С1-С4)алкільної групи або (С3-С5)циклоалкільної групи, m дорівнює 1, і n має значення, що визначені вище. 9 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 60 Можна назвати третю комбінацію, що відповідає сполукам відповідно до винаходу, у яких: R1 означає (С1-С4)алкільну групу, R2 означає -(СН2)n'-В, де n'=0,1,2,3,4 і В означає (С1-С4)алкільну групу, U означає карбонільну групу, Y, Z, V, W означають, незалежно один від іншого, гетероатом, атом вуглецю, заміщений групою R7 або групу -СН-, R7 означає атом водню або галогену або (С1-С4)алкільну групу, R3 означає атом водню, R4 означає атом водню, R5 означає атом водню, R6 означає -(СН2)n-L, де L означає групу, вибрану з наступних груп: - арильної групи, що містить 6 атомів вуглецю, необов'язково заміщеної одним або декількома атомами галогену, - гетероарильної групи, що містить 5-6 ланок, щонайменше один гетероатом якої вибраний з атома азоту або сірки, - насиченої гетероциклічної групи, у якій вказаний гетероцикл містить 5-6 ланок, щонайменше один гетероатом якого вибраний з атома азоту, атома кисню, і необов'язково заміщеної в якому-небудь положенні, включаючи атом азоту, одним або декількома замісниками, вибраними з атома фтору, фтор(С1-С4)алкільної групи або (С1-С4)алкільної групи, m дорівнює 1, і n має значення, що визначені вище. Можна назвати четверту комбінацію, що відповідає сполукам відповідно до винаходу, у яких: R1 означає (С1-С4)алкільну групу, R2 означає -(СН2)n'-В, де n'=0,1,2,3,4 і В означає (С1-С4)алкільну групу, U означає карбонільну групу, Y, Z, V, W означають, незалежно один від іншого, гетероатом, або групу -СН-, R3 означає атом водню, R4 означає атом водню, R5 означає атом водню, R6 означає -(СН2)n-L, де L означає групу, вибрану з наступних груп: - арильної групи, що містить 6 атомів вуглецю, необов'язково заміщеної одним або декількома атомами галогену, - гетероарильної групи, що містить 5-6 ланок, щонайменше один гетероатом якої вибраний з атома азоту або сірки, - насиченої гетероциклічної групи, у якій вказаний гетероцикл містить 5-6 ланок, щонайменше один гетероатом якого вибраний з атома азоту, атома кисню, і необов'язково заміщеної в якому-небудь положенні, включаючи атом азоту, одним або декількома замісниками, вибраними з атома фтору, (С1-С4)алкільної групи або (С3-С5)циклоалкільної групи, m і n мають значення, вказані вище. Можна назвати п'яту комбінацію, що відповідає сполукам відповідно до винаходу, у яких: R1 означає (С1-С4)алкільну групу, R2 означає -(СН2)n'-В, де n'=0,1,2,3,4 і В означає (С1-С4)алкільну групу, U означає карбонільну групу, Y, Z, V, W означають групу -СН-, R3, R4 означають атом водню, R5 означає атом водню, R7 означає атом водню, R6 означає -(СН2)n-L, де L означає (С1-С5)алкільну групу, лінійну або розгалужену, необов'язково заміщену (С1-С4)алкоксигрупою, або (С3-С5)циклоалкільну групу, m дорівнює 1, і n має значення, вказані вище. Можна назвати шосту комбінацію, що відповідає сполукам відповідно до винаходу, у яких: R1 означає (С1-С4)алкільну групу, R2 означає -(СН2)n'-В, де n'=0,1,2,3,4 і В означає (С1-С4)алкільну групу, U означає карбонільну групу, Y, Z, V, W означають групу -СН-, R3, R4 означають атом водню, R5 означає атом водню, 10 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 60 R7 означає атом водню, R6 означає -(СН2)n-L, де L означає арильну групу, необов'язково заміщену одним або декількома атомами галогену, m дорівнює 1, і n має значення, вказані вище. Сьома комбінація відповідає сполукам відповідно до винаходу, у яких: R1 означає (С1-С4)алкільну групу, R2 означає -(СН2)n'-В, де n'=0 або 1 і В означає (С3-С5)циклоалкільну групу або (С1С4)алкільну групу, необов'язково заміщену одним або декількома атомами фтору, U означає карбонільну групу, Y, Z, V, W означають, незалежно один від іншого, гетероатом, групу -СН-, атом вуглецю, необов'язково заміщений групою R7, або без нього, R3, R4 означають атом водню, або R3 і R4 утворюють разом з вуглецем, з яким вони зв'язані, (С3-С5)циклоалкільну групу, R5 означає атом водню, R6 означає -(СН2)n-L, де L означає насичену гетероциклічну групу, необов'язково заміщену в якому-небудь положенні, включаючи атом азоту, одним або декількома замісниками, вибраними з атома фтору, фтор(С1-С4)алкільної групи, (С1-С4)алкільної групи, лінійної або розгалуженої, або (С3-С5)циклоалкільної групи або (С1-С4)алкілсульфонамідної групи, R7, m і n мають значення, вказані вище. Восьма комбінація відповідає сполукам відповідно до винаходу, у яких: R1 означає (С1-С4)алкільну групу, R2 означає -(СН2)n'-В, де n'=0,1,2,3,4 і В означає (С1-С4)алкільну групу, необов'язково заміщену (С1-С4)алкоксигрупою, U означає карбонільну групу, Y, Z, V, W означають, незалежно один від іншого, гетероатом або атом вуглецю або групу СН-, R7 означає атом водню, R3, R4 означають атом водню, R5 означає атом водню, R6 означає -(СН2)n-L, де L означає гетероарильну групу, необов'язково заміщену (С1С4)алкільної групою, m дорівнює 1, і n має значення, вказані вище. Дев'ята комбінація відповідає сполукам відповідно до винаходу, у яких: R1 означає (С1-С4)алкільну групу, R2 означає -(СН2)n'-В, де n'=0,1,2,3,4 і В означає (С1-С4)алкільну групу, U означає групу -СН2-, Y, Z, V, W означають групу -СН-, R3, R4 означають атом водню, R5 означає атом водню, R6 означає -(СН2)n-L, де L означає гетероарильну групу, m дорівнює 1, і n має значення, вказані вище. Серед сполук формули (I) відповідно до винаходу можна, зокрема, назвати наступні сполуки: 2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(феніламіно)етил]феніл}-1,4-дигідро-1,8нафтиридин-3-карбоксамід (сполука n1) 2-аміно-1-етил-7-[4-(2-{[(1-етилпіролідин-2-іл)метил](метил)аміно}-2-оксоетил)феніл]-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n2) 2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(піридин-3-ілиламіно)етил]феніл}-1,4-дигідро1,8-нафтиридин-3-карбоксамід (сполука n3) 2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(піридин-2-іламіно)етил]феніл}-1,4-дигідро-1,8нафтиридин-3-карбоксамід (сполука n4) 2-аміно-7-(4-{2-[(2-хлорфеніл)аміно]-2-оксоетил}феніл)-1-етил-N-метил-4-оксо-1,4-дигідро1,8-нафтиридин-3-карбоксамід (сполука n5) 2-аміно-7-(4-{2-[(3,5-дифторфеніл)аміно]-2-оксоетил}феніл)-1-етил-N-метил-4-оксо-1,4дигідро-1,8-нафтиридин-3-карбоксамід (сполука n6) 2-аміно-1-етил-N-метил-4-оксо-7-{4-{2-оксо-2-[(піридин-4-ілметил)аміно]етил}феніл)-1,4дигідро-1,8-нафтиридин-3-карбоксамід (сполука n7) 11 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 2-аміно-1-етил-N-метил-4-оксо-7-(4-{2-оксо-2-[(піридин-2-ілметил)аміно]етил}феніл)-1,4дигідро-1,8-нафтиридин-3-карбоксамід (сполука n8) 2-аміно-1-етил-7-(4-{2-[(2-метоксіетил)аміно]-2-оксоетил}феніл)-N-метил-4-оксо-1,4-дигідро1,8-нафтиридин-3-карбоксамід (сполука n9) 2-аміно-7-{4-[2-(циклопропіламіно)-2-оксоетил]феніл}-1-етил-N-метил-4-оксо-1,4-дигідро-1,8нафтиридин-3-карбоксамід (сполука n10) 2-аміно-1-етил-N-метил-7-(4-{2-[(1-метилетил)аміно]2-оксоетил}феніл)-4-оксо-1,4-дигідро1,8-нафтиридин-3-карбоксамід (сполука n11) 2-аміно-7-{4-[2-(циклопентиламіно)-2-оксоетил]феніл}-1-етил-N-метил-4-оксо-1,4-дигідро-1,8нафтиридин-3-карбоксамід (сполука n12) 2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(піразин-2-іламіно)етил]феніл}-1,4-дигідро-1,8нафтиридин-3-карбоксамід (сполука n13) 2-аміно-1-етил-7-{4-[2-({[(2R)-1-етилпіролідин-2-іл]метил}аміно)-2-оксоетил]феніл}-N-метил4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n14) 2-аміно-1-етил-7-{4-[2-({[(2S)-1-етилпіролідин-2-іл]метил}аміно)-2-оксоетил]феніл}-N-метил4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n15) 2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(піримідин-4-іламіно)етил]феніл}-1,4-дигідро1,8-нафтиридин-3-карбоксамід (сполука n16) 2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(піридин-4-іламіно)етил]феніл}-1,4-дигідро-1,8нафтиридин-3-карбоксамід (сполука n17) 2-аміно-1-етил-N-метил-7-(4-{2-[(2-морфолін-4-ілетил)аміно]-2-оксоетил}феніл)-4-оксо-1,4дигідро-1,8-нафтиридин-3-карбоксамід (сполука n18) 2-аміно-1-етил-N-метил-4-оксо-7-{5-[2-оксо-2-(піридин-2-іламіно)етил]піридин-2-іл}-1,4дигідро-1,8-нафтиридин-3-карбоксамід (сполука n19) 2-аміно-1-етил-N-метил-7-{4-[1-метил-2-оксо-2-(піридин-2-іламіно)етил]феніл}-4-оксо-1,4дигідро-1,8-нафтиридин-3-карбоксамід (сполука n20) 2-аміно-1-етил-N-метил-4-оксо-7-{6-[2-оксо-2-(піридин-2-іламіно)етил]піридин-3-іл}-1,4дигідро-1,8-нафтиридин-3-карбоксамід (сполука n21) 2-аміно-1-етил-7-[4-(2-{[(4-етилморфолін-3-іл)метил]аміно}-2-оксоетил)феніл]-N-метил-4оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n22) 2-аміно-1-етил-7-[6-(2-{[(4-етилморфолін-3-іл)метил]аміно}-2-оксоетил)піридин-3-іл]-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n23) 2-аміно-1-етил-7-{4-[2-({[(2S)-1-етил-4,4-дифторпіролідин-2-іл]метил}аміно)-2оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n24) 2-аміно-1-етил-7-[4-(2-{[(4-етилморфолін-3-іл)метил]аміно}-1-метил-2-оксоетил)феніл]-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n25) 2-аміно-1-етил-7-{4-[2-({[(2S, 4R)-1-етил-4-фторпіролідин-2-іл]метил}аміно)-2оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n26) 2-аміно-1-етил-7-{4-[2-({[(2R)-1-(2-фторетил)піролідин-2-іл]метил}аміно)-2-оксоетил]феніл}N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n27) 2-аміно-1-етил-N-метил-7-{4-[2-({[(2R)-1-(метилсульфоніл)піролідин-2-іл]метил}аміно)-2оксоетил]феніл}-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n28) 2-аміно-1-етил-7-{5-[2-({[(2R)-1-(2-фторетил)піролідин-2-іл]метил}аміно)-2-оксоетил]піридин2-іл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n29) 2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-({[(2R)-1-(2,2,2-трифторетил)піролідин-2іл]метил}аміно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n30) 2-аміно-7-{4-[2-({[(2R)-1-(2,2-дифторетил)піролідин-2-іл]метил}аміно)-2-оксоетил]феніл}-1етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n31) 2-аміно-1-етил-N-метил-7-{4-[2-({[4-(1-метилетил)морфолін-3-іл]метил}аміно)-2оксоетил]феніл}-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n32) 2-аміно-7-[4-(2-{[(4-циклопропілморфолін-3-іл)метил]аміно}-2-оксоетил)феніл]-1-етил-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n33) 2-аміно-7-{5-[2-({[(2R)-1-(2,2-дифторетил)піролідин-2-іл]метил}аміно)-2-оксоетил]піридин-2іл}-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n34) 2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-оксо-2-(1,3-тіазол-2-іламіно)етил]феніл}-1,4-дигідро1,8-нафтиридин-3-карбоксамід (сполука n35) 2-аміно-1-етил-N-метил-7-[4-(2-{[(1-метил-1H-імідазол-5-іл)метил]аміно}-2-оксоетил)феніл]4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n36) 12 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 2-аміно-1-етил-N-метил-4-оксо-7-(4-{2-оксо-2-[(2-піридин-3-ілетил)аміно]етил}феніл)-1,4дигідро-1,8-нафтиридин-3-карбоксамід (сполука n37) 2-аміно-1-етил-N-метил-7-(4-{2-[(3-морфолін-4-ілпропіл)аміно]-2-оксоетил}феніл)-4-оксо-1,4дигідро-1,8-нафтиридин-3-карбоксамід (сполука n38) 2-аміно-1-етил-N-метил-4-оксо-7-(4-{2-оксо-2-[(2-піридин-2-ілетил)аміно]етил}феніл)-1,4дигідро-1,8-нафтиридин-3-карбоксамід (сполука n39) 2-аміно-1-етил-N-метил-4-оксо-7-(4-{2-оксо-2-[(2-фенілетил)аміно]етил}феніл)-1,4-дигідро1,8-нафтиридин-3-карбоксамід (сполука n40) 2-аміно-1-етил-N-метил-4-оксо-7-(4-{2-оксо-2-[(3-фенілпропіл)аміно]етил}феніл)-1,4-дигідро1,8-нафтиридин-3-карбоксамід (сполука n41) 2-аміно-1-етил-N-метил-7-[4-(2-{[2-(1-метил-1H-пиррол-2-іл)етил]аміно}-2-оксоетил)феніл]-4оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n42) 2-аміно-1-етил-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)-1,3-тіазол-2-іл]-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n43) 2-аміно-1-(3-метоксипропіл)-N-метил-4-оксо-7-{4-[2-оксо-2-(піридин-2-іламіно)етил]феніл}1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n44) 2-аміно-7-[4-(2-{[1-(2,2-дифторетил)піролідин-3-іл]аміно}-2-оксоетил)феніл]-1-етил-N-метил4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n45) 2-аміно-1-етил-7-[4-(3-{[(1-етилпіролідин-2-іл)метил]аміно}-3-оксопропіл)феніл]-N-метил-4оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n46) 2-аміно-1-етил-7-[4-(4-{[(1-етилпіролідин-2-іл)метил]аміно}-4-оксобутил)феніл]-N-метил-4оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n47) 2-аміно-1-етил-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-4-оксо-Nпропіл-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n48) 2-аміно-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-N-метил-4-оксо-1(2,2,2-трифторетил)-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n49) 2-аміно-1-циклопентил-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n50) 2-аміно-1-етил-7-[4-(5-{[(1-етилпіролідин-2-іл)метил]аміно}-5-оксопентил)феніл]-N-метил-4оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n51) 1-етил-7-[5-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)тіофен-2-іл]-N, 2-диметил-4оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n52) 2-аміно-7-{4-[2-({[(2R)-1-етилпіролідин-2-іл]метил}аміно)-2-оксоетил]феніл}-N-метил-1-(2метилпропіл)-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n53) 2-аміно-1-етил-7-{4-[1-({[(2R)-1-етилпіролідин-2-іл]метил}карбамоїл)-циклопропіл]феніл}-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n54) 2-аміно-1-етил-7-{2-[2-({[(2R)-1-етилпіролідин-2-іл]метил}аміно)-2-оксоетил]-1,3-тіазол-4-іл}N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n55) 2-аміно-1-етил-7-{4-[2-({[(2R)-1-етилпіролідин-2-іл]метил}аміно)-2-оксоетил]-2-фторфеніл}-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n56) 2-аміно-7-[3-хлор-4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-1-етил-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n57) 2-аміно-7-[3-фтор-4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-1-етил-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n58) 2-аміно-7-[3-метил-4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-1-етил-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n59) 2-аміно-1-(циклопропілметил)-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n60) 2-аміно-1-етил-7-[4-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)-2-метилфеніл]-Nметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n61) 2-аміно-1-етил-7-[3-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)феніл]-N-метил-4оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n62) 2-аміно-1-етил-N-метил-4-оксо-7-{3-[2-оксо-2-(піридин-2-іламіно)етил]феніл}-1,4-дигідро-1,8нафтиридин-3-карбоксамід (сполука n63) 2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-(піридин-2-іламіно)етил]феніл}-1,4-дигідро-1,8нафтиридин-3-карбоксамід (сполука n64) Слід зазначити, що вказані вище сполуки мають найменування, що відповідають номенклатурі IUPAC, використаній з застосуванням програмного забезпечення ACDLABS 10.0 ACD/найменування (Advanced Chemistry development). 13 UA 102858 C2 5 10 15 В подальшому описі під захисною групою Pg мають на увазі групу, що здатна, з одного боку, захищати реакційноздатну функціональну групу, таку як гідрокси- або аміногрупа, у процесі синтезу, і, з іншого боку, регенерувати збережену функціональну групу наприкінці синтезу. Приклади захисних груп, а також способи захисту і зняття захисту розкриті в публікації nd "Protective Groups in Organic Synthesis". Green et coll., 2 Edition (John & Sons, Inc., New York). 1991. Під відхідною групою мають на увазі в подальшому описі групу, що легко відщеплюється завдяки гетеролітичному розриву зв'язку з відходом електронної пари. Тому така група може бути легко замінена іншою групою, наприклад, під час реакції заміщення. Такими відхідними групами є, наприклад, галогени або активована гідроксигрупа, така як метансульфонатна, бензолсульфонатна, пара-толуолсульфонатна, трифлатна, ацетатна і т. д. Приклади а також rd способи їх одержання приведені в публікації "Advances in Organic Chemistry", J.March, 3 Edition, Wiley Interscience, 1985, cc. 310-316. Відповідно до винаходу сполуки загальної формули (I) можна одержати завдяки наступному способу. Схема 1 20 25 30 35 40 Слідуючи схемі 1, 2,6-дигалогеннікотинову кислоту формули (II) моно-заміщують у положенні 2 аміном формули R2-NH2 (де R2 має значення, вказані вище відносно сполуки формули (I)) при кімнатній температурі або при температурі в діапазоні 50-100С при класичному нагріванні або при нагріванні в мікрохвильовій печі, у протонному розчиннику, такому як спирт, наприклад, етанол, н-бутанол, трет-бутанол або вода. Потім кислоту (III), що виходить зі стадії (i), активують до одержання похідного формули (IV), або у формі фторангідриду кислоти при взаємодії з ціанурилфторидом при кімнатній температурі в присутності основи, такої як триетиламін або піридин і в розчиннику, такому як дихлорметан або ТГФ, як це описано G.OLAH et coll., у журналі Synthesis (1973), 487, або у формі імідазоліду при взаємодії з карбодіімідазолом у розчиннику, такому як ДМФ або ТГФ, або відповідно до інших способів, відомих фахівцю, таких як спосіб, описаний MUKAIYAMA і TANAKA у журналі Chem. Lett. (1976), 303 або ISHIKAWA і SASAKI у Chem. Lett. (1976), 1407. Фторангідрид кислоти або імідазолід формули (IV), отримані на виході зі стадії (ii), що представляють собою високореакційні, але стабільні продукти, потім піддають взаємодії з Nзаміщеним ціаноацетамідом формули (V) відповідно до способів А або В. Відповідно до способу А використовують два еквіваленти основи, такої як гідрид натрію або трет-бутоксид калію, для здійснення стадії (iv) конденсації N-заміщеного похідного ціанацетаміду (V) зі сполукою формули (IV) і, після витримування протягом ночі при кімнатній температурі, одержують β-кетоціанацетамід формули (VI), що потім циклізують до одержання піридино-піридинону формули (VII) при нагріванні з температурою в діапазоні 90-125С в полярному розчиннику, такому як н-бутанол, ДМСО або ДМФ. 14 UA 102858 C2 5 10 15 20 25 30 35 Спосіб В аналогічний способу А включаючи стадію конденсації (iv), але до реакційної суміші додається третій еквівалент використовуваної основи, і отриману сполуку формули (VI) циклізують in situ при кімнатній температурі й одержують відразу піридино-піридинонову сполука формули (VII). N-Алкілціаноацетаміди формули (V) одержують відповідно до стадії (iii) при взаємодії етилціаноацетаміду з надлишком аміну формули R 1-NH2 (де R1 має значення, вказані у відношенні сполук формули (I) відповідно до винаходу) у розчиннику, такому як ТГФ або етанол, при температурі від кімнатної до температури рефлюкса розчинника. Схема 2 Для одержання сполук формули (I) відповідно до винаходу використовуються два способи, де вихідною сполукою є галогенована проміжна сполука формули (VII). Відповідно до способу 1, описаного на схемі 2, проміжна сполука (VII) уводять на стадії (vi) у реакцію сполучення Сузукі з використанням боронової кислоти або складного боронового ефіру біспінасолу (IXa), де m, R3 і R4 і V, W, Y, Z визначені вище для сполук формули (I) відповідно до винаходу, за умови, що цикл містить від 5 до 6 ланок, а G є групою (С1-С4)алкокси, такою як OEt, або ланка -NR5R6, у якій R5 і R6 мають значення, вказані вище для сполук формули (I). Цю реакцію (vi) здійснюють у присутності комплексу на основі паладію (у стані окислювання(0) або (II)), такого як, наприклад, комплекс Pd(PPh3)4, PdCl2(PPh3)2, Pd2dba3, Xphos або PdCl2(dppf), у полярному, протонному або не протонному розчиннику, такому як ДМЕ, етанол, ДМФ, діоксан, або суміш цих розчинників, у присутності основи, такої як карбонат цезію, водний гідрокарбонат натрію або К3РО4, при класичному нагріванні з температурою в діапазоні 80-120 °C або при мікрохвильовому нагріванні в діапазоні 130-170 °C. У випадку, коли G означає ланку -NR5R6, у якій R5 і R6 мають значення, вказані вище для сполук формули (I), тобто, шлях 1, сполуку формули (I) відповідно до винаходу одержують безпосередньо після закінчення реакції сполучення на стадії (vi). У випадку, коли G є (С1-С4)алкоксигрупою, такою як OEt, тобто, шлях 2, то після проведення реакції сполучення Сузукі на стадії (vi) одержують сполуку (Х). Потім сполуку (Х) омилюють на стадії (vii) у присутності нуклеофільного агента, такого як LiOH або NaOH у водному розчині, у розчиннику, такому як полярний розчинник, наприклад, ТГФ, ДМФ, МеОН або EtОН при температурі від кімнатної до 80С з одержанням сполуки (XI), що потім на стадії (viii) вводять у реакцію пептидного сполучення з вибраним аміном HNR 5R6, у якому R5 і R6 мають значення, що визначені для сполуки формули (I), у присутності агента сполучення, такого як TBTU, HBTU або CDI, і основи, наприклад, діізопропілетиламіну, триетиламіну або NaHCO 3, в апротонному розчиннику, такому як дихлорметан, ТГФ або ДМФ, або іншими способами, відомими фахівцю, 15 UA 102858 C2 nd такими як способи, описані в публікації "Princiales of Peptide Synthesis", 2 Ed 1993 M Bodanszky, Springer Laboratory, для одержання сполуки формули (I). Схема 3 5 10 15 20 25 Для одержання сполук формули (I) відповідно до винаходу використовують другий спосіб, де вихідною сполукою є проміжна галогенована сполука формули (VII), цей спосіб 2 представлений на схемі 3. Проміжна галогенована сполука формули (VII) перетворюють у похідну біс-пінаколового ефіру боронової кислоти або в похідну боронової кислоти формули (VIII) відповідно до стадії (ix) шляхом взаємодії з біс(пінаколят)дибораном у присутності [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладію (II) і ацетату калію або карбонату калію в полярному розчиннику, такому як ДМСО, ДМФ, ДМЕ або діоксан, при температурі в діапазоні 50-100С, відповідно до способу, описаному ISHIYAMA, T. еt coll. у журналі J. Org. Chem., 1995, 60, 7508-7510 і GIROUX, A. et coll. у журналі Tet. Lett., 1997, 38, 3841-3844. На наступній стадії (х) сполука (VIII) у формі боронової кислоти або складного ефіру боронової кислоти вводять у реакцію типу Сузукі з галогенованою ароматичною сполукою формули (IXb), у якій X, m, R 3 і R4, U і V, W, Y, Z мають значення, вказані вище для сполук формули (I) відповідно до винаходу, за умови, що цикл містить від 5 до 6 ланок і G є (С1-С4)алкоксигрупою, такою як OEt або ланка NR5R6, у якій R5 і R6 мають значення, вказані для сполук формули (I). Для проведення цієї реакції (х) підходять умови здійснення сполучення Сузукі, описані для стадії (vi) схеми 2. У випадку, коли G є ланкою -NR5R6, у якій R5 і R6 мають значення, вказані вище, а U є або карбонілом, або метиленовою ланкою, то сполуку формули (I) відповідно до винаходу одержують безпосередньо по закінченні стадії сполучення (х) (шлях 1). У випадку, коли G є групою OEt, а U є карбонілом, тобто, йдучи шляхом 2, то в результаті сполучення Сузукі (стадія х) одержують сполуку (Х). Потім цю сполуку (Х) уводять на стадію (xi) 16 UA 102858 C2 5 10 15 20 25 30 для одержання сполуки (XI) у кислотній формі, що, у свою чергу, перетворюють на стадії (xii) у сполуку формули (I) відповідно до винаходу. Стадії (xi) і (xii) ідентичні, відповідно, стадіям (vii) і (viii), описаним вище. Якщо способи одержання вихідних продуктів, реактивів, таких як аміни HNR 5R6, або сполук формули IXa і IXb, використовуваних відповідно до схем 1, 2 і 3, не описані, то виходить, що вони є комерційно доступними або можуть бути отримані методами, описаними в літературі або відомими фахівцю. Якщо необхідно, деякі реакційноздатні групи, що знаходяться в групах R2, R5 або R6, можуть бути захищені на час протікання цих реакцій захисними групами, таким як групи, описані в nd публікації "Protective Groups in Organic Synthesis", Green et coll., 2 Edition (John Wiley & Sons, Inc., New York). Відповідно до іншого аспекту, винахід належить також до сполук формул (VIII), (X), (XI). Ці сполуки корисні як проміжні сполуки одержання сполук формули (I). Наступні приклади ілюструють одержання деяких сполук відповідно до винаходу. Ці приклади не обмежують об'єм винаходу, а тільки ілюструють його. Номери сполук, отриманих у прикладах, відповідають номерам, що приведені в таблиці, представленій нижче, що ілюструє хімічну структуру і фізичні властивості деяких сполук відповідно до винаходу. У тексті використані наступна абревіатура і брутто-формули: AcOEt етилацетат CDI карбонілдіімідазол ДХМ дихлорметан градуси Цельсія С ДМЕ диметоксіетан ДМФ диметилформамід ДМСО диметилсульфоксид EDC.HCl гідрохлорид N-[3-(диметиламіно)пропіл]-N'-етилкарбодііміду FAMSO метилтіометилсульфоксид метилу HBTU гексафторфосфат О-(бензотриазол-1-іл)-N, N,N",N'-тетраметилуронію год. година(и) HCl соляна кислота LiOH гідроксид літію Na2CO3 карбонат натрію NH4Cl хлорид амонію NaHCO3 гідрокарбонат натрію Na2SO4 сульфат натрію NaCl хлорид натрію NaOH гідроксид натрію NH4OH гідроксид амонію Na2SO4 сульфат натрію хв хвилини мл мілілітр Р2О5 дифосфорпентоксид тетрафторборат N-[(1H-бензотриазол-1-ілокси)(диметиламіно)метиліден]-NTBTU метилметанамінію ТГФ тетрагідрофуран Т.К. кімнатна температура Xphos 2-дициклогексилфосфінол-2",4",6'-триізопропілбіфеніл Використовувані мікрохвильові прилади: Biotage, Initiator Умови для проведення аналізів: Умови проведення аналізів з використанням рідинної хроматографії LC/УФ-спектроскопії UV/мас-спектрометрії MS: Прилади фірми Agilent: ВЕРХ модуль: Серія 1100; Мас-спектрометр MSD SL (Agilent); Пакет програм: Chemstation версія В.01.03 фірми Agilent LC/UV Колонка: Symmetry C18 3,5 мкм (2,1 × 50 мм) (Waters); Температура колонки: 25С; аналізуючи програма Post run: 5 хв; УФ-детектування: 220 нм; об'єм інжектування: 2 мкл розчину з концентрацією 0,5 мг/мл Умова 1: рН 3, градієнт 15 хвилин Елюенти: А: Н2О+0,005 % ТФО/В: CH3CN+0,005 % ТФО, швидкість потоку: 0,4 мл/хв, градієнт 0-10 хв від 0 до 100 %В і 10-15 хвилин 100 %В 17 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 60 Умова 2: рН 3, градієнт 30 хвилин Колонка: Symmetry C18 3,5 мкм (2,1 × 50 мм)(Waters); Температура колонки: 25С; Елюенти: А: Н2О+0,005 % ТФО/В: CH3CN+0,005 % ТФО, швидкість потоку: 0,4 мл/хв, градієнт 0-30 хв від 0 до 100 %В і 30-35 хвилин 100 %В Аналізуючи програма Post run: 6 хв; УФ-детектування: 220 нм; об'єм інжектування: 2 мкл розчину з концентрацією 0,5 мг/мл Умова 3: рН 7, градієнт 20 хвилин Колонка: Х terra MS C18 3,5 мкм (2,1 × 50 мм), Температура колонки: 20С; Елюенти: А: Н2О+AcNH4(5 нМ)+3 % CH3CN/В: CH3CN. Градієнт 0-20 хв від 0 до 100 %У; УФ-детектування: 210 нм. Умова GC Cl/CH4+: іонізація Cl/CH4+, 30 хвилин Колонка: Agilеnt HP-5MS 30 г × 250 мкм плівка товщиною 0,25 мкм. Температура 250С, газ-вектор: гелій, стала швидкість потоку 1,4 мл/хв Мас-спектрометрія (МS) Режим іонізації: електроспрей з позитивною іонізацією ESI+, діапазон мас: 90-1500 е.а.м. Спрей-камера: Температура газу: 350С; Подача сухого газу (N2): 10,0 л/хв; Тиск розпилення: 30 psig; Напруга уловлювача іонів: 4000 вольт 1 Спектри ЯМР Н одержували з використанням ЯМР-спектрометрів фірми Bruker з частотою 250, 300 або 400 МГц у ДМСО-d6, використовуючи пік сигналу ДМСО-d5 як стандарт. Хімічні зсуви δ виражені в мільйонних частках (м. ч.). Регістровані сигнали були виражені в такий спосіб: с=синглет, д=дуплет, т=триплет, г=масив або широкий синглет; Н=протон. Точки плавлення нижче 260С були вимірювані на стенді Кофлера, а точки плавлення вище 260С вимірювалися на приладі Бюхі В-545. Обертальна здатність замірювалася на полярометрі типу полярометра Perkin-Elmer із силою струму 55 мка. ПРИКЛАД 1: гідрохлорид 2-аміно-1-етил-7-{4-[2-({[(2R)-1-(2-фторетил)піролідин-2іл]метил}аміно)-2-оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n27) 1.1: 6-хлор-2-(етиламіно)піридин-3-карбонова кислота Розчин 18,0 г (84,4 ммол) 2,6-дихлорнікотинової кислоти в 180 мл (3,45 мол) 70 % розчину етиламіну у воді нагрівають при 50С протягом 10 годин. Надлишок аміну випарюють при зниженому тиску, потім додають 10 % водний розчин оцтової кислоти до випадання осаду. Твердий бежевий продукт центрифугують, промивають холодною водою і сушать у сушильній + камері. Одержують 10,5 г цільового продукту. Вихід=62 %. Точка плавлення: 158-160С. МН : 201,1 (час утримування: 7,7 хв, умова 1). 1.2: 6-хлор-2-(етиламіно)піридин-3-карбонілфторид До суспензії 10,5 г (52,3 ммол) сполуки, отриманої на стадії 1.1, у дихлорметані (250 мл) послідовно додають 4,2 мл (52,3 ммол) піридину і 8,4 мл (99,6 ммол) ціанурилхлориду. Суміш перемішують протягом 3 годин при кімнатній температурі, потім фільтрують. Твердий продукт споліскують дихлорметаном (100 мл) і фільтрат промивають два рази крижаною водою (60 мл). Органічний шар сушать над Na2SO4, потім концентрують при зниженому тиску. Одержують 10,44 г продукту у вигляді масла жовтогарячого кольору. Вихід=99 %. Продукт використовують на наступній стадії без очищення. 1.3: 2-ціано-N-метилацетамід До 10,9 г (353,6 ммол) розчину метиламіну в ТГФ, охолодженого до 0 °C, додають по краплях 20 г (176,8 ммол) етилціанацетату, потім реакційну суміш перемішують при кімнатній температурі протягом ночі. Розчинники випарюють при зниженому тиску й отриманий продукт очищають шляхом перекристалізації з толуолу. Одержують 16,8 г продукту у вигляді твердої бежевої речовини. Вихід=96 %. Точка плавлення - 99С. Спосіб А (1.4 і 1.5, викладені нижче) 1.4: 3-[6-хлор-2-(етиламіно)піридин-3-іл]-2-ціано-3-гідрокси-N-метилпроп-2-енамід До розчину 9,80 г (100 ммол) сполуки, отриманої на стадії 1.3, у 100 мл безводного ДМФ, охолодженого до 0-5С, додають невеликими порціями 3,98 г (100 ммол) 60 % гідриду натрію в мінеральному маслі. Після закінчення виділення водню суміш перемішують протягом 10 хвилин при кімнатній температурі, потім знову охолоджують до 0-5С. Додають розчин 10,1 г (49,8 ммол) сполуки, отриманої на стадії 1.2, у 60 мл ДМФ і суміш перемішують при кімнатній температурі протягом ночі, потім додають 2,85 мл (49,8 ммол) оцтової кислоти. Випарюють ДМФ при зниженому тиску, потім залишок обробляють водою й отриманий продукт екстрагують два рази сумішшю дихлорметан: метанол у співвідношенні 95:5, потім один раз сумішшю етилацетат: ТГФ (2:1). Об'єднані органічні шари сушать над MgSO 4, потім розчинники 18 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 60 випарюють при зниженому тиску. Одержують 19,0 г продукту, використовуваного в отриманому вигляді на наступній стадії. 1.5: 2-аміно-7-хлор-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід Розчин 19,0 г (49,8 ммол) неочищеного продукту, отриманого на стадії 1.4, у 600 мл нбутанолу нагрівають протягом 48 годин при 110(С. Розчинник випарюють при зниженому тиску й отриманому твердому продукті розтирають у метанолі. Потім твердий продукт відфільтровують і сушать у сушильній камері. Одержують 7,9 г цільового продукту у вигляді твердої речовини + блідо-жовтого кольору. Вихід=57 %. Точка плавлення: 283-286С. МН : 281,2; (час утримування=6,99 хв, умова 1). Спосіб В (1.6, викладений нижче, замість 1.4 і 1.5). 1.6: 2-аміно-7-хлор-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід До розчину 0,48 г (4,9 ммол) сполуки, отриманої на стадії 1.3, у безводному ДМФ (7 мл), охолодженому до 0-5 °C, додають невеликими порціям 0,4 г (9,95 ммол) 60 % гідриду натрію в мінеральному маслі. Суміш перемішують при цій температурі протягом десяти хвилин, потім додають розчин 1,0 г (4,93 ммол) сполуки, отриманої на стадії 1.2, у безводному ДМФ (5 мл). Реакційну суміш перемішують протягом 1 ночі при кімнатній температурі, потім знову додають маленькими порціями 0,2 г (4,9 ммол) 60 % гідриду натрію. Перемішування продовжують при цій же температурі протягом 30 хвилин, потім додають 0,56 мл (9,8 ммол) оцтової кислоти з наступним додаванням 60 мл води й відфільтровують твердий продукт, потім споліскують водою і сушать у сушильній камері. Одержують 1,30 г цільового продукту. Вихід=94 %. Точка + плавлення: 283-284С. МН : 281,2 (час утримування=6,99 хв, умова 1). 1.7 [7-аміно-8-етил-6-(метилкарбамоїл)-5-оксо-5,8-дигідро-1,8-нафтиридин-2-іл]боронова кислота Суспензію 8 г (0,03 мл) сполуки, отриманої на стадії 1.5 або 1.6 (у залежності від використовуваного способу А або В), 8,0 г (0,03 мл) біс(пінаколят)диборану і 8,5 г (0,08 мл) ацетату калію в диметилсульфоксиді (130 мл) дегазують аргоном протягом 15 хвилин, додають 1,4 г (1,7 ммол) комплексу [1,1'-біс(дифенілфосфіно)фероцен] дихлорпаладію (II) з дихлорметаном (1:1) і суміш нагрівають при 80 °C протягом 30 хвилин в атмосфері аргону, потім охолоджують, розбавляють 1,1 л води і підкисляють до рН=4 додаванням оцтової кислоти (50 мл). Суміш фільтрують і осад чорного кольору промивають водою (40 мл), потім простим ефіром (60 мл). Чорний залишок обробляють 575 мл розчину NaOH (1 н.) і суміш фільтрують на целіті 545. Фільтрат підкисляють 60 мл оцтової кислоти й осад відфільтровують, промивають водою і простим ефіром, потім сушать у сушильній шафі. Одержують 6,85 г продукту у вигляді + порошку білого кольору. Вихід=83 %. Точка плавлення: 335С, МН : 291,2 (час утримування=5,3 хв, умова 1). 1 ЯМР Н (250 МГц, ДМСО-d6), δ (м. ч.): 11,69 (с, 1Н); 11,12 (кв, 1Н, 4,67 Гц); 8,47 (с, 2Н); 8,44 (д, 1Н, 7,7 Гц); 7,9 (с, 1Н); 7,75 (д, 1Н, 7,7 Гц); 4,72 (г, 2Н); 2,8 (д, 3Н, 4,67 Гц); 1,22 (т, 3Н, 6,9 Гц). 1.8 1-тритил-D-пролінамід При охолодженні (крижана баня) і в інертній атмосфері додають 10 мл триетиламіну (69,7 ммол) до 5 г (33,2 ммол) гідрохлориду пролінаміду, суспендованого в хлороформі (50 мл), потім додають порцією 9,7 г (34,9 ммол) тритилхлориду. Реакцію залишають перемішуватися при кімнатній температурі протягом 2 діб. Реакційну суміш розчиняють у дихлорметані (200 мл) і послідовно промивають 2 рази розчином HCl (1 н.) (150 мл), водою (150 мл), насиченим розчином NaHCO3 (150 мл) і насиченим розчином NaCl (150 мл). Органічний шар сушать (Na2SO4), фільтрують і упарюють при зниженому тиску. Залишок перекристалізовують з 20 мл гарячого етанолу. Одержують 11 г сполуки у вигляді кристалів білого кольору. Вихід=93 %. Точка плавлення: 162С. 1.9 1-[(2R)-1-тритилпіролідин-2-іл]метанамін При охолодженні (крижана баня) і в інертній атмосфері додають по краплях 60 мл (61,6 ммол) розчину літійалюмінійгідриду (1 н.) у ТГФ до 11 г (30,8 ммол) сполуки, отриманої на стадії 1.8, суспендованої в ТГФ (60 мл). Після додавання реакційну суміш нагрівають 3 години при 70С, потім охолоджують до 0С. Потім по краплях послідовно додають 2,8 мл води (з утворенням осаду), 2,8 мл розчину NaOH (1 н.) і 8,3 мл води. Отриману суміш перемішують 30 хвилин, потім фільтрують, споліскують твердий продукт ТГФ (10 мл) і фільтрат концентрують при зниженому тиску. Одержують 10 г сполуки у вигляді порошку яскраво-жовтого кольору і використовують в отриманому вигляді на наступній стадії. Вихід=95 %. Точка плавлення: 100С. 1.10 2-(4-йодофеніл)-N-[(2R)-піролідин-2-ілметил]ацетамід В інертній атмосфері при кімнатній температурі додають 4 мл (43,8 ммол) оксалілхлориду до 3,8 г (14,6 ммол) 4-йодофенілоцтової кислоти, суспендованої в дихлорметані (54 мл). Додають дві краплі ДМФ і реакційну суміш перемішують одну годину при кімнатній температурі, 19 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 потім концентрують при зниженому тиску. Залишок обробляють толуолом і знову концентрують. Отриманий таким шляхом хлорангідрид кислоти розчиняють у дихлорметані (10 мл) і прикопують при охолодженні (крижана баня) і в інертній атмосфері до 5 г (14,6 ммол) сполуки, отриманої на стадії 1.9, суспендованої в дихлорметані (30 мл) у присутності 2,45 г (29,2 ммол) NaHCO3. Реакційну суміш перемішують протягом ночі при кімнатній температурі, потім фільтрують на целіті і концентрують при зниженому тиску. Одержують 8,5 г продукту у вигляді пінистого продукту жовтого кольору, що використовують безпосередньо на наступній стадії без + очищення. МН : 586 8,5 г (14,6 ммол) сполуки, отриманої на попередній стадії, обробляють при охолодженні (крижана баня) сумішшю етанол/HCl 35 % (41 мл/3,2 мл). Реакційне середовище перемішують 2 години при кімнатній температурі. Реакційне середовище концентрують при зниженому тиску, обробляють водою (30 мл) і екстрагують простим ефіром (30 мл × 2). Водний шар охолоджують, підлуговують за допомогою 35 % розчину NaOH, що вливається по краплях до досягнення рН=10. Потім продукт екстрагують дихлорметаном (100 мл × 6). Органічний шар сушать (Na2SO4), фільтрують і упарюють при зниженому тиску. Одержують 4,6 г сполуки у вигляді білого порошку. + Вихід=92 % наприкінці трьох стадій. Точка плавлення: 120С. МН : 345 (час утримування: 4,65 хв, умова 1). 1.11 N-{[(2R)-1-(2-фторетил)піролідин-2-іл]метил}-2-(4-йодофеніл)ацетамід У посудину, що герметизується, вводять 0,53 г NaHCO 3 (6,4 ммол) і 0,49 г 1-йод-2фторетану (2,8 ммол) до 0,88 г (2,6 ммол) сполуки, отриманої на стадії 1.10, розчиненої в ДМФ (6 мл). Посудину герметично закривають і нагрівають при 90С протягом 5 годин. Реакційну суміш охолоджують, потім випарюють ДМФ при зниженому тиску, отриманий залишок обробляють водою (10 мл) і екстрагують етилацетатом (20 мл × 2). Органічний шар сушать над сульфатом натрію, фільтрують і випарюють при зниженому тиску. Отриманий залишок очищають флеш-хроматографією на силікагелі (елюент: дихлорметан/метанол, 1 % NH4OH) із градієнтом метанолу від 0 % до 10 %. Одержують 0,82 г сполуки у вигляді порошку бежевого + кольору. Вихід=85 %. Точка плавлення: 96С. МН : 391 (час утримування: 5,1 хв, умова 1). 1.12 Гідрохлорид 2-аміно-1-етил-7-{4-[2-({[(2R)-1-(2-фторетил)піролідин-2-іл]метил}аміно)-2оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n27) У посудину, що герметизується, вводять 2,1 мл насиченого водного розчину NaHCO3 до 0,19 г (0,51 ммол) сполуки, отриманої на стадії 1.11, і до 0,15 г (0,53 ммол) сполуки, отриманої на стадії 1.7, розчиненої в суміші 1,2-диметоксіетану/етанолу 2/1 (6 мл). Після дегазування аргоном протягом 15 хвилин додають 0,03 г (0,03 ммол) тетракіс(трифенілфосфін)паладію. Реакційне середовище нагрівають при 100С протягом 3 годин. Реакційне середовище охолоджують до кімнатної температури, потім додають воду (10 мл), осад, що утворився, відфільтровують, споліскують водою (5 мл × 2), потім дихлорметаном (5 мл × 2) і сушать у сушильній камері. Потім продукт очищають флеш-хроматографією на силікагелі (елюент: дихлорметан/метанол, 1 % NH4OH) із градієнтом метанолу від 0 % до 10 %. Одержують 0,05 г продукту у вигляді білого порошку. Отримані 0,05 г (0,1 ммол) сполуки суспендують у 3 мл метанолу і додають 0,1 мл (0,1 ммол) розчину HCl (1 н.) у простому ефірі. Реакційне середовище перемішують при кімнатній температурі 30 хвилин, потім додають 5 мл простого ефіру, осад, що утворився, виділяють фільтрацією і сушать у сушильній камері. Одержують 0,031 г продукту у вигляді білого порошку. Вихід 19 %. + Точка плавлення: 180С, МН : 509,3 (час утримування 4,6 хв, умова 1) 1 ЯМР Н (400 Гц, ДМСО-d6), δ (м. ч.): 11,71 (с шир.,1Н); 11,16 (д, 1Н); 10,36 (с шир., 1Н); 8,61 (г, 1Н); 8,53 (д, 1Н, 8,1 Гц); 8,16 (д, 2Н, 8,3 Гц); 7,96 (с+д, 2Н, 8,1 Гц); 7,47 (д, 2Н, 8,3 Гц); 4,83 (г шир., 2Н); 4,61 (г, 2Н); 3,84-3,37 (масив дуже шир.,8Н); 3,15 (г, 1Н); 2,82 (д, 3Н, 4,6 Гц); 2,15-1,68 (г дуже шир.,4Н); 1,33 (т, 3Н, 6,9 Гц). ПРИКЛАД 2: Гідрохлорид 2-аміно-1-етил-N-метил-7-{4-[2-({[4-(1-метилетил)морфолін-3іл]метил}аміно)-2-оксоетил]феніл}-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n32) 2.1. 4-(1-метилетил)морфолін-3-карбоксамід До розчину 1,1 г (6,3 ммол) морфолін-3-карбоксаміду (синтез якого описаний у документі WO2005026156, Hennequin L.F.A. et coll) в ацетонітрилі (16 мл) послідовно додають 1,86 г (22,2 ммол) порошкоподібні гідрокарбонати і 0,7 мл (7,0 мл) ізопропілйодиду, потім суміш нагрівають при 150С в мікрохвильової печі протягом 30 хвилин. Реакційну суміш охолоджують до кімнатної температури, розбавляють дихлорметаном (30 мл) і фільтрують на целіті. Фільтрат концентрують при зниженому тиску й одержують 1,1 г сполуки у вигляді порошку бежевого 20 UA 102858 C2 + 5 10 15 20 25 30 35 40 45 50 55 60 кольору, використовуваної на наступній стадії без очищення. Вихід: 97 %. МН : 173,2 (час утримування: 0,72 хв, умова 1). 2.2 гідрохлорид 1-[4-(1-метилетил)морфолін-3-іл]метанамін До розчину 1,1 г (6,15 ммол) сполуки, отриманої на стадії 2.1, у безводному ТГФ, в інертній атмосфері додають по краплях 15,4 мл розчину (1М) літійалюмінійгідриду в ТГФ, потім реакційну суміш нагрівають при 70С протягом 2 годин, потім охолоджують до кімнатної температури. Потім повільно і послідовно додають 0,6 мл води, 0,6 мл їдкого натру (1 н.) і 1,8 мл води, потім реакційну суміш перемішують 30 хвилин при кімнатній температурі, осад, що випав, видаляють фільтрацією, споліскують ТГФ (20 мл), фільтрат концентрують при зниженому тиску, потім додають 6,2 мл розчину HCl (1M) у діетиловому ефірі, суміш перемішують при кімнатній температурі протягом 30 хвилин, потім концентрують при зниженому тиску. Одержують 1,0 г гідрохлориду сполуки у вигляді порошку каштанового кольору, що + використовують без очищення на наступній стадії. Вихід: 86 %. МН : 159,4 (час утримування 0,53 хв, умова 1). 2.3 етил[4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)феніл]ацетат Суміш 9,5 г (32,8 ммол) етил(4-йодофеніл)ацетату і 9,16 г (36,1 ммол) біс(пінаколят)диборану, розчиненого в безводному диметилсульфоксиді (65 мл), дегазують аргоном 15 хвилин, потім додають 27,8 г (98,4 ммол) ацетату калію і 1,34 г (1,64 мл) дихлор(фосфінофероцен)паладію і реакційну суміш нагрівають при 55С протягом 1 години 30 хвилин в атмосфері аргону. Реакційну суміш розбавляють 220 мл етилацетату, потім органічний шар промивають три рази водою (200 мл), потім сушать над Na2SO4 і концентрують при зниженому тиску. Одержують 10,8 г сполуки у вигляді неочищеного масла каштанового кольору, + що використовують в отриманому вигляді на наступній стадії. МН : 291,2 (час утримування: 9,4 хв, умова 1). 2.4: етил {4-[7-аміно-8-етил-6-(метилкарбамоїл)-5-оксо-5,8-дигідро-1,8-нафтиридин-2іл]феніл}ацетат До 6,16 г (21,9 ммол) сполуки, отриманої на стадії 1.5 або 1.6 (у залежності від використовуваного способу А або В) і 7,64 г (26,3 ммол) сполуки, отриманої на стадії 2.3, розчиненої в суміші 1,2-диметоксіетану/етанолу 2/1 (275 мл), додають 88 мл водного насиченого розчину NaHCO3. Після дегазування суміші аргоном протягом 15 хвилин додають 1,27 г (1,1 ммол) тетракіс(трифенілфосфін)паладію. Реакційне середовище нагрівають при 100С протягом 4 годин. Реакційне середовище охолоджують до кімнатної температури, потім додають воду (300 мл), осад, що утворився, відфільтровують, споліскують водою (20 мл × 2), промивають етилацетатом (50 мл), потім сушать у вакуумі над Р2О5. Одержують 5,3 г продукти у + вигляді білого порошку. Вихід: 59 %. Точка плавлення: 195С. МН : 409,1 (час утримування: 5,89 хв, умова 1). 2.5: {4-[7-аміно-8-етил-6-(метилкарбамоїл)-5-оксо-5,8-дигідро-1,8-нафтиридин-2іл]феніл}оцтова кислота До суспензії 0,87 г (2,1 ммол) сполуки, отриманої на стадії 2.4, у суміші 1/1/1 ТГФ/метанол/вода (12 мл), додають однією порцією 0,134 г (3,2 ммол) гідроксиду літію. Реакційну суміш нагрівають при 70С протягом 3 годин, потім охолоджують до кімнатної температури. Додають воду (10 мл) і підкисляють реакційне середовище розчином HCl (1н.) до рН=2, осад, що випав, відокремлюють фільтрацією і сушать у вакуумі над Р 2О5. Одержують 0,78 + г продукту у вигляді білого порошку. Вихід: 96 %. Точка плавлення: 260С. МН : 381,1 (час утримування: 6,74 хв, умова 1). 2.6: Гідрохлорид 2-аміно-1-етил-N-метил-7-{4-[2-({[4-(1-метилетил)морфолін-3іл]метил}аміно)-2-оксоетил]феніл}-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n32) В інертній атмосфері 0,18 г N, N-карбодіімідазолу додають до суспензії 0,4 г (1,1 ммол) сполуки, отриманої на стадії 2.5, у ДМФ (5 мл), реакційне середовище перемішують при кімнатній температурі півтори години, потім додають 0,225 г (1,2 ммол) сполуки, отриманої на стадії 2.2, розчиненого в ДМФ (1 мл) і попередньо перемішаного в присутності 0,13 г (1,3 ммол) карбонату натрію, потім суміш нагрівають при 80С протягом 2 годин. Видаляють ДМФ у процесі випарювання суміші при зниженому тиску, потім залишок очищають флеш-хроматографією на силікагелі (елюент: дихлорметан/метанол/1 % NH4OH) із градієнтом метанолу від 0 % до 5 %. + Одержують 0,3 г продукти у вигляді білого порошку. Вихід: 57 %. МН : 521,3 До суспензії 0,28 г (0,54 ммол) отриманої сполуки в метанолі (2 мл) додають 0,05 мл концентрованого розчину HCl (35 %). Суміш перемішують протягом однієї години, потім додають діетиловий ефір (10 мл), твердий продукт, що утворився, відокремлюють фільтрацією і сушать у вакуумі. Одержують 0,26 г гідрохлоридної солі продукту у вигляді порошку 21 UA 102858 C2 + 5 10 15 20 25 30 35 40 45 50 55 оранжуватого кольору. Вихід: 87 %. Точка плавлення: 192С. МН : 521,3 (час утримування: 9,1 хв, умова 2) 1 ЯМР Н (400 МГц, ДМСО-d6), δ (м. ч.): 11,75 (с, 1Н); 11,13 (кв, 1Н); 10,86 (с, 1Н); 8,52 (д, 2Н, 8,1 Гц); 8,16 (д, 2Н, 8,3 Гц); 8,01 (с, 1Н); 7,95 (д, 1Н, 8,1 Гц); 7,46 (д, 2Н, 8,3 Гц); 4,61 (кв, 2Н, 6,8 Гц); 3,96 (г, 3Н); 3,83-3,02 (г дуже шир., 9Н); 2,8 (с, 3Н); 1,24 (г, 9Н). ПРИКЛАД 3: Гідрохлорид 2-аміно-1-етил-N-метил-4-оксо-7-{5-[2-оксо-2-(піридин-2іламіно)етил]піридин-2-іл}-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n19) 3.1: 2-(6-хлорпіридин-3-іл)-N-піридин-2-ілацетамід В інертній атмосфері 6,23 г (38,5 ммол) N, N-карбодіімідазолу додають до суспензії 6 г (35 ммол) 2-хлорпіридилоцтової кислоти в безводному ТГФ (90 мл) при кімнатній температурі. Реакційне середовище перемішують при цій же температурі протягом 2 годин, потім додають 5,43 г (57,7 ммол) 2-амінопіридину і суміш нагрівають протягом 2 годин з рефлюксом. До реакційної суміші додають 200 мл дихлорметану, охолоджують до кімнатної температури, отриманий органічний шар промивають насиченим розчином хлориду амонію, потім водним розчином їдкого натру (1н.), сушать над Na2SO4, фільтрують і концентрують при зниженому тиску. Залишок очищають флеш-хроматографією на силікагелі (Елюент: дихлорметан/етилацетат, градієнт етилацетату від 0 % до 79 %). Одержують 5,6 г сполуки у + вигляді білого порошку. Вихід 65 %. Точка плавлення: 130С. МН : 248,1 (час утримування: 5,45 хв, умова 1). 3.2 Гідрохлорид 2-аміно-1-етил-N-метил-4-оксо-7-{5-[2-оксо-2-(піридин-2іламіно)етил]піридин-2-іл}-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n19) Працюють таким же способом, як описано в прикладі 1, стадія 1.12, але виходять з 0,32 г (1,3 ммол) сполуки, отриманої на стадії 3.1, 0,41 г (1,4 ммол) сполуки, отриманої на стадії 1.7, 74 мг (0,06 ммол) тетракіс(трифенілфосфін)паладію, 14,5 мл насиченого розчину гідрокарбонату в суміші 1,2-диметоксіетану/етанолу (2/1) (19 мл) і 0,26 мл розчину HCl (1М) у простому ефірі. + Одержують 0,095 г гідрохлоридної солі продукту у вигляді порошку жовтого кольору. МН : 458,3 (час утримування: 6,3 хв, умова 1). Вихід 16 %. Точка плавлення: 268-288С (розкладання). 1 ЯМР Н (400 МГц, ДМСО-d6), δ (м. ч.): 11,77 (с, 1Н); 11,3 (с, 1Н); 11,12 (с, 1Н); 8,74 (д, 1Н, 2 Гц); 8,62 (д, 1Н, 8,1 Гц); 8,49 (д, 1Н, 8,2 Гц); 8,36 (г, 1Н); 8,35 (д, 1Н, 8,1 Гц); 8,05 (с+дд, 2Н, 2-8,2 Гц); 8 (д, 1Н, 8,4 Гц); 7,9 (дд, 1Н, 7,2-8,4 Гц); 7,2 (дд, 1Н, 5,2-7,2 Гц); 6,33 (2HCl); 4,64 (г, 2Н); 3,97 (с, 2Н); 2,82 (с, 3Н); 1,33 (т, 3Н, 6,8 Гц). ПРИКЛАД 4: 2-аміно-1-етил-N-метил-4-оксо-7-{6-[2-оксо-2-(піридин-2-іламіно)етил]піридин-3іл}-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n21) 4.1: 2-(5-бромпіридин-2-іл)-N-піридин-2-іл-ацетамід В інертній атмосфері до 0,26 г (0,95 ммол) (5-бромпіридин-2-іл)-оцтової кислоти (синтез якої описаний у Tetrahedron, 1997, 53(24) 8257-8268, Gurnos J. Et coll), розчиненої в безводному ТГФ (4 мл), послідовно додають 0,09 г (0,95 ммол) 2-амінопіридину, 0,31 г (2,4 ммол) діізопропілетиламіну і 0,35 г (1,1 ммол) TBTU. Реакційну суміш перемішують 3 години при кімнатній температурі. Реакційну суміш концентрують при зниженому тиску і залишок обробляють етилацетатом (20 мл), потім отриманий таким шляхом органічний шар промивають насиченим розчином хлориду амонію (15 мл) і насиченим розчином гідрокарбонату (15 мл), потім сушать над Na2SO4, фільтрують і концентрують при зниженому тиску. Залишок очищають флеш-хроматографією на силікагелі (елюент: дихлорметан/етилацетат, 1 % NH4OH) із градієнтом етилацетату від 0 % до 20 %, 1 % NH4OH. Одержують 0,125 г сполуки у вигляді + порошку білого кольору. Вихід: 45 %. Точка плавлення: 131С. МН : 292-294 (час утримування: 6,1 хв, умова 1). 4.2: 2-аміно-1-етил-N-метил-4-оксо-7-{6-[2-оксо-2-(піридин-2-іламіно)етил]піридин-3-іл}-1,4дигідро-1,8-нафтиридин-3-карбоксамід (сполука n21) Працюють таким же способом, як описано в прикладі 1, стадія 1.12, але виходять з 0,42 г (1,4 ммол) сполуки, отриманої на стадії 4.1, 0,46 г (1,6 ммол) сполуки, отриманої на стадії 1.7, 83 мг (0,07 ммол) тетракіс(трифенілфосфін)паладію, 15 мл насиченого розчину гідрокарбонату в суміші 1,2-диметоксіетану/етанолу (2/1) (24 мл) і одержують 0,03 г продукту у вигляді порошку + білого кольору. Вихід: 5 %. Точка плавлення: 266С. МН : 458,1 (час утримування: 6,5 хв, умова 1). 1 ЯМР Н (400 МГц, ДМСО-d6), δ (м. ч.): 11,76 (с, 1Н); 11,10 (кв, 1Н, 4,6 Гц); 10,78 (с, 1Н); 9,32 (д, 1Н, 2,3 Гц); 8,57 (д, 1Н, 8,1 Гц); 8,53 (дд, 1Н, 2,3-8,2 Гц); 8,34 (д, 1Н, 5 Гц); 8,07 (д, 1Н, 8,2 Гц); 8,04 (д+с, 2Н, 8,2 Гц); 7,78 (дд, 1Н, 7,4-8,2 Гц); 7,59 (д, 1Н, 8,1 Гц); 7,12 (дд, 1Н, 5, 7,4 Гц); 4,61 (г, 2Н); 4,05 (с, 2Н); 2,82 (д, 3Н, 4,6 Гц); 1,33 (т, 3Н, 6,8 Гц). 22 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 ПРИКЛАД 5: Гідрохлорид 2-аміно-7-[4-(2-{[(4-циклопропілморфолін-3-іл)метил]аміно}-2оксоетил)феніл]-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n33) 5.1 4-циклопропілморфолін-3-карбоксамід До 1,2 г (7,2 ммол) гідрохлориду морфолін-3-карбоксаміду (синтез якого описаний у міжнародній заявці WO2005026156, Hennequin L.F.A. et coll), розчиненого в метанолі (36 мл), послідовно додають 2,9 г молекулярного сита 3А, 4,3 г (72 ммол) оцтові кислоти, 7 г (43,2 ммол) 2[(1-етоксициклопропіл)окси]триметилсилану і 4,4 г (31,7 ммол) ціанборгідриду натрії. Реакційну суміш нагрівають при 70С протягом 3 з половиною годин, потім охолоджують до кімнатної температури, потім фільтрують. Фільтрат концентрують при зниженому тиску, потім залишок обробляють дихлорметаном (200 мл) і промивають 3 рази водним розчином NaOH (1н.)(100мол). Органічний шар сушать над Na2SO4, фільтрують, потім концентрують при зниженому тиску. Одержують 0,58 г продукту у вигляді білого порошку. Вихід: 47 %. Точка + плавлення: 116С. МН : 171,2 (час утримування: 1,03 хв, умова 1). 5.2 1-(4-циклопропілморфолін-3-іл)метанамін, гідрохлорид В інертній атмосфері до розчину 0,58 г (3,4 ммол) сполуки, отриманої на стадії 5.1, у безводному ТГФ, охолодженому до 0 °C, додають по краплях 13,6 мл (13,6 ммол) розчину (1н.) тетрагідрофуранового комплексу з тригідридом бору в ТГФ. Реакційну суміш нагрівають при 70 °C протягом 3 год. Додають 15 мл розчину HCl (1н.) до реакційної суміші, охолодженої до кімнатної температури, після перемішування протягом 30 хвилин водний шар декантують і екстрагують 2 рази ефіром (15 мл), потім підлуговують додаванням розчину (1н.) їдкого натру. Потім водний шар екстрагують 4 рази (20 мл) етилацетатом і 4 рази (20 мл) дихлорметаном. Об'єднані органічні шари сушать над Na2SO4, фільтрують і концентрують при зниженому тиску. Залишок обробляють метанолом (4 мл) і додають 3,4 мл розчину HCl в ефірі, розчин перемішують 30 хвилин, потім додають 5 мл ефіру, твердий продукт, що утворився, виділяють фільтрацією і сушать у вакуумі над Р2О5. Одержують 0,51 г продукту у вигляді білого порошку. + Вихід: 78 %. МН : 157,2 (час утримування: 0,4 хв, умова 1). 5.3. Гідрохлорид 2-аміно-7-[4-(2-{[(4-циклопропілморфолін-3-іл)метил]аміно}-2оксоетил)феніл]-1-етил-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n33) Працюють таким же способом, як описано в прикладі 2, стадія 2.6, але виходять з 0,33 г (0,88 ммол) сполуки, отриманої на стадії 2.5, суспендованої в безводному ДМФ (5 мл), додають 0,15 г (0,92 ммол) CDI і суміш перемішують при кімнатній температурі протягом 2 годин 40 хвилин. Паралельно, в інертній атмосфері до 0,22 г (0,97 ммол) сполуки, отриманої на стадії 5.2, розчиненої в ДМФ (2 мл), додають 0,11 г (1,1 ммол) карбонату натрію і суміш перемішують при КТ протягом 2 годин, потім супернатант відбирають і додають по краплях до отриманого вище проміжному імідазоліду. Суміш нагрівають при 80 °C протягом2 год. Випарюють ДМФ при зниженому тиску і залишок очищають флеш-хроматографією на силікагелі (елюент: дихлорметан/метанол) із градієнтом метанолу від 0 % до 5 %. Одержують 0,13 г продукту у вигляді білого порошку. Вихід 28 %. До 0,13 г (0,25 ммол) отриманої сполуки, розчиненої в 2 мл метанолі, додають 0,02 г (0,3 ммол) 35,6 % концентрованого розчину HCl. Суміш перемішують при КТ протягом 1 години, твердий продукт, що утворився, виділяють фільтрацією, сушать над Р 2О5 у вакуумі. Одержують + 0,13 сполуки у вигляді білого порошку. Вихід: 92 %. Точка плавлення: 250С. МН : 519,2 (час утримування: 5,5 хв, умова 1). 1 ЯМР Н (400 МГц, ДМСО-d6), δ (м. ч.): 11,74 (с, 1Н); 11,13 (кв, 1Н, 4,6 Гц); 10,33 (с, 1Н); 8,53 (д, 1Н, 8,1 Гц); 8,38 (с, 1Н); 8,16 (д, 2Н, 8,1 Гц); 8,0 (с, 1Н); 7,97 (д, 1Н, 8,1 Гц); 7,45 (д, 2Н, 8,1 Гц); 4,61 (г, 2Н); 4,03-3,79 (г, 3Н); 3,69-3,24 (г, 8Н); 2,95 (г, 1Н); 2,81 (с, 3Н); 1,32 (т, 3Н, 6,9 Гц); 1,16-0,92 (г, 4Н). ПРИКЛАД 6: Гідрохлорид 2-аміно-1-етил-7-{4-[2-({[(2S, 4R)-1-етил-4-фторпіролідин-2іл]метил}аміно)-2-оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n26) 6.1 (4R)-1-етил-4-фтор-L-пролінамід Працюють у такий же спосіб, як описано в прикладі 2, стадія 2.1, але виходять з 0,88 г (5,2 ммол) 4(R)-фтор-2(S)-піролінкарбоксаміду (синтез якого описаний у Bioorg Med Chem 12(23), 2004, 6053-6061, Fukushima H. Er coll), 0,90 г (5,7 ммол) етилйодиду і 1,53 г (18,3 ммол) NaHCO3 у безводному ДМФ (17 мл), одержують 0,84 г продукту у вигляді білого порошку. Вихід: + 100 %. Точка плавлення: 127С. МН : 161,2 (час утримування: 0,36 хв, умова 1). 6.2: 1-[(2S, 4R)-1-етил-4-фторпіролідин-2-іл]метанамін, гідрохлорид 23 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 Працюють у такий же спосіб, як описано в прикладі 5, стадія 5.2, але виходять з 0,69 г (4,3 ммол) сполуки, отриманої на стадії 6.1, 17,3 мл (17,3 ммол) розчину (1М в ТГФ) тетрагідрофуранового комплексу з тригідридом бору в безводному ТГФ (30 мл) і з 4,3 мл розчину HCl (1M) у ефірі, одержують 0,33 г продукту у вигляді жовтої масла, що + використовується без очищення на наступній стадії. Вихід: 52 %. МН : 147,3 (час утримування: 0,36 хв, умова 1). 6.3: Гідрохлорид 2-аміно-1-етил-7-{4-[2-({[(2S, 4R)-1-етил-4-фторпіролідин-2-іл]метил}аміно)2-оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n26) В інертній атмосфері до суспензії 0,85 г (2,2 ммол) сполуки, отриманої на стадії 2.5, у дихлорметані (9 мл), додають 0,45 г (4,4 ммол) триетиламіну. Суміш охолоджують до 0С (крижана баня) і по краплях додають 0,61 г (4,4 ммол) ціанурилфториду, розчиненого в (1 мл) дихлорметану. Суміш перемішують при КТ протягом 3 годин 30 хвилин, потім розбавляють 30 мл дихлорметану, промивають 20 мл попередньо охолодженого насиченого розчину NaHCO3, сушать над Na2SO4, фільтрують і концентрують. Отриманий фторангідрид кислоти використовують на наступній стадії без очищення. До 0,24 г (1,6 ммол) сполуки, отриманої на стадії 6.2, розчиненої в безводному ДМФ (4 мл), додають 0,41 г (4,1 ммол) триетиламіну з наступним додаванням 0,63 г (1,7 ммол) фторангідриду кислоти, отриманого на попередній стадії. Суміш перемішують при КТ протягом ночі, потім випарюють ДМФ у вакуумі, залишок обробляють дихлорметаном (20 мл) і органічний шар промивають насиченим розчином NaHCO3, сушать над Na2SO4, фільтрують і концентрують при зниженому тиску. Залишок очищають флеш-хроматографією на силікагелі (елюент: дихлорметан/метанол) із градієнтом метанолу від 0 % до 3 %. Одержують 0,075 г сполуки у + вигляді білого порошку. Вихід 9 %. Альфа D=-12 (концентрація 25 мг/мл у МеОН). МН : 509 (час утримування: 5,2 хв, умова 1). До 0,07 г (0,13 ммол) сполуки, отриманої на попередній стадії, розчиненої в метанолі (2,5 мл), додають 0,13 мл (0,13 ммол) розчину HCl (1М) в ефірі. Суміш перемішують при КТ протягом 1 години, концентрують при зниженому тиску. Твердий продукт розтирають у дихлорметані (2 мл), фільтрують і сушать у вакуумі над Р2О5. Одержують 0,05 г сполуки у + вигляді порошку яскраво-жовтого кольору. Вихід: 59 %. Точка плавлення: 170С. МН : 509,3 (час утримування: 5,2 хв, умова 1). 1 ЯМР Н (400 МГц, ДМСО-d6), δ (м. ч.): 11,73 (с, 1Н); 11,12 (г, 1Н); 10,56 (с, 1Н); 8,59 (т, 1Н, 5,6 Гц); 8,54 (д, 1Н, 8,1 Гц); 8,16 (д, 2Н, 8,3 Гц); 7,99 (с, 1Н); 7,96 (д, 1Н, 8,1 Гц); 7,48 (д, 2Н, 8,3 Гц); 5,41 (дт, 1Н, 4,9-53,2 Гц); 4,61 (г, 2Н); 3,9 (г, 1Н); 3,82-3,44 (г, 6Н); 3,38 (г, 1Н); 3,12 (г, 1Н); 2,82 (г, 3Н); 2,36 (г, 1Н); 2,02 (г, 1Н); 1,33 (т, 3Н, 6,8 Гц); 1,24 (т, 3Н, 7,9 Гц). ПРИКЛАД 7: Гідрохлорид 2-аміно-1-етил-7-{4-[2-({[(2S)-1-етил-4,4-дифторпіролідин-2іл]метил}аміно)-2-оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n24) 7.1 1-етил-4,4-дифтор-L-пролінамід Працюють у такий же спосіб, як описано в прикладі 2, стадія 2.1, але виходять з 0,2 г (1,1 ммол) 4,4-дифтор-2(R)-піролінкарбоксаміду (синтез якого описаний у Bioorg Med Chem 12(23), 2004, 6053-6061, Fukushima H. E. coll), 0,18 г (1,2 ммол) етилйодиду і 0,32 г (3,7 ммол) NaHCO3 у безводному ДМФ (3,5 мл), і одержують 0,18 г продукту у вигляді білого порошку. + Вихід: 95 %. Точка плавлення: 138С. МН : 179,2 (час утримування: 1,25 хв, умова 1). 7.2: Гідрохлорид 1-[(2S)-1-етил-4,4-дифторпіролідин-2-іл]метанамін Працюють у такий же спосіб, як описано в прикладі 5, стадія 5.2, але виходять з 0,18 г (1 ммол) сполуки, отриманої на стадії 7.1, 8,2 мл (8,2 ммол) розчину (1М в ТГФ) тетрагідрофуранового комплексу з тригідридом бору в безводному ТГФ (12 мл) і з 2 мл розчину HCl (1M) в ефірі, одержують 0,2 г продукту у вигляді порошку сірого кольору, що + використовується без будь-якого очищення. Вихід: 100 %. МН : не виявлено. 7.3: Гідрохлорид 2-аміно-1-етил-7-{4-[2-({[(2S)-1-етил-4,4-дифторпіролідин-2-іл]метил}аміно)2-оксоетил]феніл}-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n24) В інертній атмосфері до 0,32 г (0,85 ммол) сполуки, отриманої на стадії 2.5, суспендованої в безводному ДМФ (4 мл), послідовно додають 0,37 мл (3,8 ммол) діізопропілетиламіну, потім розчин у ДМФ (2 мл) 0,20 г (0,85 ммол) сполуки, отриманої на стадії 7.2, у присутності 0,3 мл (1,7 ммол) діізопропілетиламіну, до отриманої реакційної суміші, охолодженої на крижаній бані, додають 0,31 г (0,9 ммол) TBTU. Реакційну суміш перемішують 6 годин при 70С, потім концентрують при зниженому тиску. Залишок очищають флеш-хроматографією на силікагелі (елюент: дихлорметан/етилацетат, 1 % NH4OH) із градієнтом етилацетату від 0 % до 100 %, 1 % NH4OH. Одержують 0,087 г сполуки у вигляді порошку рожевуватого кольору. 24 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 60 До 0,087 г (0,17 ммол) отриманої на попередній стадії сполуки, розчиненої в 2 мл метаноли, додають 0,17 мл (0,17 ммол) розчину HCl (1М в ефірі). Суміш перемішують при КТ протягом 1 год., потім додають 5 мл ефіру і твердий продукт, що утворився, виділяють фільтруванням, сушать над Р2О5 у вакуумі. Одержують 0,065 г продукту у вигляді порошку рожевуватого + кольору. Вихід: 70 %. Точка плавлення: 266С. МН : 527,3 (час утримування: 6,04 хв, умова 1). 1 ЯМР Н (400 МГц, ДМСО-d6), δ (м. ч.): 11,74 (с, 1Н); 11,12 (кв, 1Н, 4,6 Гц); 11,08 (с, 1Н); 8,58 (с, 1Н); 8,53 (д, 1Н, 8,1 Гц); 8,16 (д, 2Н, 8,3 Гц); 7,98 (с, 1Н); 7,96 (д, 1Н, 8,1 Гц); 7,47 (д, 2Н, 8,3 Гц); 4,61 (г, 2Н); 4,18 (кв, 1Н, 10,7 Гц); 3,91 (г, 1Н); 3,82 (кв, 1Н, 12,9 Гц); 3,59 (с, 2Н); 3,56 (г, 3Н); 3,17 (г, 1Н); 2,81 (с, 3Н); 2,75 (г, 1Н); 2,43 (г, 1Н); 1,32 (т, 3Н, 6,8 Гц); 1,21 (т, 3Н, 7,1 Гц). ПРИКЛАД 8: Гідрохлорид 2-аміно-1-етил-7-[4-(2-{[(4-етилморфолін-3-іл)метил]аміно}-2оксоетил)феніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n22) 8.1: 4-етилморфолін-3-карбоксамід Працюють у такий же спосіб, як описано в прикладі 2, стадія 2.1, але виходять з 0,2 г (1,1 ммол) морфолін-3-карбоксаміду (синтез якого описаний у міжнародній заявці WO2005026156, Hennequin L.F.A. et coll), з 0,18 г (1,2 ммол) етилйодиду і 0,32 г (3,7 ммол) NaHCO3 у безводному ДМФ (3,5 мл), і одержують 0,18 г продукту у вигляді білого порошку. + Вихід: 95 %. Точка плавлення: 127С. МН : 159,3 (час утримування: 0,35 хв, умова 1). 8.2: 1-(4-етилморфолін-3-іл)метанамін В інертній атмосфері до 0,06 г (0,38 ммол) сполуки, отриманої на стадії 8.1, розчиненої в безводному ТГФ, додають 0,76 мл (0,76 ммол) розчину (1М) у безводному ТГФ літійалюмінійгідриду, потім реакційну суміш нагрівають при 70 °C протягом 5 годин. До суміші, охолодженої до КТ, послідовно додають 28 мкл води, 28 мкл їдкого натру (1н.), 84 мкл води для утворенням "коржа". Суміш інтенсивно перемішують протягом 30 хвилин, потім осад видаляють фільтрацією. Фільтрат концентрують при зниженому тиску з утворенням 0,06 г продукту у вигляді безбарвної масла, що використовують без очищення на наступній стадії. Вихід: 100 %. 1 ЯМР Н (300 МГц, ДМСО-d6), δ (м. ч.): 3,82 (г, 2Н); 3,61 (г, 2Н); 2,92 (г, 2Н); 2,77 (г, 2Н); 2,4 (г, 3Н); 1,53 (с, 2Н); 1,1 (т, 3Н, 7,5 Гц). 8.3 Гідрохлорид 2-аміно-1-етил-7-[4-(2-{[(4-етилморфолін-3-іл)метил]аміно}-2оксоетил)феніл]-N-метил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду Працюють у такий же спосіб, як описано в прикладі 7, стадія 7.3, але виходять з 0,14 г (0,37 ммол) сполуки, отриманої на стадії 2.5, 0,05 г (0,37 ммол) сполуки, отриманої на стадії 8.2, 0,13 г (0,4 ммол) TBTU і 0,12 г (0,92 ммол) дізопропілетиламіну у безводному ДМФ (4 мл) і 0,17 мл розчину HCl (1M) в ефірі. Одержують 0,07 г продукту у вигляді білого порошку. Вихід: + 50 %. Точка плавлення: 190С. МН : 507,1 (час утримування: 5,4 хв, умова 1). 1 ЯМР Н (400 МГц, ДМСО-d6), δ (м. ч.): 11,73 (с, 1Н); 11,12 (кв, 1Н, 4,6 Гц); 11,03+10,76 (2с, 1Н); 8,52 (д, 2Н, 8,1 Гц); 8,15 (д, 2Н, 8,1 Гц); 7,98 (с шир., 1Н); 7,95 (д, 1Н, 8,1 Гц); 7,47 (д, 2Н, 8,1 Гц); 4,61 (г, 2Н); 3,94 (г, 2Н); 3,81 (г, 1Н); 3,58 (г, 3Н); 3,38 (г, 4Н); 3,18 (г, 3Н); 2,81 (д, 3Н, 4,6 Гц); 1,28 (г, 6Н). ПРИКЛАД 9: 1-етил-7-[5-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)тіофен-2-іл]-N, 2диметил-4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n52) 9.1: (5-хлортіофен-2-іл)оцтова кислота До 19,7 г (158,8 ммол) FAMSO додають 1,2 г (29,8 ммол) порошкоподібного гідроксиду натрії, суміш нагрівають при 70С протягом 30 хвилин, потім додають 3 г (19,8 ммол) 5-хлор-2тіофенкарбоксальдегіду і суміш знову нагрівають при 70С протягом однієї ночі. При кімнатній температурі додають 850 мл води, потім водний шар екстрагують етилацетатом (3 рази по 430 мл). Об'єднані органічні шари промивають водним насиченим розчином NaCl, сушать над Na2SO4, фільтрують і концентрують при зниженому тиску. Одержують 6,7 г продукту у вигляді + масла каштанового кольору, що використовується без очищення на наступній стадії. МН : 253 (час утримування: 7,6 хв, умова 1). До 6,7 г сполуки, отриманої на попередній стадії, розчиненої в етанолі (44 мл), додають 33 мл (132 ммол) розчину HCl (4М) у діоксані і суміш нагрівають при 80С протягом 2 годин 15 хвилин. Суміш охолоджують до КТ, розбавляють етилацетатом (400 мл) і промивають насиченим водним розчином NaHCO3 (350 мл), потім NaCl (200 мл), органічний шар сушать над Na2SO4, фільтрують і концентрують при зниженому тиску. Залишок очищають флешхроматографією на колонці із силікагелем (елюент: гептан/дихлорметан) із градієнтом дихлорметану від 0 % до 50 %. Одержують 1,93 г продукту у вигляді масла каштанового + кольору. Вихід: 32 %. МН : 205,1 (час утримування: 5,33 хв, умова 1). До 1,93 г (6,6 ммол) сполуки, отриманої на попередній стадії, розчиненої в розчинювальній суміші (ТГФ/метанол/вода 1/1/1) (33 мл), додають 0,97 г (23,1 ммол) моногідратного гідроксиду літію. Суміш нагрівають при 70С протягом 2 год., охолоджують до КТ і підкисляють до рН=1 25 UA 102858 C2 5 10 15 20 25 30 35 40 45 50 55 60 додаванням 23 мл водного розчину HCl (1н.), потім екстрагують дихлорметаном (2 рази по 30 мл). Об'єднані органічні шари промивають насиченим водним розчином NaCl, сушать над Na2SO4, фільтрують і концентрують при зниженому тиску. Одержують 1,44 г продукту у вигляді + порошку каштанового кольору і використовуваного без очищення на наступній стадії. МН : 176 (час утримування: 12,3 хв, умова GC Cl/CH4+). 9.2 2-(5-хлортіофен-2-іл)-N-[(1-етилпіролідин-2-іл)метил]ацетамід Працюють у такий же спосіб, як описано в прикладі 4, стадія 4.1, але виходять з 1,77 г (10 ммол) сполуки, отриманої на попередній стадії, 5,4 г (40 ммол) 1-етилпіролідинметиламіну, 6,4 г (20 ммол) TBTU і 2,58 г (20 ммол) діізопропілетиламіну в безводному ДМФ (100 мл). + Одержують 1,62 г продукту у вигляді білого порошку. Вихід: 56 %. Точка плавлення: МН : 287,1 (час утримування: 4,1 хв, умова 1). 9.3: 1-етил-7-[5-(2-{[(1-етилпіролідин-2-іл)метил]аміно}-2-оксоетил)тіофен-2-іл]-N, 2-диметил4-оксо-1,4-дигідро-1,8-нафтиридин-3-карбоксамід (сполука n52) Працюють у такий же спосіб, як описано в прикладі 1, стадія 1.12, але виходять з 1 г (3,5 ммол) сполуки, отриманої на стадії 9.2, 1,3 г (4,5 ммол) сполуки, отриманої на стадії 1.7, 0,24 г (0,2 ммол) тетракіс(трифенілфосфін)паладію і 14 мл насиченого розчину NaHCO3 у суміші ДМЕ/EtOH 2/1 (35 мл). Одержують 0,05 г продукту, одержаного у вигляді білого порошку. Вихід + 2 %. Точка плавлення: 250С. МН : 497 (час утримування: 5,3 хв, умова 1). 1 ЯМР Н (400 МГц, ДМСО-d6), δ (м. ч.): 11,7 (с, 1Н); 11,1 (кв, 1Н, 4,5 Гц); 8,43 (д, 1Н, 8,3 Гц); 8,0 (г, 1Н); 7,95 (с шир., 1Н); 7,82 (д, 1Н, 8,3 Гц); 7,80 (д, 1Н, 3,7 Гц); 7,0 (д, 1Н, 3,7 Гц); 4,5 (г, 2Н); 3,72 (с, 2Н); 3,27 (г, 1Н); 3,01 (г, 1Н); 2,89 (г, 1Н); 2,8 (т, 3Н, 4,5 Гц); 2,76 (г, 1Н); 2,42 (г, 1Н); 2,18 (г, 1Н); 2,07 (г, 1Н); 1,76 (г, 1Н); 1,61 (г, 2Н); 1,48 (г, 1Н); 1,3 (т, 3Н, 6,9 Гц); 1,01 (т, 3Н, 7,2 Гц). ПРИКЛАД 10: Гідрохлорид 2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-(піридин-2іламіно)етил]феніл}-1,4-дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n64) 10.1 N-[2-(4-бромфеніл)етил]піридин-2-амін У посудині, що герметизується, суміш 1,9 г (20,4 ммол) 2-амінопіридину і 6,1 г (30,6 ммол) 4бромфенілетиламіну, розчиненого в бутанолі (10 мл), нагрівають при 230 °C протягом 1 години в мікрохвильовій печі. Суміш, охолоджену до кімнатної температури, виливають у воду (50 мл) і екстрагують етилацетатом (3 рази по 100 мл), об'єднані органічні шари сушать над сульфатом натрію, фільтрують і концентрують. Залишок очищають флеш-хроматографією на колонці із силікагелем (елюент: дихлорметан/етилацетат) із градієнтом етилацетату від 0 % до 50 %. Одержують 1,4 г продукти у вигляді порошку білого кольору. Вихід: 24 %. Точка плавлення: + 71С. МН : 278,1 (час утримування: 3,71 хв, умова 1). 10.2 Гідрохлорид 2-аміно-1-етил-N-метил-4-оксо-7-{4-[2-(піридин-2-іламіно)етил]феніл}-1,4дигідро-1,8-нафтиридин-3-карбоксаміду (сполука n64) Працюють у такий же спосіб, як описано в прикладі 1, стадія 1.12, але виходять з 0,3 г (1,1 ммол) сполуки, отриманої на стадії 10.1, 0,345 г (1,2 ммол) сполуки, отриманої на стадії 1.7, 0,06 г (0,05 ммол) тетракіс(трифенілфосфін)паладію і 4,7 мл насиченого розчину NaHCO3 у суміші ДМЕ/EtOH 2/1 (15 мл). 0,12 г отриманого продукту обробляють метанолом (3 мл) і додають 0,03 мл 36 % концентрованої HCl. Одержують 0,130 г продукту у вигляді білого + порошку. Вихід: 25 %. Точка плавлення: 242С. МН : 497 (час утримування: 5,33 хв, умова 1). 1 ЯМР Н (400 МГц, ДМСО-d6), δ (м. ч.): 13,7 (с, 1Н); 11,73 (г, 1Н); 11,12 (кв, 1Н, 4,5 Гц); 8,9 (с, 1Н); 8,52 (д, 1Н, 8,1 Гц); 8,17 (д, 2Н, 8,3 Гц); 8,02 (с шир., 1Н); 7,96 (д, 1Н, 8,1 Гц); 7,89 (г, 1Н); 7,51 (д, 2Н, 8,3 Гц); 7,08 (д, 1Н, 9,1 Гц); 6,84 (т шир., 1Н, 6,7 Гц); 4,6 (г, 2Н); 3,69 (г, 2Н); 3,01 (т, 2Н, 7,2 Гц); 2,81 (д, 3Н, 4,5 Гц); 1,32 (т, 3Н, 6,9 Гц). Сполуки 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 23, 25, 28, 30, 31, 45, 46, 47, 51, 52, 56, 62, 63 і 64 отримані відповідно до варіанта синтезу, описаного у прикладі 1. Сполуки 35, 36, 37, 38, 40, 41, 42, 44, 48, 49, 50, 53, 54 і 55 отримані відповідно до варіанта синтезу, описаного у прикладі 2. Сполуки 29, 34 і 43 отримані відповідно до варіанта, описаного у прикладі 3. Прикладені нижче таблиці ілюструють хімічну структуру і фізичні властивості деяких сполук відповідно до винаходу. Таблиця 1 ілюструє сполуки формули (Ia), що відповідають сполукам формули (I), у якій U означає карбонільну групу і R6=-(CH2)n-L. Таблиця 2 ілюструє сполуки формули (I), що відповідають сполукам формули (I), у яких U означає карбонільну групу, Y, V і W означають групу -CH-, Z означає атом вуглецю, R7 означає атом водню і R6=-(CH2)n-L. Таблиця 3 ілюструє сполуки формули (Ic), що відповідають сполукам формули (I), у яких U означає групу -CH2-, Z, Y, V і W означають групу -CH-, R7 означає атом водню і R6=-(CH2)n-L. У таблицях: 26 UA 102858 C2 5 - у стовпчику "сіль" символ "-" означає сполуку у формі вільної основи, а "HCl" означає сполуку у формі гідрохлориду, а число в дужках указує на відношення (кислота: основа), - Ме, Et, n-Pr, i-Pr, n-Bu і i-Bu означають відповідно групи метильну, етильну, н-пропільну, ізопропільну, н-бутильну і ізобутильну, і - Ph і Bn означають відповідно групи фенільну і бензильну. Таблиця 1 (*) умова проведення LC/UV/MS, якщо немає відсилання на умову, то значить була використана умова 1 27 UA 102858 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyridino-pyridinone derivatives, preparation thereof, and therapeutic use thereof
Автори англійськоюBellevergue, Patrice, Lassalle, Gilbert, Mccort, Gary, Martin, Valerie, Savi, Pierre, Volle-Challier, Cecile
Назва патенту російськоюПроизводные пиридино-пиридинонов, способ их получения и применения в терапии
Автори російськоюБелльверг Патрис, Лассалль Жильбер, Маккорт Гари, Мартен Валери, Сави Пьер, Волль-Шалье Сесиль
МПК / Мітки
МПК: C07D 213/74, A61P 7/02, C07D 213/82, A61P 35/00, A61P 13/00, A61P 37/00, A61K 31/4375, A61P 9/00, C07D 471/04
Мітки: похідні, піридинопіридинонів, терапії, спосіб, застосування, одержання
Код посилання
<a href="https://ua.patents.su/44-102858-pokhidni-piridinopiridinoniv-sposib-kh-oderzhannya-i-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні піридинопіридинонів, спосіб їх одержання і застосування в терапії</a>
Попередній патент: Похідні хінуклідинкарбонату та їх застосування
Наступний патент: Різцевий блок
Випадковий патент: Пристрій для протруювання насіння під час сівби