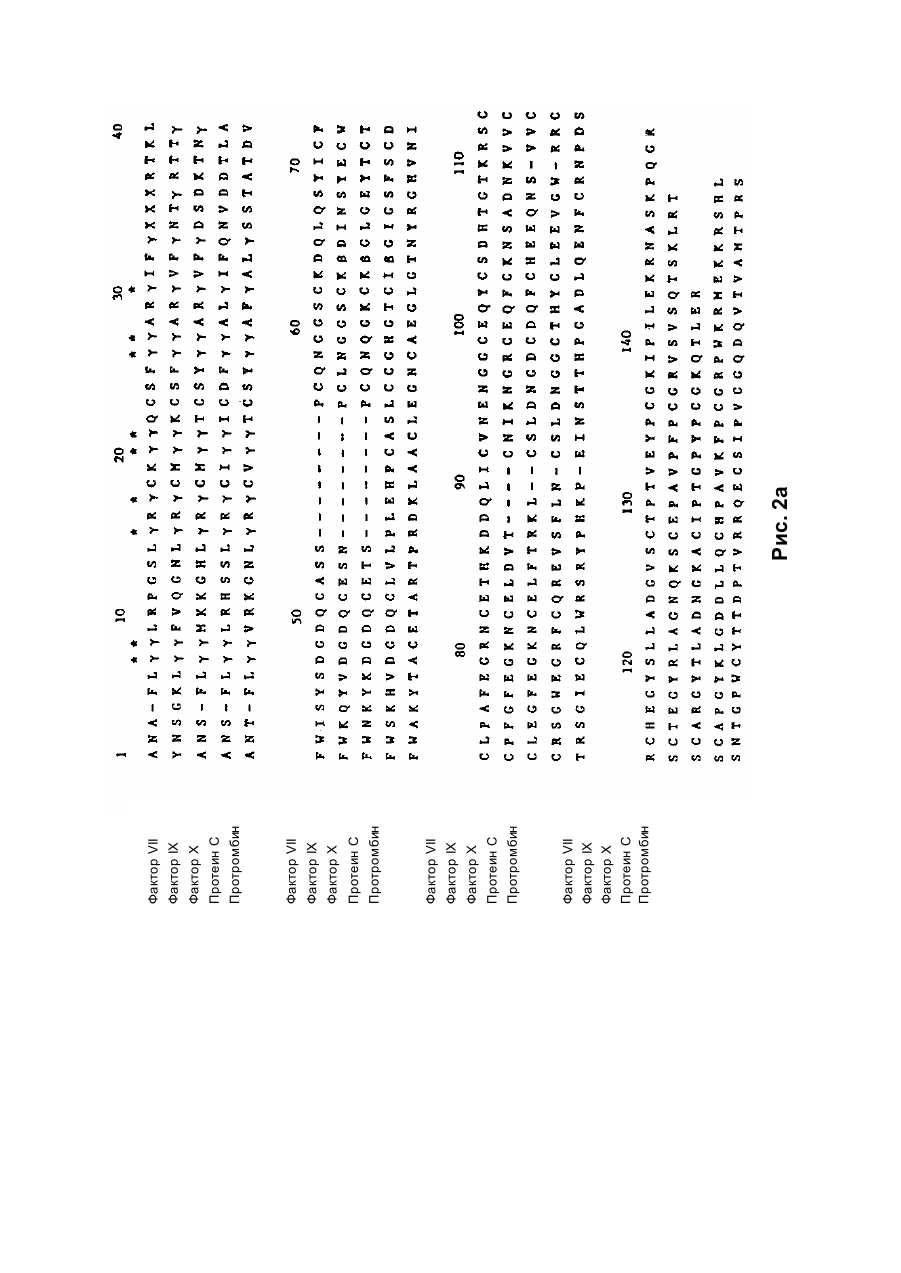
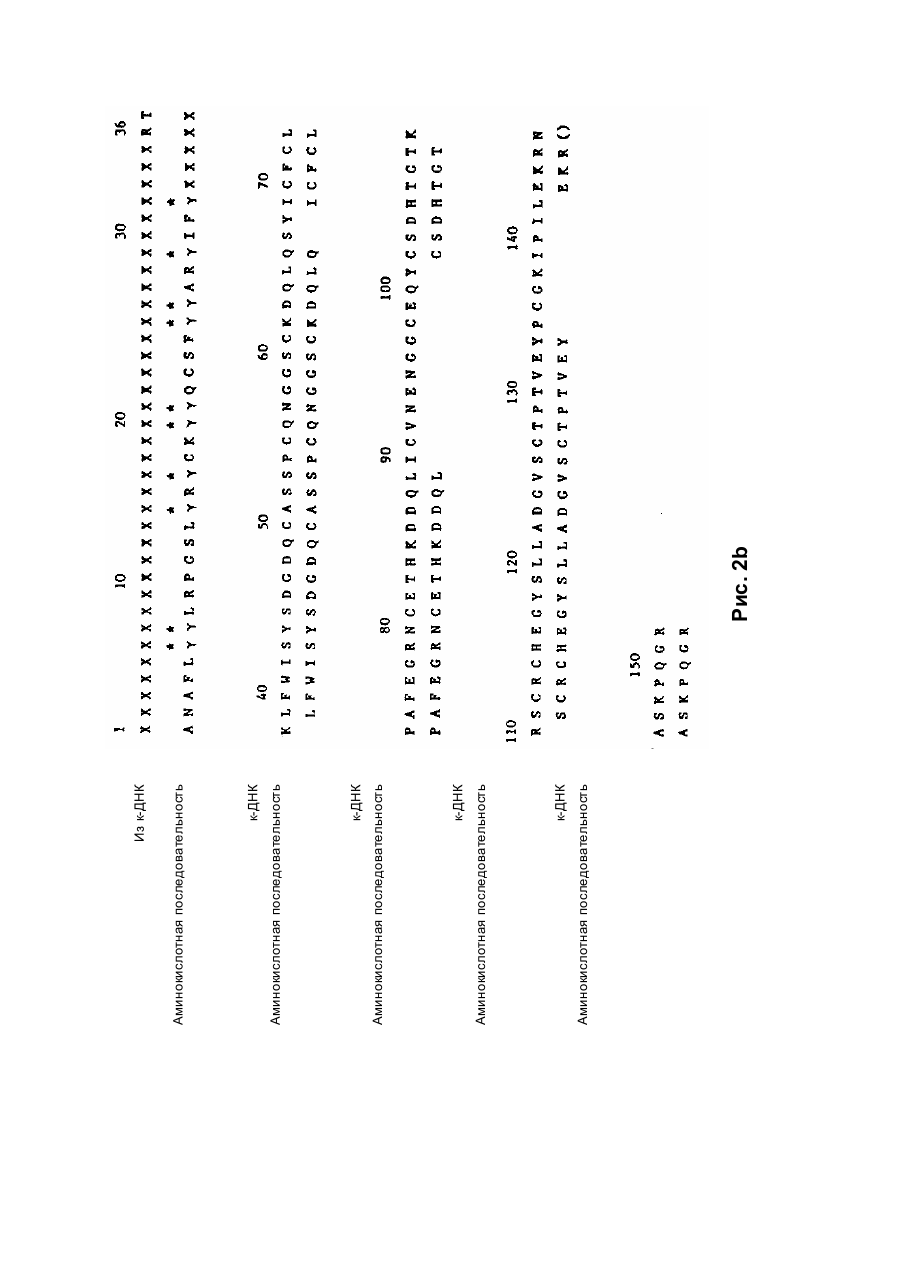
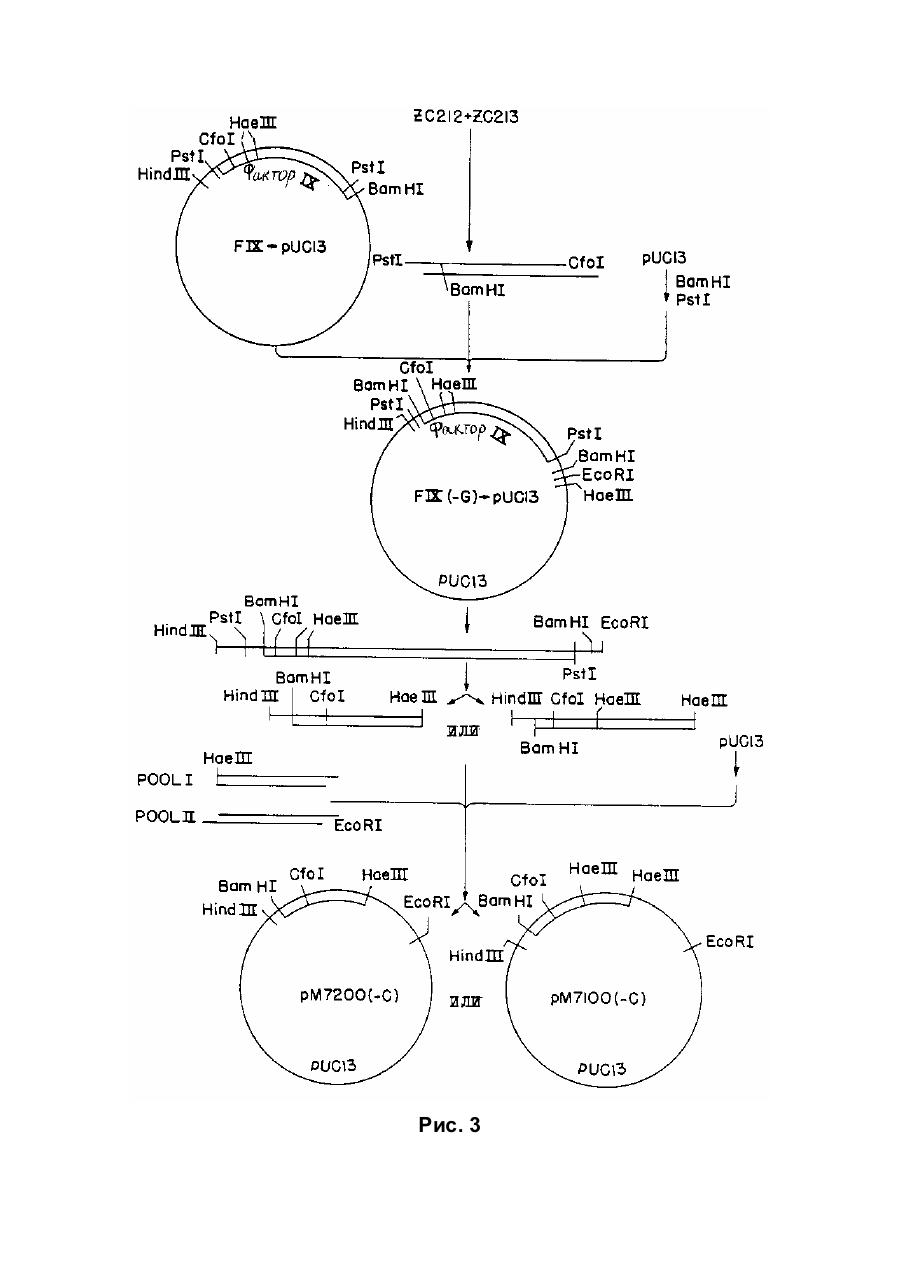
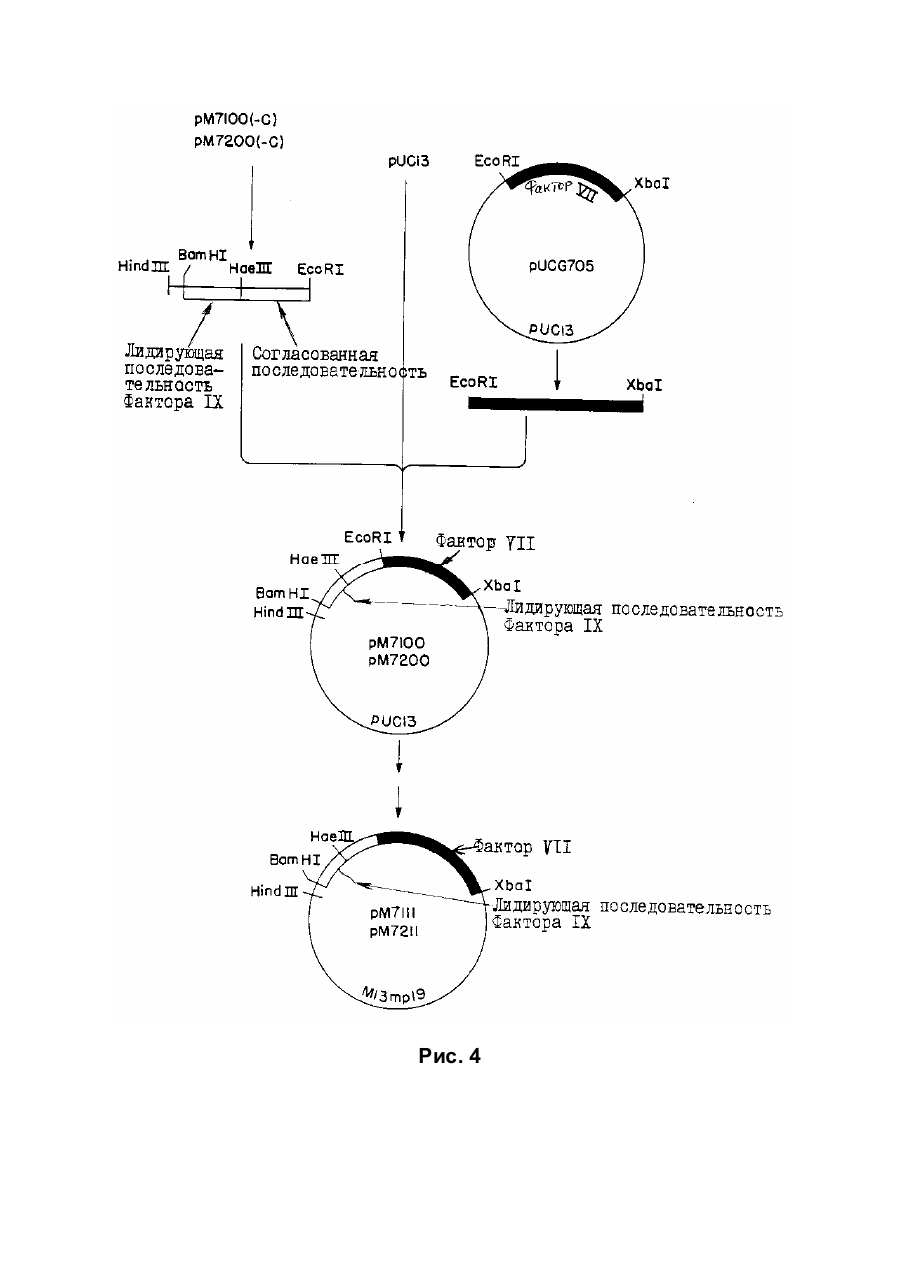
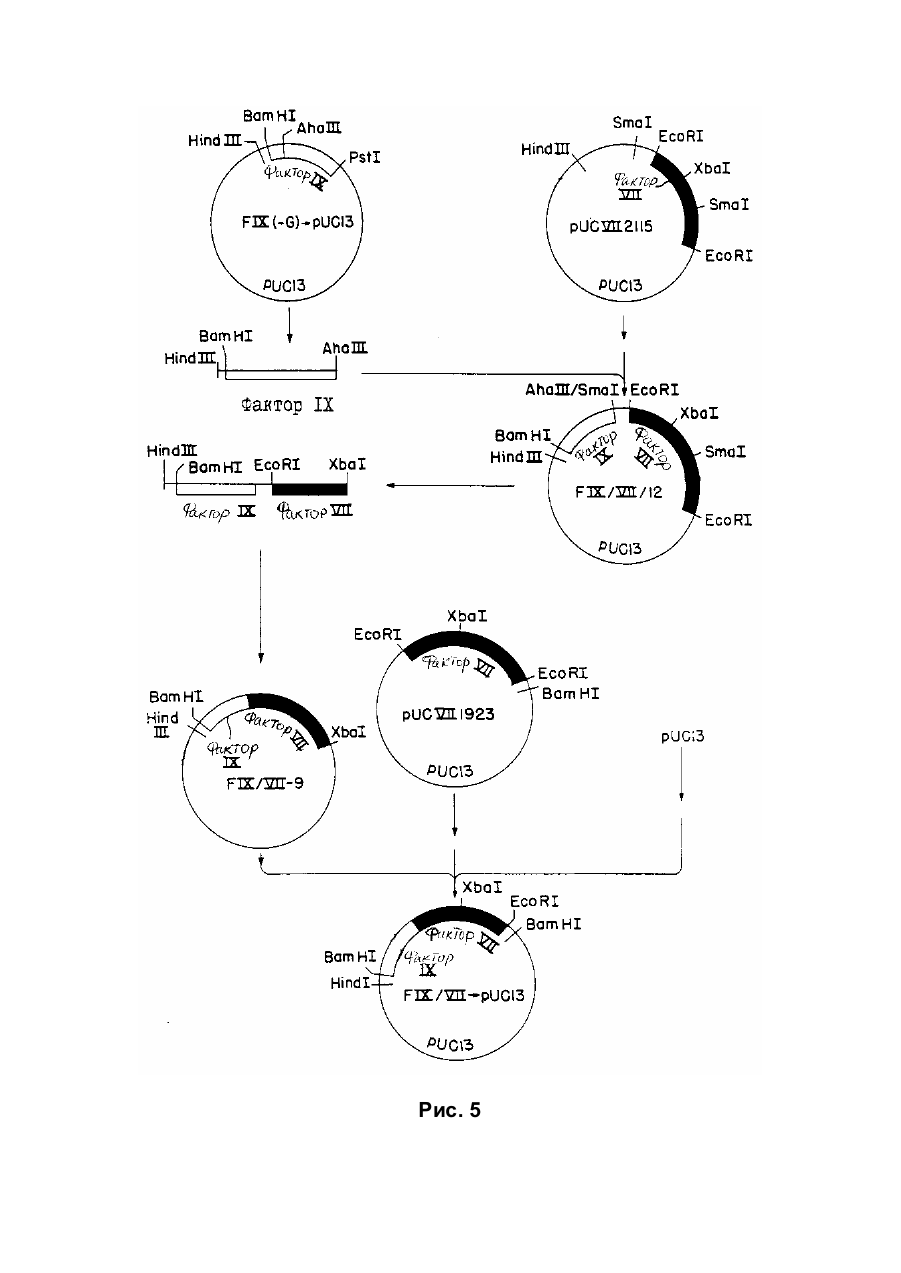
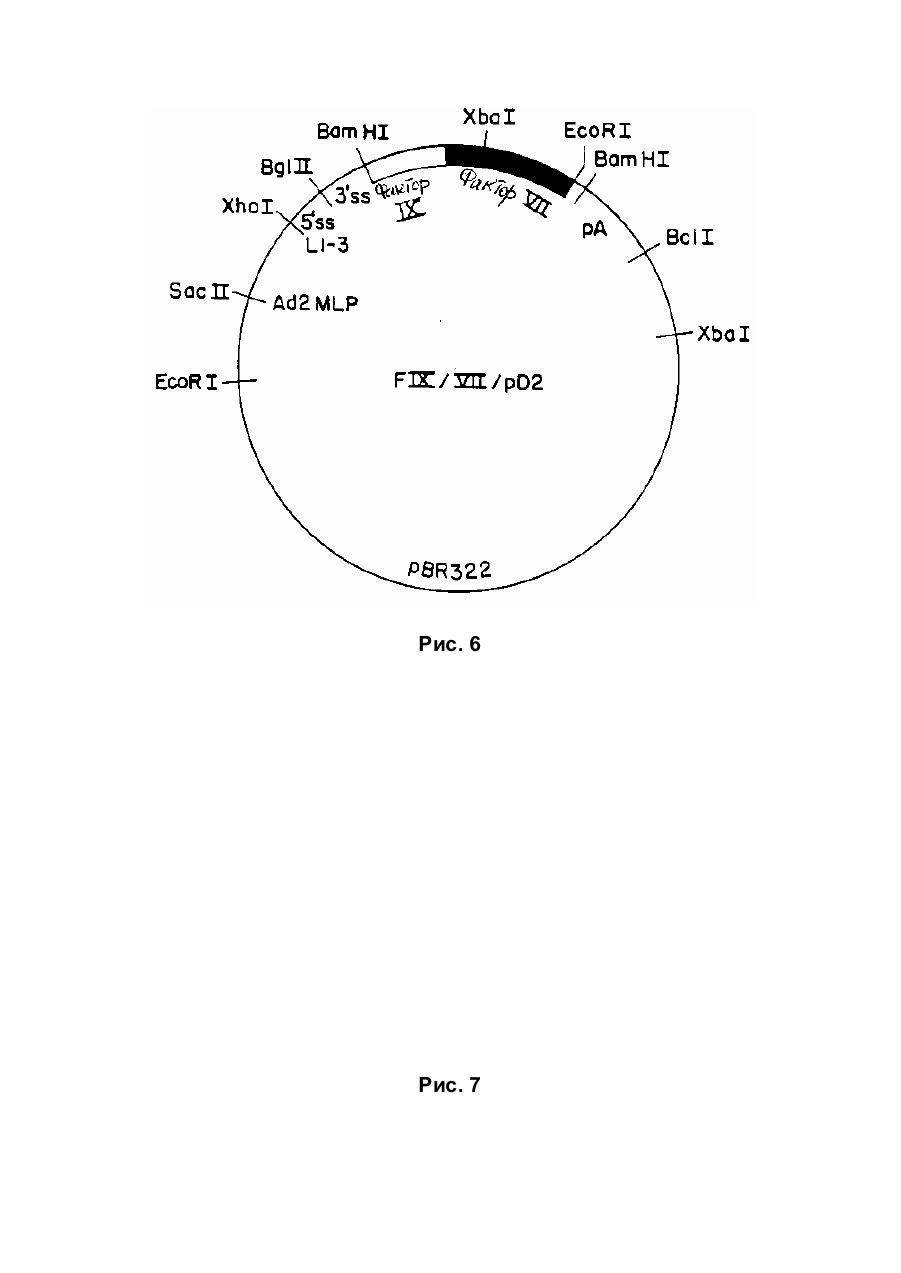
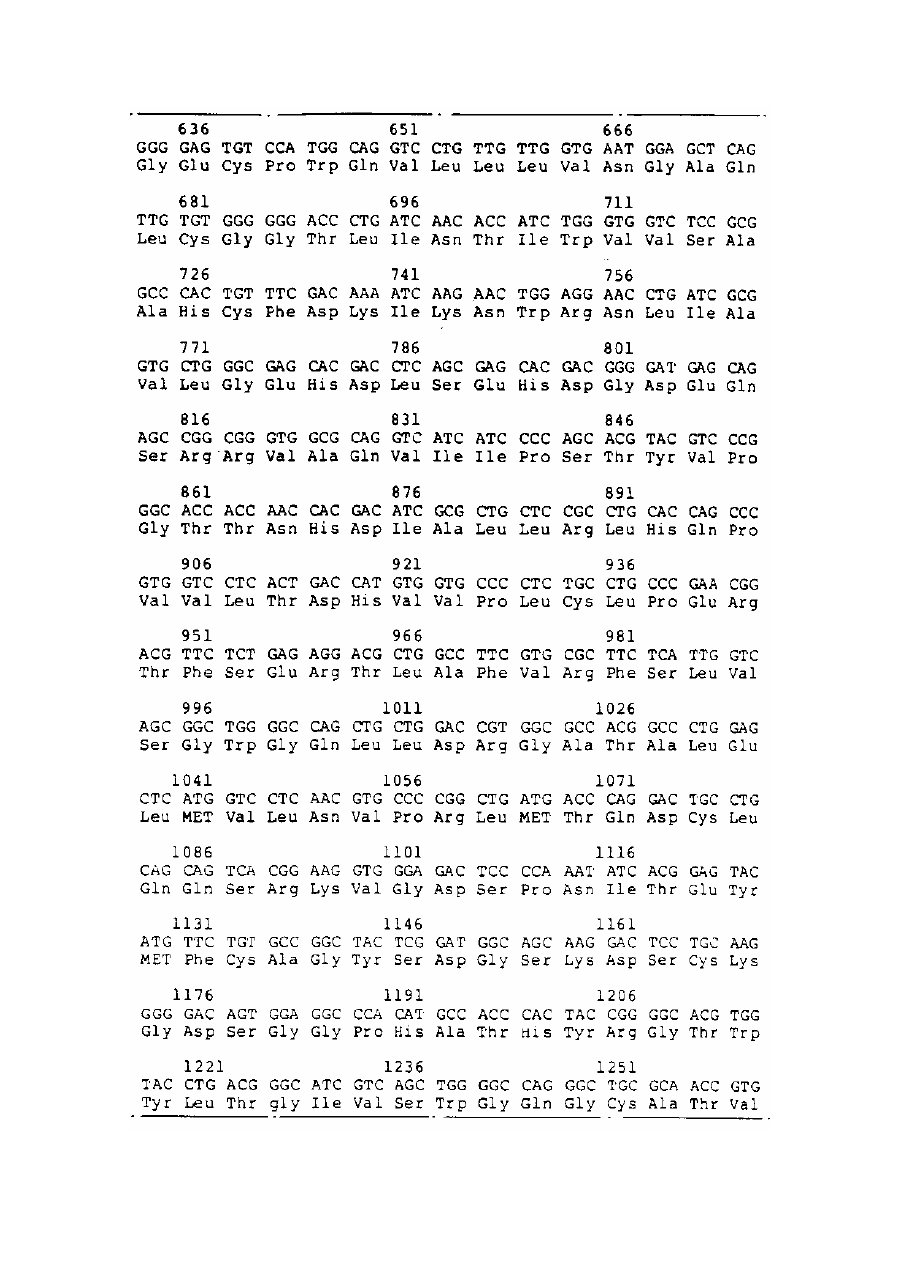
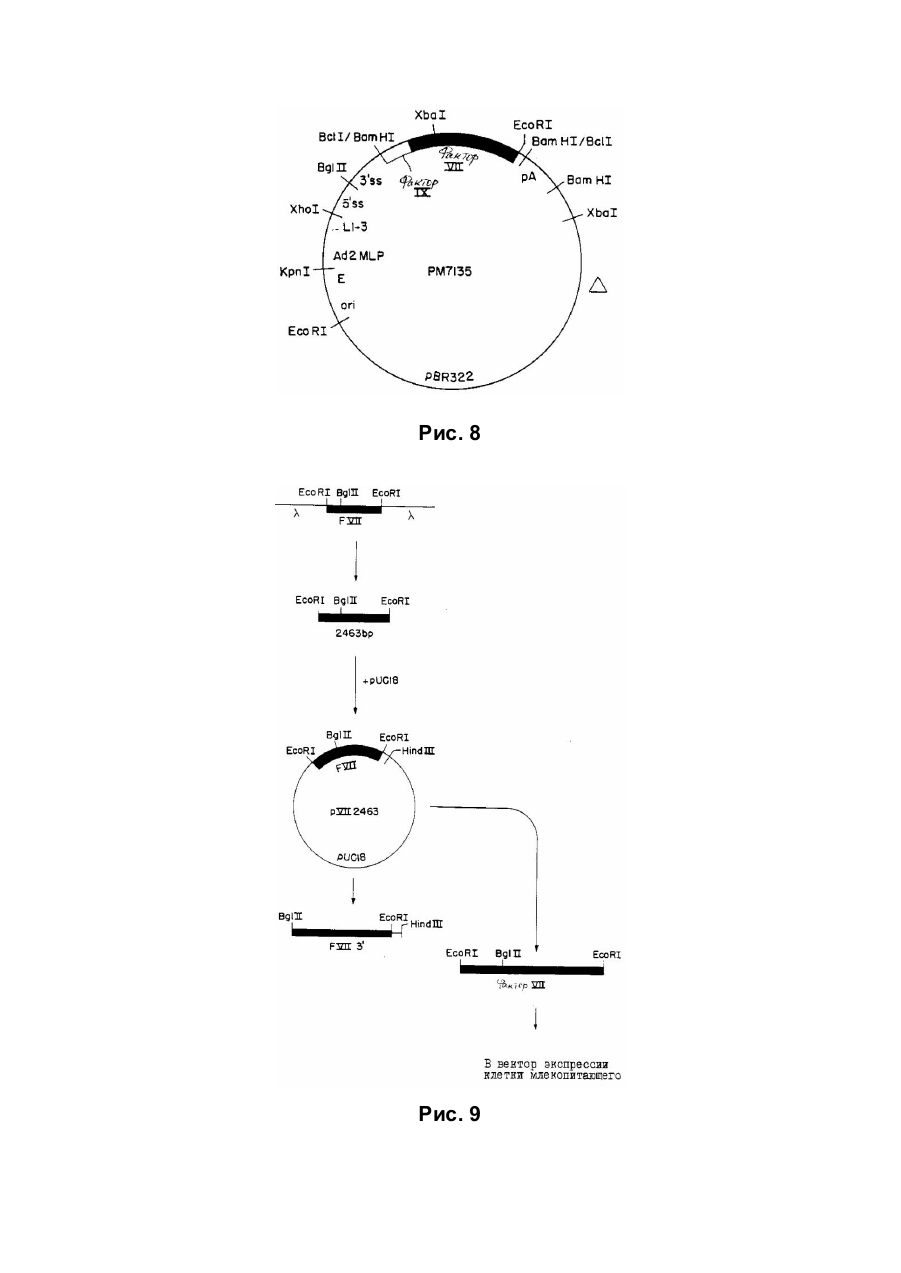
Спосіб отримання білка, який має опосередковану фактором vii активність у згортанні крові
Номер патенту: 27262
Опубліковано: 15.09.2000
Автори: Муррей Марк Дж., Хейджен Фредерік С., Вудбері Річард Г., Басбі Шарон Дж., Грей Чарлз Л., Беркнер Кетлін Л., Інслі Маргарет І.
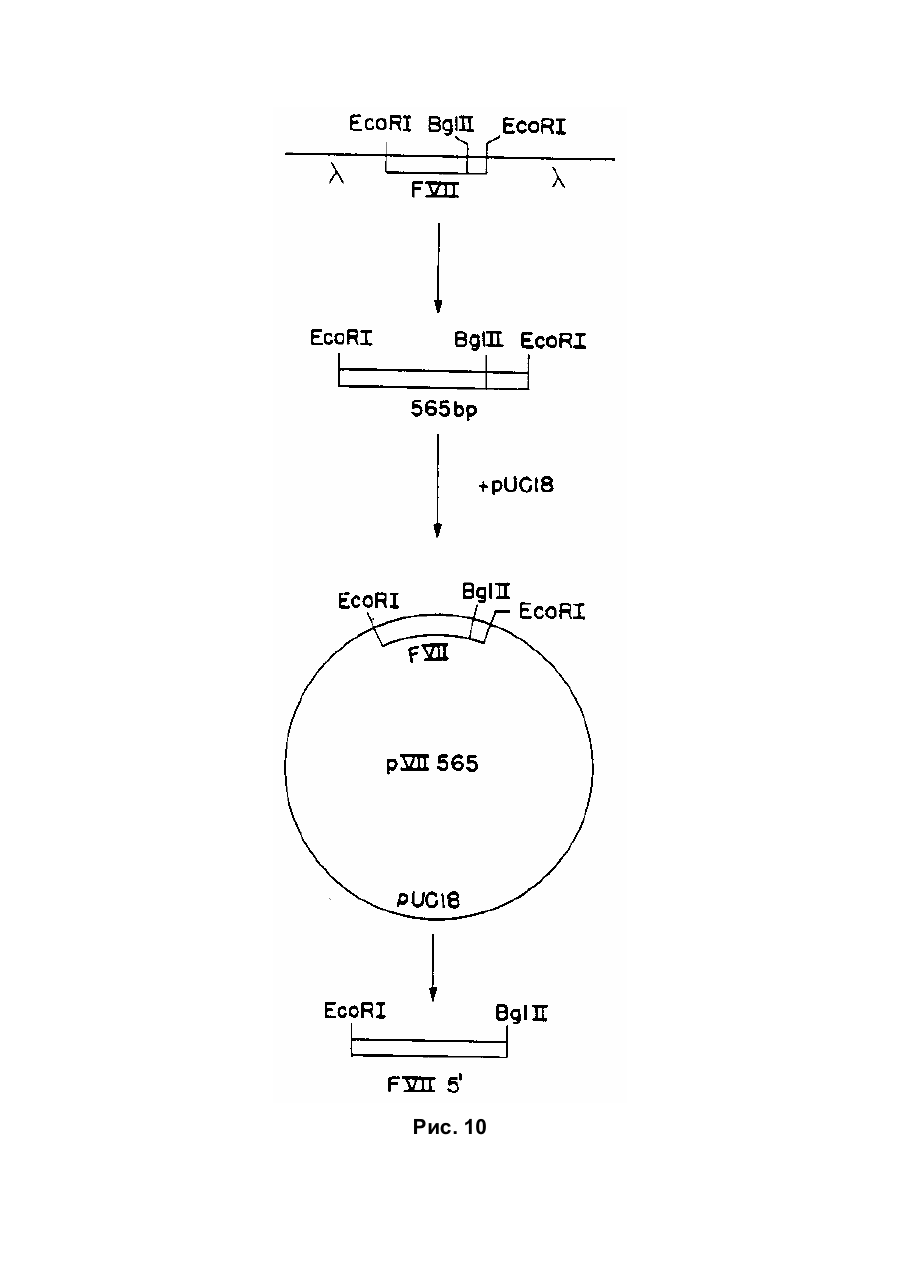
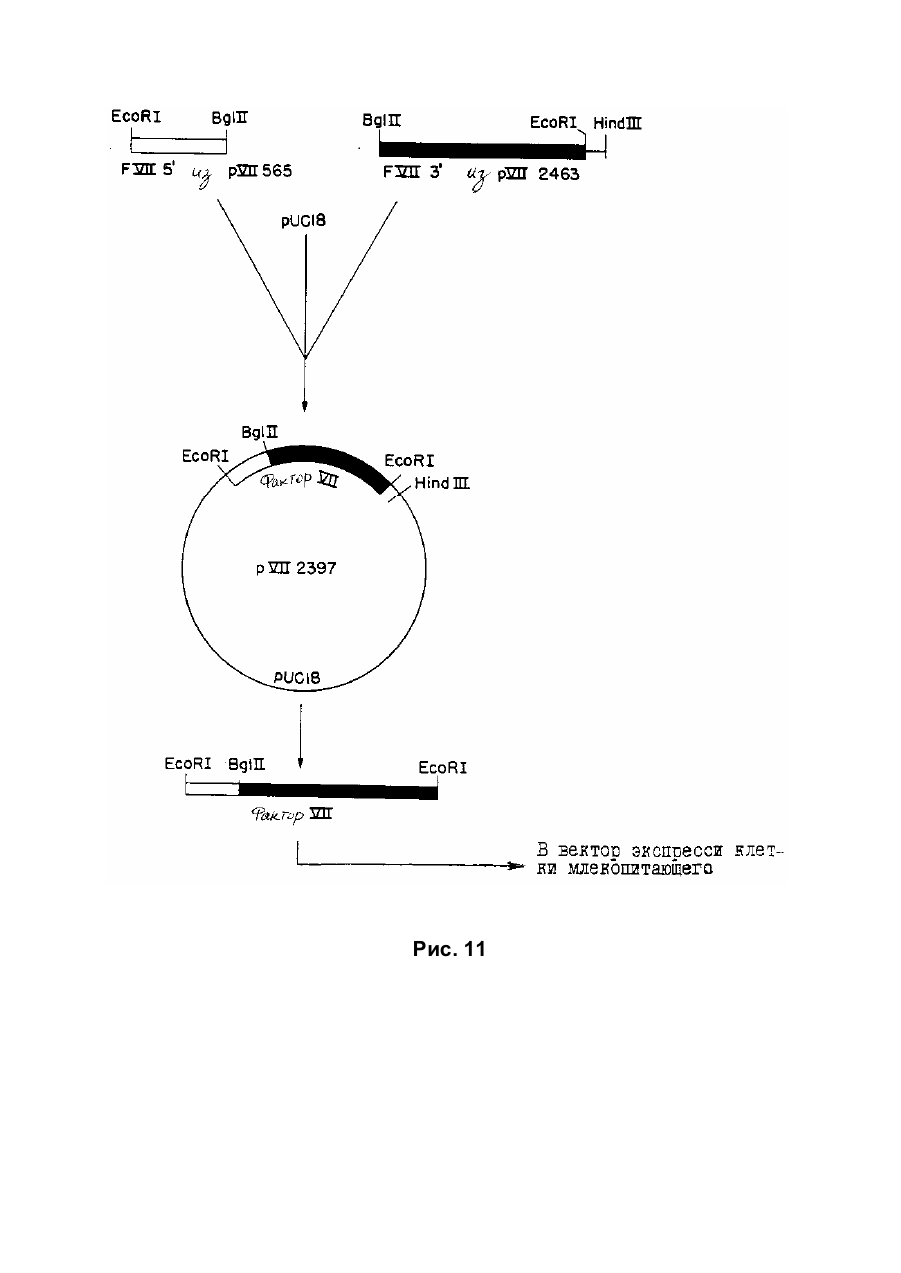
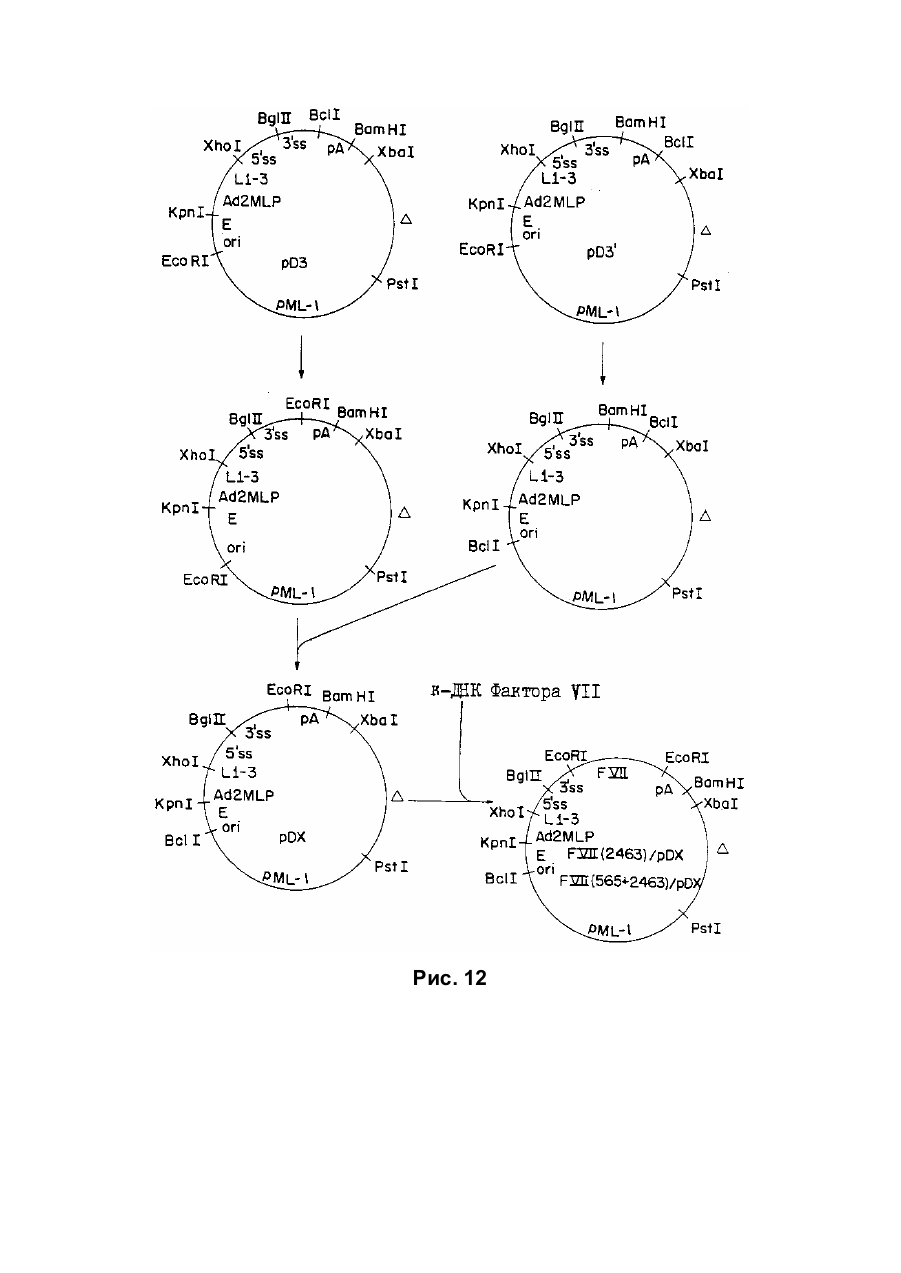
Текст
Данное изобретение в целом относится к факторам свертыва ния крови, а более конкретно к экспрессии белков, обладающи х биологической активностью по отношению к свертыванию крови. Сверты вание крови представляет собой процесс, состоящий из сложных взаимодействий различных компонентов крови или факторов, что в результате последовательных реакций приводит к образованию фибринового сгустка. Как прави ло, компоненты крови, принимающие участие в процессе, называемом "каскад" свертыва ния, представляют со бой проферменты или зимогены, кото рые представляют собой ферментативно неактивные белки, превращаемые в протеолитические ферменты действием акти ватора, который в свою оче редь является активированным фактором свертывания. Факторы сверты вания, подвергшиеся такому превращению, как правило, называют "акти вированными факторами" и обозначаются добавлением символа "а" (например, VIIa). Существуют две отдельные системы, инициирующие свертыва ние крови и впоследствии этого участвующие в нормальном гемостазе. Эти системы называют внутренней и внешней систе мами свертывания крови. Внутренняя система относится к тем реакциям, которые приводят к образованию тромба с участием тех факторов, кото рые присутствуют только в плазме крови. Промежуточной стадией внутренней системы свертывания является активирование Фактора IX в Фактор IXa, и эта реакция катализируется Фактором XIа и ионами кальция. Затем Фактор IXa принимает участие в активации Фактора Х в присутствии Фактора VIIIa, фосфо липида и ионов кальция. Внешняя система свертывания включает в се бя факто ры плазмы крови, а также компоненты, присутствующие в тканевых экстрактах. Один из указанных вы ше проферментов, Фактор VII, участвует во внешней системе свертывания крови, превращая (после его активи рования в VIIa) Фактор Х в Ха в присутствии тканевого фактора и ионов кальция. Фактор Ха, в свою оче редь, превращает затем протромбин в тромбин в присутствии Фактора Va, ионов кальция и фосфо липида. Так как акти вация Фактора Х в Фактор Ха представляет собой стадию, входящую как во внешнюю, так и во внутреннюю системы свертывания, то Фактор VIIа можно использовать для лечения пациентов, страдающи х дефи цитом ингибиторов Фактора VIII (Томас, патент США № 4382083). Есть также некоторые основания предполагать, что Фактор VIIa может принимать участие во внутренней систе ме свертывания, играя роль также в активации Фактора IХ (Зюр и Немерсон, I.Biol. Chem. 253: 2203–2209)- 1978). Экспериментальный анализ показывает, что человеческий Фактор VII представляет собой одноцепочечный гликопротеин с молекулярным весом около 50000 дальтон. В этой фор ме фактор, циркулирующий в крови, является неактивным зимогеном. Активация Факторa VII в VIIa может катализироваться несколькими различными протеазами плазмы, такими, как Факторa VIIа . Активация Фактор VII приводит к образованию двух полипептидных цепочек, а именно тяжелой цепочки (с молекулярной массой 28000) и цепочки меньшего размера (с молекулярной массой 17000), которые связаны друг с др угом по меньшей мере одной дисульфидной связью. Фактор VII может также активироваться в VIIa in vitro, например по мето дике, описанной Томасом в патенте США № 4456591. Фактор IX циркулирует в крови в форме одноцепочечного предшественника фермента и имеет молекулярный вес 57000, превращаясь в активную се риновую протеазу (Фактор IXa) под действием Фактора IVa в присутствии Фактора VIII. Фактор IXa состоит из маленькой и большой цепей молекулярного веса соответственно 16000 и 29000. Обычное лечение пациентов, страдающи х нарушениями свертыва ния (например, дефи цитом Фактора VIII и IX), как правило, включает в себя замещенную терапию с использованием криопреципита та или других фракций плазмы человека, обогащенных нуж ным фактором. Эти препараты могут быть получены из сборной человеческой плазмы, однако получение криопреципита тов требует использования относительно большого количества плазмы человека в качестве сырья. Фактор VII терапевти чески используется при лечении индивидуумов, страдающи х дефи цитом Фактора VII, а также групп людей, страдающих де фицитом Фактора VIII и IX и пациентов с болезнью Виллебранда. Если говорить подробнее, то пациенты, подвергающиеся терапевтическому лечению введением Факторов VIII и IX, часто вырабатывают анти тела на эти белки. Длительное лечение становится крайне сложным из-за присутствия этих антител. Пациентов, у которых наблюдается это осложнение, обычно лечат активированным протромбиновым комплексом, который, как известно, состоит из смеси активных и неактивных свертывающи х ферментов, включающи х Фактор VIIа. Кроме того, последние исследования указывают на то, что небольшие количества (40–50) мкг введенного Фактора VIIа эффективны при подавлении серьезных случайных кровотечений у пациентов, страдающи х де фицитом Фактора VIII и имеющи х в крови высокую концентрацию анти тел (Гендер и Кисиел, I. Clin. In vist, 71: 1836–1841, 1983). Так как при получении криопроципита тов используются различные источники плазмы, то трудно проводить испытания препаратов на отсутствие в ни х ви русных загрязнений. Например, практи чески у всех пациентов, принимающих криопреципитат, обнаруживается положительная реакция при испытании на гепатит. Последние сообще ния указывают на то, что некоторые страдающие ге мофилией пациенты, принимающие преципитат, имеют развивающийся приобретенный синдром иммунодефи цита (СПИД). Кроме того, очистка больши х количеств эти х факторов крайне сложна и дорога. Следовательно, в данной области существует потребность в разработке способа получения относительно больши х количеств очищенных препаратов Фактора VIIа и Фактора IX. Данное изобретение удовлетворяет эту потребность за счет использования технологии рекомбинантной ДНК, которая с успехом устраняет проблему вирусного загрязнения и одновременно предоставляет концентрированный и гомогенный источник активного Факто ра VIIа для ле чения пациентов, страдающих дефи цитом Фактора VIII и Фактора IX и болезнью Виллебренда, а также дает источник очищен ного Фактора IX для использования в замещающей те рапии. Говоря коротко, в данном изобретении описывается ДНК-конструкция, содержащая нуклеотидную последовательность, по крайней мере частично кодирующую Фактор VII. Нуклеотидная последовательность включает в себя первую нук леотидную последовательность, кодирующую до мен связывания кальция, соединенную со вто рой нуклеотидной последовательностью, расположенную за первой последовательностью. Вторая нуклеотидная последовательность кодирует каталити ческий участок, обеспечивающий активность Фактора VII как сериновой протеазы. Соединенные последовательности кодируют белок, который после активации обладает практически такой же биологической активностью по отношению к свертыванию крови, как Фактор VIIа. Первая нуклеотидная последовательность может быть практически такой же, как ген, кодирующий Фактор VII, Фактор IX, Фактор Х, протеин С, протромбин или протеин S. Кроме того, первая нуклеотидная последовательность может также кодировать главный пептид, кодируе мый соответствующим ге ном. В частности, первая нуклеотидная последовательность может быть получена из геномного клона или клона к-ДНК или Фактора VII, и может кодировать главный пептид и аминоконцевую последовательность Фактора VII. Первая нуклеотидная последовательность может также включать в себя двунитевый олигонуклеотид. Особенно предпочтительна такая первая нуклеотидная последовательность, которая кодирует лидерный белок и аминоконцевую последовательность Фактора IX. Кроме того, в данном изобрете нии описываются рекомбинантные плазмиды, способные интегрироваться в ДНК клетки-хозяина млекопитающего. Одна из плазмид включает в се бя промотор, расположенный после набора расщепляющи х РНК центров, и за центрами расщеп ления РНК расположена нуклеотидная последовательность, по крайней мере частично кодирующая Фактор VII. Нуклеотидная последовательность включает в себя первую н уклеотидную последовательность, кодирующую домен связывания кальция, соединенную со второй нуклеотидной последовательностью, расположенной за первой последовательностью. Вторая нуклеотидная последовательность кодирует участок, отвечающий за активность Фактора VIIа как сериновой протеазы. Соединенные последовательности кодируют белок, который после активации обладает практически такой же биологической активностью по отношению к свертыванию крови, как Фактор VIIа. После нуклеотидной последова тельности расположен сигнал полиадениляции. Аналогично указанной выше рекомбинантной плазмиде в данном изобретении описывается также вто рая плазмида, включающая в себя промотор, за которым следует набор сайтов расщепления РНК, а за сайта ми расщепления РНК идет нуклеотидная последовательность, кодирующая, по крайней мере, частично, Фактор IX. Н уклеотидная последовательность, кодирующая домен связывания кальция, соединенную со вто рой нуклеотидной последовательностью, расположенной за первой последовательностью. Вторая нуклеотидная последовательность кодирует участок, ответственный за активность Факто ра IX как сериновой протеазы. Соединенные последовательности кодируют бе лок, обладающий практически такой же биологической активностью по отношению к свертыванию крови, как Фактор IX. За нуклеотидной последовательностью следует сигнал полиадениляции. Третий аспект данного изобретения касается клеток млекопитающи х, стабильно трансформированных та ким образом, что они вырабатывают бе лок, обладающий после акти вации практически такой же биологической активностью, как Фактор VIIa. Клетки трансформируют с помощью ДНК-конструкции, содержащей нуклеотидную последовательность, по крайней мере частично кодирующую Фактор VII. Нуклеотидная последовательность включает в себя первую н уклеотидную последовательность, кодирующую до мен связывания кальция и соединенную со вто рой нуклеотидной последовательностью, расположенной после первой последовательности. Вто рая нуклеотидная последовательность кодирует участок, ответственный за активность Фактора VIIa как сериновой протеазы. Соединенные последовательности кодируют белок, который, после акти вации, проявляет практически такую же биологическую активность по отношению к свертыванию крови, как Фактор VIIa. В данном изобрете нии описываются также клетки млекопитающих, ста бильно трансформированные таким образом, чтобы вырабатывать белок, имеющий практически такую же биологическую активность, как Фактор IX. Клетки трансформируют с помощью ДНК-конструкции, содержащей н уклеотидную последовательность, по крайней мере частично кодирующую Фактор IX. Нуклеотидная последовательность включает в се бя первую н уклеотидную последовательность, кодирующую участок связывания кальция и соединена со второй нуклеотидной последовательностью, расположенной за первой. Вторая нуклеотидная последовательность кодирует участок, ответственный за каталити ческую активность Фактора IX как сериновой протеазы. Соединенные последовательности кодируют белок, имеющий практически такую же биологическую активность по отношению к свертыванию крови, как Фактор IX. В данном изобретении предлагается также способ получения белка, обладающего кровосвертывающей активностью Фактора VIIa, путем создания клетки-хозяина млекопитающего, содержащей ДНК-конструкцию, содержащую в свою очередь нуклеотидную последовательность, по крайней мере частично кодирующую Фактор VII. Н уклеотидная последовательность включает в се бя первую н уклеотидную последовательность, кодирующую до мен связывания кальция и соединенную с расположенной за ней второй последовательностью. Вторая последовательность кодирует участок, ответственный за каталитическую активность Фактора VIIa как сериновой протеазы. Соединенные последовательности кодируют белок, который, после активации, обладает практически такой же биологической кровосверты вающей активностью, как Фактор VIIa. Последовательные операции состоят в том, что клетку-хо зяина млекопитающе го выращивают в подхо дящей среде и выделяют белковый продукт, кодируемый ДНК-конструкцией и вырабаты ваемый клеткой-хозяином млекопитающего. Белковый продукт за тем активи руют с по лучением Фактора VIIa. Еще одним аспектом данного изобретения является способ получения белка, обладающего биологической кровосвертывающей активностью Фактора IX. Способ включает в себя создание клетки-хозяина млекопитающе го, содержащей ДНК-конструкцию, включающую в се бя нуклеотидную последовательность, кодирующую, по крайней мере, частично, Фактор IX. Н уклеотидная последовательность состоит из первой нуклеотидной последовательности, кодирующей участок связывания кальция, соединенной со второй нуклеотидной последовательностью, расположенной за первой. Вторая нуклеотидная последовательность кодирует участок, обеспечивающий каталитическую активность Фактора IX как сериновой протеазы. Соединенные последова тельности кодируют бе лок, обладающий практически такой же биологи ческой кровосвертывающей активностью, как Фактор IX. Клетку-хо зяина млекопитающе го сначала выращи вают в подходящей среде и затем выделяют белковый продукт, закодированный в клетке-хозяине. Описываются также белковые продук ты, получаемые описанными выше способами. В данном изобретении описывается также ДНК-конструкция, содержащая последовательность ДНК, кодирующую Фактор VII. В предпочтительном варианте последовательность ДНК включает в себя последовательность к ДНК по рисун ку Ib, о т п. о. (пары оснований) 36 до п. о. 1433. В другом предпочтительном варианте последовательность ДНК содержит последовательность к-ДНК по рисунку ib от п. о. 36 до п. о. 99, расположенную перед последова тельностью, соответствующей участку от п. о. 166 до п. о. 1433. Описываются также рекомбинантные плазмиды, способные интегрироваться в ДНК клетки-хозяина млекопитающе го, включающие в се бя только что описанные последовательности ДНК. Описаны также клетки млекопитающи х, ста бильно трансформированные с помощью рекомбинантной плазмиды, содержащей последовательность ДНК, кодирующую Фактор VII. В предпочтительных вариантах последовательность ДНК содержит последовательность к ДНК по рисун ку Ib от п. о. 36 до п. о. 1433, или последовательность к ДНК по рисун ку Ib от п. о. 36 до п. о. 99, расположенную перед последовательностью от п. о. 166 до п. о. 1433. Описан также способ получения белка, обладающего биологической кровосвертывающей активностью Фактора VIIa путем стабилизации клетки-хозяина млекопитающе го, содержащей ДНК-конструкцию, описанную выше. Клетку-хо зяина млекопитающего выращивают в подхо дящей среде и выделяют белковый продукт, кодируемый ДНК-конструкцией. Белковый продукт активируют для получения Фактора VIIa. Другие аспекты данного изобретения поясняются с помощью представленного ниже подробного описания и прилагаемых рисунков. Рисунок Ia иллюстрирует частичную последовательность к-ДНК Фактора VII, получаемую соединением к-ДНК клонов lVII2115 и lVIII923. Рисунок Ib иллюстрирует к ДНК последова тельность Факто ра VII lVII2463. Стрелки обозначают размер делеции в последовательности lVII565. Цифры над последовательностью обозначают аминокислоты. Числа, расположенные ниже, обозначают нуклеотиды. На рисун ке 2а иллюстрируются аминоконцевые участки нескольких факторов свертывания. На рисун ке 2b представлено сравнение аминокислотной последовательности Фактора VII, полученной путем деструктивного анализа белка, с последовательностью, кодируе мой к ДНК. На рисун ке 3 представлено соединение основных последовательностей Факто ра IX в последовательность, кодирующую до мен связывания кальция. На рисун ке 4 показано соединение гибридных подобных Фактору IX последова тельностей в частичную к ДНК Фактора VII с получением структурной кодирующей последовательности. На рисунке 5 показано конструирование плазмиды, содержащей последовательность, кодирующую слитый белок Фактора IX/Фактор VII. На рисунке 6 представлен экспрессивный вектор F IX/VII/pD2. Использованы следующие обозначения: Ad 2 MLP – основной промотор из аденовируса 2; L1–3 – состоящая из трех частей лидерная последовательность аденовируса 2; 5'SS – сайт 5' расщепления; 3'SS – сайт 3' расщепления; рА – сигнал полиадениляции из SV 40. На рисун ке 7 показана нуклеотидная последовательность слитой к-ДНК Фактор IX/Фактор VII. На рисунке 8 показан экспрессивный вектор рМ7135. Использованы следующие обозначения: Е – уси литель SV40; Ori-единицы структуры О–1 Ао5; рА – си гнал ранней полиадениляции из SV40; D – участок делеции "отравляющей" последовательности рВR322; другие обозначения такие же, как в рисун ке 6. На рисун ке 9 показано субклонирование 2463 п. о. к ДНК Фактора VII. На рисун ке 10 показано субклонирование 565 п. о. к ДНК Фактора VII. На рисунке 11 показано соединение 5'-окончания pVII565 и 3'-участка pVII2263 в pU18 с образованием pVII2397. На рисунке 12 иллюстрируется конструирование экспрессионных плазмид F VII (2463)/pDX и FVII (565+2463)/pDX p A обозначает сигнал полиадениляции из SV40 в ранней или поздней ориентации, как описано в Примере 9. Другие обозначения такие, как описано в рисун ке 8. Лучший ва риант осуществления изобретения Перед рассмотрением данного изобретения может быть полезно ознакомиться с обозначениями некоторых тер минов, используемыми ниже. Комплементарная ДНК или к ДНК: молекула или последовательность ДНК, ферментативно синте зированная из последовательностей, присутствующих в матрице м РНК. ДНК-Конструкция: молекула ДНК или клон таких молекул, как однонитевых,так и двунитевых, которые в частичной форме могут быть вы делены из природного гена или модифи цированные и содержащие сегменты ДНК, скомбинированные и соединенные таким способом, который отсутствуе т в природе. Плазмида или вектор: ДНК-конструкция, содержащая ге нетическую инфор мацию, которая вызывает репликацию при введении в клетку-хо зяина. Плазмида, как правило, содержит по крайней мере одну генную последовательность, экспрессия которой происхо дит в клетке-хозяине, а также последова тельности, облегчающие экспрессию такого гена, включая промоторы и инициирующие транскрипцию сайты. Они могут быть ли нейными или замкнутыми в кольцо молекулами. Соединенный: имеются в виду последовательности ДНК, соединяемые при присоединении 5'- и 3'окончаний одной последовательности соответственно к 3'- и 5'-окончаниям присоединяемой последовательности через фосфоди-эфирные связи. Соединение может достигаться такими способами, как связывание липких концов, синтезом соединенных последовательностей клонированием к ДНК или удалением или введением последовательностей способом прямого мутагенеза. Лидерный пептид: аминокислотная последовательность, имеющаяся на N-окончаниях некото рых белков и, как правило, отщепляемая от белка в ходе последующей переработки и секретирования. Лидерные пепти ды включают в себя последовательности, направляющие белок в клетке на секрети рование. Используе мое здесь выражение "Лидерный пептид" может также обозначать часть природного лидерного пептида. Домен: трехмерная, самоорганизующаяся структура из особых аминокислот в белковой молекуле, содержащая все или часть структур ных элементов, необхо димых для обеспечения определенной биологической активности белка. Биологическая активность: функция или набор функций, осуществляемых молекулой в биологическом процессе (например, в организме или in vitro). Биологические активности белков могут подразделяться на каталити ческую и эффекторную активности. Ката лити ческие активности факторов свертывания, как правило, включают в себя активацию других факто ров путем специфического расщепления предшественников. Эффекторные активности включают в се бя специфи ческое связыва ние биологически активных молекул кальцием или другими малыми молекулами, макромолекулами, такими как белки или клетками. Эффекторная активность часто необходима или существенна для каталитической активности в биологической среде. Каталитическая и эффекторная активности могут в некоторых случаях обеспечиваться одним и тем же доменом белка. Биологическая активность Фактора VIIа ха рактеризуется участием во внешней системе свертывания крови. Фактор VIIа акти вирует Фактор Х с образованием Фактора Ха, который в свою очередь превращает протромбин в тромбин, инициируя образование фибринового сгустка. Так как активация Фактора Х обычно происходит как во внешней, так и во внутренней системе свертывания крови, то Фактор VIIа может быть использован для лечения пациентов с сильной недостаточностью активных факторов IX и VII или больных болезнью Виллебранда. Биологическая активность Фактора IX ха ракте ризуется участием в свертывании крови во внутренней системе свертывания. Фактор IX акти вируется в Фактор IXa Фактором XIa. Затем Фактор IXa активирует Фактор Х в Фактор Ха в присутствии Фактора VIIIa, фосфо липида и ионов кальция. Затем Фактор Ха участвуе т в превраще нии протромбина в тромбин, инициируя образование фибринового сгустка. Как отмечалось выше, выделение Фактора VII из человеческой плазмы занимает много времени и дорого стоит, так как фактор является редким белком, присутствующим в концентрации лишь около 300 мкг на литр крови. Кроме того, его тя жело отделять от протромбина, Фактора IX и Фактора Х и он чувствите лен к протеолитическому действию в хо де очистки (Кисиел и Мак-Маллен). Хо тя одноцепочечный человеческий Фактор VII и был очищен до го могенного состояния (Кисиел и Мак–Маллен), однако опубликованные способы очистки ограничены, как правило, низким выхо дом и/или загрязнением другими факторами свертывания. Факторы VII и IX вы рабатываются в печени и требуют ви тамина К для своего биосинтеза. Витамин К необхо дим для образования особых остатков гамма-карбоксиглутаминовой кислоты в факторах. Эти необычные аминокислотные остатки, образующиеся пост-трансляционной модифи кацией, связываются с ионами кальция и ответственны за взаимодействие белка с фосфолипидными носителями. Кроме того, каждый из факто ров VII и IX содержит один остаток бета-оксиаспарагиновой кислоты, который также образуется после трансляции белков. Однако роль этой аминокислотной последовательности неизвестна. Учитывая тот факт, что активности Факторов VII и IX зависят от пост-трансляционных модификаций, включающих в себя гамма-карбоксилирование особых остатков глутаминовой кислоты и могут также зависеть от гидроксилирования особого остатка аспарагиновой кислоты, малове роятно, что активный продукт может быть получен клонированием и экспрессией Факторов VII и IX в микроорганизме. В данном изобретении, соответственно, предлагается способ получения белка, имеюще го кровосвертывающую биологическую активность Фактора VIIa, с использованием стабильно трансформированных клеток млекопитающи х. Кроме того, в данном изобретении предлагается также способ получения белка обладающего биологи ческой активностью по отноше нию к свертыванию крови, аналогичной активности Фактора IX. Как отмечалось выше, Факторы VII и IX тре буют для своего биосинтеза витамина К. Кро ме того, такие плазменные белки, как протромбин, Фактор Х, Протеин С и Протеин S также требуют для своего биосинте за витамин К. Аминоконцевые участки этих белков, содержащие остатки гамма-карбоксиглута миновой кислоты, аналогичны как по аминокислотной последовательности, так и по биологической функции (рисунок 2а). Кроме того, карбоксиконцевые участки Фактора VII, протромбина, Фактора IX, Фактора Х и Протеина С определяют их специфическое действие как сериновых протеаз. Фактор VII является белком, присутствующим в плазме в следовых количествах и счи тается, что редкой является м-РНК, кодирующая Фактор VII. Следовательно, очистка Фактора VII из плазмы в количествах, доста точных для проведения подробного анализа последовательности и определения свойства остается трудной. Разложение Факто ра VII в хо де очистки, даже в присутствии ингибиторов протеаз, было отмечено Кисиелом и Мак–Малленом (см.). В силу эти х тр удностей Фактор VII был плохо охарактеризован по сравнению с другими компонентами свертывающей систе мы крови, присутствующи ми в больших количествах. Действительно, в работе Кисиела и Мак–Маллена (см.) была получена инфор мация о последовательности только для 10 остатков каждой цепи Фактора VII и в каждой последовательности идентифи кация двух остатков является предварительной. Данные по частичной аминокислотной последовательности бычьего Факто ра VII также были опубликованы (Дискипио и др., см.). Предполагаемая редкость м РНК Факто ра VII является одной из причин плохого знания гена Фактора VII. Успех обычной техники клонирования к ДНК зависит от наличия достаточного количества м РНК, используе мой в качестве матрицы. Преждевременная терминация обратной транскрипции приводит к получению клонов к ДНК, лишенных 5'-окончания, и этому способствует низкая концентрация м РНК. Были разработаны несколько общи х подходов для клонирования к ДНК веществ, имеющи хся в низкой концентрации (Manialis и др. Molecular Goning: A Laboratory Manual, Cold Speing Harbor Laboratory (1982), но недостаток знания аминокислотной последовательности интересующего продукта делает невозможным предсказание ДНК-последовательности и разработку подхо дящи х олигонуклеотидных проб. Хотя можно относительно прямым способом получать частичный клон к ДНК гена, кодирующего редкий белок, с помощью этих разработанных подходов, однако клоны к ДНК полной длины гена, кодирующего редкие белки, такие как Фактор VII, по лучать по-прежнему исключительно трудно. По сравнению с Факто ром VII Фактор IX является относительно нередким белком и известна последовательность клона к-ДНК гена человеческого Фактора IX (Kuraehi, Davie Proc. Natl Acad Sci USA, 79: 6461–6464, 1982; и Anson и др., ЕМВО ,3: 1053–1060, 1984). Была охарактеризована структура гена Фактора IX и была определена аминокислотная последова тельность белка на основании известной нуклеотидной последовательности. Были опубликованы также некото рые данные по белковой последовательности для человеческого и бычьего Факторов IX и анализируемые последовательности (Дискипио и др., см.). Аминоконцевой участок белка содержит 12 остатков глута миновой кислоты, которые превращаются в зрелом белке в остатки гамма-карбоксиглутаминовой кислоты (GIa). Были также определены сайты расщепления, участвующие в активации Фактора IX (Kurachi и Davie, cм.). Ранее описыва лась экспрессия гена Фактора IX мето дами рекомбинантной ДНК. Так как трудно получить клон к ДНК полной длины гена Факто ра VII, то были разработаны три новых подхо да для получения 5'-окончания кодирующей последова тельности, включая участок, кодирующий лидерный пептид. По первому способу частичный клон к-ДНК Фактора VII соединяют с фрагментом, кодирующим лидерный пептид и 5'-окончание Фактора IX. Этот подход основан на том наблюдении, что аминоконцевые участки двух молекул ответственны за связывание кальция соответствующи ми белками, и на открытии того, что относящаяся к связыванию кальция активность Фактора IX аналогична активности Фактора VII. Ре зультирующий полипептид сохраняет биологическую активность нативного Фактора VII, так как за специфическую активность факто ров свертывания как сериновых протеаз отвечают карбоксиконцевые участки молекул. Второй подход сочетает клон частичной к ДНК с последовательностью ДНК, кодирующей лидерную и аминоконцевую последовательности Фактора VII. Частичная последовательность к ДНК и аминокислотная последовательность Фактора VII, описанные здесь, способны выбирать из библиотеки геномной ДНК или библиотеки к ДНК клоны, включающие 5'-окончание гена Фактора VII. В третьем способе соединяют клон частичной к ДНК с гибридными кодирующими последовательностями, содержащи ми фрагмент к ДНК, кодирующий лидерный пептид Фактора IX и сегмент синте тического гена, кодирующий согласованный домен связывания кальция или предсказанную аминоконцевую последовательность Фактора VII. Последовательность, кодирующая аминоокончание Фактора VII, была установлена с помощью описываемых здесь ранее не опубликованных данных по аминокислотной последовательности. Согласованную последовательность определили из данных по Фактору VII, и из данных, опубликованных по последовательности других плазменных белков, зависящи х от ви тамина К. В соответствии с описанным выше способом отбора клонов, содержащих 5'-окончание гена Фактора VII, авторы данного изобретения успешно получили полномерную, правильную к ДНК, пригодную для экспрессии. Среди полученных клонов к ДНК клон, обозначенный "lVII2463", содержит наибольшую вставку к ДНК Фактора VII. Бы ло установлено, что она содержит полную кодирующую последовательность фактора VII. Этот клон содержит 35 нуклеоти дов нетранслированного участка 5', 180 нуклеоти дов, кодирующи х лидерный участок из 60 аминокислот, 1218 нуклеотидов, кодирующи х 406 аминокислот зрелого белка, стопкодон, 1026 нуклеотидов нетранслируемой 3'-последовательности и 20 оснований конца poly (A)/начиная с позиции 2463/. Две нити этой к ДНК не подвергались полному анализу последовательности. Сравнение ее с двумя вставками к ДНК, выделенными ранее из клонов lVII2115 и lVIII1923, свидетельствует, что lVII2463 содержит, в индивидуальном фрагменте Есо R1, к ДНК Фактора VII, кодирующую ли дерную последовательность Фактора VII и последовательности зрелого белка. Был выделен второй клон, lVII565, содержащий вставку к ДНК, идентичную к ДНК клона lVII2463 от нуклеотида 9 до нуклеотида 638, за исключением того, что отсутствуют н уклеоти ды от 100 до 165 (рисунок 1b). При сравнении с ДНК с геномной ДНК Фактора VII установлено, что отсутствующая последовательность точно соответствует одному экзоноподобному участку. Следовательно, получены две к ДНК Фактора VII, о тражающие различные стадии сплайсинга м РНК. Лидерная последовательность, кодируе мая lVII2463, является исключительно длинной (60 аминокислот) и имеет гидрофобный характер, отличающий ся от Фактора IX, Протеина С и протромбина. Эта лидерная последовательность содержит два метиониновых остатка, в положениях -60 и -26. Инициирование наиболее вероятно начинается на первом met, так как гидрофобный участок, типичный для сигнальных пептидов, следуе т за met в положении -60, а не met в положении -26. Инте ресно, что отсутствующая после довательность в lVII565, точно соответствующая экзоноподобному участку в геномном клоне, приводит к аминокислотной лидерной последовательности из 38 аминокислот, гидрофобные характеристики которой более сходны с фактором IX, Протеином С и протромбином. Так как неясно, насколько описанные выше лидерные последовательности соответствуют нативным, то были приложены уси лия для анализа 5'-концевой последовательности. Вкратце этот способ включал в себя конструи рование и отбор библиотеки человеческой геномной ДНК и идентифи цирование геномных клонов, содержащи х последовательности гена Факто ра VII. Участок 5'-геномной последовательности присоединяли затем к к-ДНК для конструирования полномерного клона. При дополнительном конструи ровании 5'-фрагмент к-ДНК Фактора VII lVII565, содержащий участок, полностью кодирующий лидерный участок, и последовательность, кодирующую 29 аминокислот зрелого белка, связывали с фрагментом к-ДНК lVII2463 (содержащим остальную часть зрелого белка и нетранслируемые 3'-последовательности). Эта "565–2463" – последовательность кодирует полный Фактор VII, к-ДНКпоследовательность является индивидуальным Есо R1-фрагментом. Описанные выше последовательности ДНК встраивали затем в подходящий вектор экспрессии, который в свою очередь использовали для трансформирования клетки млекопитающего. Вектор экспрессии, используемый для осуществления данного изобрете ния, включает в се бя промотор, способный направлять транскрипцию чужеродного гена в трансформированной клетке млекопитающего. Предпочтительны вирусные промоторы из-за их эффективности при прямой транскрипции. Таким особенно предпочтительным промотором является основной поздний промотор аденовируса 2. Та кой вектор экспрессии будет также содержать набор сайтов сплайсинга РНК, расположенный за промото ром и выше сайта вставки гена, кодирующего белок, имеющий биологическую кровосвертывающую активность. Предпочтительные последовательности сайта сплайсинга РНК могут быть получены из аденовируса и/или из генов иммуноглобулина. В векторах экспрессии содержится также сигнал полиадениляции, расположенный за сайтом вставки. Предпочти тельны вирусные сигналы полиадениляции, такие как сигналы ранней или поздней полиадениляции из SV40 или сигнал полиадениляции из участка аденовируса 5:EIo. В особенно предпочтительном варианте вектор экспрессии содержит также вирусную лидерную последова тельность, такую как состоящий из трех частей лидер аденовируса 2, расположенную между промотором и сайтами сплайсинга РНК. Предпочти тельные векторы могут также содержать усиливающие последовательности, такие как усилитель SV40. Последовательности клонируе мой ДНК можно также вводить в культивируемые клетки млекопитающи х с помощью трансформации, вызываемой фосфа том кальция. (Wigler и др., Cell, 14; 725; 1978; Corsaro и Pearson, Somotie Cell Gemtus, 7:703, 1981; Craham и Van der Eb. Virology 52:456, 1973). Получают осадок, образованный ДНК и фосфатом кальция, и этот осадок наносят на клетки. Часть клеток поглощает ДНК удерживает ее внутри клетки в течение нескольких дней. Небольшая часть клеток (обычно 10-4) стабильно интегрирует ДНК в геном. Для идентифи кации этих ста бильных интегрантов вместе с интересующим геном обычно вво дят ген, придающий отличительный фенотипический признак (отличительный маркер). Предпочти тельными отличительными маркерами являются гены, придающие устойчивость к лекарствам, таким как G–418 и метотрексат. Отличительные маркеры можно вводить в клетки на отдельной плазмиде одновременно с интересующим геном или их можно вводить в той же самой плазмиде. Предпочтительным отличительным маркером является ген устойчивости к лекарству G–418, содержащийся в плазмиде pKO– neo/Soutlurn и Berg I. Mol Appl Genet., 1:327–341, 1982). Может оказаться желательным прибавление дополнительной ДНК, известной как "несущая ДНК", в смесь, вводимую в клетки. После того, как клетки поглотили ДНК, их оставляют расти в течение определенного времени, обычно 1–2 дня, для начала экспрессии интересующего гена. Затем проводят отбор лекарством для отбора тех клеток, кото рые обнаруживают стабильную экспрессию отличительного маркера. Для экспрессии интересующе го белка могут быть отобраны клоны таких клеток. Факторы VII и IX, вы рабатываемые трансформированными клетками, могут быть выделены из клеточной культуральной среды адсорбцией на цитрате бария. Среду перемеши вают с цитратом натрия и хло ридом бария и собирают осадок. Осадок затем можно проанализировать на присутствие соответствующе го фактора свертывания. Дальнейшую очистку можно провести с помощью иммуноадсорбции. Предпочтительно, чтобы иммуноадсорбционная колонка содержала высокоспецифи ческое моноклональное анти тело. Кроме того, очистка адсорбированного на цитрате бария продукта может проводиться более общепринятыми биохи мическими способами или с помощью жидкостной хроматографии высокого давления. Превращение одноцепочечного Фактора VII в активный двухцепочечный Фактор VIIа может проводиться с помощью Фактора XIIa, как описано Hender и Kisiel (I. Clin Invest, 71:1836–1841, 1983) или другими протеазами, имеющи ми трипсиноподобную специфичность (Kisiel и Fujikcuva. Bohring. Inst Mitt, 73: 29–42, 1983). Итак, в данном изобретении предлагается способ получения белков, имеющи х активность зависящи х от ви тамина К факторов свертывания крови, с помощью трансформированных клеток млекопитающих. Генные последовательности, кодирующие специфические домены сериновых протеаз факторов сверты вания, выделяют из библиотек к-ДНК. Последовательности, кодирующие лидерные пептиды и домены связывания кальция выделяют из библиотек к-ДНК или генома или конструи руют из синтезированных олигонуклеоти дов. Затем последовательности соединяют с получением соответствующего вектора экспрессии, кодирующе го белок, имеющий н ужную биологическую кровосвертывающую активность. Результирующий вектор и плазмиду, содержащую маркер устойчивости к лекарству совместно вводят в культивируемые клетки ткани подхо дящего млекопитающего. Трансформированные клетки отбирают затем добавлением соответствующе го лекарства, такого как G–418. Затем белковые продукты очищают из среды клеточного роста и оценивают на биологическую активность анализом насвертывание крови и перекрестным иммунологическим анализом с использованием антител, полученных против аутентичных факторов свертывания. Кратко суммируем представленные ниже примеры: в примере 1 описывается клонирование полномерной последовательности к ДНК Фактора VII. В примере 2 описывается частичная аминокислотная последовательность человеческого Фактора VII, включающая в аминоокончании последовательность из приблизительно 30 аминокислот. В примере 3 описывается конструирование и отбор библиотеки человеческой геномной ДНК и иденти фикация геномных клонов, включающих последовательности гена фактора VII. В примере 4 описано конструи рование двух сегментов гибридного гена, каждый из кото рых содержит фрагмент к ДНК, кодирующий лидерный пептид Фактора IX и синте зированный двунитевый фрагмент, кодирующий согласованный домен связывания кальция. Гибридные последовательности соединяют затем в клоны частичной к ДНК Фактора VII. С использованием мутагенеза in vitro согласованную последовательность затем изменяют так, что бы она соответствовала данным по белковой последовательности Фактора VII. В примере 5 описывается конструирова ние генной последовательности, кодирующей слитый белок, включающий свя зывающий кальций домен Фактора IX и специфический домен сериновой протеазы Фактора VII. В примере 6 описано конструи рование вектора pD2 для использования в экспрессии белков, обладающи х биологической кровосвертывающей активностью, в трансформированных клетках млекопитающи х. Слитый ген, описанный в примере 5, экспрессируют с использованием этого вектора. В примере 7 описано использование векто ра pD2 для экспрессии гена фактора IX в линии трансформированных клеток млекопитающи х. В примере 8 описывается конструи рование вектора рМ7135, содержаще го последова тельности ДНК, кодирующие продукт первичной трансляции, содержащий лидерную последовательность Фактора IX, слитую с Фактором VII. Этот вектор может быть использован для получения белка, имеюще го активность фактора VII, в ли нии трансформированных клеток млекопитающе го. В примере 9 описана экспрессия Фактора VII с использованием последова тельностей ДНК и экспрессии Фактора VII из гибридной последовательности ге номной к ДНК. Представленные ниже примеры служат для иллюстрации, и не ограничивают дан ного изобрете ния. Примеры. Расщепляющие ферменты были получены из Bithisda Researoh Laboratories (BRI) и New Englcend Biolab за исключением, специально указанных случаев, использовались так, как рекомендует поставщик. Олигонуклеотиды синтезирова ли на ДНК-синтезато ре Applied Biosystems Model 380 A и очищали на денатурированных гелях электрофо резом на полиакриламидном геле. E. coli-клетки трансформировали так, как описано Maniatis и др. (Molecular Coning: A Laboratory Manual, Cold Spring Harbor Laboratory (1982). Клонирующие векторы М13 и puC и штаммы – хозяева получали из BRI. Фактор VII получали из человеческой плазмы так, как описано Kisiel и Momullen (см.). Пример 1. Кло нирование частичной к ДНК Фактора VII А. Конструи рование библиоте ки к ДНК человеческой печени. Библиотеку к ДНК получали из м РНК печени человека в соответствии со стандартными способами. Препарат к ДНК седиментировали через градиент щелочной саха розы, и собирали фракции, содержащие частицы большие, чем приблизительно 1000 нуклеотидов. Первый препарат делали двунитевым с помощью ревертазы, обрабатывали Sl-нуклеазой и оставшиеся концы заполняли с помощью ДНК-полимеразы 1 (фрагмент Klenow) в присутствии всех четырех дезоксирибонуклеотидтрифосфатов, к ДНК с тупыми концами обрабатывали Eco RI-метилазой и связывали с фосфорилированными линкерами Есо RI с помощью Т–ДНК – лигазы. Связанный препарат ДНК подвергали интенсивному расщеплению с помощью Есо RI ля удаления избыточных линкерных последовательностей, и двунитевые ДНК большие, чем приблизительно 1000 пар оснований по длине, очищали центрифугированием в градиенте нейтральной саха розы. Нативную ДНК lgt 11 связывали в конкатемеры, расщепляли для завершения с помощью Есо R1 и 5'-концевые фосфаты удаляли обработкой бактериальной щелочной фосфатазой. Соединенные к–ДНК печени человека связывали с ДНК фага, наносили in vitro и использовали для заражения Е.соliY 1088. В этой библиотеке генерируется приблизительно 14 х 106 первичных фаговых пятен, состоящих из 7 библиотек по приблизительно 2 х 106 пятен каждая. Более чем 90% из них являются рекомбинантами, содержащи ми вставки человеческой ДНК, на что указывает потеря у них бетагалактозидазной активности и анализ 20 случайных клонов расщеплением с помощью Есо RI с последующим электрофорезом на агарозном геле. Библиотеку к ДНК в форме частиц фага очищают центрифугированием в градиенте хлорида цезия и хранят в буфере SM. В. Отбор библиотеки к ДНК печени человека для клонов Фактора VII. Описанную вы ше библиотеку экспрессивной к ДНК из печени человека отбирают на специфический анти ген, с использованием 125 I-меченого моноклонального антите ла Фактора VII, полученного с использованием очищен ного Факто ра VII. Отбор 6х10 пятен фа га идентифи цирует один изолят, обозначаемый как lVII2115, дающий положительную реакцию на антите ло. Клон фага lVII2115 испыты вают по отношению к двум другим моноклональным антителам анти-фактор VII и кроличьему поликлональному антителу к Фактору VII. Изолят lVII2115 дает положительную реакцию на все эти антитела анти-фактор VII. ДНК получают из лизата пятен lVII2115. Расщепление этой ДНК с помощью ЕсоRI освобождает вставку длинной 2139 п. о. Эту вставку субклонируют в векторы фага М13 для терминации цепи дидезокси – ДНК секвенти рования. Эта вставка к ДНК содержит сайты Pst I в положениях 214, 839 и 1205 (обозначены на рисун ке Ia соответственно Pst Ia, Pst Ib и Pst Ic) и сайт Sma I, расположенный в положении 611. Секвентируют следующие матрицы М13: 1) полномерный (2139 оснований) фрагмент Есо RIaRIa ® Eco RIb в М3mp18 (обозначает клон Г Г– 1), 2) фрагмент Pst Ia ® EcoRIa, длиной 214 оснований, в М13mp19 (F 7–2), 3) фрагмент в М13m p18 (F7–3) длиной 625 оснований, Pst Ia ® Pst I, 4) фрагмент в М13m p18 (F7–7), Pst Ib Pst Ia, 625 оснований, 5) фрагмент в М13m p10 (F7–8 )- Sma I ® ® Ps t Ib , 228 основа ний, 6) фрагмент в М13m p18 (F7–9), Pst I ® Pst Ic, 366 оснований, 7) фрагмент в М13m p18 (F7–10), Pst Ic ® ® Pst Ib, 366 оснований, 8) фрагмент в М13m p19 (F7–11), Pst Ic® ®Eco RIb, 950 оснований, 9) полномерный фрагмент в М13m p18 (F7–12), Eco RIb Eco RIa, (рестрикционный сайты обозначены также, как на рисунке Ia). Данные подтверждают последовательность у обеих нитей для 91% кодирующего участка и 15% некодирующе го 3'-участка, и дают инфор мацию по одной нити для остальных 9% кодирующе го участка и 85% некодирующе го участка. Сравнение аминокислотной последовательности, предсказанной из последовательности к ДНК, с известной аминокислотной последовательностью и с представленной ниже аминокислотной последовательностью (пример 20) указывает на наличие аномалии, которую можно объяснить отсутствием трех нуклеотидов в последовательности ДНК около положения 400. Для получения дополнительных данных по последовательности VII2115 расщеп ляют Есо RI и фрагмент, кодирующий фактор VII, вводят в pu/C 13, расщепляемый ЕсоRI. Результирующую рекомбинантную плазмиду, обозначенную pu CVII2115, расщепляют Xbal по положению 328. Расщепленный образец делят пополам: половину метят с помощью a 32р ol. СТР и ДНКполимеразы I (фрагмент Klenow), другую половину метят с помощью g32 р АТР и полинуклеотидкиназы. Меченые плазмиды расщепляют затем с помощью Pst 1 и получают фрагменты длиной 113 и 509 пар оснований. Обе нити каждого из этих фрагментов секвентируют по методу Manam и bilbert. Фрагмент длиной 113 пар оснований секвентируют полностью, а в фрагменте длиной 509 пар оснований секвентируют 210 пар оснований. В результате секвенти рования обнаруживают три дополнительных основания (один С и два G), что приводит данные по последовательности белка и указывает на то, что предыдущие аномальные результаты возникают в результате сжатия в секвентирующем ге ле, обусловленного вторичной структурой, включающей в себя G и С. Подтверждается также последовательность последних 9% кодирующего участка для обоих нитей. Дополнительный анализ вставки PU CVII2115 подтверждает, что часть этого клонированного фрагмента кодирует последовательность из 11 аминокислот, которая известна как расщепляющий сайт Фактора VII. Сравнение этой последовательности с аминокислотными последовательностями Фактора IX и Фактора Х свидетельствует о том, что клон, содержащий последовательность факто ра VII, начинается (приблизительно) с нуклеотидов, кодирующих аминокислоту 36 природного белка Фактора VII и продолжается через приблизительно 1000 кодирующих и 1100 некодирующи х н уклеотидов и последовательность poly (A). Кроме того, было установлено, что этот клон имеет мута ционный сдвиг структуры в кодирующем 3'-участке. Для получения правильного кодирующего 3'-участка все 14 миллионов клонов семи библиотек к ДНК lgt 11 подвергают отбору гибридизацией пятен с помощью транслируемой с мет-кой к ДНК lVII2115. Семь положительных изолятов отбирают затем с помощью дидезокси-секвентирования плазмид pU C, в которых субклонированы вставки к ДНК. Клоны lgt 11 расщепляют с помощью EcoR1 и фрагменты Фактора VII вставляют в puC13, которую расщепляют EcoR1. Как было установлено, за одним исключением все остальные начинают с позиции, соответствующей основанию 212 вставки в lVII2115, в одном случае – исключении имеется только некодирующая 3'-последовательность. Один из клонов, начинающийся с основания 212, был выбран для анализа и обозначен как клон puCVII1923. Так как анализ puCVII2115 указывает на присутствие мутационного сдвига между позициями 657 и 815, то puCVII1923 сначала анализировали по этому участку секвентирова нием по Makam–gilbert. Плазмиду puCVII1923 расщепляют с помощью Nar I (позиция 779 на рисунке Ia). Расщепленную ДНК метят 32 р d CTP с использованием ДНК-полимеразы I (фрагмент Klenow) и последовательно расщепляют с помощью Av 1 (проводящей расщепление по тому же сайту, что и Sma 1 на рисунке 1) и Tag 1 (сайт при 1059), получая фрагмент Nar 1–A val длиной 166 п. о. и фрагмент Nar 1–Tag 1 длиной 200 п. о. Каждый из них секвентируют. С, недостающий в pu CVII2115, обнаруживается в положении 697 и другой С, также отсутствующий в pu CVII2115, обнаруживается в положении 798. Было уста новлено, что остальная последовательность кодирующего участка pu CVII1923 является правильной по данным секвентирования по дидезокси-методу субклона М13 полной вставки py CVII1923. Праймер d ac ZC87 (таблица 1) используют для последовательности от положения 212 (рисунок 1а) до 512, праймер ZС218 (СТСТGCCTGCCGAAC) используют для последовательности от 715 до 1140 и праймер ZС217 (ATGAGAAGCGC ACGAAG) используют для последовательности от 720 до 350. Так как вставка pu CVII2115 правильна от положения 13 (позиции 1–12 содержат искусственный линкер), а pu CVII1923 правильна от позиции 212 до конца, то соединенные вместе они дают молекулу с правильной структурой начиная с позиции 13 (рисунок 1а) и до конца. Обычно используемый для этого соединения участок представляет собой сайт Xba 1 в позиции 328. Последовательность правильной составной молекулы показана на рисун ке 1а. Так как клонированием к ДНК трудно получить полномерный клон Фактора VII, то использовали три подхо да для получения отсутствующей кодирующей последовательности и необхо димых лежащи х вы ше процессорной и сигнальной последовательностей. Первый подход заключается в том, что необхо димую последовательность получают из библиотеки человеческой геномной ДНК или дополнительным отбором библиотек к ДНК. Второй подход заключается в синте зировании необхо димой кодирующей 5'-последовательности на основе данных по аминокислотной последовательности Фактора VII (пример 2) и опублико ванных последовательностей генов, кодирующи х зависимые от витамина К факторы свертывания (Kurachi и Davie см., Davie и др., см.) и в присоединении ее к части последовательности фактора IX. Тре тий подход основан на функциональной гомологичности аминоконцевых участков Фактора VII и Фактора IX. Конструируют последовательность, содержащую кодирующие участки лидерной последовательности и аминоконцевой участок Фактора IX. За тем ее в нужной ориентации присоединяют к частичной к ДНК Фактора VII. Для получения последова тельностей ДНК, содержащи х полную последовательность ДНК Фактора VII, были предприняты попытки выделять оставшуюся 5'-последовательность ДНК. Это дости гается использованием 5'-концевого фрагмента EcoRI-XbaI длиной 0,3 килобазы из к ДНК вставки lVII2115 для отбора библиотеки к ДНК, содержащей 2 х 10 фа гов. Библиотеку конструи руют с использованием poly (А)-м РНК из клеток Нер G2 с последующим применением вышеописанных способов. РНК pетранскрибируют для получения первой нити к ДНК, а вто рую нить синтезируют с по мощью ДНК-полимеразы 1 и РНК азы Н. После метилирования EcoR1 и пропускания через колонку с сефа розой 6В концы ДНК затуп ляют с помощью Т4–ДНК-полимеразы. Добавляют линкеры EcoR1 и избыточные линкеры удаляют отщеплением с помощью EcoRI и хроматографией на Сефарозе Ch 2В. ДНК, нахо дящуюся в мертвом объеме, собирают, и связывают с lgt 11, расщепленной EcoRI и обработанной кишечной бычьей фосфа тазой. ДНК наносят и вводят в Е.соli Y1088. Обнаруживают несколько положительных результа тов и фрагменты EcoRI затем субклонируют в векторы фага М13 для дидезокси-секвентирования с использованием либо универсального праймера М13 либо специфических олигонуклеотидов Фактора VII. Таким образом, получают три новых к ДНК-клона Фактора VII с полностью определенными последовательностями. Как было уста новлено, большая часть этих к ДНК из клона, обозначенного lVII2463, содержит полную кодирующую последовательность Фактора VII. Этот клон включает в се бя 35 нуклеотидов нетранслируемого 5'-участка, 180 нуклеотидов, кодирующи х 60 аминокислот ли дерного участка, 1218 нуклеоти дов кодирующи х 406 аминокислот нативного белка, стопкодон, 1026 нуклеотидов нетранслируемой 3'- последовательности и 20 оснований poli (A) – конца (начиная с позиции 2463). Обе нити этой к ДНК полностью секвентировали. Сравнение ее с двумя к ДНК, выделенными ранее из клонов lVII2115 и lVII1923, показывает, что клон lVII2463 содержит дополнительно 321 нуклеотид выше вставки в lVII2115 и 519 нуклеотидов выше вставки в lVII1923. Перекрывающиеся последовательности lVII2463 Фактора VII и эти две предыдущие к ДНК совпадают, за исключением того, что к ДНК lVII2463 не содержит делецию одного основания в позиции 1005 и 1106, обнаруженную в к ДНК lVII2115. Таким образом, lVII2463 содержит в одном фрагменте EcoRI к ДНК Фактора VII, кодирующую лидерный участок Фактора VII и последовательности зрелого белка. Была выделена дополнительная к ДНК lVII565, которая, как было установлено, содержит 5'-концевые последовательности Фактора VII, но усе чена в кодирующих последовательностях. Ее 5'-окончание соответствует нук леотиду 9 (рисунок 1). По сравнению с полимерной lVII2463, lVII565 лише на, как было установлено, последова тельности, соответствующей одному экзоноподобному участку в лидерной последовательности. В lVII565 отсутствуют основания 100–165 (рисунок 1b). Отсутствующие последовательности точно соответствуют одному экзоноподобному участку по данным геномной последовательности (как описано в примере III). Та ким образом, структура lVII565 может быть следствием альтернативных ста дий сплайсинга в лидерной последовательности. Лидерная последовательность, закодированная в lVII2463, является исключительно длиной (60 аминокислот) и имеет совершенно другой гидрофобный профиль, чем Фактор IX, протеин С и протромбин. Эта лидерная последовательность содержит два остатка метионина, в положениях – 60 и – 26. Наиболее вероятно, что инициирование начинается с первого остатка метионина, так как гидрофобный участок, типичный для сигнальных пептидов, начинается с метионина в положении – 60, а не с метионина в положении – 26. Интересно, что последовательности, отсутствующие в lVII565 и точно соответствующие экзоноподобному участку в геномном клоне, дают лидерную последовательность из 38 аминокислот с гидрофобной структурой, более близкой к структурам вышеуказанных белков. Пример 2. Аминокислотная последовательность человеческого Фактора VII. Расшифровка аминокислотной последовательности Фактора VII нужна для подтверждения идентичности полученных к ДНК-клонов, правильности последовательности к ДНК Фактора VII, для получения информации, позволяющей синтезировать специфический олигонуклеотидные пробы для отбора к ДНК и геномных библиотек для клонов, содержащих 5'-последовательность для конструирования синтетического фрагмента, кодирующего аминоконцевой участок Фактора VII. Очищенный человеческий Фактор VIIа восстанавливают и карбоксимети лируют. Ма лую и большую полипептидные цепи карбоксиметилированного фактора VIIа разделяют жидкостной хроматографией высокого давления (ЖХВД) на колонке с обращенной фазой Micvo Pack C18 (Varian Corp), создавая градиент 0,1% ТFA в дистиллированной воде (А) и 0,1 % TFA в ацетонитриле (В), 0–40 % В в те чение 5 мин, 40–80 % В в течение 25 мин и 80–100 % В в течение 5 мин. Приблизительно 300 пикомолей каждой пептидной цепи анализируют автоматизированным разложением по Эдману с использованием bas–Phase Protein Sieguencer (Appied Biosystems Ink). В аминоконцевом участке большой и малой полипептидных цепей идентифи цируют соответственно 18 и 29 остатков. Аминоконцевая последовательность большой цепи Фактора VII согласуе тся с последовательностью, кодируемой клоном к ДНК puСVII2115 (рисунок 2b). Аминокислотные остатки обозначены в рисун ках 2а и 2b одной буквой следующим образом: А–аланин, С–цистеин, D–аспарагиновая кислота, Е–глутаминовая кислота, Г–фенилаланин, М–метионин, N–аспарагин, Р– пролин, О–глута мин, R–аргинин, S–серин, Т–треонин, V–ва лин, W–триптофан, Y–ти розин, Х–неизвестный остаток, G–глицин, Н–гистидин, I–изолейцин, К–лизин, L–лейцин. * указывает на то, что остатки Gla (g) предполагаются на основа нии гомологичности струк тур других известных факторов сверты вания и отсутствия каких-либо других фенилтио гидрантои наминокислот в эти х позициях. Прочерки (–) введены для лучшего сопоставления последовательностей. Кроме того, инфор мация указывает на то, что аминокислоты, в по ложениях 5 и 9 являются лизинами, а не трео нином и аргинином, соответственно, как докладывалось ранее (Кисиел и Мак– Маллен, см.). Анализ последовательности малой цепи Факто ра VIIа, происхо дящей из аминоконцево го участка Факто ра VII, ограничен приблизительно 6 остатками до перекрывания со структурой, кодируе мой 5'-окончанием к ДНК клона puCVII2115. Для получения дополнительных данных по последовательности, два на номолякарбоксиметилированной малой цепи расщепляли 12 час бычьим химотрипсином (1:100 вес/вес, фер мент:субстрат) в 0,1 М бикарбонате аммония при рН = 7,8 и 37 оС. Полученные фрагменты очищают ЖХВД на колонке с обращенной фазой Micro Pack С18 с использованием указанных выше растворителей в градиенте 0–30 % В в течение 5 минут, 30–60 % В в течение 25 минут и 60–80 % В в течение 10 минут. Пептиды идентифицируют по их УФ-поглощению при 220 и 280 нм. Лиофилизированные пептиды (приблизительно по 1 наномолю каждого) анализируют разложением по Эдману. Результаты (рисунок 2b) подтверждают большую часть к ДНК последовательности в соответствующем участке клона puCVII2115. В целом идентифицировано 113 из 152 остатков (75%) малой цепи Фактора VIIа. Эта последовательность идентична последовательности, кодируемой известной структурой к НК. Косвенные признаки указывают на то, что Asn 145 является сайтом присоединения углевода. Пример 3. Кло нирование геномной последовательности Фактора VII. В одном подхо де получения 5'-концевой последовательности из к ДНК, библиотеку лямбда-фага, содержащую ДНК плодной печени человека, отбирают с помощью меченно-транслируемой к ДНК Фактора VII. Часть геномной библиотеки помещают на Е.сoli Е392 (АТСС 33562) с получением общего количества пятен 7,2 х 10. Пятна фага адсорбируют с пласти нок на нитроцеллюлозу и гибридизуют 32р меченной к ДНК. Получают 8 клонов и пятна очищают. С использованием фрагмента ДНК (EcoRIa–XbaI, рисунок 1) из 5'-окончания к ДНК Фактора VII (lVII2115) и стандартных мето дик иденти фицируют эти ге номные клоны, содержащие 5'-концевые последовательности. Э ти фаги обозначают как 7 m 1,7 m 2 и 7m 3. Из этих ре комбинантных фа гов получают ДНК и проводят предварительный анализ последовательности рестрикционными эндонуклеазами. Фаг 7 m 1, имеющий самый сильный сигнал гибридизации, используют для получения более подробной рестрикционной карты и помещения на эту карту последовательностей к ДНК EcoRI–XbaI внесением по Southern. Для того, что бы определить, содержит ли фаг 7 m 1 последова тельности ДНК, кодирующие аминоконцевые аминокислоты белка Фактора VII, пятна Southern ДНК фага после рестрикции гибридизуют смесями олигонуклеотидов, чьи последовательности рассчитывают из аминоконцевой аминокислотной последовательности Фактора VII. Оли гонуклеотиды ZС188 ZС360 и ZС401 (таблица 1) радиоактивно метят Т4-полинуклеотидкиназой и гибридизуют в пятна ДНК фага при температуре, на несколько градусов более низкой, чем их Тm. Результаты этого анализа показывают, что фрагмент 7m 1 Sst 1 длиной 3,7 килобазы содержит последовательности, гибридизованные этими олигонуклеотидами. Этот фрагмент Sst 1 субклонируют в М13 для анализа последовательности ДНК. Результаты, полученные с использованием ZС360 в качестве праймера секвентирования, идентифицируют область длиной приблизительно 60 нуклеотидов, что соответствует данным по аминоконцевой последовательности белка. Таблица 1 Олигонуклеотид Последовательность 1 2 ZС87 ZC188 TCC CAG TCA CGA CGT ZC212 ZC213 ZC217 ZC218 ZC235 ZC249 ZC275 ZC286 T G A GCC GG GC CTC A A CTC CTC CA A GAA GGG GTTGG GAC CTG C AG GAT CCA TGC AGC TGA ACA TGA GCG CTG GAG GCC TGG TGA TTC TGC CAT GAT C AT GTT CAG GCG CTG ATG AGA AGC GC A CGA AG CTC TGC CTG CCG AGC GAT CCA TGC AGC GC AGA ACA GСT TTG TTC TTT CA GCC CCC ATT CTG GC A CCA AAG AGG GCC AAC GCC TTC CTG GAG GAG AGA CCT GGG AGС CTG GAG AGA GAG TGT ATT GAG G 1 2 Продолжение табл. 1 ZC287 ZC288 ZC289 ZC333 ZC336 AAT ACA CTC TCT CTC CAG GCT CCC AGG TCT CTC CTC CAG GAA GGC GTT GGC CCT GTT TGG AGC AGT GTA GCT TCG AGG AGA AC A GAG AGG TTT TCG AGG CCA GCG ACG AAT TCG TCG CTG GCC TCG AAA ACC TCT CTG TTC TCC TCG AAG CTA C AC TGC TCC CAG CTT CGT CCT GTC GCT GGC CTC CCT CTT CGG GCC TGG TGA ZC360 ZC401 C C C G CA T TC T TC T TC T CA CGT AGC GTT C AG GCC CTC GAA GAT CTC GCG CGC CTC CTC GAA GCT AC A C Так как известно, что геномный клон 7 m 1 содержит последова тельности длиной 7 килобаз выше экзона 2, то этот клон участвует в кодировании нетранслируемых 5'-последовательностей Фактора VII и лидерных последовательностей до аминокислотной позиции – 17. Для подтверждения того, что экзон 1 закодирован в геномном клоне 7 m 1, используют информацию о лидерной последовательности из клонов lVII2463 и lVII5656 для расчета олигонуклеоти дов ZС528 и Z529 (см. ниже). ZС528 5'ТСА AC A GGC AGG GGC AGC ACT GCA GAG ATT 3' ZC529 5'TTC CAC GGC ATG TCC CGT GTT TCT CCT CCT3' Это используют для пробы ДНК 7 m 1 и, как установлено, субклон 7 SD гибридизован обоими этими олигонуклеотидами. Устанавливают, что экзон 1 состоит из двух экзонных последовательностей: экзона Ia, гибридизованного ZС528 (соответствует нуклеотидам 1–30 в lVII2463) и экзона Ib гибридизованного ZС528 (соответствует н уклеоти дам 119–148 в lVII2463). Секвентируют последовательности интрона, примыкающие к обоим экзонам Ia и Ib:Ia содержит согласованную до норную последовательность сплайсинга в 3'окончании экзона, а к каждому концу Ib примыкает акцептор согласованного сплайсинга (вы ше Ib) или донорная последовательность (ниже Ib). Точно определяют положение экзона Ia в ге номном клоне 7 m 1, и определяют наличие экзона Ib в определенном участке. Последовательности экзона Ib присутствуют в lVII2463, а lVII565, как оказалось, происходит из РНК, помещенной между экзоном Ia и экзоном 2, с внешней петлей последовательности экзона Ib. Получают различные 7 m 1-субклоны в puC и М13-векторах для облегчения секвентирования остальных экзонов. Соответствующие олигонуклеотиды получают из последовательностей к ДНК, соответствующи х экзонам 1–7, и используют и х для последовательностей все х экзонов кроме последнего экзона. Геномная последовательность точно соответствуе т последовательностям к ДНК на этих участках. Кроме того, были определены связывающие участки интрон/экзон для экзонов 1–7, и в настоящее время для большинства из них точно определено место в клоне 7 m 1. Размеры и положение интронов в гене Фактора VII перечислены в таблице 2. Таблица 2 Интрон Аминокислотная позиция Размер интрона (килобаз) А В С D E F G H –39 –17 37/38 46 84 131 167/168 209 0,2 1,0 1,92 0,0 68 ~2 ~1 0,56 1,31 Как известно, фаг 7 m 1 лишен 3'-окончания факто ра VII, включающе го в се бя экзон 8. Для получения этих последовательностей в 12–13 килобаз – обогащенную библиотеку Bam H1 в Xh 47,1, полученную из первичных фибропластов кожи человека вводят пробу с двумя транслируе мыми с метой фрагмента ми Pst 1 к ДНК Фактора VII (соответствуе т последова тельностям экзона 7 и нетранслируемым 3'-последовательностям). Клон, обозначенный как 7 DCI, определяют по обеим пробам. Последующим анализом с помощью рестрикционных эндонуклеаз и анализом пятен по Sonthern устанавливают, что клон 7 DCI перекрывается и простирается на приблизительно 3 килобазы за окончание клона 7 m 1 и что он содержит экзон 3. Фрагмент длиной 3,9 килобазы (XbaI–BamH1) из ДНК 7 DCI, содержащей экзон 8, субклонируют в М13 и проводят анализ последовательности с помощью олигонуклеоти дов, комплементарных окончаниям 5' и 3'. В этом клоне присутствует полная экзонная последова тельность. Пример 4. Гиб ридные гены Фактор IX – Фактор VII, содержащие синтезированную кодирующую последовательность А. Конструи рование последовательности гибридной лидерный участок Фактора IX – синтетическая последовательность, кодирующая 5'-участок Фактора VII. Вторым подхо дом для получения 5'-кодирующей последовательности Фактора VII является синтез соответствующе го двунитевого фрагмента с использованием нуклеотидной последовательности, рассчитанной на основании аминоконцевой аминокислотной последовательности Факто ра VII., аминокислотных последовательностей други х зависимых от витамина К факторов свертывания и известных нуклеотидных последовательностей ге нов других зави симых от вита мина К факторов свертывания. Для получения нужных сигналов секретирова ния и переработки для секреции аналога зрелого факто ра VII, этот син тетический фрагмент (согласованная последовательность) соединяют с одним из двух ли дерных участков, полученных из клона к ДНК Фактора IX. Этот подход иллюстрируется на рисун ке 3. к ДНК, кодирующую че ловеческий фактор IX, по лучают из библиотеки м-РНК из печени челове ка. Последовательность Фактора IX вы деляют из вектора pBR – 322 расщеплением Pst I и вводят в сайт Pst I pu C13. Эту плазмиду обозначают FIX–puC13. Для удаления G – обогащенного участка, присутствующе го в 5'-окончании вставки Фактора IX в результате клонирования к ДНК, в 5'-окончание клонированного фрагмента вводят синтетический олигонуклеотидный адаптер. Олиго нуклеотиды С212 и С213 (таблица 1) синтезируют и ренатурируют с получением перекрывания в 22 пары оснований, концы фрагмента заполняют и разрезают подхо дящи ми рестрикционными эндонуклеазами, и результи рующий фрагмент присоединяют к последовательности фактора IX. Для конструи рования адаптера по 100 микомолей каждого из ZС212 и ZС213 лиофи лизуют и повторно суспендируют в 10 мкл 10 х киназа/лигаза буфе ра (600 мМ Трис, рН = 8,0 100 мМ хло рида магния, 100 наномолей DTT) плюс 86 мкл воды. Реакцию ренатурации проводят при 65oС в течение 10 мин, смесь медленно охлаждают до комнатной температуры и помещают на лед. К этой смеси прибавляют 4 мкл смеси 2,5 мМ dDTP и 1 мкл (8 единиц) T4 – ДНК полимеразы. Реакцию проводят в течение 45 минут при 14оС. Прибавляют 10 мкл 5М ацетата аммония и ДНК экстрагируют один раз смесью фенол/хлороформ и дважды хлорофор мом, и осаждают этанолом. ДНК центрифугируют и суспендируют в 100 мкл среднего солевого буфера (Maniatis и др., см., р. 100) расщепляют 9 ед. Pst 1 и 8 ед. Cfo 1 и экстрагируют так, как описано выше. Затем конструи руют модифи цированную последовательность Фактора IX соединен 0,16 пикомоля синте тического адапторного фрагмента Pst 1–Сfo 1,0, 414, пикомоля фрагмента Cfo 1–Ва Н1 Фактора IX длиной 1,4 килобазы из FIX–puC13 и 0,14 пикомоля векторного фрагмента Bam H1–Pst 1 pu C13 длиной 2,7 килобазы в 20 мкл реакционной среды, содержащей 60 мМ трис – TCl, рН = 7,5; 10 мМ, хло рида магния, 10 мМ DTT и 0,9 ед. Т4 – лигазы. Реакционную смесь инкубируют 3 час при комнатной температуре и используют для трансфор мирования Е. coli М83. Клетки помещают на пластинки с 50 мкл 2 % Х gal (5-бром-4хлор-3-индонил-b-D-галактозид) в h-бульсы, содержащий 40 мкг/мл ампициллина, и инкубируют при 37oС в течение ночи. Белые колонии отбирают на другую пластинку, содержащую ампициллин и выращи вают при 37оС в те чение ночи. Ко лонии помещают на бумагу Ватман 540, и бумагу го товят для гибридизации. Бумагу инкубируют при 44оС в течение 2 час в 0,9 М NaCl, 0,09 М Трис-НСl, РН = 7,5 6 мМ ЭДТУК, 0,5% Nonidit Р– 40, 150 мкг/мл т-РНК. Е.Coli Бумагу метят 32р меченным С235 (Таблица 1), 14-мером, специфическим для измененной 5'-концевой последовательности. Гибридизацию с 1–2 х 106 имп/мин на фильтр проводят при 44оС в течение ночи в буфе ре предгибридизации. Затем фильтры промывают 3 раза в 6 х SS C, 0,1 % SDS при 4оС и 3 раза в 2 х SSC, 0,1 % SDS при 44оС и помещают на рентгеновскую пленку. Обнаруживают для положительных клона. Один из этих клонов обозначают FIX (-G) ® pu C13. Для подтверждения последова тельности измененного участка Фактора IX, входящего в конструкцию FIX (-G) ® puC13, проводят секвентирование непосредственно плазмиды с использованием обратного праймера BRh и с использованием конца праймера, меченного полинуклеотидкиназой и g32 Р АТР. Последовательность соответствует предсказанной. Результи рующая рекомбинантная плазмида содержит три сайта расщепления Нае III, первый в положении 39 последова тельности Факто ра IX (нумерация основана на последовательности, опубликованной Anson и др., (см.), начиная с первого АТG), вто рой в положении 130 и третий в полилинкере puC13. Сайт в положении 130 является одной парой оснований выше кодонов для сайта расщепления hys–Arg молекулы Фактора IX. В ре зультирующей конструкции гибрида Фактор IX – Фактор VII ли дерная последовательность Фактора IX, окончивающая в положении 39 или 130, соединена с синтетическим двунитевым фрагментом, содержащим предсказанную согласованную последовательность и последние 3 кодона лидерной последовательности Факто ра IX. Синтетический согласованный фрагмент получают соединением олигонуклеотидов ZС286 – ZС 289 (таблица 1) с образованием двунитевого фрагмента. По 100 пикомолей каждого олигонуклеотида лиофилизуют и суспендируют 10 мкл 1 х киназного буфе ра и инкубируют в течение ночи при 4оС, затем нагревают при 65o в те чение 10 мин. Обработанные киназой олигонуклеотиды делят на две части. Первая часть содержит ZС286 + ZС287, часть 2 содержит ZС288 + ZС289. Соединенные пары ренатурируют 10 мин при 65оС, охлаждают до комнатной температуры в течение 2 час и помещают на лед на 39 мин. Фрагмент модифи цированного Фактора IX уда ляют из FIX3–G) puC13 в виде фрагмента Hind III– EcoRI. Приблизительно 20 мкг плазмиды расщепляют 30 ед каждого из Hind III и EcoRI в 100 мкл буфера Hind III (BRh), содержаще го 4 мкг РНК-азы А, при 37оС, в течение ночи. Реакцию обрывают нагревом при 65оС в те чение 10 мин, и вектор и фрагменты Фактора IX подвергают электрофо резу на 10 % ага розном геле и очищают электроэлюированием. Фрагмент Фактора IX осаждают этанолом, суспендируют в буфере, содержащем РНК-азу А в концентрации 400 нкг/мкл и расщеп ляют 9 ед. Нае III в течение ночи при 37оС. Фрагмент Hind III – Hae III Факто ра IX длиной 39 пар основа ний выделяют из этого перевара электрофорезом на 1,5% агарозном геле с последующим электроэлюированием. Для получения фрагмента фактора Hind III – Hae III длиной 130 пар оснований FIX–puC13 расщепляют с помощью ЕсoRI и Hind III и фрагмент Фактора IX вы деляют так, как описано выше. Приблизительно 3 мкг этого фрагмента Hind III – EcoRI расщепляют 6 ед. Нае III при 37оС и в раствор, содержащий 50 мМ ЭДТУК, отбирают аликвоты с интервалами 5 мин в течение 30 мин. Аликвоты соединяют и фрагмент Hind III – Hae III длиной 130 пар оснований очищают электрофо резом на 5% акриламидном геле с последующим электроэлюированием. Результи рующие гибридные согласованные последовательности Фактора IX получают соединением четырех частей, олигонуклеотидных частей 1 и 2, фрагмента Hind III – Hae III Фактора IX (длиной 39 или 130 пар оснований) и фрагмента Hind III–EcoRI и puC13. Результирующие плазмиды используют для трансформирования Е.coli HB101 (АTCC 33684) Колонии отбирают расщеплением ДНК с помощью ЕcoRI и Hind III. Последовательность, содержащую участок Фактора IX дли ной 39 пар оснований, соединяют с синте тической согласующей последовательностью и эту конструкцию далее называют мини–FIX–FVII. Плазмиду, содержащую та кую конструкцию, обозначают рМ7200 (-С). Последовательность, содержащую последовательность Факто ра IX длиной 130 пар, соединенную с синтетической согласующей последовательностью обозначают м макси-FIX–FVII. Плазмиду, со держащую эту конструкцию, обозначают рМ7100 (-С). Согласующая последовательность кодирует полипептид, имеющий следующую аминокислотную последовательность: Ala – Asn – Ala – Phe – Leu – Gln – Arg – Pro – Gly – Sir – Leu – Gla – Arg – Gla – Cys – Hys – Gla – Glu – Cys – Ser – Phe – Gla – Aca – Arg – Gla – Tle – Phe – Gla – Gl y – Leu – Asn – Arg – Thr – H ys – Leu. В. Присоединение гибридного фрагмента согласованной последовательности Фактора IX к клону кДНК Фактора VII. Гибриды согласованного участка Фактора IX (ли бо мини, либо макси) присоединяют к 5'-участку кДНК Фактора VII и вектору puC13 связыванием трех частей (рисунки 4 и 5). Фрагмент вектора получают расщеплением 6 мкг puC13 10 ед. каждого из XbaI и Hind III в Hind III – буфере, содержащем РНК-азу А (400 нг/мкл). Фрагмент мини-FIX–FVII по лучают расщеплением 2 мкг рМ 7200 (-С) 10 ед. каждого из Hind III и EcoRI, как указано выше. Фрагмент макси – FIX–FVII аналогичным образом получают из рМ 7100 (-С). 5'Участок к-ДНК Фактора VII по лучают из плазмиды (pu CC 705), содержащей 5'-фрагмент EcoRI–Xba I pu CVII2115, субк лонированной в puC13 расщеплением с помощью XbaI и EcoRI. Расщепление проводят при 37оС в течение 2 час и продукты разделяют электрофорезом на 1,5% агарозном геле. Целевые фрагменты электроэлюируют, экстрагируют смесью фенол/хлороформ и хлороформом и осаждают эта нолом. Три фрагмента, а именно puC13 / XbaI–Hind III, Фактор IX – Фактор VII (мини или макси) (Hind III – EcoRI и 5'Фактор VII – /EcoRi – XbaI cвя зывают, затем в 20 мкл лигазного буфе ра, содержаще го 2 мкл 20 мМ АТР и 0,9 ед. Т4 – ДНК – лигазы в те чение ночи при 4 С. Колонии отбирают рестрикционным анализом с помощью Hind III и XbaI. Рекомбинантные плазмиды, содержащие мини- и макси- FIX–FVІІ последова тельности обозначают, соответственно, рМ7200 и рМ 7210 (рисунок 4). Так как при получении к-ДНК Факто ра VII использовалось прибавление линкера, то нужно провести модификации слитых последовательностей для получения правильной структуры кодирующих последовательностей. Как мини-, так и макси- стыки содержат сайт EcoRI в соединении между гибридом согласованной последовательности Факто ра IX и к-ДНК Фактора VII, и это артефакт реакции клонирова ния к-ДНК. Кроме того, мини-стык требует прибавления С для изменения последовательности в сайте Hae III от 5' AGG CCA3' до 5' ,AGG CCCA3' и установления правильной структуры считывания ниже этой последова тельности. Эти корректирующие изменения проводят нуклеотиднаправленным сайт-специфи ческим мутагенезом. Фрагмент мини- FIX–FVII удаляют из рМ7200 расщеплением с помощью Hind III и XbaI и вставляют в М13 m р19. Фрагмент макси- FIX–FVII очищают о т р М 7100 и субклонируют аналогичным образом. Мутагенные праймеры ZС333 и ZС336 (см. таблицу 1) используют для уда ления сайта EcoRI и, соответственно, вставки основания. В каждом случае используют уни версальный праймер ZС87 в качестве вто рого праймера. Мутагенный праймеры фосфо рилируют соединяя 40 пикомолей праймера и 60 пикомолей АТР с 1 ед. Т4 – ДНК – киназы, на ночь при 60оС. Для удаления сайта EcoRI из гибрида макси-FIX–FVII, 1 мкг однонитевой матрицы М13 соединяют с 20 пикомолями каждого из ZС333 и ZС87 в общем объеме 1 мкл. Праймеры ренатурируют на матрице в течение 10 мин при 65оС, охлаждают до комнатной температуры в течение 5 мин, затем помещают на лед на 5 мин. Праймеры уве личивают с помощью ДНК-полимеразы 1 (фрагмент Klenow). Для удаления сайта EcoRI и корректировки структуры считывания в гибриде мини- FIX–FVII, 1 мкг подхо дящей однонитевой матрицы М13 соединяют с 20 пикомолями каждого из ZС333, ZС336 и ZС87. Реакции ренатурации и увеличения праймера проводят так, как описано выше. Пятна отбирают с помощью 32Р – меченного праймера (ZС333 или ZС336) при 60оС и подтверждают последовательности дидезоксисеквентированием. Результирующие конструкции, содержащие макси- и мини- FIX–FVII последовательности, обозначают соответственно рМ7111 и рМ7211. Согласованная последовательность содержит несколько участков, не совпадающих с данными по последовательности белка, полученными для Факто ра VII (рисунок 2). Для получения последова тельности, кодирующей полипептид, обладающий большей гомологичностью к аминоконцевому участку Факто ра VII, согласованную последовательность изменяют олигонуклеотиднаправленным сайт-специфи ческим мутагенезом. Вводят изменения, заключающиеся во введение лейцина в положение 8, замена лизина на изолейцин в положении 18 (цифры соответствуют позиции аминокислоты после введения в позицию 8), аланина на аспарагин в позиции 26 и последовательности Gly–Leu–Asn на Ala – Ser – Asp в позициях 32–34 (на основании предварительных данных по аминокислотной последова тельности). Изменения последовательности в положениях 8 и 19 проводят с использованием рМ7111 (принимающая нить) в качестве матрицы. Праймеры С352 (5' ССС AGG TCT C AG CTC CTC C AG 3' ) и ZC333 (5'CTG, CTC CTC CTT ACA CTC TCT3' ) ренатурируют на матрице и расши ряют так, как описано выше. Результирующий клон фага обозначают р М7114. Последовательность вставки в рМ7114 подтверждают дидезоксисеквентированием. Аналогичным образом вносят изменения в положения 26–34 в матрице рМ7114 (принимающая нить) с использованием мутагенного праймера ZС366 (5' СAG CTT CGT CCT GTT C AG GCC CTC GAA GAT CTC GCG GGC CTC CTC GAA3' ) и ZС87 (таблица 1) в качестве вто рого праймера. Результирующую конструкцию обозначают рМ7115. Последовательность всех 550 п. о. вставки в векторе М13 определяют дидезокси-секвентированием устанавливают, что она является правильной. Пример 5. Конструирова ние слитой к-ДНК Фактор IX – Фактор VII Слитую к ДНК Фактор VII получают с использова нием к ДНК Фактора IX, полученной из библиоте ки к ДНК печени челове ка и последовательности к кДНК Фактора VII, опи санной в при мере 1. Точка слития, выбранная для гибридного белка, нахо дится между аминокислотой +38 (треонин) Фактора IX и первым лизином, закодированным последовательностью к ДНК Фактора VII. Та кой белок может быть закодирован последовательностью, состоящей из первых 252 по последовательности к ДНК Фактора IX и всей последовательности к ДНК Факто ра VII puCVII2115, за исключением первых двух кодонов. Для конструирования этой гибридной последовательности последовательность Фактора IX сначала сливают с puCVII2115 с использованием обычных рестрикционных сайтов. Это связывание приводит к плазмиде FIX/VII/12 (описано выше) содержащей первые 310 по к ДНК Факто ра IX соединенные с полной к ДНК Фактора VII. Для достижения точной стыковки, нужной для гибридного белка, инвентированные пары оснований удаляют олигонуклеотиднаправленным мутаге незом. Соединение последовательности к ДНК Фактора IX с последовательностью к ДНК Фактора VII достигается связыванием фрагмента Hind VIII–A a III дли ной 0,3 килобазы из FIX (-G)® ®puC13 (пример 4) с фрагментом Sma–Hind III длиной 4,7 килобазы из puCVII2115 (рисунок 5). Фрагмент Hind III – Aha III получают расщеплением 3 мкг FIX (-G) ® puC13 40 ед. Hind III в 40 мкл среднего солевого буфе ра (Maniatis и др., см.) при 37оС в течение 4 час. Объем затем уве личивают до 100 мкл слевого буфе ра и прибавляют 5 ед. Aha III и инкубирование продолжают при 37оС в течение 13 час. Фрагменты ДНК отделяют электрофорезом на 1% агарозе и полосу 0,3 килобазы выделяют так, как описано выше. Частичное Sma I – расщепление puCVII2115 проводят инкубированием 3 мкг pu CVII2115 при 25 оС в течение 1 час с 4,8 ед. Smal в реакционном объеме 30 мкл. Реакцию обрывают инкубирова нием в течение 15 мин при 65оС. Затем образец экстрагируют один раз равным объемом фенола и осаждают эта нолом. Осадок собирают 10 мин микроцентрифуги рованием, промывают 70% этанолом и сушат на воздухе. ДНК снова растворяют в 30 мкл среднего солевого буфера и разлагают 30 ел. Hind III при 37 оС в течение 3 час ДНК подвергают электрофо резу на 0,7% агарозе и фрагмент Hind III – Smal длиной 4,7 килобазы выделяют так, как описано выше. Эквимолярные количества двух фрагментов (0,048 пикомоля) связывают в 10 мкл реакционной среды, содержащей 50 мМ Трис-НCl, рН-7,5, 10 мМ хлорида магния, 1 мМ DTT, 1 мМ АТР и 3 ед. T4– ДНК-лизазы при 14 С в течение 3,5 час и затем используют для трансфор мирования Е.сoli RRI (АТСС 31343). Клетки выращи вают на ампициллиновых пластинках и 12 из результирующи х колоний отбирают рестрикционным ферментативным расщеплением на присутствие целевой плазмидной конструкции. ДНК из колонии 12 (FIX/VII/12) дает ожидаемую модель рестрикционного ферментативного расщепления и используется в следующей ста дии конструирования гибридного ге на. Олигонуклеотиднаправленный мутагенез проводят на матрице однонитевой ДНК. Таким образом, необхо димо клонировать слитые последовательности Фактора IX/Фактор VII в М13 р19. Для получения удобного небольшого фрагмента ДНК фрагмент Hind III–XbaI длиной 640 пар оснований выделяют из FIX– VII/12. Этот фрагмент содержит 310 пар оснований 5'-конца – к ДНК фактора IX и 330 пар оснований последовательности Факто ра VII. По лучают вектор расщепления 1 мкг ДНК М13mp19 RF c помощью 20 ед. Hind III и 20 ед. Xba I в 40 мкл среднего солевого буфе ра при 37оС в течение 18 час. ДНК подвергают электрофо резу на 1,2% агарозе и из геля выделяют фрагмент длиной 6,4 килобазы, как описано выше. 5 мкг ДНК FIX/VII/12 расщепляют 10 ед. Xba I в 40 мкл среднего солевого буфе ра при 37 о в течение 18 час. Добавляют 12 ед. Hind III и расщепление продолжают при 37 оС еще в течение 7 час. Результирующие фрагменты разделяют электрофо резом на 1,2% агарозе и фрагмент 640 по элюируют так, как описано выше. 10 нг линеаризованного М13 mp19 и 1 нг фрагмента 640 по связывают при 14оС в течение 1 час и затем используют для трансформирования E.coli JM101. Клетки покрывают Х-gal и IPTG, и 8 синих пятен отбирают и используют для заражения 2,5 мл культуры E.coli JM103 при А = 0,3. После 18 час выращи вания при 37оС клетки собирают центрифугированием в клинической центрифуге при комнатной температуре и 20 мкл супеpнатанта, содержаще го фаг М13, смешивают с 10 мкг/л этидий бромида. По сравнению с известными стандартами каждый из 8 клонов имеет вставку примерно нужного размера. Затем получают однонитевую ДНК из 1,5 мл супернатанта. Эту конструкцию затем секвентируют дидезоксиспособом с использованием олигонуклеотида ZC87 в качестве праймера для подтверждения того, что соединение вставки правильно. Один из правильных клонов (# 4) используют в качестве матрицы в олигонуклеотиднаправленном мутагенезе для получения функционального слития Фактор IX – Фактор VII. Олигонуклеотид ZС249, 20-мер, состоящий из 10 по целевой последовательности факто ра IX и 10 по целевой последовательности фактора VII (таблица 1) используют в качестве мутагенного праймера. В качестве второго праймера используют олигонуклеотид ZС87, гибридизующий последовательность М13 mp19. Использованная методика мутагенеза является модификацией методики Zoller и Smith (см.). Для ренатурации 20 пикомолей С249 фосфорилируют ин кубированием в течение ночи при 4 оС в 20 мкл 60 мК Трис–HCl, рН = 8,0, 10 мМ хло рида магния, 1 мМ DTT, 1 мМ АТР, 1 ед. Т4-киназы. Реакцию обрабаты вают инкубированием при 65оС в течение 15 мин и образец леофи лизуют. Один пикомоль однонитевой матрицы клона # 4 и 20 пикомолей ZС87 прибавляют в 10 мкл ренатурирующе го буфе ра (200 мМ Трис-ВСl, рН = 7,5, 100 мМ хло рида магния, 500 мМ хлорида натрия, 10 мМ DTT). Образец нагревают при 65оС в течение 10 мин, инкубируют при комнатной температуре в течение 5 мин и затем помещают на лед. К образцу прибавляют 10 мкл следующе го свежеприготовленного раствора: 20 мМ Трис–HCl, рН = 7,5,10 мМ хлорида магния 10 мМ DTT, 1 мМ diTPS, 1 м М АТР 0,15 ед/мкл Т4-ДНК-лигазы, 0,25 ед/мкл ДНК-полимеразы 1 Е.сol: (фрагмент Klenow). Затем реакционную смесь инкубируют при 15 оС в течение 3 час и образец используют для трансфор мирования E.coli JM101. Результи рующие пятна наносят на нитроцеллюлозу и отбирают гибридизацией на 32Р-меченном ZС249. Сухие фильтры ВА85 (0,45 мкм) наносят на пластинки агара, и фагу позволяют абсорбироваться в течение 5 мин. Фильтры удаляют, сушат в течение 5 мин, помещают на бумагу Ватман 4 ММ, насыщают в 0,5 М NaOH 1,5 М NaCl в те чение 5 мин, сушат на воздухе 3 мин, помещают на бумагу Ватман, насыщают в 1 м Трис–HCl, рН = 8,1, 5 M NaCl в течение 5 мин, сушат на воздухе 3 мин. Стадию с Трис-HCl повторяют и фильтры промывают в 100 мл 6 х SSC в те чение 2 мин при комнатной температуре. После высушивания на воздухе фильтры выдерживают при 80оС в течение 2 час и предгибридизируют при 47оС (Тm – 4 для ZС429) в течение ночи в 6,7 х SSC, рН = 6,5, 2 мг/мл т-РНК Е.coli и 0,2% (вес./объем) каждого из БСА Ficoll и поливинилпирролидина. После предгибридизации фильтры инкубируют при 2,5 х 106 имп/фильтр меченным ZС249 в том же самом буфе ре гибридизации SSC при 47оС в течение ночи. После гибридизации фильтры промывают 3 раза по 5–10 мин при комнатной температуре в 6 х SSC и помещают на рентгеновскую пленку. Пятна с предварительным положительным результатом снова помещают на пластинки и отбирают так, как описано выше. Затем отбирают индивидуальные пятна и получают однонитевую ДНК и секвенти руют с использованием ZС275 в кaчестве праймера. Олигонуклеотид ZС275 соответствует последовательности 40 по в 5'направлении ZС249 в той же самой нити (таблица 1). Идентифи цируют 4 положительных пятна. Полную вставку в М13 mp19 для одного клона (FIX/VII–9) секвентируют ди дезоксиспособом с использованием олигонуклеотидов ZС87 и ZС275 и устанавливают ее правильность. Подтвержденная последовательность представлена основаниями 1–567 на рисун ке 7. Затем PF ДНК из этого клона используют для заключительной стадии конструирования гибридного гена. Используют три фрагмента для изготовления финальной конструкции: фрагмент 0,6 килобазы Hind III – XbaI из FIX/VII–9, содержащий сли тые последовательности FIX/VII; фрагмент к ДНК Фактора VII XbaI– Bam HI длиной 1,7 килобазы из pu CVII1923, и фрагмент 2,7 килобазы Bam HI–Hind III из puC13. 3 мкг (FIX/VII–9 (PF–ДНК) расщепляют при 37оС в течение 6 час с помощью 45 ед. XbaI в объеме 50 мкл ДНК. Осаждают эта нолом, суспендируют и расщепляют при 37оС в те чение 4 час 50 ед. Hind III. Образец подвергают электрофорезу на 1% агарозе и полосу 0,6 килобазы электроэлюируют на бумаге NA 45 (Schlicher J Sсhuell) ДНК. Элюируют из бумаги 1,5 М NaCl 1,50 мМ Трис-HCl рН = 8 1 мМ ЭДТУК, экстрагируют фе нолом и осаждают этанолом. Для получения оставшейся последова тельности к ДНК Фактора VII 5 мкг puCVII1923 расщепляют при 37оС в те чение 3 час 36 ед. XbaI в 40 мкг среднего солевого буфера. Затем прибавляют 8 мкл 10 х крепкого солевого буфе ра, 28 мкл воды и 4 мкл (40 ед) BamHI в реакционную смесь инкубируют при 37оС в течение 3 час. Фрагменты ДНК разделяют электрофорезом в 1% агарозе и выделяют фрагмент 1,7 килобазы, так как описано выше. Фрагмент вектора получают расщеплением 1 мкг puC13 10 ед. Hind III в 20 мкл среднего со левого буфе ра при 37оС в течение 1 час. Затем прибавляют 1 мкл 10 х крепкого солево го буфера и 10 ед Bam HI и инкубирование продолжают еще в течение 2 час. ДНК очищают на 1% агарозном геле так, как описано выше. Эквимолярные количества (приблизительно 0,56 пикомоля) трех фрагментов связывают при комнатной температуре в течение 45 мин в 10 мкл 50 мМ Трис-HCl, рН=7,5, 10 мМ хлорида магния, 1 мМ DTT, 1 мМ АТР и 3 ед. T4- ДНК -лизаны. Реакционную смесь используют для трансформирования E. coli JM83. Клетки помещают на среду, со держащую 40 мкг/мл ампициллина с 50 мкл 2–% X–gal, добавленными в каждую выемку. ДНК получают из 7 белых колоний и затем отбирают расщеплением рестрикционными ферментами. Один из клонов, обнаруживший правильную структуру, обозначается FIX/VII ® puC13. Пример 6: Экспрессия биологически активных аналогов Фактора VII Вектор pD2 экспрессии клеток млекопитающих был выбран для экспрессии гена FIX/VII в трансформированных клетках животных. Его конструируют из плазмиды pD HFR–III следующим образом. Сайт Pet/I, примыкающий к D HFR–к–ДНК puHFR III превращают в сайт BamHI обычным связыванием. ДНК р DHFR III инкубируют с 10 мМ трис с рН = 7,6, 6 мМ b – MSH 6 мМ NaCl, 10 мМ хлорида магния и 2,5 ед. Pst I в течение 10 мин при 37оС с последующей экстракцией фенолом и осаждением этанолом. Липкий конец Pst I затупляют с использованием T4–ДНК-полимеразы. После экстракции фе нолом и диализа против 10 мМ трис-, рН = 8,0, 1 мМ ЭДТУК, 0,3 М NaCl, ДНК, осаждают эта нолом. ДНК суспендируют в 20 мкл 1,4 мМ АТР 50 мМ Трис, рН = =7,6, 10 мМ хлорида магния, 1 мМ дитиореитола и затем инкубируют с 5 нг линкеров BamHI, обработанных T4-полинуклеотидкиназой (New England Biolabl.) и 200 ед. T4-полинуклеотидлигазы в течение 12 час при 12оС с последующей экстракцией фенолом и осажденным этанолом. ДНК расщепляют 90 ед. BamHI при 37оС в течение 1 час и подвергают электрофорезу на 1,4% агарозном теле. Фрагмент ДНК 4,9 килобазы (соответствует ДНК р DHFR III, ли шенной к ДНК DHFR и сигнала полиадениляции SV40) электроэлюируют и рециркулируют с помощью полинуклеотидлигазы, после чего заражают им E. coli HB101. Колонии, чувствительные к ампициллину, отбирают экспресс-анализом, и правильный клон выращи вают для получения большо го количества препарата плазмидной ДНК. Результи рующую плазмиду расщепляют 20 ед. BamHI и обрабатывают 2,5 мкг бычьей кишечной фосфатазы, и подвергают электрофо резу на 1,4% агарозном геле. 25 мкг p SV 40 (клон ДНК SV 40, вве денный в сайт BamHI рВR322) расщепляют 25 ед. Bcl 1 в течение 1 час при 50оС, затем дополнительно 25 ед. BamHI и инкубируют еще в течение 1 час при 37оС. Эту ДНК подвергают электрофорезу на 1,4 % агарозном геле. Расщепленный BamHI вектор (т.е. лишенный сигнала полиадениляции) соединяют с фрагментом ДНК SV 40 (0,14–0,19 единиц карты), содержащим сигнал поздней полиадениляции инкубированием очищенных на геле фрагментов (0,1 мг каждого) в 20 мкл 50 мМ Трис, рН= 7,6, 10 мМ хлористого магния, 1 мМ дитиотреитола, 1,4 мМ АТР и 100 ед. Т4-полинуклеотидлигазы в течение 4 час при 12 оС, с последующим трансфор мирование в Е. соli RRC. Положительные колонии идентифи цируют экспресс-анализом и получают большое количество плазмидного препарата правильной ДНК, рD2. Для изготовления конструкции экспрессии фактора IX/VII, 1 мкг рD2 расщепляют при 37оС в течение 1 час с 20 ед. BamHI в 20 мкл крепкого солевого буфе ра. Добавляют 20 мкл 10 мМ Трис- НСl, рН = 8, 1 мМ ЭДТУК и 0,1 ед бычьей щелочной фосфа тазы (Boeringer). Реакционную смесь инкубируют при 37 оС в течение 1 часа и реакцию обрывают нагревом до 75оС в течение 10 мин 10 мкг FIX/VII puC13. Расщепляют при 37оС в течение 2 час с 150 ед. BamHI в 150 мкл крепкого солевого буфе ра. Фрагменты ДНК разделяют электрофорезом на 1,2 % агарозе и выделяют фрагмент 2,3 килобазы. Эквимолярные количества (0,015 пикомоля) фрагмента BamHI 2,3 килобазы и фрагмента вектора pD2 связывают при 14 С в течение 2,5 час так, как описано выше. Реакционную смесь используют для трансформирования клеток Е. соli RRl, которые затем помещают в сре ду, содержащую 10 мкг/мл ампициллина. Плазмидную ДНК получают из 12 результирующих колоний и отбирают расщеплением рестрикционными ферментами. Один из клонов, имеющий правильную карту рестрикции, обозначается FIX/VII/pD2 (рисунок 6) E. coli RRl, трансформированные FIX/VII/pD2, депонированны в АТСС под номером 53069. Ме тодика, использованная для трансфор мирования клеток почек молодых хомяков (ВНК) (получено из Американской Коллекции типовых Культур, номер ССL10) с помощью FIX/VII/pD2 аналогична стандартным мето дам. Клетки ВНК выращи вают пир 37 оС, 5 % СО2, в среде Дульбекко (с добавлением 10 термоинактивированной бычьей зародышевой сыворотке, глутамина и пенициллина-стрептомицина) в чашке Петри диаметром 60 мм для тканевых культур до заполнения 20%. В целом 10 мкг ДНК используют для заражения одной 60 мм чашки, 3,75 мкг FIX/VII/pD2 2, 1,25 мкг рКО–heo и 5 мкг ДНК из спермы лосося. ДНК осаждают в 0,3 М ацета та натрия, 75% этаноле, промывают 70 % эта нолом и снова растворяют в 20 мкл 10 мМ трис-РСl, рН = 8, 1 мМ ЭДТУК. ДНК соединяют с 440 мкл воды, 500 мкл 250 мМ NaCl, 1,5 мМ NaHPO4 · 12 мМ декстрозой и 50 мМ HEPES рН 7,12, 60 мкл 2 М CaCl2 по каплям добавляют при комнатной температуре в течение 30 мин. Затем раствор прибавляют к клеткам и клетки выдерживают 4 час при 37оС. Среду уда ляют и в течение 2 мин при комнатной температуре прибавляют 5 мл 20 % ДМСО в среде Дульбенко с сывороткой. Затем чашку быстро промывают двумя сменами среды и инкубируют в све жей среде в те чение ночи. Через 24 часа после прибавления ДНК среду уда ляют и прибавляют селективную среду (10 мг/мл G418, 498 мкг/мг, Gibco в среде Дульбекко с сывороткой). Через 10 и 13 дней индивидуальные клоны, представляющие собой клетки, имеющие вве денный рКО-h еоген и вследствие это го устройства к G 418, переносят на пластинки с 96 углублениями (или с 24 углублениями) и выращивают для анализа на белок. Клетки выращи вают в сфере Дульбекко плюс 10% плодной телячьей сыворотки, содержащей 5 мкг/мл витамина К (Phytonadion Merck). Среду о тделяют от клеток и клеточных остатков центрифугированием и анализируют на полипептид Фактора VII (с помощью Е L I S A) и на биологическую активность. Клетки удаляют с пластинок трипсином, промывают све жей средой, центрифуги руют и замораживают при –20оС. Клеточные гранулы затем оттаивают в РВS, гранулируют и суспендируют в PBS, содержащей 0,2 5 % Тритона Х-100. Образцы разбавляют и анализируют на полипептид и активность. Е L I S A–Анализ на Фактор VII проводят следующим образом. 200 мкл моноклонального антитела против че ловеческого Факто ра VII (5 мкл/мл в 0,1 М карбонате натрия, рН = 9,6), инкубируют в каждом углублении микротитровальной пластины с 96 углублениями в течение 2 час при 37оС. Затем углубления инкубируют с 220 мкл 1 % бычьего сывороточного альбумина (БСА) и 0,05 % Tween в РBS рН = 7,2, 2 час при 37оС. Пластинки промывают во дой, сушат на воздухе и хранят при 4оС. Для анализа образцов 200 мкл образца инкубируют 1 час при комнатной температуре в углублениях, покрытых анти телом. Затем углубления промывают 4 раза 200 мкл PBS, содержащего 0,05 Tween 20. Затем углубления инкубируют в течение 1 час при комнатной температуре с 200 мкл IgG фракции кроличьей поликлональной анти сыворотки против Фактора VII (5 мкг/ммл в PBS, содержащем 1 % БСА и 0,05 % Tween 20). Затем проводят инкубирование с козьими антикроличьими IgG вместе с ще лочной фосфа тазой. Эти углубления промывают затем четыре раза PBS, содержащей 0,05% Tween 20. В углубления добавляют 200 мкл пара-нитрофенилфосфа та (30 мг) раство ренного в диэтаноламиновом буфере (96 мл в литре), рН = 9,8, содержащем 56 мг/л хлористого магния. Ферментативную реакцию проводят при 37оС и появление желто го цвета регистрируют при 405 нм с использованием монитора пласти ны E L I S A. Результа ты, полученные для клеточных сред, представлены в таблице 3. Фактор VII, полученный трансфе цированными клетками, может быть извлечен из клеточных культуральных сред путем адсорбции к цитрату бария. Исто щенную среду смешивают с цитратом натрия и хлоридом бария, и преципитат собирают. Осажденное вещество затем можно исследовать на присутствие подхо дяще го коагулирующе го фактора. Дальнейшую очистку можно осуществить посредством иммуноадсорбции. Предпочтительно, что бы иммуноадсорбционная колонка содержала высокоспецифическое моноклональное анти тело. Аль тернативно, очистку ба рий-цитрат-осажденного вещества можно осуществить при помощи более традиционных биохи мических методов или путем высокоэффективной жидкостной хроматографии (ВЭЖХ). D) Конверсию одноцепочечного фактора VII в активный двухцепочечный фактор VIIa можно осуществить с использованием фактора XIIa, что приводит к получению белка, кото рый имеет та кую же или, в основном, такую же биологическую активность относительно коагуляции крови, что и человеческий Фактор VIIa или другие протеазы, имеющие трипсин-подобную специфичность. Биологическую активность Фактора VII анализируют с использованием одноэтапного анализа коагулирующей активности в соответствии с обычными способами. Результаты, полученные для клеточных сред, приведены в Таблице 3. Таблица 3 День Клеток/мл (х10-4) 1 2,9 2,7 1,9 2,8 1,96 2,26 4,71 4,14 8,79 11,28 5,1 8,4 2 3 4 5 6 Полипептид фактора VII (нг/мл) Активность фактора VII, (нг/мл) 25 6,0 47 15,9 160 550 93 300 725 531 975 600 Пример 7. Экспрессия фактора IX 14 мкг FIX (G) puC13 расщепляют 30 ед. BamHI в 30 мкл крепкого солевого буфера в течение 3 час при 37оС. Затем ДНК подвергают электрофо резу на 1 % агарозе и из геля выделяют полосу 1,4 килобазы, содержащую последовательность Факто ра IX. 3 мкг Векто ра рD2 расщеп ляют 30 ед. BamHI в 30 мкл крепкого со лево го буфе ра в те чение 3 час при 37оС. ДНК подвер гают элек трофо резу на 1% а га розе и вы деляют ли нейный фра гмент 1,5 килобазы. За тем ДНК обрабаты вают 0 ,12 ед. бы чьей щелочной фосфа та зы в 30 мкл 10 мМ Трис-HCl с рН = 8 и 1 мМ Э ДТУК в те че ние 30 мин при 37оС. Кон центрацию со ли до водят до 0,3 М аце та та натрия и образец дважды экстраги руют фе нолом, один раз хло рофор мом и осаждают ДНК эта нолом. Оса док промывают 70 % эта нолом, суша т и раство ряют в 20 мкл 10 мМ Трис-HCl , рН=8, 1 м М ЭДТУ К. Экви молярные количества (0,02 пикомоля) двух фра гменто в свя зывают с по мощью 10 ед. Т4– ДНК-ли га зы, как описано вы ше. Реакционн ую смесь используют для трансфор мирования клеток Е. coli RRl. ДНК из 12 резуль тир ующи х устойчи вы х к ампицилли ну колоний отбирают располо жением рестрикционными фермента ми. Один из клонов, с фра гментом 1,4 килобазы, вве ден ным в нужной ориентации, обозначают как FIX/–G//pD2. Клетки E. coli RRl, трансфор мированные FIX/–G//pD2 де понируют в АТСС под номером 53067. Клетки ДНК совместно трансформируют FIX/–G//pD2 и рКО-ео как описано выше. Устойчивые к лекарству клетки выбирают и готовят для анализа E L I S A и активности так, как описано в примере 6. Анализ на биологи ческую активность основан на способности Факто ра IX уменьшать время свертывания плазмы от пациентов с дефи цитом Факто ра IX до нормального значения. Это осуществляют так, как описано Proctor и Rapaport Amer. I. Clin Path, 36: 212, 1961). Результаты предоставлены в таблице 4. Таблица 4 День Клеток/мл (х10-4) 1 2 1,67 2,66 3 9,69 4 14,79 5 50,85 Полипептид фактора IX (нг/мл) Супернатант Осадок – 57 45 150 120 475 225 875 1000 – 20 20 60 60 160 140 250 260 Активность фактора IX (нг/мл) в супернатанте % активности белка в супернатанте – 27 24 72 84 198 150 408 438 – 50% 58% 50% 45% Количество полипептида Фактора IX определяют с помощью E L I S A в основном также, как описано в примере 6, с использованием поликлональной кроличьей анти сыворотки к Факто ру IX. После инкубирования углублений с образцами, содержащи ми Фактора IX, углубления промывают и инкубируют 1 час при комнатной температуре с 200 мкл аффинно очищенного кроличьего поликлонального анти-Фактора IX вместе с ще лочной фосфатазой, с разбавлением 1:1000 в PBS, содержащем 1 % БСА и 0,05 % Tween 20. Затем углубления промывают че тыре раза с PRS, содержащим 0,05 % Tween 20 и прибавляют субстрат фермента так, как описано выше. Инкубирование проводят при 4 оС в течение ночи или 2 час при 37оС. Как показано в таблице 4, 70–80% Фактора IX (полипепти да) выделяется в среду, и приблизительно 50 % этого количества биологически активно. В клеточном осадке активность Фактора IX отсутствует. Наибольшие уровни активности достигаются при прибавлении к клеточной культуральной среде витамина К (фи тонадион, Merek) к концентрации 1–10 мг/мл. Несколько дополнительных анализов проводят для демонстрации того, что клетки вырабатывают аутентичный Фактор IX. Образцы, содержащие по данным описанного выше анализа активность Факто ра IX, инкубируют с плазмой, лишенной Фактора VIII, при этом не наблюдают изменения времени свертывания, и это указывает на то, что активность обусловлена аутентичным Фактором IX, а не неспецифи ческим свертывающим агентом. Этот вывод может быть дополнительно подтвержден удалением активности Фактора IX из образцов с помощью специфического антитела. От 97 % до 98 % активности Фактора IX иммуноосаждается из клеточных супернатантов кроличьм поликлональным анти телом против Фактора IX. Это ан титело также осаждает свы ше 99% активности Фактора IX из нормальной плазмы. Активность Фактора IX не снижается в супернатантах прибавлением кроличьего поликлонального антитела на эритропротеин. Пример 8. Конструирова ние вектора экспрессии Фактора VII. Конструировать вектор экспрессии, содержащий 5'-кодирующий участок синтети ческого Фактора VII, соединенный с частичной к ДНК Факто ра VII. Вектор, обозначенный как рМ 7135, получают вставкой последовательности лидерный участок Фактора VII – 5'-участок Фактора VII из рМ 7115 и 5'-последовательности Фактора VII из FIX/VII/pD2 в плазмиду pD3, содержащую расши ритель SV40 и основной поздний промотор аденовируса 2, а также трехчленный лидерный участок. Плазмиду PD3 получают из плазмиды pDHFR III. Сайт Pst I, расположенный непосредственно выше последовательности DHFR в pDHFR III, превращают в сайт Bcl 1 расщеплением 10 мкг плазмиды 5 ед. Pst 1 в течение 10 мин при 37 оС в 100 мкг буфе ра А (10 мМ Трис, рН=8, 10 мМ хлорида магния, 6 мМ НаCl, 7 мМ b-MSH). ДНК Экстраги руют фе нолом, осаждают этиловым спиртом и суспендируют в 40 мкл буфе ра В (50 мМ Трис рН=8, 7 мМ хлорида магния, 7 мМ b-MSH), со держаще го 10 мМ dCTP и 16 ед. Т4-ДНК-полимеразы и инкубируют при 12оС в течение 60 мин. После осаждения этанолом ДНК связывают с обработанными киназой линкерами Bcl 1 (2,5 мкг) в 14 мкл буфера С (10 мМ Трис рН,8, 10 мМ хлорида магния, 1 мМ DTT, 1,4 мМ АТР), содержащего 400 е. Т4-полинуклеотидлигазы в течение 12 час при 12оС. После экстракции фенолом и осаждения этанолом ДНК суспендируют в 120 мкл буфе ре D/75 мМ КСl, 6 мМ Трис рН=7,5, 10 мМ хло ристый магний, 1 мМ DTT/, расщепляют 80 ед. Всl 1 в течение 60 мин при 50оС и подвергают электрофорезу через агарозу. Форму III плазмидной ДНК (10 мкг) выделяют из геля и связывают в 10 мкл буфера С, содержаще го 50 ед. Т4-полинуклеотидлигазы в течение 2 час при 12оС и используют для трансформирования Е. coli НВ101. Положительные колонии идентифи цируют быстрым ДНК-препаративным анализом и плазмидную ДНК (обозначаемую pDHFR 1) получают из положительных колоний и трансфор мируют в dAM E. coli. Затем получают плазмиду pD2' расщеплением pDHFR' (15 мкг) и p SV40 (25 мкг) в 100 мкл буфера D с 25 ед. Bcl 1 в течение 60 мин при 50оС, с последующим добавлением 50 ед. BamHI и дополнительным инкубированием при 37оС в течение 60 мин. Фрагменты ДНК разделяют электрофорезом на агарозном геле и выделяют 4,9 килобазы фрагмент pDHFR и фрагмент SV40, 0,2 килобазы. Эти фрагменты (200 кг ДНК pDHFR и 100 кг ДНК SV40) инкубируют в 10 мкл буфера С, содержаще го 100 ед. Т4-полинуклеотидлигазы в течение 4 часа при 12оС и результирующую конструкцию (pD2) используют для трансфор мирования Е. соli RRI. Плазмиду pD2 модифи цируют, уда ляя "отравляющие" последова тельности в участке pBR 322 (Lurcky и Botcham. Nature, 293: 79–81, 1981). Плазмиды pD2 (6,6 мкг) и рМ-1 (Lurcky и Botcham, см.) (4 мкг) инкубируют в 50 мкл буфе ра А с 10 ед. каждого из ЕсоRI и NmI в течение 2 час при 37оС, после чего подвергают электрофорезу на агарозном геле. Фрагмент 1,7 килобазы pD2 и фрагмент рМ L-1 1,8 килобазы выделяют и связывают друг с другом (по 50 кг каждого) в 20 мкг буфера С, содержащего 100 ед. Т4-полинуклеотидлигазы в течение 2 час при 12оС и затем трансформируют в Е.соli НВ101. Колонии, содержащие целевую конструкцию (обозначенную DpD2) идентифи цируют быстрым препаративным анализом. Затем 10 мкг DpD2 расщепляют 20 ед. каждого из ЕсоР1 и Bgl 11 в 50 мкл буфе ра А в течение 2 час при 37оС. ДНК подвергают электрофорезу на агарозе и выделяют целевой фрагмент 2,8 килобазы (фрагмент С), содержащий рВР 322, сайт сплайсинга 3' и последова тельности poly A. Для получения остальных фрагментов, используемых для конструи рования pD3, pDHFR III модифицируют для превраще ния сайта Sac II (sst 11) либо в сайт Hind III, либо в сайт Kpn I. Десять мкг pDHFR III расщепляют 20 ед. Est II в течение 2 час при 37 оС, затем экстрагируют фе нолом и осаждают этанолом. Ресуспендированную ДНК инкубируют в 100 мкл буфе ра В, содержащего 10 мМ dCTP и 16 ед. Т4-ДНК-полимеразы в те чение 60 мин при 12оС, экстрагируют фенолом, диализуют и осаждают эта нолом. ДНК (5 мкг) связывают с 50 кг обработанных киназой линкеров Hind III или КР 1 в 20 мкг буфера С, содержащего 400 ед. Т4-ДНК-ли газы, в течение 10 час при 12оС, экстрагируют фе нолом, и осаждают эта нолом. После суспендирования в 50 мкл буфе ра А результи рующие плазмиды расщепляют 50 ед. Hind III или Kpn 1 и подвергают электрофо резу на агарозе. Выделенную из геля ДНК (250 кг) связывают в 30 мкл буфера С, содержаще го 400 ед. Т4-ДНК-лигазы, в течение 4 час при 12 оС, и используют для трансформирования Е.соli РР1. Результи рующие плазмиды обозначают как pDHFR III (Hind III) и pDHFR III (Kpn 1). Затем фрагмент Kpn1– Bgl 11,700 по (фрагмент А), очищают от pDHFR III (Kpn1) расщеплением с помощью Bgl 11 и Kpn1 электрофо резом на агарозном геле. Расширяющую последовательность SV40 вставляют затем в pDHFR III (Hind III) сле дующим образом: 50 мкг ДНК SV40 инкубируют в 120 мкл буфере А с 50 ед. Hind III в течение 2 час при 37оС и фрагмент Hind III с SV40 (5089–968 по) очищают на геле. Плазмиду pDHFR III (Hind III) (10 мкг) обрабатывают 250 кг бычьей кишечной фосфа тазы в течение 1 час при 37оС, экстрагируют фе нолом и осаждают эта нолом. Линеаризованную плазмиду (50 кг) связывают с 250 кг Hind III Crl 40 в 16 мкг буфе ре С в течение 3 час при 12оС, с использованием 200 ед. Т4-полинуклеотидлигазы и трансфор мируют в Е. соli НВ101. Из этой плазмиды выделяют затем фрагмент ЕсоRI–Kpn1 (фрагмент В), 700 пар оснований. Для результирующе го конструирования pD3 фрагменты А и В (по 50 кг каждого) связывают с 10 кг фрагмента С с помощью Т4-полинуклеотидлигазы в течение 4 час при 12оС, и затем трансфор мируют E. coli РР1. Положительные колонии отбирают быстрым препаративным анализом и получают большое количество препарата pD3. Затем констр уи руют вектор экспрессии рМ7135 . Реп ликативную фор му р М7115 расщеп ляют BamHI и Xba I и на ге ле очища ют фра гмент 550 по, содержащий ли дерный уча сток Фактора IX и 5'-последова тель ность Факто ра VII. Плазмиду FIX/VII/pD2 расщеп ляют с по мощью Xba I и BamHI и на ге ле очищают фра гмент, 1700 по, содержащий 3'-участок к-ДНК Факто ра VII. Плазмиду pD3 расщеп ляют BolI, обрабаты вают бычьей щелочной фосфа та зой и соеди няют три фрагмента трой ным связыва нием. Результи рующие конструк ции отби рают на присутствие фра гмента Xba I дли ной 2000 пар оснований. Отбирают плаз миду, имеющую пра вильную ориен та цию, и обозначают ее как р М7135 (ри сунок 8). Пример 9. Экспрессия Фактора VII из клонов к ДНК. Для экспрессии к ДНК Фактора VII, со держащей ли дерную последова тель ность Фактора VII, ДНК из lVII2463 или lVII565 и lVII2463 клонируют в вектор экспрессии, со держащий основной поздний промотор Ad2, расши ритель SV40 , тре хчленную ли дер ную последова тельность Ad2, на бор сплайсинга и полиа дениляционный сигнал SV40 . Это т век тор содержит единствен ную последова тельность EcoPI как сайт к ДНК-вставки. Уста навливают эксп рессию последо ватель ностей из lVII2463 , кодирующей лидерную последова тельность из 60 аминокислот и из lVII565 и lVII2463 , кото рые лише ны кодонов для аминокислот о т -18 до -39 и кодируют ли дерную последо ватель ность дли ной 38 аминокислот. Так как струк тура лидерного участка Факто ра VII иден тифи цируе тся только клонированием к ДНК и так как имеется неясность, обусловленная получе нием двух различных 5'-кон цевы х к ДНК, то авто ры сконструи рова ли также последова тельность ге номной к ДНК Факто ра VII. 3'-У часток lVII2463 (о т сай та Bgl II в экзоне 2 до сайта EcoPI, свя зывающе го 3' с оконча нием (А) соеди няют с субгеномным фрагментом клона 7 1, кодирующим экзоны Ia, Ib и оставшуюся часть экзо на 2. Это т субге номный фра гмент, реконстр уи рован ный как фрагмент ЕсоR I–Bgl III, 4,4 килоба зы, соеди няют с к ДНК lVII2463 и кло нируют в вектор эксп рессии млекопитающи х. Говоря коротко, для конструирования субклона фрагмент ЕсоRI к ДНК Факто ра VII lVII2463 клонируют в сайт ЕсоRI puC13 и обозначают pVII2463. Аналогичным образом вставку к ДНК ЕсоRI lVII565 субклонируют в puC18 и обозначают p VII565. Конструируют гибрид между 5'-участком последовательности Фактора VII клона pVII565 и 3'-сегментом ДНК Фактора VII p VII2463 клонированием наибольшего 5'-фрагмента EcoRI–Bgl II Фактора VII p VII565 и фрагмента Bgl II – Hind III Фактора VII (сайт Hind III в полилинкере pVII2463) pVII2463 в puC18, расщеп ленный EcoRI и Hind III. Эту конструкцию обозначают pVII2397. Вставки pVII2463 и pVII2397 уда ляют расщеплением EcoRI и очищают на геле для вставки в векторы экспрессии в клетках млекопитающи х, как это описано ниже. А. Экспрессия полимерной к ДНК Фактора VII. Экспрессия Фактора VII достигается в векторе pDX. Этот вектор получают из pD3 (описано выше в примере 8) и pD3', вектора, идентичного pD3, за исключением того, что сигнал полиадениляции SV40 (т. е. фрагмент от BamHI SV 40/2533 по до Bcl I/2770 по) находится в поздней ориента ции. Таким образом pD3' содержит сайт BamHI в качество сайта вставки гена. Для получе ния pDX сайт EcoPI в pD3 ' превраща ют в сай т Bcl I расщеп лением EcoRI, инкубированием с нуклеазой S I и связыва нием с линкерами Bcl I. Получают ДНК из положительно идентифи цированной коло нии и получают фра гмент XL01–Pst1, 1,9 кило базы, содержащий из мененный рестрикционный сайт, элек трофо резом на агарозном геле. Во вто рой моди фи кации pD3, расщеп ленный BclI, связывают с обработан ными киназой адапто рами EcoRI–Bcl I (сконструи рованными из олигон уклеоти дов ZС525, 5' GGAATTCT 3' , и ZC526, 5' GATC AGAATTCC 3' для получения сайта EcoRI как положения вставки ге на в вектор экспрессии. Иденти фи цируют положительные колонии рестрикционным анали зом и используют ДНК из них для выде ления фрагмента Xh01–PstI, 2,3 кило базы, содержаще го модифи цированный рестрикционный сайт. Для описанных вы ше фрагмента ДНК инкубируют вместе с Т 4–ДНК-ли газой, трансфор мируют в Е.coli HB101 и по ложитель ные колонии иденти фи цируют рестрикционным анализом. Получают препарат та кой ДНК, названной pDX (ри сунок 12). Эту ДНК расщеп ляют EcoR I и затем инкубируют с бы чьей кише чной фосфо тазой. За тем очи щен ную ДНК ин кубируют с Т 4–ДНК-ли газой и фрагментом к ДНК EcoRI Факто ра VII из p VII2463 или с фрагментом к ДНК EcoРI Факто ра VII из pVII2397 . Рез ульти рующие кло ны обозначают соо тветственно FVII/2463 //pD X и FVII/565+ 2463//pD X (рисунок 12). После трансфор мирова ния в Е.соli М83 и последующе го иден тифи цирова ния рестрикционным анализом получают пре параты плазмидной ДНК и проверяют уси ленным рестрикционным расщеп лением эндонуклеазами. Плазмиды FVII/2463/pD X и FVII/565+2463//pD X де понир уют в Коллекцию к уль тур аме риканского ти па под номером соответствен но 40206 и 40205. Каждую из FVII/2463//pDX и FVII565+ +2463//pDX /10 мкг каждой/ используют для тран сфор мирования, вместе с 10 мкг несущей ДН К из спермы лосося, либо клеток ВНК tk-t13 /Fleros и др., Exper. Cell. Res, 132: 215–223, 1981), ли бо клеток СOS, с использова нием стандартного осаждения фосфа та кальция. После заражения клетки культи вируют в подхо дящей сре де, со держащей 5 мкг/мл вита мина К, в те чение 2 дней. В это время супернатан ты анализируют на EL I PA-по ложитель ные соединения с использова нием моноклонального ан тите ла проти в Фак тора VII. Как FVII/2463 //pD X, так и FVII565+2463 //pD X при во дят к выработке полипепти да Факто ра VII, обнаруживае мого в супернатанте клеток COS, а в супернатанте кле ток ВНК обнаруживается Факто -ра VII в ре зульта те вве дения FVII– 565+2463//pD X. Sham Трансфор мированные клетки ВНК или COS не вырабаты вают заметных количеств Фак тора VII (таблица 5). Явная экспрессия фактора VII наблюдается также у нескольких других линий клеток, перечисленных таблице 6. Таблица 5. ДНК Линия клеток ELIS A-положительное соединение (нг/мл культуральной среды) СOS COS COS ВНК ВНК ВНК FVII(2463)/pDX FVII(565+2463)/pDX Контроль FVII(2463)/pDX FVII(565+2463)/pDX Контроль Число клеток 2 х 106 2 х 106 2 х 106 9 х 106 9 х 106 9 х 106 15 12 2 62 6
ДивитисяДодаткова інформація
Назва патенту англійськоюThe method for obtaining of the protein, having activity in blood coagulation, mediated by the factor vii
Автори англійськоюKheijen Frederick S., Murrey Mark J., Basbi Sharon J., Berkner Kathleen L., Insli Margareth I., Woodbery Richard G.., Grey Charles L.
Назва патенту російськоюСпособ получения белка, имеющего опосредованную фактором vii активность в свертывании крови
Автори російськоюХейджен Фредерик С., Муррей Марк Дж., Басби Шарон Дж., Беркнер Кетлин Л., Инсли Маргарет И., Вудбери Ричард Г., Грей Чарлз Л.
МПК / Мітки
МПК: C12N 15/70, C12N 9/64, C12N 15/12, C12P 21/02
Мітки: згортанні, фактором, спосіб, активність, отримання, білка, крові, має, опосередковану
Код посилання
<a href="https://ua.patents.su/44-27262-sposib-otrimannya-bilka-yakijj-maeh-oposeredkovanu-faktorom-vii-aktivnist-u-zgortanni-krovi.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання білка, який має опосередковану фактором vii активність у згортанні крові</a>
Попередній патент: Спосіб контролю печатних плат з протилежних боків та машина для його здійснення
Наступний патент: Фармакологічно активні похідні катехіну
Випадковий патент: Консервований паштет із м`яса індиків