Похідні оксадіазолу та їх застосування як позитивних алостеричних модуляторів метаботропних глутаматних рецепторів
Номер патенту: 92496
Опубліковано: 10.11.2010
Автори: Гагліарді Стефанія, Паломбі Джованні, Мютєл Венсан, Бугада П'єргіуліано, Льо Пул Емманюел, Роше Жан-Філіп
Формула / Реферат
1. Сполука загальної формули І:
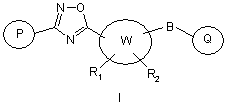 ,
,
де
W являє собою (С5-С7)циклоалкільне, (С3-С7)гетероциклоалкільне, (С3-С7)гетероциклоалкіл-(С1-С3)алкільне або (С3-С7)гетероциклоалкенільне кільце;
R1 й R2 незалежно один від одного являють собою водень, -(С1-С6)алкіл, -(С2-С6)алкеніл, -(С2-С6)алкініл, арилалкіл, гетероарилалкіл, гідроксил, аміногрупу, аміноалкіл, гідроксіалкіл, -(С1-С6)алкоксил, або R1 й R2 разом можуть утворювати (С3-С7)циклоалкільне кільце, карбонільний зв'язок С=О або вуглець-вуглецевий подвійний зв'язок;
Р й Q незалежно один від одного являють собою циклоалкільну, гетероциклоалкільну, арильну або гетероарильну групу формули:
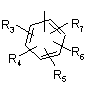 ,
,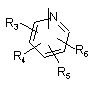 ,
,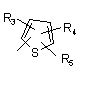 ,
,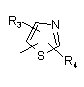 ,
,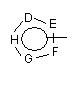 ;
;
R3, R4, R5, R6 і R7 незалежно один від одного являють собою: водень, галоген, -NO2, -(С1-С6)алкіл, -(С3-С6)циклоалкіл, -(С3-С7)циклоалкілалкіл, -(С2-С6)алкеніл, -(С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9, NR8CO2R9, NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(=O)-O-R8, -C(=O)NR8R9, -C(-NR8)R9 або -C(=NOR8)R9; при цьому, можливо, два замісники разом з атомами, що знаходяться між ними, утворюють біциклічне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце, можливо, додатково несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, -О-(С0-С6)алкіл, -О-(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -О-(С1-С3)алкіларил, -О-(С1-С3)алкілгетероарил, -N((-С0-С6)алкіл)((С0-С3)алкіларил) або -N((С0-С6)алкіл)((С0-С3)алкілгетероарил);
R8, R9, R10 незалежно один від одного являють собою: водень, (С1-С6)алкіл, (С3-С6)циклоалкіл, (С3-С7)циклоалкілалкіл, (С2-С6)алкеніл, (С2-C6)алкініл, галоген-(С1-С6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, -О-(С0-С6)алкіл, -О-(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -N((С0-С6)алкіл)2, -N((С0-С6)алкіл)((С3-С7)циклоалкіл) або -N((C0-С6)алкіл)(арил);
D, Е, F, G і Н незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-, -C(=O)-, -C(=S)-, -О-, -N=, -N(R3)- або -S-;
В являє собою одинарний зв'язок, -С(=О)-(С0-С2)алкіл-, -С(=О)-(С2-С6)алкеніл-, -С(=О)-(С2-С6)алкініл-, -С(=О)-О-, -C(=O)NR8-(C0-C2)aлкіл-, -C(=NR8)NR9-S(=O)-(С0-С2)алкіл-, -S(=О)2-(С0-С2)алкіл-, -S(=O)2NR8-(C0-C2)aлкiл-, C(=NR8)-(C0-C2)алкіл-, -C(=NOR8)-(С0-С2)алкіл- або -C(=NOR8)NR9-(C0-C2)aлкiл-;
R8 і R9 незалежно один від одного являють собою групи, визначені вище;
будь-який N може являти собою N-оксид;
або фармацевтично прийнятні солі, гідрати або сольвати зазначеної сполуки;
при цьому виключені наступні сполуки:
(3-(3-(4-бутоксифеніл)-1,2,4-оксадіазол-5-іл)піперидин-1-іл)(2-хлорпіридин-4-іл)-метанон;
(S)-(4-фторфеніл)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(S)-(тіофен-2-іл)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(4-метил-2-піразин-2-ілтіазол-5-іл)-метанон;
(2,4-дифторфеніл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(3,4,5-трифторфеніл)-метанон;
{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-(5-піридин-2-ілтіофен-2-іл)-метанон;
циклопентил-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(3,4-дифторфеніл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
бензотіазол-6-іл-{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(3,5-диметилізоксазол-4-іл)-{(5)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(4-фторфеніл)-{(S)-3-[3-(2,4,6-трифторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(4-фторфеніл)-[(S)-3-(3-піридин-3-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон;
(4-фторфеніл)-[(S)-3-(3-піридин-4-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон;
{(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(4-фторфеніл)-метанон;
(4-фторфеніл)-[(S)-3-(3-р-толіл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон;
(4-фторфеніл)-{(S)-3-[3-(2-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(4-фторфеніл)-[(S)-3-(3-піридин-2-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон;
(2-фторфеніл)-{(S)-3-[2-(3,4-дифторфеніл)-1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(4-фторфеніл)-{2-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-морфолін-4-іл}-метанон;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-тіофен-3-ілметанон;
(4-фторфеніл)-[(S)-3-(3-феніл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон;
(3,4-дифторфеніл)-[(S)-3-(3-феніл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон;
{3-[3-(4-метоксифеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-фенілметанон;
{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-фенілметанон;
(4-фторфеніл)-[3-(3-феніл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон;
(3-фторфеніл)-[3-(3-феніл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон;
(4-фторфеніл)-{3-[3-(3-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(3-фторфеніл)-{3-[3-(3-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(4-фторфеніл)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(3-фторфеніл)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(R)-(4-фторфеніл)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(2-фенілтіазол-4-іл)-метанон;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(2-метил-6-трифторметилпіридин-3-іл)-метанон;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-[1,2,3]тіадіазол-4-ілметанон;
бензотіазол-2-іл-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(5-метилізоксазол-3-іл)-метанон;
(1,5-диметил-1H-піразол-3-іл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(4-трифторметилфеніл)-метанон;
4-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-карбоніл}-бензонітрил;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-ізоксазол-5-ілметанон;
(3-хлор-4-фторфеніл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(2-феніл-2Н-піразол-3-іл)-метанон;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(5-метил-2-феніл-2Н-[1,2,3]триазол-4-іл)-метанон;
(4-фтор-3-метилфеніл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-(3-метилтіофен-2-іл)-метанон;
{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-(1-метил-1Н-пірол-2-іл)-метанон;
{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-тіазол-2-ілметанон;
{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-(4-метилтіазол-5-іл)-метанон;
{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-(6-морфолін-4-ілпіридин-3-іл)-метанон;
{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-(1Н-індол-5-іл)-метанон;
2-(4-фторфеніл)-1-{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-етанон;
3-(4-фторфеніл)-1-{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-пропан-1-он;
{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-ізохінолін-3-ілметанон;
{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-хіноксалін-6-ілметанон;
{(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]-піперидин-1-іл}-бензоімідазол-6-ілметанон;
(4-фторфеніл)-[(S)-3-(3-нафт-1-ил-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон;
{(S)-3-[3-(2,6-дифторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(4-фторфеніл)-метанон;
(4-фторфеніл)-{(S)-3-[3-(2-метоксифеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(4-фторфеніл)-[(S)-3-(3-нафт-2-ил-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон;
(4-фторфеніл)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-4-метилпіперазин-1-іл}-метанон;
(Е)-3-(4-фторфеніл)-1-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-пропенон;
1-(4-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-карбоніл}-піперидин-1-іл)-етанон;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(4-імідазол-1-ілфеніл)-метанон;
(4-фторфеніл)-{(S)-3-[3-(4-нітрофеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон;
(3,4-дифторфеніл)-{(S)-3-[3-(4-нітрофеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон. 2. Сполука за п. 1, що має формулу 1-А
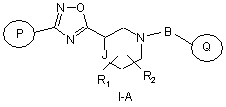 ,
,
де:
R1 і R2 незалежно один від одного являють собою водень, -(С1-С6)алкіл, -(С2-С6)алкеніл, -(С2-С6)алкініл, арилалкіл, гетероарилалкіл, гідроксил, аміногрупу, аміноалкіл, гідроксіалкіл, -(С1-С6)алкоксил, або R1 й R2 разом можуть утворювати (С3-С7)циклоалкільне кільце, карбонільний зв'язок С=О або вуглець-вуглецевий подвійний зв'язок;
Р й Q незалежно один від одного вибирають із циклоалкільної, гетероциклоалкільної, арильної або гетероарильної групи формули
 ,
,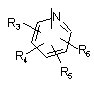 ,
,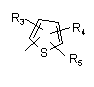 ,
,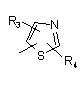 ,
,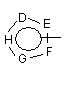 ;
;
R3, R4, R5, R6 і R7 незалежно один від одного являють собою: водень, галоген, -NO2, -(С1-С6)алкіл, -(С3-С6)циклоалкіл, -(С3-С7)циклоалкілалкіл, -(С2-С6)алкеніл, -(С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9, NR8CO2R9, NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(=O)-O-R8, -C(=O)NR8R9, -C(=NR8)R9 або C(=NOR8)R9; при цьому, можливо, два замісники разом з атомами, що знаходяться між ними, утворюють біциклічне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце, можливо, додатково несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, -О-(С0-С6)алкіл, -О-(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -О-(С1-С3)алкіларил, -О-(С1-С3)алкілгетероарил, -N((-С0-С6)алкіл)((С0-С3)алкіларил) або -N((C0-С6)алкіл)((С0-С3)алкілгетероарил);
кожен з R8, R9, R10 незалежно один від одного являє собою: водень, (С1-С6)алкіл, (С3-С6)циклоалкіл, (С3-С7)циклоалкілалкіл, (С2-С6)алкеніл, (С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, несе заміщення 1-5 незалежними групами, кожна з яких являє собою: галоген, -CN, -(С1-С6)алкіл, -О-(С0-С6)алкіл, -О-(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -N((С0-С6)алкіл)2, -N((С0-С6)алкіл)((С3-С7)циклоалкіл) або -N((C0-С6)алкіл)(арил);
D, Е, F, G і Н незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-, -C(=O)-, -C(=S)-, -О-, -N=, -N(R3)- або -S-;
В являє собою одинарний зв'язок, -C(=O)-(C0-C2)алкіл-, -С(=О)-(С2-С6)алкеніл-, -С(=О)-(С2-С6)алкініл-, -С(=О)-О-, -C(=O)NR8-(C0-C2)алкіл-, -C(=NR8)NR9-S(=O)-(C0-C2)алкіл-, -S(=О)2-(С0-С2)алкіл-, -S(=O)2NR8-(С0-C2)алкіл-, C(=NR8)-(C0-C2)алкіл-, -C(=NOR8)-(С0-С2)алкіл- або -C(=NOR8)NR9-(С0-C2)алкіл-;
R8 і R9 незалежно один від одного являють собою групи, що визначені вище;
J являє собою одинарний зв'язок, -C(R11)(R12), -О-, -N(R11)- або -S-;
R11, R12 незалежно один від одного являють собою водень, -(С1-С6)алкіл, -(С3-С6)циклоалкіл, -(С3-С7)циклоалкілалкіл, -(С2-С6)алкеніл, -(С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, -О(С0-С6)алкіл, -О(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -N((С0-С6)алкіл)((С0-С6)алкіл), -N((С0-С6)алкіл)((С3-С7)циклоалкіл) або -N((C0-С6)алкіл)(арил);
будь-який N може являти собою N-оксид;
або фармацевтично прийнятні солі, гідрати або сольвати зазначеної сполуки.
3. Сполука за п. 1 або 2, яка має формулу І-В
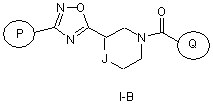 ,
,
де:
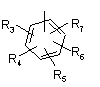
Р і Q незалежно один від одного являють собою циклоалкільну, гетероциклоалкільну, арильну або гетероарильну групу, що має формулу:
 ,
,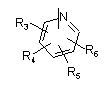 ,
,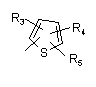 ,
,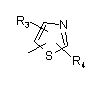 ,
,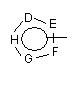 ,
,
R3, R4, R5, R6 і R7 незалежно один від одного являють собою наступні замісники: водень, галоген, -NO2, -(С1-С6)алкіл, -(С3-С6)циклоалкіл, -(С3-С7)циклоалкілалкіл, -(С2-С6)алкеніл, -(С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9, NR8CO2R9, NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(=O)-O-R8, -C(=O)NR8R9, -C(=NR8)R9 або C(=NOR8)R9; при цьому, можливо, два замісники разом з атомами, що знаходяться між ними, утворюють біциклічне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце, можливо, додатково несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, -О-(С0-С6)алкіл, -О-(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -О-(-С1-С3)алкіларил, -О-(С1-С3)алкілгетероарил, -N((-С0-С6)алкіл)((С0-С3)алкіларил) або -N((С0-С6)алкіл)((С0-С3-)алкілгетероарил);
R8, R9, R10 незалежно один від одного являють собою: водень, (С1-С6)алкіл, (С3-С6)циклоалкіл, (С3-С7)циклоалкілалкіл, (С2-С6)алкеніл, (С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, -О-(С0-С6)алкіл, -О-(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -N((С0-С6)алкіл)2, -N((С0-С6)алкіл)((С3-С7)циклоалкіл) або -N((С0-С6)алкіл)(арил);
D, Е, F, G й Н незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-, -C(=O)-, -C(=S)-, -О-, -N=, -N(R3)- або -S-;
J являє собою одинарний зв'язок, -C(R11)(R12), -О-, -N(R11)- або -S-;
R11, R12 незалежно один від одного являють собою водень, -(С1-С6)алкіл, -(С3-С6)циклоалкіл, -(С3-С7)циклоалкілалкіл, -(С2-С6)алкеніл, -(С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, -O(С0-С6)алкіл, -О(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -N((С0-С6)алкіл)((С0-С6)алкіл), -N((С0-С6)алкіл)((С3-С7)циклоалкіл) або -N((С0-С6)алкіл)(арил);
будь-який N може являти собою N-оксид;
або фармацевтично прийнятні солі, гідрати або сольвати зазначеної сполуки.
4. Сполука за будь-яким з пунктів з 1 по 3, що може існувати у виді оптичних ізомерів, причому зазначена сполука являє собою або рацемічну суміш, або індивідуальний оптичний ізомер.
5. Сполука за будь-яким з пунктів з 1 по 4, яка відрізняється тим, що зазначену сполуку вибирають з:
(4-фторфеніл)-{5-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-3,6-дигідро-2Н-піридин-1-іл}-метанону;
(4-фторфеніл)-{2-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-ілметил]-піролідин-1-іл}-метанону;
2-фтор-5-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-карбоніл}-бензонітрилу;
(S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(3-метилізоксазол-4-іл)-метанону;
(S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(3-феноксиметилфеніл)-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(тетрагідротіопіран-4-іл)-метанону;
(5-фторіндан-1-іл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(тетрагідропіран-4-іл)-метанону;
циклогексил-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(3-бензоїлфеніл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(2,4,6-трифторфеніл)-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(4-метил-[1,2,3]тіадіазол-5-іл)-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(2-фторпіридин-3-іл)-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-піридин-2-ілметанону гідро хлориду;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(2-метилпіридин-3-іл)-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(1,2,5-триметил-1H-пірол-3-іл)-метанону;
(2,4-диметилтіазол-5-іл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-о-толілметанону;
(2-етилфеніл)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(1,5-диметил-1Н-піразол-4-іл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-фуран-3-ілметанону;
(2,5-диметилфуран-3-іл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(2-метилфуран-3-іл)-метанону;
(S)-(2,3-дигідробензо[1,4]діоксин-5-іл)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(S)-(4-фтор-3-метоксифеніл)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(3-метилпіридин-4-іл)-метанону;
(S)-(2-бромтіофен-3-іл)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону;
(S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(3-метилфуран-2-іл)-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(3-метокситіофен-2-іл)-метанону;
(4-фтор-2-метилфеніл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(4-фторфеніл)-{(S)-3-[3-(6-метилпиридин-2-іл)-[1,2,4]оксадиазол-5-іл]-піперидин-1-іл}-метанону
(4-фторфеніл)-{(S)-3-[3-(5-метилфуран-2-іл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(4-фторфеніл)-[(S)-3-(3-фуран-2-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(2-метилтіофен-3-іл)-метанону;
(4-фторфеніл)-[(S)-3-(3-тіофен-2-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(4-фторфеніл)-[(S)-3-(3-тіофен-3-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(4-фторфеніл)-{(S)-3-[3-(1-метил-1Н-пірол-2-іл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(4-фторфеніл)-{(S)-3-[3-(3-метилпіридин-2-іл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(3-трифторметил-1Н-піразол-4-іл)-метанону;
(4-фтор-2-метиламінофеніл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(4-метил-1Н-пірол-3-іл)-метанону;
(5-метилізоксазол-4-іл)-[(S)-3-(3-тіофен-3-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(3,4-дифторфеніл)-[(S)-3-(3-тіофен-3-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(5-етилізоксазол-4-іл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(5-метоксиметилізоксазол-4-іл)-метанону;
(4-фторфеніл)-[(S)-3-(3-о-толіл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(2-метиламінофеніл)-метанону;
(4-фторфеніл)-[(S)-3-(3-тіазол-4-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(3,4-дифторфеніл)-[(S)-3-(3-тіазол-4-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(3,4-дифторфеніл)-[(S)-3-(3-піридин-4-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(4-фтор-2-метилфеніл)-[(S)-3-(3-піридин-4-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(3,4-дифторфеніл)-[(S)-3-(3-піридин-2-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(2-бензиламінофеніл)-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(5-метилізоксазол-4-іл)-[(S)-3-(3-феніл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(4-фторфеніл)-[(S)-3-(3-піразин-2-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
{(S)-3-[3-(4-диметиламінофеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(4-фторфеніл)-метанону;
(2,4-дифторфеніл)-[(S)-3-(3-феніл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(2,4-дифторфеніл)-{(S)-3-[3-(2-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
{(S)-3-[3-(2-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону;
(6-фторпіридин-3-іл)-[(S)-3-(3-феніл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(4-фтор-2-метилфеніл)-[(S)-3-(3-феніл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
{(S)-3-[3-(2-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону;
{(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону;
{(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону;
{(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(4-фтор-2-метилфеніл)-метанону;
(3,4-дифторфеніл)-{(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(2,4-дифторфеніл)-{(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(2,4-дифторфеніл)-[(S)-3-(3-піридин-2-іл-[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону;
(4-фтор-2-метилфеніл)-{(S)-3-[3-(2-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(4-фторфеніл)-{(S)-3-[3-(2-метилтіазол-5-іл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(6-фторпіридин-3-іл)-{(S)-3-[3-(2-метилтіазол-5-іл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(2,4-дифторфеніл)-{(S)-3-[3-(2-метилтіазол-5-іл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
(3,4-дифторфеніл)-{(S)-3-[3-(2-метилтіазол-5-іл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(4-трифторметоксифеніл)-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(2-фторпіридин-4-іл)-метанону;
{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-(3-фторпіридин-4-іл)-метанону.
6. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-5 і фармацевтично прийнятний носій та/або наповнювач.
7. Спосіб лікування або запобігання стану в ссавця, включаючи людину, причому лікуванню або запобіганню зазначеному стану сприяє або на нього впливає нейромодуляторна дія алостеричних модуляторів mGluR5, який включає введення ссавцеві, що має потребу в зазначеному лікуванні або запобіганні, ефективної кількості сполуки або композиції за будь-яким з пп. 1-6.
8. Спосіб лікування або запобігання стану в ссавця, включаючи людину, причому лікуванню або запобіганню зазначеному стану сприяє або на нього впливає нейромодуляторна дія позитивного алостерического модулятора mGluR5, що виступає у ролі підсилюючого агента, причому зазначений спосіб включає введення ссавцеві, що має потребу в зазначеному лікуванні або запобіганні, ефективної кількості сполуки або композиції за будь-яким з пп. 1-6.
9. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає тривожні розлади: агорафобію, генералізований тривожний розлад (ГТР), обсесивно-компульсивний розлад (ОКР), панічний розлад, посттравматичний стресовий розлад (ПТСР), соціофобію, інші фобії, тривожний розлад, пов'язаний з уживанням психоактивних речовин, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6.
10. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає розлад в дітей: синдром дефіциту уваги з гіперактивністю, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6.
11. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає розлад харчової поведінки: нервову анорексію, нервову булімію, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6.
12. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає розлад настрою: біполярні розлади (типу І і II), циклотимічний розлад, депресію, дистимічний розлад, великий депресивний розлад, розлад настрою, пов'язаний із вживанням психоактивних препаратів, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6.
13. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає психотичні розлади: шизофренію, маревний розлад, шизоафективний розлад, шизофреноформний розлад, психотичний розлад, пов'язаний із вживанням психоактивних речовин, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6.
14. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає когнітивні розлади: делірій, персистуючий делірій, пов'язаний із вживанням психоактивних речовин, деменцію, деменцію, викликану ВІЛ, деменцію, викликану хореєю Гентінгтона, деменцію, викликану хворобою Паркінсона, деменцію типу Альцгеймера, персистуючу деменцію, пов'язану із вживанням психоактивних речовин, помірні когнітивні порушення, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6.
15. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає розлади особистості: обсесивно-компульсивний розлад особистості, шизоїдний розлад особистості, шизотипальний розлад особистості, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6.
16. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає розлади, пов'язані із вживанням психоактивних речовин: зловживання алкоголем, алкогольну залежність, алкогольну абстиненцію, синдром відміни алкоголю з делірієм, алкогольний психотичний розлад, амфетамінову залежність, амфетамінову абстиненцію, кокаїнову залежність, кокаїнову абстиненцію, нікотинову залежність, нікотинову абстиненцію, опіоїдну залежність, опіоїдну абстиненцію, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6.
17. Спосіб лікування або запобігання запальному захворюванню центральної нервової системи, вибраному з форм розсіяного склерозу, таких як доброякісний розсіяний склероз, ремітуючий розсіяний склероз, вторинно прогресуючий розсіяний склероз, первинно прогресуючий розсіяний склероз, рецидивуючий розсіяний склероз, який включає введення ефективної кількості сполуки або композиції за будь-якимз пп. 1-6.
18. Застосування сполуки за будь-яким з пп. 1-5 для виробництва ліків для лікування або запобігання захворюванню або стану, зазначеному в будь-якому з пп. 9-17.
19. Застосування композиції за п. 6 для виробництва ліків для лікування або запобігання захворюванню або стану, зазначеному в будь-якому з пп. 9-17.
20. Застосування сполуки за будь-яким з пп. 1-5 для готування мітки для одержання зображень метаботропних глутаматних рецепторів.
Текст
1. Сполука загальної формули І: N O (19) (21) a200714073 (22) 17.05.2006 (24) 10.11.2010 (86) PCT/IB2006/001674, 17.05.2006 (31) 0510142.3 (32) 18.05.2005 (33) GB (46) 10.11.2010, Бюл.№ 21, 2010 р. (72) БУГАДА П'ЄРГІУЛІАНО, IT, ГАГЛІАРДІ СТЕФАНІЯ, IT, ЛЬО ПУЛ ЕММАНЮЕЛ, CH, МЮТЄЛ ВЕНСАН, CH, ПАЛОМБІ ДЖОВАННІ, IT, РОШЕ ЖАН-ФІЛІП, CH (73) АДДЕКС ФАРМА СА, CH (56) WO03002559 A 09.01.2003 WO0020390 A 13.04.2000 DATABASE ZREGISTRY [Online] CHEMICAL ABSTRACT SERVICE, COLUMBUS, OHIO, USA; 23 January 2001 (2001-01-23), XP002401647 retrieved from STN Database accession no. RN - 316182-88-4 DATABASE ZREGISTRY [Online] CHEMICAL ABSTRACT SERVICE, COLUMBUS, OHIO, USA; 23 January 2001 (2001-01-23), XP002402787 retrieved from STN Database accession no. RN - 316182-51-1 DATABASE ZREGISTRY [Online] CHEMICAL ABSTRACT SERVICE, COLUMBUS, OHIO, USA; 23 January 2001 (2001-01-23), XP002402788 retrieved from STN Database accession no. RN - 316182-40-8 DATABASE ZREGISTRY [Online] CHEMICAL ABSTRACT SERVICE, COLUMBUS, OHIO, USA; 23 January 2001 (2001-01-23), XP002402789 retrieved from STN Database accession no. RN - 316182-52-2 DATABASE CHEMCATS [Online] CHEMICAL ABSTRACT SERVICE, COLUMBUS, OHIO, US; XP002401648 retrieved from STN & "COMGENEX PRODUCT LIST" 15 April 2005 (2005-04-15), COMGENEX INTERNATIONAL INC , PRINCETON CORPORATE PLAZA IV, 11 DEER PARK DRIVE, STE 210, MONMOUTH, NJ, 08852, USA DATABASE CHEMCATS [Online] CHEMICAL ABSTRACT SERVICE, COLUMBUS, OHIO, US; XP002401649 retrieved from STN & "INTERCHIM INTERMEDIATES" 18 January 2005 (2005-01-18), 2 (13) 1 R4 4 3 R3R3 R7R7 R3R3 R6R6 R4R4 RR3 R3 3 RR6 R6 6 RR5 R5 5 RR5 R5 5 RR3 R3 3 , R3R3 R6R6 R5R5 , RR4 R4 4 SS S NN R4R4 R5R5 NN N 92496 NN N SS RR S R4 4 4 R4R4 S S R5R5 , DD EE D E HH H FF F GG G , ; R3, R4, R5, R6 і R7 незалежно один від одного являють собою: водень, галоген, -NO2, -(С1-С6)алкіл, -(С3С6)циклоалкіл, -(С3-С7)циклоалкілалкіл, -(С2С6)алкеніл, -(С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9, NR8CO2R9, NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, S(=O)2NR8R9, -C(=O)R8, -C(=O)-O-R8, -C(=O)NR8R9, C(-NR8)R9 або -C(=NOR 8 )R 9 ; при цьому, можливо, два замісники разом з атомами, що знаходяться між ними, утворюють біциклічне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце, можливо, додатково несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, -О-(С0С6)алкіл, -О-(С3-С7)циклоалкілалкіл, -О(арил), О(гетероарил), -О-(С1-С3)алкіларил, -О-(С1С3)алкілгетероарил, -N((-С0-С6)алкіл)((С0С3)алкіларил) або -N((С0-С6)алкіл)((С0С3)алкілгетероарил); R8, R9, R10 незалежно один від одного являють собою: водень, (С1-С6)алкіл, (С3-С6)циклоалкіл, (С3С7)циклоалкілалкіл, (С2-С6)алкеніл, (С2-C6)алкініл, галоген-(С1-С6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1С6)алкіл, -О-(С0-С6)алкіл, -О-(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -N((С0-С6)алкіл)2, -N((С0С6)алкіл)((С3-С7)циклоалкіл) або -N((C0С6)алкіл)(арил); D, Е, F, G і Н незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-, -C(=O)-, -C(=S)-, -О-, N=, -N(R3)- або -S-; В являє собою одинарний зв'язок, -С(=О)-(С0С2)алкіл-, -С(=О)-(С2-С6)алкеніл-, -С(=О)-(С2С6)алкініл-, -С(=О)-О-, -C(=O)NR8-(C0-C2)aлкіл-, C(=NR8)NR9-S(=O)-(С0-С2)алкіл-, -S(=О)2-(С0-С2)алкіл, -S(=O)2NR8-(C0-C2)aлкiл-, C(=NR8)-(C0-C2)алкіл-, C(=NOR8)-(С0-С2)алкілабо -C(=NOR8)NR9-(C0C2)aлкiл-; R8 і R9 незалежно один від одного являють собою групи, визначені вище; будь-який N може являти собою N-оксид; або фармацевтично прийнятні солі, гідрати або сольвати зазначеної сполуки; при цьому виключені наступні сполуки: (3-(3-(4-бутоксифеніл)-1,2,4-оксадіазол-5іл)піперидин-1-іл)(2-хлорпіридин-4-іл)-метанон; (S)-(4-фторфеніл)-{3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; (S)-(тіофен-2-іл)-{3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; 4 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]D DE E R3Rпіперидин-1-іл}-(4-метил-2-піразин-2-ілтіазол-5-іл)3 NN метанон; HH (2,4-дифторфеніл)-{(S)-3-[3-(4-фторфеніл)F F S S RR GG [1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; 4 4 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(3,4,5-трифторфеніл)-метанон; {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]піперидин-1-іл}-(5-піридин-2-ілтіофен-2-іл)-метанон; циклопентил-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; (3,4-дифторфеніл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; бензотіазол-6-іл-{(S)-3-[3-(4-фторфеніл)-1,2,4оксадіазол-5-іл]-піперидин-1-іл}-метанон; (3,5-диметилізоксазол-4-іл)-{(5)-3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; (4-фторфеніл)-{(S)-3-[3-(2,4,6-трифторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; (4-фторфеніл)-[(S)-3-(3-піридин-3-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон; (4-фторфеніл)-[(S)-3-(3-піридин-4-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон; {(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(4-фторфеніл)-метанон; (4-фторфеніл)-[(S)-3-(3-р-толіл-[1,2,4]оксадіазол-5іл)-піперидин-1-іл]-метанон; (4-фторфеніл)-{(S)-3-[3-(2-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; (4-фторфеніл)-[(S)-3-(3-піридин-2-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон; (2-фторфеніл)-{(S)-3-[2-(3,4-дифторфеніл)1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; (4-фторфеніл)-{2-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-морфолін-4-іл}-метанон; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-тіофен-3-ілметанон; (4-фторфеніл)-[(S)-3-(3-феніл-[1,2,4]оксадіазол-5іл)-піперидин-1-іл]-метанон; (3,4-дифторфеніл)-[(S)-3-(3-феніл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон; {3-[3-(4-метоксифеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-фенілметанон; {3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-фенілметанон; (4-фторфеніл)-[3-(3-феніл-[1,2,4]оксадіазол-5-іл)піперидин-1-іл]-метанон; (3-фторфеніл)-[3-(3-феніл-[1,2,4]оксадіазол-5-іл)піперидин-1-іл]-метанон; (4-фторфеніл)-{3-[3-(3-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; (3-фторфеніл)-{3-[3-(3-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; (4-фторфеніл)-{3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; (3-фторфеніл)-{3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; (R)-(4-фторфеніл)-{3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(2-фенілтіазол-4-іл)-метанон; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(2-метил-6-трифторметилпіридин-3іл)-метанон; 5 92496 6 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл](4-фторфеніл)-{(S)-3-[3-(4-нітрофеніл)піперидин-1-іл}-[1,2,3]тіадіазол-4-ілметанон; [1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; бензотіазол-2-іл-{(S)-3-[3-(4-фторфеніл)(3,4-дифторфеніл)-{(S)-3-[3-(4-нітрофеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; [1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон. 2. {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]Сполука за п. 1, що має формулу 1-А піперидин-1-іл}-(5-метилізоксазол-3-іл)-метанон; N O (1,5-диметил-1H-піразол-3-іл)-{(S)-3-[3-(4B P фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}N N Q метанон; J {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]R2 піперидин-1-іл}-(4-трифторметилфеніл)-метанон; R1 4-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]I-A , піперидин-1-карбоніл}-бензонітрил; де: {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]R1 і R2 незалежно один від одного являють собою піперидин-1-іл}-ізоксазол-5-ілметанон; водень, -(С1-С6)алкіл, -(С2-С6)алкеніл, -(С2(3-хлор-4-фторфеніл)-{(S)-3-[3-(4-фторфеніл)С6)алкініл, арилалкіл, гетероарилалкіл, гідрок[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; сил, аміногрупу, аміноалкіл, гідроксіалкіл, -(С1{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]С6)алкоксил, або R1 й R2 разом можуть утворюпіперидин-1-іл}-(2-феніл-2Н-піразол-3-іл)-метанон; вати (С3-С7)циклоалкільне кільце, карбонільний {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]зв'язок С=О або вуглець-вуглецевий подвійний піперидин-1-іл}-(5-метил-2-феніл-2Н-[1,2,3]триазолзв'язок; 4-іл)-метанон; Р й Q незалежно один від одного вибирають із цик(4-фтор-3-метилфеніл)-{(S)-3-[3-(4-фторфеніл)лоалкільної, гетероциклоалкільної, арильної або [1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; гетероарильної групи формули {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]піперидин-1-іл}-(3-метилтіофен-2-іл)-метанон; N N R33 R {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]R33 R R77 R R33 R R44 R піперидин-1-іл}-(1-метил-1Н-пірол-2-іл)-метанон; {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]R66 R R66 R S S R44 R R44 R R55 R піперидин-1-іл}-тіазол-2-ілметанон; R55 R R55 R {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл], , піперидин-1-іл}-(4-метилтіазол-5-іл)-метанон; {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]- N NN R3 R3 R3 DD E E D E R3 R3 N NN R3 RR R7 7 7 R3 3 3 RR R3 3 3 RR R4 R4 R4 піперидин-1-іл}-(6-морфолін-4-ілпіридин-3-іл)HH H метанон; R6 R6 R6 F FF R6 6 6 R R R RR S SS S SS R R {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]R4 4 4 RR GG G R5 R5 R5 4 4 4 4 R4 4 піперидин-1-іл}-(1Н-індол-5-іл)-метанон; R5 5 5 RR , , ; R5 5 5 RR 2-(4-фторфеніл)-1-{(S)-3-[3-(4-фторфеніл)-1,2,4R3, R4, R5, R6 і R7 незалежно один від одного являють оксадіазол-5-іл]-піперидин-1-іл}-етанон; собою: водень, галоген, -NO2, -(С1-С6)алкіл, -(С33-(4-фторфеніл)-1-{(S)-3-[3-(4-фторфеніл)-1,2,4С6)циклоалкіл, -(С3-С7)циклоалкілалкіл, -(С2оксадіазол-5-іл]-піперидин-1-іл}-пропан-1-он; С6)алкеніл, -(С2-С6)алкініл, галоген-(С1-С6)алкіл, {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]гетероарил, гетероарилалкіл, арилалкіл, арил, піперидин-1-іл}-ізохінолін-3-ілметанон; OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9, NR8CO2R9, {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, піперидин-1-іл}-хіноксалін-6-ілметанон; S(=O)2NR8R9, -C(=O)R8, -C(=O)-O-R8, -C(=O)NR8R9, {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадіазол-5-іл]C(=NR8)R9 або C(=NOR 8 )R 9 ; при цьому, можлипіперидин-1-іл}-бензоімідазол-6-ілметанон; во, два замісники разом з атомами, що знахо(4-фторфеніл)-[(S)-3-(3-нафт-1-илдяться між ними, утворюють біциклічне гетероцик[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон; лоалкільне, арильне або гетероарильне кільце; {(S)-3-[3-(2,6-дифторфеніл)-[1,2,4]оксадіазол-5-іл]причому кожне кільце, можливо, додатково несе піперидин-1-іл}-(4-фторфеніл)-метанон; заміщення 1-5 групами, кожна з яких незалежно (4-фторфеніл)-{(S)-3-[3-(2-метоксифеніл)являє собою: галоген, -CN, -(С1-С6)алкіл, -О-(С0[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанон; С6)алкіл, -О-(С3-С7)циклоалкілалкіл, -О(арил), (4-фторфеніл)-[(S)-3-(3-нафт-2-илО(гетероарил), -О-(С1-С3)алкіларил, -О-(С1[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанон; С3)алкілгетероарил, -N((-С0-С6)алкіл)((С0(4-фторфеніл)-{3-[3-(4-фторфеніл)С3)алкіларил) або -N((C0-С6)алкіл)((С0[1,2,4]оксадіазол-5-іл]-4-метилпіперазин-1-іл}С3)алкілгетероарил); метанон; кожен з R8, R9, R10 незалежно один від одного являє (Е)-3-(4-фторфеніл)-1-{(S)-3-[3-(4-фторфеніл)собою: водень, (С1-С6)алкіл, (С3-С6)циклоалкіл, (С3[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-пропенон; С7)циклоалкілалкіл, (С2-С6)алкеніл, (С2-С6)алкініл, 1-(4-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]галоген-(С1-С6)алкіл, гетероциклоалкіл, гетероарил, піперидин-1-карбоніл}-піперидин-1-іл)-етанон; гетероарилалкіл, арилалкіл або арил; кожен з яких, {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]можливо, несе заміщення 1-5 незалежними групапіперидин-1-іл}-(4-імідазол-1-ілфеніл)-метанон; ми, кожна з яких являє собою: галоген, -CN, -(С1С6)алкіл, -О-(С0-С6)алкіл, -О-(С3-С7)циклоалкілалкіл, R33 R N N S S R4 R4 R3 3 R R4 4 7 92496 -О(арил), -О(гетероарил), -N((С0-С6)алкіл)2, -N((С0С6)алкіл)((С3-С7)циклоалкіл) або -N((C0С6)алкіл)(арил); D, Е, F, G і Н незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-, -C(=O)-, -C(=S)-, -О-, N=, -N(R3)- або -S-; В являє собою одинарний зв'язок, -C(=O)-(C0C2)алкіл-, -С(=О)-(С2-С6)алкеніл-, -С(=О)-(С2С6)алкініл-, -С(=О)-О-, -C(=O)NR8-(C0-C2)алкіл-, C(=NR8)NR9-S(=O)-(C0-C2)алкіл-, -S(=О)2-(С0-С2)алкіл-, -S(=O)2NR8-(С0-C2)алкіл-, C(=NR8)-(C0-C2)алкіл-, C(=NOR8)-(С0-С2)алкілабо -C(=NOR8)NR9-(С0C2)алкіл-; R8 і R9 незалежно один від одного являють собою групи, що визначені вище; J являє собою одинарний зв'язок, -C(R11)(R12), -О-, -N(R11)- або -S-; R11, R12 незалежно один від одного являють собою водень, -(С1-С6)алкіл, -(С3-С6)циклоалкіл, -(С3С7)циклоалкілалкіл, -(С2-С6)алкеніл, -(С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, -О(С0С6)алкіл, -О(С3-С7)циклоалкілалкіл, -О(арил), О(гетероарил), -N((С0-С6)алкіл)((С0-С6)алкіл), -N((С0С6)алкіл)((С3-С7)циклоалкіл) або -N((C0С6)алкіл)(арил); будь-який N може являти собою N-оксид; або фармацевтично прийнятні солі, гідрати або сольвати зазначеної сполуки. 3. Сполука за п. 1 або 2, яка має формулу І-В N O O P N N Q J I-B , де: Р і Q незалежно один від одного являють собою циклоалкільну, гетероциклоалкільну, арильну або гетероарильну групу, що має формулу: R6 6 R R4 4 R R5 5 R N N R R3 3 R R6 6 R R5 5 R R4 4 4 S S R R5 5 5 N N R3 3 R R7 7 R R3 3 R R3 3 R R6 6 R R4 4 R R5 5 R , R R3 3 3 N N S S R4 4 R S S R5 5 R , D E D D EE H H H F FF G G G R R4 4 4 , , , R3, R4, R5, R6 і R7 незалежно один від одного являють собою наступні замісники: водень, галоген, NO2, -(С1-С6)алкіл, -(С3-С6)циклоалкіл, -(С3С7)циклоалкілалкіл, -(С2-С6)алкеніл, -(С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, NR8COR9, NR8CO2R9, NR8SO2R9, -NR10CONR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(=O)O-R8, -C(=O)NR8R9, -C(=NR8)R9 або C(=NOR8)R9; при 8 цьому, можливо, два замісники разом з атомами, що знаходяться між ними, утворюють біциклічне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце, можливо, додатково несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, О-(С0-С6)алкіл, -О-(С3-С7)циклоалкілалкіл, -О(арил), О(гетероарил), -О-(-С1-С3)алкіларил, -О-(С1С3)алкілгетероарил, -N((-С0-С6)алкіл)((С0С3)алкіларил) або -N((С0-С6)алкіл)((С0-С3)алкілгетероарил); R8, R9, R10 незалежно один від одного являють собою: водень, (С1-С6)алкіл, (С3-С6)циклоалкіл, (С3С7)циклоалкілалкіл, (С2-С6)алкеніл, (С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1С6)алкіл, -О-(С0-С6)алкіл, -О-(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -N((С0-С6)алкіл)2, -N((С0С6)алкіл)((С3-С7)циклоалкіл) або -N((С0С6)алкіл)(арил); D, Е, F, G й Н незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-, -C(=O)-, -C(=S)-, -О-, N=, -N(R3)- або -S-; J являє собою одинарний зв'язок, -C(R11)(R12), -О-, -N(R11)- або -S-; R11, R12 незалежно один від одного являють собою водень, -(С1-С6)алкіл, -(С3-С6)циклоалкіл, -(С3С7)циклоалкілалкіл, -(С2-С6)алкеніл, -(С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, -O(С0С6)алкіл, -О(С3-С7)циклоалкілалкіл, -О(арил), О(гетероарил), -N((С0-С6)алкіл)((С0-С6)алкіл), -N((С0С6)алкіл)((С3-С7)циклоалкіл) або -N((С0С6)алкіл)(арил); будь-який N може являти собою N-оксид; або фармацевтично прийнятні солі, гідрати або сольвати зазначеної сполуки. 4. Сполука за будь-яким з пунктів з 1 по 3, що може існувати у виді оптичних ізомерів, причому зазначена сполука являє собою або рацемічну суміш, або індивідуальний оптичний ізомер. D E D E R3 3 Сполука за будь-яким з пунктів з 1 по 4, яка відR 5. N N різняється тим,Hщо зазначену сполуку вибирають H з: FF S S R G G R4 (4-фторфеніл)-{5-[3-(4-фторфеніл)4 [1,2,4]оксадіазол-5-іл]-3,6-дигідро-2Н-піридин-1-іл}метанону; (4-фторфеніл)-{2-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-ілметил]-піролідин-1-іл}метанону; 2-фтор-5-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол5-іл]-піперидин-1-карбоніл}-бензонітрилу; (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(3-метилізоксазол-4-іл)-метанону; (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(3-феноксиметилфеніл)-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(тетрагідротіопіран-4-іл)-метанону; 9 (5-фторіндан-1-іл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(тетрагідропіран-4-іл)-метанону; циклогексил-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (3-бензоїлфеніл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(2,4,6-трифторфеніл)-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(4-метил-[1,2,3]тіадіазол-5-іл)метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(2-фторпіридин-3-іл)-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-піридин-2-ілметанону гідрохлориду; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(2-метилпіридин-3-іл)-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(1,2,5-триметил-1H-пірол-3-іл)метанону; (2,4-диметилтіазол-5-іл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-о-толілметанону; (2-етилфеніл)-{3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (1,5-диметил-1Н-піразол-4-іл)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-фуран-3-ілметанону; (2,5-диметилфуран-3-іл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(2-метилфуран-3-іл)-метанону; (S)-(2,3-дигідробензо[1,4]діоксин-5-іл)-{3-[3-(4фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}метанону; (S)-(4-фтор-3-метоксифеніл)-{3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(3-метилпіридин-4-іл)-метанону; (S)-(2-бромтіофен-3-іл)-{3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону; (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(3-метилфуран-2-іл)-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(3-метокситіофен-2-іл)-метанону; (4-фтор-2-метилфеніл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (4-фторфеніл)-{(S)-3-[3-(6-метилпиридин-2-іл)[1,2,4]оксадиазол-5-іл]-піперидин-1-іл}-метанону (4-фторфеніл)-{(S)-3-[3-(5-метилфуран-2-іл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (4-фторфеніл)-[(S)-3-(3-фуран-2-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(2-метилтіофен-3-іл)-метанону; (4-фторфеніл)-[(S)-3-(3-тіофен-2-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; 92496 10 (4-фторфеніл)-[(S)-3-(3-тіофен-3-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (4-фторфеніл)-{(S)-3-[3-(1-метил-1Н-пірол-2-іл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (4-фторфеніл)-{(S)-3-[3-(3-метилпіридин-2-іл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(3-трифторметил-1Н-піразол-4-іл)метанону; (4-фтор-2-метиламінофеніл)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(4-метил-1Н-пірол-3-іл)-метанону; (5-метилізоксазол-4-іл)-[(S)-3-(3-тіофен-3-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (3,4-дифторфеніл)-[(S)-3-(3-тіофен-3-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (5-етилізоксазол-4-іл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(5-метоксиметилізоксазол-4-іл)метанону; (4-фторфеніл)-[(S)-3-(3-о-толіл-[1,2,4]оксадіазол-5іл)-піперидин-1-іл]-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(2-метиламінофеніл)-метанону; (4-фторфеніл)-[(S)-3-(3-тіазол-4-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (3,4-дифторфеніл)-[(S)-3-(3-тіазол-4-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (3,4-дифторфеніл)-[(S)-3-(3-піридин-4-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (4-фтор-2-метилфеніл)-[(S)-3-(3-піридин-4-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (3,4-дифторфеніл)-[(S)-3-(3-піридин-2-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (2-бензиламінофеніл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (5-метилізоксазол-4-іл)-[(S)-3-(3-феніл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (4-фторфеніл)-[(S)-3-(3-піразин-2-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; {(S)-3-[3-(4-диметиламінофеніл)-[1,2,4]оксадіазол5-іл]-піперидин-1-іл}-(4-фторфеніл)-метанону; (2,4-дифторфеніл)-[(S)-3-(3-феніл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (2,4-дифторфеніл)-{(S)-3-[3-(2-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; {(S)-3-[3-(2-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону; (6-фторпіридин-3-іл)-[(S)-3-(3-феніл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (4-фтор-2-метилфеніл)-[(S)-3-(3-феніл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; {(S)-3-[3-(2-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону; {(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону; {(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону; {(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(4-фтор-2-метилфеніл)-метанону; (3,4-дифторфеніл)-{(S)-3-[3-(2,4-дифторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; 11 (2,4-дифторфеніл)-{(S)-3-[3-(2,4-дифторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (2,4-дифторфеніл)-[(S)-3-(3-піридин-2-іл[1,2,4]оксадіазол-5-іл)-піперидин-1-іл]-метанону; (4-фтор-2-метилфеніл)-{(S)-3-[3-(2-фторфеніл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (4-фторфеніл)-{(S)-3-[3-(2-метилтіазол-5-іл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (6-фторпіридин-3-іл)-{(S)-3-[3-(2-метилтіазол-5-іл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (2,4-дифторфеніл)-{(S)-3-[3-(2-метилтіазол-5-іл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; (3,4-дифторфеніл)-{(S)-3-[3-(2-метилтіазол-5-іл)[1,2,4]оксадіазол-5-іл]-піперидин-1-іл}-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(4-трифторметоксифеніл)метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(2-фторпіридин-4-іл)-метанону; {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадіазол-5-іл]піперидин-1-іл}-(3-фторпіридин-4-іл)-метанону. 6. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-5 і фармацевтично прийнятний носій та/або наповнювач. 7. Спосіб лікування або запобігання стану в ссавця, включаючи людину, причому лікуванню або запобіганню зазначеному стану сприяє або на нього впливає нейромодуляторна дія алостеричних модуляторів mGluR5, який включає введення ссавцеві, що має потребу в зазначеному лікуванні або запобіганні, ефективної кількості сполуки або композиції за будь-яким з пп. 1-6. 8. Спосіб лікування або запобігання стану в ссавця, включаючи людину, причому лікуванню або запобіганню зазначеному стану сприяє або на нього впливає нейромодуляторна дія позитивного алостеричного модулятора mGluR5, що виступає у ролі підсилюючого агента, причому зазначений спосіб включає введення ссавцеві, що має потребу в зазначеному лікуванні або запобіганні, ефективної кількості сполуки або композиції за будьяким з пп. 1-6. 9. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає тривожні розлади: агорафобію, генералізований тривожний розлад (ГТР), обсесивнокомпульсивний розлад (ОКР), панічний розлад, посттравматичний стресовий розлад (ПТСР), соціофобію, інші фобії, тривожний розлад, пов'язаний з уживанням психоактивних речовин, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6. 10. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає розлад в дітей: синдром дефіциту уваги з гіперактивністю, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6. 11. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає розлад харчової поведінки: нервову анорексію, нервову булімію, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6. 92496 12 12. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає розлад настрою: біполярні розлади (типу І і II), циклотимічний розлад, депресію, дистимічний розлад, великий депресивний розлад, розлад настрою, пов'язаний із вживанням психоактивних препаратів, який включає введення ефективної кількості сполуки або композиції за будьяким з пп. 1-6. 13. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає психотичні розлади: шизофренію, маревний розлад, шизоафективний розлад, шизофреноформний розлад, психотичний розлад, пов'язаний із вживанням психоактивних речовин, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6. 14. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає когнітивні розлади: делірій, персистуючий делірій, пов'язаний із вживанням психоактивних речовин, деменцію, деменцію, викликану ВІЛ, деменцію, викликану хореєю Гентінгтона, деменцію, викликану хворобою Паркінсона, деменцію типу Альцгеймера, персистуючу деменцію, пов'язану із вживанням психоактивних речовин, помірні когнітивні порушення, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6. 15. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає розлади особистості: обсесивнокомпульсивний розлад особистості, шизоїдний розлад особистості, шизотипальний розлад особистості, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6. 16. Спосіб лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає розлади, пов'язані із вживанням психоактивних речовин: зловживання алкоголем, алкогольну залежність, алкогольну абстиненцію, синдром відміни алкоголю з делірієм, алкогольний психотичний розлад, амфетамінову залежність, амфетамінову абстиненцію, кокаїнову залежність, кокаїнову абстиненцію, нікотинову залежність, нікотинову абстиненцію, опіоїдну залежність, опіоїдну абстиненцію, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6. 17. Спосіб лікування або запобігання запальному захворюванню центральної нервової системи, вибраному з форм розсіяного склерозу, таких як доброякісний розсіяний склероз, ремітуючий розсіяний склероз, вторинно прогресуючий розсіяний склероз, первинно прогресуючий розсіяний склероз, рецидивуючий розсіяний склероз, який включає введення ефективної кількості сполуки або композиції за будь-яким з пп. 1-6. 18. Застосування сполуки за будь-яким з пп. 1-5 для виробництва ліків для лікування або запобігання захворюванню або стану, зазначеному в будь-якому з пп. 9-17. 19. Застосування композиції за п. 6 для виробництва ліків для лікування або запобігання захворю 13 92496 ванню або стану, зазначеному в будь-якому з пп. 9-17. N P O B N W R1 Q R2 I Даний винахід відноситься до нових сполук формули I, які являють собою позитивні алостеричні модулятори метаботропних рецепторів-підтипу 5 («mGluR5»), які придатні для лікування або запобігання розладів центральної нервової системи, таких як, наприклад: зниження когнітивних функцій, як позитивні, так і негативні симптоми шизофренії, а також різні інші розлади центральної або периферичної нервової системи, у які залучені глутаматні метаботропні рецептори підтипу mGluR5. Даний винахід також відноситься до фармацевтичних сполук і композиції для запобігання або лікування зазначених захворювань, у які залучені рецептори mGluR5. Глутамат, основний амінокислотний трансмітер у центральній нервовій системі (ЦНС) ссавців, опосередує збудливу синаптичну нейротрансмісію за допомогою активації рецепторних каналів іонотропних глутаматних рецепторів (iGluRs, а саме NMDA, AMPA і каінатних) і метаботропних глутаматних рецепторів (mGluRs). iGluRs відповідають за швидку збудливу трансмісію (Nakanishi S et al., (1998) Brain Res. Rev., 26:230-235), тоді як mGluRs більшою мірою відіграють модулюючу роль, що сприяє тонкому настроюванню синаптичної ефективності. Глутамат бере участь у численних фізіологічних функціях, таких як довгострокове потенціювання (LTP), процес, що, як думають, лежить в основі навчання й пам'яті, а також серцевосудинної регуляції, почуттєвого сприйняття й розвитку синаптичної пластичності. Крім того, глутамат відіграє важливу роль у патофізіології різних неврологічних і психіатричних захворювань, особливо в тих випадках, коли спостерігають дисбаланс у глутаматергічній нейротрансмісії. mGluRs являють собою пов'язані з G-білками рецептори, які містять сім трансмембранних доменів. Вісім членів сімейства розділені на три групи (Групи I, II & III) відповідно до гомології їхніх амінокислотних послідовностей й їхніх фармакологічних властивостей (Schoepp DD et al. (1999) Neuropharmacology, 38:1431-1476). Активація mGluRs призводить до великої розмаїтості внутрішньоклітинних відповідей й активації різних трансдукційних каскадів. Серед членів сімейства mGluR підтип mGluR5 становить найбільший інтерес для відновлення рівноваги при недоліку або надлишку нейропередачі при нейропсихіатричних захворюваннях. mGluR5 є членом Групи I і його активація 14 20. Застосування сполуки за будь-яким з пп. 1-5 для готування мітки для одержання зображень метаботропних глутаматних рецепторів. ініціює клітинні відповіді за допомогою опосередкованих G-білком механізмів. mGluR5 зв'язується з фосфоліпазою С й стимулює фосфоінозитидний гідроліз і внутрішньоклітинну мобілізацію кальцію. Було показано, що білки mGluR5 локалізовані в постсинаптичних елементах, що граничать із постсинаптичним ущільненням (Lujan R et al. (1996) Eur. J. Neurosci., 8:1488-500; Lujan R et al. (1997) J. Chem. Neuroanat., 13:219-41), і їх рідко спостерігають у пресинаптичних елементах (Romano C et al. (1995) J. Comp. Neurol., 355:45569). Рецептори mGluR5 можуть внаслідок цього змінювати постсинаптичну відповідь на нейротрансмітер або регулювати вивільнення нейротрансмітеру. У ЦНС рецептори mGluR5 широко поширені, в основному, у корі, гипокампі, каудато-путамені (хвостатому ядрі й шкарлупі, що разом складають смугасте тіло) і прилеглому ядрі. Оскільки було показано, що зазначені області головного мозку залучені у вияви емоцій, мотиваційні процеси й численні аспекти когнітивної функції, прогнозують, що модулятори mGluR5 можуть представляти великий терапевтичний інтерес. Припускають, що створення селективних до підтипів рецептора модуляторів mGluR дозволить впливати на безліч потенційних клінічних показань. Зазначені стани включають епілепсію, нейропатичну й запальну біль, численні психіатричні розлади (наприклад, тривога й шизофренія), рухові порушення (наприклад, хвороба Паркінсона), нейропротективна дія (інсульт або травма голови), мігрень і звикання/наркотична залежність (для огляду дів. Brauner-Osborne H et al. (2000) J. Med. Chem., 43:2609-45; Bordi F and Ugolini A. (1999) Prog. Neurobiol., 59:55-79; Spooren W et al. (2003) Behav. Pharmacol., 14:257-77). Припущення про те, що гіпофункція глутаматергетичної системи, що виражається в гіпофункції рецептора NMDA може бути однієї із причин розвитку шизофренії, одержало в останні кілька років зростаючу підтримку (Goff DC and Coyle JT (2001) Am. J. Psychiatry, 158:1367-1377; Carlsson A et al. (2001) Annu. Rev. Pharmacol. Toxicol., 41:237-260 як огляд). Вказівка на роль дисфункції глутаматергічної нейротрансмісії також підтверджується тим фактом, що антагоністи глутаматних рецепторів підтипу NMDA можуть викликати повний спектр симптомів, а також психологічних проявів шизофренії, таких як гипофронтальність, порушене преімпульсне ингібування й підвищене звільнення дофаміну в підкірці. Крім того, клінічні дослідження дозволяють припустити, що частота алелей mGluR5 пов'язана із шизофренією в деяких групах населення (Devon RS et al. (2001) Mol. Psychiatry., 6:311-4), і що збільшення передачі сигналів mGluR5 виявлено в шарах пірамідальних кліток 15 кору головного мозку хворих шизофренією (Ohnuma T et al. (1998) Brain Res. Mol. Brain Res., 56:207-17). Залучення mGluR5 у неврологічні й психіатричні захворювання підтверджують дані, які показують, що активація mGluRs групи I in vivo викликає потенціювання функції рецепторів NMDA у багатьох областях головного мозку, головним чином за рахунок активації рецепторів mGluR5 (Mannaioni G et al. (2001) Neurosci., 21:5925-34; Awad H et al. (2000) J. Neurosci., 20:7871-7879; Pisani A et al. (2001) Neuroscience, 106:579-87; Benquet P et al (2002) J. Neurosci., 22:9679-86). Роль глутамату в процесах пам'яті також твердо встановлена протягом останнього десятиліття (Martin SJ et al. (2000) Annu. Rev. Neurosci., 23:649711; Baudry M and Lynch G. (2001) Neurobiol. Learn. Mem., 76:284-297). Експерименти на мишах з нульмутацією по mGluR5 підтвердило роль mGluR5 у навчанні й пам'яті. Зазначені миші показують виборчу нездатність упоратися із двома завданнями на просторове навчання й пам'ять, і знижене LTP у зоні CA1 гипокампу (Lu et al. (1997) J. Neurosci., 17:5196-5205; Schulz B et al. (2001) Neuropharmacology, 41:1-7; Jia Z et al. (2001) Physiol. Behav., 73:793-802; Rodrigues et al. (2002) J. Neurosci., 22:5219-5229). Виявлення того, що mGluR5 відповідає за потенціацію опосередкованих рецепторами NMDA струмів, може вказувати на те, що агоністи зазначених рецепторів можуть бути корисні як засоби, що поліпшують когнітивну функцію, а також як нові антипсихотичні засоби, що діють за рахунок селективного посилення функції рецепторів NMDA. Активація NMDARs може потенціювати гіпофункціональні NMDARs у нейронних ланцюгах, задіяних у шизофренії. Останні дані in vivo указують на те, що активація mGluR5 може являти собою новий й ефективний підхід до лікування зниження когнітивної функції також як позитивних і негативних симптомів шизофренії (Kinney GG et al. (2003) J. Pharmacol. Exp. Ther., 306(1):116-123). Тому рецептор mGluR5 розглядають як потенційну лікарську мішень для лікування психіатричних і неврологічних розладів, включаючи виліковні захворювання, якими в даному контексті є тривожні розлади, порушення уваги, харчові порушення, розлади настрою, психотичні розлади, когнітивні розлади, розлади особистості й розладу смислової сфери. Більшість існуючих у цей час модуляторів функції mGluR5 були розроблені як структурні аналоги глутамату, квисквалату або фенілгліцину (Schoepp DD et al. (1999) Neuropharmacology, 38:1431-1476) і вкрай перспективно розробити in vivo активні й селективні модулятори mGluR5, що діють на центр зв'язування глутамату. Новий шлях розробки селективних модуляторів полягає в ідентифікації молекул, що діють по алостеричним механізмам, модулюючи рецептор шляхом зв'язування із центром, відмінним від висококонсервативного ортостеричного центру зв'язування. Позитивні алостеричні модулятори mGluRs були запропоновані недавно як нові лікарські фо 92496 16 рми, що пропонують зазначену привабливу можливість. Зазначений тип молекул був відкритий для mGluR1, mGluR2, mGluR4, і mGluR5 (Knoflach F et al. (2001) Proc. Natl. Acad. Sci. U S A., 98:13402-13407; O'Brien JA et al. (2003) Mol. Pharmacol., 64:731-40; Johnson K et al. (2002) Neuropharmacology, 43:291; Johnson MP et al. (2003) J. Med. Chem., 46:3189-92; Marino MJ et al. (2003) Proc. Natl. Acad. Sci. U S A., 100(23):1366873; як огляд дів. Mutel V (2002) Expert Opin. Ther. Patents, 12:1-8; Kew JN (2004) Pharmacol. Ther., 104(3):233-44; Johnson MP et al. (2004) Biochem. Soc. Trans., 32:881-7). DFB і родинні молекули описані як позитивні алостеричні модулятори mGluR5 in vitro, однак вони мають низьку активність. (O'Brien JA et al. (2003) Mol. Pharmacol., 64:731-40). Були запатентовані похідні бензаміду (WO 2004/087048; O'Brien JA (2004) J. Pharmacol. Exp. Ther., 309:568-77), а недавно як позитивні алостеричні модулятори mGluR5 були описані похідні амінопиразолу (Lindsley et al. (2004) J. Med. Chem., 47:5825-8; WO 2005/087048). Серед похідних амінопиразолу, CDPPB (3-циано-N-(1,3дифеніл-1H-пиразол-5-іл)бензамід) виявив при дії in vivo ефект, подібний антипсихотичному в моделях поводження пацюків (Kinney GG et al. (2005) J. Pharmacol. Exp. Ther., 313:199-206). Цей звіт збігається з гіпотезою, що алостеричне потенціювання mGluR5 може забезпечити новий підхід до розробки антипсихотичних засобів. Недавно була описана нова серія позитивних алостеричних модуляторів рецепторів mGluR5 (WO 2005/044797). Раніше були описані похідні арилоксадиазолу (WO 04/014902 й WO 04/14881); зазначені сполуки являють собою негативні алостеричні модулятори рецепторів mGluR5. Міжнародна публікація №WO 01/54507 від Akkadix Corp., розкриває 4оксадиазолилпиперидин як противогельминтний засіб. Міжнародна публікація №WO 03/002559, зареєстрована Smith Kline Beecham laboratories, розкриває оксадиазолил алкіл пиперидин як антагоніст рецепторів орексину. Ніякі конкретні раніше описані сполуки структурно не пов'язані із сполукими згідно даному винаходу. Даний винахід відноситься до способу лікування або запобігання стану в ссавця, включаючи людину, на лікування або запобігання якого впливають або полегшують за рахунок нейромодуляторної дії позитивних алостеричних модуляторів mGluR5. Фігури Фіг.1 показує дію 10µМ речовини з Прикладу #29 даного винаходу на первинну культуру кортикальних кліток, экспресуючих mGluR5, у відсутності або в присутності 300нМ глутамату. Фіг.2 показує, що типове сполуки #5 даного винаходу значно послаблює збільшення локомоторної активності, викликане амфетаміном у дозуванні 30 & 50мг/кг внутрибрюшинно. Згідно даному винаходу, представлені нові сполуки загальної формули I 17 N 92496 R1 і R2 незалежно один від одного являють собою водень, -(C1-C6)алкіл, -(C2-C6)алкенил -(C2C6)алкіниі, арилалкіл, гетероарилалкіл, гідроксил, аміногрупу, аміноалкіл, гідроксиалкіл, -(C1C6)алкоксил, або R1 й R2 разом можуть утворювати (C3-C7)циклоалкільне кільце, карбонільний зв'язок C=O або вуглець-вуглецевий подвійний зв'язок; P й Q незалежно один від одного являють собою циклоалкільну, гетероциклоалкільну, арильну або гетероарильну групу формули O B P N W Q R1 R2 I або фармацевтично прийнятні солі, гідрати або сольвати зазначених сполук у яких W являє собою (C5-C7)циклоалкільне, (C3C7)гетероциклоалкільне, (C3-C7)гетероциклоалкіл(C1-C3)алкільне або (C3-C7)гетероциклоалкенильне кільце; R7 R3 R3 N R6 R4 R5 , R3 R6 R4 18 , S R5 , D N R3 R4 S H R4 , G E F R5 R3, R4, R5, R6, і R7 незалежно один від одного являють собою: водень, галоген, -NO2, -(C1C6)алкіл, -(C3-C6)циклоалкіл, -(C3C7)циклоалкіалкіл, -(C2-C6)алкенил, -(C2-C6)алкініл, галоген-(C1-C6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, NR8COR9, NR8CO2R9, NR8SO2R9, -NR10CO NR8R9, SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -C(=O)R8, -C(=O)-O-R8, -C(=O)NR8R9, -C(=NR8)R9, або C(=NOR8)R9; при цьому, можливо, два замісники разом з атомами, що перебувають між ними, утворюють біциклічне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце, можливо, додатково несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, CN, -(C1-C6)алкіл, -O-(C0-C6)алкіл, -O-(C3C7)циклоалкілалкіл, -O(арил), -O(гетероарил), -O-(C1-C3)алкіларил, -O-(C1-C3)алкілгетероарил, -N((C0-C6)алкіл)((C0-C3)алкіларил) або -N((C0C6)алкіл)((C0-C3-)алкілгетероарил); R8, R9, R10 кожен незалежно один від одного являють собою: водень, (C1-C6)алкіл, (C3C6)циклоалкіл, (C3-C7)циклоалкілалкіл, (C2C6)алкенил, (C2-C6)алкініл, галоген-(C1-C6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, несе заміщення 1-5 замісниками, кожен з яких незалежно являє собою: галоген, -CN, -(C1-C6)алкіл, -O-(C0C6)алкіл, -O-(C3-C7)циклоалкілалкіл, -O(арил), O(гетероарил), -N((C0-C6)алкіл)2, -N((C0C6)алкіл)((C3-C7) циклоалкіл) або -N((C0C6)алкіл)(арил); D, E, F, G й H незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-,-C(=O)-,-C(=S), -O-, -N=, -N(R3)- або -S-; B являє собою одинарний зв'язок, -C(=O)-(C0C2)алкіл-, -C(=O)-(C2-C6)алкенил-, -C(=O)-(C2C6)алкініл-, -C(=O)-O-, -C(=O)NR8-(C0-C2)алкіл-, C(=NR8)NR9-S(=O)-(C0-C2)алкіл-, -S(=O)2-(C0C2)алкіл-, -S(=O)2NR8-(C0-C2)алкіл-, C(=NR8)-(C0C2)алкіл-, -C(=NOR8)-(C0-C2)алкілабо C(=NOR8)NR9-(C0-C2)алкіл-; R8 і R9, незалежно один від одного являють собою групи, зазначені вище; будь-який N може являти собою N-оксид; Даний винахід охоплює обидва можливих стереоізомери, також як рацемічні сполуки, і індивідуальні енантиомери. При цьому виключені наступні з'єднання: (3-(3-(4-бутоксифеніл)-1,2,4-оксадиазол-5іл)пиперидин-1-іл)(2-хлорпиридин-4-іл)-метанон (S)-(4-фторфеніл)-{3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (S)-(тиофен-2-іл)-{3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(4-метил-2-пиразин-2-ілтиазол-5іл)-метанон (2,4-дифторфеніл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3,4,5-трифторфеніл)-метанон {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадиазол-5-іл]пиперидин-1-іл}-(5-пиридин-2-ілтиофен-2-іл)метанон циклопентил-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (3,4-дифторфеніл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон бензотиазол-6-іл-{(S)-3-[3-(4-фторфеніл)-1,2,4оксадиазол-5-іл]-пиперидин-1-іл}-метанон (3,5-диметилизоксазол-4-іл)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон (4-фторфеніл)-{(S)-3-[3-(2,4,6-трифторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (4-фторфеніл)-[(S)-3-(3-пиридин-3-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (4-фторфеніл)-[(S)-3-(3-пиридин-4-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон {(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадиазол5-іл]-пиперидин-1-іл}-(4-фторфеніл)-метанон (4-фторфеніл)-[(S)-3-(3-п-толил[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (4-фторфеніл)-{(S)-3-[3-(2-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон 19 (4-фторфеніл)-[(S)-3-(3-пиридин-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (2-фторфеніл)-{(S)-3-[2-(3,4-дифторфеніл)1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (4-фторфеніл)-{2-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-морфолин-4-іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-тиофен-3-ілметанон (4-фторфеніл)-[(S)-3-(3-феніл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (3,4-дифторфеніл)-[(S)-3-(3-феніл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон {3-[3-(4-метоксифеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-фенілметанон {3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-фенілметанон (4-фторфеніл)-[3-(3-феніл-[1,2,4]оксадиазол-5іл)-пиперидин-1-іл]-метанон (3-фторфеніл)-[3-(3-феніл-[1,2,4]оксадиазол-5іл)-пиперидин-1-іл]-метанон (4-фторфеніл)-{3-[3-(3-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (3-фторфеніл)-{3-[3-(3-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (4-фторфеніл)-{3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (3-фторфеніл)-{3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (R)-(4-фторфеніл)-{3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-фенілтиазол-4-іл)-метанон {{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5іл]-пиперидин-1-іл}-(2-метил-6трифторметилпиридин-3-іл)-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-[1,2,3]тиадиазол-4-ілметанон бензотиазол-2-іл-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(5-метилизоксазол-3-іл)-метанон (1,5-диметил-1H-пиразол-3-іл)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(4-трифторметилфеніл)-метанон 4-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5іл]-пиперидин-1-карбонил}-бензонитрил {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-изоксазол-5-ілметанон (3-хлор-4-фторфеніл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-феніл-2H-пиразол-3-іл)метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(5-метил-2-феніл-2H[1,2,3]триазол-4-іл)-метанон (4-фтор-3-метилфеніл)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадиазол-5-іл]пиперидин-1-іл}-(3-метилтиофен-2-іл)-метанон {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадиазол-5-іл]пиперидин-1-іл}-(1-метил-1H-пиррол-2-іл)-метанон 92496 20 {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадиазол-5-іл]пиперидин-1-іл}-тиазол-2-ілметанон {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадиазол-5-іл]пиперидин-1-іл}-(4-метилтиазол-5-іл)-метанон {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадиазол-5-іл]пиперидин-1-іл}-(6-морфолин-4-ілпиридин-3-іл)метанон {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадиазол-5-іл]пиперидин-1-іл}-(1H-индол-5-іл)-метанон 2-(4-фторфеніл)-1-{(S)-3-[3-(4-фторфеніл)1,2,4-оксадиазол-5-іл]-пиперидин-1-іл}-етанон 3-(4-фторфеніл)-1-{(S)-3-[3-(4-фторфеніл)1,2,4-оксадиазол-5-іл]-пиперидин-1-іл}-пропан-1-он {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадиазол-5-іл]пиперидин-1-іл}-ізохинолін-3-ілметанон {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадиазол-5-іл]пиперидин-1-іл}-хиноксалин-6-ілметанон {(S)-3-[3-(4-фторфеніл)-1,2,4-оксадиазол-5-іл]пиперидин-1-іл}-бензоімидазол-6-ілметанон (4-фторфеніл)-[(S)-3-(3-нафт-1-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон {(S)-3-[3-(2,6-дифторфеніл)-[1,2,4]оксадиазол5-іл]-пиперидин-1-іл}-(4-фторфеніл)-метанон (4-фторфеніл)-{(S)-3-[3-(2-метоксифеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (4-фторфеніл)-[(S)-3-(3-нафт-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (4-фторфеніл)-{3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-4-метилпиперазин-1-іл}метанон (E)-3-(4-фторфеніл)-1-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-пропенон 1-(4-{(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол5-іл]-пиперидин-1-карбонил}-пиперидин-1-іл)етанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(4-імидазол-1-ілфеніл)-метанон (4-фторфеніл)-{(S)-3-[3-(4-нитрофеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (3,4-дифторфеніл)-{(S)-3-[3-(4-нитрофеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон. З метою однозначності, варто розуміти, що в даному описі «(C1-C6)» позначає вуглецеву групу, що містить 1, 2, 3, 4, 5 або 6 атомів вуглецю. «(C0C6)» позначає вуглецеву групу, що містить 0, 1, 2, 3, 4, 5 або 6 атомів вуглецю. У даному описі «С» позначає атом вуглецю. У наведеному вище визначенні термін «(C1C6)алкіл» охоплює такі групи, як метил, етил, пропил, ізо-пропил, бутил, ізо-бутил, втор-бутил, третбутил, пентил, ізо-пентил, нео-пентил, третпентил, гексил або подібні їм. Термін «(C2-C6) алкенил» охоплює такі групи, як етенил, 1-пропенил, алил, изо-пропенил, 1бутенил, 3-бутенил, 4-пентенил і подібні їм. Термін «(C2-C6)алкинил» охоплює такі групи, як етинил, пропинил, бутинил, пентинил і подібні їм. Термін «Галоген» охоплює такі атоми, як фтор, хлор, бром і йод. Термін «Циклоалкіл» відноситься до, можливо, заміщеного карбоциклу, що не містить гетероатомів, включаючи моно-, бі- і трициклічні насичені карбоцикли, а також системи з конденсованими кільцями. Зазначені системи з конденсованими 21 92496 кільцями можуть включати повністю або частково ненасичені кільця, такі як бензольне кільце, з утворенням систем з конденсованими кільцями, таких як карбоцикли, конденсовані з бензольним кільцем. Циклоалкіл охоплює такі системи з конденсованими кільцями, як спиро-конденсовані кільцеві системи. Приклади циклоалкілів включають циклопропил, циклобутил, циклопентил, циклогексил, декагідронафталін, адамантан, індан, флуорен, 1,2,3,4-тетрагідронафталін, і подібні. Термін «Гетероциклоалкіл» відноситься до, можливо, заміщеного карбоциклу, що містить, щонайменше, один гетероатом, обраний незалежно серед O, N, S. Цей термін охоплює моно-, бі- і трициклічні насичені карбоцикли, а також системи з конденсованими кільцями. Зазначені системи з конденсованими кільцями можуть містити одне повністю або частково ненасичене кільце, таке як бензольне кільце, з утворенням систем з конденсованими кільцями, такими як карбоцикли, конденсовані з бензольним кільцем. Приклади гетероциклоалкілів включають пиперидин, пиперазин, морфолин, тетрагідротиофен, індолин, ізохінолін і подібні їм. Термін «Арил» включає (C6-C10)арильну групу, таку як феніл, 1-нафтил, 2-нафтил і подібні їм. Термін «Арилалкіл» охоплює (C6-C10)арил-(C1C3)алкільну групу, таку як бензильна група, 1фенилацетильна група, 2-фенилацетильна група, 1-фенілпропильна група, 2-фенілпропильна група, 3-фенілпропильна група, 1-нафтилметильна група, 2-нафтилметильна група й подібні їм. Термін «Гетероарил» охоплює 5-10-членну гетероциклічну групу, що містить від 1 до 4 гетероатомів, обраних серед кисню, азоту або сірки, з утворенням такого кільця, як фурил (фуранове кільце), бензофуранил (бензофуранове кільце), тиенил (тиофенове кільце), бензотиенил (бензотиофенове кільце), пиролил (пирольное кільце) імидазолил (імидазольне кільце), пиразолил (пиразольне кільце), тиазолил (тиазольне кільце), ізотиазолил (ізотиазольне кільце), триазолил (триазольне кільце), тетразолил (тетразольне кільце), пиридил (пирирдинове кільце), пиразинил (пиразинове кільце), пиримидил (пиримидинове кільце), пиридазил (пиридазинове кільце), індолил (індольне кільце), ізоіндолил (ізоіндольне кільце), бензоімидазолил (бензоімидазольне кільце), пуринил (пуринове кільце), хінолил (хінолинове кільце), фталазинил (фталазинове кільце), нафтиридинил (нафтиридинове кільце), хіноксалинил (хіноксалинове кільце), цинолил (цинолинове кільце), птеридинил (птеридинове кільце), оксазолил (оксазольR7 R3 R3 N R6 R4 R5 , не кільце), ізоксазолил (ізоксазольне кільце), бензоксазолил (бензоксазольне кільце), бензотиазолил (бензотиазольне кільце), фуразанил (фуразанове кільце) і подібні їм. Термін «Гетероарилалкіл» охоплює гетероарил-(C1-C3)алкільну групу, причому приклади гетероарилу аналогічні вище наведеним у визначенні, такі як 2-фурилметильна група, 3-фурилметильна група, 2-тиенилметильна група, 3-тиенилметильна група, 1-імидазолилметильна група, 2імидазолилметильна група, 2-тиазолилметильна група, 2-пиридилметильна група, 3пиридилметильна група, 1-хінолилметильна група або подібні. Термін «Сольват» відноситься до комплексу непостійної стехіометрії, утвореному розчиненою речовиною (наприклад, сполуким формули I) і розчинником. Розчинник являє собою фармацевтично прийнятний розчинник, переважно, такий як вода; зазначений розчинник не повинен впливати на біологічну активність розчиненої речовини. Вираження «Можливо» означає, що описана після нього подія(ї) можуть відбуватися або не відбуватися, і охоплює обидва випадки, коли подія(ї) відбувається, і коли подія(ї) не відбувається. Термін «заміщений» відноситься до заміщення зазначеним замісником або замісниками, множинні ступені заміщення припустимі, якщо не визначено інакше. Переважні сполуки згідно із даним винаходом являють собою сполуки формули I-A, наведеної нижче N O P , B N N Q J I-A R1 R2 або фармацевтично прийнятні солі, гідрати або сольвати зазначених сполук, де: R1 й R2 незалежно один від одного являють собою водень, -(C1-C6)алкіл, -(C2-C6)алкенил -(C2C6)алкінил, арилалкіл, гетероарилалкіл, гідроксил, аминогрупу, аминоалкіл, гідроксиалкіл, -(C1C6)алкоксил, або R1 й R2 разом можуть утворювати (C3-C7)циклоалкільне кільце, карбонільний зв'язок C=O або вуглець-вуглецевий подвійний зв'язок; P й Q незалежно один від одного являють собою циклоалкільну, гетероциклоалкільну, арильну або гетероарильну групу формули R3 R6 R4 22 S R5 , D N R3 R4 S H R4 , G E F R5 R3, R4, R5, R6, і R7 незалежно один від одного являють собою наступні замісники: водень, галоген, -NO2, -(C1-C6)алкіл, -(C3-C6)циклоалкіл, -(C3C7)циклоалкілалкіл, -(C2-C6)алкенил, -(C2 C6)алкінил, галоген-(C1-C6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, -OR8, -NR8R9, C(=NR10)NR8R9, -NR8COR9, NR8CO2R9, NR8SO2R9, NR10CO NR8R9, -SR8, -S(=O)R8, -S(=O)2R8, 23 92496 собою визначені вище групи; J являє собою одинарний зв'язок, -C(R11)(R12), -O-, -N(R11)- або -S-; R11, R12 незалежно один від одного являють собою водень, -(C1-C6)алкіл, -(C3-C6)циклоалкіл, (C3-C7)циклоалкілалкіл, -(C2-C6)алкенил, -(C2C6)алкінил, галоген-(C1-C6)алкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, несе заміщення 1-5 замісниками, кожен з яких незалежно являє собою: галоген, -CN, -(C1C6)алкіл, -O(C0-C6)алкіл, -O(C3-C7)циклоалкілалкіл, -O(арил), -O(гетероарил), -N((C0-C6)алкіл)((C0C6)алкіл),-N((C0-C6)алкіл)((C3-C7)циклоалкіл) або N((C0-C6)алкіл)(арил); Будь-який N може являти собою N-оксид; Даний винахід охоплює обидва можливих стереоізомери, а також включає як рацемічні сполуки, так й індивідуальні енантиомери. Більше переважні сполуки згідно із даним винаходом являють собою сполуки формули I-B S(=O)2NR8R9, -C(=O)R8, -C(=O)-O-R8, -C(=O)NR8R9, -C(=NR8)R9, або C(=NOR8)R9; при цьому, можливо, два замісники разом з атомами, що перебувають між ними, утворюють біциклічне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце, можливо, додатково несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(C1-C6)алкіл, -O-(C0-C6)алкіл, -O-(C3C7)циклоалкілалкіл, -O(арил), O(гетероарил), -O-(C1-C3)алкіларил, -O-(C1-C3)алкілгетероарил, -N((C0-C6)алкіл)((C0-C3)алкіларил) або -N((C0C6)алкіл)((C0-C3-)алкілгетероарил); R8, R9, R10 незалежно один від одного являють собою: водень, (C1-C6)алкіл, (C3-C6)циклоалкіл, (C3-C7)циклоалкілалкіл, (C2-C6)алкенил, (C2C6)алкінил, галоген-(C1-C6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожної з яких, можливо несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(C1-C6)алкіл, -O-(C0-C6)алкіл, -O-(C3C7)циклоалкілалкіл, -O(арил), -O(гетероарил), N((C0-C6)алкіл)2, -N((C0-C6)алкіл)((C3C7)циклоалкіл) або -N((C0-C6)алкіл)(арил); D, E, F, G й H незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-,-C(=O)-,-C(=S), -O-, -N=, -N(R3)- або -S-; B являє собою одинарний зв'язок, -C(=O)-(C0C2)алкіл-, -C(=O)-(C2-C6)алкенил-, -C(=O)-(C2C6)алкінил-, -C(=O)-O-, -C(=O)NR8-(C0-C2)алкіл-, C(=NR8)NR9-S(=O)-(C0-C2)алкіл-, -S(=O)2-(C0C2)алкіл-, -S(=O)2NR8-(C0-C2)алкіл-, C(=NR8)-(C0C2)алкіл-, -C(=NOR8)-(C0-C2)алкілабо C(=NOR8)NR9-(C0-C2)алкіл-; R8 й R9, незалежно один від одного являють R7 R3 R3 N R6 R4 R5 , N P , O O N N Q J I-B або фармацевтично прийнятні солі, гідрати або сольвати зазначених сполук, де: P й Q незалежно один від одного представляють: циклоалкільну, гетероциклоалкільну, арильну або гетероарильну групу формули R3 R6 R4 24 S R5 , D N R3 R4 S H R4 , G E F R5 R3, R4, R5, R6, і R7 незалежно один від одного являють собою: водень, галоген, -NO2, -(C1C6)алкіл, -(C3-C6)циклоалкіл, -(C3C7)циклоалкілалкіл, -(C2-C6)алкенил, -(C2C6)алкінил, галоген-(C1-C6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, -OR8, -NR8R9, C(=NR10)NR8R9, -NR8COR9, NR8CO2R9, NR8SO2R9, NR10CO NR8R9, -SR8, -S(=O)R8, -S(=O)2R8, S(=O)2NR8R9, -C(=O)R8, -C(=O)-O-R8, -C(=O)NR8R9, -C(=NR8)R9, або -C(=NOR8)R9; при цьому, можливо, два замісники разом з атомами, що перебувають між ними, утворюють біциклічне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце, можливо, додатково несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(C1-C6)алкіл, -O-(C0C6)алкіл, -O-(C3-C7)циклоалкілалкіл, -O(арил), O(гетероарил), -O-(-C1-C3)алкіларил, -O-(C1-C3) алкілгетероарил, -N((-C0-C6)алкіл)((C0C3)алкіларил) або -N((C0-C6)алкіл)((C0-C3)алкілгетероарил); R8, R9, R10 незалежно один від одного являють собою: водень, (C1-C6)алкіл, (C3-C6)циклоалкіл, (C3-C7)циклоалкілалкіл, (C2-C6)алкенил, (C2C6)алкінил, галоген-(C1-C6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, заміщений 1-5 незалежними замісниками: галоген, -CN, -(C1-C6)алкіл, -O-(C0C6)алкіл, -O-(C3-C7)циклоалкілалкіл, -O(арил), O(гетероарил), -N((C0-C6)алкіл)2, -N((C0C6)алкіл)((C3-C7)циклоалкіл) або -N((C0C6)алкіл)(арил); D, E, F, G й H незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-,-C(=O)-,-C(=S), -O-, -N=, -N(R3)- або -S-; J являє собою одинарний зв'язок, -C(R11)(R12), -O-, -N(R11)- або -S-; R11, R12 незалежно один від одного являють собою водень, -(C1-C6)алкіл, -(C3-C6)циклоалкіл, (C3-C7)циклоалкілалкіл, -(C2-C6)алкенил, -(C2C6)алкінил, галоген-(C1-C6)алкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких можливо додатково несе заміщення 1-5 групами, кожна з яких незалежно являє собою: галоген, CN, -(C1-C6)алкіл, -O(C0-C6)алкіл, -O(C3C7)циклоалкілалкіл, -O(арил), -O(гетероарил), 25 N((C0-C6)алкіл)((C0-C6)алкіл),-N((C0-C6)алкіл)((C3C7)циклоалкіл) або -N((C0-C6)алкіл)(арил); будь-який N може являти собою N-оксид; даний винахід охоплює обидва можливих стереоізомери, а також як їх рацемічні сполуки, і індивідуальні енантиомери. Особливо переважними сполукими є: (4-фторфеніл)-{5-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-3,6-дигідро-2H-пиридин-1іл}-метанон (4-фторфеніл)-{2-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-ілметил]-пиролидин-1-іл}метанон 2-фтор-5-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонил}бензонитрил (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-метилізоксазол-4-іл)-метанон (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(5-метилізоксазол-4-іл)-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-феноксиметилфенил)-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(тетрагідротиопиран-4-іл)-метанон (5-фторіндан-1-іл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(тетрагідропиран-4-іл)-метанон циклогексил-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (3-бензоилфенил)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2,4,6-трифторфеніл)-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(4-метил-[1,2,3]тиадиазол-5-іл)метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-фторпиридин-3-іл)-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-пиридин-2-ілметанона гідрохлорид {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-метилпиридин-3-іл)-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(1,2,5-триметил-1H-пирол-3-іл)метанон (2,4-диметилтиазол-5-іл)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-o-толилметанон (2-етилфенил)-{3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (1,5-диметил-1H-пиразол-4-іл)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-фуран-3-ілметанон (2,5-диметилфуран-3-іл)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-метилфуран-3-іл)-метанон (S)-(2,3-дигідробензо[1,4]диоксин-5-іл)-{3-[3-(4 92496 26 фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон (S)-(4-фтор-3-метоксифенил)-{3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-метилпиридин-4-іл)-метанон (S)-(2-бромтиофен-3-іл)-{3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(6-фторпиридин-3-іл)-метанон (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-метилфуран-2-іл)-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-метокситиофен-2-іл)-метанон (4-фтор-2-метилфенил)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон (4-фторфеніл)-{(S)-3-[3-(6-метилпиридин-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (4-фторфеніл)-{(S)-3-[3-(5-метилфуран-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (4-фторфеніл)-[(S)-3-(3-фуран-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-метилтиофен-3-іл)-метанон (4-фторфеніл)-[(S)-3-(3-тиофен-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (4-фторфеніл)-[(S)-3-(3-тиофен-3-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (4-фторфеніл)-{(S)-3-[3-(1-метил-1H-пирол-2іл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (4-фторфеніл)-{(S)-3-[3-(3-метилпиридин-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-трифторметил-1H-пиразол-4іл)-метанон (4-фтор-2-метиламинофенил)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(4-метил-1H-пирол-3-іл)-метанон (5-метилізоксазол-4-іл)-[(S)-3-(3-тиофен-3-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (3,4-дифторфеніл)-[(S)-3-(3-тиофен-3-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (5-етилізоксазол-4-іл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(5-метоксиметилізоксазол-4-іл)метанон (4-фторфеніл)-[(S)-3-(3-o-толил[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-метиламинофенил)-метанон (4-фторфеніл)-[(S)-3-(3-тиазол-4-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (3,4-дифторфеніл)-[(S)-3-(3-тиазол-4-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (3,4-дифторфеніл)-[(S)-3-(3-пиридин-4-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (4-фтор-2-метилфенил)-[(S)-3-(3-пиридин-4-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (3,4-дифторфеніл)-[(S)-3-(3-пиридин-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон 27 (2-бензиламинофенил)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон (5-метилізоксазол-4-іл)-[(S)-3-(3-феніл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (4-фторфеніл)-[(S)-3-(3-пиразин-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон {(S)-3-[3-(4-диметиламинофенил)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-(4фторфеніл)-метанон (2,4-дифторфеніл)-[(S)-3-(3-феніл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (2,4-дифторфеніл)-{(S)-3-[3-(2-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон {(S)-3-[3-(2-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(5-метилізоксазол-4-іл)-метанон (6-фторпиридин-3-іл)-[(S)-3-(3-феніл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (4-фтор-2-метилфенил)-[(S)-3-(3-феніл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон {(S)-3-[3-(2-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(6-фторпиридин-3-іл)-метанон {(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадиазол5-іл]-пиперидин-1-іл}-(5-метилізоксазол-4-іл)метанон {(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадиазол5-іл]-пиперидин-1-іл}-(6-фторпиридин-3-іл)метанон {(S)-3-[3-(2,4-дифторфеніл)-[1,2,4]оксадиазол5-іл]-пиперидин-1-іл}-(4-фтор-2-метилфенил)метанон (3,4-дифторфеніл)-{(S)-3-[3-(2,4-дифторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (2,4-дифторфеніл)-{(S)-3-[3-(2,4-дифторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (2,4-дифторфеніл)-[(S)-3-(3-пиридин-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон (4-фтор-2-метилфенил)-{(S)-3-[3-(2фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон (4-фторфеніл)-{(S)-3-[3-(2-метилтиазол-5-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (6-фторпиридин-3-іл)-{(S)-3-[3-(2-метилтиазол5-іл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}метанон (2,4-дифторфеніл)-{(S)-3-[3-(2-метилтиазол-5іл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон (3,4-дифторфеніл)-{(S)-3-[3-(2-метилтиазол-5іл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(4-трифторметоксифенил)метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-фторпиридин-4-іл)-метанон {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-фторпиридин-4-іл)-метанон. Даний винахід відноситься до фармацевтично прийнятних солей, утворених приєднанням кислот до сполук формули I або до фармацевтично прийнятних носіїв або розріджувачів. Даний винахід відноситься до способу лікування або запобігання стану в ссавця, включаючи людину, лікування або запобігання якого здійснюють або полегшують за допомогою нейромодуляторної дії алостеричних модуляторів mGluR5 і зок 92496 28 рема позитивних алостеричних модуляторів mGluR5. Даний винахід відноситься до способу лікування або запобігання різних розладів периферичної й центральної нервової системи, таких толерантність або залежність, тривога, депресія, психіатричне захворювання, таке як психоз, запальна або нейропатична біль, погіршення пам'яті, хвороба Альцгеймера, ішемія, зловживання й схильність до наркотиків, як визначено в прикладеній формулі винаходу. Даний винахід відноситься до фармацевтичних композицій, які забезпечують від приблизно 0,01 до 1000мг активного компонента на окрему дозу. Зазначені композиції можна вводити будьяким підходящим способом. Наприклад, орально у формі капсул або таблеток, парентерально у формі розчинів для ін'єкцій, поверхово у формі мазей або лосьонів, через очі у формі очної примочки, ректально у формі супозиториїв. Фармацевтичні композиції згідно із даним винаходом можна виготовити загальноприйнятими в цій області способами; тип застосовуваних фармацевтичних композицій може залежати від обраного способу введення. Загальна добова доза зазвичай перебуває в межах від приблизно 0,05 до 2000мг. Способи синтезу Сполуки загальної формули I можна одержати способами, відомими в області органічного синтезу, як це частково описано в нижченаведених схемах синтезу. У всіх описаних нижче схемах варто розуміти, що для чутливих або реакційноздатних груп у разі потреби застосовують захисні групи відповідно до загальних принципів хімії. На захисні групи впливають у відповідності зі стандартними способами органічного синтезу (Green T.W. and Wuts P.G.M. (1991) Protecting Groups in Organic Synthesis, John Wiley et Sons). Зазначені групи видаляють на підходящій стадії синтезу сполуки із застосуванням способів, очевидних для фахівців у даній області. Вибір процесу, як і умов реакції й порядку їхнього виконання, повинен відповідати готуванню сполук формули I. Сполуки формули I можуть бути представлені у виді суміші енантиомерів, яку можна розділити на індивідуальні чисті R- або S-енантиомери. Якщо, наприклад, бажано одержати конкретний енантиомер сполуки формули I, його можна одержати шляхом асиметричного синтезу, або способом одержання із застосуванням хиральної допоміжної речовини, при цьому розділяють отриману суміш диастереомерів і видаляють допоміжну групу, щоб одержати необхідні енантиомери в очищеному виді. Як варіант, якщо молекула містить основну функціональну групу, таку як аминогрупа, або кислотну функціональну групу, таку як карбоксил, зазначене поділ легко можна здійснити шляхом фракційної кристалізації з різних розчинників солей сполук формули I з оптично активними кислотами або іншими відомими в літературі способами, наприклад, хиральною колоночною хроматографією. Поділ кінцевого продукту й проміжної або вихідної речовини можна здійснювати будь-яким 29 підходящим способом, відомим у даній області техніки, як описано Eliel E.L., Wilen S.H. and Mander L.N. (1984) Stereochemistry of Organic Compounds, Wiley-Interscience. Безліч гетероциклічних сполук формули I можна одержати, використовуючи широко відомі в даній області синтетичні підходи (Katrizky A.R. and. Rees C.W. (1984) Comprehensive Heterocyclic Chemistry, Pergamon Press). Продукт реакції можна виділити й очистити, застосовуючи стандартні методики, такі як екстракція, хроматографія, кристалізація, перегонка, тощо. 92496 30 Сполуки формули I, у яких W являє собою 3заміщене пиперидинове кільце, можна одержати відповідно до послідовності синтезу, показаної на Схемах 1-4. При цьому P й Q незалежно один від одного являють собою арил або гетероарил, як описано вище B являє собою -C(=O)-(C0-C2)алкіл-; -S(=O)2(C0-C2)алкіл-. речовину амидоксим можна одержати відомими способами органічного синтезу, що частково описує наступна схема синтезу Схема 1. Схема 1 У свою чергу, проводять реакцію нитрильного похідного (наприклад, 4-фторбензонитрил) з гідроксиламином у нейтральному або лужному середовищі, такий як триетиламин, ди-изопропилетиламин, карбонат натрію, гідроксид натрію, тощо, у підходящому розчиннику (наприклад, метиловий спирт, етиловий спирт). Реакцію, як правило, проводять при повільному підвищенні температури реакційної суміші від кімнатної температури до температури в діапазоні від 70°С до 80°С включно за час у діапазоні від приблизно 1 години до 48 годин включно (див. наприклад, Lucca, George V. De; Kim, Ui T.; Liang, Jing; Cordova, Beverly; Klabe, Ronald M.; et al; J.Med.Chem.; EN; 41; 13; 1998; 2411-2423, Lila, Christine; Gloanec, Philippe; Cadet, Laurence; Herve, Yolande; Fournier, Jean; et al.; Synth.Commun.; EN; 28; 23; 1998; 4419-4430 і див.: Sendzik, Martin; Hui, Hon C.; Tetrahedron Lett.; EN; 44; 2003; 8697-8700 і наведені тут посилання на реакцію в нейтральному середовищі). Схема 2 Заміщене похідне амидоксиму (описане на Схемі 1) можна перетворити в похідне ациламидоксиму із застосуванням способу, наведеного на Схемі 2. На Схемі 2, PG1 являє собою амінозахисну групу, таку як трет-бутилоксикарбонил, бензилоксикарбонил, этоксикарбонил, бензил, і тому подібних. Реакцію сполучення можна прискорити за допомогою агентів сполучення, відомих в області органічного синтезу, таких як КДІ (1-(3диметиламинопропил)-3-етилкарбодиїмід), ДЦК (N,N’-дициклогексилкарбодиїмід), у присутності підходящої основи, такої як триетиламин, ди-ізопропилетиламин, у підходящому розчиннику (наприклад, тетрагідрофуран, дихлорметан, N,Nдиметилформамид, диоксан). Зазвичай в реакційній суміші може також бути присутнім докаталізатор, такий як HOBT (гідроксибензотриазол), HOAT (1-гідрокси-7-азабензотриазол). Реак цію зазвичай проводять у температурному діапазоні від кімнатної температури до 60°С включно протягом інтервалу часу від приблизно 2 годин до 12 годин, щоб одержати проміжну сполуку ациламидоксим. Реакцію циклізації можна викликати термічно в діапазоні температур від приблизно 80°С до приблизно 150°С протягом приблизно 218 годин (див. наприклад, Suzuki, Takeshi; Iwaoka, Kiyoshi; Imanishi, Naoki; Nagakura, Yukinori; Miyata, Keiji; et al.; Chem.Pharm.Bull.; EN; 47; 1; 1999; 120122). Продукт реакції можна виділити й очистити з використанням стандартних методик, таких як екстракція, хроматографія, кристалізація, перегонка, тощо. Кінцеву стадію можна здійснювати або способом, описаним на Схемі 3, або способом, описаним на Схемі 4. 31 92496 32 Схема 3 Як показано на Схемі 3, захисні групи PG1 видаляють із використанням стандартних способів. На Схемі 3, де B визначено вище,xявляє собою галоген, наприклад, похідне пиперидину, взаємодіє з показаною реакцією арил- або гетероарилацилхлоридом з використанням способу, легко зрозумілого фахівцю. Реакцію можна прискорити за допомогою основи, такої як триетиламин, диізо-пропиламин, пирирдин, у підходящому розчиннику (наприклад, тетрагідрофуран, дихлорметан). Реакцію зазвичай проводять при повільному підвищенні температури реакційної суміші від 0°С до кімнатної температури протягом інтервалу часу від приблизно 4 годин до 12 годин. Схема 4 Як показано на Схемі 4, захисні групи PG1 видаляють із використанням стандартних способів. Реакцію сполучення можна прискорити за допомогою агентів сполучення, відомих в області органічного синтезу, таких як КДІ (1-(3диметиламинопропил)-3-етилкарбодиїмід), ДЦК (N,N’-дициклогексилкарбодиїмід), або за допомогою агентів сполучення на полімерному носії, таких як карбодиїмід на полімерному носії (PS-DCC, ex Argonaut Technologies), у присутності підходящої основи, такої як триетиламин, ди-ізопропилетиламин, у підходящому розчиннику (наприклад, тетрагідрофуран, дихлорметан, N,Nдиметилформамид, диоксан). Зазвичай в реакцій ній суміші може також бути присутнім співкаталізатор, такий як HOBT (гідроксибензотриазол), HOAT (1-гідрокси-7-азабензотриазол). Реакцію зазвичай проводять при кімнатній температурі протягом інтервалу часу від приблизно 2 годин до 12 годин. Сполуки формули I, у яких W являє собою 2заміщене морфолинове кільце, можна одержати відповідно до послідовності синтезу, показаної на Схемах 5-6. При цьому P й Q незалежно один від одного являють собою арил або гетероарил, як описано вище, B являє собою -C(=O)-(C0-C2)алкіл-; -S(=O)2(C0-C2)алкіл-. Схема 5 На Схемі 5, заміщене похідне амидоксиму (описане на Схемі 1) можна перетворити в похідне ацил-амидоксиму, шляхом взаємодії з похідним морфолину, за допомогою процесу, подібного тоСхема 6 му, що описаний на Схемі 2. Подібним чином, похідне ацил-амидоксиму можна циклізувати у похідне 1,2,4-оксадиазолу відповідно до процесу, описаному на Схемі 2. 33 Як показано на Схемі 6, захисні групи PG1 видаляють із застосуванням стандартних способів. Реакція сполучення, показана на Схемі 6, подібна до реакцій, описаних на Схемах 3 й 4 (при цьому X=OH). Сполуки формули I, у яких W являє собою 2заміщене пиперазинове кільце, можна одержати 92496 34 відповідно до послідовності синтезу, показаної на Схемах 7-9. При цьому P й Q незалежно один від одного являють собою арил або гетероарил, як описано вище B являє собою -C(=O)-(C0-C2)алкіл-; -S(=O)2(C0-C2)алкіл-. Схема 7 На Схемі 7 пиперазин-2-карбоновую кислоту селективно захищають по атому азоту в положенні 4. PG1 являє собою аміно-захисну групу, таку як тбутилоксикарбонил, тощо. Зазначену реакцію можна здійснити за допомогою таких реагентів, як 2(boc-оксимино)-2-фенилацетонитрил, ди-третбутилдикарбонат, тощо, у суміші підходящого органічного розчинника (наприклад, диоксан, тетрагідрофуран) з водою. Зазвичай pН реакційної суміші підтримують у діапазоні від 8 до 12, додаючи підходящу основу, таку як гідроксид натрію, гідроксид калію, триетиламин або аналогічну. Реакцію зазвичай проводять при кімнатній температурі протягом інтервалу часу від приблизно 1 години до 4 годин (див. наприклад: Bigge, Christopher F.; Hays, Sheryl J.; Novak, Perry M.; Drummond, James T. et al.; Tetrahedron Letters; 30, 39; 1989; 51935196 and WO 2004/022061). Захищене по N4 похідне пиперазину можна перетворити в похідне пиперазину, що заміщене в положенні 1, використову ючи стандартні умови для відновлювального аминування. R11 може являти собою, наприклад, C1C6-алкіл, C3-C6-циклоалкіл, C3-C7-циклоалкілалкіл, арилалкіл, гетероарилалкіл. Реакцію можна здійснювати шляхом взаємодії захищеного по N4 похідного пиперазину з альдегідом або кетоном (наприклад, формальдегідом) у присутності підходящого відновлювального агента, такого як триацетоксиборогідрид натрію, циано-борогідрид натрію, борогідрид натрію, тощо, у підходящому розчиннику, такому як ацетонитрил, тетрагідрофуран, метанол, этанол, 1,2-дихлорэтан, тощо. Зазвичай для здійснення реакції необхідне додавання кислоти, щоб понизити pН реакційної суміші до значення pН нижче, ніж приблизно 7, при цьому кислоту додають у міру необхідності, і використають таку кислоту, як оцтова кислота, соляна кислота або аналогічна сполука. Реакцію зазвичай проводять при кімнатній температурі протягом проміжку часу від приблизно 2 годин до 4 годин. Схема 8 На Схемі 8, заміщене похідне амидо-оксима (описане на Схемі 1) можна перетворити в похідне ацил-амидо-оксиму, шляхом взаємодії з похідним пиперазину (як описано на Схемі 8), за допомогою процесу, подібного до процесу, описаному на Схемі 2. Подібним образом, похідне ацил-амидооксиму можна циклізувати у похідне 1,2,4оксадиазолу, відповідно до процесу, описаному на Схемі 2. Схема 9 Як показано на Схемі 9, захисні групи PG1 видаляють із застосуванням стандартних способів. Реакція сполучення, показана на Схемі 9, подібна до реакцій, описаним на Схемах 3 й 4 (X=галоген, OH). Сполуки формули I, що мають основну природу, можуть утворювати широкий спектр різних фа 35 рмацевтично прийнятних солей з різними органічними й неорганічними кислотами. Зазначені солі легко одержати обробкою основних сполук, власне кажучи, еквівалентною кількістю обраної мінеральної або органічної кислоти в підходящому органічному розчиннику, такому як метанол, етанол або ізо-пропанол (див. Stahl P.H., Wermuth C.G., Handbook of Pharmaceuticals Salts, Properties, Selection and Use, Wiley, 2002). Наступні не обмежувальні приклади призначег (грами) мг (міліграми) мл (мілілітри) μл (мікролітри) M (молярний) МГц (мегагерц) ммоль (мілімолі) мін (хвилини) AcOEt (етилацетат) K2CO3 (карбонат калію) CDCl3 (дейтерійований хлороформ) КДІ.HCl (1-(3-диметиламинопропил)-3етилкарбодиїмід, гідрохлорид) EtOH (етиловий спирт) % (відсоток) ДХМ (дихлорметан) DIEA (ди-изо-пропилетиламин) Т. пл. (температура плавлення) Всі посилання на розчин солі відносяться до насиченого водяного розчину NaCl. Якщо не зазначено інакше, всі температури виражені в °C (градуси Цельсия). Всі реакції проводять в інертній атмосфері при кімнатній температурі, якщо не відзначене інше. 1 H ЯМР спектри записують на приладі Brucker 500МГц або на Brucker 300МГц. Хімічні зрушення виражені в мільйонних частках (м. буд., одиниці δ). Константи взаємодії виражені в герцах (Гц). Структури розщеплення описують видимі мультиплетности й позначені як с (синглет), д (дублет), т (триплет), кв (квадруплет), квінт (квінтуплет), м (мультиплет). РХ-МС записують у наступних умовах: Спосіб A) Прилад Waters Alliance 2795 HT Micromass ZQ. Стовпчик Waters XTerra MS C18 (50x4,6мм, 2,5μм). Витрата 1мол/хв. Рухлива фаза: фаза A=вода/CH3CN 95/5+0,05% ТФУК, фаза B=вода/CH3CN=5/95+0,05% ТФУК. 0-1хв. (A: 95%, B: 5%), 1-4хв. (A: 0%, B: 100%), 4-6хв. (A: 0%, B: 100%), 6-6,1хв. (A: 95%, B: 5%). T=35°C; УФдетектирование: Waters Photodiode array 996, 200400нм. Спосіб B) Прилад Waters Alliance 2795 HT Micromass ZQ. Стовпчик Waters XTerra MS C18 (50x4,6мм, 2,5μм). Витрата 1,2мол/хв. Рухлива фаза: фаза A=вода/CH3CN 95/5+0,05% ТФУК, фаза B=вода/CH3CN=5/95+0,05% ТФУК. 0-0,8хв. (A: 95%, B: 5%), 0,8-3,3хв. (A: 0%, B: 100%), 3,3-5хв. (A: 0%, B: 100%), 5-5,1хв. (A: 95%, B: 5%). T=35°C; УФ-детектирование: Waters Photodiode array 996, 200-400нм. Спосіб C) Прилад Waters Alliance 2795 HT 92496 36 ні проілюструвати даний винахід. Фізичні дані, наведені для сполук, що служить прикладами, узгодяться із установленою структурою зазначених сполук. Приклади Якщо не обговорене інше, всі вихідні речовини отримані від промислових постачальників і використані без подальшого очищення. Зокрема, наступні скорочення можуть бути використані в прикладах і протягом опису. кт (кімнатна температура) MeOH (метанол) Гц (Герц) РХ-МС (Рідинна Хроматографія — Мас-спектрометрія) ВЕРХ (Високо Ефективна Рідинна Хроматографія) ЯМР (Ядерний Магнітний Резонанс) 1H (протон) Na2SO4 (сульфат натрію) MgSO4 (сульфат магнію) HOBT (1-гідроксибензотриазол) RT (час утримання) NaOH (гідроксид натрію) ч (година) HCl (соляна кислота) n-BuLi (н-бутиллітій) ТГФ (тетрагідрофуран) Micromass ZQ. Стовпчик Waters Symmetry C18 (75x4,6мм, 3,5μм). Витрата 1мол/хв. Рухлива фаза: фаза A=вода/CH3CN 95/5+0,05% ТФУК, фаза B=вода/CH3CN=5/95+0,05% ТФУК. 0-0,1хв. (A: 95%, B: 5%), 1-11хв. (A: 0%, B: 100%), 11-12хв. (A: 0%, B: 100%), 12-12,1хв. (A: 95%, B: 5%). T=35°C; УФ-детектирование: Waters Photodiode array 996, 200-400нм. Спосіб D) Прилад Waters Alliance 2795 HT Micromass ZQ. Стовпчик Waters Symmetry C18 (75x4,6мм, 3,5μм). Витрата 1,5мол/хв. Рухлива фаза: фаза A=вода/CH3CN 95/5+0,05% ТФУК, фаза B=вода/CH3CN=5/95+0,05% ТФУК. 0-0,5хв. (A: 95%, B: 5%), 0,5-7хв. (A: 0%, B: 100%), 7-8хв. (A: 0%, B: 100%), 8-8,1хв. (A: 95%, B: 5%). T=35°C; УФдетектирование: Waters Photodiode array 996, 200400нм. Спосіб E): Pump 515, 2777 Sample Manager, Micromass ZQ Single quadrupole (Waters). Стовпчик 2,1*50мм нержавіюча сталь, набита 3,5 м SunFire RP C-18 (Waters); витрата 0,25мол/хв, коефіцієнт поділу MS: відходи / 1:4; Рухлива фаза: фаза A=вода/ацетонитрил 95/5+0,1% ТФУК, фаза B=вода/ацетонитрил 5/95+0,1% ТФУК. 0-1,0хв. (A: 98%, B: 2%), 1,0-5,0хв. (A: 0%, B: 100%), 5,0-9,0хв. (A: 0%, B: 100%), 9,1-12хв. (A: 98%, B: 2%); УФдетектирование: довжина хвилі 254 нм; Обсяг закола: 5μл. Спосіб F): система ВЕРХ: Waters Acquity, детектор MS: Waters ZQ2000. Стовпчик: Acquity UPLC-BEH C18 50x2, ммx1,7μм; витрата 0,4мол/хв; рухлива фаза: фаза A=вода/ацетонитрил 95/5+0,1% ТФУК, фаза B=вода/ацетонитрил 5/95+0,1% ТФУК. 0-0,25хв. (A: 37 92496 98%, B: 2%), 0,25-4,0хв. (A: 0%, B: 100%), 4,05,0хв. (A: 0%, B: 100%), 5,1-6хв. (A: 98%, B: 2%); УФ-детектування: довжина хвилі 254нм. Всі мас-спектри зняті способами електророзпилювальної іонізації (ESI). За ходом більшості реакцій спостерігали за допомогою тонкошарової хроматографії на 0,25мм пластинах силікагелю Macherey-Nagel (60F-2254), візуалізація за допомогою УФ освітлення. Високошвидкісну колонкову хроматографію (flash chromatography) виконували на силікагелі (220-440 меш, Fluka). Визначення температури плавлення виконували на приладі Buchi B-540. Приклад 1 (4-фторфеніл)-{5-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-3,6-дигідро-2H-пиридин-1іл}-метанон N O N F N F O 1 (A) 5,6-дигідро-2H-пиридин-1,3-дикарбонової кислоти 1-трет-бутиловий ефір До розчину гідрохлориду 1,2,5,6тетрагідропиридин-3-карбонової кислоти (0,6м, 3,66ммоль, ex Asinex) у воді (15мол) і диоксані (15мол) додають 1N NaOH, щоб довести величину p до 11. Потім за один прийом додають ди-третбутилкарбонат (0,88м, 4,03ммоль) і залишають реакційну суміш при перемішуванні на всю ніч. Видаляють розчинник при зниженому тиску й висушують отриману коричневу тверду речовину у вакуумній печі при 50°С протягом ночі, а потім використовують на наступній стадії без подальшого очищення. РХ-МС (RT): 6,5хв. (Спосіб C); МС (ES+) дає m/z: 228,0, 128,0. 1 (B) 5-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5іл]-3,6-дигідро-2H-пирирдин-1-карбонові кислоти 1трет-бутиловий ефір Суміш 5,6-дигідро-2H-пиридин-1,3дикарбонової кислоти 1-трет-бутилового ефіру (3,66ммоль), 4-фтор-N-гідроксибензамидина (0,565м, 3,66ммоль), HOBT (0,495м, 3,66ммоль), КДІ.HCl (1,052м, 5,49ммоль) і сухого триетиламину (0,77мол, 5,49ммоль) у сухому диоксані (40мол) витримують при перемішуванні й кімнатній температурі протягом уікенду, в атмосфері азоту. Потім реакційну суміш кип'ятять зі зворотним холодильником протягом 6 годин і випарюють розчинник при зниженому тиску. Отриманий залишок розбавляють водою (40мол) і етилацетатом (40мол), розділяють фази й промивають органічний шар послідовно водою (40мол, двічі), 1N NaOH (40мол, двічі) і розчином солі. Органічний шар висушують над сульфатом натрію й видаляють розчинник у вакуумі, щоб одержати 1,3г коричневого масла, яке очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: гексан/етилацетат 8:2). Одержують 5-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-3,6-дигідро-2Hпирирдин-1-карбонової кислоти трет-бутиловий ефір у виді білої твердої речовини (1,0г). 38 Вихід: 79%; РХ-МС (RT): 7,05хв. (Спосіб C); МС (ES+) дає m/z: 345,9, 289,9; 1 H-ЯМР (CDCl3), δ (м. буд.): 8,10 (дд, 2H); 7,22 (м, 1H); 7,16 (дд, 2H); 4,41 (м, 2H); 3,60 (т, 2H); 2,44 (м, 2H); 1,51 (з, 9H). 1 (C) 5-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5іл]-1,2,3,6-тетрагідропиридину гідрохлорид До розчину 5-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-3,6-дигідро-2H-пирирдин-1карбонової кислоти трет-бутилового ефіру (0,3м, 0,87ммоль) у дихлорметані (5мол) додають 4мол 4N HCl (диоксановий розчин) при 0°С, дозволяють реакційній суміші нагрітися до кімнатної температури й перемішують протягом 3 годин. Випарюють розчинник при зниженому тиску, щоб одержати цільову сполуку у виді білої твердої речовини (244мг), яку використовують на наступній стадії без подальшого очищення. Вихід: 100%; РХ-МС (RT): 5,0хв. (Спосіб C); МС (ES+) дає m/z: 246,0. 1 (D) (4-фторфеніл)-{5-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-3,6-дигідро-2H-пиридин-1іл}-метанон До суспензії 5-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-1,2,3,6-тетрагідропиридину гідрохлориду (244мг, 0,87ммоль) у сухому дихлорметані (10мол), додають по краплях при 0°C триетиламин (256μл, 1,82ммоль) і 4фторбензоілхлорид (103μл, 0,87ммоль). Залишають реакційну суміш нагрітися до кімнатної температури й перемішують протягом ночі в атмосфері азоту. Потім розчин обробляють водою (5мол) і розділяють фази. Органічний шар промивають послідовно 1N HCl (10мол, 3 рази), 1N NaOH (10мол, двічі), потім висушують над Na2SO4 і випарюють при зниженому тиску. Одержують (4фторфеніл)-{5-[3-(4-фторфеніл)-[1,2,4]оксадиазол5-іл]-3,6-дигідро-2H-пиридин-1-іл-метанон у виді жовтої твердої речовини (0,28г). Вихід: 88%; т. пл.=138-140°C; РХ-МС (RT): 7,89хв. (Спосіб E); МС (ES+) дає m/z: 368,1. 1 H-ЯМР (CDCl3), δ (м. д.): 8,08 (м, 2H); 7,49 (дд, 2H); 7,26 (м, 1H); 7,16 (дд, 2H); 7,14 (дд, 2H); 4,60 (м, 2H); 3,75 (м, 2H); 2,54 (м, 2H). Приклад 2 (4-фторфеніл)-{2-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-ілметил]-пиролидин-1-іл}метанон N O N N F O F 2 (A) 2-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5ілметил]-пиролидин-1-карбонової кислоти третбутиловий ефір Суміш N-Boc-2-пиролидинуксусної кислоти (0,2м, 0,87ммоль), 4-фтор-N-гідроксибензамидину (0,13м, 0,87ммоль), HOBT (0,11м, 0,87ммоль), КДІ.HCl (0,25м, 1,31ммоль) і сухого триетиламину (0,24мол, 1,74ммоль) у сухому диоксані (15мол) витримують при перемішуванні й кімнатній температурі протягом 2 годин в атмосфері азоту. Потім реакційну суміш кип'ятять зі зворотним холодиль 39 ником протягом ночі, і випарюють розчинник при зниженому тиску. Отриманий залишок розбавляють дихлорметаном (20мол) і обробляють 5% розчином лимонної кислоти (10мол), розділяють фази й промивають органічний шар послідовно 10% розчином NaOH (10мол) і розчином солі. Органічний шар висушують над сульфатом натрію й видаляють розчинник при зниженому тиску, щоб одержати чорновий продукт у виді коричневого масла, яке очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: ДХМ/MeOH 99,9/0,1). Одержують 2-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-ілметил]пиролидин-1-карбонової кислоти трет-бутиловий ефір у виді білої твердої речовини (80мг). Вихід: 26%; РХ-МС (RT): 7,82хв. (Спосіб C); МС (ES+) дає m/z: 348,0, 291,9, 248,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,07 (дд, 2H); 7,16 (дд, 2H); 4,28 (м, 1H); 3,51-3 24 (м, 3H); 3,06 (м, 1H); 2,07 (м, 1H); 1,85 (м, 3H); 1,47 (з, 9H). 2 (B) 3-(4-фторфеніл)-5-пиролидин-2-ілметил[1,2,4]оксадиазолу гідрохлорид Розчин 2-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5ілметил]-пиролидин-1-карбонової кислоти третбутилового ефіру (0,08м, 0,23ммоль) в 4N HCl (диоксановий розчин, 4мол) перемішують при кімнатній температурі протягом 4 годин. Розчинник випарюють при зниженому тиску, щоб одержати цільову сполуку у виді білої твердої речовини (65мг), яку використовують на наступній стадії без подальшого очищення. Вихід: 100%; РХ-МС (RT): 6,2хв. (Спосіб C); МС (ES+) дає m/z: 248,0. 2 (C) (4-фторфеніл)-{2-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-ілметил]-пиролидин-1-іл}метанон До суспензії 3-(4-фторфеніл)-5-пиролидин-2ілметил-[1,2,4]оксадиазолу гідрохлориду (65мг, 0,23ммоль) у сухому дихлорметані (4мол) додають по краплях при 0°C триетиламин (80μл, 0,57ммоль) і 4-фторбензоилхдорид (30μл, 0,25ммоль). Залишають реакційну суміш нагрітися до кімнатної температури й перемішують протягом 12 годин в атмосфері азоту. Потім розчин обробляють 1N HCl (10мол) і розділяють фази. Органічний шар промивають послідовно 1N розчином NaOH (10мол) і розчином солі (6мол, двічі), потім висушують над Na2SO4 і випарюють при зниженому тиску, щоб одержати чорновий продукт у виді твердої речовини, яку очищають шляхом розтирання з диетиловим ефіром/гексаном 1:1. Одержують (4-фторфеніл)-{2-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-ілметил]-пиролидин-1-іл}метанон у виді білої твердої речовини (0,073г). Вихід: 86%; т. пл.=158-162°C; РХ-МС (RT): 7,68хв. (Спосіб E); МС (ES+) дає m/z: 369,9. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,09 (дд, 2H); 7,57 (дд, 2H); 7,17 (дд, 2H); 7,09 (дд, 2H); 4,70 (м, 1H); 3,47 (м, 4H); 2,27 (м, 1H); 1,84 (м, 3H). Приклад 3 2-фтор-5-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонил}бензонитрил 92496 40 N O N O N F N F 3 (A) (S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол5-іл]-пиперидин-1-карбонової кислоти третбутиловий ефір Суміш N-гідрокси-4-фторбензамидина (5м, 32,4ммоль), S-1-Boc-пиперидин-3-карбонової кислоти (7,43м, 32,4ммоль), КДІ.HCl (9,33м, 48,6ммоль), HOBT (4,9м, 32,4ммоль) і ТЕА (9мол, 64,8ммоль) у диоксані (60мол) перемішують протягом ночі при кімнатній температурі в атмосфері азоту. Потім реакційну суміш нагрівають при 100°С протягом 2 годин і випарюють розчинник при зниженому тиску. Отриманий залишок розбавляють водою (50мол) і етилацетатом (50мол), розділяють фази й промивають органічний шар 2N розчином Na2CO3 (50молx2 рази), висушують над Na2SO4. Випарювання розчинника при зниженому тиску дає чорновий продукт у виді твердої речовини, яку очищають за допомогою високошвидкісної хроматографії (силікагель, градієнт елюенту: від петролейний ефір/етилацетат 95:5 до петролейний ефір/етилацетат 9:1). Одержують (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонової кислоти трет-бутиловий ефір у виді білої твердої речовини (7,3г). Вихід: 65%. [α]D20=+70,7° (c=1,01, MeOH). 1 H-ЯМР (CDCl3), δ (м. буд.): 8,06 (дд, 2H); 7,15 (дд, 2H); 4,26 (м, 1H); 3,95 (м, 1H); 3,54-2,80 (м, 3H); 2,24 (м, 1H); 2,03-1,50 (м, 3H); 1,45 (з, 9H). 3 (B) (S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол5-іл]-пиперидину гідрохлорид До розчину (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонової кислоти трет-бутилового ефіру (0,2м, 0,57ммоль) у дихлорметані (5мол), додають при 0°С 4мол 4N HCl (диоксановый розчин), залишають реакційну суміш нагрітися до кімнатної температури й перемішують протягом 3 годин. Випарюють розчинник при зниженому тиску, щоб одержати цільову сполуку у виді білої твердої речовини (163мг), яку використовують на наступній стадії без подальшого очищення. Вихід: 100%; РХ-МС (RT): 4,9хв. (Спосіб C); МС (ES+) дає m/z: 248,0. 3 (C) 2-фтор-5-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонил}бензонитрил Суміш (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (224мг, 0,79ммоль), 3-циано-4-фторбензойної кислоти (140мг, 0,87ммоль), HOAT (162мг, 1,19ммоль), PS-DCC (ex Argonaut Technologies, 1,3м, 1,56ммоль, завантаження=1,2ммоль/г) і ТЕА (0,29мол, 1,98ммоль) у сухому дихлорметані (10мол) витримують при орбітальному перемішуванні (IKA Vibrax VXR). Смолу відфільтровують і неодноразово промивають дихлорметаном; фільтрат промивають 1N HCl (10молx2 рази), 1N NaOH (10молx2 рази) і розчином солі, потім висушують 41 92496 над сульфатом натрію й випарюють при зниженому тиску. Отриманий чорновий продукт очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: ДХМ/MeOH 99,8/0,2) щоб одержати 260мг 2-фтор-5-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонил}бензонітрилу. Вихід: 83% (біла тверда речовина); т. пл. 144146°C; [α]D20=+88,4° (c=2,24, CHCl3); РХ-МС (RT): 7,29хв. (Спосіб C); МС (ES+) дає m/z: 395,0. 1 H-ЯМР (ДМСО-d6, 373 K), δ (м. буд.): 8,03 (дд, 2H); 7,90 (дд, 1H); 7,80 (ддд, 1H); 7,53 (дд, 1H); 7,35 (дд, 2H); 4,18 (дд уш, 1H); 3,71 (дт, 1H); 3,62 (дд, 1H); 3,50-3,32 (м, 2H); 2,26 (м, 1H); 2,08-1,95 (м, 1H); 1,88-1,76 (м, 1H); 1,76-1,62 (м, 1H). Приклад 4 (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-метил-ізоксазол-4-іл)-метанон O O N O N N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 3-метилізоксазол-4-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Вихід: 99% (жовта смолиста тверда речовина); [α]D20=+86,0° (c=1,37, CHCl3); РХ-МС (RT): 6,9хв. (Спосіб E); МС (ES+) дає m/z: 357,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,46 (з, 1H); 8,06 (дд, 2H); 7,16 (дд, 2H); 4,39 (м, 1H); 3,93 (дт, 1H); 3,65 (дд, 1H); 3,41 (ддд, 1H); 3,24 (ддд, 1H); 2,37 (з, 3H); 2,32 (м, 1H); 2,16-1,87 (м, 2H); 1,76-1,59 (м, 1H). Приклад 5 (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(5-метил-ізоксазол-4-іл)-метанон O N O O N N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), з використанням 5-метилізоксазол-4-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Вихід: 95% (жовте масло); [α]D20=+95,1° (c=1,27, CHCl3); РХ-МС (RT): 6,91хв. (Спосіб E); МС (ES+) дає m/z: 357,1. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,23 (з, 1H); 8,06 (дд, 2H); 7,16 (дд, 2H); 4,39 (м, 1H); 3,94 (м, 1H); 3,59 (дд, 1H); 3,36 (ддд, 1H); 3,25 (ддд, 1H); 2,54 (з, 3H); 2,34 (м, 1H); 2,16-1,89 (м, 2H); 1,76-1,62 (м, 1H). Приклад 6 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-феноксиметилфенил)-метанон 42 O N O N O N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 3-феноксиметилбензойної кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Вихід: 40% (безбарвне масло); [α]D20=+83,8° (c=0,60, CHCl3); РХ-МС (RT): 9,24хв. (Спосіб E); МС (ES+) дає m/z: 458,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,06 (дд, 2H); 7,48 (м, 2H); 7,42 (дд, 1H); 7,36 (м, 1H); 7,26 (м, 2H); 7,14 (дд, 2H); 6,98-6,90 (м, 3H); 5,09 (з, 2H); 4,43 (м, 1H); 3,99 (м, 1H); 3,43 (дд, 1H); 3,30-3,17 (м, 2H); 2,33 (м, 1H); 2,08-1,82 (м, 2H); 1,76-1,57 (м, 1H). Приклад 7 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(тетрагідротиопиран-4-іл)-метанон O N O S N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням тетрагідротиопиран-4-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: гексан/етилацетат 7:3). Вихід: 46% (біла тверда речовина); т. пл.=139141°C; [α]D20=+81,9° (c=1,12, CHCl3); РХ-МС (RT): 7,54хв. (Спосіб E); МС (ES+) дає m/z: 376,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,07 (дд, 2H); 7,16 (дд, 2H); 3,94 (м, 1H); 3,44 (м уш, 1H); 3,28-3,10 (м, 2H); 2,80-2,56 (м, 5H); 2,30 (м, 1H); 2,10-1,83 (м, 7H); 1,71-1,54 (м, 1H). Приклад 8 (5-фторіндан-1-іл)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон F O N O N N F Суміш (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)) (122мг, 0,43ммоль), 5-фторіндан-1-карбонової кислоти (78мг, 0,43ммоль), HOBT (58мг, 0,43ммоль), КДІ.HCl (124мг, 0,64ммоль) і сухого триетиламину 43 92496 (121μл, 0,86ммоль) у сухому дихлорметані (7мол) витримують із перемішуванням при кімнатній температурі протягом «вихідних» (48+годин), в атмосфері азоту. Розчинник випарюють при зниженому тиску, і отриманий залишок розбавляють 1N HCl (40мол) і етилацетатом (40мол), розділяють фази й промивають органічний шар послідовно 1N HCl (40мол, двічі), 1N NaOH (40мол, двічі) і розчином солі. Органічний шар висушують над сульфатом натрію й видаляють розчинник у вакуумі, щоб одержати залишок, який очищають задопомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 7:3), щоб одержати чисту цільову сполуку (133мг). Вихід: 75% (жовте масло); РХ-МС (RT): 8,12хв. (Спосіб E); МС (ES+) дає m/z: 410,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,05 (м, 2H); 7,35 (дд, 2H); 7,08 (м, 1H); 6,99 (м, 1H); 6,85; (м, 1H); 4,44 (дд, 1H); 4,34 (ддд, 1H); 3,94 (ддд, 1H); 3,68 (дд, 1H); 3,54-3,32 (м, 2H); 3,08-2,85 (м, 2H); 2,452,14 (м, 3H); 2,04 (м, 1H); 1,89 (м, 1H); 1,68 (м, 1H). Приклад 9 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(тетрагідропиран-4-іл)-метанон O N O N O N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням тетрагідропиран-4-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють шляхом розтирання з диетиловим ефіром. Вихід: 66% (біла тверда речовина; т. пл.=98100°C; [α]D20=+81,2° (c=1,08, CHCl3); РХ-МС (RT): 6,96хв. (Спосіб E); МС (ES+) дає m/z: 360,13. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,07 (дд, 2H); 7,16 (дд, 2H); 4,02 (м, 3H); 3,47 (м, 3H); 3,20 (м, 2H); 2,82 (м, 1H); 2,31 (м, 1H); 2,11-1,84 (м, 5H); 1,711,54 (м, 3H). Приклад 10 Циклогексил-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон O N O N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням циклогексанкарбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B). Очищення кінцевої сполуки здійснюють шляхом розтирання з диетиловим ефіром. Вихід: 18% (біла тверда речовина); т. пл.=8085°C; [α]D20=+82,7° (c=1,13, CHCl3); РХ-МС (RT): 44 8,13хв. (Спосіб E); МС (ES+) дає m/z: 358,16. 1 H-ЯМР (CDCl3, 300МГц), δ (м. буд.): 8,08 (дд, 2H); 7,16 (дд, 2H); 4,03 (м, 1H); 3,45 (м, 1H); 3,223,08 (м, 2H); 2,56 (м, 1H); 2,30 (м, 1H); 2,07-1,47 (м, 10H); 1,38-1,21 (м, 4H). Приклад 11 (3-бензоилфенил)-{(S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон O N O N N O F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 3-бензоілбензойної кислоти й (S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 99:1:0,1). Вихід: 90% (біла тверда речовина); т. пл.=158163°C; [α]D20=+84,1° (c=0,94, CHCl3); РХ-МС (RT):8,01хв. (Спосіб E); МС (ES+) дає m/z: 456,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,04 (м, 2H); 7,887,75 (м, 4H); 7,67-7,43 (м, 5H); 7,14 (дд, 2H); 4,42 (м уш, 1H); 3,97 (м уш, 1H); 3,53 (дд, 1H); 3,27 (м, 2H); 2,33 (м, 1H); 2,09-1,85 (м, 2H); 1,68 (м, 1H). Приклад 12 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2,4,6-трифторфеніл)-метанон F O N O N F N F F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 2,4,6-трифторбензойної кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 99:1:0,1), а потім послідовно одиний колонкової хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 99,5:0,5:0,05). Вихід: 9% (біла тверда речовина); т. пл.=125130°C; [α]D20=+97,9° (c=1,19, CHCl3); РХ-МС (RT):7,78хв. (Спосіб E); МС (ES+) дає m/z: 406,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,06 (м, 2H); 7,15 (м, 2H); 6,71 (м, 2H); 4,91 й 3,84 (м, 1H); 4,48 й 3,54 (м, 1H); 3,62-3,11 (м, 3H); 2,36 (м, 1H); 2,12-1,59 (м, 3H). Приклад 13 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(4-метил-[1,2,3]тиадиазол-5-іл)метанон 45 92496 O N O S N N N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 4-метил-[1,2,3]тиадиазол-5-карбонової кислоти як переважна кислота й (S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Вихід: 90% (жовте масло); [α]D20=+103,4° (c=1,15, CHCl3); РХ-МС (RT): 7,22хв. (Спосіб E); МС (ES+) дає m/z: 374,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,06 (дд, 2H); 7,17 (дд, 2H); 4,27 (м, 1H); 3,77 (м, 1H); 3,67 (дд, 1H); 3,39 (м, 1H); 3,27 (м, 1H); 2,73 (с, 3H); 2,33 (м, 1H); 2,17-1,87 (м, 2H); 1,69 (м, 1H). Приклад 14 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-фторпиридин-3-іл)-метанон F O N O N N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 2-фторникотинової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевого сполуки здійснюють шляхом розтирання з диетиловим ефіром. Вихід: 67% (біла тверда речовина); т. пл.=11020 112°C; [α]D =+108,3° (c=1,0, CHCl3); РХ-МС (RT): 5,82хв. (Спосіб); МС (ES+) дає m/z: 367,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,54 (м, 1H); 8,06 (м, 2H); 7,47 (м, 1H); 7,15 (м, 3H); 4,78 (м, 1H); 3,882,97 (м, 4H); 2,54 (з, 3H); 2,33 (м, 1H); 2,12-1,33 (м, 3H). Приклад 15 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-пиридин-2-ілметанона гідрохлорид O N O N N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням пиколинової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 99:1:0,1). 46 Вихід: 50% (блідо-жовте масло); [α]D20=+124,9° (c=1,05, CHCl3); РХ-МС (RT): 6,87хв. (Спосіб E); МС (ES+) дає m/z: 353,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,58 (д уш, 1H); 8,06 (м, 2H); 7,77 (ддд, 1H); 7,66 (ддд, 1H); 7,32 (м, 1H); 7,14 (дд, 2H); 5,14-3,91 (м уш, 2H); 3,60 (м уш, 1H); 3,38 (м, 1H); 3,25 (м, 1H); 2,38 (м, 1H); 2,101,69 (м, 3H). Приклад 16 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-метилпиридин-3-іл)-метанон O N O N N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 2-метилникотинової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Вихід: 55% (блідо-жовта тверда речовина); т. пл.=115-116°C; [α]D20=+99° (c=0,94, CHCl3); РХ-МС (RT): 5,82хв. (Спосіб E); МС (ES+) дає m/z: 367,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,54 (м, 1H); 8,06 (м, 2H); 7,47 (м, 1H); 7,15 (м, 3H); 4,78 (м, 1H); 3,882,97 (м, 4H); 2,54 (з, 3H); 2,33 (м, 1H); 2,12-1,33 (м, 3H). Приклад 17 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(1,2,5-триметил-1H-пирол-3-іл)метанон O N O F N N N Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 1,2,5-триметил-1H-пирол-3-карбонової кислоти як переважної кислоти й (S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії (силікагель, градієнт елюенту: від ДХМ/MeOH/NH4OH 99:1:0,1 до ДХМ/MeOH/NH4OH 98:2:0,2). Вихід: 89% (біла тверда речовина); т. пл.=122126°C; [α]D20=+111,9° (c=0,95, CHCl3); РХ-МС (RT): 7,54хв. (Спосіб E); МС (ES+) дає m/z: 383,1. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,04 (дд, 2H); 7,34 (дд, 2H); 5,79 (кв уш, 1H); 4,33 (м, 1H); 3,92 (м, 1H); 3,50 (дд, 1H); 3,36 (з, 3H); 3,35-3,20 (м, 2H); 2,24 (м, 1H); 2,19 (з, 3H); 2,15 (з, 3H); 1,96 (м, 1H); 1,83 (м, 1H); 1,58 (м, 1H). Приклад 18 (2,4-диметилтиазол-5-іл)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон 47 92496 O N O F N N N S Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 2,4-диметилтиазол-5-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевого сполуки здійснюють за допомогою високошвидкісної хроматографії (силікагель, градієнт елюенту: від ДХМ/MeOH/NH4OH 99:1:0,1 до ДХМ/MeOH/NH4OH 98:2:0,2). Вихід: 100% (блідо-жовта смолиста тверда речовина); [α]D20=+100,6° (c=1,05, CHCl3); РХ-МС (RT): 7,08хв. (Спосіб E); МС (ES+) дає m/z: 387,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,04 (дд, 2H); 7,37 (дд, 2H); 4,19 (дд, 1H); 3,72 (м, 1H); 3,68 (дд, 1H); 3,46-3,34 (м, 2H); 2,61 (з, 3H); 2,28 (з, 3H); 2,22 (м, 1H); 2,01 (м, 1H); 1,84 (м, 1H); 1,63 (м, 1H). Приклад 19 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-o-толилметанон O N O F N N Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 2-метилбензойної кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевого сполуки здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 99,5:0,5:0,05). Вихід: 99% (безбарвна смолиста тверда речовина); [α]D20=+100,1° (c=1,29, CHCl3); РХ-МС (RT): 7,8хв. (Спосіб E); МС (ES+) дає m/z: 366,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,04 (м, 2H); 7,37 (дд, 2H); 7,33-7,10 (м, 4H); 4,05-3,10 (м, 5H); 2,25 (м, 1H); 2,20 (з, 3H); 2,00 (м, 1H); 1,80 (м уш, 1H); 1,60 (м уш, 1H). Приклад 20 (2-етилфенил)-{3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон O N O F N N Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 2-етилбензойної кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 99,5:0,5:0,05). Вихід: 100% (безбарвна смолиста тверда речовина); [α]D20=+88,7° (c=1,0, CHCl3); РХ-МС (RT): 48 8,12хв. (Спосіб E); МС (ES+) дає m/z: 380,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,04 (дд, 2H); 7,407,26 (м, 2H); 7,35 (дд, 2H); 7,21 (дт, 1H); 7,13 (д уш, 1H); 4,39-3,85 (м уш, 1H); 3,84-3,46 (м уш, 2H); 3,38 (м 1H); 3,22 (м, 1H); 2,55 (кв, 2H); 2,24 (м, 1H); 2,01 (м, 1H); 1,81 (м, 1H); 1,61 (м, 1H); 1,14 (т, 3H). Приклад 21 (1,5-диметил-1H-пиразол-4-іл)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон O N N O N N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 1,5-диметил-1H-пиразол-4-карбонової кислоти як переважна кислота й (S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють шляхом пропущення неочищеного продукту через касету із силікагелем (силікагель: 2м, елюент: ДХМ/MeOH/NH4OH 98:2:0,2). Вихід: 39% (безбарвне масло); [α]D20=+106,0° (c=0,5, CHCl3); РХ-МС (RT): 6,72хв. (Спосіб E); МС (ES+) дає m/z: 370,1. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,07 (дд, 2H); 7,47 (з, 1H); 7,15 (дд, 2H); 4,57 (м, 1H); 4,18 (м, 1H); 3,78 (з, 3H); 3,49 (дд, 1H); 3,24 (м, 2H); 2,38 (з, 3H); 2,33 (м, 1H); 2,07-1,87 (м, 2H); 1,68 (м, 1H). Приклад 22 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-фуран-3-ілметанон O N O F N N O Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням фуран-3-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевого сполуки здійснюють шляхом пропущення неочищеного продукту через касету із силікагелем (силікагель: 2м, елюент: гексан/етилацетат 7:3). Вихід: 78% (жовте масло); [α]D20=+103,1° (c=0,55, CHCl3); РХ-МС (RT): 7,22хв. (Спосіб E); МС (ES+) дає m/z: 342,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,07 (дд, 2H); 7,73 (м, 1H); 7,43 (м, 1H); 7,16 (дд, 2H); 6,57 (м, 1H); 4,57 (м, 1H); 4,18 (м, 1H); 3,51 (дд, 1H); 3,25 (м, 2H); 2,35 (м, 1H); 2,10-1,87 (м, 2H); 1,70 (м, 1H). Приклад 23 (2,5-диметилфуран-3-іл)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон 49 92496 O N O F N O N Зазначену сполуки одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 2,5-диметилфуран-3-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють шляхом пропущення неочищеного продукту через касету із силікагелем (силікагель: 2м, елюент: гексан/етилацетат 7:3). Вихід: 39% (біла тверда речовина); т. пл.=114118°C; [α]D20=+102,5° (c=0,6, CHCl3); РХ-МС (RT): 7,71хв. (Спосіб E); МС (ES+) дає m/z: 370,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,07 (дд, 2H); 7,16 (дд, 2H); 5,93 (з, 1H); 4,52 (м, 1H); 4,14 (м, 1H); 3,43 (дд, 1H); 3,19 (м, 2H); 2,33 (с, 3H); 2,32 (м, 1H); 2,24 (з, 3H); 2,05-1,85 (м, 2H); 1,65 (м, 1H). Приклад 24 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-метилфуран-3-іл)-метанон O N O F O N N Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 2-метилфуран-3-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють шляхом пропущення неочищеного продукту через касету із силікагелем (силікагель, 2м, елюент: гексан/етилацетат 7:3). Вихід: 61% (жовте масло); [α]D20=+101,5° (c=0,59, CHCl3); РХ-МС (RT): 7,47хв. (Спосіб E); МС (ES+) дає m/z: 356,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,07 (дд, 2H); 7,26 (д, 1H); 7,15 (дд, 2H); 6,36 (д, 1H); 4,51 (м, 1H); 4,12 (м, 1H); 3,46 (дд, 1H); 3,21 (м, 2H); 2,39 (з, 3H); 2,34 (м, 1H); 2,08-1,86 (м, 2H); 1,68 (м, 1H). Приклад 25 (S)-(2,3-дигідробензо[1,4]диоксин-5-іл)-{3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон O N O N N O O F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 2,3-дигідробензо[1,4]диоксин-5-карбонової кислоти як переважної кислоти й (S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють шляхом пропущення неочищеного продукту через касету із силікагелем (силікагель: 2м, елюент: гексан/етилацетат 1:1). 50 Вихід: 89% (біла тверда речовина); т. пл.=5760°C; [α]D20=+104,4° (c=0,51, CHCl3); РХ-МС (RT): 7,53хв. (Спосіб E); МС (ES+) дає m/z: 410,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,05 (м, 2H); 7,37 (дд, 2H); 6,92-6,81 (м, 2H); 6,72 (м, 1H); 4,66-3,66 (м уш, 2H); 4,26 (з, 4H); 3,48 (м, 1H); 3,34 (м, 1H); 3,18 (м, 1H); 2,25 (м, 1H); 1,98 (м, 1H); 1,81 (м, 1H); 1,61 (м, 1H). Приклад 26 (S)-(4-фтор-3-метоксифенил)-{3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон O N O F N O N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 4-фтор-3-метоксибензойної кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють шляхом пропущення неочищеного продукту через касету із силікагелем (силікагель: 2м, елюент: гексан/етилацетат 1:1). Вихід: 49% (біла тверда речовина); т. пл.=109111°C; [α]D20=+88,7° (c=0,505, CHCl3); РХ-МС (RT): 7,68хв. (Спосіб E); МС (ES+) дає m/z: 400,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,03 (дд, 2H); 7,35 (дд, 2H); 7,20 (дд, 1H); 7,15 (дд, 1H); 6,98 (ддд, 1H); 4,21 (дд, 1H); 3,86 (з, 3H); 3,74 (дт, 1H); 3,58 (дд, 1H); 3,48-3,27 (м, 2H); 2,26 (м, 1H); 2,10-1,94 (м, 1H); 1,84 (м, 1H); 1,68 (м, 1H). Приклад 27 (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-метилпиридин-4-іл)-метанон O N O N F N N Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 3-метилизоникотинової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють шляхом пропущення неочищеного продукту через касету із силікагелем (силікагель: 2м, елюент: ДХМ/MeOH/NH4OH 95:5:0,5). Вихід: 77% (біла тверда речовина); т. пл.=5963°C; [α]D20=+81,9° (c=0,51, CHCl3); РХ-МС (RT): 6,07хв. (Спосіб E); МС (ES+) дає m/z: 367,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,49 (з, 1H); 8,43 (д, 1H); 8,04 (дд, 2H); 7,35 (дд, 2H); 7,15 (д, 1H); 4,06-3,78 (м уш, 1H); 3,65 (м, 1H); 3,41 (м, 1H); 3,34-3,12 (м, 2H); 2,25 (м, 1H); 2,20 (з, 3H); 2,02 (м, 1H); 1,80 (м, 1H); 1,65 (м, 1H). Приклад 28 (S)-(2-бромтиофен-3-іл)-{3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон 51 92496 N O F N O Br N S Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 2-бромтиофен-3-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють шляхом пропущення неочищеного продукту через касету із силікагелем (силікагель: 2м, елюент: гексан/етилацетат 7:3) і наступної високошвидкісної хроматографії (силікагель, елюент: гексан/етилацетат 7:3). Вихід: 44% (біла тверда речовина); [α]D20=+45,7° (c=0,93, CHCl3); РХ-МС (RT): 7,82хв. (Спосіб E); МС (ES+) дає m/z: 437,9. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,04 (дд, 2H); 7,61 (д, 1H); 7,34 (дд, 2H); 7,00 (д, 1H); 4,18 (м, 1H); 3,71 (м, 1H); 3,60 (дд, 1H); 3,40 (ддд, 1H); 3,30 (ддд, 1H); 2,27 (м, 1H); 2,02 (м, 1H); 1,87 (м, 1H); 1,68 (м, 1H). Приклад 29 (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(6-фторпиридин-3-іл)-метанон N O F N O N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 6-фторникотинової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють шляхом пропущення неочищеного продукту через касету із силікагелем (силікагель, 2м, елюент: гексан/етилацетат 1:1). Вихід: 59% (біле масло); [α]D20=+62,1° (c=0,97, CHCl3); РХ-МС (RT): 7,08хв. (Спосіб E); МС (ES+) дає m/z: 371,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,30 (м, 1H); 8,087,96 (м, 3H); 7,35 (дд, 2H); 7,19 (дд, 1H); 4,22 (дд, 1H); 3,75 (ддд, 1H); 3,64 (дд, 1H); 3,51-3,32 (м, 2H); 2,27 (м, 1H); 2,03 (м, 1H); 1,83 (м, 1H); 1,71 (м, 1H). Приклад 30 (S)-{3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-метилфуран-2-іл)-метанон N O F N O 52 починають із гексана/етилацетата 8:2, потім елююють ДХМ). Вихід: 12% (біле масло); [α]D20=+47,6° (c=1,0, CHCl3); РХ-МС (RT): 6,32хв. (Спосіб E); МС (ES+) дає m/z: 356,1. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,04 (дд, 2H); 7,56 (м, 1H); 7,35 (дд, 2H); 6,43 (м, 1H); 4,31 (дд, 1H); 3,88 (ддд, 1H); 3,67 (дд, 1H); 3,45-3,33 (м, 2H); 2,26 (м, 1H); 2,14 (з, 3H); 2,03 (м, 1H); 1,88 (м, 1H); 1,67 (м, 1H). Приклад 31 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-метокситиофен-2-іл)-метанон O O N O N S N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 3-метокситиофен-2-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють шляхом пропущення неочищеного продукту через касету із силікагелем (силікагель: 2м, елюент: ДХМ/MeOH 99:1), після чого проводять колонкову хроматографію (силікагель, елюент: ДХМ), після чого виконують третє очищення за допомогою препаративної ВЕРХ. Вихід: 16% (безбарвне масло); [α]D20=+103,6° (c=0,4, CHCl3); РХ-МС (RT): 7,39хв. (Спосіб E); МС (ES+) дає m/z: 388,1. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,05 (дд, 2H); 7,56 (д, 1H); 7,34 (дд, 2H); 6,96 (д, 1H); 4,26 (м, 1H); 3,89 (м, 1H); 3,87 (з, 3H); 3,55 (дд, 1H); 3,37 (м, 1H); 3,26 (ддд, 1H); 2,26 (м, 1H); 2,07-1,81 (м, 2H); 1,64 (м, 1H). Приклад 32 (4-фтор-2-метилфенил)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон O N O N F N F N O Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 3-метилфуран-2-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють шляхом пропущення неочищеного продукту через касету із силікагелем (силікагель: 2м, градієнт елюенту: Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 4-фтор-2-метилбензойної кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють за допомогою високошвидкісний колонкової хроматографії (силікагель, елюент: петролейний ефір/етилацетат 6:4). Вихід: 37% (безбарвне масло); [α]D20=+89,1° (c=0,55, CHCl3); РХ-МС (RT): 7,79хв. (Спосіб E); МС (ES+) дає m/z: 384,1. 53 92496 1 H-ЯМР (CDCl3), δ (м. буд.): 8,04 (дд, 2H); 7,35 (дд, 2H); 7,20 (дд, 1H); 7,04 (м, 2H); 4,13 (м, 1H); 3,77-3,48 (м, 2H); 3,39 (м, 1H); 3,26 (м, 1H); 2,26 (м, 1H); 2,23 (з, 3H); 2,01 (м, 1H); 1,81 (м, 1H); 1,63 (м, 1H). Приклад 33 (4-фторфеніл)-{(S)-3-[3-(6-метилпиридин-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон O N O N F N N 33 (A) (S)-3-[3-(6-метилпиридин-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонової кислоти трет-бутиловий ефір До розчину 6-метилпиридин-2-карбонітрилу (0,24м, 2ммоль) в EtOH (4мл), додають при кімнатній температурі гідроксиламин (50% вес. водяний розчин, 0,49мл, 8ммоль) і перемішують розчин зі зворотним холодильником протягом 1,5ч. Розчинник видаляють при зниженому тиску, щободержати N-гідрокси-6-метилпиридин-2-карбоксамидин, що негайно використовують на наступній стадії. Суміш N-гідрокси-6-метилпиридин-2карбоксамидину (2ммоль), S-1-Boc-пиперидин-3карбонової кислоти (0,46м, 2ммоль), КДІ.HCl (0,57м, 3ммоль), HOBT (0,31м, 2ммоль) і ТЕА (0,56мл, 4ммоль) у диоксані (10мл) перемішують протягом 24 годин при кімнатній температурі, в атмосфері азоту, після чого реакційну суміш кип'ятять зі зворотним холодильником протягом 5 годин. Розчинник випарюють при зниженому тиску. Отриманий залишок розбавляють водою (50мл) і етилацетатом (50мл), розділяють фази й промивають органічний шар послідовно водою (50млx2 рази) і 1N NaOH (50млx2 рази). Органічний шар висушують над Na2SO4 і випарюють при зниженому тиску. Очищення неочищеного продукту за допомогою високошвидкісної хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 98/2/0,2) дає 0,31м (S)-3-[3-(6-метилпиридин-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонової кислоти трет-бутилового ефіру. Вихід: 45%; РХ-МС (RT): 4,6хв. (Спосіб A); МС (ES+) дає m/z: 344,9. 1 H-ЯМР (CDCl3, 333 K), δ (м. буд.): 33 (B) 2-метил-6-((S)-5-пиперидин-3-іл[1,2,4]оксадиазол-3-іл)-пирирдини гідрохлорид (S)-3-[3-(6-метилпиридин-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонової кислоти трет-бутиловий ефір (0,32м, 0,93ммоль) розчиняють у диоксані (2мл) і додають по краплях 4мл HCl 4N (диоксановый розчин) при температурі 0°С. Отриману суміш перемішують при кімнатній температурі протягом 1,5 годин. Розчинник випарюють при зниженому тиску, щоб одержати 260мг (вихід: 100%) 2-метил-6-((S)-5-пиперидин-3-іл[1,2,4]оксадиазол-3-іл)-пирирдини гідрохлориду у виді білої твердої речовини. РХ-МС (RT): 2,67хв. (Спосіб A); МС (ES+) дає m/z: 245,1. 33 (C) (4-фторфеніл)-{(S)-3-[3-(6 54 метилпиридин-2-іл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-метанон До суспензії 2-метил-6-((S)-5-пиперидин-3-іл[1,2,4]оксадиазол-3-іл)-пирирдину гідрохлориду (260мг, 0,93ммоль) у сухому дихлорметані (15мл), додають по краплях при 0°С триетиламин (0,32мл, 2,32ммоль) і 4-фторбензоілхлорид (0,12мл, 1,02ммоль). Залишають реакційну суміш нагрітися до кімнатної температури й перемішують протягом 24 годин в атмосфері азоту. Потім розчин обробляють 1N NaOH (10мл) і розділяють фази. Органічний шар промивають водою (5мл) і розчином солі (5мл), а потім висушують над Na2SO4 і випарюють при зниженому тиску. Черновій продукт очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 98:2:0,2) щоб одержати 50мг цільової сполуки. Вихід: 53% (безбарвна смолиста тверда речовина); [α]D20=+103,8° (c=1,26, CHCl3); РХ-МС (RT): 6,41хв. (Спосіб E); МС (ES+) дає m/z: 367,1. 1 H-ЯМР (CDCl3), δ (м. буд.): 7,89-7,79 (м, 2H); 7,48 (дд, 2H); 7,42 (дд, 1H); 7,21 (дд, 2H); 4,21 (дд, 1H); 3,75 (ддд, 1H); 3,61 (дд, 1H); 3,48-3,29 (м, 2H); 2,58 (з, 3H); 2,28 (м, 1H); 2,03 (м, 1H); 1,84 (м, 1H); 1,66 (м, 1H). Приклад 34 (4-фторфеніл)-{(S)-3-[3-(5-метилфуран-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон O N O N F N O 34 (A) (S)-3-[3-(5-метилфуран-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонової кислоти трет-бутиловий ефір Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (A), починаючи з 5-метилфуран-2-карбонітрилу. (S)-3-[3-(5-метилфуран-2-іл)-[1,2,4]оксадиазол5-іл]-пиперидин-1-карбонової кислоти третбутиловий ефір одержують у чистому виді в результаті високошвидкісної колонкової хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 99,5:0,5:0,05). Вихід: 58% (безбарвне масло); РХ-МС (RT): 5,3хв. (Спосіб A); МС (ES+) дає m/z: 334,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 7,03 (дд, 1H); 6,31 (м, 1H); 4,01 (ддт, 1H); 3,64 (м, 1H); 3,43 (дд, 1H); 3,28-3,12 (м, 2H); 2,39 (з, 3H); 2,16 (м, 1H); 1,91 (м, 1H); 1,79 (м, 1H); 1,62-1,50 (м, 1H); 1,41 (з, 9H). 34 (B) (S)-3-[3-(5-метилфуран-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлорид Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (B), починаючи з (S)-3-[3-(5-метилфуран-2-іл)-[1,2,4]оксадиазол-5іл]-пиперидин-1-карбонової кислоти третбутилового ефіру. Вихід: 100% (жовта тверда речовина); РХ-МС (RT): 3,7хв. (Спосіб A); МС (ES+) дає m/z: 234,0. 34 (C) (4-фторфеніл)-{(S)-3-[3-(5-метилфуран2-іл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}метанон 55 92496 Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (C), починаючи з (S)-3-[3-(5-метилфуран-2-іл)-[1,2,4]оксадиазол-5іл]-пиперидину гідрохлориду. (4-фторфеніл)-{(S)-3-[3-(5-метилфуран-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон одержують у чистому виді в результаті високошвидкісної колонкової хроматографії (силікагель, елюент: ДХМ/MeOH 99,5:0,5). Вихід: 53% (безбарвне масло); [α]D20=+107,4° (c=0,98, CHCl3); РХ-МС (RT): 7,29хв. (Спосіб E); МС (ES+) дає m/z: 356,1. 1 H-ЯМР (CDCl3), δ (м. буд.): 7,48 (дд, 2H); 7,28 (дд, 2H); 7,09 (м, 1H); 6,36 (м, 1H); 4,45 (м, 1H); 3,96 (м, 1H); 3,60-3,15 (м, 3H); 2,38 (з, 3H); 2,21 (м, 1H); 1,92 (м, 1H); 1,74 (м, 1H); 1,1 (м, 1H). Приклад 35 (4-фторфеніл)-[(S)-3-(3-фуран-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон O N O N F N O 35 (A) (S)-3-(3-фуран-2-іл-[1,2,4]оксадиазол-5іл)-пиперидин-1-карбонової кислоти третбутиловий ефір Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (A), починаючи з фуран-2-карбонітрилу. (S)-3-(3-фуран-2-іл-[1,2,4]оксадиазол-5-іл)пиперидин-1-карбонової кислоти трет-бутиловий одержують у чистому виді в результаті високошвидкісної колонкової хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 99,5:0,5:0,05). Вихід: 75% (біла тверда речовина); РХ-МС (RT): 5,0хв. (Спосіб A); МС (ES+) дає m/z: 320,0. 1 H-ЯМР (CDCl3), δ (м. буд.): 7,88 (дд, 1H); 7,15 (дд, 1H); 6,69 (дд, 1H); 4,01 (ддт, 1H); 3,63 (м, 1H); 3,44 (дд, 1H); 3,30-3,13 (м, 2H); 2,16 (м, 1H); 1,92 (м, 1H); 1,79 (м, 1H); 1,55 (м, 1H); 1,41 (з, 9H). 35 (B) (S)-3-(3-фуран-2-іл-[1,2,4]оксадиазол-5іл)-пиперидину гідрохлорид Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (B), починаючи з (S)-3-(3-фуран-2-іл-[1,2,4]оксадиазол-5-іл)пиперидин-1-карбонової кислоти трет-бутилового ефіру. Вихід: 100% (біла тверда речовина); РХ-МС (RT): 2,81хв. (Спосіб A); МС (ES+) дає m/z: 220,0. 35 (C) (4-фторфеніл)-[(S)-3-(3-фуран-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (C), починаючи з (S)-3-(3-фуран-2-іл-[1,2,4]оксадиазол-5-іл)пиперидину гідрохлориду. (4-фторфеніл)-[(S)-3-(3-фуран-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон одержують у чистому виді в результаті високошвидкісний колонкової хроматографії (силікагель, елюент: ДХМ/MeOH 99,5:0,5). Вихід: 72% (блідо-жовта тверда речовина); [α]D20=+114,8° (c=1,13, CHCl3); РХ-МС (RT): 7,08хв. (Спосіб E); МС (ES+) дає m/z: 342,1. 56 1 H-ЯМР (CDCl3), δ (м. буд.): 7,99 (м, 1H); 7,48 (дд, 2H); 7,28 (дд, 2H); 7,22 (м, 1H); 6,74 (м, 1H); 4,44 (м, 1H); 3,97 (м, 1H); 3,59-3,15 (м, 3H); 2,23 (м, 1H); 1,92 (м, 1H); 1,75 (м, 1H); 1,61 (м, 1H). Приклад 36 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(2-метилтиофен-3-іл)-метанон O S N O N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 8, із застосуванням 2-метилтиофен-3-карбонової кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Очищення кінцевої сполуки здійснюють за допомогою високошвидкісної колонкової хроматографії (силікагель, елюент: петролейний ефір/етилацетат 6:4). Вихід:% (безбарвне масло); РХ-МС (RT): 7,63хв. (Спосіб E); МС (ES+) дає m/z: 371,2. 1 H-ЯМР (CDCl3), δ (м. буд.): 8,04 (дд, 2H); 7,35 (дд, 2H); 7,27 (д, 1H); 6,92 (д, 1H); 4,18 (д, 1H); 3,71 (дд, 1H); 3,61 (дд, 1H); 3,42-3,25 (м, 2H); 2,38 (з, 3H); 2,25 (м, 1H); 2,01 (м, 1H); 1,83 (м, 1H); 1,63 (м, 1H). Приклад 37 (4-фторфеніл)-[(S)-3-(3-тиофен-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон O N O N N F S 37 (A) (S)-3-(3-тиофен-2-іл-[1,2,4]оксадиазол-5іл)-пиперидин-1-карбонової кислоти третбутиловий ефір Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (A), починаючи з тиофен-2-карбонітрилу. (S)-3-(3-тиофен-2-іл-[1,2,4]оксадиазол-5-іл)пиперидин-1-карбонової кислоти трет-бутиловий ефір одержують у чистому виді в результаті високошвидкісної колонкової хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 99,5:0,5:0,05). Вихід: 77% (безбарвне масло); РХ-МС (RT): 7,16хв. (Спосіб A); МС (ES+) дає m/z: 335,94. 1 H-ЯМР (ДМСО-d6), δ (м. буд.): 7,79 (дд, 1H); 7,76 (дд, 1H); 7,24 (дд, 1H); 4,01 (дд, 1H); 3,63 (м, 1H); 3,46 (дд, 1H); 3,32-3,14 (м, 2H); 2,17 (м, 1H); 1,93 (м, 1H); 1,79 (м, 1H); 1,57 (м, 1H); 1,41 (з, 9H). 37 (B) (S)-3-(3-тиофен-2-іл-[1,2,4]оксадиазол-5іл)-пиперидину гідрохлорид Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (B), починаючи з (S)-3-(3-тиофен-2-іл-[1,2,4]оксадиазол-5-іл)пиперидин-1-карбонової кислоти трет-бутилового ефіру. Вихід: кількісний (біла тверда речовина); РХМС (RT): 3,9хв. (Спосіб A); МС (ES+) дає m/z: 235,98. 57 92496 37 (C) (4-фторфеніл)-[(S)-3-(3-тиофен-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (C), починаючи з (S)-3-(3-тиофен-2-іл-[1,2,4]оксадиазол-5-іл)пиперидину гідрохлориду. (4-фторфеніл)-[(S)-3-(3-тиофен-2-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон одержують у чистому виді в результаті високошвидкісної колонкової хроматографії (силікагель, елюент: ДХМ/MeOH 99,5:0,5). Вихід: 81% (білий порошок); [α]D20=+107,36° (c=1,15, MeOH); РХ-МС (RT): 7,16хв. (Спосіб E); МС (ES+) дає m/z: 358,1. 1 H-ЯМР (ДМСО-d6), δ (м. буд.): 7,80 (дд, 1H); 7,76 (дд, 1H); 7,47 (дд, 2H); 7,24 (дд, 1H); 7,22 (дд, 2H); 4,19 (м, 1H); 7,73 (м, 1H); 3,59 (дд, 1H); 3,453,28 (м, 2H); 2,25 (м, 1H); 2,00 (м, 1H); 1,82 (м, 1H); 1,66 (м, 1H). Приклад 38 (4-фторфеніл)-[(S)-3-(3-тиофен-3-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон O N O N F N S 38 (A) (S)-3-(3-тиофен-3-іл-[1,2,4]оксадиазол-5іл)-пиперидин-1-карбонової кислоти третбутиловий ефір Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (A), починаючи з тиофен-3-карбонітрилу. (S)-3-(3-тиофен-3-іл-[1,2,4]оксадиазол-5-іл)пиперидин-1-карбонової кислоти трет-бутиловий ефір одержують у чистому виді в результаті високошвидкісної колонкової хроматографії (силікагель, елюент: ДХМ/MeOH 99,5:0,5). Вихід: 60% (безбарвне масло); РХ-МС (RT): 5,5хв. (Спосіб A); МС (ES+) дає m/z: 335,94. 1 H-ЯМР (ДМСО-d6), δ (м. буд.): 8,17 (дд, 1H); 7,70 (дд, 1H); 7,56 (дд, 1H); 4,03 (ддт, 1H); 3,65 (м, 1H); 3,44 (дд, 1H); 3,29-3,12 (м, 2H); 2,17 (м, 1H); 1,93 (м, 1H); 1,81 (м, 1H); 1,63-1,49 (м, 1H); 1,41 (з, 9H). 38 (B) (S)-3-(3-тиофен-3-іл-[1,2,4]оксадиазол-5іл)-пиперидину гідрохлорид Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (B), починаючи з (S)-3-(3-тиофен-3-іл-[1,2,4]оксадиазол-5-іл)пиперидин-1-карбонової кислоти трет-бутилового ефіру. Вихід: кількісний (біла тверда речовина); РХМС (RT): 3,9хв. (Спосіб A); МС (ES+) дає m/z: 235,98. 38 (C) (4-фторфеніл)-[(S)-3-(3-тиофен-3-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (C), починаючи з (S)-3-(3-тиофен-3-іл-[1,2,4]оксадиазол-5-іл)пиперидину гідрохлориду. (4-фторфеніл)-[(S)-3-(3-тиофен-3-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон одержують у чистому виді в результаті високошвидкісний колонкової хроматографії (силікагель, 58 елюент: ДХМ/MeOH 99,5:0,5). Вихід: 62% (білий порошок); [α]D20=+104,98° (c=0,93, MeOH); РХ-МС (RT): 7,21хв. (Спосіб E); МС (ES+) дає m/z: 358,1. 1 H-ЯМР (ДМСО-d6), δ (м. буд.): 8,17 (дд, 1H); 7,70 (дд, 1H); 7,56 (дд, 1H); 7,46 (дд, 2H); 7,22 (дд, 2H); 4,21 (дд, 1H); 3,75 (ддд, 1H); 3,57 (дд, 1H); 3,39 (м, 1H); 3,32 (ддд, 1H); 2,26 (м, 1H); 2,00 (м, 1H); 1,83 (м, 1H); 1,66 (м, 1H). Приклад 39 (4-фторфеніл)-{(S)-3-[3-(1-метил-1H-пирол-2іл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон O N O N N F N 39 (A) (S)-3-[3-(1-метил-1H-пирол-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонової кислоти трет-бутиловий ефір Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (A), починаючи з 1-метил-1H-пирол-2-карбонітрилу. (S)-3-[3-(1-метил-1H-пирол-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонової кислоти трет-бутиловий ефір одержують у чистому виді в результаті високошвидкісної колонкової хроматографії (силікагель, елюент: ДХМ/MeOH 99,5:0,5). Вихід: 22% (безбарвне масло); РХ-МС (RT):хв. (Спосіб); МС (ES+) дає m/z:. 39 (B) (S)-3-[3-(1-метил-1H-пирол-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлорид Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (B), починаючи з (S)-3-[3-(1-метил-1H-пирол-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонової кислоти трет-бутилового ефіру. Вихід: кількісний (біла тверда речовина); РХМС (RT): 3,90хв. (Спосіб A); МС (ES+) дає m/z: 233,11. 39 (C) (4-фторфеніл)-{(S)-3-[3-(1-метил-1Hпирол-2-іл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (C), починаючи з (S)-3-[3-(1-метил-1H-пирол-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду. (4-фторфеніл)-{(S)-3-[3-(1-метил-1H-пирол-2іл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон одержують у чистому виді в результаті високошвидкісної колонкової хроматографії (силікагель, елюент: ДХМ/MeOH 98,5:1,5). Вихід: 68% (блідо-жовте масло); [α]D20=+92,82° (c=1,04, MeOH); РХ-МС (RT): 7,19хв. (Спосіб E); МС (ES+) дає m/z: 355,2. 1 H-ЯМР (ДМСО-d6), δ (м. буд.): 7,46 (дд, 2H); 7,23 (дд, 2H); 7,02 (дд, 1H); 6,78 (дд, 1H); 6,17 (дд, 1H); 4,19 (м, 1H); 3,90 (з, 3H); 3,73 (м, 1H); 3,54 (дд, 1H); 3,41-3,24 (м, 2H); 2,23 (м, 1H); 1,96 (м, 1H); 1,81 (м, 1H); 1,63 (м, 1H). Приклад 40 (4-фторфеніл)-{(S)-3-[3-(3-метилпиридин-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон 59 92496 O N O N F N N 40 (A) (S)-3-[3-(3-метилпиридин-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонової кислоти трет-бутиловий ефір Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (A), починаючи з 3-метилпиридин-2-карбонітрилу. (S)-3-[3-(3-метилпиридин-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-карбонової кислоти трет-бутиловий ефір одержують у чистому виді в результаті високошвидкісної колонкової хроматографії (силікагель, елюент: ДХМ/MeOH 99:1). Вихід: 47% (безбарвне масло); РХ-МС (RT): 7,8хв. (Спосіб C); МС (ES+) дає m/z: 344,99. 40 (B) 3-метил-2-((S)-5-пиперидин-3-іл[1,2,4]оксадиазол-3-іл)-пирирдини гідрохлорид Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (B), починаючи з (S)-3-[3-(3-метилпиридин-2-іл)-[1,2,4]оксадиазол5-іл]-пиперидин-1-карбонової кислоти третбутилового ефіру. Вихід: кількісний (біла тверда речовина); РХМС (RT): 3,4хв. (Спосіб A); МС (ES+) дає m/z: 245,10. 40 (C) (4-фторфеніл)-{(S)-3-[3-(3метилпиридин-2-іл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-метанон Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 33 (C), починаючи з 3-метил-2-((S)-5-пиперидин-3-іл[1,2,4]оксадиазол-3-іл)-пирирдини гідрохлориду. (4-фторфеніл)-{(S)-3-[3-(3-метилпиридин-2-іл)[1,2,4]оксадиазол-5-іл]-пиперидин-1-іл}-метанон одержують у чистому виді в результаті високошвидкісної колонкової хроматографії (силікагель, елюент: ДХМ/MeOH/NH4OH 98:2:0,2). Вихід: 90% (коричневе масло); [α]D20=+84,84° (c=0,94, MeOH); РХ-МС (RT): 6,47хв. (Спосіб E); МС (ES+) дає m/z: 367,2. 1 H-ЯМР (ДМСО-d6), δ (м. буд.): 8,57 (дд, 1H); 7,82 (м, 1H); 7,48 (м, 3H); 7,23 (дд, 2H); 4,22 (м, 1H); 3,75 (м, 1H); 3,59 (дд, 1H); 3,45 (м, 1H); 3,31 (ддд, 1H); 2,46 (з, 3H); 2,27 (м, 1H); 2,00 (м, 1H); 1,82 (м, 1H); 1,66 (м, 1H). Приклад 41 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(3-трифторметил-1H-пиразол-4іл)-метанон N O F O F F F N N N N H Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 3-трифторметил-1H-пиразол-4-карбонової кислоти як переважної кислоти й (S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидинугідрохлориду (отриманого, як описано в Прикладі 3 (B)). 60 Вихід: 23% (біла тверда речовина); [α]D20=+90,80° (c=0,7, CHCl3); РХ-МС (RT): 7,29хв. (Спосіб E); МС (ES+) дає m/z: 410,2. 1 H-ЯМР (ДМСО-d6), δ (м. буд.): 8,04 (дд, 2H); 7,96 (з уш, 1H); 7,34 (дд, 2H); 4,24 (м, 1H); 3,79 (м, 1H); 3,55 (дд, 1H); 3,38-3,20 (м, 2H); 2,97 (з уш, 1H); 2,27 (м, 1H); 2,01 (м, 1H); 1,82 (м, 1H); 1,62 (м, 1H). Приклад 42 (4-фтор-2-метиламинофенил)-{(S)-3-[3-(4фторфеніл)-[1,2,4]оксадиазол-5-іл]-пиперидин-1іл}-метанон HN O N O F N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 4-фтор-2-метиламинобензойної кислоти як переважної кислоти й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Вихід: кількісний (ясно-коричневе масло); [α]D20=+69,74° (c=0,83, MeOH); РХ-МС (RT): 8,04хв. (Спосіб E); МС (ES+) дає m/z: 399,1. 1 H-ЯМР (ДМСО-d6), δ (м. буд.): 8,04 (дд, 2H); 7,35 (дд, 2H); 7,06 (дд, 1H); 6,41-6,31 (м, 2H); 5,38 (з уш, 1H); 4,19 (м, 1H); 3,70 (м, 1H); 3,58 (дд, 1H); 3,43 (ддд, 1H); 3,30 (ддд, 1H); 2,72 (д, 3H); 2,23 (м, 1H); 1,99 (м, 1H); 1,81 (м, 1H); 1,63 (м, 1H). Приклад 43 {(S)-3-[3-(4-фторфеніл)-[1,2,4]оксадиазол-5-іл]пиперидин-1-іл}-(4-метил-1H-пирол-3-іл)-метанон O NH N O N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (C), із застосуванням 4-метил-1H-пирол-3-карбонової кислоти як переважної кислота й (S)-3-[3-(4-фторфеніл)[1,2,4]оксадиазол-5-іл]-пиперидину гідрохлориду (отриманого, як описано в Прикладі 3 (B)). Вихід: 9% (білий порошок); т. пл.=167,5168,9°C; РХ-МС (RT): 7,01хв. (Спосіб E); МС (ES+) дає m/z: 355,2. 1 H-ЯМР (ДМСО-d6), δ (м. буд.): 10,39 (з уш, 1H); 8,04 (дд, 2H); 7,34 (дд, 2H); 6,81 (м, 1H); 6,52 (м, 1H); 4,35 (м, 1H); 3,94 (м, 1H); 3,52 (дд, 1H); 3,35-3,20 (м, 2H); 2,25 (м, 1H); 2,02 (з, 3H); 1,98 (м, 1H); 1,83 (м, 1H); 1,60 (м, 1H). Приклад 44 (5-метилізоксазол-4-іл)-[(S)-3-(3-тиофен-3-іл[1,2,4]оксадиазол-5-іл)-пиперидин-1-іл]-метанон O N O N N S O N
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel oxadiazole derivatives and their use as positive allosteric modulators of metabotropic glutamate receptors
Автори англійськоюBugada Piergiuliano, Gagliardi Stefania, Le Poul Emmanuel, Mutel Vincent, Palombi Giovanni, Rocher Jean-Philippe
Назва патенту російськоюПроизводные оксадиазола и их применение как положительных аллостерических модуляторов метаботропных глутаматных рецепторов
Автори російськоюБугада Пьергиулиано, Гаглиарди Стефания, Льо Пул Эмманюэл, Мютел Венсан, Паломби Джованни, Роше Жан-Филип
МПК / Мітки
МПК: A61K 31/4245, C07D 413/14, C07D 413/04, A61P 25/00, C07D 417/14
Мітки: позитивних, глутаматних, застосування, рецепторів, метаботропних, модуляторів, алостеричних, похідні, оксадіазолу
Код посилання
<a href="https://ua.patents.su/44-92496-pokhidni-oksadiazolu-ta-kh-zastosuvannya-yak-pozitivnikh-alosterichnikh-modulyatoriv-metabotropnikh-glutamatnikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Похідні оксадіазолу та їх застосування як позитивних алостеричних модуляторів метаботропних глутаматних рецепторів</a>
Попередній патент: Заміщені похідні оксадіазолу як позитивні алостеричні модулятори метаботропних глутаматних рецепторів
Наступний патент: Склади, що містять пептиди, які стимулюють рецептор еритропоетину та їхнє застосування
Випадковий патент: Трифазний трансформатор












