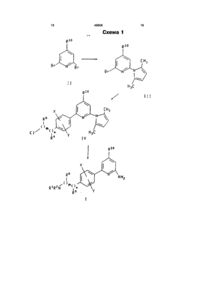
Похідні 6-фенілпіридил-2-аміну, фармацевтична композиція, спосіб інгібування синтази оксиду нітрогену у ссавців та спосіб лікування
Формула / Реферат
1. Сполука формули
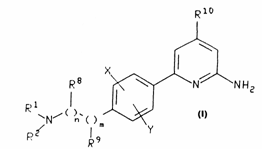 ,
,
та її фармацевтично прийнятні солі, в яких
R1 та R2 незалежно вибирають з (С1-С6) алкілу, тетрагідронафталіну та аралкілу, арильна група якого є фенілом чи нафтилом, а алкільна, лінійна чи розгалужена, містить 1-6 атомів карбону, і де вказані (С1-С6) алкіл, тетрагідронафталініл або арильна група вказаного аралкілу, як варіант, можуть бути заміщені одним-трьома замісниками, які незалежно вибирають з галогену, нітро-, гідрокси-, ціано- та аміногруп, (С1-С4) алкоксилу та (С1-С4) алкіламіногрупи;
або R1 та R2 разом з нітрогеном, до якого вони приєднані, утворюють піперазинове, піперидинове або піролідинове кільце, або азабіцикл, що включає 6-14 кільцевих членів, один-три з яких є атомами нітрогену, а решта - атомами карбону;
і де вказані піперазиновий, піперидиновий або піролідиновий цикли, як варіант, можуть бути заміщені одним чи більше замісниками, які незалежно вибирають з (С1-С6) алкілу, аміногрупи, (С1-С6) алкіламіногрупи, [ді – (С1-С6) алкіл]аміногрупи, фенілу, який заміщено 5-6-членним гетероциклом, що включає 1-4 кільцевих атоми нітрогену, бензоїлом, бензоїлметилом, бензилкарбонілом, феніламінокарбонілом, фенілетилом та феноксикарбонілом, і де фенільні групи будь-якого з наведених замісників, як варіант, можуть бути заміщені одним чи більше замісниками, які незалежно вибирають з галогену, (С1-С3) алкілу, (С1-С3) алкоксилу, нітро-, ціано- або аміногрупи, СF3 або ОСF3;
n - 0, 1 чи 2;
m -0, 1 чи 2;
кожний з R8 та R9 незалежно вибирають з (С1-С4) алкілу, арил (С1-С4) алкілу, арильна група якого є фенілом чи нафтилом, алкілу та феналілу;
Х та Y незалежно вибирають з метилу, метоксилу, гідроксилу та гідрогену; а
R10 – (С1-С4) алкіл;
з умовою, що R8 відсутній, коли N = 0, а R9 відсутній, коли m = 0,
або фармацевтично прийнятні солі приєднання кислот цих сполук.
2. Сполука за п.1, яка відрізняється тим, що NR1R2 є заміщеним, як варіант, піперазиновим, піперидиновим або піролідиновим циклом, де зазначені піперазиновий, піперидиновий або піролідиновий цикли заміщені, як варіант, одним чи більше замісниками, переважно, від нуля до двох замісників, які незалежно вибрано з (С1-С6) алкілу, аміногрупи, (С1-С6) алкіламіногрупи, [ді-(С1-С6) алкіл]аміногрупи, фенілу, який заміщено 5-6-членним гетероциклом з 1-4 кільцевими атомами нітрогену, бензоїлом, бензоїлметилом, бензилкарбонілом, феніламінокарбонілом, фенілетилом та феноксикарбонілом, і де фенільні групи будь-якого з наведених замісників, як варіант, заміщені одним чи більше замісниками, які незалежно вибрано з галогену, (С1-С3) алкілу, (С1-С3) алкоксилу, нітро-, ціано- або аміногрупи, СF3 або ОСF3;
R3 та R4 вибирають з гідрогену, алкілу, арилу, ацилу, ароїлу, карбамоїлу, карбалкоксилу; а
R5 вибирають з гідрогену, алкілу, арилу та аралкілу.
3. Сполука за п.1, яка відрізняється тим, що NR1R2:
4-феноксикарбонілпіперазин-1-іл;
4-(4-флуорфенілацетил)піперазин-1-іл;
4-фенілетилпіперазин-1-іл;
4-феноксиметилкарбонілпіперазин-1-іл;
4-феніламінокарбонілпіперазин-1-іл;
4-бензоїлметилпіперазин-1-іл; або
4-бензилкарбонілпіперазин-1-іл.
4. Сполука за п.1, яка відрізняється тим, що NR1R2 - група формули
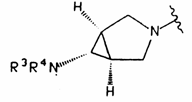 ,
,
в якій R3R4N – NН2.
5. Сполука за п.1, яка відрізняється тим, що NR1R2 - група формул
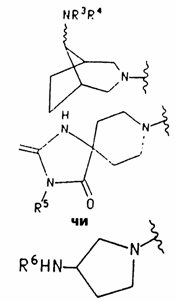 ,
,
в яких R5 - аралкіл, а R6 - (4-флуор)фенілацетил.
6. Сполука за п.1, яка відрізняється тим, що її вибирають з групи, що включає:
1-(4-{2-[4-(6-амінопіридин-2-іл)феніл]етил}піперазин-1-іл)етанон;
1-(4-{2-[4-(6-амінопіридин-2-іл)феніл]етил}піперазин-1-іл)-2-метоксіетанон;
1-(4-{2-[4-(6-амінопіридин-2-іл)феніл]етил}піперазин-1-іл)-2-феноксіетанон;
(4-{2-[4-(6-амінопіридин-2-іл)феніл]етил}піперазин-1-іл)циклопентилметанон;
1-(4-{2-[4-(6-амінопіридин-2-іл)феніл]етил}піперазин-1-іл)-2-фенілетанон;
3-{2-[4-(6-амінопіридин-2-іл)феніл]етил}-3-азабіцикло[3,1,0]гекс-6-иламін;
2-(4-{2-[4-(6-амінопіридин-2-іл)феніл]етил}піперазин-1-іл)-1-фенілетанон;
1-(4-{2-[4-(6-амінопіридин-2-іл)феніл]етил}піперазин-1-іл)-2-(4-флуорфеніл)етанон;
6-{4-[2-(4-фенетилпіперазин-1-іл)етил]феніл}-піридин-2-іламін;
2-(4-{2-[4-(6-амінопіридин-2-іл)феніл]етил}піперазин-1-іл)-1-фенілетанол;
{2-[4-(6-амінопіридин-2-іл)феніл]етил}-(3-окса-9-азабіцикло[3,3,1]нон-7-іл)амін;
6-(4-{2-[4-(2-аміно-2-фенілетил)піперазин-1-іл]етил}феніл)піридин-2-іламін;
6-{4-[2-(4-аміно-2,6-диметилпіперидин-1-іл)етил]феніл}піридин-2-іламін;
6-{4-[2-(4-метилпіперазин-1-іл)етил]феніл}піридин-2-іламін;
(3-{2-[4-(6-амінопіридин-2-іл)-феніл]етил}-3-азабіцикло[3,1,0]гекс-6-ил)диметиламін;
6-[4-(2-аміноетил)феніл]піридин-2-іламін;
6-{4-[2-(8-азаспіро[4,5]дец-8-ил)етил]феніл}піридин-2-іламін;
6-{4-[2-(4-ізобутилпіперазин-1-іл)етил]феніл}піридин-2-іламін;
п-толіламід 4-{2-[4-(6-амінопіридин-2-іл)феніл]етил}піперазин-1-карбонової кислоти;
6-(4-{2-[4-(3-фенілпропіл)піперазин-1-іл]етил}феніл)піридин-2-іламін;
1-(4-{2-[4-(6-амінопіридин-2-іл)-феніл]етил}піперазин-1-іл)-2-(4-хлорфеніл)етанон;
8-{2-[4-(6-амінопіридин-2-іл)феніл]етил}-3-бензил-1,3,8-триазаспіро[4,5]декан-2,4-діон;
N-(1-{2-[4-(6-амінопіридин-2-іл)феніл]етил}піролідин-3-іл)-2-(4-флуорфеніл)ацетамід;
8-{2-[4-(6-амінопіридин-2-іл)феніл]етил}-8-азабіцикло[3,2,1]окт-3-иламін;
3-{2-[4-(6-амінопіридин-2-іл)феніл]етил}-3-азабіцикло[3,2,1]окт-8-иламін;
2-аміно-1-(4-{2-[4-(6-амінопіридин-2-іл)феніл]етил}піперазин-1-іл)-3-фенілпропан-1-он;
6-{4-[2-(4-амінопіперидин-1-іл)етил]феніл}піридин-2-іламін;
6-{4-[2-(4-бензгідрилпіперазин-1-іл)етил]феніл}піридин-2-іламін;
6-{4-[2-(4-бензгідрилпіперидин-1-іл)етил]феніл}піридин-2-іламін
та фармацевтично прийнятні солі цих сполук.
7. Фармацевтична композиція для лікування чи попередження станів, до яких входять: мігрень, запальні захворювання, приступ, гострий чи хронічний біль, гіповолемічний та травматичний шок, проникне поранення, хвороба Крона, виразковий коліт, септичний шок, розсіяний склероз, СНІД-споріднене слабоумство, нейродегенеративні захворювання, нейронна токсичність, хвороба Альцгеймера, хімічна залежність та звичка, блювання, епілепсія, тривожність, психози, травма голови, віковий синдром нестачі дихання, симптоми при відмові від морфіну, запальні кишкові захворювання, остеоартрити, ревматоїдні артрити, овуляція, поширена кардіоміопатія, гостре поранення хребта, хвороби Хантингтона та Паркінсона, глаукома, дегенерація жовтої плями, діабетичні нейропатія та нефропатія, а також рак у ссавців, яка містить ефективну при лікуванні чи попередженні таких станів кількість сполуки за п.1, а також фармацевтично прийнятний носій.
8. Спосіб лікування чи попередження станів, до яких входять: мігрень, запальні захворювання, приступ, гострий чи хронічний біль, гіповолемічний та травматичний шок, проникне поранення, хвороба Крона, виразковий коліт, септичний шок, розсіяний склероз, СНІД-споріднене слабоумство, нейродегенеративні захворювання, нейронна токсичність, хвороба Альцгеймера, хімічна залежність та звичка, блювання, епілепсія, тривожність, психози, травма голови, віковий синдром нестачі дихання, симптоми при відмові від морфіну, запальні кишкові захворювання, остеоартрити, ревматоїдні артрити, овуляція, поширена кардіоміопатія, гостре поранення хребта, хвороби Хантингтона та Паркінсона, глаукома, дегенерація жовтої плями, діабетичні нейропатія та нефропатія, а також рак у ссавців, що включає застосування вказаним ссавцем ефективної при лікуванні чи попередженні таких станів кількості сполуки за п.1.
9. Фармацевтична композиція для інгібування синтази оксиду нітрогену (СОН) у ссавців, яка містить ефективну при інгібуванні СОН кількість сполуки за п.1, а також фармацевтично прийнятний носій.
10. Спосіб інгібування СОН у ссавців, включаючи людину, який полягає у застосуванні вказаним ссавцем ефективної при інгібуванні СОН кількості сполуки за п.1.
11. Фармацевтична композиція для лікування чи попередження станів, до яких входять: мігрень, запальні захворювання, приступ, гострий чи хронічний біль, гіповолемічний та травматичний шок, проникне поранення, хвороба Крона, виразковий коліт, септичний шок, розсіяний склероз, СНІД-споріднене слабоумство, нейродегенеративні захворювання, нейронна токсичність, хвороба Альцгеймера, хімічна залежність та звичка, блювання, епілепсія, тривожність, психози, травма голови, віковий синдром нестачі дихання, симптоми при відмові від морфіну, запальні кишкові захворювання, остеоартрити, ревматоїдні артрити, овуляція, поширена кардіоміопатія, гостре поранення хребта, хвороби Хантингтона та Паркінсона, глаукома, дегенерація жовтої плями, діабетичні нейропатія та нефропатія, а також рак у ссавців, яка містить ефективну при інгібуванні СОН кількість сполуки за п.1, а також фармацевтично прийнятний носій.
12. Спосіб лікування чи попередження станів, до яких входять: мігрень, запальні захворювання, приступ, гострий чи хронічний біль, гіповолемічний та травматичний шок, проникне поранення, хвороба Крона, виразковий коліт, септичний шок, розсіяний склероз, СНІД-споріднене слабоумство, нейродегенеративні захворювання, нейронна токсичність, хвороба Альцгеймера, хімічна залежність та звичка, блювання, епілепсія, тривожність, психози, травма голови, віковий синдром нестачі дихання, симптоми при відмові від морфіну, запальні кишкові захворювання, остеоартрити, ревматоїдні артрити, овуляція, поширена кардіоміопатія, гостре поранення хребта, хвороби Хантингтона та Паркінсона, глаукома, дегенерація жовтої плями, діабетичні нейропатія та нефропатія, а також рак у ссавців, що включає застосування вказаним ссавцем ефективної при інгібуванні СОН кількості сполуки за п.1.
Текст
1 Сполука формули та и фармацевтично прийнятні солі, в яких R1 та R2 незалежно вибирають з (С-і-Сє) алкілу, тетрапдронафталшу та аралкілу, арильна група якого є фенілом чи нафтилом, а алкільна, лінійна чи розгалужена, містить 1-6 атомів карбону, і де вказані (С-і-Сє) алкіл, тетрапдронафталшіл або арильна група вказаного аралкілу, як варіант, можуть бути заміщені одним-трьома замісниками, які незалежно вибирають з галогену, нітро-, гідрокси-, ціано- та аміногруп, (С1-С4) алкоксилу та (С1-С4) алкіламшогрупи, або R1 та R разом з нітрогеном, до якого вони приєднані, утворюють піперазинове, піперидинове або піролідинове кільце, або азабіцикл, що включає 6-14 кільцевих членів, один-три з яких є атомами нітрогену, а решта - атомами карбону, і де вказані піперазиновий, піперидиновий або піролідиновий цикли, як варіант, можуть бути заміщені одним чи більше замісниками, які незалежно вибирають з (С-і-Сб) алкілу, аміногрупи, (С-і-Сє) алкіламшогрупи, [ді - (С-і-Сє) алкіл]амшогрупи, фенілу, який заміщено 5-6-членним гетероциклом, що включає 1-4 кільцевих атоми нітрогену, бензоілом, ІНГІБУВАННЯ бензоїл метилом, бензил карбонілом, феніламшокарбонілом, фенілетилом та феноксикарбонілом, і де фенільні групи будь-якого з наведених замісників, як варіант, можуть бути заміщені одним чи більше замісниками, які незалежно вибирають з галогену, (С-і-Сз) алкілу, (С-і-Сз) алкоксилу, нітро-, ціано- або аміногрупи, CF3 або OCF3, п -0, 1 чи 2, m -0, 1 чи 2, кожний з R та R незалежно вибирають з (С1-С4) алкілу, арил (С1-С4) алкілу, арильна група якого є фенілом чи нафтилом, алкілу та феналілу, Х т а Y незалежно вибирають з метилу, метоксилу, гідроксилу та гідрогену, а R - ( d - C 4 ) алкіл, з умовою, що R відсутній, коли N = 0, a R відсутній, коли m = 0, або фармацевтично прийнятні солі приєднання кислот цих сполук 2 Сполука за п 1 , яка відрізняється тим, що NR1R2 є заміщеним, як варіант, піперазиновим, піперидиновим або піролідиновим циклом, де зазначені піперазиновий, піперидиновий або пірол ідиновий цикли заміщені, як варіант, одним чи більше замісниками, переважно, від нуля до двох замісників, які незалежно вибрано з (С-і-Сє) алкілу, аміногрупи, (С-і-Сб) алкіламшогрупи, [ді-(Сі-Сб) алкіл]аміногрупи, фенілу, який заміщено 5-6-членним гетероциклом з 1-4 кільцевими атомами нітрогену, бензоілом, бензоїл метилом, бензил карбонілом, феніламшокарбонілом, фенілетилом та феноксикарбонілом, і де фенільні групи будь-якого з наведених замісників, як варіант, заміщені одним чи більше замісниками, які незалежно вибрано з галогену, (С-і-Сз) алкілу, (С-і-Сз) алкоксилу, нітро-, ціано- або аміногрупи, CF3 або OCF3, R3 та R4 вибирають з гідрогену, алкілу, арилу, ацилу, ароілу, карбамоілу, карбалкоксилу, а R вибирають з гідрогену, алкілу, арилу та аралкілу 3 Сполука за п 1 , яка відрізняється тим, що NR1R2 4-феноксикарбонілпіперазин-1-іл, 4-(4-флуорфенілацетил)піперазин-1-іл, 4-фенілетилпіперазин-1 -іл, 4-феноксиметилкарбонілпіперазин-1-іл, 4-феніламшокарбонілпіперазин-1-іл, О (О о о 49006 іл)етил]феніл}піридин-2-іламін, 6-{4-[2-(4-метилпіперазин-1-іл)етил]феніл}піридин2-іламш, (3-{2-[4-(6-амшопіридин-2-іл)-феніл]етил}-3азабіцикло[3,1,0]гекс-6-ил)диметиламш, К 6-[4-(2-аміноетил)феніл]піридин-2-іламш, 6-{4-[2-(8-азаспіро[4,5]дец-8ил)етил]феніл}піридин-2-іламш, 6-{4-[2-(4-ізобутилпіперазин-1 іл)етил]феніл}піридин-2-іламін, п-толіламід 4-{2-[4-(6-амшопіридин-2іл)феніл]етил}піперазин-1 -карбонової кислоти, 3 4 в якій R R N-NH 2 6-(4-{2-[4-(3-фенілпропіл)піперазин-15 Сполука за п 1 , яка відрізняється тим, що іл]етил}феніл)піридин-2-іламін, 1 2 NR R - група формул 1-(4-{2-[4-(6-амшопіридин-2-іл)феніл]етил}піперазин-1-іл)-2-(4-хлорфеніл)етанон, 8-{2-[4-(6-амшопіридин-2-іл)феніл]етил}-3-бензил1,3,8-триазаспіро[4,5]декан-2,4-дюн, І\І-(1-{2-[4-(6-амінопіридин-2іл)феніл]етил}піролідин-3-іл)-2-(4флуорфеніл)ацетамід, 8-{2-[4-(6-амшопіридин-2-іл)феніл]етил}-8азабіцикло[3,2,1]окт-3-иламш, 3-{2-[4-(6-амшопіридин-2-іл)феніл]етил}-3азабіцикло[3,2,1]окт-8-иламш, 2-амшо-1-(4-{2-[4-(6-амшопіридин-2іл)феніл]етил}піперазин-1 -іл)-3-фенілпропан-1 -он, 6-{4-[2-(4-амшопіперидин-1-іл)етил]феніл}піридин2-іламш, 6-{4-[2-(4-бензпдрилпіперазин-1іл)етил]феніл}піридин-2-іламін, 6-{4-[2-(4-бензпдрилпіперидин-1іл)етил]феніл}піридин-2-іламін та фармацевтично прийнятні солі цих сполук 7 Фармацевтична композиція для лікування чи попередження станів, до яких входять мігрень, запальні захворювання, приступ, гострий чи хронів яких R - аралкіл, a R - (4-флуор)фені л ацетил чний біль, пповолемічний та травматичний шок, 6 Сполука за п 1, яка відрізняється тим, що її випроникне поранення, хвороба Крона, виразковий бирають з групи, що включає коліт, септичний шок, розсіяний склероз, СНІД1-(4-{2-[4-(6-амшопіридин-2споріднене слабоумство, нейродегенеративні заіл)феніл]етил}піперазин-1-іл)етанон, хворювання, нейронна токсичність, хвороба Альц1-(4-{2-[4-(6-амшопіридин-2геймера, хімічна залежність та звичка, блювання, іл)феніл]етил}піперазин-1-іл)-2-метоксіетанон, епілепсія, тривожність, психози, травма голови, 1-(4-{2-[4-(6-амшопіридин-2віковий синдром нестачі дихання, симптоми при іл)феніл]етил}піперазин-1-іл)-2-феноксіетанон, ВІДМОВІ від морфіну, запальні кишкові захворюван(4-{2-[4-(6-амшопіридин-2-іл)феніл]етил}піперазиння, остеоартрити, ревматоїдні артрити, овуляція, 1-іл)циклопентилметанон, поширена кардюмюпатія, гостре поранення хреб1-(4-{2-[4-(6-амшопіридин-2та, хвороби Хантингтона та Паркінсона, глаукома, іл)феніл]етил}піперазин-1-іл)-2-фенілетанон, дегенерація жовтої плями, діабетичні нейропатія 3-{2-[4-(6-амшопіридин-2-іл)феніл]етил}-3та нефропатія, а також рак у ссавців, яка містить азабіцикло[3,1,0]гекс-6-иламін, ефективну при лікуванні чи попередженні таких 2-(4-{2-[4-(6-амшопіридин-2станів КІЛЬКІСТЬ сполуки за п 1, а також фармацевіл)феніл]етил}піперазин-1 -іл)-1 -фенілетанон, тично прийнятний носій 1-(4-{2-[4-(6-амшопіридин-28 Спосіб лікування чи попередження станів, до іл)феніл]етил}піперазин-1-іл)-2-(4яких входять мігрень, запальні захворювання, флуорфеніл)етанон, приступ, гострий чи хронічний біль, пповолемічний 6-{4-[2-(4-фенетилпіперазин-1-іл)етил]феніл}та травматичний шок, проникне поранення, хворопіридин-2-іламін, ба Крона, виразковий коліт, септичний шок, розсі2-(4-{2-[4-(6-амшопіридин-2яний склероз, СНІД-споріднене слабоумство, нейіл)феніл]етил}піперазин-1 -іл)-1 -фенілетанол, родегенеративні захворювання, нейронна {2-[4-(6-амшопіридин-2-іл)феніл]етил}-(3-окса-9токсичність, хвороба Альцгеймера, хімічна залежазабіцикло[3,3,1]нон-7-іл)амш, ність та звичка, блювання, епілепсія, тривожність, 6-(4-{2-[4-(2-амшо-2-фенілетил)піперазин-1психози, травма голови, віковий синдром нестачі іл]етил}феніл)піридин-2-іламін, дихання, симптоми при ВІДМОВІ ВІД морфіну, запа6-{4-[2-(4-амшо-2,6-диметилпіперидин-1льні кишкові захворювання, остеоартрити, ревма4-бензоілметилпіперазин-1-іл, або 4-бензилкарбонілпіперазин-1 -іл 4 Сполука за п 1 , яка відрізняється тим, що 1 2 NR R - група формули 49006 тоїдні артрити, овуляція, поширена кардюмюпатія, ня, остеоартрити, ревматоїдні артрити, овуляція, гостре поранення хребта, хвороби Хантингтона та поширена кардюмюпатія, гостре поранення хребПаркінсона, глаукома, дегенерація жовтої плями, та, хвороби Хантингтона та Паркінсона, глаукома, діабетичні нейропатія та нефропатія, а також рак у дегенерація жовтої плями, діабетичні нейропатія ссавців, що включає застосування вказаним ссавта нефропатія, а також рак у ссавців, яка містить цем ефективної при лікуванні чи попередженні ефективну при інгібуванні СОН КІЛЬКІСТЬ сполуки таких станів КІЛЬКОСТІ сполуки за п 1 за п 1, а також фармацевтично прийнятний носій 12 Спосіб лікування чи попередження станів, до 9 Фармацевтична композиція для інгібування синяких входять мігрень, запальні захворювання, тази оксиду нітрогену (СОН) у ссавців, яка містить приступ, гострий чи хронічний біль, пповолемічний ефективну при інгібуванні СОН КІЛЬКІСТЬ сполуки та травматичний шок, проникне поранення, хвороза п 1, а також фармацевтично прийнятний носій ба Крона, виразковий коліт, септичний шок, розсі10 Спосіб інгібування СОН у ссавців, включаючи яний склероз, СНІД-споріднене слабоумство, нейлюдину, який полягає у застосуванні вказаним родегенеративні захворювання, нейронна ссавцем ефективної при інгібуванні СОН КІЛЬКОСТІ токсичність, хвороба Альцгеймера, хімічна залежсполуки за п 1 ність та звичка, блювання, епілепсія, тривожність, 11 Фармацевтична композиція для лікування чи психози, травма голови, віковий синдром нестачі попередження станів, до яких входять мігрень, дихання, симптоми при ВІДМОВІ ВІД морфіну, запазапальні захворювання, приступ, гострий чи хронільні кишкові захворювання, остеоартрити, ревмачний біль, пповолемічний та травматичний шок, тоїдні артрити, овуляція, поширена кардюмюпатія, проникне поранення, хвороба Крона, виразковий гостре поранення хребта, хвороби Хантингтона та коліт, септичний шок, розсіяний склероз, СНІДПаркінсона, глаукома, дегенерація жовтої плями, споріднене слабоумство, нейродегенеративні задіабетичні нейропатія та нефропатія, а також рак у хворювання, нейронна токсичність, хвороба Альцссавців, що включає застосування вказаним ссавгеймера, хімічна залежність та звичка, блювання, цем ефективної при інгібуванні СОН КІЛЬКОСТІ споепілепсія, тривожність, психози, травма голови, луки за п 1 віковий синдром нестачі дихання, симптоми при ВІДМОВІ від морфіну, запальні кишкові захворюван Винахід відноситься до деяких похідних 6фенілпіридил-2-амша , що виявляють активність інгібіторів синтази оксиду нітрогену (СОН), фармацевтичним композиціям, що їх містять, та їх використанню при лікуванні та попередженні розладів центральної нервової системи та запальних, септичного шоку та інших ВІДОМІ три ізоформи СОН - індуціююча (І-СОН) та дві основні - нейронна (Н-СОН) та ендотеліальна (Е-СОН) Кожна з цих ферментних форм здійснює конверсію аргініну у цитрулін , утворюючи при цьому молекулу оксиду нітрогену (N0) у ВІДПОВІДЬ на різні стимули Можна вважати, що надлишок оксиду нітрогену, що виробляється СОН, грає роль у патології ряду розладів та станів ссавців Наприклад, можна вважати, що N0, яку виробляє І-СОН, грає роль у захворюваннях, що включають таку системну гіпотензію, як токсичний шок та терапія деякими цитокшами Було показано, що пацієнти, які хворі на рак і яких лікували такими цитокшами, як штерлейкін 1 (ІЛ-1), штерлейкін 2 (ІЛ-2) та пухлинний фактор некрозу (ПФН), страждали від викликаного цитокшами шоку та гіпотензії, обумовленої NO, що його виробляють макрофаги, тобто IСОН, див Chemical & Engineering News, Dec 20, p 33 (1993) Інгібітори І-СОН здатні попереджати це Можна також вважати, що І-СОН грає роль у патології таких захворювань центральної нервової системи, як ішемія Наприклад, інгібування І-СОН показала зменшення пошкоджень від церебральної ішемії у пацюків, див Am J Physiol , 268, р R286 (1995) Пригнічення ад'ювантів, викликаних артритами, селективним інгібуванням І-СОН наведено у Br J Pharmacol , 273, р 15-24 (1995) Можна думати, що N0, який виробляється НСОН, грає роль у таких захворюваннях, як церебральна ішемія, біль, та толерантність до опіатів Наприклад, інгібування Н-СОН зменшує об'єм інфаркту після закупорки проксимальної середньої церебральної артерії у пацюків, див J CerebrlBlood Flow Metab , 14, p 924-929 (1994) Також було показано, що інгібування Н-СОН діє на антиноцицептивність, що свідчить про активність на ПІЗНІЙ фазі викликаного формаліном вилизування задньої лапи та досліду викликаного оцтовою кислотою черевного скорочення, див Br J Pharmacol , 110, р 219 - 224 (1993) Наприкінці, відмова від ОПІОІДІВ у гризунів, як описано у Neuropsychopharmacol , 13, р 269 - 293 (1995), полегшується інгібуванням Н-СОН Згідно З винаходом запропоновано сполуки фоомули та їх фармацевтично прийнятні солі, в яких R1 та R незалежно вибирають з Сі-Сєалкілу, тетрапдронафталшу та аралкіла, арильна група якого є фенілом чи нафтилом, а алкільна, лінійна 49006 8 чи розгалужена, містить 1-6 атомів карбону, і де атомів нітрогену, бензоілом, бензоїл метилом, вказані Сі-Сєалкіл, тетрапдронафталш та аралкіл, бензил карбонілом, феніламшокарбонілом, феніяк варіант, можуть бути заміщені 1-3 замісниками, летилом та феноксикарбонілом, і де фенільні грукраще - 0-2 замісниками, які незалежно вибирають пи будь-якого з наведених замісників, як варіант, з галогену, наприклад хлору, фтору, брому, йоду, можуть бути заміщені одним чи більше замісниканітро-, гідрокси-, ціано- та аміногруп, d ми, краще - 0-2 замісниками, які незалежно вибиС4алкоксилута Сі-С4алкіламіногрупи, рають з галогену, Сі-Сзалкілу, Сі-Сзалкоксилу, 1 2 нітро-, ціано- або аміногрупи, CF3 або OCF3, або R та R разом з нітрогеном, до якого вони приєднані, утворюють піперазинове, піперидинове п -0,1 чи 2, або піролідинове кільце, або азабіцикл, що вклюm -0,1 чи 2, чає 6-14 кільцевих членів, 1-3 з яких атоми нітрокожний з R та R незалежно вибирають з d гену, а решта, карбон, прикладами вказаних азабіС4алкілу, арил-Сі-С4алкілу, арильна група якого є циклів є фенілом чи нафтилом, алілута феналілу, X та Y незалежно вибирають з метилу, метоксилу, гідроксилу та гідрогену, а 10 R - Сі-С4алкіл, 8 9 з умовою, що R відсутній, коли N=0, a R відсутній, коли т = 0 До рамок винаходу також відносяться фармацевтичне прийнятні солі приєднання кислот сполук формули (І), для чого можна використовувати кислоти, що утворюють нетоксичні солі, наприклад, що містять аніони кислот хлоридної, пдробромідноі, пдроюдидної, нітратної, сульфатної (також пдросульфатний), фосфатної (також пдрофосфатні), оцтової, молочної, лимонної (також пдроцитратні), винної (також пдротартратний), янтарної, малеїнової, фумарової, глюконової, сахарної, бензойної, метансульфонової, етансульфонової, бензолсульфонової, л-толуолсульфонової та памової [наприклад, 1,1-метилен-біс-(2-пдрокси-3нафтоат)] Алкіл, ЯКЩО не визначено інше, означає насичений одновалентний ЛІНІЙНИЙ ЧИ розгалужений, циклічний або комбінований вуглеводневий радикал Один чи більше замісників означає число замісників від одного до максимального для наявних можливих позицій приєднання Галоген, якщо не визначено інше, означає хлор, фтор, бром, юд Прикладами кращих сполук згідно з винаходом є сполуки формули (І) та їх фармацевтичне прийнятні солі, в яких R1R2N 4-феноксикарбонілпіперазин-1-іл, 4-(4-флуорфенілацетил)піперазин-1-іл, 4-фенілетиллпіперазин-1-іл, 4-феноксиметилкарбонілпіперазин-1-іл, 4-феніламшокарбонілпіперазин-1 -іл, 4-бензоілметилпіперазин-1 -іл, або 0 4-бензилкарбонілпіперазин-1 -іл Прикладами інших кращих сполук згідно з виде RJTa R4 вибирають з гідрогену, Сі-Сєалкілу, находом є сполуки формули (І) та їх фармацевтифенілу, нафтилу, Сі-Сєалкіл-С(=О)-, НС(=О)-, d чне прийнятні солі, в яких R1R N - група Сєалкоксил-С(=О)-, феніл-С(=О)-, нафтил-С(=О)-, 7 8 7 8 а також R R NC(=O)-, де R та R незалежно вибирають з гідрогену та СгСеалкілу, R5 вибирають з гідрогену, Сі-Сєалкілу, фенілу, нафтилу, феніл-Сі-Сєалкілу та нафтил-Сг Сєалкілу-, і де вказані піперазинове, піперидинове або піролідинове кільця, як варіант, можуть бути заміщені одним чи більше замісниками, краще - 0-2 в ЯКІЙ R 3 R 4 N-NH 2 замісниками, які незалежно вибирають з d Іншими кращими сполуками згідно з винахоСєалкілу, аміногрупи, Сі-Сєалкіламіногрупи, [ді-Сг дом є сполуки формули (І) та їх фармацевтичне Сбалкіл]амшогрупи, фенілу, який заміщено 5-6прийнятні солі, в яких R1R N - групи членним гетероциклом, що включає 1-4 кільцевих 49006 R6HN в яких R - аралкіл, наприклад, бензил, a R (4-флуор)фенілацетил Найкращі сполуки згідно з винаходом включають 1-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}піперазин-1-іл)-етанон, 1-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}піперазин-1-іл)-2-метоксіетанон, 1-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}піперазин-1-іл)-2-феноксіетанон, (4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}піперазин-1-іл)-циклопентилметанон, 1-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}піперазин-1 -іл)-2-фенілетанон, 3{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}-3азабіцикло[3,1,0]гекс-6-иламін, 2-(4-{2-[4-(6-амшопІридин-2-іл)-феніл]-етил}піперазин-1 -іл)-1 -фенілетанон, 1-(4{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}піперазин-1-іл)-2-(4-флуорфеніл)-етанон, 6-{4-[2-(4-фенетилпіперазин-1-іл)-етил]-феніл}піридин-2-іламін, 2-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}піперазин-1 -іл)-1 -фенілетанол, {2-[4-(6-амшопіридин-2-іл)-феніл]-етил}-(3окса-9-азабіцикло[3,3,1]нон-7-іл)амш, 6-(4-{2-[4-(2-амшо-2-фенілетил)піперазин-1-іл]етил}-феніл)-піридин-2-іламІн, 6-{4-[2-(4-амшо-2,6-диметилпіперидин-1-іл)етил]-феніл}-піридин-2-іламш, 6-{4-[2-(4-метилпіперазин-1-іл)-етил]-феніл}піридин-2-іламін, (3{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}-3азабіцикло[3,1,0]гекс-6-ил)диметиламш, 6-[4-(2-аміноетил)-феніл]-піридин-2-іламш, 6-{4-[2-(8-азаспіро[4,5]дец-8-іл)-етил]-феніл}пІридин-2-іламш, 6-{4-[2-(4-ізобутилпіперазин-1-іл)-етил]-феніл}піридин-2-іламін, 2-(4-{2-[4-(6-амІнопіридин-2-іл)-феніл]-етил}піперазин-1-іл)-М-ізопропілацетамід, п-толіламід 4{2-[4-(6-амшопіридин-2-іл)-феніл]етил}-піперазин-1-карбонової кислоти, 6-(4-{2-[4-(3-фенілпропіл)піперазин-1-іл]-етил}феніл)-піридин-2-іламін, 1-(4-{2-[4-(6-ам1нопіридин-2-іл)-феніл]-етил}птеразин-1-іл)-2-(4-хлорфеніл)етанон, 8-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}-3бензил-1,3,8-тріазаспіро[4,5]декан-2,4-дюн, 10 М-(1-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}піролідин-3-іл)-2-(4-флуорфеніл)-ацетамід, 8-{2-[4-(6-амінопіридин-2-іл)-феніл]-етил}-8азабіцикло[3,2,1]окт-3-иламш, 3-{2-[4-(6-амінопіридин-2-іл)-феніл]-етил}-3азабіцикло[3,2,1]окт-8-иламш, 2-аміно-1-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]етил}-піперазин-1 -іл)-3-фенілпропан-1 -он, 6-{4-[2-(4-амінопіперидин-1-іл)-етил]-феніл}піридин-2-іламін, 6-{4-[2-(4-бензпдрилпіперазин-1-іл)-етил]феніл}-піридин-2-іламш, 6-{4-[2-(4-бензпдрилпіперидин-1-іл)-етил]феніл}-піридин-2-іламш, 6-{4-[(циклогексилметиламшо)-метил]-феніл}піридин-2-іламін, 6-{4-[(циклогексилметиламшо)-метил]-2метоксифеніл}-піридин-2-іламін, 6-[4-(фенетиламшометил)-феніл]-піридин-2їламін, 6-[2-метокси-4-(фенетиламшометил)-феніл]піридин-2-іламін, 6-[4-(4-амшопіперидин-1-ілметил]-феніл}піридин-2-іламін, 6-{4-[(циклогексилметиламшо)-метил]-2флуорфеніл}-піридин-2-іламш, Інші сполуки формули (І) включають 1-(4-{2-[4-(6-амінопіридин-2-іл)-2метоксифеніл]-етил} -піперазин1-іл)-2фенілетанон, 6-{4-[2-(4'ізобутилпіперазин-1-іл)-етил]-2метоксифеніл}-піридин-2-іламін, 3-{2-[4-(6-амінопіридин-2-іл)-2-метоксифеніл]етил}-3-азабщикло[3,1,0]гекс-6-иламін, {2-[4-(6-амшопіридин-2-іл)-2-метоксифеніл]етил}-(3-окса-9-азабіцикло[3,3,1 ]нон-7-іл)амш, 6-(4-{2-[4-(2-аміно-2-фенілетил)піперазин-1-іл]етил}-2-метоксифеніл)-піридин-2-іламш, 6-{4-[2-(4-аміно-2-метоксипіперидин-1-іл)етил]-2-метоксифеніл}-пІридин-2-іламш, 2-(4-{2-[4-(6-амінопіридин-2-іл)-2метоксифеніл]-етил}-піперазин1-in)-Nізопропілацетамід, 6-[4-(4-амшопІперидин-1-ілметил]-2метоксифеніл}-піридин-2-іламін, 1-(4-{2-[4-(6-амінопіридин-2-іл)-2-метилфеніл]етил}-піперазин-1-іл)-2-фенілетанон, 6-{4-[2-(4'ізобутилпіперазин-1-іл)-етил]-2метилфеніл}-піридин-2-іламш, 3-{2-[4-(6-амінопіридин-2-іл)-2-метилфеніл]етил}-3-азабщикло[3,1,0]гекс-6-иламін, 2-(4-{2-[4-(6-амінопіридин-2-іл)-2-метилфеніл]етил}-піперазин-1-іл)-1-фенілетанон, 1-(4-{2-[4-(6-амінопіридин-2-іл)-2-метилфеніл]етил}-піперазин-1-іл)-2-(4-флуорфеніл)-етанон, 6-{4-[2-(4-фенетилпіперазин-1-іл)-етил]-2метилфеніл}-піридин-2-іламш, 2-(4{2-[4-(6-амшопіридин-2-іл)-2-метилфеніл]етил}-піперазин-1-іл)-1-фенілетанол, {2-[4-(6-амшопіридин-2-іл)-2-метилфеніл]етил}-3-окса-9-азабіцикло[3,3,1]нон-7-іламш, 6-(4-{2-[4-(2-аміно-2-фенілетил)піперазин-1-іл]етил}-2-метилфеніл)-піридин-2-іламін, 6-{4-[2-(4-амІно-2І6-диметилпІперидин-1-іл)етил]-2-метилфеніл}-піридин-2-іламш, 2-(4-{2-[4-(6-амінопіридин-2-іл)-2-метилфеніл] 12 11 49006 етил}-піперазин-1-іл)-І\І-, ізопропілацетамід, іл)амш, а також 6-[4-(4-амшопіперидин-1-ілметил]-2{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}-(9-(4метилфеніл}-піридин-2-іламш, метокси)бензил-3-окса-9-азабіцикло[3,3,1 ]нон-7іл)амш І\І-(1-{2-[4-(6-амінопіридин-2-іл)-феніл]-етил}піролідин-3-іл)-2-фенілацетамід, Згідно З винаходом також запропоновано фармацевтичні композиції для лікування чи попереІ\І-(1-{2-[4-(6-амінопіридин-2-іл)-феніл]-етил}дження таких станів, як мігрень, запальні захворюпіролідин-3-іл)-2-(3-трифлуорметилфеніл)вання, наприклад, астма, приступ, гострий чи ацетамід, хронічний біль, пповолемічний та травматичний І\І-(1-{2-[4-(6-амінопіридин-2-іл)-феніл]-етил}шок, проникаюче поранення, хвороба Крона, вирапіролідин-3-іл)-2-(4-толіл)-ацетамід, зковий коліт, септичний шок, розсіяний склероз, І\І-(1-{2-[4-(6-амінопІридин-2-іл)-феніл]-етил}СНІД-споріднене слабоумство, нейродегенеративпіролідин-3-іл)-2-(4-метоксифеніл)-ацетамід, ні захворювання, нейронна токсичність, хвороба 2-(4-{2-[4-(6-амшопіридин-2-іл)-2Альцгеймера, хімічна залежність та звичка, наприметоксифеніл]-етил} -піперазин-1-іл)-1клад, до ЛІКІВ, алкоголю та нікотину, блювання, фенілетанон, епілепсія, тривожність, психози, травма голови, 1-(4-{2-[4-(6-амшопіридин-2-іл)-2віковий синдром нестачі дихання, симптоми при метоксифеніл]-етил}-піперазин-1-іл)-2-(4ВІДМОВІ від морфіну, запальні кишкові захворюванфлуорфеніл)-етанон, ня, остеоартрити, ревматоїдні артрити, овуляція, І\І-(1-{2-[4-(6-амінопіридин-2-іл)-феніл]-етил}поширена кардюмюпатия, гостре поранення спинпіролідин-3-іл)-2-цимклогексилацетамід, ного хребта, хвороби Хантингтона та Паркінсона, 2-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}глаукома, дегенерація жовтої плями, діабетичні піперазин-1-іл)-1-(4-толіл)-етанон, нейропатія та нефропатія, а також рак у ссавців, 2-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}включаючи людину, які містять ефективну при ліпіперазин-1-іл)-1-(4-метоксифеніл)-етанон, куванні чи попередженні таких станів КІЛЬКІСТЬ 2-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}сполуки формули (І) чи її фармацевтичне прийняпіперазин-1 -іл)-1 -(4-хлорфеніл)-етанон, тної солі, а також фармацевтичне прийнятний но2-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}сій піперазин-1 -іл)-1 -(4-флуорфеніл)-етанон, 2-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}Згідно З винаходом також запропоновано спопіперазин-1 -іл)-1 -циклогексилетанон, сіб лікування чи попередження таких станів, як мігрень, запальні захворювання, наприклад, аст1-(4-{2-[4-(6-амшопіридин-2-іл)-2-флуорфеніл]ма, приступ, гострий чи хронічний біль, пповолеміетил}-піперазин-1-іл)-2-фенілетанон, чний та травматичний шок, проникаюче поранен6-{4-[2-(4-ізобутилпіперазин-1-іл)-етил]-2ня, хвороба Крона, виразковий коліт, септичний флуорфеніл}-піридин-2-іламш, шок, розсіяний склероз, СНІД-споріднене слабо3-{2-[4-(6-амшопіридин-2-іл)-2-флуорфеніл]умство, нейродегенеративні захворювання, нейетил}-3-азабіцикло[3,1,0]гекс-6-иламш, ронна токсичність, хвороба Альцгеймера, хімічна 2-(4-{2-[4-(6-амшопіридин-2-іл)-2-флуорфеніл]залежність та звичка, наприклад, до ЛІКІВ, алкогоетил}-піперазин-1-іл)-1-феніл етанон, лю та нікотину, блювання, епілепсія, тривожність, 1-(4-{2-[4-(6-амшопіридин-2-іл)-2-флуорфеніл]психози, травма голови, віковий синдром нестачі етил} -піперазин- 1-іл)-2-(4-флуорфені л)-етаном, дихання, симптоми при ВІДМОВІ ВІД морфіну, запа6-{4-2-(4-фенетилпіперазин-1чл)-етил]-2льні кишкові захворювання, остеоартрити, ревмафлуорфеніл}-піридин-2-іламш, тоїдні артрити, овуляція, поширена кардюмюпа2-(4-{2-[4-(6-амшопіридин-2-іл)-2-флуорфеніл]тия, гостре поранення спинного хребта, хвороби етил}-піперазин-1-іл)-1-феніл етанол, Хантингтона та Паркінсона, глаукома, дегенерація {2-[4-(6-амшопіридин-2-іл)-2-флуорфеніл]жовтої плями, діабетичні нейропатія та нефропаетил}-3-окса-9-азабіцикло[3,3,1]нон-7-іламш, тія, а також рак у ссавців, включаючи людину, який 6-(4-{2-[4-(2-амшо-2-фенілетил)піперазин-1-іл]полягає у застосуванні вказаним ссавцем ефектиетил}-2-флуорфеніл)-піридин-2-іламш, вної при лікуванні чи попередженні таких станів 6-{4-[2-(4-амІно-2-флуорпіперидин-1-іл)-етил]КІЛЬКОСТІ сполуки формули (І) чи и фармацевтичне 2-флуорфеніл}-піридин-2-іламш, прийнятної солі 2-(4-{2-[4-(6-амшопіридин-2-іл)-2-флуорфеніл]етил} -піперазин-1 -іл)-М-ізопропілацетамід, Згідно З винаходом також запропоновано фармацевтичні композиції для інгібування синтази 6-[4-(4-амшопіперидин-1-ілметил]-2оксиду нітрогену (СОН) у ссавців, включаючи люфлуорфеніл}-піридин-2-іламш, дину, які містять ефективну при інгібуванні СОН 6-{4-[2-(4-амІно-2,6-діетилпіперидин-1-іл)КІЛЬКІСТЬ сполуки формули (І) чи и фармацевтичне етил]-фент}-піридин-2-іламш, прийнятної солі, а також фармацевтичне прийнят6-{4-[2-(4-амшо-2,6-дибензилпіперидин-1нл)ний носій етил]-феніл}-піридин-2-іламш, {2-[4-(6-амшопіридин-2-іл)-феніл]-етил}-(9-(4Згідно З винаходом також спосіб інгібування флуор)-бензил-3-окса-9-азабіцикло[3,3,1]нон-7СОН у ссавців, включаючи людину, який полягає у іл)амш, застосуванні вказаним ссавцем ефективної при інгібуванні СОН КІЛЬКОСТІ сполуки формули (І) чи її {2-[4-(6-амшопіридин-2-іл)-феніл]-етил}-(9-(4фармацевтичне прийнятної солі хлор)-бензил-3-окса-9-азабіцикло[3,3,1]нон-7іл)амш, Згідно З винаходом також запропоновано фармацевтичні композиції для лікування чи Попере{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}-(9-(4дження таких станів, як мігрень, запальні захворюметил)бензил-3-окса-9-азабіцикло[3,3,1]нон-7 13 49006 14 вання, наприклад, астма, приступ, гострий чи хропсихози, травма голови, віковий синдром нестачі нічний біль, пповолемічний та травматичний шок, дихання, симптоми при ВІДМОВІ ВІД морфіну, запапроникаюче поранення, хвороба Крона, виразкольні кишкові захворювання, остеоартрити, ревмавий коліт, септичний шок, розсіяний склероз, СНІДтоїдні артрити, овуляція, поширена кардюмюпаспоріднене слабоумство, нейродегенеративні затия, гостре поранення спинного хребта, хвороби хворювання, нейрона токсичність, хвороба АльцХантингтона та Паркінсона, глаукома, дегенерація геймера, хімічна залежність та звичка, наприклад, жовтої плями, діабетичні нейропатія та нефропадо ЛІКІВ, алкоголю та нікотину, блювання, епілептія, а також рак у ссавців, включаючи людину, який сія, тривожність, психози, травма голови, віковий полягає у застосуванні вказаним ссавцем ефектисиндром нестачі дихання, симптоми при ВІДМОВІ вної при інгібуванні СОН КІЛЬКОСТІ сполуки формуВІД морфіну, запальні кишкові захворювання, осли (II) чи и фармацевтично прийнятної солі теоартрити, ревматоїдні артрити, овуляція, пошиСполуки формули (І) мають хіральні рена кардюмюпатия, гостре поранення спинного центри, а тому можуть існувати у різних енантюхребта, хвороби Хантингтона та Паркінсона, глауменних та діастереомерних формах До рамок кома, дегенерація жовтої плями, діабетичні нейровинаходу відносяться усі оптичні ізомери та степатія та нефропатія, а також рак у ссавців, вклюреоізомери сполук формули (І) та їх суміші, а тачаючи людину, які містять ефективну при кож усі визначені вище фармацевтичні композиції інгібуванні СОН КІЛЬКІСТЬ сполуки формули (І) чи II та способи лікування, що включають чи викорисфармацевтичне прийнятної солі, а також фарматовують їх, ВІДПОВІДНО цевтично прийнятний носій Вищенаведені формули І та II включають ідентичні описаним сполуки, але в яких один чи більше Згідно З винаходом також запропоновано споз атомів гідрогену, карбону чи інших заміщено на сіб лікування чи попередження таких станів, як їх ізотопи Так сполуки можна використовувати при мігрень, запальні захворювання, наприклад, астдослідах та діагностиці при вивченні фармакокшема, приступ, гострий чи хронічний біль, пповолемітичного метаболізму та при аналізі зв'язування чний та травматичний шок, проникаюче поранення, хвороба Крона, виразковий коліт, септичний Сполуки формули (І) можна виготовити як пошок, розсіяний склероз, СНІД-споріднене слабоказано на нижченаведених схемах реакцій Якщо умство, нейродегенеративні захворювання, нейне вказано інше, R1, R , R3, R4, R5, R\ R7, R8, R9 та рона токсичність, хвороба Альцгеймера, хімічна R однакові у формулі І та на схемах реакцій і у залежність та звичка, наприклад, до ЛІКІВ, алкогопоясненнях до них лю та нікотину, блювання, епілепсія, тривожність, 15 49006 16 Схема 1 1 0 II HC . III 9 . Y 49006 17 18 Схема 2 Сн, Ъх ОНС oweи,С УЇ V E-toH/нгО VI I НО,С 20 49006 19 Схема З СИ 30-402 ынг*он-нс1 Xtl! 22 49006 21 Схема 4 Bf 8Н3-$Пег XV XIV CH XVI 30-40Z сн 1. RlCHO, NaCNBK3 2. R2CHO, NaCNBH3 R 'v XVI II мнгон-нс 49006 23 24 Схема 5 BL ut xvin-P XX I мнгон-нсі PhthN-C0s£-t XX! X II X NH2NH2 ШП ВИХІДНІ матеріали реакцій зі схеми 1 є промисловими аоо їх легко виготовити доступними спеціалістам способами з відомих сполук Перетворити сполуку формули II за схемою 1 у сполуку формули III можна спочатку перетворюючи сполуку формулиII у відповідну 2-амшосполуку реакцією з аміаком у полярному гідроксильному чи безпдроксильному розчиннику при температурах приблизно 100 - 250°С та тиску приблизно 345 3450кПа протягом 1 - 24 годин, краще в автоклаві з неіржавіючої сталі Пірольну групу далі вводять, додаючи гексан-2,5-дюн у чистому стані або такому неполярному розчиннику, як толуол, у присутності такого кислотного каталізатору, як оцтова чи 25 49006 26 хлоридна кислота, при температурі від кімнатної му чи спиртовому розчині, краще, воднодо, частіше, кипіння розчинника протягом 1 - 72 етанольному, при 25 - 100°С протягом 1 - 48 годин, годин і може включати деблокування такої протектуючої Перетворити сполуку формули III з вищенавегрупи, як т-бутоксикарбонільна, реакцією з трифденої реакції у сполуку IV можна використовуючи луороцтовою або ВІДПОВІДНОЮ полігалогенованою опосередковану перехідним металом реакцію спооцтовою кислотою, чи таким газуватим пдрогенхлучення з придатно заміщеним арилюдидом чи галідом, як НСІ, у галогенованому вуглеводні, етебромідом Конкретніше, літійове похідне сполуки рному розчиннику або етилацетаті при 70 - 100°С формули III отримують у етерному чи вуглеводнепротягом 10 хвилин - 24 годин Кінцеву сполуку І за вому розчиннику при температурах приблизно від схемою 2 виготовляють відновленням X бораном, -100°С до кімнатної, краще -78°С, використовуючи тріалкіл бораном, аланом або алюмопдридом ЛІтакий алкіллітий.як бутиллітій, протягом 10 - 120 ТІЮ у такому етерному розчиннику, як етиловий хвилин, а потім додаванням такого каталізатору з етер чи тетрапдрофуран ЛТФ), при -100 - 100°С металом, як хлорид цинку, та нагріванням до кімпротягом ЗО хвилин - 24 годин, використовуючи, як натної температури для досягнення переметалуваріант, флуорид цезію та карбонат лужного чи вання Далі додають арилюдид, наприклад, 1-юдлужно-земельного металу у водно-спиртовому 4-(2-хлоретил)бензол, або бромід та такий перехірозчиннику при 25 - 125°С протягом 1 - 72 годин дний метал, як паладій у формі тетракістрифенілЗа схемою 3 сполуку XI одержують депдраційфосфінпаладію, і нагрівають до ЗО - 100°С, звиним сполученням N-фенетил піперазину з 4чайно, температури кипіння розчинника протягом 1 бромфенілоцтовою кислотою дією такого депдра- 24 годин туючого засобу, як карбодммід, наприклад, N-етилг\|-(диметиламінопропіл)карбодммід, у галогеноваПеретворити сполуку формули IV у бажану ному вуглеводні або такому N.N-діалкіламіді, як сполуку формули І можна спочатку видаливши ДМФ, при 0 - 100°С протягом 1 - 48 годин Сполуку протектуючу пірольну групу з використанням пдXI перетворюють у XII відновленням бораном, тріроксиламшу або його гідрохлориду у такому поляалкіл бораном, аланом або алюмопдридом ЛІТІЮ у рному протонному розчиннику, як спирт, при темтакому етерному розчиннику, як етиловий етер чи пературах приблизно від кімнатної до 150°С, тетрапдрофуран ЛТФ), при -100 - 100°С протягом звичайно, температури кипіння розчинника, протяЗО хвилин - 24 годин, використовуючи, як варіант, гом 1 - 72 годин Це супроводжують додаванням флуорид цезію та карбонат лужного чи лужнозепридатної NR R2-rpynn при заміщенні хлору амимельного металу у водно-спиртовому розчиннику ном формули HNR R2, використовуючи такий попри 25 - 125°С протягом 1 - 72 годин Сполуку XII лярний протонний розчинник або полярний апродалі перетворюють у літій-органічне похідне таким тонний розчинник, як спирт, диметилформамід літій-органічним реагентом, як бутиллітій, з дода(ДМФ), метилізобутилкетон або N-метилпіролідон ванням до 4-метил-2-(2,5-диметил пірол іл)(ММП), як варіант, у присутності такого каталізатопіридину у такому етерному розчиннику, як етилору, як юдид натрію, при температурах приблизно вий етер, при -70 - 70°С протягом ЗО хвилин - 24 від кімнатної до 200°С, звичайно, температури годин Кінцеву сполуку І за схемою 3 виготовляють кипіння розчинника, а у випадку ДМФ та ІЧМП деблокуванням за допомогою гідрохлориду гидро140°С, протягом до 100 годин, звичайно 12 - 24 ксиламіну у водному чи спиртовому розчині, крагодин ще, водно-етанольному, при 25 - 100°С протягом 1 За схемою 2 сполуку формули VI виготовля- 48 годин ють реакцією V з п-формілбензолбороновою кислотою у розчиннику, що містить спирт, краще етаЗа схемою 4 сполуку XIV одержують депдранол, як варіант, змішаний з водою чи ційним сполученням дибензиламінуз 4галогенованим вуглеводнем, при 25 - 150°С протябромфенілоцтовою кислотою дією такого депдрагом 1 - 24 годин, використовуючи каталізатор на туючого засобу, як карбодммід, наприклад, N-етилоснові паладію ступеню окиснення 0 чи 2, звичайг\|-(диметиламінопропіл)карбодммід, у галогеновано з фосфіновими лігандами, краще у формі тетному вуглеводні або такому N.N-діалкіламіді, як ракістрифенілфосфінпаладію Сполуку формули ДМФ, при 0 - 100°С протягом 1 - 48 годин Сполуку VII виготовляють реакцією VI з тозилметилізоціаXIV перетворюють у XV відновленням бораном, нідом у присутності т-бугоксиду калію та етанолу у тріалкіл бораном, аланом або алюмопдридом ЛІтакому етерному розчиннику, як 1,2-диметоксіетан, ТІЮ у такому етерному розчиннику, як етиловий при -100 - 100°С протягом 1 - 24 годин Сполуку етер чи тетрапдрофуран ЛТФ), при -100 - 100°С формули VIII виготовляють з VII основним гідроліпротягом ЗО хвилин - 24 годин, використовуючи, як зом нітрилу з використанням гідроксиду лужного варіант, флуорид цезію та карбонат лужного чи металу у такому водно-спиртовому розчині, як волужноземельного металу у водно-спиртовому роздно-етанольний, при 25 - 125°С протягом 0,5 - 24 чиннику при 25 - 125°С протягом 1 - 72 годин Спогодин Сполуку формули IX виготовляють з VIII луку XV далі перетворюють у літій-органічне похідепдраційним сполученням з аміаком або первиндне таким літій-органічним реагентом, як ним чи вторинним аміном, дією такого депдратуюбутиллітій, з додаванням до 4-метил-2-(2,5чого засобу, як карбодммід, наприклад, г\І-етил-І\Ідиметилпіроліл)-піридину у такому етерному роз(диметиламшопропіл)карбодимід, у галогенованочиннику, як етиловий етер, при -70 - 70°С протяму вуглеводні або такому N.N-діалкіламіді, як гом ЗО хвилин - 24 годин, одержуючи сполуку XVI ДМФ, при 0 - 100°С протягом 1 - 48 годин Сполуку Сполуку XVII далі виготовляють з XVI пдрогеноліформули X виготовляють з IX деблокуванням за зом воднем чи форміатом амонію у присутності як допомогою гідрохлориду гидроксиламшу у воднокаталізатора такого благородного металу, як па 28 27 49006 ладій в етерному, галоген-вуглеводневому, спирСполуки формули І (активні сполуки, згідно з товому чи водно-спиртовому розчиннику при 0 винаходом) мають основний характер і здатні 100°С протягом ЗО хвилин - 24 годин Сполуку утворювати широкий ряд солей з неорганічними та XVIII далі виготовляють з XVII відновним амінуорганічними кислотами Хоча при застосуванні до ванням з альдегідом чи кетоном таким засобом, на ссавців такі солі повинні бути фармацевтичне приоснові боропдриду, як ціанборопдрид чи тріацетойнятними, на практиці часто бажано спочатку виксиборопдрид натрію в етерному, галогенділити сполуку формули І з реакційної суміші як вуглеводневому, спиртовому чи водно-спиртовому фармацевтичне неприйнятну сіль, а потім перерозчиннику при 0 - 100°С протягом 1 - 72 годин творити и у фармацевтичне прийнятну сіль спочаКінцеву сполуку І виготовляють деблокуванням за тку виділивши під дією лужного реагенту вільну допомогою пдрохлориду гидроксиламшу у воднооснову, а потім реакцією з ВІДПОВІДНОЮ КИСЛОТОЮ му чи спиртовому розчині, краще, водноСІЛЬ приєднання кислоти до основної активної етанольному, при 25 - 100°С протягом 1 - 48 годин сполуки згідно з винаходом легко приготувати обробкою основної сполуки придатною еквівалентЗа схемою 5 сполуку XIX одержують реакцією ною КІЛЬКІСТЮ вибраної мінеральної чи органічної відомого (ЕР 470794А1, див Chem Abs, 116 кислоти у водному чи такому органічному розчин193935) 2-бром-5-метиланізолу з алкіллітієм, звинику, як метанол або етанол При обережному чайно, бутиллітиєм в етерному чи вуглеводневому випарюванні розчинника легко одержати потрібну розчиннику при -100 - 0°С протягом 1 хвилини - 24 сіль годин, додаванням при -100 - 0°С алкіл- чи арилборатного естеру, звичайно, тр і етил борату, та Активні сполуки згідно з винаходом та їх фарперемішуванням при температурі 0°С з її поступомацевтичне прийнятні солі корисні як інгібітори вим підвищенням до закипання розчинника, частіСОН, тобто вони здатні інгібувати фермент СОН у ше 65°С, протягом 1 - 48 годин Сполуку XIX прессавців, атому здатні діяти як терапевтичний засіб творюють у XX реакцією з 6-бром-2-(2,5при лікуванні вищезгаданих захворювань уражедиметилпіролідил)піридином та лужним карбонаних ссавців том у розчині, що містить спирт, краще етанол, як Активні сполуки згідно з винаходом та їх фарваріант, змішаний з водою чи галогенованим вугмацевтично прийнятні солі можна вживати перолеводнем, при 25 - 150°С протягом 1 - 24 годин, рально, парентерально, або за місцем Взагалі, ці використовуючи каталізатор на основі паладію сполуки найбажаніше вживати у дозах приблизно ступеню окиснення 0 чи 2, звичайно з фосфінови0,01 - 250мг/добу одной чи кількома піддозами, ми лігандами, краще у формі тетракістрифенілфотобто, 1 - 4 піддози/добу, але в залежності від висфінпаладію Сполуку XXI виготовляють з XX споду, маси та стану лікуємого суб'єкту, а також вибчатку деблокуванням з використанням раного шляку застосування Однак, рівень дозупдроксиламіну або його пдрохлориду у водному вання, що найбажаніше застосовувати, складає чи спиртовому розчиннику, краще, водно0,07 - 2,1мг/кг/добу, хоча він може залежати від етанольному, при 25 - 150°С протягом 1 - 48 годин, виду, маси та стану лікуємого'суб'єкту, його ІНДИВІсупроводжуючи це реакцією з Nдуальноїчутливості до вказаних ЛІКІВ, а також типу карбетоксифталімідом у вуглеводневому розчинвибраної фармацевтичної композиції, періоду та нику при температурі від кімнатної до закипання інтервалу прийому У деяких випадках рівень дорозчинника, звичайно, 110°С, протягом 1 - 48 гозування, що менше вищевказаної нижчої межі, дин Перетворення сполуки XXI у XXII можна здійможе бути більше, ніж адекватним, у той час як в снити реакцією з N-бромсукцинімідом у хлороваінших випадках можна застосовувати більші дози ному вуглеводневому розчиннику, звичайно, не викликаючи будь-яких шкідливих побічних настетрахлориді карбону (ТХК), з каталітичною КІЛЬКІлідків при умові, що ці великі дози розділено на СТЮ такого радикального ініціатору, як азобісизокілька малих для застосування протягом доби бутиронітрил, при температурі від кімнатної до Активні сполуки згідно з винаходом можна 100°С протягом 10 хвилин - 24 годин Сполуку XXII вживати поодинці або у комбінації з фармацевтичперетворюють у XXIII реакцією з таким аміном, як не прийнятними носіями чи розріджувачами трьофенетиламш, у вуглеводневому, галогенма вищезазначеними шляхами і з застосуванням у вуглеводневому, етерному чи такому апротонному вигляді одної чи кількох доз Звичайніше застосуполярному розчиннику, як ацетонітрил, з лужним вання нових терапевтичних засобів згідно з винакарбонатом при температурі від кімнатної до ходом може відбуватися у широкому виборі різних 100°С протягом 10 хвилин - 48 годин Кінцеву споформ дозування, тобто, вони можуть бути поєдналуку І за схемою 5 виготовляють деблокуванням ні з різними фармацевтичне прийнятними інертXXIII за допомогою гідразину у водному, спиртоними носіями у формі капсул, таблеток, пастилок, вому чи етерному розчині, краще, воднольодяників, порошків, спреїв, кремів, мазей, супоетанольному при температурі від кімнатної до зиторієв, желе, гелей, паст, лосьонов, водних су150°С протягом 1 - 72 годин спензій, розчинів для ІН'ЄКЦІЙ, елексирів, сиропів, тощо Такі носи включають тверді розріджувачі або Виготовлення інших сполук окремо не описанаповнювачі, стерильні водні середовища та різні но, виходячи з того, що в експериментальному нетоксичні органічні розчинники тощо Крім того, розділі наведено комбінації вищенаведених реакпероральні фармацевтичні композиції можуть цій, що спеціалістам повинно бути зрозуміло включати підсолоджуючі та/або смакові добавки Для кожної з вищеописаних реакцій тиск не є Звичайно терапевтичне активні сполуки згідно з критичним параметром, якщо не позначено інше винаходом входять у ці дозовані форми у конценПрийнятний тиск від 0,5 до 5 атмосфер, але кратрації 5 - 70% за масою щим за зручністю є ЗОВНІШНІЙ ТИСК у 1 атмосферу ЗО 29 49006 Таблетки для перорального застосування, що мультиплет, ш -широкий включають такі носи, як мікрокристалічна целюлоПриклад 1 6-{4-[2-(4-фенетилпіперазин-1-іл)за, цитрат натрію, карбонат кальцію, фосфат етил]-феніл}-піридин-2-іламш кальцію та гліцин, можна успішно застосовувати з а) 2-амшо-6-бромпіридин такими дезинтегруючими засобами, як крохмаль, В автоклаві на ЗООмл розмістили 40г особливо, ккурудзяний, картопляний або зтапюки, (168ммоль) 2,6-дибромпіридину та 125мл 30% алпнова кислота та деякі складні силікати, разом з водного гідроксиду амонію, закрили та нагрівали З гранулюючими зв'язувачами типу полівшілпіролігодини при 170°С і 2750кПа Після охолодження дону, сахарози, желатину та гуміарабіку, а також вміст екстрагували етилацетатом, промивали розтакими змащувачами, як стеарат магнію, лаурилсолом та сушили сульфатом натрію Розчинник сульфат натрію та тальк, які при цьому часто ковипарювали і залишок хроматографували на силірисні кагелі з 2% метанолом у метиленхлориді як елюентом, отримавши 19,5г (67%) світложовтої твердої Тверді композиції такого типу можна вживати сполуки також як наповнювачі желатинових капсул, кращі 1 матеріали при цьому включають також лактозу чи Н-ЯМР (CDCI3l d) 106,8, 116 8, 139,9, 158,8 7 81 молочний цукор, а також високомолекулярний поМС (%) 173/175 (продукт, Вг 7Вг , 100/98) ліетилен гліколь Коли для перорального застосуб) 2-бром-6-(2,5-диметилпірол-1 -іл)піридин вання бажані водні суспензії та/або елексири, акУ круглодонну колбу на 1л з пасткою Динтивний інгредієнт можна поєднувати з різними Старка, зворотним холодильником та впуском для підсолоджуючими або смаковими, забарвлюючими азоту додали 21,3г (123ммоль) 2-амшо-6добавками, а за бажанням, також емульсифікуюбромпіридину, 400мл толуолу, 14,1г (123ммоль) чими та/або суспендуючими разом з такими розріацетонілацетону та 20 крапель оцтової кислоти, джувачами, як вода, етанол, пропіленгліколь, глінагрівали 5 діб під зворотним холодильником церин та їх комбінації (ТШХ у 1/1 етилацетат/гексані, Rf = 0,8 для продукту реакції, 0,5 для реагенту) Після охолодження Для парентерального застосування можна завміст розбавляли етилацетатом, промивали насистосовуватирозчини активних компонентів згідно з ченим водним розчином гідрокарбонату натрію та винаходом у кунжутній чи арахісовій олії або у ворозсолом і сушили сульфатом натрію Розчинник дному пропіленгліколі Водні розчини потрібно випарювали і залишок хроматографували на силібуферувати (кращі рН вищі за 8),а рідкий розрікагелі з 5% метанолом у метиленхлориді як елюеджувач треба спочатку робити ІЗОТОНІЧНИМ Такі нтом, отримавши 14,4г (47%) світложовтої легководні розчини та суспензії придатні для внутрішплавкої твердої сполуки ньовенних ІН'ЄКЦІЙ Масляні розчини придатні для 1 внутрішньосуглобових, внутрішньом'язових та Н-ЯМР (CDCI3l 5) 2,16 (с, 6Н), 5,89 (с, 2Н), підшкірних ІН'ЄКЦІЙ Виготовлення усіх таких розчи7,17 (д, J-7, 1Н), 7,47 (д, J-7, 1Н),7,67(т, J-8, 1Н) 1 нів у стерильних умовах здійснюють стандартними Х-ЯМР (CDCIs, 5) 13,3, 107,6, 120,3, 126,4, фармацевтичними способами, добре відомими 128,7, 139,8, 140,6, 151,9 спеціалістам МС (%) 251/253 (продукт, Вг79/Вг81, 100/98) Крім того, активні сполуки згідно з винаходом в) 2-(4-юдфеніл)етанол можна вживати також за місцем при лікуванні заУтригорлу круглодонну колбу на 500мл з крапальних станів шкіри у вигляді кремів, желе, гелей, пельною воронкою та впуском для азоту додали паст, пластирів, мазей тощо згідно зі стандартною 20,5г (150ммоль) 2-(4-амшофеніл)етанолу та 100 фармацевтичною практикою мл гарячої води з утворенням розчину, до якого Здатність сполук формули І інгібувати Е-СОН краплями додали розчин 3,5мл концентрованої можна визначити описаними Schmidt et al у сульфатної кислоти у Юмл води і охолодили до Proc Natl Acad Sci USA, 88 365-369 (1991) та 4°С Підтримуючи температуру 0 - 5°С, краплями Pollock et al у Proc Natl Acad Sci USA, 88 10480додали розчин 13,5мл концентрованої сульфатної 10484 (1991) способами кислоти у 50мл води і при тій же температурі краплями додали розчин 13г (188ммоль) нітриту натрію Здатність сполук формули І інгібувати І-СОН у 50мл води Через ЗО хвилин перемішування при можна визначити описаними Schmidt et al у 0 - 5°С краплями додали розчин 85г (512ммоль) Proc Natl Acad Sci USA, 88 365-369 (1991) та юдиду калію у ЮОмл води, розчину дали нагрітися Garvey et al у J Biol Chem , 269 26669-26676 до кімнатної температури і перемішували 2 годи(1994) способами Здатність сполук формули І ни, потім гріли при 60°С ЗО хвилин, охолоджували і інгібувати Н-СОН можна визначити описаними ДВІЧІ по 250мл екстрагували етилацетатом, промиBredt and Synder у Proc Natl Acad Sci USA, 87 682вали водним розчином тіосульфату натрію та роз685 (1990) способами солом і сушили сульфатом натрію Розчинник виПротестовано 100 сполук формули І, усі випарювали і залишок хроматографували на явили при інгібуванні І-СОН та Н-СОН величину силікагелі з 20% та 50% етилацетатом у гексані як ІК 5 0 < ЮцМ елюентом, отримавши 30,7г (82,5%) світложовтої Винахід ілюстровано нижченаведеними притвердої сполуки кладами які окремими підробицями не лімітують 1 винахід Температури плавління не коректували Н-ЯМР (CDCI3, S) 2,74 (м, 2Н), 3,79 (м, 2Н), Спектри ЯМР на 1Н та 13С вимірювали у дейтерох6,93 (м, 2Н), 7,57 (м, 2Н) 1 лороформі CDCI3 або у CD3OD чи CD3SOCD3, розХ-ЯМР (CDCI3, S) 38,6, 63,3, 91,7, 131,1, ташування ПІКІВ надано у млн 1 з тетрамети лей ла137,6, 138,3 ном як внутрішнім стандартом Позначки ПІКІВ С МС (%) 247 (продукт, 23) синглет, д - дублет, т - триплет, к - квартет, м г) 2-(4-юдфеніл)етилхлорид 32 31 49006 Утригорлу круглодонну колбу на 500мл з крамавши 7,8г (88%) продукту як світлокоричеву твепельною воронкою, зворотним холодильником та рду речовину впуском для азоту додали 30,7г (124ммоль) 2-(4^Н-ЯМР (CDCI3, 5) 2,97 (шс, 2Н, NH2), 3,05 (т, юдфеніл)етанолу, 100мл хлороформу та 10,0мл J-7, 2Н), 3,68 (т, J-7, 2Н), 6,85 (м, піридину, потім краплями протягом 15 хвилин до1Н), 6,88 (м, 1Н), 7,33 (м, 2Н), 7,68 (6, J-7, 1H), дали розчин 13,5мл тюнілхлориду у 50мл хлоро7,78 (м, 2Н) форму і гріли під зворотним холодильником 2 гоМС (%) 232 (продукт, 60), 183 (100) дини, охолоджували, розчинник випарювали і є) 6-{4-[2-(4-фенетилпіперазин-1-іл)залишок переносили в етилацетат, промивали 1Н етил]феніл)-піридин-2-іламін хлорид ною кислотою, насиченим водним розчиУ круглодонну колбу на 50мл зі зворотним хоном гідрокарбонату натрію та розсолом і сушили лодильником та впуском для азоту додали 0,02г сульфатом натрію Розчинник випарювали і зали(0,65ммоль) пдрохлориду 6-(4-(2-хлоретилфеніл)шок хроматографували на силікагелі з 20% етилапіридин-2-іламіну 0,125г (0,98ммоль) дмзопропілецетатом у гексані як елюентом, отримавши 32,6г тиламшу, 0,208г (1,9ммоль) карбонату натрію та (99%) продукту як масло 5мл сухого ДМФ, гріли під зворотним холодильни1 ком 18 годин, охолоджували, виливали у воду, Н-ЯМР (CDCI3l 5) 3,00 (т, J-7, 2H), 3,68 (т, J-7, екстрагували в етилацетат, органічний шар екст2Н), 6,99 (м, 2Н), 7,63 (м, 2Н) 13 рагували у 1Н хлрридну кислоту і водний шар С-ЯМР (CDCI3, 5) 38,6, 44,6, 92,7, 128,8, промивали свіжим етилацетатом, підлужували 1Н 130,9, 137,3 водним гідроксидом натрію і екстрагували в етид) 2-(2,5-диметилпірол-1-іл)-6-(4-(2лацетат, органічний шар промивали розсолом і хлоретилфеніл)-піридин сушили сульфатом натрію і випарювали, залишок У тригорлу круглодонну колбу на 1 л з воронхроматографували на силікагелі з 2% та 5% метакою, зворотним холодильником та впуском для нолом у метиленхлориді як елюентом, отримавши азоту додали 10,0г (40ммоль) 2-бром-6-(2,571 мг (28%) продукту як кремову тверду речовину з диметилпірол-1-іл)піридину та 200мл сухого ТГФ, т п л 111 -113°С охолоджували до -78°С, потім краплями протягом 10 хвилин додали 25,0мл (40ммоль) 1,6М розчину бутиллітію у гексані, перемішували 20 хвилин при 78°С, потім краплями протягом 40 хвилин додали ЮОмл (ЮОммоль) 1,6М розчину хлориду цинку в етері, підтримуючи температуру -70°С, після цього дали нагрітися розчину до кімнатної температури і додали 11,0г (40ммоль) 2-(4юдфеніл)етилхлориду, а потім 200мг тетракістрифенілфосфшпаладію Суміш гріли під зворотним холодильником 3 години, охолоджували, фільтрували крізь броунмілерит, фільтрат випарювали і залишок переносили в етилацетат, промивали розсолом і сушили сульфатом натрію Розчинник випарювали і залишок фільтрували через силікагель з метиленхлоридом, концентрували і хроматографували на силікагелі з 1% етилацетатом у гексані як елюентом, отримавши 7,3г (59%) продукту як масло 1 Н-ЯМР (CDCI3, 5) 2,19 (с, 6Н), 3,10 (т, J-7, 2Н), 3,73 (т, J-7, 2Н), 5,91 (с, 2Н), 7,12 (д, J-7, 1Н), 7,32 (т, J-8, 2Н), 7,72 (м, 1Н), 7,82 (м, 1Н), 8,01 (м, 2Н) 13 С-ЯМР (CDCI3, 5) 13,5, 28,9, 44,7, 106,9, 118,1, 119,8, 127,1, 128,7, 129,3, 137,1, 138,6, 139,4, 151,7, 156,6 МС(%) 311 (продукт+1,23) є) Гідрохлорид 6-(4-(2-хлоретилфеніл)піридин-2-іламіну Утригорлу круглодонну колбу на 500мл зі зворотним холодильником та впуском для азоту додали 9,0г (29,0ммоль) 2-(2,5-диметилпірол-1-іл)-6(4-(2-хлоретилфеніл)-піридину, 250мл етанолу, 50мл води та 10,1г (145ммоль) пдрохлориду пдроксиламіну, гріли під зворотним холодильником 36 годин, охолоджували, випарювали і залишок переносили в етилацетат, промивали насиченим водним розчином гідрокарбонату натрію та розсолом і сушили сульфатом натрію і випарювали, залишок хроматографували на силікагелі з 2% метанолом у метиленхлориді як елюентом, отри 1 Н-ЯМР (CDCI3, 5) 2,64 (м, 6Н), 2,84 (м, 2Н), 4,52 (шс, 2Н), 6,41 (д, J-8, 1H), 7,04 (д, J-7, 1H), 7,17,3 (м, 7Н), 7,45 (т, J-8, 1Н), 7,84 (м, 2Н) 13 С-ЯМР (CDCI3, 5) 33,3, 33,6, 53,2, 60,3, 60,5, 106,9, 110,7, 126,1, 126,8, 128,7, 128,9, 137,6, 138,3, 140,3, 140,9, 156,1, 158,2 МС (%) 387 (продукт + 1, 100) Аналіз розраховано для C25H30N4 • І/2Н2О C 75,91, Н7.90, N 14,16, знайдено С 76,00, Н8.01, N 14,17 Приклад 2 6-({ 2-[6-(т-бутоксикарбоніламіно)3-азабіцикло[3,1,0]гекс-6-ил]етил}-феніл)-піридин2-іламш Потрібну сполуку виготовили способом за прикладом 1є з 6-(т-бугоксикарбоніламіно)-3азабіцикло[3,1,0]гексану (вихід 48%) як коричневе масло 1 Н-ЯМР (CDCI3, 5) 1,43 (с, 9Н), 1,50 (м, 1Н), 1,70 (м, 1Н), 2,40 (м, 1Н), 2,64 (м, 2Н), 2,75 (м, 1Н), 3,15 (м, 1Н), 4,46 (м, 1Н), 6,42 (д, J-8, 1Н), 7,05 (д, J-7, 1Н), 7,22 (м, 2Н), 7,47 (т, J-8, 1H), 7,81 (д, J-8, 1Н) 13 С-ЯМР (CDCI3, 5) 28,4, 31,2, 35,2, 36,4, 54,5, 56,9, 60,3, 79,4, 106,8, 110,5, 126,7, 128,8, 137,4, 138,3, 141,1, 156,1, 158,2, 162,5 МС(%) 395 (продукт, 100) 3-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил}-3азабіцикло[3,1,0]гекс-6-иламін У круглодонну колбу на 25мл з впуском для азоту додали 0,135г (0,342ммоль) 6-({2-[6-(тбутоксикарбоніламшо)-3-азабіцикло[3,1,0]гекс-6ил]етил}-феніл)-піридин-2-іламшу та Змл трифлуороцтової кислоти, перемішували ЗО хвилин при кімнатній температурі, випарювали і залишок розтирали з ТГФ та етиловим етером, отримавши 195мг (76%) продукту як жовтувату тверду речовину з т п л 187- 190°С 1 Н-ЯМР (CDCI3, 5) 2,33 (м, 2Н), 2,95 (м, 1Н), 3,10 (м, ЗН), 3,47 (м, 2Н), 3,6-4,0 (м, 2Н), 6,95 (д, J8, 1Н), 7,13 (д, J-7, 1Н), 7,49 (м, 2Н), 7,76 (м, 2Н), 33 49006 7,94 (т, J-7, 1H) С-ЯМР (вільна основа у CDCI 3 , 5) 25,8, 32,7, 35,2, 55,0, 57,3, 106,8, 110,8, 126,7, 128,9, 137,5, 138,3, 141,0, 156,1, 158,2 МС (%) 295 (продую-+ 1, 100) Аналіз розраховано для C18H22N43C2HF3O2 C 45,29, Н 3,96, N 8,80, знайдено С 45,30, Н 3,93, N 8,80 Приклад 3 1-(4-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-піперазин-1-іл)-2-фенілетанон а) 6-({2-[4-(г-бутоксикарбоніл)-піперазин-1-іл]етил}-фент)-піридин-2-іламін Потрібну сполуку виготовили способом за прикладом 1є з т-бутоксикарбоніл)-піперазину (вихід 57,5%) з кип'ятінням ПІД зворотним холодильником у метилізобутилкетоні протягом 5 діб як світлокоричневу тверду сполуку 1 Н-ЯМР (CDCI 3 , 5) 1,45 (с, 9Н), 2,46 (м, 4Н), 2,61 (м, 2Н), 2,84 (м, 2Н), 3,45 (м, 4Н), 4,48 (шс, 1Н), 6,42 (д, J-8, 1Н), 7,05 (д, J-7, 1Н), 7,25 (м, 2Н), 7,47 (т, J-8, 1Н), 7,84 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 28,4, 33,3, 53,0, 60,3, 106,9, 110,7, 126,8, 128,9, 137,7, 138,3, 140,7, 154,8, 156,0, 158,2 МС (%) 383 (продукт + 1, 14), 283 (70), 197 (72), 143(70), 99(100) б) 6-{[2-(піперазин-1-іл)-етил]-феніл}-піридин2-іламш Потрібну сполуку виготовили способом за прикладом 26 (вихід 94%) як світлокоричневу тверду сполуку 1 Н-ЯМР (CDCI 3 , 5) 1,69 (с, 1Н), 2,49 (шс, 4Н), 2,58 (м, 2Н), 2,85 (м, 2Н), 2,91 (м, 4Н), 4,49 (шс, 2Н), 6,41 (д, J-8, 1Н), 7,04 (д, J-7, 1Н), 7,26 (м, 2Н), 7,46 (т, J-8, 1Н), 7,84 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 33,1, 46,1, 54,5, 61,0, 106.8, 110,7, 126,8, 128,9, 137,6, 138,3, 140,9, 156,1, 158,2 МС(%) 283 (продукт, 100) в) 1-(4-{2-[4-(6-амшопіридин-2-іл)-феніл]-етил} -піперазин- 1-іл)-2-фенілетанон У круглодонну колбу на 25мл з впуском для азоту додали 0,150г (0,53ммоль) 6-{[2-(піперазин1 -іл)-етил]-феніл}-піридин-2-іламшу, 15мл метиленхлориду, 0,070мл (0,53ммоль) тріетиламшу та 0,070мл (0,53ммоль) фенілацетилхлориду, перемішували 1 годину при кімнатній температурі і залишок хроматографували на силікагелі з 2,5% метанолом у метиленхлориді як елюентом, отримавши 126мг (59%) продукту як кремову тверду речовину з т пл 135-137°С ^Н-ЯМР (CDCI 3 , 5) 2,31 (м, 2Н), 2,48 (м, 2Н), 2,60 (м, 2Н), 2,79 (м, 2Н), 3,45 (м, 2Н), 3,67 (м, 2Н), 3,73 (с, 2Н), 4,53 (шс, 2Н), 6,42 (д, J-8, 1Н), 7,03 (д, J-7, 1Н), 7,2-7,4 (м, 7Н), 7,47 (т, J-8, 1Н), 7,82 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 33,1, 41,0, 41,7, 46,0, 52,6, 53,0, 59,9, 107,0, 110,7, 126,8, 126,9, 128,6, 128,7, 128.9, 135,1, 137,6, 138,4, 140,5, 155,9, 158,2 МС (%) 401 (продукт + 1, 100) Аналіз розраховано для C25H28N4O • І/4Н2О С 74,14, Н 7,04, N 13,83, знайдено С 74,48, Н 7,05, N 13,86 Приклад 4 4-{{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-піперазин-1-карбонова кислота 34 У круглодонну колбу на 25мл з впуском для азоту додали 0,150г (0,53ммоль) 6-{[2-(піперазин1-іл)-етил]-феніл}-піридин-2-іламшу, 60ші фенілізоціанату, 10мл 1,2-дихлоретану, 10мл етилацетату та 0,064г (0,53ммоль) 4-диметиламшопіридину, перемішували 14 годин при кімнатній температурі, випарювали і залишок хроматографували на силікагелі з 5% метанолом у метиленхлориді як елюентом, отримавши 205мг (96%) продукту як піну з т п л 60°С 1 Н-ЯМР (CDCI 3 , 5) 2,55 (м, 4Н), 2,68 (м, 2Н), 2,85 (м, 2Н), 3,52 (м, 4Н), 4,49 (шс, 2Н), 6,39 (с, 1Н), 6,42 (д, J-8, 1Н), 7,0-7,4 (м, 7Н), 7,48 (т, J-8, 1Н), 7,82 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 33,3, 44,1, 52,8, 60,1, 106,9, 110,8, 119,9, 123,1, 126,9, 128,9, 137,7, 138.4, 139,0, 155,0, 156,0, 158,2 МС (%) 402 (продукт + 1, 100) Аналіз розраховано для C24H27N5O • І/2Н2О С 70,22, Н 6,88, N 17,06, знайдено С 70,27, Н 6,60, N 17,22 Приклад 5 1-(4-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-піперазин-1 -іл)-2-(4флуорфеніл)етанон У круглодонну колбу на 50мл зі зворотним холодильником та впуском для азоту додали 0,200г (0,71ммоль) 6-{[2-(піперазин-1-іл)-етил]-феніл}піридин-2-іламіну, Юмл сухого ДМФ, 0,109г (0,71ммоль) 4-флуорфенілоцтовоі кислоти, 0,204г (1,1ммоль) етил(3диметиламшопропіл)карбодмміду та 0,36мл (2,1ммоль) дизопропілетиламшу, перемішували при кімнатній температурі 18 годин, виливали у воду, екстрагували в етилацетат, органічний шар екстрагували у 1Н хлоридну кислоту і водний шар промивали свіжим етилацетатом, підлужували 1Н водним гідроксидом натрію і екстрагували в етилацетат, органічний шар промивали розсолом і сушили сульфатом натрію і випарювали, залишок хроматографували на силікагелі з 3% метанолом у метиленхлориді як елюентом, отримавши ЮОмг (34%) продукту як кремову тверду речовину з т пл 143-145°С 1 Н-ЯМР (CDCI 3 , 5) 2,34 (м, 2Н), 2,46 (м, 2Н), 2,60 (м, 2Н), 2,79 (м, 2Н), 3,45 (м, 2Н), 3,66 (м, 2Н), 3,67 (с, 2Н), 4,52 (шс, 2Н), 6,41 (д, J-8, 1H), 6,9-7,3 (м, 6Н), 7,46 (т, J-8, 1Н), 7,82 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 33,2, 39,9, 41,8, 46,0, 52,7, 53,1, 59,9, 106,9, 110,7, 115,4, 115,7, 126,8, 128,7, 128,9, 130,2, 130,3, 130,7, 130,8, 137,7, 138,3, 140.5, 155,9, 158,2, 160,1, 163,4, 169,2 МС (%) 419 (продукт + 1, 100) Аналіз розраховано для C25H27FN4O C 71,75, Н6.50, N 13,39, знайдено С 71,46, Н 6,68, N 13,39 Приклад 6 6-{4-[2-(3,4-дипдро-1Н-ізохінолш-2іл)етил]-феніл}-піридин-2-іламш Потрібну сполуку виготовили способом за прикладом 1 з 1,2,3,4-тетрапдроізохінолшу (вихід 76%), т п л 130-132°С { Н-ЯМР (CDCI 3 , 5) 2,8-3,0 (м, 8Н), 3,76 (шс, 2Н), 6,39 (д, J-8, 1Н), 7,0-7,3 (м, 7Н), 7,46 (т, J-8, 1Н), 7,87 (д, J-8, 2H) 13 С-ЯМР (CDCI 3 , 5) 29,0, 33,6, 50,9, 60,0, 107,0, 110,7, 125,7, 126,2, 126,7, 127,0, 128,7, 129,0, 134,2, 134,5, 137,7, 138,4, 140,9, 156,0, 35 158,4 MC (%) 330 (продую-+ 1, 100) Аналіз розраховано для C22H23N3 С 80,21, Н 7,04, N 12,75, знайдено С 80,05, Н 7,11, N 12,62 Приклад 7 4-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-піперазин- 1-іл)-фуран-2-ілметанон Потрібну сполуку виготовили способом за прикладом 1 з (2-фуроіл)піперазину (вихід 51%), т пл 152-154°С 1 Н-ЯМР (CDCI 3 l 5) 2,55 (м, 2Н), 2,65 (м, 2Н), 2,82 (м, 2Н), 3,81 (шс, 2Н), 4,55 (шс, 2Н), 6,44 (м, 2Н), 6,96 (м, 1Н), 7,02 (д, J-8, 1Н), 7,23 (м, 2Н), 7,45 (м, 2Н), 7,83 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 33,2, 53,2ш, 60,0, 106,9, 110,6, 111,2, 126,9, 128,9, 137,7, 138,3, 140,6, 143,6, 148,0, 155,9, 158,3, 159,1 МС (%) 377 (продукт + 1, 100) Аналіз розраховано для C22H24N4O2 • ЗМЬЬО С 67 76, Н 6 59, N 14 37 Знайдено С 67 65, Н 6 25, N 14 44 Приклад 8 6-{4-[2-(4-м-толілпіперазин-1-іл)етил]феніл)-піридин-2-іламін виготовили способом за прикладом 1 з (3толіл)піперазину (вихід 60%), т пл 158 - 160°С 1 Н-ЯМР (CDCI 3 , 5) 2 32 (с ЗН), 2 69 (м, 4Н), 2 89 (м, 2Н) 3 23 (м, 4Н), 4 52 (шс, 2Н), 6 43 (д, J=8, 1Н), 6 6-6 8 (м ЗН) 7 07 (д, J=8, 1Н), 7 16 (м, 1Н), 7 29 (м, 2Н) 7 48 (т, J=8, 1Н), 7 86 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 21 8, 33 4, 49 2, 53 3, 60 З, 1 0 6 9 , 1 1 0 7 1 1 3 2 , 10 1 1 6 9 , 1 2 0 6 1 2 6 9 , 1 2 8 9 137 7, 138 3 138 8, 140 8 151 4, 156 0, 158 2 МС (%) 377 (продукт + 1, 100) Аналіз розраховано для C24H28N4 • Ш Ь ^ О С 76 46, Н 7 62, N 14 86 Знайдено С 76 45, Н 7 43, N 14 66 Приклад 9 6-{4-[2-(4-(3трифлуорметилфеніл)піперазин-1-іл)-етил]феніл)піридин-2-іламін виготовили способом за прикладом 1 з (3трифлуорметилфеніл)піперазину (вихід 62%), т пл 1 8 9 - 1 9 1 °С 1 Н-ЯМР (CDCI 3 , 5) 2 68 (м 4Н), 2 88 (м, 2Н), 3 26 (м, 4Н) 4 51 (шс, 2Н), 6 43 (д, J=8, 1Н), 7 0-7 4 (м, 7Н) 7 47 (т J=8 1Н), 7 86 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 33 4, 48 7 53 0, 60 2, 1069 1107, 1120, 1 1 2 1 , 1157 1158 1186 122 5 126 2, 126 9, 128 9, 129 5 1 3 1 2 , 1 3 1 6 1 3 7 7 , 1 3 8 3 1407, 151 4 156 0, 1 5 8 2 МС (%) 427 (продукт + 1, 41) Аналіз розраховано для C24H25F3N4 C 67 59 Н 5 91, N 13 14 Знайдено С 67 ЗО 25 Н 5 95 N 13 28 Приклад 10 1-(4-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-піперазин-1-іп)-етанон виготовили способом за прикладом 1 з (Nацетил)піперазину (вихід 47%), т пл 201 - 203°С 1 Н-ЯМР (CDCI 3 , 5) 2 08 (с, ЗН) 2 49 (м 4Н) 2 62 (м, 2Н), 2 82 (м, 2Н) 3 47 (м, 2Н), 3 64 (м, 2Н), 4 47 (шс, 2Н) 6 43 (д J=8, 1H), 7 05 (д, J=8 1H) ' 7 1-72 (м, 2Н), 7 47 (т, J=8, 1Н) 7 84 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 21 3 33 3, 41 4, 46 3, 52 7 53 3, 60 1 106 9 110 7 126 9 128 9, 137 7, 138 3 140 6, 156 0, 158 2, 168 9 МС (%) 325 (продукт + 1, 100) Аналіз розраховано для C19H24N4O С 70 34 Н 49006 36 7 46, N 17 27 Знайдено С 70 21 Н 7 77, N 1 7 1 0 Приклад 11 1-(4-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-піперазин-1-іл)-2-метоксіетанон виготовили способом за прикладом 1 з 4-(2метоксіацетил)піперазину (вихід 53%), т п л 148 150°С 1 Н-ЯМР (CDCI 3 l 5) 2 49 (м 4Н) 2 61 (м, 2Н), 2 83 (м, 2Н) 3 40 (с, ЗН), 3 48 (м, 2Н), 3 65 (м, 2Н), 4 08 (с, 2Н) 4 53 (шс, 2Н) 6 41 (д J=8, 1Н), 7 03 (д, J=7 1Н) 7 24 (м, 2Н), 7 46 (т, J=8, 1Н) 7 83 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 33 2, 41 8, 44 9, 52 8 53 4, 59,0, 60 0, 71,8, 106 9 110 7 126 9 128 9, 137 7, 138 3 140 5, 155 9, 158 3, 167 4 МС (%) 355 (продукт + 1, 100) Аналіз розраховано для C20H26N4O2 - С 67 77 Н 7 39, N 15 81 Знайдено С 67 80 Н 7 66, N 15 79 Приклад 12 1-(4-{2-[4-(6-амшопіридин-2-іл)феніл]-етил} -піперазин-1-іл)-2-феноксіетанон виготовили способом за прикладом 1 з 4-(2феноксіацетил)піперазину (вихід 57,5%), т п л 127 -130°С 1 Н-ЯМР (CDCI 3 , 5) 2 49 (м 4Н) 2 60 (м, 2Н), 2 81 (м, 2Н) 3 59 (м, 2Н), 3 65 (м, 2Н), 4 51 (шс, 2Н) 4 68 (с, 2Н) 6 43 (д J=8, 1H), 6,8-7,0 (м, ЗН) 7 05 (д, J=8 1Н) 7 2-7,4 (м, 4Н), 7 47 (т, J=8, 1H) 7 83 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 33 2, 42 1, 45 4, 52 7 53 З, 60 0, 67,7, 106 9 110 7 114,6, 121,7, 126 9 128 9, 129,6, 137 7, 138 3 140 5, 155 9, 157,8, 158 23, 166 4 МС (%) 417 (продукт + 1, 100) Аналіз розраховано для C25H28N4O2 C 71 32 Н 6 82, N 13 31 Знайдено С 71 55 Н 6 93, N 13 25 Приклад 13 (4-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-піперазин-1-іл)-циклопентилметанон виготовили способом за прикладом 1 з 4(циклопентанкарбоніл)піперазину (вихід 62%), т п л 18-187°С 1 Н-ЯМР (CDCI 3 , 5) 1 55 (м 2Н), 1 74(м, 2Н), 1 79 (м 4Н), 2 48 (м, 4Н), 2 63 (м, 2Н), 2 83 (м, ЗН), 3 53 (м, 2Н), 3 65 (м, 2Н), 4 51 (шс, 2Н), 6 42 (д, J=8 1Н), 7 0 3 ( д , J=7 1Н) 7 25(г А, 2Н), 7 46 (т, J=8, 1Н), 7 8 3 ( м , 2Н) 13 С-ЯМР (CDCI 3 , 5) 26 0, ЗО 1, 33 3 41 0, 41 8, 45,5, 52 9 53 6 60 1, 5 106 9, 110 7, 126 9 128 9 137 7 , 1 3 8 3 140 6 156 0,158 2,174 5 МС (%) 379 (продукт + 1, 41) Аналіз розраховано для C23H30N4O • 3/4НгО С 70 47, Н 8 10 N 14 29 Знайдено С 70 40, Н 7 91, N 14 02 Приклад 14 6-{4-[2-(5-метил-2,5діазабіцикло[2,2,1]гепт-2-ил)-етил]-феніл}-піридин2-іламш виготовили способом за прикладом 1 з 5метил-2,5-діазабіцикло[3,3,1]гептану (вихід 29%), т п л 132°С (розкл ) як пдрохлорид МС (%) 309 (продукт + 1 , 4 ) , 279 (7), 167 (18) 149(100), 113(19) Аналіз розраховано для C19H24N3 • ЗНСІ С 53 34, Н 6 83, N 13 10 Знайдено С 53 61, Н 6 94, N 12,05 Приклад 15 6-{4-[2-(4-(4-фенілтіазол-2-іл) 37 піперазин-1-іл)-етил]-феніл}-піридин-2-іламш виготовили способом за прикладом 1 з N-(4фенілтіазол-2-іл)-піперазину (вихід 30%), т пл 158 -161 °С 1 Н-ЯМР (CDCI 3 l 5) 2 65 (м 4Н), 2 87 (м, 2Н), З 58 (м, 6Н) 4 50 (шс, 2Н) 6 42 (д, J=8, Н) 6 76 (с, 1Н), 7 04 (д, J= 7, 1Н), 7 2-7 4 (м, 5Н), 7 47 (д, J=8 1Н), 7 8 5 ( м , 4Н) 13 С-ЯМР (CDCI 3 l 5) 33 3, 48 4, 52 4 60 2, 101 5, 1 0 7 0 1 1 0 7 , 126 1, 126 9, 127 6 128 5 128 9, 129 3 135 1, 137 6 138 4, 140 6, 151 9, 155 9, 25 158 2, 160 9 171 0 МС (%) 442 (продукт + 1, 100) Аналіз розраховано для C26H27N5S • 1/4НгО С 70 02, Н 6 21 N 15 70 Знайдено С 69 92, Н 6 18 N 15 31 Приклад 16 2-(4-{2-[4-(6-амшрпіридин-2-іл)феніл]-етил}-піперазин- 1-іл)-1-фенілетанон виготовили способом за прикладом 1 з N(бензоілметил)піперазину (вихід 66%), т пл 225°С (розкл) як пдрохлорид 1 Н-ЯМР (CDCIs, 5) 2 8-3 2 (м, 10Н), 3 56 (м, 2Н) 3 88 (с, 2Н) 6 48 (м, 1Н) 6 99 (м, ІН), 7 2-7 6 (м, 6Н), 7 82 (м, 2Н), 7 93 (м, 2Н) 13 С-ЯМР (CDCIs, S) 31 6 42 4, 51 7, 52 6, 54 1, 59 2, 63 6, 107 6 110 6 127 1, 128 0 128 7, 129 0, 129/3, 133 5, 135 7, 137 2, 138 9, 139 1, 154 8 МС (%) 401 (продукт + 1, 100) Аналіз розраховано для C25H28N4O • ЗНСІ • ЗН 2 О С 53 24 Н 6 61 N 9 93 Знайдено С 53 39, Н 6 2 1 , N 10 06 Приклад 17 6-{4-[2-(4-ізобутилпіперазин-1 -іл)етил]-феніл}-піридин-2-іламш виготовили способом за прикладом 1 з N-ізобутилпіперазину (вихід 44,5%), т п л 8 5 - 8 8 ° С 1 Н-ЯМР (CDCI 3 , S) 0 88 (д, J=7, 6Н), 1 77 (м, ІН), 2 11 (д J=7, 2H) 2 5-2 7 (м 10Н), 2 83 (м 2Н) 4 49 (шс, 2Н), 6 40 (д, J=8, ІН), 7 03 (д, J=7 5 ІН), 7 24 (м 2Н), 7 45 (т, J=8, ІН), 7 82 (м 2Н) 13 С-ЯМР (CDCIs, S) 20 9 25 3 33 2, 53 0 53 З, 60 2, 6 6 7 , 1 0 6 9 , 1 1 0 7 , 1 2 6 9 , 1 2 8 9 , 137 65, 1 3 8 4 140 7, 156 0, 158 3 МС (%) 339 (продукт + 1, 42) Аналіз розраховано для C2iH3oN4' 1/2H2O С 72 58, Н 8 99, N 16 12 Знайдено С 72 98, Н 9 1 2 , N 16 44 Приклад 18 6-{4-[2-(1,2,3,4тетрапдронафталін-2-амшо)-етил]-феніл}-піридин2-іламш виготовили способом за прикладом 1 з 2амінотетраліну як пдрохлорид (вихід 18%), т п л 320 - 330°С 1 Н-ЯМР (CD 3 OD, 5) пдрохлорид 1 8 - 2 0 (м, 2Н), 2 4-2 5 (м, 4Н) 2 9-3 0 (м, 2Н), 3 1-32 (м, ЗН), 6 99 (д, J=8 1Н) 7 1-72 (м, 5Н), 7 59 (м, 2Н), 7 83 (м, 2Н), 7 9-8 0 ( м , 1Н) 13 С-ЯМР (CDCI3, 5) 15 5, 27 2, 28 4, 33 2 56 2, 66 9, 112 0, 112 9, 127 5, 127 9 128 8, 129 8, 130 3, 131 2 133 0, 136 0, 141 7, 1 4 5 9 МС (%) 344 (продукт + 1, 100) Аналіз розраховано для C23H25N3 • 2НСІ • 1/2Н2О С 64 94 Н 6 63, N 9 88 Знайдено С 64 07, Н 6 83 N 9 86 Приклад 19 6-(дибензиламшо)-етил]-феніл}піридин-2-іламін 49006 38 виготовили способом за прикладом 1 з дибензиламшу як пдрохлорид (вихід 14%), т п л 206 208°С 1 Н-ЯМР (CD 3 OD, 5) пдрохлорид 2 91 (т J=7, 2Н), 3 80(т, J=7, 2Н), 4,24 (шс, 4Н), 6 97 (д J=8, 1Н) 7 15 (д, J=7 1Н), 7 4-7 5 (м, 12Н), 7 74 (м, 2Н), 7 9 7 ( д д , J=7 8, 1H) 13 С-ЯМР (CDCIs, 5) 39 9 52 1, 63 6, 1 1 1 8 , 112 5, 128 2, 130 3, 130 7, 130 9 131 1, 131 З, 132 4, 144 8, 145 9, 148 5 156 7 МС (%) 309 (4), 215 (25), 198 (100), 155 (22) 135(13), 119(47) 103(21) Аналіз розраховано для C27H27N3 • ЗНСІ С 64 48, Н 6 0 1 , N 8 36 Знайдено С 64 84, Н 6 3 1 , N9 07 Приклад 20 6-{4-[2-(8-азаспіро[4,5]дец-8-ил)етил]~феніл}-піридин-2-іламш виготовили способом за прикладом 1 з 8-азаспіро[4,5]декану (вихід 63%), т п л 1 3 0 - 1 3 2 ° С { Н-ЯМР (CDCIs, S) 1 3-1 7 (м, 12Н), 2 47 (шс, 4Н), 2 59 (м, 2Н), 2 86 (м, 2Н), 4 49 (шс, 2Н) 6 42 (д J=8 1Н), 7 0 4 ( д J=7 5 1Н), 7 2-7 3 (м 2Н), 7 46 (т, J=8, 1Н), 7 8 3 ( м , 2Н) 13С-ЯМР (CDCIs, S) 24 3, 33 5 37 5, 38 0, 40 7, 51 5, 60 8, 106 8 110 7, 126 8, 128 9, 137 6 138 3, 141 1, 1 5 6 1 , 1 5 8 2 МС (%) 336 (продукт + 1, 79) Аналіз розраховано для C22H29N4 • 1/4НгО С 77 72, Н 8 75, N 12 36 Знайдено С 77 74, Н 8 74, N 12 41 Приклад 21 6-{4-[2-(4-диметиламшопіперидин1-іл)-етил]-феніл}-піридин-2-іламш виготовили способом за прикладом 1 з 4-(N,Nдиметиламшо)піперидину (вихід 60%), т п л 174 176°С 1 Н-ЯМР (CDCIs, S) 1 5-1 6 (м, 2Н) 1 8 (м 2Н), 2 0 (м, 2Н), 2 29 (с, 6Н) 2 60 (м 2Н), 2 80 (м, 2Н) 3 15 (м, 2Н), 3 4-3 5 (м, 1Н), 4 51 (шс, 2Н NH), 6 41 (д J=8, 1Н) 7 04 (д J=7 1Н), 7 24 (м, 2Н), 7 46 (т, J=8, 1Н) 7 8 2 ( м , 2Н) 13 С-ЯМР (CDCIs, S) 28 1, 33 6, 41 5, 53 1, 60 4, 62 3 106 9, 110 7, 126 8, 128 9, 137 6 138 3, 141 0, 1561, 1582 МС (%) 325 (продукт + 1, 100) 280 (45) 197 (65) Аналіз розраховано для C23H25N3 • 1/2НгО С 72 03, Н 8 77, N 16 80, Знайдено С 72 09, Н 8 57, N 16 86 Приклад 22 6-{4-[2-(1,3-дипдроізошдол-2-іл)етил]-феніл}-піридин-2-іламш виготовили способом за прикладом 1 з дипдроїзоіндолу (вихід 19%), т пл 140 - 143°С 1 Н-ЯМР (CDCIs, S) 2 97 (м 4Н) 4 00 (шс, 4Н), 4 51 (шс 2Н), NH) 6 42 (д, J=8, 1Н), 7 06 (д, J=8, 1Н), 7 20 (м, 4Н), 7 32 (м, 2Н), 7 47 (т J=B, 1H), 7 8 6 ( м 2Н) 13 С-ЯМР (CDCIs, S) 35 5, 57 8, 59 2, 106 9, 110 8, 122 3, 126 7 126 9, 128 9, 137 7 138 3, 1399 1408 1561, 1582 МС (%) 325 (продукт + 1, 92), 197 (43), 132 (100) Аналіз розраховано для C21H21N3 • 1/2НгО С 77 75, Н 6 84, N 12,95 Знайдено С 78 03, Н 6 78, N 12 58 Приклад 23 2-(4-{2-[4-(6-амшопіридин-2-іл) 39 феніл]-етил}-піперазин-1-іл)-^ізопропілацетамід виготовили способом за прикладом 1 з 4-(Nізопропілацетамідо)піперазину (вихід 78%), т пл 163-165°С 1 Н-ЯМР (CDCIs, S) 1 14 (д,и=6, 6Н) 2 55 (м 8Н) 2 6 (м, 2Н), 2 75 (м, 2Н) 2,96 (с, 2Н), 4 07 (hp,J=6, 1Н), 4 52 (шс 2Н NH), 6 42 (д, J=8, 1H), 6 92 (м 1Н), 7 03 (д, J=7, 1Н) 7 24 (м, 2Н), 7 46 (т J=8 1Н) 7 8 2 ( м , 2Н) 13 С-ЯМР (CDCIs, S) 22 8, 33 4, 40 7, 53 2 53 4, 60 2, 61 6, 106 9, 110 7, 126 9, 128 9, 137 7, 138 3 1 4 0 7 , 1 5 6 0 158 2, 1 6 9 1 МС (%) 401 (продукт + 1, 100) 198 (75) Аналіз розраховано для C22H32N5O С 69 26 Н 8 19, N 18 36 Знайдено С 68 97, 25 Н 8 36, N 18 58 Приклад 24 Етиловий естер 4-{2-[4-(6амшопіридин-2-іл)-феніл]-етил}-піперазин-1-іл)оцтової кислоти виготовили способом за прикладом 1 з 4-(Nкарбоетоксиметил)піперазину (вихід 16%), легкоплавкий 1 Н-ЯМР (CDCI 3 , 5) 1 26 (т, J= 7, ЗН), 2 5-2 7 (м 10Н) 2 83 (м, 2Н), 3 20 (с, 2Н), 4 1 7 (к, J=7 2H), 4 49 (шс, 2Н) 6 41 (д, J=8, 1H), 7 04 (д, J=7 1H) 7 25 (м, 2Н), 7 46 (т J=7, 1Н) 7 82 (м, 2Н) 13С-ЯМР (CDCIs, S) 14 25, 33 3 52 9, 53 0, 59 6, 60 2, 60 6, 106,9, 110 7 126 8, 128 9 137 6 1 3 8 3 1 4 0 8 1 5 6 0 158 2, 1 7 0 3 ІК(см 1 ,КВг) 1740(С=0) МС (%) 369 (продукт + 1, 100), 197 (35) 185 (70), 119(38) МСВР(%) 369 23070(продукт + 1 100, розраховано 369 22905) Приклад 25 4-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-піперазин- 1-іл)-фенілметанон виготовили способом за прикладом 1 з N(бензоіл)піперазину (вихід 43%), т пл 125 - 127°С 1 Н-ЯМР (CDCIs, S) 2 4 (м, 2Н), 2 5-2 7 (м, 4Н), 2 85 (м, 2Н), 3 5 (м, 2Н) 3,8 (м, 2Н), 4 53 (шс, 2Н), NH), 6 41 (д, J-8, 1Н), 7 03 (д, J-7 1Н), 7 24 (м 2Н), 7 38 (м, 5Н) 7 45 (т J-8, 1Н) 7 83 (м 2Н) 13 С-ЯМР (CDCIs, S) 33 2,60 1, 106 9, 110 7, 126 9 127 1,128 5 128 9 129 7, 135 8, 1С(%) 387 (продукт + 1, 92), 203 (35), 105 (100) Аналіз розраховано для C24H26N4O • 1/4НгО С 73 72, Н 6 83, N 14 33 Знайдено С 73 96, Н 6 88 N 14 39 Приклад 26 6-{4-[2-(3-фенілпіролідин-1-іл)етил]-феніл}-піридин-2-іламш виготовили способом за прикладом 1 з 3фенілпіролідину як пдрохлорид (вихід 54%), т пл 100°С (розкл) 1 Н-ЯМР (MeOD, 5) пдрохлорид 2 2-2 6 (м, 2Н), 3 2-3 4 (м, 5Н) 3 5-3 7 (м 2Н), 3 7-4,0 (м, 2Н) 6 99 (д, J=8, 1Н), 7 17 (д, J=7 1Н), 7 3-7 5 (м, 5Н), 7 59 (м, 2Н) 7 83 ґм, 2Н), 7 97(т, J=8, 1H) ІЗ С-ЯМР (CDCIs, S) 31 9, 32 7, 32 8, 34 2 55 0 56 5 , 5 6 9,57 5,60 6,60 9 , 1 1 1 9 1 1 2 9 , 1 2 8 4 1 2 8 6 , 128 7 128 9, 130 0, 1 3 1 2 1 3 1 9 , 139 8 140 8 141 6, 1 4 5 9 , 1 4 7 8 1 5 6 8 МС (%) 344 (продукт + 1, 100) 197 (26), 160 (40) Аналіз розраховано для C23H25N3 • 2НСІ • 49006 40 5/4Н2О С 62 94 Н 6 77, N 9 57 Знайдено С 62 90, Н 6 93 N 9 46 Приклад 27 6-{4-[2-(4-(1-феніл-1Н-тетразол-5іл)піперазин-1-іл)-етил]-феніл}-піридин-2-іламш виготовили способом за прикладом 1 з 4-(Nфенілтетразол-5-іл)піперазину (вихід 50%), т пл 212-214°С 1 Н-ЯМР (CDCIs, 5) 2 55 (м 4Н) 2 64 (м, 2Н), 2 80 (м, 2Н), 3 28 (і я, 4Н), 4 52 (шс, 2Н, NH), 6 42 (fl,J=6, 1Н) 7 04 (д J=7, 1Н), 7 23 (м, 2Н), 7 4-7 6 (м 6Н) 7 81 (м, 2Н) 13 С-ЯМР (CDCIs, 5) 33 2, 48 7 52 1 60 0, 1 0 7 0 , 1 1 0 7 1 2 3 7 123 8 126 9 128 9, 129 7, 129 9 130 1 135 0, 137 7 138 4 140 5, 155 9 157 5, 10 158 2, 160 8 МС(%) 427 (продукт + 1, 100) 197(85) Аналіз розраховано для C24H26N8 • І/2Н2О C 66 19, Н 6 25 N 25 73 Знайдено С 66 03, Н 6 24 N 2 5 88 Приклад 28 2-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-1,2,3,4-тетрапдроізохінолш-3карбонова кислота виготовили способом за прикладом 1 з 3карбокси-(1,2,3,4-тетрапдроізохінолшу) як пдрохлорид (вихід 17%), т пл 110°С (розкл ) 1 Н-ЯМР (CDCIs, S) 2 9-3 1 (м, 6Н) 3 7 (і^ 1Н), 4 4 (м 2Н), 4 54 (шс, 2Н NH), 6 43 (д, J=8, 1Н) 7 07 2 (м, 4Н), 7 05 (д J=7, 1Н), 7 28 (м, 2Н), 7 47 (t,J=8,1H), 7 8 6 ( M 2 H ) 13 С-ЯМР (CDCIs, S) 33 2, 60 1, 106 9 1 1 0 7 , 126 9 127 1, 128 5 128 9 129 7, 135 8, 137 7 138 3 140 5, 155 9 158 3, 170 3 МС(%) 387 (продукт+ 1, 81), 197 (100) Аналіз розраховано для C23H23N3O2 , 5 03 (м, з частковим С 78 25 Н 8 27 N 12 59 Знайдено С 77 98, Н обміном для NH2), 6 41 (д J=8, 1Н), 6 99 (д, J=7, 8 25, N 12 60 1Н), 7 1-73 (м, 7Н), 745 (т, J=8, 151H), 776 (м, Приклад 51 Пдрохлорид 3-{2-[4-(62Н) амшопіридин-2-іл)-феніл]-етил}-313 С-ЯМР (CDCI3, 5) 33 1 43 6 44 8 52 8,60 1, азабіцикло[3,1,0]гекс-6-ил-(3-фенілпропіл )амшу 107,1, 110 8, 126 9, 127,3, 127 7 128 6 128 9, виготовили з кінцевого продукту з прикладу 2 137 7, 138 5, 139 3, 140 5, 155, 9, 157 7, 158 3 реакцією з 3-фенілпропіональдепдом відновним МС(%) 416 (продукт + 1, 60), 283 (100), 232 амінуванням ціанборопдридом натрію у метанолі, (56), 197(80), 99(70) а як пдрохлорид - з 1,2-дихлоретану (вихід 27%), Аналіз розраховано для C25H29N5O- I/4H2O C т п л 160-163°С 1 71 49, Н 7 28, N 16 67 Знайдено С 71 45, Н 7 06, Н-ЯМР (CDCI3, 5) 1 44 (м 2Н), 1 83 (qn, 2H), N 16 67 2 43 (м ЗН), 2 6-2 8 (м, 8Н), 3 09 (м, 2Н), 4 54 (шс Приклад 48 6-{4-[2-(4-(1 -(4-флуорфеніл)-1 Н2Н, NH), 6 43 (д J=8, 1Н), 7 07 (д J=7, 1Н), 7 1 -7 З тетразол-5-іл)піперазин-1-іл)-етил]-феніл) (м, 7Н) 7,48 (т, J=8, 1Н), 7 85 (м, 2Н) 13 піридин-2-іламін С-ЯМР (CDCI3, 5) 24 4, 31 5 33 6, 35 2, 39 0 виготовили способом за прикладом 1 з [(4,49 1, 55 0, 57 3, 106 8, 110 7, 125 8, 126 7, 128 3, флуорфеніл)-1-Н-тетразол-5-іл]піперазину (вихід 128 4, 128 9, 137 5, 138 3, 141 0, 142 1, 156 1, 158 2 20%),тпл 185-187°С Аналіз розраховано для C27H32N4 • 2НСІ • { Н-ЯМР (CDCI3, 5) 2 58 (м 4Н) 2 67 (м, 2Н), 2Н20 • 1/2С2Н4СІ2 С 58,90, Н 7 06, N 9 81 Знай2 81 (м, 2Н), 3 28 (м 4Н), 4 51 (шс 2Н NH) 6 45 48 47 49006 дено С 59 19, Н7 18 N9 46 МС (%) 413 (продукт + 1, ЗО) 229 (65), 197 Приклад 52 2-(3-{2-[4-(6-амшопіридин-2-іл)(ЗО), 131 (100) феніл]-етил}-3-азабіцикло[3,1,0]гекс-6-иламш)Аналіз розраховано для C27H32N4 • ЗНСІ С ацетамід 62 13, Н 6 76, N 10 73 Знайдено С 62 44, Н 7 1 1 , виготовили з кінцевого продукту з прикладу 2 з N 10 49 юдацетамідом (вихід 39,5%), т пл 140°С (розкл ) Приклад 56 І\І-(1-{2-[4-(6-амінопіридин-2-іл)1 Н-ЯМР (CDCI3l 5) 1 51 (м, 2Н), 2 41 (м 1 Н), феніл]-етил}-піролідин-3-іл)-2-(4-флуорфеніл)2 50 (м 2Н), 2 65 (м, 2Н), 2 75 (м, 2Н), 3 05 (м 2Н) ацетамід 3 25 (с, 2Н), 6 49 (д, J=8, 1Н), 6 96 (д, J=7, 1Н) 7 24 виготовили способом за прикладом 1 з (1-{2(м, 2Н), 7 48 (дд, J=7,8, 1Н) 7 74 (м, 2Н) [4-(6-амшопіридин-2-іл)-феніл]-етил}-піролідин-313 С-ЯМР (CDCI3, 5) 25 3 35 7 40 6, 56 1 58 6, іл)-2-амшу та 4-флуорфенілоцтовоі кислоти за 60 1, 108 5, 111 1, 128 0, 129 8, 139 2 139 7, 141 9 допомогою г\І-етил-І\І-(3157,1, 161 0, 1770 диметиламшопропіл)карбодмміду (вихід 55%), МСВР (%) 352 (продукт + 1 43), 155 (47), 119 т пл 90°С (розкл ) 1 (100) 103(54) Н-ЯМР (CDCI3, 5) 1 54 (м, 2Н), 2 24 (м, ЗН), Приклад 53 6-{4-[2-(4-(2-(4-флуорфеніл)2 53 (м), 1Н), 2 72 (м, 2Н), 2 79 (м, 2Н), 2 98 (м 1Н), етил)піперазин-1-іл)-етил]-феніл}-піридин-2-іламш 4 5 (м, 2Н), 6 19 (м, 1Н), 6 40 (д, J=8, 1Н), 7 02 (м, виготовили способом за прикладом 1 з (4ЗН), 7 20 (м, 4Н), 7 46 (т J=8, 1Н), 7 82 (м, 2Н) 13 флуор)фенетил)-піперазину (вихід 35%), т пл 165 С-ЯМР (CDCI3, 5) 32 1,34 6 42 7,48 6, 52 8 -167°С 57 2, 60 6, 107 0, 110 7, 5 115 5, 115 7, 126 9, 1 Н-ЯМР (CDCI3l 5) 2 5-2 7 (м, 12Н), 2 7-2 9 (м, 128 8, 130 8, 130 9, 137 8, 138 4, 140 2, 155 8, 4Н), 4 51 (шс, 2Н, NH), 6 42 (д, J=8, 1Н), 6 95 (м, 158 3, 160 8, 163 2, 170 2 МС (%) 419 (продукт + 1, 43), 391 (38) 1672Н), 7 05 (д, J=8 1Н), 7 14 (м, 2Н), 7 25 (м, 2Н), (40) 149(100), 119(46), 113(73) 7 47(т, J=8, 1H), 7 8 3 ^ 2Н) МСВР розраховано для C25H28N4OF 419,2247 "С-ЯМР (CDCI3, 5) 32 8 33 3, 53 1, 60 3, 60 5, Знайдено 419,2266 106,9, 1107, 1150, 1153, 126 8, 128 9, 130 0, Приклад 57 8-{2-[4-(6-амшопіридин-2-іл)130 1, 135 9, 136 0, 137 6, 138 3 140 9, 156 1, феніл]-етил}-3-фенетил-1,3,8158,2, 159 8, 163 0 тріазаспіро[4,5]декан-2,4-дюн МС (%) 405 (продукт + 1, 92), 221 (100) 197 виготовили способом за прикладом 1 з 3(53), 123(75) фенетил-1,3,8-тріазаспіро[4,5]декан-2,4-дюну як Аналіз розраховано для C24H25N8F С 72 61 Н пдрохлорид (вихід 45%), т пл 176 - 180°С 7 31, N 13 55 Знайдено С72 74.Н7 05, N 13 22 1 Н-ЯМР (CDCI3, 5) 1 51 (м 2Н) 2 02 (м, 2Н), Приклад 54 6-{4-[2-(4-(1-метил-22 23 (м 2Н), 2 63 (м, 2Н), 2 82 (м, 2Н), 2 92 (м, 4Н), фенілетил)піперазин-1-іл)-етил]-феніл}-піридин-23 73 (т J=7, 2Н), 4 54 (шс, 2Н, NH), 6 42 (д, J=8, їламін 1Н), 7 05 (м, 2Н), 7 2-7 3 (м, 5Н), 7 47 (т, J=8, 1Н), виготовили способом за прикладом 1 з (17 83(м 2Н) метил-2-фенілетил)-піперазину як пдрохлорид 13 С-ЯМР (СОСІз, 5) 33 2, 33 3, 33 8, 39 5, 49 0, (вихід 30%), т пл 252 - 256°С 1 59 7, 60 1, 106 9, 110 7 126 6 126 9, 128 5, 128 9, Н-ЯМР (CDCI3, 5) 0 95 (д, J=6, ЗН), 2 41 (м, 129 0, 137 7, 138 4, 140 7, 156 0, 156 8, 158 3, 1Н), 2,5-2 7 (м, ЮН), 2 83 (м, ЗН), 3 04 (м, 1Н), 4 54 176 1 (шс 2Н, NH), 6 41 (д, J=8, 1Н), 7 04 (д, J=7 1Н), МС (%) 470 (продукт + 1, 70), 360 (67), 340 7 1-7 3{м, 7Н) 7 46(т J=8, 1Н), 7 84 (м, 2Н) 13 (100), 338(75), 332(55) С-ЯМР (CDCI3, 5) 14 4, 33 4 39 3 48 3, 53 6, Аналіз розраховано для С28Н31М5О2 • 1/2Н20 60 4, 61 3 106 9, 110 7, 125 8 126 9, 127 0, 128 2, С 70 27, Н 6 74, N 14 63 Знайдено С 70 16, Н 128 9, 129 3, 137 6, 138 3, 140,6 140 9, 156 1 6 65, N 14 85 158 3 Приклад 58 8-{2-[4-(6-амшопіридин-2-іл)МС (%) 401 (продукт + 1, 64), 309 (35) 217 феніл]-етил}-8-азабіцикло[3,2,1]окт-3-иламш (40) 197(34), 91 (100) виготовили способом за прикладом 1 з тАналіз розраховано для C26H32N4 • ЗНСІ • бутилкарбамату 8-азабіцикло[3,2,1]окт-3-иламшу з Н2О С 59 15, Н 7 06, N 10 61 Знайдено С 59,07, Н наступним видаленням т-бутилкарбаматної групи 7 22, N 10 46 за допомогою трифлуороцтової кислоти, як пдроПриклад 55 6-{4-[2-(4-(1,2,3,4хлорид (вихід 67%), т пл > 300°С (розкл ) тетрапдронафталін-2-іл)піперазин-1-іл)-етил]1 Н-ЯМР (CDCI3 5) 1 45 (м 4Н), 1 54 (м, 2Н), феніл}-піридин-2-іламш 1 68 (м, 2Н), 1 91 (м 2Н), 2 63 (м 2Н), 2 78 (м, 2Н), виготовили способом за прикладом 1 з 2 93 (м, 1Н), 3 29 (м 2Н), 4 50 (шс 2Н, NH) 6 39 (1,2,3,4-тетрапдронафталін-2-іл)-піперазину як (д, J=8, 1Н) 7 03 (д, J=7, 1Н) 7 24 (м, 2Н), 7 45 (т пдрохлорид (вихід 30%), т пл > 220°С (розкл ) 1 J=8, 1Н) 7 81 (м 2Н) Н-ЯМР (CDCI3, 5) 1 65 (м 1Н), 2 15 (м,1Н) 13 С-ЯМР (СвСІз, 5) 26 9, 35 6 41 2 43 0, 53 З, 2 6-3 0 (м, 17Н)4 52 (шс, 2Н, NH), 6 41 (д, J=8, 1H), 58,8 106 8, 110 7, 126, 128 9, 137 5, 138 3, 141 1, 7 09 (м, 5Н), 7 26 (м 2Н), 7 46 (т J=8, 1Н), 7 84 (м, 156 0, 158 2 2Н) 13 МС(%) 323 (продукт + 1, 23), 197 (25) 149 С-ЯМР (CDCI3, 5) 26 1,29 4 32 0, 33 3, 49 1 (36), 109(57), 95(100) 53 5, 60 3, 60 4, 106 9, 110 7, 125 7, 125 8, 126 9, Аналіз розраховано для C20H26N4 • НСІ • 128 5, 128 9, 129 5, 135 9, 136 4, 137 6, 138 3, 3/2Н2О • СН 2 СІ 2 С 53 57, Н 6 85, N 11 90 Знайде1409, 1561, 1582 49 но С 53 90, Н 7 09, N 12 14 Знайдено С 53 35, Н 7 07, N 1 79 Приклад 59 Бензиламід 4-амшо-1-{2-[4-(6амшопіридин-2-іл)-феніл]-етил}-піперидин-1-іл)карбонової кислоти виготовили способом за прикладом 1 з бензиламіду 4-амшо-піперидин-карбоновоі кислоти, як пдрохлорид (вихід 67%), т пл > 240°С (розкл ) 1 Н-ЯМР (СвСІз, 5) 1 47 (м, 2Н), 2 36 (м, 4Н), 2 64 (м, 2Н), 2 87 (м, 2Н), 2 92 (м 2Н), 4 42 (д J=6, 2Н), 4 47 (с, 2Н), 6 42 (д, J=8, 1Н), 7 05 (д, J=7,1H), 7 2-7 4 (м, 7Н) 7 47 (т J=8 1Н), 7 83 (м 2Н), 8 02 (шс, 1Н, NH) 13 С-ЯМР (СОСІз, 5) 33 1, 34 8, 43 2, 48 9, 55 1, 60 3 107 1, 110 9, 126 9, 127 3, 127 6, 128 6, 128 9, 137 7, 138 5, 140 5, 156 0, 158 3, 177 0 МС(%) 430 (продукт + 1, 100), 197 (47), 133 962) Аналіз розраховано для C26H31N5O • НСІ • 5/4Н 2 О-СН 2 СІ 2 С 56 55 Н 6 42, N 12 21 15 Знайдено С 56 88, Н 6 84, N 12 09 Приклад 60 6-{4-[2-(4-(2-амшоетил)-піперазин1-іл)-етил]-феніл}-піридин-2-іламш виготовили способом за прикладом 1 з тбутилкарбамату (2-амшоетил)-піперазину з наступним видаленням т-бутилкарбаматної групи за допомогою трифлуороцтової кислоти у метиленхлориді, як гігроскопічний трифлуорацетат (вихід 90%) { Н-ЯМР (CDCI 3 , 5) 1 93 (м, 2Н) 2 3-2 5 (м, 14Н) 2 81 (м 2Н), 4 50 (шс, 2Н, NH), 6 40 (д, J=8 1Н) 7 03 (д J=7, 1Н), 7 23 (м 2Н) 7 45 (т, J=8, 1Н), 7 81 (м, 2Н) 13 С-ЯМР (СвСІз, 5) 33 3, 53 2, 60 4, 106 9, 110 7, 126 8, 128 9, 137 6, 138 3, 140 9, 156 0, 158 2 МС (%) 326 (продукт-М, 8), 167 (25) 149 (100), 133(45), 119(28), 113(25) МСВР розраховано для C19H27N5 326 2345 Знайдено 326 2340 Приклад 61 2-амшо-1-(4-і 2-[4-(6амшопіридин-2-іл)-феніл]-етил} -піперазин-1-іл)-3фенілпропан-1-он виготовили з продукту з прикладу 36 та т-БОКфенілаланшу за допомогою г\І-етил-І\І-(3диметиламшопропіл)карбодмміду (вихід 68%) з наступним депротектуванням за допомогою трифлуороцтової кислоти у метиленхлориді, (вихід 78%), та з діетилового етеру як пдрохлорид, т пл 230°С (розкл ) 1 Н-ЯМР (CDCI 3 , 5) 1 89 (м, 1Н) 2 31 (м, 2Н) 2 50 (м ЗН), 2 74 (гп, ЗН), 2 90 (м, 1Н) 3 10 (м, 1Н), 3 31 (м, 1Н), 3 5-3 7 (м, 2Н), 3 94 (м, 1Н), 4 59 (шс, 2Н NH), 6 39 (д, J=8 1H) 7 02 (д, J=7, 1H) 7 1-73 (м, 7Н), 7 44 (т, J=8, 1Н), 7 82 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 33 1, 41 9, 45 2, 52 5, 52 8, 59 9, 107 0, 110 6, 126 9, 128 6, 128,8 129 4, 137 6, 137 7, 138 3, 140 5, 155 8, 158 3, 173 0 МС (%) 430 (продукт + 1, 23), 167 (26), 149 (100) 133(72) 113(25) МСВР розраховано для С 2 бН 3 іІМ 5 О • ЗНСІ5/4Н 2 О С 56 19, Н 6 99, N 11 70 Знайдено С 56 55, Н 6 73 N 11 32 Приклад 62 {2-[4-(6-амшопіридин-2-іл)-феніл]етил}-(8-бензил-8-азабіцикло[3,2,1 ]окт-3-ил)-амш виготовили способом за прикладом 1 з (8 49006 50 бензил-8-азабіцикло[3,2,1]окт-3-ил)-амшу (вихід 78%), як пдрохлорид, т пл 260°С (розкл ) 'Н-ЯМР (CDCI 3 l 5) 1 45 (м, ЗН), 1 53 (м, 2Н), 1 72 (м, 2Н), 1 97 (м, 2Н) 2 7-2 9 (м, 4Н), 3 18 (м, 2Н), 3 54 (с 2Н) 4 49 (шс 2Н, NH), 6 41 (д, J=8, 1Н) 7 04 (д, J-7, 1Н) 7 2-7 4 (м, 7Н), 7 46 (т, J=8, 1Н), 7 8 3 ( м 2Н) 13 С-ЯМР (CDCI 3 , 5) 27 0 36 5 38 3 48 1,48 9 55 5, 58 5, 106 9 110 8, 126 6, 126 9 128 1, 128 5, 128 9 137 7 , 1 3 8 3 , 1 4 0 3 140 7 156 0,158 2 МС (%) 413 (продукт + 1, 6), 200 (40), 133 (28), 91 (100) Аналіз розраховано для C27H32N4 • ЗНСІ • Н 2 О С 60 06, Н 6 9 1 , N 10 38 Знайдено С 60 33, Н 6 82, N 10 39 Приклад 63 1-(1-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-піперидин-4-іл)-3-фенілсечовина виготовили способом за прикладом 1 з (4фенілуреідо)-піперидину як пдрохлорид, т пл 280°С (розкл ) 1 Н-ЯМР (CDCI 3 , 5) 1 41 (м, 2Н) 1 93 (м 2Н), 2 17 (м, 2Н), 2 585 (м, ЗО 2Н), 2 79 (м 2Н), 2 92 (м, 2Н) 3 60 (м, 1Н), 6 39 (д, J=8 1Н), 6 92 (м, 2Н), 7 27 4 (м, 7Н), 7 42 (т, J=8, 1Н), 7 69 (м, 2Н) 13 С-ЯМР (MeOD, 6) 31 9, 32 8, 46 2, 52 4 60 1, 107 3, 110 9, 119 0, 122 4, 127 0, 128 8, 137,8, 138 6 139 3 , 1 4 0 0 , 1 5 5 6,155 9 , 1 5 8 5 МС (%) 416 (продукт + 1, 78), 323(52), 232 (50), 197 (100), 133 (82) 1 19 (79), 103 (69) Аналіз розраховано для C25H29N5O • 2НСІ • 1/2Н 2 О-3/4СН 2 СІ 2 С 55 1 1 , Н 6 02, N 12 48 Знайдено С 55 34, Н 6 05, N 12 14 Приклад 64 1-(1-{2-[4-(6-амшопіридин-2-іл)феніл]-етил} -піперидин-4-іл)-3-бензилсечовина виготовили способом за прикладом 1 з (4бензилуреідо)-піперидину (вихід 24%), як пдрохлорид, т пл 120°С (розкл ) 1 Н-ЯМР (CDCI 3 , 1 42 (м, 2Н), 1 93 (м 2Н), 2 16 (м, 2Н), 2 58 (м, 2Н), 2 7-2 9 (м, 4Н), 3 60 (м, 1Н), 4 32 (д J=5, 2Н), 4 48 (шс 2Н NH) 4 90 (м 1Н), 6 41 (д, J=8 1Н), 7 03 (д J=7, 1Н), 7 1 -7 3 (м 7Н), 7 4 6 ( т , J=8, 1Н), 7 81 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 32 7, 33 4, 44 5, 47 1, 52 З, 60 2 106 9 , 1 1 0 8,126 9 127 3 , 1 2 7 5 , 1 2 8 6 128 9, 137 7, 138 6, 139 2, 140 6, 156 0, 157 5, 15 158 2 МС (%) 430 (продукт + 1, 10), 155 (50), 135 (28) 1 19(100), 103(55) Аналіз розраховано для C26H31N5O-2HCI-H2O С 60 00, Н 6 78 N 13 45 Знайдено С 60 23, Н 6 57, N 13 29 Приклад 65 І\І-(1-{2-[4-(6-амінопіридин-2-іл)феніл]-етил}-піперидин-4-іл)-2-(4-флуорфеніл)ацетамід виготовили способом за прикладом 1 з 4-((4флуорфеніл)-ацетамідо)-піперидину (вихід 35%), як пдрохлорид, т пл 170°С (розкл) 1 Н-ЯМР (CDCI 3 , 5) 1 37 (м, 2Н), 1 88 (м, 2Н) 2 14 (м, 2Н), 2 59 (и 2Н), 2 77 (м 2Н) 2 83 (м 2Н), 3 50 (с, 2Н) 3 79 (м, 1Н) 4 46 (шс 2Н, NH), 5 23 (д, 25 J=7 1Н), 6 42 (д, J=8, 1Н) 7 02 (м ЗН), 7 2-7 З (м, 5Н), 7 46(дц,и=7,8 1Н), 7 81 (м 2Н) 13 С-ЯМР (CDCI 3 , 5) 32 0, 33 5, 43 0, 46 5, 52 2, 60 2, 106 9, 110 7, 115 7, 115 95, 126 8, 128 9, 130 8, 130 9 137 6, 138 3, 140 7, 156 0, 158 2, 170 0 51 49006 MC (%) 433 (продукт + 1, 70), 155 (48), 119 (100) 103(61) Аналіз розраховано для C25H28N4OF • 2НСІ • 3/4Н 2 О С 60 17 Н 6 3 1 , N 10 80 Знайдено С 60 56, Н 6 24 N 10 75 Приклад 66 {2-[4-(6-амшопіридин-2-іл)-феніл]етил}-(8-азабіцикло[3,2,1]окт-3-ил)-амш виготовили способом за прикладом 1 з Nбензил-(8-азабіцикло[3,2,1]окт-3-ил)-амшу з наступним дебензилуванням форміатом амонію та 10% паладієм на активованому вугіллі (вихід 71%), як пдрохлорид, т пл 170°С (розкл) 1 Н-ЯМР (CDCI 3 l 5) 1 24 (м 2Н), 1 58 (м, 2Н), 1 7-1 9 (м, 4Н), 2 7-2 9 (м, 4Н) 3 54 (м, 2Н) 4 10 (м, 1Н) 4 49 (шс, 2Н, NH) 6 41 (д J-8, 1Н), 7 04 (д J=7, 1Н), 7 2-7 3 (м, 2Н), 7 46 (м 1Н), 7 82 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 29 1, 36 4, 40 7 47 9, 19 0, 54 2 106 9, 110 8, 126 9, 128 9 137 7, 138 4, 140 5, 156 0, 158 2 МС (%) 323 (продукт + 1, 66), 199 (55), 133(81), 110(100) Аналіз розраховано для С20Н26 • 2НСІ • 2Н2О • СН 2 СІ 2 С 53 7 і , Н 7 24, N 12 38 Знайдено С 53 48 Н 7 23, N 1 2 04 Приклад 67 6-{4-[2-(4-амшопіперидин-1-іл)етил]-феніл}-піридин-2-іламш виготовили способом за прикладом 1 з 4-(т-бутоксикарбоніламшо)піперидину з наступним деблокуванням за допомогою трифлуороцтової кислоти у метиленхлориді, при кімнатній температурі як трифлуорацетат (вихід 100%), т п л 1 9 0 - 1 9 5 ° С 1 Н-ЯМР (CDCI 3 , 5) 1 99 (м, 2Н), 2 28 (м 2Н/ 3 17 (м, 4Н) 3 41 (м 2Н) 3 50 (tv 1Н) , 3 78 (м 2Н), 6 96 (д, J=8, 1Н), 7 14 (д, J=7, 1Н), 7 52 (м, 2Н), 7 78 (м, 2Н), 7 95 (flA,J=7,8f 1Н) 13 С-ЯМР (CDCI 3 , 5) 28 5, 31 1, 46 7, 46 8, 51 9, 1120, 1129, 1289 1 3 1 1 , 1323, 1413, 1458, 1481, 1568 МС (%) 297 (продукт + 1, 100), 197 (50), 133 (52) Аналіз розраховано для C18H24N4 • 3C2HF3O2 • Н 2 О С 43 9 1 , Н 4 45, N 8 53 Знайдено С 43 82, Н 4 11, N 8 48 Приклад 68 Морфолінамід 4-амшо-1-{2-[4-(6амшопіридин-2-іл)-феніл]-етил}-піперидин-4карбонової кислоти виготовили способом за прикладом 1 з морфолінаміду 4-амінопіперидин-4-карбоновоі кислоти з наступним депротектуванням за допомогою трифлуороцтової кислоти у метиленхлориді, (вихід 13%), як пдрохлорид, т пл > 280°С (розкл ) { Н-ЯМР (CDCI 3 , 5) 2 2-2 4 (м 4Н), 2 57 (м, 2Н), 2 79 (м, 2Н), 2 8-2 9 (м, 4Н), 3 5- 37 (м, 8Н) 4 48 (шс, 2Н), 6 41 (д, J=8 1Н), 7 04 (д J-7, 1Н), 7 24 (м, 2Н) 7 46 (т, J=8, 1Н) 7 81 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 33 4, 34 0, 37 0, 56 4, 49 9, 60 3, 61 3, 67 1, 106 9, 110 7, 126 8, 128 9, 137 0, 138 3, 156 0, 158 2 (карбонільний карбон при скануванні не виявлено) М С ( % ) 410 (продукт + 1, 12) 242(100) Аналіз розраховано для C25H29N5O • 2НСІ • 1/2Н 2 О-3/4СН 2 СІ 2 С 55 1 1 , Н 6 02 N 12 48 Знайдено С 55 34, Н 6 05 N 12 14 Приклад 69 Пірол ід инамід4-амшо-1-{2-[4-(6амшопіридин-2-іл)-феніл]-етил}-піперидин-4 52 карбонової кислоти виготовили способом за прикладом 1 з піролідинаміду 4-амшопіперидин-4-карбоновоі кислоти (вихід 39%), як пдрохлорид, т пл 220°С (розкл ) 1 Н-ЯМР (CDCI 3 , 5) 1,8 (шс, 6Н) 2 51 (м, 4Н), 2 59 (м 2Н), 2 79 (м, 2Н) 3 4-3 6 (м, 4Н), 3 8 (шс, 4Н) 4 51 (шс 2Н), 6 39 (д J=8, 1Н), 7 02 (д, J=7, 1Н) 7 22 (м, 2Н), 7 46 (т, J=8, 1Н), 7 80 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 33 4 35 6 45 4, 48 0 59 8, 56 1, 60 4, 106 9, 110 7, 126 8 128 9, 137 6, 138 3, 141 0, 1 5 6 0 158 2, 1 7 3 8 FAB MC (%) 394 (продукт + 1, 28) 197 (38), 149(63) 133(100) Аналіз розраховано для C23H31N5O • НСІ • 1/4Н 2 О-СН 2 СІ 2 С 55 50, Н 6 64, N 13 48 Знайдено С 55 79, Н 6 85, N 13 10 Приклад 70 6-{4-[2-(3-амшопіролідин-1-іл)етил]-феніл}-піридин-2-іламш виготовили способом за прикладом 1 з 3-(т-бутоксикарбоніламшо)піролідину з наступним депротектуванням за допомогою трифлуороцтової кислоти у метиленхлориді, при кімнатній температурі як пдрохлорид (вихід 92%), т пл 135°С (розкл) 1 Н-ЯМР (CDCI 3 , 5) 1 4-1 5 (м, ЗН) 2 16 (м, 1Н), 2 3 7 ( м , 1Н), 2 5 2 ( м , 1Н), 2 7-> 2 9 (м, 6Н), 3 51 (м, 1Н), 4 53 (шс, 2Н NH), 6 42 (д, J=8, 1Н) 7 05 (д, ЗО J=7, 1Н), 7 27 (м, 2Н) 7 4 7 ( т , J=8, 1Н), 7 8 4 ( м , 2Н) 13 С-ЯМР (CDCI 3 , S) 126 8, 35 2,35 3,51 0,53 3,58 0 64 1,106 8,110 7 128 8, 137 6, 138 3, 141 0, 156 1, 158,2 МС (%) 283 (продукт + 1, 100), 197 (37) 99 (75) Аналіз розраховано для C17H22N4 • ЗНСІ • Н 2 О С 49 83, Н 6 64, N 13 67 Знайдено С 49 94 Н 6 89 N 13 29 Приклад 71 1-(3-{2-[4-(6-амшопіридин-2-іл)феніл]-етиламшо}-8-азабіцикло[3,2,1]окт-3-ил)-2(4-флуорфеніл)-етанон виготовили способом за прикладом 1 з 1амшо-8-азабіцикло[3,2,1]окт-3-ил)-2-(4флуорфеніл)-етанону як пдрохлорид, (вихід 23,5%), т пл 170°С (розкл ) 1 Н-ЯМР (CDCI 3 , 5) 1 12 (к 1Н), 1 39 (м, 1Н), 1 61 (м 2Н), 1 84 (м,4Н), 2 79 ( 4Н), 2 97 (м 1Н), 3 56 (дд, J= 15 35, 2Н), 4 165 (ь 1Н) 4 49 (шс 2Н 10 NH), 4,68 (м, 1Н) 6 42 (д, J=8 1Н) 6 96 (м, 2Н), 7 04 (д, J=8, 1Н), 7 1-73 (м, 4Н) 7 47 (т, J=8 1H), 7 83 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 27 2 28 9, 36 3 38 3 39 9, 4 0 4 4 7 9 4 8 9 , 5 1 1 , 54 4, 1 0 7 0 , 1 1 0 8 , 1 1 5 3 , 115 5 127 0, 128 9 130 3 1310, 137 9 138 4, 140 2 1 5 5 9 , 158 2, 1 6 2 9 1 6 6 2 МС (%) 459 (продукт + 1, 27), 133 (98), 110 (100) 109(30) Аналіз розраховано для C28H31N4OF • 2НСІ • 3/4Н 2 О С 6 1 7 0 , Н 6 38, N 10 28 Знайдено С 61 82, Н 6 43 N 10 11 Приклад 72 1-(1-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-піролідин-3-іл)-3-фенілсечовина виготовили з прикладу 73 з фенілізоціанатом (вихід 53,5%), з метиленхлориду/етеру як пдрохлорид, т пл 130°С (розкл ) 1 Н-ЯМР (CDCI 3 , 1 64 (м, 1Н) 2 22 (м, 2Н), 2 46 (м, 1Н), 2 69 (м, 2Н), 2 79 (м, 4Н), 2 97 (м, 1Н), 4 25 53 (шс 1Н, NH), 4 54 (шс 2Н, NH), 5 94 (шс, 1Н, NH), 6 40 (д, J=8, 1Н), 6 9-7 0 (м, ЗН), 7 2-7 3 (м, 5Н), 7 4 6 д , J=8 1Н) 7 8 0 ( м , 2Н) 13 С-ЯМР (CDCI 3 , 5) 32 3, 34 7, 49 4, 53 1 57 3, 61 0, 107 1, 110 8, 119 9, 122 8, 126 9, 128 8, 129 0, 137 6 138 5 139 3 1406 155 8 , 1 5 6 0 158 4 МС (%) 402 (продую- + 1, 97), 197(48), 155(48), 133(100), 119(78), 103 3 0 (48) Аналіз розраховано для C24H27N5O • 2НСІ • 1/2С 4 Ню0 • 1/2СН 2 С1 2 С 57 46, Н 6 37 N 12 64 Знайдено С 57 74, Н 6 35, N 12 44 Приклад 73 1-(1-{2-[4-(6-амінопіридин-2-іл)феніл]-етил}-піролідин-3-іл)-3-бензилсечовина виготовили з прикладу 73 з бензилізоціанатом (вихід 42%), з метиленхлориду/етеру як пдрохлорид, т пл 90°С (розкл ) 1 Н-ЯМР (CDCI 3 l 1 65 (м, 1Н) 2 19 (м, 2Н), 2 45 (гп 1Н) 2 6-2 8 (м, 6Н) 2 95 (м, 1Н), 4 17 (м, 1Н), 4 28 (д, J=6, 2Н), 4 52 (м 2Н, NH), 5 27 (м, 1Н), 6 40 (д, J=8, 1Н) 7 01 (д, J=7, 1Н), 7 2-7 3 (м, 7Н), 7 45(т, J=8 1Н), 7 7 9 ( м , 2Н) 13 С-ЯМР (CDCIs, 5) 32 4, 34 7, 44 3, 49 7, 53 0, 57 2, 61 0 107 0 110 7, 126 8, 127 1, 127 5 128 5 128 8, 137 6, 138 4, 139 5, 140 5 155 9, 157 8 158 2 МС (%) 416 (продукт + 1, 100), 197 (52), 133 (63), 119(55), 91 (65) Аналіз розраховано для C21H29N5O • 2НСІ • 1/2С 4 Ню0 • 1/2СН 2 СІ 2 • 1/2Н2О С 57 25, Н 6 64, N 12 14 Знайдено С 56 93 Н 6 64, N 11 74 Приклад 74 1-(1-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-піролідин-3-іл)-3циклогексилсечовина виготовили з прикладу 73 з циклогексилізоціанатом (вихід 27%), з метиленхлориду/етеру як пдрохлорид, т пл 120°С (розкл) 1 Н-ЯМР (CDCIs, 1 02 (м, ЗН), 1 26 (м, ЗН), 1 50 (м, 1Н), 1 60 (м, ЗН), 1 83 (м, 2Н), 2 56 (м, 1Н), 2 69 (м 2Н), 2 79 (м, 2Н), 2 91 (м 1Н) 3 47 (м, 1Н), 4 18 (м 1Н) 5 50 (м, 1Н), 6 38 (д, J=8 1Н), 6 99 (д, J=7, 1Н), 7 19 (м 2Н), 7 42 (д J=8, 1Н), 7 79 (м, 2Н) 13 С-ЯМР (CDCI 3 , S) 25 0, 25 6, 32 3, 33 9, 34 7 4 8 7 4 9 4 , 5 3 1 , 57 5, 6 1 1 , 1 0 7 0 1 1 0 6 , 1 2 6 9 128 8, 137 7, 138 3, 140 4, 155 8, 157 4, 158 4 МС (%) 408 (продукт + 1, 95), 309 (62), 197 (100), 133(61) Аналіз розраховано для C24H33N5O • 2НСІ • 1/2С 4 Ню0 • 1/2СН 2 СІ 2 • 5/4Н 2 О С 54 64 Н 7 53, N 12 02 Знайдено С 54 52, Н 7 28 N 12 00 Приклад 75 {2-[4-(6-амшопіридин-2-іл)-феніл]етил}-(8-метил-8-азабіцикло[3,2,1 ]окт-3-ил)-амш виготовили способом за прикладом 1 з (8метил-8-азабіцикло[3,2,1]окт-3-ил)-амшу (вихід 27%), з етеру як пдрохлорид, т пл 98°С (розкл ) { Н-ЯМР (CDCI 3 , S) 0 9-1 9 (мультиплети, 8Н), 2 49 (с, ЗН), 2 8-3 0 (м, 6Н), 3 25 (м, 1Н), 3 49 (шс, 2Н, NH), 6 42 (д, J=8, 1Н), 7 02 (д, J=7, 1Н) 7 23 (м, 2Н), 7 46 (т, J=8, 1Н), 7 81 (м, 2Н) МС (%) 337 (продукт + 1, 6), 200 (40), 133 (28), 91 (100) Аналіз розраховано для C21H28N4 • ЗНСІ • 5/2Н 2 О • 1/4С 4 Ню0 С 5 1 8 7 , Н 7 62, N 1 1 0 0 Знайдено С 51 87, Н 7 58 N 10 98 Приклад 76 {2-[4-(6-амшопіридин-2-іл)-феніл]етил}-(3-бензил-3-азабіцикло[3,1,0]гекс-6-ил)-амш 49006 54 виготовили способом за прикладом 1 з (3бензил-3-азабіцикло[3,1,0]гекс-6-амшу (вихід 19%), як бежевий твердий пдрохлорид 1 Н-ЯМР (CDCIs, S) 1 42 (м, 2Н), 2 38 (м, 2Н), 2 51 {м, 1Н), 2 84 (м, 2Н), 2 94 (м 4Н), 3 55 (с, 2Н), 4 52 (шс, 2Н, NH), 6 41 (д j=8, 1Н) 7 04 (д, J=8, 1Н) 7 2-7 3 (м 7Н) 7 46 (т, J=8 1Н), 7 83 (м, 2Н) 13 С-ЯМР (CDCIs, S) 24 3 35 7, 38 7 50 5, 54 4, 59 1. 106 9, 110 7, 126 8, 126 9 128 2, 128 6 128 9, 137 7, 138 4, 139 5, 140 4, 156 0 158 2 МС (%) 385 (продукт + 1, 20), 155 (64), 119 (100) Аналіз розраховано для C23H31N5O • НСІ • 1/4Н2О • СН 2 СІ 2 С 55 50, Н 6 64, N 13 48 Знайдено С 55 79, Н 6 85, N 1 3 10 Приклад 77 {2-[4-(6-амшопіридин-2-іл)-феніл]етил}-[8-(4-флуорбензил)-8азабіцикло[3,2,1 ]окт-3-ил]-амш виготовили способом за прикладом 1 з 8-(4флуорбензил)-8-азабіцикло[3,2,1]окт-3-амшу (вихід 22%), як пдрохлорид, т пл 190°С (розкл ) { Н-ЯМР (CDCIs, S) 1 43 (м, 2Н), 1 52 (м, 2Н), 1 70 (м, 2Н), 1 95 (м, 2Н) 2 7-2 8 (м, 5Н), 3 14 (м 2Н) 3 50 (с 2Н) 4 49 (шс, 2Н, NH) 1 41 (д J=8, 1Н), 6 94 (м, 2Н) 7 04 (д, J=8 1Н) 77 24 (м, 2Н), 7 ЗО (м, 2Н), 7 46 (т, J=8, 1Н), 7 83 (м, 2Н) 13 С-ЯМР (CDCIs, S) 27 0, 36 4, 38 3, 48 0, 48 9, 5"1 8 58 3, 106 9, 110 7, 114 7, 114 9, 126 7, 126 8, 126 9, 128 9, 129 8, 129 9, 135 9 137 8 ЗО 138 3, 140 6, 156 0, '158 2,160 5 162 9 МС (%) 431 (продукт + 1, 44), 218 (56), 109 (100) Аналіз розраховано для C27H31N4F • ЗНСІ • 3/2Н 2 О С 57 20, Н 6 58, N 9 88 Знайдено С 57 ЗО, Н 6 91 N 9 56 Приклад 78 {2-[4-(6-амшопіридин-2-іл)-феніл]етил}-[8-(4-хлорбензил)-8-азабіцикло[3,2,1 ]окт-3ил]-амш виготовили способом заприкладом 1 з 8-(4(вихід хлорбензил)-8-азабіцикло[3,2,1]окт-3-амшу 29%), як пдрохлорид, т пл 198°С (розкл ) { Н-ЯМР (CDCIs, S) 1 42 (м 2Н), 1 52 (м, 2Н), 1 68 (м, 2Н), 1 94 (м, 2Н), 2 8-2 9 (м, 5Н), 3 13 (шс 2Н) 3 49 (с, 2Н), 4 53 (шс, 2Н, NH) 6 40 (д, J=8, 1Н), 7 03 (д J=7, 1Н) 7 2-7 3 (м, 7Н), 7 45 (т, J=8 1Н), 7 8 2 ( м 2Н) 13 С-ЯМР (CDCIs, S) 24 0. 36 2, 37 9 47 9, 49 0, 5 4 8 5 8 1 1 0 7 0 10 1 1 0 7 126 8, 127 0, 128 2, 128 3, 128 9, 129 8, 130 0, 132 2, 137 8 138 4 1387, 1404 1560, 1582 МС (%) 447 (продукт + 1, 45), 234 (54), 125 (100) Аналіз розраховано для C27H31N4CI • ЗНСІ • 1/2Н2О С 57 36, Н 6 24 N 9 91 Знайдено С 57,27, Н 6 44, N 9 57 Приклад 79 Фенетиламід 4-амшо-1-{2-[4-(6амшопіридин-2-іл)-феніл]-етил}-піперидин-4карбонової кислоти виготовили способом за прикладом 1 з фенетиламіду 4-амшопіперидин-4-карбоновоі кислоти (вихід 12%), як пдрохлорид, т пл 215 - 219°С (розкл ) 1 Н-ЯМР (CDCIs, S) 1 31 (м, 2Н), 1 80 (шс, 2Н), 2 25 (м 4Н), 2 62 (м, 2Н) 2 8-3 0 (м 6Н) 3 48 (м, 2Н), 4 49 (шс, 2Н, NH), 6 41 (д, J=8, 1Н), 7 04 (д 55 49006 J=7, 1H) 7 2-7 4 (м, 7Н), 7 46 (т, J=8, 1Н), 7 82 2Н) 13 С-ЯМР (CDCI 3 l 5) 33 4, 35 0, 35 8, 40 4, 49 О 55 2, 60 4, 106 9, 110 7, 126 4, 126 8, 128 5 128 8, 128 9, 137 6 138 3 139 1 140 9, 156 0, 158 2, 176 9 МС (%) 444 (продую- + 1, 15) 197 (54), 133 (100) Аналіз розраховано для C27H33N5O • ЗНСІ С 58 65, Н 6 56 N 12 66 Знайдено С 58 29, Н 6 97 N 12 28 Приклад 80 Феніламід 4-амшо-1-{2-[4-(6амінопіридин-2-іл)-феніл]-етиламшо}-піролідин-1карбонової кислоти виготовили способом за прикладом 1 з феніламіду З-амшопіролідин-1 -карбонової кислоти (вихід 8%), з етилового етеру як пдрохлорид, т пл 130°С (розкл) 1 Н-ЯМР (CDCI 3 l 5) 1 64 (м, 1Н), 2 20 (м, 2Н), 2 46 (дд, J=3 7, 1Н) 2 66 (м, 2Н), 2 78 (м, 4Н), 2 97 (м, 1Н), 4 25 (шс 1Н, NH), 4 53 (шс 2Н, NH), 5 85 (д J=7, 1H), 6 40 (д, J=8, 1H) 6 9-7 0 (м, ЗН), 7 27 3 (м 5Н) 7 46 (т, J=8, 1Н), 7 79 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) 32 4, 34 8, 49 6 53 1 57 З, 61 0, 107 1, 110 8 120 0, 122 9, 126 9, 128 8, 129 0, 137 6 , 1 3 8 4 , 1 3 9 2 , 1 4 0 7 155 6 156 0 158 3 МС (%) 402 (продукт + 1, 100) 283 (20) 264 (18) Аналіз розраховано для C24H27N5O • 2НСІ • Н 2 0 • С 4 НюО С 59 3G, Н 7 29, N 12 36 Знайдено С 59 34, Н 6 69 N 12 59 Приклад 81 (3-{2-[4-(6-амшопіридин-2-іл)феніл]-етиламшо}-піролідин-1-іл)фенілметанон виготовили способом за прикладом 1 з 3амшопіролідин-1-ілфенілметанону (вихід 10%), з етилового етеру як пдрохлорид, т пл 130°С (розкл ) 1 Н-ЯМР (CDCI 3 , 5) 1 71 (м, 1Н) 1 98 та 2 13 (мультиплети, 1Н) 2 7-3 0 (м, ЗН) 3 2-3 8 (мультиплети, 6Н) 4 51 (шс 2Н, NH) 6 42 (д, J=8, 1H), 7 04 (т J=7, 1Н) 7 20 (д J=8, 1Н), 7 26 (м, 1Н), 7 38 (м, ЗН), 7 46 (м, ЗН) 7 83 (м, 2Н) 13 С-ЯМР (CDCI 3 , 5) ЗО 8 32 5, 36 0, 44 7, 47 8 4 9 2 4 9 3 , 5 2 1 , 5 5 1 , 56 3, 57 9, 1 0 7 0 , 11075, 127 0, 127 1, 128 2, 128 3 128 9 129 9, 137 9, 138 4, 140 0, 155 8 158 2, 169 8 МС (%) 387 (продукт + 1, 75), 155 (44), 1 19 (100), 105(60) Аналіз розраховано для C24H26N4O • НСІ • 1/2СН 2 СІ 2 • С 4 НюО С 63 44, Н 7 1 0 , N 10 38 Знайдено С 63 33, Н 6 72, N 10 39 Приклад 82 6-{4-[2-(1 -бензил піролідин-3іламшо)-етил]-феніл}-піридин-2-іламш виготовили способом за прикладом 1 з 1-бензилпіролідин-Заміну як пдрохлорид, (вихід 27%), т пл 145°С (розкл) 1 Н-ЯМР (CDCI 3 , 5) 1 49 (м, 1Н), 2 08 (м, 1Н), 2 26 (дд J= 5,9 1Н) 2 73 (м, 1Н), 2 81 (с, 4Н), 3 29 (м, 1Н), 3 56 (ABq J=19, Dn=13 2Н), 4 52 (шс 2Н NH), 6 3 9 ( д J=8 1Н), 7 0 4 ( д , J=7,1H), 7 28 (м 7Н), 7 4 5 ( т J=8, 1Н), 7 8 3 ( м , 2Н) 13 С-ЯМР (CDCI 3 , 5) 32 1, 36 3, 49 5, 53 0, 57 З, 60 5, 60 7, 106 9, 110 7, 126 88 126 94, 128 2 128 8, 128 9, 137 8 138 3,139 0, 140 5, 156 0, 158 3 МС (%) 373 (продукт + 1, 100), 155 (35), 119 56 (78), 103(35) Аналіз розраховано для C24H28N4 • ЗНСІ • 1/2Н2О С 58 72, Н 6 57 N 11 41 Знайдено С 58 37, Н 6 67, N 11 23 Приклад 83 г\І-(8-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-8-азабіцикло[3,2,1]окт-3-ил]-бензамід виготовили способом за прикладом 1 з 8азабіцикло[3,2,1]окт-3-бензаміду (вихід 29%), як пдрохлорид, т пл 211 °С (розкл ) 1 Н-ЯМР (CDCIs, 5) 1 67 (м, 2Н), 1 78 (м, 2Н) 1 92 (м 2Н) 2 00 (м, 2Н), 3 39 (м, 2Н), 4 36 (м 1Н), 4 47 (шс, 2Н, NH), 5 96 (д J=8, 1Н), 6 42 (д J=8 1Н), 7 04 (д, J=8, 1Н), 7 26 (м 2Н), 7 40 (м, 2Н), 7 47 (м, 2Н), 7 70 (м, 2Н), 7 82 (м, 2Н) 13 С-ЯМР (CDCIs, S) 26 4, 35 4, 37 65, 41 6 53 8, 59 2 106 9, 110 7, 126 8 128 5, 128 9 131 4, 134 7, 137 7, 138 3, 140 7, 156 0 158 2, 166 7 МС (%) 427 (продукт + 1, 100) Аналіз розраховано для C27H30N4O • 2НСІ • Н 2 О С 62 67, Н 6 62, N 10 83 Знайдено С 62 85, Н 6 57, N 10 52 Приклад 84 {2-[4-(6-амшопіридин-2-іл)-феніл]етил}-(3-бензил-3-азабіцикло[3,3,1 ]нон-9-іл)амш виготовили способом за прикладом 1 з (3бензил-3-азабіцикло[3,3,1]нон-9-іл)амшу (вихід 24%), як суміш пдрохлоридів ендо- та екзоізомерів, т пл 190°С (розкл ) 1 Н-ЯМР (CDCIs, S) 1 44 (м 2Н), 1 76 (м 4Н), 2 37 (м, 2Н), 2 55 (м, 2Н), 2 86 (с 4Н), ? 94 (м, 2Н), 3 28 та 3 27 (синглети, 2Н, ендо- та екзоізомерів у приблизному співвідношенні 1 1, N-бензильноі групи СН 2 ), 4 47 (шс, 2Н, NH), 6 44 (дд, J=2,8, 1H), 7 07 (дд, J=3 7 1Н), 7 1 -7 3 (м 7Н), 7 47 (дт, J=2,8, 1Н), 7 8 6 ( м , 2Н) 13 С-ЯМР (CDCI 3 , S) 21 2 24 5, 32 3, 33 0, 47 8, 5 3 1 , 6 0 2 , 635, 638, 1069, 1107, 1262 1266, 126 9 128 1, 128 2 128 6 128 7, 128 9, 129 0, 138 3, 139 0, 141 0, 158 0, 159 0 МС (%) 427 (продукт + 1, 68), 91 (100) Аналіз розраховано для C28H34N4 • ЗНСІ • 1/2Н2О С 6 1 7 1 , Н 7 0 3 , N 1 0 2 8 Знайдено С 61 86, Н 7 19 N 9 97 Приклад 85 ^(8-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-8-азабіцикло[3,2,1]окт-3-ил]-2-(4флуорфеніл)-ацетамід виготовили способом за прикладом 1 з 8азабіцикло[3,2,1]окт-3-ил]-2-(4-флуорфеніл)ацетаміду (вихід 23%), як пдрохлорид, т пл 160°С (розкл) 1 Н-ЯМР (CDCIs, S) 1 49 (м, 2Н), 1 69 (м 2Н), 1 76 (м 2Н), 1 93 (м, 2Н) 2 58 (м, 2Н), 2 81 (м, 2Н) 3 33 (шс, 2Н) 3 44 (с, 2Н) 3 49 (с, 11-1), 4 13 (м 1Н) 10 4 4 9 ( ш с , 2Н, NH) 6 41 (д J=8, 1Н), 7 01 (м, ЗН), 7 21 (м, 4Н/ 7 45 (т, J=8, 1Н), 7 81 (м, 2Н) 13 С-ЯМР (CDCIs, S) 26 1, 35 1, 37 6 37 8, 41 0, 4 2 9 5 2 9 , 5 4 0 59 4, 1 0 7 0 , 1 1 0 7 , 1 1 5 7 , 1 1 5 9 126 9, 127 3, 128 9, 129 0, 129 4 130 9, 137 8, 138 4, 140 3, 155 9, 158 2 170 1 МС (%) 459 (продукт + 1, 100), 197 (21), 119 (31), 103(36) Аналіз розраховано для C28H34N4OF • 2НСІ • 1/2Н2О С 62 22, Н 6 34, N 10 37 Знайдено С 61 99, Н 6 50, N 10 01 Приклад 86 6-{4-[2-(3-амшопіперидин-1чл)етил]-феніл}-піридин-2-іламш виготовили спосо 57 49006 бом за прикладом 1 з 3-(т-бутоксикарбоніламшо)піперидину з наступною конденсацією з (6амшопіридин-2-іл)-феніл]-2-хлоретаном та деблокуванням трифлуороцтовою кислотою у метиленхлориді як пдрохлорид, (вихід 100%), т пл 150°С (розкл) 1 Н-ЯМР (CDCI 3 l 5) 1 20 (м, 1Н), 1 42 (м, 1Н), 1 62 (м, 1Н) 1 85 (м, 1Н) 2 31 (тд, J=2 9, 1Н), 2 51 (м, 2Н), 2 79 (м 2Н), 2 86 (м ЗН), 3 08 (м, 1Н) 4 52 (шс 2Н, NH), 6 39 (дд J=1 8, 1Н), 7 02 (дд, J=1,7, 1Н), 7 23 (м, 2Н), 7 44 (тд J=1,8, 1Н), 7 81 (м, 2Н) 13 С-ЯМР (CDCIs, 5) 25 1, 31 8 36 3, 46 6, 48 1 52 4, 54 75, 106 9, 110 7 126 9, 128 9, 137 7, 138 З, 140 5, 156 0, 158 2 МС (%) 297 (продукт + 1, 57), 135 (40) 119 (100), 103(62) Аналіз розраховано для C18H24N4 • ЗНСІ • НгО • 1/2СН 2 СІ 2 С 51 70, Н 6 80 N 13 03 Знайдено С 51 90, Н 6 64, N 12 59 Приклад 87 І\І-(3-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-3-азабіцикло[3,3,1]нон-9-іл)бензамід, анті ізомер виготовили способом за прикладом 1 з антмзомеру 3-азабіцикло[3,3,1]нон-9-іл)бензаміду (вихід 18%), як пдрохлорид, т пл 185°С (розкл ) 1 Н-ЯМР (CDCIs, S) 1 35 (м, 1Н), 1 71 (м, 4Н), 1 95 (м 2Н), 2 4-2 5 (м 5Н) 2 79 (м, 2Н), 3 04 (м, 2Н), 4 1 0 ( м , 1Н) 4 5 3 ( ш с 2Н NM), 6 41 (дд, J=1 8, 1Н), 6 42 (м 1Н), 7 05 (дд, J= 1,7, 1Н) 7 25 (м, 2Н) 7 4-7 5 (м, 4Н), 7 75 (м, 2Н), 7 84 (м, 2Н) 13 С-ЯМР (CDCI 3 , 20 6 25 3, 32 9, 33 5, 5 1 4 , 59 5, 59 9, 106 8 110 6, 126 6, 126 8, 128 6, 158 9, 1 3 1 3 , 135 1, 137 3, 138 3, 1 4 1 5 156 1, 158 2 166 9 МС (%) 441 (продукт + 1, 41), 149 (75), 119 (100) Аналіз розраховано для C28H32N4O • 2НСІ • 1/2Н2О • 1/4С 4 Ню0 С 64 38, Н 6 99 N 10 36 Знайдено С 64 49 Н 6 43 N 9 91 Приклад 88 І\І-(3-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-3-азабіцикло[3,3,1]нон-9-іл)бензамід, синізомер виготовили способом за прикладом 1 з синізомеру 3-азабіцикло[3,3,1]нон-9-іл)бензаміду (вихід 9%), як твердий гігроскопічний пдрохлорид 1 Н-ЯМР (CDCI 3 , 5) ) 1 37 (м, 1Н), 1 81 (м, 4Н) 2 00 (м, 2Н), 2 33 (м 1Н), 2 51 (м 4Н), 2 83 (м, 4Н), 4 04 (м, 1Н), 4 48 (шс, 2Н, NH) 6 42 (дд, J= 1,8, 1Н), 7 05 (дд, J=1,7 1Н) 7 24 (м, 2Н), 7 4-7 5 (м, 4Н), 7 7 4 ( м , 2Н), 7 8 2 ( м , 2Н) 13 С-ЯМР (CDCIs, 20 3, 3 1 9 33 4, 33 7, 50 8, 53 8, 60 5, 107 1 110 7, 126 7, 126 8 128 6, 128 9, 1 3 1 3 135 1, 137 0 138 6 1 4 1 4 , 155 6, 158 1 166 6 МС (%) 441 (продукт =+ 1, 5), 391 (10) 167 (23), 149(100) Аналіз розраховано для C28H32N4O • НСІ • 1/2СН 2 СІ 2 - 1/2С 4 Ню0 С 65 82, Н 7 06 N 10 07 Знайдено С 66 20 Н 6 80 N 1 0 1 0 Приклад 89 6-{4-[2-(4-бензпдрилпіперазин-3іламшо)-етил]-феніл}-піридин-2-іламш виготовили способом за прикладом 1 з 4бензпдрилпіперазину як пдрохлорид, (вихід 54%), т пл 170°С (розкл ) 1 Н-ЯМР (CDCIs, S) 2 45 (м, 4Н), 2 56 (м, 4Н), 58 2 61 (м, 2Н), 2 82 (м, 2Н), 4 24 (с 1Н) 4 54 (шс, 2Н, NH) 6 37 (д, J=6 1Н), 7 04 (д, J=8, 1Н), 7 19 (м 2Н) 7 26 (м, 6Н), 7 42 (м, 5Н) 7 85 (м, 2Н) 13 С-ЯМР (CDCIs, S) 33 4, 51 9 52 0, 53 5, 60 4, 10ЛО, 110 6 126 8, 5 126 9, 128 0 128 5, 128 9, 137 6, 138 3, 141 0, 142 8 156 0, 158 З МС (%) 449 (продукт + 1, 17), 253 (12), 167 (100), 149(14) Аналіз розраховано для C30H32N4 • 2НСІ • 1/4СН2С12 С 66 94, Н 6 41 N 10 32 Знайдено С 66 57 Н6 22 N 10 17 Приклад 90 6-{4-[2-(4-бензпдрилпіперидин-3іламшо)-етил]-феніл} -піридин-2-іламш виготовили способом за прикладом 1 з 4бензпдрилпіперидину як пдрохлорид, (вихід 24%), т пл 175°С (розкл ) 1 Н-ЯМР (CDCIs, 5) 1 32 (м 2Н), 1 56 (м, 2Н), 2 11 (м, 2Н) 2 14 (м, 1Н), 2 61 (м, 2Н), 2 83 (м 2Н), 2 99 (м, 2Н), 3 50 (д, J=11 1Н) 4 46 (шс, 2Н, NH), 6 41 (дд, J-0 5, 8, 1Н), 7 04 (дд, J=0 5, 7 5, 1Н), 7 14 (м 2Н), 7 2-7 3 (м, 10Н), 7 46 (т J=8, 1Н) 7 82 (м 2Н) 13 С-ЯМР (CDCIs, 6) 31 2, 33 4, 39 5, 53 9, 58 9, 60 6, 106 9, 110 7, 126 2 126 8, 128 0, 128 5 128 9 1383 1437, 1560, 1582 МС (%) 448 (продукт + 1 100), 264 (32), 149 (70) Аналіз розраховано для C31H33N3 • 2НСІ 1/4СН2СІ2 С 69 28, Н 6 "0, N 7 76 Знайдено С 68 96, Н 6 48, N 7 36 Приклад 91 3-{2-[4-(6-амшопіридин-2-іл)феніл]-етил}-3-азабіцикло[3,3,1]нон-9-іламін виготовили способом за прикладом 1 з тбутилкарбамату 3-азабіцикло[3,3,1]нон-9-іламшу з депротектуванням трифлуороцтовою кислотою у метиленхлориді (вихід 85%), як твердий легкоплавкий пдрохлорид 1 Н-ЯМР (CDCIs, S) 1 28 (м, 1Н), 1 48 (м 2Н), 1 61 (шс,2Н), 1 82 (м, 2Н), 2 26 (м, 2Н), 2 35 (м 1Н), 2 46 (т, J=7, 2Н), 2 78 (м, ЗН), 3 02 (м, 2Н, 4 46 (шс, 2Н, NH), 6 41 (дд, J=0 5,8, 1H), 7 05 (д J=0 6, 7, 1Н), 7 24 (м, 2Н), 7 46 (т J=8 1Н), 7 82 (м, 2Н) 13 С-ЯМР (CDCIs, S) 20 9, 24 1, 33 7, 36 1 52 8, 60 2, 106 7, 110 7, 126 6, 128 9 137 2 138 3, 141 7, 156 2, 158 1 МС (%) 337 (продукт + 1, 13), 279 (14), 167 (ЗО), 149(100) 113(39) Аналіз розраховано для C21H28N4O • 2НСІ • 1/2СН2СІ2 • С4НюО С 58 23, Н 7 86, N 10 65 Знайдено С 58 15 Н 7 31 N10 72 Приклад 92 Етиловий естер 3-{2-[4-(6амшопіридин-2-іл)-феніл]-етил}-3азабіцикло[3,1,0]гексан-6-карбоновоі кислоти виготовили способом за прикладом 1 з етилового естеру 3-азабіцикло[3,1,0]гексан-6-карбоновоі кислоти (вихід 18%), як твердий легкоплавкий пдрохлорид 1 Н-ЯМР (CDCIs, S) 1 23 (т, J=7, ЗН) 1 93 (шс 2Н) 1 99 (шс, 1Н) 2 40 (д, J=9, 1Н), 2 65 (м 2Н) 2 71 (м 2Н), 3 12 (д, J=9, 2Н) 4 49 (шс, 2Н, NH), 6 40 (д, J=8, 1Н), 7 04 (д, J=7 5, 1Н), 7 21 (м, 2Н) 7 45(т, J=7 5, 1Н), 7 81 (м, 2Н) 13 С-ЯМР (CDCIs, S) 14 3, 21 8, 26 3 35 1, 54 4, 56 4 30 2, 106 8, 110 7, 126 7 128 8, 137 5, 138 3 141 0, 1561, 158 2, 1739 60 59 49006 1 MC (%) 352 (продую- + 1, 5), 167 (22), 149 Н-ЯМР (CDCI3l 5) 1 38 (м, 2Н) 1 80 (м 2Н) (100), 113(20) 1 99 (м, 2Н), 2 46 (м, 1Н), 2 83 (м, 4Н), 2 90 (м 2Н), Аналіз розраховано для C21H25N3O2 • 2НСІ С, 3 48 (с, 2Н) 4 57 (шс, 2Н), 6 40 (д, J=8, 1Н) 7 05 (д, Н, N Знайдено С Н N J=7 1Н), 7 30 (м 7Н), 7 45 (т J=8, 1H), 7 85 (м Приклад 93 3-{2-[4-(6-амшопіридин-2-іл)2Н) 13 феніл]-етил}-3-азабіцикло[3,1,0]гексан-6С-ЯМР (CDCI3, 5) 32 7, 36 3, 48 0, 52 5 54 9, карбонова кислот 36 1,106 9,110 7,126 9 128 2,128 9 129 1,137 8, виготовили гідролізом прикладу 2 2Н хлорид138 3, 138 6, 140 6, 156 0, 158 3 ною кислотою при 70°С протягом 8 годин (вихід FAB MC(%) 387 (продукт + 1, 47) 174(31) 149 83%), як твердий легкоплавкий пдрохлорид (100) 119(97), 103(52) { Н-ЯМР (CDCI3, 5) 2 18 (с, 2Н), 2 31 (м 2Н) МСВР розраховано для C25H30N4 (продукт + 3 28 (с, 1Н), 3 4-3 6 (м, 4Н), 3 89 (м 2Н), 6 96 (м, 1) 387,2548 Знайдено 387,2582 1Н), 7 15 (м, 1Н), 7 53 (м, 2Н) 7 79 (м, 2Н) 7 94 (м Приклад 97 3-{2-[4-(6-амшопіридин-2-іл)1Н) феніл]-етил}-3-азабіцикло[3,1,0]гекс-6-іламін (антм13 С-ЯМР (CDCI3, 5) 24 3, 29 2, 31 5, 38 8 55 7, зомер) 1107, 11 16, 1247, 1276, 1285, 1300, 1306, виготовили способом за прикладом 1 з т131 0 140 0, 1446, 1464 1554, 1679 бутилкарбамату 3-азабіцикло[3,1,0]гекс-6-іламшу МС (%) 324 (продукт + 1, 3),279(11), 167 (25) (антмзомеру) з депротектуванням трифлуороцто149(100) 129(12) 113(27) вою кислотою у метиленхлориді (вихід 79%), а як МСВР розраховано для C19H22N3O2 (продукт + пдрохлорид - з етилового етеру 1 1) 324,1712 Знайдено 324,1717 Н-ЯМР (CDCI3, 5) 1 34 (м, 2Н), 1 90 (шс 2Н), Приклад 94 т-Бутиловий естер 3-{2-[4-(62 29 (т, J = 7, 1Н), 2 63 (м, 2Н), 2 69 (м, 2Н), 2 76 амінопіридин-2-іл)-феніл]-етиламшо}-піперидин-1(м 2Н), 3 09 (д, J=9, 2Н), 4 52 (шс 2Н), 6 41 (д, карбонової кислоти J=8, 1Н), 7 04 (д, J=8, 1Н), 7 22 (м, 2Н), 7 45 (т, J=8 виготовили способом за прикладом 1 з т1Н), 7 82(м, 2Н) 13 бутилового естеру піперидин-1 -карбонової кислоти С-ЯМР (CDCI3, 5) 19 9, 34 4 35 4, 52 7, 57 0, (вихід 29%), як піну 1068, 1107 1267, 1288, 1375, 1383, 1412, 1 Н-ЯМР (CDCI3, 5) 1 43 (с, 9Н), 1 6-1 8 (м ЗН), 1561, 1582 2 35 (м, 2Н), 2 54 (м, ЗН), 2 76 (т, J=8, 2Н), 3 74 (м FAB MC (%) 295 (продукт +1,3), 279 (10), 167 1Н), 4 55 (шс 2Н) 5 03 (шс 1Н), 6 39 (д, J=8, U-I), (20), 149(100), 129(6), 113(25) 7 03 (д J=7 1Н), 7 22 (м, 2Н) 7 44 (т, J=8 1Н), 7 83 Аналіз розраховано для C18H22N4 • 2НСІ • (м, 2Н) 1/4СН2С12 • 1/2С4Ню0 • 5/4Н2О С 54 27, Н 15 7 20, 13 С-ЯМР (CDCI3, 5) 22 3 28 5, 29 7 33 3, 46 З, N 12 50 Знайдено С 53 92, Н 6 83, N 12 19 533, 585, 603, 789, 1068, 1106, 1268, 1289, Приклад 98 6-{4-[2-(піперидин-4-іламіно)135 138 3, 141 0, 155 2, 1560, 1583 етил]-феніл}-піридин-2-іламш виготовили деблокуМС (%) 397 (продукт + 1, 56) 297 (38), 280 ванням прикладу 96 форміатом амонію та 10% (48) 213(40) 197(95) 157(100) паладієм на активованому вугіллі у киплячому МСВР розраховано для C23H33N4O2 (продукт + етанолі (вихід 67,5%), а як пдрохлорид - з етило1) 397,26035 Знайдено 397,2581 вого етеру 1 Приклад 95 6-{4-[2-(піперидин-3-іламіно)Н-ЯМР (CDCI3, 5) 1 ЗО (м, 2Н) 1 87 (м, 2Н) етил]-феніл}-піридин-2-іламш виготовили депроте2 65 (м, ЗН), 2 81 (м 2Н), 2 88 (м, 2Н), 3 13 (м, 2Н), ктуванням прикладу 94 трифлуороцтовою кисло4 54 (шс 2Н), 6 42 (d J=8, 1H), 7 04 (д J=8, 1H), тою у метиленхлориді (вихід 92%), а як пдрохло7 25 (м 2Н), 7 46 (т, J=8, 1Н), 7 83 (м, 2Н) 13 рид - з етилового етеру С-ЯМР (СОСІз, 5) 32 3, 36 1, 44 2, 47 7, 53 9, 1 Н-ЯМР (CDCI3, 5) 1 35 (шс, 2Н) 1 58 (м, 1Н), 107 0, 110 7, 127 0 128 9, 137 8, 138 4 140 3, 1 69 (м 1Н) 1 85 (м, 1Н), 2 07 (м, 1Н), 2 60 (м, 2Н) 155 95, 158 3 2 74 (м, 1Н), 2 79 (м, 2Н), 2 81 (м, 4Н), 4 47 (шс, МС (%) 297 (продукт + 1, 10), 199 (35), 149 2Н), 6 41 (д, J=8, 1Н), 7 04 (д, J=8, 1Н) 7 23 (м, (100), 119(30) 2Н), 7 46 (т, J=8, 1Н) 7 82 (м, 2Н) Аналіз розраховано для C18H24N4 • ЗНСІ • 13 С-ЯМР (CDCI3, 5) 23 8, 33 3, 34 2, 48 1, 53 6 1/4Н2О • 1/2С4Ню0 С 53 70, Н 7 32, N 12 52 60 6 62 7, 106 8 110 7, 126 8 128 9, 137 5, 138 3, Знайдено С 53 61, Н 6 99, N 1218 141 1, 1560 1582 Приклад 99 6-{4-[2-((піперидин-4-ілметил)FAB МС (%) 297 (продукт + 1, 12), 167925), амшо)-етил]-феніл} -піридин-2-іламш 149(100), 119(27), 111 (25) виготовили способом за прикладом 1 з 4Аналіз розраховано для C18H24N4 • ЗНСІ • амінометилпіперидину з депротектуванням трифСН2О • 1/4С4Ню0 С 51 59, Н 7 18, N 12 67 Знайлуороцтовою кислотою у метиленхлориді (вихід дено С 51 86, Н7 23, N 12 31 80,5%), як пдрохлорид 1 Приклад 96 6-{4-[2-(1-бензил піперидин-4Н-ЯМР (CDCI3, 5) 1 25 (м, ЗН), 1 87 (м, 2Н), іламшо)-етил]-феніл}-піридин-2-іламш 2 65 (м 2Н), 2 81 (м 2Н), 2 88 (м, 2Н), 3 13 (м, 2Н), виготовили способом за прикладом 1 з 14 54 (шс 2Н) 6 42 (д, J=8 1H) 7 04 (д, J=8, 1H), бензил-4-амшопіперидину (вихід 82%), очистку 7 26 (м, 2Н), 7 46 (т, J=8, 1Н), 7 83 (м 2Н) 13 здійснили утворенням т-бутилкарбаматного похідС-ЯМР (CDCI3, 5) 32 3, 36 1 44 2, 47 7, 53 9, ного, його хроматографуванням та депротекту107 0, 110 7 127 0, 128 9, 137 8, 138 4, 140 3 ванням трифлуороцтовою кислотою у метилен155 95, 158 3 хлориді як пдрохлорид FAB МС (%) 297 (продукт + 1, 16) 199 (35),
ДивитисяДодаткова інформація
Назва патенту англійською6-phenyl-pyridin-2-ylamine derivatives, pharmaceutical composition, method of inhibition of of nitric oxide syntase of mammals and method of treatment
Назва патенту російськоюПроизводные 6-фенилпиридил-2-амина, фармацевтическая композиция, способ ингибирования синтазы оксида нитрогена у млекопитающих и способ лечения
МПК / Мітки
МПК: A61P 25/00, A61K 31/00, A61P 15/00, A61P 25/16, A61P 1/00, A61P 11/00, A61P 25/30, C07D 487/08, A61P 19/02, A61P 19/00, A61K 31/44, C07D 401/10, A61P 25/06, C07D 471/10, C07D 451/04, C07D 405/12, C07D 498/08, A61P 27/06, A61P 15/08, A61P 25/28, C07D 409/12, A61P 25/26, A61P 37/00, C07D 417/12, A61P 43/00, A61P 9/00, A61P 29/00, A61P 27/00, A61P 9/02, C07D 401/12, C07D 213/73, A61P 3/00
Мітки: інгібування, фармацевтична, ссавців, композиція, 6-фенілпіридил-2-аміну, синтази, оксиду, похідні, нітрогену, лікування, спосіб
Код посилання
<a href="https://ua.patents.su/45-49006-pokhidni-6-fenilpiridil-2-aminu-farmacevtichna-kompoziciya-sposib-ingibuvannya-sintazi-oksidu-nitrogenu-u-ssavciv-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 6-фенілпіридил-2-аміну, фармацевтична композиція, спосіб інгібування синтази оксиду нітрогену у ссавців та спосіб лікування</a>