Похідні піразолу, композиція, що містить ці сполуки, і спосіб застосування (варіанти)
Номер патенту: 85884
Опубліковано: 10.03.2009
Автори: Лян Жуй, Пармі Емма Р., Го Цзянь, Сюн Юйшен, Броканьєр Лінда
Формула / Реферат
1. Сполука, представлена формулою І:
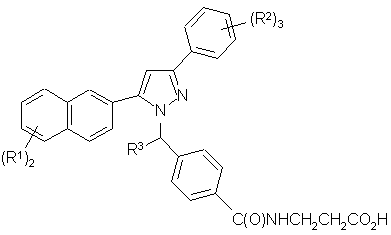 , I
, I
або її фармацевтично прийнятна сіль або сольват, де:
кожний R1 означає Н або вибраний із групи, яка складається з:
(a) галогену, ОН, CO2R4, CN, SOpR5 або NO2,
(b) С1-6алкілу або ОС1-6алкілу, необов'язково заміщеного:
(1) 1-5 галогеногрупами аж до утворення пергалогеналкільної групи;
(2) CO2R4;
(3) фенілом, необов'язково заміщеним у такий спосіб:
(і) 1-5 галогеногрупами,
(іі) 1 CO2R4, CN, S(O)pR5, NO2 або C(O)NR6R7 групою,
(ііі) 1-2 С1-10алкільними або алкоксильними групами, причому кожна необов'язково заміщена: 1-5 атомами галогену аж до утворення пергалогеналкілу, і 1-2 ОН або CO2R4 групами;
кожний R2 вибраний з R1, визначеного вище, або дві R2 групи, узяті разом, можуть утворювати конденсовану 5-6-членну циклічну структуру, що містить 1-2 атоми кисню й 1-2 атоми вуглецю, кожний з яких необов'язково заміщений 1-2 атомами F;
R3 означає Н або С1-3алкіл;
R4 означає Н або С1-6алкіл, і
R5 вибраний із групи, яка складається з: С1-10алкілу, фенілу, нафтилу або Аr-С1-10алкілу, де Аr вибраний з фенілу і нафтилу;
R6 і R7 кожний незалежно являє собою Н або С1-3алкіл, і р означає 0, 1 або 2.
2. Сполука за п. 1, де
один R1 означає Н і інший означає Н або вибраний із групи, яка складається з: (а) галогену, ОН, CO2R4, CN, SOpR5 або NO2, (b) C1-6алкілу або ОС1-6алкілу, необов'язково заміщеного: (1) 1-5 галогеногрупами аж до утворення пергалогеналкільної групи; (2) CO2R4; (3) фенілом, необов'язково заміщеним у такий спосіб: (і) 1-5 галогеногрупами, (іі) 1 CO2R4, CN, S(O)pR5, NO2 або C(O)NR6R7 групою, (ііі) 1-2 С1-10алкільними або алкоксильними групами, причому кожна необов'язково заміщена: 1-5 атомами галогену, аж до утворення пергалогеналкілу, і 1-2 ОН або CO2R4 групами.
3. Сполука за п. 2, де один R1 означає Н і інший означає Н або вибраний із групи, яка складається з: (а) галогену або ОН; і (b) С1-4алкілу або ОС1-4алкілу, кожний з яких необов'язково заміщений 1-3 галогеногрупами.
4. Сполука за п. 1, де кожний R2 означає Н або вибраний із групи, яка складається з: (а) галогену, вибраного з Сl і F, (b) С1-6алкілу або ОС1-6алкілу, необов'язково заміщеного 1-3 галогеногрупами, або дві R2 групи, узяті разом, утворюють конденсовану 5-6-членну циклічну структуру, що містить 1-2 атоми кисню й 1-2 атоми вуглецю, кожний з яких необов'язково заміщений 1-2 атомами F.
5. Сполука за п. 1, де R3 означає Н або метил.
6. Сполука за п. 1, де
один R1 означає Н і інший означає Н або вибраний із групи, яка складається з:
(a) галогену, ОН, CO2R4, CN, SOpR5 або NO2,
(b) С1-6алкілу або ОС1-6алкілу, необов'язково заміщеного:
(1) 1-5 галогеногрупами аж до утворення пергалогеналкільної групи;
(2) CO2R4;
(3) фенілом, необов'язково заміщеним у такий спосіб:
(і) 1-5 галогеногрупами,
(іі) 1 CO2R4, CN, S(O)pR5, NO2 або C(O)NR6R7 групою,
(ііі) 1-2 С1-10алкільними або алкоксильними групами, причому кожна необов'язково заміщена: 1-5 атомами галогену, аж до утворення пергалогеналкілу, і 1-2 ОН або CO2R4 групами;
кожний R2 означає Н або вибраний із групи, яка складається з: (а) галогену, вибраного з Сl і F, (b) С1-6алкілу або ОС1-6алкілу, необов'язково заміщеного 1-3 галогеногрупами, або дві R2 групи, узяті разом, утворюють конденсовану 5-6-членну циклічну структуру, що містить 1-2 атоми кисню й 1-2 атоми вуглецю, кожний з яких необов'язково заміщений 1-2 атомами F: і
R3 означає Н або метил;
R4 означає Н або С1-6алкіл;
R5 вибраний із групи, яка складається з: С1-10алкілу, фенілу, нафтилу або Аr-С1-10алкілу, Аr вибраний з фенілу або нафтилу;
R6 і R7 кожний незалежно являє собою Н або С1-3алкіл, і р означає 0, 1 або 2.
7. Сполука за п. 1 або її фармацевтично прийнятна сіль або сольват, де один R1 являє собою Н і інший вибраний з Сl, F, CF3 або ОС1-3алкілу;
R2 являє собою галоген, CF3, ОС1-3алкіл або OCF3, і
R3 означає Н або метил.
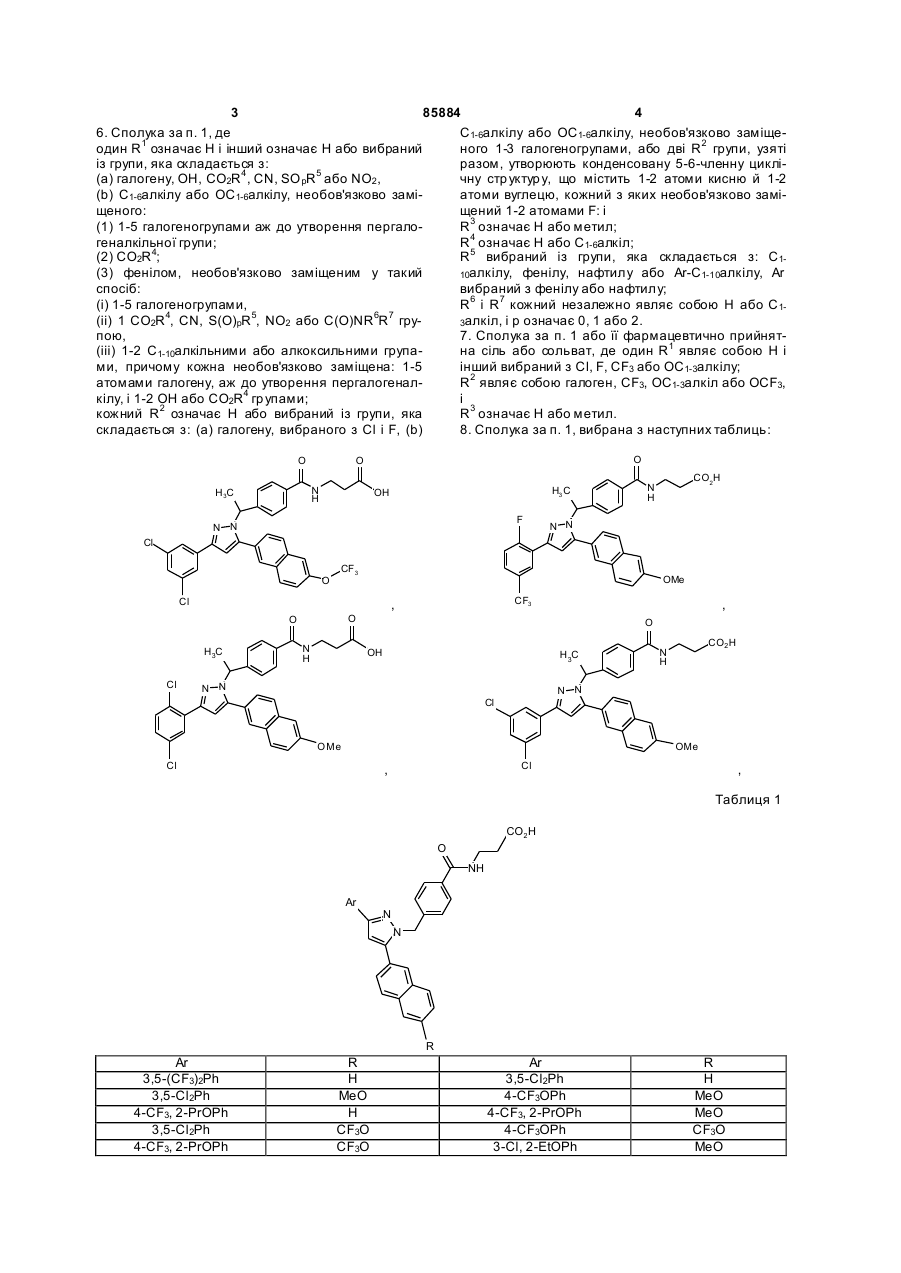
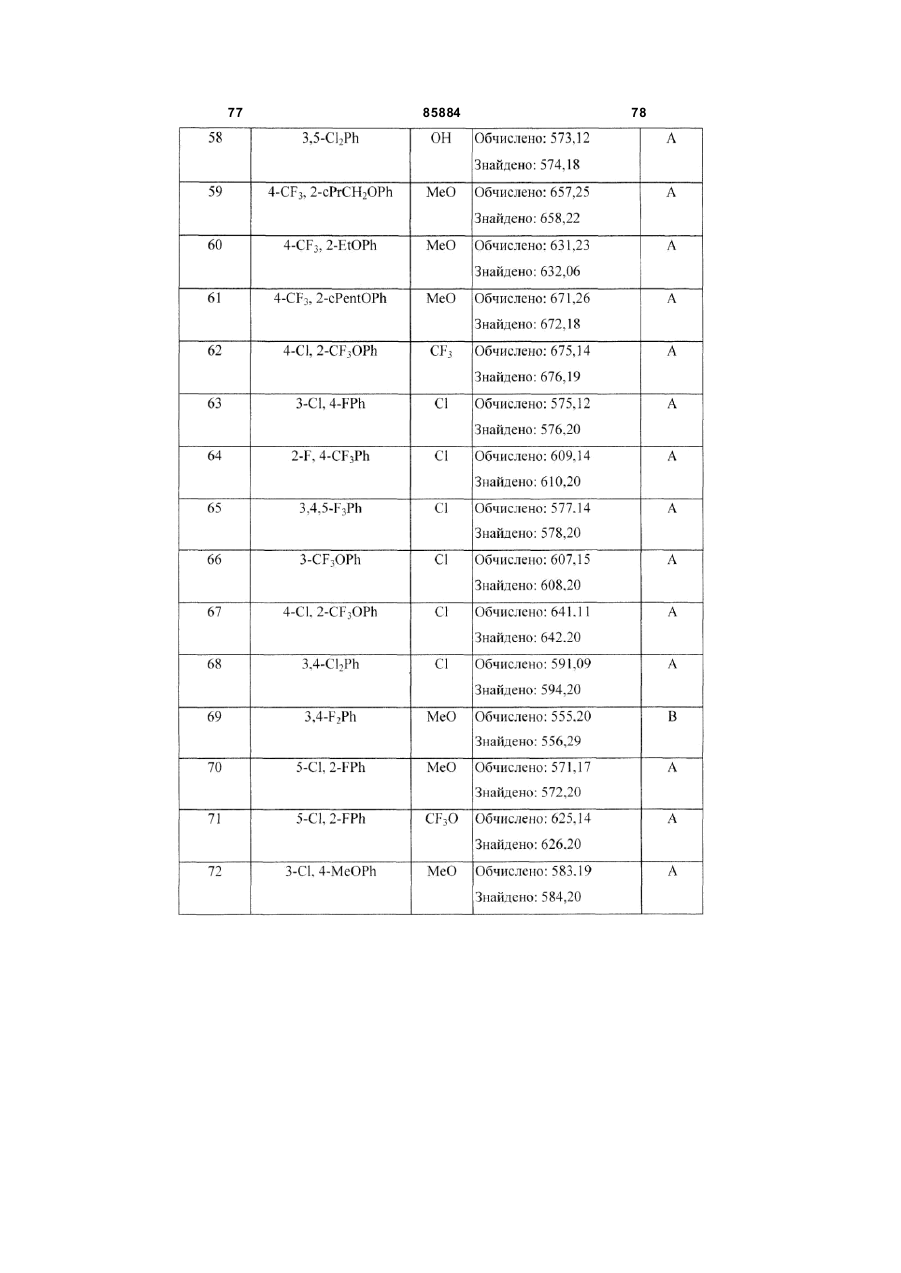
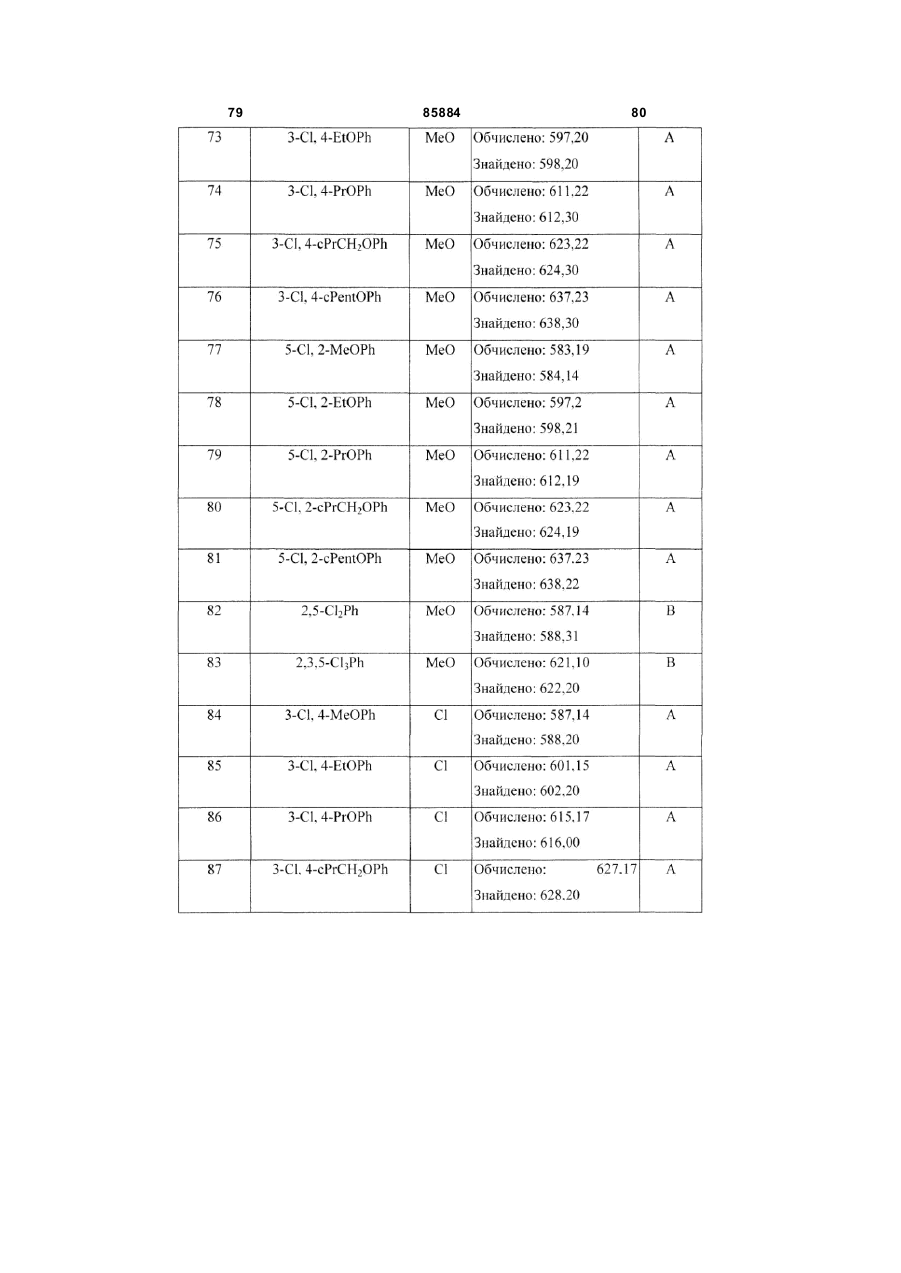
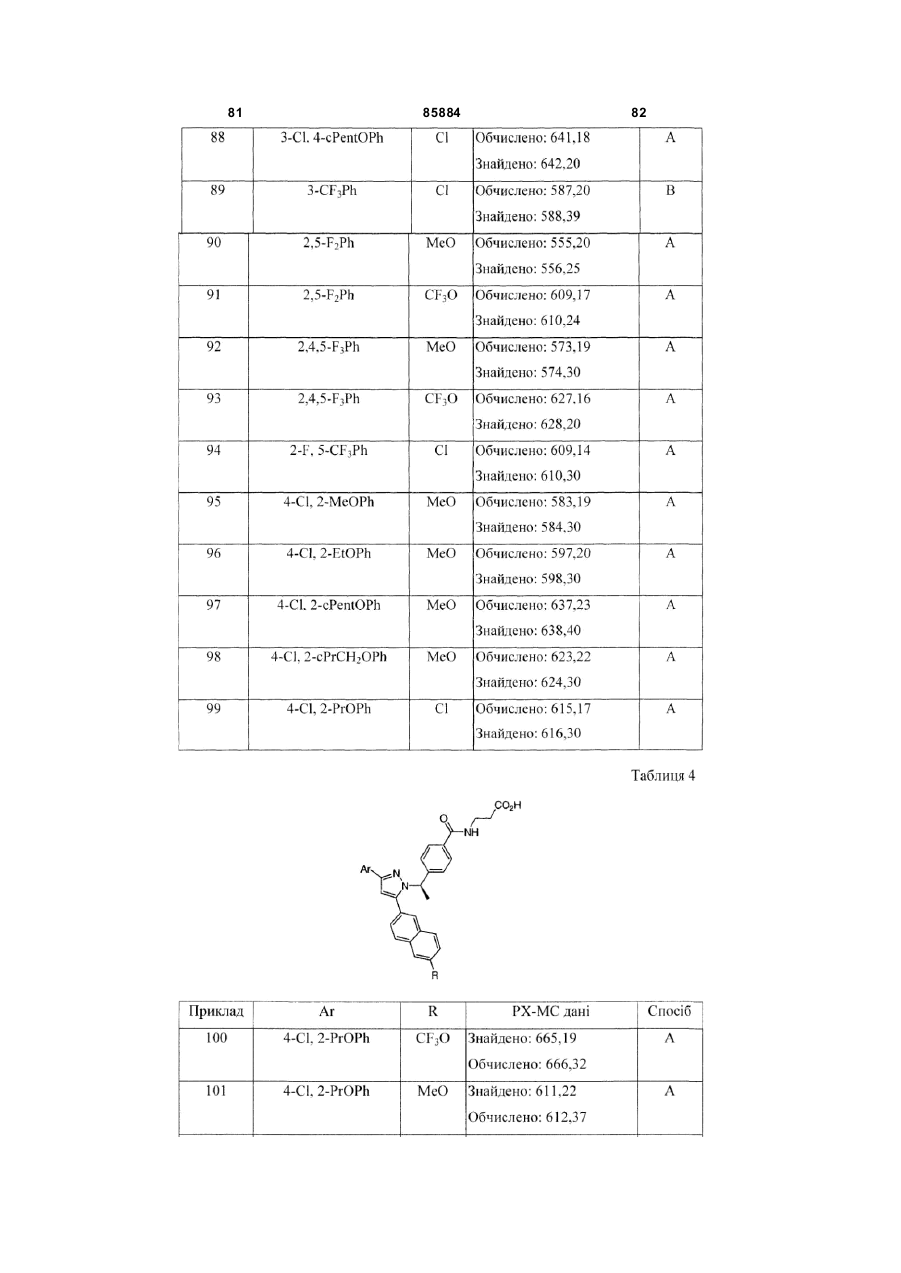
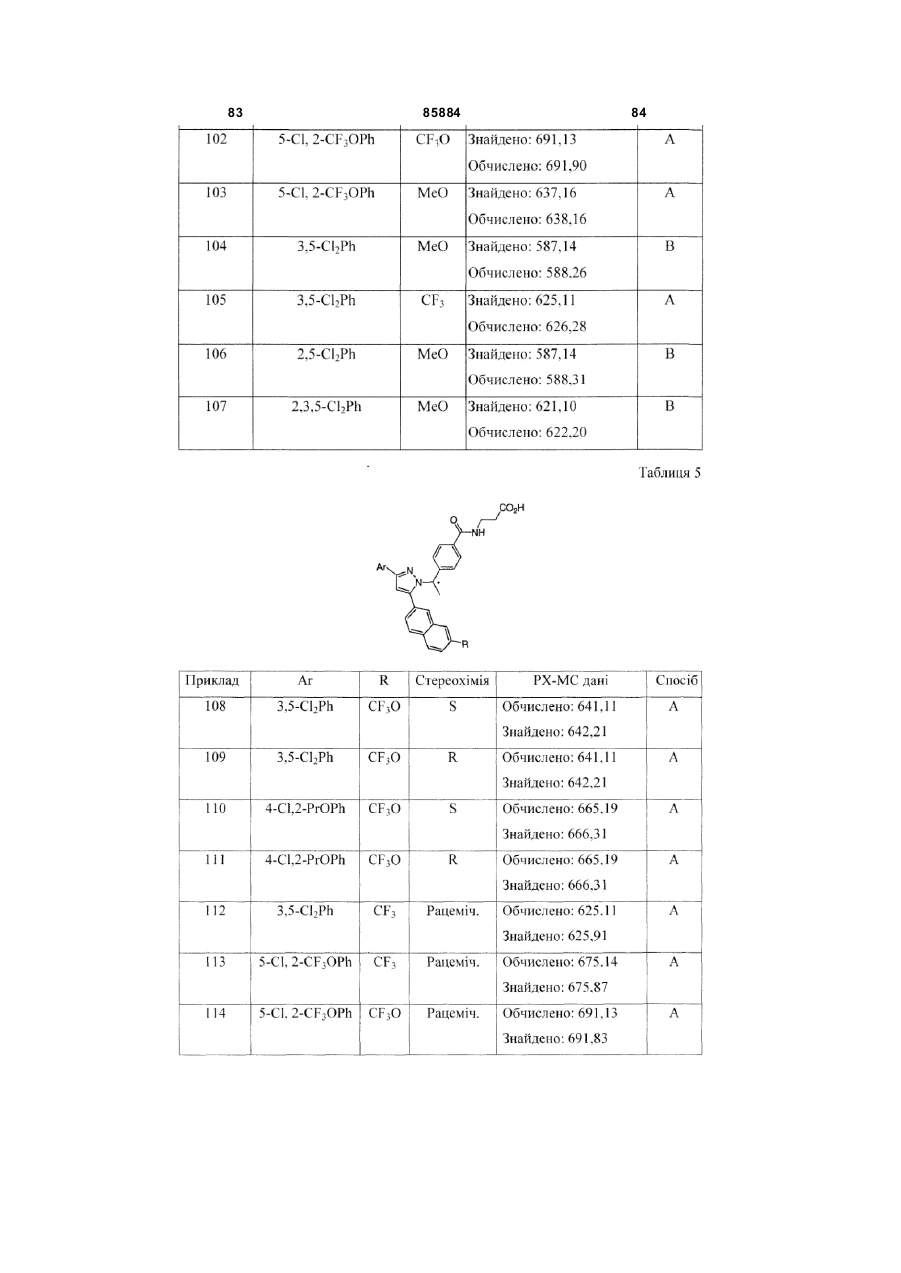
8. Сполука за п. 1, вибрана з наступних таблиць:
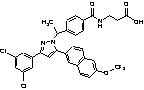 ,
,
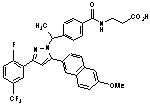 ,
,
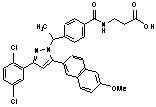 ,
,
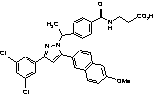 ,
,
Таблиця 1

Ar
R
Ar
R
3,5-(CF3)2Ph
H
3,5-Cl2Ph
H
3,5-Cl2Ph
MeO
4-CF3OPh
MeO
4-CF3, 2-PrOPh
H
4-CF3, 2-PrOPh
MeO
3,5-Cl2Ph
CF3O
4-CF3OPh
CF3O
4-CF3, 2-PrOPh
CF3O
3-Cl, 2-EtOPh
MeO
4-Cl, 3-FPh
MeO
2,4-F2Ph
MeO
2-CF3OPh
MeO
2-EtOPh
MeO
2-F, 5-CF3Ph
MeO
4-Cl, 2-EtOPh
MeO
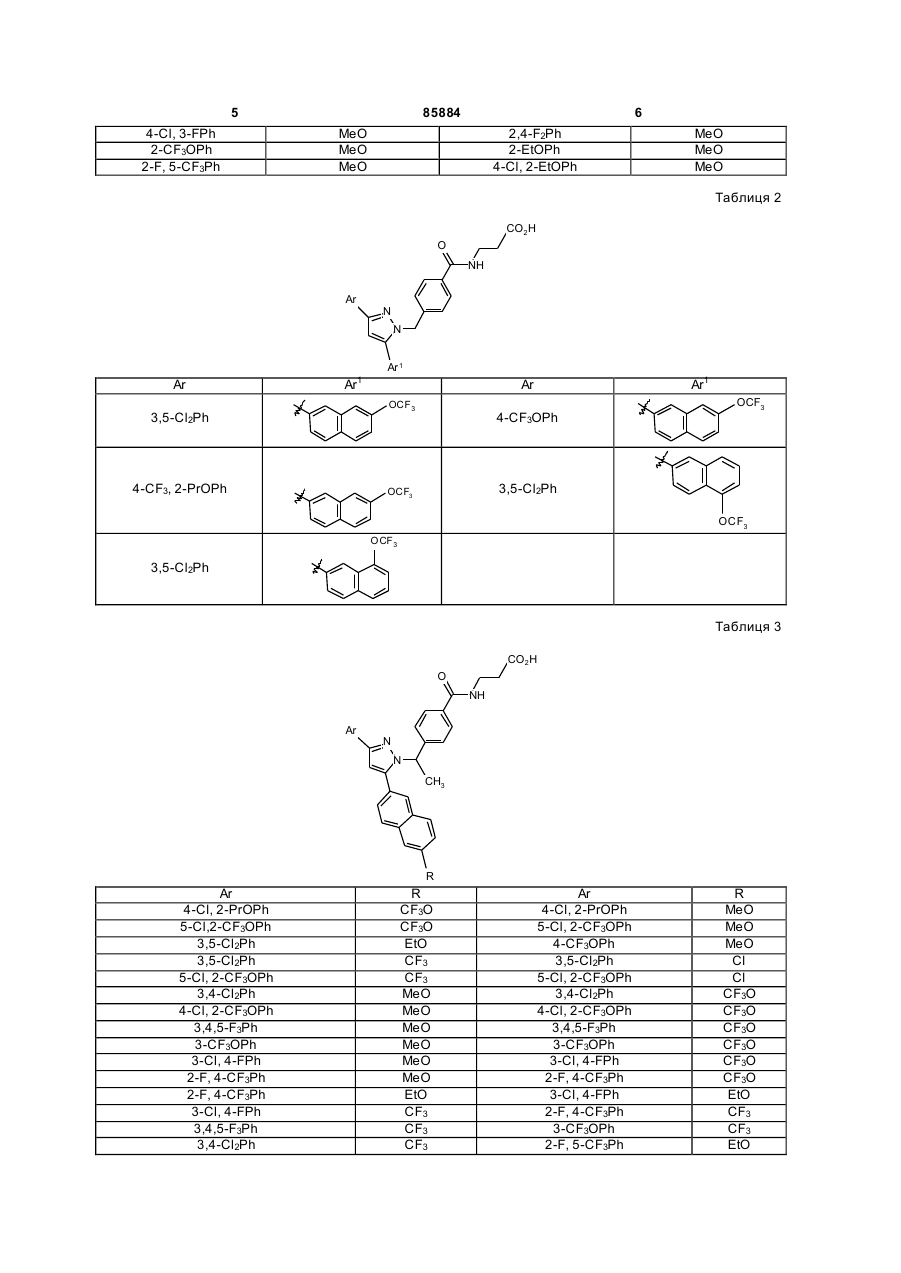
Таблиця 2
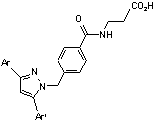
Ar
Ar1
Ar
Ar1
3,5-Cl2Ph
![]()
4-CF3OPh
![]()
4-CF3, 2-PrOPh
![]()
3,5-Cl2Ph
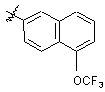
3,5-Cl2Ph
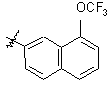
Таблиця 3
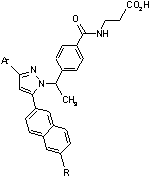
Ar
R
Ar
R
4-Cl, 2-PrOPh
CF3O
4-Cl, 2-PrOPh
MeO
5-Cl,2-CF3OPh
CF3O
5-Cl, 2-CF3OPh
MeO
3,5-Cl2Ph
EtO
4-CF3OPh
MeO
3,5-Cl2Ph
CF3
3,5-Cl2Ph
Cl
5-Cl, 2-CF3OPh
CF3
5-Cl, 2-CF3OPh
Cl
3,4-Cl2Ph
MeO
3,4-Cl2Ph
CF3O
4-Cl, 2-CF3OPh
MeO
4-Cl, 2-CF3OPh
CF3O
3,4,5-F3Ph
MeO
3,4,5-F3Ph
CF3O
3-CF3OPh
MeO
3-CF3OPh
CF3O
3-Cl, 4-FPh
MeO
3-Cl, 4-FPh
CF3O
2-F, 4-CF3Ph
MeO
2-F, 4-CF3Ph
CF3O
2-F, 4-CF3Ph
EtO
3-Cl, 4-FPh
EtO
3-Cl, 4-FPh
CF3
2-F, 4-CF3Ph
CF3
3,4,5-F3Ph
CF3
3-CF3OPh
CF3
3,4-Cl2Ph
CF3
2-F, 5-CF3Ph
EtO
2-F, 5-CF3Ph
CF3O
3,5-Cl2Ph
OH
4-CF3, 2-cPrCH2OPh
MeO
4-CF3, 2-EtOPh
MeO
4-CF3, 2-cPentOPh
MeO
4-Cl, 2-CF3OPh
CF3
3-Cl, 4-FPh
Cl
2-F, 4-CF3Ph
Cl
3,4,5-F3Ph
Cl
3-CF3OPh
Cl
4-Cl, 2-CF3OPh
Cl
3,4-Cl2Ph
Cl
3,4-F2Ph
MeO
5-Cl, 2-FPh
MeO
5-Cl, 2-FPh
CF3O
3-Cl, 4-MeOPh
MeO
3-Cl, 4-EtOPh
MeO
3-Cl, 4-PrOPh
MeO
3-Cl, 4-cPrCH2OPh
MeO
3-Cl, 4-cPentOPh
MeO
5-Cl, 2-MeOPh
MeO
5-Cl, 2-EtOPh
MeO
5-Cl, 2-PrOPh
MeO
5-Cl, 2-cPrCH2OPh
MeO
5-Cl, 2-cPentOPh
MeO
2,5-Cl2Ph
MeO
2,3,5-Cl3Ph
MeO
3-Cl, 4-MeOPh
Cl
3-Cl, 4-EtOPh
Cl
3-Cl, 4-PrOPh
Cl
3-Cl, 4-cPrCH2OPh
Cl
3-Cl, 4-cPentOPh
Cl
3-CF3Ph
Cl
2,5-F2Ph
MeO
2,5-F2Ph
CF3O
2,4,5-F3Ph
MeO
2,4,5-F3Ph
CF3O
2-F, 5-CF3Ph
Cl
4-Cl, 2-MeOPh
MeO
4-Cl, 2-EtOPh
MeO
4-Cl, 2-cPentOPh
MeO
4-Cl, 2-cPrCH2OPh
MeO
4-Cl, 2-PrOPh
Cl
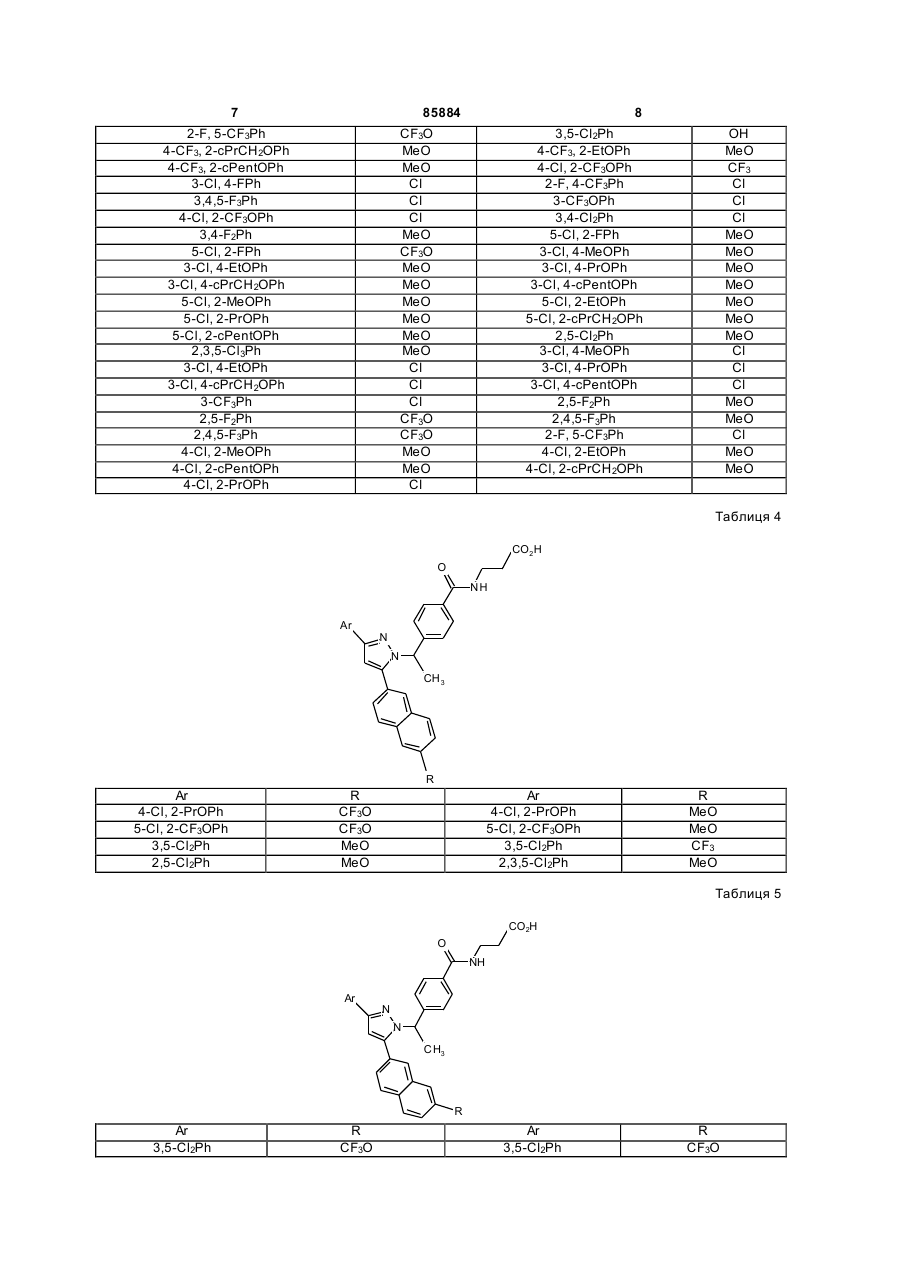
Таблиця 4

Аr
R
Ar
R
4-Cl, 2-PrOPh
CF3O
4-Cl, 2-PrOPh
MeO
5-Cl, 2-CF3OPh
CF3O
5-Cl, 2-CF3OPh
MeO
3,5-Cl2Ph
MeO
3,5-Cl2Ph
CF3
2,5-Cl2Ph
MeO
2,3,5-Cl2Ph
MeO
Таблиця 5
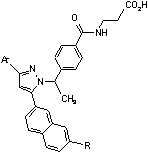
Ar
R
Ar
R
3,5-Cl2Ph
CF3O
3,5-Cl2Ph
CF3O
4-Cl, 2-PrOPh
CF3O
4-Cl, 2-PrOPh
CF3O
3,5-Cl2Ph
CF3
5-C1, 2-CF3OPh
CF3
5-C1, 2-CF3OPh
CF3O
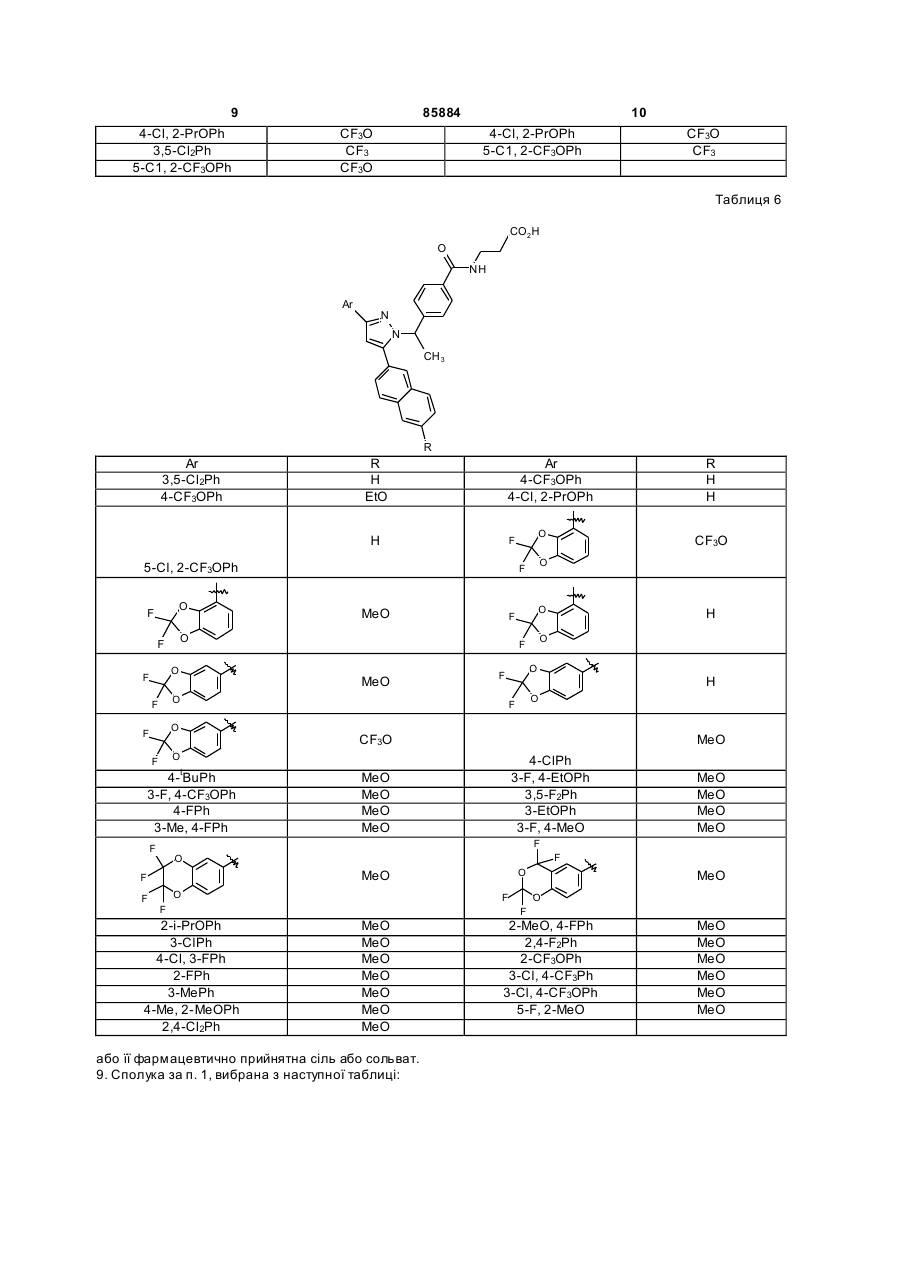
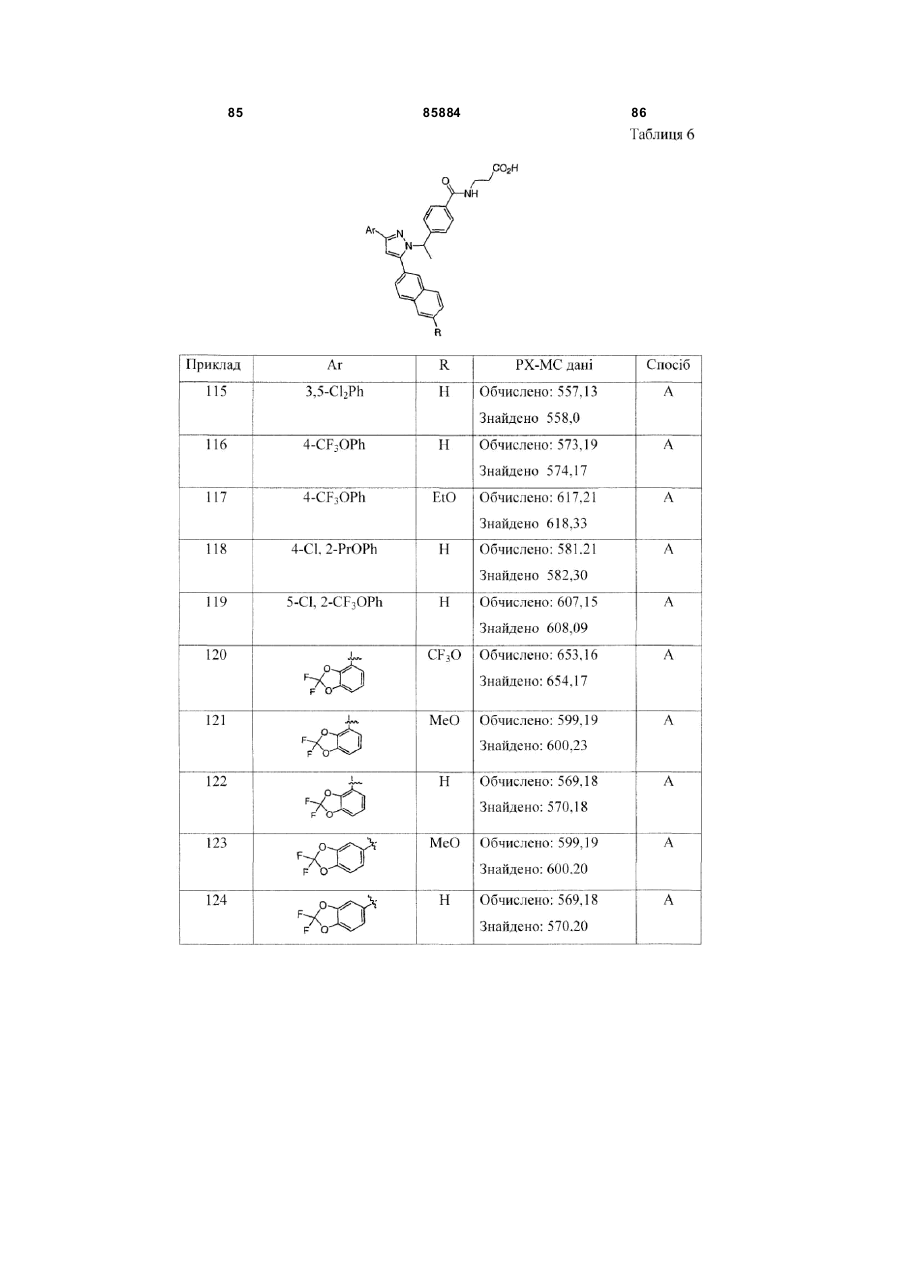
Таблиця 6
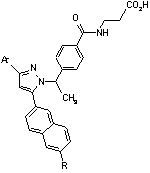
Ar
R
Ar
R
3,5-Cl2Ph
H
4-CF3OPh
H
4-CF3OPh
EtO
4-Cl, 2-PrOPh
H
5-Cl, 2-CF3OPh
H
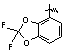
CF3O
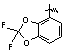
MeO
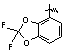
H
![]()
MeO
![]()
H
![]()
CF3O
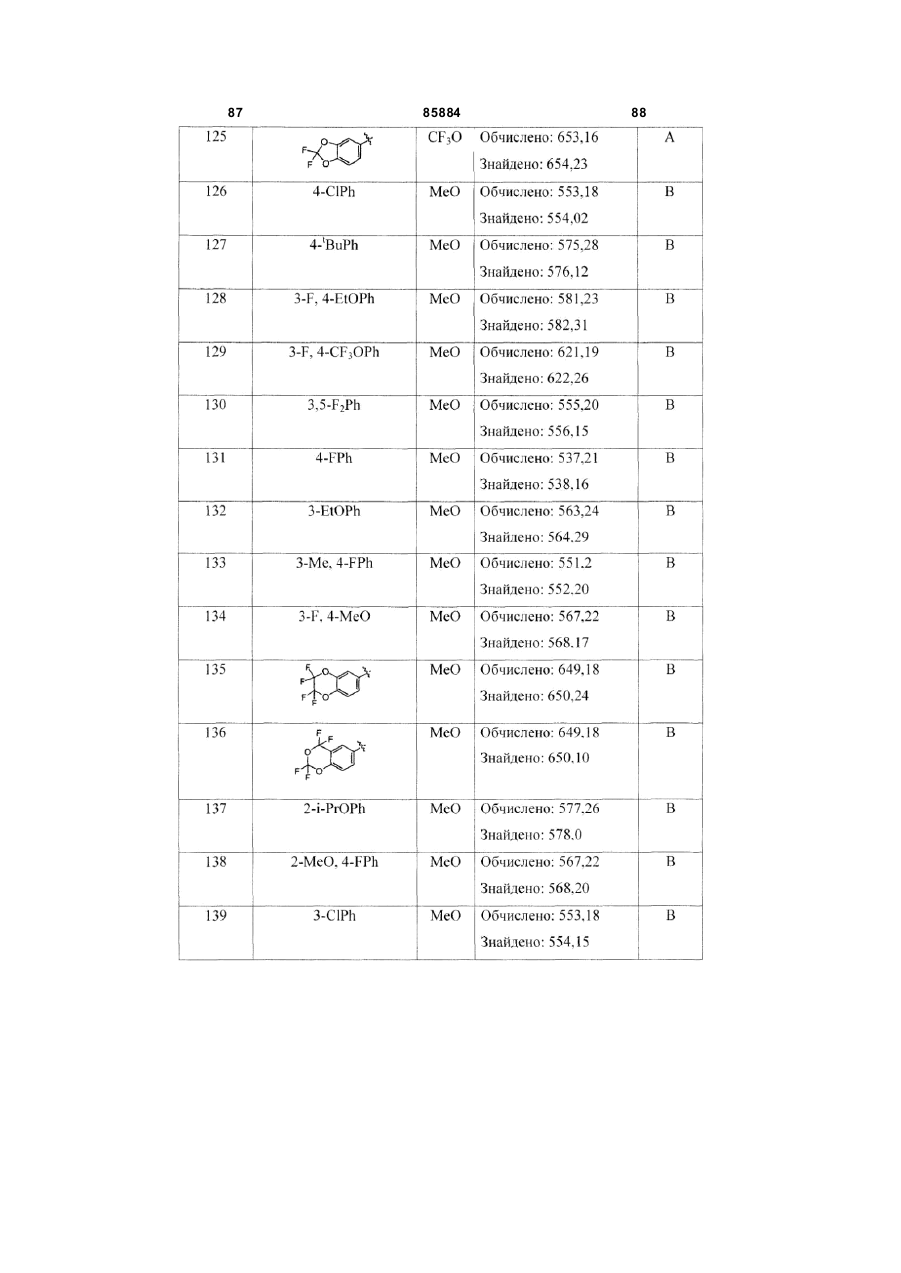
4-ClPh
MeO
4-tBuPh
MeO
3-F, 4-EtOPh
MeO
3-F, 4-CF3OPh
MeO
3,5-F2Ph
MeO
4-FPh
MeO
3-EtOPh
MeO
3-Me, 4-FPh
MeO
3-F, 4-MeO
MeO
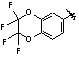
MeO
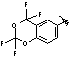
MeO
2-i-PrOPh
MeO
2-MeO, 4-FPh
MeO
3-ClPh
MeO
2,4-F2Ph
MeO
4-Cl, 3-FPh
MeO
2-CF3OPh
MeO
2-FPh
MeO
3-Cl, 4-CF3Ph
MeO
3-MePh
MeO
3-Cl, 4-CF3OPh
MeO
4-Me, 2-MeOPh
MeO
5-F, 2-MeO
MeO
2,4-Cl2Ph
MeO
або її фармацевтично прийнятна сіль або сольват.
9. Сполука за п. 1, вибрана з наступної таблиці:
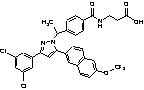 ,
,
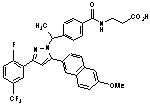 ,
,
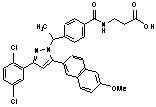 ,
,
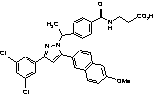 ,
,
або її фармацевтично прийнятна сіль або сольват.
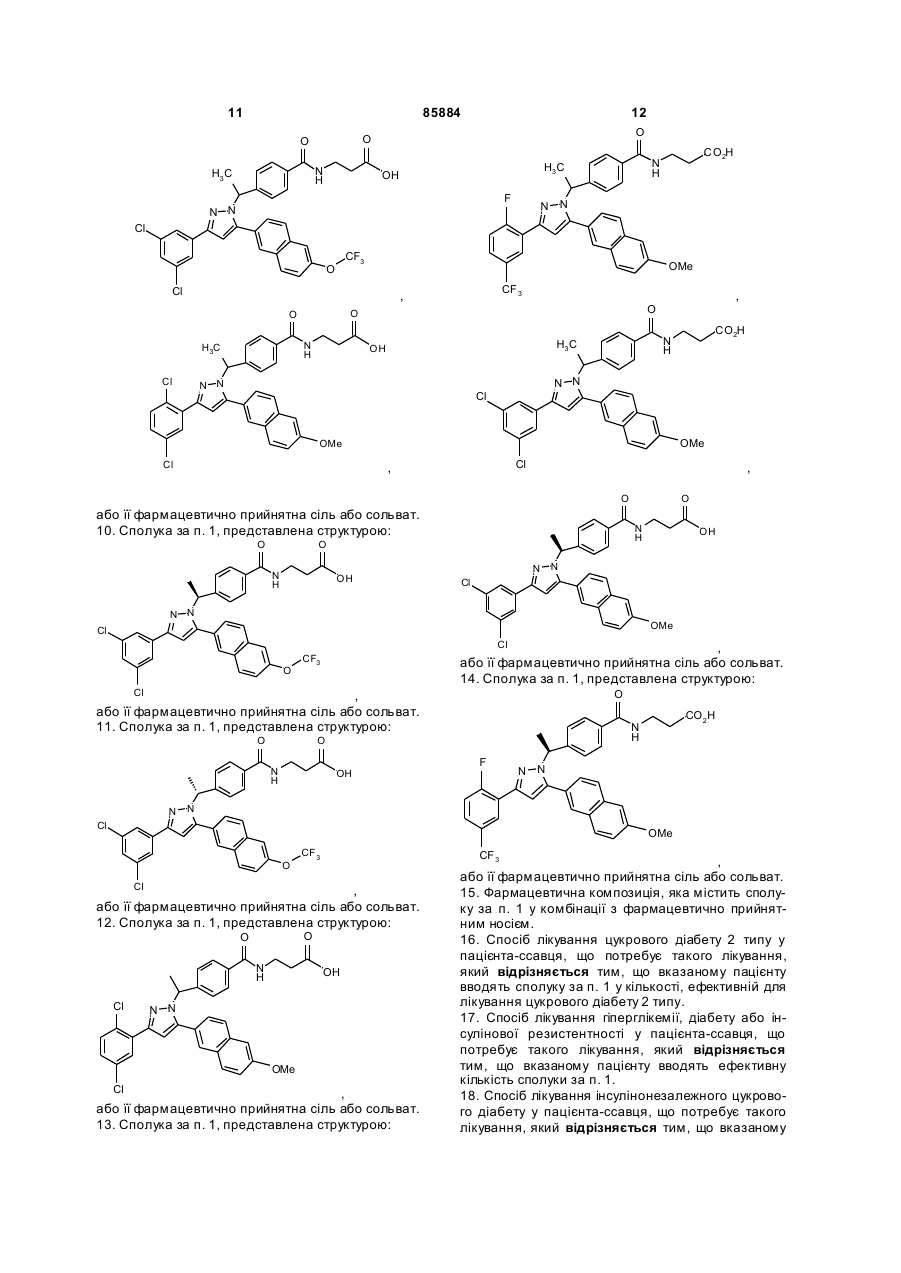
10. Сполука за п. 1, представлена структурою:
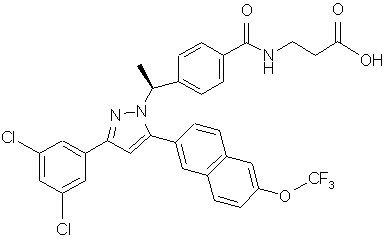 ,
,
або її фармацевтично прийнятна сіль або сольват.
11. Сполука за п. 1, представлена структурою:
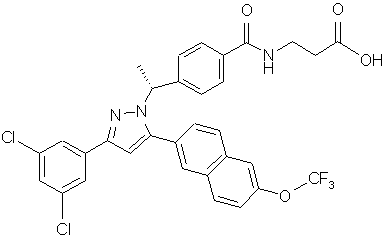 ,
,
або її фармацевтично прийнятна сіль або сольват.
12. Сполука за п. 1, представлена структурою:
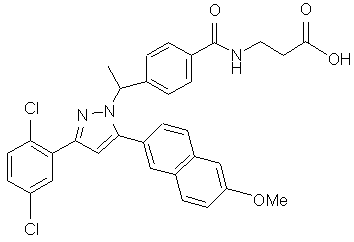 ,
,
або її фармацевтично прийнятна сіль або сольват.
13. Сполука за п. 1, представлена структурою:
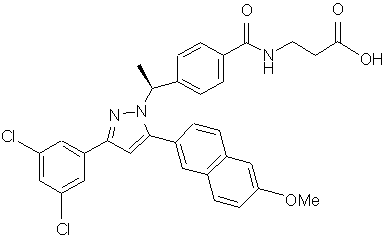 ,
,
або її фармацевтично прийнятна сіль або сольват.
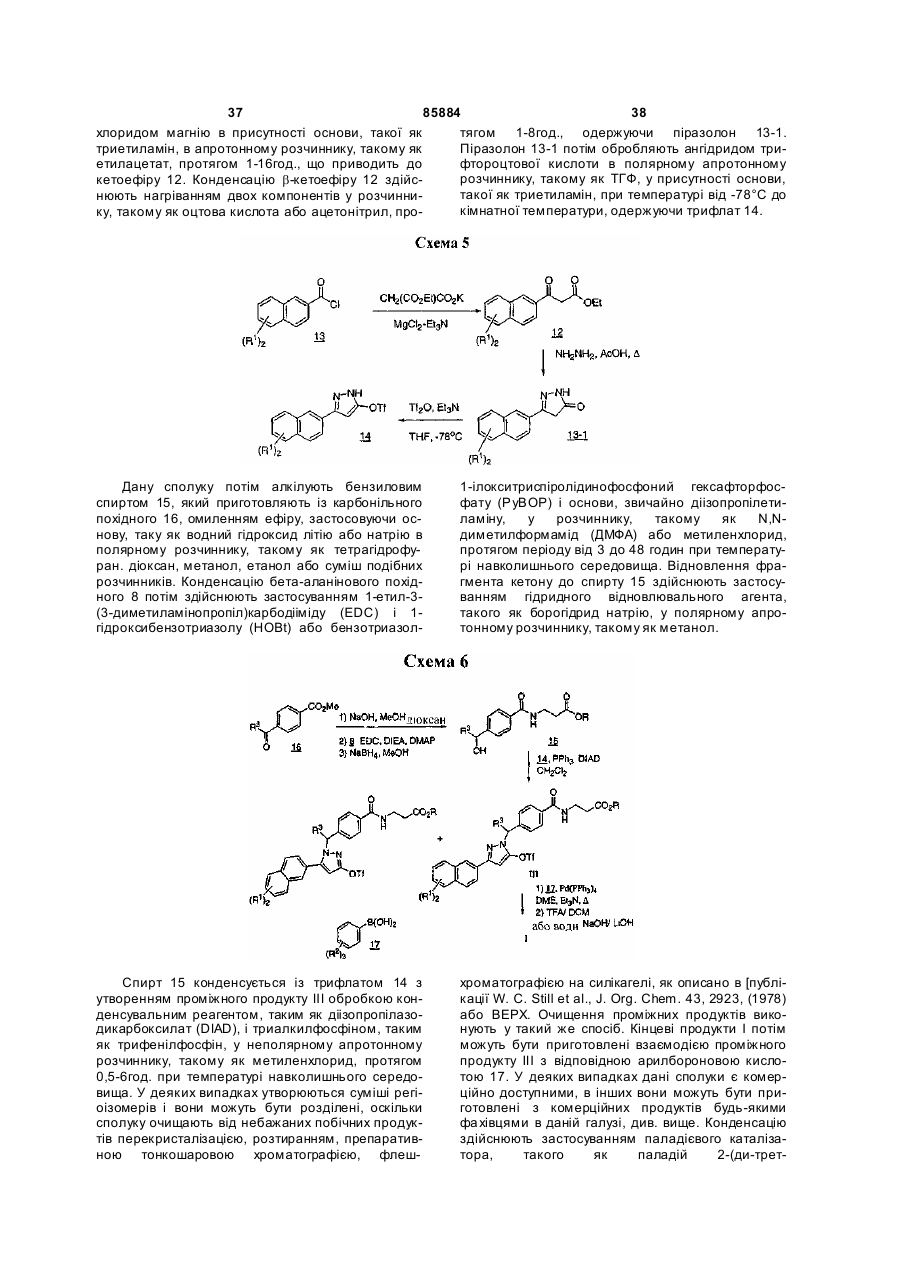
14. Сполука за п. 1, представлена структурою:
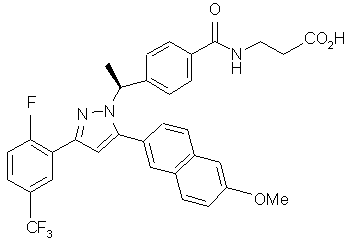 ,
,
або її фармацевтично прийнятна сіль або сольват.
15. Фармацевтична композиція, яка містить сполуку за п. 1 у комбінації з фармацевтично прийнятним носієм.
16. Спосіб лікування цукрового діабету 2 типу у пацієнта-ссавця, що потребує такого лікування, який відрізняється тим, що вказаному пацієнту вводять сполуку за п. 1 у кількості, ефективній для лікування цукрового діабету 2 типу.
17. Спосіб лікування гіперглікемії, діабету або інсулінової резистентності у пацієнта-ссавця, що потребує такого лікування, який відрізняється тим, що вказаному пацієнту вводять ефективну кількість сполуки за п. 1.
18. Спосіб лікування інсулінонезалежного цукрового діабету у пацієнта-ссавця, що потребує такого лікування, який відрізняється тим, що вказаному пацієнту вводять протидіабетичну ефективну кількість сполуки за п. 1.
19. Спосіб лікування ожиріння у пацієнта-ссавця, що потребує такого лікування, який відрізняється тим, що вказаному пацієнту вводять сполуку за п. 1 у кількості, ефективній для лікування ожиріння.
20. Спосіб лікування ліпідного розладу, вибраного із групи, яка складається з дисліпідемії, гіперліпідемії. гіпертригліцеридемії, гіперхолестеринемії. низького рівня HDL і високого рівня LDL, у пацієнта-ссавця. що потребує такого лікування, який відрізняється тим, що вказаному пацієнту вводять сполуку за п. 1 у кількості, ефективній для лікування зазначеного ліпідного розладу.
21. Спосіб лікування атеросклерозу у пацієнта-ссавця, що потребує такого лікування, який відрізняється тим, що вказаному пацієнту вводять сполуку за п. 1 у кількості, ефективній для лікування атеросклерозу.
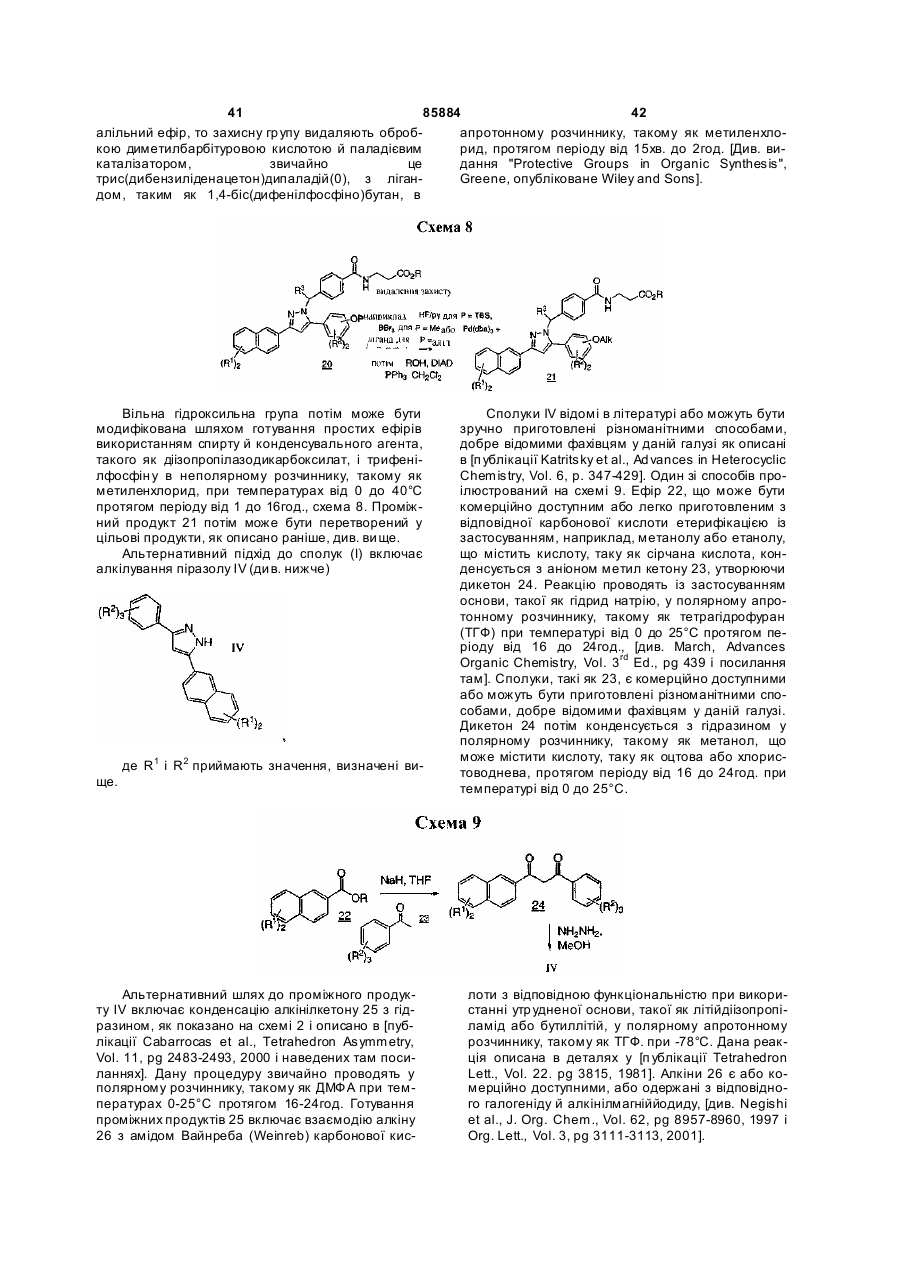
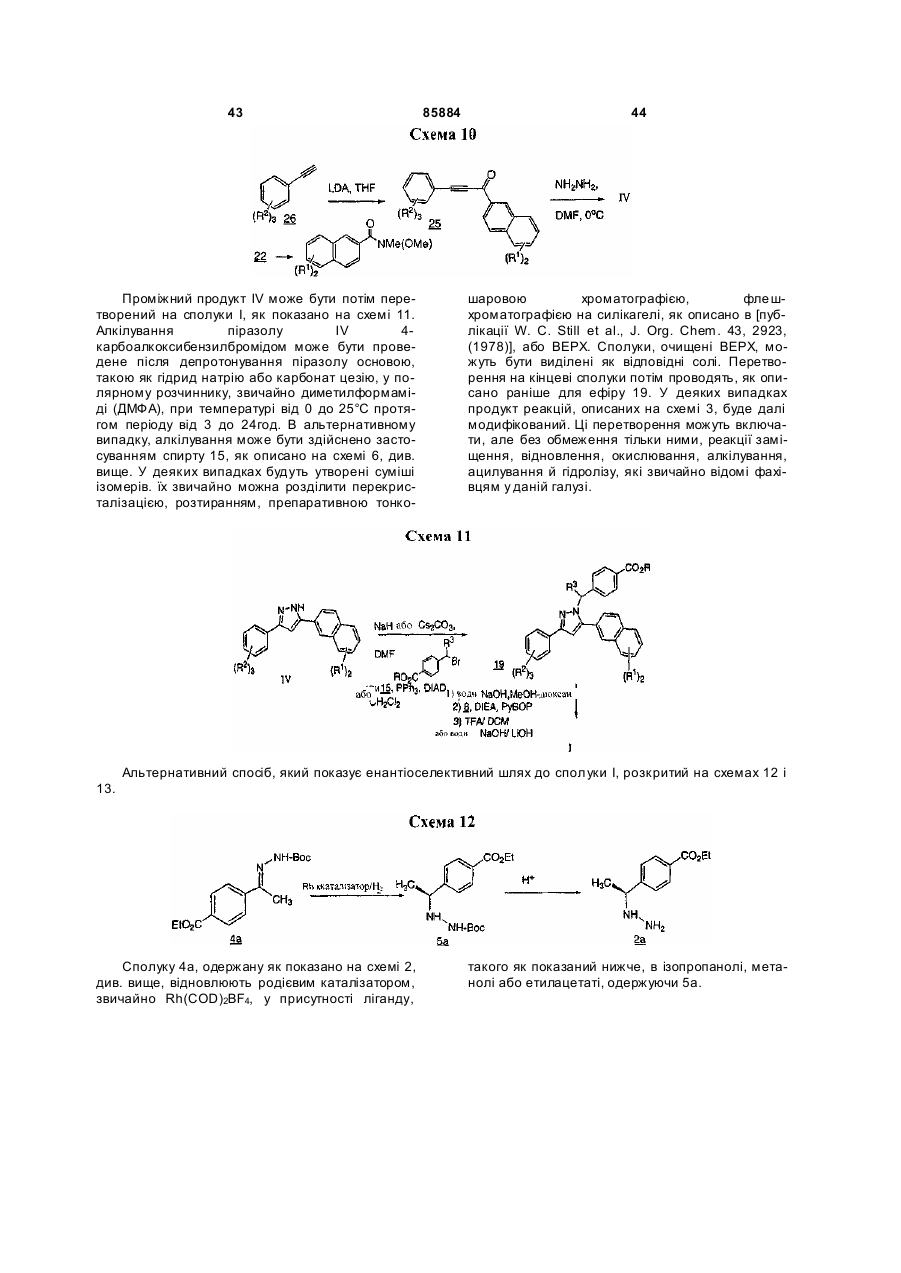
Текст
1. Сполука, представлена формулою І: C2 2 (19) 1 3 85884 4 6. Сполука за п. 1, де С1-6алкілу або ОС 1-6алкілу, необов'язково заміщеодин R1 означає Н і інший означає Н або вибраний ного 1-3 галогеногрупами, або дві R2 групи, узяті із групи, яка складається з: разом, утворюють конденсовану 5-6-членну циклі(a) галогену, ОН, CO2R4 , CN, SO pR5 або NO2 , чну стр уктур у, що містить 1-2 атоми кисню й 1-2 (b) С1-6алкілу або ОС 1-6алкілу, необов'язково заміатоми вуглецю, кожний з яких необов'язково заміщеного: щений 1-2 атомами F: і (1) 1-5 галогеногрупами аж до утворення пергалоR3 означає Н або метил; геналкільної групи; R4 означає Н або С1-6алкіл; 4 (2) CO2R ; R5 вибраний із групи, яка складається з: С1(3) фенілом, необов'язково заміщеним у такий 10алкілу, фенілу, нафтилу або Аr-С 1-10алкілу, Аr спосіб: вибраний з фенілу або нафтилу; (і) 1-5 галогеногрупами, R6 і R7 кожний незалежно являє собою Н або С 1(іі) 1 CO2R4, CN, S(O)pR5, NO2 або C(O)NR6R7 гру3алкіл, і р означає 0, 1 або 2. пою, 7. Сполука за п. 1 або її фармацевтично прийнят(ііі) 1-2 С1-10алкільними або алкоксильними групана сіль або сольват, де один R1 являє собою Н і ми, причому кожна необов'язково заміщена: 1-5 інший вибраний з Сl, F, CF3 або ОС 1-3алкілу; атомами галогену, аж до утворення пергалогеналR2 являє собою галоген, CF3, ОС1-3алкіл або OCF3, кілу, і 1-2 ОН або CO2R4 гр упами; і кожний R2 означає Н або вибраний із групи, яка R3 означає Н або метил. складається з: (а) галогену, вибраного з Сl і F, (b) 8. Сполука за п. 1, вибрана з наступних таблиць: O O O N H H 3C H3 C OH F N N CO2H N H N N Cl O CF 3 OMe Cl H3C Cl , O O N H CF3 , O OH H 3C N N CO2 H N H N N Cl OMe OMe Cl Cl , , Таблиця 1 CO 2 H O NH Ar N N R Ar 3,5-(CF3)2Ph 3,5-Cl2Ph 4-CF3, 2-PrOPh 3,5-Cl2Ph 4-CF3, 2-PrOPh R H MeO H CF3O CF3O Ar 3,5-Cl2Ph 4-CF3OPh 4-CF3, 2-PrOPh 4-CF3OPh 3-Cl, 2-EtOPh R H MeO MeO CF3O MeO 5 4-Cl, 3-FPh 2-CF3OPh 2-F, 5-CF3Ph 85884 6 MeO MeO MeO 2,4-F2Ph 2-EtOPh 4-Cl, 2-EtOPh MeO MeO MeO Таблиця 2 CO 2 H O NH Ar N N Ar 1 Ar Ar 1 OCF3 3,5-Cl2Ph 4-CF3, 2-PrOPh Ar1 Ar 4-CF3OPh OCF3 3,5-Cl2Ph OCF3 OCF3 OCF 3 3,5-Cl2Ph Таблиця 3 CO2H O NH Ar N N CH3 R Ar 4-Cl, 2-PrOPh 5-Cl,2-CF3OPh 3,5-Cl2Ph 3,5-Cl2Ph 5-Cl, 2-CF3OPh 3,4-Cl2Ph 4-Cl, 2-CF3OPh 3,4,5-F3Ph 3-CF3OPh 3-Cl, 4-FPh 2-F, 4-CF3Ph 2-F, 4-CF3Ph 3-Cl, 4-FPh 3,4,5-F3Ph 3,4-Cl2Ph R CF3O CF3O EtO CF3 CF3 MeO MeO MeO MeO MeO MeO EtO CF3 CF3 CF3 Ar 4-Cl, 2-PrOPh 5-Cl, 2-CF3OPh 4-CF3OPh 3,5-Cl2Ph 5-Cl, 2-CF3OPh 3,4-Cl2Ph 4-Cl, 2-CF3OPh 3,4,5-F3Ph 3-CF3OPh 3-Cl, 4-FPh 2-F, 4-CF3Ph 3-Cl, 4-FPh 2-F, 4-CF3Ph 3-CF3OPh 2-F, 5-CF3Ph R MeO MeO MeO Cl Cl CF3O CF3O CF3O CF3O CF3O CF3O EtO CF3 CF3 EtO 7 2-F, 5-CF3Ph 4-CF3, 2-cPrCH2OPh 4-CF3, 2-cPentOPh 3-Cl, 4-FPh 3,4,5-F3Ph 4-Cl, 2-CF3OPh 3,4-F2Ph 5-Cl, 2-FPh 3-Cl, 4-EtOPh 3-Cl, 4-cPrCH 2OPh 5-Cl, 2-MeOPh 5-Cl, 2-PrOPh 5-Cl, 2-cPentOPh 2,3,5-Cl3Ph 3-Cl, 4-EtOPh 3-Cl, 4-cPrCH 2OPh 3-CF3Ph 2,5-F2Ph 2,4,5-F3Ph 4-Cl, 2-MeOPh 4-Cl, 2-cPentOPh 4-Cl, 2-PrOPh 85884 CF3O MeO MeO Cl Cl Cl MeO CF3O MeO MeO MeO MeO MeO MeO Cl Cl Cl CF3O CF3O MeO MeO Cl 8 3,5-Cl2Ph 4-CF3, 2-EtOPh 4-Cl, 2-CF3OPh 2-F, 4-CF3Ph 3-CF3OPh 3,4-Cl2Ph 5-Cl, 2-FPh 3-Cl, 4-MeOPh 3-Cl, 4-PrOPh 3-Cl, 4-cPentOPh 5-Cl, 2-EtOPh 5-Cl, 2-cPrCH 2OPh 2,5-Cl2Ph 3-Cl, 4-MeOPh 3-Cl, 4-PrOPh 3-Cl, 4-cPentOPh 2,5-F2Ph 2,4,5-F3Ph 2-F, 5-CF3Ph 4-Cl, 2-EtOPh 4-Cl, 2-cPrCH 2OPh OH MeO CF3 Cl Cl Cl MeO MeO MeO MeO MeO MeO MeO Cl Cl Cl MeO MeO Cl MeO MeO Таблиця 4 CO2H O NH Ar N N CH 3 R Аr 4-Cl, 2-PrOPh 5-Cl, 2-CF3OPh 3,5-Cl2Ph 2,5-Cl2Ph R CF3O CF3O MeO MeO Ar 4-Cl, 2-PrOPh 5-Cl, 2-CF3OPh 3,5-Cl2Ph 2,3,5-Cl2Ph R MeO MeO CF3 MeO Таблиця 5 CO2H O NH Ar N N CH3 R Ar 3,5-Cl2Ph R CF3O Ar 3,5-Cl2Ph R CF3O 9 4-Cl, 2-PrOPh 3,5-Cl2Ph 5-C1, 2-CF3OPh 85884 CF3O CF3 CF3O 10 4-Cl, 2-PrOPh 5-C1, 2-CF3OPh CF3O CF3 Таблиця 6 CO2H O NH Ar N N CH 3 R Ar 3,5-Cl2Ph 4-CF3OPh R H EtO Ar 4-CF3OPh 4-Cl, 2-PrOPh H 5-Cl, 2-CF3OPh O F O F O F MeO 4-tBuPh 3-F, 4-CF3OPh 4-FPh 3-Me, 4-FPh H O F O F H O F CF3O MeO O F O F O F 4-ClPh 3-F, 4-EtOPh 3,5-F2Ph 3-EtOPh 3-F, 4-MeO MeO MeO MeO MeO MeO MeO MeO MeO F F F O O MeO F F MeO CF3O O F O F O F R H H O F F 2-i-PrOPh 3-ClPh 4-Cl, 3-FPh 2-FPh 3-MePh 4-Me, 2-MeOPh 2,4-Cl2Ph MeO O F MeO MeO MeO MeO MeO MeO MeO або її фармацевтично прийнятна сіль або сольват. 9. Сполука за п. 1, вибрана з наступної таблиці: 2-MeO, 4-FPh 2,4-F2Ph 2-CF3OPh 3-Cl, 4-CF3Ph 3-Cl, 4-CF3OPh 5-F, 2-MeO MeO MeO MeO MeO MeO MeO 11 85884 O O O N H H3 C 12 OH F N N CO2H N H H3C N N Cl CF3 O OMe Cl N H H3C , O O O Cl CF 3 , N N N N Cl OMe OMe Cl Cl , , O або її фармацевтично прийнятна сіль або сольват. 10. Сполука за п. 1, представлена структурою: O OH O N H O N H CO2H N H H3C OH OH N N Cl N N OMe Cl Cl O CF3 Cl , або її фармацевтично прийнятна сіль або сольват. 11. Сполука за п. 1, представлена структурою: O , або її фармацевтично прийнятна сіль або сольват. 14. Сполука за п. 1, представлена структурою: O O N H OH CO2H N H F N N N N Cl OMe O CF3 Cl , або її фармацевтично прийнятна сіль або сольват. 12. Сполука за п. 1, представлена структурою: O O N H Cl OH N N OMe Cl , або її фармацевтично прийнятна сіль або сольват. 13. Сполука за п. 1, представлена структурою: CF 3 , або її фармацевтично прийнятна сіль або сольват. 15. Фармацевтична композиція, яка містить сполуку за п. 1 у комбінації з фармацевтично прийнятним носієм. 16. Спосіб лікування цукрового діабету 2 типу у пацієнта-ссавця, що потребує такого лікування, який відрізняється тим, що вказаному пацієнту вводять сполуку за п. 1 у кількості, ефективній для лікування цукрового діабету 2 типу. 17. Спосіб лікування гіперглікемії, діабету або інсулінової резистентності у пацієнта-ссавця, що потребує такого лікування, який відрізняється тим, що вказаному пацієнту вводять ефективну кількість сполуки за п. 1. 18. Спосіб лікування інсулінонезалежного цукрового діабету у пацієнта-ссавця, що потребує такого лікування, який відрізняється тим, що вказаному 13 85884 14 пацієнту вводять протидіабетичну ефективну кільта-ссавця, що потребує такого лікування, який кість сполуки за п. 1. відрізняє ться тим, що вказаному пацієнту вво19. Спосіб лікування ожиріння у пацієнта-ссавця, дять сполуку за п. 1 у кількості, ефективній для що потребує такого лікування, який відрізняється лікування зазначеного ліпідного розладу. тим, що вказаному пацієнту вводять сполуку за п. 21. Спосіб лікування атеросклерозу у пацієнта1 у кількості, ефективній для лікування ожиріння. ссавця, що потребує такого лікування, який відрі20. Спосіб лікування ліпідного розладу, вибраного зняється тим, що вказаному пацієнту вводять із групи, яка складається з дисліпідемії, гіперліпісполуку за п. 1 у кількості, ефективній для лікувандемії, гіпертригліцеридемії, гіперхолестеринемії, ня атеросклерозу. низького рівня HDL і високого рівня LDL, у пацієн Даний винахід належить до похідних піразолу, композицій, які містять ці сполуки, і різних способів лікування, пов'язаних із цукровим діабетом 2 типу й родинних станів. Діабет належить до патологічного процесу, причинами якого є багато факторів, і відрізняється підвищеними рівнями глюкози в плазмі (гіперглікемія) у стані натще або після введення глюкози протягом перорального тесту на толерантність до глюкози. Явно виражений цукровий діабет (наприклад, вміст глюкози в крові >126мг/дл натще) пов'язаний з підвищеною й передчасною серцевосудинною захворюваністю й смертністю й належить прямо або побічно до різних метаболічних станів, що включають зміни метаболізму ліпідів, ліпопротеїнів і аполіпопротеїнів. У пацієнтів з інсулінонезалежним цукровим діабетом (цукровий діабет 2 типу), які складають приблизно 95% пацієнтів із цукровим діабетом, часто виявляють підвищені кількості сироваткових ліпідів, таких як холестерин і тригліцериди, і вони мають погані показники ліпідів крові з високими рівнями холестерину ліпопротеїдів низької щільності (LDL-C) і холестерину ліпопротеїдів високої щільності (HDL-C). Зазначені пацієнти, які страждають від цукрового діабету 2 типу, знаходяться, таким чином, у гр упі підвищеного ризику з виникнення макросудинних і мікросудинних ускладнень, які включають коронарну хворобу серця, удар, захворювання периферичних судин, гіпертензію (наприклад, кров'яний тиск >130/80мм Hg у стані спокою), нефропатію, невропатію й ретинопатію. Для пацієнтів із цукровим діабетом 2 типу характерні підвищені рівні інсуліну в плазмі в порівнянні з пацієнтами-недіабетиками; у цих пацієнтів розвивається резистентність до інсулінової стимуляції метаболізму глюкози й ліпідів в основних тканинах, чутливи х до інсуліну (м'язи, печінка й жирові тканини). Таким чином, діабет 2 типу щонайменше на початку природного розвитку хвороби характеризується, в основному, інсуліновою резистентністю, а не зниженням утворення інсуліну, що призводить до недостатнього поглинання, окислювання й збереження глюкози в м'язах, неадекватного пригнічення ліполізу в жировій тканині й надлишкового утворення й виділення глюкози печінкою. Головний ефект зниженої чутливості до інсуліну виражається у високих рівнях інсуліну, що циркулює в крові без відповідного зниження глюкози в плазмі (гіперглікемія). Гіперінсулінемія являє собою фактор ризику для виникнення гіперте нзії й може також додавати внесок у розвиток судинних захворювань. Глюкагон служить як головний регуляторний гормон, який послаблює ефект інсуліну з інгібування печінкового глюконеогенезу й звичайно виділяється альфа-клітинами в панкреатичних острівцях у відповідь на падіння рівнів глюкози в крові. Даний гормон зв'язується зі специфічними рецепторами в клітинах печінки, що викликає глікогеноліз і підвищення глюконеогенезу через події, опосередковані цАМР (сАМР, циклічний аденозинмонофосфат). У результаті цього генерується глюкоза (наприклад, утворення печінкової глюкози) для полегшення підтримки еуглікемії шляхом запобігання значному падінню рівня глюкози в крові. На додаток до збільшення кількості циркулюючого інсуліну, діабетики 2 типу характеризуються підвищеними кількостями глюкагону в плазмі й підвищеними швидкостями утворення глюкози в печінці. Антагоністи глюкагону застосовують для підвищення інсулінової чутливості в печінці, при цьому знижується швидкість глюконеогенезу й глікогенолізу й зменшується швидкість виділення глюкози в печінці, що приводить до зниження рівнів глюкози в плазмі. Сутність винаходу Даний винахід належить до сполуки, представленої формулою І: або її фармацевтично прийнятної солі або сольвату, де: кожний R1 означає Η або вибраний із групи, яка складається з: (a) галогену, ОН, CO2R4 , CN. SO pR5 або NO2 , (b) С1-6алкілу або ОС 1-6алкілу, необов'язково заміщеного: (1) 1-5 галогеногрупами аж до утворення пергалогеналкільної групи; (2) CO2R4; (3) фенілом, необов'язково заміщеним у такий спосіб: (і) 1-5 галогеногрупами, (іі) 1 CO2R4, CN, S(O)pR5, NO2 або C(O)NR6R7 гр упою, (iiі) 1-2 С110алкільними або алкоксильними групами, причому кожна необов'язково заміщена: 1-5 атомами гало 15 85884 16 гену аж до утворення пергалогеналкілу, і 1-2 ОН і ароматичні гетероциклічні групи, конденсовані із або CO2R4 гр упами; циклоалкільними кільцями. Гетероарил також кожний R2 вибраний з R1, визначеного вище, включає такі групи в зарядженому вигляді, наприабо дві R2 групи, узяті разом, можуть утворювати клад, піридиній. конденсовану 5-6-членну циклічну структуру, що "Гетероцикліл" (Hetcy) означає моно- і біциклімістить 1-2 атоми кисню й 1-2 атоми вуглецю, кожчні насичені кільця й кільцеві системи, що містять ний з яких необов'язково заміщений 1-2 атомами щонайменше один гетероатом, вибраний з N, S і F; О, причому кожне із зазначених кілець містить від R3 означає Η або С1-3алкіл; 3 до 10 атомів, серед яких точкою приєднання моR4 означає Η або С1-6алкіл, і же бути вуглець або азот. Приклади "гетероцикліR5 вибраний із групи, яка складається з: С1лу" включають піролідиніл, піперидиніл, піперазиніл, імідазолідиніл, 2,3-дигідрофуро(2,3-b)піридил, 10алкілу, арилу або Ar-С 1-10алкілу; R6 і R7 кожний незалежно являє собою Η або бензоксазиніл, тетрагідрохінолініл, тетрагідроізохіС1-3алкіл, і p означає 0, 1 або 2. нолініл, дигідроіндоліл тощо. Даний термін також Винахід описаний тут у деталях з використанвключає частково ненасичені моноциклічні кільця, ням термінів, визначених нижче, якщо не обговоякі не є ароматичними, такі як 2- або 4-піридони, рено особливо. приєднані через азот, або N"Алкіл", а також інші групи, що мають префікс заміщені(1H,3H)піримідин-2,4-діони (N-заміщені "алк", такі як алкокси, алканоїл тощо, означає вугурацили). Гетероцикліл, крім того, включає такі лецеві ланцюги, які можуть бути лінійними, розгагрупи в зарядженому вигляді, наприклад, піперилуженими або циклічними, або їх комбінаціями, що диній. містять зазначене число атомів вуглецю. Якщо "Галоген" (Halo) включає фтор, хлор, бром і число не зазначене, то 1-10 атомів вуглецю прийод. значені для лінійних або розгалужених алкільних Коли R1 відрізняється від Н, то він може бути груп. Приклади алкільних груп включають метил, приєднаний до нафтильної групи в будь-якій доетил, пропіл, ізопропіл, бутил, втор- і трет-бутил, ступній для приєднання точці. пентил, гексил, гептил, октил, ноніл тощо. ЦиклоаУ самому широкому аспекті даний винахід налкіл являє собою підклас алкілу; якщо не зазначележить до сполуки, представленої формулою І: не число атомів, то 3-10 атомів вуглецю призначені для утворення 1-3 карбоциклічних кілець, які є конденсованими. Приклади циклоалкілу включають циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, декагідронафтил тощо. "Алкеніл" означає вуглецеві ланцюги, які містять щонайменше один вуглець-вуглецевий подвійний зв'язок, і які можуть бути лінійними або розгалуженими, або їх комбінаціями. Приклади алкенілу включають вініл, аліл, ізопропеніл, пентеніл. гексеніл, гептеніл, 1-пропеніл, 2-бутеніл, 2метил-2-бутеніл тощо. "Алкініл" означає вуглецеві ланцюги, які місабо її фармацевтично прийнятної солі або сотять щонайменше один вуглець-вуглецевий польвату, де: кожний R1 означає Η або вибраний із трійний зв'язок, і які можуть бути лінійними або групи, яка складається з: розгалуженими, або їх комбінаціями. Приклади (a) галогену, ОН, CO2R4 , CN, SO pR5 або NO2 , алкінілу включають етеніл, пропаргіл, 3-метил-1(b) С1-6алкілу або ОС 1-6алкілу, необов'язково пентиніл, 2-гептиніл тощо. заміщеного: (1) 1-5 галогеногрупами аж до утво"Арил" (Ar) означає моно- і біциклічні ароматирення пергалогеналкільної групи; (2) CO2R4, (3) чні кільця, що містять 6-12 атомів вуглецю. Прифенілом, необов'язково заміщеним у такий спосіб: клади арилу включають феніл, нафтил, інденіл (і) 1-5 галогеногрупами, (іі) 1 CO2R4, CN, S(O)pR5, тощо. "Арил"' також включає моноциклічні кільця, NO2 або C(O)NR6R7 гр упою, (ііі) 1-2 С1конденсовані з арильною групою. Приклади вклю10алкільними або алкоксильними групами, причому чають тетрагідронафтил, інданіл тощо. кожна необов'язково заміщена: 1-5 атомами гало"Гетероарил" (HAR) означає моно- або біцикгену аж до утворення пергалогеналкілу, і 1-2 ОН лічне ароматичне кільце або кільцеву систему, що або CO2R4 гр упами; містить щонайменше один гетероатом, вибраний з кожний R2 вибраний з R1, визначеного вище, О, Sі N, причому кожне кільце містить від 5 до 6 або дві R2 групи, узяті разом, можуть утворювати атомів. Приклади включають піроліл, ізоксазоліл, конденсовану 5-6-членну циклічну структуру, що ізотіазоліл. піразоліл, піридил, оксазоліл, оксадіамістить 1-2 атоми кисню й 1-2 атоми вуглецю, кожзоліл, тіадіазоліл, тіазоліл, імідазоліл, триазоліл, ний з яких необов'язково заміщений 1-2 атомами тетразоліл, фураніл, триазиніл, тієиіл, піримідил, F; піридазиніл, піразиніл, бензоксазоліл, бензотіазоR3 означає Η або С1-3алкіл; ліл, бензімідазоліл, бензофураніл, бензотіофеніл, R4 означає Η або С1-6алкіл, і фуро(2,3-b)піридил, хіноліл, індоліл, ізохіноліл тоR5 вибраний із групи, яка склада€ться з: С1що. Гетероарил також включає ароматичні гете10алкілу, арилу або Ar-С 1-10алкілу; роциклічні групи, конденсовані з гетероциклами, R6 і R7 кожний незалежно являє собою Η або які є неароматичними або частково ароматичними, С1-3алкіл, і p означає 0, 1 або 2. 17 85884 18 Інший аспект винаходу, який представляє інЩе більш конкретно, інший аспект винаходу, терес, належить до описаної вище сполуки форякий представляє інтерес, належить до сполук мули І, у якій один R1 означає Η і інший означає Η формули І або їх фармацевтично прийнятних соабо вибраний із групи, яка складається з: лей або сольватів, де один R1 являє собою Η і 4 5 (a) галогену, ОН, CO2R , CN, SO pR або NO2 . інший вибраний з СІ, F, CF3 або ОС1-3алкілу; і R2 (b) С1-6алкілу або ОС 1-6алкілу, необов'язково являє собою галоген, CF3, ОС1-3алкіл або OCF3, і заміщеного: (1) 1-5 галогеногрупами аж до утвоR3 означає Η або метил. рення пергалогеналкільної групи; (2) CO2R4; (3) Інший аспект винаходу, який представляє інфенілом, необов'язково заміщеним у такий спосіб: терес, належить до фармацевтичної композиції, (і) 1-5 галогеногрупами, (іі) 1 CO2R4, CN, S(O)pR5, яка містить сполуки описаної вище формули І у NO2 або C(O)NR6R7 гр упою, (ііі) 1-2 С1комбінації з фармацевтично прийнятним носієм. Інший аспект винаходу, який представляє ін10алкільними або алкоксильними групами, причому кожна необов'язково заміщена: 1-5 атомами галотерес, належить до способу лікування цукрового гену, аж до утворення пергалогеналкілу, і 1-2 ОН діабету 2 типу у пацієнта-ссавця, що потребує таабо CO2R4 гр упами. кого лікування, який включає введення зазначеноБільш конкретно, інший аспект винаходу, який му пацієнтові сполуки описаної вище формули І у представляє інтерес, належить до описаної вище кількості, ефективній для лікування цукрового діасполуки формули І, у якій один R 1 означає Η і інбету 2 типу. ший означає Η або вибраний із групи, яка складаІнший аспект винаходу, який представляє інється з: (а) галогену або ОН; і (b) С1-4алкілу або терес, належить до способу уповільнення початку ОС1-4алкілу, кожний з яких необов'язково заміщецукрового діабету 2 типу у пацієнта-ссавця, що ний 1-3 галогеногрупами. потребує цього, який включає введення пацієнтові Інший аспект винаходу, який представляє інсполуки описаної вище формули І у кількості, що є терес, належить до описаної вище сполуки форефективною для уповільнення початку цукрового мули І, у якій кожний R2 означає Η або вибраний із діабету 2 типу. групи, яка складається з: (а) галогену, вибраного з Інший аспект винаходу, який представляє інСІ і F, (b) С1-6алкілу або ОС 1-6алкілу, необов'язково терес, належить до способу лікування гіперглікезаміщеного 1-3 галогеногрупами, або дві R2 групи, мії, діабету або інсулінової резистентності у пацієузяті разом, можуть утворювати конденсовану 5-6нта-ссавця, що потребує такого лікування, який членну циклічну стр уктур у, що містить 1-2 атоми включає введення зазначеному пацієнтові сполуки кисню й 1-2 атоми вуглецю, кожний з яких необоописаної вище формули І у кількості, ефективній в'язково заміщений 1-2 атомами F. для лікування гіперглікемії, діабету або інсулінової Інший аспект винаходу, який представляє інрезистентності. терес, належить до описаної вище сполуки форІнший аспект винаходу, який представляє інмули І. у якій кожний R3 означає Η або метил. терес, належить до способу лікування інсулінонеБільш конкретно, інший аспект винаходу, який залежного цукрового діабету у пацієнта-ссавця, представляє інтерес, належить до описаної вище що потребує такого лікування, який включає ввесполуки формули І, у якій: дення пацієнтові протидіабетичної ефективної один R1 означає Η і інший означає Η або вибкількості сполуки описаної вище формули І. рані із групи, яка складається з: Інший аспект винаходу, який представляє ін(a) галогену, ОН, CO2R4 . CN, SO pR5 або NO2 , терес, належить до способу лікування ожиріння у (b) С1-6алкілу або ОС 1-6алкілу, необов'язково пацієнта-ссавця, що потребує такого лікування, заміщеного: (1) 1-5 галогеногрупами аж до утвоякий включає введення зазначеному пацієнтові рення пергалогеналкільної групи; (2) CO2R4; (3) сполуки описаної вище формули І у кількості, ефефенілом, необов'язково заміщеним у такий спосіб: ктивній для лікування ожиріння. (і) 1-5 галогеногрупами, (іі) 1 CO2R4, CN, S(O)pR5, Інший аспект винаходу, який представляє інNO2 або C(O)NR6R7 гр упою, (ііі) 1-2 С1терес, належить до способу лікування синдрому X у пацієнта-ссавця, що потребує такого лікування, 10алкільними або алкоксильними групами, причому кожна необов'язково заміщена: 1-5 атомами галоякий включає введення зазначеному пацієнтові гену, аж до утворення пергалогеналкілу, і 1-2 ОН сполуки описаної вище формули І у кількості, ефеабо CO2R4 гр упами; ктивній для лікування синдрому X. кожний R2 означає Η або вибраний із групи, Інший аспект винаходу, який представляє іняка складається з: (а) галогену, вибраного з СІ і F, терес, належить до способу лікування ліпідного (b) С1-6алкілу або ОС 1-6алкілу, необов'язково замірозладу, вибраного із групи, що складає з дисліпіщеного 1-3 галогеногрупами, або дві R2 групи, узядемії, гіперліпідемії, гіпертригліцеридемії, гіперхоті разом, можуть утворювати конденсовану 5-6лестеринемії, низького HDL і високого LDL, у пацічленну циклічну стр уктур у, що містить 1-2 атоми єнта-ссавця. що потребує такого лікування, який кисню й 1-2 атоми вуглецю, кожний з яких необовключає введення зазначеному пацієнтові сполуки в'язково заміщений 1-2 атомами F; описаної вище формули І у кількості, ефективній R3 означає Η або метил; для лікування зазначеного ліпідного розладу. R4 означає Η або С1-6алкіл; Інший аспект винаходу, який представляє інR5 вибраний із групи, яка складається з: С1терес, належить до способу лікування атеросклерозу у пацієнта-ссавця, що потребує такого ліку10алкілу, арилу або Ar-С 1-10алкілу; R6 і R7 кожний незалежно являє собою Η або вання, який включає введення зазначеному С1-3алкіл, і p означає 0, 1 або 2. пацієнтові сполуки описаної вище формули І у кількості, ефективній для лікування атеросклерозу. 19 85884 20 Інший аспект винаходу, який представляє інневропатії, (20) синдрому X й інших станів і порутерес, належить до способу лікування стану, вибшень, де інсулінова резистентність є компонентом , раного із групи, яка складається з: (1) гіперглікемії, у пацієнта-ссавця, що потребує такого лікування, (2) низької толерантності до глюкози, (3) інсуліноякий включає введення зазначеному пацієнтової резистентності, (4) ожиріння, (5) ліпідних розві сполуки описаної вище формули І і сполуки, ладів, (6) дисліпідемії, (7) гіперліпідемії, (8) гіпервибраної із групи, яка складається з: тригліцеридемії, (9) гіперхолестеринемії, (10) (a) DPP-IV інгібіторів, таких як сполуки, розкринизьких рівнів HDL, (11) високих рівнів LDL, (12) ті в [пат. США №6699871В1, виданому 2 березня, атеросклерозу і його ускладнень. (13) рестенозу 2004 і включеному в даний опис шляхом посилансудин, (14) панкреатиту, (15) ожиріння живота, (16) ня]; (b) інсулінових сенсибілізаторів, вибраних із нейродегенеративного захворювання, (17) ретигрупи, яка складається з (і) PPAR агоністів і (іі) нопатії, (18) нефропатії, (19) невропатії, (20) синдбігуанідів; (с) інсуліну й інсулінових міметиків; (d) рому X й інших станів і порушень, де інсулінова сульфонілсечовин і інших засобів, що підвищують резистентність є компонентом, у пацієнта-ссавця, секрецію інсуліну; (e) інгібіторів альфащо потребує такого лікування, який включає ввеглюкозидази; (f) інших антагоністів глюкагонового дення зазначеному пацієнтові сполуки описаної рецептора; (g) GLP-1, GLP-1 міметиків і агоністів вище формули І у кількості, ефективній для лікуGLP-1 рецептора; (h) GIP, GIP міметиків і агоністів вання зазначеного стану. GIP рецептора; (і) РАСАР, РАС АР міметиків і агоІнший аспект винаходу, який представляє інністів РАС АР 3 рецептора; (j) холестеринзнижуютерес, належить до способу уповільнення стану, чих засобів, вибраних із групи, яка складається з вибраного із групи, яка складається з: (1) гіперглі(і) інгібіторів HMG-CoA редуктази. (іі) речовин, що кемії, (2) низької толерантності до глюкози, (3) інпідсилюють екскрецію, (ііі) нікотинілового спирту, сулінової резистентності, (4) ожиріння, (5) ліпідних нікотинової кислоти і її солей, (iv) PPAR альфарозладів, (6) дисліпідемії, (7) гіперліпідемії, (8) гіагоністів, (ν) PPAR альфа/гамма подвійних агоніспертригліцеридемії, (9) гіперхолестеринемії, (10) тів, (vi) інгібіторів абсорбції холестерину, (vii) інгібінизьких рівнів HDL, (11) високих рівнів LDL, (12) торів ацил КоА(СоА):холестеринацилтрансферази, атеросклерозу і його ускладнень, (13) рестенозу (viii) антиоксидантів і (іх) L XR модуляторів; (k) судин, (14) панкреатиту, (15) ожиріння живота, (16) PPAR дельта-агоністів; (l) сполук проти ожиріння; нейродегенеративного захворювання, (17) рети(m) інгібітору кишкового транспортера жовчних нопатії, (18) нефропатії, (19) невропатії, (20) синдкислот; (n) протизапальних засобів, за виключенрому X й інших станів і порушень, де інсулінова ням глюкокортикоїдів; (о) інгібіторів протеїнтирорезистентність є компонентом, у пацієнта-ссавця, зинфосфатази-1В (РТР-1В) і (р) СВ1 антагонісщо потребує такого лікування, який включає вветів/зворотних агоністів, таких як римонабант, і дення зазначеному пацієнтові сполуки описаної засобів, розкритих в [WO 03/077847A2, опубліковище формули І у кількості, ефективній для уповіваній 25 вересня, 2003. і в WO 05/000809, опублільнення зазначеного стану. кованій 6 січня, 2005, включених у даний опис Інший аспект винаходу, який представляє іншляхом посилання], терес, належить до способу зниження ризик) пропри цьому зазначені сполуки вводяться пацієяву стану, вибраного із групи, яка складається з: нтові в кількостях, які є ефективними для лікуван(1) гіперглікемії. (2) низької толерантності до глюня зазначеного стану. кози. (3) інсулінової резистентності, (4) ожиріння, Інший аспект винаходу, який представляє ін(5) ліпідних розладів. (6) дисліпідемії, (7) гіперліпітерес, належить до способу лікування стану, вибдемії, (8) гіпертригліцеридемії, (9) гіперхолестерираного із групи, яка складається з: гіперхолестеринемії, (10) низьких рівнів HDL, (11) високих рівнів немії. атеросклерозу, низьких рівнів HDL, високих LDL, (12) атеросклерозу і його ускладнень, (13) рівнів LDL, гіперліпідемії, гіпертригліцеридемії й рестенозу судин, (14) панкреатиту. (15) ожиріння дисліпідемії, у пацієнта-ссавця. що потребує такоживота, (16) нейродегенеративного захворювання, го лікування, який включає введення зазначеному (17) ретинопатії, (18) нефропатії, (19) невропатії, пацієнтові терапевтично ефективних кількостей (20) синдрому X й інших станів і порушень, де інсполуки описаної вище формули І і інгібітору H MGсулінова резистентність є компонентом, у пацієнCoA редуктази. та-ссавця, що потребує такого лікування, який Більш конкретно, інший аспект винаходу, який включає введення зазначеному пацієнтові сполуки представляє інтерес, належить до способу лікуописаної вище формули І у кількості, ефективній вання стану, вибраного із групи, яка складається з: для зниження ризику прояву зазначеного стану. гіперхолестеринемії, атеросклерозу, низьких рівнів Інший аспект винаходу, який представляє інHDL, високих рівнів LDL, гіперліпідемії, гіпертригтерес, належить до способу лікування стану, вибліцеридемії й дисліпідемії, у пацієнта-ссавця, що раного із групи, яка складається з: потребує такого лікування, який включає введення (1) гіперглікемії, (2) низької толерантності до зазначеному пацієнтові терапевтично ефективних глюкози, (3) інсулінової резистентності, (4) ожирінкількостей сполуки описаної вище формули І і інгіня, (5) ліпідних розладів, (6) дисліпідемії, (7) гіпербітору HMG-Co A редуктази, де інгібітор HMG-CoA ліпідемії, (8) гіпертригліцеридемії, (9) гіперхолесредуктази являє собою статин. теринемії, (10) низьких рівнів HDL, (11) високих Ще більш конкретно, інший аспект винаходу, рівнів LDL, (12) атеросклерозу і його ускладнень, який представляє інтерес, належить до способу (13) рестенозу судин, (14) панкреатиту, (15) ожилікування стану, вибраного із групи, яка складаріння живота, (16) нейродегенеративного захвоється з: гіперхолестеринемії, атеросклерозу, низьрювання, (17) ретинопатії, (18) нефропатії, (19) ких рівнів HDL, високих рівнів LDL, гіперліпідемії, 21 85884 22 гіпертригліцеридемії й дисліпідемії, у пацієнтальнення початку або зниження ризику прояву атессавця, що потребує такого лікування, який вклюросклерозу у пацієнта-людини. що потребує такого чає введення зазначеному пацієнтові терапевтичлікування, який включає введення зазначеному но ефективних кількостей сполуки описаної вище пацієнтові ефективних кількостей сполуки описаформули І і інгібітору H MG-Co A редуктази, де інгіної вище формули І і інгібітору абсорбції холестебітор HMG-CoA редуктази являє собою статин, рину, де інгібітор абсорбції холестерину являє вибраний із групи, яка складається з: ловастатину, собою езетиміб. симвастатину, правастатину, флувастатину, аторІнший аспект винаходу, який представляє інвастатину, ітавастатин у, ZD-4522 і ривастатину. терес, належить до способу уповільнення початку Інший аспект винаходу, який представляє інабо зниження ризику прояву інших захворювань і терес, належить до способу зниження ризику простанів, наведених вище, у пацієнта-ссавця, що яву стану, вибраного із групи, яка складається з. потребує такого лікування, який включає введення гіперхолестеринемії, атеросклерозу, низьких рівнів зазначеному пацієнтові ефективних кількостей HDL. високих рівнів LDL, гіперліпідемії, гіпертригсполуки описаної вище формули І і інгібітору абсоліцеридемії й дисліпідемії й ускладнень таких старбції холестерину. нів, який включає введення пацієнтові-ссавцеві, Більш конкретно, інший аспект винаходу, який що потребує такого лікування, терапевтично ефепредставляє інтерес, належить до способу уповіктивних кількостей сполуки описаної вище формульнення початку або зниження ризику прояву інли І і інгібітору HMG-CoA редуктази. ших захворювань і станів, наведених вище, у паціІнший аспект винаходу, який представляє інєнта-людини, що потребує такого лікування, який терес, належить до способу уповільнення початку включає введення зазначеному пацієнтові ефекабо зниження ризику прояву атеросклерозу у пацітивних кількостей сполуки описаної вище формули єнта-людини, що потребує такого лікування, який І і Інгібітору абсорбції холестерину, де інгібітор включає введення зазначеному пацієнтові ефекабсорбції холестерину являє собою езетиміб. тивних кількостей сполуки описаної вище формули Інший аспект винаходу, який представляє інІ і інгібітору HMG-CoA редуктази. терес, належить до фармацевтичної композиції, Більш конкретно, інший аспект винаходу, який яка містить (1) сполуки описаної вище формули І; представляє інтерес, належить до способу упові(2) сполуки, вибрані із групи, що складає з: (a) льнення початку або зниження ризику прояву атеDPP-IV інгібіторів, таких як сполуки, розкриті в [пат. росклерозу у пацієнта-людини, що потребує такого США №6699871В 1, виданому 2 березня, 2004, лікування, який включає введення зазначеному включеному в даний опис шляхом посилання]; (b) пацієнтові ефективних кількостей сполуки описаінсулінових сенсибілізаторів, вибраних із групи, що ної вище формули І і інгібітору HMG-CoA редуктаскладає з (і) PPAR агоністів і (іі) бігуанідів: (с) інсузи, де інгібітор HMG-CoA редуктази являє собою ліну й інсулінових міметиків; (d) сульфонілсечовин статин. і інших засобів, що підвищують секрецію інсуліну; Ще більш конкретно, інший аспект винаходу, (e) інгібіторів альфа-глюкозидази; (f) інших антагоякий представляє інтерес, належить до способу ністів глюкагонового рецептора; (g) GLP-1, GLP-1 уповільнення початку або зниження ризику прояву міметиків і агоністів GLP-1 рецептора; (h) GIP, GIP атеросклерозу у пацієнта-людини, що потребує міметиків і агоністів GIP рецептора; (і) РАСАР, такого лікування, який включає введення зазначеРАС АР міметиків і агоністів РАС АР 3 рецептора; (j) ному пацієнтові ефективних кількостей сполуки холестеринзнижуючих засобів, вибраних із групи, описаної вище формули І і інгібітору HMG-CoA що складає з (і) інгібіторів HMG-CoA редуктази, (іі) редуктази, де інгібітор HMG-CoA редуктази являє речовин, що підсилюють екскрецію, (ііі) нікотинілособою статин, вибраний із групи, яка складається вого спирту, нікотинової кислоти і її солей, (iv) з: ловастатину, симвастатину. правастатину, флуPPAR альфа-агоністів, (ν) PPAR альфа/гамма повастатину, аторваста тину, ітаваста тину, ZD-4522 і двійних агоністів, (vi) інгібіторів абсорбції холестеривастатину. рину, (vii) інгібіторів ацил Ще більш конкретно, інший аспект винаходу, КоА(СоА):холестеринацилтрансферази, (viii) антиякий предсіавляє інтерес, належить до способу оксидантів і (іх) LXR модуляторів; (k) PPAR дельуповільнення початку або зниження ризику прояву та-агоністів; (l) сполук проти ожиріння; (m) інгібітоатеросклерозу у пацієнта-людини, що потребує ру кишкового транспортера жовчних кислот; (n) такого лікування, який включає введення зазначепротизапальних засобів, за виключенням глюкоконому пацієнтові ефективних кількостей сполуки ртикоїдів; (о) інгібіторів протеїнтирозинфосфатазиописаної вище формули І і інгібітору HMG-CoA 1В (РТР-1В) і (р) СВ1 антагоністів/зворотних агоніредуктази. де інгібітор HMG-CoA редуктази являє стів, таких як римонабант, і засобів, розкритих в собою симвастатин. [WO 03/077847A2, опублікованій 25 вересня, 2003, Інший аспект винаходу, який представляє іні в WO 05/000809, опублікованій 6 січня. 2005], і (3) терес, належить до способу уповільнення початку фармацевтично прийнятного носія. або зниження ризику прояву атеросклерозу у паціОдна з фармацевтичних композицій, яка предєнта-людини, що потребує такого лікування, який ставляє інтерес, складена із сполуки формули І, включає введення зазначеному пацієнтові ефекописаної в даній роботі, або її фармацевтично тивних кількостей сполуки описаної вище формули прийнятної солі або сольвату в комбінації з DPP-IV І і інгібітору абсорбції холестерину. інгібітором, вибраним із групи, яка складається з: Більш конкретно, інший аспект винаходу, який представляє інтерес, належить до способу упові 23 85884 або її фармацевтично прийнятної солі або сольвату в комбінації з фармацевтично прийнятним носієм. Інша фармацевтична композиція, яка представляє інтерес, складена із сполуки формули І, описаної в даній роботі, або її фармацевтично прийнятної солі або сольвату в комбінації з антагоністом/зворотним агоністом СВ1 рецептора, у комбінації з фармацевтично прийнятним носієм. Приклади антагоністів/зворотних агоністів СВ1 рецептора, які представляють особливий інтерес в описаному тут винаході, включають римонабант і нижченаведені сполуки, які розкриті в [WO 03/077847A2, опублікованій 25 вересня. 2003]: (1) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]2-(4-хлорфенілокси)-2-метилпропанамід; (2) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]2-(2-піридилокси)-2-метил-пропанамід; (3) N-[3-(4-хлорфеніл)-1-метил-2-(3піридил)пропіл]-2-(4-хлорфенілокси)-2метилпропанамід; (4) N-[3-(4-хлорфеніл)-1 -метил-2фенілпропіл]-2-(3,5-дифторфенілокси)-2метилпропанамід; (5) N-[3-(4-хлорфеніл)-2-феніл-1-метилпропіл]2-(3,5-дихлорфенілокси)-2-метилпропанамід; (6) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]2-(3-хлорфенілокси)-2-метилпропанамід; (7) N-[3-(4-хлорфеніл)-2-(3,5-дифторфеніл)-1метилпропіл]-2-(2-піридилокси)-2метилпропанамід; (8) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]2-(5-хлор-2-піридилокси)-2-метилпропанамід; (9) N-[3-(4-хлорфеніл)-1-метил-2-фенілпропіл]2-(6-метилпіридилокси)-2-метилпропанамід; (10) N-[3-(4-хлорфеніл)-1-метил-2фенілпропіл]-2-(фенілокси)-2-метилпропанамід; (11) N-[3-(4-хлорфеніл)-1-метил-2фенілпропіл]-2-(5-трифторметилпіри-дилокси)-2метилпропанамід; (12) N-[3-(4-хлорфеніл)-2-(3-піридил)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; (13) N-[3-(4-хлорфеніл)-2-(3-ціанофеніл)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; (14) N-[3-(4-хлорфеніл)-2-(5-хлор-3-піридил)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; 24 (15) N-[3-(4-хлорфеніл)-2-(5-метил-3-піридил)1-метилпропіл]-2-(5-трифторметил-2-піридилокси)2-метилпропанамід; (16) N-[3-(4-хлорфеніл)-2-(5-ціано-3-піридил)1-метилпропіл]-2-(5-трифторметил-2-піридилокси)2-метилпропанамід; (17) N-[3-(4-хлорфеніл)-2-(3-метилфеніл)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; (18) N-[3-(4-хлорфеніл)-2-феніл-1метилпропіл]-2-(4-трифторметил-2-піридилокси)-2метилпропанамід; (19) N-[3-(4-хлорфеніл)-2-феніл-1метилпропіл]-2-(4-трифторметил-2-піримідилокси)2-метилпропанамід; (20) N-[3-(4-хлорфеніл)-1-метил-2-(тіофен-3іл)пропіл]-2-(5-хлор-2-піридилокси)-2метилпропанамід; (21) N-[3-(5-хлор-2-піридил)-2-феніл-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; (22) N-[3-(4-метилфеніл)-1-метил-2фенілпропіл]-2-(4-трифторметилфенілокси)-2метилпропанамід; (23) N-[3-(4-фторфеніл)-2-(3-ціанофеніл)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; (24) N-[3-(4-хлорфеніл)-2-(1-індоліл)-1метилпропіл]-2-(5-трифторметил-2-оксипіридин-2іл)-2-метилпропанамід; (25) N-[3-(4-хлорфеніл)-2-(7-азаіндол-N-іл)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; (26) N-[3-(4-хлорфеніл)-2-(1-індолініл)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; (27) N-[3-(4-хлорфеніл)-2-(N-метиланіліно)-1метилпропіл]-2-(5-трифторметил-2-піридилокси)-2метилпропанамід; (28) N-[3-(4-мeтoкcифeнiл)-2-(3-цiaнoфeнiл)l1мeтилпpoпiл]-2-(5-тpифтop-метил-2піридилокси)-2-метилпропанамід; (29) N-[3-(4-хлорфеніл)-2-(3-ціанофеніл)-1метилпропіл]-2-(6-трифторметил-2-піримідилокси)2-метилпропанамід; (30) N-[2-(3-ціанофеніл)-1,4-диметилпентил]-2(5-трифторметил-2-піридилокси)-2метилпропанамід; 25 85884 26 (31) N-[3-(4-хлорфенiл)-2-(1-оксидо-5-ціано-3ганічні основи й неорганічні або органічні кислоти піридил)-1-метилпропіл]-2-(5-трифторметил-2а також солі, які можуть бути перетворені на фарпіридилокси)-2-метилпропанамід; мацевтично прийнятні солі. Солі, що походять від (32) N-[2-(3-ціанофеніл)-3-циклобутил-1неорганічних основ, включають солі алюмінію, метилпропіл]-2-(5-трифторметил-2-піридилокси)-2амонію, кальцію, міді, тривалентного заліза, двометилпропанамід; валентного заліза, літію, магнію, тривалентного (33) N-[2-(3-ціанофеніл)-1-метилгептил]-2-(5марганцю, двовалентного марганцю, калію, натрифторметил-2-піридилокси)-2-метилпропанамід; трію, цинку й тому подібних. Особливо переваж(34) N-[2-(3-ціанофеніл)-3-циклопентил-1ними є солі амонію, кальцію, магнію, калію й наметилпропіл]-2-(5-трифторметил-2-піридилокси)-2трію. Солі, що походять від фармацевтично метилпропанамід; прийнятних органічних нетоксичних основ, вклю(35) N-[2-(3-ціанофеніл)-3-циклогексил-1чають солі первинних, вторинних і третинних аміметилпропіл]-2-(5-трифторметил-2-піридилокси)-2нів, заміщених амінів, що включають заміщені аміметилпропанамід; ни природного походження, циклічні аміни, і і в [WO 05/000809, опублікованій 6 січня, 2005], основні іонообмінні смоли, такі як аргінін, бетаїн, що включає наступні сполуки: кофеїн, холін, Ν,Ν'-дибензилетилендіамін, діети3-{1-[біс(4-хлорфеніл)метил]азетидин-3ламін, 2-діетиламіноетанол, 2іліден}-3-(3,5-дифторфеніл)-2,2диметиламіноетанол, етаноламін, етилендіамін, Nдиметилпропаннітрил, етилморфолін, N-етилпіперидин. глюкамін, глюко1-{1-[1-(4-хлорфеніл)пентил]азетидин-3-іл}-1замін, гістидин, іідрабамін, ізопропіламін, лізин, (3,5-дифторфеніл)-2-метилпропан-2-ол, метилглюкамін, морфолін, піперазин, піперидин, 3-((S)-(4-хлорфеніл){3-[(1S)-1-(3,5поліамінні смоли, прокаїн, пурини, теобромін, тридифторфеніл)-2-гідрокси-2-метилпропіл]азетидинетиламін, триметиламін, трипропіламін, тромета1-іл}метил)бензонітрил, мін (tromethamine) тощо. 3-((S)-(4-хлорфеніл){3-[(1S)-1-(3,5У випадку, коли сполука даного винаходу є осдифторфеніл)-2-фтор-2-метилпропіл]азетидин-1новною, солі можуть бути приготовлені з фармаіл}метил)бензонітрил, цевтично прийнятних нетоксичних кислот, які 3-((4-хлорфеніл){3-[1-(3,5-дифторфеніл)-2,2включають неорганічні й органічні кислоти. Такі диметилпропіл]азетидин-1-іл}метил)бензонітрил, кислоти включають оцтову, бензолсульфонову, 3-((1S)-1-{1-[(S)-(3-ціанофеніл)(4бензойну, камфорсульфонову, лимонну, етансуціанофеніл)метил]азетидин-3-іл}-2-фтор-2льфонову, фумарову, глюконову, глутамінову, метилпропіл)-5-фторбензонітрил, бромистоводневу. хлористоводневу, ізетіонову, 3-[(S)-(4-хлорфеніл)(3-{(1S)-2-фтор-1-[3-фтормолочну, малеїнову, яблучн у, мигдальну, мета5-(4Н-1,2,4-триазол-4-іл)феніл]-2нсульфонову, слизову, азотну, памову, пантотенометилпропіл}азетидин-1-іл)метил]бензонітрил і ву, фосфорну, бурштинову, сірчану, винну, п5-((4-хлорфеніл){3-[(1S)-1-(3,5-дифторфеніл)толуолсульфонову кислоту й тому подібні. 2-фтор-2-меіилпропіл]азетидин-1-іл}метил)тіофенОсобливо переважними є лимонна, бромисто3-карбонітрил, воднева, хлористоводнева, малеїнова, фосфорна, а також їх фармацевтично прийнятні солі й сосірчана й винна кислоти. львати в комбінації з фармацевтично прийнятним Сольвати, використані в даній роботі, наленосієм. жать до сполуки формули І або її солей у сполуОптичні ізомери, діастереомери, геометричні ченні з розчинником, таким як вода. Типові приізомери, таутомери клади включають гідрати, напівгідрати, тригідрати Багато які сполуки формули І містять один або й тому подібні. кілька асиметричних центрів і, таким чином, існуПри посиланнях на сполуки формули І передють у вигляді рацематів і рацемічних сумішей, бачається включення фармацевтично прийнятних окремих енантіомерів, діастереомерних сумішей і солей і сольватів. індивідуальних діастереомерів. Даний винахід Даний винахід належить до способу протидії включає всі такі ізомерні форми сполук у чистому або інгібування утворення або активності глюкаговигляді й також у вигляді сумішей. ну за допомогою зменшення швидкості глюкогенеДеякі із сполук, описаних у даній роботі, місзу й глікогенолізу й концентрації глюкози в плазмі. тять олефінові подвійні зв'язки й, якщо не обговоСполуки формули І можуть бути застосовані у рено особливо, призначені для включення як Е, виробництві лікарського засобу для профілактичтак i Ζ геометричних ізомерів. ного або терапевтичного лікування хворобливих Деякі із сполук, описаних у даній роботі, мають станів у ссавців, пов'язаних з підвищеними рівнярізні точки приєднання водню, що належать до ми глюкози, які одержують змішуванням сполуки таутомерів. Такий приклад може являти собою формули І з матеріалами-носіями для відтворення кетон або його енольну форму, відомі як кетолікарського засобу. енольні таутомери. Індивідуальні таутомери, а Інтервали доз також їх суміші охоплені сполуками формули І. Профілактична або терапевтична доза сполуСолі й сольвати ки формули І буде, звичайно, змінюватися залежСолі й сольвати сполук формули І включені в но від природи й тяжкості стану, який підлягає ліданий винахід. Термін "фармацевтично прийнятні куванню, вибраної конкретної сполуки й способу її солі" належить до солей, приготовлених з фармавведення. Вона буде також змінюватися відповідцевтично прийнятних в основному нетоксичних но до віку, маси й реакції індивідуального пацієнта. основ і кислот, які включають неорганічні або орВ основному, добовий дозовий діапазон знахо 27 85884 28 диться в інтервалі від приблизно 0,001мг до придо продукту, який містить активний і інертний інгблизно 100м на кг маси тіла,переважно від приредієнт(и) (фармацевтично прийнятні наповнюваблизно 0,01мг до приблизно 50мг на кг і більш печі), які представляють наповнювач, а також до реважно від приблизно 0,1мг до приблизно 10мг будь-якого продукту, який одержують, прямо або на кг, в однократних або розділених дозах, повтопобічно, шляхом комбінації, комплексоутворення рюваних через визначені інтервали часу. У деяких або агрегації будь-яких двох або декількох інгредівипадках може виникнути потреба в застосуванні єнтів, або шля хом дисоціації одного або декількох дозувань понад дані інтервали. Терміни "ефективінгредієнтів, або в результаті інших типів реакцій на кількість", ''протидіабетична ефективна кільабо взаємодій між інгредієнтами. Переважно, комкість" і інші терміни, які з'я вляються в процесі запозицію складають із сполуки формули І у кількосстосування, що регулює кількість сполуки, ті, ефективній для лікування, попередження або призначеної для використання, належать до пеуповільнення початку цукрового діабету 2 тип у, у редбачених дозових інтервалів, причому береться комбінації з фармацевтично прийнятним носієм. в розрахунок будь-яка необхідна зміна понад заБудь-який придатний спосіб введення може значені інтервали, установлювана фахівцембути використаний для забезпечення ссавця, осомедиком. бливо людини, ефективним дозуванням сполуки Типові дозування сполук формули І, а також їх даного винаходу. Наприклад, може бути викорисфармацевтично прийнятних солей і сольватів для таний пероральний, ректальний, локальний, паредорослих особин знаходяться в інтервалі від принтеральний, очний, легеневий, назальний і тому близно 0,1мг до приблизно 1,0г на добу, переважподібний спосіб. Приклади лікарських форм вклюно від приблизно 1мг до приблизно 500мг, в одночають таблетки, пастилки, дисперсії, суспензії, кратних або розділених дозах, повторюваних розчини, капсули, креми, мазі, аерозолі тощо, при через визначені інтервали часу. Типові дозування цьому переважними є таблетки. сполук, застосовуваних у комбінації із сполуками Для готування пероральних композицій моформули І, є відомими, або їх визначення знахожуть бути використані будь-які звичайні фармацедиться в компетенції фахівця в даній галузі з уравтичні середовища, такі як, наприклад, вода, гліхуванням опису, представленого в даній роботі. колі, масла, спирти, коригенти, консерванти, При використанні внутрішньовенного або пебарвники тощо, у випадку пероральних рідин, нарорального введення типовий інтервал доз знахоприклад, суспензій, еліксирів і розчинів; або носії, диться в інтервалі від приблизно 0,001мг до притакі як крохмалі, цукри, мікрокристалічна целюлоблизно 100мг (переважно від 0,01мг до приблизно за, розріджувачі, гранулоутворювальні засоби, 10мг) сполуки формули І на кг маси тіла на добу, і замаслювачі, зв'язувальні речовини, диспергатори більш переважно від приблизно 0,1мг до приблизтощо, у випадку пероральних твердих препаратів, но 10мг сполуки формули І на кг маси тіла на добу. наприклад, порошків, капсул і таблеток. ПереважПри застосуванні в комбінації з іншими засоними є тверді пероральні препарати. Через легбами вищевказані дозування для глюкагонового кість їх введення, таблетки й капсули являють соантагоніста забезпечуються разом зі звичайною бою найбільш вигідні пероральні стандартні дозою для іншого лікарського засобу. Наприклад, лікарські форми. Якщо потрібно, то таблетки моколи включений DPP-IV інгібітор, такий як інгібітожуть бути з покриттям, здійснюваним за стандартри, розкриті в [пат. США №6699871B1], DPP-IV. ними водними або неводними методиками. інгібітор може бути застосований у кількостях, що На додаток до звичайних лікарських форм, змінюються від приблизно 1,0мг до приблизно представлених ви ще, сполуки формули І можуть 1000мг, переважно від приблизно 2,5мг до прибути уведені способами контрольованого вивільблизно 250мг, і, особливо, від приблизно 50мг до нення діючої речовини й/або вивільняючими приприблизно 100мг, уведених в однократних добових стосуваннями, такими як описані в [патентах США дозах або в розділених дозах, повторюваних через №№ 3845770; 3916899; 3536809; 3598123; визначені інтервали часу, як доцільно. Аналогічно, 3630200 і 4008719]. при застосуванні глюкагонового антагоніста в комФармацевтичні композиції даного винаходу, бінації з СВ1 антагоністом/зворотним агоністом, придатні для перорального введення, можуть бути СВ1 антагоніст/зворотний агонист може бути запредставлені як окремі дози, такі як капсули, саше стосований у кількостях, що змінюються від приабо таблетки, причому кожна містить попередньо близно тільки 0,1мг аж до приблизно 1000 мг, фіксовану кількість активного інгредієнта, як побільш конкретно, у кількостях, що змінюються від рошок або гранули або як розчин або суспензія у приблизно 1,0мг до приблизно 100мг, і ще більш водній рідині, неводній рідині, як емульсія олія-уконкретно, у кількостях від приблизно 1,0мг до воді або емульсія вода-у-масляної рідини. Такі приблизно 10мг, уведених в однократних добових композиції можуть бути приготовлені будь-яким дозах або в розділених дозах, повторюваних через прийнятним фармацевтичним способом. Всі такі визначені інтервали часу, як доцільно. Приклади способи включають стадію змішування активного доз СВ1 антагоніста/зворотного агоніста включаінгредієнта(ів) з компонентами носія. В основному, ють 1мг, 2мг, 3мг, 4мг, 5мг, 6мг, 7мг, 8мг, 9мг і композиції приготовляють рівномірним і ретельним 10мг. змішуванням активного інгредієнта(ів) з рідким або Фармацевтичні композиції тонкоподрібненим твердим компонентом носія й Як визначено вище, фармацевтична композипотім, якщо необхідно, перетворенням суміші в ція містить сполуку формули І або її фармацевтинеобхідну форму продукту. Наприклад, таблетки чно прийнятну сіль або сольват і фармацевтично можуть бути приготовлені пресуванням або форприйнятний носій. Термін "композиція" належить муванням. Пресовані таблетки можуть бути приго 29 85884 30 товлені стисненням вільнотекучого порошку або рідиною. Бажано, щоб кожна таблетка містила, гранул, що містять активний інгредієнт(и), необонаприклад, від приблизно 0,1мг до приблизно 1,0г в'язково змішаний з одним або декількома наповактивного інгредієнта, і кожна капсула або саше нювачами, наприклад, зв'язувальними речовинамістила від приблизно 0,1мг до приблизно 500мг ми, замаслювачами, розріджувачами, поверхневоактивного інгредієнта. активними речовинами й дисперсантами. ФормоДалі представлені приклади фармацевтичних вана таблетка може бути зроблена формуванням лікарських форм, які містять сполуки формули І: суміші порошкової сполуки, зволоженої інертною Ін'єктована суспензія (в/г) Сполука формули І Метилцелюлюза Твін 80 Бензиловий спирт Бензальконій хлорид Вода для ін'єкції Капсула Сполука формули І Лактоза Mg стеарат Загальне мг/мл 10,0 5,0 0,5 9,0 1,0 t.d. 1,0мл мг/капсула 25,0 735 1,5 600мг Комбінована терапія Як раніше описано, сполуки формули І можуть бути застосовані в комбінації з іншими лікарськими засобами, які використовуються в лікуванні/профілактиці/уповільненні початку цукрового діабету 2 типу, а також інших захворювань і станів, описаних у даній роботі, для яких застосовні сполуки формули І. Інші лікарські засоби можуть бути уведені звичайно використовуваним способом і у звичайно використовуваній кількості одночасно або послідовно із сполукою формули І. Коли сполуку формули І застосовують одночасно з одним або декількома іншими лікарськими засобами, переважною є комбінована фармацевтична композиція, що містить такі інші лікарські засоби на доповнення до сполуки формули І. Відповідно, фармацевтичні композиції даного винаходу включають ті композиції, які альтернативно містять один або кілька інших інгредієнтів на доповнення до сполуки формули І. Приклади інших активних інгредієнтів, які можуть бути об'єднані із сполукою формули І, уведених або роздільно, або в ті ж самі фармацевтичні композиції, включають, але без обмеження тільки ними: (а) бігуаніди (наприклад, буформін, метформін, фенформін), (b) PPA агоністи (наприклад, троглітазон, піоглітазон, розиглітазон), (с) інсулін, (d) соматостатин, (e) інгібітори альфа-глюкозидази (наприклад, воглибоза, міглітол, акарбоза), (f) DPP-IV інгібітори, такі як інгібітори, розкриті в [пат. США № 6699871В1, виданому 2 березня, 2004], (g) LXR модулятори й (h) засоби, що підсилюють секрецію інсуліну (наприклад, ацетогексамід, карбутамід, хлорпропамід, гліборнурид, гліклазид, глімепірид, гліпізид. гліквідин, глізоксепід, глібурид, глігексамід, гліпінамід, фенбутамід, толазамід, толбутамід, толцикламід, натерглінід і репаглінід) і СВ1 інгібітори, такі як римонабант і сполуки, розкриті в [WO 03/077847 А2, опублікованій 2 вересня, 2003, і в WO 05/000809 А1, опублікованій 6 січня, 2005]. Масове відношення сполуки формули І до др угого активного інгредієнта може змінюватися в Таблетка Сполука формули І Мікрокристалічна целюлоза Повідон Набухлий крохмаль Стеарат магнію Загальне Мг/таблетка 25,0 415 14,0 4,35 2,5 500мг Аерозоль Сполука формули І Лецитин, NF Liq.Conc Трихлорметан, NF Дихлордифторметан, NF На ємність 250мг 1,2мг 4,025г 12,15г широких інтервалах і залежить від ефективної дози кожного активного інгредієнта. Звичайно, буде застосована ефективна доза кожного інгредієнта. Таким чином, коли сполуку формули І поєднують із РРА агоністом, масове відношення сполуки формули І до РРА агоніста буде звичайно змінюватися від приблизно 1000:1 до приблизно 1:1000. переважно від 200:1 до приблизно 1:200. Комбінації сполуки формули І і інших активних інгредієнтів в основному будуть також знаходитися у вищезгаданому інтервалі, але в кожному випадку повинна бути застосована ефективна доза кожного активного інгредієнта. Для комбінованих продуктів сполуку формули І можна змішати з будь-якими іншими активними інгредієнтами й потім додати до інгредієнтів носія; в альтернативному випадку порядок змішування може бути змінений. Приклади фармацевтичних комбінованих композицій включають: (1) сполуку формули І, (2) сполуку, вибрану із групи, яка складається з: (a) DPPIV інгібіторів; (b) інсулінових сенсибілізаторів, вибраних із групи, яка складається з (і) PPAR агоністів і (іі) бігуанідів; (с) інсуліну й інсулінових міметиків; (d) сульфонілсечовин і інших засобів, що підвищують секрецію інсуліну; (e) інгібіторів альфаглюкозидази; (f) антагоністів/зворотних агоністів СВ1 рецептора; (g) GLP-1, GLP-1 міметиків і агоністів GLP-1 рецептора; (h) GIP, GIP міметиків і агоністів GIP рецептора; (і) РАС АР, РАСАР міметиків і агоністів ΡАС АР 3 рецептора; (j) холестеринзнижуючих засобів, вибраних із групи, яка складається з (і) інгібіторів HMG-CoA редуктази, (іі) речовин, що підсилюють екскрецію, (iiі) нікотинілового спирту, нікотинової кислоти і її солей, (iv) PPAR альфаагоністів. (ν) PPAR альфа/гамма подвійних агоністів, (vi) інгібіторів абсорбції холестерину, (vii) інгібіторів ацил КоА(СоА):холестеринацилтрансферази, (viii) антиоксидантів і (іх) L XR модуляторів: (k) PPAR дельта-агоністів; (l) сполук проти ожиріння; (m) інгібітору кишкового транспортера жовчних кислот; (n) протизапальних засобів, за виключен 31 85884 32 ням глюкокортикоїдів; (о) інгібіторів протеїнтирохуванням конкретних прикладів, які представлені. зинфосфатази-1В (РТР-1В); (р) СВ1 антагонісУ синтетичних схемах використані скорочення з тів/зворотних агоністів і (3) фармацевтично прийннаступними значеннями, якщо не обговорено осоятного носія. бливо: Сполуки формули І можуть бути синтезовані за загальними схемами, наведеними нижче, з ураВu=бутил, t-Bu=трет-бутил ВОС, Вос=трет-бутилоксикарбоніл СOD=циклооктадієн СDІ=карбонілдіімідазол DСС=дициклогексилкарбодіімід DІЕА=діізопропілетиламін DМАС=диметилацетамід Вn і ВnzІ=бензил CBZ, Сbz=бензилоксикарбоніл DСМ=дихлорметан DІАD=діізопропілазодикарбоксилат DМАР=4-диметиламінопіридин DMPU=1,3-диметил-3,4,5,6-тетрагідро-2(1Н)піримідинон EtOН=етанол FAB-мас-спектр=мас-спектроскопія з бомбардуванням DМF=ДМФА=N,N-диметилформамід прискореними атомами EtOAc=етилацетат НРLC=ВЕРХ=високоефективна рідинна хроматографія eq.;=eквiвaлeнт(и) LАН=літійалюмогідрид НОАс=оцтова кислота МТВЕ=метил-трет-бутиловий ефір НОВТ, НОВt=гідроксибензтриазол MeCN, СН3СN=ацетонітрил МеОН=метанол ТFА=трифтороцтова кислота Ме=метил NМе2=диметиламіно РВS=фосфа тний буферний фізіологічний розчин 2СlРh=2-хлорфеніл Рh=феніл ІРА=ізопропанол ТНР=ТГФ=тетрагідрофуран Ру, Руr=піридил З6Н11=циклогeксил ІРАс=iзопропілацетат іРr=ізопропіл RT=к. т. =кімнатна температура 2,4-dіСlРh=2,4-Сl2Рh-2,4-дихлорфеніл Сполуки даного винаходу можуть бути приготовлені за методиками, представленими на наступних загальних синтетичних схемах. В одному з варіантів здійснення даного винаходу сполуки можуть бути приготовлені із проміжного продукту II (див. нижче) де R2 і R3 приймають значення, визначені вище, і R означає алкільну груп у. Сполуки II, у свою чергу, можуть бути приготовлені конденсацією b-кетоефіру І і бензилгідразину 2. Сполуки, такі як 1, є комерційно доступними, відомими в літературі або можуть бути зручно приготовлені різноманітними способами, добре відомими фахівцям у даній галузі. Один шлях проілюстрований на схемі 1 і описаний у [публікації Clay et al., Synthesis, 1993, 290]. Хлорангідрид кислоти 3, що може бути комерційно доступним або легко приготовленим з відповідної карбонової кислоти обробкою тіонілхлоридом при підвищених температурах або оксалілхлоридом у розчиннику, такому як метиленхлорид, у присутності каталітичної кількості диметилформаміду (ДМФА) при кімнатній температурі, обробляють етилмалонатом калію й хлоридом магнію в присутності основи, такої як триетиламін, в апротонному розчиннику, такому як етилацетат, протягом 1-16год., що приводить до кетоефіру 1. Бензилгідразин 2 може бути приготовлений з відповідного карбонільного аналога конденсацією із трет-бутилкарбазатом у присутності оцтової кислоти в неполярному розчиннику, такому як толуол, при підвищеній температурі протягом від 16 до 24год., схема 2. Проміжний продукт 4 потім відновлюють гідридним відновним агентом, таким як ціаноборогідрид натрію, і 1 еквівалентом птолуолсульфонової кислоти, які додають по краплях. В альтернативному випадку, оцтова кислота може бути використана як співрозчинник замість толуолсульфонової кислоти. Реакцію проводять у полярному апротонному розчиннику, такому як тетрагідрофуран (ТГФ) протягом 16-48год. при температурі навколишнього середовища. Після водної обробки борановий комплекс можна розкласти повільним додаванням водного розчину гідроксиду натрію або іншої сильної основи з одержанням карбамату 5 [див. Calabretta et al., Synthesis, 1991, 536]. Зняття захисної ВОС групи здійснюють обробкою кислотою, такою як трихлороцтова кислота, у метиленхлориді при темпера 33 85884 34 турі навколишнього середовища протягом 0,25льної стаціонарної фази В альтернативному випа2год. Реакція може бути проведена з або без додку, гідразон 4 може бути безпосередньо давання триізопропілсилану. Гідразин 2 може бути відновлений воднем і хіральним каталізатором, застосований або у вигляді його трифторацетатної таким як родій DuPHOS комплекс, як описано в солі прямо після видалення захисту, або у вигляді [публікації Burk et al, Tetrahedron, 1994, 50, 4399]. вільної основи, яка може бути приготовлена, і проРозчинник, застосований для реакції, звичайно був дукту, виділеного у вигляді гідрохлориду, додаспиртом, таким як 2-пропанол, і використовувався ванням водної хлористоводневої кислоти й випаводень при підвищеному тиску. Дана реакція порюванням розчинника. У випадку (R3 не означає винна дати продукт збагаченої енантіоселективноН), коли проміжний продукт 5 містить хіральний сти, який може бути далі очищений хіральною центр, енантіомери в даній точці можуть бути розхроматографією, описаною вище. ділені хроматографією із застосуванням гомохіра Конденсацію b-кетоефіру 1 і бензилгідразину 2, описану на схемі 3, проводять нагріванням двох компонентів у розчиннику, такому як оцтова кислота або ацетонітрил, протягом 1-8год., одержуючи піразолон 6. Перехід на даній стадії до ефіру b-аланіну 7 може бути досягнутий омиленням ефіру 6, застосовуючи основу, гаку як водний гідроксид літію або натрію в полярному розчиннику, такому як тетрагідрофуран, діоксан, метанол, етанол або суміш подібних розчинників. Конденсацію бета-аланінового ефіру 8 потім здійснюють застосуванням 1-етил-3-(3диметиламінопропіл)карбодііміду (EDC) і 1гідроксибензотриазолу (НОВt) або бензотриазол1-ілокситриспіролідинофосфоній гексафторфосфату (РуВОР) і основи, звичайно діізопропілетиламіну, у розчиннику, такому як Ν,Νдиметилформамід (ДМФА) або метиленхлорид, протягом періоду від 3 до 48 годин при темпера турі навколишнього середовища, одержуючи сполуки 7. Піразолон 7 потім обробляють ангідридом трифторметансульфонової кислоти в полярному апротонному розчиннику, такому як ТГФ, у присутності основи, такої як триетиламін, при температурі від -78°С до кімнатної температури, одержуючи проміжний продукт II. Даний продукт очищають від небажаних побічних продуктів перекристалізацією, розтиранням, препаративною тонкошаровою хроматографією, флешхроматографією на силікагелі, як описано в [публікації W. C. Still et al., J. Org. Chem., 43, 2923, (1978)], або ВЕРХ. Очищення проміжних продуктів виконують у такий же спосіб. Якщо проміжний продукт II є рацемічним (тобто, R3 не означає водень), то дана сполуки може бути розділена хіральною ВЕРХ із застосуванням або нормальної фази, або надкритичних рідких умов. 35 85884 36 Кінцеві продукти І можуть бути приготовлені взаємодією проміжного продукту II із відповідною нафтилбороновою кислотою 9. Дані сполуки є комерційно доступними або можуть бути приготовлені з комерційних продуктів. Один такий спосіб проілюстрований на схемі 4, для якої трициклічний проміжний продукт 10 приготовлений за [публікацією Schlosser et al., Eur. J. Org, Chem., 2001, 3991]. Потім він може бути підданий ароматизації обробкою йодидом натрію в апротонному розчиннику, такому як ацетонітрил. з наступним додаванням триметилсилілхлориду. Реакційну суміш перемішують при температурі навколишнього середовища протягом періоду від 1 до 5год. для одержання броміду 11. Дана сполука потім може бути перетворена на боронову кислоту обробкою біс(пінаколато)дибором, ацетатом калію й паладієвим каталізатором, таким як хлорид паладію II, і лігандом, таким як дифенілфосфінофероцен (dppf). Реакційну суміш нагрівають у полярному апротонному розчиннику, такому як ДМСО, протягом 1-5год. із наступним розщепленням боронатного ефіру обробкою розведеною кислотою, такою як хлористоводнева кислота, у розчиннику, такому як ацетон, протягом тривалого часу. Альтернативний шлях до боронової кислоти включає обробку нафтилгалогеніду 11 сильною основою, такою як бутиллітій, у полярному апротонному розчиннику, такому як ТГФ, при низьких температурах з наступним додаванням триалкілборату, такого як триметилборат. Реакційну суміш перемішують потім 1-5год. із нагріванням до температури навколишнього середовища, потім гасять розведеною кислотою, такою як розведена хлористоводнева кислота, перед виділенням проміжного продукту 9. Арилтрифлат II може бути уведений у взаємодію з бороновою кислотою 9 із застосуванням паладієвого каталізатора, такого як паладій 2-(дитрет-бутилфосфіно)біфеніл або трифенілфосфін. Звичайно розчинник являє собою або диметоксіетан (DME), етанол або толуол, триетиламін, карбонат цезію або натрію або фторид натрію також додають до реакції, яка може також включати воду й здійснюється при підвищених температурах і може бути проведена в мікрохвильовому реакторі [див. Wang et аl., Tet. Lett. 2000, 41, 4713 для родинних реакцій перехресного сполучання]. Видалення ефіру, коли R означає Me або Et, виконують омиленням з використанням основи, такої як водний гідроксид літію або натрію, у полярному розчиннику, такому як тетрагідрофуран, метанол, етанол або суміш подібних розчинників. Коли R означає залишок трет-бутилового ефіру, його щонайкраще видаляють обробкою трифтороцтовою кислотою в метиленхлориді протягом 0,5-3год. при температурі навколишнього середовища. Продукт очищають від небажаних побічних продуктів перекристалізацією, розтиранням, препаративною тонкошаровою хроматографією, флешхроматографією на силікагелі, як описано в [публікації W. С. Still et al., J. Org. Chem., 43, 2923, (1978)], або ВЕРХ. Очи щення проміжних продуктів виконують у такий же спосіб. У деяких випадках продукт реакцій, описаних на схемі 4, буде далі модифікований. Ці перетворення можуть включати, але без обмеження тільки ними, реакції заміщення, відновлення, окислювання, алкілування, ацилування й гідролізу, які звичайно відомі фахівцям уданій галузі. Альтернативний шлях до сполук (І) включає готування проміжного продукту III (див. нижче) де R1 і R2 приймають значення, визначені вище, і R означає алкільну груп у. Сполуки формули III, у свою чергу, можуть бути приготовлені конденсацією b-кетоефіру 12 і гідразину. Сполуки, такі як 12, можуть бути зручно приготовлені різноманітними способами, добре відомими фахівцям у даній галузі. Один із способів проілюстрований на схемі 5. Хлорангідрид кислоти 13, який може бути комерційно доступним або легко приготовленим з відповідної карбонової кислоти обробкою тіонглхлоридом при підвищених температурах або оксалілхлоридом у розчиннику, такому як метиленхлорид, у присутності каталітичної кількості диметилформаміду (ДМФА) при кімнатній температурі, обробляють етилмалонатом калію й 37 85884 38 хлоридом магнію в присутності основи, такої як тягом 1-8год., одержуючи піразолон 13-1. триетиламін, в апротонному розчиннику, такому як Піразолон 13-1 потім обробляють ангідридом триетилацетат, протягом 1-16год., що приводить до фтороцтової кислоти в полярному апротонному розчиннику, такому як ТГФ, у присутності основи, кетоефіру 12. Конденсацію b-кетоефіру 12 здійстакої як триетиламін, при температурі від -78°С до нюють нагріванням двох компонентів у розчинникімнатної температури, одержуючи трифлат 14. ку, такому як оцтова кислота або ацетонітрил, про Дану сполуку потім алкілують бензиловим спиртом 15, який приготовляють із карбонільного похідного 16, омиленням ефіру, застосовуючи основу, таку як водний гідроксид літію або натрію в полярному розчиннику, такому як тетрагідрофуран. діоксан, метанол, етанол або суміш подібних розчинників. Конденсацію бета-аланінового похідного 8 потім здійснюють застосуванням 1-етил-3(3-диметиламінопропіл)карбодііміду (EDC) і 1гідроксибензотриазолу (HOBt) або бензотриазол 1-ілокситриспіролідинофосфоний гексафторфосфату (РуВОР) і основи, звичайно діізопропілетиламіну, у розчиннику, такому як Ν,Νдиметилформамід (ДМФА) або метиленхлорид, протягом періоду від 3 до 48 годин при температурі навколишнього середовища. Відновлення фрагмента кетону до спирту 15 здійснюють застосуванням гідридного відновлювального агента, такого як борогідрид натрію, у полярному апротонному розчиннику, такому як метанол. Спирт 15 конденсується із трифлатом 14 з утворенням проміжного продукту III обробкою конденсувальним реагентом, таким як діізопропілазодикарбоксилат (DIAD), і триалкилфосфіном, таким як трифенілфосфін, у неполярному апротонному розчиннику, такому як метиленхлорид, протягом 0,5-6год. при температурі навколишнього середовища. У деяких випадках утворюються суміші регіоізомерів і вони можуть бути розділені, оскільки сполуку очищають від небажаних побічних продуктів перекристалізацією, розтиранням, препаративною тонкошаровою хроматографією, флеш хроматографією на силікагелі, як описано в [публікації W. С. Still et al., J. Org. Chem. 43, 2923, (1978) або ВЕРХ. Очищення проміжних продуктів виконують у такий же спосіб. Кінцеві продукти І потім можуть бути приготовлені взаємодією проміжного продукту III з відповідною арилбороновою кислотою 17. У деяких випадках дані сполуки є комерційно доступними, в інших вони можуть бути приготовлені з комерційних продуктів будь-якими фа хівцями в даній галузі, див. вище. Конденсацію здійснюють застосуванням паладієвого каталізатора, такого як паладій 2-(ди-трет 39 85884 40 бутилфосфіно)біфеніл або трифенілфосфін. Звиодержуючи проміжний продукт 18. Каталізована чайно розчинник являє собою або диметоксіетан, паладієм конденсація з відповідною нафтилбороетанол або толуол, і триетиламін, карбонат цезію новою кислотою 9 може бути проведена на цій або натрію або фторид натрію також додають до стадії застосуванням способу, аналогічного спосореакції, яка може також включати воду й здійснюбу, описаному вище. Кінцева обробка може бути ватися при підвищених температурах і може бути здійснена омиленням ефіру 19 з використанням проведена в мікрохвильовому реакторі. Видаленоснови, такої як водний гідроксид літію або натрію, ня ефіру, коли R=Me або Et, виконують омиленням у полярному розчиннику, такому як тетрагідрофуз використанням основи, такої як водний гідроксид ран, діоксан, метанол, етанол або суміш подібних літію або натрію, у полярному розчиннику, такому розчинників. Конденсацію бета-аланінового похідяк тетрагідрофуран, діоксан, метанол, етанол або ного 8 потім здійснюють застосуванням 1-етил-3суміш подібних розчинників. Коли R означає зали(3-диметиламінопропіл)карбодііміду (EDC) і 1шок трет-бутилового ефіру, його щонайкраще вигідроксибензотриазолу (HOBt) або бензотриазолдаляють обробкою трифтороцтовою кислотою в 1-ілокситриспіролідинофосфоний гексафторфосметиленхлориді протягом 0,5-3год. при темперафату (РуВОР) і основи, звичайно діізопропілетитурі навколишнього середовища. Продукт очищаламіну, у розчиннику, такому як N,Nють від небажаних побічних продуктів перекристадиметилформамід (ДМФА) або метиленхлорид, лізацією, розтиранням, препаративною протягом періоду від 3 до 48 годин при температутонкошаровою хроматографією, флешрі навколишнього середовища, одержуючи складхроматографією на силікагелі, як описано в [публіний ефір кінцевого продукту І. Видалення ефіру, кації W. C. Still et al., J. Org. Chem., 43, 2923, коли R=Me або Et. здійснюють омиленням з вико(1978)], або ВЕРХ. Очи щення проміжних продуктів ристанням основи, такої як водний гідроксид літію виконують у такий же спосіб. Якщо продукт є раабо натрію, у полярному розчиннику, такому як цемічним (тобто, R3 не означає водень), то потім тетрагідрофуран, діоксан, метанол, етанол або дана сполука може бути розділена хіральною суміш подібних розчинників. Коли R означає залиВЕРХ (HPLC) із застосуванням або нормальної шок трет-бутилового ефіру, його щонайкраще вифази, або надкритичних рідких умов. У деяких видаляють обробкою трифтороцтовою кислотою в падках продукт реакцій, описаних на схемі 6, буде метиленхлориді протягом 0,5-3год. при темперадалі модифікований. Ці перетворення можуть турі навколишнього середовища. Продукт очищавключати, але без обмеження тільки ними, реакції ють від небажаних побічних продуктів перекристазаміщення, відновлення, окислювання, алкілуванлізацією, розтиранням, препаративною ня, ацилування й гідролізу, які звичайно відомі тонкошаровою хроматографією, флешфа хівцям у даній галузі. хроматографією на силікагелі, як описано в [публіВ альтернативному випадку модифікація піракації W. C. Still et al., J. Org. Chem., 43, 2923, золону 6 може бути проведена в іншому порядку. (1978)], або ВЕРХ. Очи щення проміжних продуктів Піразолон 6 потім обробляють ангідридом тривиконують у такий же спосіб. Якщо сполука І є рафторметансульфонової кислоти (Tf2O) у полярноцемічною (тобто, R3 не означає водень), то потім му апротонному розчиннику, такому як ТГФ, у придана сполука може бути розділена хіральною сутності основи, такої як триетиламін, при ВЕРХ із застосуванням або нормальної фази, або температурі від -78°С до кімнатної температури, надкритичних рідких умов. У деяких випадках продукт І або попередній складний ефір від реакцій, описаних ви ще на схемах, буде далі модифікований. Ці перетворення можуть включати, але без обмеження тільки ними, реакції заміщення, відновлення, окислювання, алкілування, ацилування й гідролізу, які звичайно відомі фахівцям у даній галузі. Одна така модифікація, показана тут, коли одна R2 група являє собою захищений фенол, як у сполуці 20 (R означає не водень), включає вивільнення спирту й наступ ну етерифікацію, схема 8. Гідроксильна група може бути захищена у вигляді силільного простого ефіру, і в цьому випадку для реакції застосовують фторидне джерело, в основному фтористоводневу кислоту або фторид тетрабутиламонію. Видалення метоксіефірного захисту звичайно здійснюють звичайно обробкою сполуки трибромідом бору в розчиннику, такому як метиленхлорид, протягом періоду 1-16год. при температурі навколишнього середовища. Нарешті, якщо спирт захищений як 41 85884 42 алільний ефір, то захисну гр упу видаляють обробапротонному розчиннику, такому як метиленхлокою диметилбарбітуровою кислотою й паладієвим рид, протягом періоду від 15хв. до 2год. [Див. викаталізатором, звичайно це дання "Protective Groups in Organic Synthesis", трис(дибензиліденацетон)дипаладій(0), з ліганGreene, опубліковане Wiley and Sons]. дом, таким як 1,4-біс(дифенілфосфіно)бутан, в Вільна гідроксильна група потім може бути модифікована шляхом готування простих ефірів використанням спирту й конденсувального агента, такого як діізопропілазодикарбоксилат, і трифенілфосфін у в неполярному розчиннику, такому як метиленхлорид, при температурах від 0 до 40°С протягом періоду від 1 до 16год., схема 8. Проміжний продукт 21 потім може бути перетворений у цільові продукти, як описано раніше, див. ви ще. Альтернативний підхід до сполук (І) включає алкілування піразолу IV (ди в. нижче) де R1 і R2 приймають значення, визначені вище. Альтернативний шлях до проміжного продукту IV включає конденсацію алкінілкетону 25 з гідразином, як показано на схемі 2 і описано в [публікації Cabarrocas et al., Tetrahedron Asymmetry, Vol. 11, pg 2483-2493, 2000 і наведених там посиланнях]. Дану процедуру звичайно проводять у полярному розчиннику, такому як ДМФА при температурах 0-25°С протягом 16-24год. Готування проміжних продуктів 25 включає взаємодію алкіну 26 з амідом Вайнреба (Weinreb) карбонової кис Сполуки IV відомі в літературі або можуть бути зручно приготовлені різноманітними способами, добре відомими фахівцям у даній галузі як описані в [п ублікації Katritsky et al., Ad vances in Heterocyclic Chemistry, Vol. 6, p. 347-429]. Один зі способів проілюстрований на схемі 9. Ефір 22, що може бути комерційно доступним або легко приготовленим з відповідної карбонової кислоти етерифікацією із застосуванням, наприклад, метанолу або етанолу, що містить кислоту, таку як сірчана кислота, конденсується з аніоном метил кетону 23, утворюючи дикетон 24. Реакцію проводять із застосуванням основи, такої як гідрид натрію, у полярному апротонному розчиннику, такому як тетрагідрофуран (ТГФ) при температурі від 0 до 25°С протягом періоду від 16 до 24год., [див. March, Advances Organic Chemistry, Vol. 3 rd Ed., pg 439 і посилання там]. Сполуки, такі як 23, є комерційно доступними або можуть бути приготовлені різноманітними способами, добре відомими фахівцям у даній галузі. Дикетон 24 потім конденсується з гідразином у полярному розчиннику, такому як метанол, що може містити кислоту, таку як оцтова або хлористоводнева, протягом періоду від 16 до 24год. при температурі від 0 до 25°С. лоти з відповідною функціональністю при використанні утр удненої основи, такої як літійдіізопропіламід або бутиллітій, у полярному апротонному розчиннику, такому як ТГФ. при -78°С. Дана реакція описана в деталях у [п ублікації Tetrahedron Lett., Vol. 22. pg 3815, 1981]. Алкіни 26 є або комерційно доступними, або одержані з відповідного галогеніду й алкінілмагніййодиду, [див. Negishi et al., J. Org. Chem., Vol. 62, pg 8957-8960, 1997 і Org. Lett., Vol. 3, pg 3111-3113, 2001]. 43 Проміжний продукт IV може бути потім перетворений на сполуки І, як показано на схемі 11. Алкілування піразолу IV 4карбоалкоксибензилбромідом може бути проведене після депротонування піразолу основою, такою як гідрид натрію або карбонат цезію, у полярному розчиннику, звичайно диметилформаміді (ДМФА), при температурі від 0 до 25°С протягом періоду від 3 до 24год. В альтернативному випадку, алкілування може бути здійснено застосуванням спирту 15, як описано на схемі 6, див. вище. У деяких випадках будуть утворені суміші ізомерів. їх звичайно можна розділити перекристалізацією, розтиранням, препаративною тонко 85884 44 шаровою хроматографією, фле шхроматографією на силікагелі, як описано в [публікації W. C. Still et al., J. Org. Chem. 43, 2923, (1978)], або ВЕРХ. Сполуки, очищені ВЕРХ, можуть бути виділені як відповідні солі. Перетворення на кінцеві сполуки потім проводять, як описано раніше для ефіру 19. У деяких випадках продукт реакцій, описаних на схемі 3, буде далі модифікований. Ці перетворення можуть включати, але без обмеження тільки ними, реакції заміщення, відновлення, окислювання, алкілування, ацилування й гідролізу, які звичайно відомі фахівцям у даній галузі. Альтернативний спосіб, який показує енантіоселективний шлях до сполуки І, розкритий на схемах 12 і 13. Сполуку 4а, одержану як показано на схемі 2, див. вище, відновлюють родієвим каталізатором, звичайно Rh(COD)2BF4, у присутності ліганду, такого як показаний нижче, в ізопропанолі, метанолі або етилацетаті, одержуючи 5а. 45 85884 Ph2-F-C-P-tBu2 являє собою каталізатор Жозифоса (Josiphos), що розкритий у [пат. США №6777567У2] (Solvias) і комерційно доступний від Strem. Xyl-P-Phos розкритий у [пат. США № 5886182] (Synetix) і комерційно доступний від Як показано вище на схемі 13, комерційно доступні сполуки 27 і 28 конденсуються. Спочатку сполуку 28 змішують із ТГФ-розчином третбутоксиду калію при зниженій температурі, такій як приблизно від -20°С до приблизно -5°С, для утворення еноляту (не показаний). Ефір 27 додають із підігрівом до приблизно 20°С, одержуючи дикетон 1a. Дикетон 1а змішують із сполукою 2а в придатному розчиннику. Приклади включають EtOН, ТГФ, НОАс, ДМФА, ІРА, ДМСО, DMAc, DMPU, MeCN, толуол і ІРАс. Безводний LiCl додають для одержання за регіоселективним способом необхідного проміжного продукту 19 у вигляді етилового ефіру. Перетворення даного етилового ефіру на піразолзаміщену кислоту 29 виконують при гідролітичних умовах, наприклад, у суміші ТГФ і МеОН з NaOH при кімнатній температурі. 46 Strem. Me-f-Ketalphos також комерційно доступний від Chiral Quest. Зняття захисту з ВОС-карбамату кислотою, бензолсульфоновою кислотою, в основному в безводних умовах приводить до проміжного продукту 2а з відсутністю за хисту. Продукт 29 у вигляді кислоти потім може бути виділений такими способами, як кристалізація. Установленням рН до нейтрального значення можуть бути осаджені й вилучені продукт, що не прореагував, і побічні продукти. Придатні розчинники для кристалізації й суміші розчинників включають комбінації МТВЕ/гептан і МеОН/вода. Сполуку 29 потім піддають взаємодії з бетааланінетиловим ефіром, HCl сіллю, через утворення хлорангідриду кислоти (не показаний), що може бути приготовлений використанням оксаліл або тіонілхлориду з наступним видаленням HCl відгонкою. В альтернативному випадку, як показано на схемах, амідування може бути здійснено використанням CDI як активуючого агента, у придатному розчиннику, наприклад, ТГФ при к. т. з наступним додаванням бета-аланіну у формі етилового ефіру, HCl солі, при 50°С. Для гідролізу 47 85884 48 етилового ефіру додають основу, наприклад, NaOH, у розчиннику, такому як МеОН, при к. т. Підкислення за допомогою HCl дає продукт, що може бути проекстрагований за допомогою іРАс і виділений наступною кристалізацією із суміші ацетонітрил/Н2О. Загальний експеримент: препаративну ВЕРХ Стадія А. 2-Бром-7виконували на YMC-Pack Pro С18 колонці (трифторметокси)нафталін. Дану сполуку одержу(150x20мм внутрішній діаметр (i.d.)) з елююванням вали, використовуючи умови для 2-бром-6при 20мл/хв. 0-100% ацетонітрилом у воді (0,5% (трифторметокси)нафталіну, описані вище. ЯМР TFA). (500МГц, CDCl3) d: 7,35 (дд, J=2,4, 8,9Гц, 1Н), 7,58 Наступні приклади наведені, щоб винахід міг (ушир. с, 1Н); 7,59 (дд, J=2,0, 8,8ц, 1Н); 7,73 (д, бути представлений більш повно. їх не слід J=8,8Гц, 1Н); 7,84 (д, J=9,0Гц, 1Н); 8,00 (д, J=2,0Гц, сприймати як обмеження даного винаходу в будь1Н). якому відношенні. Стадія В. [7-(Трифторметокси)-2Одержання проміжних продуктів описано нижнафтил]боронова кислота. Дану сполуку одержуче, вони використані в синтезах прикладів 1-149. вали, використовуючи умови для [6(трифторметокси)-2-нафтил]бороновоі кислоти, описані вище. ЯМР (500МГц, CDCl3) d: 7,74 (дд, J=2,2, 8,9Гц, 1Н); 7,93 (ушир. с, 1Н); 7,97 (д, J=8,9Гц, 1Н); 8,02 (д, J=8,3Гц, 1Н); 8,34 (д, J=8,3Гц, 1Н); 8.85 (ушир. с, 1Н). Стадія А. 2-бром-6-(трифторметокси)нафталін. 2-Бром-6-(трифторме-токси)-1,4-дигідро-1.4епоксинафталін [посилання: Schlosser, Μ., Castgnetti, E., Eur. J. Org. Chem. 2001, 3991-3997] (1,09г, 3,55ммоль) і Nal (1,6г, 10,7ммоль) розчиняли в сухому CH3CN (40мл) з наступним додаванням TMSCl (1,35мл, 10,7ммоль). Реакційну суміш перемішували протягом 2,5год., гасили 5% Na2SO3 і екстрагували ефіром. Ефірний розчин промивали 5% Na2SO3, насиченим сольовим розчином і сушили над Na2SO4. Неочищений продукт хроматографували (SiO2, гексани), одержуючи 2-бром-6(трифторметокси)нафталін у вигляді білих кристалів. ЯМР (500МГц, CDCl3) d: 7,36 (дд, J=2,6, 9,0Гц, 1Н); 7,60 (дд, J=2,0, 8,8Гц, 1Н); 7,63 (ушир. с, 1Н); 7,69 (д, J=8,8Гц, 1H), 7,77 (д, J=9,0Гц, 1Н); 8,01 (д, J=2,0Гц, 1Н). Стадія В. [6-(Трифторметокси)-2нафтил]боронова кислота. 2-Бром-6(трифторметокси)нафталін (428мг, 1,47ммоль), біс(пінаколато)дибор (410мг, 1,62ммоль) і КОАс (433мг, 4,41ммоль) суспендували в ДМСО (12мл). Суміш дезоксигенували у вакуумі періодичними надходженнями N2 з наступним додаванням каталізатора PdCl2(dppf) (30мг, 2,5мл. %) Реакційну суміш нагрівали в атмосфері N2 до 80°С протягом 2год. Реакційну суміш розбавляли гексаном (100мл), промивали водою, насиченим сольовим розчином і сушили над Na2SO4. Після випарювання розчинника одержаний залишок обробляли ацетоном (20мл) і 2Η HCl (5мл) протягом 24год. Сиру боронову кислоту очищали ВЕРХ з оберненою фазою, одержуючи [6-(трифторметокси)-2нафтил]боронову кислоту у вигляді білого порошку. ЯМР (500МГц, CDCl3) d: 7,44 (дд, J=2,3, 9,0Гц, 1Н); 7,74 (ушир. с, 1Н), 7,98 (д, J=8,2Гц, 1Н); 8,11 (д, J=9,0Гц, 1Н); 8,35 (дд, J=1,1, 8,2Гц, 1Н), 8,85 (ушир. с, 1Н). Стадія А. 2-Бром-5(трифторметокси)нафталін. Дану сполуку одержували, використовуючи умови для 2-бром-6(трифторметокси)нафталіну, описані вище. ЯМР (500МГц, CDCl3) d: 7,39 (дд, J=1,6, 7,8Гц, 1Н); 7,48 (т, J=8Гц, 1Н); 7,66 (дд, J=1,9, 9,0Гц, 1Н); 7,69 (д, J=8,3Гц, 1Н); 8,01 (д, J=9,0Гц, 1Н); 8,05 (д, J=1,9Гц, 1Н). Стадія В. [5-(Трифторметокси)-2нафтил]боронова кислота. Дану сполуку одержували, використовуючи умови для [6(трифторметокси)-2-нафтил]боронової кислоти, описані вище. ЯМР (500МГц, CDCl3) d: 7,51 (дд, J=1,4, 7,6Гц, 1Н); 7,55 (т, J=8Гц, 1Н), 8,02 (д, J=8,0Гц, 1H); 8,29 (д, J=8,5Гц, 1Н); 8,40 (дд, J=1,1, 8,5Гц, 1Н); 8,86 (ушир. с, 1Н). Стадія А. 2-Бром-8(трифторметокси)нафталін. Дану сполуку одержували, використовуючи умови для 2-бром-6(трифторметокси)нафталіну, описані вище. ЯМР (500МГц, CDCl3) d: 7,41 (дд, J=1,9, 7,7Гц, 1Н); 7,47 (т, J=8Гц, 1H); 7,64 (дд, J=2,0, 8,8Гц, 1Н); 7,75 (д, J=8,7Гц, 2Н); 8,29 (д, J=1,9Гц, 1Н). Стадія В. [8-(Трифторметокси)-2нафтил]боронова кислота. Дану сполуку одержу 49 85884 50 вали, використовуючи умови для [6[ (трифторметокси)-2-нафтил]боронової кислоти, 5-Хлор-2-(трифторметокси)феніл]боронова кислота. Розчин н-ВuLi (17мл, 1,6Μ у гексані) доописані вище. ЯМР (500МГц, CDCl3) d: 7,48 (д, давали впорскувальним насосом протягом однієї J=7,6Гц, 1Н); 7,59 (т, J=7,9Гц, 1Н); 7,88 (д, J=8,2Гц, години до ТГФ (50мл) розчину 1-хлор-41Н); 8,05 (д, J=8,2Гц, 1Н); 8,40 (дд, J=1,2, 8,2Гц, (трифторметокси)бензолу (5,0г, 25,5ммоль) і діізо1Н); 8,18 (с, 1Н). пропіламіну (0,42мл, 3ммоль) при -78°С. Через 20хв. додавали триметилборат (8мл, 70ммоль), суміш перемішували при -78°С протягом 2 годин. Охолоджувальну баню видаляли, реакційній суміші давали нагріватися до кімнатної температури (1-2год.). Реакційну суміш потім гасили 2Η HCl (40мл) і перемішували протягом ночі. Розчинник видаляли при зниженому тиску й залишок розчиняли в суміші СН3CN-Н2О-діоксан. ВЕРХ з оберне(2,2,4,4-Тетрафтор-4Н-1,3-бензодіоксин-6ною фазою, після ліофілізації, давала [5-хлор-2іл)боронова кислота. Дану сполуку одержували, (трифторметокси)феніл]боронову кислоту у виглявикористовуючи умови для [6-(трифторметокси)-2ді білого порошку. ЯМР (500МГц, CDCl3) d: 7,32 (д, нафтил]боронової кислоти, описані вище ЯМР J=8,8Гц, 1Н), 7,60 (дд, J=2,7, 8,8Гц, 1Н); 8,20 (д, (500МГц, CDCl3) d: 7,32 (д, J=8,3Гц, 1Н); 8,43 (д, J=2,7Гц, 1Н). J=8,3Гц, 1Н); 8,44 (с, 1Н). (2,2,3,3-Тетрафтор-2,3-дигідро-1,4бензодіоксин-6-іл)боронова кислота. Дану сполуку одержували, використовуючи умови для [6-(трифторметокси)-2нафтил]боронової кислоти, описані вище. ЯМР (500МГц, CDCl3) d: 7,30 (д, J=8,2Гц, 1Н); 7,96 (д, J=1,4Гц, 1Н); 8,01 (дд, J=1,4, 8,2Гц, 1Н). [3-Фтор-4-(трифторметокси)феніл]боронова кислота. Розчин 4-бром-2-фтор-1(трифторметокси)бензолу (1,0мг, 3,9ммоль) у ТГФ (5мл) повільно додавали до н-ВuLi (3,0мл, 1,6Μ у гексані) у ТГФ (5мл) при -78°С. Через 20хв. додавали триметилборат (1,4мл, 12ммоль). суміш перемішували при -78°С протягом 2 годин. Охолоджувальну баню видаляли, реакційній суміші давали нагріватися до кімнатної температури (12год.). Реакційну суміш потім гасили 2Η HCl (10мл) і перемішували протягом ночі. Розчинник видаляли при зниженому тиску й залишок розчиняли в суміші СН3СN-Н2О-діоксан. ВЕРХ з оберненою фазою, після ліофілізації, давала [3-фтор-4(трифторметокси)феніл]боронову кислоту у вигляді дрібного порошку. ЯМР (500МГц. CDCl3) d: 7,47 (м, 1Н); 7,99 (м, 2Н). [3-Хлор-4-(трифторметокси)феніл]боронова кислота. Розчин NaNO2 (2,4г, 33ммоль) у воді (6мл) повільно додавали до суспензії [3-хлор-4(трифторметокси)феніл]аміну (2,95г, 13.9ммоль) в 20мл 15% HCl при 0°С. Твердий продукт видаляли фільтруванням і розчин NaBF4 (2,4г, 22ммоль) у воді (15мл) змішували з фільтратом. Тверду речовину збирали фільтруванням, сушили при 40°С, одержуючи 2,62г діазонієвої солі. РХ-МС (LC-MS): одинарний пік із правильним МС (223,6). Одержану вище тверду речовину потім змішували з біс(пінаколато)дибором (2,14г, 8.4ммоль), PdCl2(dppf) (180мг, 2,5%) у колбі, дезоксигенованої у вакуумі періодичними надходженнями N2, з наступним додаванням МеОН (N2 продувка). Суміш перемішували при кімнатній температурі протягом 2год. Розчинник випарювали й залишок хроматографували (SiO2, градієнт 0-10% етилацетат у гексані), одержуючи боратний ефір у вигляді масла. ЯМР (500МГц, CDCl3) d: 1,34 (с, 12Н); 7,31 (кд. J=1,5, 8,2Гц, 1Н); 7,71 (дд, J=1,5, 8,2Гц, 1Н): 7,90 (д, J=1,5Гц, 1Н). Боратний ефір гідролізували в ацетоні-НСІ, як описано для [6-(трифторметокси)-2нафтил]боронової кислоти, одержуючи [3-хлор-4(трифторметокси)феніл]боронову кислоту у вигляді дрібного порошку. ЯМР (500МГц, CDCl3) d: 7,48 (кд, J=1,6, 8,1Гц, 1Н); 8,13 (дд, J=1,6, 8,1Гц, 1Н); 8,25 (д, J=1,6Гц, 1Н). 51 85884 52 Стадия А. 6-(Трифторметил)-1,4-дигідро-1,4шар промивали послідовно двома порціями води й епоксинафталін. До 25мл тетрагідрофурану при однією порцією насиченого сольового розчину. 78°С додавали н-бутиллітій (13,9мл, 22,2ммоль), Органічний шар сушили над сульфатом магнію, потім діізопропіламін (3,1мл, 22,2ммоль). Одержаконцентрували у вакуумі й залишок очищали ну суміш перемішували при -78°С протягом 10хв., флеш-колонковою хроматографією (SiO2, 5% етипотім повільно додавали фуран (24мл, 330ммоль). лацетат/іексани), одержуючи 2-бром-6До реакційної суміші додавали 4(трифторметил)нафталін у вигляді білої твердої бромбензотрифторид (5г, 22,2ммоль) у вигляді речовини. 1H ЯМР (500МГц, CDCl3) d: 8,15 (с, 1Н); розчину в 10мл тетрагідрофурану, видаляли холо8,11 (с, 1Н); 7,89 (д, J=8,7Гц, 1Н); 7,83 (д, J=8,7Гц, дну баню, і суміші давали нагріватися до кімнатної 1Н); 7,70 (дд, J=1,6, 8,7Гц, 1Н); 7,69 (дд, J=1,8, температури протягом 2,5год. Додавали воду, су8,7Гц, 1Н). міш виливали в гексани, і органічний шар промиСтадія D. [6-(Трифторметил)-2вали послідовно двома порціями 1Η HCl і однією нафтил]боронова кислота. 2-Бром-6порцією насиченого сольового розчину. Органіч(трифторметил)нафталін (50мг, 0,182ммоль), ний шар сушили над сульфатом магнію, концентбіс(пінаколато)дибор (92мг, 0,362ммоль) і ацетат рували у вакуумі й маслянистий залишок очищали калію (53мг, 0,540ммоль) суспендували в 2,5мл флеш-колонковою хроматографією (SiO2, 5% етиметилсульфоксиду. Суміш дезоксигенували чотилацетат/гексани), одержуючи зазначену в заголоврма порціями азоту у вакуумі й додавали дихку сполуку. 1H ЯМР (500МГц, CDCl3) d: 7,51 (с, 1Н); лор[1,1'-біс(дифенілфосфіно)фероцен]паладій (II) 7,35 (м, 2Н); 7,10 (м, 2Η); 5,81 (ушир. с, 2Н). дихлорметановий аддукт (3,7мг, 0,0045ммоль) і ΒΕΡΧ/MC: m/z=213,00 (M+1). одержану суміш нагрівали при 80°С у атмосфері Стадія В. 2-Бром-6-(трифторметил)-1,4азоту протягом 1год. Суміш охолоджували, розбадигідро-1,4-епоксинафталін і 2-бром-7вляли етилацетатом і промивали послідовно дво(трифторметил)-1,4-дигідро-1,4-епоксинафталін. 6ма порціями води й однією порцією насиченого (Трифторметил)-1,4-дигідро-1,4-епоксинафталін сольового розчину. Органічний шар сушили над (380мг, 1,79ммоль) і карбонат натрію (200мг, сульфатом магнію, концентрували у вакуумі й за1,89ммоль) змішували в 11мл чотирихлористого лишок суспендували в суміші 10мл ацетону й 2мл вуглецю й нагрівали до 70°С. До суміші додавати водної 2Η хлористоводневої кислоти. Одержану по краплях бром (288мг, 1,80ммоль) у вигляді розсуміш нагрівали при 60°С протягом 16 годин і сиру чину в 3мл чотирихлористого вуглецю й одержану боронову кислоту очи щали ВЕРХ з оберненою суміш нагрівали при 80°С протягом 10хв. Блідофазою, одержуючи [6-(трифторметил)-2жовтий розчин охолоджували, фільтрували через нафтил]боронову кислоту у вигляді білого порошпухкий шар сульфату натрію й концентрували у ку. 1H ЯМР (500МГц, DMSO) d: 8,47 (с, 1Н); 8,38 (с, вакуумі. Одержаний маслянистий залишок суспен1Н); 8,33 (ушир. с, 2Н); 8,14 (д, J=8,7Гц, 1Н); 8,07 дували в 4мл тетрагідрофурану й додавали до (д, J=8,2Гц, 1Н); 8,00 (д, J=8,2Гц, 1Н); 7,73 (дд, суспензії трет-бутоксид калію (638мг, 5,4ммоль) в J=1,6, 8,5Гц, 1Н). 5мл тетрагідрофурану при 50°С. Після нагрівання при 50°С протягом 24год. суміш охолоджували, виливали в гексани й промивали послідовно двома порціями води й однією порцією насиченого сольового розчину. Органічний шар сушили над сульфатом магнію, концентрували у вакуумі й очищали препаративною ТШХ (TLC) (SiO 2m 5% етилацетат/гексани), одержуючи зазначені в загоСтадия А. 2-Бром-7-(трифторметил)нафталін. ловку сполуки. 2-Бром-6-(трифторметил)-1,4Дану сполуку одержували, додержуючись способу 1 дигідро-1,4-епоксинафталін: H ЯМР (500МГц, 2,6-ізомеру, описаного вище для проміжного проCDCl3) d: 7,51 (м, 2Н); 7,40 (д, J=7,3Гц); 7,02 (д, дукту J. 1H ЯМР (500МГц, CDCl3) d: 8,11 (д, J=2Гц, 1Н); 5,84 (ушир. с, 1Н); 5,55 (с, 1Н) і 2-бромJ=1,6Гц, 1Н); 8,07 (с, 1Н); 7,94 (д, J=8,7Гц, 1Н); 7-(трифторметилу 1,4-дигідро-1,4-епоксинафталін 7,79 (д, J=9,0Гц, 1Н); 7,70 (дд, J=1,8, 8,9Гц, 1Н); (одержані у вигляді 2:1 суміші із проміжним проду7,68 (дд, J=1,9, 8,9Гц, 1Н). ктом реакції (1R,2R,3S,4S)-2,3-бибром-6Стадія В. [7-(Трифторметил)-2(трифторметил)-1,2,3,4-тетрагідро-1,4нафтил]боронова кислота. Дану сполуку одержуепоксинафталіном). Дану суміш розділяли на навали, додержуючись способу 2,6-ізомеру, описаноступній стадії. 1H ЯМР (500МГц, CDCl3) d: 7,65 (м, го вище для проміжного продукту J. 1H ЯМР 2,5Н); 7,61 (д, J=8,0Гц, 0,5Н); 7,52 (д, J=7,8Гц, (500МГц, CD3OD) d: 8,29 (м, 2Н); 8,05 (д, J=8,7Гц, 0,5Н); 7,40 (м, 2Н); 7,00 (д, J=2,1Гц, 1Н); 5,83 1Н); 8,00-7,88 (м, 2Н); 7,69 (д, J=8,5Гц, 1Н). (ушир. с, 1Н); 5,61 (с, 0,5Н); 5,55 (с, 1Н); 4,27 (м, 0,5Н). Стадія С. 2-Бром-6-(трифторметил)нафталін. 2-бром-6-(трифторметил)-1,4-дигідро-1,4епоксинафталін (624мг, 2,14ммоль) і йодид натрію (980мг, 6,54ммоль) розчиняли в 13мл сухого ацетонітрилу й додавали триметилсилілхлорид (0,823мл, 6,54ммоль). Одержану суміш перемішували при температурі навколишнього середовища протягом 3,5год., виливали в гексани й органічний 53 85884 54 Стадия А. 2-Бром-6-хлорнафталін. 6-Бром-2зинкарбоксилат. Розчин трет-бутилкарбазату нафтойну кислоту (4,00г, 15,9ммоль) обробляли (13,90г, 105ммоль) і етил 4-ацетилбензоату 40мл тіонілхлориду при 80°С протягом 1год. Суміш (20,00г, 0,104ммоль) у толуолі (120мл) перемішуконцентрували у вакуумі й утворений неочищений вали при 80°С протягом ночі (15год.). Трет-бутил хлорангідрид кислоти (3г, 11,1ммоль) змішували з 2-{1-[4(етоксикарбо2,2'-азобісізобутиронітрилом (731мг, 4,45ммоль) в ніл)феніл]етиліден}пдразинкарбоксилат виділявся 25мл чотирихлористого вуглецю й 15мл хлорбену вигляді кристалічної твердої речовини, його збизолу. Дану суміш повільно додавали за допомогою рали фільтруванням суміші. ВЕРХ/МС: m/z=307,3 краплинної лійки до суміші натрієвої солі 2(M+1)+, Rt=3,47хв. 1H ЯМР (500МГц, CDCl3) d: 8,05 меркаптопіридин-1-оксиду (1,99г, 13,7ммоль) і 4(2Н, д, J=8,5Гц), 7,88 (2Н, д, J=8,5Гц), 7,79 (1Н, (диметиламіно)піридину (150мг, 1,23ммоль) при ушир. с), 4,41 (2Н, кв, J=7,0Гц), 2,24 (3H, с), 1,58 100°С. Після закінчення додавання суміш перемі(9Н, с), 1,43 (3H, т, J=7,0Гц). шували протягом додаткових 4год., о холоджували Стадія В. Трет-бутил-2-{1-[4й твердий осад побічного продукту видаляли філь(етоксикарбоиіл)феніл]етил]гідразин-карбоксилат. труванням. Фільтрат концентрували у вакуумі й У наповненій N2 круглодонній колбі, оснащеній залишок очищали флеш-колонковою хроматограсироватковими ковпачками й магнітною мішалкою, фією (SiO2 , гексани), одержуючи зазначену в загорозчиняли NaBH3CN (6,0г, 0,095моль) і трет-бутилловку сполуку у вигляді білої твердої речовини. 1H 2-{1-[4ЯМР (500МГц, CDCl3) d: 8,02 (ушир. с, 1Н); 7,83 (д, (етоксикарбоJ=1,6Гц, 1Н); 7,72 (д, J=8,7Гц, 1Н); 7,66 (д, J=8,7Гц, ніл)феніл]етиліден}гідразинкарбоксилат (25,6г, 1Н); 7,60 (дд, J=2,0, 8,9Гц, 1Н); 7,47 (дд, J=2,1, 0,084моль) у ТГФ (200мл). Розчин моногідрату п8,7Гц, 1Н). толуолсульфонової кислоти (17,3г, 0,091моль) в Стадія В. 2-(6-Хлор-2-нафтил)-4,4,5,5ЕРА (50мл) повільно додавали впорскувальним тетраметил-1,3,2-діоксаборолан. 2-Бром-6насосом. На завершення додавання було потрібно хлорнафталін (205мг, 0,849ммоль), приблизно 10год. Суміш розбавляли за допомогою біс(пінаколато)дибор (432мг, 1,70ммоль) і ацетат EtOAc (200мл) і суспензію екстрагували насиченим калію (250мг, 2,55ммоль) розчиняли в 12мл месольовим розчином (150мл). Органічну фазу відотилсульфоксиду. Суміш дезоксигенували чотирма кремлювати, сушили (Na2SO4) і концентрували на порціями азоту у вакуумі й додавали дихлор[1,1'роторному випарнику, одержуючи білу тверду ребіс(дифенілфосфіно)фероцен]паладій (II) дихлорчовину. Дан у тверду речовину брали в СН 2Сl2 метановий аддукт (70мг, 0,085ммоль). Одержану (100мл) і до розчину додавали 1Η NaOH (100мл). суміш нагрівали при 80°С у атмосфері азоту проСуспензію інтенсивно перемішували при к. т. протягом 3год., потім дозволяли їй знаходитися при тягом 1 години й потім розбавляли СН2Сl2 (100мл). температурі навколишнього середовища протягом Органічну фазу відокремлювали й екстрагували 16год. Суміш розбавляли етилацетатом, промива1Η HCl (2x150мл), насиченим сольовим розчином ли послідовно двома порціями води й однією пор(2x150мл), сушили (Na2SO4) і концентрували прицією насиченого сольового розчину. Органічний близно до 50мл. Продукт осаджувався у вигляді шар сушили над сульфатом магнію, концентрувабілої твердої речовини, яку збирали фільтруванли у вакуумі й залишок очищали флешням і промиванням гексаном, одержуючи третколонковою хроматографією, одержуючи зазначебутил-2-{1-[4(етоксикарбоніл)феніл]етил}гідразинкарбоксилат. ну в заголовку сполуку. 1H Я МР (500МГц, DMSO) d: ВЕРХ/МС: m/z=331, 3 (M+Na)+, Rt=3,24хв. 1H ЯМР 8,34 (с, 1Н); 8,10 (м, 2H); 7,89 (д, J=8,3Гц, 1Н); 7,76 (д, J=8,3Гц, 1Н); 7.54 (дд, J=1,8, 8,7Гц, 1Н); 1,33 (500МГц, CDCl3) d: 8,03 (2Η, д, J=8,0Гц), 7,44 (2Н, (ушир. с, 12Н). д, J=8,0Гц), 5,99 (1H, ушир. с), 4,40 (2Н, кв, Стадія С. (6-Хлор-2-нафтил)боронова кислота. J=7,0Гц), 4,29 (1Н, г), 1,45 (9Н, с), 1,41 (3H, т, 2-(6-Хлор-2-нафтил)-4,4,5,5-тетраметил-1,3,2J=7,0Гц), 1,35 (3H, д, J=6,5Гц). діоксаборолан (340мг, 1,18ммоль) суспендували в Стадія С. (1-[4суміші 20мл ацетону й 5мл водної 2 Η хлористо(Етоксикарбоніл)феніл1етил}гідразиній хлорид. водневої кислоти й нагрівали при 50°С протягом Трет-бутил-2-{1-[416год. Продукт очищали ВЕРХ з оберненою фа(етоксикарбоніл)феніл]етил}гідразинкарбоксилат зою, одержуючи зазначену в заголовку сполуку у (29г, 94ммоль) обробляли 100мл TFA-DCMвигляді білого порошку. 1H ЯМР (500МГц. D MSO) триізопропілсилану (20:20:1) при кімнатній температурі протягом однієї години. Суміш концентруd: 8,38 (с, 1Н); 8,23 (с, 2Н); 8,01 (д, J=2,1Гц. 1Н); вали при зниженому тиску, і залишок розчиняли у 7,95 (д. J=8,7Гц, 1Н); 7,91 (д, 8,2Гц, 1Н); 7,84 (д, воді (100мл), промивали 2 рази за допомогою J=8,2Гц, 1Н); 7,50 (дд, J=2,3, 8,7Гц, 1Н). DCM. DCM-шар знову екстрагували 3 рази водою. До об'єднаного водного розчину додавали HCl (5Н, 20мл) і суміш концентрували до ~50мл. Додавали CH3CN (50мл) і після ліофілізації одержували 22,7г {1-[4-(етоксикарбоніл)феніл]етил}гідразиній хлориду. ЯМР (500МГц, ацетон-d6) d: 1,34 (т, J=7,1Гц, 3H); 1,67 (д, J=6,8Гц, 3H); 4,33 (кв, J=7,1Гц, 2Н), 4,97 (кв, J=6,8Гц, 1Н); 7,76 (д, J=8,5Гц, 2Н), 7,97 (д, J=8,5Гц, 2Н). МС C11H16N2 O2 Обчислено: 208,12; Знайдено (М+1): 209,19. Стадія А. Трет-бутил 2-{1-[4(етоксикарбоніл)феніл]етиліден)гідра 55 85884 56 концентрували на роторному випарнику й залишкову TFA видаляли співвипарюванням від толуолу. Утворений етил 4-(1-гідразино)етил]бензоат потім розчиняли в СН2СI2 (15мл) і охолоджували до 78°С. Повільно додавали розчин бензоїлхлориду (365мкл, 3,15ммоль) і 2,6-ди-трет-бутил-4метилпіридину (745мг, 3,63ммоль) у СН 2СI2 (5мл) Стадія D. ((1S)-1-[4при -78°С. Після витримування при -78°С протягом (Етоксикарбоніл)феніл]етил}гідразиній трифтор3 годин реакційну суміш швидко поміщали в колоацетат і {(1R)-1-[4нку з SiO2 і елюювали сумішшю 30% EtOAc/гексан. (етоксикарбоніл)феніл]етил}гідразиній трифтораФракції, що містять продукт, концентрували й поцетат. Трет-бутил-2-{1-[4тім очищали за допомогою ВЕРХ із використанням (етоксикарбоніл)феніл]етил}гідразинкарбоксилат колонки Kromasil C8 (від 10% до 70% аналізували хіральною ВЕРХ, застосовуючи два CH3CN/H2O/0,1% TFA, 12хв.) і знову на колонці із типи умов. 1) Daicel колонка Chiralcel OJ. 40°С, силікагелем (30% EtOAc/гексан), одержуючи (R)0,75мл/хв., 10% EtOН/90% н-гептан: t1 6,66хв.; t2 (+)-етил 4-[1-(2-бензоїлгідразино)етил]бензоат. 12,25хв. Енантіомери розділяли на препаративній ВЕРХ/МС: m/z=313,3 (M+1)+, Rt=3,08хв. Колонка шкалі, використовуючи дану колонку (30% Daicel Chiralcel OJ, 40°C, 0,5мл/хв., 10% ізопропаEtOН/70% н-гептан). 2) Daicel колонка ChiralPak нол/90% н-гептан: t=35,79хв.; [a]D20=+192,4° (с1, AD, 40°C, 0,75мл/хв., 10% EtOН/90% н-гептан: t1 12,17хв.; t 2 15,49хв. Енантіомери розділяли на СHCl3); 1H ЯМР (500МГц. CDCl3) d: 8,03 (2Н, д, препаративній шкалі, використовуючи дану колонJ=8,0Гц), 7,94 (1Н, ушир. с), 7,66 (2Н, д, J=7,5Гц), ку (20% EtOН/80% н-гептан). Енантіомер, що шви7,51 (1Н, т, J=7,5Гц), 7,54 (2Н, д, J=8,0Гц), 7,40 дко рухається, був однаковим у кожному випадку (2Н, т, J=8,0Гц), 4,39 (2Н, кв, J=7,0Гц), 4,36 (1Н, кв, й, як потім було встановлено, є (S)-енантіомером J=7,0Гц), 1,46 (3H, д, J=6,0Гц), 1,41 (3H, т, ([a]D20=-120° (с 1.1 МеОН), див. нижче. Також видіJ=7,0Гц); 1ЗС ЯМР (500МГц, CDCI3) d: 167,76, ляли більш повільний (R)-енантіомер ([a]D20=+122° 166,69. 148,16, 132,70, 132,27, 130,21, 130,18, 128,94, 127,47, 127,15, 61,22, 60,21, 21,21, 14,58. (c1.1 MeOH). (S)-(-)-етил 4-[1-(2-бензоїлгідразино)етил]бензоат Будь-який енантіомер може бути позбавлений готували аналогічно з більш рухливого ізомеру захисту за допомогою 45:45:10 TFA:DCM:TIPS трет-бутил 2-{1-[4(40°C, 1,5год.). Надлишок реагенту й розчинник випарювали й залишок розчиняли у воді. Водний (етоксикарбоніл)феніл]етил}гідразинкарбоксилату. ВЕРХ/МС: m/z=313,4 (M+1)+, Rt=3,09хв. Колонка розчин промивали 2 рази за допомогою DCM. Daicel Chiralcel OJ, 40°С, 0,5мл/хв., 10% ізопропаDCM шари знову екстрагували додатковою кількістю води. Об'єднаний водний розчин упарювали нол/90% н-гептан: t=34,99хв.; [a]D20=-194,4° (с1, при зниженому тиску (темп.
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrazole derivatives, compositions containing such compounds and methods of use (variants)
Автори англійськоюParmee Emma R., Xiong Yusheng, Guo Jian, Liang Rui, Brockunier Linda
Назва патенту російськоюПроизводные пиразола, композиция, которая содержит эти соединения, и способ применения (варианты)
Автори російськоюПарми Эмма Р., Сюн Юйшен, Го Цзянь, Лян Жуй, Броканьер Линда
МПК / Мітки
МПК: A61K 31/415, C07D 231/12, C07D 405/04, A61K 31/4155
Мітки: композиція, піразолу, застосування, спосіб, варіанти, сполуки, похідні, містить
Код посилання
<a href="https://ua.patents.su/46-85884-pokhidni-pirazolu-kompoziciya-shho-mistit-ci-spoluki-i-sposib-zastosuvannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Похідні піразолу, композиція, що містить ці сполуки, і спосіб застосування (варіанти)</a>
Попередній патент: Спосіб радикальної абдомінальної трахелектомії у хворих репродуктивного віку на рак шийки матки
Наступний патент: Спосіб виготовлення паливних брикетів
Випадковий патент: Спосіб отримання біогумусу та кормової добавки для тваринництва