Макроциклічні пептиди, які мають активність щодо вірусу гепатиту с, фармацевтична композиція та застосування фармацевтичної композиції
Номер патенту: 74546
Опубліковано: 16.01.2006
Автори: Кемерон Дейл Р., Фоше Анн-Марі, Гіро Еліз, Гудро Наталі, Хальмос Тедді, Лінас-Брюне Монтсе, Тсантріцос Юла С.
Формула / Реферат
1. Сполука формули (I):
, (І)
де
W означає СН або N,
R21 означає Н, галоген, C1-С6алкіл, С3-С6циклоалкіл, C1-С6галоалкіл, C1-С6алкокси, С3-C6циклоалкокси, гідрокси або N(R23)2, де
кожен R23 незалежно один від одного означає Н, C1-С6алкіл або С3-С6циклоалкіл,
R22 означає Н, галоген, C1-С6алкіл, С3-C6циклоалкіл, C1-С6галоалкіл, C1-С6тіоалкіл, C1-С6алкокси, С3-C6циклоалкокси, С2-С7алкоксіалкіл, С3-C6циклоалкіл, С6- або С10арил або Het, де Het означає п'яти-, шести- або семичленний насичений або ненасичений гетероцикл, що містить один-чотири гетероатоми, вибрані із азоту, кисню і сірки,
при цьому зазначений циклоалкіл, арил або Het заміщено радикалом R24, де
R24 означає Н, галоген, C1-С6алкіл, С3-C6циклоалкіл, C1-С6алкокси, С3-C6циклоалкокси, NO2, N(R25)2, NH-C(O)-R25 або NH-C(O)-NH-R25, де кожен R25 незалежно один від одного означає Н, C1-С6алкіл або С3-C6циклоалкіл, або
R24 означає NH-C(O)-OR26, де R26 означає C1-С6алкіл або С3-C6циклоалкіл,
R3 означає гідрокси, NH2 або групу формули -NH-R31, де
R31 означає С6- або С10арил, гетероарил, -C(O)-R32, -C(O)-NHR32 або -C(O)-OR32, де
R32 означає C1-С6алкіл або С3-C6циклоалкіл,
D означає насичений або ненасичений алкіленовий ланцюг, що містить 5-10 атомів, який необов'язково включає один-три гетероатоми, незалежно один від одного вибрані із O, S або N-R41, де
R41 означає Н, С1-С6алкіл, С3-С6циклоалкіл або-C(O)-R42, де R42 означає С1-С6алкіл, С3-C6циклоалкіл або C6- або С10арил,
R4 означає Н або один-три замісники на будь-якому атомі вуглецю ланцюга D, де замісники незалежно один від одного вибрані із групи, яка містить C1-С6алкіл, C1-С6галоалкіл, C1-С6алкокси, гідрокси, галоген, аміно, окси, тіогрупу або C1-С6тіоалкіл, і
А означає амід формули -C(O)-NH-R5, де
R5 вибирають із групи, яка містить С1-С8алкіл, С3-C6циклоалкіл, С6- або C10арил або C7-C16аралкіл, або
А означає карбонову кислоту,
або її фармацевтично прийнятна сіль або складний ефір.
2. Сполука формули I за п. 1, де 1-вуглецевий центр має (R)-конфігурацію і D приєднаний у син-орієнтації щодо аміду або у син-орієнтації щодо A, як це представлено структурами (і) та (ii):
(і), (іі).
3. Сполука формули I за п. 1 або 2, де D приєднаний у син-орієнтації до А, як це представлено структурною формулою (ii).
4. Сполука формули I за будь-яким з пп. 1-3,
де
W означає N;
R21 означає Н, C1-С6алкіл, C1-С6алкокси, гідрокси, хлор або N(R23)2, де R23 означає Н або C1-С6алкіл;
R22 означає Н, C1-C6тіоалкіл, C1-С6алкокси, феніл або Het, вибраний із групи, яка включає
де R24 означає Н, C1-С6алкіл, NH-R25, NH-C(O)-R25, NH-C(O)-NH-R25, де
кожен R25 незалежно один від одного означає: Н, C1-С6алкіл або С3-C6циклоалкіл; або NH-C(O)-OR26, де R26 означає C1-C6алкіл.
5. Сполука формули I за п. 4, де R21 означає Н або С1-С6алкокси.
6. Сполука формули I за п. 4, де R22 означає C1-C4алкокси, феніл або Het, що вибирають із групи, яка містить
де R24 означає Н, C1-С6алкіл, NH-R25 або NH-C(O)-R25, де кожен R25 означає C1-С6алкіл або С3-C6циклоалкіл, або NH-C(O)-OR26, де R26 має значення, зазначені в п. 4.
7. Сполука формули I за п. 6, де R21 означає метокси.
8. Сполука формули I за п. 7, де R22 означає етокси або Het, що вибраний із групи, яка містить
де R24a означає NH-R25 або NH-C(O)-R25, де R25 означає С1-С6алкіл;
або R24a означає NH-C(O)-OR26, де R26 означає C1-C6алкіл, і R24b означає Н або C1-С6алкіл.
9. Сполука формули I за п. 1, де R3 означає амід формули NH-C(O)R32 або сечовину формули NH-C(О)-NH-R32, або карбамат формули NH-C(O)-OR32, де R32 означає С1-С6алкіл або С3-C6циклоалкіл.
10. Сполука формули I за п. 9, де R3 означає сечовину або карбамат, де R32 означає C1-С6алкіл або C4-С6циклоалкіл.
11. Сполука формули I за п. 10, де R3 означає карбамат, a R32 означає трет-бутил, циклобутил або циклопентил.
12. Сполука формули I за будь-яким з пп. 1-11, де D означає насичений або ненасичений алкіленовий ланцюг, що містить 6-8 атомів, який необов'язково включає один або два гетероатоми, незалежно один від одного вибрані із O, S або N-R41, де R41 означає Н, C1-C6алкіл або С2-С7ацил.
13. Сполука формули I за п. 12, де D необов'язково містить один гетероатом, вибраний з NH і N-(С2-С7)ацилу.
14. Сполука за п. 13, де гетероатом вибраний з NH і N(Ac).
15. Сполука за п. 13, де ланцюг D містить 7 атомів.
16. Сполука за п. 15, де гетероатом знаходиться в положенні 10 ланцюга D.
17. Сполука за п. 13, де ланцюг D є насиченим.
18. Сполука формули I за п. 12, де D означає насичений або ненасичений алкіленовий ланцюг, що містить 6-8 атомів, який необов'язково включає один гетероатом, вибраний із O або S.
19. Сполука за п. 18, де ланцюг D містить 7 атомів.
20. Сполука за п. 19, де гетероатом знаходиться в положенні 9 ланцюга D.
21. Сполука за п. 20, де ланцюг D заміщено у положенні 8 радикалом R4, де R4 означає Н або C1-С6алкіл.
22. Сполука за п. 21, де радикал R4 означає Н або метил.
23. Сполука за п. 22, де радикал R4 означає Н або 8-(S)-Ме.
24. Сполука за п. 23, де ланцюг D є насиченим.
25. Сполука за п. 19, де ланцюг D містить один подвійний зв'язок між положеннями 11 і 12.
26. Сполука за п. 25, де подвійний зв'язок знаходиться в транс-орієнтації.
27. Сполука формули I за п. 12, де D означає насичений або ненасичений алкіленовий ланцюг, що містить 6-8 атомів, усі з яких являють собою атоми вуглецю.
28. Сполука формули I за п. 27, де D означає ланцюг, що містить 7 атомів.
29. Сполука формули I за п. 28, де ланцюг D є насиченим.
30. Сполука за п. 29, де ланцюг D заміщено радикалом R4, де R4 означає Н, оксо, гідрокси, алкокси або алкіл.
31. Сполука за п. 30, де радикал R4 означає Н або C1-С6алкіл.
32. Сполука за п. 31, де радикал R4 означає Н або метил.
33. Сполука за п. 32, де радикал R4 означає Н або 10-(S)-Ме.
34. Сполука формули I за п. 28, де D містить один подвійний зв'язок.
35. Сполука формули I за п. 34, де подвійний зв'язок знаходиться між положеннями 13 і 14 ланцюга D.
36. Сполука формули I за п. 35, де подвійний зв'язок знаходиться в цис-орієнтації.
37. Сполука за п. 36, де ланцюг D заміщено радикалом R4, де R4 означає Н, оксо, гідрокси, C1-С6алкоксі або C1-С6алкіл.
38. Сполука за п. 37, де R4 означає Н або C1-С6алкіл.
39. Сполука за п. 38, де R4 означає Н або метил.
40. Сполука за п. 39, де R4 означає Н або 10-(S)-Ме.
41. Сполука формули I за будь-яким з пп. 1-40, де А означає карбонову кислоту.
42. Сполука за п. 1, де
W означає N,
R3 означає групу формули -NH-C(O)-NHR32 або -NH-C(O)-OR32, де
R32 означає C1-C4алкіл або C4-С6циклоалкіл,
D означає насичений або ненасичений алкіленовий ланцюг, який складається з 6-8 атомів, приєднаний до циклопропільного залишку сполуки формули І у син-орієнтації щодо А, що необов'язково включає один або два гетероатоми, незалежно один від одного вибрані із O, S або N-R41, де R41 означає Н або С2-С7ацил,
R4 означає Н або один-три замісники, незалежно один від одного вибрані з гідрокси або C1-С6алкілу, і
А означає карбонову кислоту,
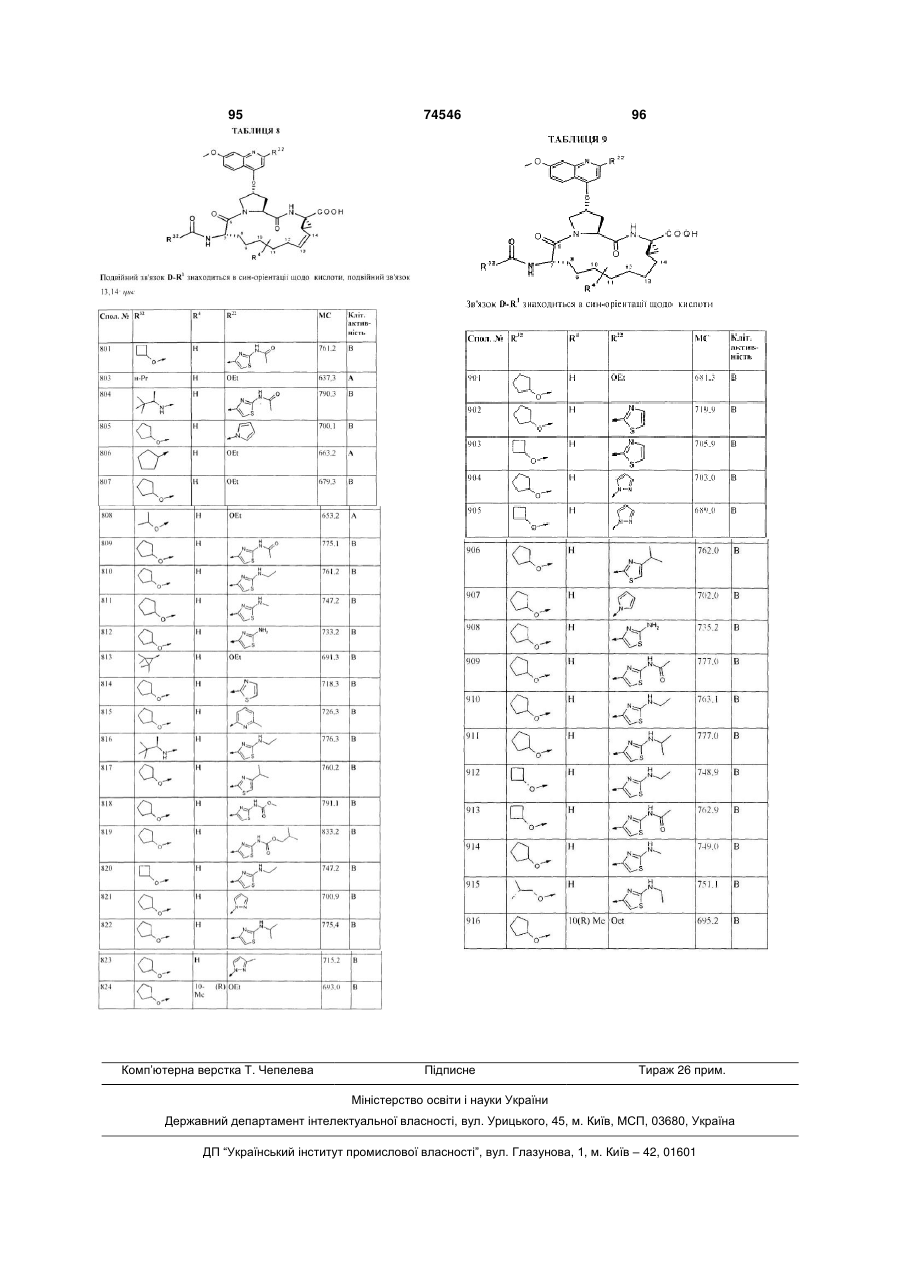
або її фармацевтично прийнятна сіль або складний ефір.
43. Сполука формули I за п. 42, де
R21 означає Н або метокси,
R22 означає C1-С6алкоксі або Het, вибраний із групи, яка містить
де
R24a означає Н, C1-С6алкіл, NH-R25, NH-C(O)-R25 або NH-C(O)-NH-R25, де
R25 означає Н, C1-С6алкіл або С3-C6циклоалкіл, або
R24a означає NH-C(O)-OR26, де
R26 означає C1-С6алкіл або С3-C6циклоалкіл і
R24b означає Н або C1-С6алкіл;
R3 означає сечовину формули N-C(O)-NHR32 або карбамат формули N-C(O)-OR32,
де R32 означає C1-С6алкіл або С3-C6циклоалкіл;
D означає алкіленовий ланцюг, що містить 7 атомів, який необов'язково включає один подвійний зв'язок між положеннями 11,12 або 13,14,
при цьому ланцюг D необов'язково включає один гетероатом, незалежно вибраний із O, S, NH, N(Me) або N(Ac),
і R4 означає Н або C1-С6алкіл.
44. Сполука формули I за п. 43, де R21 означає метокси та R22 означає етокси або
де R24a означає NН-(C1-C4алкіл), NH-C(O)-(C1-C4алкіл), NН-С(O)-О-(C1-C4алкіл) або NН-С(O)-NН-(C1-C4алкіл), і
D означає С7-ланцюг, всі атоми якого являють собою вуглець і який є насиченим або містить один подвійний цис-зв'язок між положеннями 13 і 14.
45. Сполука за п. 43, де R3 означає NH-C(O)-OR32,
де R32 означає С1-С4-алкіл або С4-С6-циклоалкіл; D означає ланцюг, який складається з 7 атомів вуглецю, який є насиченим або містить подвійний цис-зв’язок між положеннями 13 та 14; і R22 означає
,
де R24а означає NH-(C1-C4алкіл), NH-(С3-С6-циклоалкіл), NH-С(О)-(C1-C4алкіл), NH-С(О)-О-(C1-C4алкіл), або NH-С(О)-NH-(C1-C4алкіл).
46. Сполука за п. 1, яка представлена формулою:
,
що включає один стереоізомер на 1-вуглецевому центрі, де подвійний зв'язок, стереохімія D і R22 мають такі значення:
Сполука №
Подвійний зв'язок:
Стереохімія D:
R22:
101
12,13-транс
1R, D у син-орієнтації щодо аміду
феніл
102
немає
1R, D у син-орієнтації щодо кислоти
феніл
103
немає
1R, D у син-орієнтації щодо аміду
Феніл.
47. Сполука за п. 1, яка представлена формулою:
,
що включає один стереоізомер на 1-вуглецевому центрі, де R3, R4, положення подвійного зв'язку, стереохімія D, R21 і R22 мають такі значення:
Сполука №
R3:
R4:
Подвійний зв'язок:
Стереохімія 1-вуглецевого центру і D:
R21:
R22:
202
NH-Boc
H
11,12-транс
1R або 1S, D у син-орієнтації щодо кислоти
Н
Н
203
NH-
ацетил
H
11,12-транс
1R або 1S, D у син-орієнтації щодо кислоти
Н
Н
205
NH-Boc
11-OH
12-OH
цис
немає
1R або 1S, D у син-орієнтації щодо кислоти
Н
Н
206
NH-Boc
H
13,14-цис
1R, D у син-орієнтації щодо кислоти
Н
Н
207
NH-Boc
H
13,14-цис
1R, D у син-орієнтації щодо кислоти
OMe
Н
208
NH-Boc
H
13,14-цис
1R, D у син-орієнтації щодо кислоти
OMe
феніл
209
NH-С(O)-
NH-трет-
Bu
H
13,14-цис
1R, D у син-орієнтації щодо кислоти
OMe
феніл
210
NH-Boc
H
13,14-цис
1S, D у син-орієнтації щодо кислоти
OMe
феніл
211
NH2
H
13,14-цис
1R, D у син-орієнтації щодо кислоти
OMe
феніл
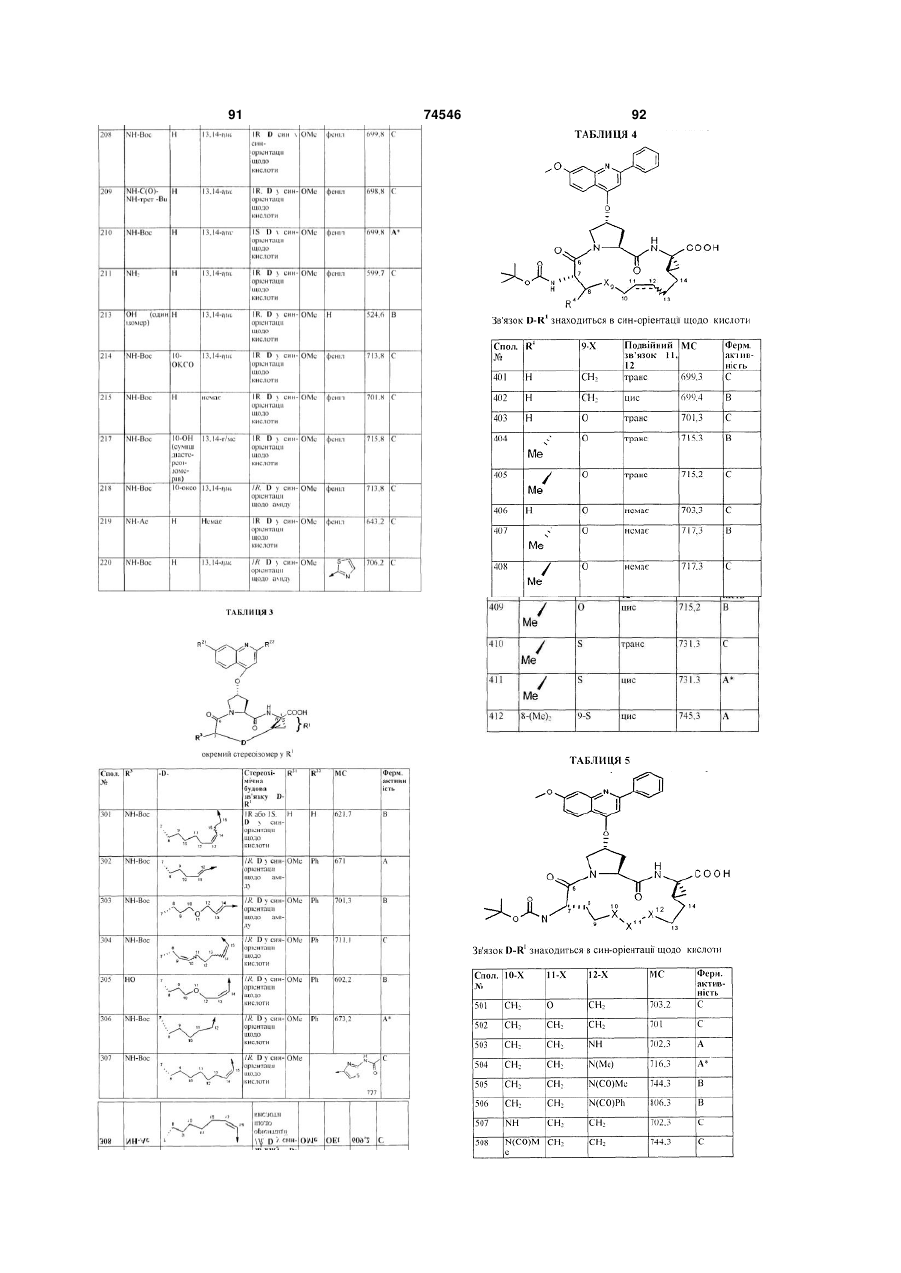
213
OH
(один ізомер)
H
13,14-цис
1R, D у син-орієнтації щодо кислоти
OMe
Н
214
NH-Boc
10-оксо
13,14-цис
1R, D у син-орієнтації щодо кислоти
OMe
феніл
215
NH-Boc
H
немає
1R, D у син-орієнтації щодо кислоти
OMe
феніл
217
NH-Boc
10-OH
(суміш
діасте-
реоізо-
мерів
)
13,14-цис
1R, D у син-орієнтації щодо кислоти
OMe
феніл
218
NH-Boc
10-оксо
13,14-цис
1R, D у син-орієнтації щодо аміду
OMe
феніл
219
NH-Ac
H
немає
1R, D у син-орієнтації щодо кислоти
OMe
феніл
220
NH-Boc
H
13,14-цис
1R, D у син-орієнтації щодо кислоти
OMe
.
48. Сполука за п. 47, що наведена під номером 208.
49. Сполука за п. 47, що наведена під номером 209 .
50. Сполука за п. 47, що наведена під номером 214.
51. Сполука за п. 47, що наведена під номером 217.
52. Сполука за п. 1, яка представлена формулою:
,
що включає один стереоізомер на 1-вуглецевому центрі, де R3, D, стереохімія D, R21 і R22 мають такі значення:
Сполука
№
R3:
-D-:
Стереохімія 1-вуглецевого центру і D:
R21:
R22:
301
NH-Boc
1R або 1S, D у син-орієнтації щодо кислоти
Н
Н
302
NH-Boc
1R, D у син-орієнтації щодо аміду
OMe
феніл
303
NH-Boc
1R, D у син-орієнтації щодо аміду
OMe
феніл
304
NH-Boc
1R, D у син-орієнтації щодо кислоти
OMe
феніл
305
HO
1R, D у син-орієнтації щодо кислоти
OMe
феніл
306
NH-Boc
1R, D у син-орієнтації щодо аміду
OMe
феніл
307
NH-Boc
1R, D у син-орієнтації щодо кислоти
OMe
308
NH-Ac
1R, D у син-орієнтації щодо кислоти
OMe
OEt
53. Сполука за п. 1, яка представлена формулою:
,
де D знаходиться в син-орієнтації щодо карбонової кислоти -СООН, a R4, Х9 і подвійний зв'язок між положеннями 11 і 12 мають такі значення:
Сполука №
R4:
Х9:
Подвійний зв'язок 11,12:
401
Н
СН2
транс
402
Н
СН2
цис
403
Н
O
транс
404
O
транс
405
O
транс
406
Н
O
немає
407
O
немає
408
O
немає
409
O
цис
410
S
транс
411
S
цис
412
8-(Ме)2
9-S
цис.
54. Сполука за п. 53, що наведена під номером 408.
55. Сполука за п. 1, яка представлена формулою:
,
де D знаходиться в син-орієнтації щодо карбонової кислоти -СООН, а Х10, Х11 і Х12 мають такі значення:
Сполука №
Х10:
Х11:
Х12:
501
СН2
O
СН2
502
СН2
СН2
СН2
503
СН2
СН2
NH
504
СН2
СН2
N(Me)
505
СН2
СН2
N(CO)Me
506
СН2
СН2
N(CO)Ph
507
NH
СН2
СН2
508
N(CO)Me
СН2
СН2.
56. Сполука за п. 55, що наведена під номером 508.
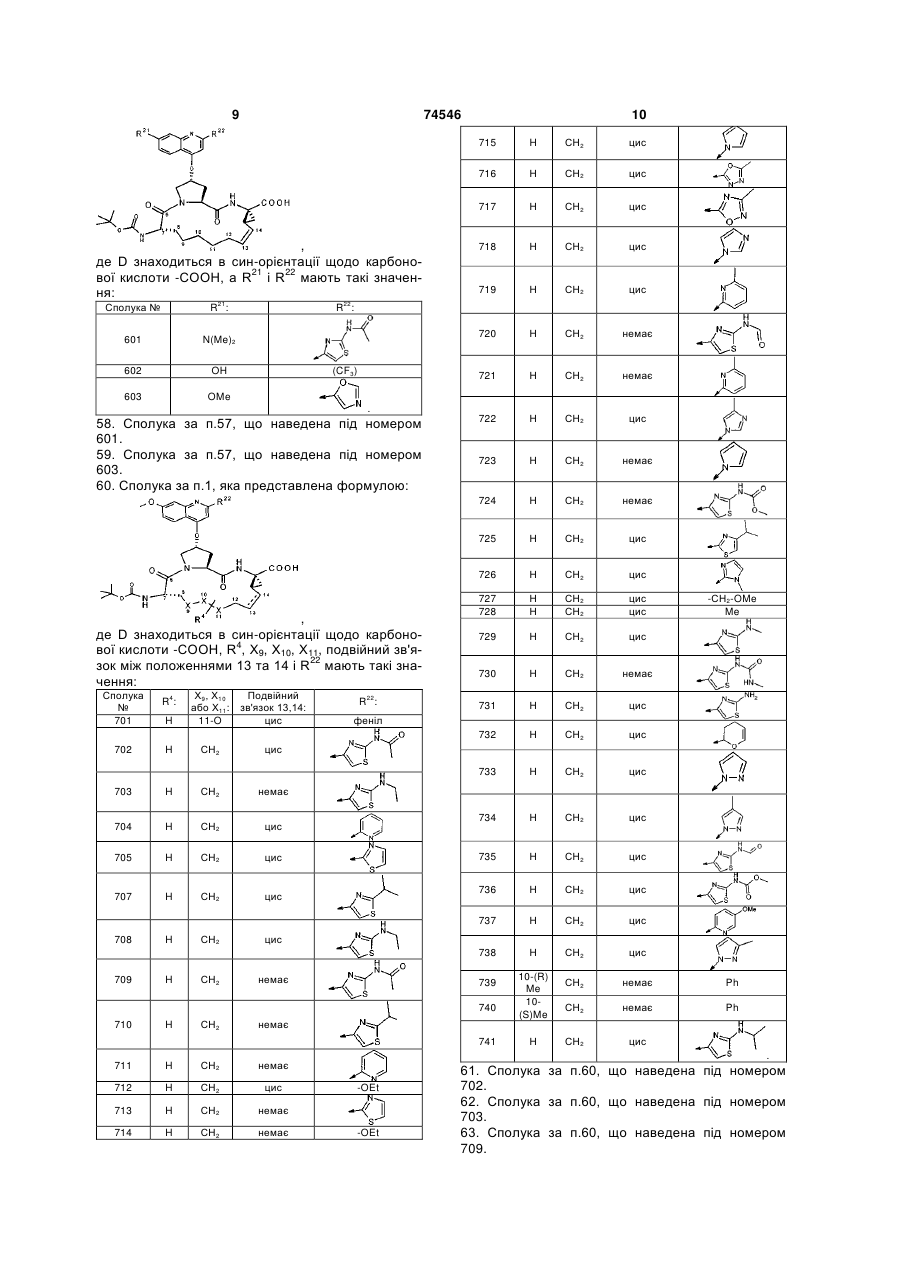
57. Сполука за п. 1, яка представлена формулою:
,
де D знаходиться в син-орієнтації щодо карбонової кислоти -СООН, a R21 і R22 мають такі значення:
Сполука №
R21:
R22:
601
N(Me)2
602
OH
(CF3)
603
OMe
.
58. Сполука за п. 57, що наведена під номером 601.
59. Сполука за п. 57, що наведена під номером 603.
60. Сполука за п. 1, яка представлена формулою:
,
де D знаходиться в син-орієнтації щодо карбонової кислоти -СООН, R4, Х9, Х10, Х11, подвійний зв'язок між положеннями 13 та 14 і R22 мають такі значення:
Сполука №
R4:
Х9, Х10 або Х11:
Подвійний зв'язок 13,14:
R22:
701
H
11-O
цис
феніл
702
H
СН2
цис
703
H
СН2
немає
704
H
СН2
цис
705
H
СН2
цис
707
H
СН2
цис
708
H
СН2
цис
709
H
СН2
немає
710
H
СН2
немає
711
H
СН2
немає
712
H
СН2
цис
-OEt
713
H
СН2
немає
714
H
СН2
немає
-OEt
715
H
СН2
цис
716
Н
СН2
цис
717
Н
СН2
цис
718
Н
СН2
цис
719
Н
СН2
цис
720
Н
СН2
немає
721
Н
СН2
немає
722
Н
СН2
цис
723
Н
СН2
немає
724
Н
СН2
немає
725
Н
СН2
цис
726
Н
СН2
цис
727
Н
СН2
цис
-СН2-OMe
728
Н
СН2
цис
Me
729
Н
СН2
цис
730
Н
СН2
немає
731
Н
СН2
цис
732
Н
СН2
цис
733
Н
СН2
цис
734
Н
СН2
цис
735
Н
СН2
цис
736
Н
СН2
цис
737
Н
СН2
цис
738
Н
СН2
цис
739
10-(R) Me
СН2
немає
Ph
740
10-(S)Me
СН2
немає
Ph
741
Н
СН2
цис
.
61. Сполука за п. 60, що наведена під номером 702.
62. Сполука за п. 60, що наведена під номером 703.
63. Сполука за п. 60, що наведена під номером 709.
64. Сполука за п. 60, що наведена під номером 714.
65. Сполука за п. 60, що наведена під номером 715.
66. Сполука за п. 60, що наведена під номером 719.
67. Сполука за п. 60, що наведена під номером 725.
68. Сполука за п. 60, що наведена під номером 736.
69. Сполука за п. 60, що наведена під номером 738.
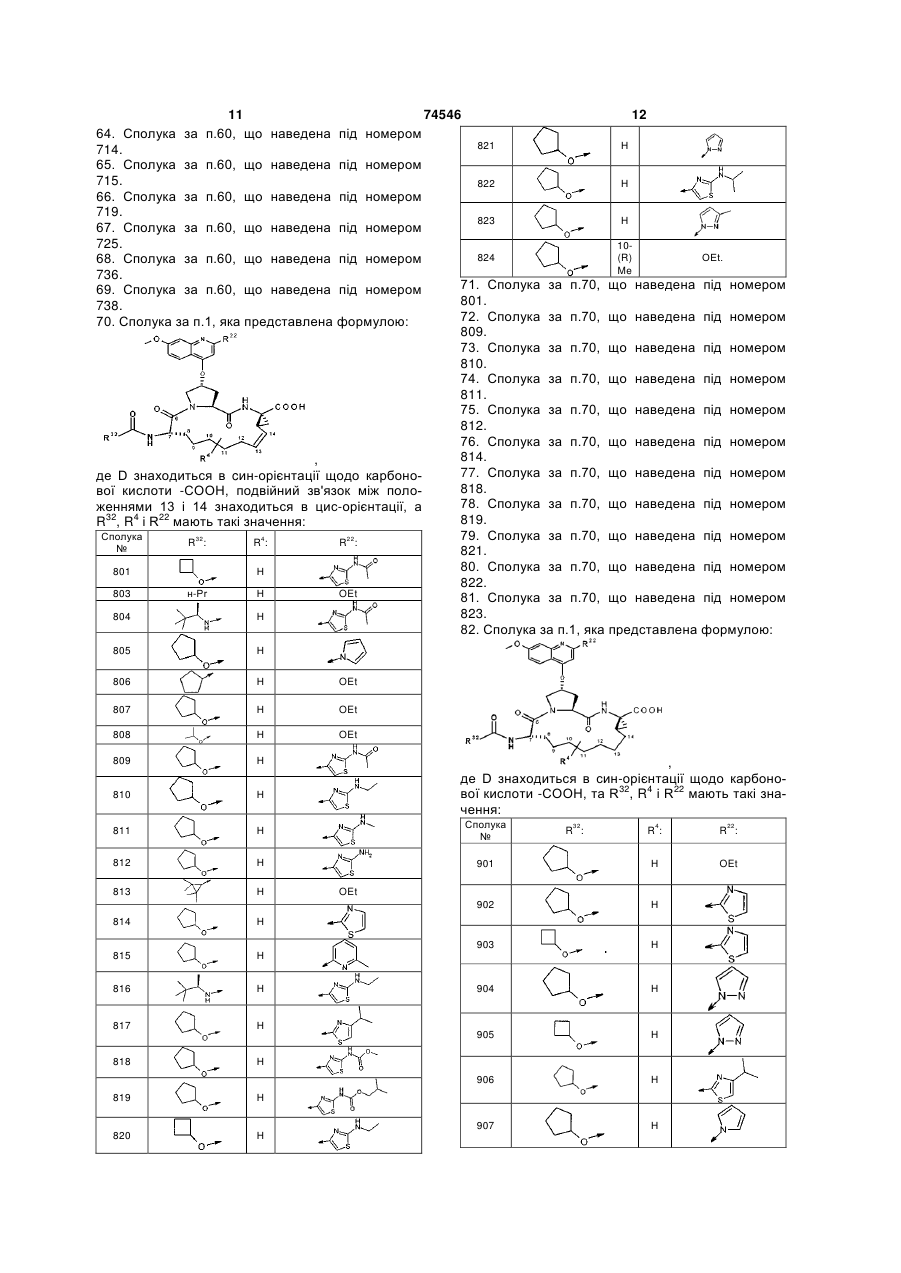
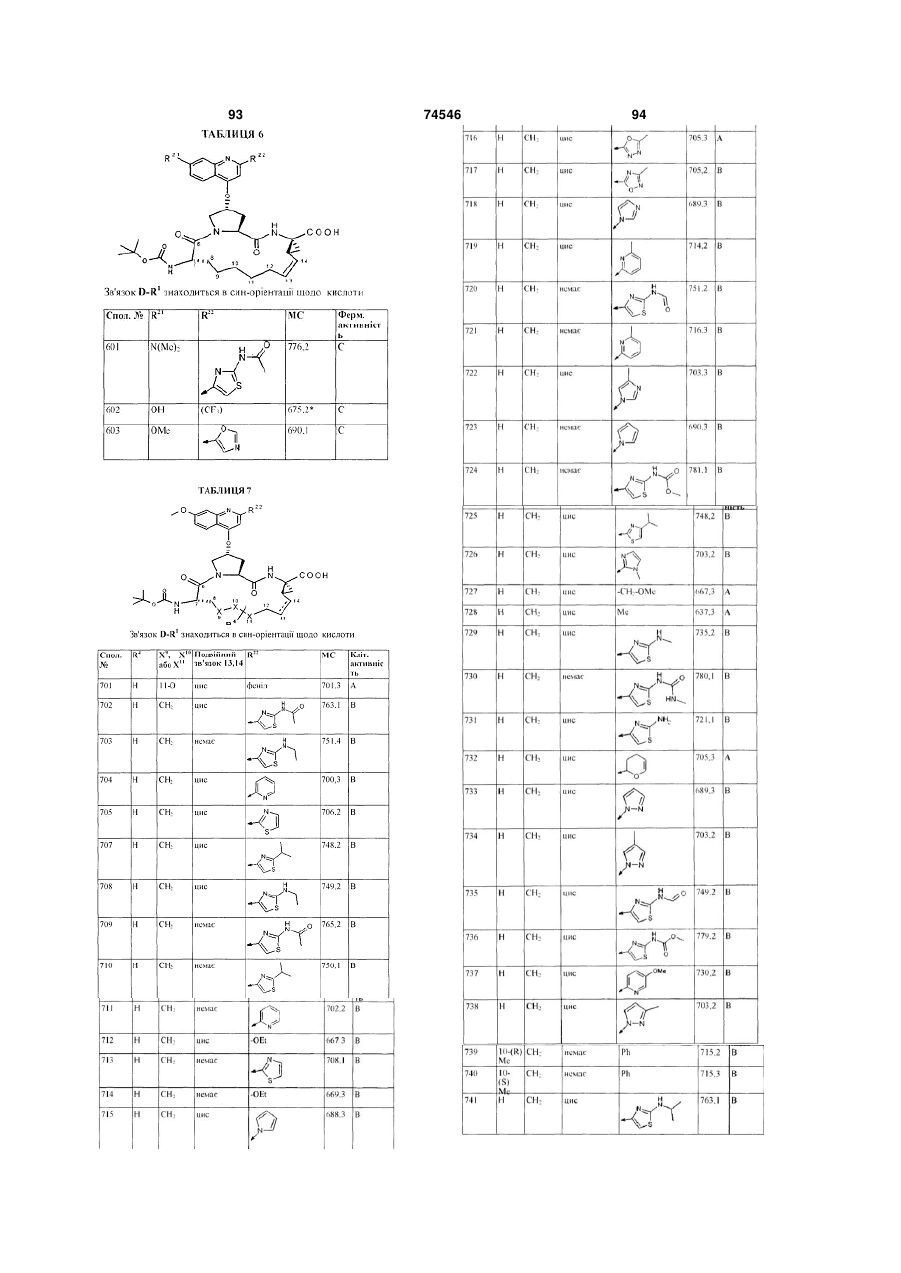
70. Сполука за п. 1, яка представлена формулою:
,
де D знаходиться в син-орієнтації щодо карбонової кислоти -СООН, подвійний зв'язок між положеннями 13 і 14 знаходиться в циc-орієнтації, a R32, R4 і R22 мають такі значення:
Сполука №
R32:
R4:
R22:
801
Н
803
н-Рr
Н
OEt
804
Н
805
Н
806
Н
OEt
807
Н
OEt
808
Н
OEt
809
Н
810
Н
811
Н
812
Н
813
Н
OEt
814
Н
815
Н
816
Н
817
Н
818
Н
819
Н
820
Н
821
Н
822
Н
823
Н
824
10-(R) Me
OЕt.
71. Сполука за п. 70, що наведена під номером 801.
72. Сполука за п. 70, що наведена під номером 809.
73. Сполука за п. 70, що наведена під номером 810.
74. Сполука за п. 70, що наведена під номером 811.
75. Сполука за п. 70, що наведена під номером 812.
76. Сполука за п. 70, що наведена під номером 814.
77. Сполука за п. 70, що наведена під номером 818.
78. Сполука за п. 70, що наведена під номером 819.
79. Сполука за п. 70, що наведена під номером 821.
80. Сполука за п. 70, що наведена під номером 822.
81. Сполука за п. 70, що наведена під номером 823.
82. Сполука за п. 1, яка представлена формулою:
,
де D знаходиться в син-орієнтації щодо карбонової кислоти -СООН, та R32, R4 і R22 мають такі значення:
Сполука №
R32:
R4:
R22:
901
Н
OEt
902
Н
903
Н
904
Н
905
Н
906
Н
907
Н
908
Н
909
Н
910
Н
911
Н
912
Н
913
Н
914
Н
915
Н
916
10(R) Me
OЕt.
83. Сполука за п. 82, що наведена під номером 904.
84. Сполука за п. 82, що наведена під номером 909.
85. Сполука за п. 82, що наведена під номером 914.
86. Сполука за п. 82, що наведена під номером 916.
87. Фармацевтична композиція, яка містить ефективну щодо вірусу гепатиту C кількість сполуки формули I за будь-яким з пп. 1-44, 46, 47, 52, 53, 55, 57, 60, 70, 82 або її терапевтично прийнятної солі або складного ефіру в суміші з фармацевтично прийнятним носієм або допоміжною речовиною.
88. Фармацевтична композиція за п. 87, яка крім того містить додатково імуномодуляторний агент.
89. Фармацевтична композиція за п. 88, де додатковий імуномодуляторний агент вибирають із групи, яка містить -, - і -інтерферони.
90. Фармацевтична композиція за п. 87, яка додатково містить антивірусний агент.
91. Фармацевтична композиція за п. 90, де антивірусний агент вибирають із групи, яка містить рибавірин і амантадин.
92. Фармацевтична композиція за п. 87, яка додатково містить інший інгібітор HCV протеази.
93. Фармацевтична композиція за п. 87, яка додатково містить інгібітор інших мішеней життєвого циклу HCV.
94. Фармацевтична композиція за п. 93, де інгібітор інших мішеней життєвого циклу HCV вибирають з групи, яка включає геліказу, полімеразу або металопротеазу.
95. Фармацевтична композиція за п. 89, де імуномодуляторний агент являє собою α-інтерферон.
96. Фармацевтична композиція за п. 89, яка додатково містить антивірусний агент.
97. Фармацевтична композиція за п. 96, де антивірусний агент являє собою рибавірин.
98. Фармацевтична композиція за п. 95, яка додатково містить антивірусний агент.
99. Фармацевтична композиція за п. 98, де антивірусний агент являє собою рибавірин.
100. Застосування фармацевтичної композиції за будь-яким з пп. 87-94 для приготування лікарського засобу, призначеного для лікування або профілактики захворювання, яке викликане вірусом гепатиту С у ссавця.
101. Застосування за п. 100, яке відрізняється тим, що реплікацію вірусу гепатиту C інгібують шляхом впливу на вірус гепатиту сполуки формули I за п. 1 як активного компонента фармацевтичної композиції у кількості, яка має інгібувальну дію на протеазу NS3 вірусу гепатиту С.
102. Фармацевтична композиція, яка містить ефективну щодо вірусу гепатиту C кількість сполуки формули I за будь-яким з пп. 48-51, 54, 56, 58, 59, 61-69, 71-81, 83-86 або її терапевтично прийнятної солі або складного ефіру в суміші з фармацевтично прийнятним носієм або допоміжною речовиною.
103. Фармацевтична композиція за п. 102, яка додатково містить ще один імуномодуляторний агент.
104. Фармацевтична композиція за п. 103, де додатковий імуномодуляторний агент вибирають із групи, яка містить -, - і -інтерферони.
105. Фармацевтична композиція за п. 104, де додатковий імуномодуляторний агент являє собою α-інтерферон.
106. Фармацевтична композиція за п. 102, яка додатково містить антивірусний агент.
107. Фармацевтична композиція за п. 106, де антивірусний агент являє собою рибавірин.
108. Фармацевтична композиція за п. 104, яка додатково містить антивірусний агент.
109. Фармацевтична композиція за п. 108, де антивірусний агент являє собою рибавірин.
110. Фармацевтична композиція за п. 105, яка додатково містить антивірусний агент.
111. Фармацевтична композиція за п. 110, де антивірусний агент являє собою рибавірин.
112. Фармацевтична композиція за п. 102, яка додатково містить ще один інгібітор HCV протеази.
113. Фармацевтична композиція за п. 102, яка додатково містить ще один інгібітор інших мішеней життєвого циклу HCV.
114. Фармацевтична композиція за п. 113, в якій вказаний інгібітор вибирають із групи, яка включає геліказу, полімеразу або металопротеазу.
Текст
1. Сполука формули (I): C2 2 (19) 1 3 74546 4 де 13. Сполука формули I за п.12, де D необов'язково W означає N; містить один гетероатом, вибраний з NH і N-(С2R21 означає Н, C1-С6алкіл, C1-С6алкокси, гідрокси, С7)ацилу. хлор або N(R23)2, де R23 означає Н або C1-С6алкіл; 14. Сполука за п.13, де гетероатом вибраний з NH R22 означає Н, C1-C6тіоалкіл, C1-С6алкокси, феніл і N(Ac). або Het, вибраний із групи, яка включає 15. Сполука за п.13, де ланцюг D містить 7 атомів. 16. Сполука за п.15, де гетероатом знаходиться в положенні 10 ланцюга D. 17. Сполука за п.13, де ланцюг D є насиченим. 18. Сполука формули I за п.12, де D означає насичений або ненасичений алкіленовий ланцюг, що містить 6-8 атомів, який необов'язково включає один гетероатом, вибраний із O або S. 19. Сполука за п.18, де ланцюг D містить 7 атомів. 20. Сполука за п.19, де гетероатом знаходиться в або положенні 9 ланцюга D. де R24 21. Сполука за п.20, де ланцюг D заміщено у поозначає Н, C1-С6алкіл, NH-R25, NH-C(O)-R25, NHложенні 8 радикалом R4, де R4 означає Н або C1C(O)-NH-R25, де С6алкіл. кожен R25 незалежно один від одного означає: Н, 22. Сполука за п.21, де радикал R4 означає Н або C1-С6алкіл або С3-C6циклоалкіл; або NH-C(O)метил. OR26, де R26 означає C1-C6алкіл. 23. Сполука за п.22, де радикал R4 означає Н або 5. Сполука формули I за п.4, де R21 означає Н або 8-(S)-Ме. С1-С6алкокси. 22 24. Сполука за п.23, де ланцюг D є насиченим. 6. Сполука формули I за п.4, де R означає C125. Сполука за п.19, де ланцюг D містить один поC4алкокси, феніл або Het, що вибирають із групи, двійний зв'язок між положеннями 11 і 12. яка містить 26. Сполука за п.25, де подвійний зв'язок знаходиться в транс-орієнтації. 27. Сполука формули I за п.12, де D означає насичений або ненасичений алкіленовий ланцюг, що містить 6-8 атомів, усі з яких являють собою атоми вуглецю. 24 де R 28. Сполука формули I за п.27, де D означає лан25 25 означає Н, C1-С6алкіл, NH-R або NH-C(O)-R , де цюг, що містить 7 атомів. кожен R25 означає C1-С6алкіл або С3-C6циклоалкіл, 29. Сполука формули I за п.28, де ланцюг D є наабо NH-C(O)-OR26, де R26 має значення, зазначені сиченим. в п.4. 30. Сполука за п.29, де ланцюг D заміщено ради7. Сполука формули I за п.6, де R21 означає метокалом R4, де R4 означає Н, оксо, гідрокси, алкокси кси. або алкіл. 8. Сполука формули I за п.7, де R22 означає етокси 31. Сполука за п.30, де радикал R4 означає Н або або Het, що вибраний із групи, яка містить C1-С6алкіл. 32. Сполука за п.31, де радикал R4 означає Н або метил. 33. Сполука за п.32, де радикал R4 означає Н або або 10-(S)-Ме. де R24a означає NH-R25 або NH-C(O)-R25, де R25 34. Сполука формули I за п.28, де D містить один означає С1-С6алкіл; подвійний зв'язок. або R24a означає NH-C(O)-OR26, де R26 означає C135. Сполука формули I за п.34, де подвійний зв'яC6алкіл, і R24b означає Н або C1-С6алкіл. зок знаходиться між положеннями 13 і 14 ланцюга 9. Сполука формули I за п.1, де R3 означає амід D. 32 формули NH-C(O)R або сечовину формули NH36. Сполука формули I за п.35, де подвійний зв'яC(О)-NH-R32, або карбамат формули NH-C(O)зок знаходиться в цис-орієнтації. OR32, де R32 означає С1-С6алкіл або С337. Сполука за п.36, де ланцюг D заміщено радиC6циклоалкіл. калом R4, де R4 означає Н, оксо, гідрокси, C13 10. Сполука формули I за п.9, де R означає сечоС6алкоксі або C1-С6алкіл. вину або карбамат, де R32 означає C1-С6алкіл або 38. Сполука за п.37, де R4 означає Н або C1C4-С6циклоалкіл. С6алкіл. 11. Сполука формули I за п.10, де R3 означає кар39. Сполука за п.38, де R4 означає Н або метил. бамат, a R32 означає трет-бутил, циклобутил або 40. Сполука за п.39, де R4 означає Н або 10-(S)циклопентил. Ме. 12. Сполука формули I за будь-яким з пп.1-11, де 41. Сполука формули I за будь-яким з пп.1-40, де D означає насичений або ненасичений алкіленоА означає карбонову кислоту. вий ланцюг, що містить 6-8 атомів, який необов'яз42. Сполука за п.1, де ково включає один або два гетероатоми, незалежW означає N, но один від одного вибрані із O, S або N-R41, де R3 означає групу формули -NH-C(O)-NHR32 або R41 означає Н, C1-C6алкіл або С2-С7ацил. NH-C(O)-OR32, де 5 74546 6 R32 означає C1-C4алкіл або C4-С6циклоалкіл, де R24a означає NН-(C1-C4алкіл), NH-C(O)-(C1D означає насичений або ненасичений алкіленоC4алкіл), NН-С(O)-О-(C1-C4алкіл) або NН-С(O)-NНвий ланцюг, який складається з 6-8 атомів, приєд(C1-C4алкіл), і наний до циклопропільного залишку сполуки форD означає С7-ланцюг, всі атоми якого являють сомули І у син-орієнтації щодо А, що необов'язково бою вуглець і який є насиченим або містить один включає один або два гетероатоми, незалежно подвійний цис-зв'язок між положеннями 13 і 14. один від одного вибрані із O, S або N-R41, де R41 45. Сполука за п.43, де R3 означає NH-C(O)-OR32, означає Н або С2-С7ацил, де R32 означає С1-С4-алкіл або С4-С6-циклоалкіл; D 4 R означає Н або один-три замісники, незалежно означає ланцюг, який складається з 7 атомів вугодин від одного вибрані з гідрокси або C1-С6алкілу, лецю, який є насиченим або містить подвійний і цис-зв’язок між положеннями 13 та 14; і R22 ознаА означає карбонову кислоту, чає 24a або її фармацевтично прийнятна сіль або складR N ний ефір. S 43. Сполука формули I за п.42, де , 24а R21 означає Н або метокси, де R означає NH-(C1-C4алкіл), NH-(С3-С622 R означає C1-С6алкоксі або Het, вибраний із груциклоалкіл), NH-С(О)-(C1-C4алкіл), NH-С(О)-О-(C1пи, яка містить C алкіл), або NH-С(О)-NH-(C -C алкіл). 4 1 4 46. Сполука за п.1, яка представлена формулою: або де R24a означає Н, C1-С6алкіл, NH-R25, NH-C(O)-R25 або NH-C(O)-NH-R25, де R25 означає Н, C1-С6алкіл або С3-C6циклоалкіл, або R24a означає NH-C(O)-OR26, де R26 означає C1-С6алкіл або С3-C6циклоалкіл і R24b означає Н або C1-С6алкіл; R3 означає сечовину формули N-C(O)-NHR32 або карбамат формули N-C(O)-OR32, 32 де R означає C1-С6алкіл або С3-C6циклоалкіл; D означає алкіленовий ланцюг, що містить 7 атомів, який необов'язково включає один подвійний зв'язок між положеннями 11,12 або 13,14, при цьому ланцюг D необов'язково включає один гетероатом, незалежно вибраний із O, S, NH, N(Me) або N(Ac), і R4 означає Н або C1-С6алкіл. 44. Сполука формули I за п.43, де R21 означає метокси та R22 означає етокси або , що включає один стереоізомер на 1-вуглецевому центрі, де подвійний зв'язок, стереохімія D і R22 мають такі значення: СпоПодвійний лука Стереохімія D: зв'язок: № 101 12,13-транс 1R, D у син-орієнтації щодо аміду 102 немає 1R, D у син-орієнтації щодо кислоти 103 немає 1R, D у син-орієнтації щодо аміду R22: феніл феніл Феніл. 47. Сполука за п.1, яка представлена формулою: , що включає один стереоізомер на 1-вуглецевому центрі, де R3, R4, положення подвійного зв'язку, стереохімія D, R21 і R22 мають такі значення: Сполука R3: № 202 NH-Boc 203 NH- ацетил 205 NH-Boc 206 NH-Boc 207 NH-Boc 208 NH-Boc 209 NH-С(O)- NH-трет- Bu 210 NH-Boc 211 NH2 213 OH (один ізомер) 214 NH-Boc 215 NH-Boc 217 NH-Boc 218 NH-Boc 219 NH-Ac 220 NH-Boc R4: H H 11-OH 12-OH цис H H H H H H H 10-оксо H 10-OH (суміш діастереоізомерів ) 10-оксо H H Подвійний зв'язок: Стереохімія 1-вуглецевого центру і D: 11,12-транс 1R або 1S, D у син-орієнтації щодо кислоти 11,12-транс 1R або 1S, D у син-орієнтації щодо кислоти немає 1R або 1S, D у син-орієнтації щодо кислоти 13,14-цис 1R, D у син-орієнтації щодо кислоти 13,14-цис 1R, D у син-орієнтації щодо кислоти 13,14-цис 1R, D у син-орієнтації щодо кислоти 13,14-цис 1R, D у син-орієнтації щодо кислоти 13,14-цис 1S, D у син-орієнтації щодо кислоти 13,14-цис 1R, D у син-орієнтації щодо кислоти 13,14-цис 1R, D у син-орієнтації щодо кислоти 13,14-цис 1R, D у син-орієнтації щодо кислоти немає 1R, D у син-орієнтації щодо кислоти 13,14-цис 1R, D у син-орієнтації щодо кислоти 13,14-цис 1R, D у син-орієнтації щодо аміду немає 1R, D у син-орієнтації щодо кислоти 13,14-цис 1R, D у син-орієнтації щодо кислоти R21: R22: Н Н Н Н OMe OMe OMe OMe OMe OMe OMe OMe OMe OMe OMe Н Н Н Н Н феніл феніл феніл феніл Н феніл феніл феніл феніл феніл OMe . 7 74546 48. Сполука за п.47, що наведена під номером 208. 49. Сполука за п.47, що наведена під номером 209. 50. Сполука за п.47, що наведена під номером 214. 51. Сполука за п.47, що наведена під номером 217. 52. Сполука за п.1, яка представлена формулою: Сполука № R3: 301 8 , що включає один стереоізомер на 1-вуглецевому центрі, де R3, D, стереохімія D, R21 і R22 мають такі значення: Стереохімія 1-вуглецевого центру і D: R21: R22: NH-Boc 1R або 1S, D у син-орієнтації щодо кислоти Н Н 302 NH-Boc 1R, D у син-орієнтації щодо аміду OMe феніл 303 NH-Boc 1R, D у син-орієнтації щодо аміду OMe феніл 304 NH-Boc 1R, D у син-орієнтації щодо кислоти OMe феніл 305 HO 1R, D у син-орієнтації щодо кислоти OMe феніл 306 NH-Boc 1R, D у син-орієнтації щодо аміду OMe феніл 307 NH-Boc 1R, D у син-орієнтації щодо кислоти OMe 308 NH-Ac 1R, D у син-орієнтації щодо кислоти OMe -D-: 53. Сполука за п.1, яка представлена формулою: , де D знаходиться в син-орієнтації щодо карбонової кислоти -СООН, a R4, Х9 і подвійний зв'язок між положеннями 11 і 12 мають такі значення: Сполука № R4: Х9: 401 402 403 Н Н Н СН2 СН2 O Подвійний зв'язок 11,12: транс цис транс O транс 404 O транс O немає 407 O немає 408 O немає 409 O цис 410 S транс 411 S цис 9-S цис. 405 406 412 Н 8-(Ме)2 OEt 54. Сполука за п.53, що наведена під номером 408. 55. Сполука за п.1, яка представлена формулою: , де D знаходиться в син-орієнтації щодо карбонової кислоти -СООН, а Х10, Х11 і Х12 мають такі значення: Сполука № 501 502 503 504 505 506 507 508 Х10: СН2 СН2 СН2 СН2 СН2 СН2 NH N(CO)Me Х11: O СН2 СН2 СН2 СН2 СН2 СН2 СН2 Х12: СН2 СН2 NH N(Me) N(CO)Me N(CO)Ph СН2 СН2. 56. Сполука за п.55, що наведена під номером 508. 57. Сполука за п.1, яка представлена формулою: 9 74546 10 715 цис 718 Н СН2 цис 719 Н СН2 цис Н СН2 немає Н СН2 немає 722 Н СН2 цис 723 Н СН2 немає Н СН2 немає Н СН2 цис Н СН2 цис 727 728 Н Н СН2 СН2 цис цис 729 Н СН2 цис 730 Н СН2 немає 731 Н СН2 цис 732 Н СН2 цис 733 603 СН2 726 OH Н 725 602 цис 721 Н СН2 цис 734 N(Me)2 СН2 724 601 Н 720 R21: цис 717 Сполука № СН2 716 , де D знаходиться в син-орієнтації щодо карбонової кислоти -СООН, a R21 і R22 мають такі значення: H Н СН2 цис R22: OMe (CF3) . 58. Сполука за п.57, що наведена під номером 601. 59. Сполука за п.57, що наведена під номером 603. 60. Сполука за п.1, яка представлена формулою: , де D знаходиться в син-орієнтації щодо карбонової кислоти -СООН, R4, Х9, Х10, Х11, подвійний зв'язок між положеннями 13 та 14 і R22 мають такі значення: Сполука № 701 -СН2-OMe Me H Х9, Х10 або Х11: 11-O Подвійний зв'язок 13,14: цис 702 H СН2 цис 703 H СН2 немає 704 H СН2 цис 705 H СН2 цис 735 Н СН2 цис 707 H СН2 цис 736 Н СН2 цис 737 Н СН2 цис 708 H СН2 цис 738 Н СН2 цис 10-(R) Me 10(S)Me СН2 немає Ph СН2 немає Ph Н СН2 цис R4: 709 H СН2 H СН2 феніл немає 710 R22: немає 739 740 741 711 H СН2 712 H СН2 цис 713 H СН2 немає 714 H СН2 немає . немає -OEt -OEt 61. Сполука за п.60, що наведена під номером 702. 62. Сполука за п.60, що наведена під номером 703. 63. Сполука за п.60, що наведена під номером 709. 11 74546 12 64. Сполука за п.60, що наведена під номером 821 Н 714. 65. Сполука за п.60, що наведена під номером 715. 822 Н 66. Сполука за п.60, що наведена під номером 719. 823 Н 67. Сполука за п.60, що наведена під номером 725. 10824 (R) OЕt. 68. Сполука за п.60, що наведена під номером Me 736. 71. Сполука за п.70, що наведена під номером 69. Сполука за п.60, що наведена під номером 801. 738. 72. Сполука за п.70, що наведена під номером 70. Сполука за п.1, яка представлена формулою: 809. 73. Сполука за п.70, що наведена під номером 810. 74. Сполука за п.70, що наведена під номером 811. 75. Сполука за п.70, що наведена під номером 812. 76. Сполука за п.70, що наведена під номером 814. , 77. Сполука за п.70, що наведена під номером де D знаходиться в cин-орієнтації щодо карбоно818. вої кислоти -СООН, подвійний зв'язок між поло78. Сполука за п.70, що наведена під номером женнями 13 і 14 знаходиться в циc-орієнтації, a 819. R32, R4 і R22 мають такі значення: 79. Сполука за п.70, що наведена під номером Сполука 32 4 22 R : R: R : № 821. 80. Сполука за п.70, що наведена під номером 801 Н 822. 803 н-Рr Н OEt 81. Сполука за п.70, що наведена під номером 823. 804 Н 82. Сполука за п.1, яка представлена формулою: 805 Н 806 Н OEt 807 Н OEt 808 Н OEt 809 Н 810 Н 811 Н Сполука № 812 Н 813 Н 814 Н 815 Н 816 Н 817 Н 818 Н 819 Н 820 Н , де D знаходиться в син-орієнтації щодо карбонової кислоти -СООН, та R32, R4 і R22 мають такі значення: R32: R4: R22: 901 Н OEt 902 Н 903 Н 904 Н 905 Н 906 Н 907 Н OEt 13 74546 14 95. Фармацевтична композиція за п.89, де імуно908 Н модуляторний агент являє собою α-інтерферон. 96. Фармацевтична композиція за п.89, яка додатково містить антивірусний агент. 909 Н 97. Фармацевтична композиція за п.96, де антивірусний агент являє собою рибавірин. 910 Н 98. Фармацевтична композиція за п.95, яка додатково містить антивірусний агент. 99. Фармацевтична композиція за п.98, де антиві911 Н русний агент являє собою рибавірин. 100. Застосування фармацевтичної композиції за 912 Н будь-яким з пп.87-94 для приготування лікарського засобу, призначеного для лікування або профілак913 Н тики захворювання, яке викликане вірусом гепатиту С у ссавця. 101. Застосування за п.100, яке відрізняється тим, 914 Н що реплікацію вірусу гепатиту C інгібують шляхом впливу на вірус гепатиту сполуки формули I за п.1 915 Н як активного компонента фармацевтичної композиції у кількості, яка має інгібувальну дію на протеазу NS3 вірусу гепатиту С. 10(R) 916 OЕt. Me 102. Фармацевтична композиція, яка містить ефективну щодо вірусу гепатиту C кількість сполуки 83. Сполука за п.82, що наведена під номером формули I за будь-яким з пп.48-51, 54, 56, 58, 59, 904. 61-69, 71-81, 83-86 або її терапевтично прийнятної 84. Сполука за п.82, що наведена під номером солі або складного ефіру в суміші з фармацевтич909. но прийнятним носієм або допоміжною речовиною. 85. Сполука за п.82, що наведена під номером 103. Фармацевтична композиція за п.102, яка до914. датково містить ще один імуномодуляторний 86. Сполука за п.82, що наведена під номером агент. 916. 104. Фармацевтична композиція за п.103, де дода87. Фармацевтична композиція, яка містить ефектковий імуномодуляторний агент вибирають із грутивну щодо вірусу гепатиту C кількість сполуки пи, яка містить -, - і -інтерферони. формули I за будь-яким з пп.1-44, 46, 47, 52, 53, 105. Фармацевтична композиція за п.104, де дода55, 57, 60, 70, 82 або її терапевтично прийнятної тковий імуномодуляторний агент являє собою αсолі або складного ефіру в суміші з фармацевтичінтерферон. но прийнятним носієм або допоміжною речовиною. 106. Фармацевтична композиція за п.102, яка до88. Фармацевтична композиція за п.87, яка крім датково містить антивірусний агент. того містить додатково імуномодуляторний агент. 107. Фармацевтична композиція за п.106, де анти89. Фармацевтична композиція за п.88, де додатвірусний агент являє собою рибавірин. ковий імуномодуляторний агент вибирають із гру108. Фармацевтична композиція за п.104, яка допи, яка містить -, - і -інтерферони. датково містить антивірусний агент. 90. Фармацевтична композиція за п.87, якадодат109. Фармацевтична композиція за п.108, де антиково містить антивірусний агент. вірусний агент являє собою рибавірин. 91. Фармацевтична композиція за п.90, де антиві110. Фармацевтична композиція за п.105, яка дорусний агент вибирають із групи, яка містить рибадатково містить антивірусний агент. вірин і амантадин. 111. Фармацевтична композиція за п.110, де анти92. Фармацевтична композиція за п.87, яка додатвірусний агент являє собою рибавірин. ково містить інший інгібітор HCV протеази. 112. Фармацевтична композиція за п.102, яка до93. Фармацевтична композиція за п.87, яка додатдатково містить ще один інгібітор HCV протеази. ково містить інгібітор інших мішеней життєвого 113. Фармацевтична композиція за п.102, яка доциклу HCV. датково містить ще один інгібітор інших мішеней 94. Фармацевтична композиція за п.93, де інгібітор життєвого циклу HCV. інших мішеней життєвого циклу HCV вибирають з 114. Фармацевтична композиція за п.113, в якій групи, яка включає геліказу, полімеразу або метавказаний інгібітор вибирають із групи, яка включає лопротеазу. геліказу, полімеразу або металопротеазу. Даний винахід стосується сполук, композицій, способів одержання таких сполук і способів лікування інфекції, викликуваної вірусом гепатиту С (HCV). Даний винахід стосується, зокрема, нових пептидних аналогів, фармацевтичних композицій, що містять такі аналоги, і способів застосування цих аналогів для лікування HCV-інфекціі. Вірус гепатиту С (HCV) є основним збудником гепатиту, що не належить до гепатитів А і В, який виникає після переливання крові і який уражає 15 74546 16 людей в усьому світі Встановлено, що понад 170 леотидів і має одну відкриту рамку зчитування мільйонів людей у світі заражено вірусом. Великий (ВРС), яка кодує один великий поліпротеїн, що відсоток носіїв стають хронічно інфікованими, і в складається приблизно з 3000 амінокислот. У забагатьох пацієнтів це призводить до хронічного ражених клітинах цей поліпротеїн розщеплюється захворювання печінки, так званого хронічного геу багатьох сайтах клітинними і вірусними протеапатиту С. У свою чергу, ця групахв.орих має висозами з утворенням структурних і неструктурних кий ризик захворювання такою серйозно(NS) протеїнів. У випадку HCV під дією двох вірусюхв.оробою печінки, як цироз печінки печінковоних протеаз утворюються зрілі неструктурні протеклітинний рак і остання стадіяхв.ороби печінки, яка їни (NS2, NS3, NS4A, NS4B, NS5A і NS5B). Перша приводить досмерті. з них, що поки ще недостатньо охарактерізована, Механізм, за допомогою якого відбувається розщеплює зв'язок NS2-NS3, друга являє собою збереження вірусу HCV в організмі і забезпечуєтьсеринпротеазу, що міститься в N-кінцевій області ся високий коефіцієнт захворюваності хронічноNS3 (далі позначена як NS3-протеаза), і вона опоюхв.оробою печінки, поки недостатньо вивчений. середкує усі подальші розщеплення, що відбуваНевідомо як HCV взаємодіє з імунною системою ються по ходу транскрипції відносно NS3, як у цисхазяїна і переборює її дію. Крім того, також іще не оріентації, у сайті розщеплення NS3-NS4A, так і в виявлено ролі клітинних і гуморальних імунних транс-орієнтації в інших сайтах NS4A-NS4B, NS4Bвідповідей у захисті від HCV-інфекції і при захвоNS5A, NS5A-NS5B. Протеїн NS4A, імовірно, має рюванні гепатитом. Є дані про те, що імуноглобумножинні функції, діючи як кофактор для NS3ліни можна застосовувати для профілактики зв'япротеази і, можливо, сприяючи локалізації на заного з переливанням крові вірусного гепатиту мембрані NS3 інших вірусних репліказ. Утворення однак. Центр із контролю захворюваності сьогодні комплексу протеїну NS3 з NS4A, імовірно, необне рекомендує лікування з використанням імуногхідне для процесування, посилення протеолітичної лобулінів для цієї мети. Відсутність ефективної ефективності у всіх сайтах. Протеїн NS3 також має захисної імунної відповіді утрудняє розробку вакнуклеозидтрифзсфатазну активність і РНКцини або адекватних профілактичних мір після геліказною активністю NS5B являє собою РНКекспозиції, тому найближчим часом надії головним залежну РНК-полімеразу, що бере участь у реплічином покладають на антивірусні засоби. кації HCV. З метою виявлення фармацевтичних агентів, [У заявці на патент WO 97/06804] описано (-)ефективних щодо лікування HCV-інфекції в пацієенантіомер нуклеозидного аналога цитозин-1,3нтів, що страждають на хронічний гепатит С, було оксатіолану (також відомий як ЗТС), який має акпроведено різні клінічні випробування. У цих витивність щодо HCV. Хоча в проведених раніше пробуваннях застосовували інтерферон-альфа клінічних дослідженнях для цієї сполуки виявлено індивідуально або в комбінації з іншими антивірусактивність щодо ВІЛ і HBV, поки немає клінічного ними агентами. Ці дослідження дозволили встанодоказу його активності щодо HCV і не виявлено вити, що в переважної кількості учасників експейого механізм дії щодо цього вірусу. рименту не було виявлено реакції на такі схеми Загальна стратегія розробки антивірусних агелікування а з тих учасників, що виявилися чутлинтів складається в інактивації кодованих вірусом вими до лікування, у більшої частини після закінферментів, що є важливими для реплікації вірусу. чення лікування спостерігали рецидив. Значні зусилля, вжиті у зв'язку з цим для виявТаким чином, до останнього часу терапія з вилення сполук, що інгібують NS3-протеазу або РНКкористанням інтерферону (ІFN) залишалася єдигеліказу HCV привели до таких результатів. ним доступним методом лікування пацієнтів, що [У патенті US 5633388] описано заміщені гетестраждають на хронічний гепатит С, яка має довероциклом карбоксаміди та їхні аналоги, які мають дену в клінічних умовах ефективність. Однак триактивність щодо HCV. Мішенню для цих сполук є валість дії такого лікування є невеликою, і крім геліказна активність протеїну NS3 вірусу, однак того, лікування інтерфероном викликає серйозні поки немає даних про їхні клінічні випробування. побічні дії (тобто ретинопатію, тиреоідит, гострий Chu та ін. [Tet Lett, (1996), 7229-7232] описали панкреатит, депресію), що знижує якість життя фенантренхінон, який має активність щодо NS3пацієнтів, яких піддають лікуванню. Сьогодні інтепротеази HCV in vitro. Ніяких додаткових даних рферон у сполученні з рибавірином запропоновапро цю сполуку не опубліковано. но для лікування пацієнтів не чутливих до ІFN, У науковій доповіді, представленій на Дев'ятій застосовуваного індивідуально. Такий підхід сьоміжнародній конференції з антивірусних дослігодні рекомендовано для лікування пацієнтів які джень [Ninth International Conference on Antiviral раніше не піддавалися лікуванню, і він є найбажаResearch, Urabandai, Fukyshima, Japan (1996), нішим у терапії HCV. Однак побічні дії, викликані Antiviral Research, (1996), 30, 1, A23 (реферат 19)], IFN, не зменшуються при такій спільній терапії. повідомлялося про триазолідинові похідні, що маТаким чином, існує необхідність у розробці ють інгібувальну активність щодо HCV-протеази. ефективних антивірусних агентів для лікування У деяких дослідженнях описано сполуки, які HCV-інфекціі, що були б позбавлені недоліків ісмають інгібувальну дію щодо інших серинпротеаз, нуючих методів лікування, заснованих на застосутаких як людська еластаза лейкоцитів. Одну групу ванні фармацевтичних засобів. таких сполук описано [в WO 95/33764 (Hoechst HCV являє собою укладений в оболонку позиMarion Roussel, 1995)]. Описані в даній заявці пептивний ланцюг РНК-ового вірусу сімейства тиди являють собою морфолінілкарбонілбензоілFlaviviridae Геном HCV, представлений одноланпептидні аналоги, що структурно відрізняються від цюговою РНК, складається приблизно з 9500 нукпептидів за даним винаходом. 17 74546 18 [У WO 98/17679 (на ім'я VeKTex молекулярною масою, що мають здатність прониPharmaceuticals Inc)] описано інгібітори серинкати через клітинні мембрани й інгібувати NS3протеази, зокрема, NSЗ-протеази вірусу гепатипротеазну активність у культурі клітин. ту С Ще одна перевага сполук за даним винаходом Фірмою Hoffman LaRoche (WO 98/22496, US полягає в тім, що вони мають активність щодо 5866684 і US 6018020) також описано гексапептиобох основних генотипів, виявлених ν клінічних ди, що є інгібіторами протеїназн, як антивірусні ізолятах (1а і 1б), що переконливо підтверджує, агенти для лікування HCV-інфекціі. що ці сполуки мають активність щодо усіх відомих Steinkuhler та ін і Ingallinella та ін опублікували сьогодні генотипів HCV. дані про продукт інгібування NS4A-4B [Biochemistry Об'єктом даного винаходу є сполуки фор(1998), 37, 8899-8905 і 8906-8914]. мули (1) [У WO 97/43310] на ім'я Schering Corporation описано послідовності пептидів, що складаються з 20 і 21 амінокислот, які мають активність щодо NS3-протеази HCV. [У WO 98/46597] на ім'я університету Еморі (І) описано пептиди і міметики пептидів, які мають активність in vitro щодо серинпротеаз. [У WO 98/46630] на ім'я Peptide Therapeutics L united описано депсипептидний субстрат що має здатність інгібувати NS3-протеазу HCV. де Нарешті, [у патенті US 5869253] описано ферW означає СН або N, ментативні молекули РНК, що мають здатність R21 означає Н, галоген, С1-С6алкіл, С3інгібувати NS3-протеазу HCV. С6циклоалкіл, С1-С6галоалкіл, С1-С6алкокси, С3В жодній із зазначених вище заявок на патент С6циклоалкокси, гідрокси або N(R23)2, де кожен R21 не описано циклічні пептиди що мають активність незалежно один від одного означає Н, С1-С6алкіл щодо NS3-протеази HCV. або С3-С6циклоалкіл, і [У WO 99/07733, WO 99/07734, WO 00/09543 і R22 означає Н, галоген, С1-С6алкіл, С3WO 00/09558] описано гекса-тетрапептиди і триС6циклоалкіл, С1-С6галоалкіл, С1-С6тіоалкіл, С1пептидні аналоги, що мають здатність інгібувати С6алкокси, С3-С6циклоалкокси, С2-С7алкоксіалкіл, NS3-протеазу. Однак у цих описах не запропоноС3-С6циклоалкіл, С6- або С10арил або Het, де Het вані макроциклічні аналоги за даним винаходом і означає п'яти-, шести- або семичленний насиченаведена інформація не може привести до їх ний чи ненасичений гетероцикл, який містить створення. один-чотири гетероатома, вибраних із азоту, кис[У заявці WO 99/38888 на ім'я Institute de ню та сірки, Richerche di Biologia Moleculare (IRBM), опублікопри цьому зазначений циклоалкіл, арил або ваній 5 серпня 1999p.], описано малі пептидні інгіHet заміщено радикалом R24, де бітори NS3-протеаз HCV. R24 означає Н, галоген, С1-С6алкіл, С3У цьому описові не запропоновано і не зазнаС6циклоалкіл, С1-С6алкокси, С1-С6циклоалкокси, чено циклічної будови пептидів за даним винахоNO2, N(R25)2, NH-C(O)-R25 або NH-C(O)-NH-R25, де дом. Крім того цей опис опублікований після дати кожен R25 незалежно один від одного означає Н, пріоритету даного опису. С1-С6алкіл або С3-С6циклоалкіл, [У заявці WO 99/64442 на ім'я lRBM], яку також або опубліковано після дати пріоритету даного опису, R24 означає NH-C(O)-OR26, де R26 означає С1описано олігопептиди що включають кетокислоти С6алкіл або С3-С6циклоалкіл, R3 означає гідрокси, в положенні Ρ1. NH2 або групу формули -NH-R31, де R31 означає [Заявку WO 99/50230 на ім'я VeKTex С6- або С10арил, гетероарил, -C(O)-R32, -C(O)-OR32 Pharmaceuticals (опублікована 7 жовтня 1999p.)] або також опубліковано після дати пріоритету даної -C(O)-NHR32, де заявки І в цьому випадку в публікації навіть віддаR32 означає С1-С6алкіл або С3-С6циклоалкіл, лено не маються на увазі які-небудь циклічні пепD означає насичений або ненасичений алкілетиди за даним винаходом. новий ланцюг, що складається з 5-10 атомів, який Однією з переваг даного винаходу є те, що в необов'язково включає один-три гетероатома, неньому заявлено макроциклічні пептиди, які мають залежно один від одного вибраних із О, S, або Nінгібувальну активність щодо NS3-протеази вірусу R41, де гепатиту С. R41 означає Н, С1-С6алкіл, С3-С6циклоалкіл або Ще однією перевагою об'єкта даного винаходу -C(O)-R42, де R42 означає С1-С6алкіл, С3є той факт, що ці пептиди специфічно інгібують С6циклоалкіл або С6- або С10арил, NS3-протеазу і не виявляють помітної інгібувальR4 означає Η або один-три замісника на будьноі активності щодо інших серинпротеаз, таких як якому атомі вуглецю ланцюга D, де замісники нееластаза лейкоцитів людини (HLE), еластаза панзалежно один від одного вибирають із групи, яка креатичної залози свині (РРЕ) або бичачий хімотмістить С1-С6алкіл, С1-С6галоалкіл, С1-С6алкокси, рипсин підшлункової залози, або щодо цистеїнпгідрокси, галоген, аміно, окси, тіогрупу або С1ротеаз таких як катепсин В печінки людини (Cat В). С6тіоалкіл, і І ще однією перевагою даного винаходу є те, А означає амід формули -C(O)-NH-R5, що в ньому наведено невеликі пептиди з низькою де R5 вибирають із групи, яка містить С 1 19 74546 20 С8алкіл, С3-С6циклоалкіл, С6- або С10арил чи С7сується сполуки формули: С16аралкіл, або А означає карбонову кислоту, або її фармацевтично прийнятна сіль або складний ефір Під обсяг даного винаходу також підпадає фаУ контексті даного опису поняття "вініл-АЦКК" рмацевтична композиція, яка містить ефективну стосується сполуки формули: щодо вірусу гепатиту С кількість сполуки формули І або її фармацевтично прийнятної солі чи її складного ефіру в суміші з фармацевтично прийнятним носієм або допоміжною речовиною. У контексті даного опису поняття "гомоалілВажливим об'єктом даного винаходу є спосіб АЦКК" стосується сполуки формули: лікування інфекції, викликуваної вірусом гепатиту С у ссавця, який передбачає введення ссавцеві ефективної щодо вірусу гепатиту С кількості сполуки формули І або й терапевтично прийнятної солі або складного ефіру, чи описаної вище композиції. Поняття "гало" у контексті даного опису ознаІншим важливим об'єктом даного винаходу є чає галогеновий замісник, вибраний із групи, яка спосіб інгібування реплікації вірусу гепатиту С містить бром, хлор, фтор або йод. шляхом оброблення вірусу такою кількістю сполуПоняття "С1-С6галоалкіл" індивідуально або в ки формули І, що інгібує NS3-протеазу вірусу гепакомбінації з іншим замісником у контексті даного титу С, або її терапевтично прийнятної солі чи опису означає ациклічні алкільні замісники з пряскладного ефіру, або описаної вище композиції. мим або розгалуженим ланцюгом, які містять 1-6 Ще одним об'єктом даного винаходу є спосіб атомів вуглецю і мають один або кілька замісників лікування інфекції, викликуваної вірусом гепатиту атома водню, що представляють собою галоген, С у ссавця, який передбачає введення ссавцеві вибраний з ряду, що включає бром, хлор, фтор ефективної щодо вірусу гепатиту С кількості комабо йод. позиції, яка містить сполуки формули І або її тераПоняття "С1-С6тіоалкіл" індивідуально або в певтично прийнятну сіль або складний ефір. Згідно комбінації з іншим замісником у контексті даного з одним із варіантів здійснення, фармацевтичні опису означає ациклічні алкільні замісники з прякомпозиції за даним винаходом включають додатмим або розгалуженим ланцюгом, що містять тіковий імуномодулятор. Приклади додаткових імуольну групу, такі як тіопропіл. номодуляторів включають (але не обмежуючись Поняття "С1-С6алкіл" або "(нижч )алкіл" у конними) α-, β- або γ-інтерферони. тексті даного опису, само по собі або в комбінації з В альтернативному варіанті здійснення фаріншим замісником, означає ациклічні алкільні замімацевтичні композиції за даним винаходом можуть сники з прямим або розгалуженим ланцюгом, що додатково включати антивірусний агент. Прикламістять від 1 до 6 атомів вуглецю, і включає, надами антивірусних агентів є рибавірин і амантаприклад, метил, етил, пропіл, бутил, гексил, 1дин. метилетил, 1-метилпропіл, 2-метилпропіл, 1,1Ще в одному альтернативному варіанті здійсдиметилетил. нення фармацевтичні композиції за даним винаПоняття "С3-С6циклоалкіл" у контексті даного ходом можуть додатково включати інші інгібітори опису, само по собі або в комбінації з іншим замісHCV-протеази. ником, означає циклоалкільний замісник, що місІ ще в одному варіанті здійснення фармацевтить від 3 до 6 атомів вуглецю, і включає циклоптичні композиції за даним винаходом можуть доропіл, циклобутил, циклопентил і циклогексил. датково включати інгібітор інших мішеней життєвоПоняття "ненасичений циклоалкіл» включає, го циклу HCV, таких як геліказа, полімераза, наприклад, заміщений циклогексеніл: металопротеаза або IRES. Визначення Якщо не зазначено іншого, то в контексті даного опису використовувані поняття мають такі знаПоняття "насичений або ненасичений алкілен" чення. у контексті даного опису означає двовалентний У тих випадках, коли для позначення конфігуалкільний замісник, отриманий шляхом видалення рації замісника, наприклад, R4 сполуки формули І, одного атома водню з обох кінців насиченого або використовують символи (R) або (S), то позначенненасиченого аліфатичного вуглеводню з прямим ня стосується всієї сполуки, а не тільки замісника. або розгалуженим ланцюгом і включає, наприклад, Позначення "P1, Р2 і Р3" у контексті даного -СН2СН2С(СН3)2СН2СН2-, -CH2CH2CH=CHCH2CH2опису стосується положення амінокислотних заабо -СН2С=ССН2СН2-. Такий алкільний ланцюг лишків, починаючи з С-кінця пептидних аналогів і необов'язково може включати гетероатом, такий простираючись до N-кінця (тобто Р1 означає пояк кисень (наприклад, -СН3-СН2-О-СН2-). ложення 1 щодо С-кінця, Р2 означає положення 2 Поняття "С1-С6алкокси" індивідуально або в щодо С-кінця і т.д.) [див Berger А і Schechter 1, комбінації з іншим замісником означає замісник Transactions of the Royal Society London series О-С1-С6алкокси, де алкіл має зазначене вище зна(1970), B257, 249-264]. чення і містить до шести атомів вуглецю. Поняття У контексті даного опису поняття "1алкокси включає метокси, етокси, пропокси, 1аміноциклопропілкарбонова кислота" (АДКК) стометилетокси, бутокси і 1,1-диметилетокси. Остан 21 74546 22 ній замісник зазвичай позначають як трет.-бутокси. кінцеву функцію, заміщено алкоксикарбонільною Поняття "С3-С6циклоалкіл" індивідуально або в функцією: комбінації з іншим замісником у контексті даного опису означає замісник -О-С3-С6циклоалкіл, що містить від 3 до 6 атомів вуглецю. де фрагмент R складного ефіру вибирають з Поняття "С1-С6алкоксіалкіл" у контексті даного алкілу (наприклад, метилу, етилу, н-прошлу, трет.опису означає замісник С1-С6алкіл-О-С1-С6алкіл, бутилу, н-бутилу), алкоксіалкіла (наприклад, методе алкіл має зазначені вище значення і містить до ксиметилу), алкоксіацилу (наприклад, ацетоксимешести атомів вуглецю. Наприклад, метоксиметил тилу), аралкіла (наприклад, бензилу), арилоксіалозначає -СН2-О-СН3. кіла (наприклад, феноксиметилу) арилу Поняття "С2-С7ацил" індивідуально або в ком(наприклад, фенілу), необов'язково заміщеного бінації з іншим замісником означає С1-С6алкільну галогеном, С1-С4алкілом або С1-С4алкоксигрупою. групу, зв'язану з карбонільною групою, таку як Інші придатні у функції проліків складні ефіри моС(О)-С1-С6алкіл. жна знайти [в "Design of prodrugs", Bundgaard H, Поняття "С6,- або С10-арил" у контексті даного вид Elsevier (1985)], публікацію включено в даний опису, індивідуально або в комбінації з іншим заопис як посилання Такі фармацевтично прийнятні місником, означає або ароматичну моноциклічну складні ефіри зазвичай гідролізуються in vivo при систему, що містить 6 атомів вуглецю, або аромавведенні ссавцеві і перетворюються на кислотну тичну біциклічну систему, що містить 10 атомів форму сполуки формули І. вуглецю. Наприклад, арил включає фенільну або Стосовно вищенаведених складних ефірів, нафтильну кільцеву систему. якщо не зазначено іншого, будь-який присутній Поняття "С7-С16аралкіл" у контексті даного алкільний фрагмент у бажаному варіанті містить 1опису, індивідуально або в комбінації з іншим за16 атомів вуглецю, особливо бажано 1-6 атомів місником, означає арил, як його визначено вище, вуглецю. Будь-який присутній у таких складних зв'язаний з алкільною групою, де алкіл має зазнаефірів арильний фрагмент у бажаному варіанті чені вище значення, і містить від 1 до 6 атомів вугявляє собою фенільну групу. лецю. Аралкіл включає, наприклад, бензил і бутиЗокрема, складні ефіри можуть являти собою лфеніл. складний С1-С16алкіловий ефір, незаміщений бенПоняття "Het" у контексті даного опису, індивізиловий ефір або бензиловий ефір, заміщений дуально або в комбінації з іншим замісником, принаймні одним атомом галогену, С1-С6алкілом, означає одновалентний замісник, отриманий шляС1-С6алкокси-, нітрогрупою або трифторметилом. хом видалення водню з 5-, 6- або 7-членного наПоняття "фармацевтично прийнятна сіль" у сиченого або ненасиченого (у тому числі ароматиконтексті даного опису включає солі, отримані з чного) гетероцикла, що містить від 1 до 4 фармацевтично прийнятних основ. Приклади пригетероатомів, вибраних із ряду, який включає азот, йнятних основ включають холін, етаноламін і етикисень і сірку. Приклади придатних гетероциклів лендіамін. Під обсяг даного винаходу також підпавключають тетрагідрофуран, тіофен, діазепін, ізодають солі Na+, K+ і Са++ [див також ксазол, піперидин, діоксан, морфолін, пирімідин "Pharmaceutical salts", Birge S.Μ. та ін., J.Pharm або Sei., (1977), 66, 1-19], публікацію включено в даний Поняття "Het" також включає гетероцикл як його визначено вище, злитий з одним або декількома іншими циклами, які можуть являти собою гетероцикли або будь-який інший цикл. Одним із прикладів є тіазол[4,5-b]піридин. Хоча його зазвичай позначають "Het", поняття «гетероарил» у контексті даного опису строго означає ненасичений гетероцикл, подвійні зв'язки якого утворюють ароматичну систему Відповідними прикладами гетероароматичних систем є хінолін, індол, піридин, Поняття "фармацевтично прийнятний складний ефір" у контексті даного опису індивідуально або в комбінації з іншим замісником означає складні ефіри сполуки формули І, у яких кожну з карбоксильних функцій у молекулі, але бажано С опис як посилання. Бажані варіанти здійснення R1: Бажані варіанти здійснення даного винаходу включають описані вище сполуки формули I, у яких радикал R1 вибирають із двох різних діастереоізомерів, де вуглецевий центр у положенні 1 має R-конфігурацію, що представлено структурами: D знаходиться в син-оріентації щодо аміду (і), або знаходиться в син-оріентаціі щодо А (іі) (і)та(іі): У бажанішому варіанті лінкер D зв'язаний з R1 у cин-орієнтації по відношенню до А, як це представлено структурою (іі). R2 Бажані варіанти здійснення даного винаходу включають зазначені вище сполуки формули І, де фрагмент R2 означає 23 74546 24 де W у бажаному варіанті означає N. В оптимальному варіанті R32 означає трет.У бажаному варіанті R21 означає Н, С1-С6алкіл, бутил, циклобутил або циклопентил. С1-С6алкокси, гідрокси, хлор або N(R23)2, де R23 D: бажано означає Η або С1-С6алкіл. Бажаніше R21 Бажані варіанти здійснення даного винаходу означає Η або С1-С6алкокси. В оптимальному вавключають сполуки формули І, де лінкер D являє 21 ріанті R означає метокси. собою насичений або ненасичений алкіленовий У бажаному варіанті R22 означає Н, С1ланцюг, що складається з 6-8 атомів. Бажаніше С6тіоалкіл, С1-С6алкокси, феніл або Het, вибраний лінкер D являє собою ланцюг, що складається з 7 із групи, яка містить: атомів. У бажаному варіанті ланцюг D містить один або два гетероатома, вибраних із групи, яка містить О, S, NH, N-С1-С6алкіл або N-С2-С7ацил. Бажаніше ланцюг D необов'язково містить один гетероатом, вибраний із групи, яка включає NH або NС2-С7ацил, а в оптимальному варіанті N(Ac), і він знаходиться на атомі в положенні 10 ланцюга В оптимальному варіанті ланцюг, що містить атом азоту, є насиченим. В альтернативному варіанті D містить один гетероатом, вибраний із О або S. Бажано, щоб ланцюг D містив 7 атомів, атом О або S знаходився в положенні 9 ланцюга. У бажаному варіанті цей У бажаному варіанті R24 означає Н, С1-С6алкіл, ланцюг має замісник R4, де R4 означає Η або С125 25 25 NH-R , NH-C(O)-R або NH-C(O)-NH-R або NHС6алкіл. Бажаніше R4 означає Η або метил В опC(O)-OR26. тимальному варіанті R4 означає Η або 8-(S)-Ме. 2 Бажаніше R означає С1-С4алкокси, феніл або Ще краще, якщо ланцюг D є насиченим. В альтерHet, вибраний із групи, яка містить: нативному варіанті D містить один подвійний зв'язок між положеннями 11 і 12. У бажаному варіанті цей подвійний зв'язок знаходиться в трансорієнтаціі. В альтернативному варіанті D являє собою насичений або ненасичений алкіленовий ланцюг, що містить тільки атоми вуглецю. У цьому випадку ланцюг D бажано є насиченим і складається з 7 атомів. Бажаніше ланцюг D має замісник R, де R означає Н, оксо, тіо, гідрокси, тіоалкіл, алкокси або 24 25 Бажаніше R означає Η, С1-С6алкіл, NH-R , алкіл Бажаніше R означає Η або С1-С6алкіл. Ще 25 26 NH-C(O)-R , або NH-C(O)-OR . бажаніше R4 означає Η або метил. В оптимально22 В оптимальному варіанті R означає етокси, му варіанті R4 означає Η або 10-(S)-Me. або Het вибирають із групи, яка містить: В альтернативному варіанті D являє собою алкіленовий ланцюг, що складається тільки з атомів вуглецю, який бажано містить один подвійний зв'язок і включає 7 атомів. Бажаніше зазначений подвійний зв'язок знаходиться між положеннями 13 і 14 ланцюга. В оптимальному варіанті цей по24а 25 В оптимальному варіанті R означає NH-R , двійний зв'язок знаходиться в цис-оріентації. У NH-C(O)-R25, або NH-C(O)-OR26. бажаному варіанті цей ланцюг D заміщено R4, де 24b В оптимальному варіанті R означає Η або R4 означає Н, оксо, гідрокси, алкокси або алкіл. С1-С6алкіл. Бажаніше R4 означає Η або С1-С6алкіл. Ще бажа25 У бажаному варіанті кожен R незалежно ніше R4 означає Η або метил. В оптимальному один від одного означає Н, С1-С6алкіл або С3варіанті R4 означає Η або 10-(S)-Ме. С6циклоалкіл. Бажаніше R25 означає С1-С6алкіл A: або С3-С6циклоалкіл. Бажаніше R25 означає С1Бажані варіанти здійснення даного винаходу С6алкіл. В оптимальному варіанті R26 означає С1включають описані вище сполуки формули 1, де А С6алкіл. означає карбонову кислоту. R3 : Конкретні варіанти здійснення: Бажані варіанти здійснення даного винаходу Бажані варіанти здійснення даного винаходу включають описані вище сполуки формули І, де включають описані вище сполуки формули І, де R2 фрагмент R3 бажано означає амід формули NHозначає замісник, що являє собою хінолін (тобто C(O)-R32, сечовину формули NH-C(O)-NH-R32 або W означає N); карбамат фомули NH-C(O)-OR32. Бажаніше R3 R3 означає групу формули -NH-C(O)-NHR32 означає карбамат або сечовину. В оптимальному або -NH-C(O)-OR32, варіанті R3 означає карбамат. де R означає С1-С4алкіл або С4-С6циклоалкіл; У бажаному варіанті R32 означає С1-С6алкіл D означає такий, що складається з 6-8 атомів 32 або С3-С6циклоалкіл. Бажаніше R означає С1насичений або ненасичений алкіленовий ланцюг, С6алкіл або С4-С6циклоалкіл. приєднаний до R1 у син-орієнтаціі щодо А, який 25 74546 26 необов'язково містить один або два гетероатома, допомогою ін'єкції або інфузіі, а також введення в незалежно один від одного вибраних із О, S або Nділянку ушкодження. R41, де R41 означає С2-С7ацил; Фармацевтичні композиції можуть мати форму R4 означає Η або один-три замісника, незалестерильного препарату для ін'єкції, наприклад, жно один від одного вибраних із гідрокси або С1стерильної ін'єкованої водної або жиророзчинної С6алкіла; і суспензії. Ця суспензія може бути отримана за А означає карбонову кислоту, або їх фармацедопомогою добре відомих методів з використанвтично прийнятні солі чи складні ефіри. ням диспергувальних або змочувальних агентів Більш бажаними є сполуки формули І, де R1 (таких як, наприклад, Твін 80) і суспендувальних має зазначені вище значення, R21 означає Η або агентів. метокси; Фармацевтичні композиції за даним винахоR22 означає С1-С6алкокси, або Het вибирають дом можуть уводитися перорально у вигляді будьіз групи, яка містить: якої прийнятної дозованої форми для перорального введення, включаючи (але не обмежуючись ними) капсули, таблетки і водні суспензії і розчини. У випадку таблеток для перорального введення зазвичай застосовувані носії включають лактозу і кукурудзяний крохмаль. Як правило, також додаде R24а означає Н, С1-С6алкіл, NH-R25, NHють замаслювачі, такі як стеарат магнію. Для пеC(O)-R25, NH-C(O)-NH-R25, рорального введення у формі капсул прийнятні де R25 означає Н, С1-С6алкіл або С3розріджувачі включають лактозу і безводний кукуС6циклоалкіл; рудзяний крохмаль Коли пероральним шляхом або R24a означає NH-C(O)-OR26, де R26 означає уводять водні суспензії, дійову речовину поєднуС1-С6алкіл або С3-С6циклоалкіл, і R24b означає Η ють з емульгувальними і суспендувальними агенабо С1-С6алкіл; тами. У разі потреби можна додавати певні підсоR3 означає сечовину формули NH-C(O)-NHR32 лоджувальні речовини і/або коригенти і/або або карбамат формули NH-C(O)-OR32, де R3 ознабарвники. чає С1-С6алкіл або С3-С6циклоалкіл; Інші придатні наповнювачі або носії для зазнаD означає такий, що містить 7 атомів вуглецю чених вище препаративних форм і композицій монасичений або ненасичений алкіленовий ланцюг, жна знайти в звичайних фармацевтичних довідниякий необов'язково включає один подвійний зв'яках, [наприклад, у "Remington's Pharmaceutical зок між положеннями 11, 12 або 13, 14. Sciences", The Science and Practice of Pharmacy, При цьому ланцюг D необов'язково включає 19-е вид Mack Publishing Company, Easton, Penn., один гетероатом, незалежно вибраний із О, S, NH, (1995)]. N(Me) або N(Ac); і Дози в діапазоні від приблизно 0,01 до прибR4 означає Η або С1-С6алкіл. лизно 100мг/кг ваги тіла на день, у бажаному варіНайбільш бажаними є сполуки формули І, де анті від приблизно 0,5 до приблизно 75мг/кг ваги R21 означає метокси і R22 означає етокси або: тіла на день сполуки за даним винаходом, що є інгібітором протеази, можна застосовувати для монотерапії з метою попередження і лікування опосередкованої HCVхв.ороби. Як правило, фар24a мацевтичні композиції за даним винаходом можуть де R означає NН-(С1-С4алкіл), NH-C(O)-(С1уводитися від приблизно 1 до приблизно 5 разів на С4алкіл), або NН-С(О)-О-(С1-С4алкіл); і день або в іншому варіанті шляхом безперервної D являє собою насичений ланцюг або містить інфузії. Таке введення може застосовуватися як один подвійний зв'язок, який знаходиться в цисдля екстреного, так і для тривалого лікування. Кіорієнтаціі між положеннями 13, 14. лькість дійової речовини, яка може бути об'єднана Нарешті, під об’єм даного винаходу підпадаз носіями для одержання стандартної дозованої ють усі сполуки формули І, наведені в таблиформи, повинна варіюватися в залежності від хацях 1-9. зяїна, що підлягає лікуванню, і конкретного шляху Фармацевтичні композиції за даним винаховведення. Звичайна композиція може містити від дом можна вводити перорально, парентерально приблизно 5% до приблизно 95% дійової речовини або за допомогою пристрою для імплантації. Ба(мас %). У бажаному варіанті такі композиції місжаним є пероральне введення або введення за тять від приблизно 20% до приблизно 80% дійової допомогою ін'єкції. Фармацевтичні композиції за речовини. даним винаходом можуть містити будь-які загальЯк має бути очевидним фахівцеві в даній галуноприйняті нетоксичні фармацевтично прийнятні зі, можна застосовувати і нижчі або вищі дози, ніж носії, ад'юванти або наповнювачі. У деяких випадті, що зазначено вище. Специфічні схеми дозуванках значення pH композиції може регулюватися за ня і лікування для будь-якого конкретного пацієнта допомогою фармацевтично прийнятних кислот, можуть залежати від різних факторів, включаючи основ або буферів з метою підвищення стабільноактивність конкретної застосовуваної сполуки, вік, сті сполуки, включеної в композицію або у форму вагу тіла, загальний стан здоров'я, стать, раціон, для її введення. У контексті даного опису поняття час уведення, швидкість виведення, суміщення "парентеральний" включає підшкірний, внутрішлікарських засобів, серйозність і особливості розньошкірний, внутрішньовенний, внутрішньом'язовиткухв.ороби, схильність пацієнта до інфекції, і вий, внутрішньосуглобний, інтрасиновіальний, інвони визначаються лікарем-куратором. Як правитрастернальний, інтратекальний шлях уведення за 27 74546 28 ло, лікування починають з невеликих доз, істотно HCV. Такий додатковий агент може вводитися нижчих за оптимальну дозу пептиду. Потім дозу ссавцеві до, одночасно або після введення компопідвищують невеликими порціями до досягнення зиції за даним винаходом. оптимальної дії в конкретних умовах. Зазвичай Запропоновані в даному винаході композиції найбажаніше вводити сполуку в такому діапазоні також можна застосовувати як лабораторні реагеконцентрацій, які забезпечують антивірусну активнти. Заявниками вперше запропоновано низьконість, але не мають ніякої шкідливої або небезпемолекулярні сполуки, які мають високу активність і чної побічної дії. специфічність щодо NS3-протеази HCV. Деякі зі Коли композиції за даним винаходом включасполук за даним винаходом можуть являти собою ють комбінацію сполуки формули І і одного або інструмент для розроблення систем аналізу реплідекількох додаткових терапевтичних або профілакації вірусу, створення систем аналізу в організмі ктичних агентів, то сполука і додатковий агент матварин і вивчення залежності між будовою і біолоють бути присутніми у діапазоні доз від приблизно гічною активністю з метою розширення розуміння 10% до 100% і, бажаніше, від приблизно 10% до механізмів пов'язаних із HCV захворювань. 80% від дози, зазвичай застосовуваної в режимі Сполуки за даним винаходом також можна замонотерапії. стосовувати для викорінювання або попередження Коли ці сполуки або їхні фармацевтично привірусного забруднення матеріалів, і тим самим йнятні солі поєднують у препаративній формі з вони знижують ризик зараження вірусом персонафармацевтично прийнятним носієм, те отримана лу лабораторій або медичних установ, які мають композиція може вводитися in vivo ссавцеві, такоконтакт із такими матеріалами (наприклад, кров'ю, му як людина, для інгібування NS3-протеази HCV тканинами, хірургічними інструментами і предмеабо для лікування чи попередження інфекції, витами одягу, лабораторними інструментами і предкликуваної вірусом HCV. Такого лікування також метами одягу, приладами і матеріалами для збору можна досягти при використанні сполуки за даним крові). винаходом в комбінації з агентами, що включають Методика імуномодулятори, такі як α-, β- або γ-інтерферони, Деякі методи синтезу ациклічних проміжних інші антивірусні агенти, такі як рибавірин, амантапродуктів для сполук формули І [описано в WO дин, інші інгібітори NS3-протеази HCV; інгібітори 00/09543 і WO 00/09558]. інших мішеней у життєвому циклі HCV, які вклюСполуки за даним винаходом синтезують згідчають (але не обмежуючись ними) геліказу, поліно з загальним процесом, проілюстрованим на меразу, металопротеазу або внутрішній сайт вхосхемах І, II і llІ (де PG означає відповідні захисні ду в рибосому (IRES), або їх комбінацію. Додаткові групи). [На всіх наведених нижче схемах D' має те агенти можуть бути об'єднані зі сполуками за дасаме значення, що і D, але є коротшим на 2-5 атоним винаходом для створення однократної дозомів]. ваної форми. В альтернативному варіанті ці додаКоли розглядаються сполуки формули І, де А ткові агенти можуть уводитися ссавцеві окремо у означає N-заміщений амід, то вініл-АЦКК або говигляді частини багаторазової дозованої форми. моаліл АЦКК (R1) піддають сполученню з відповідЗгідно з іншим варіантом здійснення даний виним аміном перед сполученням з Р2. Методи таконахід стосується способів інгібування активності го сполучення добре відомі фахівцям у даній NS3-протеази HCV у ссавців шляхом уведення галузі. Як відомо фахівцям у даній галузі, такий сполуки формули І, у якій замісники мають зазнаамід (А) є незахищеним, але може мати кожен із чені вище значення. вищенаведених придатних замісників R5. Згідно з бажаним варіантом здійснення ці споРеакцію замикання кільця (макроциклізацію) соби можна застосовувати для зниження активноздійснюють або шляхом олефінового метатезису сті NS3-протеази HCV у ссавця. Якщо фармацев(Схема І), або, коли лінкер містить атом азоту, тична композиція включає як дійову речовину шляхом відновлювального амінування (Схема II), тільки сполуку за даним винаходом, то такі спосоабо шляхом утворення пептидного зв'язку за Схеби можуть додатково включати стадію введення мою III. ссавцеві агента, вибраного з імуномодулятора, Ці процеси докладно описано нижче: антивірусного агента, інгібітору HCV-протеази або А Макроциклізащя шляхом олефінового метаінгібітору інших мішеней у життєвому циклі HCV, тезису таких як геліказа. полімераза або металопротеаза. Схема I Такий додатковий агент може вводитися ссавцеві до, одночасно або після введення композицій за даним винаходом. Згідно з іще одним бажаним варіантом здійснення ці способи можна застосовувати для інгібування реплікації вірусу в організмі ссавця. Такі способи можна застосовувати для лікування або попередження викликуваної HCVхв.ороби. Якщо фармацевтична композиція включає як дійову речовину тільки сполуку за даним винаходом, то такі способи можуть додатково включати стадію введення ссавцеві агента, обраного з імуномодулятора, антивірусного агента, інгібітору HCV-протеази або інгібітору інших мішеней у життєвому циклі 29 74546 30 Схема І: Стадія А: Гідроборування подвійного зв'язку Існує кілька шляхів здійснення послідовності згідно з методом Брауна [Н.С.Brown і B.C.Subba реакцій сполучення, які добре відомі фахівцям у Rao, J.Am.Che. Sac. 1959, 81, 6434-6437] з наступданій галузі. Використовуючи як вихідний продукт ним окислюванням утвореного спирту [наприклад, 4-(S)-гідроксипролін, замісник у 4-гідроксигрупу за допомогою періодинату Дес-Мартина, J.Am. можна ввести за допомогою реакції Міцунобу [за Сhem. Soc. 1991, 113, 7277-7287] приводить до методом, описаним у Mitsunobu, Cunthesis 1981, одержання відповідного альдегіду. January, 1-28, Ratio та ін., Tet. Lett. 1994, 56, 3779Стадія Б: Гідрування в присутності кислоти 3792; Krchnak та ін., Tet. Lett. 1995, 36, 6193-6196] приводить до видалення амінозахисної групи, пісперед здійсненням макроциклізації або після неї. В ля чого проводять макроциклізацію шляхом відноальтернативному варіанті зборка може бути здійсвлювального амінування. нена з використанням відповідного 4-(R)Фрагмент Р3, використовуваний у цьому сингідроксизаміщеного проліну згідно з загальними тезі, може бути легко отриманий із різних амінокипроцесами, [описаними у WO 00/09543 і WO слот, таких як лізин, орнітин, глутамін [за допомо00/09558] (нижче наведено конкретні приклади цих гою реакції Гофмана: Веr. 1881, 14, 2725] та інші; фрагментів). модифікації цього методу синтезу добре відомі в Стадії А, Б, В: У цілому фрагменти P1, P2 і РЗ даній галузі. можуть бути зв'язані за допомогою добре відомих Стадія В: Вторинний амін у лінкері D (отримаметодів пептидного сполучення, і їх у цілому [опиний на стадії Г) необов'язково алкілають за допосано у WO 00/09543 і WO 00/09558]. могою алкілгалогеніду або ацетплують за допомоСтадія Г: Одержання макроциклу може бути гою алкіл- чи арилхлорангідриду з використанням здійснене шляхом олефінового метатезису з викометодик, добре відомих у даній галузі, з одержанристанням каталізатора, що містить Ru, як це опиням інгібіторів, які мають загальну структуру II. сано [в Miller, S.J., Blackwell, Η.Ε., Grubbs, R.H. Якщо А' являє собою захищену карбонову кислоту, J.Am. Chem. Soc. 1996, 118, 9606-9614 (a); то відповідним чином також видаляють захисні Kingsbury, J.S., Harrity. J.Ρ.A., Bonitatebus, Ρ.J., групи. Hoveyda, A.H. J.Am. Сhem. Soc. 1999, 121, 791-799 В. Макроциклізація шляхом утворення лактаму (б) і в Huang, J., Stevens, Ε.D., Nolan, S.Ρ., З іншого боку, варто розуміти, що зазначені Petersen, J.L.;.J.Am. Chem. Soc. 1999, 121, 2674макроциклічні сполуки, які мають загальні структу2678 (в)]. Слід також зазначити, що для цієї реакції ри І і II, можуть бути синтезовані іншими методаможна використовувати каталізатори, які містять ми. інші перехідні метали, такі як Мо. Наприклад, Р1 і Р3 можуть бути спочатку з'єднані з лінкером D, потім піддані сполученню з Р2, і реакція макроциклізації може привести до утворення лактаму, яке може бути здійснене двома можливими шляхами як це відомо фахівцям у даній галузі, що проілюстровано на схемі III. Схема ІІІ Стадія Ε: Подвійний зв'язок необов'язково може бути відновлений за допомогою стандартних методів гідрування, добре відомих у даній галузі. Якщо А' являє собою захищену карбонову кислоту, то також відповідним чином видаляють захисні групи. Б. Макроциклізація шляхом відновлювального амінування (для лінкерів, що містять Ν) Якщо лінкер містить атом азоту, макроциклізація може бути здійснена шляхом відновлювального амінування, як проілюстровано на Схемі II з одержанням інгібіторів, які мають загальну структуру Π. Схема ІІ Синтез Р1 Для синтезу інгібіторів, що мають загальні структури І і II, потрібні однакові фрагменти Р1: а) вініл-АЦКК, синтез і виділення якого [описано в WO 00/09543 і WO 00/09558], або б) гомоаліл-АЦКК (приклад 1, сполука If). Синтез Р2 Деякі з фрагментів Р2, використовувані при синтезі сполук формули І, [описано в WO 00/09543 і WO 00/09558] 31 74546 32 Інші фрагменти Р2 синтезують у такий спосіб Приклади такого процесу [описано в WO Синтез 2-"Het"-4-гідрокси-700/09543 і WO 00/09558]. метоксихінолінового похідного Синтез 2-карбокси-4-заміщеного амінотіазоль(і) Підхід, заснований на використанні у функних похідних формули Vlld ції вихідного продукту відповідної "Het''-карбонової Згідно з загальною методологією синтезу, кислоти Ivb представленою на схемі Vll, одержують різні 4Схема IV алкілтіазоліл-2-карбонові кислоти, що представляють собою сполуки, які мають загальну структуру Vlld. Схема Vll Синтез здійснюють за модифікованим методом, [описаним у Li та ін., J. Med. Chem. 1994, 34, 3400-3407]. Проміжний продукт IVa, де R21 означає ОМе (приклад 7, сполука 7b) одержують згідно з методом, [описаним у Brown та ін., J. Med. Chem. 1989, 32, 807-826]. Стадія А: Проміжний продукт IVa піддають сполученню з гетероциклічними карбоновими кислотами IVb в основних умовах у присутності РОСl3 для активації карбоксилатної групи. Для одержання інгібіторів використовують різні карбонові кислоти, які мають загальну структуру IVb, які або є у продажу, або можуть бути синтезовані як показано на схемах V, VI і VII, або можуть бути синтезовані індивідуально за допомогою методів, описаних у конкретних прикладах. Стадія Б: Замикання кільця з наступною дегідратацією здійснюють в основних умовах, одержуючи хіноліни, що мають загальну структуру IVd. (i.а). Синтез "Неt"-карбонових кислот загальної формули IVb Синтез 2-(заміщений)аміно-4карбоксіамінотіазолових похідних (Vс) Застосовують модифікований процес, [описаний у Berdikhina та ін., Chem. Heterocycl. Compd. (у перекладі на англійську мову) 1991, 4, 427-433]. Схема V Згідно з загальною методологією синтезу, представленою на схемі V, з використанням тіосечовин (Va), які мають різні алкільні замісники (R25 означає алкільну групу), і 3-бромпіровиноградної кислоти одержують різні 2-алкіламінотіазоліл-4карбонові кислоти, що являють собою сполуки, із загальною структурою Vc. Цей тип реакції конденсації широко відомий у даній галузі. В альтернативному варіанті фрагмент Р2, що включає похідні 2-амінозаміщеного тіазола, синтезують з відповідного 2-карбоксильного похідного, як показано на схемі VI, за методом, [описаним в Unangst, P.C.; Connor, D.Т. / Heterocyc. Chem. 29, 5, 1992, 1097-1100]. Схема Vl Використовують процес, [описаний у Janusz та ін., J.Med. Chem. 1998, 41, 3515-3529] з наступними модифікаціями: етилтіооксамат (Vlla) вводять у взаємодію з різними (β-бромкетонами, що мають загальну структуру Vllb (R24 означає алкільну групу), одержуючи тіазолілкарбонові кислоти, що мають загальну структуру Vlld. Такий тип реакції конденсації широко відомий у даній галузі техніки. Синтез 2-карбокси(заміщений)імідазольних похідних (VIIIb) Згідно з загальною методологією синтезу, представленою на схемі VIII, одержують різні алкілімідазоліл-2-карбонові кислоти, що представляють собою сполуки, які мають загальну структуру VIIIb. Схема VIII Використовують процес, [описаний у Baird та ін., J. Amer. Chem. Soc: 1996, 118, 6141-6146]: алкілімідазол депротонуть за допомогою сильної основи (наприклад, н-BuLi) і потім вводять у взаємодію із СO2, одержуючи карбонову кислоту формули VllIb. Такий тип реакції конденсації широко відомий у даній галузі. б. Синтез 4-гідрокси-7-метокси-2-(імідазоліл або піразоліл)хінолінів 4-Гідрокси-7-R21-хіноліни, що мають у положенні С2 імідазолільний або хінолільний фрагмент, одержують у цілому згідно з методологією, представленою на схемі IX. Схема IX 33 74546 34 Синтез основного проміжного продукту, (де R21 Стадія В: Після відновлення α-азиду, каталізоозначає ОМе) 4-бензилокси-2-хлор-7ваного за допомогою SnCl3, здійснюють захист метоксихіноліну формули ІХа докладно описано у утвореного аміну у вигляді його третприкладі 6 (сполука 6е) бутилкарбамату, одержуючи проміжні продукти, Стадія А: При високих температурах для защо мають загальну структуру Хс. Такі реакції шиміщення 2-хлор-фрагмента в сполуці ІХа можуть роко відомі в даній галузі. використовуватися різні імідазоли, алкілзаміщені Стадія Г: На завершення хиральний допоміжімідазоли, піразоли або алкілзаміщені піразоли, у ний продукт гідролізують в основних умовах, нарезультаті чого одержують сполуки, які мають заприклад, у суміші Н2О2 з LiOH, одержуючи лінкери гальну структуру ІХb. амінокислотного типу, що мають загальну структуСтадія Б: Після видалення бензильної захисру Хе. ної групи з 4-гідрокси-фрагмента хіноліну за допоВ альтернативному варіанті фрагменти Р3, які могою стандартних методів гідрування одержують мають загальну структуру Хе, синтезують за метохінолінові похідні, що мають загальну структуру дом, [описаним у M.J Burk та ін., J. Am. Сhem. Soc ІXс. 1998, 120, 657-663], проілюстрованому на схемі XI. Синтез Р3 Ці сполуки розрізняються кількістю метиленових Для макроциклізації шляхом олефінового меланок (-СН2-) у лінкері (m=1-5) і заміщенням алкітатезису синтезують різні фрагменти Р3, які місльних груп у R4 , але вони не містять гетеро атотять відповідне D-лінкерне подовження. У цілому мів. фрагменти Р3 з умістом кінцевого олефіну синтеСхема Xl зують для метатезису згідно з наведеними нижче загальними схемами (Схеми X, XI і XII). Синтез лінкерів із класу А Даний загальний метод синтезу використовують з метою одержання лінкерів, що містять тільки атоми вуглецю (не мають гетероатомів) (Схема X). Схема X Синтез здійснюють за методом, [описаним у Evans та ін., J. Am. Сhem. Soc. 1990, 772, 40114030]. Вихідні карбонові кислоти (Ха) є в продажу або їх можна отримати згідно з описаними в літературі методами, відомими фахівцям у даній галузі. Стадія А: Карбонову кислоту Ха активують за допомогою півалоілхлориду і потім вводять у взаємодію з аніоном хирального допоміжного 4(S)-4(фенілметил)-2-оксазолідинону Еванса згідно із широко відомим методом (див. огляд: [D.J.Ager та ін., Aldrichimica Acta 1997, 30, 3-11] і наведені в ньому посилання), одержуючи сполуки, що мають загальну структуру Хb. Стадія Б: Стереоселективне α-азидування хирального іміденолата, такого, який можна отримати зі сполук, що мають загальну структуру Хb, у присутності основи, такої як KHMDS, за допомогою тризилазиду, також є широко відомим в даній галузі (див огляд: [D.J.Ager та ін., Aldrichmica Acta 1997, 30, 3-11] і наведені в ньому посилання). Стадія А: Похідне одноосновної кислоти формули ХІb одержують із наявного в продажу діетил2-ацетамідомалонату шляхом стандартного гідролізу складного ефіру в основних умовах. Стадія Б: Реакція конденсації типу Кневенагеля між альдегідом, який має загальну структуру ХІс і сполукою формули ХІb у присутності основи, такої як піридин, і оцтового ангідриду приводить до утворення енаміду формули Xld, що є проміжним продуктом, що характеризується Z-стереохімічною конфігурацією щодо знову утвореного подвійного зв'язку, як показано на схемі. Стадія В: Регіоселективне і енантіоселекіивне каталітичне гідрування проміжного продукту, що являє собою енамід формули Xld з одержанням проміжного продукту, що являє собою амінокислоту формули Хlе, здійснюють за методом Бурка. Стадія Г: Потім азот ацетамідового похідного формули Хlе двічі захищають шляхом приєднання замісника, що являє собою трет.-бутилкарбамат, перед ацетатною групою, а також у вигляді етилового ефіру, продукт гідролізують у стандартних основних умовах, одержуючи фрагменти РЗ, що мають загальну структуру Xlf. Синтез лінкерів із класу Б Загальна структура лінкерів із класу Б 35 74546 36 Brucker при частоті 400Мгц, хімічні зрушення (δ) виражено в част./млн і віднесено до внутрішнього дейтерієвого розчинника, якщо не зазначено іншого ЯМР-спектри всіх кінцевих сполук (інгібіторів) Цю загальну схему синтезу застосовують з реєстрували в розчині їхніх солей із трифтороцтометою одержання лінкерів, що містять кисень або вою кислотою (ТФК) у ДМСО-d6, якщо не зазначесірку. но іншого. Експрес-хроматографію на колонці проСхема Xll водили на силікагелі (SiO2) за методом Стила [W.С.Still та ін., J.Org. Chem., (1978), 43, 2923]. У прикладах використовуються такі скорочення Вn: бензил, Воc: трет.-бутилоксикарбоніл {Ме3СОС(О)}, БСА: бичачий сироватковий альбумін; КБЗ: бензилоксикарбоніл; ХАПС: 3-[(3холамідопропіл)диметиламоній]-1пропансульфонат, ДБУ: 1,8діазабіцикло[5.4.0]ундец-7-ен; СН2СІ2=ДХМ: метиленхлорид; ДЕАД: діетилазодикарбоксилат; ДIАД: діізопропілазодикарбоксилат; ДlЕА: діізопропілетиламін; ДІПЕА: діізопропілетиламін: ДМАП: димеСтадія А: Відповідним чином захищені амінотиламінопіридин; ДЦК: 1,3кислоти, такі як метиловий ефір Вос-(L)-серину, дициклогексилкарбодіімід; ДМЕ: 1,2метиловий ефір Вос-(L)-треоніну або метиловий диметилоксіетан: ДМФ: диметилформамід; ДМСО: ефір Boc-(L)-алотреоніну, алкілують за допомогою диметилсульфоксид; ДТТ: дитіотреітол або треоалкілйодиду в присутності Ag2O, одержуючи мети1,4-димеркапто-2,3-бутандюл; ДФФА: дифенілфоловий ефір формули Хllb. сфорилазид; ЕДТК: етилендіамінтетраоцтова кисСтадія Б: За допомогою гідролізу складного лота; Et: етил; EtOH: етанол; EtOAc: етилацетат; метилового ефіру в стандартних основних умовах Et2O: діетиловий ефір; ЕСМС: мас-спектрометрія з одержують лінкери у вигляді простого ефіру, що іонізацією електронним пучком; ГАТУ: [гексафтомають загальну структуру Хllс (X означає О). рфосфат O-7-азабензотриазол-1-іл)-1,1,3,3Стадія В: Аналог, що містить сірку, одержують тетраметилуронію]; РХВР: рідинна хроматографія з тієї ж самої вихідної амінокислоти формули Хllа високого дозволу; MC: мас-спектрометрія; MALDI(захищеної відповідним чином, як зазначено вище) TOF: часопролітна мас-спектрометрія з матричною і її гідроксильну групу перетворюють на групу, що лазерною десорбцією зразка; FAB: бомбардування легко видаляється (таку як проміжний продукт, що швидкими атомами; ЛАГ: алюмогідрид літію; Me: являє собою тозилат формули Xlld), використовуметил; МеОН: метанол; МЕС: (2-{Nючи стандартні методи, широко відомі в даній гаморфоліно}етансульфонова кислота); NaHMDS: лузі. біс(триметилсиліл)амід натрію; NMM: NСтадія Г: Після цього тозильний фрагмент заметилморфолін; ΝΜΜО: оксид N-метилморфолін; міщають аніоном тіоацетату, одержуючи шляхом ΝΜΠ: N-метилпіролідин, Рг: пропіл; Succ: 3інверсії хирального центра на β-атомі вуглецю карбоксипропаноіл; pNA: 4-нітрофеніламіно або проміжний продукт, що являє собою складний тіопара-нітроанілід; ТБАФ: фторид тетра-нефір Хllе. бутиламонію; ТБТУ: тетрафторборат 2-(1НСтадія Д: Шляхом гідролізу тіоефірного фрагбензотриазол-1-іл)-1,1,3,3-тетраметилуронію; мента в слабких основних умовах одержують вільТКЕФ: гідрохлорид трис(2-карбоксіетил)фосфіну, ний тіол формули Xllf. ТФК: трифтороцтова кислота; ТГФ: тетрапдрофуСтадія Ε: Алкілування тіольного фрагмента ран; ТИС: триізопропілсилан; ТШХ: тонкошарова легко може бути здійснене в основних умовах за хроматографія; ТМСЕ: триметилсилілетил; допомогою алілйодиду. Трис/НСІ гідрохлорид трис(гідроксиметил)аміном Стадія Ж: На завершення шляхом гідролізу етану. складного метилового ефіру за допомогою станФрагменти P1 дартних методів одержують сульфідний аналог Приклад 1 формули ХІІс (X означає S). Синтез трет-бутил-(1R,2R)/(1S,2S)-1-аміно-2Синтез фрагмента R3: гомоалілциклопропілкарбоксилату (1f): Приклади синтезу фрагментів, де R3 означає NH-R31, [описано в WO 00/09543]. Приклади Нижче винахід проілюстровано на прикладах, які не обмежують його обсягу Інші конкретні методи синтезу або розділення описано, [наприклад, у WO 00/09543 і WO 00/09558]. Температури подано в градусах за Цельсієм. Відсотки для розчинів являють собою %мас./об., а співвідношення в розчинах являють собою співвідношення об'ємів, якщо не зазначено іншого. Спектри ядерного магнітного резонансу (ЯМР) реєстрували за допомогою спектрометра фірми 37 74546 38 А. До суспензії хлориду бензилтріетиламоній Г. До розчину циклопропільного похідного 1е (5,08г, 22,3ммоля) у 50%-вому водному розчині (1,19г, 3,35ммоля, у 30мл ТГФ), додавали трет.NaOH (50мл), послідовно додавали 1,2-дибром-5BU4NF (6,7мл у вигляді 1М розчину в ТГФ, гексен (1b, 8,10г, 33,46ммоля) і ди-трет6,7ммоля) і суміш спочатку перемішували при КТ бутилмалонат (1а, 4,82г, 22,30ммоля). Суміш інтепротягом 16год., а потім нагрівали до температури нсивно перемішували при КТ протягом 16год., подефлегмації протягом 15хв. Розчинник обережно тім розбавляли Н2О і екстрагували СН2СІ2 випарювали при зниженому тиску (внаслідок високої летючості вільного аміну If необхідно прийняти (3 50мл) Потім органічний шар промивали Н2О запобіжних заходів при випарюванні розчинника) (2 50мл), соляним розчином/H2O (2/1,2 50мл), Неочищенин залишок знову розчиняли в EtOAc сушили надмгSО4 і упарювали. Неочищений за(100мл) і промивали Н2О (2 50мл), соляним розлишок очищували за допомогою експресчином (50мл), сушили надмгSО4 і потім знову обехроматографії на колонках на силікагелі, викорисрежно випарювали розчинник Неочищений протовуючи у функції елюенту градієнт від 3 до 5% дукт 1f (що являє собою суміш двох енантюмерів ЕtOAс у гексані, одержуючи сполуку 1с з виходом 1f' і 1f") використовували для сполучення з похід38% (2,48г). 1 ним проліну Р2 без додаткового очищування. На H ЯМР (CDCl3, 400МГц): δ 1,19 (bd, J=7,9Гц, цій стадії за допомогою експрес хроматографії 2H), 1,25-1,33 (m, 1Н), 1,46 (s, 9H), 1,48 (s, 9H), легко можна було виділити фрагмент Р1Р2, який 1,47-1,60 (m, 1H), 1,75-1,82 (m, 1H), 2,14-2,22 (m, має потрібну стереохімічну будову Р1 (приклад 21, 2H), 4,93-5,50 (m, 2H), 4,96 (dm, J=10,2Гц, 1H), 5,18 фрагмент 21b). (dm, J=17,2Гц, 1H). Фрагменти Р2 ES(+) MC m/z 297 (M+H)+. Приклад 2 Б. До суспензії трет-бутоксида калію (5,75г, Синтез Вос-4(R)-[(7-метокси-451,25ммоля) у безводному діетиловому ефірі хінолініл)окси]проліну (2с): (150мл) при 0°, додавали Н2О(203мкл, 11,27ммоля) і реакційну суміш перемішували при 0° протягом 10хв. Додавали розчин сполуки 1с у діетиловому ефірі (2,48г у 10мл діетилового ефіру, 10,25ммоля) і суміш перемішували при КТ протягом 5год. Суміш розбавляли охолодженою на льоді Н2О і екстрагували діетиловим ефіром (3 200мл) Водний шар підкислювали до pH 3,5-4 за допомогою охолодженого на льоді 10%-вого 4-гідрокси-7-метоксихінолін (2b) одержували водного розчину лимонної кислоти і повторно ексметодом, [описаним у Μ.W.Chun, K.K.Olmstead, Υ.S.Choi, С.О.Lee, С –K.Lee, J.Η.Kirn, Lee, J.Bioorg. трагували за допомогою EtOAc (3 200мл) EtOAcMed.Chem. Lett., 1997, 7, 789]. Розчин сполуки 2b шар промивали Н2О (2 100мл), соляним розчином (1,88г, 10,73ммоля) і ДЕАД (3,4мл, 21,46ммоля) у (100мл), сушили надмгSО4 і упарювали, одержуюбезводному ТГФ додавали при перемішуванні до чи сполуку Id з виходом 85% у перерахуванні на розчину захищеного цис-гідроксипроліну 2а (2,63г, кількість відновленого вихідного продукту. 1 10,73ммоля) і трифенілфосфіну (5,63г, H ЯМР (CDCl3, 400МГц): δ 1,51 (s, 9Н), 1,6421,46ммоля) у безводному ТГФ (160мл) при 0° в 1,68 (m, 1Н), 1,68-1,75 (m, 1H), 1,77-1,88 (m, 1H), атмосфері N2. Реакційній суміші давали нагрітися 1,96-2,01 (m, 1H), 2,03-2,22 (m, 3H), δ ,01 (dm, до КТ і перемішували її протягом 14год. Потім ТГФ J=6,4Гц, 1Н), δ ,03 (dm, J=14,9Гц, 1H), δ,72-δ,83(m, випарювали і виділяли чистий продукт 2с за допо1Η). могою експрес-хроматографії на колонці, викорисEC(+)MS m/z 241 (M+H)+. товуючи у функції елюента 5%-вий МеОН у EtOAc В. До розчину кислоти Id у безводному бензолі , вихід 35% (1,5г). (1,14г у 25мл бензолу, 4,74ммоля), додавали Et3N 1 H ЯМР (CDCl3, 400МГц): δ 1,44 (s, 9H), 1,65 (800мкл, 6,68ммоля), а потім додавали дифеніл(bs, 1H), 2,34-2,43 (m, 1H), 2,63-2,76 (m, 1H), 3,78 фосфорилазид (1,13мл, 6,21ммоля) і суміш нагрі(s, 3H), 3,75-3,85 і 3,89-3,99 (2m, 1H, 2 ротамера), вали до температури дефлегмації протягом 3,95 (s, 3H), 4,51 і 4,60 (2t, J=8Гц, 1H, 2 ротамера), 3,6год. Потім додавали триметилсилілетанол 5,15 (bs, 1H), 6,53-6,59 (m, 1H), 7,12-7,18 (dd, J=8,9 (1,36мл, 9,48ммоля) і продовжували перемішуванi 2,2Гц, 1Н), 7,36 (d, J=2,6Гц, 1Н), 8,03 (bd, J=9,2Гц, ня при температурі дефлегмації ще протягом 4год. 1Н), 8,65 (bd, J=5,1Гц, 1Н). Потім суміш охолоджували до КТ, упарювали до Приклад 3 половини її початкового об'єму, розбавляли діетиСинтез 2-етокси-4-гідрокси-7-метоксихіноліну ловим ефіром (30мл) і промивали 6%-вим водним (3с) розчином NaHCO3 (2 30мл), соляним розчином (50мл), сушили надмгSO4 і упарювали. Залишок у вигляді олії хроматографували на силікагелі, використовуючи у функції елюенту 10%-вий EtOAc у гексані, в результаті чого одержували чисту сполуку 1е з виходом 88% (1,49г) Синтез метил-пара-метоксіантранілату 3а 1 H ЯМР (CDCl3, 400МГц): δ 0,03 (s, 9H), 0,91здійснювали за методом, [описаним у Katz та ін., 0,99 (m, 2H), 1,18-1,29 (m, 2H), 1,45 (bs, 11Н), 1,56J.Org. Сhem., 1953, 18, 1380-1400]. 1,72 (m, 2H), 2,02-2,18 (m, 2H), 4,12 (t, J=8,3Гц, 2Н), Загальна процедура синтезу похідного хінолі4,93 (dm, J=10,2Гц, 1H), 4,98 (dm, J=17,2Гц, 1H), ну 3с являє собою модифікацію методу, [описано5,07 (bs, 1H), 5,71-5,83 (m, 1H). 39 74546 40 го у ВАЦККг та ін., Indian Journal of Chemistry, (1,37г). Його очищували за допомогою експрес1995, Sat. B, 330-332]. хроматографіі на колонці, одержуючи продукт 4b А. Метил-пара-метоксіантранілат 3а (3,069г, (1,04г, вихід 75%) у вигляді безбарвної олії. 16,96ммоля) розчиняли в триетилортоацетаті Б. До суміші, яка містить тільки що активовані (4,7мл, 25,4ммоля), потім додавали розчин безвомолекулярні сита з розміром 4Å (500мг) і ацетамідної НСl (4н розчин у діоксані, 50мкл, 0,6ммоля). доксим (248мг, 3,35ммоля) додавали ТГФ (3мл). Суміш, що утворилася, витримували при темпераУтворену суміш перемішували протягом 15хв. в турі дефлегмації протягом 19год. Потім леткі коматмосфері азоту при температурі навколишнього поненти випарювали у вакуумі, одержуючи просередовища, після чого порціями додавали NaH дукт 3b (4,92г, олія бурштинового кольору, (60%-вий у мінеральній олії, 124мг, 3,24ммоля). кількісний вихід), який використовували на наступСуспензію, що утворилася, перемішували при теній стадії без подальшого оброблення. мпературі навколишнього середовища протягом Б. До розчину субстрату 3b (за теоретичною 1год., після чого додавали складний ефір 4b оцінкою 16,96ммоля) у ТГФ (34мл) при -78°С в (500мг, 1,56ммоля) у вигляді розчину в ТГФ (5мл) атмосфері азоту додавали LiHMDS (1M розчин у Утворену суміш витримували при температурі деТГФ, 22мл, 1,3екв.). Невдовзі після додавання флегмації протягом 1год., потім фільтрували через охолоджувальну баню видаляли і суміш переміцеліт, промивали EtOAc (3 порції по 20мл) і концешували при температурі навколишнього середонтрували у вакуумі. Неочищену суміш, що утворивища протягом 1год., після чого додавали ще одну лася, очищували за допомогою експреспорцію LiHMDS (16мл). Утворену суміш перемішухроматографії (100%-вий EtOAc), одержуючи провали до повного зникнення вихідного продукту дукт 4с (352мг, вихід 65%) у вигляді твердої речо(1год.) за даними ТШХ (100% EtOAc, час утриманвини білого кольору. ня імідату Rf=0,7, час утримання продукту Rf=0,2). В. До простого Мем-ефіру 4с (170мг, Після цього додавали НСl (4н розчин у діоксані, 0,493ммоля) у ТГФ (4мл) додавали водний розчин 10мл) і суміш концентрували у вакуумі. Утворений НСl (1н., 1мл). Утворену суміш перемішували при пастоподібний продукт розтирали із сумішшю температурі навколишнього середовища протягом EtOAc (10мл) і водного розчину NaH2PO4 (1M, 1год., потім розбавляли водним розчином 10мл) і опромінювали ультразвуком. У результаті NaH2PO4 (1M, 50мл). Твердий продукт, що утвориутворювався рясний осад, zrbq збирали фільтрався, фільтрували, розтирали з EtOAc, фільтрували цією, промивали водою і сушили, одержуючи поті сушили, одержуючи потрібний продукт (4d) (90мг. рібний продукт 3с у вигляді твердої речовини бевихід 71%) у вигляді твердої речовини білого кожевого кольору (3,117г, вихід 84% для двох стадій, льору MC (ES+) 258 (М+1), (ES-) 256 (М-1). 1 чистота >99% за даними аналізу за допомогою H ЯМР (400МГц, ДМСО-d): δ (част./млн) 8,03 РХВР). (d, J=9,2Гц, 1Н), 7,38 (d, J=2,2Гц, 1H), 7,06 (d, 1 H ЯМР (400МГц, ДМСО-d): δ (част./млн) 7,88 J=8,6Гц, 1H), 6,85 (br s, 1H), 3,88 (s, 3H), 2,64 (s, (d, J=8,9Гц, 1Н), 6,98 (br s, 1H), 6,89 (br d, J=8,6Гц, 3H). 1Η), 5,94 (br s, 1H), 4,30 (br s, 2H), 3,84 (s, 3H), 1,34 Приклад 5 (t, J=7,0Гц, 3Н). Синтез 4-гідрокси-7-метокси-2(5-метил-1,3,4Приклад 4 оксадіазол-2-іл)хіноліну (5е). Синтез 4-гідрокси-7-метокси-2-(3-метил-1,2,4оксадіазол-5-іл)хіноліну (4d). А. До розчину 2-карбометокси-4-гідрокси-7метоксихіноліну 4а [його одержання описано в WO 00/09543 і WO 00/09558] (1г, 4,29ммоля) у ДМФ (10мл) в атмосфері азоту додавали NaH (60%-вий у мінеральній олії, 190мг, 4,98ммоля). Утворену суміш перемішували при температурі навколишнього середовища протягом 1год., потім краплями додавали хлорид MEM (455мкл, 4,98ммоля) і суміш, яка утворилася, перемішували при температурі навколишнього середовища ще протягом 19,5год. Реакційну суміш розбавляли EtOAc (100мл), промивали Н2О (50мл), соляним розчином (50мл), сушили над MgSO4, концентрували у вакуумі, одержуючи неочищений продукт реакції А До субстрату 4b (465мг, 1,45ммоля) в етанолі (5мл) додавали безводний гідразин (57мкл, 1,8ммоля). Розчин, що утворився, витримували при температурі дефлегмації протягом 4год., потім концентрували у вакуумі, одержуючи продукт 5а (704мг, кількісний вихід неочищеного продукту) у вигляді твердої речовини жовтого кольору, який використовували без очищення на наступній стадії. Б. Сполуку 5а (за теоретичною оцінкою 1,45ммоля) у триетилортоацетаті (5мл) витримували при 100-110°С в атмосфері азоту. Потім утворену суміш розбавляли EtOAc (100мл), промивали водним насиченим розчином NaHCО3 (50мл), соляним розчином (50мл), сушили над 41 74546 42 MgSО4, концентрували у вакуумі й очищували за вали при температурі навколишнього середовища допомогою експрес-хроматографії на колонці протягом 1год., потім додавали бензилбромід (100%-вий EtOAc). Сполуку 5b (359мг, вихід 61% (7,6мл, 63,6ммоля) і реакційну суміш перемішувадля двох стадій) одержували у вигляді олії жовтого ли протягом 16год. Після цього розчин розбавляли кольору MC (ES+) 392 (m+1), (ES-) 390 (m-1). сумішшю EtOAc (220мл) - гексан (220мл) і фільтВ. Сполуку 5b (333мг, 0,852ммоля) витримуварували утворений твердий продукт, розтирали з ли при 140°С в глибокому вакуумі протягом 8,5год. водним насиченим розчином NaHCO3 (110мл), і очищували за допомогою експрес-хроматографії промивали водою, сумішшю гексан-ЕtOАс (співна колонці (100%-вий EtOAc), одержуючи суміш відношення 1:1, 100мл) і сушили в глибокому вакусполуки 5b (116мг, вихід 35%, Rf=0,5) і сполуки 5с умі У результаті одержували продукт 6с (5,6г, чис(138мг, скоректований вихід 72%, Rf=0,3). До розтота 91%, вихід 35%) у вигляді твердої речовини чину сполуки 5с (138мг, 0,4ммоля) у ТГФ (4мл) жовтого кольору. додавали водний розчин НСl (1н., 1мл) і утворену До сполуки 6с (2,67г, 9,52ммоля) в оцтовій кисуміш перемішували до завершення реакції (30хв.) слоті (21мл) додавали ізо-амілнітрит (3,8мл, ТГФ випарювали у вакуумі і додавали водний роз28,6ммоля), утворену суміш перемішували при чин NaН2РО4 (1М, 2мл). Суспензію, що утворилатемпературі навколишнього середовища і спостеся, опромінювали ультразвуком, фільтрували і рігали за допомогою РХВР. Через 2год. додавали твердий продукт сушили в глибокому вакуумі, одеще одну порцію ізо-амілнітриту (1,3мл, 9,52ммоля) ржуючи потрібний продукт 5d, (75мг, вихід 73%) у і суміш залишали перемішуватися протягом 90год. вигляді твердої речовини бежевого кольору MC (за даними РХВР вміст продукту 81%, субстрату (ES+) 258 (m+1), (ES-) 256 (m-1). 1H ЯМР (400МГц, 3%). До суспензії, що утворилася, додавали воду ДМСО-d): δ 8,03 (d, J=9,2Гц, 1Н), 7,39 (d, J=2,2Гц, (100мл) і потім фільтрували. Зібрану тверду речо1H), 7,06 (br d, J=8,6Гц, 1H), 6,85 (br.s, 1H), 3,88 (s, вину сушили в глибокому вакуумі, одержуючи про3H), 2,64 (s, 3H). дукт 6d (2,35г, чистота 92%, вихід 72%). Приклад 6 Г. До сполуки 6d (1,5г, 4,39ммоля) додавали Синтез 4-бензилокси-2-(хлор)-7оксихлорид фосфору (13мл, 141ммоля) і утворену метоксихіноліну (6е). суміш витримували при температурі дефлегмації протягом 1год., після чого розбавляли EtOAc (150мл) і реакцію припиняли шляхом повільного додавання при 0°С водного розчину NaOH (1н., 150мл), доводячи значення pH до 9. Розділяли два шари й органічний шар сушили над MgSO4 і концентрували у вакуумі, одержуючи тверду речовину коричневого кольору, яку очищували за допомогою експрес-хроматографії на колонці (15%-вий EtOAc/гексан). Одержували продукт 6е (819мг, чистота >99%, вихід 62%) у вигляді твердої речоА. Наявний у продажу мета-внізидин (25г, 0,20 вини жовтого кольору. 1 моля) у діоксані (80мл) охолоджували до 0°С і доH ЯМР (400МГц, CDCl3): δ 8,07 (d, J=9,2Гц, давали безводну НСl (4н. розчин у діоксані, 75мл, 1Η), 7,50-7,40 (m, 5H), 7,29 (d, J=2,5Гц 1H), 7,12 0,30моля) Потім додавали Et2O (500мл) і продов(dd, J=9,2, 2,5Гц, 1H), 6,73 (s, 1H), 5,26 (s, 2H), 3,92 жували перемішування протягом 1год. Після цього (s, 3H). фільтрацією одержували твердий продукт бежевоПриклад 7 го кольору і сушили у вакуумі, одержуючи сіль 6а Синтез 4-гідрокси-2-(1-імідазоліл)-7(31,88г, вихід 98%). метоксихіноліну (7b), 4-гідрокси-2-(4-метил-1Б. До цієї солі додавали етилціаноацетат імідазоліл)-7-ічетоксихіноліну (7d); 4-гідрокси-7(21,3мл, 0,20 моля) і суміш, помістивши її в колбу, метокси-2-(1-піразоліл)хіноліну (1f); і 4-гідрокси-2забезпечену дистиляційною насадкою і колбою (3-метил-1-піразоліл)-7-метоксихіноліну (7h). для збору продукту, нагрівали до 280-300°С. Для спостереження за ходом реакції проводили збір етанолу. Після того, як накопичувалося 9мл етанолу (теоретично розрахована кількість становить 11,7мл), нагрівання припиняли, реакційну суміш охолоджували до КТ, розбавляли сумішшю вода (200мл) - EtOAc (200мл), потім перемішували і додавали водний розчин NaH2PO4 (300мл). Після перемішування ще протягом 1год., фільтрації і сушіння одержували продукт 6b (19,06г, чистота 84,5%, вихід - 50%) у вигляді твердої речовини жовтого кольору, який використовували при проведенні наступної реакції без додаткового очищування. В. Сполуку 6b (11,0г, 57,8ммоля) у ДМФ (100мл) при 0°С додавали до NaH (60%-вий розчин у мінеральній олії, 2,78г, 115,6ммоля). Після цього крижану баню видаляли і суміш перемішу 43 74546 44 А. Сполуку 6е (423мг, 1,41ммоля) та імідазол рдої речовини жовтого кольору MC (ES+) 242 (400мг, 5,88ммоля) витримували при 110°С протя(m+1), (ES-) 240 (m-1). 1 гом 20год. Потім суміш розбавляли EtOAc і промиH ЯМР (400МГц, ДМСО-d): δ 8,72 (d, J=2,5Гц, вали водою і соляним розчином, сушили над 1Η), 8,31 (s, 1Η), 8,00 (d, J=8,9Гц, 1Η), 7,83 (br.s, MgSO4, концентрували при зниженому тиску, оде1Η), 7,43 (br.s, 1Η), 7,24 (br.s, 1H), 7,10 (d, J=8,6Гц, ржуючи сполуку 7а (422мг, чистота 96% , вихід 1Η), 6,59 (br.s, 1H), 3,90 (s, 3H). 90%) у вигляді твердої речовини жовтого кольору. Γ. Сполуку 6е (217мг, 0,724ммоля) і 4Сполуку 7а (319мг, 0,963ммоля) у присутності Pd метилпіразол (594мг, 7,24ммоля) витримували при (5%/С, 64мг) у суміші етанолу (5мл) і ТГФ (5мл) 110°С протягом 23год. Потім суміш, яка являє сопродували воднем і залишали в атмосфері водню бою суміш 1:1 дебензилованої сполуки 7h і бензипри тиску 1ат. Після перемішування протягом лованого продукту 7g, розбавляли EtOAc (2-3мл) і 7,5год. при температурі навколишнього середофільтрували, одержуючи чистий дебензилований вища реакційну суміш фільтрували, промивали продукт 7h (111мг, чистота 95%, вихід 54%) у висумішшю хлороформ-метанол і концентрували, гляді твердої речовини білого кольору. 1 одержуючи продукт 7b (130мг, чистота 97,7%, виH ЯМР (400МГц, ДМСО-d): δ 8,58 (d, J=2,6Гц, хід 56%) у вигляді твердої речовини жовтого ко1Η), 7,98 (d, J=9,2Гц, 1Η), 7,25 (br.s, 1H), 7,20 (s, льору MC (ES+) 242 (m+1), (ES-) 240 (m-1). 1H), 7,04 (br.d, J=9,2Гц, 1H), 6,38 (s, 1H), 3,89 (s, 1 H ЯМР (400МГц, ДМСО-d): δ 8,51 (s, 1H), 8,03 3H), 2,30 (s, 3H). (d, J=8,9Гц, 1H), 7,93 (s, 1H), 7,23 (d. J=1,9Гц, 1Η), Приклад 8 7,15 (s, 1Η), 7,12 (dd, J=9,2, 2,2Гц, 1Η), 6,92 (br s, Синтез 4-гідрокси-7-метокси-2[4-(21H), 3,91 (s, 3H). ізопропіламінотіазоліл)]хіноліну (8f). Б. Сполука 6e (251мг. 0,837ммоля) і 4Примітка [3 використанням однієї й тієї ж схеметилімідазол (344мг, 4,19ммоля) витримували ми синтезу шляхом заміни сполуки 8b на інші алкіпри 110°С протягом 20год. Потім суміш розбавлялтіосечовини одержували різні 2ли EtOAc, промивали водою і соляним розчином, алкіламінотіазолільні замісники]. сушили над MgSO4, і концентрували при зниженому тиску, одержуючи неочищений продукт, що містить суміш 10:1 ізомерів 4-метил- і 5метилімідазолілу відповідно. Основний потрібний ізомер 11с, що являє собою тверду речовину білого кольору (166мг, чистота 99%, вихід 57%), відокремлювали від другої більш полярної фракції (76мг, вихід 23%) яка містить суміш ізомерів 4- і 5метилімідазолілу, за допомогою експресхроматографії на колонці (100%-вий EtOAc) Сполуку 7с (163мг, 0,472ммоля) у присутності Pd (5%/С, 33мг) у суміші етанолу (2,4мл) і ТГФ (5мл) продували воднем і залишали в атмосфері водню при тиску 1ат. Після перемішування протягом 18год. при температурі навколишнього середовища реакційну суміш фільтрували, промивали сумішшю хлороформ-метанол і концентрували, одержуючи сполуку 7d (118мг, чистота 99%, вихід 98%) у вигляді твердої речовини білого кольору. 1 Н ЯМР (400МГц, ДМСО-d): δ 8,42 (br s, 1Н), 8,01 (d, J=9,2Гц, 1Н), 7,64 (br s, 1H), 7,21 (br.s, 1H), 7,10 (d, J=8,9Гц, 1H), 6,89 (br.s, 1 H), 3,90 (s, 3H), 2,20 (s, 3H). В. Сполуку 6e (184мг, 0,614ммоля) і піразол (209мг, 3,07ммоля) витримували при 110°С протяА. Для перетворення мета-анізидину на спогом 17год. Потім суміш розбавляли EtOAc і промилук) 8а використовували протокол, ідентичний вали водним розчином NaOH (1н.) і соляним роз[описаному в літературі F.J.Brown та ін., J.Med. чином, сушили над MgSО4, концентрували при Chem. 1989, 32, 807-826]. Однак процедуру очизниженому тиску, одержуючи неочищений продукт щення було модифіковано для гого, щоб уникнути який очищували за допомогою експресочищення за допомогою хроматографії EtOAcхроматографії на колонці (суміш 2:1 гексан-ЕtOАс), фазу, яка містить потрібний продукт, обробляли одержуючи сполуку 7е (103мг, вихід 50%) у вигляді сумішшю, що містить MgSO4, вугілля і 5мас.% (у твердої речовини світло-жовтого кольору. Сполуку перерахуванні на теоретично розраховану масу) 7е (103мг, 0,311ммоля) у присутності Pd (5%/С, силікагелю. Після фільтрації через целіт продукт 20мг) у суміші етанолу (2мл) і ТГФ (2мл) продуварозтирали з простим ефіром. Сполуку 8а одержули воднем і залишали в атмосфері водню при тисвали у вигляді твердої речовини світлоку 1ат. Після перемішування протягом 5,5год. при коричневого кольору з чистотою >99% (за даними температурі навколишнього середовища реакційну аналізу за допомогою РХВР). суміш фільтрували, промивали сумішшю хлороБ. Суспензію ізопропілтюсечовини (8b, 3,55г, форм-метанол і концентрували, одержуючи сполу30ммолей) і 3-бромпіровиноградноі кислоти (8с, 5г, ку 7f (77мг, чистота 99%, вихід 99%) у вигляді тве 45 74546 46 1екв.) у діоксані (300мл, 0,1М) нагрівали до 80°С. Після того, як температура досягала 80°С, розчин ставав прозорим, і незабаром після цього відбувалося осадження продукту у вигляді твердої речовини білого кольору Після нагрівання протягом 2год. розчин охолоджували до КТ і фільтрували осад білого кольору, одержуючи сполуку 8d з високою чистотою (чистота >98% за даними ЯМРаналізу) і з виходом 94% (7,51г). В. Суміш, яка містить карбонову кислоти 8d (4,85г, 18,2ммоля) і похідне аніліну 8а (3г, 1екв.) у піридині (150мл, 0,12М) охолоджували до -30°С А. До розчину 3-метилбутан-2-ону (8г, (після охолодження прозорий розчин перетворю93ммоля) в МеОН (100мл) при -30°С, додавали вався практично на суспензію). Потім повільно краплями протягом 45хв. Вr2 (4,79мл, 93ммоля, протягом періоду часу, що становить 5хв., дода1екв.). Потім утворену суміш перемішували при КТ вали оксихлорид фосфору (3,56мл, 2,1екв.). Реакпротягом 90хв. Додавали пентан і розчин промиційну суміш перемішували при -30°С протягом вали 5%-вим водним розчином NaHCO3, органіч1год., баню видаляли і реакційній суміші давали ний шар сушили над безводним Na2SO4, фільтрунагрітися до КТ. Через 1,5год. реакційну суміш вали і концентрували у вакуумі. Отриману сполуку зливали на лід, значення pH доводили до 11 за 9b, що являє собою неочищену олію жовтого кодопомогою 3н водного розчину NaOH, екстрагувальору, використовували без додаткового очищули за допомогою СН2Сl2, сушили над безводним вання. Розчин, що містить етилтіооксамат (9а, MgSO4, фільтрували і концентрували у вакуумі. 1,8г, 13,5ммоля) і похідне бромкетону 9b Потім тверду речовину бежевого кольору очищу(13,5ммоля) перемішували при 70°С протягом вали за допомогою експрес-хроматографії (45%15год. Після цього суміш концентрували у вакуумі і вий EtOAc у гексані), одержуючи сполуку 8е у випотім очищували за допомогою експресгляді твердої речовини світло-жовтого кольору з хроматографії на колонці, використовуючи у функвиходом 73% (6,07г). ції елюенту 15%-вий EtOAc у гексані, одержуючи Г. Розчин трет.-BuOK (2,42г, 21,6ммоля) у безсполуку 9с (740мг, вихід 28%). водному трет.-BuOH (40мл, 0,14М, очищений дисБ. Розчин сполуки 9с (700мг, 3,5ммоля) у сутиляцією від металевого Mg) нагрівали до темпеміші ТГФ/МеОН/H2О (співвідношення 3:1:1,13мл) ратури дефлегмації. Протягом 5хв. додавали обробляли при КТ протягом 5h LiOHH2O (148мг, порціями сполуку 8е (1,8g, 5,4ммоля) і утворений 3,5ммоля, 1екв.). Потім значення pH доводили до розчин темно-червоного кольору перемішували 6 за допомогою 0,1н. розчину НСl і суміш концентпри температурі дефлегмації ще протягом 20хв. рували досуха у вакуумі, одержуючи кислоту 13d, (завершення реакції оцінювали за допомогою яку безпосередньо використовували на наступній РХВР). Суміш охолоджували до КТ і додавали НСl стадії без додаткового очищування. (4н. у діоксані, 1,5екв.). Потім суміш концентрували В. Розчин, що містить 4-метокси-2у вакуумі для того, щоб гарантувати, що вилучено аміноацетофенон (проміжна сполука 8а, 570мг, всю кількість НСl і діоксану, продукт двічі повторно 3,45ммоля) і похідне карбонової кислоти 9d розчиняли в СН2СІ2 і сушили у вакуумі, одержуючи (590мг, 3,45ммоля, 1екв.) у піридині (30мл) охолов результаті гідрохлорид сполуки 8f у вигляді тведжували до -20°С. Потім краплями протягом 5хв. рдої речовини бежевого кольору (1,62г, чистота додавали РОСl3 (0,35мл, 3,79ммоля, 1,1екв.). Роз93% за даними РХВР). Потім продукт зливали у чин, що утворився, перемішували при -10°С протяфосфатний буфер (1н. розчин NaH2PO4, pH=~4,5) і гом 2год. Реакцію припиняли шляхом додавання опромінювали ультразвуком. Твердий продукт Н2О і суміш концентрували у вакуумі. Залишок бежевого кольору фільтрували і сушили у вакуумі, зливали на насичений водний розчин NaHCO3 і одержуючи сполуку 8f (1,38г, вихід 81%) у вигляді екстрагували EtOAc. Органічний шар сушили над твердої речовини бежевого кольору (чистота 91% безводним MgSO4, фільтрували і концентрували у за даними РХВР). вакуумі. Неочищений продукт очищували за допо1 H ЯМР (400МГц, ДМСО): δ 8,27 (s, 1Н), 8,12 могою експрес-хроматографії на колонці, викорис(d, 1H, J=9,2Гц), 7,97 (br.s, 1H), 7,94 (s, 1H), 7,43 (s, товуючи у функції елюенту 25%-вий EtOAc у гек1H), 7,24 (dd, 1H, J=9,2, 2,2Гц), 3,97 (m, 1H), 3,94 сані, у результаті чого одержували сполуку 9е у (s, 3H), 1,24 (d, 2H, J=6,4Гц). вигляді твердої речовини білого кольору (740мг, Приклад 9 вихід 67%). Синтез 4-гідрокси-7-метокси-2-[2-(4Г. Трет.-BuOK (518мг, 2,1екв.) додавали до суізопропілтіазоліл)]хіноліну (9f). спензії сполуки 9е (700мг, 2,2ммоля) у безводному Примітка: 3 використанням однієї й тієї ж схетрет.-BuOH (11мл). Утворену суміш нагрівали ми синтезу, у якій сполуку 9b заміщали іншими αдо75°С протягом 7,5год., потім розчин охолоджубромкетонами, одержували різні 2-(4вали до КТ і підкислювали шляхом додавання НСl алкіл)тіазолільні замісники. (4н. розчин НСl у діоксані, 2,5мл). Суміш концентрували у вакуумі й отриманий залишок зливали на 1н. розчин NaH2PO4 і фільтрували. Потім твердий продукт розтирали з невеликою кількістю EtOAc, фільтрували і сушили у вакуумі, одержуючи сполу 47 74546 48 ку 9f у вигляді твердої речовини світло-бежевого (400МГц, ДМСО-d): δ 7,99 (d, J=8,9Гц, 1H), 7,49 (s, кольору (270мг, вихід 41%). 1H), 7,37 (s, 1H), 7,18 (s, 1H), 6,92 (d, J=8,9Гц, 1H), 1 H ЯМР (400МГц, ДМСО-d6): δ 8,00 (br.s, 1H), 6,31 (s, 1H), 3,87 (s,3H), 3,84 (s,3H). 7,60 (br.s, 1H), 7,51 (br.s, 1H), 7,43 (br.s, 1H), 7,29 Приклад 11 (br.s, 1H), 7,14(br.s 1H), 6,95 (br.a, 1H), 3,90 (s, 3H), Синтез 4-гідрокси-2-(1-піроліл)-73,15 (m, 1H), 1,33 (d, J=5,4Fu, 6H) метоксихіноліну (11b). Приклад 10 Синтез 4-гідрокси-2-(1-метил-2-імідазоліл)-7метоксихіноліну (10d). А. Розчин N-метилімідазолу 10a (5г, 61ммоль) у 100мл ТГФ охолоджували до -78°С. Краплями протягом 15хв. додавали H-BuLi (24,4мл 2,5М розчину в Et2O, 1екв.). Утворену суміш перемішували протягом 90хв. при -78°С, після чого порціями зливали на надлишок твердого СO2. Гетерогенну суміш перемішували протягом 2год. і потім давали їй нагрітися до КТ. Додавали 1н. розчин НСl до досягнення значення pH5, відокремлювали водний шар і ліофілізували Отриманий у такий спосіб залишок екстрагували EtOAc (для видалення солей), сушили (Na2SO4), фільтрували і концентрували при зниженому тиску. В результаті одержували 6,2г (вихід 80%) твердого продукту 10b білого кольору. Б. Розчин, що містить 4-метокси-2аміноацетофенон 8а (394мг, 2,39ммоля) і похідне карбонової кислоти 10b (301мг, 1екв.) у піридині (10мл), охолоджували до -20°С. Потім краплями протягом 5хв. додавали РОСl3 (244мкл, 1,1екв.) Розчин, що утворився, перемішували при -10°С протягом 2,5год. Потім додавали воду і суміш концентрували при зниженому тиску. Залишок зливали на насичений розчин NaHCO3 і екстрагували EtOAc. Органічну фазу сушили (MgSO4), фільтрували і концентрували при зниженому тиску. Продукт очищували за допомогою хроматографії на силікагелі (25%-вий ЕtOАс/Нех), одержуючи 530мг (вихід 81%) у вигляді твердої речовини 10с світложовтого кольору. В. До суспензії субстрату 10с (500мг, 1,8ммоля) у 8мл трет.-BuOH додавали трет.-BuOK (431мг, 2,1екв.). Потім утворену суміш нагрівали до 75°С протягом 7год. Розчину давали охолонути протягом ночі до кімнатної температури і додавали 2,5мл НСl (4н. розчин у діоксані). Суміш концентрували при зниженому тиску й отриманий залишок розбавляли EtOAc. Додавали 1н. розчин NaOH до досягнення значення pH7 Відокремлювали органічну фазу і сушили (MgSO4), фільтрували і концентрували при зниженому тиску, одержуючи 145мг сполуки 10d (вихід 31%) у вигляді твердої речовини світло-бежевого кольору 1H ЯМР А. Розчин, що містить субстраті la (отриманий зі сполуки 6с шляхом гідрогенолізу бензильної групи в присутності 5%-вого Pd/C у розчині етанолТГФ) (1г, 5,25ммоля) і 2,5диметокситетрагідрофуран (0,68мл, 1екв.) у крижаній оцтовій кислоті, кип'ятили зі зворотним холодильником протягом 4,5год. і потім давали остудитися до КТ. Потім суміш концентрували при зниженому тиску. Залишок розбавляли метанолом і додавали 1н. NaOH (водний розчин) до досягнення значення pH7. Продукт очищували за допомогою хроматографії на силікагелі (3%-вий МеОН/СН2Сl2, залишок попередньо адсорбували на силікагелі) У результаті одержували 140мг (вихід 13%) сполуки lib у вигляді твердої речовини білого кольору. 1 Н ЯМР (400МГц, ДМСО-d): δ 7,98 (d, J=9,2Гц, 1H), 7,64 (s, 2H), 7,18 (d, J=2,5Гц, 1H), 7,05 (br.d, J=7,9Гц, 1H), 6,88 (br.s, 1H), 6,32 (s, 2H), 3,90 (s, 3H). Приклад 12 Синтез 4-гідрокси-7-метокси-2-(6-метил-2піридил)хіноліну (12d). А. 6-Метилпіколінову кислоту 12a (411мг, 3,0ммоля) і SOCl2 (0,520мл, 7,2ммоля, 2,4екв.) кип'ятили зі зворотним холодильником протягом 2год. у бензолі (5мл). Розчинник і надлишок SOCl2 видаляли з реакційної суміші у вакуумі і залишок розтирали з пентаном. Твердий продукт, що утворився, відфільтровували і фільтрат концентрували, одержуючи хлорангідрид 12b (500мг, 2,6ммоля). Б. До розчину неочищеного хлорангідриду 12b в СН2Сl2 (5мл) при 0°С додавали розчин аніліну 8а (344мг, 2,08ммоля), ДlПЕА (1,45мл, 8,35ммоля) і ДМАП (61мг, 0,5ммоля) у CH2O2 (10мл). Реакційну суміш перемішували при КТ протягом 16год. Леткі компоненти видаляли у вакуумі, залишок розчиняли в EtOAc і розчин промивали 5%-вим NaHCO3 (2x), H2O і соляним розчином. Потім органічний шар сушили над MgSO4 i концентрували у вакуумі. 49 74546 50 Суміш очищували за допомогою експрес6,91 (dd, J=8,9 і 1,9Гц, 1Η), 7,54 (d, J=1,9Гц, 1Η), хроматографії на колонці, використовуючи у функ7,60 (dd, J=8,9 i 2,9Гц, 1Η), 7,97 (d, J=8,9Гц, 1Η), ції елюенту суміш EtOAc / гексан (1:2), одержуючи 8,21 (d, J=8,6Гц, 1Η), 8,48 (d, J=1,9Гц, 1Η). амід 12с (490мг, вихід 82%). Приклад 14 В. До суспензії аміду 12с (490мг, 1,71ммоля) у Синтез 4-гідрокси-7-метокси-2-(оксазол-5трет.-BuOH (10мл), додавали трет.-BuOK (410мг, іл)хіноліну (14с): 3,43ммоля) і суміш перемішували при 75°С протягом 6год., а потім при КТ протягом 16год. Потім суміш зливали на фосфатний буфер (175мл, pH=7) і перемішували протягом 30хв. Твердий продукт двічі розтирали з етилацетатом. Органічну фазу промивали соляним розчином, сушили над MgSO4 і концентрували у вакуумі. Отриманий твердий продукт розтирали з EtOAc, одержуючи похідне хіноліну 12d (263мг, вихід 58%) 1H ЯМР (CDCl3, 400МГц): δ 2,68 (s, 3Η), 3,94 (s, 3Η), 6,85А. Захищене похідне хіноліну 4b із прикладу 4 6,88 (2d. J=8,68 і 9,5Гц, 2Η), 6,94 (dd, J=8,9 і 2,2Гц, (3,8г, 11,8ммоля) розчиняли в СН2Сl2 (60мл) і охо1Η), 7,27 (dd, J=6,7 і 1,9Гц, 1Η), 7,73-7,79 (m, 2Η), лоджували до -78°С, після чого дуже повільно про8,28 (d, J=8,9Гц, 1Η), 10,3 (br.s, 1Η). тягом 15хв. додавали гідрид діізобутилалюмінію Приклад 13 (ДИБАЛ) (7,9мл, 1екв, 1,5М розчин у толуолі). ПісСинтез 4-гідрокси-7-метокси-2-(5-метокси-2ля перемішування протягом 80хв. додавали додапіридил)хіноліну (13d). ткову порцію ДИБАЛ (5,5мл, 0,7екв., 1,5Μ розчин у толуолі). Після перемішування при -78°С ще протягом 2год., реакцію обережно припиняли за допомогою метанолу (4мл) при -78°С і потім зливали на водний розчин сегнетової солі (1н. K-Na тартрат). Густу пасту перемішували зі СН2СІ2 (300мл) протягом 2год. доти, доки суміш не ставала прозорою. Фази розділяли і органічну фазу сушили (MgSO4), фільтрували і концентрували, одержуючи тверду речовину білого кольору. Шляхом очищення за допомогою експрес-хроматографії (SiO2, 230-400меш) з використанням суміші 50%-вий EtOAc/гексан одержували альдегід 14а у вигляді твердої речовини білого кольору (2,5г, вихід 73%). А. До розчину сполуки 13а (623мг, 3,73ммоля) Б. До суспензії K2СO3 (48мг, 0,34ммоля) у Меу МеОН додавали NaOH (2M, 4,70мл) і реакційну ОН (7мл) при перемішуванні додавали толуолсусуміш перемішували при КТ протягом 2год. Потім льфонілметилізоціанид (66мг, 0,34ммоля). Реакрозчин підкислювали за допомогою НСl (6н., ційну суміш нагрівали до 45°С і додавали альдегід 2,2мл) і концентрували, одержуючи сполуку 13b, 14а (0,10г, 0,34ммоля). Реакційну суміш нагрівали яку використовували на наступній стадії без очидо 80°С протягом 16год. і потім концентрували щування. досуха у вакуумі. Після здійснення очищення за Б. До розчину неочищеної сполуки 13b допомогою експрес-хроматографи (SiO2, 230(~3,73ммоля) у піридині (25мл), додавали 8а 400меш) одержували потрібний оксазол 14b (500мг, 3,03ммоля) і розчин охолоджували до (0,089г, вихід 80%) MC: 331,0 (Μ+Η)+. 25°С, після чого додавали РОСl3 (0,35мл, В. MEM-захищений гідроксихінолін 14b розчи3,73ммоля). Реакційну суміш перемішували при няли в ТГФ (3мл) і обробляли водним розчином 10°С протягом 1год., а потім при 0°С протягом НСl (1н., 1мл). Реакційну суміш перемішували про2год. Потім суміш зливали на H2О і екстрагували тягом 30хв. при КТ, після чого концентрували доEtOAc (2-3х) Об'єднані органічні шари промивали суха ν вакуумі Залишок обробляли фосфатним 5%-вим NaHCO2 i соляним розчином, сушили над буфером (3мл 1н. розчин, pH4,5) і перемішували, MgSO4 і концентрували у вакуумі. Неочищений після чого продукт відфільтровували, промивали продукт очищували за допомогою експресдистильованою водою і сушили протягом ночі в хроматографії на колонці, використовуючи у функглибокому вакуумі (60°С, 16год.). Одержували поції елюенту суміш EtOAc /гексан (1:2), у результаті трібний гідроксихінолін 14с у вигляді твердої речочого одержували амід 13с (617мг, вихід 55%). вини рудувато-коричневого кольору (0,065г, вихід В. До суспензії аміду 13с (617мг, 2,05ммоля) ν 100%). MC: 242,9 (Μ+Η)+. безводному трет.-BuOH (10мл) додавали трет.1 H ЯМР (ДМСО-d6): δ 8,65 (s, 1H), 8,02 (bs, 1H) BuOK (490мг, 4,11ммоля) і суміш перемішували 7,97 (d, J=8,9Гц, 1Н), 7,19 (s, 1H), 6,93 (d, J=7,9Гц, при 75°С протягом 6год., а потім при КТ протягом 1H), 6,42 (bs, 1H), 3,87 (s, 3H). ES (+) MC m/z 242,9 16год. Реакційну суміш зливали на фосфатний (M+H)+. буфер (175мл, pH=7) і перемішували протягом Фрагменти пептидного лшкера (Р3) 30хв. Твердий продукт, що утворився, фільтруваПриклад 15 Синтез (2S)-N-Boc-амінонон-8ли і розтирали з EtOAc, одержуючи похідне хіноліеноєвої кислоти (15g). ну 13d (250мг, вихід 43%) 1H ЯМР (ДМСО, 400МГц): δ 3,86 (s, 3Η), 3,94 (s, 3Η), 6,72 (bs, 1Η), 51 А. До розчину наявного в продажу діетил-2ацегамідомалонату 15а (100г, 0,46моля) в діоксані (500мл) додавали краплями протягом 30-45хв. водний розчин гідроксиду натрію (1Μ, 1екв., 460мл). Суміші, що утворилася, давали вистоятися протягом 16,5год., потім діоксан випарювали у вакуумі, водний розчин екстрагували трьома порціями по 300мл етилацетату і підкислювали до pH1 за допомогою концентрованої НСІ. Розчин залишали кристалізуватися в бані із сумішшю лідвода Після появи невеликої кількості кристалів суміш опромінювали ультразвуком, у результаті чого утворювався рясний осад. Після фільтрації і сушіння у вакуумі одержували сполуку 15b, (62,52г, вихід 72%) у вигляді твердої речовини білого кольору. Б. До перемішуваної за допомогою магнітної мішалки емульсії з умістом наявного у продажу 7октен-1,2-діолу 15с (25г, 0,173моля) і Н2О (100мл), яка знаходиться в круглодонній колбі об'ємом 1л, додавали протягом 20хв. (слабка екзотермічна реакція) водний розчин періодату натрію (40,7г, 0,190моля, 1,1екв., у 475мл Н2О). Утворену суміш перемішували при кімнатній температурі ще протягом 1год. (завершення реакції підтверджували за допомогою ТШХ). Потім суміш зливали в ділильну лійку і водний шар відокремлювали від органічного шару Водний розчин насичували за допомогою NaCl, зливали і ще раз відокремлювали від органічної фракції. Дві органічні фракції поєднували, сушили над сульфатом натрію і фільтрували через бавовняну пробку (в піпетці Пастера), одержуючи сполуку 15d (15,135г, безбарвна олія, вихід 78%). Водний розчин екстрагували СH2Сl2, сушили над безводним MgSO4, і концентрували у вакуумі (без нагрівання, при температурі кипіння гептаналу 153°С), одержуючи додаткову кількість сполуки 15d (1,957г, безбарвна олія, вихід 10%). Загальний вихід становив 88%. В. До твердого етил-2-ацетамідомалонату 15b (7,57г, 40ммолей) протягом 1хв. додавали 6гептенал 15d (4,48г, 40ммолей) у розчині піридину (32мл, 10екв.). Розчин, що утворився, охолоджували в бані при 10°C і протягом 4хв. додавали оцтовий ангідрид (12мл, 3,2екв.). Утворений розчин оранжевого кольору перемішували протягом 3год. при КТ і додавали ще одну порцію етил-2ацетамідомалонату 15b (2,27г). Утворену суміш перемішували при кімнатній температурі ще протягом 11год. Потім додавали лід (60мл) і розчин 74546 52 перемішували протягом 1,5год., після чого суміш розбавляли 250мл води й екстрагували двома порціями простого ефіру. Ефірний розчин промивали 1н. розчином НСl, насиченим розчином NaHCCh, сушили над Na2SO4, концентрували й очищували за допомогою експрес-хроматографії (40%-вий EtOАс/гексан), одержуючи сполуку 15е (4,8г, вихід 50%) у вигляді олії світло-жовтого кольору. Г. До дегазованого (шляхом барботації аргоном протягом 30хв.) розчину Z-етил-2-ацетамідо2,8-нонадієноату 15е (8,38г, 35ммолей) у безводному етанолі (70мл) додавали (S.S)>Et-DUPHOS Rh(COD)OTf (51мг, S/C=496) Суміш поміщали в атмосферу водню при тиску 30фунтів./кв. дюйм (після 4 циклів вакуум-Н2) і перемішували за допомогою шейкера Пара протягом 2год. Утворену суміш упарювали досуха, одержуючи неочищену сполуку 15f, яку використовували на наступній стадії без очищування. Д. До розчину неочищеного (S)-етил 2ацетамідо-8-ноненоату 15f (7,3г, 30,3ммоля) у ТГФ (100мл) додавали Вос2О (13,2г, 2екв.) і ДМАП (740мг, 0,2екв.) і реакційну суміш витримували при температурі дефлегмації протягом 2,5год. Потім більшу частину розчинника, що являє собою ТГФ, випарювали, неочищену суміш розбавляли СН2Сl2 і промивали 1н. НСl для видалення ДМАП.Потім органічний шар екстрагували насиченим водним розчином NaHCO3, сушили над безводним Na2SO4 і концентрували у вакуумі. Після цього неочищений продукт розбавляли ТГФ (50мл) і водою (30мл), додавали LiOH·H2O (2,54г, 2екв.) і утворену суміш перемішували при КТ протягом 25год. (завершення гідролізу підтверджували за допомогою ТШХ). Реакційну суміш концентрували у вакуумі для видалення більшої частини розчинника, що являє собою ТГФ, і розбавляли за допомогою СН2Сl2. Утворений розчин промивали 1н розчином НСl, сушили над безводним Na2SO4 і концентрували у вакуумі. Для видалення невеликої кількості домішок і надлишку Вос2О неочищений продукт очищували за допомогою експрес-хроматографії (використовуючи у функції елюенту градієнт розчинника 100%-вий гексан - 100%-вий EtOAc). У результаті одержували зазначену в заголовку сполуку 15g з високою чистотою у вигляді олії світложовтого кольору (5,82г, вихід 71%) 1H ЯМР (ДМСО, 400МГц): δ 7,01 (d, J=8Гц, 1Н), 5,79 (tdd, Jt=6,7Гц, Jd=17,0, 10,2Гц, 1Н), 5,00 (md, Jd=17,0Гц, 53 74546 54 1Н), 4,93 (md, Jd=10,2Гц, 1H), 3,83 (m, 1H), 2,00 (q, розчину) і випарювали ТГФ до досягнення ¾ його J=6,9Гц, 2H), 1,65-1,5 (m, 2H), 1,38 (s, 9H), 1,35початкового об'єму. Залишок екстрагували за до1,21 (m, 6H). помогою ЕtOАс (2 150мл) і об'єднані органічні шаПриклад 15a ри промивали 5%-вим розчином NaHCO3 Альтернативний метод синтезу (2S)-N-Boc(3 50мл), соляним розчином (2 50мл), сушили над амінонон-8-еноєвої кислоти (15g): MgSO4 і упарювали. Неочищений продукт, що утворився, у вигляді олії хроматографували на силікагелі, використовуючи у функції елюенту 15%-вий EtOAc у гексані, у результаті чого одержували сполуку 15j з виходом 68% (1,88г). 1 Н ЯМР (CDCl3, 400МГц): δ 1,35-1,47 (m, 6H), 1,67-1,74 (m, 2H), 2,02-2,09 (m, 2H), 2,65 (dd, J=13,4 і 9,9Гц, 1H), 2,84-3,02 (m, 2H), 3,31 (dd, J=13,4 і 3,2Гц, 1Н), 4,13-4,22 (m, 2H), 4,62-4,71 (m, 1H), 4,93 (d, J=10,2Гц, 1Н), 5,00 (dd, J=17,2 і 1,6Гц, 1Н), 5,75-5,84 (m, 1H), 7,18-7,38 (m,5H). В. До розчину KHMDS (0,8M розчин у ТГФ, 22мл, 17,5ммоля) у безводному ТГФ (50мл) при 78°С при перемішуванні додавали за допомогою канюлі розчин похідного кислоти 15j (3,25г, 10,30ммоля) у безводному ТГФ (40мл) при -78°С. Суміш перемішували при -78°С протягом 45хв. До цієї суміші додавали розчин трисилазиду (3,67г, 11,85ммоля) у безводному ТГФ (40мл) при -78°С. А. До суспензії тонко нарізаної магнієвої струСуміш перемішували при -78°С протягом 3хв., пожки (0,55г, 22,5ммоля) у безводному ТГФ (30мл), тім реакцію припиняли за допомогою оцтової кисяка містить диброметан (0,1мл), при перемішуванлоти (5мл). Після цього суміш перемішували при ні додавали краплями протягом 15хв. (реакція є КТ протягом 1год. 45хв. і, нарешті, при 40°С протяслабко екзотермічною) 8-бром-1-октен (15h, гом 15хв. Більшу частину ТГФ випарювали. Зали2,52мл, 15ммолей). Через 30хв. суміш нагрівали шок розчиняли в EtOAc (100мл) і органічний роздо 38°С протягом 1год. і потім охолоджували до чин промивали H2О (50мл), 5%-вим розчином 78°С, після чого її додавали за допомогою канюлі NaHCO3 (3 50мл) і соляним розчином (50мл), до надлишкової кількості твердого СО2. Суміш (MgSO4) і випарювали. Отриманий продукт у вирозбавляли діетиловим ефіром (100мл) і розчин гляді олії хроматографували на силікагелі, викорипромивали соляним розчином (2 50мл), сушили стовуючи у функції елюенту суміш гексан/СН2Сl2 над MgSO4 і упарювали. Одержували неочищений (1/1), у результаті чого одержували сполуку 15k продукт у вигляді олії, який очищували за допомо(2,47г, вихід 67%). 1 гою хроматографії на силікагелі, використовуючи у Н ЯМР (CDCl3, 400МГц): δ 1,32-1,45 (m, 6Н), функції елюенту 15%-вий EtOAc у гексані, у ре1,45-1,6 (m, 1Н), 1,75-1,88 (2, 2Н, ротамери), 2,01зультаті чого одержували сполуку 15і з виходом 2,11 (m, 2Н), 2,82-2,87 (m, 1H), 3,33 (dd, J=13,4 і 62% (1,44г). 3,2Гц, 1Н), 4,10-4,28 (m, 2H), 4,62-4,72 (m, 1H), 1 Н ЯМР (CDCl3, 400МГц): δ 1,31-1,42 (m, 6H), 4,90-5,05 (m, 3H), 5,73-5,88 (m, 1H), 7,17-7,38 (m, 1,60-1,69 (m, 2H), 2,02-2,09 (m, 2H), 2,35 (t, 5H). J=8,3Гц, 2Н), 4,99 (dm, J=10,0Гц, 1Н), 5,04 (dm, Г. До розчину безводного SnCl2(2,61г, J=17,0Гц, 1Н), 5,75-5,86 (m, 1H) 13,8ммоля) у безводному МеОН (80мл) при переБ. До інтенсивно перемішуваного розчину кармішуванні додавали при 0°С за допомогою канюлі бонової кислоти 15і (1,36г, 8,7ммоля) у безводнорозчин азиду 15k (2,45г, 6,9ммоля) у безводному му ТГФ (70мл) при –78°С додавали за допомогою МеОН (20мл). Суміш перемішували при КТ протяшприца в безводних умовах продистильований гом 4год. Випарювали МеОН і отриманий пінопобезпосередньо перед проведенням реакції Et3N дібний продукт розчиняли в суміші діоксан/Н2О (1,6мл, 11,3ммоля) і півалоілхлорид (1,18мл, (100мкл/20мкл) і обробляли Вос2О (3,0г, 9,58ммоля). Суміш перемішували при -78°С протя13,8ммоля) і NaHCO3 (2,89г, 34,5ммоля) (у разі гом 15хв., а потім при 0°С протягом 45хв. Суміш потреби значення pH доводили до 8 за допомогою знову охолоджували до -78°С і потім переносили додаткової кількості NaHCO3), і суміш перемішуваза допомогою канюлі в безводний розчин літієвої ли при КТ протягом 16год. Частину діоксану випасолі 4(S)-4-(фенілметил)-2-оксазолідинону в ТГФ рювали (-50%) і залишок двічі екстрагували EtOAc. при -78°С, для цього попередньо одержували реаОрганічний розчин промивали соляним розчином ктив, що являє собою літієву сіль оксазолідинону, (2 50мл), сушили й упарювали. Отриманий залишляхом повільного додавання н-BuLi (2,00М розшок хроматографували на силікагелі, використочин у гексані, 7,85мл, 15,7ммоля) у розчин оксазовуючи у функції елюенту 20-25%-вий EtOAc у геклідинону (2,78г, 15,7ммоля) у ТГФ (20мл) при сані, одержуючи сполуку 15I (1,75г, вихід 60%). 1 78°С. Н ЯМР (CDCl3, 400МГц): δ 1,27-1,53 (m, 6Н), Реакційну суміш перемішували при -78°С про1,46(s, 9Н), 1,80 (m, 1Н), 2,00-2,08 (m, 1H), 2,80 (t, тягом 15хв., а потім при КТ протягом 1,5год. НаJ=12,1Гц, 1H), 3,34 (d, 14,3Гц, 1H), 4,17-4,23 (m, самкінець реакцію припиняли за допомогою вод2H), 4,60-4,66 (m, 1H),4,93 (d, J=10,2Гц, 1H), 5,05 ного розчину бісульфату натрію (100мл 1М (dd, J=17,2 і 1,9Гц, 1Η), 5,13 (bs, 1H), 5,38-5,43 (m, 55 74546 56 1H), 5,74-5,84 (m, 1H), 7,22-7,36 (m, 5H). Б. До розчину тетракис(трифенілфосфін)Рd (0) Д. До розчину N-Вос-захищеного похідного 151 (0,116г, 5мл %, 0,1ммоля) у безводному ДМФ (1,74г, 4,04ммоля) у суміші ТГФ/Н2О (75мл/15мл) (7мл) при перемішуванні додавали (за допомогою додавали при перемішуванні при 90°С Н2О2 (30% шприца в атмосфері N2) складний діефір 16с (0,687г, 2ммоля) у безводному ДМФ (3мл) Суміш об./мас., 2,05мл, 16,2ммоля) і LiOH H2O (0,34г, перемішували при КТ протягом 3,5год. ДМФ випа8,1ммоля) і розчин перемішували при 0°С протярювали при зниженому тиску і залишок розбавлягом 1год. Реакцію припиняли шляхом додавання ли EtOAc (20мл). EtOAc-розчин промивали 0,5н. Na2CO3 (2,24г у Н2О, 15мл, 17,8ммоля). Значення охолодженої на льоді НСl (5мл), соляним розчиpH доводили до 4-5 за допомогою 10%-вого водном (10мл), сушили й упарювали. Залишок хроманого розчину лимонної кислоти, і суміш розбавлятографували на силікагелі, використовуючи у фунли EtOAc. Водну фракцію екстрагували ще один кції елюенту 15-20%-вий EtOAc у гексані, у раз EtOAc і органічний розчин двічі промивали результаті чого одержували сполуку 16d (0,253г, соляним розчином, сушили й упарювали. Залишок вихід 42%) хроматографували на силікагелі, використовуючи 1 Н ЯМР (CDCl3, 400МГц): δ 1,44 (s, 9Η), 1,84у функції елюенту 20%-вий гексан у EtOAc, у ре1,94 (m, 1Н), 2,08-2,22 (m, 1Η), 2,33 (dd, J=14,0 і зультаті чого одержували вільну карбонову кисло7,3Гц, 2H), 2,45-2,55 (m, 4H), 3,74 (s, 3Н), 4,28 (bm, ту 15g (0,76г, вихід 70%). Ця сполука у всіх відно1H), 4,98 (dm, J=10,2Гц, 1H), 5,03 (dm, J=17,2Гц, шеннях була ідентичною сполуці з прикладу 15. 1Η), 5,00-5,10 (m, 1H), 5,74-5,85 (m, 1H). Приклад 16 Приклад 17 Синтез метилового ефіру (2S)-N-Вос-аміно-5Синтез (2S,5R)-N-Boc-2-аміно-δ-метилнон-8оксонон-8-еноєвої кислоти (16d): еноєвої кислоти (17f). Цей процес синтезу заснований на методі, [описаному в Τ.Tsuda та ін., J.Am. Chem. Sac., 1980,/02,6381-6384] А. До розчину моноалілового ефіру малонової кислоти (1,50г, 10,4ммоля) у безводному ТГФ (20мл) в атмосфері N2 при -78°С при інтенсивному перемішуванні протягом 5хв. краплями додавали H-Bu2Mg (0,9М розчин у гексані, 5,8мл, 5,2ммоля). Потім густу суспензію перемішували при КТ протягом 1год. і упарювали досуха (вакуумний відсос в атмосфері N2) Тверду магнієву сіль 16b сушили у вакуумі протягом 1год. Похідне глутамінової кислоти 16а спочатку змішували з 1,1'-карбонілідіімідазолом (1,65г, 10,21ммоля) у безводному ТГФ і суміш перемішували при КТ протягом 1год. для того, щоб активувати фрагмент вільної кислоти. Потім активоване похідне глутамінової кислоти вносили за допомогою канюлі в розчин магнієвої солі 16b і отриману реакційну суміш перемішували при КТ протягом 16год. Потім її розбавляли EtOAc і органічний розчин промивали 0,5н. охолодженої на льоді НСl, промивали соляним розчином, сушили й упарювали. Отриманий залишок хроматографували на силікагелі, використовуючи у функції елюенту 3540%-вий EtOAc у гексані, у результаті чого одержували сполуку 16с (1,85г, вихід 53%). 1 Н ЯМР (CDCl3, 400МГц): δ 1,44 (s, 9H), 1,851,95 (m, 1Η), 2,12-2,22 (m, 1Η), 2,58-2,74 (m, 2H), 3,48 (s, 2H), 3,74 (s, 3Н), 4,24-4,34 (m, 1Η), 4,52 (dm, J=5,7Гц, 2Н), 5,09 (m, 1H), 5,25 (dm, J=10,2Гц, 1H), 5,34 (dm, J=17,2Гц, 1H), 5,91 (m, 1H). А,Б,В,Г. Наявний у продажу (R)-(+)цитронелаль 17а спочатку перетворювали на похідне амінокислоти 17b, використовуючи ті самі стадії синтезу, які було раніше описано в прикладі 15 для перетворення альдегіду I5d на проміжний продукт, що являє собою амінокислоту 15f. Д. Сполуку 17b (0,675г, 5,6ммоля) розчиняли в суміші трет.-ВuОН/ацетон/Н2О (1:1:1, 18мл) і поміщали в крижану баню (0°С). Послідовно додавали NMMO (0,789г, 6,74ммоля, 1,2екв.) і OsO4 (2,5мас.% у трет.-BuOH, 0,7мл, 0,067ммоля, 0,012екв.) і реакційну суміш перемішували при КТ протягом 4год. Більшу частину ацетону видаляли шляхом випарювання у вакуумі і потім суміш екстрагували EtOAc. Після цього органічний шар промивали Н2О і соляним розчином, сушили над безводним MgSO4 і упарювали досуха. За допомогою експрес-хроматографії на колонці з використанням у функції елюенту 1%-вого EtOH у EtOAc одержували діол 17с з високою чистотою з виходом 77% (0,575г). Ε. До розчину 17с (0,575г, 1,73ммоля) у ТГФ/Н2О (1:1, 20мл) при 0°С додавали NaIО4 (0,48г, 2,25ммоля, 1,3екв.) і реакційну суміш перемішували при КТ протягом 3,5год. Потім більшу частину розчинника, що являє собою ТГФ, видаляли шляхом випарювання у вакуумі і суміш, яка залишилася, екстрагували EtOAc (2 100мл). Після цього об'єднані органічні шари промивали 5%-вим водним розчином лимонної кислоти (2 20мл), 5%вим водним розчином NaHCO3 (20мл) і соляним розчином (2 50мл), потім EtOAc-розчин сушили над безводним MgSO4 і упарювали досуха у вакуумі. Проміжний продукт, що являє собою альдегід 17d (0,47г неочищеного продукту) використовували на наступній стадії без додаткового очищу 57 74546 58 1 вання. Н ЯМР (CDCl3, 400МГц): δ 1,21 (d, J=6,0Гц, Ж. До розчину Рh3РСН3Вr (925мг, 2,6ммоля) у 3Н), 1,45 (s, 9Н), 3,75 (s, 3Н), 3,82-3,87 (m, 1Н), безводному толуолі (15мл) додавали KHMDS 3,99-4,07 (m, 2H), 4,29 (dd, J=9,5 і 2,5Гц, 1Н), 5,14 (0,5М розчин у толуолі, 5,2мл, 2,6ммоля) і утворе(dm, J=10,5Гц, 1Н), 5.21 (dm, J-17,2Гц, 1H), 5,75ну суспензію жовтого кольору перемішували при 5,84 (m, 1H). КТ протягом 30хв. в атмосфері N2. По закінченні В. Сполуку, що являє собою складний ефір цього періоду часу суспензію спочатку охолоджу18с (99мг, 0,362ммоля) розчиняли в суміші вали до 0°С, додавали за допомогою шприца розТГФ/МеОН/Н2О (2:1:1,4мл) і додавали LiOH-H2O чин альдегіду 17d (0,47г, 1,73ммоля, розчинений у (61мг, 1,45ммоля). Розчин перемішували при КТ 15мл безводного ТГФ) і суміші давали нагрітися до протягом 2год. і потім підкислювали за допомогою КТ. Після перемішування при КТ протягом 1год. 1н розчину НСl до досягнення значення pH~3, пісбільшу частину ТГФ видаляли випарюванням у ля чого розчинники видаляли у вакуумі Утворену вакуумі, до суміші додавали ЕtOАс (100мл) і оргасполуку 18d у вигляді олії використовували без нічний шар промивали Н2О (30мл), 5%-вим водним додаткового оброблення для синтезу макроциклірозчином NaHCO3 (30мл) і соляним розчином чних інгібіторів. (30мл). Потім EtOAc-розчин сушили над безводПриклад 19 ним MgSO4 і упарювали досуха у вакуумі. Після Синтез (2S, 38)-ІЧ-вос-2-аміно-3очищення за допомогою експрес-хроматографії на (меркаптоаліл)бутанової кислоти (19е): колонці на силікагелі з використанням у функції елюенту суміші гексан EtOAc (3:2) виділяли чисту сполуку 17е з виходом 63% (0,29г) для двох останніх стадій. З метою одержання сполуки 17f здійснювали гідроліз складного етилового ефіру й одночасну заміну N-ацетильноі захисної групи на групу Вос в проміжному продукті 17е, використовуючи таку ж процедуру, яку описано для перетворення сполуки 15f на сполуку 15g (17f, 310мг, кількісний вихід) 1Н А. Сполуку 19а (9,1ммоля) розчиняли в піриЯМР (CDCl3, 400МГц): δ 0,88 (d, J=6,4Гц, 3Н), 1,18дині (5мл) і розчин охолоджували до 0°С в крижа1,28 (m, 2H), 1,35-1,48 (m, 3Н), 1,45 (s, 9H), 1,64ній бані, додавали невеликими порціями тозилх1,74 (m, 1Н), 1,81-1,89 (m, 1H), 1,94-2,12 (m, 2H), лорид (2,3г, 11,8ммоля, 1,3екв.) і рекационну 4,28 (bd, J=~3,2Гц, 1Н), 4,93 (dm, J=11,1Гц, 1Н), суміш перемішували при КТ протягом 24год. По 5,00 (dm, J=16,8Гц, 1H), 5,74-5,84 (m, 1H). закінченні цього періоду часу реакційну суміш розПриклад 18 поділяли між діетиловим ефіром (300мл) і Н2O Синтез N-Вос-О-аліл-(L)-треоніну (18d): (100мл). Потім ефірний шар промивали 0,2н. розчином НСІ (6 100мл) і соляним розчином (100мл), сушили над безводним MgSО4, фільтрували і концентрували досуха у вакуумі. Після очищення неочищенного продукту за допомогою експресхроматографіі на колонці з використанням у функА. Вос-(L)-треонін 18а (500мг, 2,28ммоля) часції елюенту суміші гексан/ЕtOАс (градієнт від 8:2 тково розчиняли в суміші CH2Cl2/MeOH (8мл/0,5мл до 7:3) виділяли похідне тозила 19b з виходом відповідно) при 0°С. Повільно додавали розчин 85% (3,05г). діазометану в діетиловім ефірі доти, доки не одеБ. До розчину проміжного продукту 19b (775мг, ржували виражене жовте забарвлення, яке вказує 2ммоля) у безводному ДМФ (2,5мл) додавали тіона присутність надлишку діазометану. Після випаацетат калію (365мг, 3,2ммоля, 1,6екв.) і реакційну рювання розчинників одержували складний метисуміш перемішували при КТ протягом 24год. Потім ловий ефір 18b у вигляді мутної олії білого кольобільшу частину ДМФ випарювали у вакуумі і суміш, ру (0,534г). яка залишилася, розподіляли між EtOAc і Н2О. Б. Потім проміжний продукт 18b (311мг, Водний шар повторно екстрагували EtOAc, об'єд1,33ммоля) розчиняли в безводному діетиловому нані органічні шари промивали соляним розчином, ефірі (8мл), додавали Ag2O (341мг, 1,47ммоля) і сушили над безводним MgSO4 і упарювали досуактивовані безпосередньо перед цим 4Å молекуха. Шляхом очищення неочищеного продукту за лярні сита (1г). На завершення в реакційну колбу допомогою експрес-хроматографії на колонці з додавали алілйодид (134мкл, 1,47ммоля) і суміш використанням у функції елюенту суміші гекперемішували при температурі дефлегмації Через сан/ЕЮАс (у співвідношенні 4:1) виділяли сполуку 20год. і 30хв. додавали ще дві порції алілйодиду 19с з виходом 80% (465мг). (щораз по 45мкл, 0,50ммоля) і продовжували пеВ. До розчину складного тіоефіру 19с (465мг) у ремішування в цілому протягом 36год. Потім суміш суміші H2O/EtOH (співвідношення 3:5,8мл) додафільтрували через целіт і очищували за допомовали 0,2М водний розчин NaOH (2,4мл) і суміш гою експрес-хроматографії на колонці на силікагеперемішували при КТ протягом 1,5год. Потім долі, використовуючи у функції елюенту суміш давали алілйодид (0,292мл, 3,2ммоля, 2екв.) і ЕtOАс/гексан (14), у результаті чого одержували продовжували перемішування при КТ ще протягом 73мг (вихід 27%) сполуки 18с у вигляді прозорої 30хв. Реакційну суміш концентрували до половини олії. її початкового об'єму і потім екстрагували EtOAc. 59 74546 60 Водний шар підкислювали до значення рН=~3 за 5,35 (bd, J=7Гц, 1Η), 5,72-5,83 (m, 1H). допомогою водного 0,5н. розчину НСl і повторно В. Після цього складний ефір розчиняли в суекстрагували EtOAc. Об'єднані органічні шари міші ТГФ/МеОН/Н2О (2:2:1,5мл), додавали промивали соляним розчином, сушили над безвоLіОН Н2О (50мг, 2,0ммоля, 2екв.) і реакційну суміш дним MgSO4 і упарювали досуха у вакуумі. Реакперемішували при 40°С протягом 4год. для того, ційна суміш містила принаймні чотири продукти, щоб гідролізувати складний ефір 20с до кислоти усі ці продукти виділяли за допомогою експрес20b. Реакційну суміш підкислювали 0,5н. НСl до хроматографії на колонці на силікагелі, використорН-4-5, ТГФ і МеОН випарювали повністю і водний вуючи у функції елюенту суміш гексан/EtOAc (грарозчин, що залишився, екстрагували EtOAc. дієнт від 9:1 до 3:1). Структура найменш полярної EtOAc-шар сушили над безводним MgSO4 і упарюсполуки (ТШХ Rf=0,68 у суміші гексан/EtOAc, 4 1) вали досуха, одержуючи сполуку 20b, яку викорисвідповідала потрібному продукту 19d (83мг, вихід товували в наступному синтезі макроциклічних 18%). інгібіторів без додаткового очищування. 1 Н ЯМР (CDCl3, 400МГц): δ 1,24 (d, J=7,0Гц, Проміжні ациклічні дипептиди і трипептиди 3Н), 1,46 (s, 9H), 3,13-3,19 (m, 2H), 3,24-3,29 (m, Загальний метод проведення реакцій сполу1H), 3,77 (s, 3H), 4,50 (dd, J=8,6 і 3,8Гц, 1H), 5,12 чення в розчині і конкретні приклади їхнього здійс(d, J=12,4Гц, 1Н), 5,15 (dd, J=18,4 і 1,3Гц, 1H), 5,22 нення [описано в WO 00/09543 і WO 00/09558]. (bd, J=7,6Гц, 1H), 5,75-5,85 (m, 1H). Ці методи було використано для синтезу проГ. Розчин складного метилового ефіру 19d міжних дипептидів 26с, 30а і трипептидів 23а, 24а, (83мг, 0,287ммоля) у суміші MeOH/H2O (3:1,4мл) 31а, 32а і 33а. змішували з водним розчином NaOH (0,2н., 1,3мл, Приклад 21 0,26ммоля) протягом 24год. при КТ і протягом Синтез ациклічного трипептиду 21е: 1год. при 40°С. Реакційну суміш підкислювали холодним водним розчином НСl (0,5н. НСl, при 0°С. рН=4-5), МеОН видаляли у вакуумі і водну суміш, яка залишилася, екстрагували EtOAc. Органічний розчин сушили над MgSO4 і упарювали досуха, одержуючи сполуку 19е. Сполуку 19е використовували для заключного синтезу інгібіторів без будь-якого додаткового очищування. Приклад 20 Синтез (S)-N-Boc-2-аміно-3-метил-3-(1меркапто-4-бутеніл)бутанової кислоти (20с): А. L-пеніциламін 20а (448мг, 3ммоля) розчиняли в суміші ДМФ/ДМСО (співвідношення 5:1,6мл), додавали 4-бромпентен (0,46мл, 4,5ммоля, 1,5екв.) і CsOH H2O (1,0г, 6мл, 2екв.), і реакційну суміш перемішували при КТ. Через 24год. до реакційної суміші додавали Вос2О (820мг, 3,75ммоля, 1,25екв.) і продовжували перемішування ще протягом 12год. Після цього ДМФ видаляли у вакуумі, суміш, яка залишилася, розбавляли холодним 0,5н. водним розчином НСl, доводячи до рН=~4-5, і потім екстрагували EtOAc (2x50мл) Органічний шар промивали соляним розчином (2х), сушили над безводним MgSO4 і упарювали досуха, одержуючи неочищену карбонову кислоту 20b. Б. Очищування сполуки 20b виявилося важким, тому неочищений продукт спочатку обробляли діазометаном для одержання відповідного складного метилового ефіру 20с, а потім очищували за допомогою експрес-хроматографіі на колонці, використовуючи у функції елюенту суміш гексан/ЕtOАс (94), у результаті чого одержували 190мг (вихід 20%) чистого складного метилового ефіру 20с. 1 Н ЯМР (400МГц, CDCl3): δ 1,35 (s, 3Н), 1,37 (s,3H), 1,44 (s,9H), 1,59-1,67 (πι, 2Η), 2,11-2,17 (m, 2H), 2,51-2,60 (m, 2H), 3,74 (s, 3Н), 4,29 (d, J=8,6Гц, 1Н), 4,98 (dm, J=10,5Гц, 1H), 5,03 (dm, J=19Гц, 1H), А. До розчину, що містить похідне проліну 21а (отримане з наявного в продажу Вос-4(R)гідроксипроліну і 4-хлорхіноліну за методом, [описаним у WO 00/05543 і WO 00/09558] (1,32г, 3,68ммоля) і неочищений гомоаліл АЦКК 1f (~3,35ммоля) у СН2Сl2 (10мл), послідовно додавали NMM (1,21мл, 10,05ммоля) і ГАТУ (1,53, 4,02ммоля), і суспензію перемішували при КТ протягом 18год. Пο закінченні цього періоду часу розчинник випарювали і неочищену реакційну суміш повторно розчиняли в EtOAc (30мл). Розчин промивали 5%-вим водним розчином NaНСО3 (2 10мл), соляним розчином (10мл), сушили над MgSO4 і упарювали. Неочищений продукт очищували за допомогою хроматографії на силикагелі, використовуючи у функції елюенту 8%-вий діетиловий ефір у EtOAc, у результаті чого одержували потрібний діастереомер сполуки 21b з виходом 20% (абсолютну стерехімічну будову не визначали). 1 Н ЯМР (CDCl3, 400МГц): δ 0,93 і 1,01 (t, J=8,3Гц, 1Н, ротамери в співвідношенні 3:7), 1,141,35 (m, 2H), 1,44 (s, 9H), 1,45 (s, 9H), 1,50-1,82 (m, 4H), 2,08-2,24 (m, 2H), 2,32 (bs, 0,7Н), 2,63 (bs, 0,75Н), 2,93 (bs, 0,75Н), 3,16 (m, 0,25Н), 3,77 (bs, 1,5Н), 3,88 (bs, 0,5Н), 4,4-4,55 (m, 1H), 4,98 (d, J=10,2Гц, 1Н), 5,03 (dd, J=17,2 і 1,6Гц, 1H), 5,24 (bs, 1Н), 5,75-5,88 (m, 1H), 6,57 і 6,78 (2bs, 1H, 2 ротамера), 7,42-7,58 (m, 3H), 7,63-7,73 (m, 2H), 8,04 (d, J=8,3Гц, 1Н), 8,11 (d, J=8,3Гц, 1Н), 8,74 (d, J=5,1Гц, 1Н).
ДивитисяДодаткова інформація
Назва патенту англійськоюMacrocyclic peptides having activity relative to hepatitis c virus, a pharmaceutical composition and use of the pharmaceutical composition
Автори англійськоюGoudreau Nathalie
Назва патенту російськоюМакроциклические пептиды, которые имеют активность касательно вируса гепатита с, фармацевтическая композиция и применение фармацевтической композиции
Автори російськоюГудро Натали
МПК / Мітки
МПК: A61K 31/7052, C07K 5/08, A61P 43/00, A61K 45/00, C07K 5/078, A61K 38/21, A61P 31/14, A61P 1/16, A61K 38/43, A61K 31/13, A61K 38/46, A61K 38/00
Мітки: фармацевтично, композиції, вірусу, пептиди, макроциклічні, активність, фармацевтична, композиція, застосування, мають, гепатиту
Код посилання
<a href="https://ua.patents.su/48-74546-makrociklichni-peptidi-yaki-mayut-aktivnist-shhodo-virusu-gepatitu-s-farmacevtichna-kompoziciya-ta-zastosuvannya-farmacevtichno-kompozici.html" target="_blank" rel="follow" title="База патентів України">Макроциклічні пептиди, які мають активність щодо вірусу гепатиту с, фармацевтична композиція та застосування фармацевтичної композиції</a>
Попередній патент: Спосіб керування модуляцією світлового потоку в оптично керованій комірці на основі багатошарової структури та пристрій для його здійснення
Наступний патент: Фармацевтична композиція на основі сполук, які мають холінергічну дію, і b-міметиків та спосіб її одержання
Випадковий патент: Ультразвуковий витратомір