Похідні n-((3-оксо-2,3-дигідро-1н-ізоіндол-1-іл)ацетил)гуанідину як інгібітори nhe-1 для лікування інфаркту та стенокардії
Номер патенту: 81118
Опубліковано: 10.12.2007
Автори: Біго Антоні, Каррі Жан-Крістоф, Міньяні Серж, Ронан Батіст, Хофмайстер Армін, Клеєманн Хайнц-Вернер
Формула / Реферат
1. Сполуки формули І
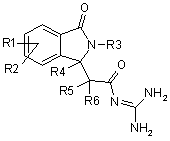 , (I)
, (I)
в якій
R1 і R2 незалежно один від одного являють собою водень, алкіл, що має 1, 2, 3 або 4 атоми вуглецю, алкеніл, що має 2, 3, 4, 5 або 6 атомів вуглецю, алкініл, що має 2, 3, 4, 5 або 6 атомів вуглецю, арил, гетероарил, F, Сl, Br, I, NO2, NH2, алкіламіно, що має 1, 2, 3 або 4 атоми вуглецю, NRaRb, алкілкарбоніламіно, що має 1, 2, 3 або 4 атоми вуглецю, ОН, алкокси, що має 1, 2, 3 або 4 атоми вуглецю, S(O)nR7, CO2H, алкоксикарбоніл, що має 1, 2, 3 або 4 атоми вуглецю, алкілкарбоніл, що має 1, 2, 3 або 4 атоми вуглецю, CONH2, CONRaRb, CN, поліфторалкіл, що має 1, 2, 3 або 4 атоми вуглецю, поліфторалкокси, що має 1, 2 або 3 атоми вуглецю, або SO3Н;
R1 і R2, самі по собі, необов'язково заміщені лінійною або розгалуженою алкільною групою, що має 1, 2, 3 або 4 атоми вуглецю;
n дорівнює 0, 1 або 2
R3 являє собою водень, арил, гетероарил, групу типу Alk-R8 або циклоалкіл, що має 3, 4, 5, 6, 7 або 8 атомів вуглецю,
де циклоалкіл необов'язково заміщений одним або більше замісниками, вибраними з групи, що складається з F, Сl, Br або І,
Alk являє собою алкіл, що має 1, 2, 3, 4 або 5 атомів вуглецю у лінійному або розгалуженому ланцюгу,
R8 являє собою водень, циклоалкіл, що має 3, 4, 5, 6, 7 або 8 атомів вуглецю, поліфторалкіл, що має 1, 2, 3 або 4 атоми вуглецю, арил, гетероарил, ОН, алкокси, що має 1, 2, 3 або 4 атоми вуглецю, СО2Н, CONH2, CONRaRb, NH2, алкіламіно, що має 1, 2, 3 або 4 атоми вуглецю, або NRаRb;
R4, R5 і R6 незалежно один від одного являють собою водень або лінійний або розгалужений алкіл, що має 1, 2, 3 або 4 атоми вуглецю;
R7 являє собою лінійний або розгалужений алкіл, що має 1, 2, 3 або 4 атоми вуглецю;
Ra і Rb незалежно один від одного визначені як R7, або альтернативно Ra і Rb разом з атомом азоту, до якого вони приєднані, утворюють 5- або 6-членний гетероцикл, що необов'язково містить інший гетероатом, вибраний з О, S або N;
і їх рацемічні суміші, енантіомери і діастереоізомери і їх суміші, їх таутомери та їх фармацевтично прийнятні солі.
2. Сполуки формули І за п. 1, де
R1 і R2 незалежно один від одного являють собою водень, алкіл, що має 1, 2, 3 або 4 атоми вуглецю, F, Сl, Br, I, NH2, алкіламіно, що має 1, 2, 3 або 4 атоми вуглецю, NRaRb, алкілкарбоніламіно, що має 1, 2, 3 або 4 атоми вуглецю, ОН, алкокси, що має 1, 2, 3 або 4 атоми вуглецю, СО2Н, алкоксикарбоніл, що має 1, 2, 3 або 4 атоми вуглецю, поліфторалкіл, що має 1, 2, 3 або 4 атоми вуглецю, поліфторалкокси, що має 1, 2 або 3 атоми вуглецю, або SO3Н,
R1 і R2, самі по собі, необов'язково заміщені лінійною або розгалуженою алкільною групою, що має 1, 2, 3 або 4 атоми вуглецю;
R3 являє собою групу типу Alk-R8 або циклоалкіл, що має 3, 4, 5, 6, 7 або 8 атомів вуглецю,
де циклоалкіл необов'язково заміщений одним або більше замісниками, вибраними з групи, що складається з F, Сl або Br,
Alk являє собою алкіл, що має 1, 2, 3, 4 або 5 атомів вуглецю у лінійному або розгалуженому ланцюгу,
R8 являє собою водень, циклоалкіл, що має 3, 4, 5, 6, 7 або 8 атомів вуглецю, поліфторалкіл, що має 1, 2, 3 або 4 атоми вуглецю, арил або гетероарил;
R4, R5 і R6 незалежно один від одного являють собою водень або лінійний або розгалужений алкіл, що має 1, 2, 3 або 4 атоми вуглецю;
Ra і Rb незалежно один від одного являють собою лінійний або розгалужений алкіл, що має 1, 2, 3 або 4 атоми вуглецю, або Ra і Rb разом з атомом азоту, до якого вони приєднані, утворюють 5- або 6-членний гетероцикл, що необов'язково містить інший гетероатом, вибраний з О, S і N,
і їх рацемічні суміші, енантіомери і діастереоізомери і їх суміші, їх таутомери та їх фармацевтично прийнятні солі.
3. Сполуки формули І за п.1 або 2, де
R1 і R2 незалежно один від одного являють собою водень, алкіл, що має 1, 2, 3 або 4 атоми вуглецю, F, Сl, Br, І, ОН, алкокси, що має 1, 2, 3 або 4 атоми вуглецю, поліфторалкіл, що має 1, 2, 3 або 4 атоми вуглецю, або поліфторалкокси, що має 1, 2 або 3 атоми вуглецю,
R1 і R2, самі по собі, необов'язково заміщені лінійним або розгалуженим алкілом, що має 1, 2, 3 або 4 атоми вуглецю;
R3 являє собою групу типу Alk-R8 або циклоалкіл, що має 3, 4, 5, 6, 7 або 8 атомів вуглецю,
де циклоалкіл необов'язково заміщений одним або більше замісниками, вибраними з групи, що складається з F або Сl,
Alk являє собою алкіл, що має 1, 2, 3, 4 або 5 атомів вуглецю у лінійному або розгалуженому ланцюгу,
R8 являє собою водень, циклоалкіл, що має 3, 4, 5, 6, 7 або 8 атомів вуглецю, або поліфторалкіл, що має 1, 2, 3 або 4 атоми вуглецю;
R4, R5 і R6 незалежно один від одного являють собою водень або лінійний або розгалужений алкіл, що має 1, 2, 3 або 4 атоми вуглецю;
і їх рацемічні суміші, енантіомери і діастереоізомери і їх суміші, їх таутомери та їх фармацевтично прийнятні солі.
4. Сполука за одним або більше з пп.1-3, яка відрізняється тим, що вона вибрана з групи, що включає:
N-[2-(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)-2-метилпропіоніл]гуанідин,
N-[2-(2-циклопропілметил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)-2-метилпропіоніл]гуанідин,
N-[(3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(3-оксо-2-(4,4,4-трифторбутил)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-ізобутил-7-метил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(4-аміно-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5-аміно-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6-аміно-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(7-аміно-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(4-гідроксі-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5-гідроксі-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6-гідроксі-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(7-гідроксі-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(4,7-дихлор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(4-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(4,5-дифтор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6,7-дифтор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(4-карбоксі-2-ізобутил-3-оксо-2,3-дигідро-1H-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5-карбоксі-2-ізобутил-3-оксо-2,3-дигідро-1H-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6-карбоксі-2-ізобутил-3-оксо-2,3-дигідро-1H-ізоіндол-1-іл)ацетил]гуанідин,
N-[(7-карбоксі-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-ізобутил-1-метил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
і їх рацемічні суміші, енантіомери і діастереоізомери і їх суміші, їх таутомери та їх фармацевтично прийнятні солі.
5. Сполука за одним або більше з пп. 1-3, яка відрізняється тим, що вона
вибрана з групи, що включає:
N-[(2-метил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-етил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(3-оксо-2-пропіл-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[2-(3-оксо-2-пропіл-2,3-дигідро-1Н-ізоіндол-1-іл)пропіоніл]гуанідин,
N-[(2-ізопропіл-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[2-(2-бутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)пропіоніл]гуанідин,
N-[(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[2-(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)пропіоніл]гуанідин,
N-[(2-циклопропілметил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-бензил-3-оксо-2,3-дигідро-1H-ізоіндол-1-іл)ацетил]гуанідин,
N-[(3-оксо-2-(2,2,2-трифторетил)-2,3-дигідро-1H-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-ізобутил-4-метил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-ізобутил-5-метил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-ізобутил-6-метил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5-трет-бутил-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6-трет-бутил-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-ізобутил-5-ізопропоксі-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5-хлор-2-ізобутил-3-оксо-2,3-дигідро-1H-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6-хлор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5-хлор-2-циклопропілметил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6-хлор-2-циклопропілметил-3-оксо-2,3-дигідро-1H-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5-хлор-3-оксо-2-(2,2,2-трифторетил)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6-хлор-3-оксо-2-(2,2,2-трифторетил)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5-хлор-3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6-хлор-3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5,6-дихлор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(7-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(4,7-дифтор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(5-бром-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(6-бром-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-ізобутил-3-оксо-5-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-ізобутил-3-оксо-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-циклопропілметил-3-оксо-5-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(2-циклопропілметил-3-оксо-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(3-оксо-2-(2,2,2-трифторетил)-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(3-оксо-2-(2,2,2-трифторетил)-5-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(3-оксо-5-трифторметил-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(3-оксо-6-трифторметил-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(3-оксо-2-(4,4,4-трифторбутил)-5-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[(3-оксо-2-(4,4,4-трифторбутил)-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
[1-(2-гуанідино-1-метил-2-оксоетил)-3-оксо-1,3-дигідроізоіндол-2-іл]оцтова кислота,
N-{2-[3-оксо-2-(2-піролідин-1-ілетил)-2,3-дигідро-1Н-ізоіндол-1-іл]пропіоніл}гуанідин,
N-[2-(2-гідроксіетил)-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)пропіоніл]гуанідин,
N-{2-[6-метансульфоніл-3-оксо-2-(2,2,2-трифторетил)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
N-[2-(2-циклопропілметил-6-метансульфоніл-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідиній,
N-{2-[5,6-дифтор-3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
N-{2-[5,6-дихлор-3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
N-[2-(5,6-дихлор-2-циклопропілметил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
N-[2-(5,6-дихлор-2-циклопропіл-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил] гуанідин,
N-{2-[5,6-дихлор-3-оксо-2-(2,2,2-трифторетил)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
N-{2-[5,6-дифтор-3-оксо-2-(2,2,2-трифторетил)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
і їх рацемічні суміші, енантіомери і діастереоізомери, їх таутомери та їх фармацевтично прийнятні солі.
6. Сполука за одним або більше з пп.1-3, яка відрізняється тим, що вона вибрана з групи, що включає:
(R)-N-{2-[6-метансульфоніл-3-оксо-2-(2,2,2-трифторетил)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(S)-N-{2-[6-мeтaнcyльфoнiл-3-oкco-2-(2,2,2-тpифтopeтил)-2,3-дигiдpo-1H-ізоіндол-1-іл]ацетил}гуанідин,
(R)-N-[2-(2-циклопропілметил-3-оксо-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(S)-N-[2-(2-циклопропілметил-3-оксо-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(R)-N-{2-[5,6-дифтор-3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(S)-N-{2-[5,6-дифтор-3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(R)-N-{2-[5,6-дихлор-3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(S)-N-{2-[5,6-диxлop-3-oкco-2-(3,3,3-тpифтopпpoпiл)-2,3-дигiдpo-1H-iзoiндoл-1-іл]ацетил}гуанідин,
(R)-N-[2-(5,6-дихлор-2-циклопропілметил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(S)-N-[2-(5,6-дихлор-2-циклопропілметил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(R)-N-[2-(5,6-дихлор-2-циклопропіл-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(S)-N-[2-(5,6-дихлор-2-циклопропіл-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(R)-N-{2-[5,6-дихлор-3-оксо-2-(2,2,2-трифторетил)-2,3-дигідро-1Н-ізоіндол-]1-іл]ацетил}гуанідин,
(S)-N-{2-[5,6-дихлор-3-оксо-2-(2,2,2-трифторетил)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(R)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(R)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-5-трифторметил-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(S)-N-{2-[3-oкco-2-(2,2,2-тpифтopeтил)-5-тpифтopмeтил-2,3-дигiдpo-1H-ізоіндол-1-іл]ацетил}гуанідин,
(R)-N-[2-(6-хлор-3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(S)-N-[2-(6-хлор-3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(R)-N- [2-(5-хлор-3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(S)-N-[2-(5-xлop-3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(R)-N-{2-[3-оксо-6-трифторметил-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(S)-N-{2-[3-оксо-6-трифторметил-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(R)-N-{2-[3-оксо-5-трифторметил-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(S)-N-{2-[3-оксо-5-трифторметил-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(R)-N-{2-[6-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(S)-N-{2-[6-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(R)-N-(2-[5-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(S)-N-{2-[5-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин,
(R)-N-[2-(6-хлор-2-циклопропілметил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(S)-N-[2-(6-хлор-2-циклопропілметил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
(R)-N-[2-(5-хлор-2-циклопропілметил-3-оксо-2,3-дигідро-1H-ізоіндол-1-іл)ацетил]гуанідин,
(S)-N-[2-(5-хлор-2-циклопропілметил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин,
і їх фармацевтично прийнятні солі та таутомери.
7. Сполука формули І і/або її фармацевтично прийнятні солі за одним або більше з пп.1-6 для застосування як лікарського засобу.
8. Фармацевтична композиція, що застосовується для людей, у ветеринарії і/або для захисту рослин, що містить ефективну кількість сполуки формули І і/або її фармацевтично прийнятних солей, вказаних в одному з пп. 1-6, разом з фармацевтично прийнятним середовищем.
9. Фармацевтична композиція, що застосовується для людей, у ветеринарії і/або для захисту рослин, що містить ефективну кількість сполуки формули І і/або її фармацевтично прийнятних солей, вказаних в одному з пп. 1-6, разом з фармацевтично прийнятним середовищем у комбінації з іншими фармакологічно активними інгредієнтами або лікарськими засобами.
10. Застосування сполуки формули І і/або її фармацевтично прийнятних солей, вказаних в одному з пп. 1-6, для одержання лікарського засобу для лікування або профілактики гострого або хронічного порушення, розладів або непрямих ускладнень органів і тканин, викликаних ішемією або реперфузією, для лікування або профілактики аритмії, небезпечної для життя фібриляції шлуночків серця, інфаркту міокарда, стенокардії, для лікування або профілактики ішемічних станів серця, ішемічних станів периферичної і центральної нервової системи або удару або ішемічних станів периферичних органів і тканин, для лікування або профілактики шокових станів, наприклад алергічного шоку, кардіогенного шоку, гіповолемічного шоку або бактеріального шоку, захворювань, в яких проліферація клітин являє собою первинну або вторинну причину раку, метастазу, гіпертрофії простати і гіперплазії простати, атеросклерозу або порушень ліпідного обміну, високого кров'яного тиску, зокрема ессенціальної гіпертензії, розладів центральної нервової системи, зокрема розладів, що виникають внаслідок підвищеної збудливості ЦНС, таких як епілепсія або конвульсії, що викликаються ЦНС, або розладів центральної нервової системи, зокрема тривожних станів, депресій або психозів, для лікування або профілактики інсуліннезалежного цукрового діабету (NIDDM) або ускладнень, викликаних діабетом, тромбозів, розладів, що виникають у результаті ендотеліальної дисфункції, переміжної кульгавості, для лікування або профілактики фіброзних захворювань внутрішніх органів, фіброзів печінки, фіброзів нирок, фіброзів судин, фіброзів легень і фіброзів серця, для лікування або профілактики серцевої недостатності або застійної серцевої недостатності, гострих або хронічних запальних розладів, розладів, викликаних найпростішими, малярії і кокцидіозу у домашньої птиці і для використання у хірургічних операціях і при трансплантації органів, для консервації і зберігання трансплантатів для хірургічних операцій, для запобігання обумовленій віком зміні тканин, для одержання лікарського засобу, направленого проти старіння, або для збільшення тривалості життя, для лікування і зниження кардіотоксичних дій при тиреотоксикозі або для одержання діагностичного допоміжного засобу.
11. Застосування сполуки формули І і/або її фармацевтично прийнятних солей, вказаних в одному з пп.1-6, у комбінації з іншими лікарськими засобами або активними інгредієнтами для одержання лікарського засобу, призначеного для лікування або профілактики гострого або хронічного порушення, розладів або непрямих ускладнень органів і тканин, викликаних ішемією або реперфузією, для лікування або профілактики аритмії, небезпечної для життя фібриляції шлуночків серця, інфаркту міокарда, стенокардії, для лікування або профілактики ішемічних станів серця, ішемічних станів периферичної і центральної нервової системи або удару або ішемічних станів периферичних органів і тканин, для лікування або профілактики шокових станів, наприклад алергічного шоку, кардіогенного шоку, гіповолемічного шоку або бактеріального шоку, захворювань, в яких проліферація клітин являє собою первинну або вторинну причину раку, метастазу, гіпертрофії простати і гіперплазії простати, атеросклерозу або порушень ліпідного обміну, високого кров'яного тиску, зокрема ессенціальної гіпертензії, розладів центральної нервової системи, зокрема розладів, що виникають внаслідок підвищеної збудливості ЦНС, таких як епілепсія або конвульсії, викликані ЦНС, або розладів центральної нервової системи, зокрема тривожних станів, депресій або психозів, для лікування або профілактики інсуліннезалежного цукрового діабету (NIDDM) або ускладнень, викликаних діабетом, тромбозів, розладів, що виникають у результаті ендотеліальної дисфункції, переміжної кульгавості, для лікування або профілактики фіброзних захворювань внутрішніх органів, фіброзів печінки, фіброзів нирок, фіброзів судин, фіброзів легень і фіброзів серця; для лікування або профілактики серцевої недостатності або застійної серцевої недостатності, гострих або хронічних запальних розладів, розладів, викликаних найпростішими, малярії і кокцидіозу у домашньої птиці і для використання у хірургічних операціях і при трансплантації органів, для консервації і зберігання трансплантатів для хірургічних операцій, для запобігання обумовленій віком зміні тканин, для одержання лікарського засобу, направленого проти старіння, або для збільшення тривалості життя, для лікування і зниження кардіотоксичних дій при тиреотоксикозі або для одержання діагностичного допоміжного засобу.
12. Застосування сполуки формули І і/або її фармацевтично прийнятних солей, вказаних в п.10, у комбінації з кардіотоксичними або цитотоксичними лікарськими засобами або активними інгредієнтами для одержання лікарського засобу зі зниженими кардіотоксичними і цитотоксичними властивостями.
13. Застосування сполуки формули І і/або її фармацевтично прийнятних солей окремо або у комбінації з іншими лікарськими засобами або активними інгредієнтами за п.10 або 11 для одержання лікарського засобу для лікування і/або профілактики гострого або хронічного порушення, розладів або непрямих ускладнень органів і тканин, викликаних ішемією або реперфузією.
14. Застосування сполуки формули І і/або її фармацевтично прийнятних солей окремо або у комбінації з іншими лікарськими засобами або активними інгредієнтами, вказаними в п.10 або 11, для одержання лікарського засобу для лікування небезпечної для життя фібриляції шлуночків серця.
15. Застосування сполуки формули І і/або її фармацевтично прийнятних солей окремо або у комбінації з іншими лікарськими засобами або активними інгредієнтами за п.10 або 11 для одержання лікарського засобу для лікування або профілактики метастазу.
16. Застосування сполуки формули І і/або її фармацевтично прийнятних солей окремо або у комбінації з іншими лікарськими засобами або активними інгредієнтами, вказаними в п.10 або 11 для одержання лікарського засобу для лікування або профілактики фіброзних захворювань серця, серцевої недостатності або застійної серцевої недостатності.
17. Застосування сполуки формули І або її фармацевтично прийнятних солей, вказаних в одному з пп.1-6, окремо або у комбінації з іншими лікарськими засобами або активними інгредієнтами для одержання лікарського засобу для лікування або профілактики захворювань, пов'язаних з NHE.
18. Застосування сполуки формули І і/або її фармацевтично прийнятних солей, вказаних в одному з пп.1-6, окремо або у комбінації з іншими лікарськими засобами або активними інгредієнтами для одержання лікарського засобу для лікування або профілактики захворювань, пов'язаних з NHE1.
19. Спосіб одержання сполук формули І, вказаних в одному з пп. 1-6, де R4 і R6 являють собою водень, який відрізняється тим, що
а) комплексний гідрид піддають взаємодії з фталімідом формули (II), Rl, R2 і R3 мають такі ж значення, як визначено у пп.1-6,
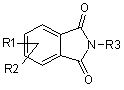 , (II)
, (II)
b) одержаний продукт потім піддають взаємодії з алкоксикарбонілметилентрифенілфосфораном у толуолі, або з триалкілфосфоноацетатом і основою;
c) одержаний продукт піддають взаємодії з гуанідинійхлоридом і основою або з гуанідином, наприклад, у спирті, що має 1, 2, 3 або 4 атоми вуглецю.
20. Спосіб одержання сполук формули І, вказаних в одному з пп. 1-6, де R4 і R6 являють собою водень, який відрізняється тим, що
а) сполуку формули III (R1 і R2 мають такі ж значення, як визначено у пп.1-6) піддають взаємодії з алкоксикарбонілметилентрифенілфосфораном у толуолі, або з триалкілфосфоноацетатом і основою
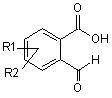 , (III)
, (III)
b) одержаний продукт піддають взаємодії з аміном формули R3NH2 (R3 має такі ж значення, як визначено в одному або більше з пп.1-6) і карбодіімідом;
c) одержаний продукт піддають взаємодії з гуанідинійхлоридом і основою,
або з гуанідином, наприклад, у спирті, що має 1, 2, 3 або 4 атоми вуглецю.
21. Спосіб одержання сполук формули І, вказаних в одному з пп.1-6, де R4 являє собою алкіл і R6 являє собою водень, який відрізняється тим, що
a) фталімід формули (II), як визначено у п. 19, піддають взаємодії з алкілмагнійгалогенідом або алкіллітієвим реагентом у простому ефірі;
b) одержаний продукт потім піддають взаємодії з алкоксикарбонілметилентрифенілфосфораном у толуолі або з 1-етокси-1-триметилсилоксіетиленом і кислотою Льюїса;
c) одержаний продукт піддають взаємодії з гуанідинійхлоридом і основою, або з гуанідином, наприклад у спирті, що має 1, 2, 3 або 4 атоми вуглецю.
22. Спосіб одержання сполук формули І, вказаних в одному з пп. 1-6, де R6 являє собою алкіл, який відрізняється тим, що
а) сполуку формули IV (R1-R5 мають такі ж значення, як визначено у пп.1-6) піддають взаємодії у присутності літійдіізопропіламіду з R6-Hal, де Hal являє собою F, Сl, Вr або І
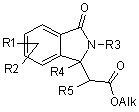 , (IV)
, (IV)
b) одержаний продукт піддають взаємодії з гуанідинійхлоридом і основою, або з гуанідином, наприклад у спирті, що має 1, 2, 3 або 4 атоми вуглецю.
Текст
1. Сполуки формули І O UA 2 (19) 1 C2 (54) ПОХІДНІ N-((3-ОКСО-2,3-ДИГІДРО-1Н-ІЗОІНДОЛ-1-ІЛ)АЦЕТИЛ)ГУАНІДИНУ ЯК ІНГІБІТОРИ NHE-1 ДЛЯ ЛІКУВАННЯ ІНФАРКТУ ТА СТЕНОКАРДІЇ 3 81118 4 Alk являє собою алкіл, що має 1, 2, 3, 4 або 5 атоми вуглецю, або поліфторалкокси, що має 1, 2 атомів вуглецю у лінійному або розгалуженому або 3 атоми вуглецю, ланцюгу, R1 і R2, самі по собі, необов'язково заміщені R8 являє собою водень, циклоалкіл, що має 3, 4, лінійним або розгалуженим алкілом, що має 1, 2, 3 5, 6, 7 або 8 атомів вуглецю, поліфторалкіл, що або 4 атоми вуглецю; має 1, 2, 3 або 4 атоми вуглецю, арил, гетероарил, R3 являє собою групу типу Alk-R8 або циклоалкіл, ОН, алкокси, що має 1, 2, 3 або 4 атоми вуглецю, що має 3, 4, 5, 6, 7 або 8 атомів вуглецю, СО2Н, CONH2, CONRaRb, NH2, алкіламіно, що має де циклоалкіл необов'язково заміщений одним або 1, 2, 3 або 4 атоми вуглецю, або NRаRb; більше замісниками, вибраними з групи, що R4, R5 і R6 незалежно один від одного являють складається з F або Сl, собою водень або лінійний або розгалужений Alk являє собою алкіл, що має 1, 2, 3, 4 або 5 алкіл, що має 1, 2, 3 або 4 атоми вуглецю; атомів вуглецю у лінійному або розгалуженому R7 являє собою лінійний або розгалужений алкіл, ланцюгу, що має 1, 2, 3 або 4 атоми вуглецю; R8 являє собою водень, циклоалкіл, що має 3, 4, Ra і Rb незалежно один від одного визначені як 5, 6, 7 або 8 атомів вуглецю, або поліфторалкіл, R7, або альтернативно Ra і Rb разом з атомом що має 1, 2, 3 або 4 атоми вуглецю; азоту, до якого вони приєднані, утворюють 5- або R4, R5 і R6 незалежно один від одного являють 6-членний гетероцикл, що необов'язково містить собою водень або лінійний або розгалужений інший гетероатом, вибраний з О, S або N; алкіл, що має 1, 2, 3 або 4 атоми вуглецю; і їх рацемічні суміші, енантіомери і і їх рацемічні суміші, енантіомери і діастереоізомери і їх суміші, їх таутомери та їх діастереоізомери і їх суміші, їх таутомери та їх фармацевтично прийнятні солі. фармацевтично прийнятні солі. 2. Сполуки формули І за п. 1, де 4. Сполука за одним або більше з пп.1-3, яка R1 і R2 незалежно один від одного являють собою відрізняється тим, що вона вибрана з групи, що водень, алкіл, що має 1, 2, 3 або 4 атоми вуглецю, включає: F, Сl, Br, I, NH2, алкіламіно, що має 1, 2, 3 або 4 N-[2-(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1атоми вуглецю, NRaRb, алкілкарбоніламіно, що іл)-2-метилпропіоніл]гуанідин, має 1, 2, 3 або 4 атоми вуглецю, ОН, алкокси, що N-[2-(2-циклопропілметил-3-оксо-2,3-дигідро-1Нмає 1, 2, 3 або 4 атоми вуглецю, СО2Н, ізоіндол-1-іл)-2-метилпропіоніл]гуанідин, алкоксикарбоніл, що має 1, 2, 3 або 4 атоми N-[(3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідро-1Нвуглецю, поліфторалкіл, що має 1, 2, 3 або 4 ізоіндол-1-іл)ацетил]гуанідин, атоми вуглецю, поліфторалкокси, що має 1, 2 або N-[(3-оксо-2-(4,4,4-трифторбутил)-2,3-дигідро-1Н3 атоми вуглецю, або SO3Н, ізоіндол-1-іл)ацетил]гуанідин, R1 і R2, самі по собі, необов'язково заміщені N-[(3-оксо-2,3-дигідро-1Н-ізоіндол-1лінійною або розгалуженою алкільною групою, що іл)ацетил]гуанідин, має 1, 2, 3 або 4 атоми вуглецю; N-[(2-ізобутил-7-метил-3-оксо-2,3-дигідро-1НR3 являє собою групу типу Alk-R8 або циклоалкіл, ізоіндол-1-іл)ацетил]гуанідин, що має 3, 4, 5, 6, 7 або 8 атомів вуглецю, N-[(4-аміно-2-ізобутил-3-оксо-2,3-дигідро-1Нде циклоалкіл необов'язково заміщений одним або ізоіндол-1-іл)ацетил]гуанідин, більше замісниками, вибраними з групи, що N-[(5-аміно-2-ізобутил-3-оксо-2,3-дигідро-1Нскладається з F, Сl або Br, ізоіндол-1-іл)ацетил]гуанідин, Alk являє собою алкіл, що має 1, 2, 3, 4 або 5 N-[(6-аміно-2-ізобутил-3-оксо-2,3-дигідро-1Натомів вуглецю у лінійному або розгалуженому ізоіндол-1-іл)ацетил]гуанідин, ланцюгу, N-[(7-аміно-2-ізобутил-3-оксо-2,3-дигідро-1НR8 являє собою водень, циклоалкіл, що має 3, 4, ізоіндол-1-іл)ацетил]гуанідин, 5, 6, 7 або 8 атомів вуглецю, поліфторалкіл, що N-[(4-гідроксі-2-ізобутил-3-оксо-2,3-дигідро-1Нмає 1, 2, 3 або 4 атоми вуглецю, арил або ізоіндол-1-іл)ацетил]гуанідин, гетероарил; N-[(5-гідроксі-2-ізобутил-3-оксо-2,3-дигідро-1НR4, R5 і R6 незалежно один від одного являють ізоіндол-1-іл)ацетил]гуанідин, собою водень або лінійний або розгалужений N-[(6-гідроксі-2-ізобутил-3-оксо-2,3-дигідро-1Налкіл, що має 1, 2, 3 або 4 атоми вуглецю; ізоіндол-1-іл)ацетил]гуанідин, Ra і Rb незалежно один від одного являють собою N-[(7-гідроксі-2-ізобутил-3-оксо-2,3-дигідро-1Нлінійний або розгалужений алкіл, що має 1, 2, 3 ізоіндол-1-іл)ацетил]гуанідин, або 4 атоми вуглецю, або Ra і Rb разом з атомом N-[(4,7-дихлор-2-ізобутил-3-оксо-2,3-дигідро-1Назоту, до якого вони приєднані, утворюють 5- або ізоіндол-1-іл)ацетил]гуанідин, 6-членний гетероцикл, що необов'язково містить N-[(4-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Нінший гетероатом, вибраний з О, S і N, ізоіндол-1-іл)ацетил]гуанідин, і їх рацемічні суміші, енантіомери і N-[(5-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Ндіастереоізомери і їх суміші, їх таутомери та їх ізоіндол-1-іл)ацетил]гуанідин, фармацевтично прийнятні солі. N-[(6-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Н3. Сполуки формули І за п.1 або 2, де ізоіндол-1-іл)ацетил]гуанідин, R1 і R2 незалежно один від одного являють собою N-[(4,5-дифтор-2-ізобутил-3-оксо-2,3-дигідро-1Нводень, алкіл, що має 1, 2, 3 або 4 атоми вуглецю, ізоіндол-1-іл)ацетил]гуанідин, F, Сl, Br, І, ОН, алкокси, що має 1, 2, 3 або 4 атоми N-[(6,7-дифтор-2-ізобутил-3-оксо-2,3-дигідро-1Нвуглецю, поліфторалкіл, що має 1, 2, 3 або 4 ізоіндол-1-іл)ацетил]гуанідин, 5 81118 6 N-[(4-карбоксі-2-ізобутил-3-оксо-2,3-дигідро-1HN-[(5-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(5-карбоксі-2-ізобутил-3-оксо-2,3-дигідро-1HN-[(6-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(6-карбоксі-2-ізобутил-3-оксо-2,3-дигідро-1HN-[(5,6-дихлор-2-ізобутил-3-оксо-2,3-дигідро-1Нізоіндол-1-іл)ацетил]гуанідин, ізоіндол-1-іл)ацетил]гуанідин, N-[(7-карбоксі-2-ізобутил-3-оксо-2,3-дигідро-1НN-[(7-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Нізоіндол-1-іл)ацетил]гуанідин, ізоіндол-1-іл)ацетил]гуанідин, N-[(2-ізобутил-1-метил-3-оксо-2,3-дигідро-1НN-[(4,7-дифтор-2-ізобутил-3-оксо-2,3-дигідро-1Нізоіндол-1-іл)ацетил]гуанідин, ізоіндол-1-іл)ацетил]гуанідин, і їх рацемічні суміші, енантіомери і N-[(5-бром-2-ізобутил-3-оксо-2,3-дигідро-1Ндіасїтереоізомери і їх суміші, їх таутомери та їх ізоіндол-1-іл)ацетил]гуанідин, фармацевтично прийнятні солі. N-[(6-бром-2-ізобутил-3-оксо-2,3-дигідро-1Н5. Сполука за одним або більше з пп. 1-3, яка ізоіндол-1-іл)ацетил]гуанідин, відрізняється тим, що вона N-[(2-ізобутил-3-оксо-5-трифторметил-2,3-дигідровибрана з групи, що включає: 1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(2-метил-3-оксо-2,3-дигідро-1Н-ізоіндол-1N-[(2-ізобутил-3-оксо-6-трифторметил-2,3-дигідроіл)ацетил]гуанідин, 1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(2-етил-3-оксо-2,3-дигідро-1Н-ізоіндол-1N-[(2-циклопропілметил-3-оксо-5-трифторметиліл)ацетил]гуанідин, 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(3-оксо-2-пропіл-2,3-дигідро-1Н-ізоіндол-1N-[(2-циклопропілметил-3-оксо-6-трифторметиліл)ацетил]гуанідин, 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[2-(3-оксо-2-пропіл-2,3-дигідро-1Н-ізоіндол-1N-[(3-оксо-2-(2,2,2-трифторетил)-6-трифторметиліл)пропіоніл]гуанідин, 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(2-ізопропіл-3-оксо-2,3-дигідро-1Н-ізоіндол-1N-[(3-оксо-2-(2,2,2-трифторетил)-5-трифторметиліл)ацетил]гуанідин, 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[2-(2-бутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1N-[(3-оксо-5-трифторметил-2-(3,3,3іл)пропіоніл]гуанідин, трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1N-[(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1іл)ацетил]гуанідин, іл)ацетил]гуанідин, N-[(3-оксо-6-трифторметил-2-(3,3,3N-[2-(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1іл)пропіоніл]гуанідин, іл)ацетил]гуанідин, N-[(2-циклопропілметил-3-оксо-2,3-дигідро-1НN-[(3-оксо-2-(4,4,4-трифторбутил)-5ізоіндол-1-іл)ацетил]гуанідин, трифторметил-2,3-дигідро-1Н-ізоіндол-1N-[(2-бензил-3-оксо-2,3-дигідро-1H-ізоіндол-1іл)ацетил]гуанідин, іл)ацетил]гуанідин, N-[(3-оксо-2-(4,4,4-трифторбутил)-6N-[(3-оксо-2-(2,2,2-трифторетил)-2,3-дигідро-1Hтрифторметил-2,3-дигідро-1Н-ізоіндол-1ізоіндол-1-іл)ацетил]гуанідин, іл)ацетил]гуанідин, N-[(2-ізобутил-4-метил-3-оксо-2,3-дигідро-1Н[1-(2-гуанідино-1-метил-2-оксоетил)-3-оксо-1,3ізоіндол-1-іл)ацетил]гуанідин, дигідроізоіндол-2-іл]оцтова кислота, N-[(2-ізобутил-5-метил-3-оксо-2,3-дигідро-1НN-{2-[3-оксо-2-(2-піролідин-1-ілетил)-2,3-дигідроізоіндол-1-іл)ацетил]гуанідин, 1Н-ізоіндол-1-іл]пропіоніл}гуанідин, N-[(2-ізобутил-6-метил-3-оксо-2,3-дигідро-1НN-[2-(2-гідроксіетил)-3-оксо-2,3-дигідро-1Нізоіндол-1-іл)ацетил]гуанідин, ізоіндол-1-іл)пропіоніл]гуанідин, N-[(5-трет-бутил-2-ізобутил-3-оксо-2,3-дигідро-1НN-{2-[6-метансульфоніл-3-оксо-2-(2,2,2ізоіндол-1-іл)ацетил]гуанідин, трифторетил)-2,3-дигідро-1Н-ізоіндол-1N-[(6-трет-бутил-2-ізобутил-3-оксо-2,3-дигідро-1Ніл]ацетил}гуанідин, ізоіндол-1-іл)ацетил]гуанідин, N-[2-(2-циклопропілметил-6-метансульфоніл-3N-[(2-ізобутил-5-ізопропоксі-3-оксо-2,3-дигідро-1Ноксо-2,3-дигідро-1Н-ізоіндол-1ізоіндол-1-іл)ацетил]гуанідин, іл)ацетил]гуанідиній, N-[(5-хлор-2-ізобутил-3-оксо-2,3-дигідро-1HN-{2-[5,6-дифтор-3-оксо-2-(3,3,3-трифторпропіл)ізоіндол-1-іл)ацетил]гуанідин, 2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, N-[(6-хлор-2-ізобутил-3-оксо-2,3-дигідро-1НN-{2-[5,6-дихлор-3-оксо-2-(3,3,3-трифторпропіл)ізоіндол-1-іл)ацетил]гуанідин, 2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, N-[(5-хлор-2-циклопропілметил-3-оксо-2,3-дигідроN-[2-(5,6-дихлор-2-циклопропілметил-3-оксо-2,31Н-ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(6-хлор-2-циклопропілметил-3-оксо-2,3-дигідроN-[2-(5,6-дихлор-2-циклопропіл-3-оксо-2,3-дигідро1H-ізоіндол-1-іл)ацетил]гуанідин, 1Н-ізоіндол-1-іл)ацетил] гуанідин, N-[(5-хлор-3-оксо-2-(2,2,2-трифторетил)-2,3N-{2-[5,6-дихлор-3-оксо-2-(2,2,2-трифторетил)-2,3дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, N-[(6-хлор-3-оксо-2-(2,2,2-трифторетил)-2,3N-{2-[5,6-дифтор-3-оксо-2-(2,2,2-трифторетил)-2,3дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, N-[(5-хлор-3-оксо-2-(3,3,3-трифторпропіл)-2,3і їх рацемічні суміші, енантіомери і дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, діастереоізомери, їх таутомери та їх N-[(6-хлор-3-оксо-2-(3,3,3-трифторпропіл)-2,3фармацевтично прийнятні солі. дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, 7 81118 8 6. Сполука за одним або більше з пп.1-3, яка (R)-N-{2-[3-оксо-5-трифторметил-2-(3,3,3відрізняється тим, що вона вибрана з групи, що трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1включає: іл]ацетил}гуанідин, (R)-N-{2-[6-метансульфоніл-3-оксо-2-(2,2,2(S)-N-{2-[3-оксо-5-трифторметил-2-(3,3,3трифторетил)-2,3-дигідро-1Н-ізоіндол-1трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1іл]ацетил}гуанідин, іл]ацетил}гуанідин, (S)-N-{2-[6-мeтaнcyльфoнiл-3-oкco-2-(2,2,2(R)-N-{2-[6-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3тpифтopeтил)-2,3-дигiдpo-1H-ізоіндол-1дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, іл]ацетил}гуанідин, (S)-N-{2-[6-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3(R)-N-[2-(2-циклопропілметил-3-оксо-6дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, трифторметил-2,3-дигідро-1Н-ізоіндол-1(R)-N-(2-[5-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, (S)-N-[2-(2-циклопропілметил-3-оксо-6(S)-N-{2-[5-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,3трифторметил-2,3-дигідро-1Н-ізоіндол-1дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, іл)ацетил]гуанідин, (R)-N-[2-(6-хлор-2-циклопропілметил-3-оксо-2,3(R)-N-{2-[5,6-дифтор-3-оксо-2-(3,3,3дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1(S)-N-[2-(6-хлор-2-циклопропілметил-3-оксо-2,3іл]ацетил}гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, (S)-N-{2-[5,6-дифтор-3-оксо-2-(3,3,3(R)-N-[2-(5-хлор-2-циклопропілметил-3-оксо-2,3трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1дигідро-1H-ізоіндол-1-іл)ацетил]гуанідин, іл]ацетил}гуанідин, (S)-N-[2-(5-хлор-2-циклопропілметил-3-оксо-2,3(R)-N-{2-[5,6-дихлор-3-оксо-2-(3,3,3дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1і їх фармацевтично прийнятні солі та таутомери. іл]ацетил}гуанідин, 7. Сполука формули І і/або її фармацевтично (S)-N-{2-[5,6-диxлop-3-oкco-2-(3,3,3прийнятні солі за одним або більше з пп.1-6 для тpифтopпpoпiл)-2,3-дигiдpo-1H-iзoiндoл-1застосування як лікарського засобу. іл]ацетил}гуанідин, 8. Фармацевтична композиція, що застосовується (R)-N-[2-(5,6-дихлор-2-циклопропілметил-3-оксодля людей, у ветеринарії і/або для захисту рослин, 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, що містить ефективну кількість сполуки формули І (S)-N-[2-(5,6-дихлор-2-циклопропілметил-3-оксоі/або її фармацевтично прийнятних солей, 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, вказаних в одному з пп. 1-6, разом з (R)-N-[2-(5,6-дихлор-2-циклопропіл-3-оксо-2,3фармацевтично прийнятним середовищем. дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, 9. Фармацевтична композиція, що застосовується (S)-N-[2-(5,6-дихлор-2-циклопропіл-3-оксо-2,3для людей, у ветеринарії і/або для захисту рослин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, що містить ефективну кількість сполуки формули І (R)-N-{2-[5,6-дихлор-3-оксо-2-(2,2,2-трифторетил)і/або її фармацевтично прийнятних солей, 2,3-дигідро-1Н-ізоіндол-]1-іл]ацетил}гуанідин, вказаних в одному з пп. 1-6, разом з (S)-N-{2-[5,6-дихлор-3-оксо-2-(2,2,2-трифторетил)фармацевтично прийнятним середовищем у 2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, комбінації з іншими фармакологічно активними (R)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6інгредієнтами або лікарськими засобами. трифторметил-2,3-дигідро-1Н-ізоіндол-110. Застосування сполуки формули І і/або її іл]ацетил}гуанідин, фармацевтично прийнятних солей, вказаних в (S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6одному з пп. 1-6, для одержання лікарського трифторметил-2,3-дигідро-1Н-ізоіндол-1засобу для лікування або профілактики гострого іл]ацетил}гуанідин, або хронічного порушення, розладів або непрямих (R)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-5ускладнень органів і тканин, викликаних ішемією трифторметил-2,3-дигідро-1Н-ізоіндол-1або реперфузією, для лікування або профілактики іл]ацетил}гуанідин, аритмії, небезпечної для життя фібриляції (S)-N-{2-[3-oкco-2-(2,2,2-тpифтopeтил)-5шлуночків серця, інфаркту міокарда, стенокардії, тpифтopмeтил-2,3-дигiдpo-1H-ізоіндол-1для лікування або профілактики ішемічних станів іл]ацетил}гуанідин, серця, ішемічних станів периферичної і (R)-N-[2-(6-хлор-3-оксо-2-(3,3,3-трифторпропіл)центральної нервової системи або удару або 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, ішемічних станів периферичних органів і тканин, (S)-N-[2-(6-хлор-3-оксо-2-(3,3,3-трифторпропіл)для лікування або профілактики шокових станів, 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, наприклад алергічного шоку, кардіогенного шоку, (R)-N[2-(5-хлор-3-оксо-2-(3,3,3-трифторпропіл)гіповолемічного шоку або бактеріального шоку, 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, захворювань, в яких проліферація клітин являє (S)-N-[2-(5-xлop-3-оксо-2-(3,3,3-трифторпропіл)собою первинну або вторинну причину раку, 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, метастазу, гіпертрофії простати і гіперплазії (R)-N-{2-[3-оксо-6-трифторметил-2-(3,3,3простати, атеросклерозу або порушень ліпідного трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1обміну, високого кров'яного тиску, зокрема іл]ацетил}гуанідин, ессенціальної гіпертензії, розладів центральної (S)-N-{2-[3-оксо-6-трифторметил-2-(3,3,3нервової системи, зокрема розладів, що трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1виникають внаслідок підвищеної збудливості ЦНС, іл]ацетил}гуанідин, таких як епілепсія або конвульсії, що викликаються ЦНС, або розладів центральної нервової системи, 9 81118 10 зокрема тривожних станів, депресій або психозів, домашньої птиці і для використання у хірургічних для лікування або профілактики операціях і при трансплантації органів, для інсуліннезалежного цукрового діабету (NIDDM) або консервації і зберігання трансплантатів для ускладнень, викликаних діабетом, тромбозів, хірургічних операцій, для запобігання обумовленій розладів, що виникають у результаті віком зміні тканин, для одержання лікарського ендотеліальної дисфункції, переміжної засобу, направленого проти старіння, або для кульгавості, для лікування або профілактики збільшення тривалості життя, для лікування і фіброзних захворювань внутрішніх органів, зниження кардіотоксичних дій при тиреотоксикозі фіброзів печінки, фіброзів нирок, фіброзів судин, або для одержання діагностичного допоміжного фіброзів легень і фіброзів серця, для лікування засобу. або профілактики серцевої недостатності або 12. Застосування сполуки формули І і/або її застійної серцевої недостатності, гострих або фармацевтично прийнятних солей, вказаних в хронічних запальних розладів, розладів, п.10, у комбінації з кардіотоксичними або викликаних найпростішими, малярії і кокцидіозу у цитотоксичними лікарськими засобами або домашньої птиці і для використання у хірургічних активними інгредієнтами для одержання операціях і при трансплантації органів, для лікарського засобу зі зниженими кардіотоксичними консервації і зберігання трансплантатів для і цитотоксичними властивостями. хірургічних операцій, для запобігання обумовленій 13. Застосування сполуки формули І і/або її віком зміні тканин, для одержання лікарського фармацевтично прийнятних солей окремо або у засобу, направленого проти старіння, або для комбінації з іншими лікарськими засобами або збільшення тривалості життя, для лікування і активними інгредієнтами за п.10 або 11 для зниження кардіотоксичних дій при тиреотоксикозі одержання лікарського засобу для лікування і/або або для одержання діагностичного допоміжного профілактики гострого або хронічного порушення, засобу. розладів або непрямих ускладнень органів і 11. Застосування сполуки формули І і/або її тканин, викликаних ішемією або реперфузією. фармацевтично прийнятних солей, вказаних в 14. Застосування сполуки формули І і/або її одному з пп.1-6, у комбінації з іншими лікарськими фармацевтично прийнятних солей окремо або у засобами або активними інгредієнтами для комбінації з іншими лікарськими засобами або одержання лікарського засобу, призначеного для активними інгредієнтами, вказаними в п.10 або 11, лікування або профілактики гострого або для одержання лікарського засобу для лікування хронічного порушення, розладів або непрямих небезпечної для життя фібриляції шлуночків ускладнень органів і тканин, викликаних ішемією серця. або реперфузією, для лікування або профілактики 15. Застосування сполуки формули І і/або її аритмії, небезпечної для життя фібриляції фармацевтично прийнятних солей окремо або у шлуночків серця, інфаркту міокарда, стенокардії, комбінації з іншими лікарськими засобами або для лікування або профілактики ішемічних станів активними інгредієнтами за п.10 або 11 для серця, ішемічних станів периферичної і одержання лікарського засобу для лікування або центральної нервової системи або удару або профілактики метастазу. ішемічних станів периферичних органів і тканин, 16. Застосування сполуки формули І і/або її для лікування або профілактики шокових станів, фармацевтично прийнятних солей окремо або у наприклад алергічного шоку, кардіогенного шоку, комбінації з іншими лікарськими засобами або гіповолемічного шоку або бактеріального шоку, активними інгредієнтами, вказаними в п.10 або 11 захворювань, в яких проліферація клітин являє для одержання лікарського засобу для лікування собою первинну або вторинну причину раку, або профілактики фіброзних захворювань серця, метастазу, гіпертрофії простати і гіперплазії серцевої недостатності або застійної серцевої простати, атеросклерозу або порушень ліпідного недостатності. обміну, високого кров'яного тиску, зокрема 17. Застосування сполуки формули І або її ессенціальної гіпертензії, розладів центральної фармацевтично прийнятних солей, вказаних в нервової системи, зокрема розладів, що одному з пп.1-6, окремо або у комбінації з іншими виникають внаслідок підвищеної збудливості ЦНС, лікарськими засобами або активними таких як епілепсія або конвульсії, викликані ЦНС, інгредієнтами для одержання лікарського засобу або розладів центральної нервової системи, для лікування або профілактики захворювань, зокрема тривожних станів, депресій або психозів, пов'язаних з NHE. для лікування або профілактики 18. Застосування сполуки формули І і/або її інсуліннезалежного цукрового діабету (NIDDM) або фармацевтично прийнятних солей, вказаних в ускладнень, викликаних діабетом, тромбозів, одному з пп.1-6, окремо або у комбінації з іншими розладів, що виникають у результаті лікарськими засобами або активними ендотеліальної дисфункції, переміжної інгредієнтами для одержання лікарського засобу кульгавості, для лікування або профілактики для лікування або профілактики захворювань, фіброзних захворювань внутрішніх органів, пов'язаних з NHE1. фіброзів печінки, фіброзів нирок, фіброзів судин, 19. Спосіб одержання сполук формули І, вказаних фіброзів легень і фіброзів серця; для лікування в одному з пп. 1-6, де R4 і R6 являють собою або профілактики серцевої недостатності або водень, який відрізняється тим, що застійної серцевої недостатності, гострих або а) комплексний гідрид піддають взаємодії з хронічних запальних розладів, розладів, фталімідом формули (II), Rl, R2 і R3 мають такі ж викликаних найпростішими, малярії і кокцидіозу у значення, як визначено у пп.1-6, 11 81118 12 або з гуанідином, наприклад, у спирті, що має 1, 2, O 3 або 4 атоми вуглецю. 21. Спосіб одержання сполук формули І, вказаних R1 N R3 в одному з пп.1-6, де R4 являє собою алкіл і R6 являє собою водень, який відрізняється тим, що R2 a) фталімід формули (II), як визначено у п. 19, O , (II) піддають взаємодії з алкілмагнійгалогенідом або b) одержаний продукт потім піддають взаємодії з алкіллітієвим реагентом у простому ефірі; алкоксикарбонілметилентрифенілфосфораном у b) одержаний продукт потім піддають взаємодії з толуолі, або з триалкілфосфоноацетатом і алкоксикарбонілметилентрифенілфосфораном у основою; толуолі або з 1-етокси-1-триметилсилоксіетиленом c) одержаний продукт піддають взаємодії з і кислотою Льюїса; гуанідинійхлоридом і основою або з гуанідином, c) одержаний продукт піддають взаємодії з наприклад, у спирті, що має 1, 2, 3 або 4 атоми гуанідинійхлоридом і основою, або з гуанідином, вуглецю. наприклад у спирті, що має 1, 2, 3 або 4 атоми 20. Спосіб одержання сполук формули І, вказаних вуглецю. в одному з пп. 1-6, де R4 і R6 являють собою 22. Спосіб одержання сполук формули І, вказаних водень, який відрізняється тим, що в одному з пп. 1-6, де R6 являє собою алкіл, який а) сполуку формули III (R1 і R2 мають такі ж відрізняється тим, що значення, як визначено у пп.1-6) піддають а) сполуку формули IV (R1-R5 мають такі ж взаємодії з значення, як визначено у пп.1-6) піддають алкоксикарбонілметилентрифенілфосфораном у взаємодії у присутності літійдіізопропіламіду з R6толуолі, або з триалкілфосфоноацетатом і Hal, де Hal являє собою F, Сl, Вr або І основою O O OH R1 H R2 O R1 R2 N R3 R4 O R5 , (III) b) одержаний продукт піддають взаємодії з аміном формули R3NH2 (R3 має такі ж значення, як визначено в одному або більше з пп.1-6) і карбодіімідом; c) одержаний продукт піддають взаємодії з гуанідинійхлоридом і основою, OAlk , (IV) b) одержаний продукт піддають взаємодії з гуанідинійхлоридом і основою, або з гуанідином, наприклад у спирті, що має 1, 2, 3 або 4 атоми вуглецю. Даний винахід відноситься до нових сполук ізоіндолону формули І R1 і R2 незалежно один від одного являють собою водень, алкіл, що має 1,2, 3 або 4 атоми вуглецю, алкеніл, що має 2, 3, 4, 5 або 6 атомів вуглецю, алкініл, що має 2, 3, 4, 5 або 6 атомів вуглецю, арил, гетероарил, F, СІ, Br, I, NO2, NH2, алкіламіно, що має 1, 2, 3 або 4 атоми вуглецю, NRaRb, алкілкарбоніламіно, що має 1, 2, 3 або 4 атоми вуглецю, ОН, алкокси, що має 1, 2, 3 або 4 атоми вуглецю, S(O)nR7, СО2Н, алкоксикарбоніл, що має 1, 2, 3 або 4 атоми вуглецю, алкілкарбоніл, що має 1, 2, 3 або 4 атоми вуглецю, CONH2, CONRaRb, CN, поліфторалкіл, що має 1, 2, 3 або 4 атоми вуглецю, поліфторалкокси, що має 1, 2 або 3 атоми вуглецю, або SO3H; R1 і R2, самі по собі, необов'язково заміщені лінійною або розгалуженою алкільною групою, що має 1, 2, 3 або 4 атоми вуглецю; n дорівнює 0, 1 або 2; R3 являє собою водень, арил, гетероарил, групу типу Alk-R8 або циклоалкіл, що має 3, 4, 5, 6, 7 або 8 атомів вуглецю, де циклоалкіл необов'язково заміщений одним або більше замісниками, вибраними з групи, що складається з F, СІ, Br або І, Запропоновані сполуки є придатними як протиаритмічні лікарські засоби з кардіозахисним компонентом для профілактики інфаркту та лікування інфаркту і для лікування стенокардії. Вони також інгібують превентивним способом патофізіологічні процеси, пов'язані з розвитком порушень, викликаних ішемією, зокрема, виникнення викликаної ішемією серцевої аритмії і серцевої недостатності. Даний винахід відноситься до сполук формули І, в якій: 13 81118 14 Alk являє собою алкіл, що має 1, 2, 3, 4 або 5 Особлива перевага віддана сполукам атомів вуглецю у лінійному або розгалуженому формули І, в яких значення є наступними: ланцюгу, R1 і R2 незалежно один від одного являють R8 являє собою водень, циклоалкіл, що має 3, собою водень, алкіл, що має 1, 2, 3 або 4 атоми 4, 5, 6, 7 або 8 атомів вуглецю, поліфторалкіл, що вуглецю, F, СІ, Br, І, ОН, алкокси, що має 1, 2, 3 має 1, 2, 3 або 4 атоми вуглецю, арил, гетероарил, або 4 атоми вуглецю, поліфторалкіл, що має 1, 2, ОН, алкокси, що має 1, 2, 3 або 4 атоми вуглецю, 3 або 4 атоми вуглецю, або поліфторалкокси, що СО2Н, CONH2, CONRaRb, NH2, алкіламіно, що має має 1, 2 або 3 атоми вуглецю, R1 і R2, самі по собі, 1, 2, 3 або 4 атоми вуглецю або NRaRb; необов'язково заміщені лінійним або R4, R5 і R6 незалежно один від одного розгалуженим алкілом, що має 1, 2, 3 або 4 атоми являють собою водень або лінійний або вуглецю; розгалужений алкіл, що має 1, 2, 3 або 4 атоми R3 являє собою групу типу Alk-R8 або вуглецю; циклоалкіл, що має 3, 4, 5, 6, 7 або 8 атомів R7 являє собою лінійний або розгалужений вуглецю, алкіл, що має 1, 2, 3 або 4 атоми вуглецю; де циклоалкіл необов'язково заміщений одним Ra і Rb незалежно один від одного являють або більше замісниками, вибраними з групи, що собою лінійний або розгалужений алкіл, що має 1, складається з F або СІ, 2, 3 або 4 атоми вуглецю, або альтернативно Ra і Alk являє собою алкіл, що має 1, 2, 3, 4 або 5 Rb разом з атомом азоту, до якого вони приєднані, атомів вуглецю у лінійному або розгалуженому утворюють 5- або 6-членний гетероцикл, що ланцюгу, необов'язково містить інший гетероатом, вибраний R8 являє собою водень, циклоалкіл, що має 3, з О, S або N; 4, 5, 6, 7 або 8 атомів вуглецю, або поліфторалкіл, і їх рацемічних сумішей, енантіомерів і що має 1, 2, 3 або 4 атоми вуглецю; діастереоізомерів та їх сумішей, їх таутомерів і їх R4, R5 і R6 незалежно один від одного фармацевтично прийнятних солей. являють собою водень або лінійний або Перевага віддана сполукам формули І, в яких розгалужений алкіл, що має 1, 2, 3 або 4 атоми значення є наступними: вуглецю; R1 і R2 незалежно один від одного являють і їх рацемічним сумішам, енантіомерам і собою водень, алкіл, що має 1, 2, 3 або 4 атоми діастереоізомерам і їх сумішам, їх таутомерам та вуглецю, F, СІ, Br, I, NH2, алкіламіно, що має 1, 2, 3 їх фармацевтично прийнятним солям. або 4 атоми вуглецю, NRaRb, алкілкарбоніламіно, В одному варіанті сполуки формули І є такими, що має 1, 2, 3 або 4 атоми вуглецю, ОН, алкокси, як визначено вище, і R3 являє собою атом водню, що має 1, 2, 3 або 4 атоми вуглецю, СО2Н, арильну або гетероарильну групу або ланцюг типу алкоксикарбоніл, що має 1, 2, 3 або 4 атоми Alk-R8, де Alk являє собою ланцюг, що вуглецю, поліфторалкіл, що має 1, 2, 3 або 4 складається з 1-5 атомів вуглецю у лінійному або атоми вуглецю, поліфторалкокси, що має 1, 2 або розгалуженому ланцюгу, і R8 являє собою атом 3 атоми вуглецю, або SO3H; водню, (С3-С6)циклоалкільну групу, (С1R1 і R2, самі по собі, необов'язково заміщені С4)поліфторалкільну групу, арильну групу, лінійною або розгалуженою алкільною групою, що гетероарильну групу, гідроксильну групу, (С1має 1, 2, 3 або 4 атоми вуглецю; С4)алкоксигрупу, карбоксильну групу, R3 являє собою групу типу Alk-R8 або карбоксамідну групу, аміногрупу, (С1циклоалкіл, що має 3, 4, 5, 6, 7 або 8 атомів С4)алкіламіногрупу або групу NRaRb. вуглецю, В одному варіанті сполуки формули І є такими, де циклоалкіл необов'язково заміщений одним як визначено вище, і R4 являє собою атом водню. або більше замісниками, вибраними з групи, що В іншому варіанті R5 являє собою атом водню. складається з F, СІ або Br, Окрема перевага віддана сполукам формули І, Alk являє собою алкіл, що має 1, 2, 3, 4 або 5 які відрізняються тим, що вони вибрані з групи, що атомів вуглецю у лінійному або розгалуженому включає: ланцюгу, N-[2-(2-ізобутил-3-оксо-2,3-дигідро-1НR8 являє собою водень, циклоалкіл, що має 3, ізоіндол-1-іл)-2-метилпропіоніл]гуанідин, 4, 5, 6, 7 або 8 атомів вуглецю, поліфторалкіл, що N-[2-(2-циклопропілметил-3-оксо-2,3-дигідромає 1, 2, 3 або 4 атоми вуглецю, арил або 1Н-ізоіндол-1-іл)-2-метилпропіоніл]гуанідин, гетероарил; N-[(3-оксо-2-(3,3,3-трифторпропіл)-2,3-дигідроR4, R5 і R6 незалежно один від одного 1Н-ізоіндол-1-іл)ацетил]гуанідин, являють собою водень або лінійний або N-[(оксо-2-(4,4,4-трифторбутил)-2,3-дигідророзгалужений алкіл, що має 1, 2, 3 або 4 атоми 1Н-ізоіндол-1-іл)ацетил]гуанідин, вуглецю; N-[(3-оксо-2,3-дигідро-1Н-ізоіндол-1Ra і Rb незалежно один від одного являють іл)ацетил]гуанідин, собою лінійний або розгалужений алкіл, що має 1, N-[(2-ізобутил-7-метил-3-оксо-2,3-дигідро-1Н2, 3 або 4 атоми вуглецю, або Ra і Rb разом з ізоіндол-1-іл)ацетил]гуанідин, атомом азоту, до якого вони приєднані, утворюють N-[(4-аміно-2-ізобутил-3-оксо-2,3-дигідро-1Н5- або 6-членний гетероцикл, що необов'язково ізоіндол-1-іл)ацетил]гуанідин, містить інший гетероатом, вибраний з О, S і N, N-[(5-аміно-2-ізобутил-3-оксо-2,3-дигідро-1Ні їх рацемічним сумішам, енантіомерам і ізоіндол-1-іл)ацетил]гуанідин, діастереоізомерам і їх сумішам, їх таутомерам та N-[(6-аміно-2-ізобутил-3-оксо-2,3-дигідро-1Нїх фармацевтично прийнятним солям. ізоіндол-1-іл)ацетил]гуанідин, 15 81118 16 N-[(7-аміно-2-ізобутил-3-оксо-2,3-дигідро-1НN-[(5-трет-бутил-2-ізобутил-3-оксо-2,3-дигідроізоіндол-1-іл)ацетил]гуанідин, 1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(4-гідрокси-2-ізобутил-3-оксо-2,3-дигідроN-[(6-трет-бутил-2-ізобутил-3-оксо-2,3-дигідро1Н-ізоіндол-1-іл)ацетил]гуанідин, 1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(5-гідрокси-2-ізобутил-3-оксо-2,3-дигідроN-[(2-ізобутил-5-ізопропокси-3-оксо-2,31Н-ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(6-гідрокси-2-ізобутил-3-оксо-2,3-дигідроN-[(5-хлор-2-ізобутил-3-оксо-2,3-дигідро-1Н1Н-ізоіндол-1-іл)ацетил]гуанідин, ізоіндол-1-іл)ацетил]гуанідин, N-[(7-гідрокси-2-ізобутил-3-оксо-2,3-дигідроN-[(6-xлop-2-iзoбyтил-3-oкco-2,3-дигiдpo-1H1Н-ізоіндол-1-іл)ацетил]гуанідин, iзoiндoл-1-iл)aцeтил]гyaнiдин, N [(4,7-дихлор-2-ізобутил-3-оксо-2,3-дигідроN-[(5-хлор-2-циклопропілметил-3-оксо-2,31Н-ізоіндол-1-іл)ацетил] гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(4-фтор-2-ізобутил-3-оксо-2,3-дигідро-1НN-[(6-хлор-2-циклопропілметил-3-оксо-2,3ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(5-фтор-2-ізобутил-3-оксо-2,3-дигідро-1НN-[(5-хлор-3-оксо-2-(2,2,2-трифторетил)-2,3ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(6-фтор-2-ізобутил-3-оксо-2,3-дигідро-1НN-[(6-хлор-3-оксо-2-(2,2,2-трифторетил)-2,3ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(4,5-дифтор-2-ізобутил-3-оксо-2,3-дигідроN-[(5-хлор-3-оксо-2-(3,3,3-трифторпропіл)-2,31Н-ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(6,7-дифтор-2-ізобутил-3-оксо-2,3-дигідроN-[(6-хлор-3-оксо-2-(3,3,3-трифторпропіл)-2,31Н-ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(4-карбокси-2-ізобутил-3-оксо-2,3-дигідроN-[(5-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,31Н-ізоіндол-1-іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(5-карбокси-2-ізобутил-3-оксо-2,3-дигідроN-[(6-хлор-3-оксо-2-(4,4,4-трифторбутил)-2,31Н-ізоіндол-1-іл)ацетил] гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(6-карбокси-2-ізобутил-3-оксо-2,3-дигідроN-[(5,6-дихлор-2-ізобутил-З-оксо-2,3-дигідро1Н-ізоіндол-1-іл)ацетил]гуанідин, 1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(7-карбокси-2-ізобутил-3-оксо-2,3-дигідроN-[(7-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Н1Н-ізоіндол-1-іл)ацетил]гуанідин, ізоіндол-1-іл)ацетил]гуанідин, N-[(2-ізобутил-1-метил-3-оксо-2,3-дигідро-1НN-[(4,7-дифтop-2-iзoбyтил-3-oкco-2,3-дигiдpoізоіндол-1-іл)ацетил]гуанідин, 1H-iзoiндoл-1-іл)ацетил]гуанідин, і їх рацемічні суміші, енантіомери, N-[(5-бром-2-ізобутил-3-оксо-2,3-дигідро-1Ндіастереоізомери і їх суміші, їх таутомери та їх ізоіндол-1-іл)ацетил]гуанідин, фармацевтично прийнятні солі. N-[(6-бром-2-ізобутил-3-оксо-2,3-дигідро-1НІнша перевага віддана сполукам формули І, які ізоіндол-1-іл)ацетил]гуанідин, відрізняються тим, що вони вибрані з групи, яка N-[(2-ізобутил-3-оксо-5-трифторметил-2,3включає: дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(2-метил-3-оксо-2,3-дигідро-1Н-ізоіндол-1N-[(2-ізобутил-3-оксо-6-трифторметил-2,3іл)ацетил]гуанідин, дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, N-[(2-етил-3-оксо-2,3-дигідро-1Н-ізоіндол-1N-[(2-циклопропілметил-3-оксо-5іл)ацетил]гуанідин, трифторметил-2,3-дигідро-1Н-ізоіндол-1N-[(3-оксо-2-пропіл-2,3-дигідро-1Н-ізоіндол-1іл)ацетил]гуанідин, іл)ацетил]гуанідин, N-[(2-циклопропілметил-3-оксо-6N-[2-(3-оксо-2-пропіл-2,3-дигідро-1Н-ізоіндолтрифторметил-2,3-дигідро-1Н-ізоіндол-11-іл)пропіоніл]гуанідин, іл)ацетил]гуанідин, N-[(2-ізопропіл-3-оксо-2,3-дигідро-1Н-ізоіндолN-[(3-оксо-2-(2,2,2-трифторетил)-61-іл)ацетил]гуанідин, трифторметил-2,3-дигідро-1Н-ізоіндол-1N-[2-(2-бутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1іл)ацетил]гуанідин, іл)пропіоніл]гуанідин, N-[(3-оксо-2-(2,2,2-трифторетил)-5N-[(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндолтрифторметил-2,3-дигідро-1Н-ізоіндол-11-іл)ацетил]гуанідин„ іл)ацетил]гуанідин, N-[2-(2-ізобутил-3-оксо-2,3-дигідро-1НN-[(3-оксо-5-трифторметил-2-(3,3,3ізоіндол-1-іл)пропіоніл]гуанідин, трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1N-[(2-циклопропілметил-3-оксо-2,3-дигідро-1Ніл)ацетил]гуанідин, ізоіндол-1-іл)ацетил]гуанідин, N-[(3-оксо-6-трифторметил-2-(3,3,3N-[(2-бензил-3-оксо-2,3-дигідро-1Н-ізоіндол-1трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1іл)ацетил]гуанідин, іл)ацетил]гуанідин, N-[(3-оксо-2-(2,2,2-трифторетил)-2,3-дигідроN-[(3-оксо-2-(4,4,4-трифторбутил)-51Н-ізoiндол-1-іл)ацетил]гуанідин, трифторметил-2,3-дигідро-1Н-ізоіндол-1N-[(2-ізобутил-4-метил-3-оксо-2,3-дигідро-1Ніл)ацетил]гуанідин, ізоіндол-1-іл)ацетил]гуанідин, N-[(3-оксо-2-(4,4,4-трифторбутил)-6N-[(2-ізобутил-5-метил-3-оксо-2,3-дигідро-1Нтрифторметил-2,3-дигідро-1Н-ізоіндол-1ізоіндол-1-іл)ацетил]гуанідин, іл)ацетил]гуанідин, N-[(2-ізобутил-6-метил-3-оксо-2,3-дигідро-1Н[1-(2-гуанідино-1-метил-2-оксоетил)-3-оксо-1,3ізоіндол-1-іл)ацетил]гуанідин, дигідроізоіндол-2-іл]оцтова кислота, 17 81118 18 N-{2-[3-оксо-2-(2-піролідин-1-ілетил)-2,3(S)-N-{2-[5,6-дихлор-3-оксо-2-(2,2,2дигідро-1Н-ізоіндол-1-іл]пропіоніл}гуанідин, трифторетил)-2,3-дигідро-1Н-ізоіндол-1N-[2-(2-гідроксіетил)-3-оксо-2,3-дигідро-1Ніл]ацетил}гуанідин, ізоіндол-1-іл)пропіоніл]гуанідин, (R)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6N-{2-[6-метансульфоніл-3-оксо-2-(2,2,2трифторметил-2,3-дигідро-1Н-ізоіндол-1трифторетил)-2,3-дигідро-1Н-ізоіндол-1іл]ацетил}гуанідин, іл]ацетил}гуанідин, (S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-6N-[2-(2-циклопропілметил-6-метансульфонілтрифторметил-2,3-дигідро-1Н-ізоіндол-13-оксо-2,3-дигідро-1Н-ізоіндол-1іл]ацетил}гуанідин, іл)ацетил]гуанідиній, (R)-N-{2-[3-oкco-2-(2,2,2-тpифтopeтил)-5N-{2-[5,6-дифтор-3-оксо-2-(3,3,3тpифтopмeтил-2,3-дигiдpo-1H-ізоіндол-1трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1іл]ацетил}гуанідин, іл]ацетил}гуанідин, (S)-N-{2-[3-оксо-2-(2,2,2-трифторетил)-5N-{2-[5,6-дихлор-3-оксо-2-(3,3,3трифторметил-2,3-дигідро-1Н-ізоіндол-1трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1іл]ацетил}гуанідин, іл]ацетил}гуанідин, (R)-N-[2-(6-xлop-3-oкco-2-(3,3,3N-[2-(5,6-дихлор-2-циклопропілметил-3-оксотpифтopпpoпiл)-2,3-дигiдpo-1Н-iзoiндoл-12,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, іл)ацетил]гуанідин, N-[2-(5,6-дихлор-2-циклопропіл-3-оксо-2,3(S)-N-[2-(6-хлор-3-оксо-2-(3,3,3дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1N-{2-[5,6-дихлор-3-оксо-2-(2,2,2-трифторетил)іл)ацетил]гуанідин, 2,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, (R)-N-[2-(5-xлop-3-oкco-2-(3,3,3N-{2-[5,6-дифтор-3-оксо-2-(2,2,2-трифторетил)тpифтopпpoпiл)-2,3-дигiдpo-1H-iзoiндoл-12,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, іл)ацетил]гуанідин, і їх рацемічні суміші, енантіомери і (S)-N-[2-(5-хлор-3-оксо-2-(3,3,3діастереоізомери, їх таутомери та їх трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1фармацевтично прийнятні солі. іл)ацетил]гуанідин, Ще одна інша перевага віддана сполукам (R)-N-{2-[3-oкco-6-тpифтopмeтил-2-(3,3,3формули І, які відрізняються тим, що вони вибрані тpифтopпpoпiл)-2,3-дигiдpo-1H-ізоіндол-1з групи, яка включає: іл]ацетил}гуанідин, (R)-N-{2-[6-метансульфоніл-3-оксо-2-(2,2,2(S)-N-{2-[3-оксо-6-трифторметил-2-(3,3,3трифторетил)-2,3-дигідро-1Н-ізоіндол-1трифторпропіл)-2,3-дигідро-1Н-лзоіндол-1іл]ацетил}гуанідин, іл]ацетил}гуанідин, (S)-N-{2-[6-метансульфоніл-3-оксо-2-(2,2,2(R)-N-{2-[3-oкco-5-тpифтopмeтил-2-(3,3,3трифторетил)-2,3-дигідро-1Н-ізоіндол-1тpифтopпpoпiл)-2,3-дигiдpo-1H-ізоіндол-1-іл] іл]ацетил}гуанідин, ацетил}гуанідин, (R)-N-[2-(2-циклопропілметил-3-оксо-6(S)-N-{2-[3-оксо-5-трифторметил-2-(3,3,3трифторметил-2,3-дигідро-1Н-ізоіндол-1трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1іл)ацетил]гуанідин, іл]ацетил}гуанідин, (S)-N-[2-(2-циклопропілметил-3-оксо-6(R)-N-{2-[6-хлор-3-оксо-2-(4,4,4трифторметил-2,3-дигідро-1Н-ізоіндол-1трифторбутил)-2,3-дигідро-1Н-ізоіндол-1іл)ацетил]гуанідин, іл]ацетил}гуанідин, (R)-N-{2-[5,6-дифтор-3-оксо-2-(3,3,3(S)-N-{2-[6-хлор-3-оксо-2-(4,4,4-трифторбутил)трифторпропіл)-2,3-дигідро-1Н-ізоіндол-12,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, іл]ацетил}гуанідин, (R)-N-{2-[5-xлop-3-oкco-2-(4,4,4(S)-N-{2-[5,6-дифтор-3-оксо-2-(3,3,3тpифтopбyтил)-2,3-дигiдpo-1H-iзoiндoл-1трифторпропіл)-2,3-дигідро-1Н-ізоіндол-1іл]ацетил}гуанідин, іл]ацетил}гуанідин, (S)-N-{2-[5-хлор-3-оксо-2-(4,4,4-трифторбутил)(R)-N-{2-[5,6-дихлор-3-оксо-2-(3,3,32,3-дигідро-1Н-ізоіндол-1-іл]ацетил}гуанідин, трифторіфопіл)-2,3-дигідро-1Н-ізоіндол-1(R)-N-[2-(6-хлор-2-циклопропілметил-3-оксоіл]ацетил}гуанідин, 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, (S)-N-{2-[5,6-дихлор-3-оксо-2-(3,3,3(S)-N-[2-(6-хлор-2-циклопропілметил-3-оксотрифторпропіл)-2,3-дигідро-1Н-ізоіндол-12,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, іл]ацетил}гуанідин, (R)-N-[2-(5-хлор-2-циклопропілметил-3-оксо(R)-N-[2-(5,6-диxлop-2-циклoпpoпiлмeтил-32,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, oкco-2,3-дигiдpo-1H-iзoiндoл-1-іл)ацетил]гуанідин, (S)-N-[2-(5-хлор-2-циклопропілметил-3-оксо(S)-N-[2-(5,6-дихлор-2-циклопропілметил-32,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, і їх фармацевтично прийнятні солі і таутомери. (R)-N-[2-(5,6-дихлор-2-циклопропіл-3-оксо-2,3Якщо сполуки винаходу містять один або дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, більше асиметричних центрів, вони незалежно (S)-N-[2-(5,6-дихлор-2-циклопропіл-3-оксо-2,3одна від одної можуть мати S- і R-конфігурацію. дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин, Сполуки можуть бути у формі оптичних ізомерів, (R)-N-{2-[5,6-диxлop-3-oкco-2-(2,2,2діастереоізомерів, рацематів або їх сумішей у тpифтopeтил)-2,3-дигiдpo-1H-iзoiндoл-1будь-якому співвідношенні. іл]ацетил}гуанідин, Даний винахід включає всі таутомерні форми сполук формули І. 19 81118 20 Алкільні радикали можуть являти собою тетразоліл і триазоліл. Заміщені гетероарильні прямий або розгалужений ланцюг. Вказане радикали можуть бути заміщені у будь-яких відноситься і до тих випадків, якщо вони мають положеннях. замісники або зустрічаються як замісники інших Сполуки формули І інгібують клітинний радикалів, наприклад в алкіламіно, антипорт натрій-протон (Na+/H+-обмін, NHE), алкілкарбоніламіно, алкокси, зокрема, вони інгібують підтип NHE1. Внаслідок алкоксикарбонільному, алкілкарбонільному, інгібуючих властивостей у відношенні ΝΉΕ, поліфторалкільному або сполуки формули І і/або їх фармацевтично поліфторалкоксирадикалах. Приклади алкільних прийнятні солі є придатними для профілактики і радикалів включають метил, етил, н-пропіл, лікування захворювань, викликаних активацією ізопропіл (=1-метилетил), н-бутил, ізобутил (=2NHE або активованих NHE, і захворювань, метилпропіл), втор-бутил (=1-метилпропіл), третвикликаних повторно порушенням, пов'язаним з бутил (=1,1-диметилетил) або пентил. Переважні NHE. алкільні радикали являють собою метил, етил, нОскільки інгібітори NHE переважно діють пропіл, ізопропіл, трет-бутил та ізобутил. Один або через їх вплив на регуляцію клітинного рН, вони більше, наприклад 1, 2, 3, 4, 5, 6, 7, 8 або 9 атомів можуть бути звичайно вигідно об'єднані з іншими водню в алкільних радикалах можуть бути сполуками, які регулюють внутрішньоклітинний рН, заміщені атомами фтору з утворенням при цьому придатні для комбінації партнери поліфторалкільних радикалів. Приклади таких являють собою інгібітори ферментної групи радикалів включають дифторметил, карбонат-дегідратази, інгібітори систем, що трифторметил, пентафторетил, 2,2,2переносять бікарбонат-іони, таких як трифторетил; 3,3,3-трифторпропіл; 3,3,3котранспортер бікарбонату натрію (NBC) або трифторбутил, 4,4,4-трифторбутил. натрійзалежного обміну хлорид-бікарбонат Поліфторалкоксирадикали являють собою (NCBE), та інгібітори NHE з інгібуючою дією алкоксирадикали, що містять 1-3 атоми вуглецю, відносно інших підтипів NHE, тому що через них заміщені 1, 2, 3, 4, 5, 6 або 7 атомами фтору, можна посилити або модулювати фармакологічно зокрема, трифторметокси. релевантні ефекти регулювання рН наведених у Приклади циклоалкільних радикалів даному описі інгібіторів NHE. включають циклопропіл, циклобутил, циклопентил, Застосування сполук винаходу відноситься до циклогексил, циклогептил або циклооктил. Один профілактики і лікування гострих і хронічних або більше, наприклад 1 або 2 атоми водню у захворювань у ветеринарії і медицині, зокрема, у циклоалкільних радикалах можуть бути заміщені медицині. атомами фтору, хлору, брому або йоду, зокрема, Таким чином, інгібітори NHE винаходу є атомами фтору. Заміщені циклоалкільні радикали придатними для лікування захворювань, можуть бути заміщені у будь-яких положеннях. викликаних ішемією і реперфузією. Алкенільні радикали містять 2, 3, 4, 5 або 6 Наведені у даному описі сполуки є атомів вуглецю і 1, 2 або 3 спряжених або придатними як протиаритмічні лікарські засоби неспряжених подвійних зв'язки у прямому або внаслідок їх фармакологічних властивостей. розгалуженому ланцюгу. Алкінільні радикали Завдяки їх кардіозахисному компоненту, містять 2, 3, 4, 5 або 6 атомів вуглецю і 1, 2 або 3 інгібітори NHE формули І і/або їх фармацевтично спряжених або неспряжених потрійних зв'язки у прийнятні солі є значною мірою придатними для прямому або розгалуженому ланцюгу. профілактики інфаркту і лікування інфаркту і для Арильні радикали вибрані з фенілу, 1лікування стенокардії, при цьому у вказаних нафтилу, 2-нафтилу та інденілу. Заміщені арильні випадках вони також превентивно інгібують або радикали можуть бути заміщені у будь-яких значною мірою ослаблюють патофізіологічні положеннях. процеси, пов'язані з розвитком порушень, Гетероарильні радикали являють собою викликаних ішемією, зокрема, виникнення моноциклічні або біциклічні ароматичні 3, 4, 5, 6, 7, викликаної ішемією серцевої аритмії. Завдяки їх 8, 9 або 10-членні циклічні сполуки, в яких 1, 2, 3 захисній дії проти патологічних гіпоксичних та або 4 кільцевих атоми являють собою атоми ішемічних станів, сполуки формули І і/або їх кисню, атоми сірки або атоми азоту, наприклад 1, фармацевтично прийнятні солі, що 2 або 3 атоми азоту, 1 або 2 атоми кисню, 1 або 2 використовуються відповідно до винаходу, атоми сірки або комбінацію різних гетероатомів. внаслідок інгібування механізму Na+/H+ клітинного Гетероарильні радикали можуть бути приєднані обміну, можуть бути використані як лікарські через будь-яке положення, наприклад положення засоби для лікування всіх викликаних ішемією 1, положення 2, положення 3, положення 4, гострих або хронічних порушень або захворювань, положення 5, положення 6, положення 7 або викликаних первинно або повторно. положення 8. Приклади гетероарилів являють Даний винахід також відноситься до собою фурил, тієніл, піроліл, імідазоліл, піразоліл, застосування вказаних сполук як лікарських триазоліл, тетразоліл, оксазоліл, ізоксазоліл, засобів при хірургічних втручаннях. Тому сполуки тіазоліл, ізотіазоліл, піридиніл, піразиніл, можуть бути використані під час трансплантації піримідиніл, піридазиніл, індоліл, індазоліл, органів; при цьому сполуки можуть бути хіноліл, ізохіноліл, фталазиніл, хіноксалініл, використані для захисту органів донора перед хіназолініл і цинолініл, зокрема, тіазоліл, тієніл, видаленням і під час видалення, для захисту піроліл, піридазиніл, піридиніл, піримідиніл, фурил, видалених органів, наприклад під час обробки або імідазоліл, ізоксазоліл, оксазоліл, піразиніл, 21 81118 22 їх зберігання у фізіологічних розчинах і під час Сполуки формули І відповідно до винаходу перенесення в організм реципієнта. і/або їх фармацевтично прийнятні солі додатково є Сполуки винаходу є також цінними також придатними для лікування різних типів шоку, лікарськими засобами із захисною дією при такого як, наприклад, алергічний, кардіогенний, проведенні ангіопластичних хірургічних операцій, гіповолемічний і бактеріальний шок. наприклад на серці, а також на периферичних Сполуки формули І і/або їх фармацевтично органах і судинах. прийнятні солі можуть бути також використані для Виявлено, що сполуки винаходу є виключно профілактики і лікування тромботичних розладів, ефективними лікарськими засобами проти аритмії, тому що вони як інгібітори здатні самі інгібувати небезпечної для життя. Припиняється фібриляція агрегацію тромбоцитів. Вони, крім того, здатні шлуночків серця і відновлюється фізіологічний інгібувати або запобігати такому, що зустрічається синусовий ритм серця. після ішемії і реперфузії, надмірному вивільненню Оскільки інгібітори NHE1 у тканинах і органах медіаторів запалення і коагуляції, зокрема, людини, зокрема, серці, ефективно захищають не фактору Вілебранда і білків селектину, що тільки від пошкоджень, викликаних ішемією і утворює тромб. Таким чином можна зменшити і реперфузією, але також і від цитотоксичної дії усунути патогенну дію значимих факторів, що лікарських препаратів, подібних до тих, які утворюють тромб. Інгібітори NHE даного винаходу використовуються, зокрема, у терапії раку і терапії можуть бути, тому об'єднані з іншими аутоімунних захворювань, спільне введення зі антикоагулянтними і/або тромболітичними сполуками формули І і/або їх фармацевтично активними інгредієнтами, такими як, наприклад, прийнятними солями є придатним для інгібування рекомбінантний або природний активатор цитотоксичних, зокрема, кардіотоксичних побічних плазміногену тканини, стрептокіназа, урокіназа, ефектів вказаних сполук. Зменшення ацетилсаліцилова кислота, антагоністи тромбіну, цитотоксичної дії, зокрема, кардіотоксичності, антагоністи фактора Ха, лікарські засоби з внаслідок комбінованої лікарської терапії, що фібринолітичною активністю, антагоністи включає використання інгібіторів NHE1, дає тромбоксанового рецептора, інгібітори додаткову можливість збільшення дози фосфодієстерази, антагоністи фактора Vila, цитотоксичних терапевтичних засобів і/або клопідогрел, тиклопідин і т.д. Зокрема, корисним є пролонгування лікарської терапії такими спільне застосування інгібіторів NHE :· даного лікарськими засобами. Терапевтична вигода винаходу з інгібіторами NCBE і/або з інгібіторами вказаної цитотоксичної терапії може бути помітно карбонат-дегідратази, такими як, наприклад, збільшена за рахунок комбінації з інгібіторами ацетазоламід. NHE. Сполуки формули І і/або їх фармацевтично Крім цього, інгібітори NHE1 формули І прийнятні солі, що використовуються відповідно винаходу і/або їх фармацевтично прийнятні солі до винаходу, крім того відрізняються сильною можуть бути використані у тому випадку, коли є інгібуючою дією на проліферацію клітин, надмірне продукування гормонів щитовидної наприклад, проліферацію фібробласту і залози, яке уражає серце, тиреотоксикоз або проліферацію клітин гладкого судинного м'яза. зовнішній приплив гормонів щитовидної залози. Сполуки формули І і/або їх фармацевтично Сполуки формули І і/або їх фармацевтично прийнятні солі є тому придатними як цінні лікарські прийнятні солі є тому придатними для поліпшення засоби при захворюваннях, в яких проліферація якості терапії кардіотоксичними лікарськими клітин являє собою первинну або вторинну препаратами. причину, і, отже, можуть бути використані як Відповідно до їх захисної дії проти протиатеросклеротичні засоби, засоби для ушкодження, викликаного ішемією, сполуки лікування хронічної ниркової недостатності і винаходу є також придатними як лікарські засоби злоякісних утворень. для лікування ішемії нервової системи, зокрема, Було показано, що за допомогою інгібіторів центральної нервової системи, при цьому вони є NHE пригнічується міграція клітин. Сполуки придатними, наприклад, для лікування удару або формули І і/або їх фармацевтично прийнятні солі є набряку мозку. тому придатними як цінні лікарські засоби при Сполуки формули І і/або їх фармацевтично захворюваннях, в яких міграція клітин являє собою прийнятні солі є також придатними для терапії і первинну або вторинну причину, таких як, профілактики захворювань і розладів, викликаних наприклад, злоякісні утворення з явною підвищеною збудливістю центральної нервової схильністю до метастазу. системи, зокрема, для лікування епілептичних Сполуки формули І і/або їх фармацевтично розладів, клонічних і тонічних судом, станів прийнятні солі додатково відрізняються здатністю психологічної депресії, тривожних розладів і уповільнювати або запобігати фіброзним психозу. У таких випадках розкриті у даному описі розладам. Тому вони є придатними як чудові інгібітори NHE можна використовувати окремо або засоби для лікування фіброзу серця і фіброзу у комбінації з іншими речовинами з легень, фіброзу печінки, фіброзу нирок та інших антиепілептичною активністю або з фіброзних розладів. Отже, вони можуть бути протипсихотичними активними інгредієнтами або з використані для лікування гіпертрофії і гіперплазії інгібіторами карбонат-дегідратази, наприклад з органів, наприклад, серця і простати. Тому вони є ацетазоламідом, та з іншими інгібіторами NHE або придатними для профілактики і лікування серцевої натрійзалежного обміну хлорид-бікарбонат недостатності (застійної серцевої (NCBE). 23 81118 24 недостатності=СНF) і для лікування і профілактики загального вмісту сироваткового холестерину, гіперплазії простати або гіпертрофії простати. зокрема, важливим є зниження частки у Оскільки при гіпертензії спостерігається загальному вмісті холестерину специфічних значне посилення NHE, сполуки формули І і/або їх атерогенних ліпідних фракцій, зокрема, фармацевтично прийнятні солі є придатними для ліпопротеїнів низької щільності (LDL) і профілактики і лікування високого кров'яного тиску ліпопротеїнів дуже низької щільності (VLDL), тому і серцево-судинних розладів. У даних випадках що вказані ліпідні фракції являють собою вони можуть бути використані окремо або у атерогенний фактор ризику. І навпаки, захисна відповідній комбінації із засобами і композиціями, функція проти коронарної хвороби серця призначеними для лікування високого кров'яного приписується ліпопротеїнам високої щільності. тиску і серцево-судинних розладів. Таким чином, Відповідно, гіполіпідемічні лікарські засоби повинні вони можуть бути об'єднані, наприклад, з одним бути здатні знижувати не тільки загальний вміст або декількома діуретиками з тіазидоподібною холестерину, але зокрема, вміст фракцій VLDL і дією, діуретиками, що пригнічують реабсорбцію LDL у сироватковому холестерині. У наш час натрію і хлоридів не тільки у проксимальних і знайдено, що інгібітори NHE1 показують цінні дистальних канальцях, але і у петлі Генле, терапевтично корисні властивості, що впливають альдостероном і антагоністами на рівні сироваткових ліпідів. Тому вони значно псевдоальдостерону, такими як гідрохлортіазид, знижують підвищені концентрації сироваткових інданамід, політіазид, фуроземід, піретанід, LDL і VLDL, які спостерігаються, наприклад, тораземід, буметанід, амілорид, триамтерен, внаслідок підвищеного споживання багатих спіронолактон або еплерон. Інгібітори NHE даного холестерином і ліпідами продуктів або у випадках винаходу можуть бути, крім того, використані у патологічних метаболічних змін, наприклад комбінації з блокаторами кальцієвого каналу, генетично споріднених гіперліпідемій. Отже, вони такими як верапаміл, дилтіазем, амлодипін або можуть бути використані для профілактики і ніфедипін, і з інгібіторами АСЕ, такими як, регресії атеросклеротичних уражень усуненням наприклад, раміприл, еналаприл, лізиноприл, етіологічного фактора ризику. У цьому випадку фозиноприл або каптоприл. Додатковими включені не тільки первинні гіперліпідемії, але вигідними партнерами для комбінації є також бетатакож деякі вторинні гіперліпідемії, що блокатори, такі як метопролол, альбутерол і т.д., зустрічаються, наприклад, разом з діабетом. Крім антагоністи ангіотензинового рецептора і підтипів, цього, сполуки формули І і/або їх фармацевтично що належать рецептору, такі як лозартан, прийнятні солі приводять до помітного зменшення ірбезартан, валзартан, омапатрилат, інфарктів, викликаних метаболічними розладами, і гемопатрилат, антагоністи ендотеліну, інгібітори зокрема, до значного зменшення розміру реніну, агоністи аденозинового рецептора, викликаного інфаркту і його тяжкості. Тому вказані інгібітори і активатори калієвих каналів, такі як сполуки корисно використовувати для одержання глібенкламід, глімепірид, діазоксид, кромакалім, лікарського засобу для лікування міноксидил та їх похідні, активатори калієвого гіперхолестеринемії, для одержання лікарського каналу, сприйнятливі до мітохондрального АТФ засобу для профілактики атерогенезу, для (канал мітоК (АТФ)), інгібітори Kv 1.5 і т.д. одержання лікарського засобу для профілактики і Виявлено, що інгібітори ΝΗΕ1 формули І і/або лікування атеросклерозу, для одержання їх фармацевтично прийнятні солі надають значну лікарського засобу для профілактики і лікування протизапальну дію і тому можуть бути використані захворювань, викликаних підвищеними рівнями як протизапальні лікарські засоби. Інгібування холестерину, для одержання лікарського засобу вивільнення медіаторів запалення у зв'язку з цим для профілактики і лікування захворювань, заслуговує особливої уваги. Отже, сполуки можуть викликаних ендотеліальною дисфункцією, для бути використані окремо або у комбінації з одержання лікарського засобу для профілактики і протизапальним лікарським засобом для лікування викликаної атеросклерозом гіпертензії, профілактики або лікування хронічних і гострих для одержання лікарського засобу для запальних розладів. Особливо корисними для профілактики і лікування викликаних використання у комбінації є стероїдні і нестероїдні атеросклерозом тромбозів, для одержання протизапальні лікарські засоби. Сполуки винаходу лікарського засобу для профілактики і лікування можуть бути також використані для лікування викликаного гіперхолестеринемією і викликаного розладів, викликаних найпростішими, малярії і ендотеліальною дисфункцією ішемічного кокцидіозу у домашньої птиці. ураження і постішемічної реперфузії, для Додатково було знайдено, що сполуки одержання лікарського засобу для профілактики і формули І і/або їх фармацевтично прийнятні солі лікування викликаних гіперхолестеринемією і показують сприятливий вплив на сироваткові викликаних ендотеліальною дисфункцією ліпопротеїни. Загальновизнано, що дуже високі серцевих гіпертрофій і кардіоміопатій і застійної рівні жиру у крові, що називаються серцевої недостатності (CHF), для одержання гіперліпопротеїнемією, являють собою істотний лікарського засобу для профілактики і лікування фактор ризику розвитку атеросклеротичних викликаних гіперхолестеринемією і викликаних судинних уражень, зокрема, коронарної хвороби ендотеліальною дисфункцією серцевих серця. Тому зниження підвищеного рівня коронарних вазоспазмів та інфарктів міокарда, для сироваткових ліпопротеїнів має виняткову одержання лікарського засобу для лікування важливість для профілактики і регресії вказаних розладів у комбінаціях з гіпотензивними атеросклеротичних уражень. Крім зниження засобами, переважно з інгібіторами ангіотензин 25 81118 26 конвертуючого ферменту (АСЕ) і антагоністами патологічні, обумовлені віком вияви, що ангіотензинового рецептора. Доведено, що індукуються протягом тривалого періоду старіння, комбінація інгібітору NHE формули І і/або його такі як хвороба, інвалідність і смерть, які тепер фармацевтично прийнятних солей з активним можуть бути піддані лікуванню інгібіторами NHE, інгредієнтом, що понижує рівні жиру у крові, являють собою захворювання і розлади, які переважно з інгібітором HMG-CoA редуктази викликаються по суті пов'язаними з віком змінами (наприклад, ловастатином або правастатином), життєвих органів і їх функції та стають все більш останній з яких здійснює майже гіполіпідемічну дію значимими при старінні організму. і таким чином посилює гіполіпідемічні властивості Розлади, пов'язані з функціональними інгібітору NHE формули І і/або його порушеннями, обумовленими віком, або з виявами фармацевтично прийнятних солей, являє собою виснажування органів, обумовленого віком, корисну комбінацію з посиленою дією і зниженим являють собою, наприклад, неадекватну реакцію і використанням активного інгредієнта. реактивність кровоносних судин на реакції Таким чином, сполуки формули І і/або їх скорочення і розслаблення. Обумовлене віком фармацевтично прийнятні солі приводять до зниження реактивності судин на подразники, що ефективного захисту проти ендотеліального скорочують і розслабляють, яка є важливим ушкодження різного походження. Вказаний захист процесом серцево-судинної системи і, отже, для судин від синдрому ендотеліальної дисфункції життя і здоров'я, може бути значною мірою означає, що сполуки формули І і/або їх усунене або зменшене інгібіторами NHE. Одна фармацевтично прийнятні солі є цінними важлива функція і ступінь підтримки реактивності лікарськими засобами для профілактики і судин являє собою блокаду або затримку лікування вазоспазмів коронарних судин, обумовленого віком прогресування ендотеліальної периферичних судинних захворювань, зокрема, дисфункції, яке може бути значною мірою усунене переміжної кульгавості, атерогенезу і інгібіторами NHE. Сполуки формули І і/або їх атеросклерозу, гіпертрофії лівого шлуночка серця і фармацевтично прийнятні солі є, тому досить застійної кардіоміопатії і тромботичних придатними для лікування і профілактики захворювань. обумовленого віком прогресування ендотеліальної Крім того, було знайдено, що сполуки дисфункції, зокрема, переміжної кульгавості. формули І і/або їх фармацевтично прийнятні солі є Прикладом іншої змінної, що характеризує придатними при лікуванні інсуліннезалежного процес старіння, є зниження скорочувальної діабету (NIDDM) з обмеженою здатності серця і зниження адаптації серця до інсулінорезистентністю. У зв'язку з цим може бути необхідного хвилинного серцевого викиду. корисне підвищення антидіабетичної активності і Знижена активність серця внаслідок процесу якості дії сполук винаходу при об'єднанні їх з старіння у більшості випадків пов'язана з бігуанідом, таким як метформін, з дисфункцією серця, яка викликана, серед іншого, антидіабетичною сульфонілсечовиною, такою як відкладенням з'єднувальної тканини у тканині глібурид, глімепірид, толбутамід і т.д., з інгібітором міокарда. Вказане відкладення з'єднувальної глюкозидази, з агоністом PPAR, таким як тканини характеризується збільшенням маси розиглітазон, піоглітазон і т.д., з інсуліновим серця, розширенням шлуночків серця і обмеженою продуктом, що має різні форми для введення, з серцевою функцією. Несподівано було виявлено, інгібітором DB4, з інсуліносенсибілізатором або з що можна майже повністю інгібувати також меглітинідом. старіння серцевого органу. Тому сполуки формули Крім невідкладних антидіабетичних дій, І і/або їх фармацевтично прийнятні солі є значною сполуки формули І і/або їх фармацевтично мірою придатними для лікування і профілактики прийнятні солі протидіють розвитку ускладнень серцевої недостатності, застійної серцевої діабету і тому можуть бути використані як лікарські недостатності (CHF). засоби для профілактики і лікування застійних Хоча у попередніх патентах і заявках на уражень внаслідок діабету, таких як діабетична патент пропонувалося лікування різних форм раку, нефропатія, діабетична ретинопатія, діабетична що вже з'явився, авторами несподівано було кардіоміопатія, та інших розладів, що є наслідком виявлено, що можна не тільки лікувати рак, що діабету. У даному зв'язку, вони можуть бути з вже з'явився, інгібуванням проліферації клітин, користю об'єднані з антидіабетичними лікарськими але також запобігти і значно затримати засобами, вказаними вище для лікування NIDDM. захворюваність раком, обумовлену віком, завдяки У даному зв'язку, повинна бути, зокрема, важлива використанню інгібіторів NHE. Виявлення, що комбінація з дозованою формою інсуліну, що особливо заслуговує уваги, полягає у тому, що надає сприятливу дію. порушення всіх органів, які зустрічаються Інгібітори ΝΉΕ формули І даного винаходу внаслідок старіння, і не тільки деякі різновиди і/або їх фармацевтично прийнятні солі, крім раку, пригнічуються або з'являються з досить захисних дій від гострих ішемічних станів і від значною затримкою. Сполуки формули І і/або їх подальшої схильності у рівній мірі до гострої фармацевтично прийнятні солі, тому є значною реперфузії, показують також прямі терапевтично мірою придатними для лікування і, зокрема, для застосовні дії проти захворювань і розладів всього профілактики обумовлених віком різновидів раку. організму ссавця, які пов'язані з виявами хронічно У наш час авторами знайдено, що є не тільки у прогресуючого процесу старіння, і які виникають значній мірі зрушена у часі і понад звичайні незалежно від станів гострої гіпоперфузії і при статистичні дані затримка у виникненні нормальних неішемічних станах. Вказані обумовлених віком порушень всіх досліджених 27 81118 28 органів, включаючи серце, судини, печінку і т.д., формули (І) відповідно до наступної загальної але і досить значна затримка у виникненні раку у схеми синтезу: літніх людей. І навпаки, несподівано було також виявлено збільшення тривалості життя до такої міри, яка не була досяжна досі ніякими іншими групами лікарських засобів або природними продуктами. Унікальна дія інгібіторів NHE, крім використання активних інгредієнтів окремо для людей і тварин, також робить можливою об'єднання вказаних інгібіторів NHE з іншими активними началами лікарських засобів, заходами, речовинами і природними продуктами, які застосовуються у геронтології і які базуються на різному механізмі дії. Такі класи активних інгредієнтів, що використовуються у геронтологічній терапії, являють собою, зокрема, вітаміни і речовини з антиоксидантною активністю. Оскільки існує кореляція між калорійним навантаженням або споживанням їжі і процесом старіння, може мати місце комбінація з дієтичними заходами, наприклад, засобами, що пригнічують Загальна схема синтезу є наступною: апетит. Подібно можна розглянути комбінацію з a) комплексний гідрид піддають взаємодії з гіпотензивними лікарськими препаратами, фталімідом (формули II) в аліфатичному спирті, наприклад, інгібіторами АСЕ, антагоністами b) потім одержаний продукт піддають ангіотензинового рецептора, діуретиками, взаємодії з алкоксикарбонілантагоністами Са2+ і т.д., або з лікарськими метилентрифенілфосфораном у толуолі, або з засобами, які нормалізують обмін речовин, такими триалкілфосфоноацетатом і основою, як засоби, що знижують рівень холестерину. c) одержаний продукт піддають взаємодії з Сполуки формули І і/або їх фармацевтично гуанідинійхлоридом і основою, або з гуанідином, прийнятні солі є, тому значною мірою придатними наприклад, у спирті, що має 1, 2, 3 або 4 атоми для профілактики обумовлених віком змін тканин і вуглецю. для збільшення тривалості життя при одночасному Реакцію відновлення а) переважно здійснюють збереженні високої якості життя. з використанням гідриду, такого як боргідрид калію Сполуки винаходу є ефективними інгібіторами або боргідрид натрію в аліфатичному спирті, що клітинного антипорту натрій-протон (Na/H обмін), має 1, 2, 3 або 4 атоми вуглецю, переважно у який при великому числі розладів (ессенціальна метанолі, або у тетрагідрофурані, при температурі гіпертензія, атеросклероз, діабет і т.д.) також між 0°С і температурою кипіння реакційної суміші. посилюється у клітинах, які легко піддаються Реакцію b) звичайно здійснюють у присутності оцінкам, у таких як, наприклад, еритроцити, відповідного алкокситромбоцити або лейкоцити. Сполуки відповідно до карбонілметилентрифенілфосфорану у винаходу, отже, є придатними як чудові і прості розчиннику, такому як толуол, при температурі між наукові засоби, наприклад при їх використанні як 20°С і температурою кипіння реакційної суміші, діагностичних засобів для визначення і або у присутності відповідного розрізнення різних типів гіпертензії, а також триалкілфосфоноацетату і основи, такої як гідрид атеросклерозу, діабету і застійних ускладнень натрію, у розчиннику, такому як 1,2-диметоксіетан, внаслідок діабету, проліферативних розладів і т.д. при температурі між 0°С і температурою кипіння Даний винахід також відноситься до способів реакційної суміші. синтезу похідних ізоіндолону формули І Реакцію с) звичайно здійснюють у присутності гідрохлориду гуанідинію і основи, такої як третбутоксид каяію, в інертному розчиннику, такому як диметилформамід, при температурі між 20°С і температурою кипіння реакційної суміші або у присутності гуанідину у розчиннику, такому як спирт, що має 1, 2, 3 або 4 атоми вуглецю, переважно в ізопропанолі, при температурі між 20°С і температурою кипіння реакційної суміші. Альтернативно, деякі сполуки формули І, в якій R4 і R6 являють собою водень, можуть бути Крім того, сполуки формули І можуть бути у одержані з альдегідів формули (III) відповідно до формі таутомерів, рацемічних сумішей, загальної схеми синтезу: енантіомерів і діастереоізомерів. Вони також утворюють частину винаходу. Сполуки формули І, в яких R4 і R6 являють собою водень, можуть бути одержані з фталімідів 29 Загальна схема синтезу є наступною: a) сполуки формули III піддають взаємодії з алкоксикарбоніл-метилентрифенілфосфораном у толуолі або з триалкілфосфоноацетатом і основою, b) одержаний продукт піддають взаємодії з аміном формули R3NH2 (R3 має таке ж значення, як у формулі І) і карбодіімідом, c) одержаний продукт піддають взаємодії з гуанідинійхлоридом і основою, або з гуанідином, наприклад, у спирті, що має 1, 2, 3 або 4 атоми вуглецю. Реакцію а) звичайно здійснюють у присутності відповідного алкоксикарбонілметилентрифенілфосфорану в інертному розчиннику, такому як толуол, при температурі між 20°С і температурою кипіння реакційної суміші, або у присутності відповідного триалкілфосфоноацетату і основи, такої як гідрид натрію, у розчиннику, такому як 1,2-диметоксіетан, при температурі між 0°С і температурою кипіння реакційної суміші. Реакцію b) здійснюють у присутності відповідного аміну R3NH2. Процес звичайно здійснюють у присутності реагенту поєднання, що використовується у хімії пептидів, такого як карбодіімід (наприклад, Ν,Ν'дициклогексилкарбодіімід) або Ν,Ν'карбонілдіімідазол в інертному розчиннику, такому як простий ефір (наприклад тетрагідрофуран або діоксан), амід (наприклад, диметилформамід) або хлорований інертний розчинник (наприклад, метиленхлорид, 1,2-дихлоретан або хлороформ), при температурі між 0°С і температурою кипіння реакційної суміші. Реакцію с) звичайно здійснюють у присутності гідрохлориду гуанідинію і основи, такої як третбутоксид калію, в інертному розчиннику, такому як диметилформамід, при температурі між 20°С і температурою кипіння реакційної суміші, або у присутності гуанідину у розчиннику, такому як спирт, що має 1, 2, 3 або 4 атоми вуглецю, переважно в ізопропанолі, при температурі між 20°С і температурою кипіння реакційної суміші. Сполука формули І, в якій R4 являє собою алкільну групу і R6 являє собою водень, може бути 81118 30 одержана з фталімідів формули (II) відповідно до наступної загальної схеми синтезу: Загальна схема синтезу є наступною: а) фталімід (формули II) піддають взаємодії з галогенідом алкілмагнію або з алкіллітієвим реагентом, наприклад, у простому ефірі, b) одержаний продукт потім піддають взаємодії з алкоксикарбонілметилентрифенілфосфораном у толуолі або з 1етокси-і-триметилсилоксіетиленом і кислотою Льюїса, c) одержаний продукт піддають взаємодії з гуанідинійхлоридом і основою, або з гуанідином, наприклад, у спирті, що має 1, 2, 3 або 4 атоми вуглецю. Реакцію а) переважно, здійснюють з використанням галогеніду алкілмагнію або алкіллітієвого реагенту у розчиннику, такому як простий ефір, переважно тетрагідрофуран, при температурі між 0°С і температурою кипіння реакційної суміші. Реакцію b) можна здійснювати у присутності відповідного алкоксикарбонілметилентрифенілфосфорану у розчиннику, такому як толуол, при температурі між 20°С і температурою кипіння реакційної суміші, або у присутності 1-етокси-1-триметилсилоксіетилену і кислоти Льюїса, такої як хлорид титану (IV) або триметилсилілтрифлат, в інертному розчиннику, такому як дихлорметан, при температурі між -78°С і 20°С. Одержання похідних, таких як 1-етокси-1триметилсилоксіетен, описане у: [Synth. Commun. 1987, 17, 1]. Реакцію с) звичайно здійснюють у присутності гідрохлориду гуанідинію і основи, такої як третбутоксид калію, в інертному розчиннику, такому як диметилформамід, при температурі між 20°С і температурою кипіння реакційної суміші, або у присутності гуанідину у розчиннику, такому як спирт, що має 1, 2, 3 або 4 атоми вуглецю, переважно в ізопропанолі, при температурі між 20°С і температурою кипіння реакційної суміші. Сполуки формули І, в яких R6 являє собою алкільну групу, можуть бути одержані зі складного ефіру формули (IV) відповідно до наступної загальної схеми синтезу: 31 Загальна схема синтезу є наступною: a) сполуку формули IV піддають взаємодії у присутності діізопропіламіду літію з R6-Hal, де Hal означає F, СІ, Br або І, b) одержаний продукт піддають взаємодії з гуанідинійхлоридом і основою, або з гуанідином, наприклад у спирті, що має 1, 2, 3 або 4 атоми вуглецю. Реакцію а) можна здійснювати у присутності діізопропіламіду літію в інертному розчиннику, такому як простий ефір (переважно тетрагідрофуран), і у присутності відповідного алкілгалогеніду R6-Hal при температурі між -78°С і 0°С. Реакцію b) звичайно здійснюють у присутності гідрохлориду гуанідинію і основи, такої як третбутоксид калію, в інертному розчиннику, такому як диметилформамід при температурі між 20°С і температурою кипіння реакційної суміші, або у присутності гуанідину у розчиннику, такому як спирт, що має 1, 2, 3 або 4 атоми вуглецю, переважно в ізопропанолі, при температурі між 20°С і температурою кипіння реакційної суміші. Якщо сполуки формули (II) є комерційно недоступними, вони можуть бути одержані, наприклад (шлях а) з відповідних ангідридів формули (V) у присутності відповідного аміну R3NH2 і кислоти, такої як паратолуолсульфонова кислота, у розчиннику, такому як толуол, при температурі між 20°С і температурою кипіння реакційної суміші; або (шлях b) за методом Габріеля з використанням як вихідних продуктів фталімідів калію формули (VI) у присутності відповідного алкілгалогеніду формули R3Hal та у розчиннику, такому як диметилформамід, при температурі між 0°С і температурою кипіння реакційної суміші, із застосуванням або адаптацією методики, розкритої в: [Tetrahedron, 1998, 54, 14437]. 81118 32 Якщо сполуки формули (V) є комерційно недоступними, вони можуть бути одержані, наприклад, з відповідних фталевих кислот в ангідриді оцтової кислоти при температурі між 20°С і температурою кипіння реакційної суміші. Якщо необхідно, для амінної, спиртової або кислотної функціональної групи використовують захисну групу і такі методики видалення захисної групи, які описані [T.W. Greene, Protective Groups in Organic Synthesis, J.Wiley-Interscience Publication (1991)]. Сполуки формули І можуть бути необов'язково перетворені в адитивні солі неорганічної або органічної кислоти взаємодією такої кислоти у розчиннику, наприклад, в органічному розчиннику, такому як спирт, кетон, простий ефір або хлорований розчинник. Дані солі також утворюють частину винаходу. Приклади фармацевтично прийнятних солей, які можуть бути наведені, включають наступні солі: бензолсульфонат, л.ілін аце, гідрохлорид, ацетат, цитрат, етансульфонат, фумарат, глюконат, йодат, л.ілі, ізетіонат, метансульфонат, метиленбісф-оксинафтоат), нітрат, оксалат, памоат, фосфат, саліцилат, сукцинат, сульфат, л.ілін, л.ілін ацетат і птолуолсульфонат. Якщо сполуки містять кислотну групу, вони здатні утворювати солі з основами, наприклад, солі лужного металу, переважно натрієві або калієві солі або солі амонію, наприклад, солі з аміаком або органічними амінами або амінокислотами. Вони можуть також бути присутніми у вигляді цвітер-іона. Список скорочень: CAN Ацетонітрил CDI Діімідазол-1-ілметанон DCI Хімічна іонізація десорбцією DEA Діетиламін DIP 2-Ізопропоксипропан DME 1,2-диметоксіетан ДМФА Ν,Ν-диметилформамід EA Етилацетат El Електронний удар Іонізація електростатичним ES розпиленням EtOH Етанол HEP н-Гептан HOAc Оцтова кислота ВЕРХ Високоефективна рідинна хроматографія KotBu Трет-бутилат калію MeOH Метанол 33 81118 34 т.пл. Температура плавлення етил(2-метил-3-оксо-2,3-дигідро-1Н-ізоіндол-1MTB 2-Метокси-2-метилпропан іл)ацетату у вигляді жовтого масла. (Rf=0,25, NMP 1-Метилпіролідин-2-он тонкошарова хроматографія на силікагелі, елюент: i-PrOH Ізопропанол суміш циклогексан/етилацетат (50/50 за об'ємом)). RT Час утримання c) 3-Гідрокси-2-метил-2,3-дигідроізоіндол-1-он TФOK Трифтороцтова кислота 3,4г Боргідриду калію повільно додають до Винахід ілюструють наступні приклади. суспензії 10г N-метилфталіміду в 220мл метанолу Приклад 1: в інертній атмосфері. Реакційну суміш а) N-[2-(2-Метил-3-оксо-2,3-дигідро-1Нперемішують при температурі приблизно 20°С ізоіндол-1-іл)ацетил]гуанідин протягом 20 годин і потім по краплях додають 200мл дистильованої води. Потім частково (близько 120мл) випарюють розчинник при зниженому тиску (2кПа) і температурі близько 35°С і залишок розбавляють 400мл дистильованої води. Суміш екстрагують 400мл етилацетату. Органічну фазу сушать над сульфатом магнію, фільтрують і потім концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 30°С. У результаті одержують 4,5г 3-гідрокси-2метил-2,3-ДИгідроізоіндол-1-ону у вигляді білого порошку, що плавиться при 130°С. Приклад 2 До суспензії 5,2г трет-бутоксиду калію у 100мл а) N-[2-(2-ізобутил-3-оксо-2,3-дигідро-1Ндиметилформаміду додають 4,3г ізоіндол-1-іл)ацетил]гуанідин гуанідинійхлориду. Реакційну суміш перемішують в інертній атмосфері при температурі приблизно 20°С протягом 1 години і потім додають розчин 2г етил(2-метил-3-оксо-2,3-дигідро-1Н-ізоіндол-1іл)ацетату у 20мл диметилформаміду. Реакційну суміш перемішують при температурі приблизно 20°С протягом 16 годин, потім додають 100мл води. Доводять рН до 8 додаванням 50мл 1Н хлористоводневої кислоти і суміш концентрують при зниженому тиску (0,6кПа) при температурі приблизно 30°С. Одержаний після випарювання залишок переносять у воду і потім фільтрують. У N-[(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндолрезультаті одержують 0,35г N-[(2-метил-3-оксо-2,31-іл)ацетил]гуанідин одержують, дотримуючись дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідину у вигляді методики прикладу 1, з використанням як вихідних не зовсім білої твердої речовини, що плавиться продуктів 5г трет-бутоксиду калію, 5,2г + при 214°С. Мас-спектр El: m/e 246 (М ), m/е 159 гуанідинійхлориду і 2,5г етил(2-ізобутил-3-оксо(основний пік), m/е 146. 2,3-дигідро-1Н-ізоіндол-1-іл)ацетату. Реакційну b) Етил(2-мeтил-3-оксо-2,3-дигідро-1Нсуміш перемішують при температурі приблизно ізоіндол-1-іл)ацетат 20°С протягом 24 годин і потім фільтрують. 11,5г Фільтрат переносять у 150мл води і 200мл етоксикарбонілметилентрифенілфосфорану етилацетату. Після розділення фаз осадженням додають до суспензії 4,5г 3-гідрокси-2-метил-2,3відділяють органічну фазу і водну фазу дигідроізоіндол-1-ону в 110мл толуолу. Реакційну екстрагують двічі 200мл етилацетату. Органічні суміш кип'ятять зі зворотним холодильником при екстракти об'єднують, сушать над сульфатом перемішуванні протягом 16 годин і потім магнію, фільтрують і концентрують досуха при охолоджують до температури приблизно 20°С. зниженому тиску (0,6кПа) і температурі приблизно Потім суміш концентрують досуха при зниженому 45°С. Залишок після випарювання переносять у тиску (2кПа) і температурі приблизно 40°С. Масло, діетиловий ефір, утворений осад відфільтровують що залишилося, переносять у 50мл діетилового і потім декілька разів промивають діетиловим ефіру. Утворений залишок відфільтровують і потім ефіром. Тверду речовину сушать при зниженому промивають двічі 10мл діетилового ефіру. тиску (10Па) і температурі приблизно 45°С. У Фільтрат концентрують досуха при зниженому результаті одержують 1,5г N-[(2-ізобутил-3-оксотиску (2кПа) і температурі приблизно 40°С з 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідину у одержанням забарвленого в оранжевий колір вигляді білої твердої речовини, що плавиться при масла, яке очищають хроматографією під тиском 250°С. Мас-спектр El: m/e 288 (М+), m/е 201 аргону (60кПа) на колонці з силікагелем (розмір (основний пік). частинок 20-45мкм) при послідовному елююванні b) Етил(2-ізобутил-3-оксо-2,3-дигідро-1Нсумішами циклогексан/етилацетат (70/30, 65/35, ізоіндол-1-іл)ацетат 60/40 за об'ємом). Фракції, що містять очікуваний До суспензії 1,6г 60% гідриду натрію у 60мл продукт, об'єднують і концентрують при 1,2-диметоксіетану в інертній атмосфері додають зниженому тиску (2кПа) при температурі по краплях 7,7мл триетилфосфоноацетату при приблизно 30°С. У результаті одержують 4,1г підтримці температури нижче 10°С і охолоджують 35 81118 36 до 0°С при перемішуванні. Реакційній суміші охолоджують до температури приблизно 20°С. дають можливість нагрітися до температури Реакційну суміш концентрують досуха при приблизно 20°С і потім перемішують протягом 45 зниженому тиску (2кПа) і температурі приблизно хвилин. Потім додають 5,3г 3-гідрокси-2-ізобутил40°С. Залишок переносять у 50мл насиченого 2,3-дигідроізоіндол-1-ону, суміш кип'ятять зі розчину бікарбонату натрію та екстрагують двічі зворотним холодильником протягом 3,5 годин і 75мл дихлорметану. Органічні екстракти потім охолоджують до температури приблизно об'єднують, сушать над сульфатом магнію, 20°С. Реакційну суміш обробляють 40мл фільтрують і потім концентрують досуха при дистильованої води і потім 100мл діетилового зниженому тиску (2кПа) при температурі ефіру. Після розділення фаз осадженням водну приблизно 20°С. У результаті одержують 6,5г Nфазу екстрагують двічі 100мл діетилового ефіру. ізобутилфталіміду у вигляді білої твердої Органічні екстракти об'єднують, сушать над речовини, що плавиться при 92°С. сульфатом магнію, фільтрують і потім Приклад 3 концентрують досуха при зниженому тиску (2кПа) і а) (-)-N-[2-(2-ізобутил-3-оксо-2,3-дигідро-1Нтемпературі приблизно 18°С з одержанням блідоізоіндол-1-іл)ацетил]гуанідин жовтого масла, яке очищають хроматографією під тиском аргону (60кПа) на колонці з силікагелем (розмір частинок 15-40мкм) при послідовному елююванні сумішами циклогексан/етилацетат (60/40 і потім 50/50 за об'ємом). Фракції, що містять очікуваний продукт, об'єднують і концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 30°С. У результаті одержують 6,3г етил(2-ізобутил-3-оксо-2,3-дигідро1Н-ізоіндол-1-іл)ацетату у вигляді блідо-жовтого масла. (Rf=0,56, тонкошарова хроматографія на силікагелі, елюент: суміш циклогексан/етилацетат (50/50 за об'ємом)). (-)-N-[(2-ізобутил-3-оксо-2,3-дигідро-1Нc) 3-Гідрокси-2-ізобутил-2,3-дигідроізоіндол-1ізоіндол-1-іл)ацетил]гуанідин одержують, он дотримуючись методики прикладу 1, з 3-Гідрокси-2-ізобутил-2,3-дигідроізоіндол-1-он використанням як вихідних продуктів 2,6г третодержують, дотримуючись методики прикладу 1, з бутоксиду калію, 2,6г гуанідинійхлориду і 1,25г використанням як вихідних продуктів 6,5г Nетил(-)-(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндолізобутилфталіміду в 60мл метанолу і 1,7г 1-іл)ацетату. Реакційну суміш перемішують при боргідриду калію. Реакційну суміш перемішують температурі приблизно 20°С протягом 40 годин і при температурі приблизно 20°С протягом 20 потім фільтрують. Фільтрат переносять у 80мл годин, потім охолоджують до температури води і 120мл етилацетату. Після розділення фаз приблизно 0°С і додають по краплях 50мл осадженням відділяють органічну фазу і водну дистильованої води. Метанол частково випарюють фазу екстрагують двічі 120мл етилацетату. при зниженому тиску (2кПа) і температурі Органічні екстракти об'єднують, сушать над приблизно 35°С і залишок екстрагують три рази сульфатом магнію, фільтрують і концентрують 60мл дихлорметану. Органічні екстракти додуха при зниженому тиску (0,6кПа) і температурі об'єднують, сушать над сульфатом магнію, приблизно 40°С. Залишок після випарювання фільтрують і потім концентрують досуха при переносять у 30мл діетилового ефіру, утворений зниженому тиску (2кПа) і температурі приблизно осад відфільтровують і потім три рази промивають 25°С з одержанням блідо-жовтого масла, яке 5мл діетилового ефіру. Тверду речовину сушать очищають хроматографією під тиском аргону при зниженому тиску (10Па) і температурі (60кПа) на колонці з силікагелем (розмір частинок приблизно 45°С. У результаті одержують 0,75г (-)40-63мкм) при елююванні сумішшю N-[(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1циклогексан/етилацетат (60/40 за об'ємом). іл)ацетил]гуанідину у вигляді не зовсім білої Фракції, що містять очікуваний продукт, об'єднують твердої речовини, що плавиться при 264°С. (aD20=і концентрують досуха при зниженому тиску (2кПа) 10,2°±0,6° у метанолі при 0,5%). Мас-спектр El: при температурі близько 40°С. У результаті m/e 288 (М+), m/e 245, m/e 201, m/e 132. одержують 5,8г 3-гідрокси-2-ізобутил-2,3b) Етил-(-)-(2-ізобутил-3-оксо-2,3-дигідро-1Ндигідроізоіндол-1-ону у вигляді білої твердої ізоіндол-1-іл)ацетат і етил-(+)-(2-ізобутил-3-оксоречовини, що плавиться при 82°С. 2,3-дигідро-1Н-ізоіндол-1-іл)ацетат d) N-ізобутилфталімід Етил-(-)-(2-ізобутил-3-оксо-2,3-дигідро-1НРозчин 3,2мл ізобутиламіну у 3мл толуолу при ізоіндол-1-іл)ацетат і етил-(+)-(2-ізобутил-3-оксоперемішуванні додають до суспензії 5,2г ангідриду 2,3-дигідро-1Н-ізоіндол-1-іл)ацетат одержують фталевої кислоти у 50мл толуолу. Реакційну суміш розділенням 3,0г етил(2-ізобутил-3-оксо-2,3нагрівають при температурі приблизно 60°С дигідро-1Н-ізоіндол-1-іл)ацетату ВЕРХ протягом 1 години і потім при температурі хроматографією на колонці з хіральною приблизно 100°С протягом 2-х годин. Потім у стаціонарною фазою WHELK-01SS з розміром реактор встановлюють апаратуру Діна-Старка, частинок 10мкм при послідовному елююванні реакційну суміш нагрівають при температурі сумішами гептан/ізопропанол (90/10 за об'ємом) і приблизно 130°С протягом 2-х годин і потім потім гептан/етанол (90/10 і потім 50/50 за 37 81118 38 об'ємом). Фракції, що містять перший енантіомер, об'єднують і концентрують при зниженому тиску (1кПа) і температурі приблизно 40°С. Залишок сушать при зниженому тиску (3кПа) і температурі приблизно 40°С. У результаті одержують 1,3г етил-(-)-(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол1-іл)ацетату у вигляді в'язкого масла, забарвленого у блідий коричнювато-жовтий колір (aD20=-16,2°±0,6° у ДМСО при 0,5%). Фракції, що містять другий енантіомер, об'єднують і концентрують при зниженому тиску (1кПа) і температурі приблизно 40°С. Залишок сушать при N-[(3-оксо-2-пропіл-2,3-дигідро-1Н-ізоіндол-1зниженому тиску (3кПа) і температурі приблизно іл)ацетил]гуанідин одержують, дотримуючись 40°С. У результаті одержують 1,0г етил-(+)-(2методики прикладу 1, з використанням як вихідних ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1продуктів 3,9г трет-бутоксиду калію, 3,3г іл)ацетату у вигляді в'язкого блідо-жовтого масла гуанідинійхлориду і 1,8г етил(3-оксо-2-пропіл-2,3(aD20=-15,1°±0,7° у ДМСО при 0,5%). Етил(2дигідро-1Н-ізоіндол-1-іл)ацетату. Реакційну суміш ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетат перемішують при температурі приблизно 20°С описаний у прикладі 2. протягом 1 години і потім додають 60мл води. Приклад 4 Водну фазу екстрагують 3 рази 50мл етилацетату і (+)-N-[2-(2-ізобутил-3-оксо-2,3-дигідро-1Нпотім концентрують досуха при зниженому тиску ізоіндол-1-іл)ацетил]гуанідин (0,6кПа) і температурі приблизно 45°С. Залишок переносять у воду, розтирають і фільтрують. Тверду речовину переносять у метанол і потім розчинник випарюють досуха при зниженому тиску (0,6кПа) і температурі приблизно 45°С. У результаті одержують 0,6г N-[(3-оксо-2-пропіл-2,3дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідину у вигляді блідо-жовтої пухнастої твердої речовини, що плавиться при 229°С. Мас-спектр El: m/e 274 (М+), m/e 187, m/e 86 (основний пік). b) Етил(3-оксо-2-пропіл-2,3-дигідро-1Нізоіндол-1-іл)ацетат Етил(3-оксо-2-пропіл-2,3-дигідро-1Н-ізоіндол(+)-N-[(2-ізобутил-3-оксо-2,3-дигідро-1Н1-іл)ацетат одержують, дотримуючись методики ізоіндол-1-іл)ацетил]гуанідин одержують, прикладу 2, з використанням як вихідних продуктів дотримуючись методики прикладу 1, з 0,8г 60% гідриду натрію в 20мл 1,2використанням як вихідних продуктів 2,0г третдиметоксіетану, 4,0мл триетилфосфоноацетату і бутоксиду калію, 2,1г гуанідинійхлориду і 1,0г етил1,9г 3-гідрокси-2-пропіл-2,3-дигідроізоіндол-1-ону. (+)-(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1Неочищений продукт очищають хроматографією іл)ацетату. Реакційну суміш перемішують при під тиском аргону (60кПа) на колонці з силікагелем температурі приблизно 20°С протягом 40 годин і (розмір частинок 15-40мкм) при елююванні потім фільтрують. Фільтрат переносять у 70мл сумішшю циклогексан/етилацетат (50/50 за води і 100мл етилацетату. Після розділення фаз об'ємом). Фракції, що містять очікуваний продукт, осадженням відділяють органічну фазу і водну об'єднують і концентрують досуха при зниженому фазу екстрагують двічі 100мл етилацетату. тиску (2кПа) і температурі приблизно 30°С. У Органічні екстракти об'єднують, сушать над результаті одержують 1,9г етил(3-оксо-2-пропілсульфатом магнію, фільтрують і концентрують 2,3-дигідро-1Н-ізоіндол-1-іл)ацетату у вигляді досуха при зниженому тиску (0,6кПа) і температурі жовтого масла. (Rf=0,7, тонкошарова приблизно 40°С. Залишок від випарювання хроматографія на силікагелі, елюент: суміш переносять у 30мл діетилового ефіру, утворений циклогексан/етилацетат (30/70 за об'ємом)). осад відфільтровують і потім промивають три рази c) 3-Гідрокси-2-пропіл-2,3-дигідроізоіндол-1-он 5мл діетилового ефіру. Тверду речовину сушать 3-Гідрокси-2-пропіл-2,3-дигідроізоіндол-1-он при зниженому тиску (10Па) і температурі одержують, дотримуючись методики прикладу 1, з приблизно 45°С. У результаті одержують 0,56г (+)використанням як вихідних продуктів 1,5г NN-[(2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1пропілфталіміду у 25мл метанолу і 0,48г іл)ацетил]гуанідину у вигляді оранжево-жовтої боргідриду калію. Реакційну суміш перемішують твердої речовини, що плавиться при 264°С. при температурі приблизно 20°С протягом 20 (aD20=+13,9°±0,6° у метанолі при 0,5%). Етил-(+)годин, потім охолоджують до температури (2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1приблизно 0°С і додають по краплях дистильовану іл)ацетат описаний у прикладі 3. Мас-спектр DCI: воду. Потім частково випарюють метанол при + m/e 289 (М+Н) . зниженому тиску (2кПа) і температурі приблизно Приклад 5 35°С і залишок охолоджують до 0°С. Одержаний а) N-[2-(3-оксо-2-пропіл-2,3-дигідро-1Носад відфільтровують і потім промивають ізоіндол-1-іл)ацетил]гуанідин холодною водою. Тверду речовину переносять у дихлорметан і потім розчинник випарюють досуха 39 81118 40 при зниженому тиску (2кПа) і температурі етилфталіміду у 20мл метанолу і 1,2г боргідриду приблизно 35°С. У результаті одержують 1,0г 3калію. Реакційну суміш перемішують при гідрокси-2-пропіл-2,3-дигідроізоіндол-1-ону у температурі приблизно 20°С протягом 20 годин, вигляді забарвленого у бежевий колір порошку. потім охолоджують до температури приблизно 0°С (Rf=0,6, тонкошарова хроматографія на силікагелі, і по краплях додають дистильовану воду. елюент: суміш циклогексан/етилацетат (30/70 за Одержаний осад відфільтровують і потім об'ємом)).промивають холодною водою. Потім з фільтрату Приклад 6 частково випарюють метанол при зниженому тиску а) N-[2-(2-етил-3-оксо-2,3-дигідро-1Н-ізоіндол(2кПа) і температурі приблизно 35°С і залишок 1-іл)ацетил]гуанідин охолоджують до 0°С. Одержаний таким чином другий залишок відфільтровують і потім промивають холодною водою. Дві фракції твердої речовини сушать при зниженому тиску (2кПа) і температурі приблизно 35°С. У результаті одержують 1,9г 3-гідрокси-2-етил-2,3дигідроізоіндол-1-ону у вигляді пластівчастого білого порошку. (Rf=0,5, тонкошарова хроматографія на силікагелі, елюент: суміш циклогексан/етилацетат (30/70 за об'ємом)). Приклад 7 а) N-[2-(2-ізопропіл-3-оксо-2,3-дигідро-1Нізоіндол-1-іл)ацетил]гуанідин N-[(2-етил-3-оксо-2,3-дигідро-1Н-ізоіндол-1іл)ацетил]гуанідин одержують, дотримуючись методики прикладу 1, з використанням як вихідних продуктів 4,3г трет-бутоксиду калію, 3,7г гуанідинійхлориду і 1,9г етил(2-етил-3-оксо-2,3дигідро-1Н-ізоіндол-1-іл)ацетату. Реакційну суміш перемішують при температурі приблизно 20°С протягом 20 годин і потім додають 60мл води. Водну фазу екстрагують 3 рази 50мл етилацетату і потім концентрують досуха при зниженому тиску (0,6кПа) і температурі приблизно 45°С. Залишок переносять у воду, розтирають і фільтрують. Тверду речовину переносять у метанол і потім N-[(2-ізопропіл-3-оксо-2,3-дигідро-1Н-ізоіндолрозчинник випарюють досуха при зниженому тиску 1-іл)ацетил]гуанідин одержують, дотримуючись (0,6кПа) і температурі приблизно 45°С. У методики прикладу 1, з використанням як вихідних результаті одержують 0,56г N-[(2-етил-3-оксо-2,3продуктів 1,5г трет-бутоксиду калію, 1,3г дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідину у вигляді гуанідинійхлориду і 0,7г етил(2-ізопропіл-3-оксоне зовсім білої твердої речовини, що плавиться 2,3-дигідро-1Н-ізоіндол-1-іл)ацетату. Реакційну при 223°С. Мас-спектр El: m/e 260 (М+), m/e 173, суміш перемішують при температурі приблизно m/e 160, m/e 132. 20°С протягом 20 годин і потім додають 30мл b) Етил(2-етил-3-оксо-2,3-дигідро-1Н-ізоіндолводи. Водну фазу екстрагують 3 рази 50мл 1-іл)ацетат етилацетату і потім концентрують досуха при Етил(2-етил-3-оксо-2,3-дигідро-1Н-ізоіндол-1зниженому тиску (0,6кПа) і температурі приблизно іл)ацетат одержують, дотримуючись методики 45°С. Залишок переносять у воду, розтирають і прикладу 2, з використанням як вихідних продуктів фільтрують. Тверду речовину переносять у суміш 0,6г 60% гідриду натрію в 20мл 1,2дихлорметан/метанол (90/10 за об'ємом), диметоксіетану, 3,2мл триетилфосфоноацетату і фільтрують і фільтрат очищають хроматографією 1,8г 3-гідрокси-2-етил-2,3-дигідроізоіндол-1-ону. під тиском аргону (60кПа) на колонці з силікагелем Неочищений продукт очищають хроматографією (розмір частинок 15-40мкм) при елююванні під тиском аргону (60кПа) на колонці з силікагелем сумішшю дихлорметан/метанол (90/10 за (розмір частинок 15-40мкм) при елююванні об'ємом). Фракції, що містять очікуваний продукт, сумішшю циклогексан/етилацетат (50/50 за об'єднують і концентрують досуха при зниженому об'ємом). Фракції, що містять очікуваний продукт, тиску (2кПа) і температурі приблизно 40°С. У об'єднують і концентрують досуха при зниженому результаті одержують 0,05г N-[(2-ізопропіл-3-оксотиску (2кПа) і температурі приблизно 30°С. У 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідину у результаті одержують 2,0г етил(2-етил-3-оксо-2,3вигляді білої твердої речовини. Мас-спектр ЕІ: m/e дигідро-1Н-ізоіндол-1-іл)ацетату у вигляді блідо274 (M+), m/e 187, m/e 132. Інфрачервоний спектр жовтого масла. (Rf=0,7, тонкошарова (КBr): 3412; 1974; 1667; 1603; 1531; 1367 і 698см-1. хроматографія на силікагелі, елюент: суміш b) Етил(2-ізопропіл-3-оксо-2,3-дигідро-1Ндихлорйетан/метанол (90/10 за об'ємом)). ізоіндол-1-іл)ацетат с) 3-Гідрокси-2-етил-2,3-дигідроізоіндол-1-он Етил(2-ізопропіл-3-оксо-2,3-дигідро-1Н3-Гідрокси-2-етил-2,3-дигідроізоіндол-1-он ізоіндол-1-іл)ацетат одержують, дотримуючись одержують, дотримуючись методики прикладу 1, з методики прикладу 2, з використанням як вихідних використанням як вихідних продуктів 4,0г Nпродуктів 0,63г 60% гідриду натрію у 20мл 1,2 41 81118 42 диметоксіетану, 3,1мл триетилфосфоноацетату і b) Етил(2-циклопропілметил-3-оксо-2,32,0г 3-гідрокси-2-ізопропіл-2,3-дигідроізоіндол-1дигідро-1Н-ізоіндол-1-іл)ацетат ону. Неочищений продукт очищають Етил(2-циклопропілметил-3-оксо-2,3-дигідрохроматографією під тиском аргону (60кПа) на 1Н-ізоіндол-1-іл)ацетат одержують, дотримуючись колонці з силікагелем (розмір частинок 15-40мкм) методики прикладу 2, з використанням як вихідних при елююванні сумішшю циклогексан/етилацетат продуктів 0,61г 60% гідриду натрію в 20мл 1,2(60/40 за об'ємом). Фракції, що містять очікуваний диметоксіетану, 3,0мл триетилфосфоноацетату і продукт, об'єднуютьі концентрують досуха при 1,55г 3-гідрокси-2-циклопропілметил-2,3-дигідрозниженому тиску (2кПа) і температурі приблизно ізоіндол-1-ону. Неочищений продукт очищають 30°С. У результаті одержують 0,84г етил(2хроматографією під тиском аргону (60кПа) на ізопропіл-3-оксо-2,3-дигідро-1Н-ізоіндол-1колонці з силікагелем (розмір частинок 15-40мкм) іл)ацетату у вигляді блідо-жовтого масла. (Rf=0,7, при елююванні сумішшю циклогексан/етилацетат тонкошарова хроматографія на силікагелі, елюент: (70/30 за об'ємом). Фракції, що містять очікуваний суміш дихлорметанол/метанол (90/10 за об'ємом)). продукт, об'єднують і концентрують досуха при c) 3-Гідрокси-2-ізопропіл-2,3-дигідроізоіндол-1зниженому тиску (2кПа) і температурі приблизно он 30°С. У результаті одержують 1,45г етил(23-Гідрокси-2-ізопропіл-2,3-дигідроізоіндол-1-он циклопропілметил-3-оксо-2,3-дигідро-1Н-ізоіндолодержують, дотримуючись методики прикладу 1, з 1-іл)ацетату у вигляді безбарвного масла (Rf=0,52, використанням як вихідних продуктів 4,0г Nтонкошарова хроматографія на силікагелі, елюент: ізопропілфталіміду у 20мл метанолу і 1,1г суміш циклогексан/етилацетат 50/50 за об'ємом)). боргідриду калію. Реакційну суміш перемішують с) 3-гiдрокси-2-циклопропілметил-2,3при температурі приблизно 20°С протягом 20 дигідроізоіндол-1-он годин, потім охолоджують до температури 3-Гідрокси-2-циклопропілметил-2,3приблизно 0°С і додають по краплях дистильовану дигідроізоіндол-1-он одержують, дотримуючись воду. Потім розчинник випарюють досуха при методики прикладу 1, з використанням як вихідних зниженому тиску (2кПа) і температурі приблизно продуктів 4,3г N-циклопропілметилфталіміду у 35°С. У результаті одержують 6,1г 3-гідрокси-240мл метанолу і 1,2г боргідриду калію. Реакційну ізопропіл-2,3-дигідроізоіндол-1-ону у вигляді білого суміш перемішують при температурі приблизно воску. (Rf=0,65, тонкошарова хроматографія на 20°С протягом 20 годин, потім охолоджують до силікагелі, елюент: суміш циклогексан/етилацетат температури приблизно 0°С і додають по краплях (30/70 за об'ємом)). дистильовану воду. Одержаний залишок Приклад 8 відфільтровують, одержану тверду речовину потім а) N-[2-(2-циклопропілметил-3-оксо-2,3переносять у дихлорметан і концентрують досуха дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин при зниженому тиску (2кПа) і температурі близько 40°С. У результаті одержують 4,1г 3-гідрокси-2циклопропілметил-2,3-дигідроізоіндол-1-ону у вигляді білого порошку (Rf=0,38, тонкошарова хроматографія на силікагелі, елюент: суміш циклогексан/етилацетат (50/50 за об'ємом)). d) N-циклопропілметилфталімід N-циклопропілметилфталімід одержують, дотримуючись методики прикладу 2, з використанням як вихідних продуктів 4г ангідриду фталевої кислоти, 2,3мл циклопропілметиламіну і каталітичної кількості паратолуолсульфонової кислоти в 40мл толуолу. Реакційну суміш нагрівають при температурі приблизно 140°С Ν-[(2-циклопропілметил-3-оксо-2,3-дигідро-1Нпротягом 2-х годин, потім охолоджують до ізоіндол-1-іл)ацетил]гуанідин одержують, температури приблизно 20°С і перемішують дотримуючись методики прикладу 1, з протягом 16 годин. Реакційну суміш концентрують використанням як вихідних продуктів 2,9г третдосуха при зниженому тиску (2кПа) і температурі бутоксиду калію, 2,5г гуанідинійхлориду і 1,5г приблизно 40°С. Залишок переносять у етил(2-циклопропілметил-3-оксо-2,3-дигідро-1Ндихлорметан і двічі промивають насиченим ізоіндол-1-іл)ацетату. Реакційну суміш водним розчином бікарбонату натрію. Після перемішують при температурі приблизно 20°С осадження фаз відділяють органічну фазу, сушать протягом 20 годин і потім додають 20мл води. над сульфатом магнію, фільтрують і потім Водну фазу екстрагують 3 рази 100мл концентрують досуха при зниженому тиску (2кПа) і етилацетату. Органічні екстракти об'єднують і температурі приблизно 40°С. У результаті потім концентрують досуха при зниженому тиску одержують 4,3г N-циклопропілметилфталіміду у (0,6кПа) і температурі приблизно 35°С. Залишок вигляді пухнастої білої твердої речовини (Rf=0,46, переносять у воду, розтирають, відфільтровують і тонкошарова хроматографія на силікагелі, елюент: потім сушать в ексикаторі. У результаті одержують суміш циклогексан/етилацетат (40/60 за об'ємом)). 1,2г N-[(2-циклопропілметил-3-оксо-2,3-дигідро-1НПриклад 9 ізоіндол-1-іл)ацетил]гуанідину у вигляді не зовсім а) N-[2-(2-бензил-3-оксо-2,3-дигідро-1Нбілого порошку, що плавиться при 229°С. Масізоіндол-1-іл)ацетил]гуанідин спектр: DCI: m/e 287 (М+Н)+. 43 0,22г натрію додають до 20мл абсолютного етанолу в інертній атмосфері. Після повного зникнення натрію додають 0,94г гуанідинійхлориду. Реакційну суміш перемішують в інертній атмосфері при температурі приблизно 20°С протягом 1 години і, потім додають розчин 2г етил(2-бензил-3-оксо-2,3-дигідро-1Н-ізоіндол-1іл)ацетату в 5мл абсолютного етанолу. Реакційну суміш перемішують при температурі приблизно 20°С протягом 18 годин і потім концентрують досуха при зниженому тиску (2кПа) і температурі близько 40°С. Залишок переносять у суміш 10мл води і 30мл діетилового ефіру і потім перемішують при температурі приблизно 0°С протягом 15 хвилин. Одержаний осад відфільтровують, промивають двічі 10мл охолодженої льодом води і потім сушать в ексикаторі при зниженому тиску (2кПа) і температурі приблизно 20°С. У результаті одержують 1,2г N-[(2-бензил-3-оксо-2,3-дигідро1Н-ізоіндол-1-іл)ацетил]гуанідину у вигляді білого порошку, що плавиться при 222-225°С. Інфрачервоний спектр (КBr) 3488; 3410; 3344; 1662; 1621; 1521; 1382 і 704 см-1. b) Етил(2-бензил-3-оксо-2,3-дигідро-1Нізоіндол-1-іл)ацетат Етил(2-бензил-3-оксо-2,3-дигідро-1Н-ізоіндол1-іл)ацетат одержують, дотримуючись методики прикладу 2, з використанням як вихідних продуктів 3,2г 60% гідриду натрію в 200мл 1,2диметоксіетану, 16,4мл триетилфосфоноацетату і 9,5г 3-гідрокси-2-бензил-2,3-дигідроізоіндол-1-ону. Суміш кип'ятять зі зворотним холодильником протягом 18 годин і потім охолоджують до температури приблизно 20°С. Реакційну суміш обробляють 100мл води і потім 100мл етилацетату. Після розділення фаз осадженням водну фазу екстрагують двічі 100мл етилацетату. Органічні екстракти об'єднують, промивають 50мл насиченого розчину солі, сушать над сульфатом магнію, фільтрують і потім концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 40°С. Залишок очищають хроматографією під тиском аргону (60кПа) на колонці з силікагелем (розмір частинок 15-40мкм) при послідовному елююванні сумішами циклогексан/етилацетат (75/25 і потім 67/33 за об'ємом). Фракції, що містять очікуваний продукт, об'єднують і концентрують, досуха при зниженому тиску (2кПа) і температурі приблизно 40°С. У результаті одержують 8,7г етил(2-бензил-3-оксо2,3-дигідро-1Н-ізоіндол-1-іл)ацетату у вигляді в'язкого жовтого масла. (Rf=0,35, тонкошарова хроматографія на силікагелі, елюент: суміш циклогексан/етилацетат (75/25 за об'ємом)). с) 3-Гідрокси-2-бензил-2,3-дигідроізоіндол-1-он 81118 44 3-Гідрокси-2-бензил-2,3-дигідроізоіндол-1-он одержують, дотримуючись методики прикладу 1, з використанням як вихідних продуктів 10,2г Nбензилфталіміду в 100мл метанолу і 2,6г боргідриду калію. Реакційну суміш перемішують при температурі приблизно 20°С протягом 20 годин, потім охолоджують до температури приблизно 0°С і додають по краплях 50мл дистильованої води. Потім метанол частково випарюють при зниженому тиску (2кПа) і температурі приблизно 40°С і додатково додають 50мл дистильованої води. Водну фазу екстрагують 3 рази 50мл етилацетату. Органічні екстракти об'єднують, промивають 50мл насиченого розчину солі, сушать над сульфатом магнію, фільтрують і потім концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 40°С. Залишок сушать в ексикаторі при зниженому тиску (2кПа) і температурі приблизно 20°С. У результаті одержують 9,5г 3-гідрокси-2-бензил-2,3дигідроізоіндол-1-ону у вигляді білого порошку. (Rf=0,20, тонкошарова хроматографія на силікагелі, елюент: суміш циклогексан/етилацетат (75/25 за об'ємом)). d) N-бензилфталімід N-бензилфталімід одержують, дотримуючись методики прикладу 2, з використанням як вихідних продуктів 10г ангідриду фталевої кислоти, 7,3мл бензиламіну і каталітичної кількості паратолуолсульфонової кислоти у 100мл толуолу. Реакційну суміш нагрівають при температурі приблизно 140°С протягом 3-х годин і потім охолоджують до температури приблизно 20°С. Реакційну суміш переносять в 100мл насиченого водного розчину бікарбонату натрію і водну фазу екстрагують двічі 100мл етилацетату. Органічні екстракти об'єднують, промивають 50мл насиченого розчину солі, сушать над сульфатом магнію, фільтрують і потім концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 40°С. Залишок сушать в ексикаторі при зниженому тиску (2кПа) і температурі приблизно 20°С. У результаті одержують 10,3г Nбензилфталіміду у вигляді білого порошку. (Rf=0,44, тонкошарова хроматографія на силікагелі, елюент: суміш циклогексан/етилацетат (75/25 за об'ємом)). Приклад 10 a) N-[2-(6-трет-бутил-2-ізобутил-3-оксо-2,3дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин N-[(6-трет-бутил-2-ізобутил-3-оксо-2,3-дигідро1Н-ізоіндол-1-іл)ацетил]гуанідин одержують, дотримуючись методики прикладу 9, з використанням як вихідних продуктів 20мл абсолютного етанолу, 0,37г натрію, 1,56г 45 81118 46 гуанідинійхлориду і 3,53г етил(6-трет-бутил-2силікагелі, елюент: суміш циклогексан/етилацетат ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1(75/25 за об'ємом)). іл)ацетату в 10мл абсолютного етанолу. Реакційну с) 5-Трет-бутил-3-гідрокси-2-ізобутил-2,3суміш перемішують при температурі приблизно дигідроізоіндол-1-он і 6-трет-бутил-3-гідрокси-220°С протягом 16 годин і потім концентрують ізобутил-2,3-дигідроізоіндол-1-он досуха при зниженому тиску (2кПа) і температурі 5-Трет-бутил-3-гідрокси-2-ізобутил-2,3приблизно 40°С. Залишок переносять у суміш дигідроізоіндол-1-он і 6-трет-бутил-3-гідрокси-215мл води і 45мл діетилового ефіру і потім ізобутил-2,3-дигідроізоіндол-1-он одержують, перемішують при температурі приблизно 0°С дотримуючись методики прикладу 1, з протягом 2-х годин. Одержаний осад використанням як вихідних продуктів 10,4г 4-третвідфільтровують, двічі промивають 10мл бутил-Н-ізобутилфталіміду у 60мл метанолу і 2,3г охолодженої льодом води і потім сушать в боргідриду калію. Реакційну суміш перемішують ексикаторі при зниженому тиску (2кПа) і при температурі приблизно 20°С протягом 19 температурі приблизно 20°С. У результаті годин, потім охолоджують до температури одержують 2,5г N-[(6-трет-бутил-2-ізобутил-3-оксоприблизно 0°С і додають по краплях 50мл 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідину у дистильованої води. Потім метанол частково вигляді коричневого порошку, що плавиться при випарюють при зниженому тиску (2кПа) і 214-215°С. Мас-спектр: DCI: m/e 345 (М+Н)+. температурі приблизно 40°С і додатково додають b) Етил(5-трет-бутил-2-ізобутил-3-оксо-2,350мл дистильованої води. Водну фазу двічі дигідро-1Н-ізоіндол-1-іл)ацетат і етил(6-третекстрагують 100мл етилацетату. Органічні бутил-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1екстракти об'єднують, промивають 50мл іл)ацетат насиченого розчину солі, сушать над сульфатом Етил(5-трет-бутил-2-ізобутил-3-оксо-2,3магнію, фільтрують і потім концентрують досуха дигідро-1Н-ізоіндол-1-іл)ацетат і етил(6-третпри зниженому тиску (2кПа) і температурі бутил-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1приблизно 40°С. Залишок сушать в ексикаторі при іл)ацетат одержують, дотримуючись методики зниженому тиску (2кПа) і температурі приблизно прикладу 2, з використанням як вихідних продуктів 20°С. У результаті одержують 9,9г суміші 5-трет2,9г 60% гідриду натрію у 200мл 1,2бутил-3-гідрокси-2-ізобутил-2,3-дигідроізоіндол-1диметоксіетану, 15,2мл триетилфосфоноацетату і ону і 6-трет-бутил-3-гідрокси-2-ізобутил-2,39,6г суміші 5-трет-бутил-3-гідрокси-2-ізобутил-2,3дигідроізоіндол-1-ону у вигляді жовтої піни. дигідроізоіндол-1-ону і 6-трет-бутил-3-гідрокси-2(Rf=0,26 і 0,30, межі не визначені, тонкошарова ізобутил-2,3-дигідроізоіндол-1-ону. Суміш хроматографія на силікагелі, елюент: суміш кип'ятять зі зворотним холодильником протягом 18 циклогексан/етилацетат (75/25 за об'ємом)). годин і потім охолоджують до температури d) 4-Трет-бутил-N-ізобутилфталімід приблизно 20°С. Реакційну суміш обробляють 4-Трет-бутил-N-ізобутилфталімід одержують, 110мл води і потім 100мл етилацетату. Після дотримуючись методики прикладу 2, з розділення фаз осадженням водну фазу використанням як вихідних продуктів 10г ангідриду екстрагують двічі 100мл етилацетату. Органічні 4-трет-бутилфталевої кислоти і 4,9мл екстракти об'єднують, промивають 100мл ізобутиламіду в 100мл толуолу. Реакційну суміш насиченого розчину солі, сушать над сульфатом нагрівають при температурі приблизно 75°С магнію, фільтрують і потім концентрують досуха протягом 10 хвилин, потім додають каталітичну при зниженому тиску (2кПа) і температурі кількість паратолуолсульфонової кислоти і суміш приблизно 40°С. Залишок розділяють ВЕРХ нагрівають при температурі приблизно 140°С хроматографією на колонці з хіральною протягом 3-х годин. Після охолоджування до стаціонарною фазою WHELK-01SS з розміром температури приблизно 60°С, реакційну суміш частинок 10мкм при послідовному елююванні концентрують досуха при зниженому тиску (2кПа). сумішами гептан/ізопропанол (90/10 і потім 50/50 Залишок переносять у суміш 50мл води і 30мл за об'ємом). Фракції, що містять перший насиченого водного розчину бікарбонату натрію і регіоізомер, об'єднують і концентрують при водну фазу екстрагують двічі 200мл зниженому тиску (1кПа) і температурі приблизно дихлорметану. Органічні екстракти об'єднують, 40°С. Залишок сушать при зниженому тиску (3кПа) промивають 50мл насиченого розчину солі, і температурі приблизно 40°С. У результаті сушать над сульфатом магнію, фільтрують і потім одержують 1,81г етил (5-трет-бутил-2-ізобутил-3концентрують досуха при зниженому тиску (2кПа) і оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетату у вигляді температурі приблизно 40°С. Залишок сушать в в'язкого сірого масла (Rf=0,43, тонкошарова ексикаторі при зниженому тиску (2кПа) і хроматографія на силікагелі, елюент: суміш температурі приблизно 20°С. У результаті циклогексан/етилацетат (75/25 за об'ємом)). одержують 10,4г 4-трет-бутил-N-ізобутилфталіміду Фракції, що містять другий регіоізомер, об'єднують у вигляді в'язкого жовтого масла. (Rf=0,75, і концентрують при зниженому тиску (1кПа) і тонкошарова хроматографія на силікагелі, елюент: температурі приблизно 40°С. Залишок сушать при суміш циклогексан/етилацетат (75/25 за об'ємом)). зниженому тиску (3кПа) і температурі приблизно Приклад 11 40°С. У результаті одержують 3,53г етил(6-третN-[2-(5-трет-бутил-2-ізобутил-3-оксо-2,3бутил-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин іл)ацетату у вигляді в'язкого сірого масла. (Rf=0,38, тонкошарова хроматографія на 47 81118 48 15мл води і 45мл діетилового ефіру і потім перемішують при температурі приблизно 0°С протягом 4-х годин. Одержаний осад відфільтровують, промивають двічі 20мл охолодженої льодом води і потім сушать в ексикаторі при зниженому тиску (2кПа) і температурі приблизно 20°С. У результаті одержують 1г N-[(5-хлор-2-ізобутил-3-оксо-2,3дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідину і N-[(6хлор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1N-[(5-трет-бутил-2-ізобутил-3-оксо-2,3-дигідроіл)ацетил]гуанідину у вигляді білого порошку. 1Н-ізоіндол-1-іл)ацетил]гуанідин одержують, (Аналіз: C15H19CIN4O2, обчислено, % С: 55,81, Н: дотримуючись методики прикладу 9, з 5,93, СІ: 10,98, N: 17,36, О: 9,91; знайдено, % С: використанням як вихідних продуктів 10мл 55,67, Н: 6,18, СІ: 11,32, N:17,05). Мас-спектр: DCI: абсолютного етанолу, 0,19г натрію, 0,80г m/е 323 (М+Н)+. гуанідинійхлориду і 1,81г етил(5-трет-бутил-2b) Етил(5-хлор-2-ізобутил-3-оксо-2,3-дигідроізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-11Н-ізоіндол-1-іл)ацетат і етил(6-хлор-2-ізобутил-3іл)ацетату в 10мл абсолютного етанолу. Реакційну оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетат суміш перемішують при температурі приблизно Етил(5-хлор-2-ізобутил-3-оксо-2,3-дигідро-1Н20°С протягом 18 годин і потім концентрують ізоіндол-1-іл)ацетат і етил(6-хлор-2-ізобутил-3досуха при зниженому тиску (2кПа) і температурі оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетат приблизно 40°С. Залишок переносять у суміш одержують, дотримуючись методики прикладу 2, з 10мл води і 30мл діетилового ефіру і потім використанням як вихідних продуктів 4г 60% перемішують при температурі приблизно 0°С гідриду натрію у 200мл 1,2-диметоксіетану, 20,3мл протягом 1 години. Одержаний осад триетилфосфоноацетату і 12г 5-хлор-3-гідрокси-2відфільтровують, промивають двічі 10мл ізобутил-2,3-дигідроізоіндол-1-ону і 6-хлор-3охолодженої льодом води і потім сушать в гідрокси-2-ізобутил-2,3-дигідроізоіндол-1-ону. ексикаторі при зниженому тиску (2кПа) і Суміш кип'ятять зі зворотним холодильником температурі приблизно 20°С. У результаті протягом 18 годин і потім охолоджують до одержують 1,1г N-[(5-трет-бутил-2-ізобутил-3-оксотемператури приблизно 20°С. Реакційну суміш 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідину у обробляють 200мл води і потім 100мл вигляді білого порошку, що плавиться при 262етилацетату. Після розділення фаз осадженням 263°С. Етил(5-трет-бутил-2-ізобутил-3-оксо-2,3водну фазу екстрагують двічі 200мл етилацетату. дигідро-1Н-ізоіндол-1-іл) ацетат описаний у Органічні екстракти об'єднують, промивають прикладі 10. (Аналіз: C19H28N4O2, обчислено, % С: 100мл насиченого розчину солі, сушать над 66,25, Н: 8,19, N:16,27, О: 9,29; знайдено, % С: сульфатом магнію, фільтрують і потім 66,13, Н: 8,50, N:16,12). концентрують досуха при зниженому тиску (2кПа) і Приклад 12 температурі приблизно 40°С. Залишок очищають а) N-[2-(5-хлор-2-ізобутил-3-оксо-2,3-дигідрохроматографією під тиском аргону (60кПа) на 1Н-ізоіндол-1-іл)ацетил]гуанідин і N-[(6-хлор-2колонці з силікагелем (розмір частинок 32-63мкм) ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1при послідовному елююванні сумішами іл)ацетил]гуанідин циклогексан/етилацетат (90/10 і потім 80/20 за об'ємом). Фракції, що містять очікуваний продукт, об'єднують і концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 40°С. У результаті одержують 3,1г етил(5-хлор-2-ізобутил3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетату і етил(6-хлор-2-ізобутил-3-оксо-2,3-дигідро-1Нізоіндол-1-іл)ацетату у вигляді в'язкого жовтого масла. (Rf=0,34, тонкошарова хроматографія на силікагелі, елюент: суміш циклогексан/етилацетат (75/25 за об'ємом)). N-[(5-хлор-2-ізобутил-3-оксо-2,3-дигідро-1Нc) 5-Хлор-3-гідрокси-2-ізобутил-2,3ізоіндол-1-іл)ацетил]гуанідин і N-[(6-хлор-2дигідроізоіндол-1-он і 6-хлор-3-гідрокси-2-ізобутилізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-12,3-дигідроізоіндол-1-он іл)ацетил]гуанідин одержують, дотримуючись 5-Хлор-3-гідрокси-2-ізобутил-2,3методики прикладу 9, з використанням як вихідних дигідроізоіндол-1-он і 6-хлор-3-гідрокси-2-ізобутилпродуктів 20мл абсолютного етанолу, 0,35г натрію, 2,3-дигідроізоіндол-1-он одержують, 1,46г гуанідинійхлориду і 3,1г етил(5-хлор-2дотримуючись методики прикладу 1, з ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1використанням як вихідних продуктів 12г 4-хлор-Nіл)ацетату і етил(6-хлор-2-ізобутил-3-оксо-2,3ізобутилфталіміду, 100мл метанолу і 3г боргідриду дигідро-1Н-ізоіндол-1-іл)ацетату в 15мл калію. Реакційну суміш перемішують при абсолютного етанолу. Реакційну суміш температурі приблизно 20°С протягом 20 годин, перемішують при температурі приблизно 20°С потім охолоджують до температури приблизно 0°С протягом 18 годин і потім концентрують досуха і додають по краплях 100мл дистильованої води. при зниженому тиску (2кПа) і температурі Потім частково випарюють метанол при приблизно 40°С. Залишок переносять у суміш 49 81118 50 зниженому тиску (2кПа) і температурі приблизно при зниженому тиску (2кПа) і температурі 40°С. Водну фазу екстрагують двічі 150мл приблизно 40°С. Залишок переносять у суміш етилацетату. Органічні екстракти об'єднують, 100мл води і 200мл етилацетату. Органічну фазу промивають 50мл насиченого розчину солі, промивають 100мл води і потім 150мл насиченого сушать над сульфатом магнію, фільтрують і потім розчину хлориду натрію. Вказану органічну фазу концентрують досуха при зниженому тиску (2кПа) і сушать над сульфатом магнію і концентрують при температурі приблизно 40°С. Залишок сушать в зниженому тиску (2кПа) і температурі приблизно ексикаторі при зниженому тиску (2кПа) і 40°С. У результаті одержують білу тверду температурі приблизно 20°С. У результаті речовину, яку потім знову переносять у суміш одержують 12г 5-хлор-3-гідрокси-2-ізобутил-2,315мл води і 50мл діетилового ефіру і перемішують дигідроізоіндол-1-ону і 6-хлор-3-гідрокси-2протягом 1,5 годин при температурі приблизно ізобутил-2,3-дигідроізоіндол-1-ону у вигляді білого 20°С. Одержану таким чином білу тверду речовину порошку. (Rf=0,15, тонкошарова хроматографія на відфільтровують, промивають двічі 50мл силікагелі, елюент: суміш циклогексан/етилацетат діетилового ефіру і сушать в ексикаторі при (75/25 за об'ємом)). зниженому тиску (2Па) і температурі приблизно d) 4-Хлор-N-ізобутилфталімід 35°С. У результаті одержують 0,92г N-[(5-бром-24-Хлор-N-ізобутилфталімід одержують, ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1дотримуючись методики прикладу 2, з іл)ацетил]гуанідину і N-(6-бром-2-ізобутал-3-оксовикористанням як вихідних продуктів 10г ангідриду 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідину у 4-хлорфталевої кислоти, 5,4мл ізобутиламіну і вигляді білого порошку. (Аналіз: C15H19BrN4O2, каталітичної кількості паратолуолсульфонової обчислено, % С: 49,06, Н: 5,21, Br: 21,76, N: 15,26, кислоти у 100мл толуолу. Реакційну суміш О: 8,71; знайдено, % С: 48,97, Н: 5,34, СІ: 14,72, N: нагрівають при температурі приблизно 140°С 21,52). Мас-спектр: El: m/e 366 (M+), m/e 279, m/e протягом 16 годин і потім охолоджують до 86 (основний пік). температури приблизно 20°С. Реакційну суміш b) Етил(5-бром-2-ізобутил-3-оксо-2,3-дигідропереносять в 100мл насиченого водного розчину 1Н-ізоіндол-1-іл)ацетат і етил(6-бром-2-ізобутил-3бікарбонату натрію і водну фазу екстрагують двічі оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетат 100мл етилацетату. Органічні екстракти Етил(5-бром-2-ізобутил-3-оксо-2,3-дигідро-1Ноб'єднують, промивають 50мл насиченого розчину ізоіндол-1-іл)ацетат і етил(6-бром-2-ізобутил-3солі, сушать над сульфатом магнію, фільтрують і оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетат потім концентрують досуха при зниженому тиску одержують, дотримуючись методики прикладу 2, з (2кПа) і температурі приблизно 40°С. Залишок використанням як вихідних продуктів 5,0г 60% сушать в ексикаторі при зниженому тиску (2кПа) і гідриду натрію у 250мл 1,2-диметоксіетану, 24,8мл температурі приблизно 20°С. У результаті триетилфосфоноацетату і 23,7г 5-бром-3-гідроксиодержують 12г 4-хлор-N-ізобутилфталіміду у 2-ізобутил-2,3-дигідроізоіндол-1-ону і 6-бром-3вигляді білого порошку. (Rf=0,85, тонкошарова гідрокси-2-ізобутил-2,3-дигідроізоіндол-1-ону. хроматографія на силікагелі, елюент: суміш Суміш кип'ятять зі зворотним холодильником циклогексан/етилацетат (75/25 за об'ємом)). протягом 4-х годин і потім охолоджують до Приклад 13 температури приблизно 20°С. Реакційну суміш а) N-[2-(5-бром-2-ізобутил-3-оксо-2,3-дигідрообробляють 300мл води і потім суміш екстрагують 1Н-ізоіндол-1-іл)ацетил]гуанідин і N-[(6-бром-23 рази 250мл діетилового ефіру. Органічні ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1екстракти об'єднують, промивають 300мл іл)ацетил]гуанідин насиченого розчину солі, сушать над сульфатом магнію, фільтрують і потім концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 40°С. Залишок очищають хроматографією під тиском аргону (80кПа) на колонці з силікагелем (розмір частинок 32-63мкм) при послідовному елююванні сумішами циклогексан/етилацетат (95/5 за об'ємом), циклогексан/метанол (90/10) і циклогексан/етилацетат (80,20). Фракції, що містять очікуваний продукт, об'єднують і концентрують досуха при зниженому тиску (2кПа) і N-[(5-бром-2-ізобутил-3-оксо-2,3-дигідро-1Нтемпературі близько 40°С. У результаті одержують ізоіндол-1-іл)ацетил]гуанідин і N-[(6-бром-23,72г етил(5-бром-2-ізобутил-3-оксо-2,3-дигідроізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-11Н-ізоіндол-1-іл)ацетату і етил(6-бром-2-ізобутиліл)ацетил]гуанідин одержують, дотримуючись 3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетату у методики прикладу 9, з використанням як вихідних вигляді безбарвного масла. (Rf=0,70, тонкошарова продуктів 30мл абсолютного етанолу, 0,36г натрію, хроматографія на силікагелі, елюент: суміш 1,5г гуанідинійхлориду і 3,7г етил(5-бром-2циклогексан/етилацетат (50/50 за об'ємом)). ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1c) 5-Бром-3-гідрокси-2мзобутил-2,3іл)ацетату і етил(6-бром-2-ізобутил-3-оксо-2,3дигідроізоіндол-1-он і 6-бром-3-гідрокси-2дигідро-1Н-ізоіндол-1-іл)ацетату в 20мл ізобутил-2,3-дигідроізоіндол-1-он абсолютного етанолу. Реакційну суміш 5-Бром-3-гідрокси-2-ізобутил-2,3перемішують при температурі приблизно 20°С дигідроізоіндол-1-он і 6-бром-3-гідрокси-2протягом 16 годин і потім концентрують досуха 51 81118 52 ізобутил-2,3-дигідроізоіндол-1-он одержують, ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1дотримуючись методики прикладу 1, з іл)ацетату в 10мл абсолютного етанолу. Реакційну використанням як вихідних продуктів 23,6г 4-бромсуміш перемішують при температурі приблизно N-зобутилфталіміду у 200мл метанолу і 4,5г 20°С протягом 16 годин і потім знову концентрують боргідриду калію. Реакційну суміш перемішують досуха при зниженому тиску (2кПа) і температурі при температурі приблизно 20°С протягом 16 приблизно 40°С. Потім залишок переносять у годин, потім охолоджують до температури суміш 5мл води і 15мл діетилового ефіру і потім приблизно 0°С і додають по краплях 175мл знову концентрують досуха при таких же умовах. дистильованої води. Потім частково випарюють Залишок переносять у 100мл етилацетату, метанол при зниженому тиску (2кПа) і температурі органічну фазу промивають двічі 60мл водного 1Н приблизно 40°С. Водну фазу екстрагують 3 рази розчину гідроксиду натрію і потім двічі 60мл 4Н 200мл етилацетату. Органічні екстракти розчину хлористоводневої кислоти. Кислі водні об'єднують, сушать над сульфатом магнію, екстракти об'єднують, обробляють водним 30% фільтрують і потім концентрують досуха при розчином гідроксиду натрію до рН 14 і потім зниженому тиску (2кПа) і температурі приблизно екстрагують 3 рази 50мл етилацетату. Органічні 40°С. У результаті одержують 23,7г 5-бром-3екстракти об'єднують, промивають 100мл гідрокси-2-ізобутил-2,3-дигідроізоіндол-1-ону і 6насиченого розчину хлориду натрію, сушать над бром-3-гідрокси-2-ізобутил-2,3-дигідроізоіндол-1сульфатом магнію і концентрують досуха при ону у вигляді білого порошку. (Rf=0,79, зниженому тиску (2кПа) і температурі приблизно тонкошарова хроматографія на силікагелі, елюент: 40°С. Одержану таким чином жовту тверду суміш циклогексан/етилацетат (50/50 за об'ємом)). речовину переносять у 20мл діетилового ефіру, d) 4-Бром-N-ізобутилфталімід перемішують при температурі приблизно 20°С 4-Бром-N-ізобутилфталімід одержують, протягом 1 години і потім відфільтровують. Тверду дотримуючись методики прикладу 2, з речовину промивають двічі 20мл діетилового використанням як вихідних продуктів 20г ангідриду ефіру і потім сушать в ексикаторі при зниженому 4-бромфталевої кислоти, 9,2мл ізобутиламіну і тиску (2Па) і температурі приблизно 35°С. У каталітичної кількості паратолуолсульфонової результаті одержують 0,34г N-[(5-трифторметил-2кислоти у 200мл толуолу. Реакційну суміш ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1нагрівають при температурі приблизно 140°С іл)ацетил]гуанідину у вигляді жовтого порошку, що протягом 6 годин і потім охолоджують до плавиться при 224°С. (Аналіз: С16Н19F3N4О2, температури приблизно 20°С. Реакційну суміш обчислено, % С: 53,93, Н: 5,37, F: 15,99, N: 15,72, концентрують досуха при зниженому тиску (2кПа) і О: 8,98; знайдено, % С: 53,95, Н: 5,15, F: 15,00, N: температурі приблизно 40°С і потім залишок 15,59). переносять в 350мл етилацетату і 300мл Приклад 15 насиченого розчину бікарбонату натрію. Після а) N-[2-(2-ізобутил-3-оксо-6-трифторметил-2,3осадження відділяють водну фазу і потім дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин екстрагують двічі 350мл етилацетату. Об'єднані органічні екстракти промивають 300мл насиченого розчину солі, сушать над сульфатом магнію, фільтрують і потім концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 40°С. У результаті одержують 23,6г 4-бром-Nізобутилфталіміду у вигляді білого порошку. (Rf=0,91, тонкошарова хроматографія на силікагелі, елюент: суміш циклогексан/етилацетат (50/50 за об'ємом)). Приклад 14 N-[2-(2-ізобутил-3-оксо-6-трифторметил-2,3N-[2-(2-ізобутил-3-оксо-5-трифторметил-2,3дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин одержують, дотримуючись методики прикладу 9, з використанням як вихідних продуктів 10мл абсолютного метанолу, 0,13г натрію, 0,52г гуанідинійхлориду і 1,25г етил(6-трифторметил-2ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1іл)ацетату в 10мл абсолютного етанолу. Реакційну суміш перемішують при температурі приблизно 20°С протягом 16 годин і потім концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 40°С. Потім залишок переносять у суміш 5мл води і 15мл діетилового ефіру і потім N-[2-(2-ізобутил-3-оксо-5-трифторметил-2,3знову концентрують досуха при таких же умовах. дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин Залишок переносять в 100мл етилацетату і одержують, дотримуючись методики прикладу 9, з органічну фазу промивають двічі 50мл водного 1Н використанням як вихідних продуктів 10мл розчину гідроксиду натрію і потім 30мл водного 4Н абсолютного етанолу, 0,19г натрію, 0,78г розчину хлористоводневої кислоти. Кислу водну гуанідинійхлориду і 1,86г етил(5-трифторметил-2фазу обробляють водним 30% розчином 53 81118 54 гідроксиду натрію до рН 14 і потім екстрагують 3 40°С. У результаті одержують 1,25г етил(6рази 50мл етилацетату. Органічні екстракти трифторметил-2-ізобутил-3-оксо-2,3-дигідро-1Ноб'єднують і промивають насиченим розчином ізоіндол-1-іл)ацетату у вигляді безбарвного хлориду натрію, сушать над сульфатом магнію і в'язкого масла. (Rf=0,46, тонкошарова потім концентрують досуха при зниженому тиску хроматографія на силікагелі, елюент: суміш (2кПа) і температурі приблизно 40°С. Одержану циклогексан/етилацетат (75/25 за об'ємом)). таким чином білу тверду речовину переносять у с) 5-Трифторметил-3-гідрокси-2-ізобутил-2,320мл діетилового ефіру, перемішують при дигідроізоіндол-1-он і 6-трифторметил-3-гідрокситемпературі приблизно 20°С і потім фільтрують. 2?ізобутил-2,3-дигідроізоіндол-1-он Тверду речовину сушать в ексикаторі при 5-Трифторметил-3-гідрокси-2-ізобутил-2,3зниженому тиску (2кПа) і температурі приблизно дигідроізоіндол-1-он і 6-трифторметил-3-гідрокси20°С. У результаті одержують 0,099г N-[2-(22-ізобутил-2,3-дигідроізоіндол-1-он одержують, ізобутил-3-оксо-6-трифторметил-2,3-дигідро-1Ндотримуючись методики прикладу 1, з ізоіндол-1-іл)ацетил]гуанідину у вигляді блідовикористанням як вихідних продуктів 14,9г 4жовтої твердої речовини, що плавиться при 154°С. трифторметил-N-ізобутилфталіміду у 300мл Мас-спектр: El: m/e 356 (М+), m/e 269, m/e 200, m/e метанолу і 2,96г боргідриду калію. Реакційну суміш 86 (основний пік). перемішують при температурі приблизно 20°С b) Етил(5-трифторметил-2-ізобутил-3-оксо-2,3протягом 16 годин, потім охолоджують до дигідро-1Н-ізоіндол-1-іл)ацетат і етил(6температури приблизно 0°С і додають по краплях трифторметил-2-ізобутил-3-оксо-2,3-дигідро-1Н100мл дистильованої води. Потім частково ізоіндол-1-іл)ацетат випарюють метанол при зниженому тиску (2кПа) і Етил(5-трифторметил-2-ізобутил-3-оксо-2,3температурі приблизно 40°С. Водну фазу дигідро-1Н-ізоіндол-1-іл)ацетат і етил(6екстрагують 3 рази 200мл етилацетату. Органічні трифторметил-2-ізобутил-3-оксо-2,3-дигідро-1Некстракти об'єднують, промивають 300мл ізоіндол-1-іл)ацетат одержують, дотримуючись насиченого розчину хлориду натрію, сушать над методики прикладу 2, з використанням як вихідних сульфатом магнію, фільтрують і потім продуктів 1,32г 60% гідриду натрію у 120мл 1,2концентрують досуха при зниженому тиску (2кПа) і диметоксіетану, 6,57мл триетилфосфоноацетату і температурі приблизно 40°С. У результаті 12,07г 5-трифторметил-3-гідрокси-2-ізобутил-2,3одержують 12,07г 5-трифторметил-3-гідрокси-2дигідроізоіндол-1-ону і 6-трифторметил-3-гідроксиізобутил-2,3-дигідроізоіндол-1-ону і 62-ізобутил-2,3-дигідроізоіндол-1-ону. Суміш трифторметил-3-гідрокси-2-ізобутил-2,3кип'ятять зі зворотним холодильником протягом дигідроізоіндол-1-ону у вигляді білого порошку. 24-х годин і потім охолоджують до температури (Rf=0,64, тонкошарова хроматографія на приблизно 20°С. Реакційну суміш потім силікагелі, елюент: суміш циклогексан/етилацетат обробляють 150мл води і потім суміш екстрагують (50/50 за об'ємом)). 3 рази 250мл діетилового ефіру. Органічні d) 4-Трифторметил-N-ізобутилфталімід екстракти об'єднують, промивають 150мл 4-Трифторметил-N-ізобутилфталімід насиченого розчину солі, сушать над сульфатом одержують, дотримуючись методики прикладу 2, з магнію, фільтрують і потім концентрують досуха використанням як вихідних продуктів 14,8г при зниженому тиску (2кПа) і температурі ангідриду 4-трифторметилфталевої кислоти, приблизно 40°С. Суміш 2,3г залишку упорскують 7,2мл ізобутиламіну і каталітичної кількості на колонку діаметром 8см, що містить 1,2кг паратолуолсульфонової кислоти у 160мл толуолу. хіральної стаціонарної фази WHELK 01SS. Реакційну суміш нагрівають при температурі Здійснюють елюювання рухомою фазою, що приблизно 140°С протягом 5 годин і потім складається з суміші дихлорметану, етанолу і охолоджують до температури приблизно 20°С. гептану, взятих у співвідношенні 14,5/0,5/85 об./об. Реакційну суміш концентрують досуха при В ідентичних умовах проводять два додаткових зниженому тиску (2кПа) і температурі приблизно упорскування 2,7г і 3г. Фракції, що містять перший 40°С і залишок переносять у 250мл етилацетату і регіоізомер, об'єднують і концентрують досуха при 200мл насиченого водного розчину бікарбонату зниженому тиску (1кПа) і температурі приблизно натрію. Після осадження відділяють водну фазу і 40°С. У результаті одержують 1,86г етил(5потім екстрагують двічі 250мл етилацетату. трифторметил-2-ізобутил-3-оксо-2,3-дигідро-1НОрганічні екстракти об'єднують, промивають ізоіндол-1-іл)ацетату у вигляді білої твердої насиченим розчином солі, сушать над сульфатом речовини (Rf=0,64, тонкошарова хроматографія на магнію, фільтрують і потім концентрують досуха силікагелі, елюент: суміш циклогексан/етилацетат при зниженому тиску (2кПа) і температурі (50/50 за об'ємом)). Фракції, що містять другий приблизно 40°С. У результаті одержують 14,9г 4регіоізомер, об'єднують і концентрують досуха при трифторметил-№ізобутилфталіміду у вигляді зниженому тиску (1кПа) і температурі приблизно жовтого порошку. (Rf=0,59, тонкошарова 40°С з одержанням 2,79г білої твердої речовини. хроматографія на силікагелі, елюент: суміш Утворений продукт повторно очищають циклогексан/етилацетат (75/25 за об'ємом)). хроматографією під тиском аргону (80кПа) на Ангідрид 4-трифторметилфталевої кислоти колонці з силікагелем (розмір частинок 32-63мкм) може бути одержаний адаптацією або при елююванні сумішшю циклогексан/етилацетат застосуванням методики, описаної [Cavalleri et al., (90/10 за об'ємом). Фракції, що містять очікуваний J. Med. Chem., 13(1), 148-149, (1970)]. продукт, об'єднують і концентрують досуха при Приклад 16 зниженому тиску (2кПа) і температурі приблизно 55 81118 56 а) N-[2-(2-ізобутил-5-ізопропокси-3-оксо-2,3насиченого розчину солі, сушать над сульфатом дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин магнію, фільтрують і потім концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 40°С. Залишок очищають хроматографією під тиском аргону (80кПа) на колонці з силікагелем (розмір частинок 32-63мкм) при елююванні сумішшю циклогексан/етилацетат (90/10 за об'ємом) і потім сумішшю циклогексан/етилацетат (80/20 за об'ємом). Фракції, що містять очікуваний продукт, об'єднують і концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 40°С. У результаті одержують 0,42г етил(5-ізопропілокси-2-ізобутил3-оксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетату у N-[2-(2-ізобутил-5-ізопропокси-3-оксо-2,3вигляді безбарвного масла. (Rf=0,57, тонкошарова дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин хроматографія на силікагелі, елюент: суміш одержують, дотримуючись методики прикладу 9, з циклогексан/етилацетат (50/50 за об'ємом)). використанням як вихідних продуктів 20мл с) 5-Ізопропілокси-3-гідрокси-2-ізобутил-2,3абсолютного етанолу, 0,086г натрію, 0,36г дигідроізоіндол-1-он гуанідинійхлориду і 0,42г етил(5-ізопропілокси-25-Ізопропілокси-3-гідрокси-2-ізобутил-2,3ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1дигідроізоіндол-1-он одержують, дотримуючись іл)ацетату. Реакційну суміш перемішують при методики прикладу 1, з використанням як вихідних температурі приблизно 20°С протягом 18 годин і продуктів 1,16г N-ізобутил-4потім концентрують досуха при зниженому тиску ізопропілоксифталіміду у 20мл метанолу і 0,24г (2кПа) і температурі приблизно 40°С. Потім боргідриду калію. Реакційну суміш перемішують залишок переносять у 50мл етилацетату і при температурі приблизно 20°С протягом 17 органічну фазу промивають двічі 30мл водного 1Н годин, потім охолоджують до температури розчину гідроксиду натрію і потім двічі 50мл приблизно 0°С і додають по краплях 30мл водного 1Н розчину хлористоводневої кислоти. дистильованої води. Потім частково випарюють Кислу водну фазу обробляють водним 30% метанол при зниженому тиску (2кПа) і температурі розчином гідроксиду натрію до рН 14 і потім приблизно 40°С і додають 50мл води. Водну фазу екстрагують 3 рази 30мл етилацетату. Органічні екстрагують 3 рази 70мл етилацетату. Органічні екстракти об'єднують, промивають 50мл екстракти об'єднують, промивають 100мл насиченого водного розчину солі, сушать над насиченого розчину хлориду натрію, сушать над сульфатом магнію і концентрують при зниженому сульфатом магнію, .фільтрують і потім тиску (2кПа) і температурі приблизно 40°С. концентрують досуха при зниженому тиску (2кПа) і Залишок розтирають у діетиловому ефірі, потім температурі приблизно 40°С. У результаті фільтрують і сушать в ексикаторі при зниженому одержують 1,08г 5-ізопропілокси-3-гідрокси-2тиску (2Па) і температурі приблизно 40°С протягом ізобутил-2,3-дигідроізоіндол-1-ону у вигляді 2-х годин. У результаті одержують 0,0175г N-[2-(2в'язкого безбарвного масла. (Rf=0,50, тонкошарова ізобутил-5-ізопропокси-3-оксо-2,3-дигідро-1Нхроматографія на силікагелі, елюент: суміш ізоіндол-1-іл)ацетил]гуанідину у вигляді білого циклогексан/етилацетат (50/50 за об'ємом)). порошку, що плавиться при 208°С. 1H ЯМР d) N-ізобутил-4-ізопропілоксифталімід (300МГц, d6-(CD3)2SO, d у м.ч.): 0,75 (д, J=6,5Гц: Суміш 1г 4-гідрокси-N-ізобутилфталіміду, 3Н); 0,90 (д, J=5,5Гц: 3Н); 1,30 (мт: 6Н); 2,01 (мт: 0,85мл 2-бромпропану і 1,38г карбонату калію у 1Н); 2,40 (дд, J=15 і 6,5Гц: 1Н); 2,65 (дд, J=15 і 5мл диметилформаміду перемішують при 6,5Гц: 1Н); 3,00 (дд, J=13,5 і 5,5Гц: 1Н); 3,53 (дд, температурі приблизно 60°С протягом 17 годин. J=13,5 і 10Гц: 1Н); 4,68 (мт: 1Н); 4,96 (широкий т, Потім реакційну суміш охолоджують до J=6,5Гц: 1Н); від 6,40 до 7,10 (широкий температури приблизно 20°С і потім концентрують мультиплет: 2Н); 6,98 (дд, J=8,5 і 2Гц: 1Н); 7,09 (д, досуха при зниженому тиску (2кПа) і температурі J=2Гц: 1Н); 7,54 (д, J=8,5Гц: 1H); від 7,60 до 8,20 приблизно 40°С. Залишок переносять у 70мл води (широкий мультиплет: 2Н). і потім екстрагують 3 рази 75мл етилацетату. b) Етил(5-ізопропілокси-2-ізобутил-3-оксо-2,3Органічні фази об'єднують, промивають дигідро-1Н-ізоіндол-1-іл)ацетат насиченим розчином хлориду натрію, сушать над Етил(5-ізопропілокси-2-ізобутил-3-оксо-2,3сульфатом магнію, фільтрують і потім дигідро-1Н-ізоіндол-1-іл)ацетат одержують, концентрують досуха при зниженому тиску (2кПа) і дотримуючись методики прикладу 2, з температурі приблизно 40°С. У результаті використанням як вихідних продуктів 0,149г 60% одержують 1,16г N-ізобутил-4гідриду натрію в 20мл 1,2-диметоксіетану, 1,23мл ізопропілоксифталіміду у вигляді білої твердої триетилфосфоноацетату і 1,08г 5-ізопропілокси-3речовини. (Rf=0,50, тонкошарова хроматографія гідрокси-2-ізобутил-2,3-дигідроізоіндол-1-ону. на силікагелі, елюент: суміш Суміш кип'ятять зі зворотним холодильником циклогексан/етилацетат (75/25 за об'ємом)). протягом 5 годин і потім охолоджують до e) 4-Гідрокси-N-ізобутилфталімід температури приблизно 20°С. Реакційну суміш 4-Гідрокси-N-ізобутилфталімід одержують, обробляють 100мл води і потім суміш екстрагують дотримуючись методики прикладу 2, з 3 рази 100мл діетилового ефіру. Органічні використанням як вихідних продуктів 7,26г екстракти об'єднують, промивають 100мл 57 81118 58 ангідриду 4-ацетоксифталевої кислоти, 7,35мл колонці з силікагелем (розмір частинок 15-40мкм) ізобутиламіну і каталітичної кількості при елююванні сумішшю дихлорметан/метанол паратолуолсульфонової кислоти у 75мл толуолу. (90/10 за об'ємом). Фракції, що містять очікуваний Реакційну суміш нагрівають при температурі продукт, об'єднують і концентрують досуха при приблизно 140°С протягом 4-х годин, потім зниженому тиску (2кПа) і температурі приблизно охолоджують до температури приблизно 40°С і 20°С. Залишок переносять у простий концентрують досуха при зниженому тиску (2кПа). діізопропіловий ефір, розтирають, фільтрують і Залишок переносять в 175мл етилацетату і 150мл потім сушать. У результаті одержують 0,15г N-[(7насиченого розчину бікарбонату натрію. Після фтор-2-ізобутил-3-оксо-2,3-дигідро-1Н-ізоіндол-1осадження відділяють водну фазу і потім іл)ацетил]гуанідину у вигляді блідо-жовтої твердої екстрагують двічі 150мл етилацетату. Органічні речовини, що плавиться при 205°С. 1H ЯМР екстракти об'єднують, промивають 200мл (300МГц, d6-(CD3)2SO, d м.ч.): 0,74 (д, J=6,5 Гц: насиченого розчину солі, сушать над сульфатом 3Н); 0,89 (д, J=6,5Гц: 3Н); 2,06 (мт: 1Н); 2,38 (дд, магнію, фільтрують і потім концентрують досуха J=15 і 7,5Гц: 1Н); 2,90 (дд, J=15 і 4,5Гц: 1Н); 3,04 при зниженому тиску (2кПа) і температурі (дд, J=13,5 і 4,5Гц: 1Н); 3,56 (дд, J=13,5 і 10Гц: 1Н); приблизно 40°С. Залишок переносять в 100мл 5,23 (дд, J=7,5 і 4,5Гц: 1Н); від 6,20 до 7,00 циклогексану, перемішують при температурі (широкий мультиплет: 2Н); від 7,35 до 7,60 (мт: приблизно 20°С протягом 1,5 годин і потім 3Н); від 7,50 до 8,20 (широкий мультиплет: 2Н). фільтрують. Тверду речовину сушать в ексикаторі b) Етил(7-фтор-2-ізобутил-3-оксо-2,3-дигідропри зниженому тиску (2кПа) і температурі 1Н-ізоіндол-1-іл)ацетат приблизно 20°С. У результаті одержують 4,0г 4Етил(7-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Нгідрокси-N-ізобутилфталіміду у вигляді білої ізоіндол-1-іл)ацетат одержують, дотримуючись твердої речовини. (Rf=0,25, тонкошарова методики прикладу 2, з використанням як вихідних хроматографія на силікагелі, елюент: суміш продуктів 0,2г 60% гідриду натрію у 15мл 1,2циклогексан/етилацетат (75/25 за об'ємом)). диметоксіетану, 1,1мл триетилфосфоноацетату і Ангідрид 4-ацетоксифталевої кислоти може 0,8г 4-фтор-3-гідрокси-2-ізобутил-2,3бути одержаний адаптацією або застосуванням дигідроізоіндол-1-ону. Неочищений продукт методики, описаної [J. Sah, J. Med. Chem., 42 (16), очищають хроматографією під тиском аргону 3014-3017, (1999) і N.J. Hinde, J. Chem. Soc, Perkin (50кПа) на колонці з силікагелем (розмір частинок Trans. 2, 5, 1249-125, (1998)]. 40-63мкм) при елююванні сумішшю Приклад 17 циклогексан/етилацетат (80/20 за об'ємом). а) N-[2-(7-фтор-2-ізобутил-3 -оксо-2,3-дигідроФракції, що містять очікуваний продукт, об'єднують 1Н-ізоіндол-1-іл)ацетил]гуанідин і концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 20°С. У результаті одержують 0,44г етил(7-фтор-2-ізобутил-3-оксо2,3-дигідро-1Н-ізоіндол-1-іл)ацетату у вигляді жовтого масла. (Rf=0,59, тонкошарова хроматографія на силікагелі, елюент: суміш циклогексан/етилацетат (50/50 за об'ємом)). c) 4-Фтор-3-гідрокси-2-ізобутил-2,3дигідроізоіндол-1-он 4-Фтор-3-гідрокси-2-ізобутил-2,3дигідроізоіндол-1-он одержують, дотримуючись методики прикладу 1, з використанням як вихідних продуктів 3,9г 3-фтор-N-ізобутилфталіміду у 20мл N-[(7-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Нметанолу і 0,95г боргідриду калію. Реакційну суміш ізоіндол-1-іл)ацетил]гуанідин одержують, перемішують при температурі приблизно 20°С дотримуючись методики прикладу 1, з протягом 19 годин, потім охолоджують до використанням як вихідних продуктів 1,29г треттемператури приблизно 0°С і додають по краплях бутоксиду калію, 1,32г гуанідинійхлориду і 0,67г дистильовану воду. Одержаний осад етил(7-фтор-2-ізобутил-3-оксо-2,3-дигідро-1Нвідфільтровують, промивають холодною водою і ізоіндол-1-іл)ацетату. Реакційну суміш потім сушать в ексикаторі при зниженому тиску перемішують при температурі приблизно 20°С (2кПа) і температурі приблизно 20°С. У результаті протягом 20 годин і потім фільтрують. Фільтрат одержують 3,5г 4-фтор-3-гідрокси-2-ізобутил-2,3переносять у 40мл води і 60мл етилацетату. Після дигідроізоіндол-1-ону у вигляді липкого білого розділення фаз осадженням відділяють органічну порошку. (Rf=0,36, тонкошарова хроматографія на фазу і водну фазу екстрагують двічі 60мл силікагелі, елюент: суміш циклогексан/етилацетат етилацетату. Органічні екстракти об'єднують, (60/40 за об'ємом)). сушать над сульфатом натрію, фільтрують і d) 3-Фтор-N-ізобутилфталімід концентрують досуха при зниженому тиску 3-Фтор-Ν-ізобутилфталімід одержують, (0,6кПа) і температурі приблизно 55°С. Залишок дотримуючись методики прикладу 2, з після випарювання переносять у діетиловий ефір, використанням як вихідних продуктів 3,4г знову концентрують досуха у таких же умовах, ангідриду 3-фторфталевої кислоти, 2,0мл потім переносять у воду і знову концентрують ізобутиламіну і каталітичної кількості досуха у таких же умовах. Залишок очищають паратолуолсульфонової кислоти у 20мл толуолу. хроматографією під тиском аргону (50кПа) на Реакційну суміш нагрівають при температурі 59 81118 60 приблизно 140°С протягом 3-х годин. Після b) (5,6-Дихлор-2-ізобутил-3-оксо-2,3-дигідроохолоджування до температури приблизно 20°С 1Н-ізоіндол-1-іл)ацетилхлорид реакційну суміш концентрують досуха при До розчину 0,36г (5,6-дихлор-2-ізобутил-3зниженому тиску (2кПа). Залишок переносять у оксо-2,3-дигідро-1Н-ізоіндол-1-іл)оцтової кислоти у дихлорметан і промивають насиченим водним 10мл дихлорметану в інертній атмосфері додають розчином бікарбонату натрію. Після осадження по краплях 0,72г оксалілхлориду. Реакційну суміш відділяють органічну фазу, сушать над сульфатом перемішують в інертній атмосфері при магнію, фільтрують і потім концентрують досуха температурі приблизно 20°С протягом 3-х годин, при зниженому тиску (2кПа) і температурі потім концентрують досуха при зниженому тиску приблизно 40°С. Залишок сушать в ексикаторі при (2кПа) і температурі приблизно 40°С. У результаті зниженому тиску (2кПа) і температурі приблизно одержують неочищений (5,6-дихлор-2-ізобутил-320°С. У результаті одержують 4,0г 3-фтор-Νоксо-2,3-дигідро-1Н-ізоіндол-1-іл)ацетилхлорид у ізобутилфталіміду у вигляді не зовсім білого вигляді в'язкогозеленого масла, яке порошку. (Rf=0,73, тонкошарова хроматографія на безпосередньо використовують вище (на стадії а). силікагелі, елюент: дихлорметан). c) (5,6-Дихлор-2-ізобутил-3-оксо-2,3-дигідроПриклад 18 1Н-ізоіндол-1-іл)оцтова кислота а) N-[2-(5,6-дихлор-2-ізобутил-3-оксо-2,3До 5мл абсолютного етанолу в інертній дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідин атмосфері додають 0,09г натрію. Після повного зникнення натрію додають 0,04г гуанідинійхлориду. Реакційну суміш перемішують в інертній атмосфері при температурі приблизно 20°С протягом 1,5 години і потім додають розчин 0,93г етил(5,6-дихлор-2-ізобутил-3-оксо-2,3дигідро-1Н-ізоіндол-1-іл)ацетату в 10мл абсолютного етанолу. Реакційну суміш перемішують при температурі приблизно 20°С протягом 18 годин і потім концентрують досуха при зниженому тиску (2кПа) і температурі приблизно 40°С. Залишок переносять у суміш 5мл води і 15мл діетилового ефіру і потім перемішують при температурі 20°С протягом 1 години. Суміш До 4,0мл абсолютного етанолу в інертній концентрують досуха при зниженому тиску (2кПа) і атмосфері додають 0,04г натрію. Після повного температурі приблизно 40°С. Залишок переносять зникнення натрію додають 0,16г у суміш дихлорметану і етилацетату і потім гуанідинійхлориду. Реакційну суміш перемішують в фільтрують. Фільтрат очищають хроматографією інертній атмосфері при температурі приблизно під тиском аргону (80кПа) на колонці з силікагелем 20°С протягом 45 хвилин і потім фільтрують. (розмір частинок 32-63мкм) при елююванні Фільтрат концентрують досуха при зниженому сумішшю дихлорметан/метанол (95/5 за об'ємом). тиску (2кПа) і температурі приблизно 40°С. Фракції, що містять очікуваний продукт, об'єднують Залишок розбавляють 10мл тетрагідрофурану і і концентрують досуха при зниженому тиску (2кПа) потім додають одержаний нижче (на стадії b) і температурі приблизно 40°С. Залишок розчин (5,6-дихлор-2-ізобутил-3-оксо-2,3-дигідропереносять у діетиловий ефір, розтирають і потім 1Н-ізоіндол-1-іл)ацетилхлориду у 5мл фільтрують. Тверду речовину сушать в ексикаторі тетрагідрофурану. Реакційну суміш перемішують при зниженому тиску (2Па) і температурі при температурі приблизно 20°С протягом 16 приблизно 35°С, потім знову розчиняють у 70мл годин і потім концентрують досуха при зниженому етилацетату і обробляють 50мл водного 1Н тиску (2кПа) і температурі приблизно 40°С. розчину гідроксиду натрію. Після розділення фаз Залишок переносять в 50мл етилацетату і потім осадженням органічну фазу промивають 50мл промивають двічі 50мл 1Н розчину водного 1Н розчину гідроксиду натрію. Водні хлористоводневої кислоти. Водні екстракти екстракти об'єднують і потім обробляють водним об'єднують, рН доводять до 14 додаванням 309/о 5Н розчином хлористоводневої кислоти до рН 1. розчину гідроксиду натрію і суміш екстрагують 3 Після триразової екстракції 50мл етилацетату рази 50мл етилацетату. Органічні екстракти органічні екстракти об'єднують, промивають 100мл об'єднують, промивають 100мл насиченого насиченого розчину солі, сушать над сульфатом розчину солі, сушать над сульфатом магнію, магнію, фільтрують і потім концентрують досуха фільтрують і потім концентрують досуха при при зниженому тиску (2кПа) і температурі зниженому тиску (2кПа) і температурі приблизно приблизно 40°С. У результаті одержують 0,36г 40°С. Залишок переносять в етилацетат і потім (5,6-дихлор-2-ізобутил-3-оксо-2,3-дигідро-1Нконцентрують досуха при таких же умовах. ізоіндол-1-іл)оцтової кислоти у вигляді жовтої Залишок переносять у 20мл діетилового ефіру, твердої речовини. (Rf=0,33, тонкошарова розтирають і потім фільтрують. Тверду речовину хроматографія на силікагелі, елюент: сушать в ексикаторі при зниженому тиску (2кПа) і дихлорметан/метанол (90/10 за об'ємом)). температурі приблизно 35°С. У результаті d) Етил(5,6-дихлор-2-ізобутил-3-оксо-2,3одержують 0,04г N-[(5,6-дихлор-2-ізобутил-3-оксодигідро-1Н-ізоіндол-1-іл)ацетат 2,3-дигідро-1Н-ізоіндол-1-іл)ацетил]гуанідину у Етил(5,6-дихлор-2-ізобутил-3-оксо-2,3-дигідровигляді не зовсім білого порошку, що плавиться 1Н-ізоіндол-1-іл)ацетат одержують, дотримуючись при 154°С. Мас-спектр: DCI: m/e 357 (М+Н)+.
ДивитисяДодаткова інформація
Назва патенту англійськоюN-((3-oxo-2, 3-dihydro-1h-isoindol-1-yl) acetyl) guanidine derivatives as nhe-1 inhibitors for the treatment of infarction and angina pectoris
Автори англійськоюKleemann Heinz-Werner, Hofmeister Armin, Mignani, Serge, Bigot Antony, Ronan Baptiste
Назва патенту російськоюПроизводные n-((3-оксо-2,3-дигидро-1н-изоиндол-1-ил)ацетил)гуанидина как ингибиторы nhe-1 для лечения инфаркта и стенокардии
Автори російськоюКлееманн Хайнц-Вернер, Хофмайстер Армин, Биго Антоне, Ронан Батист
МПК / Мітки
МПК: A61P 13/08, A61P 43/00, A61P 3/06, A61P 33/02, A61P 9/02, A61P 9/10, A61K 45/00, A61P 9/12, A61P 33/06, A61P 25/22, A61P 9/06, A61P 25/24, A01N 47/40, A61P 25/08, A61P 35/00, A61P 7/02, A61K 31/4035, C07D 209/46, A61P 37/06, A61P 25/00, A61P 3/10, A61P 25/20, A61P 9/00
Мітки: стенокардії, інфаркту, nhe-1, похідні, лікування, інгібітори, n-((3-оксо-2,3-дигідро-1н-ізоіндол-1-іл)ацетил)гуанідину
Код посилання
<a href="https://ua.patents.su/49-81118-pokhidni-n-3-okso-23-digidro-1n-izoindol-1-ilacetilguanidinu-yak-ingibitori-nhe-1-dlya-likuvannya-infarktu-ta-stenokardi.html" target="_blank" rel="follow" title="База патентів України">Похідні n-((3-оксо-2,3-дигідро-1н-ізоіндол-1-іл)ацетил)гуанідину як інгібітори nhe-1 для лікування інфаркту та стенокардії</a>
Попередній патент: Селективні модулятори рецепторів естрогенів
Наступний патент: Спосіб і пристрій для інтенсифікації ліквідації прихватів колони труб
Випадковий патент: Саморегенерувальний фільтр












