Похідні 4-оксо-3,5-дигідро-4н-піридазино-[4,5-b]індол-1-ацетаміду, лікувальний засіб та фармацевтична композиція
Номер патенту: 57088
Опубліковано: 16.06.2003
Автори: Севрен Мірей, ФРУАССАН Жак, Марге Франк, Дюбуа Лоран, Еванно Яннік, Бартш Режін, Жіль Катерін
Формула / Реферат
1. Похідні 4-оксо-3,5-дигідро-4Н-піридазино-[4,5b]індол-1-ацетаміду загальної формули (I)
, (I)
де
X - атом гідрогену чи галогену або метил, метоксил чи фенілметоксил,
Y- атом гідрогену, 1 чи 2 атоми галогену або гідроксил, метоксил, метил або нітрогрупа,
R1 - атом гідрогену чи (С1-С4)алкіл,
R2 та R3, кожний незалежно один від одного - атом гідрогену, (С1-С4)алкіл чи фенілметил,
або інакше, R2 та R3 разом з атомом нітрогену, до якого вони приєднані, утворюють азетидиніл, піролідиніл, 3-етоксипіролідиніл, піперидиніл, морфолініл, 4-метилпіперазиніл або 1,3-тіазолідиніл.
2. Сполука за п.1, яка відрізняється тим, що X знаходиться в положенні 8 або 9 i представляє атом гідрогену чи галогену, Y - атом гідрогену, R1 - метил чи етил, R2 - атом гідрогену чи метил, a R3 - метил, або інакше, R2 тa R3 разом з атомом нітрогену, до якого вони приєднані, утворюють азетидинільне чи піролідинільне кільце.
3. Лікувальний засіб, який відрізняється тим, що є сполукою за п. 1 або 2.
4. Фармацевтична композиція, яка відрізняється тим, що містить сполуку за п. 1 або 2 з фармацевтично прийнятним наповнювачем.
Текст
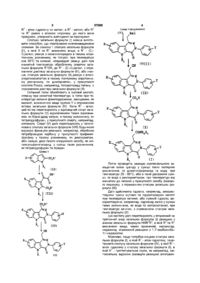
1 ПОХІДНІ 4-оксо-3,5-дипдро-4Н-піридазино [4,5Ь]шдол-1-ацетаміду загальної формули (І) Q HELR, сил чи фенілметоксил, Y- атом гідрогену, 1 чи 2 атоми галогену або гідроксил, метоксил, метил або нітрогрупа, Ri - атом гідрогену чи (Сі-С4)алкіл, R2 та R3, кожний незалежно один від одного - атом гідрогену, (Сі-С4)алкіл чи фенілметил, або інакше, R2 та R3 разом з атомом нітрогену, до якого вони приєднані, утворюють азетидиніл, пірол ІДИНІЛ, 3-етоксипіролідиніл, піперидиніл, морфолініл, 4-метилпіперазиніл або 1,3тіазолідиніл 2 Сполука за п 1, яка відрізняється тим, що X знаходиться в положенні 8 або 9 і представляє атом гідрогену чи галогену, Y - атом гідрогену, Ri - метил чи етил, R2 - атом гідрогену чи метил, a R3 метил, або інакше, R2 та R3 разом з атомом нітрогену, до якого вони приєднані, утворюють азетидинільне чи піролідинільне кільце 3 Лікувальний засіб, який відрізняється тим, що є сполукою за п 1 або 2 4 Фармацевтична композиція, яка відрізняється тим, що містить сполуку за п 1 або 2 з фармацевтично прийнятним наповнювачем Де X - атом гідрогену чи галогену або метил, меток Зпдно з винаходом запропоновано сполуки загальної формули (І) Q (І) в якій X - атом гідрогену чи галогену, або метил, метоксил чи фенілметоксил, Y - атом гідрогену, 1 чи 2 атоми галогену, або гідроксил, метоксил, метил, або нітрогрупа, R1 - атом гідрогену чи (Сі-С4)алкіл, R2 та R3, кожний незалежно від інших - атом гідрогену, (С-і-С4)алкіл, чи фенілметил, або інакше, R 2 Ta R3 разом з атомом нітрогену, до якого вони приєднані, утворюють азетидиніл, пірол ІДИНІЛ, 3-етоксипірол ІДИНІЛ, піперидиніл, морфолініл, 4-метилпіперазиніл або 1,3тіазолідиніл, формули яких такі о / —К и \ 4-У 0 N 4У \ _ ) Н-СН Кращими є сполуки загальної формули (І), в якій X в позиції 8 чи 9 представляє атом гідрогену чи галогену, Y - атом гідрогену, R1 - метил чи етил, О 00 00 о ю 57088 2 3 Схема 1 (продовження) 2 R - атом гідрогену чи метил, a R - метил, або R 3 та R разом з атомом нітрогену, до якого вони приєднані, утворюють азетидиніл чи піролідиніл Сполуки загальної формули (І) можна виготовити способом, що ілюстровано нижченаведеними схемами За схемою 1 сполука загальної формули 1 1 (II), в якій X та R визначено вище, a R - ( d С^алкіл, реагує з оксалілхлоридом в такому апротонному розчиннику, як толуол, при температурі між 50°С та кипіння, штермедіат реакції далі при кімнатній температурі обробляють спиртом загальної формули R"OH, де R" - (Сі-С4)алкіл, з отриманням діестеру загальної формули (III), або інакше, сполука загальної формули (II) реагує з алкілхлорглюксилатом в такому полярному апротонному розчиннику, як дихлорметан, у присутності кислоти Л'юіса, наприклад, тетрахлориду титану, з отриманням діестеру загальної формули (III) Останній потім обробляють в оцтовій кислоті, спершу при кімнатній температурі, а потім при температурі кипіння фенілпдразином, заміщеним, як варіант, визначеною вище групою Y з отриманням естеру загальної формули (IV) Коли R1 - алкіл, цей естер перетворюють у ВІДПОВІДНИЙ спирт загальної формули (V) відновленням таким відновником, як боропдрид натрію, в такому розчиннику, як тетрапдрофуран, у присутності спирту, наприклад, метанолу Спирт (V) далі перетворюють у галогеновану сполуку загальної формули (VIII) будь-якою відомою фахівцям реакцією, наприклад, обробкою тетрабромідом карбону у присутності трифенілфосфіну у такому розчиннику, як дихлорметан, або інакше, дією такого хлоруючого засобу, як метансульфонілхлорид, у суміші таких розчинників, як тетрапдрофуран та піридин Схема 1 (V}, наї X COjR1 {ID Потім проводять реакцію нуклеофільного заміщення юном ціаніду у суміші таких полярних розчинників, як диметилформамід та вода, при температурі 20 - 80°С, або в такій двофазній суміші, як вода з дихлорметаном, при температурі від кімнатної до кипіння у присутності засобу фазового переносу, з отриманням сполуки загальної формули (IX) Далі здійснюють гідроліз, наприклад, використовуючи суміш оцтової та пдрохлоридної кислот при температурі кипіння, або лужний гідроліз, використовуючи, наприклад, гідроксид калію у суміші таких розчинників, як вода та метоксіетанол, при температурі кипіння, з отриманням сполуки загальної формули (X) Цю кислоту далі перетворюють у вторинний чи третинний амід загальної формули (І) реакцією з аміном загальної формули HNR2R3, в якій R2 та R3 визначено вище, через проміжний, наприклад, імідазолід, отриманий реакцією з 1,1'-карбонілбіс1Н-1М1ДЭЗОЛОМ Можливо, якщо потрібна кінцева сполука загальної формули (І), в якій R1 - атом гідрогену, перетворити сполуку загальної формули (IV), в якій R1 атом гідрогену у сполуку загальної формули (І), в якій R1 - протектувальна група, як наприклад, метоксильна, відомою фахівцям реакцією алкілуван 57088 ня Перетворення за схемою 1 продовжують до отримання сполуки загальної формули (IX), а потім кислотним гідролізом останньої, при чому видаляється і метоксильна протектувальна група, отримують сполуку загальної формули (X), в якій 1 R - атом гідрогену За схемою 2 сполуку визначеної вище загальної формули (II) перетворюють у сполуку загальної формули (VI) будь-яким відомим фахівцям способом, наприклад, електрофільною реакцією в кислому середовищі Останню далі обробляють в оцтовій кислоті, спершу при кімнатній температурі, а потім при температурі кипіння фенілпдразином, заміщеним, як варіант, визначеною вище групою Y з отриманням сполуки загальної формули (VII), яку перетворюють у галогеноване похідне загальної формули (VIII) реакцією радикального типу, використовуючи, наприклад, N-бромсукцинімід, у такому розчиннику, як тетрахлорид карбону, у присутності такого засобу, як 2,2'-азобіс(2метилпропюнітрил) Сполуку загальної формули (VIII) далі обробляють згідно зі схемою 1 Можливо, якщо потрібно, перетворити сполуку загальної формули (І), в якій X - атом галогену, у сполуку загальної формули (І), в якій X - метил, будь-якою відомою фахівцям реакцією сполучення, наприклад, використовуючи тетраметилстанум у присутності комплексу паладію сполуку загальної формули (XI) окисненням спиртової функціональної групи з використанням, наприклад, дюксиду мангану у такому розчиннику, як дихлорметан Альдегід (XI) потім перетворюють у нітрил загальної формули (XII) реакцією з (4метилбензолсульфоніл)метилізоціанідом ("TosMIC") у такому розчиннику, як 1,2диметоксіетан, у присутності такої основи, як 1,1диметилетоксид калію Нітрил (XII) потім перетворюють у естер загальної формули (XIII), в якій R" нижчий алкіл, дією такої кислоти, як пдрогенхлорид в спиртовому розчиннику формули R"OH Наприкінці, цей естер загальної формули (XIII) перетворюють у вторинний чи третинний амід загальної формули (І) реакцією з аміном загальної 2 3 3 формули HNR R , в якій R та R визначено вище, наприклад, у присутності похідного тріалкілалюмінію у такому розчиннику, як толуол ВИХІДНІ сполуки загальної формули (II), в яких, в основному, R1 - гідроген, описані в літературі За бажанням, сполуку, у формулі якої R1 - гідроген, можна піддавати реакції алкілування для отримання сполуки, у формулі якої R - алкіл Схема З ОН Схема 2 V ^ r y r {VI I) Hal К "О" Подібно, сполуку загальної формули (І), в якій Y - метоксил, можна перетворити у сполуку, в формулі якої Y - гідроксил, будь-яким відомим способом, наприклад, дією триброміду бору у такому хлорованому розчиннику, як дихлорметан Можливо, якщо потрібно, перетворити сполуку загальної формули (І), в якій X - атом хлору, у сполуку загальної формули (І), в якій X - атом гідрогену, наприклад, гідруванням у присутності паладію-навупллі За схемою 3 сполуку загальної формули (V), в якій R1 - алкіл, а X - атом хлору, перетворюють у Нижченаведені приклади ілюструють виготовлення деяких сполук згідно з винаходом Мікроаналіз на елементи та спектри 14 і ЯМР підтверджують будову отриманих сполук Номери у дужках у назвах прикладів відповідають номерам у першій колонці нижченаведеної таблиці 1 В назвах речовин дефіс "-" є частиною назви, 57088 а риска _ використана для переносу, при відсутності якого її треба знищити, замінювати и дефісом чи проміжком не можна Приклад 1 (Сполука №9) 5-етил-8-флуорг\І,г\І-диметил-4-оксо-3-феніл-3,5-дипдро-4Нпіридазино-[4,5-Ь]-шдол-1-ацетамід 1 1 Етил(1 -етил-5-флуор-1 Н-шдол-2-карбоксилат) Суспензію 3,8г (95ммоль) 60% гідриду натрію (промитого попередньо петролейним ефіром) та 15г (72,4ммоль) етил(5-флуор-1Н-шдол-2-карбоксилату) в ЮОмл диметилформаміду перемішували протягом 2 годин при кімнатній температурі і потім додавали розчин 7,5мл (93,7ммоль) йодетану, в 20мл диметилформаміду Після перемішування протягом 10 годин при кімнатній температурі, реакційну суміш виливали у льодяну воду і екстрагували діетиловим етером Органічну фазу промивали кілька разів водою, сушили сульфатом магнію та концентрували під зниженим тиском Отримали 17г (72ммоль) жовтого масла, яке використовували у наступній операції 1 2 Метил[2-(етоксикарбоніл)-1-етил-5-флуора-оксо-1 Н-індол-3-ацетат] Розчин 17г (72ммоль) етил(1-етил-5-флуор1Н-шдол-2-карбоксилату) та 7,4мл (84,5ммоль) оксалілхлориду у 500мл толуолу гріли під зворотним холодильником протягом 6 годин Додавали ще 5мл (57ммоль) оксалілхлориду, гріли протягом 1 години під зворотним холодильником і суміші давали повернутися до кімнатної температури Додавали 200мл метанолу, суміш перемішували протягом 10 хвилин і випарювали розчинник під зниженим тиском Отримане масло переносили у дихлорметан і органічну фазу промивали водою, сушили сульфатом магнію і концентрували під зниженим тиском Після перекристалізації з пропан-2-олу отримали 14г (43,6ммоль) сполуки у формі білого твердого продукту 1 3 Метил(5-етил-8-флуор-4-оксо-3-феніл-3,5дипдро-4Н-піридазино[4,5-Ь]шдол-1-карбоксилат) При кімнатній температурі 18,4мл (187,2ммоль) фенілпдразину додавали до розчину 14г (43,6ммоль) метил(2-(етоксикарбоніл)-1-етил5-флуор-а-оксо-1Н-шдол-3-ацетату) у 150мл оцтової кислоти і реакційну суміш перемішували протягом ЗО хвилин при кімнатній температурі, а потім протягом 2 годин під зворотним холодильником Суміш охолоджували, додавали ЮОмл води і ВІДДІЛЯЛИ нерозчинний матеріал фільтруванням, промивали його на скляному фільтрі 70/30 сумішшю води і ацетону Виділили 10,5г (28,6ммоль) білого твердого продукту, який використовували у наступній операції 14 5-Етил-8-флуор-1 -(пдроксиметил)-З-феніл-3,5-дипдро-4Н-піридазино[4,5-Ь]індол-4-он Кількома порціями при кімнатній температурі до розчину Юг (27,3ммоль) метил(5-етил-8-флуор4-оксо-3-феніл-3,5-дипдро-4Н-піридазино[4,5Ь]шдол-1-карбоксилату) у 200мл тетрапдрофурану і 5,8мл метанолу додавали 5,1г (135ммоль) боропдриду натрію, і суміш перемішували протягом 4 годин під зворотним холодильником Суміш виливали у льодяний 0,1Н розчин пдрохлоридної кислоти, нерозчинний матеріал ВІДДІЛЯЛИ фільтруванням, промивали його на скляному фільтрі во 8 дою та діетиловим етером, а потім сушили 7,2г (21,4ммоль) сполуки отримали у формі білого твердого продукту, який використовували у наступній операції 15 1 -(бромметил)-5-етил-8-флуор-3-феніл3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-4-он 11,5г (43,84ммоль) трифенілфосфшу кількома порціями додавали до розчину 7,2г (21,4ммоль) 5етил-8-флуор-1-(пдроксиметил)-3-феніл-3,5дипдро-4Н-піридазино[4,5-Ь]шдол-4-ону і 15,3г (46,13ммоль) тетраброміду карбону у 500мл дихлорметану і розчин перемішували протягом 12 годин при кімнатній температурі Суміш концентрували до 1/3 під зниженим тиском і осад ВІДДІЛЯЛИ фільтруванням, промивали ефіром і сушили під зниженим тиском Отримали 4г (Юммоль) твердого продукту До маточнику додавали ЗООмл дихлорметану, 8г (24,1ммоль) тетраброміду карбону і 5г (19,06ммоль) трифенілфосфшу і розчин перемішували протягом 12 годин при кімнатній температурі, а потім концентрували до 1/3 Осад ВІДДІЛЯЛИ фільтруванням, промивали ефіром і сушили під зниженим тиском, отримавши ще 3,2г (8ммоль) твердого продукту 16 5-етил-8-флуор-4-оксо-3-феніл-3,5-дипдро-4Н-піридазино[4,5-и]шдол-1-ацетонітрил Двофазну суміш 7,2г (18ммоль) 1(бромметил)-5-етил-8-флуор-3-феніл-3,5-дипдро4Н-піридазино [4,5-Ь]шдол-4-ону, 3,53г (72ммоль) ціаніду натрію і 0,58г (1,8ммоль) броміду тетрабутиламонію у ЗООмл дихлорметану і 150мл води енергійно перемішували протягом 12 годин Органічну фазу ВІДДІЛЯЛИ, промивали кілька разів водою, сушили сульфатом магнію і концентрували під зниженим тиском Виділили 5,8Г (16,8ММОЛЬ) сполуки, яку використовували у наступній операції 1 7 5-Етил-8-флуор-4-оксо-3-фент-3,5-дипдро4Н-піридазино[4,5-Ь]шдол-1-оцтова кислота Розчин 5,8г (16,8ммоль) 5-етил-8-флуор-4оксо-3-феніл-3,5-дипдро-4Н-піридазино[4,5Ь]шдол-1-ацетонітрилу у 200мл у 1/1 суміші концентрованої пдрохлоридної кислоти і льодяної оцтової кислоти гріли під зворотним холодильником протягом 2 годин Розчин охолоджували, додавали ЮОмл води, нерозчинний матеріал ВІДДІЛЯЛИ фільтруванням і добре промивали водою і ефіром на скляному фільтрі Після сушки у шафі отримали 5,2г (15ммоль) білого твердого продукту, який використовували у наступній операції 1 8 5-етил-8-флуор-г\І,г\І-диметил-4-оксо-3-феніл-3,5-дипдро-4Н-піридазино[4,5-Ь]індол-1-ацетамід Суспензію 1г (2,73ммоль) 5-етил-8-флуор-4оксо-3-феніл-3,5-дипдро-4Н-піридазино[4,5Ь]шдол-1-оцтової кислоти і 0,7г (4,3ммоль) 1,1'карбонілбіс-1Н-імідазолу у 200мл тетрапдрофурану перемішували протягом 3 годин при 50°С Реакційну суміш охолоджували до 25°С, додавали надлишок зрідженого диметиламіну і реакційну суміш перемішували протягом 12 годин при кімнатній температурі, концентрували її під зниженим тиском, додавали ЮОмл дихлорметану і ЮОмл води і органічну фазу ВІДДІЛЯЛИ, промивали водою, сушили сульфатом магнію і концентрували 57088 під зниженим тиском Отримане масло кристалізували з ефіру Після фільтрування і перекристалізації з етилацетату виділили 0,75г (1,9ммоль) білих кристалів Точка плавлення 183-184°С Приклад 2 (Сполука №25) 1-[2-(8-хлор-5-метил-4-оксо-3-феніл-3,5дипдро-4Н-піридазино[4,5-Ь]шдол-1-іл)-1оксоетил]піролідин 2 1 Метил(5-хлор-2-(етоксикарбоніл)-1-метила-оксо-1 Н-індол-3-ацетат) 15мл (170ммоль) оксалілхлориду додавали до розчину 31,5г (ІЗЗммоль) етил(5-хлор-1-метил-1Ншдол-2-карбоксилату) у ЮОмл толуолу, нагрівали до 60°С і гріли суміш під зворотним холодильником протягом 1 години Розчин охолоджували, додавали 50мл метанолу, суміш концентрували під зниженим тиском і залишок переносили в ЮОмл дихлорметану і 50мл води, додавали гідрокарбонат натрію, органічну фазу ВІДДІЛЯЛИ і сушили сульфатом магнію, розчинник випарювали під зниженим тиском, залишок розтирали в ефірі і осад ВІДДІЛЯЛИ фільтруванням і сушили під зниженим тиском Отримали 19г (59ммоль) твердого продукту Точка плавлення 119-120°С 2 2 Метил(8-хлор-5-метил-4-оксо-3-феніл-3,5дипдро-4Н-піридазино[4,5-Ь]шдол-1-карбоксилат) Розчин 19г (59ммоль) метил(5-хлор-2-(етоксикарбоніл}-1-метил-а-оксо-1Н-шдол-3-ацетату) і 26г (240ммоль) фенілпдразину у 250мл оцтової кислоти гріли під зворотним холодильником протягом 2 годин Суміш охолоджували, додавали 250мл 1/1 суміші води і ацетону і залишали стояти при 4°С протягом 15 годин Осад ВІДДІЛЯЛИ фільтруванням, промивали водою та ацетоном і сушили під зниженим тиском Отримали 17,4г (47ммоль) твердого продукту Точка плавлення 265 - 266°С 2 3 8-хлор-1 -(пдроксиметил)-5-метил-3-феніл3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-4-он Розчин 17,2г (47ммоль) метил(8-хлор-5-метил4-оксо-3-феніл-3,5-дипдро-4Н-піридазино[4,5Ь]шдол-1-карбоксилату), 8,7г (230ммоль) боропдриду натрію і 9,4мл (230ммоль) метанолу у ЗООмл тетрагідрофурану гріли під зворотним холодильником протягом 4 годин Суміш охолоджували і виливали при перемішуванні у розчин ЮОмл 2Н пдрохлоридної кислоти і ЮОмл дихлорметану Осад ВІДДІЛЯЛИ фільтруванням, промивали водою та дихлорметаном і сушили під зниженим тиском Отримали 15г (44ммоль) твердого продукту Точка плавлення 278 - 280°С 24 1 -(бромметил)-8-хлор-5-метил-3-феніл3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-4-он Синтез виконано як у прикладі 1 5 з 15г (44ммоль) 8-хлор-1 -(пдроксиметил)-5-метил-3-феніл-3,5-дипдро-4Н-піридазино[4,5-Ь]індол-4-ону Після кількаразової обробки і очистки хроматографією на силікагелі виділили 15г (37ммоль) твердого продукту Точка плавлення 253 - 254°С 25 8-хлор-5-метил-4-оксо-3-феніл-3,5дипдро-4Н-піридазино[4,5-Ь]шдол-1-ацетонітрил Синтез виконано як у прикладі 1 6 з 12,5г (Зммоль) 1-(бромметил)-8-хлор-5-метил-3-феніл3,5-дипдро-4Н-піридазино(4,5-Ь]індол-4-ону у су 10 міші хлороформу і води Після ОЧИСТКИ на колонці силікагелю отримали Юг (28ммоль) твердого продукту Точка плавлення 230°С 26 8-хлор-5-метил-4-оксо-3-феніл-3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-1-оцтова кислота Розчин Юг (28ммоль) 8-хлор-5-метил-4-оксо3-феніл-3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-1ацетонітрилу у суміші 200мл концентрованої пдрохлоридної кислоти і 200мл оцтової кислоти гріли при Ю0°С протягом 4 годин Розчин концентрували під зниженим тиском, залишок переносили в 250мл води і осад ВІДДІЛЯЛИ фільтруванням, промивали водою та сушили під зниженим тиском Отримали 10,2г (27ммоль) твердого продукту Точка плавлення 206 - 208°С 27 1 -[2-(8-хлор-5-метил-4-оксо-3-феніл-3,5дипд-ро-4Н-піридазино[4,5-Ь]індол-1-іл)-1оксоетил]піролідин Розчин 1,5г (4ммоль) 8-хлор-5-метил-4-оксо-3феніл-3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-1-оцтової кислоти і 1,2г (7,4ммоль) 1,1'-карбонілбіс-1Німідазолу у тетрагідрофурані перемішували протягом 1 години при 50°С Суміш охолоджували і додавали надлишок піролідину Після перемішування протягом 15 годин осад ВІДДІЛЯЛИ фільтруванням, промивали водою та ефіром і перекристалізовували з пропан-2-олу Отримали 0,65г (1,5ммоль) твердого продукту Точка плавлення 261 - 262°С Приклад 3 (сполука №27) г\І,г\І,5-триметил-4-оксо-3-феніл-3,5-дипдро-4Нпіридазино[4,5-Ь]шдол-1-ацетамід 31 5-Метил-4-оксо-3-феніл-3,5-дипдро-4Нпіридазино[4,5-Ь]шдол-1-оцтова кислота Розчин 3,3г (9ммоль) 8-хлор-5-метил-4-оксо-3феніл-3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-1-оцтової кислоти, 2,8г (44ммоль) форміату амонію і 1,8г 10% паладію-на-вупллі у 500мл етанолу гріли під зворотним холодильником протягом 5 годин Реакційну суміш охолоджували, додавали дихлорметан, каталізатор видаляли фільтруванням через діатомову землю і розчинник випарювали під зниженим тиском Отримали Зг (9ммоль) сполуки, яку використовували у наступній операції 3 2 г\І,г\І,5-Триметил-4-оксо-3-феніл-3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-1-ацетамід Суспензію 1г (Зммоль) 5-метил-4-оксо-3феніл-3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-1-оцтової кислоти і 0,7г (4,Зммоль) 1,1'-карбонілбіс-1Німідазолу у 200мл тетрагідрофурану перемішували протягом 2 годин при 60°С Реакційну суміш охолоджували до 25°С, додавали надлишок зрідженого диметиламіну у розчині в тетрагідрофурані і реакційну суміш перемішували протягом 72 годин при кімнатній температурі, концентрували її під зниженим тиском, додавали ЗООмл води і осад ВІДДІЛЯЛИ фільтруванням, промивали водою та ефіром і перекристалізовували з пропан-2-олу 0,75г (2ммоль) твердого продукту виділили Точка плавлення 214-215°С Приклад 4 (сполука №26) 1-[2-(5-Метил-4-оксо-3-феніл-3,5-дипдро-4Нпіридазино[4,5-Ь]шдол-1-іл)-1-оксоетил]піролідин Синтез виконано як у прикладі 3 2 з 1 г (Зммоль) 5-метил-4-оксо-3-феніл-3,5-дипдро-4Нпіридазино[4,5-Ь]шдол-1-оцтової кислоти і з над 12 11 57088 лишку піролідину Продукт перекристалізовували з 3,2г (Юммоль) додаткового продукту Точка плавпропан-2-олу Отримали 0,5г (1,3ммоль) твердого лення 128°С продукту Точка плавлення 214-215°С 55 9-бром-1,5-диметил-3-феніл-3,5-дипдроПриклад 5 (сполука №31) 4Н-піридазино[4,5-Ь]шдол-4-он 1-[2-(9-бром-5-метил-4-оксо-3-феніл-3,5-дипд22г (71ммоль) метил 3-ацетил-4-бром-1ро-4Н-піридазино[4,5-Ь]шдол-1 -іл)-1 -оксоетил]пірометил-1Н-шдол-2-карбоксилату при нагріванні лідин розчинили у 350мл оцтової кислоти, додавали ЗОмл (ЗООммоль) фенілпдразину, перемішування 51 Метил [2-азидо-3-(2-бромфеніл)проп-2проводили протягом 1 години при кімнатній теменоат] пературі і реакційну суміш гріли під зворотним хоРозчин 75мл (624ммоль) 2-бромбензальдепду лодильником протягом 5 годин, при кімнатній темі 252г (2,2ммоль) метил(азидоацетату у 160мл пературі протягом 15 годин, а потім знов під звометанолу додавали краплями протягом 3 годин ротним холодильником протягом 7 годин Додавапри температурі -10 - -8°С, під азотом та з механіли 28мл фенілпдразину і повторювали процес чним перемішуванням, до розчину 476мл метокСуміш концентрували під зниженим тиском, залисиду натрію (30% у метанолі) у 950мл метанолу шок переносили у воду, осад ВІДДІЛЯЛИ фільтруПеремішували протягом 2 годин при темпераванням, промивали водою та сушили під зниженим турі нижче 5°С Суміш виливали на 1,5кг льоду тиском і очищали хроматографічно на колонці з Осад ВІДДІЛЯЛИ фільтруванням, промивали водою силікагелем Виділили 11,1г (ЗОммоль) продукту та сушили під зниженим тиском при захисті від Точка плавлення 189 -190°С світла Отримали 116г (0,41 моль) твердого продукту, який швидко використовували у наступній 56 9-бром-1 -(бромметил)-5-метил-3-фенілоперації 3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-4-он 5 2 Метил 4-бром-1Н-шдол-2-карбоксилат 14 Розчин 10,1г (27,1ммоль) 9-бром-1,5Розчин 116г (0,41 моль) метил(2-азидо-3-(2диметил-3-феніл-3,5-дипдро-4Н-піридазино[4,5бромфеніл)проп-2-еноату) у 1,5л толуолу додаваЬ]шдол-4-ону, 6г (34ммоль) N-бромсукциніміду і ли краплями протягом 4 годин з механічним пере0,46г (2,8ммоль) 2,2'-азобіс(2-метилпропюнітрилу) мішуванням до розчину 2л толуолу, нагрівали до гріли під зворотним холодильником протягом 5 кипіння і кип'ятили ще 1 годину Розчинник випагодин Знов додавали Зг (17ммоль) Nрювали під зниженим тиском і залишок переносибромсукциніміду і 0,23г (1,4ммоль) 2,2'-азобіс(2ли в 2л циклогексану Осад ВІДДІЛЯЛИ фільтруванметилпропюнітрилу) Суміш гріли під зворотним ням, промивали толуолом і сушили під зниженим холодильником протягом 2 годин, залишали при тиском Виділили 37,85Г (149ММОЛЬ) продукту Макімнатній температурі на 15 годин і знов гріли під точник концентрували під зниженим тиском і зазворотним холодильником протягом 5 годин Сулишок очищали хроматографічно на колонці з симіш концентрували під зниженим тиском і залишок лікагелем Виділили 12,2Г (48ММОЛЬ) додаткового переносили у воду і екстрагували етилацетатом продукту Органічну фазу сушили, розчинник випарювали під зниженим тиском і залишок очищали хроматогра5 3 Метил 4-бром-1 -метил-1 Н-шдол-2-карбофічно на колонці з силікагелем Виділили 5,9г ксилат (ІЗммоль) продукту Синтез виконано як у прикладі 11 з 20г (79ммоль) метил 4-бром-1Н-шдол-2-карбоксилату, 5 7 9-бром-5-метил-4-оксо-3-феніл-3,5-дипд3,8г 60% натрію гідриду і бмл йодметану Після ро-4Н-піридазино[4,5-Ь]шдол-1-ацетонітрил реакції розчинник випарювали під зниженим тисРозчин 6,4г (14,3ммоль) 9-бром-1-(броммеком і залишок переносили у воду Суміш екстрагутил)-5-метил-3-феніл-3,5-дипдро-4Нвали етилацетатом Органічну фазу сушили і розпіридазино[4,5-Ь]шдол-4-ону, 3,6г (73ммоль) ціанічинник випарювали під зниженим тиском Продукт ду натрію і 0,57г (Іммоль) броміду тетрабути л амосушили під зниженим тиском Отримали 20,6г нію у суміші 170мл дихлорметану і 85мл води гріли (77ммоль) твердого продукту Точка плавлення під зворотним холодильником протягом 3 годин з 85 - 86°С механічним перемішуванням Розділення проводили відстоюванням і реакційну суміш екстрагува5 4 Метил 3-ацетил-4-бром-1-метил-1 Н-індолли дихлорметаном Органічну фазу промивали 2-карбоксилат водою та сушили сульфатом натрію, а розчинник ЗЗмл трифлуороцтового ангідриду додавали випарювали під зниженим тиском Отримали 5,6г до розчину 13,2мл оцтової кислоти, 1,6мл фосфа(14,2ммоль) продукту, який використовували у тної кислоти і 170мл ацетонітрилу, перемішування наступній операції проводили протягом 10 хвилин при кімнатній температурі і додавали розчин 20,6г (77ммоль) метил 5 8 9-бром-5-метил-4-оксо-3-феніл-3,5-дипд4-бром-1-метил-1,Н-шдол-2-карбоксилату у 120мл ро-4Н-піридазино[4,5-Ь]шдол-1-оцтова кислота ацетонітрилу Суміш перемішували протягом 4 Розчин 4,8г (12,2ммоль) 9-бром-5-метил-4годин при кімнатній температурі, виливали у воду і оксо-3-фент-3,5-дипдро-4Н-піридазино[4,5-Ь]шдолекстрагували ефіром Органічну фазу сушили су1-ацетонітрилу у суміші 190мл оцтової кислоти і льфатом натрію, розчинник випарювали під зни50мл концентрованої пдрохлоридної кислоти гріли женим тиском і залишок переносили в суміш цикпід зворотним холодильником протягом 6 годин логексану і дихлорметану Осад ВІДДІЛЯЛИ фільтРозчин концентрували під зниженим тиском і заруванням, промивали ефіром і сушили під знижелишок переносили в суміш дихлорметану і води ним тиском 18,8г (біммоль) продукту отримали Підлужували 30% розчином гідроксиду натрію, Маточник концентрували і залишок очищали хророзділення проводили відстоюванням, а екстракматографічно на колонці з силікагелем Виділили цію проводили дихлорметаном, водну фазу підки 14 13 57088 слювали концентрованою пдрохлоридною кислотокси)-3,5-дипдро-4Н-піридазино[4,5-Ь]індол-1-іл)тою при охолодженні на льодяній бані Осад ВІДДІ1-оксоетил]піролідин ЛЯЛИ фільтруванням, промивали водою та сушили Синтез виконано як у прикладі 3 2 з 0,38г під зниженим тиском Отримали 3,1г (7,5ммоль) (0,86ммоль) 5-метил-4-оксо-3-феніл-8твердого продукту (фенілметокси)-3,5-дипдро-4Н-піридазино[4,5Ь]шдол-1-оцтової кислоти Отримали 0,35г 59 1 -[2-(9-бром-5-метил-4-оксо-3-феніл-3,5(0,7ммоль) твердого продукту Точка плавлення дипдро-4Н-піридазино[4,5-Ь]шдол-1-іл)-1203 - 204°С оксоетил]піролідин Синтез виконано як у прикладі 3 2 з 3,1г Приклад 9 (сполука №17) (7,5ммоль) 9-бром-5-метил-4-оксо-3-феніл-3,5-диг\І,г\І,5,8-тетраметил-4-оксо-3-фент-3,5-дипдропдро-4Н-піридазино[4,5-Ь]індол-1-оцтової кислоти, 4Н-піридазино[4,5- Ь]шдол-1-ацетамід 1,4г 1,1'-карбонілбіс-1Н-імідазолу і 0,7мл піроліди91 1-(хлорметил)-5,8-диметил-3-фент-3,5ну Після реакції, додавали воду і осад ВІДДІЛЯЛИ дипдро-4Н-піридазино[4,5-Ь]шдол-4-он фільтруванням і сушили лід зниженим тиском, пе50мл піридину додавали до суспензії 9,5г рекристалізовували його з пропан-2-олу, промива(29,7ммоль) 1-(пдроксиметил)-5,8-діметил-3-фели ефіром і пентаном, і сушили під зниженим тисніл-3,5-дипдро-4Н-піридазино[4,5- Ь]шдол-4-ону у ком Отримали 2,3г (4,9ммоль) твердого продукту 600мл тетрапдрофурану і нагрівали до 60°С ДоТочка плавлення 209-210°С давали 4,5мл (59,4ммоль) метансульфонілхлориду і суміш залишали на 15 годин при кімнатній теПриклад 6 (сполука №11) 9-бром-5-метил-ІЧмпературі, додавали 500мл дихлорметану, осад метил-4-оксо-3-феніл-3,5-дипдро-4Н-піридазивидаляли фільтруванням, відділення проводили но[4,5-Ь]шдол-1-ацетамід відстоюванням і органічну фазу промивали водою, Синтез виконано як у прикладі 3 2 з 0,78г сушили сульфатом натрію і розчинник випарювали (1,9ммоль) 9-бром-5-метил-4-оксо-3-феніл-3,5-дипід зниженим тиском Отримали 5г (14,8ммоль) пдро-4Н-піридазино[4,3-Ь]шдол-1-оцтової кислоти продукту, який використовували у наступній опеПродукт перекристалізовували з пропан-2-олу рації Отримали 0,57г (1,3ммоль) твердого продукту Точка плавлення 267 - 268°С 92 5,8-Диметил-4-оксо-3-феніл-3,5-дипдроПриклад 7 (сполука №38) 1-[2-(5,9-Диметил-44Н-піридазино[4,5- Ь]шдол-1-ацетонітрил оксо-3-феніл-3,5-дипдро-4Н-піридазино[4,5Розчин 5г (14,8ммоль) 1-(хлорметил)-5,8Ь]шдол-1-іл)-1-оксоетил]піролідин диметил-3-феніл-3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-4-ону, 2,7г (55ммоль) ціаніду натрію і 0,5г Розчин 1,2г (2,6ммоль) 1-[2-(9-бром-5-метил-4(Зммоль) йодиду натрію у суміші 50мл диметилоксо-3-феніл-3,5-дипдро-4Н-піридазино[4,5формаміду і ЗОмл води перемішували протягом 2 Ь]шдол-1-іл)-1-оксоетил]піролідину, 0,22г годин при 50°С Суміш залишали при кімнатній (О.Зммоль) хлориду біс(трифенілфосфш)палатемпературі і осад ВІДДІЛЯЛИ фільтруванням, продію(ІІ), 0,41г (1,55ммоль) трифенілфосфшу і 1,5мл мивали водою та пентаном і сушили під зниженим (1 О.Зммоль) тетраметилстануму у 15мл диметилтиском Отримали Зг (9,1ммоль) продукту, який формаміду гріли при 120°С протягом 18 годин у використовували у наступній операції закритій посудині Суміш концентрували під зниженим тиском і залишок переносили у дихлорме93 5,8-Диметил-4-оксо-3-феніл-3,5-дипдротан і розчин гідрокарбонату натрію Органічну фа4Н-піридазино[4,5-Ь]шдол-1-оцтова кислота зу промивали 10% розчином флуориду калію і суСинтез виконано як у прикладі 1 7 з 3,4г шили сульфатом натрію, розчинник випарювали (10,4ммоль) 5,8-диметил-4-оксо-3-феніл-3,5під зниженим тиском і залишок очищали хроматогдипдро-4Н-піридазино[4,3-Ь]шдол-1-ацетонітрилу, рафічно на колонці з силікагелем Продукт переотримали 2г (5,8ммоль) продукту, який використокристалізовували з пропан-2-олу, промивали ефівували у наступній операції ром і пентаном і сушили під зниженим тиском 9 4 N, І\І,5,8-тетрааметил-4-оксо-3-феніл-3,5Отримали 0,82г (2ммоль) твердого продукту Точдипдро-4Н-піридазино[4,5-Ь]шдол-1-ацетамід ка плавлення 214-215°С Синтез виконано як у прикладі 3 2 з 1 г (2,9ммоль) 5,8-диметил-4-оксо-3-феніл-3,5Приклад 8 (сполука №23) 1-[2-(5-Метил-4оксо-3-феніл-8-(фенілметокси)-3,5-дипдро-4Н-підипдро-4Н-піридазино[4,5-Ь]шдол-1-оцтової кисридазино[4,5-Ь]шдол-1-іл)-1-оксоетил]піролідин лоти Продукт перекристалізовували з пропан-2олу Отримали 0,5г (1,Зммоль) твердого продукту 8 1 5-Метил-4-оксо-3-феніл-8-(фенілметокси)Точка плавлення 209-210°С 3,5-дипдро-4Н-піридазино[4,5-Ь]шдол-1-оцтова кислота Приклад 10 (сполука №43) 8
ДивитисяДодаткова інформація
Назва патенту англійською4-oxo-3,5-dihydro-4н-pyridazino-[4,5-b]-indole-1-acetamide derivatives, production thereof and application in therapy
Автори англійськоюEvanno Yannick, Dubois Laurent
Назва патенту російськоюПроизводные 4-оксо-3,5-дигидро-4н-пиридазино-[4,5-b]-индол-1-ацетамида, их изготовление и применение в терапии
Автори російськоюЭванно Янник, Дюбуа Лоран
МПК / Мітки
МПК: C07D 487/04, A61K 31/5025
Мітки: засіб, 4-оксо-3,5-дигідро-4н-піридазино-[4,5-b]індол-1-ацетаміду, фармацевтична, лікувальний, композиція, похідні
Код посилання
<a href="https://ua.patents.su/12-57088-pokhidni-4-okso-35-digidro-4n-piridazino-45-bindol-1-acetamidu-likuvalnijj-zasib-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-оксо-3,5-дигідро-4н-піридазино-[4,5-b]індол-1-ацетаміду, лікувальний засіб та фармацевтична композиція</a>
Попередній патент: Спосіб освітлення колоїдних дисперсій
Випадковий патент: Пристрій для навчальних операцій на вологих органах