Спосіб одержання гідрохлориду 1-(трифлуорометил)циклопропанаміну
Номер патенту: 114555
Опубліковано: 26.06.2017
Автори: Клюковський Денис Вікторович, Пустовіт Юрій Митрофанович, Бездудний Андрій Васильович, Онисько Петро Петрович
Формула / Реферат
Спосіб одержання гідрохлориду 1-(трифлуорометил)циклопропанаміну формули (1):
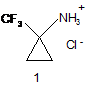 ,
,
який відрізняється тим, що 1-(трифлуороацетил)аміноциклопропанкарбонову кислоту піддають взаємодії з тетрафлуоридом сірки при температурі 80-85 °C протягом 16-18 годин з наступним зняттям трифлуороацетильної групи з атома азоту проміжного 2,2,2-трифлуоро-N-[1-(трифлуорометил)циклопропіл]ацетаміду нагріванням у метанолі, насиченому хлоридом водню.
Текст
Реферат: Винахід належить до органічної хімії, а саме до нового способу одержання гідрохлориду 1(трифлуорометил)циклопропанаміну формули (1): + NH3 CF3 Cl 1 . В основі винаходу лежить препаративно простий і зручний в синтетичному плані двостадійний метод отримання цільової сполуки реакцією комерційно доступної 1(трифлуороацетил)аміноциклопропанкарбонової кислоти з тетрафлуоридом сірки з подальшим UA 114555 C2 (12) UA 114555 C2 зняттям захисної трифлуороацетильної групи з атома азоту проміжного продукту нагріванням у метанолі, насиченому хлоридом водню. Вихід цільової сполуки становить 65,3 %. UA 114555 C2 Винахід належить до органічної хімії, а саме до нового способу одержання гідрохлориду 1(трифлуорометил)циклопропанаміну формули (1): + NH3 CF3 Cl 1 5 10 15 20 25 30 35 40 45 50 . Сполука даного типу в останній час знайшла широке застосування як вихідна для отримання значної кількості біологічно активних речовин широкого спектра дії [1-11, 13-16]. Спосіб одержання гідрохлориду 1-(трифлуорометил)циклопропанаміну, який заявляється, в науковій літературі та патентних виданнях не описаний. З наукової та патентної літератури відомі два методи отримання гідрохлориду 1(трифлуорометил)циклопропанаміну [8,9,12,13,15,16]. Найближчим по суті (прототипом) до методу, який заявляється, є метод, який полягає у взаємодії 1-аміноциклопропанкарбонової кислоти з тетрафлуоридом сірки у присутності великого надлишку безводного флуориду водню з подальшим виділенням з реакційної суміші 1(трифлуорометил)циклопропанаміну у вигляді гідрохлориду [12]. Суттєвим недоліком цього методу є використання в процесі великої кількості небезпечного високотоксичного безводного флуориду водню. Другий метод базується на реакції важкодоступної та комерційно дорогої 1(трифлуорометил)циклопропанкарбонової кислоти з високотоксичним та потенційно вибухонебезпечним дифенілфосфорилазидом у присутності триетиламіну і третбутилового спирту з утворенням відповідного третбутил-1-(трифлуорометил)циклопропілкарбамату з подальшим перетворенням останнього у гідрохлорид цільового 1(трифлуорометил)циклопропанаміну [8,9,13,15,16]. Недоліками цього методу є використання в процесі важкодоступної та комерційно дорогої 1-(трифлуорометил)циклопропанкарбонової кислоти і високотоксичного та потенційно вибухонебезпечного дифенілфосфорилазиду. Задачею винаходу є пошук нового зручного та ефективного способу одержання гідрохлориду 1-(трифлуорометил)циклопропанаміну без суттєвих недоліків, властивих описаним методам. Задача досягається взаємодією синтетично та комерційно доступної 1(трифлуороацетил)аміноциклопропанкарбонової кислоти з тетрафлуридом сірки з утворенням 2,2,2-трифлуоро-N-[1-(трифлуорометил)циклопропіл]-ацетаміду і наступним зняттям трифлуороацетильної групи з атома азоту останнього насиченим розчином хлориду водню в метанолі. Спосіб отримання, який заявляється, полягає в тому, що комерційно та синтетично доступну 1-(трифлуороацетил)аміноциклопропанкарбонову кислоту [17] піддають обробці тетрафлуоридом сірки при температурі 80-85 °C протягом 16-18 годин. Вихід проміжного 2,2,2трифлуоро-N-[1-(три-флуорометил)циклопропіл]ацетаміду становить 68 %. Зняття трифлуороацетильної групи з атома азоту останнього розчином хлориду водню в метанолі проходить практично кількісно при температурі 65 °C за 8 годин з утворенням цільового гідрохлориду 1-(трифлуорометил)-циклопропанаміну з виходом 96 %. Одержаний результат не є заздалегідь передбачуваним, оскільки у науковій і патентній літературі не знайдено прикладів флуорування тетрафлуоридом сірки 1(трифлуороацетил)аміноциклопропанкарбонової кислоти. Склад та будова отриманих речовин підтверджені даними елементного аналізу та спектрами ядерного магнітного резонансу. Винахід ілюструється прикладами одержання проміжного 2,2,2-трифлуоро-N-[1(трифлуорометил)циклопротл]ацетаміду (Приклад 1) та цільового гідрохлориду 1(трифлуорометил)циклопропанаміну (Приклад 2). Приклад 1 2,2,2-Трифлуоро-N[1-(трифлуорометил)циклопропіл]ацетамід. 3 13,79 г (0,07 моль) 1-(трифлуороацетил)аміноциклопропанкарбонової кислоти, 0,5 см води та 22,7 г (0,21 моль) тетрафлуориду сірки витримують у неіржавстальному автоклаві при температурі 80-85 °C протягом 16-18 годин. Газоподібні продукти реакції випускають з охолодженого автоклава, а залишок виливають на 150 г криги. Реакційну суміш екстрагують 3 хлористим метиленом (тричі по 60 см ). Об'єднаний екстракт послідовно промивають водою, насиченим розчином бікарбонату натрію, водою, сушать безводним сульфатом натрію, 1 UA 114555 C2 510 15 20 25 30 35 40 45 50 55 60 фільтрують і розчинник випарюють. Залишок сублімують у вакуумі водяної помпи (20 мм рт. ст.) при температурі 100 °C. Вихід 10,52 г (68 %). Т. топл. 85-86 °C. Знайдено, %: F 51,89, N 6,23. C5H6F6NO. Вирахувано, %: F 51,56, N 6,33. 1 Спектр ЯМР Н (400 МГц, DMSO-d6, ТМС), δ, м. ч.: 1,17 (м., 2Н, СН2); 1,35 (м., 2Н, СН2); 10,29 (уш. с., 1H, NH). 1 Спектр ЯМР Н (400 МГц, CDCl3, ТМС), δ, м. ч.: 1,22 (м., 2Н, СН2); 1,42 (м., 2Н, СН2); 7,26 (уш. с., 1Н, NH). 19 Спектр ЯМР F (188.143 МГц, CDCl3, FCCl3), δ, м. ч.: -76,41 (c.,3F, COCF3); -74,26 (с, 3F, CF3). 13 2 Спектр ЯМР С (125 МГц, CDCl3, ТМС), δ, м. ч.: 11,25 (с, СН2СН2); 33,21 (кв., JCF=39 Гц, 1 1 2 CF3CNH), 115,38(кв., JCF=298 Гц, COCF3); 124,40 (кв., JCF=275 Гц, CF3); 157,76 (кв., JCF=37 Гц, СО). Приклад 2 Гідрохлорид 1-(трифлуорометил)циклопропанаміну. Розчин 8,84 г (0,04 моль) 2,2,2-трифлуоро-N-[1-(трифлуорометил)циклопропіл]ацетаміду в 3 50 см насиченого хлоридом водню метанолу кип'ятять впродовж 8 годин, розчинник випарюють, залишок сублімують у вакуумі масляної помпи (0,12 мм рт. ст.) при температурі 100 °C. Вихід 6,26 г (96 %). Знайдено, %: Сl-21,78, F-34,95, N-8,58. C4H7ClF3N. Вирахувано, %: Сl-21,95, F-35,28, N-8,67. 1 Спектр ЯМР Н (400 МГц, DMSO-d6, ТМС), δ, м. ч.: 1,32 (м., 2Н, СН2), 1,43 (м., 2Н, СН2), 9,71 + 1 (уш. с, 3Н, NH3 ) (Літ.[16]: ЯМР Н (DMSO-d6, ТМС), δ, м. ч.: 1,27-1,47 (м., 4Н, СН2), 9,66 (уш. с, + 3Н, NH3 ). 19 Спектр ЯМР F (188,143 МГц, DMSO-d6, FCCl3), δ, м. ч.: -72,24 д. (с, 3F, CF3). 13 2 Спектр ЯМР С (125 МГц, DMSO-d6, ТМС), δ, м. ч.: 8,16(с, СН2СН2); 34,06(кв., JCF=39 Гц, + 1 CF3CNH3 ), 123,07(кв., JCF=274 Гц, CF3). Джерела інформації: 1. К. Vandyck et al. Carboxamide derivatives and the use thereof as medicaments for the treatment of hepatitis В WO 2015/059212, Publ. 30.04.2015 2. R. Armer et al. Heterocyclic compounds as hedgehog signaling pathway inhibitors WO 2014/191737, Publ. 04.12.2014 3. K. Vandyck et al. Sulphamoylpyrrolamide derivatives and the use thereof as medicaments for the treatment of hepatitis B, WO 2014/184350 Publ. 20.11.2014 4. K. Vandyck et al. Sulphamoylthiophenamide derivatives and the use thereof as medicaments for the treatment of hepatitis B, WO 2014/184365 Publ. 20.11.2014 5. S.D.P. Baugh, Hong Ye Novel antiviral agents against HBV infection WO 2014/106019 Publ. 03.07.2014 6. S.J. Last et al. Sulfamoylarylamides and the use thereof as medicaments for the treatment of hepatitis В WO 2014/033170, Publ. 06.03.2014 7. Wenqing Yao, D.M. Burns, Jincong Zhuo Azetidinyl phenyl, pyridyl or pyrazinyl carboxamide derivatives as JAK inhibitors В WO 2012/177606, Publ. 27.12.2012 8. Jayant Thatte et al. Cannabinoid receptor modulators WO 2012/116279, Publ. 30.08.2012 9. S. Allen et al. Substituted pyrazolo[l, 5-a]pyrimidine compounds as TRK kinase inhibitors WO 2011/006074, Publ. 13.01.2011 10. T. Seitz et al. Use of dithiine-tetracarboximides for controlling phytopathogenic fungi US 2010/0120884, Publ. 13.05.2010 11. E. Canales et al. 2,4,6-Trisubstituted pyrido(3,2-d)pyrimidines useful for treating viral infections WO 2010/002998, Publ. 07.01.2010 12. В. Baasner Cyclopropylamines containing trifluoromethyl groups Pat. US 4774358, Publ. 27.09.1988 13. Хіаоуап Zhang et al. Discovery of novel HCV inhibitors: Synthesis and biological activity of 6(indol-2-yl)pyridine-3-sulfonamides targeting hepatitis С virus NS4B Bioorganic&Medicinal Chem.Lett. 2013, 23, pp.3947-3953 14. D. Barnes-Seeman et al. Metabolically Stable tert-Butyl Replacement ACS Med. Chem.Lett. 2013, 4, pp.514-516 15. S.E. Lazerwith etal. Optimization of Pharmacokinetics through Manipulation of Physicochemical Properties in a series of HCV Inhibitors ACS Med.Chem.Lett. 2011, 2, pp. 715719 16. E.N. Flemming etal. New 3-Alkylamino-4H-1, 2,4-thiadizine 1,1-Dioxyde Derivatives Activate ATP-Sensitive Potassium Channels of Pancreatic Beta Cells J. Med.Chem. 2006, 49, pp.4127-4139 17. M.R. Hickey et al. Trifluoroacetylation of Amino Acids under Aqueous Conditions Using a Readily Prepared Non-Odoriferous Reagent Synlett 2005, 2, pp. 255-258. 2 UA 114555 C2 ФОРМУЛА ВИНАХОДУ Спосіб одержання гідрохлориду 1-(трифлуорометил)циклопропанаміну формули (1): + NH3 CF3 Cl 5 1 , який відрізняється тим, що 1-(трифлуороацетил)аміноциклопропанкарбонову кислоту піддають взаємодії з тетрафлуоридом сірки при температурі 80-85 °C протягом 16-18 годин з наступним зняттям трифлуороацетильної групи з атома азоту проміжного 2,2,2-трифлуоро-N-[1(трифлуорометил)циклопропіл]ацетаміду нагріванням у метанолі, насиченому хлоридом водню. 10 Комп’ютерна верстка О. Рябко Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 3
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07C 211/62, C07C 211/35
Мітки: 1-(трифлуорометил)циклопропанаміну, одержання, гідрохлориду, спосіб
Код посилання
<a href="https://ua.patents.su/5-114555-sposib-oderzhannya-gidrokhloridu-1-trifluorometilciklopropanaminu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання гідрохлориду 1-(трифлуорометил)циклопропанаміну</a>
Попередній патент: Полімерний композиційний матеріал
Наступний патент: Фенольна добавка для композиції електроосаджуваного покриття, яка містить циклічний гуанідин
Випадковий патент: Спосіб заправки системи нейтралізації автомобіля аміаковмісною рідиною









