Спосіб одержання n-(1-трифлуорометил-2-ацил)вініламідів карбонових кислот
Номер патенту: 74348
Опубліковано: 25.10.2012
Автори: Бездудний Андрій Васильович, Онисько Петро Петрович, Лобанов Сергій Володимирович, Синиця Анатолій Данилович
Формула / Реферат
Спосіб одержання N[-(1-трифлуорометил-2-ацил)вініламідів карбонових кислот загальної формули:
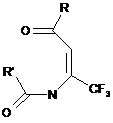 ,
,
де R=EtO, Ph, 4-FC6H4, 3-FC6H4, 4-С1С6Н4, 4-МеОС6Н4, 3-CF3C6H4;
R' - CF3, CCl3, 2-FC6H4, який відрізняється тим, що N-ацилтрифлуороацетаміди нагрівають з ілідами фосфору в апротонному органічному розчиннику при температурі 60-70 °C протягом 4 годин, з наступним виділенням цільових продуктів звичайними методами.
Текст
Реферат: UA 74348 U UA 74348 U Корисна модель належить до органічної хімії, а саме до нового способу одержання N-(1трифлуорометил-2-ацил)вініламідів карбонових кислот, загальної формули 1: R O R' CF3 N O 1 , 5 10 15 20 25 де R=EtO, Ph, 4-FC6H4, 3-FC6H4, 4-СlС6Н4, 4-МеОС6Н4, 3-CF3C6H4; R' = CF3, ССl3, 2-FC6H4 Сполуки даного типу, завдяки наявності енамінового фрагменту, функціональних груп біля зв'язку ОС та фармакофорної трифлуорометильної групи, можуть знайти застосування в органічному синтезі для одержання різноманітних ациклічних та гетероциклічних трифлуорометилвмісних похідних [1-3], а також як базові системи для дизайну та синтезу речовин із потенційною фармакологічною дією. Відомо, що введення трифлуорометильної групи в сполуки приводить, як правило, до покращення їх фізико-хімічних, біологічних і фармако-кінетичних властивостей [4, 5]. Описаний в літературі [6] метод синтезу єдиного відомого в літературі представника сполук 1 (R=EtO, R' = CF3), включає довготривале кип'ятіння важкодоступного етил трифлуороацетоацетату з ацетатом амонію, що приводить до амінотрифлуорокротонату, CF3C(NH2)=CHCOOEt, 89 % [7], та наступне ацилювання останнього трифлуорооцтовим ангідридом. Стадія ацилювання здійснюється неселективно і приводить до суміші (1:1) С- та N-трифлуороацетильних похідних [6]. Виділення цільового продукту (вихід 43 %) з цієї суміші здійснюється тільки за допомогою колонкової хроматографії, що обмежує препаративні масштаби способу, при цьому половина реагентів витрачається не за призначенням, а загальний вихід по двох стадіях складає лише 38.2 %. Окрім цього, метод не має загального характеру, оскільки важко передбачити регіоспрямованість ацилювання в залежності від замісників R та R', невизначеною залишається геометрія зв'язку С=С. В основу корисної моделі поставлена задача є розробка нового та зручного методу синтезу N-(1-трифлуорометил-2-ацил)вініламідів карбонових кислот, загальної формули 1: R O R' N O 30 35 1 CF3 , де R=EtO, Ph, 4-FC6H4, 3-FC6H4, 4-СlС6Н4, 4-МеОС6Н4, 3-CF3C6H4; R' - CF3, ССl3, 2-FC6H4 Спосіб одержання сполук, які заявляються, полягає в тому, що препаративно доступні Nацилтрифлуороацетаміди 2 нагрівають з ілідами фосфору 3 в апротонному органічному розчиннику (толуол) при температурі 60-70 °C протягом 4 годин. Цільові продукти виділяють з реакційної суміші стандартними методами, а їх очистка здійснюється перегонкою в вакуумі. Виходи цільових сполук складають 76-92 %, чистота перевищує 95 %. 1 UA 74348 U R O O R' N 2 5 10 15 20 25 30 35 40 45 50 Ph3P=CHCOR 3 CF3 O R' CF3 N O 1 . Основою запропонованого підходу є стереоселективне створення нового зв'язку С=С за реакцією Віттіга N-ациламідів трифлуорооцтової кислоти з ілідами фосфору, що відкриває ефективний шлях до трифлуорометилзаміщених енамідів з фіксованою Z-конфігурацією замісників біля зв'язку С=С, які можуть знайти практичне застосування, як базові сполуки для створення комбінаторних бібліотек потенційних фармацевтичних сполук. Отриманий результат не був заздалегідь передбачуваним, оскільки, по-перше, реакція Віттіга не є типовою для амідів кислот та ілідів з електроноакцепторними замісниками біля атому вуглецю. По друге, неочевидною була можливість реалізації процесу за участі однієї, а не двох груп С=О. По третє, у випадку несиметричних імідів 2 (при R' CF3) важко було передбачити, яка з двох нееквівалентних груп С=O буде вступати в реакцію. По четверте, важко було передбачити стереоселективність процесу. Насправді ж в запропонованій схемі процес утворення нового зв'язку С=С з утворенням N(1-трифлуорометил-2-ацил)вініламідів карбонових кислот характеризується високою регіо- і стереоселективністю, здійснюється за участю більш електрофільної групи С=О, активованої CF3 замісником та приводить виключно до сполук із Z-конфігурацією подвійного зв'язку. Перевагою методу, що пропонується, є реалізація його при помірному нагріванні компонентів, можливість варіювання природи ацильних груп, легкості виділення і очищення цільових продуктів. Склад та будова одержаних сполук підтверджена даними елементного аналізу та спектрами ядерного магнітного резонансу, а для сполуки 1 (R=4-FC6H4, R' = CF3) методом рентгеноструктурного аналізу (Фіг.). Корисна модель ілюструється загальним методом одержання N-(1-трифлуорометил-2ацил)вініламідів карбонових кислот загальної формули 1. Суміш 0.01 моль відповідного N-ацилтрифлуороацетаміду та 3.48 г (0.01 моль) етил (трифенілфосфораніліден)ацетату в 30 мл толуолу нагрівають при 60-70 °C 4 години. Толуол видаляють у вакуумі, залишок екстрагують гексаном (3 × 20 мл). Гексан відганяють у вакуумі, перегонкою залишку одержують цільовий продукт. Приклад 1. Етил (2Z)-4,4,4-трифлуоро-3-[(трифлуорацетил)аміно]бут-2-еноат. Вихід 86 %, т.кип. 701 72 °C (10 мм рт.ст.). Спектр ЯМР Н (CDCl3, TMC): 1.34 т.(3Н), 4.30 к (2Н), 6.04 с (1Н), 11.64 ш.с 19 13 (1Н). Спектр ЯМР F (CDCl3, FCCl3): -65.9 с (3F, CF3),-76.4 с (3F, CF3). Спектр ЯМР С (CDCl3, TMC): 13.3 с, 61.5 с, 105.3 д, 115.4 к, 118.5 к, 138.3 к, 152.1 к, 166.4 с. Приклад 2. (2Z)-3-Трифлуорацетиламіно-4,4,4-трифлуоро-1-фенілбут-2-ен-1-он. Вихід 87 %, т.кип. 92 °C 1 (0.5 мм.рт.ст.). Спектр ЯМР Н (CDC13, TMC): 7.09 с (1Н), 7.57-7.73 м (3Н), 8.03 д (2Н), 13.0 с 19 13 (1H). Спектр ЯМР F (CDCl3, FCCI3): -68.6 с (3F, CF3),-75.9 с (3F, CF3). Спектр ЯМР С (CDCl3, TMC): 106.6 k, 115.1 к, 118.4 k, 128.5 с, 129.2 с, 134.8 с, 136.6 с, 138.6 к, 153.5 к. Приклад 3. (2Z)-3-Трифлуорацетиламіно-4,4,4-трифлуоро-1-(4-флуорофеніл)бут-2-ен-1-он. 1 Вихід 88 %, т.кип. 98 °C (0.5 мм.рт.ст.). Спектр ЯМР Н (CDC13, TMC): 7.12 с (1H), 7.16-7.19 м 19 (2Н), 7.83 м (2Н), 13.20 с (1Н). Спектр ЯМР F (CDCl3, FCCl3): -66.7 с (3F, CF3),-76.9 с (3F, CF3),13 102.5 м (IF, 4-FPh) Спектр ЯМР С (CDCl3, TMC): 106.6 к, 115.1 к, 118.4 к, 128.5 с, 129.2 с, 134.8 с, 136.6 с, 138.6к, 153.5 k. Приклад 4. (2Z)-3-Трифлуорацетиламіно-4,4,4-трифлуоро-1-(3-флуорофеніл)бут-2-ен-1-он. 1 Вихід 80 %, т.кип. 101 °C (0.5 мм.рт.ст.). Спектр ЯМР Н (CDCl3, TMC): 7.00 с (1H), 7.38 т 19 (1Н), 7.54 м (1Н), 7.69 д (1Н), 7.78 д (1Н), 12.80 с (1H). Спектр ЯМР F (CDC13, FCCl3): -65.6 с 13 (3F, CF3),-75.2 с (3F, CF3),-110.3 с (IF, З-FPh). Спектр ЯМР С (CDC13, TMC): 96.6 к, 116.1 д, 121.4 к, 124.2 д, 124.6 д, 124.8 д, 132.8 д, 138.5 д, 146.4 к, 159.2 к, 164.2 д, 190.5 к. Приклад 5. (2Z)-3-Трифлуорацетиламіно-4,4,4-трифлуоро-1-(4-хлорофеніл)бут-2-ен-і-он. 2 UA 74348 U 1 5 10 15 20 25 30 35 Вихід 76 %, т.кип. 110 °C (0.5 мм.рт.ст.). Спектр ЯМР Н (CDCl3, TMC): 7.60 с (1Н), 7.95 д 19 (2Н), 8.28 д (2Н), 13.30 с (1H). Спектр ЯМР F (CDCl3, FCCl3): -65.5 с (3F, CF3),-75.7 с (3F, CF3). Приклад 6. (2Z)-1-(4-Метоксифеніл)-3-трифлуорацетиламіно-4,4,4-трифлуоро-бут-2-ен-1-он. 1 Вихід 92 %, т.кип. 158 °C (0.5 мм.рт.ст.). Спектр ЯМР Н (CDC13, TMC): 7.00 с (1Н), 7.03 с 19 (2Н), 8.01 с (2Н), 13.20 с (1Н). Спектр ЯМР F (CDC13, FCC13): -66.54 с (3F, CF3),-76.82 с (3F, 13 CF3). Спектр ЯМР С (CDCl3, TMC): 55.73 с, 106.67 к, 114.52 с, 118.40 к, 128.60 с, 129.49 с, 131.16 с, 136.60 с, 138.16 к, 153.62 к, 165.13 с, 190.08 с. Приклад 7. (2Z)-3-Трифлуорацетиламіно-4,4,4-трифлуоро-1-[(3-(трифлуорометил)феніл]бут-2-ен-1-он. 1 Вихід 84 %, т.кип. 98 °C (0.5 мм.рт.ст.). Спектр ЯМР Н (CDCl3, TMC): 7.07 с (1H), 7.73 т (1Н), I9 7.96 д (1H), 8.17 д (1Н), 8.27 с (1Н), 12.82 с (1Н). Спектр ЯМР F (CDCl3, FCC13): - 64.2 с (3F, 13 CF3),-68.9 с (3F, CF3),-76.0 с (3F, CF3). Спектр ЯМР С (CDCl3, TMC): 106.2 к, 115.0 к, 119.0 к, 123.8 к, 125.4 м., 129.9с, 131.0 д., 131.5 с, 132.1 д, 137.1 с, 139.5 к, 153.4 к, 190.8 с. Приклад 8. Етил (2Z)-4,4,4-трифлуоро-3-[(трихлороацетил)аміно]бут-2-еноат. 1 Вихід 74 %, т.кип. 106 °C (0,5 мм рт.ст.). Спектр ЯМР Н (CDC13, TMC): 1.34 т (3Н), 4.30 к 19 (2Н), 6.04 с (1Н), 11.78 ш.с (1Н). Спектр ЯМР F (CDCl3, FCCl3): -66.3 с (3F, CF3). Спектр ЯМР 13 С (CDCl3, TMC): 13.96 с, 62.40 с, 91.96 с, 106.14 к (0.6 Гц), 119.23 к (27 Гц), 139.25 к (7Гц), 157.87 с, 167.10 с. Приклад 9. Етил (2Z)-4,4,4-трифлуоро-3-[(2-флуоробензоїл)аміно]бут-2-еноат. 1 Вихід 84 %, т.пл. 39 °C. Спектр ЯМР Н (CDC13, TMC): 1.29 т (ЗН), 4.24 к (2Н), 5.95 с (1Н), 19 7.17 дд (1Н), 7.27 т (1Н), 7.53 д (1H), 8.07 т (1Н), 11.06 ш.с (1Н). Спектр ЯМР F (CDCl3, FCCl3): 13 65.05 с (3F, CF3),-111.75 с (IF). Спектр ЯМР C (CDCl3, TMC): 14.07 с, 61.49 с, 105.31 к (6Гц), 116.51 д (24Гц), 120.03 к (274 Гц), 120.22д (11Гц), 128.58 д (11Гц), 132.13 д (8Гц), 134.76 д (10Гц), 139.92 к (35 Гц), 160.19 с, 160.66 д (251 Гц), 166.70 с. Джерела інформації: 1. Koichi M., Tatsushi M., Lili Z., Yoshimitsu I., Shigekazu I. Tetrahedron: Asymmetry, 2010, 21,910, 1158. 2. Тростянская И.Г., Луценко СВ., Ефимова И.В., Казанкова М.А., Белецкая И.П. ЖорХ. 1996, 32, 7, 1054. 3. Енамины в органическом синтезе: сб. науч. тр. Свердловск: УрО АН СССР, 1990.-108 с. 4. Organofluorine Compounds in Medicinal Chemistry and Biomedical Applications (Eds: Filler R., Kobayashi Y., Yagupolskii L. M.), Elsevier, Amsterdam, 1993. 5. Smits R., Cadicamo CD., Burger K., Koksh B. Chem. Soc. Rev., 2008, 37, 8, 1727. 6. Decock-Plancquaert M.-A., Evariste F., Guillot N., Janousek Z., Maliverney C, Merenyi R., Viehe H. G. Bull Soc. Chim. Belg.,1992, 101, 4, 313. 7. Lutz A.W., Trotto S.H. J. Heterocyclic Chem. 1972, 9, 513. 40 ФОРМУЛА КОРИСНОЇ МОДЕЛІ Спосіб одержання формули: N-(1-трифлуорометил-2-ацил)вініламідів карбонових кислот загальної R O R' N 45 CF3 O , де R=EtO, Ph, 4-FC6H4, 3-FC6H4, 4-С1С6Н4, 4-МеОС6Н4, 3-CF3C6H4; R' - CF3, CCl3, 2-FC6H4, який відрізняється тим, що N-ацилтрифлуороацетаміди нагрівають з ілідами фосфору в апротонному органічному розчиннику при температурі 60-70 °C протягом 4 годин, з наступним виділенням цільових продуктів звичайними методами. 3 UA 74348 U Комп’ютерна верстка M. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 4
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the production of n-(1-trifluoromethyl-2-acyl)vinylamide carboxylates
Автори англійськоюOnysko Petro Petrovych, Lobanov Serhii Volodymyrovych, Bezdudnyi Andrii Vasyliovych, Synytsia Anatolii Danylovych
Назва патенту російськоюСпособ получения n-(1-трифлуорометил-2-ацил)виниламидов карбоновых кислот
Автори російськоюОнисько Петр Петрович, Лобанов Сергей Владимирович, Бездудный Андрей Васильевич, Синица Анатолий Данилович
МПК / Мітки
МПК: C07D 333/10
Мітки: n-(1-трифлуорометил-2-ацил)вініламідів, кислот, карбонових, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/6-74348-sposib-oderzhannya-n-1-trifluorometil-2-acilvinilamidiv-karbonovikh-kislot.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання n-(1-трифлуорометил-2-ацил)вініламідів карбонових кислот</a>
Попередній патент: Настоянка “дух царів” (“духъ царей”, “spirits of the tsars”)
Наступний патент: Спосіб запобігання зіткненням автомобілів
Випадковий патент: Пристрій для одночасно-роздільної експлуатації продуктивних горизонтів газоконденсатних свердловин










