Сполуки n-ортохлорфеніл-3-(7′-теофіліл)-сукцинімід та n-парахлорфеніл-3-(7′-теофіліл)-сукцинімід з потенційними фізіологічними властивостями
Формула / Реферат
Сполуки N-ортохлорфеніл-3-(7'-теофіліл)-сукцинімід та N-парахлорфеніл-3-(7'-теофіліл)-сукцинімід загальної формули
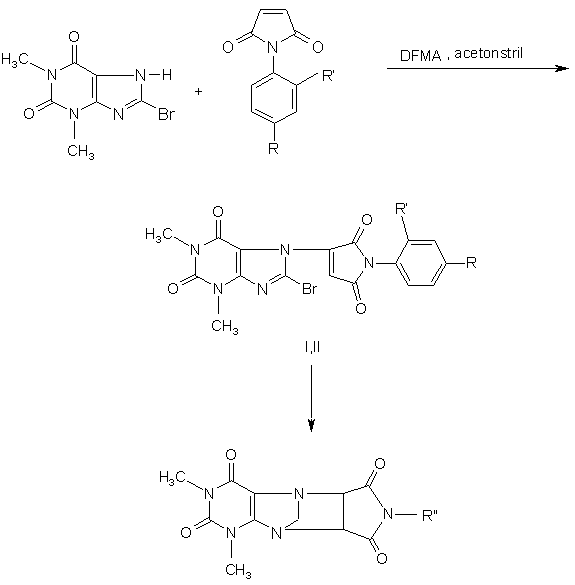 ,
,
аддукти-продукти циклізації сполук (І,ІІ),
де R - H, R'-Cl, R" - PhCl (ortho) (I); R - Cl, R' - H, R" - PhCl (para) (II), для яких можливе циклування за рахунок 7,8-циклоприєднання з утворенням поліциклічних аддуктів,
з потенційними фізіологічними властивостями.
Текст
Сполуки N-ортохлорфеніл-3-(7'-тео філіл)сукцинімід та N-парахлорфеніл-3 -(7'-тео філіл)сукцинімід загальної форм ули 2 O H3 C O O N N H N N O N DFMA , acetonstril R' + Br R CH3 O H 3C N O R' O N N N N R Br O CH3 I,II O N O N CH3 N R" O кулу малеїніміду [1,2]. Було синтезовано похідні малеїніміду з анксіолітичним типом дії; що впливають на пост-синаптичні рецептори; психотропні агенти та з іншими типами дії. Давно відомими і найбільш перспективними є по хідні мале їнімідів, що мають протисудомну активність, на основі яких були розроблені і успішно застосовуються у медичній практиці такі лікарські засоби, як етосуксімід, фенсуксімід, морсуксімід, метсуксімід, пуфемід. їх застосовують (19) Корисна модель відноситься до хімії гетероциклічних сполук, а саме, до N-ортохлорфеніл-3-(7'теофіліл)-сукциніміду та N-парахлорфеніл-3-(7'теофіліл)-сукциніміду (далі, сполуки І, II), які можуть бути фізіологічно активними за рахунок наявності в будові фрагменту молекули циклічного іміду. Як свідчать результати наукових робіт спрямованість фізіологічної дії речовини даного класу залежить від будови введеного замісника в моле UA (11) , аддукти-продукти циклізації сполук (І,ІІ), де R - H, R'-Cl, R" - PhCl (ortho) (I); R - Cl, R' - H, R" - PhCl (para) (II), для яких можливе циклування за рахунок 7,8-циклоприєднання з утворенням поліциклічних аддуктів, з потенційними фізіологічними властивостями. (13) N U O N 21100 H 3C 3 21100 4 при лікуванні малих приступів епілепсії, а також Cхема 3. при міоклонічних приступах, пікнолептичних приступах та непікнолептичних приступах у підліткі в, які супро водж уються коро ткочасною втра тою O свідомості , короткочасни х втрата х свідомості у O маленьких дітей, а типови х зага льних приступа х при вторинній епілепсії, тяжких комплексних приNH NH ступах. Сполуки із ряду заміщених малеїнімідів у порівнянні з похідними барбітуро во ї кисло ти, O O гіда тоіна та оксазолідин 2,4 -діон у у меншому ступені проявляють побічну та токсичну дію, а також їх можна отримувати за допомогою відносРеакцією суль фален у з малеїнімідом в ацено простих методів синтезу. тоні в умова х фо толіз у за допомогою L-ртутної При дослідженні реакцій малеїнімідів з похідлампи типу Hanovia 450-W синтезовано тетрагідними індолу встановлено, що індол не реагує з Nротієноциклобутапіроледіон-2,2-діоксид [1], (схема арилімідами малеїнової кислоти навіть при тем4): Схема 4. пературі 150°С. 2-Метиліндол та його похідні, нуклеофільність b -вуглецевого атому яких значно O O більша у порівнянні з індолом, вступають у реакO O h, ацетон цію з імідами при 90-120°С [3]. NH O S NH O S + Схему реакції можна представити як нуклеофільне приєднання по подвійному зв'язку малеїO O німіду, з проміжним утворенням цвіттер-іону, що стабілізуюється у відповідний імід бурштинової який вступає в реакції заміщення по атому вокислоти (схема 1): дню при гетероатомі азоту (схема 5): С хе ма 1. O N R1 .. N Схема 5. O CH R3 N + N R R O R2 R3 N R1 N R3 O R2 R Синтезовано продук ти взаємодії малеїнімідів з похідними індолу (із збереженням будо ви молек ули мале їнімі ду за ра хунок вза ємодії ті льки функціона льни х гр уп ) загального виду [4,5], (схема 2): Схема 2. R4 O N R3 O R5 R6 N R2 O O H R1 O R2 O R1 біс(індоліл)малеїніміди Малеїніміди реагують з гетероциклічними системами. Описано метод синтезу поліциклічних гетероарилпіперазінілімідів реакцією арил- або гетероарилпіперазинів з поліциклічними алкілімідами [1], (схема 3): O O S NH + HN O N R Br(CH2 )4Br O O S N O (CH 2)4 N N R Огля д лі тера турни х дан и х дає можли ві сть про гноз ува ти , що в рез уль та ті нуклео фі льного приєднання молек ул скла дни х азо то вмісни х біциклі чни х си стем (заміщених та незаміщених теофілінів) до N-заміщеного малеїніміду можливе утворення нових сполук з потенційною біологічною активністю: протипухлинною, протисудомною, а також антимікробною дією [1, 6, 7]. Раніше нами були отримані інші нові гетероциклічні похідні малеїнімідів шляхом нуклеофільного приєднання по подвійному зв'язку [8, 9]. Стр уктурні аналоги продуктів р е ак ці й те о фі лін у та N п а р а (о р то )-хло р фе н і лма ле їн імі ді в з п о тен ці й н им и фізіологічними властивостями на сьогодні не відомі (літературний опис відсутній). В основу корисної моделі поставлено хімічну будову молекули сполук N-ортохлорфеніл-3-(7'тео філіл)-сукцинімід та N-парахлор феніл-3-(7'тео філіл)-сукцинімід (далі, сполуки І, II) з потенційними фізіологічними властивостями шляхом взаємодії ІЯ-пара(орто)-хлорфенілмалеїнімідів та теофіліну (за участю а гомів водню при 7 та 8 положенні молекули теофіліну) у молярному співвідношенні 1 : 1 . Реакції проводилися у системі розчинників диметилформамід - ацетонітрил ( 1 : 1 ) при постійному кип'ятінні та перемішуванні реакційної суміші 48 годин з метою забезпечення отримання сполук (І, II) з потенційними фізіологічними властивостями. Можливе утворення більш складних аддуктів сполук (І, II) - поліциклічних систем за рахунок подальшого проходження реакції 7, 8 5 21100 6 циклоприєднання (циклізації) в молекулах сполук орто хло р фені лмале їнімі ду в ДМФА , кип'ятять (І, II) (схема 6): 48 годин. Охолоджують, заливають суміш водою. Осад, що утворився, відфільтровують, промиваСхем а 6. ють сухим метанолом і сушать у пістолеті Фішера. Продукт -порошок бордового кольору. Вихід 6070%. Ттопл. 151-156°С. O O O N DFMA , acetonstril H3 C Ме тодика синтез у N-пара хлор феніл-3 -(7'N N H R' тео філіл)-сукциніміду (II). + O N N Br До розчину 1.0 г (0 ,0055 моль) тео філін у в 3мл ацетонітрилу при перемішуванні та на гріR CH3 ванні до кипін ня до дають 1 .1 5г (0 ,005 5 моль) N-пара хлор фенілма ле їніміду в ДМФА , кип'ятять ' R O O 48 годин. Охолоджують, заливають суміш водою. H 3C N N Осад, що утворився, відфільтровують, промиваN R ють сухим метанолом і сушать у пістолеті Фішера. O N N Br O Продукт - порошок бордового кольору. Вихід 60CH3 70%. Ттопл. 151-156 °С. I,II Інди відуа льність сполук (І, II) контролюва ли методом тонкошаро во ї хромато гра фі ї, склад підтверджували даними елементного аналізу. УФ - спектри сполук (І, II) записували на спекO O трофотометрі Mel Temp II (USA). H 3C N N ІЧ - спектри записували на спектрофотометрі N R" UR-20 (виробник "Charles Ceise Hena", Germany). O N N Спектри ПМР сполук (І, II) записували на O CH3 приладах "Bru ker WP-200" (виробник "Bruker", де R-H, R’-Cl, R”-PhCl (ortho) (I); R-Cl, R’-H, R”-PhCl Switzerland), "Varian T-60" (виробник "Varian", USA) (para) (II). з робочою частотою 200-132 МГц у виді розчинів Варіювання умов проведення реакцій: промиДМСО-D6 (вн утрішні стандарти ТМС та Г МДС). вання кінцевих продуктів реакцій під час фільтруТШХ виконували на пластинах Silufol-254. вання в вакуумі сухим метанолом без перекристаГРХ визначали на газорідинному хроматографі лізації та сушка в пістолеті Фішера дозволили "Perkin Е1тег"з УФ-детектором (виробник "Perkin", збільшити практичний вихід сполук (І, II) до 60Germany). 70%. Хр о ма то грам а , ІЧ-, П МР - спе к тр и спо лук Таким чином, можна зробити висновок, що (І, II) і ден ти фік ува ли у п ор і вн ян ні з хроматогсполуки (І, II) з потенційними фізіологічними власрамами, УФ-, ІЧ-, ПМР - спектрами вихідних спотивостями можуть бути перспективними у розробці лук. нових лікарських засобів з проти судомною активСинтезовані сполуки (І, II) - це кристалічний ністю, з анксіолітичним типом дії; що впливають на порошки бордового кольору, ізолюються без криспостсинаптичні рецептори, психотропних агентів талізації, з метою очистки промиваються сухим та з іншими типами дії. метанолом. Дані елементного аналізу на С, Н, N Ознаки способу. Ме тодика син тез у ІЧсполук (І, II) відповідають розрахованим значенорто хлор феніл-3 -(7'-тео фі ліл)-сукциніміду (І). ням (таблиця 1). До розчину 1,0 г (0 ,0055 моль) тео філін у в 3 мл ацетонітрилу при перемішуванні та на грі ванні до кипіння дода ють 1 ,15 г (0 ,0055 моль) NТаблиця 1 Дані елементного аналізу сполук (І, II) Сполука Бруто-формула І II С17Н14O 4N5Cl С17Н14O 4N5Cl В ІЧ-спектрах сполук (І, II) в області 600900см -1 спостерігаються інтенсивні смуги непласких де формаційних коливань С-Н ароматичних кілець, в той час як вален тні коливання С-С зв'язків бензольних ядер при 1585-1600см -1 та 1400-1500см -1 ідентифікувати неможливо, так як дані області спектру близькі до коливань зв'язку С=С ,>N - Н групи. В ІЧ-спектрі стандартної речовини (сукцинімід) деформаційні коливання С-Н ароматичного кільця в області 600-900см -1 відсутні. Знайдено, у% С Н N 51,95 3,20 17,19 51,93 3,18 17,15 Розраховано, у% С Н N 52,51 3,60 18,0 52,51 3,6 18,0 Валентні коливання карбонільних гр уп (С=О ) сполук (І, II) проявляються високоінтенсивним максимумом в області 1660-1700см -1 (дві смуги) і є найбільш характеристичними, так як інші смуги в даній області практично відсутні. Крім того, в 14 - спектрі сполуки (І, II) в низькочастотній області спектра можна легко визначити в результаті високої інтенсивності смугу зв'язку С-С1 (530-600см-1), хоча цінність даної ідентифікації обмежена, оскільки про присутність 7 21100 8 галоїду в молекулі відомо з даних елементного явність в молекулах пуринового кільця. Віднесенаналізу і якісних реакцій на галоген. ня сигналів в 14 - спектрах сполук (І, II) наведено ІЧ - спек три сп олук (І, II) ха рак тери з ують в таблиці 2. ся си гна лом пр и 1 600 см - 1 , що підтверджує наТаблиця 2 Спектральні характеристики: ІЧ, ЯМР 1Н, синтезованих сполук (І, II) та сукциніміду - сполуки порівняння Сполука 1 Сукцинімід ІЧ -спектр ( n , КВr,см-1) 2 1500-1600(>N-H) 1630,1700(С=О) І 530-600 (Ph-Cl) 600-900 (С-Н, Ph) 1600 (purine ring) 1660-170 0 (С=О) II 530-600 (Ph-Cl) 600-900 (С-Н, Ph) 1600 (purine ring) 1660-170 0 (C =O) ПМР - спектри сполук (І, II) мають сигнали у вигляді мультиплетів при 7.5-7,64 м. д., що відповідає протонам ароматичного кільця, характерні сигнали у вигляді синглетів при 2.70, 2.80, 3.24 і 3.45 м. д., що відповідає протонам груп –СН3 гетероциклічного кільця. ПМР - спектри сполук (І, II) мають сигнали у вигляді синглетів при 2,70, 2,80 м. д., що відпо відає двом про тонам молек ули сукциніміду в четвер том у положенні , си гнал у вигляді синглету при 3,25м. д. відповідає протон у залишку молекули сукциніміду в третьому положенні. Крім того, ідентифіковано сигнал протону у 8му положенні молекули теофіліну для сполук (І, II) при 8.40 м. д. у вигляді синглету, в той час як в молекулі вихідної сполуки - незаміщеного теофіліну цей сигнал спостерігається при 8.30 м.д. Віднесення сигналів в ПМР спектра х сполук (І, II) наведено в таблиці 2. ПМР спектр сполуки (І) представлено на рисунку 1. ГРХ хроматограма та мас-спектр сполуки (І) представлені на рисунку 2. Таким чином, можна зробити висновок, що сполуки (І, II) з потенційними фізіологічними властивостями можуть бути перспективними у розробці нових лікарських засобів з проти судомною активністю, з анксіолітичним типом дії; що впливають на постсинаптичні рецептори, психотропних агентів та з іншими типами дії. Завданням корисної моделі є опис хімічної будови нових сполук: N-ортохлорфеніл-3-(7’теофіліл)-сукцинімід та N-парахлорфеніл-3-(7'теофіліл)-сукцинімід, які можуть бути фізіологічно ЯМР 1Н -спектр, d , (J, Гц), DMCO- d6, CCI4 3 2.70, 2 .80 (с, с, С(О)СН 2, 2Н); 3. 23 (с, СН3, 3Н); 3,25 (с., С(О)СН-, 1Н); 3. 45 (с, СН3, 3Н); 7,5-7,64 (м., Ph, 4Н); 8.40 (с, Н (8), 1H). 2,70, 2 .80 (с, с, С(О)СН 2, 2Н); 3. 23 (с, СН3, 3Н); 3,25 (c, С (О)СН -, 1Н); 3. 45 (с, СН3, 3Н); 7,5-7,64 (м., Ph, 4Н ); 8 .4 0(с., Н ( 8) , 1H). активними за рахунок наявності в будові фрагменту молекули циклічного іміду. ЛІТЕРАТУРА 1. Magid Abou - Gharbia, Usha R. Patel and all. // J. Med. Chem.- 1988. - Vol.31, №7. -P.1382-1385. 2. Richards M.N. (Merrel D., Res. Inst. 67084, Strasbourg, Fr.) // J. Pharmacol. Exp. Ther.-1 9 9 0 .2 5 5 (1 ).-P. 8 3 -89 . 3. Агбалян С.Г., Хачикян Р.Д., Лулукян К.К. V Армянский химический журнал. -1976. - т.29, №4. С.362-364. 4. Schultz, Michael, Tsaklakidis, Christos and all. Ger. Offen. De 4,005,970(C1.C07D403/04), 29 Aug. 1991. //Chem. Abstr. -1991. - Vol.115. - P.848. 5. Tsaklakidis Christos, Schultz Michael and all. Ger. Offen. De 4,005,969(C1.C07D403/14), 29 Aug. 1991. //Chem. Abstr. -1991. - Vol.115. - P.931. 6. Cooncy Da vid A., Milman Harry A., Cable Ritchard G. // Biochem. Pharmacol. - 1978,27(2), P.I51-166. 7. Balasubramaniyan V., Balasubramaniyan P., Shaikh A.S. // Te trahedron. - 1986, 42(10),P.27312738. 8. Вельчинская Е.В., Кузьменко И.Й., Кулик Л.С. Синтез новых производныхзамещенных урацилов и пиримидинов.// Химикофармацевтический журнал. Росс. Федерация . 1999.- № 3.- С.40 - 42. 9. Вельчинська О.В., Кузьменко І.Й., Драпайло А.Б. Синтез нових похідних заміщених малеїнімідів як потенційних фізіологічно активни х аген тів. Тези. доп.XVIII-о ї Укр. конф. з орг. хімії. 1998. Дніпропетровськ, с 369. 9 Комп’ютерна в ерстка Г. Паяльніков 21100 Підписне 10 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds of n-orthochlorophenyl-3-(7'-theophyilyl) -succinimide and n-parachlorophenyl-3-(7'- theophylyl) -succinimide with potential physiological properties.
Автори англійськоюVelchynska Olena Vasylivna
Назва патенту російськоюСоединения n-ортохлорфенил-3-(7'-теофилил)-сукцинимид и n-парахлорфенил-3-(7'-теофилил)-сукцинимид с потенциальными физиологическими свойствами
Автори російськоюВельчинская Елена Васильевна
МПК / Мітки
МПК: C07D 239/553, C07C 21/00, A61K 33/16
Мітки: властивостями, сполуки, фізіологічними, потенційними, n-ортохлорфеніл-3-(7'-теофіліл)-сукцинімід, n-парахлорфеніл-3-(7'-теофіліл)-сукцинімід
Код посилання
<a href="https://ua.patents.su/5-21100-spoluki-n-ortokhlorfenil-3-7-teofilil-sukcinimid-ta-n-parakhlorfenil-3-7-teofilil-sukcinimid-z-potencijjnimi-fiziologichnimi-vlastivostyami.html" target="_blank" rel="follow" title="База патентів України">Сполуки n-ортохлорфеніл-3-(7′-теофіліл)-сукцинімід та n-парахлорфеніл-3-(7′-теофіліл)-сукцинімід з потенційними фізіологічними властивостями</a>
Попередній патент: Сполуки n-параметоксифеніл-3-(7′-теофіліл-8-бром)-сукцинімід та n-ортометоксифеніл-3-(7′-теофіліл-8-бром)-сукцинімід з потенційними фізіологічними властивостями
Наступний патент: Спосіб лікування хворих на системні хвороби сполучної тканини
Випадковий патент: Спосіб визначення оксиду вуглецю (іі) в продуктах горіння









