Потенціометричний мультифункціональний біосенсор для послідовного специфічного визначення активностей розчинених трипсину та хімотрипсину в суміші за швидкістю гідролізу специфічних субстратів
Номер патенту: 23469
Опубліковано: 25.05.2007
Автори: Білоіван Ольга Анатоліївна, Рогальова Наталія Станіславівна
Формула / Реферат
Потенціометричний мультифункціональний біосенсор для послідовного специфічного визначення активностей розчинених трипсину та хімотрипсину в суміші за швидкістю гідролізу специфічних субстратів, що містить два рН-чутливих польових транзистори (рН-ПТ), об'єднаних на одному чіпі з можливістю роботи у режимі диференційної пари, на один з рН-ПТ нанесена робоча мембрана, специфічна до субстрату трипсину, на другий - робоча мембрана, специфічна до субстрату хімотрипсину, робоча мембрана одного з рН-чутливих транзисторів встановлена з можливістю функціонування як референтна або робоча мембрана відносно мембрани другого рН-ПТ, а біосенсор призначений для підключення до потенціометричної установки.
Текст
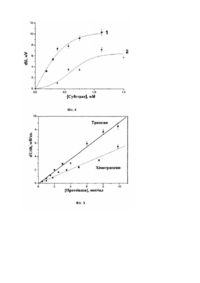
Корисна модель відноситься до біології, зокрема до засобів дослідження серинових протеїназ (ферментів класу пептидгідролаз підкласу протеїнази), а саме до конструкції потенціометричного мультифункціонального біосенсора для послідовного специфічного визначення активностей розчинених трипсину та хімотрипсину в суміші, і може бути використана для здійснення експрес-методу специфічного кількісного визначення активності протеїназ та для здійснення контролю якості білкових препаратів. Для практичної медицини t особливий інтерес має застосування у якості терапевтичних засобів очищених препаратів ферментів, коферментів та інгібіторів, що регулюють ферментативну активність. Особливо це стосується білок-руйнуючих ферментів, а саме протеїназ. Протеїнази та їх інгібітори широко використовують також в легкій та харчовій промисловостях та ін. Аналіз активності протеїназ, як небажаних домішок, є необхідною умовою для визначення якості високоочищених білкових препаратів. Кількісне визначення специфічної активності цих ферментів дає змогу найбільш точніше підібрати специфічні інгібітори для їх інактивації у разі, необхідності. Розширення об'ємів виробництва лікарських та ін. засобів висуває все більш високі вимоги до специфічності, чутливості, швидкості методів моніторінгу активності цих ферментів. Розвиток експрес-методів специфічного кількісного визначення активності протеїназ є актуальним для фармокологічних та біохімічних досліджень, клінічної діагностики, здійснення контролю якості комерційних білкових препаратів, екологічного моніторингу, та ін. В основі відомих авторам існуючих методів визначення активності протеїназ лежить кількісний аналіз продуктів фермент-залежної деградації білкових чи специфічних штучни х субстратів. Методи, що традиційно застосовуються для вимірювання протеолітичної активності, засновані на кількісному визначенні вільних амінокислот чи пептидів після обробки гідролізованного білкового субстрату концентрованими кислотами [Anson ML The estimation of pepsin, trypsin, papain and cathepsin with hemoglobin.// J. Gen. PhysioL- 1938.- 22, No 1.- P. 7989.] або на детекції вимірювання поглинання світла в результаті ферментативного гідролізу синтетичних пептидних субстратів [Schwert G.W., Такепака Y. Determination of trypsin and chymotrypsin // Biochem. Biphys. Acta.1955.-16.-P.570-575; Erlanger B.F., Kokowsky N.. Cohen W. The preparation and properties of two new chromogenic substrates for. trypsin., /Arch. Biochem. -1961, -95, P.-271]. Відтак, визначення активності протеїназ за гідролізом білків є трудомістким та займає багато часу, методи із застосуванням хромогенних субстратів неефективні у разі забарвлених та непрозорих зразків, таких як суцільна кров та суспензія клітинної культури. Для збільшення чутливості аналізу розроблені субстрати, що містять хромогенні або флуорогенні речовини, що ковалентно зв'язані с С-кінцевою або N-кінцевою ділянкою пептиду, або які мають у своєму складі радіоактивні ізотопи [Maeda Я. Assay of proteolytic enzymes by the fluorescence polarization technique.//Anal Bioehem.-1979.-92, 1. -:222227; Fernandez Murray P., Silberstein S., Cantore ML, and Passeron S. A radioactive method for the measurement of trypsin and trypsin-like activities. // Anal. Biochem. 1989. 179. P. 56-59]. Однак їм властивий ряд недоліків, таких, як потреба у корекції фона при їх використанні, достатньо вироку варіабельність результатів від вимірювання до вимірювання, необхідність підготовки зразків у день аналізу та ін. Не виключений певний ризик при їх застосуванні, пов'язаний з радіацією та канцерогенами. Застосування мультифункціонального біосенсора для специфічного визначення активності протеїназ (в даному випадку, трипсину та хімотрипсину) дасть змогу суттєво спростити процедуру та скоротити час аналізу і є перспективним для застосування в автоматизованому циклі на виробництві. Відомі пристрої подібного призначення для визначення специфічної естеразної активності окремих протеїназ (трипсину), наприклад, біосенсор для визначення активності трипсин-подібних протеїназ на основі рН-чутливи х польових транзисторів та іммобілізованого комплексу трипсин-а2-макроглобулін (Biloivan О.A., Dzyade vich S.V., Boubriak O.A., Soldatkin A.P., El'skaya A.V. Development of Enzyme Biosensor Based on ISFETs for Quantitative Analysis of Serine Proteinases // Electroanalysis 2004, 16, №22,1883 -1888), який дозволяє визначати розчинний трипсин в межах концентрацій 0,1-30 од.акт.БАЕЕ/мл. чи потенціометричний хемосенсор на основі полііончутливи х електродів, що визначає активність трипсин-подібних протеїназ за гідролізом субстрату протаміну (Dai S., Esson J.M., Lutze О., Ramamurthy Ж, Yang V.C ., Meyerhoff ME. Bioanalytical applications of polyion-sensitive electrodes // Journal of Pharmaceutical and Biomedical Analysis.-1999.-19, P. 1-14). Але, на сьогоднішній день авторам не відомі конструкції біосенсорів, які дозволяють специфічно визначати активність протеїназ в суміші (зокрема трипсину та хімотрипсину). В основу пропонованої корисної моделі поставлено задачу створення потенціометричного мультифункціонального біосенсора для послідовного специфічного визначення активностей розчинених трипсину та хімотрипсину в суміші за швидкістю гідролізу декількох високоспецифічних субстратів, а саме, визначення трипсину за гідролізом N a -бензоїл-L-apгінін етилового ефіру (БАЕЕ) та хімотрипсину за гідролізом N a -бензоїлL-тирозин етилового ефіру (БТЕЕ). Поставлена задача вирішується пропонованим потенціометричним мульти-функціональним біосенсором для послідовного специфічного визначення активностей розчинених трипсину та хімотрипсину в суміші за швидкістю гідролізу специфічних субстратів, що містить два рН-чутливи х польових транзистора (рН-ПТ), об'єднаних на одному чіпі з можливістю роботи у режимі диференційної пари. На один з рН-ПТ нанесена робоча мембрана, специфічна до субстрату трипсину, на другий - робоча мембрана, специфічна до субстрату хімотрипсину. Робоча мембрана одного з рН-чутливих транзисторів встановлена з можливістю функціонування у якості референтної або робочої мембрани відносно мембрани другого рН-ПТ, а біосенсор призначений для підключення до потенціометричної установки. У пропонованому пристрої у якості чутли вих (активних) мембран біосенсору використаний іммобілізований комплекс протеїназ (трипсин або хімотрипсин) з a 2-макроглобуліном ( a 2- М). a 2- М за своїми властивостями є унікальним інгібітором для всіх серинових протеїназ - при зв'язуванні протеїназ він залишає вільним їх активний центр, але екранує доступ до нього (до активного центру) високомолекулярних білкових молекул. Таким чином, зв'язані в комплекс з a 2 - макроглобуліном ферменти зберігають активність тільки по відношенню до дрібних молекул штучних субстратів (таких, як БАЕЕ та БТЕЕ) і не взаємодіють з іншими білковими інгібіторами та субстратами, антитілами і ферментами (Roberts R.C. Alpha-2-Macroglobulin // J.Med.-1985.-16,Nl-2-3.-P129-219). a 2-M також захищає робочий фермент мембрани від пошкодження внаслідок гідролізу протеїназами розчину, що аналізується (Biloivan O.A., Dzyade vich S.V., Boubriak O.A., Soldatkin A.P., El'skaya A.V. De velopment of Enzyme Biosensor Based on ISFETs for Quantitative Analysis of Serine Proteinases // Electroanalysis 2004, 16, №22,1883 1888). Для фіксації на поверхні перетворювача комплексів фермент-аг-макроглобулін застосовували метод іммобілізації у насичених випарах глутарового альдегіду (Biloivan О.А., D zyadevich S.V., Boubriak O.A., Soldatkin A.P., El'skaya A.V. Development of Enzyme Biosensor Based on ISFETs for Quantitative Analysis of Serine Proteinases // Electroanalysis 2004,16, №22, 1883-1888). Суть корисної моделі пояснюється схематичними кресленнями, де: на фіг. 1 показано конструкцію пропонованого потенціометричного мультифункціонального біосенсора для послідовного специфічного визначення активностей розчинених трипсину та хімотрипсину в суміші за швидкістю гідролізу специфічних субстратів; на фіг. 2 показано схему експериментальної установки на базі рН-чутливи х польових транзисторів; на фіг. 3 представлені типовий відгук біосенсора та принципова схема проведення аналізу активності протеїназ; на фіг. 4 представлені графіки залежностей відгуку створеного мультифункціонального біосенсору від концентрацій субстратів БАЕЕ та БТЕЕ; на фіг. 5 представлені калібрувальні криві для визначення концентрації трипсину та хімотрипсину за участю розробленого мультифункціонального біосенсора, отримані в 10 мМ фосфатному буфері при рН 7,6 та 25°С. 1 для трипсину, 2 - для хімотрипсину. Будова потенціометричного мультифункціонального біосенсора та потенціометричної установки, до якої він підключений. Пропонований потенціометричний мультифункцюнальний біосенсор для послідовного специфічного визначення активностей розчинених трипсину та хімотрипсину в суміші за швидкістю гідролізу специфічних субстратів (фіг. 1) містить два рН-чутливи х польових транзистора 1 і 2, об'єднаних на одному чіпі на кремнієвій підложці 3 і встановлених з можливістю роботи у режимі диференційної пари. На рН-чутливий польовий транзистор 1 нанесена робоча мембрана, призначена для визначення концентрації специфічного субстрату трипсину, на рН-ПТ 2 - нанесена робоча мембрана, призначена для визначення концентрації специфічного субстрату хімотрипсину, і, в залежності від складу субстрату, який призначений для застосовування в аналізі, кожна з мембран біосенсора функціонує чи як активна, чи як референтна. Пропонований пристрій забезпечений струмопровідними елементами, які з'єднані з відповідними струмопровідними шинами 4, призначеними для підключення пристрою до експериментальної установки. Пристрій забезпечений епоксидним покриттям 5 струмопровідних елементів. Пропонований потенціометричний мультифункціональний біосенсор для послідовного специфічного визначення активностей розчинених трипсину та хімотрипсину в суміші працює у складі експериментальної установки (фіг. 2), створеної на базі рН-чутливи х польових транзисторів. Експериментальна установка складається з джерела живлення 6 /ДЖ/ (марки Б5-45), до якого підключені два рН-ПТ (на одному чипі) за допомогою спеціального тримача. Експериментальна установка має комірку 7 для досліджуваного розчину. У порожнину комірки 7, заповнену відповідним буфером, занурені чутливі мембрани, нанесеш на рН-чутливі польові транзистори 1 і 2, що підключені до вольтметрів 8 /В/. Вольтметри 8 призначені для контролю величини потенціалу на затворах кожного з польових транзисторів 1 і 2. Польові транзистори 1 і 2 підключені також до відповідних входів вимірювального приладу - 9 /С/ (самописця марки ENDIM 622.01). Експериментальна установка забезпечена магазинами опорів 10 (марки Р 33), встановленими для регуляції напруги на каналах рНПТ з метою попереднього калібрування установки. t Формування ферментних мембран на поверхні перетворювачів здійснювали наступним чином: Приготування вихідних сумішей для ферментних мембран: наважку 2,5мг a 2 М розчиняли в 25 мкл 50мМ фосфа тного буфера (рН 7,6) - розчин 1; 1,4 мг трипсину або 1,5 мг a -хімотрипсину розчиняли в 50 мкл 0,0025н НСl (розведений розчин кислоти застосовували щоб запобігти автолізу ферменту)- розчин 2; 5мкл розчину 2 додавали до 25 мкл розчину 1 та інкубували суміш впродовж 25 хвилин при 25°С. Перед проведенням іммобілізації до суміші додавали 10% гліцерину. Іммобілізація: Ферментні мембрани формували на підзатворних ділянках рН-чутливи х польових транзисторів 1 і 2 крапельним методом. Біосенсор з нанесеними розчинами переносили до ексикатора з атмосферою насичених парів глутарового альдегіду (ГА) на 40 хвилин. Після інкубації в парах ГА мембрани ретельно висушували на повітрі. Готові мембрани відмивали тричі 50 мМ фосфатним буфером (рН 7,6) від залишків ГА. З метою зв'язання a 2 М та трипсину (хімотрипсину) в мембрані, що знаходяться поза комплексом трипсин (хімотрипсин)- a 2 М датчик інкубували в розчині трипсину (хімотрипсину) (0,5 мг/мл) протягом 15 хв. при 25°С, відмивали знов 50 мМ фосфатним буфером (рН 7,6), інкубували у розчині соєвого інгібітору трипсину та хімотрипсину (0,5 мг/мл) протягом 15 хв. при 25°С та відмивали буфером. Принцип проведення вимірювань за допомогою рН-чутливих польових транзисторів. В основі визначення - реакція ферментативного гідролізу штучного субстрату Na-бензоїл-Ь-аргінін етилового ефіру гідрохлориду (БАЕЕ), що відповідає рівнянню реакції: Трипсин БАЕЕ + Н 2О ¾¾¾¾ ® Na - Бензоїл- L - Аргинин + Етанол + Н+ ¾ Або реакція гідролізу N a -бензоїл-L-тирозин етиловий ефіру (БТЕЕ): Хімотрипси н БАЕЕ + Н2 О ¾¾ ¾¾¾¾® Na - Бензиїл- L - Тирозин + Етанол + Н+ Протон, що утворюється внаслідок цієї реакції може бути зареєстрований за допомогою рН-чутливого польового транзистору, якщо ця реакція проходить на його поверхні в шарі іммобілізованого ензиму. Створений таким чином біосенсор може бути відкалібровано для визначення концентрації субстратів БАЕЕ та БТЕЕ. Але його можна застосувати і для непрямого визначення активності протеїназ, за схемою, яка показана на Фіг. 3. Пропонований потенціометричний мультифункціональний біосенсор для послідовного специфічного визначення активностей розчинених трипсину та хімотрипсину в суміші працює так: Перед початком вимірювань рН-чутливі польові транзистори 1 і 2 з нанесеними мембранами тричі промивали у 10 мМ-ному фосфатному буфері (рН 7,5) і залишали зануреними у буфер на протязі 0,5-1,0 годин. Після виконання названих дій пропонований пристрій струмопровідними шинами 4 підключали до установки. Вимірювання здійснювали у відкритій скляній комірці 7 об'ємом Імл, що була заповнена буфером (10 мМ фосфа тний буфер, рН 7,6). Напругу на двох рН-ПТ вирівнювали за допомогою магазинів опорів 10, значення напруги контролювали за показниками вольтметрів 8. Для біосенсора, вміщеного у вимірювальну комірку 7, визначали базову лінію, після чого вносили аліквоту розчину субстрату. Після отримання стаціонарного відгуку біосенсора на певну концентрацію субстрату додавали тестований розчин. Зміну величини сигналу біосенсора в часі реєстрували автоматично за допомогою приладу 9 (самописця). Неспецифічні зміни вихідного сигналу, що пов'язані з коливаннями температури, рН середовища, електричними наводками компенсувалися, завдяки застосуванню диференційного режиму вимірювань. Всі виміри проводили в термостатованій комірці при температурі +25°С та інтенсивному перемішуванні. Типовий відгук біосенсора та принципова схема проведення аналізу активності протеїназ представлені на Фіг. 3. Визначення активності проводили в два етапи: після отримання стаціонарного відгуку біосенсора на певну концентрацію субстрату (dUs) додавали тестований розчин з вмістом протеїнази, що індукувало гідроліз субстрату в загальному об'ємі проби (який не реєструється у ди ференційному режимі вимірювань за допомогою рН-чутливи х ПТ). Це спричиняє поступове, залежне від часу зменшення концентрації субстрату і відповідно зміну величини відгуку сенсора, що може бути зареєстровано. Реєстрована швидкість зміни потенціалу - (dUs- dUi)/dt (далі позначається як - dU/dt) вживалась як міра активності протеїназ у тестованому розчині. Приклад визначення концентрацій трипсину та хііиотрипсину за допомогою запропонованого мультиферментного потенціометричного біосенсору На фіг. 4 представлені графіки залежностей відгуку створеного мультифункціонального біосенсору від концентрацій субстратів БАЕЕ (4.1) та БТЕЕ (4.2), отримані у 10 мМ фосфа тному буфері при рН 7,6 та 25°С. Лінійні ділянки отриманих кривих встановлені для концентрацій 0,1-0,75 мМ для БАЕЕ та 0,1- 1,0 для БТЕЕ. За оптимальну вихідн у концентрації субстратів (ту, якій відповідає максимальна величина відгуку на лінійній ділянці калібрувальної кривої біосенсора) для проведення аналізу протеїназ за допомогою мультифункціонального біосенсора встановлені -0,75мМ (для БАЕЕ та для БТЕЕ). На фіг. 5 наведені калібрувальні криві для визначення концентрації трипсину та хімотрипсину за участю розробленого мультифункціонального біосенеору, отримані в 10 мМ фосфа тному буфері при рН 7,6 та 25°С. Показана принципова можливість визначення концентрації ферментів в межах 0,1-10 мкг/мл. Таким чином, пропонований пристрій дозволяє послідовно визначати активності розчинених трипсину та хімотрипсину в суміші за гідролізом декількох високоспецифічних субстратів, а саме, визначити трипсин за гідролізом БАЕЕ та хімотрипсин за гідролізом БТЕЕ.
ДивитисяДодаткова інформація
Назва патенту англійськоюPotentiometric multifunction biological detector for sequentially determining the activity of trypsin and chymotrypsin in solution by the speed of hydrolysis of chemical compounds
Назва патенту російськоюПотенциометрический многофункциональный биологический датчик для последовательного определения активности трипсина и химотрипсина в растворе по скорости гидролиза специфических химических соединений
МПК / Мітки
МПК: G01N 33/02
Мітки: трипсину, гідролізу, активностей, визначення, хімотрипсину, мультифункціональний, субстратів, специфічного, біосенсор, суміші, потенціометричний, розчинених, послідовного, швидкістю, специфічних
Код посилання
<a href="https://ua.patents.su/5-23469-potenciometrichnijj-multifunkcionalnijj-biosensor-dlya-poslidovnogo-specifichnogo-viznachennya-aktivnostejj-rozchinenikh-tripsinu-ta-khimotripsinu-v-sumishi-za-shvidkistyu-gidroliz.html" target="_blank" rel="follow" title="База патентів України">Потенціометричний мультифункціональний біосенсор для послідовного специфічного визначення активностей розчинених трипсину та хімотрипсину в суміші за швидкістю гідролізу специфічних субстратів</a>
Попередній патент: Датчик вигину каната
Наступний патент: Спосіб попереднього вапнування дифузійного соку
Випадковий патент: Відстійник