Сполука n-феніл-3-(3′-етилфеніл-1′-аміно)-сукцинімід з потенційними фізіологічними властивостями
Номер патенту: 25641
Опубліковано: 10.08.2007
Формула / Реферат
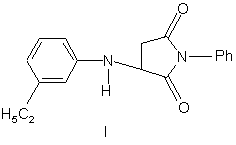
Сполука N-феніл-3-(3'-етилфеніл-1'-аміно)-сукцинімід з потенційними фізіологічними властивостями загальної формули:
 .
.
Текст
Сполука N-феніл-3-(3'-етилфеніл-1'-аміно)сукцинімід з потенційними фізіологічними властивостями загальної формули: 2 3 25641 Реакцією сульфалену з малеїнімідом в ацетоні в умовах фотолізу за допомогою L-ртутної лампи Схема 2. 4 типу Hanovia 450-W синтезовано тетрагідротієноциклобутапіроледіон-2,2-діоксид (схема 2), [1]: O O O O S NH + O h, ацетон O S NH O O який вступає в реакції заміщення по атому водню при гетероатомі азоту (схема 3): Схема 3. O O O O NH + H N S N R O Br(CH2) 4Br O S N (CH 2) 4 N O O N R N-вмісні гетероциклічні сполуки менше нуклеофільні, у порівнянні з аліфатичними та ароматичними амінами, але їх нуклеофільність достатня для здійснення реакції Мі хаеля [4 ]. При взаємодії малеїнімідів із заміщеним бензолом в присутності сірчаної кислоти або сірчаної та фосфорної кислот можливе отримання Nарилмалеїнімідів із збереженням або розкриттям циклу малеїніміду (схема 4), [5]: Схема 4. R2 O R1 N O O R2 R3 R5 R4 R1 NH OR або R3 R4 R5 O R1 - R 5 = H, Hal, NO2, OH, COOH, Ph, SO3H Термічна циклізація N-арилмалеїнімідів з фенолами призводить до утворення біциклічних продуктів наступного тип у, які можуть виділятися як екзо- і ендоциклоадукти або утворювати полімери, наприклад, при УФ-опроміненні (схема 5), [6]: Схема 5. O R N Ar O R = OPh, орто - HOC6H4-, пара - CH3C 6H 4OФрагмент гомо полімеру, який утворюється при цьому, може мати наступний вигляд (схема 6): Схема 6. Ar O N O n Раніше автором були отримані нові гетероциклічні похідні малеїнімідів шляхом нуклеофільного приєднання по подвійному зв'язку [7, 8]. Вважається, що малеїніміди взаємодіють з ароматичними амінами через утворення проміжних донорноакцепторних комплексів, з утворенням похідних аріламіносукцинімідів, як описано в літературі [9]. Даний метод синтезу нових похідних малеїнімідів перенесено на заміщені ароматичні аміни. Структурні аналоги сполуки N-феніл-3-(3'етилфеніл-1'-аміно)-сукцинімід з потенційними фізіологічними властивостями в літературі описано. Сполука (І) синтезована з метою отримання нового поліфункціонального гетероциклічного синтону для подальшого вивчення її фізико-хімічних та біологічних властивостей, а також вивчення можливості проходження хімічних реакцій між ароматичними амінами та заміщеними малеїнімідами. В основу корисної моделі поставлено хімічну будову молекули сполуки N-феніл-3-(3'-етилфеніл1'-аміно)-сукцинімід (далі, сполука І) з потенційними фізіологічними властивостями шляхом взаємодії N-фенілмалеїніміду та мета-етиланіліном у молярному співвідношенні 1:1,05. Реакції проводи лися в ізопропіло вому спир ті при температурі 80-90°С та перемішуванні реакційної суміші 21 годину з метою забезпечення отримання сполуки (І) з потенційними фізіологічними властивостями (схема 7): 5 25641 6 Схема 7. O NH2 + N O i - PrOH, t Ph O H5C 2 NH2 N Ph O H 5C 2 p - комплекс O + NH2 N O + NH 2 Ph O H 5C 2 H 5C2 N Ph O s - комп лекс O N N Ph H H 5C 2 O I N-феніл-3-(3'-етиленфеніл-1'-аміно)-сукцинімід Можна запропонувати схему утворення проміжних донорно-акцепторних комплексів, які перетворюються на кінцевий продукт - сполуку Nфеніл-3-(3'-етиленфеніл-1'-аміно)-сукцинімід, аналогічно до того, як описано в літературі [9]. Варіювання умов проведення реакцій та внесення змін до методики синтезу, а саме: обробка кінцевого продукту сумішшю безводних розчинників гексан - діетиловий ефір (1:1), кристалізація із ізопропілового спирту та промивання залишку осаду під час фільтрування в вакуумі сухим гексаном дозволили збільшити практичний вихід сполуки (І) до 50%. УФ-спектр сполуки (І) характеризується загальним показником - наявністю l max в широкому інтервалі від 211 до 240нм у зв'язку із спряженням фрагменту молекули заміщеного ароматичного ядра з додатковими хромофорами - Nфенілзаміщеним циклом малеїніміду, з групами С=О та вторинною аміногрупою. В ІЧ-спектрі сполуки (І) смуги d NH спостерігаються в області 1450,1490см-1. Валентні коливання груп С=О проявляються високоінтенсивним ма ксимумом в області 1700,1710см-1 та є найбільш характеристичними, оскільки інші сигнали в цій області практично відсутні. Крім того, в низькочастотній області спектру легко визначити в результаті високої інтенсивності смуги зв'язків С-Н (Ph) при 620-900см -1. Сигнал групи -С2Н5 проявляється в області 2926см-1. В ПМР-спектрі сполуки (І) спостерігаються сигнали у вигляді триплету при 1.23м.д. та у ви гляді синглетів при 2.45м.д. і 3.26 м.д. трьох протонів групи –СН3 та дво х протонів групи -СН2 (у складі С2Н5) відповідно, а також характерна спін-спінова взаємодія протонів групи –СН3 через три зв'язки (J3Н,Н=7.2Гц) та через два зв'язки (J2Н,Н=3.6Гц). Спостерігається сигнал у вигляді квартету при 4.485м.д. протону -HCN (спін-спінова взаємодія протону групи з сусідніми протонами через три зв'язки J3Н,Н=0.8Гц) та у вигляді дублету при 4.83м.д. протону групи -NH (спін-спінова взаємо дія протону групи з сусідніми протонами через три зв'язки J3Н,Н=5.2Гц). Сигнали двомалеїнового кільця –СОСН2 ідентифікуються в області 6.05м.д. та 7.08м.д. у вигляді мультиплету, сигнали дев'яти протонів двох феніл радикалів ідентифікуються в області 6.42-6.68м.д. та 7.27-7.63м.д. у ви гляді мультиплетів. Таким чином, можна зробити висновок, що сполука (І) з потенційними фізіологічними властивостями може бути перспективною у розробці нових лікарських засобів з протисудомною активністю, з анксіолітичним типом дії; що впливають на постсинаптичні рецептори, психотропних агентів та з іншими типами дії. Методика синтезу сполуки N-феніл-3-(3'етиленфеніл-1'-аміно)-сукцинімід (І). До розчину 1.38г N-фенілмалеїніміду (0,008моль) в 40мл ізопропілового спирту додають по краплях 1.03г (1.056мл, 0,0085моль) метаетиланіліну при кімнатній температурі, перемішують реакційну суміш 21 годин у при температурі 80-90°С. Маслоподібний продукт, що отримують після упарювання розчинника, заливають сумішшю безводних розчинників гексан - діетиловий ефір (1:1). Залишок - осад темно-жовтого забарвлення кристалізують з ізопропілового спирту, о холоджують при кімнатній температурі, промивають залишок під час фільтрування в вакуумі сухим гексаном, сушать на повітрі. Практичний вихід 1,27г (50%). Т. топл. 111114°С. Індивідуальність сполуки (І) контролювали методом тонкошарової хроматографії, склад підтверджено даними елементного аналізу. УФ-спектр сполуки (І) записували на спектрофотометрі Mel Temp II (USA). ІЧ-спектр записували на спектрофотометрі UR20 (виробник "Charles Ceise Hena", Germany). Спектри ПМР сполуки (І) записували на прилада х "Bruker WP-200 " (виробник "Bruker", Switzerland), "Varian T-60" (виробник "Varian", USA) з робочою частотою 200-132МГц у виді розчинів ДМСО-D6 (вн утрішні стандарти ТМС та Г МДС). 7 25641 ТШХ виконували на пластинах Silufol-254. ГРХ визначали на газорідинному хроматографі "Perkin Еlmer"з УФ-детектором (виробник "Perkin", Germany). Хроматограма, УФ-, ІЧ-, ПМРспектри сполуки (І) ідентифікували у порівнянні з хроматограмами, УФ-, ІЧ-, ПМР-спектрами вихідних сполук. Синтезована сполука (І) - це кристалічний порошок жовтого забарвлення, ізолюється з кристалізацією із ізопропілового спирту, з метою очистки промивається сухим гексаном. Дані елементного аналізу на С, Н, N сполуки (І) відповідають розрахованим значенням. В УФ-спектрі сполуки (І) ідентифіковано значення l max , положення яких коливаються в широкому інтервалі від 211 до 240нм у зв'язку із спряженням фрагменту молекули заміщеного ароматичного ядра з додатковими хромофорами N-феніл-заміщеним циклом малеїніміду, з групами С=О та вторинною аміногрупою (Фіг.1). В ІЧ-спектрі сполуки (І) смуги d NH спостерігаються в області 1450, 1490см -1. Валентні коливання груп С=О проявляються високоінтенсивним ма ксимумом в області 1700, 1710см -1 та є найбільш характеристичними, оскільки інші сигнали в цій області практично відсутні. Крім того, в низькочастотній області спектру легко визначити в резуль 8 таті високої інтенсивності смуги зв'язків С-Н (Ph) при 620-900см - 1 . Сигнал групи -С2Н5 проявляється в області 2926см -1. Співвідношення інтегральних інтенсивностей сигналів в ПМР-спектрі сполуки (І) підтверджує наявність трьох протонів групи –СН3 та двох протонів групи –СН2 (у складі -С2Н5) у ви гляді триплету при 1.23м.д. та у вигляді синглетів при 2.45м.д. і 3.26м.д. відповідно, а також характерна спінспінова взаємодія протонів групи –СН3 через три зв'язки (J3Н,Н=7.2Гц) та через два зв'язки (J2Н,Н=3.6Гц). Спостерігається сигнал у вигляді квартету при 4.485м.д. протону групи -HCN (спін-спінова взаємодія протону гр упи з сусі дніми протонами через три зв'язки J3Н,Н=0.8Гц) та у вигляді дублету при 4.83м.д. протону групи - NH (спін-спінова взаємодія протону групи з сусідніми протонами через три зв'язки J3Н,Н=5.2Гц). Сигнали двомалеїнового кільця –СОСН 2 ідентифікуються в області 6.05м.д. та 7.08м.д. у вигляді мультиплету, сигнали дев'я ти протонів дво х феніл радикалів ідентифік уються в області 6.42-6.68м.д. та 7.27-7.63м.д. у вигляді мультиплетів (Фіг.2). Віднесення сигналів в УФ-, ІЧ-, П МР-спектрах, дані елементного аналізу сполуки (І) наведено у таблиці. Таблиця 1 Віднесення сигналів в УФ-, ІЧ-, ПМР- спектрах, дані елементного аналізу сполуки (1) Знайдено, у% СНN Бруттоформула 72.88;6.02;10.4 C18H18N2O2 Обчислено, УФ-спектр ІЧ-спектр (КВr), Спектр ПМР у% (ДМСО-D6), см -1 g l max ЕtOН, СН N нм ¶ , м.д. (J, Гц) 73.4; 6.11; 9.51 211, 231, 235 , 240 620-900(С1.23 (T ., J3Н,Н, 7.2Гц, H,Ph),1450, 1490 J2Н,Н 3.6Гц,СН3,3Н); (>N-Н),1700, 2.45,3.26(с.,с.,СН2,2Н); 1710(С=О), 4.485(кв., J3Н,Н 0.8Гц, 2926 (С2Н5) HCN,1H); 4.83(д., J 3Н,Н 5.2Гц, NH,1H);6.05,7.08 (М., COCH 2,2H);6.426.68(м., Рh, 4H);7.277.63 (м.,Рh, 5Н) Таким чином, можна зробити висновок, що сполука (І) з потенційними фізіологічними властивостями може бути перспективною у розробці нових лікарських засобів з протисудомною активністю, з анксіолітичним типом дії; що впливають на постсинаптичні рецептори, психотропних агентів та з іншими типами дії. Завданням корисної моделі є опис хімічної будови нової сполуки N-феніл-3-(3'-етиленфеніл-1'аміно)-сукцинімід (сполука (І)) з потенційними фізіологічними властивостями та високою реакційною здатністю, які можуть проявлятися за рахунок наявності в будові молекули спряженої системи між ароматичним ядром та фрагментом молекули циклічного іміду. Література: 1. Magid Abou - Gharbia, Usha R. Patel and all. //J. Med. Chem.- 1988. - Vol.31, №7. - P.1382-1385. 2. Richards M.N. (Merrel D., Res. Inst. 67084, Strasbourg, Fr.) //J. Pharmacol. Exp. Ther. -1990. 255(1). - P.83-89. 3. Amagat P. //Traite de Chemie Organique. 1941. - Vol.13. - P.502-521. 4. Лулукян К. К., Агбалян С. Г. //Армянский химический журнал. - 1987. -т.40, №5. -С.296-312. 5. Sasakihara H., Akatsuka A. And all. Jpn. Kokai Tokkyo Koho IP 04,290,868 [92,290,868] (C1.C07D207/448), 15 Oct. 1992. //Chem. Abstr. 1993. - Vol.118. 147457t. 6. Derek Bryce - Smith, Andrew Gilbert, Ian S. McColl and (in part) Michael G.B. Drew, Paul Yianni //J. Chem. Soc. Perkin Trans. - 1987. - Vol.1. P.1147-1151. 7. Вельчинская Е.В., Кузьменко И.Й., Кулик Л.С. Синтез новых производных замещенных урацилов и пиримидинов. //Химико-фарма 9 25641 цевтический журнал. Рос. Федерация. -1999.- №3.С.40-42. 8. Вельчинська О.В., Кузьменко І.Й., Драпайло А.Б. Синтез нових похідних заміщених малеїнімідів як потенційних фізіологічно активних агентів. Тези. Комп’ютерна в ерстка Л.Литв иненко 10 доп. XVIІІ-ої Укр.конф.з орг.хімії. 1998. Дніпропетровськ, с.369. 9. М. Farcaslu, R. Istratolu, Rev. Roum. Chim., Vol.15, №12, 253 (1970). Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCompound of n-phenyl-3-(3'-ethylphenyl-1'-amino)-succinimide with potential physiological properties
Автори англійськоюVelchynska Olena Vasylivna
Назва патенту російськоюСоединение n-фенил-3-(3'-этилфенил-1'-амино)-сукцинимид с потенциальными физиологическими свойствами
Автори російськоюВельчинская Елена Васильевна
МПК / Мітки
МПК: C07C 21/00, C07D 239/553, A61K 33/16
Мітки: сполука, властивостями, n-феніл-3-(3'-етилфеніл-1'-аміно)-сукцинімід, потенційними, фізіологічними
Код посилання
<a href="https://ua.patents.su/5-25641-spoluka-n-fenil-3-3-etilfenil-1-amino-sukcinimid-z-potencijjnimi-fiziologichnimi-vlastivostyami.html" target="_blank" rel="follow" title="База патентів України">Сполука n-феніл-3-(3′-етилфеніл-1′-аміно)-сукцинімід з потенційними фізіологічними властивостями</a>
Попередній патент: Спосіб діагностики вертебро-базилярної недостатності при інсульті стовбура мозку
Наступний патент: Спосіб отримання сполуки з потенційними фізіологічними властивостями 2-діетиламіно-4-метил-6-(2′-бром-1′,1′-дифтор-2′-хлоретокси)-піримідин
Випадковий патент: Роздавальний пристрій для видачі листових виробів, зокрема серветок









