Спосіб одержання комплексної сполуки платини /іі/з н-днк, що має протипухлинну активність
Номер патенту: 3801
Опубліковано: 27.12.1994
Автори: Майданевич Надія Миколаївна, Бударін Лев Іванович, Кейсевич Людвіг Владіславович, Волченскова Іліма Іліодорівна, Трохименко Олена Петрівна, Шалімов Сергій Олександрович
Формула / Реферат
Способ получения комплексного соединения платины (II) с н-ДНК, обладающего противоопухолевой активностью, взаимодействием цис-дихлордиаминплатины с дезоксирибонуклеиновой кислотой, выделенной из селезенки крупного рогатого скота, марки А, при нагревании до 78,0±0,5°С в водной среде, отличающийся тем, что процесс проводят в присутствии хлористого натрия и цитрата натрия при мольном соотношении цис-дихлордиаминплатины, фосфора, н-ДНК, хлористого натрия и цитрата натрия 6:4:30:3 в течение 15-20 минут.
Текст
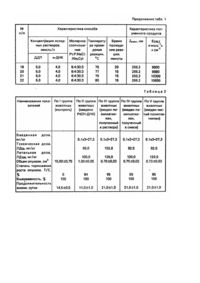
Изобретение относится к способу получения нового комплексного соединения платины, обладающего противоопухолевой активностью. Известно соединение цис-дихлордиаминплатина (П) [1] формулы: цис-РtСІ2(NН3)2 (сокращено ДДП), обладающее высокой противоопухолевой активностью, однако характеризующееся очень высокой почечной токсичностью, что снижает его эффективность. Известен также циклобутан -1,1-дикар-боксиаминплатина (П), соединение платины (П), с 1,2диаминциклогексаном. содержащие анионы малоновой кислоты и ее производных, 4-карбоксифталат, а также другие аналоги ДДП [2-5], которые обладают противоопухолевой активностью и менее токсичны, чем ДДП. Однако эти препараты по уровню противоопухолевого действия уступают ДДП. Из известных аналогов по эффективности действия, определяемой уровнем противоопухолевой активности и токсичности наиболее близко к заявляемому ве ществу соединение поли{бис{гидроксохлораминаквап-латина (П)-тетракис[хлораминдиакваплатина (П)} m -дезоксирибонуклеат [6], формулы: {[Pt(OH)CINH 3)(H2О)] 2[PtCI(NH 3)(H2 О)2] 4}n- m -ДНК (сокращенно PtOH-ДНК), где n = 2000±100, а m -ДНКмостиковый полианион дезоксирибонуклеиновой кислоты формулы; (C39H51О 32 N15P 4-)n 4n-. Это соединение тормозит рост опухоли на 94% и характеризуется токсической дозой ЛД50 = 66.0 мг/кг, что в определенных случаях может быть недостаточным. Получают его из гидролизованной ДДП и дезоксирибонуклеиновой высокомолекулярной кислоты селезенки крупного рогатого скота, марки А, (н-ДНК) по следующей методике: предварительно нагретые до температуры плавления н-ДНК водные растворы н-ДНК и гидролизованной до заданной степени превращения цис-дихлордиаминплатины (П) смешивают в молярном соотношении Pt:P = 1,5:1 и термостатируют реакционную смесь при той же температуре до окончания реакции. Препарат РtOН-ДНК получают в растворе и как индивидуальное вещество в твердом виде. В основу изобретения положена задача синтеза вещества, обладающего более высокой противоопухолевой активностью и меньшей токсичностью, способного в высокой степени тормозить рост опухоли и увеличивать срок жизни онкологических больных, путем введения в реакционную смесь специальных добавок. Решение задачи заключается в способе получения комплексного соединения платины (II) с н-ДНК, обладающего противоопухолевой активностью, взаимодействием цис-дихлордиаминплатины с дезоксирибонуклеиновой кислотой выделенной из селезенки крупного рогатого скота, марки А, при нагревании до 78,0±0,5°С в водной среде, в котором согласно изобретения, процесс проводят в присутствии хлористого натрия и цитрата натрия при мольном соотношении цис-дихлордиаминплатины, фосфора, н-ДНК, хлористого натрия и цитрата натрия 6:4:30:3 в течение 15-20 минут. Способ получения нового вещества заключается в том, что предварительно нагретые до температуры плавления н-ДНКводные цитратно-солевые растворы цис-дихлордиаминплатины и н-ДНК смешивают в молярном соотношении Pt:P:NaCI:Na3Cyt = 6:4;30:3 и термостатируют при этой температуре до окончания реакции. Нативную ДНК растворяют в цитратно-солевом растворе (15 ммоль) и NaCI, 1,5 ммоль/л Na3Cytnpn комнатной температуре и нагревают о термостате до Тпл. Цис-дихлордиаминплатину (П) растворяют в таком же цитратно-солевом растворе, предварительно нагретом до температуры н-ДНК. Окончание взаимодействия ДДП и н-ДНК контролируют спектрофотометрически по достижению параметров УФ-спектра поглощения l макс = 266,2 ±0,1 НМ И Е266.2 = 10000±100 лмоль-1 см -1. Заявляемое вещество получают в водном растворе и Q твердом виде как индивидуальное вещество ИЛЕ как смесь с NaCI + Na 3CyT • 5,5 Н2О. Ниже приводятся примеры конкретного выполнения реакции Пример 1. Высокомолекулярную н-ДНК с температурой плавления 78,0±0,5°С в количестве 0,500 г растворяют при комнатной температуре в 0,375л водного раствора, содержащего 15 ммоль/л NaCI + +1,5 ммоль/л Na3Cyt (в дальнейшем такой раствор будет называться цитратно-солевым) и нагревают раствор в термостате до 78,0±0,5°С со скоростью 1°С в минуту. Препарат ДДП в количестве 0,675 г растворяют в 0,375 л цитратно-солевого раствора, предварительно нагретого в термостате до 78,0±0,5°С. Приготовленные растворы н-ДНК и ДДП смешивают при 78,0±0,5°С, тщательно перемешивают и термостатируют при 78,0±0,5°С еще в течение 15 минут. Пример 2. Опыт проводят, как в примере 1, только реакционную смесь подвергают лиофильной сушке по методике изготовления сухой плазмы крови. Раствор полиплатиллена, полученный по реакции при постоянном вращении, охлаждают до минус 40°С в течение 40 минут, выдерживают при этой температуре 12 часов, а затем температуру повышают до минус 20°С, образец откачивают в течение 40 часов, нагревают до плюс 40°С и снова откачивают 26 часов. Полученный после лиофильной сушки лиофилизат представляет собой сложное вещество, состоящее из полиплатиллена, NaCI и Na3Cyt . 5,5 Н 2О в мольном соотношении Pt:P:NaCI:Na 3Cyt = 6:4:30:3. Пример 3. Опыт проводят, как в примере 2, только из полученного после лиофильной сушки сложного вещества (лиофилизата) удаляют NaCI и Na3Cyt . 5,5 Н2О. Для этого к 0,250 г лиофилизата добавляют 50 мл дистиллированной воды и тщательно перемешивают. Полученную взвесь центрифугир уют при комнатной температуре со скоростью 7000 об/мин в течение 15 минут на центрифуге ОПн-8. Осадок отделяют от надосадочного раствора декантацией, промывают водой, спиртом, эфиром и сушат на воздухе. С ухое вещество хранят при комнатной температуре в закрытой стеклянной посуде. Выход чистого полиплатиллена составляем 60% от теоретического. Для экспериментальной проверки заявляемого способа получения полиплатиллена было проведено еще 22 опыта. 10 из которых показали положительные результаты. В положительных опытах получен продукт, УФспектры которого имеют параметры, характерные для заявляемого соединения. Результаты опытов сведены в таблице 1, где приведены характеристики полученных продуктов в зависимости от способа их получения. Способы получения охарактеризованы следующими параметрами: выбором концентрации исходных растворов ДДП и н-ДНК. молярным соотношением Pt:P:NaCI:Na 3Cyt . 5.5 Н2О, временем и температурой проведения реакции. Из таблицы 1 следует, что выбор исходных концентраций ДДП и н-ДНК в пределах ошибки опыта не влияет на характеристики полученного продукта (опыты №№ 1-6). Максимальная концентрация ДДП ограничена ее растворимостью, составляющей 0,2523%. Минимальная концентрация ДДП ограничена минимально возможной для хорошей спектрофотометрической регистрации концентраций н-ДНК, составляющей 3 мг/л. Опыты №№ 7-12 показали, что отклонение от соотношения Pt:P:NaCI:Na3Cyt в сторону избытка одного из компонентов не позволяет получить целевое соединение полипла-тиллен с вышеуказанными параметрами УФ-спектра. Результаты опытов №№ 13-16 указывают, что взаимодействие реагентов по реакции протекает быстро и заканчивается за время, не превышающее 5 минут. Увеличение времени термостатирования реакционной смеси до 30 минут не влияет на параметры продукта реакции. Результаты опытов №№ 17-22 говорят о существенном влиянии температуры проведения реакции на такой параметр продукта реакции как Е266.2. Из зависимости Е266.2 от температуры видно, что для получения заявляемого соединения полиплатиллена термостатирование реакционной смеси надо' вести при 78.0±0,5°С. За пределами указанного температурного интервала нельзя получить продукт с необходимыми параметрами УФспектра. Приведенные выше данные позволяют заключить, что смешением предварительно 5 нагретых до температуры плавления н-ДНК и цис-дихлордиаминплатины (П) в молярном соотношении Pt:P:NaCI:Na 3Cyt . 6:4:30:3 с последующим термостатированием при этой температуре в течение времени, необходимом для окончания реакции, позволяет получить соединение, характеризуемое формулой {[PtCI(NH 3)(H2О)2 ]6} n- m -ДНК с нижеописанными физико-химическими свойствами. Соединение представляет собой биологически активное высокомолекулярное вещество, которое способно эффективно тормозить рост опухоли и увеличивать продолжительность жизни организма при низкой токсичности и тем самым превосходит известные противоопухолевые препараты. Полученное заявляемым способом вещество - полиплатиллен существуе т в растворе и в твердой фазе в виде смеси с хлоридом натрия и цитратом натрия (формула цитрата натрия) – Na3C6О7H5 . 5,5 Н2О, сокращенно Na3Cyt) и как индивидуальное вещество. Смесь полиплатиллена с хлоридом натрия и цитратом натрия представляет собой порошок желтого цвета. Индивидуальное соединение мелкокристаллический светло-коричневый порошок. Оно устойчиво в растворах и в твердом виде, способно длительное время храниться на воздухе и в холодильнике без изменения свойств. Состав и строение соединения определены на основе химико-аналитических и физико-химических исследований твердых образцов и растворов. Элементный анализ соединения в смеси с солями натрия и в индивидуальном состоянии подтверждает состав синтезированного целевого продукта полиплатиллена. Для смеси {[PtCI(NH3)(H2О)2]6}n- m -ДНК + 30 n NaCI + 3 n Na 3C6O7H5 .5,5 Н2О найдено, %: 5 Pt 20,41; СІ 22,10; С 11,29; N 5,07; P 1,99; H 2,06; Na 15,40 вычислено, %: Pt 20,23; С122.10; С 11,83; N 5,08; Р 2,14; H 2,19; Na 15,51. Для индивидуального соединения полиплатиллена найдено, %: Рt 39.81; СІ 7.40; С 15.62; N10,11; Р4.38; H 2,83. вычислено, %: Pt 39,58; СІ 7,21; С 15,83; N 9,95; Р 4,19; H 2,67. Измеренная вискозиметрическим методом молекулярная масса полиплатиллена составляет 6,2.106 дальтонов. Рассчитанная на основе данных о среднестатистической молекулярной массе полиплатиллена и массы его среднестатистической мономерной единицы формула (среднестатистическая величина n = 2100±100): {[PtCI(NH 3)(H2О)2 ]6 (C39H49O32N15P 4]}. Следовательно, в среднем на 2000 нуклеотидных квартетов ДНК, состоящих из пар адеyин-тимин, гуанинцитозин. приходится примерно 12000 комплексных частиц [PtCI(NH 3)(H2О)]+. Полученный в индивидуальном виде по-липлатиллен плохо растворяется в воде. Его растворимость повышается в присутствии солей натрия (NaCI + Na3Cyi), Так при 20°С растворимость препарата в дистиллированной воде составляет всего 0,0005%, а в растворе, содержащем 18 ммоль/л NaCl и 1,8 ммоль/л Na3Cyt, - 0,005%. Значительно лучше, чем индивидуальное вещество, растворяется полиплатиллен, полученный в смеси с NaCI + Na 3Cyt: растворимость такого образца в воде при 20°С равна 0,015%. Однако и эта величина на порядок ниже максимально достижимой концентрации соединения, полученного в растворе. Пониженная растворимость твердых образцов говорит о необратимой десольватации полиплатиллена при его выделении из водного раствора, что обусловливает необходимость использовать суспензии твердых образцов при биологических испытаниях. Раствор чистого полиплатиллена практически не проводит электрический ток. что свидетельствует об отсутствии электролитической диссоциации при его растворении. УФ-спектры образцов полиплатиллена, полученных в водном растворе и выделенных в твердом виде индивидуально или как смесь с NaCI + Na3Cyt, после растворения в воде характеризуются максимальным поглощением l макс = 266,2 нм, тогда как для свободной н-ДНК l макс = 258,0 нм. Молекулярный коэффициент поглощения полиплатиллена в расчете на моль нуклеотида, Е266,2 = 10000 л • моль -1 см -1, а у н-ДНК -Е258.0 = 7000 л • моль-1 см -1. Смещение максимума поглощения в длинноволновую область на 8,2 нм у полиплатиллена по сравнению с н-ДНК говорит о связывании макромолекулы с платиносодержащими группировками в результате образования ковалентных связей между ионом металла и донорными атомами азота оснований ДНК. Более высокая величина длинноволнового смещения УФ-максимума поглощения у полиплатиллена, Dl = 8.2 нм, по сравнению с аналогичной величиной Dl = 7,7 нм для соединения РtОН-ДНК, свидетельствует о том, что в среднем ковалентные связи между платиной и основаниями ДНК в полиплатилле-не прочнее, чем в соединении РtOН-ДНК. Сопровождающий это связывание гипер-хромный эффект составляет 30%, указывая на сильные конформационные изменения двойной спирали ДНК при взаимодействии с металлом. Изменения в ИК-спектрах полиплатиллена по сравнению со свободной ДНК свидетельствуют о том. что металл в нем связывается не только с азотистыми основаниями ДНК, но и с атомами кислорода фосфатны х групп. При 1225 и 1060, см-1 находятся полосы валентных колебаний фосфодиэфирных мостиков ДНК. В области 1500-1700 см -1 наблюдаются полосы валентных колебаний C=C,C=N,C=0 азотистых оснований ДНК, в области 3000-3700 см -1 полосы валентных колебаний групп С-Н, N-Н, O-Н, входящи х в состав ДНК и молекул воды. Кроме того, при 340 см' наблюдается валентное колебание Pt-CI, при 1340 см'1 деформационное колебание координированной молекулы NH3. і Ло данным термического анализа чистый полиплатиллен не теряет молекулу воды даже при нагревании до 200°С, что свидетельствует о ее прочном связывании. Смесь полиплатиллена с NaCI + Na3Cyt . 5,5 Н2О при прогревании до 200°С теряет кристаллизационную воду цитрата натрия. Найдено, что потеря воды для смеси полиплатиллен + NaCI + Na3Cyt . 5,5 Н2О составляет 5,10%, а вычисленное количество кристаллизационной воды равно 5,13%. Спектры отражения твердого полиплатиллена имеют значения коэффициентов спектрального отражения, R %, в экстремальных точках, отличные от значений R для ДДП. Для смеси полиплатиллен + NaCI + Na3Cyt .5,5 Н2О R267.1 = 8,97; R333 = 26,28; в то время как для ДДП R242.2 = 9,7, R269,7 = 13,6, R333,3= 10.4, R340 = 17.10, R414.6= 14,80, R514.4 = 50,57. Спектры отражения подтверждают, что полиплатиллен представляет собой вещество, содержащее комплекс платины. состав координационной сферы которого изменен за счет замещения одной молекулы аммиака и одного аниона хлора молекулой воды и фрагментами ДНК. Данные элементного анализа, вискозиметрии, кондуктометрии, УФ- и ИК-спектров поглощения, а также спектров отражения свидетельствуют о том, что синтезированное соединение действительно высокомолекулярное вещество поли{гексакис[хлороаминакваплатина(П)]}- m -дезокси-рибонуклеат формулы {[PtCI(NH 3)(H2 О)2] 6}n- m -ДНК.. В таблице 2 представлены результаты испытаний токсичности и противоопухолевой активности заявляемого соединения и соединения PtOH-ДНК, выбранного в качестве базового. Опыты проводили на мышах и крысах обоего пола разведения питомника "Столбовая". Токсичность изучали на группах животных из половозрелых нелинейных мышей весом 30,0 ± 2,0 г, прошедших карантин 20 дней (в каждой группе было по 10 животных). Препараты вводили внутрибрюшинно трехкратно с интервалом в два часа по 0,5 мл. Для инъекций PtOH-ДНК использовали водные растворы, а для инъекций полиплатиллена - цитратно-солевые растворы (водный раствор, содержащий 15 ммоль/л NaCI и 1,5 ммоль/л Na3Cyt) или водные суспензии его твердых образцов, представлявших собой индивидуальное вещество или его смесь с NaCI + Na 3Cyt. Суммарные дозы препаратов составляли 34,0, 68,0, 84,0, 102.0 и 136 мг/кг. Количество погибших животных в каждой группе отмечали через каждые 24-48 часов. Расчет токсичной дозы, ЛД50, проводили по методике. Летальную дозу, ЛД100 , определяли экспериментально. В результате проведенных опытов установлено, что для соединения PtOH-ДНК ЛД50 = 66,0, ЛД100 = 100 мг/кг. Токсичность полиплатиллена зависит от формы его введения. Для препарата, полученного в растворе, ЛД50 = 102,0, а ЛД100 = 136 мг/кг; для препарата, выделенного индивидуально или в смеси с NaCI + Na3Cyt .5,5 Н2О, ЛД50= 82,5, ЛД100= 120,0 мг/кг. Из сравнения приведенных величин следует, что токсичность полиплатиллена значительно ниже, чем у соединения PtOH-ДНК. Особенно снижена токсичность у полиплатиллена, полученного в растворе. Согласно, гистологическим исследованиям гибель животных, получавши х токсические дозы препаратов обусловлена энтеротоксичностью. Имеет место выраженная дисплазия клеток эпителия в кишечнике, нарушение его регенераторной функции, сокращение количества митозов. Незначительные изменения отмечены в почках: небольшой отек стромы, зернистая дистрофия канальцев. мелкоочаговые кровоизлияния. Противоопухолевую активность каждого из препаратов оценивали из экспериментов, проведенных на пяти группах животных (в каждой группе по 10 животных). Белым беспородным крысам весом 150-200 г под кожу бедра трансплантировали 2 . 108 - 2 х1010 клеток перевивного штамма лейкоза Швеца. Животные 1 группы служили для контроля, II группа получала соединение PtOH-ДНК, III - полиплатиллен, полученный в растворе, IV - полиплатиллен, полученный в смеси с NaCI + Na3Cyt 5,5 H2O, V - полиплатиллен, полученный в индивидуальном виде. Препараты вводили внутрибрюшинно трехкратно на 4-6 сутки после трансплантации опухоли, т.е. в период логарифмической фазы ее роста, второй и третий раз - с интервалами 24 - 48 часов соответственно. Суммарные дозы препаратов составляли 27,3 мг/кг в расчете на чистый препарат. Противоопухолевую активность оценивали по следующим физиологическим показателям: - по объему опухоли, v (см 3); - по степени угнетения роста опухоли (Т/С, %); і - выживаемости животных на 10-е сутки (ВЖ, %); - продолжительность жизни животных (ПЖЖ, сутки). Расчеты производили по следующим Формулам: где m 1, m 2, m 3 - три взаимно-перпендикулярных измерения опухолевого узла; где VКОН и Voп - объем опухоли в контрольной и опытной группах соответственно: где А - число животных на 10-е сутки после трансплантации опухоли, N - число животных в данной группе. ПЖЖ определяли по числу суток, прошедших о т момента перевивки опухоли до гибели последнего животного в данной группе. Данные о биологической активности полиплатиллена. приведенные в таблице, подтверждены актом испытаний противоопухолевой активности и токсичности. Анализ данных, представленных в таблице 2, показывает, что препарат PtOH-ДНК по сравнению с контролем тормозит рост опухоли на 94%. Его применение позволяет получить 100%-ную выживаемость животных. В то же время продолжительность жизни животных при его применении уменьшается на 3-е суток по сравнению с контролем, т.е. не леченными животными. Противоопухолевая активность полиплатиллена не зависит от формы введения препарата. Во всех случаях он тормозит рост опухоли на 95%, обеспечивает 100%-ную выживаемость животных. В тоже время продолжительность их жизни увеличивается по сравнению г. контролем на 7-8 суток, а по сравнению с PtOH-ДНК - вдвое, т.е. на 10±1 суток. Сравнительный анализ данных, приведенных в таблице, позволяет заключить, что заявляемое соединение, полиплатиллен, менее токсично, чем препарат PtOH-ДНК, особенно. если его применять в виде препарата, полученного в растворе. По уровню противоопухолевой активности и выживаемости он не уступает соединению PtOH-ДНК, а по такому показателю, какпродолжительность жизни, существенно превосходит его, так как увеличивает продолжительность жизни в два раза. Таким образом, создание высокомолекулярного соединения платины (П) с ДНК, полиплатиллена, привело к получению вещества более эффективного, чем известные противоопухолевые препараты, так как по показателям физиологической активности, характеризующим его противоопухолевый эффект, предлагаемый препарат превосходит или сопоставим с известными веществами и выгодно отличается от них из-за уменьшения токсичности. Выявленный комплекс свойств: высокие показатели степени торможения роста опухоли, выживаемости животных и продолжительности их жизни при одновременном снижении токсичности делает предложенное соединение перспективным для создания препаратов, эффективных для лечения злокачественных опухолей. Дополнительным преимуществом предлагаемого противоопухолевого вещества является обеспечение им возможности расширить ряд высокомолекулярных платиносодержащих противоопухолевы х препаратов и тем самым обеспечить преодоление эффекта привыкания организма к платиновым противоопухолевым средствам. Способ обеспечивает также получение вещества в растворе и в твердой фазе как индивидуального соединения в чистом виде и как смеси его с хлоридом и цитратом натрия.
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of platinum /??/? n-dna complex compound, posessing antitumor activity
Автори англійськоюVolchenkova Ilima Iliodorivna, Volchenskova Ilima Iliodorivna, Maidanevych Nadiia Mykolaivna, Budarin Lev Ivanovych, Trokhymenko Olena Petrivna, Shalimov Serhii Oleksandrovych, Keisevych Ludwig Vladyslavovych
Назва патенту російською?????? ????????? ???????????? ?????????? ??????? /??/? ?-???, ??????????? ?????????????????? ???????????
Автори російськоюВолченскова Илима Илиодоровна, Майданевич Надежда Николаевна, Бударин Лев Иванович, Трохименко Елена Петровна, Шалимов Сергей Александрович, Кейсевич Людвиг Владиславович
МПК / Мітки
МПК: A61K 31/295, C07F 15/00, A61P 35/00
Мітки: іі/з, має, одержання, платини, сполуки, н-днк, спосіб, протипухлинну, комплексної, активність
Код посилання
<a href="https://ua.patents.su/5-3801-sposib-oderzhannya-kompleksno-spoluki-platini-ii-z-n-dnk-shho-maeh-protipukhlinnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання комплексної сполуки платини /іі/з н-днк, що має протипухлинну активність</a>
Попередній патент: Спосіб здобування катіоніту
Наступний патент: Пристрій для управління намоточним верстатом
Випадковий патент: Система для очищення судноплавних каналів