Спосіб алкоксиметилювання 1н-пірольних сполук
Формула / Реферат
1. Способ алкоксиметилирования 1Н-пиррольных соединений при температуре от 0 до 150°С, предпочтительно от 20 до 60°С, отличающийся тем, что 1H-пиррольные соединения обрабатывают диалкоксиметаном, диметилформамидом и оксихлоридом фосфора в присутствии апротонного растворителя и полученную реакционную смесь обрабатывают третичным амином.
2. Способ по п.1, отличающийся тем, что 1Н-пиррольное соединение представляет собой соединение формулы (I):
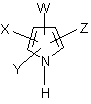 , (I)
, (I)
где W представляет собой CN, NO2, S(O)nCR, или ![]() ,
,
Х представляет собой водород, галоген, CN, NO2, S(O)mСR3, С1-С4-галоидалкил, Q или фенил, необязательно замещенный одним или несколькими галогенами, NO2, CN, С1-С4-алкильными, С1-С4-галоидалкильными, С1-С4-алкокси или С1-С4-галоидалкокси группами,
Y представляет собой водород, галоген, С1-С4-галоидалкил или фенил,
необязательно замещенный одним или несколькими галогенами, NO2, CN, С1-С4-
алкильными, С1-С4-галоидалкильными, С1-С4-алкокси или С1-С4-галоидалкокси
группами,
Z представляет собой водород, галоген или С1-С4-галоидалкил,
n и m каждый независимо равны целому числу 0, 1 или 2,
R и R3 каждый независимо представляют С1-С6-галоидалкил,
R1 и R2 каждый независимо представляют С1-С4-алкил, С1-С4-галоидалкил или
фенил, необязательно замещенный одним или несколькими галогенами, NO2, CN, С1-С4-алкильными, С1-С4-галоидалкильными, С1-С4-алкокси или С1-С4-галоидалкокси группами,
Q представляет собой
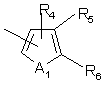 ,
,
где R4, R5, и R6 каждый независимо представляют собой водород, галоген, NO2, СНО, или R5 и R6 могут вместе с атомами, к которым они присоединены, образовывать кольцо, в котором R5 и R6 представляют структуру
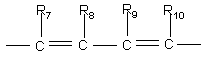 ,
,
где R7, R8, R9 и R10 каждый независимо представляют собой водород, галоген, CN или NO2,
А и А1, каждый независимо представляют собой О или S.
3. Способ по п.1, отличающийся тем, что W представляет собой CN или NO2,
X представляет собой галоген, С1-С4-галоидалкил или фенил, необязательно замещенный одним или несколькими галогенами или С1-С4-галоидалкильными группами, Y представляет собой водород, галоген, С1-С4-галоидалкил и Z представляет собой водород, галоген или С1-С4-галоидалкил.
4. Способ по п. 1, отличающийся тем, что апротонным растворителем является ароматический углеводород или алифатический нитрил.
5. Способ по п. 4, отличающийся тем, что растворителем является толуол, ксилолы или ацетонитрил.
6. Способ по п. 1, отличающийся тем, что третичным амином является три(С1-С6-алкил)амин.
7. Способ по п. 1, отличающийся тем, что третичным амином является триэтиламин.
8. Способ по п. 1, отличающийся тем, что 1-(акоксиметил)пиррольным соединением является 1-(С1-С6-алкоксиметил)пиррол, а ди(алкокси)метаном является ди(С1-С6-алкокси)метан.
9. Способ по п. 8, отличающийся тем, что ди(С1-С6-алкокси)метаном является диэтоксиметан.
10. Способ по п. 9, отличающийся тем, что 1Н-пиррольное соединение имеет структуру
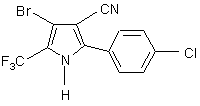 .
.
Текст
1. Способ алкоксиметилирования 1Н-пиррольных соединений при температуре от 0 до 150°С, предпочтительно от 20 до 60°С, отличающийся тем, что 1H-пиррольные соединения обрабатывают диалкоксиметаном, диметилформамидом и оксихлоридом фосфора в присутствии апротонного растворителя и полученную реакционную смесь обрабатывают третичным амином. 2. Способ по п.1, отличающийся тем, что 1Нпиррольное соединение представляет собой соединение формулы (I): 3 39935 4 6. Способ по п. 1, отличающийся тем, что тре10. Способ по п. 9, отличающийся тем, что 1Нтичным амином является три(С1-С6-алкил)амин. пиррольное соединение имеет структуру 7. Способ по п. 1, отличающийся тем, что треCN Br тичным амином является триэтиламин. 8. Способ по п. 1, отличающийся тем, что 1Cl (акоксиметил)пиррольным соединением является N F 3C 1-(С1-С6-алкоксиметил)пиррол, а ди(алкокси)метаном является ди(С1-С6-алкокси)метан. H . 9. Способ по п. 8, отличающийся тем, что ди(С1-С6алкокси)метаном является диэтоксиметан. Карбонитрильные пирролы, нитропирролы, арилпирролы, бисарилпирролы, тиоалкилпирролы, алкилсульфонилпирролы, тиокарбоксамидпирролы и гетероарилпирролные соединения и их производные являются высоко эффективными инсектицидными, акарицидными, нематоцидными, моллюскоцидными и эндектицидными агентами, которые можно использовать как в отношении растений, так и животных. Обычно, вышеуказанные производные пиррола с алкоксиметильным заместителем у атома азота пиррольного кольца являются более эффективными, чем исходные соединения пиррола. Алкоксиметилирование пирролов по атому азота с образованием N-(алкоксиметил)пиррола обычно осуществляют с помощью конденсации соответствующего пиррола с a-галоидметиловым эфиром в присутствии сильного основания, такого, как гидрид натрия (см. например, I.Muchowski et al, Ioyrnal of Organic Chemistry, 49(1), 203(1984), или трет-бутоксид калия (например, патент США 5010098). Однако, использование a-галоидметиловых эфиров в масштабах производства на промышленных пилотных установках нежелательно из-за канцерогенных свойств указанных эфиров. Далее, применение таких сильных оснований, как металлгидриды или трет-бутоксиды в крупном масштабе является дорогостоящим и опасным. Использование алкилаля и реагента Вилсмейера, как известно, дает алкоксиметиловый эфир фенольной гидроксильной группы, например, по способу патента CШA 4500738. Однако данный процесс недостаточно успешен в отношении атома азота пиррольного кольца, и реакция не идет. Поэтому целью настоящего изобретения является создание безопасного и эффективного способа получения N-(алкоксиметил)пиррола без отдельного получения a-галоидметиловых эфиров и без обращения с ними. Другой целью настоящего изобретения является создание способа алкоксиметилирования пирролов без применения таких сильных оснований, как гидриды металлов или трет-бутоксиды металлов. Еще одной целью настоящего изобретения является создание легко доступного источника N-алкоксимотильных производных широкого круга важных пестицидных соединений пиррола. Остальные цели и отличительные особенности изобретения станут очевидны из представленного далее описания. Предложен безопасный и эффективный способ получения 1-(алкоксиметил)пиррольных соедине ний, который включает осуществление взаимодействия 1-Н-пиррольного соединения с ди-(алкокси)метаном, диметилформамидом и оксихлоридом фосфора в присутствии апротонного растворителя с образованием реакционной смеси, и обработку реакционной смеси третичным амином, необязательно при повышенной температуре. С помощью способа настоящего изобретения можно получить с высоким выходом, эффективностью и со значительно уменьшенным вредом для окружающей среды и человека широкий круг пестицидных соединений 1-(алкоксиметил)пиррола, таких, как: карбонитрилы пиррола, нитропирролы, арилпирролы, бисарилпирролы, тиоалкилпирролы, алкилсульфонилпирролы, алкилсульфонилпирролы, карбоксамидпирролы, тиокарбоксамидпирролы, гетероарилпирролы и т.п. Соединения пиррола обладают множеством полезных биологических свойств, таких как бактерицидные фунгицидные, акарицидные, инсектицидные, моллюскоцидные и нематоцидные виды активности. Безопасный и эффективный способ получения производных по кольцевому атому азота пирролов обеспечивает значительные преимущества как для медицинского, так и для сельскохозяйственного применения пирролов. В частности, алкоксиметилирование пирролов, которые демонстрируют сельскохозяйственные пестицидные свойства, имеет тенденцию улучшать эти свойства. Однако, известные до сих пор способы алкоксиметилирования азота пиррольного кольца включают использование и работу с a-галоидметиловым эфиром (канцероген) либо с таким сильным основанием, как гидрид металла или алкоксид металла (наносят вред и дорого стоят) или с обоими. Было обнаружено, что соединения 1-H-пиррола можно алкоксиметилировать по азоту пиррольного кольца с получением 1-(алкоксиметил)пиррола с высоким выходом и без сильных оснований металлов, и без необходимости выделения или обращения с канцерогенными промежуточными соединениями, с помощью взаимодействия соединения 1-Н-пиррола с ди(С1-С6 алкокси) метаном и реагентом Вилсмейера в присутствии апротонного растворителя с получением реакционной смеси, и последующего добавления к этой реакционной смеси третичного амина с получением целевого соединения 1-(С1-С6 алкоксиметил)пиррола. Неожиданно было обнаружено, что последовательное добавление третичного амина к смеси соединения 1-Н-пиррола, ди-(С1-С6 алкокси)метана и реагента Вилсмейера в апротонном раство 2 5 39935 6 рителе обеспечивает прекрасную конверсию 1-Нси)метана, диметилформамида и оксихлорида фопиррола в соотетствующий 1-(С1-С6 алкоксимесфора в апротонном растворителе перемешивают тил)пиррол. при 0°-150°С, предпочтительно, 20°-60°С, в течеСогласно одному варианту настоящего изобние около 0,25-2,0 часов, затем полученную смесь ретения пиррольное соединение формулы 1: обрабатывают примерно 1-2 молярными эквиваформула /1/ лентами третичного /3°/амина, перемешивают при 0°-150°С, предпочтительно, около 0°-60°, до завершения реакции, и гасят водой с получением целевого 1-(C1-C6 алкоксиметил)пиррола. При использовании, например 1-Н-пиррола формулы I, реакция представлена на схеме I, где ДМF обозначает диметилформамид, a R11 представляет C1-C6 где: алкил. W представляет CN, NO2, S(O)n CR или X представляет водород, галоген, CN, NO2, S(O)m CR3,C1-C4 галоидалкил, или фенил, необязательно замещенный одним или более гаолгенами, NO2, CN, C1-C4 алкильными, C1-C4 галоидалькильными, C1-C4 алкокси или C1-C4 галоидалкокси группами. Y представляет водород, галоген, C1-C4 галоидалкил или фенил, необязательно замещенный одним или более галогенами, NO2, CN C1-C4 алкильными, C1-C4 галоидалкильными, C1-C4 алкокси или C1-C4 галоидалкокси группами, Z представляет водород, галоген или C1-C4 галоидалкил m и n каждый независимо представляет целое число 0,1 или 2, R и R3 каждый независимо представляет C1-C6 галоидалкил, R1 и R2 каждый независимо представляет C1-C4 алкил, C1-C4галоидалкил или фенил, необязательно замещенный одним или более галогенами, NO2, CN, C1-C4 алкильными, C1-C4 галоидалкильными, C1-C4 алкокси или C1-C4 галоидалкокси группами. Q представляет: Хотя подходящими являются стехиометрические количества 1-H-пиррола, ди/C1-C6 алкокси/метана, диметилформамида и оксихлорида фосфора, предпочтителен некоторый избыток реагента Вилсмейера /ДMF и POCI3/, около 1,0-1,5 молярных эквивалентов, и около 1,0-2,0 молярных эквивалентов ди/C1-C6 алкокси/метана. Стехиометрические количества указаны в расчете на молярные эквиваленты используемого исходного 1-Н-пиррола. Апротонные растворители, пригодные для использования в способе настоящего изобретения, представляют собой ароматические углеводороды, галоидированные ароматические углеводороды, алифатические нитрилы, эфиры и т.п. Наиболее предпочтительные апротонные растворители представлены толуолом, ксилолами, галоидбензолами и ацетонитрилом. Скорость реакции возрастает с повышением температуры, однако, слишком высокие температуры невыгодны и приводят к побочным реакциям и снижают выход. Для способа настоящего изобретения предпочтительны температуры в интервале около 0°-150° и наиболее предпочтительны температуры около 20°- 60°С. Третичные амины, пригодные для использования в способе настоящего изобретения, включают любые тризамещенные амины известные специалистам, такие, как триалкиламины, диалкилариламины, триариламины и т.п. предпочтительно, триалкиламины, и предпочтительно, триэтиламин. Способ настоящего изобретения можно использовать для получения 1-(алкоксиметил)-производных, 1-Н-пиррола. Предпочтительными 1-H-пиррольными соединениями являются соединения формулы I, где W, Х, Y и Z имеют указанные ранее значения. Более предпочтительными соединениями формулы I являются соединения, в которых W представляет CN или NO2, Х представляет водород, галоген или C1-C4 галоидалкил, Y представляет водород, галоид или C1-C4 галоидалкил, а Z представляет галоид, C1-C4 галоидалкил или фенил, необязательно замещенный одной или более из C1-C4 галоидалкильных групп или одним или более галогенами. R4, R5, и R6 каждый независимо представляет водород, галоген NO2, CHO или R5 и R6, взятые вместе с атомами, к которым они присоединены, образуют кольцо, в котором R5R6 имеет структуру: R7 R8 R9 и R10 каждый независимо представляют водород, галоген, CN или NO2, и А и А1 каждый независимо представляет О или S можно безопасно и эффективно превратить в 1-(C1-C6 алкоксиметил)пиррол формулы II где W, X, У и Z имеют значения указанные ранее для формулы I, а R11 представляет C1-C6 алкил. На практике, смесь приблизительно стехиометрических количеств 1-Н-пиррола, ди-(C1-C6 алкок 3 7 39935 8 Предпочтительными соединениями формулы II, полученными по способу настоящего изобретения, являются соединения, в которых R11 представляет C1-C6 алкил, W представляет CN, или NO2, Х представляет галоид или C1-C4 галоидалкил, Y представляет водород или C1-C4 галоидалкил, а Z представляет фенил, необязательно замещенный одним или более галогенами, или C1-C4 галоидалкильными группами. Более предпочтитеПеремешиваемую смесь 4-бром-2-(n-хлорфельными соединениями формулы II являются тем, нил)-5-(трифторметил)-пиррол-3-карбонитрила /17,4г, в которых R11 представляет C1-C3 алкил(особенно 0,05моля), ди-(н-бутокси)метана /12,0г, 0,075моля/ С2Н5), W представляет CN, Х представляет водои диметилформамида /4,6г,0,063моля/ в ксилолах в род, Y представляет СF3, и Z представляет фенил, атмосфере азота обрабатывают оксихлоридом фонеобязательно замещенный одними атомами хлосфора /9,6г, 0,063моля/ порционно при 30-37°C в ра или брома. течение 10 минут, нагревают при 45-50°С в течение Для более полного понимания изобретения 0,75 часа, охлаждают до 35°С, прикалывают триэприводятся следующие примеры. Они являются тиламин /8,1г, 0,08моля/ за 0,25 часа и нагревают только иллюстративными и НИКОИМ образом не огпри 45-50°С в течение дополнительно 0,75 часа. раничивают объем и суть изобретения. Затем реакционную смесь охлаждают до 25°С, обТермины НРZС=ВЭЖХ и 1Н ЯМР обозначают рабатывают водой и дополнительными ксилолами высокоэффективную жидкостную хроматографию и перемешивают в течение 0,5 часа. Фазы разделяи протонный ядерный магнитный резонанс, соотют и органическую фазу концентрируют в вакууме с ветственно. получением указанного в заголовке продукта в виде Пример 1. светлокоричневого твердого продукта, т. плавления Получение 4-бром-2-(n-хлорфенил)-I-(этокси52,0-53,5°С, 20,6 г, выход 94,6%, по данным1Н ЯМР метил)-5-(трифторметил)пиррол-3-карбонитрила и масс-спектроскопии. Пример 3. Получение 4-бром-2(n-хлорфенил)-1-(метоксиметил)-5-(трифторметил)пиррол-3-карбонитрила Перемешиваемую смесь 4-бром-2-(n-хлорфенил)-5-(трифторметил)пиррол-3-карбонитрила /17,4 г, 0,05 моля/, диэтоксиметана /10,4 г, 0,10 моля/ и диметилформамида /4,6 г, 0,0625 моля/ в толуоле в атмосфере азота, обрабатывают порционно оксихлоридом фосфора /9,6 г, 0,0625 моля/ при 35-45°С в течение 10 минут, нагревают при 45-53°С в течение около 0,5 часа, охлаждают до 35°C прикапывают триэтиламин /7,25, 0,0715 моля/ за 2 часа при 35-45°С. Реакционную смесь обрабатывают водой, фильтруют и осадок на фильтре, сушат в вакууме при 60°С с получением указанного в заголовке продукта 20,8г, степень чистоты 92,7%, выход 94,6% по данным ВЭЖХ. Тем же способом, и заменяя толуол на следующие растворители, получают указанное в заголовке соединение с указанными далее выходами: Растворитель Ацетонитрил Ксилолы Хлорбензол по способу примера 2, и заменяя ди-(н-бутокси)метан на диметоксиметан, указанное в заголовке соединение получают с выходом 66%, оно охарактеризовано данными 1Н ЯМР и масс-спектроскопии. Пример 4. Получение 2-(n-хлорфенил)-1-(этоксиметил)5-(трифторметил)-пиррол-3-карбонитрила Перемешиваемую смесь 2-(n-хлорфенил)-5(трифторметил)пиррол-3-карбонитрила (13,5 г, 0.05моля), диэтоксиметана (7,8г, 0,075моля)и диметилформамида /5,5г, 0,075моля/ в ацетонитриле в атмосфере азота, обрабатывают оксихлоридом фосфора /11,5г, 0,075моля/ за 0,525 часа при 39-45°С, нагревают при 39-45°С в течение 0,75 часа и прикалывают триэтиламин/10,1г, 0,10моля/ при 45-55°С в течение 0,5 часа. Реакционную смесь разбавляют водой, перемешивают в течение 16 часов при 25°С и концентрируют в вакууме с получением неочищенного продукта. Этот материал перемешивают при кипении с обратным холодильником со смесью толуола и Выход,% 94,7 96,4 93,6 Пример 2. Получение 4-бром-1-(н-бутоксиметил)-2-(nхлорфенил)-5-(трифторметил)пиррол-3-карбонитрила 4 9 39935 10 разбавленной водной NаОН и охлаждают до комнатного в заголовке продукта в виде твердого вещества, ной температуры. Фазы разделяют , органическую т. плавления 83-84,5°С, 13,1г, выход 80%, идентифифазу концентрируют в вакууме с получением указанкация по данным масс-спектроскопии. __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 456-20-90 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 5
ДивитисяДодаткова інформація
Автори англійськоюBarton Jerry Michael
Автори російськоюБартон Джерри Майкл
МПК / Мітки
МПК: A01N 43/36, C07D 207/34, C07D 207/325, C07D 207/36, C07D 207/42
Мітки: спосіб, 1н-пірольних, сполук, алкоксиметилювання
Код посилання
<a href="https://ua.patents.su/5-39935-sposib-alkoksimetilyuvannya-1n-pirolnikh-spoluk.html" target="_blank" rel="follow" title="База патентів України">Спосіб алкоксиметилювання 1н-пірольних сполук</a>
Попередній патент: Спосіб корекції психологічного стану людини і плавучий центр для його здійснення
Наступний патент: Прості діефіри та спосіб їх одержання
Випадковий патент: Насосний агрегат









