Псевдополіморфні форми дигідрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, способи їх отримання та фармацевтичні композиції на їх основі
Номер патенту: 54568
Опубліковано: 17.03.2003
Автори: Фанара Доменіко, Тиммерманс Жак, Делерс Мішель, Бодсон Гі, Бервар Монік, Дожимон Шарль
Формула / Реферат
1. Безводний дигідрохлорид 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, який відрізняється тим, що його рентгенівська дифракційна картина дає максимуми на наступних значеннях ![]()
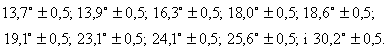
2. Моногідрат дигідрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, який відрізняється тим, що його рентгенівська дифракційна картина дає максимуми на наступних значеннях ![]()
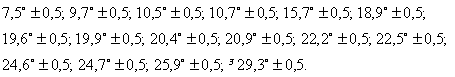
3. Спосіб отримання безводного дигідрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, описаного в п. 1, який відрізняється тим, що моногідрат дигідрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти нагрівають в розчиннику в умовах дефлегмації.
4. Спосіб за п. 3, який відрізняється тим, що розчинник, що застосовують, являє собою ацетон або метилетилкетон.
5. Спосіб отримання моногідрату дигідрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, описаного в п. 2, який відрізняється тим, що 2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксіацетамід гідролізують в присутності хлористоводневої кислоти.
6. Спосіб за п. 5, який відрізняється тим, що гідроліз проводять при температурі, що знаходиться в межах від 40°С до температури флегми реакційної суміші.
7. Спосіб отримання моногідрату дигідрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, описаного в п. 2, який відрізняється тим, що безводний дигідрохлорид 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти перекристалізовують у водній хлористоводневій кислоті.
8. Фармацевтична композиція, що містить безводний дигідрохлорид 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, описаний в п. 1, яка застосовується в поєднанні з відповідними для нього наповнювачами, розріджувачами або носіями.
9. Фармацевтична композиція за п. 8, яка відрізняється тим, що вона являє собою тверду фармацевтичну композицію, що містить щонайменше один гідроксильований наповнювач, носій або розріджувач.
10. Фармацевтична композиція за п. 8 або 9, яка відрізняється тим, що вона додатково містить наповнювач з повільним виділенням лікарської складової і циклодекстрин.
11. Фармацевтична композиція, яка містить моногідрат дигідрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, описаний в п. 2, що використовується в поєднанні з відповідними для нього наповнювачами, розріджувачами або носіями.
12. Фармацевтична композиція, яка містить суміш безводного дигідрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, описаного в п. 1, і моногідрату дигідрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, описаного в п. 2, що використовується в поєднанні з відповідними для неї наповнювачами, розріджувачами і носіями.
Текст
1 Безводний дипдрохлорид 2-[2-[4-[б і с (4фторфеніл)метил]-1-піперазиніл]етоксі]оцтовоі кислоти, який відрізняється тим, що його рентгенівська дифракційна картина дає максимуми на наступних значеннях 29 13,7° ± 0,5, 13,9° ± 0,5, 163° ± 0,5, 1 Q0° ± 0,5, 18,6° ± 0,5, 19,1° ± 0,5, 23,1° ± 0,5, 24,1° ± 0,5, 25,6° ± 0,5, і 3Q2° ± 0,5 2 Моногідрат дипдрохлориду 2-[2-[4-[б і с (4фторфеніл)метил]-1-піперазиніл]етоксі]оцтовоі кислоти, який відрізняється тим, що його рентгенівська дифракційна картина дає максимуми на наступних значеннях 29 75° ±05 97° ±05 105° ±05 107° ±05 157° ±05 189° ±05 196°±05 199°±05 204°±05 2 9°±05 222°±05 225°±05 0 24 6° ±0 5 247° ±0 5 259° ±05 і 293° ±05 3 Спосіб отримання безводного дипдрохлориду 2[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоКСІ]ОЦТОВОІ кислоти, описаного в п 1, який відрізняється тим, що моногідрат дипдрохлориду 2-[2[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти нагрівають в розчиннику в умовах дефлегмації 4 Спосіб за п 3, який відрізняється тим, що розчинник, що застосовують, являє собою ацетон або метилетилкетон 5 Спосіб отримання моногідрату дипдрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1піперазиніл]етоксі]оцтовоі кислоти, описаного в п 2, який відрізняється тим, що 2-[4-[біс(4фторфеніл)метил]-1-піперазиніл]етоксіацетамід пдролізують в присутності хлористоводневої кислоти 6 Спосіб за п 5, який відрізняється тим, що гідроліз проводять при температурі, що знаходиться в межах від 40°С до температури флегми реакційної суміші 7 Спосіб отримання моногідрату дипдрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоКСІ]ОЦТОВОІ кислоти, описаного в п 2, який відрізняється тим, що безводний дипдрохлорид 2-[2-[4[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтовоі кислоти перекристалізовують у водній хлористоводневій КИСЛОТІ 8 Фармацевтична композиція, що містить безводний дипдрохлорид 2-[2-[4-[біс(4-фторфеніл)метил]1-піперазиніл]етоксі]оцтовоі кислоти, описаний в О п 1, яка застосовується в поєднанні з ВІДПОВІДНИМИ для нього наповнювачами, розріджувачами або носіями 9 Фармацевтична композиція за п 8, яка відрізняється тим, що вона являє собою тверду фармацевтичну композицію, що містить щонайменше один пдроксильований наповнювач, носій або розріджувач 10 Фармацевтична композиція за п 8 або 9, яка відрізняється тим, що вона додатково містить наповнювач з повільним виділенням лікарської складової і циклодекстрин 11 Фармацевтична композиція, яка містить моногідрат дипдрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтовоі кислоти, описаний в п 2, що використовується в поєднанні з ВІДПОВІДНИМИ для нього наповнювачами, розріджувачами або носіями 12 Фармацевтична композиція, яка містить суміш безводного дипдрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтовоі кислоти, описаного в п 1, і моногідрату дипдрохлориду 2-[2[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, описаного в п 2, що використовується в поєднанні з ВІДПОВІДНИМИ ДЛЯ неї наповнювачами, розріджувачами і носіями 00 (О ю ю 54568 Даний винахід відноситься до нових псевдополіморфних кристалічних форм дипдрохлориду 2-[2-[4-[біс-(4-фторфеніл)метил]-1-піперазиніл]етокси]оцтовоі кислоти, до способів його отримання і до утримуючих їх фармацевтичних композицій Відома 2-[2-[4-[Біс-(4-фторфеніл)метил]-1 -піперазиніл]етокси]оцтова кислота, що іменується далі ефлетиризином (МНН - міжнародне непатентоване найменування), являє собою сполуку наступної формули F. жаючи на те, що ефлетиризин був вивчений на предмет його терапевтичної застосовності, таким його кристалічним формам до цього часу увага не приділялася Даний винахід заснований на несподіваному відкритті двох псевдокристалічних форм дипдрохлориду ефлетиризину, а саме безводного дипдрохлориду ефлетиризину і моногідрату дипдрохлориду ефлетиризину 3 метою розпізнавання безводний дипдрохлорид ефлетиризину іменується нижче «Формою А», а моногідрат дипдрохлориду ефлетиризину іменується нижче «Формою В» ВІДПОВІДНО ДО ІНШОГО варіанту здійснення да .о он Ефлетиризин включений в загальну формулу І ВІДПОВІДНО до Європейського патенту №58146, виданого на ім'я даного заявника, яка відноситься до заміщених похідних бензпдрилпіперазину Як і у відомої також 2-[2-[4-[(4-[хлорфеніл)фенілметил]-1-піперазиніл]етокси]оцтовоі кислоти, що іменується далі цетиризином (МНН), у ефлетиризина були виявлені чудові антипстамінні властивості Він належить до фармакологічного класу другого покоління антагоністів Hi-рецепторів гістаміну і проявляє in vitro високий ступінь схожості і вибірковості до Hi-рецепторів Як і цетиразин, його доцільно застосовувати в якості антиалерпчного, антипстамінного, бронхолітичного і спазмолітичного засобів Результати останніх КЛІНІЧНИХ досліджень свідчать про корисність застосування ефлетиризину при його назальному введенні у вигляді аерозолю для лікування алергічного риніту і ринокон'юнктивиту (J -F Dessanges et al , Allergy and Clm Immunol News (1994), Suppl №2, abstract 1864, С De Vos et al , Allergy and Clm Immunol News (1994), Suppl №2, abstract 428) Результати іншого останнього КЛІНІЧНОГО дослідження (на стадії публікації") показують, що ефлетиризин дає несподівано хороші результати при лікуванні кропивниці, дифузного нейродерміту і ЗУДУ У зв'язку з терапевтичним інтересом, що підвищується до ефлетиризину, нами була поставлена задача отримати фармацевтичні композиції, що містять ефлетиризин Ефлетеризин являє собою аморфну тверду речовину Однак було б вельми бажано використати продукт з характеристиками, що відтворюються, який завжди виявляв би себе однаково під час приготування лікарського засобу, зокрема, з тим, щоб задовольняти нормативним вимогам Виходячи з цього, нами були зроблені спроби приготувати кристалічні форми ефлетиризину Незва ного винаходу запропоновані способи отримання цих нових псевдополіморфних форм, а також запропоновані способи перетворення Форми А в Форму В і Форми В в Форму А Даний винахід заснований також на відкритті тієї обставини, що ці дві нові псевдополіморфні форми мають різні властивості Більш конкретно, нами було відкрито, що тверді фармацевтичні композиції, що містять Форму А дипдрохлориду ефлетиризину, виявляють згодом більш високу СТІЙКІСТЬ при зберіганні, ніж тверді фармацевтичні композиції, що містять Форму В Передбачається, що такий більш високий ступінь СТІЙКОСТІ при зберіганні зумовлений кращою сумісністю з твердими носіями і розріджувачами, що застосовуються, як правило, в подібного роду твердих фармацевтичних композиціях ВІДПОВІДНО, даний винахід відноситься також до фармацевтичних композицій, що містять Форму А або Форму В в поєднанні з ВІДПОВІДНИМИ ДЛЯ НИХ фармацевтичними наповнювачами, носіями або розріджувачами, переважно до твердих фармацевтичних композицій, що містять Форму А З точки зору способів отримання згаданих вище псевдополіморфних форм дипдрохлориду ефлетиризину, Форма В може бути отримана шляхом гідролізу у водному середовищі 2-[4-[біс-(4фторфеніл)метил]-1-піперазиніл]етоксиацетаміду в присутності хлористоводневої кислоти при температурі, що знаходиться в межах від 40°С до температури флегми реакційної суміші Потім Форма В може бути піддана перекристалізації у водній кислоті або в суміші розчинників, що містять воду і хлористоводневу кислоту Потім Форма В може бути перетворена в Форму А шляхом и нагрівання до температури флегми в розчиннику, наприклад, в ацетоні або метилетилкетоні При необхідності Форма А може бути зворотно перетворена в Форму В шляхом перекристалізації у водній хлористоводневій кислоті Слідуючи нижче приклади ілюструють способи отримання Форми А і Форми В дипдрохлориду ефлетиризину ВІДПОВІДНО до даного винаходу У цих прикладах диференціальні термограми були записані за допомогою диференціального скануючого калориметра DSC 7 (PERKIN ELMER) з градієнтом температури 20°С/хв 1 Приготування 2-[4-[біс-(4-фторфеніл)метил]1-піперазиніл]етоксиацетаміду і дипдрохлориду 2 54568 [4-[біс-(4-фторфеніл)метил]-1До суспензії, що складається з 2,76кг (7,1 піперазиніл]етоксиацетаміду моль) 2-[4-[біс-(4-фторфеніл)метил]-1-піперазиніл]етоксиацетаміду в 6,4л води, додається 37%Суспензія, що складається з 11,0г (0,038 моль) ний (процентне співвідношення маси) водний роз1 -[біс-(4-фторфеніл)метил]-1 -піперазину, 10,5г чин хлористоводневої кислоти (6,38л) Отримана (0,076 моль) 2-(2-хлоретил)ацетаміду і 8,1г безвореакційна суміш нагрівається до 65°С і витримудного карбонату натрію в 40мл ксилола, зазнає ється при цій температурі протягом 1 години Понагріву до 140°С і витримується в цих умовах детім вона зазнає охолоджування до 0°С і залишафлегмації протягом 4 годин Осад, який утворюється для кристалізації Осад, який утворюється, ється, відфільтровується, після чого промивається відфільтровується при 0°С, промивається 6н розтолуолом Після ЦЬОГО фільтрат і толуол, викорисчином хлористоводневої кислоти (1,5л), внаслідок таний для промивки, об'єднуються в одне ціле чого утвориться неочищений моногідрат дипдрохОтримана органічна фаза зазнає екстракції 80мл лориду ефлетиризину 1н водного розчину хлористоводневої кислоти, а водна фаза ДВІЧІ промивається толуолом До Потім цей неочищений продукт зазнає розчиотриманої водної фази додається толуол, після нення шляхом його нагріву до 60°С в 13,5л води, чого додаються 80мл 1н водного розчину гідропісля чого отриманий розчин ДВІЧІ промивається в ксиду натрію, а отримана водна суміш зазнає ра1л толуолу Після ЦЬОГО водна фаза підкислюється зової екстракції толуолом Потім органічна фаза 16л 37%-ного (процентне співвідношення маси) зазнає одноразової промивки водою, просушення розчину хлористоводневої кислоти і охолоджуєтьнад безводним сульфатом натрію, а розчинники ся до 0°С Осад, який утворюється, відфільтровувипаровуються до повного просушування за допоється при 0°С і промивається 6н розчином хлоримогою роторного випарника На цій стадії залишок стоводневої кислоти (2,4л), після чого отриманий після випаровування складається з 2-[4-[біс-(4продукт зазнає сушки протягом 4 днів при темпефторфеніл)метил]-1-піперазиніл]етоксиацетаміду, ратурі приблизно 50°С У результаті утвориться який може бути перетворений в свою дипдрохломоногідрат дипдрохлориду ефлетиризину у вигляридну сіль таким чином залишок після випаровуді білої твердої речовини (вихід 3,14КГ, 92%) вання береться з 50мл ізопропанолу і фільтруєтьДиференціальна скануюча термограма Форми ся, потім до ізопропанолового розчину додається В показує перший ендотермічний максимум, що 4,38н спиртовий розчин хлористоводневої кислознаходиться між 155 і 170°С, і другий ендотермічти (17,5мл), після чого отримана суміш залишаєтьний максимум, що знаходиться між 210 і 235°С ся на кристалізацію Осад фільтрується, промива4 Отримання безводного дипдрохлориду ефється ізопропанолом і діетиловим ефіром, після летиризину (Форма А), перетворення Форми В в чого просушується у вакуумі У результаті на виФорму А ході утворяться 15,8г (90%) дипдрохлориду 2-[4Приготовляється 3,143кг (6,53 моль) суспензії [біс-(4-фторфеніл)метил]-1Форми В, отриманої ВІДПОВІДНО ДО методики припіперазиніл]етоксиацетаміду готування за прикладом 3, в 35л метилетилкетону Отримана суміш підігрівається до температури Температура плавлення 229,51 °С флегми і витримується при цій температурі протяМас-спектр 389 (вільна основа М+), 345 і 203 гом 2 годин Протягом 2 годин 50 хвилин в цих 2 Отримання ефлетиризину умовах дефлегмації вилучається вода з одночасДо суміші, що містить 325мл етанолу, 130мл ним доданням, що пропорцюнально збільшується, 1н водного розчину гідроксиду натрію і 62мл 6,3н 5л метилетилкетону Отримана суміш зазнає оховодного розчину гідроксиду натрію і що знаходитьлоджування до 25°С, перемішування протягом ся в круглодонній колбі, оснащеній механічною ночі, фільтрування і подальшої промивки метилмішалкою, впускним отвором для азоту і конденетилкетоном (10л) У результаті утворюється безсатором, додаються 30г (0,065 моль) 2-[4-[біс-(4водний дипдрохлорид ефлетиризину (Форма А), фторфеніл)метил]-1-піперазиніл]етоксиацетаміду який зазнає сушки під вакуумом при 50°С (Вихід Отримана суміш зазнає нагріву в атмосфері азоту і 98,6%, 2983г) витримується в умовах дефлегмації протягом 1,5 годин Потім реакційна суміш охолоджується до Аналіз для C21H24F2N2O3 2HCI кімнатної температури, а и рН доводиться до 5 обчислено С 54,44 Н 5,66 N 6,05 СІ 15,30 F шляхом додання 78мл 5н водного розчину хлори8,19 стоводневої кислоти Після ЦЬОГО додається вода, встановлено С 54,80 Н 5,68 N 5,86 СІ 15,50 а етанол випаровується під вакуумом за допомоF 8,21 гою роторного випарника Отримана внаслідок Диференціальна скануюча термограма Форми цього водна фаза екстрагується дихлорметаном А показує ендотермічний максимум, що знахоОрганічна фаза зазнає сушки над безводним судиться між 220 і235°С льфатом натрію і випаровування до повного про5 Перетворення Форми А в Форму В сушення, внаслідок чого утворяться 25г неочищеПриготовляється 699г суспензії Форми А, ного ефлетиризину у вигляді аморфної твердої отриманої ВІДПОВІДНО до методики приготування за речовини, 5г якого п єре кристал і зо вується в ацетоприкладом 4, в Зл води Отримана суміш нагріванітрил ється до 60°С до повного розчинення, після чого відразу ж фільтрується До цього розчину при 50°С Аналіз для C21H24F2N2O3 протягом ЗО хвилин додається 37%-ний (процентобчислено С 64,60 Н 6,19 N 7,17 F 9,73 не співвідношення маси) водний розчин хлористовстановлено С 64,45 Н 6,27 N 7,24 F 9,44 водневої кислоти (Зл) Потім за допомогою декіль3 Отримання моногідрату дипдрохлориду ефкох кристалів Форми В ІНІЦІЮЄТЬСЯ процес летиризину (Форма В) 54568 8 кристалізації Отримана суміш охолоджується, во-шлункового тракту людини, тобто при 1,2, 4,0 і перемішується спочатку протягом 1 години при 7,5 Внаслідок проведення випробування за допокімнатній температурі, а потім протягом 2 годин могою приладу USP XXII №2 (фармакопея США, при 0°С Тверда речовина, яка утвориться, відфі1990р), в якому в якості мішалки використовуєтьльтровується, промивається 0,6л 6н водного розся лопать (50об/хв), а комплект гранул розміщучину хлористоводневої кислоти і просушується під ється на дні посудини (статичний метод дисків), вакуумом при 50°С (вихід 676г, 93%) були отримані стабільні показники кров'яного тиску, що відтворюються Для подальшого обчисленАналіз для C21H25F2N2O3 2HCI Н2О ня питомої швидкості розчинення вибиралися стаобчислено С 52,41 Н 5,86 N 5,82 СІ 14,73 F тистично оцінені (р < 0,05) ЛІНІЙНІ відрізки всіх 7,89 кривих розчинення, що відтворюються) встановлено С 52,08 Н 6,03 N 5,44 СІ 14,55 F 7,83 Результати представлені в таблиці 1, яка ілюструє питомі швидкості розчинення Форм А і В, Псевдополіморфні форми А і В дипдрохлори2 виражені в мг/см /хв при трьох значеннях рН, що ду ефлетиризину додатково характеризуються їх перевіряються ВІДПОВІДНИМИ рентгенівськими порошковими дифракційними спектрами і питомими швидкостями розчинення Таблиця 1 I Рентгенівські порошкові дифракційні спектри Питомі ШВИДКОСТІ розчинення Рентгенівські порошкові дифракційні спектри записувалися на дифрактометрі PHILIPS PW 1710 Питома швидкість розчинення, мг/см^/хв з використанням випромінювання СиКа як джереРН Форма А Форма В ло Зразки порошку, що підлягають аналізу, були 1,2 5,04 ± 0,34 4,05 ± 0,64 засипані в тримач без подрібнення або перемішу4,0 5,43 ± 0,342 3,58 ± 0,50 вання Спектри записувалися при кімнатній темпе7,5 4,52 ± 0,34 3,31 ±0,04 ратурі в межах від 26 = 4° до 26 = 50° при швидкості сканування 17хв Дані, приведені в таблиці 1, свідчать про те, Для Форми А характерні дифракційні максищо як Форма А, так і Форма В мають питомі швидмуми спостерігаються на наступних значеннях 26 кості розчинення, що перевищують 0,1мг/см2/хв 13,7° ±0,5, 13,9° ±0,5, 16,3° ±0,5, 18,0° ±0,5, 18,6° при трьох значеннях рН, що перевіряються Це ±0,5, 19,1° ±0,5, 23,1° ±0,5, 24,1° ±0,5, 25,6° ± 0,5 свідчить про те, що розчинення, ймовірно, не є і 30,2° ± 0,5 стадією, що обмежує швидкість, в процесі всмоктуваності in vivo для твердих фармацевтичних Для Форми В характерні дифракційні максикомпозицій, що містять як форму А, так і Форму В муми спостерігаються на наступних значеннях 26 Однак питома швидкість розчинення Форми В зна7,5° ± 0,5, 9,7° ± 0,5, 10,5° ± 0,5, 10,7° ± 0,5, 15,7° ± чно нижче, ніж у Форми А Це означає, що, якщо 0,5, 18,9° ± 0,5, 19,6° ± 0,5, 19,9° ± 0,5, 20,4° ± 0,5, потрібно по можливості найбільш швидкий ступінь 20,9° ± 0,5, 22,2° ± 0,5, 22,5° ± 0,5, 24,6° ± 0,5, 24,7° розчинення твердої лікарської форми, Форма А, з ±0,5, 25,9° ±0,5 і 29,3° ±0,5 терапевтичної точки зору, є переважною кристаліII Питома швидкість розчинення чною формою для використання в твердій фармаДослідження біологічної доступності лікарської цевтичній композиції речовини показали, що питома швидкість розчинення менше за 0,1мг/см2/хв часто може служити Даний винахід відноситься також до фармацев якості передбаченого параметра, що визначає втичних композицій, що містять Форму А або Форвсмоктуваність лікарської речовини у людей, яка му В в поєднанні з ВІДПОВІДНИМИ для неї фармацеобмежена швидкістю його розчинення Отже, пивтичними наповнювачами У разі твердих фарматома швидкість розчинення є передбаченим парацевтичних композицій, як ні дивно, але доцільніше метром біологічної доступності Цей параметр завикористати Форму А, а не форму В Нами дійсно лежить від всіляких фізико-хімічних властивостей, було виявлено, що тверді фармацевтичні комповключаючи хімічну форму (сіль, сольват), кристазиції, що містять Форму А в поєднанні із звичайнилічну форму, розчинність і змочуванність ми носіями і розріджувачами, наприклад, сорбітом, виявляють більш високу СТІЙКІСТЬ при зберіганні, Визначення питомої швидкості розчинення ніж композиції, які містять Форму В проводилося таким чином Форма, що підлягає випробуванню, була подрібнена і змішана з мікроЦе ілюструється результатами наступного докристалічною целюлозою AVICEL PH102 (суха слідження, направленого на вивчення СТІЙКОСТІ зв'язуюча речовина, поліпшуюча властивості прозгаданих двох псевдополіморфних форм в присутцесу таблетування) Відношення речовини до суності D-сорбіту під час зберігання в жорстких темміші наповнювачів становило 70 ЗО (процентне пературних умовах, тобто в герметичних ампулах співвідношення маси) АЛІКВОТНІ КІЛЬКОСТІ (500МГ) при 40 або 60°С були піддані пресуванню в гранули шляхом стисУ цьому дослідженні з використанням методу нення до остаточно прикладеного навантаження, високоефективної рідинної хроматографії був рівного 10т, з метою отримання суцільної і відомої зроблений аналіз декількох зразків Форми А, Фоплощі поверхні з нульовою пористістю рми В, D-сорбіту і сумішей Форми А, Форми В з Dсорбітом, взятих в пропорції 1 1 (процентне співЕксперименти на розчинення проводилися при відношення маси) 37°С з використанням 500мл водного середовища при трьох різних значеннях рН, призначених для Кожний зразок був підданий рівномірному пообхвату очікуваного діапазону значень рН кишкодрібненню і змішуванню АЛІКВОТНІ КІЛЬКОСТІ 54568 (500мг) були спресовані в гранули діаметром 13мм при прикладеному навантаженні в 1 тонну, яка є звичайною силою стиснення при виготовленні фармацевтичних таблеток Кожна спресована гранула була відразу ж подрібнена до ступеню тонкодисперсного порошку, а для зберігання в герметично запаяній скляній ампулі при 40 або 60°С була залишена аліквотна КІЛЬКІСТЬ Зразки були проаналізовані методом високоефективної рідинної хроматографії на початку випробування, а також через 4, 16 і 24 тижні У першій серії аналізу рідинно - хроматографічні і ультрафіолетові спектри записувалися рідинно-хроматографічною системою моделі KONTRON HPLC 300, оснащеною ультрафіолетовим детектором Колонка, що застосовувалась відноситься до типу RP-ABZ 250 з внутрішнім діаметром 4,6мм і розміром часток 5мкм, а жвава фаза, що застосовувалась складалася з суміші ацетонітрилу з водою в пропорції 25 75 (процентне співвідношення об'єму), причому вода містила 770мг/л ацетату амонію Зразки, що підлягають аналізу, були розчинені в суміші ацетонітрилу з водою в пропорції 25 75 (процентне співвідношення об'єму) при концентрації 2мг/мл, і цей розчин по Юмкл був вприснений в рідинно-хроматографічну систему При порівнянні рідинно-хроматографічних спектрів, отриманих для окремих компонентів і двокомпонентних сумішей, вважалося, що зареєстровані нові максимуми свідчать про взаємодію з Dсорбітом При їх наявності ці нові максимуми були квантифіковані і додатково проаналізовані методами високоефективної рідинної хроматографії і мас-спектрометри з використанням масспектрометра VG Quattro, сполученого з рідиннохроматографічною системою KONTRON HPLC Після зберігання при 40 або 60°С протягом 4, 16 або 24 тижнів в спектрограмах, отриманих методом високоефективної рідинної хроматографії в поєднанні з ультрафіолетовим аналізом, якінебудь зміни зареєстровані не були Не був також виявлений і D-сорбіт При порівнянні зі спектрами чистої Форми А або Форми В в спектрограмах для двокомпонентних сумішей з'явилися нові максимуми Нові максимуми були особливо значні для Форми В, яка заздалегідь була залишена на зберігання при 60°С При використанні методу високоефективної рідинної хроматографії в поєднанні з масспектрометрією нові максимуми, що спостерігаються для двокомпонентних сумішей, були визначені як ВІДПОВІДНІ складному моноефіру сорбітефлетиризину і депдрированим формам складного моноефіру сорбіт-ефлетиризину Останній з'явився після більш тривалих періодів зберігання, ніж перший У таблиці 2 приведені результати КІЛЬКІСНОГО визначення складного моноефіру сорбіт 10 ефлетиризину, що утворилося в двокомпонентних сумішах після зберігання при 40 або 60°С Відносна квантифікація складного моноефіру проводилася методом високоефективної рідинної хроматографії в поєднанні з ультрафіолетовим аналізом Таблиця 2 Квантифікація складного моноефіру сорбітефлетиризину за деякі проміжки часу Відносний процент площі 40°С 60°С Час, ТИЖНІ Форма А Форма В Форма А Форма В 0,03 0,29 0,45 0,46 0,04 0,87 2,69 2,95 0 0 0 4 16 0,04 0,07 0,13 0,13 0,16 0,23 24 Дані, приведені в таблиці 2, свідчать про те, що, коли Форма А або Форма В спресована в гранулу з D-сорбітом і зберігається при 40 або 60°С, складний моноефір сорбіт-ефлетиризину утворюється в КІЛЬКОСТІ, яка збільшується згодом Крім того, вони свідчать проте, що утворення складного моноефіру відбувається в абсолютно малих кількостях для Форми А при зберіганні при 40 і 60°С і для Форми В при зберіганні при 40°С Однак утворення складного моноефіру для Форми В при зберіганні при 60°С відбувається на вельми істотному рівні Ці результати свідчать про те, що Форма А дипдрохлориду ефлетиризину в меншій мірі взаємодіє з пдроксилованими наповнювачами, носіями або розріджувачами, що звичайно використовуються в твердих фармацевтичних композиціях, і що, таким чином, вона більш придатна для отримання таких композицій, ніж Форма В Даний винахід відноситься також до фармацевтичної композиції, що містить Форму А або Форму В або суміш Форми А і Форми В в поєднанні з ВІДПОВІДНИМИ для них наповнювачами, розріджувачами або носіями Фармацевтичні композиції ВІДПОВІДНО до винаходу можуть мати різноманітні форми На особливий інтерес заслуговують лікарські форми пролонгованої дії, а найбільш переважні композиції містять наповнювач з повільним виділенням лікарської складової в поєднанні з цикл од екстрином Прикладом такої композиції може служити наступний склад ЗОмг безводного дипдрохлориду 2[2-[4-[біс-(4-фторфеніл)метил]-1-піперазиніл]етокси]оцтовоі кислоти, 14,7мг Encompress® 82,3мг циклодекстрину, 70мг Metocel® K15MCR, 1 мг Aerosil® 200, 2мг стеарату магнію Підписано до друку 03 04 2003 р Тираж 39 прим ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюPseudopolymorphic forms of 2-[2-[4-[bis(4-fluorophenyl)methyl]-l-piperazinyl]ethoxy]acetic acid
Назва патенту російськоюПсевдополиморфные формы дигидрохлорида 2-[2-[4-[бис(фторфенил)метил]-1-пиперазинил]этокси]уксусной кислоты
МПК / Мітки
МПК: A61P 43/00, A61P 25/08, A61P 37/08, C07D 295/088, A61K 31/495, A61P 17/00, C07D 295/08, A61P 11/08
Мітки: композиції, способи, 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової, основі, фармацевтичні, дигідрохлориду, форми, кислоти, отримання, псевдополіморфні
Код посилання
<a href="https://ua.patents.su/5-54568-psevdopolimorfni-formi-digidrokhloridu-2-2-4-bis4-ftorfenilmetil-1-piperaziniletoksioctovo-kisloti-sposobi-kh-otrimannya-ta-farmacevtichni-kompozici-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Псевдополіморфні форми дигідрохлориду 2-[2-[4-[біс(4-фторфеніл)метил]-1-піперазиніл]етоксі]оцтової кислоти, способи їх отримання та фармацевтичні композиції на їх основі</a>









