Спосіб індукції одинарних та поєднаних уражень слизової оболонки стравоходу і порожнини рота в експериментальних тварин
Номер патенту: 64581
Опубліковано: 10.11.2011
Автори: Філіпський Андрій Вікторович, Заячківська Оксана Станіславівна, Савицька Мар'яна Ярославівна, Гжегоцький Мечислав Романович, Пшик-Тітко Ірена Олегівна
Формула / Реферат
Спосіб індукції одинарних та поєднаних уражень слизової оболонки стравоходу (СОС) і порожнини рота (СОПР) в експериментальних тварин, який включає експериментальне пошкодження СОС та СОПР шляхом введення ульцеротропних речовин, який відрізняється тим, що експериментальне пошкодження СОС та СОПР проводять шляхом щоденного внутрішньостравохідного перфузування кислотно-пепсинової суміші за допомогою нагнітальної помпи протягом 7 днів та шляхом водно-іммобілізаційного стресу протягом 3,5 год.
Текст
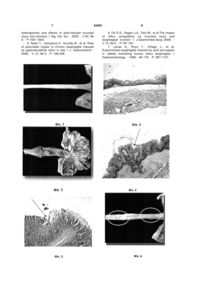
Спосіб індукції одинарних та поєднаних уражень слизової оболонки стравоходу (СОС) і порожнини рота (СОПР) в експериментальних тварин, який включає експериментальне пошкодження СОС та СОПР шляхом введення ульцеротропних речовин, який відрізняється тим, що експериментальне пошкодження СОС та СОПР проводять шляхом щоденного внутрішньостравохідного перфузування кислотно-пепсинової суміші за допомогою нагнітальної помпи протягом 7 днів та шляхом водно-іммобілізаційного стресу протягом 3,5 год. (19) (21) u201104893 (22) 19.04.2011 (24) 10.11.2011 (46) 10.11.2011, Бюл.№ 21, 2011 р. (72) ЗАЯЧКІВСЬКА ОКСАНА СТАНІСЛАВІВНА, ПШИК-ТІТКО ІРЕНА ОЛЕГІВНА, САВИЦЬКА МАР'ЯНА ЯРОСЛАВІВНА, ФІЛІПСЬКИЙ АНДРІЙ ВІКТОРОВИЧ, ГЖЕГОЦЬКИЙ МЕЧИСЛАВ РОМАНОВИЧ (73) ЛЬВІВСЬКИЙ НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ ІМЕНІ ДАНИЛА ГАЛИЦЬКОГО 3 кованих закидом шлункового вмісту - ознакою ГЕРХ. В основу корисної моделі поставлено задачу розробити доступний спосіб експериментального моделювання ураження СОС та СОПР, що за структурно-функціональними характеристиками буде співвідносний з ураженнями епітеліального бар'єру стравоходу, що виникають під час ГЕРХ. Поставлена задача вирішується тим, що у способі індукції одинарних і поєднаних уражень слизової оболонки стравоходу і порожнини рота в експериментальних тварин, який включає експериментальне пошкодження СОС та СОПР шляхом введення ульцеротропних речовин, згідно з корисною моделлю, експериментальне пошкодження СОС та СОПР проводять шляхом щоденного внутрішньостравохідного перфузування кислотнопепсинової суміші за допомогою нагнітальної помпи протягом 7 днів та шляхом водноіммобілізаційного стресу протягом 3,5 год. Враховуючи існуючі виняткові труднощі в клінічних дослідженнях стравоходу, запропоновано ефективний спосіб індукції пошкоджень СОС та СОПР в експерименті, при застосуванні якого провідне місце належить чинникам і процесам, що відіграють першорядну роль у виникненні кислотоасоційованої патології стравоходу та її екстраезофагальних проявів. Вивчення резистентності слизового бар'єру стравоходу слід розпочинати на одній з швидковідтворюваних моделей "гострих" уражень стравоходу. Запропонований спосіб здійснюють таким чином. Для відтворення у щурів ознак, ревалентних клінічним, що формуються під час ГЕРХ, використовують щоденне внутрішньостравохідне перфузування кислотно-пепсинової суміші за допомогою нагнітальної помпи протягом 7 днів і водноіммобілізаційний стрес протягом 3,5 год. Проведені експериментальні дослідження ілюструються фотографіями: на фіг.1 представлено типові макроскопічні зміни СОС щурів групи контролю, на фіг.2 - гістологічна картина слизової оболонки нижньої третини стравоходу у тварин групи контролю представлена плоским роговіючим епітелієм; препарати фарбовано гематоксиліном та еозином (ГЕ), при збільшенні ×100, на фіг.4 - зміни епітеліальної висилки, на фіг.5 - зміни топології мембран, на фіг.6 - стрес-асоційовані неерозивні зміни СОС щурів під час індукції уражень СОС за умов моделювання ГЕРХ, на фіг.3 - ерозивновиразкові ураження СОС шляхом перфузування кислотно-пепсинової суміші, на фіг.7 - розшарування та вогнищева десквамація рогового шару, виражений набряк підслизової основи слизової оболонки нижньої третини стравоходу у тварин за умов індукції неерозивного езофагіту, ГЕ ×200, на фіг.8 - послаблення передепітеліального слизовогідробікарбонатного комплексу епітеліального бар'єру СОРП, вогнищевий акантолізис, злущення рогового шару, на фіг.9 - деструктивні зміни СОПР з інтенсивною лейкоцитарною інфільтрацією. З метою отримання одинарних і поєднаних уражень слизової оболонки стравоходу і ротової порожнини подібних до тих, що виникають при 64581 4 гастроезофагальній рефлюксній хворобі та неерозивній рефлюксній хворобі (НЕРХ), використовували модифікацію малоінвазивної експериментальної методики індукції уражень COC per os [3]. Експерименти виконувались на білих нелінійних щурах-самцях масою 180-220 г, які утримувались згідно з правилами "належної лабораторної практики" (GLP) з дотриманням загальних етичних принципів проведень експериментів на тваринах, ухвалених І національним конгресом з біоетики (Київ, 2000), і відповідно до Міжнародних принципів "Європейської конвенції про захист хребетних тварин, яких використовують для експериментів та в інших наукових цілях" (Страсбург, 1986), і розділених на групи з 6-8 тварин. Щурам контрольної групи (1 група) перфузували плацебо (10 мл 0,9 % NaCl розчину), 2 та 3 груп - моделювали кислотний тип ураження СОС за допомогою 10 мл кислотно-пепсинової суміші з домішками жовчі (1,0 мл), зібраної від завчасно прооперованих тварин. У 4 та 5 групах моделювали водно-іммобілізаційний стрес (ВІС). Експериментальних тварин утримували в умовах віварію на стандартному раціоні, застосовуючи перед експериментом 12-годинну харчову депривацію, проте з вільним доступом до води. Для відтворення у щурів ознак, ревалентних клінічним, що формуються під час ГЕРХ, використовували щоденне внутрішньостравохідне перфузування кислотно-пепсинової суміші за допомогою нагнітальної помпи (Infusion Pump-353, "Medipan", Польща) протягом 7 днів. Під пентобарбіталовим наркозом (Biowet, Польща) в дозі 10 мг/кг, внутрішньоочеревинно, через систему поліетиленових дренажів (Intramedic Polyethylene Tubing, "ClayAdams Division of Becton,Dickinson Company", США), введених per os на 3-4 см у стравохід, щурам контрольної групи перфузували 20 мл фізрозчину (0,9 % розчин NaCl), тоді як іншим - кислотно-пепсинову суміш, що складалась з 0,25 N НСl з пепсином (0,1 мг/мл перфузату) та жовчі (1 мл), зібраної завчасно від попередньо прооперованих тварин, з рН=0,68 (рН-метр CG840, SCHOTT, Німеччина). Перфузії здійснювали зі швидкістю 20 мм/год. щодня протягом 7 днів. Під час маніпуляцій проводили моніторинг за тваринами, утримуючи їх у стані середньої седатації та спонтанного дихання, в розпластаному горизонтальному положенні (за допомогою гумових шворок) з 30° краніальним підвищенням. Температура перфузованих розчинів становила 37°С. Усі препарати були виробництва "Sigma Chemical Co.", США. Після знеболення щурів виводили з експерименту. Для індукції неерозивних пошкоджень СОС, що ревалентні НЕРХ, використовували широковживану модель водно-іммобілізаційного стресу (ВІС) за Takagi et al., 1964, попередньо застосовуючи 24-годинну харчову депривацію з необмеженим доступом до води. Після завершення експерименту тварин наркотизували пентобарбіталом [Biowet, Польща, 20 мг/кг, внутрішньоочеревинно] і робили забір крові для визначення вмісту ІЛ-1, ФНП- у сироватці крові за допомогою твердофазного методу 5 імуноферментного аналізу (ELISA) та відповідних наборів (в-во "Dialcone", Франція). Морфологічну картину внутрішніх органів вивчено з використанням загальноприйнятих методів макроскопічних досліджень за МІУ, світлової мікроскопії (гістологічні препарати були пофарбовані гематоксилін-еозином). При цьому виняткова увага надавалась стандартизації отриманих результатів у кількісному та якісному вигляді: індексах, балах тощо відносно попередньо визначеної візуальноаналогової шкали. Пошкодження на СОС оцінено за частотою (кількість тварин у групі, що мають виразки) та множинністю виразкоутворення (середня кількість виразок, що припадає на одну тварину). Для візуалізації мікроскопічних уражень ясен та нижньої третини стравоходу гістологічний матеріал фіксовано у 10 % забуференому розчині формаліну. Подальші проведення матеріалу, заливання парафіном, виготовлення зрізів виконано за загальноприйнятою методикою. Препарати фарбовано гематоксиліном та еозином. Дослідження препаратів проведено за допомогою мікроскопа Olympus BX 41 при збільшенні 100 та 200. Макроскопічні пошкодження СОС у щурів групи контролю були відсутні (фіг.1). В інтактних тварин, що склали контрольну групу, морфо-функціональна організація СОС представлена епітеліальною пластинкою, утвореною багатошаровим плоским епітелієм, який лежить на базальній мембрані; власною пластинкою, представленою пухкою сполучною тканиною з судинами та типовими клітинними елементами й волокнистими структурами, що характерні для сполучної тканини; м'язовою пластинкою - один шар гладких міозитів; підслизовою основою з пухкою сполучною тканиною (фіг.2). Пошкоджувальний вплив кислотнопепсиновою сумішшю викликав появу ерозій, виразний набряк у підслизовій ділянці, розширення міжклітинних з'єднань, екстравазати, розпушення та багатошаровість базальних мембран (фіг.3). Виражені альтеративні зміни епітеліальної вистилки (фіг.4), заокруглення клітин спричиняють зміни топології мембран, а, отже, їхньої текучості, порушення зв'язків, що забезпечують контакти з субстратом росту (фіг.5), призводять до інтенсифікації процесів катаболізму, послаблюють захисні механізми формування опірності епітеліального бар'єру проксимального відділу травної системи. У тварин, яким індукували стрес-асоційований неерозивний езофагіт, у поверхневому шарі зареєстровано паракератоз, вогнищева або дифузна деструкція мас кератогіаліну; в епітеліальних елементах виражені альтеративні зміни - вакуолізація та загибель клітин з акантолізисом, десквамацією поверхневихчастин епітеліального шару та розширення міжклітинних контактів, у підлеглій сполучній тканині - периваскулярні крововиливи та лейкоцитарні інфільтрати, виразний набряк підслизової, ознаки запалення, порушення мікроциркуляції. Відзначалося розшарування та вогнищева десквамація рогового шару, виражений набряк підслизової основи слизової оболонки 64581 6 нижньої третини стравоходу у тварин за умов індукції неерозивного езофагіту (Фіг.6,7). Змодельовані умови призвели до порушення гідрофобних властивостей апікальних мембран епітеліоцитів не лише у СОС, а й у функціонально поєднаних органах, а саме, послаблення передепітеліального слизово-гідробікарбонатного комплексу епітеліального бар'єру СОРП, вогнищевий акантолізис, злущення рогового шару (Фіг.8) і деструктивні зміни СОПР з інтенсивною лейкоцитарною інфільтрацією (Фіг.9). Серед чинників, що визначають резистентність епітеліального бар'єру стравоходу і функціонально поєднаних органів, численні хемокіни, відповідальні за пластичну відбудову та фізіологічну регенерацію, ангіогенез, оновлення рогового шару тощо, воєдино з іншими неспецифічними факторами формують захисні властивості проксимального відділу травної системи. До біомаркерів запальних реакцій належать інтерлейкіни ІЛ-1 і ФНП1. У групі контролю концентрація ІЛ-1 у сироватці крові склала 24,16±0,30 пг/мл, ФНП-1 1,05±0,11 пг/мл. Моделювання кислотнопепсинових уражень призвело до збільшення серологічного вмісту ІЛ-1 до 55,35±7,88 пг/мл, ФНП1 - 5,56±0,55 пг/мл (р
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the induction of single and combined injuries of the esophagus and oral mucosa in experimental animals
Автори англійськоюZaiachkivska Oksana Stanislavivna, Pshyk-Titko Irena Olehivna, Savytska Mariana Yaroslavivna, Filipskyi Andrii Viktorovych, Hzhehotskyi Mechyslav Romanovych
Назва патенту російськоюСпособ индукции одинарных и соединенных поражений слизистой оболочки пищевода и полости рта у экспериментальных животных
Автори російськоюЗаячковская Оксана Станиславовна, Пшик-Титко Ирена Олеговна, Савицкая Марьяна Ярославовна, Филипский Андрей Викторович, Гжегоцкий Мечислав Романович
МПК / Мітки
МПК: A61M 5/142, G09B 23/28
Мітки: порожнини, слизової, індукції, оболонки, стравоходу, одинарних, спосіб, тварин, рота, уражень, поєднаних, експериментальних
Код посилання
<a href="https://ua.patents.su/5-64581-sposib-indukci-odinarnikh-ta-poehdnanikh-urazhen-slizovo-obolonki-stravokhodu-i-porozhnini-rota-v-eksperimentalnikh-tvarin.html" target="_blank" rel="follow" title="База патентів України">Спосіб індукції одинарних та поєднаних уражень слизової оболонки стравоходу і порожнини рота в експериментальних тварин</a>
Попередній патент: Сигналізатор метану, суміщений з головним світильником
Наступний патент: Автоматизована геоінформаційна система контролю над збором, перевезенням і вивантаженням об’єктів