Спосіб одержання a-(2,4-дисульфофеніл)-n-трет-бутилнітрону та його солей
Номер патенту: 71653
Опубліковано: 15.12.2004
Автори: Вайда Джон, Макгінлі Джон, Блікст Йорген, Крак Генрі, Пухов Сергей
Формула / Реферат
1. Спосіб одержання сполуки загальної формули (І)
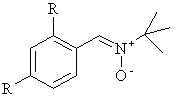 ,(I)
,(I)
де кожний R незалежно є SO3H або її сіль,
який включає реакцію альдегіду загальної формули (II)
 ,(II)
,(II)
де R визначено вище,
з ацетатом N-трет-бутилгідроксиламонію у рідкому реакційному розчиннику.
2. Спосіб за п.1, який відрізняється тим, що R – SO3-Na+.
3.Спосіб за п.1 чи п.2, який відрізняється тим, що на еквівалент альдегіду (II) використовують від 1,25 до 2,5 еквівалентів ацетату N-трет-бутилгідроксиламонію.
4. Спосіб за будь-яким з пп.1 - 3, який відрізняється тим, що реакційний розчинник містить спирт.
5. Спосіб за будь-яким з пп.1 - 3, який відрізняється тим, що реакційний розчинник містить суміш спиртів.
6. Спосіб за п. 4, який відрізняється тим, що спирт є метанолом.
7. Спосіб за будь-яким з пп. 4 - 6, який відрізняється тим, що реакційний розчинник містить до 10 % за об'ємом води.
8. Спосіб за п. 7, який відрізняється тим, що реакційний розчинник містить приблизно 5 % за об'ємом води.
9. Спосіб за будь-яким з пп. 1 - 8, який відрізняється тим, що продукт виділяють кристалізацією, яку проводять при додаванні ізопропілового спирту до реакційної суміші.
10. Спосіб за п. 9, який відрізняється тим, що на один еквівалент альдегіду (II) використовують від 1,6 до 2,0 еквівалентів ацетату N-трет-бутилгідроксиламонію.
Текст
1. Спосіб одержання сполуки загальної формули (І) 2 (11) 1 3 71653 4 описує використання таких самих сполук для лікуПродукти й вихідні матеріали вання струсу мозку. У цьому способі для виготовлення сполуки aІснують різні методи синтезу 4,5-дигідро-1,4(2,4-сульфофеніл)-N-трет-бутилнітрону загальної дифеніл-3,5-феніламіно-1,2,4-тріазолів. У способі, формули (І) здійснюють реакцію альдегіду загальщо найчастіше використовують, застосовують реної формули (II) ацетатом з N-третакцію конденсації похідного гідроксиламіну з викобутилгідроксіамонію. Сполуки загальних формул ристанням альдегідів чи кетонів, звичайно без ка(І) і (II) можуть бути кислотами чи солями. талізатора (J.S. Roberts in D.H.R. Barton i W.D. Солі сполук вищенаведеної формули (1) можOllis, Comprehensive Organic Chemistry, Volume 2, на одержати за допомогою реакції вільної кислоти pp.500-504, Pergamon Press, 1979; R.D. Hinton і (у якій R означає SO3H), чи іншої її солі, із двома Е.Г. Janzen, J. Org. Chem., 1992, 57, pp.2646-2651). чи більше еквівалентами відповідної основи, викоВигідності цієї реакції заважають її чутливість до ристовуючи способи, що відомі фахівцям. стеричної перешкоди, повільні швидкості реакції, а Солі сполук формул (І) і (II), що наведені вище, у деяких випадках, відносна недоступність і/чи звичайно виготовляють з фармацевтично прийнянестабільність гідроксиламінового вихідного матетними катіонами. Катіоном може бути одновалентріалу. Останні проблеми іноді можна перебороти на речовина (это обычно называют метелом, иоодержанням необхідного гідроксиламіну на місці ном, но это проблемы авторов), наприклад, натрій, за допомогою відновлення такої більш легко докалій, літій, амоній, алкіламоній чи діетаноламоній. ступної сполуки, як відповідне нітропохідне. Цю Або ж це може бути багатовалентний катіон, назагальну методику використовують у вищезгадаприклад, магнію, кальцію, алюмінію чи цинку. Це них патентах, де описане виготовлення a-(2,4може бути також змішаною сіллю, виготовленою дисульфофеніл)-N-трет-бутилнітрону за допомобагатовалентним катіоном, як-то кальцієм чи маггою реакції 4-форміл-1,3-бензолсульфонової киснієм, у комбінації з таким фармацевтично прийнялоти з N-трет-бутилгідроксиламіном у метанолі тним аніоном, як, наприклад, галоїдним (наприпри нагріванні під зворотним холодильником проклад, хлоридом), фосфатним, сульфатним, тягом приблизно 18 годин. ацетатним, цитратним чи тартратним. Обидва R у ци х формулах є звичайно однакоa-(2-сульфофеніл)-N-трет-бутилнітрон виготовими. Однак, їх можна вибрати незалежно від тільвляли за допомогою реакції натрієвої солі 2ки що перелічених варіантів. бензолсульфокислоти з N-третБажано, щоб обидва R у вищенаведених фобутилгідроксиламіном у етанолі при нагріванні під рмулах (І) і (II) були однаковими й кожний означав зворотним холодильником протягом 2 діб (Е.Г. SO3-Na+. Janzen and R.V. Shetty, "Tetrahedron Letters", 1979, Ацетат N-трет-бутилгідроксіамонію розкритий сторінки від 3229 до 3232). у співподаній заявці WO 00/02848. Таку модифікацію способу виготовлення 6Альдегіди, що відповідають загальній формулі феніл-N-метилнітрону описано у французькому (II), є у продажу чи їх можна виготовити з доступпатенті 1,437,188, що належить E.I. DuPont них матеріалів із використанням способів, що віNemours and Co. домі фахівцям. Продажна двонатрієва сіль 4Нами розкрито новий спосіб виготовлення aформіл-1,3-бензолдисульфокислоти (II; R=SO 3(2,4-сульфофеніл)-N-трет-бутилнітрону та його Na+) звичайно містить малі, але істотні, кількості солей, який має істотні переваги і є особливо привідповідного бензилового спирту та відповідних датним для великомасштабного виробництва. похідних бензойної кислоти й хлориду натрію як Згідно з одним аспектом винаходу запропонодомішки. Бажано, але не обов'язково, щоб такий вано спосіб виготовлення сполуки загальної форматеріал був очищений перед використанням у мули (І) способі за цим винаходом. Двонатрієва сіль 4форміл-1,3-бензолдисульфокислоти (II; R=SO 3Na+). звичайно містить змінну кількість асоційованої води. Вміст такої води взагалі не є критичним для способу за цим винаходом, але взагалі бажано його враховувати при визначенні повного складе кожний R незалежно є SO3H чи її сіль. ду реакційної суміші для одержання сполуки форУ цьому способі використовують реакцію альмули (І). дегіду загальної формули (II) Спосіб Перший етап полягає в конденсуванні ацетату N-трет-бутилгідроксіамонію (III) з альдегідом (II). Цю реакцію, як правило, проводять окремими партіями при перемішуванні. За бажанням можна проводити реакцію безупинно в проточному де R визначено вище, реакторі. з ацетатом N-трет-бутилгідроксиламонію (III) Бажано використовувати у цьому способі, як (СН3)3СМНОНСН3СО2Н (III) правило, приблизно від 1,25 до 2,5 еквівалентів Згідно з другим аспектом винаходу запропоноацетату N-трет-бутилгідроксіамонію (ІІІ) на кожен вано спосіб виготовлення й виділення сполуки еквівалент альдегіду (II). Особливо бажано викозагальної формули (І). На першій стадії цього прористовувати приблизно 1,6-2,0 еквіваленти Ацетацесу сполуку одержують способом, що тільки що ту N-трет-бутилгідроксіамонію (III). було описано. На наступній стадії сполуку виділяКонденсацію за цим винаходом виконують у ють в чистому виді. 5 71653 6 розчині, використовуючи відповідний інертний розчинником, але такою, у якій нітропродукт менш розчинник, у якому вихідні матеріали є досить розрозчинний. Ця речовина являє собою, як правило, чинними. Краще. використовувати відповідний летучий матеріал, що містить 5 чи менше атомів полярний органічний розчинник, наприклад, спирт карбону. Твердий продукт виділяють за допомогою чи суміш спиртів. Особливо бажано, щоб розчинфільтрації та висушують. Особливо бажано . викоником був метанол. Далі, бажано, щоб реакційна ристовувати як кристалізатор ізопропіловий спирт. суміш містила відповідний відсоток води, як праІншим способом кристалізацію можна викликавило, менше за 10% за об'ємом, а саме, приблизти додаванням відповідної речовини типу ізопроно від 2% до 10% за об'ємом. Найкраще, якщо пілового спирту чи етилацетату без попереднього розчинник міститиме приблизно 5% за об'ємом нагрівання фільтрату. Знову ж, особливо бажано води. Установлено, що присутність відповідної використання ізопропілового спирту. кількості води дає значні переваги, особливо в тім, Вміст води в двонатрієвій солі a-(2,4що стосується гальмування перетворення альдедисульфофеніл)-N-трет-бутилнітрону, отриманої гіду (II) у небажаний побічний продукт (IV). способом за цим винаходом, залежить від характеру методики, яку використовують для виділення продукту, і заключного процесу сушки, який використовують. Таким чином, екстенсивна сушка за підвищеної температури і під зниженим тиском дасть безводний по суті матеріал. Такий матеріал, у результаті реакції з розчинником R1OH. однак, помітно гігроскопічний, у результаті чого Присутність відповідної кількості води в розутворюється тригідрат. Висушування тригідрату чиннику також збільшує розчинність двонатрієвої відновлює безводну форму. Тригідрат отримують солі 4-форміл-1,3-бензолдисульфокислоти (II; безпосередньо за допомогою кристалізації двона+ R=SO3 Na ) у вихідному матеріалі й таким спосотрієвої солі a-(2,4-дисульфофеніл)-N-третбом значно поліпшує кінетику процесу та дозволяє бутилнітрону з гарячої води, чи пропусканням звовикористовува ти більш концентровану систему. Як ложеного повітря через твердий продукт. правило, кількість розчиннику в реакції підтримуДодавання приблизно 5% за об'ємом води до ють приблизно в межах від 2 до 8мл на грам ніткристалізатору може сприяти перетворенню проропродукту чи більше, переважно в межах від 2 до дукту в гідратовану форму й зменшити кількість 6 і особливо - від 3 до 4мл/г. оклюдованих органічних рідин у чистому продукті Конденсацію проводять за температур, що та може понизити вміст домішок, наприклад, альможуть знаходитися в межах від температури надегіду, що не встиг прореагувати. вколишнього середовища до приблизно 150°С, Винахід ілюстровано наступними прикладами, причому гарні результати досягаються за темпеале в жодному разі не обмежено ними. ратур, що не перевищують приблизно 125°С, пеПриклад 1 реважно - за температур приблизно від 40°С до Двонатріева сіль a-(2,4-дисульфофеніл)-N100°С. трет-бутилнітрону (масштаб 10г) Конденсація йде відносно легко і, як правило, Двонатрієву сіль 4-форміл-1,3протягом приблизно від 15 хвилин до 5 годин з бензолдисульфокислоти (10,0г, 27,6ммоль, 85,6% тривалістю реакції від 30 до 90 хвилин. Практично, масова частка), ацетат N-третступінь завершення реакції перевіряють аналітичбутилгідроксиламонію (6,1г, 37,5ммоль, 1,4екв., но, і реакцію продовжують доти, поки не буде до91,6% масова частка, воду (2г) і метанол (38г) досягнутий бажаний ступінь її завершення. давали до 100мл тригорлої колби за кімнатної теВиділення продукту формули (І), утвореного мператури в атмосфері азоту. Суміш розмішували при вищезгаданій конденсації, можна здійснити, і колбу поміщали на масляну баню, яку витримувикористовуючи стандартні способи, які відомі вали при 72°С. Через 2,3год. аналіз за допомогою фа хівцям у цій області. Особливо вигідно те, що ВЕРХ (високоефективна рідинна хроматографія) продукт можна виділити за допомогою викорис(частка в %) показав, що залишилося менше 0,3% тання відповідного способу кристалізації. Отже, у двонатрієвої солі 4-форміл-1,3типовому випадку виділення, після завершення бензолдисульфокислоти. Чистий фільтрат охолореакції альдегіду (II) з ацетатом N-третджували до 20°С і відфільтровували. Чистий розбутилгідроксіамонію (III) реакційну суміш охолочин поміщали у колбу на 250мл зі зворотним ходжують до температури навколишнього середолодильником, нагрівали до кипіння, а потім вища, а потім фільтрують, щоб видалити будь-які додавали краплями ізопропіловий спирт (70г). Піснерозчинні речовини. Фільтрат потім доводять до ля додавання ізопропілового спирту (40г) починатемператури, що може бути від 0°С до температулася кристалізація. Гарячу баню заміняли холодри кипіння розчиннику, але переважно - від 35 до ною водяною банею, і рідкий розчин 50°С, а кристалізацію ініціюють додаванням відпоохолоджували до 11°С. Через 30 хвилин продукт відного засобу кристалізації типу ізопропілового виділяли за допомогою фільтрації та висушували спирту чи етилацетату. Оптимальна температура відсмоктуванням, отримавши білу тверду речовиосадження може змінюватися в залежності від ну (11,2г). Цей матеріал висушували протягом ночі масштабу реакції, у залежності від того, переміпри 50°С у вакуумній сушильній шафі. Маса видішують суспензію чи залишають її у спокої, і від леного висушеного продукту була 8,55г (78,8%). необхідного розміру частинок твердого продукту. Виявилося, що чисто та, визначена за допомоКристалізуюча речовина є, як правило, органігою хроматографії (частка в %, ВЕРХ), відповідала чною рідиною, що може змішуватися з реакційний вмісту двонатрієвої солі a-(2,4-дисульфофенил)-N 7 71653 8 трет-бутилнитрону більше 99%. лишилося менше 0,2% 4-форміл-1,3-двонатрієвої Приклад 2 солі бензолдисульфокислоти. Реакційну суміш фільтрували через лінійний фільтр. Фільтрат пеДвонатрієва сіль a-(2,4-дисульфоФеніл)-Nреміщали в перегінний апарат, і розчин нагрівали трет-бутилнітрону (масштаб 100г) потім до 80°С. Потім додавали ізопропіловий Двонатрієву сіль 4-форміл-1,3спирт (1000мл), і починали дистиляцію. Додавали бензолдисульфокислоти (100,0г, 0,31моль, 96,3% другу частин у ізопропілового спирту (1000мл), і масова частка), ацетат N-трет-бутил гідроксил амонію (66,8г, 0,43моль, 1,4екв., 97,0% масова дистиляцію продовжували доти, поки температура дистиляту не досягала 80°С. Отриману в резульчастка), воду (10г) і метанол (337мл) додавали у таті суспензію охолоджували нижче 11°С, відфільопоряджену чохлом тригорлу колбу на 1л при темтровували, і отриманий твердий залишок висушупературі навколишнього середовища. Суміш розвали протягом 2год., щоб одержати білий твердий мішували і нагрівали при 72°С.Через 3 години ВЕРХ-аналіз показав, що частка двонатрієвої солі продукт. Вихід складав 744,5г (80,7%). Чистота, визначена за допомогою хроматог4-форміл-1,3-бензолдисульфокислоти була менше рафу (частка у % за ВЕРХ), відповідала вмісту 0,2%. Реакційну суміш охолоджували й фільтрували. Фільтрат переміщали в апарат на 2л зі зворотдвонатрієвої солі a-(2,4-дисульфофенил)-N-третним холодильником і нагрівали до 80°С. Коли субутилнітрону більше за 99%. міш починала кипіти, краплями додавали Приклад 5 ізопропіловий спирт (765мл), і нагрівання продовДвонатрієва сіль a-(2,4-дисульфрфеніл)-Nжували протягом наступних 0,5год. Отриману сутрет-бутилнітрону (масштаб 100г) спензію охолоджували до нижче 11°С. Білий тверДвонатрієву сіль 4-форміл-1,3дий продукт відфільтровували і висушували при бензолдисульфокислоти (100,0г, 0,31моль, 96,3% 50°С у вакуумній сушильній шафі протягом 24год. масова частка), N-трет-бутилгідроксіамонію ацетат Вихід склав 83,0гр. (72,8%). (66,8г, 0,43моль, 1,4екв., 97,0% масова частка), Чистота, визначена за допомогою хроматогводу (20г) і метанол (337мл) поміщали в 1-літрову рафа (частка в % за ВЕРХ), відповідала вмісту тригорлу колбу, оснащену нагрівальною оболондвонатрієвої солі a-(2,4-дисульфофенил)-N-треткою, за кімнатної температури. Суміш розмішувабутилнитрону більше за 99%. ли і нагрівали до 72°С. Реакційну суміш охолоджуПриклад 3 вали до кімнатної температури. Потім додавали метилат натрію (3,5г, 64,7ммоль), і суміш розмішуДвонатрієва сіль a-(2,4-дисульфофеніл)-Nвали протягом 0,5год. Потім суміш фільтрували. трет-бутилнітрону (масштаб 500г) Двонатрієву сіль 4-форміл-1,3ВЕРХ-аналіз показав, що у фільтраті залишилося менше 0,2% двонатрієвої солі 4-форміл-1,3бензолдисульфокислоти (500,0г, 1,4моль, 87,0% бензолдисульфокислоти. Реакційну суміш переномасова частка.), ацетат N-третсили потім у 1-літровий перегінний апарат, і розбутилгідроксиламонію (336,0г, 2,18моль, 1,5екв., чин нагрівали до 80°С. Після того, як було зібрано 97,0% масова частка), воду (20г) і метанол (1700мл) завантажували при кімнатній температурі 100мл дистиляту, додавали ізопропіловий спирт (400мл), і дистиляцію продовжували доти, поки в 5-літрову опоряджену чохлом тригорлу колбу, температура дистиляту не досягала 78°С. Отриоснащену зверху мішалкою й лабораторною нагріману в результаті суспензію фільтрували при вальною банею з рециркуляцією. Суміш перемі60°С, і отриманий твердий залишок висушували у шували, і колбу нагрівали до 72°С. Через 3,0год. розчин фільтрували. Фільтрат потім нагрівали до вакуумній сушильній шафі протягом 24год., щоб одержати білий твердий продукт. Вихід був 91,1г 80°С і кип'ятили під зворотним холодильником (82,8%). протягом 1 години. Потім розчинник (760мл) видаЧистота, визначена за допомогою хроматогляли дистиляцією за атмосферного тиску. Потім рафа (частка у % за ВЕРХ), відповідала вмісту додавали ізопропіловий спирт (2200мл) і суспензію, охолоджену до температури менше 11°С, двонатрієвої солі a-(2,4-дисульфофенил)-N-третвідфільтровували і висушували у вакуумній субутилнитрону більше 99%. шильній шафі протягом 96год. для того, щоб одеПриклад 6 ржати білий продукт у твердому виді. Двонатрієва сіль a-(2,4-дисульфофеніл)-NЧистота, визначена за допомогою хроматогтрет-бутилнітрону (без добавки води) (масштаб рафа (частка у % за ВЕРХ), відповідала вмісту 100г) двонатрієвої солі a-(2,4-дисульфофенил)-N-третДвонатрієву сіль 4-форміл-1,3бутилнитрону 99%. бензолдисульфокислоти (100,0г, 0,32моль, 99,6% Приклад 4 масова частка) додавали в 1-літрову круглодонну колбу, оснащену магнітною мішалкою і нагрівальДвонатрієва сіль a-(2,4-дисульфофеніл)-Nним кожухом. Послідовно додавали метанол трет-бутилнітрону (масштаб 750г) (400мл) і ацетат N-трет-бутилгідроксіамонію (73,9г, Двонатрієву сіль 4-форміл-1,30,48моль, 1,5екв., 97,0% масова частка). Суміш бензолдисульфокислоти (750,0г, 2,32моль, 85,6% перемішували і нагрівали зі зворотним холодильмасова частка), ацетат N-третбутилгідроксиламонію (501,0г, 3,26моль, 1,4екв., ником. Через 6год. ВЕРХ-аналіз показав частку a91,6% масова частка), воду (150г) і метанол (2,4-дисульфофеніл)-N-трет-бутилнітрону 99,1%. (2530мл) додавали в 5-літрову опоряджену чохлом Реакційна суміш була білою суспензією. Потім тригорлу колбу при температурі навколишнього додавали ізопропіловий спирт (800мл), і суспензію середовища. Суміш розмішували і нагрівали до охолоджували до 2°С. Продукт відфільтровували з 72°С. Через 3,2год. ВЕРХ-аналіз показав, що завикористанням лійки Бюхнера, промивали ізопро 9 71653 10 піловим спиртом (200мл) і потім висушували у ваДвонатрієву сіль 4-форміл-1,3куумній сушильній шафі при 50°С протягом 7год. бензолдисульфокислоти (43кг) додавали при пеВихід був 88,0г (71,9%). Цей приклад показує, що ремішуванні до 500-літрового реактору, який місконденсацію можна проводити без додавання вотив ацетат N-трет-бутилгідроксиламонію (39кг), ди до реакційної суміші. воду (8,6л) та метанол (111кг) в інертній атмосфеПриклад 7 рі (азоту). С уміш перемішували і нагрівали при температурі кожуха 70°С. Після того, як темпераДвонатрієва сіль a-(2,4-дисульФоФеніл)-Nтрет-бутилнітрону (кількість 4600г) тура всередині досягла 60°С, нагрівання продовжували протягом ще 2-18 годин. Реакцію вважали Двонатрієву сіль 4-форміл-1,3закінченою, коли ВЕРХ-аналіз показав, що залибензолдисульфокислоти (4590,9г, 14,3моль, 98,0% шилося менше 0,3% двонатрієвої солі 4-формілмасова частка), ацетат N-трет1,3-бензолдисульфокислоти. Гарячий чистий розбутилгідроксиламонію (3988,4г, 24,6моль, 1,4екв., 97,0% масова частка), воду (760мл) і метанол чин переміщали через лінійний фільтр у др угий 50літровий реактор, попередньо підігрітий до 85°С. (12,6л) розмішували і нагрівали в 50-літровому Далі додавали ізопропіловий спирт (267кг), щоб реакторі при температурі рубашки 72°С. Через осадити продукт. Потім додавали воду (13,5л), і 60хв. кип'ятіння під зворотним холодильником рідину відстоювали протягом 12-18 годин. Білу ВЕРХ-аналіз показав, що реакція закінчилася (залишилося менше 0,3% двонатрієвої солі 4-формілсуспензію переносили до фільтрової сушилки, промивали ізопропіловим спиртом (2х71кг), потім 1,3-бензолдисульфокислоти). Гарячий прозорий висушували під вакуумом (у присутності слабкого розчин переносили через лінійний фільтр у другий потоку азоту) з температурою кожуха 80°С для 50-літровий реактор, попередньо підігрітий до отримання білого твердого продукту (43кг). 75°С. Після додаткового 30 хвилинного кип'ятіння під зворотним холодильником реактор охолоджуНеочікуване відкриття, що альдегід загальної формули (II) може безпосередньо реагувати з ацевали до 45°С додавали ізопропіловий спирт татом N-трет-бутилгідроксиламонію, робить цей (30,0л) при швидкості 1-2л/хвилину. Реакційну суфакт особливо вигідним. Вільна форма основи Nміш охолоджували до менше 30°С, фільтрували, трет-бутилгідроксиламін нестабільна, маючи тенпромивали ізопропіловим спиртом, далі висушували в сушильній шафі Грюнберга при 70°С протяденцію особливо піддаватися окисненню повітрям. Це виявлено утворенням синього забарвлення, що гом 47 годин, одержавши білий твердий продукт. вказує на присутність продукту окиснення, 2Вихід склав 81%. метил-2-нітрозопропану. Вільну основу N-третПриклад 8 бутилгідроксиламіну не можна тому легко зберігаДвонатрієва сіль a-(2,4-дисульфофеніл)-Nти, але треба виготовляти безпосередньо перед трет-бутилнітрону (кількість 4600г) Двонатрієву використанням в кожному випадку, коли це потрібсіль 4-форміл-1,3-бензолдисульфокислоти но. Це - потенційний недолік способів, що могли б (4598,9г, 14,4моль, 98,0% масова частка), ацетат вимагати обробки N-трет-бутилгідроксиламіну як N-трет-бутилгідроксиламонію (4000,0г, 24,6моль, вільної основи. Цей недолік починає особливо 98,0% масова частка), воду (750мл) і метанол спричиняти неприємності, коли реакцію проводять (12,6л) перемішували і нагрівали в 50-літровому у великому масштабі. Безпосереднє використання реакторі при температурі 75°С. Через 60хв. кип'я в цьому винаході ацетату N-треттіння під зворотним холодильником ВЕРХ-аналіз бутилгідроксиламіну дає вирішення цієї проблеми. показав, що реакція закінчилася (залишилося меБільше того, якщо в наведеному вище способі нше 0,2% двонатрієвої солі 4-форміл-1,3ацетат N-трет-бутилгідроксиламонію замінити інбензолдисульфокислоти). Гарячий прозорий розшими солями, наприклад, хлоридом N-третчин переносили через лінійний фільтр у другий 50бутилгідроксиламонію, реакція не буде перебігати літровий реактор, попередньо підігрітий до 75°С. задовільно. Після додаткового 30 хвилинного кип'ятіння під Мало того, що ацетат N-третзворотним холодильником додавали ізопропілобутилгідроксиламонію можна використовува ти в вий спирт (30,0л) зі швидкістю 1-2л/хвилину. Реакцьому винаході безпосередньо, але також і реакційну суміш охолоджували до менше 30°С, відфіція з альдегідом формули (II) протікає значно льтровували, промивали ізопропиловим спиртом швидше, ніж коли використовують вільну основу (2x8л), потім сушили в сушильній шафі Грюнберга N-трет-бутилгідроксиламіну. Таким чином, у цьому при 85°С протягом 23 годин, одержавши білий способі, реакція, як правило, завершується в метвердий продукт. Вихід склав 76%. жах 1,5 годин, навіть при кількості 5000г. Приклад 9 Двонатріева сіль a-(2,4-дисульфофеніл)-Nтрет-бутилнітрону (43кг) Комп’ютерна в ерстка О. Гапоненко Підписне Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for the preparation of a-(2,4-disulfophenyl)-n-tret-butylnitrone and salts thereof
Назва патенту російськоюСпособ получения a-(2,4-дисульфофенил)-n-трет-бутилнитрона и его солей
МПК / Мітки
МПК: C07C 291/00, C07C 303/00, C07C 309/00
Мітки: спосіб, солей, a-(2,4-дисульфофеніл)-n-трет-бутилнітрону, одержання
Код посилання
<a href="https://ua.patents.su/5-71653-sposib-oderzhannya-a-24-disulfofenil-n-tret-butilnitronu-ta-jjogo-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання a-(2,4-дисульфофеніл)-n-трет-бутилнітрону та його солей</a>
Попередній патент: Кладка коксової печі
Наступний патент: Пристрій для імпедансного акустичного каротажу
Випадковий патент: Спосіб визначення об'єму крововтрати під час вагінальних пологів









