Похідні 4-ароїл-3-r-6,7,8,9-тетрагідропіразоло[3,4-b]хінолін-5(4н)-онів
Номер патенту: 72341
Опубліковано: 10.08.2012
Автори: Бородіна Вікторія Василівна, ЛІПСОН ВІКТОРІЯ ВІКТОРІВНА, Петрова Олеся Миколаївна, Замігайло Лалі Лаврентіївна
Формула / Реферат
Похідні 4-ароїл-3-R-6,7,8,9-тетрагідропіразоло[3,4-b]хінолін-5(4H)-онів загальної формули:
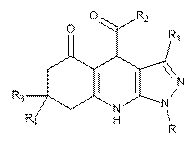 ,
,
де R=Н, R1=R3=Me: R2=Ph; 4-СlС6Н4; 4-BrC6H4; 4-NO2C6H4; R1=Ph, R2=4-MeOC6H4; R1=4-MeC6H4: R2=4-ClC6H4; 4-BrC6H4; 4-FC6H4; R3=R=H: R1=Me: R2=4-BrC6H4; 4-FC6H4; R=Me, R2=4-FC6H4; R=Ph, R2=4-BrC6H4; 4-FC6H4; R=H: R1=(CO)NHPh, R2=4-ClC6H4; R1=(CO)NH-3-Me-C6H4: R2=Ph; 4-MeOC6H4; R1=(CO)NH-3-F-C6H4: R2=4-MeOC6H4.
Текст
Реферат: Похідні 4-ароїл-3-R-6,7,8,9-тетрагідропіразоло[3,4-b]хінолін-5(4H)-онів загальної формули: , де R=Н, R1=R3=Me: R2=Ph; 4-СlС6Н4; 4-BrC6H4; 4-NO2C6H4; R1=Ph, R2=4-MeOC6H4; R1=4-MeC6H4: R2=4-ClC6H4; 4-BrC6H4; 4-FC6H4; R3=R=H: R1=Me: R2=4-BrC6H4; 4-FC6H4; R=Me, R2=4-FC6H4; R=Ph, R2=4-BrC6H4; 4-FC6H4; R=H: R1=(CO)NHPh, R2=4-ClC6H4; R1=(CO)NH-3-Me-C6H4: R2=Ph; 4MeOC6H4; R1=(CO)NH-3-F-C6H4: R2=4-MeOC6H4. UA 72341 U (12) UA 72341 U UA 72341 U 5 10 15 20 25 30 35 40 Корисна модель належить до галузі органічної хімії та стосується нових речовин - похідних 4-ароїл-3-R-6,7,8,9-тетрагідропіразоло[3,4-b]хінолін-5(4H)-онів. Ці похідні можуть бути напівпродуктами синтезу біологічно активних сполук, які утворюються в результаті хімічної трансформації кето- і вторинних аміногруп. Серед похідних піразоло[3,4-b]хінолінів виявлені сполуки з протипухлинною та противірусною активністю[1-3]. Спосіб побудови хінолінового фрагмента у складі тетрагідропіразоло[3,4-b]хінолін-5-онів найчастіше ґрунтується на реакціях 3-заміщених 5-амінопіразолів з 1,3-біелектрофільними сполуками на основі циклогексанонів або їх синтетичними попередниками або еквівалентами [4, 4 5]. Але наявність у молекулі названого аміноазолу, окрім аміногрупи, ендоциклічних N та С нуклеофільних центрів уможливлює утворення на його основі не лише піразоло[3,4b]хінолінової, а й піразоло[5,1-b]хіназолінової системи. До того ж, у разі використання несиметричних біелектрофілів не виключено утворення суміші ароїлзаміщених піразоло[3,4-b]- та -[3,4-с]хінолінонів або піразоло[5,1-b]- та [1,5а]хіназолінонів [4, 5]. Альтернативний шлях до частково гідрогенізованих піразоло[3,4-b]хінолін5-онів, пов'язаний із утворенням азольного фрагмента на основі вже існуючої хінолінонової системи є значно менш застосованим з причин низької доступності придатних для цього тетрагідроамінохінолінонів. Отже, актуальним є виявлення таких 1,3-біелектрофільних компонентів циклоконденсації, які б забезпечували регіоселективність у формуванні піразоло[3,4-b]хінолін-5-онової системи. Задачею корисної моделі є одержання похідних 4-ароїлтетрагідро-піразоло[3,4-b]хінолін-5ону як потенційно біологічно активних сполук або напівпродуктів їх синтезу, придатних для створення нових лікарських препаратів. Поставлена задача вирішується тим, що синтезують похідні 4-ароїл-3-R-6,7,8,9тетрагідропіразоло[3,4-b]хінолін-5(4H)-онів загальної формули: , де R=Н, R1=R3=Me: R2=Ph; 4-СlС6Н4; 4-BrC6H4; 4-NO2C6H4; R1=Ph, R2=4-MeOC6H4; R1=4MeC6H4: R2=4-ClC6H4; 4-BrC6H4; 4-FC6H4; R3=R=H: R1=Me: R2=4-BrC6H4; 4-FC6H4; R=Me, R2=4FC6H4; R=Ph, R2=4-BrC6H4; 4-FC6H4; R=H: R1=(CO)NHPh, R2=4-ClC6H4; R1=(CO)NH-3-Me-C6H4: R2=Ph; 4-MeOC6H4; R1=(CO)NH-3-F-C6H4: R2=4-MeOC6H4 Технічний результат - розширення спектру сполук, які можуть бути використані у створенні ліків. Зазначені сполуки одержують шляхом трикомпонентної конденсації 3(5)-амінопіразолів з гідратами арилгліоксалів і 1,3-циклогексанонами при нагріванні у середовищі розчинника, зокрема, у спиртах або воді. У результаті каскадного перебігу цієї реакції утворюється 1,3біелектрофільна сполука - ароїл метилен похідна 1,3-циклогександіону, циклоконденсація якої з 3(5)-амінопіразолами є регіоселективною і приводить виключно до утворення тетрагідропіразоло[3,4-b]хінолін-5(4H)-онів. Спосіб одержання похідних 4-ароїл-3-R-6,7,8,9-тетрагідропіразоло[3,4-b]хінолін-5(4H)-онів ілюструється схемою: , де R=Н, R1=R3=Me: R2=Ph; 4-ClC6H4; 4-BrC6H4; 4-NO2C6H4; R1=Ph, R2=4-MeOC6H4; R1=4MeC6H4: R2=4-ClC6H4; 4-BrC6H4; 4-FC6H4; R3=R=H: R1=Me: R2=4-BrC6H4; 4-FC6H4; R=Me, R2=4 1 UA 72341 U 5 10 15 20 25 30 35 40 45 50 55 60 FC6H4; R=Ph, R2=4-BrC6H4; 4-FC6H4; R=H: R1=(CO)NHPh, R2=4-ClC6H4; R1=(CO)NH-3-Me-C6H4: R2=Ph; 4-MeOC6H4; R1=(CO)NH-3-F-C6H4: R2=4-MeOC6H4. 1 Хімічну будову синтезованих сполук доведено ЯМР Н, IЧ, мас-спектрами. Приклад 1. 4-(4-Фторобензоїл)-3-метил-6,7,8,9-тетрагідро-1H-піразоло-[3,4-b]хінолін-5(4H)-он. Суміш 0,12 г (1 ммоль) циклогександіону, 0,1 г (1 ммоль) 5-аміно-3-метил-1H-піразолу та 0,17 г гідрату и-фторофенілгліоксалю у 8 мл етанолу кип'ятять протягом 1 год. Осад цільової сполуки відфільтровують і промивають на фільтрі етанолом. Вихід 0,24 г (73 %), т. пл. 221-223 °С. 1 1 Спектр ЯМР Н, (ДМСО-d6, 200 МГц) δ, м.ч.: 11,87 (р.с, 1Н, N Hпip), 9,88 (р.с, 1Н, NH), 8,05-7,98 (д.д, 2Н, 2o-Ar, J 8,4), 7,28 (т, 2Н, 2м-Аr, J 88), 5,38 (с, 1H, СН), 2,51 (р.с, 2Н, СН2), 2,27-2,00 (м, 2Н, СН2), 1,83-1,71 (м, 5Н, СН2+Ме). Визначено, %: С 66,54; Н 5,03; N 12,98. C18H16FN3O2. Розраховано, %: С 66,45; Н 4,96; N 12,92. Приклад 2. 4-(4-Фторобензоїл)-1,3-диметил-6,7,8,9-тетрагідро-1H-піразоло[3,4-b]хінолін-5(4H)-он. Суміш 0,12 г (1 ммоль) циклогександіону, 0,11 г (1 ммоль) 1,3-диметил-1H-піразол-5-аміну та 0,17 г гідрату n-фторофенілгліоксалю у 8 мл етанолу кип'ятять протягом 1 год. Осад цільової сполуки відфільтровують та промивають на фільтрі етиловим спиртом. Вихід 0,25 г (75 %), т. пл. 256-258 1 °С. Спектр ЯМР Н, (ДМСО-d6, 200 МГц) δ, м.ч.: 9.63 (р.с, 1H, NH), 8,07-8,03 (д.д, 2Н, 2o-Ar, J 8,4), 7,20 (т, 2Н, 2м-Аr, J 8,4), 5,40 (с, 1Н, СН), 3,62 (с, 3Н, N-Me), 2,62-2,57 (м, 2Н, СН2), 2,242,19 (м, 2Н, СН2), 1,97-1,95 (м, 2Н, СН2), 1,58 (м, 3Н, Me). Визначено, %: С 67,31; Н 5,23; N 12,29. C19H18FN3O2. Розраховано, %: С 67,24; Н 5,25; N 12,38. Приклад 3. 4-(4-Фторобензоїл)-1,3-диметил-6,7,8,9-тетрагідро-1H-піразоло[3,4-b]хінолін-5(4H)-он. Суміш 0,12 г (1 ммоль) циклогександіону, 0,11 г (1 ммоль) 1,3-диметил-1H-піразол-5-аміну та 0,17 г гідрату n-фторофенілгліоксалю у 10 мл води перемішують при 35-40 °С 3 год. до утворення білого осаду цільової сполуки, який відфільтровують та промивають на фільтрі етиловим спиртом. Вихід 0,23 г (69 %), т. пл. 256-258 °С. Приклад 4. 4-(4-Бромобензоїл)-3-метил-1-феніл-6,7,8,9-тетрагідро-1H-піразоло[3,4-b]хінолін-5(4H)-он. Суміш 0,12 г (1 ммоль) циклогександіону, 0,17 г (1 ммоль) 3-метил-1-феніл-1H-піразол-5-аміну та 0,23 г гідрату n-бромофенілгліоксалю у 10 мл етанолу кип'ятять протягом 1,5 год. Після охолодження розчину фільтрують осад цільової сполуки, який промивають на фільтрі етанолом. 1 Вихід 0,31 г (68 %), т. пл. 212-214 °С. Спектр ЯМР Н, (ДМСО-d6, 200 МГц) δ, м.ч.: 9,55 (р.с, 1Н, NH), 8,01 (д, 2Н, 8, 2o-Ar, J 8,2), 7.73 (д, 2Н, 8, 2o-Ar, J 8,2), 7,61-7,39 (м, 5Н, Ph), 5,57 (с, 1Н, СН), 2,60-2,52 (м, 2Н, СН2), 2,30-2,11 (м, 2Н, СН2), 1,86-1,77 (м, 2Н, СН2), 1,68 (м, 3Н, Me). Визначено, %: С 62,31; Н 4,33; N 9,12. C24H20BrN3O2. Розраховано, %: С 62,35; Н 4,36; N 9,09. Приклад 5. 4-Бензоїл-3,7,7-триметил-6,7,8,9-тетрагідро-1H-піразоло[3,4-b]хінолін-5(4H)-он. Суміш 0,14 г (1 ммоль) димедону, 0,1 г (1 ммоль) 5-аміно-3-метил-1H-піразолу та 0,16 г гідрату фенілгліоксалю у 7 мл етанолу кип'ятять протягом 2 год. Розчин охолоджують і відфільтровують осад цільової сполуки, який промивають на фільтрі етанолом. Вихід 0,27 г (82 %), т. пл. 198-200 1 7 °С. Спектр ЯМР Н, (ДМСО-d6, 200 МГц) δ, м.ч.: 11.86 (р.с, 1Н, N Hпip), 9,83 (р.с, 1H, NH), 7,89 (д, 2Н, 2o-Ph, J 6,8), 7,51-7,45 (м, 3Н, n-Рh+2м-Ph), 5,36 (с, 1Н, СН), 2,42-1,86 (м, 4Н, 2СН2), 1,70 (с, 3Н, Мепір), 0,99 (с, 3Н, Me), 0,88 (с, 3Н, Me). Визначено, %: С 71,54; Н 6,38; N 12,48. C20H21N3O2. Розраховано, %: С 71,62; Н 6,31; N 12,53. Приклад 6. 4-(4-Метоксибензоїл-7,7-диметил-3-феніл-6,7,8,9-тетрагідро-1H-піразоло[3,4-b]хінолін-5(4H)он. Суміш 0,14 г (1 ммоль) димедону, 0,16 г (1 ммоль) 5-аміно-3-феніл-1H-піразолу та 0,18 г гідрату n-метоксифенілгліоксалю у 8 мл етанолу кип'ятять протягом 1,5 год. Після охолодження розчину відфільтровують осад цільової сполуки, який промивають на фільтрі етанолом. Вихід 1 0,19 г (45 %), т. пл. 288-290 °С. Спектр ЯМР Н, (ДМСО-d6, 200 МГц) δ, м.ч.: 12.47 (р.с, 1H, 1 N Hпip), 10.00 (р.с, 1Н, NH), 7.74 (д, 2Н, 2м-Аr, J 8,2), 7,35-7,17 (м, 5Н, 2о-+n-+2м-Рh), 5,77 (с, 1Н, СH), 3,73 (с, 3Н, ОМе), 2,54-1,91 (м, 4Н, 2СН2), 1,01 (с, 3Н, Me), 0,90 (с, 3Н, Me). Визначено, %: С 73,12; Н 5,94; N 9,88. C26H25N3O3. Розраховано, %: С 73,05; Н 5,89; N 9,83. Приклад 7. 4-(4-Хлоробензоїл)-7,7-диметил-3-(n-толіл)-6,7,8,9-тетра-гідро-1H-піразоло[3,4-b]хінолін5(4H)-он. Суміш 0.14 г (1 ммоль) димедону, 0.17 г (1 ммоль) 3-(n-толіл)-1H-піразол-5-аміну та 0,19 г гідрату n-хлорофенілгліоксалю у 10 мл етанолу кип'ятять протягом 1,5 год. Розчин охолоджують та відфільтровують осад цільової сполуки, кристалізують з етилового спирту. 1 Вихід 0,28 г (63 %), т. пл. 294-296 °С. Спектр ЯМР Н, (ДМСО-d6, 200 МГц) δ, м.ч.: 12,42 (р.с, 1Н, 2 UA 72341 U 1 5 10 15 20 N Hпip), 10,02 (р.с, 1H, NH), 7,63 (д, 2Н, 2o-Ar, J 8,4), 7,26 (д, 2Н, 2м-Ar, J 8,8), 7,13 (д, 2Н, 2м-Тоl, J 7,4), 6,90 (д, 2Н, 2o-Tol, J 7,8), 5,74 (с, 1Н, СН), 2,48-1,93 (м, 7Н, 2СН2+МеТоl), 1,02 (с, 3Н, Me), 0,91 (с, 3Н, Me). Визначено, %: С 69,97; Н 5,51; N 9,38. C26H24ClN3O2. Розраховано, %: С 70,03; Н 5,42; N 9,42. Література 1. Пат. 101955480 (A) CN, МПК А61K 31/4745; А61Р 35/00; C07D 471/04. Pyrazolo[3,4b]quinoline compound and preparation method thereof / Yanfang Wu; Limin Yang; Xinsheng Wang; Heming Zhang; Yanyan Yin (CN); Xinxiang Medical University (CN). - № CN20101110807; Заявл. 28.01.10; Опубл. 26.01.11, www.ep.esp@cenet.com. 2. Пат. 2006041900 (А2) WO, МПК А61K 31/4745; C07D 471/02. Substituted N-aryl-1Hpyrazolo[3,4-b]quinoline-4-amines and analogs as activators of caspases and inducers of apoptosis / Zhang Han-Zhong (US); Cai Sui Xiong (US); Drewe John A (US); Cytovia Inc (US); Zhang Han-Zhong (US); Cai Sui Xiong (US). - № WO2005US35793; Заявл. 07.10.04; Опубл. 06.10.06, www.ep.esp@cenet.com. 3. Пат. 4920128 US, МПК C07D 471/04; A61K 31/415; A61K 31/435. Pyrazolo[3,4-b]quinolines and their use as antiviral agents / Bell M. R. (US); Ackerman J.H. (US); Sterling Drug Inc. (US); - № US 19880196598; Заявл. 08.07.87; Опубл. 20.05.88, www.ep.esp@cenet.com. 4. Anwar H.F., Elnagdi M.H. Recent developments in aminopyrazole chemistry // Arkivoc - 2009. Vol. (i). - P. 198-250. 5. Jachak M.N., Avhale A.B., Medhane V.J., Toche R.B. J. Heterocycl. Chem. - 2006. - Vol. 43. P. 1169. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 25 Похідні 4-ароїл-3-R-6,7,8,9-тетрагідропіразоло[3,4-b]хінолін-5(4H)-онів загальної формули: 30 , де R=Н, R1=R3=Me: R2=Ph; 4-СlС6Н4; 4-BrC6H4; 4-NO2C6H4; R1=Ph, R2=4-MeOC6H4; R1=4-MeC6H4: R2=4-ClC6H4; 4-BrC6H4; 4-FC6H4; R3=R=H: R1=Me: R2=4-BrC6H4; 4-FC6H4; R=Me, R2=4-FC6H4; R=Ph, R2=4-BrC6H4; 4-FC6H4; R=H: R1=(CO)NHPh, R2=4-ClC6H4; R1=(CO)NH-3-Me-C6H4: R2=Ph; 4MeOC6H4; R1=(CO)NH-3-F-C6H4: R2=4-MeOC6H4. Комп’ютерна верстка Л.Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 3
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of 4-aroyl-3-r-6,7,8,9-tetrahydropyrazolo[3,4-b]quinoline-5(4h)-ones
Автори англійськоюLipsonViktoria Viktorivna, Borodina Viktoria Vasylivna, Zamihailo Lali Lavrentiivna, Petrova Olesia Mykolaivna
Назва патенту російськоюПроизводные 4-ароил-3-r-6,7,8,9-тетрагидропиразоло[3,4-b]хинолин-5(4н)-онов
Автори російськоюЛипсон Виктория Викторовна, Бородина Виктория Васильевна, Замигайло Лали Лаврентьевна, Петрова Олеся Николаевна
МПК / Мітки
МПК: C07D 401/00
Мітки: 4-ароїл-3-r-6,7,8,9-тетрагідропіразоло[3,4-b]хінолін-5(4н)-онів, похідні
Код посилання
<a href="https://ua.patents.su/5-72341-pokhidni-4-arol-3-r-6789-tetragidropirazolo34-bkhinolin-54n-oniv.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-ароїл-3-r-6,7,8,9-тетрагідропіразоло[3,4-b]хінолін-5(4н)-онів</a>
Попередній патент: Ультразвуковий медичний інструмент
Наступний патент: Гідродинамічний кавітаційний активатор
Випадковий патент: Жаростійка феритна сталь









