Спосіб одержання 5-(о-аміноаніліно)-3-арилпіразолів
Номер патенту: 75942
Опубліковано: 15.06.2006
Автори: Дзвінчук Ігор Борисович, Лозинський Мирон Онуфрійович
Формула / Реферат
Спосіб одержання 5-(о-аміноаніліно)-3-арилпіразолів загальної формули 1:
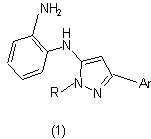 ,
,
де при R = Ph, Аr = 4-NO2С6Н4 (а), 3,4,5-(СН3О)3С6Н2 (б), 4-СН3ОС6Н4 (в), 2-тієніл (г);
а при Ar = Ph, R = Ph (д), 4-NO2С6Н4 (е), 3-СlС6Н4 (є), 4-СН3С6Н4 (ж), CH2CH2CN (з),
який відрізняється тим, що взаємодією гідразонів 2-ароїлметил-1Н-бензімідазолів із трифторацетангідридом отримують 5-(о-трифторацетаміноаніліно)-3-арилпіразоли загальної формули 2
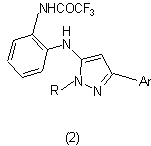 ,
,
які потім дезацилюють.
Текст
Спосіб одержання 5-(о-аміноаніліно)-3арилпіразолів загальної формули 1: NH2 NHCOCF3 H N R N N Ar N Ar , C2 N (11) UA активований атом галогену [17]. Наведені в хімічних та патентних виданнях методи одержання анілінопіразолів не є універсальними. Вони мають певні препаративні обмеження і можуть бути використані лише для синтезу окремих типів сполук. Зокрема, переважна більшість з них не придатна для одержання 5анілінопіразолів, що містять в о-положенні анілінового фрагменту аміногрупу і можуть бути цінними реагентами для подальшої структурної модифікації молекули. Відомий лише один метод [18], за яким отримано 5-(о-аміноаніліно)піразоли. Ця розробка найбільш близька по суті та одержаним результатам і вибрана нами за аналог. Вона базується на двухстадійному хімічному перетворенні, що включає взаємодію 4-феніл-1,5-бензодіазепін-2-ону і Р2S5 з утворенням тіопохідного, який потім при взаємодії з гідразином рециклізується і дає 5-(оаміноаніліно)-3-фенілпіразол. Вихід тіопохідного в першоджерелі не вказаний, вихід продуктів другої стадії становить 75%. (19) Винахід відноситься до органічної хімії, зокрема до методів синтезу анілінопіразолів, а саме до нового, загального способу одержання раніше практично невідомих 5-(о-аміноаніліно)-3арилпіразолів, які можуть знайти застосування в техніці, медицині, сільському господарстві, а також як вихідні речовини для синтезу різних типів піразоломістких сполук. Анілінопіразоли широко використовуються в органічному синтезі, оскільки серед них знайдено дисперсні барвники [1], антиоксиданти для полімерів [2], антипірени [3], пестициди [4, 5], регулятори росту рослин [6], імунодепресанти [7] та протизапальні засоби [8]. Для одержання анілінопіразолів використовують різноманітні методи: N-арилювання амінопіразолів [3], конденсацію піразолонів з аніліном [9], циклоконденсацію ацилтіоацетанілідів або їх похідних із гідразинами [9-13], ре-циклізацію 2-аніліно1,3,5-тіадіазинів [14], гідразинолізну рециклізацію 3-аніліно-1,2-дитіолів [15], взаємодію бісарилімідоїлхлоридів дихлормалонової кислоти з гідразином [16], взаємодію анілінів з піразолами, що містять 75942 (13) (1) де при R=Ph, Аr=4-NO2С6Н4 (а), 3,4,5-(СН3О)3С6Н2 (б), 4-СН3ОС6Н4 (в), 2-тієніл (г); а при Ar=Ph, R=Ph (д), 4-NO2С6Н4 (е), 3-СlС6Н4 (є), 4-СН3С6Н4 (ж), CH2CH2CN (з), який відрізняється тим, що взаємодією гідразонів 2-ароїлметил-1Н-бензімідазолів із трифторацетангідридом отримують 5-(отрифторацетаміноаніліно)-3-арилпіразоли загальної формули 2 (2) , які потім дезацилюють. H N R 2 3 75942 Ph Ph NH2 H H N N R P2S5 N O H R H N N2H4 R R=H, CH3 N R R S R H H N N Ph Недоліком цього методу є те, що він має вузькі препаративні можливості і не може бути застосований для одержання 5-(о-аміноаніліно)-3-арилпіразолів, заміщених по піразольному атому азоту в положенні 1. Задачею винаходу є розробка простого, загального методу синтезу 5-(о-аміноаніліно)-3арилпіразолів, який дозволяє широко варіювати природу замісників в 3-арильному фрагменті та в положенні 1. Поставлена задача досягається двухстадійним перетворенням, що виходить із гідразонів 2ароїлметил-1Н-бензімідазолів. На першій стадії ці сполуки рециклізуються при взаємодії з трифтороцтовим ангідридом із утворенням 1-заміщених 5(о-трифторацетаміноаніліно)-3-арилпіразолів 2а-з, які містять ацильну групу, що легко знімається. На другій стадії проводять дезаци-лювання основою, зокрема гідразином, з утворенням цільових продуктів 1а-з. Виходи 5-(о-трифторацетаміноаніліно)-3арилпіразолів 2а-з 70-95%, а 5-(о-аміноаніліно)-3арилпіразолів 1а-з 85-99%. Загальний вихід цільових сполук становить 68-91%. H NH2 NHCOCF3 Ar N N HN R N (CF3CO)2O H N R N N2H4 H N R N N Ar N Ar 2а-з 1а-з 1,2, при R-Ph Ar=4-NO2C6H4 (а), 3,4,5(СН3О)3С6Н2 (б), 4-СН3ОС6Н4 (в), 2-тієніл (г); а при Ar=Ph R=Ph (д),4-NO2C6H4 (е), 3-СlС6Н4 (є), 4-СН3С6Н4 (ж), СН2СН2СN (з) Загальна методика одержання 5-(отрифторацетаміноаніліно)-3-арилпіразолів (2а-з). До суспензії 2ммоль відповідного гідразону 2ароїлметил-1Н-бензімід-азолу в 2,0мл безводного діоксану при охолодженні на водяній бані (2025°С) і перемішуванні добавляють краплями 0,42мл (3ммоль) трифторацетан-гідриду на протязі 3-4хв. Розчин витримують 1год при 20-25°С, а потім розбавляють сумішшю 1мл 20%-го водного розчину амоніаку і 3мл води. Суміш підігрівають при перемішуванні до повної кристалізації масла, що виділилось. Якщо кристалізація не відбувається, реакційну суміш упарюють до ½ об'єму, відганяючи діоксан, і розбавляють 2мл 2-пропанола. Після остигання осад відфільтровують, промивають охолодженою сумішшю води і 2-пропанолу (1:1), сушать при 90°С і кристалізують із толуолу. Загальна методика одержання 5-(отрифторацетаміноаніліно)-3-арилпіразолів (1а-з). До суміші 0,3г відповідної сполуки 2а-з і 1,5мл метанолу, що нагрівають на бані при 95-100°С, добавляють 0,3мл 80%-го гідразингідрату. Суміш кип'ятять 30хв і розбавляють при перемішуванні 1,5мл води. Якщо продукт виділяється у вигляді масла, добавляють 0,5мл діетилового естеру. Після остигання осад відфільтровують, промивають сумішшю метанолу і води (1:1), сушать 5год при 100°С. Продукти утворюються в аналітично чистому стані. Винахід ілюструється наступними прикладами. 4 Приклад 1 Одержання 5-(о-трифторацетаміноаніліно)-3(4-нітрофеніл)-1-фенілпіразолу (2а). Синтезують із 0,74г (2ммоль) фенілгідразону 2-(4-нітрофенацил)-1Н-бензімідазолу за загальною методикою. Вихід 0,85г (90%), т. топл. 229-230,5 С. Знайдено %: С 59,02; Н 3,49; N 14,89. C22H16F3N5О3. Вирахувано %: С 59,10; Н 3,45; N 14,98. ІЧ спектр (KBr): 1700 (C=О), 3265, 3425 (NH). Спектр ЯМР 1Н (ДМСО-d6): 6,76 (1Н, с, 4-Н), 6,88-6,93 (2Н, м, 2-СF3СОNНС6Н4: 4-, 6-H), 7,137,18 (1Н, м, 2-СF3СОNHC6Н4: 5-Н), 7,21 (1Н, д, J=7,8 Гц, 2-СF3СОNНС6Н4: 3-Н), 7,35-7,40 (1Н, м, n-протон Ph), 7,45-7,50 (2Н, м, м-протони Ph), 7,70 (2Н, д, J-7,8 Гц, о-протони Ph), 7,83 (1H, с, NHHet), 8,15 i 8,29 (2х 2Н, 2д, J-9,0 Гц, 4-NO2C6H4), 10,76 (1H, с, NHCO). Приклад 2 Одержання 5-(о-трифторацетаміноаніліно)-3(3,4,5-триметокси-феніл)-1-фенілпіразолу (2б). Синтезують із 0,84г (2ммоль) фенілгідразону 2-(3,4,5-триметоксифен-ацил)-1Н-бензімідазолу за загальною методикою. Вихід 0,82г (80%), т. топл. 197-198,5 С. Знайдено %: С 60,85; H 4,45; N 10,78. С236Н23F3N4O4. Вирахувано %: С 60,94; H 4,52; N 10,93. ІЧ спектр (KBr): 1725 (C=O), 3300, 3425 (NH). Спектр ЯМР 1Н (ДМСО-d6): 3,69 (3Н, с, ОСН3), 3,84 (6Н, с, 2 ОСН3), 6,68 (1H, с, 4-Н), 6,816,89 (2Н, м, 2-СF3СОNНС6Н4: 4-, 6-Н), 7,11-7,16 (1H, м, 2-СF3СONНС6Н4: 5-Н), 7,15 (2Н, с, С6Н3), 7,18 (1H, д, J=6,9Гц, 2-CF3CONHC6H4: 3-Н), 7,317,36 (1H, м, n-протон Ph), 7,43-7,48 (2Н, м, мпротони Ph), 7,69 (1H, с, NHHet), 7,74 (2Н, д, J-7,5 Гц, о-протони Ph), 10,74 (lH,c,NHCO) Приклад 3 Одержання 5-(о-трифторацетаміноаніліно)-3(4-метоксифеніл)-1-фенілпіразолу (2в). Синтезують із 0,71г (2ммоль) фенілгідразону 2-(4-метоксифенацил)-1Н-бензімідазолу за загальною методикою. Вихід 0,69г (76%), т. топл. 129130,5°С. Знайдено %: С 63,48; H 4,18; N 12,15. С24Н19F3N4O2. Вирахувано %: С 63,71; H 4,23; N 12,38. ІЧ спектр (KBr): 1690, 1715 (С=O), 3300, 3340 (NH). Спектр ЯМР 1Н (ДМСО-d6): 3,80 (3Н, с, ОСНз), 6,53 (1H, с, 4-Н), 6,79-6,88 (2Н, м, 2СF3СONНС6Н4: 4-, 6-Н), 6,99 i 7,80 (2х 2Н, 2д, J=8,7 Гц, 4-СН3ОС6Н4), 7,10-7,16 (1H, м, 2СF3СONНС6Н4: 5-Н), 7,18 (1H, д, J=7,5Гц, 2СF3СОNНС6Н4: 3-Н), 7,28-7,33 (1H, м, n-протон Ph), 7,41-7,46 (2Н, м, м-протони Ph), 7,74 (1H, с, NHHet), 7,75 (2Н, д, J=8,7Гц, о-протони Ph), 10,74 (1H, c, NHCO). Приклад 4 Одержання 5-(о-трифторацетаміноаніліно)-3(2-тієніл)-1-фенілпір-азолу (2г). Синтезують із 0,66 г (2ммоль) фенілгідразону 2-(2-тієнілметил)-1Н-бензімідазолу за загальною методикою. Вихід 0,66г (77%), т. топл. 135-136,5 С. Знайдено %: С 58,75; Н 3,46; N 13,01. С21Н15F3N4O8. Вирахувано %: С 58,87; Н 3,53; N 13,08. ІЧ спектр (КВr): 1700, 1730 (C=O), 3150, 3370, 3395 (NH). Спектр ЯМР 1Н (ДМСО-d6): 6,50 (1Н, с, 4-Н), 6,82-6,90 (2Н, м, 2-СF3СONНС6Н4: 4-, 6-Н), 7,10-7,14 (2Н, м, 2-СF3СОNHС6Н4: 5-Н + 2тиенил: 4-Н), 7,19 (1Н, д, J=7,8Гц. 2CF3CONHC6H4: 3-Н), 7,30-7,35 (1Н, м, n-протон 5 75942 6 Ph), 7,42-7,47 (2Н, м, м-протоны Ph), 7,47-7,51 (2Н, 7,24-7,63 (2х2Н, 2д, J-8,1 Гц, 4-МеС6Н4), 7,33 i 7,42 м, 2-тиенил: 3-, 5-Н), 7,71 (2Н, д, J=8,7Гц, о(1Н і 2Н, 2м, n- i м-протони Ph), 7,67 (1Н, с, протоны Ph), 7,74 (1Н, с, NHHet), 10,74 (1Н, с, NHHet), 7,87 (2Н, д, J-7,2Гц, о-протони Ph), 10,72 NHCO). (1H, с, NHCO). Приклад 5. Приклад 9 Одержання 5-(о-трифторацетаміноаніліно)Одержання 5-(о-трифторацетаміноаніліно)-31,3-дифенілпіразолу (2д). феніл-1-ціаноетил-піразолу (2з). Синтезують із 0,65г (2ммоль) фенілгідразону Синтезують із 0,61г (2ммоль) ціаноетилгідра2-фенацил-1Н-бензімід-азолу за загальною метозону 2-фенацил-1Н-бенз-імідазолу за загальною дикою. Вихід 0,68 г (81%), т. топл. 144-145 С. методикою. Вихід 0,67г (83%), т. топл. 152-153,5 С. Знайдено %: С 65,36; Н 4,18; N 13,18. С23Н17F3N4O. Знайдено %: С 60,12; Н 4,18; N 17,47. С20Н16F3N5О. Вирахувано %: С 65,40; Н 4,06; N 13,26. ІЧ спектр Вирахувано %: С 60,15; Н 4,04; N 17,54. ІЧ спектр (КВr): 1700 (С=O), 3200, 3280, 3600 (NH). Спектр (KBr): 1735 (CO), 2275 (C N), 3270, 3435 (NH). ЯМР 1Н (ДМСО-d6): 6,60 (1Н, с, 4-Н), 6,80 (1Н, д, Спектр ЯМР 1Н (ДМСО-d6): 3,05 (2Н, т, J=6,9Гц, J=7,8 Гц, 2-СF3СОNНС6Н4: 6-Н), 6,85 (1Н, м, 2CH2CN); 4,26 (2Н, т, J=6,6 Гц, CH2N); 6,49 (1H, с, 4СF3СОNНС6Н4: 4-Н), 7,12 (1Н, м, 2-СF3СОNНС6Н4: Н); 6,83 (1H, д, J=7,5 Гц, 2-CF3CONHC6H4: 6-Н); 5-Н), 7,18 (1Н, д, J=7,8Гц, 2-CF3CONHC6H4: 3-Н), 6,89 (1H, м, 2-СF3СОNНС6Н4: 4-Н); 7,17-7,23 (2Н, 7,29-7,36 (2Н, м, n-протони NPh і CPh), 7,41-7,46 м, 2-СF3СОNНС6Н4: 5-, 3-Н); 7,28-7,33 (1H, м, n(4Н, м, м-протони NPh і CPh), 7,75 (2Н, д, J=7,5Гц, протон Ph); 7,38-7,43 (2Н, м, м-протони Ph); 7,63 о-протони NPh), 7,77 (1Н, с, NH), 7,87 (2Н, д, J=6,9 (1H, с, NH); 7,81 (2Н, д, J=7,5Гц, о-протони Ph); Гц, о-протони CPh). 10,75 (1H, с, NHCO). Приклад 6 Приклад 10 Одержання 5-(о-трифторацетаміноаніліно)-1Одержання 5-(о-аміноаніліно)-3-(4(4-нітрофеніл)-3-фенілпіразолу (2е). нітрофеніл)-1-фенілпіразолу (1a). Синтезують із 0,74 г (2ммоль) 4Синтезують із 0,3г сполуки 2а за загальною нітрофенілгідразону 2-фенацил-ІН-бензімідазолу методикою. Вихід 0,22г (94%), т. топл. 200-201,5 С. за загальною методикою. Вихід 0,83г (92%), т. Знайдено %: С 67,76; Н 4,53; N 18,64. C21H17N5O2. топл. 203,5-205 С. Знайдено %: С 59,02; Н 3,49; N Вирахувано %: С 67,91; Н 4,61; N 18,86. ІЧ спектр 14,89. C23H16F3N5O3. Вирахувано %: С 59,10; Н (KBr): 3230, 3335, 3415 (NH). Спектр ЯМР 1Н 3,45; N 14,98. ІЧ спектр (KBr): 1700 (C=O), 3315 (ДМСО-d6): 4,87 (2Н, с, NH2), 6,40 (1H, с, 4-Н), 6,47(NH). Спектр ЯМР 1Н (ДМСО-d6): 6,72 (1Н, с, 4-Н), 6,53 (1H, м, 2-NH2C6H4: 4-Н), 6,69-6,79 (2Н, м, 26,78 (1Н, д, J=8,1Гц, 2-СF3СONНС6Н4: 6-Н), 6,89 NH2C6H4: 3-, 5-Н), 6,82 (1H, д, J=7,5Гц, 2-NH2C6H4: (1Н, м, 2-СF3СОNНС6Н4: 4-Н), 7,14 (1Н, м, 26-Н), 7,16 (1H, с, NH), 7,36-7,42 (1H, м, n-протон СF3СОNHС6Н4: 5-Н), 7,22 (1Н, д, J=7,8Гц, 2Ph), 7,49-7,54 (2Н, м, м-протони Ph), 7,60 (2Н, д, СF3СОNНС6Н4: 3-Н), 7,36-7,49 (3Н, м, n- i мJ=7,8Гц, о-протони Ph), 8,10 і 8,25 (2х2Н, 2д, J-9,0 протони Ph), 7,93 (2Н, д, J=7,2 Гц, о-протони Ph), Гц, n-NO2С6Н4). 8,11 (1Н, с, NHHet), 8,15 i 8,28 (2х 2Н, 2д, J=9,3 Гц, Приклад 11 4-NO2С6Н4), 10,80 (1Н, с, NHCO). Одержання 5-(о-аміноаніліно)-3-(3,4,5Приклад 7 триметоксифеніл)-1-феніл-піразолу (16). Одержання 5-(о-трифторацетаміноаніліно)-1Синтезують із 0,3г сполуки 26 за загальною (3-хлорфеніл)-3-фе-нілпіразолу (2є). методикою. Вихід 0,23г (94%), т. топл. 173-174,5 С. Синтезують із 0,72г (2ммоль) 4Знайдено %: С 69,08; Н 5,69; N 13,43. C24H24N4O3. нітрофенілгідразону 2-фенацил-1Н-бензімідазолу Вирахувано %: С 69,21; Н 5,81; N 13,45. ІЧ спектр за загальною методикою. Вихід 0,64 г (70%), т. (КВr): 3350, 3375, 3410 (NH). Спектр ЯМР 1Н топл. 125-126,5 'С. Знайдено %: С 60,44; Н 3,65; N (ДМСО-d6): 3,68 (3Н, с, ОСН3), 3,83 (6Н, с, 2 ОСН3), 12,19. С23Н16СlF3N4O. Вирахувано %: С 60,47; Н 4,81 (2Н, с, NH2), 6,37 (1Н, с, 4-Н), 6,46-6,52 (1Н, м, 3,53; N 12,26. ІЧ спектр (KBr): 1710 (C=O), 3200, 2-NH2С6Н4: 4-Н), 6,67-6,74 (2Н, м, 2-NН2С6Н4: 3-, 51 3300 (NH). Спектр ЯМР Н (ДМСО-d6): 6,54 (1Н, с, Н), 6,77 (1Н, д, J=7,5Гц, 2-NH2C6H4: 6-Н), 6,98 (1Н, 4-Н), 6,84 (1Н, д, J-8,1 Гц, 2-СF3СОNНС6Н4: 6-Н), с, NH), 7,10 (2Н, с, С6Н2), 7,32-7,37 (1Н, м, n-протон 6,90 (1Н, м, 2-СF3СОNНС6Н4: 4-Н), 7,15 (1Н, м, 2Ph, 7,46-7,51 (2Н, м, м-протон Ph), 7,71 (2Н, д, СF3СОNHС6Н4: 5-Н), 7,22 (1Н, д, J=7,5Гц, 2J=7,8Гц, о-протон Ph). СF3СОNНС6Н4: 3-Н), 7,33-7,88 (9Н, м, Ph + 3Приклад 12. СlС6Н4), 7,86 (1Н, с, NHHet), 10,73 (1Н, с, NHCO). Одержання 5-(о-аміноаніліно)-3-(4Приклад 8. метоксифеніл)-1-фенілпіразолу (1в). Одержання 5-(о-трифторацетаміноаніліно)-1Синтезують із 0,3г сполуки 2в за загальною (4-толіл)-3-фенілпір-азолу (2ж). методикою. Вихід 0,23г (99%), т. топл. 143,5-145 С. Синтезують із 0,68г (2ммоль) 4-толілгідразону Знайдено %: С 74,43; Н 5,75; N 15,89. C22H20N4O. 2-фенацил-1Н-бензімід-азолу за загальною метоВирахувано %: С 74,14; Н 5,66; N 15,72. ІЧ спектр дикою. Вихід 0,68г (77%), т. топл. 160-161,5 С. (КВr): 3340, 3395 (NH). Спектр ЯМР 1Н (ДМСО-d6): Знайдено %: С 66,12; Н 4,16; N 12,75. C24H19F3N4O. 3,75 (3Н, с, ОСН3), 4,82 (2Н, с, NH2), 6,22 (1Н, с, 4Вирахувано %: С 66,05; Н 4,39; N 12,84. ІЧ спектр Н), 6,45-6,50 (1Н, м, 2-NH2C6H4: 4-Н), 6,67-6,70 (2Н, (KBr): 1700 (C=O), 3285, 3425 (NH). Спектр ЯМР 1Н м, 2-NH2C6H4: 3-, 5-Н), 6,76 (1Н, д, J-7,8 Гц, 2(ДМСО-d6): 2,32 (3Н, с, СН3), 6,58 (1Н, с, 4-Н), 6,79 NH2C6H4: 6-Н), 6,97 i 7,75 (2хН, 2д, J=8,4Гц, n(1Н, д, J=7,8 Гц, 2-СF3СNНС6Н4: 6-Н), 6,85 (1Н, м, СН3ОС6Н4), 7,00 (1Н, с, NH), 7,29-7,34 (1Н, м, n2-СF3СОNHС6Н4: 4-Н), 7,13 (1Н, м, 2-СF3СNНС6Н4: протон Ph, 7,44-7,49 (2Н, м, м-протони Ph), 7,71 5-Н), 7,18 (1Н, д, J=7,8 Гц, 2-CF3CONHC6H4: 3-Н), (2Н, д, J=8,4Гц, о-протони Ph). 7 75942 8 Приклад 13 Гц, 2-NН2С6Н4: 6-Н), 6,95 (1H, с, NH), 7,27-7,33 (3Н, Одержання 5-(о-аміноаніліно)-3-(2-тієніл)-1м, n-протон Ph+МеС6Н4: 3-, 5-Н), 7,37-7,42 (2Н, м, фенілпіразолу (1г). м-протони Ph), 7,60 (2Н, д, J=8,1Гц, МеС6Н4: 2-, 6Синтезують із 0,3г сполуки 2г за загальною Н), 7,81 (2Н, д, J=7,2Гц, о-протони Ph). методикою. Вихід 0,22г (96%), т. топл. 165-166,5°С. Приклад 18 Знайдено %: С 68,49; Н 4,9; N 16,76. C19H16N4S. Одержання 5-(о-аміноаніліно)-3-феніл-1Вирахувано %: С 68,65; Н 4,85; N 16,85. ІЧ спектр ціаноетилпіразолу (1з). (КВr): 3360, 3380, 3465 (NH). Спектр ЯМР 1H Синтезують із 0,3г сполуки 2з за загальною (ДМСО-d6): 4,85 (2Н, с, NH2), 6,12 (1Н, с, 4-Н), 6,46методикою. Вихід 0,21г (85%), т. топл. 173-175°С. 6,51 (1Н, м, 2-NH2C6H4: 4-Н), 6,68-6,77 (2Н, м, 2Знайдено %: С 71,13; Н 5,75 N 23,02. C18H17N5. NH2C6H4: 3-, 5-Н), 6,79 (1Н, д, J=7,2Гц, 2-NH2C6H4: Вирахувано %: С 71,27; Н 5,65; N 23,09. ІЧ спектр 6-Н), 7,06-7,09 (2Н м, NH + 2-тієніл: 4-Н), 7,32-7,37 (КВr): 2270 (C N), 3285, 3350, 3440 (NH). Спектр (1Н, м, n-протон Ph, 7,41-7,51 (4Н, м, м-протони ЯМР 1Н (ДМСО-d6): 3,05 (2Н, т, J=6,9Гц, CH2CN); Ph+2-тієніл: 3-, 5-Н), 7,69 (2Н, д, J=8,1Гц, о4,30 (2Н, т, J=6,6 Гц, CH2N); 4,88 (2Н, с, NH2); 5,97 протони Ph). (1H, с, 4-Н); 6,51-6,56 (1H, м, 2-NH2C6H4: 4-Н); 6,71Приклад 14 6,72 (2Н, м, 2-NH2C6H4: 3-, 5-Н); 6,82 (1H, д, Одержання 5-(о-аміноаніліно)-1,3J=7,8Гц, 2-NH2C6H4: 6-Н); 7,13 (1H, с, NH); 7,24дифенілпіразолу (1д). 7,29 (1H, м, n-протон Ph); 7,34-7,39 (2Н, м, мСинтезують із 0,3г сполуки 2д за загальною протони Ph); 7,73 (2Н, д, J=7,2Гц, о-протони Ph). методикою. Вихід 0,22г (94%), т. топл. 156-157 С. Література: Знайдено %: С 77,16; Н 5,67 N 17,08. C21H17ClN4. 1. Amer F.A., Afsah E., Soafan M. Synthesis of 4, Вирахувано %: С 77,28; Н 5,56; N 17,16. ІЧ спектр 4'-Aryldihydrazono-3-(3'-pyridyl)-2-pyrazolin-4,5(КВr): 3350, 3380, 3460 (NH). Спектр ЯМР 1Н diones and 1-aryl-3-(3'-pyridil)-4,4'-arylbisazo-5(ДМСО-d6): 4,85 (2Н, с, NH2), 6,30 (1H, с, 4-Н), 6,45aryliminopyrazoles and their application as disazo 6,51 (1H, м, 2-NH2C6H4: 4-Н), 6,67-6,71 (2Н, м, 2disperse dyes // J. Chem. Technol. Biotechnol. NH2С6Н4: 3-, 5-Н), 6,76 (1H, д, J=8,1Гц, 2-NH2С6Н4: 1980. - Vol. 30. - P.78-84. 6-Н), 7,06 (1H, с, NH), 7,29-7,43 (4Н, м, n- i м2. Ger. (East) DD 149.231 (Сl. С08К5/34) 01 Jun протони CPh + м-протон NPh), 7,46-7,51 (2Н, м, м1981. Stabilizers for polymers, low-molecular-weight протони NPh), 7,73 (2Н, д, J=7,8 Гц, о-протони organic compounds, and oils / M. Schuiz, H. Krause, NPh), 7,83 (2Н, д, J=6,9Гц, о-протони CPh). L. Moegel, G. Neubert (VEB Leuna-Werke "Walter Приклад 15 Ulbricht"); Chem. Abst. - 1982. - Vol. 96: 53269h. Одержання 5-(о-аміноаніліно)-1-(43. Eur. Pat. Appl. EP 178,035 (Cl. C07D231/38) нітрофеніл)-3-фенілпіразолу (1e). 16 Apr 1986. Antiinflammatory 3-aminopyrazoles / Синтезують із 0,3г сполуки 2е за загальною R.A. Appleton, S.C. Burford, D.N. Hardem, D. методикою. Вихід 0,23г (99%), т. топл. 170-171,5°С. Wilkinson (Fisons PLC); Chem. Abst. - 1986. - Vol. Знайдено %: С 67,83; Н 4,55 N 18,69. С21Н17N5O2. 105: 427996f. Вирахувано %: С 67,91; Н 4,61; N 18,86. ІЧ спектр 4. Ger. Offen. DE 19,544,798 (Cl. C07D231/38) 5 (КВr): 3330, 3390, 3480 (NH). Спектр ЯМР 1H Jun 1997. Preparation of (ДМСО-d6): 4,94 (2Н, с, NH2), 6,28 (1H, с, 4-Н), 6,46anilinopyrazolethiocarbamates as pesticides / M. Heil, 6,51 (1H, м, 2-NH2С6Н4: 4-Н), 6,72-6,78 (3Н, м, 2C. Erdelen, U. Wachen-dorf(Bayer A.-G., Germany); NH2C6C4: 3-, 5-, 6-Н), 7,32-7,46 (4Н, м, NH+n- i мChem. Abst. - 1979. - Vol. 127: 65764n. протони Ph), 7,86 (2Н, д, J=7,2Гц, о-протони Ph), 5. Ger. Offen. 2,747,531 (Cl. C07D231/14) 26 8,10 і 8,34 (2х2Н, 2д, J=6,9Гц, n-С6H4). Apr 1979. Substituted 3-aminopyrazoles / P. Plath, B. Приклад 16 Wuerzer, W. Rohz (BASF A.-G.); Chem. Abst. - 1979. Одержання 5-(о-аміноаніліно)-3-феніл-1-(3- Vol. 91: 56998с. хлорфеніл)піразолу (1є). 6. Борисевич А.Н., Брагина А.Ш., Форсюк В.П., Синтезують із 0,3г сполуки 2є за загальною Домбровская Л.И. Синтез и рострегулирующее действие замещенных 1-ацилпиразола // Физиол. методикою. Вихід 0,23г (98%), т. топл. 109-110,5 С. акт. в-ва - 1977. - Вып. 9. - С.47-52. Знайдено %: С 69,73; Н 4,48 N 15,39. C21H17N5O2. 7. Papageorgiou C., Albert R., Floersheim P., Вирахувано %: С 69,90; Н 4,75; N 15,53. ІЧ спектр Lemaire M., Bitch F., Neber H.P., Andersen E., (КВк): 3370, 3455 (NH). Спектр ЯМР 1Н (ДМСО-d6): Hungerford V., Schreier M.H. Pyrazole bioisosteres of 4,86 (2Н, с, NH2), 6,23 (1H, с, 4-Н), 6,45-6,51 (1H, м, leflunoamide as B-Cell immunosuppressants for 2-NH2C6H4: 4-Н), 6,70-6,77 (3Н, м, 2-NH2C6H4: 3-, 5-, xenotransplantation and chronic rejution: scope and 6-Н), 7,21 (1H, с, NH), 7,30-7,84 (9Н, м, Ph + 3limitations // J. Med. Chem. - 1998. - Vol. 41. СlС6Н4). P.3530-3538. Приклад 17 8. Jpn. Kokai Tokkyo Koho JP Одержання 5-(о-аміноаніліно)-1-(4-толіл)-362,267,269[87,267,269] (Cl. C07D231/38) 19 Nov фенілпіразолу (1ж). 1987. 3-Aminopyrazole derivatives as Синтезують із 0,3г сполуки 2ж за загальною antiinflammatory agents and process for their методикою. Вихід 0,23г (98%), т. топл. 173-175°С. preparation / Fisons Corp. Jpn.; Chem. Abst. - 1987. Знайдено %: С 74,43; Н 5,75 N 16,29. C22H20N4. Vol. 109: 149523z. Вирахувано %: С 77,62; Н 5,92; N 16,46. ІЧ спектр 9. Борисевич А.Н., Пелькис П.С. Ариламиды (КВr): 3350, 3375, 3460 (NH). Спектр ЯМР 1Н замещенной тионуксусной кислоты. Взаимодейст(ДМСО-d6): 2,35 (3Н, с, СН3), 4,81 (2Н, с, NHh), 6,29 вие ариламидов моноацетилтионуксусной кислоты (1H, с, 4-Н), 6,45-6,50 (1Н, м, 2-NН3С6Н4: 4-Н), 6,66с нуклеофильными реагентами // ХГС. - 1969. 6,70 (2Н, м, 2-NH2C6H4: 3-, 5-Н), 6,75 (1H, д, J-7,8 9 75942 10 №2. - С.312-315. 15. Грабенко А.Д., Кулаева Л.Н. Исследования 10. Грабенко А.Д., Кулаева Л.Н. Синтез произв ряду замещенных ариламидов дитиокарбоновых водных пиразола из ариламидов тиокарбоновых кислот XV. Окисление ариламидов дитиомалонокислот // Укр. хим. журн. - 1977. - Т. 43. - С.170-173. вой кислоты в замещенные 1,2-дитиола // ХГС. 11. Schafer H., Gewald К. Substituted 41974. - №7. - С.924-927. nitropyrazoles from nitroketenaminals // J. Pract. 16. Шиванюк А.Ф., Дашковская Е.В., Роженко Chem. - 1981. - Vol. 323. - P.332-336. А.Б., Лозинский М.О., Онищук Н.П., Букреев А.И., 12. Ibrahim N.S. Reaction of isothiocianates with Дьяченко O.A., Атовмян Л.О. Бисарилимидоилхactive methilene reagent: a new approch for the лориды дихлормалоновой кислоты и их превраsynthesis ofpyrazole, pyrimidine and pyrazolo[l,5щения // ЖОХ. - 1990. - Т. 26. - С.1629-1638. a]pyrimidine derivatives // Chem. Ind. - 1989. - Vol. 17. Дзиомко В.М., Томсонс У.А., Рябокобылко 19. - P.654-655. Ю.С. Производные дибензо-[f,j]-5,1213. Abdou O.A., Hussein F.Z., Gaber S.M. дигидропиразоло[4,5-с:5',4'Utilization ofthiazolylacetonitriles in the synthesis m][1,2,5,8,9,12]гексаазатетрадецина первый ofthiophene, thiazole, pyrazolo[l,5-a]pyrimidine and представитель новой макрогетероциклической pyrazolo-[5,1-е] triazine derivatives // Heteroatom системы // ХГС. - 1976. -№7. -С.968-971. Chem. - 1999. - Vol. 10. - P.508-516. 18. Essassi E.M., Salem M. Synthese des 14. Pfeiffer W.-D., Dilk E., Bulka E. Uber die pyrazolyl-1-benzimidazoles a partir des dihydroRingverengerung von б-Н-1,3,4-thiadiazinen bei 1,3(2H)benzo[2,3-b]diazepine-l,5-jnes-2 //Bull. Soc. einwirkung von Basen // Synthesis - 1977. - Vol. 3. Chim. Belg. - 1985. - Vol. 94. - P.755-758. P. 196-198. Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for the preparation of 5-(о-aminoanilino)-3-arylpyrazoles
Автори англійськоюDzvinchuk Ihor Borysovych, Lozynskyi Myron Onufriovych, Lozynskyi Myron Onufriiovych
Назва патенту російськоюСпособ получения 5-(о-аминоанилино)-3-арилпиразолов
Автори російськоюДзвинчук Игорь Борисович, Лозинский Мирон Онуфриевич
МПК / Мітки
МПК: C07D 231/38
Мітки: 5-(о-аміноаніліно)-3-арилпіразолів, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/5-75942-sposib-oderzhannya-5-o-aminoanilino-3-arilpirazoliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5-(о-аміноаніліно)-3-арилпіразолів</a>
Попередній патент: Спосіб інкубації яєць при осцилюючій температурі
Наступний патент: Пристрій для виготовлення розгорток картонних паковань
Випадковий патент: Спосіб редукування безперервнолитих заготівок









