Похідні [1,3,4]оксадіазоло[2′,3′:2,3]піримідо[1,6-а]бензімідазолу та спосіб їх одержання
Номер патенту: 75785
Опубліковано: 15.05.2006
Автори: Чернега Олександр Миколайович, Дзвінчук Ігор Борисович, Лозинський Мирон Онуфрійович
Формула / Реферат
l. [l,3,4] Oксадіазоло [2',3':2,3]піримідо[1,6-а]бензімідазоли загальної формули:
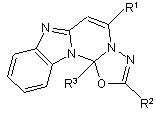 ,
,
де R1 = СН3;
R2 = Ar, Het;
R3 = СF3.
2. Спосіб одержання сполук за п. 1, який відрізняється тим, що ацилгідразони 2-ацетоніл-1Н-бензімідазолу піддають взаємодії з трифтороцтовим ангідридом при 15-20 0С в органічному розчиннику (наприклад, в діоксані) з подальшим виділенням цільових продуктів із розчинів звичайними методами.
Текст
l. [l,3,4] Oксадіазоло [2',3':2,3]піримідо[1,6а]бензімідазоли загальної формули: 2 де R1 = СН3; R2 = Ar, Het; R3 = СF3. 2. Спосіб одержання сполук за п. 1, який відрізняється тим, що ацилгідразони 2-ацетоніл-1Нбензімідазолу піддають взаємодії з трифтороцтовим ангідридом при 15-20 0С в органічному розчиннику (наприклад, в діоксані) з подальшим виділенням цільових продуктів із розчинів звичайними методами. R1 N N N N O , N N Вказані сполуки, їх властивості і застосування в науковій літературі та патентних виданнях не описані. Із найближчих структурних аналогів широко відомі і детально вивчені похідні піримідо[1,6а]бензімідазолу N (11) Винахід відноситься до органічної хімії, а саме до похідних нової гетероциклічної системи [1,3,4]оксадіазоло[2',3':2,3]піримідо[1,6а]бензімідазолу загальної формули: R1 N 75785 (13) R2 C2 R3 N R2 1 де R = СНз; R2 = Аr, Het; R3 = СF3 та до способу їх отримання. Сполуки нового типу можуть знайти застосування як фізіологічне активні препарати, аналітичні реагенти, а також як вихідні речовини для синтезу раніше невідомих сполук. N Похідні такої гетероциклічної системи проявляють бактерицидну [1], протизапальну [2-4], знеболюючу [4], антиамебну і антигельмінтну [5] активність, а також широко досліджуються як інгібітори деяких ферментів [6-10] та реагенти для виявлення нуклеїнової кислоти [11] або паладію (II) [12]. Для їх синтезу використовують звичайні в хімії гетероциклічних сполук методи добудови піримідинового кільця до бензімідазольного (наприклад реакцією 2-ціанометилбензімідазолу з ацилюючи UA N O (19) R3 3 75785 4 ми реагентами [13, 14]) або добудови бензімідазоБудова та склад всіх отриманих льного кільця до піримідинового (наприклад, цик[1,3,4]оксадіазоло[2',3':2,3]піримідо-[1,6лізацією піримі-дин-6-тіонів, заміщених в положена]бензімідазолів доведені даними елементного ні 1 о-амінофенільною групою [2-4]). Одначе аналізу, ІЧ спектрів (поглинання зв'язків С=С, C=N) розроблені раніше способи синтезу не дозволяють і ЯМР 1H. Будова відповідної 4-нітрофенілзаміотримувати сполуки нової героциклічної системи, щеної похідної однозначно встановлена також на що заявляється. основі рентгеноструктурно-го аналізу (див. фіг.). Метою винаходу є синтез нової гетероциклічВинахід ілюструється загальною методикою ної системи добудовою до бензімідазольного фраотримання похідних гменту відразу піримідинового та оксадіазольного [1,3,4]оксадіазоло[2',3':2,3]піримідо[1,6кілець, що відкриває шлях до сполук, які можуть а]бензімідазолу і наступними прикладами синтезу знайти практичне використання як фізіологічно їх окремих представників. активні препарати, аналітичні реагенти, а також як Загальна методика одержання похідних вихідні речовини у синтезі раніше невідомих типів [1,3,4]oкcaдiaзoлo[2',3':2,3]-піримідо[1,6сполук. а]бензімідазолу. Мета досягається До 5ммоль відповідного ароїлгідразону 2[1,3,4]оксадіазоло[2',3':2,3]піримідо[1,6-а]бензімідацетоніл-1Н-бензімідазолу в 2.5мл безводного азолами, що описуються, та розробкою способу їх діоксану при 15-20°С добавляють по краплям при отримання. перемішуванні 15ммоль трифтороцтового ангідриСпосіб отримання сполук, що заявляються, ду на протязі 2-3хв. Розчин, що утворився, витриполягає в тому, що ацилгід-разони 2-ацетоніл-1Нмують при зазначеній температурі 1 год, забезпебензімідазолу піддають взаємодії з трифтороцточивши ізоляцію від негативної дії атмосферної вим ангідридом при 15-20°С в органічному розчинвологи, а потім розбавляють при перемішуванні нику, наприклад, в діоксані. Продукти виділяють сумішшю 5мл 20%-го водного розчину амоніаку і після обробки реакційного розчину дією основи, 20мл води. Продукт виділяється у вигляді осаду наприклад, амоніаку. Виходи становлять 61-88%. або масла, які обробляють, як вказано в конкретR1 них прикладах. N 1 R N (CF3CO)2O Приклад 1. H N N Одержання 5-метил-2-(4-нітрофеніл)-12аN N H N N трифтормеR3 O тил[1,3,4]оксадіазоло[2',3':2,3]пipимiдo[16O R2 a]бeнзiмiдaзoлy. R2 Осад, що утворився при реакції 4де R1 = СН3; R2 = 4-NO2С6Н4, С6Н5, 43 нітробензоїлгідразону 2-ацетоніл-1Н-бензімідазолу Н3СОС6Н4, 2-тієніл, 4-піридил; R – СF3. за загальною методикою, відфільтровують, проТакий результат не є очікуваним, оскільки рамивають водою, сушать при 100°С і кристалізують ніше було встановлено [15], що близький за будоіз 1-бутанолу. Вихід 70%, т. топл. 220-220.5°С. вою бензоїлгідразон 2-фенацил-1Н-бензімідазолу Знайдено %: С 54.88; H3.05; N16.78. С19Н12F3N5O3. реагує з трифтороцтовим ангідридом за іншим Вирахувано %: С54.95; H2.91; N16.86. ІЧ спектр напрямком - з отриманням сполуки піразолу: (KBr): 1640. Спектр ЯМР 1H (ДМСО-d6): 2.43 с (3Н, H СН3), 6.35 с (1Н, 6-Н), 7.31-7.41м (2Н, 9-, 10-Н), Ph N NHCOCF3 7.66 д (1Н, J=7.8 Гц, 8-Н), 7.84 д (1Н, J=7.8 Гц, 11(CF3CO)2O Ph N N Н), 8.21 и 8.37 два д, (2х2Н, J=8.4 Гц, 2-, 6- и 3-, 5HN N НАr). N N H Приклад 2. Ph O O Одержання 5-метил-2-феніл-12аPh трифторметил[1,3,4]оксадіазолоІстотною відмінністю вихідних ацилгідразонів [2',3':2,3]піримідо[1,6-а]бензімідазолу. від наведеного бензоїл-гідразону є протилежне Осад, що утворився при реакції бензоїлгідрарозташування структурних фрагментів відносно зону 2-ацетоніл-1Н-бензімідазолу за загальною гідразонового подвійного зв'язку. Воно, згідно з методикою, відфільтровують, промивають водою, відомими для гідразонів даними [16], зпричинене сушать при 100°С і кристалізують із суміші 2тим, що метильна група (R1 = СН3) на відміну від пропанолу і води (1:1). Вихід 88%, т. топл. 126феніль-ної чинить значно менший просторовий 127.5°С. Знайдено %: С61.49; H3.48; N15.06. тиск на ациламіновий замісник, і це не перешкоС19Н13F3N4O. Вирахувано %: С61.62; H3.54; джає стійкому розташуванню метальної і ациламіN15.13. ІЧ спектр (КВr): 1600, 1640. Спектр ЯМР 1H нової групи по одну сторону відносно гідразоново(ДМСО-d6): 2.41с (3Н, СН3), 6.29 с (1Н, 6-Н), 7.29го подвійного зв'язку. Саме така особливість 7.39м (2Н, 9-, 10-Н), 7.57-7.67м (4Н, 8-Н и 3-, 4-, 5геометрії молекул вихідних ацилгідразонів, очевиНAr), 7.81 д (1Н, J=6.6 Гц, 11-Н), 7.95 д (2Н, J=6.0 дно, і приводить до якісно нового результату - пеГц, 2-, 6-НAr). ребігу реакції за іншим напрямком, що забезпечує Приклад 3. практично одночасну добудову піримідинового і Одержання 5-метил-2-(4-метоксифеніл)-12аоксадіазольного кілець до бензімідазольного з трифторметил[1,3,4]утворення сполук нової гетероциклічної системи, оксадіазоло[2’,3':2,3]тримідо[1,6-а]бензшідазолу. які можуть знайти практичне використання. Масло, що утворилось при реакції 4метоксибензоїлгідразону 2-ацето-ніл-1Н 5 75785 6 бензімідазолу за загальною методикою, відділяantiinflammatory evaluation of resulting heterocyclic ють, промивають водою, сушать при 100°С і розcompounds // Phosphorus, Sulfur Silicon Relat. Elem. чиняють в мінімальній кількості діетилового есте- 1994. - Vol. 88. - P. 45-51. ру. Розчин пропускають через колонку з оксидом 3. Soudhi S. M., Magan A., Sahu R., Mahesh V. алюмінію, використовуючи в якості елюента діетиK., Shukia R., Patnaik G. K. Evaluation of some antiловий естер. Естер випарюють у вакуумі водоinflammatory pyrimidobenzimidazoles synthesized via струминного насосу. Залишок кристалізують із novel tin (II) chloride-hydrochloric acid assisted water суміші бензола і гексану (2:1). Вихід 75%, т. топл. addition and reduction of 4,4,6-trimethyl-1-(2122-123.5°С. Знайдено %: С 59.87; H3.72; N13.77. nitroaryl)-1, 4-dihydropyrimidine-2(3H)-thiones // С20Н15F3N4O2. Вирахувано %: С 60.00; H 3.78; N Synthesis -1994, - Vol. 11.-P.1175-1180. 13.99.ІЧ спектр (KBr): 1635. Спектр ЯМР 1Н 4. Soudhi S. M., Verma R. P., Nidhi Singhal M. S„ (ДМСО-d6): 2.39 с (3Н, СН3), 3.84 с (3Н, ОСН3), Sharma V. K., Shukia R., Patnaik G. K. Anti6.26 с (1Н, 6-Н), 7.12 и 7.90 два д, (2х2Н, J=8.7 Гц, inflammatory and analgesic activity evaluation of 3-, 5- и 2-, 6-НАr), 7.30-7.39 м (2Н, 9-, 10-Н), 7.65 д heterocyclic compounds synthesized by the reaction (1Н, J=7.2 Гц, 8-Н), 7.81 д (1Н, J=7.5 Гц, 11-Н). of4-isothiocyanato-4methyl-2-pentanone with Приклад 4. amines // Phosphorus, Sulfur Silicon Relat. Elem. Одержання 5-метил-2-(2-тієніл)-12а1996. - Vol. 118. - P. 7-19. трифторметил[1,3,4]оксаді5. Soudhi S. M., Sahu R., Magan A., Ghosh D. азоло[2',3':2,3]піримідо[1,6-а]бензімідазолу. K., Mukhopadhya R. M., Chatterjee G. K., Масло, що утворилось при реакції 2ChaudhuriS. K. Anti-amoebic and anthelmintic тієноїлгідразону 2-ацетоніл-ІН-бензімідазолу за evaluation of heterocyclic compounds containing загальною методикою, відділяють, промивають nitrogen and/or sulfur // Indian Drugs - 1994. - Vol. 31 водою, сушать при 100°С і розчиняють в мінімаль(7). -P.317-320. ній кількості діетилового естеру. Розчин пропуска6. Gmuender H., Kuratli К., Keck W. In the ють через колонку з оксидом алюмінію, використоpresence ofsubunit A ingibitors DNA gyrase cleaves вуючи в якості елюента діетиловий естер. Естер DNA fragments as short as 20 bp at specific sites // випарюють у вакуумі водоструминного насосу. Nucleic Acids Res. - 19997. - Vol. 25 (3). - P. 604Залишок кристалізують із бензолу. Вихід 71 %, т. 610. топл. 123-124°С. Знайдено %: С 54.16; H 2.87; N 7. Hang В., Chenna A., Fraenkel-Courat H., 14.79. С17Н11F3N4OS. Вирахувано %: С 54.25; H Singer B. An unusual mechanism for the major 2.95; N 14.89. ІЧ спектр (KBr): 1635. Спектр ЯМР 1H human apurinic/apyrimidinic (AP) endonuclease (ДМСО-d6): 2.37 с (3Н, СН3), 6.28 с (1Н, 6-Н), 7.26involving 5' cleavage of DNA containing a benzene7.29 м (1Н, 4-НAr), 7.32-7.39 м (2Н, 9-, 10-Н), 7.65 д derived exocyclic adduct in the absence of an AP site (1Н, J=7.5 Гц, 8-Н), 7.77 д (1Н, J=7.5 Гц, 11-Н), 7.93 // Proc. Natl. Acad. Sci U. S. A. - 1996. -Vol. 93 (24). д (1Н, J=3.6 Гц, 5-НAr), 7.98 д (1Н, J=4.8 Гц, 3-НAr). P. 13737-13741. Приклад 5. 8. Hang В., Chenna A., Sagi J., Singer В. Одержання 5-метил-2-(4-піридил)-12аDifferential cleavage of oligonucleotides containing трифторметил[1,3,4]оксаthe benzene-derived adduct, N6-benzetheno-dA, by діазоло[2',3':2,3]піримідо[1,6-а]бензімідазолу. the major human AP endonuclease HAP1 and Масло, що утворилось при реакції 4Escherichia coli exonuclease III and endonuclease IV піридилкарбонілгідразону 2-ацето-ніл-1Н// Carcinogenesis - 1998. - Vol. 19 (8). - P. 1339бензімідазолу за загальною методикою, відділя1343. ють, промивають водою, сушать при 100°0С і роз9. Albertini S., ChetalatA.-A., Miller В., Muster W., чиняють в мінімальній кількості метиленхлориду. Pujadas E., Strobel R., Gocke E. Genotoxiticy of 17 Розчин пропускають через колонку з оксидом gyrase - and four mammmalian topoisomerase IIалюмінію, використовуючи в якості елюента метиpoisons in prokariotic and eukariotic test systems // ленхлорид. Розчинник випарюють у вакуумі водоMutagenesis - 1995. - Vol. 10 (4). - P. 343-351. струминного насосу. Залишок кристалізують із 210. Hubschwerlen С., Pflinger P., Kompis I. пропанолу. Вихід 61 %, т. топл. 181-182.5°С. ЗнайDesign and synthesis of novel DNA-gyrase inhibitors дено %: С 58.08; H 3.15; N 18.71. С18Н12F3N5O. Ви// Trends Med. Chem. 90, Proc. Int. Symp. Med. рахувано %: С 58.22; H 3.26; N 18.86. ІЧ спектр Chem., 11th - 1992. - P. 315-319; Chem. Abst. - 1995. (KBr): 1640. Спектр ЯМР 1Н (ДМСО-d6): 2.42 с (3Н, - Vol. 122: 255586a. СН3), 6.34 с (1Н, 6-Н), 7.31-7.41 м (2Н, 9-, 10-Н), 11. U.S.US 5,175,273 (Cl. 536-27; С07H 19/073) 7.66 д (1Н, J=7.2 Гц, 8-Н), 7.85 д (1Н, J=7.8 Гц, 1129 Dec 1992. Preparation of pyridinone and Н), 7.89 и 8.21 два д, (2х2Н, J=5.7 Гц, 2-, 6- и 3-, 5pyrimidinone-containing oligodeoxyribonucleotide НAr). duplexes / N. W. Bischofberger, M. D. Matteucci Джерела інформації. (Genentech Inc.); Chem. Abst. - 1993. -Vol.119: 1. U. S. U S 5,283,248 (Cl. 514-267; A61К PI17758v. 31/505) 01 Feb 1994. Aminosubstituted pyrimido[1,612. Sahu R., sondhi S. M., Gupta B. Extraction a]benzimidazoles as bactericides /J. L. Srecklin, I. and spectrophotometric determination of Pd (II) with Kompis, J. Srecklin (Hoffmann-La-Roche Inc.); Chem. 3,4,4a,5-tetrahydro-3, 3, 4a-trimethyl-7-(substituted) Ab. - 1994. -Vol. 120: P270464m. pyrimido(1,6-a)-benzimidazole-1-thiol (PBT) // Talanta 2. Sahu R. K., Magan A., Gupta G., Sondhi S. M., - 1995. - Vol. 42 (3). - P. 401-405. Srimal R. K,, Patnaik G. K. Reactions of 413. Zielinsfci W., Zaki M. E. A. Synthesis of new isothiocyanato-4-methyl-2-pentanone with amines heterocyclic benzimidazole derivates based on 2having functional group at (3-position and cyanomethylbenzimidazole // Pol. J. Chem. - 1994. 7 75785 8 Vol. 68 (8). - P. 1569-1574; Chem. Abst.-1995.-Vol. 43 (1). - P. 35-40; Chem. Abst. - 1998. - Vol. 129: 122: 105755r. 230690m. 14. Harizi A., Hajjem В., Baccar В. Action ofN15. Дзвинчук И. Б., Лозинский M. О. Рециклиacyl, N-ethoxy carbonyl, and Nзация при трифторацетилировании бензоилгидраphenylaminothyocarbonyl imidates on 2-cyanomethylзона 2-фенацил-1Н-бензимидазола // ХГС. - 2003. 1H-benzimidazole. New synthesis ofpyrimido[1,6- № 3. - С. 436-437. a]benzimidazoles // Rev. Roum. Chim. - 1998. - Vol. 16. Китаев Ю. П., Бузыкин Б, И. Гидразоны. Москва: Наука, 1974. - 415 с. Комп’ютерна верстка М.Клюкін Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською[1,3,4]oxadiazolo[2,3:2,3]pyrimido[1,6-a]benzimidazole derivatives and process for preparation thereof
Автори англійськоюDzvinchuk Ihor Borysovych, Cherneha Oleksandr Mykolaiovych, Lozynskyi Myron Onufriiovych, Lozynskyi Myron Onufriovych
Назва патенту російськоюПроизводные [1,3,4]оксадиазоло[2',3':2,3]пиримидо[1, 6-а]бензимидазола и способ их получения
Автори російськоюДзвинчук Игорь Борисович, Чернега Александр Николаевич, Лозинский Мирон Онуфриевич
МПК / Мітки
МПК: C07D 271/12, C07D 235/04, C07D 237/26
Мітки: 1,3,4]оксадіазоло[2',3':2,3]піримідо[1,6-а]бензімідазолу, похідні, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/4-75785-pokhidni-134oksadiazolo2323pirimido16-abenzimidazolu-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні [1,3,4]оксадіазоло[2′,3′:2,3]піримідо[1,6-а]бензімідазолу та спосіб їх одержання</a>
Попередній патент: 3-(5-аміноурацил)-5,6-бензокумарину гідробромід та препарат на його основі
Наступний патент: Пристрій для зберігання блістерної упаковки та видалення лікарської дози з неї
Випадковий патент: Спосіб хонінгування отворів деталей тертя з високолегованих композитних матеріалів на основі нікелю








