Імуностимулюючий засіб та протитуберкульозний засіб
Формула / Реферат
1. Імуностимулюючий засіб, який містить N-(2,4-діоксо-6-метил-5-піримідил)сульфоніл-N'-(4-піридинкарбоніл)гідразин формули (І)
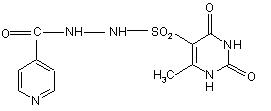
та цільові добавки.
2. Імуностимулюючий засіб за п. 1, який відрізняється тим, що цільові добавки вибрані з групи, що включає пропіленгліколь, натрію цикламат, камедь ксантанову, фруктозовий сироп, натрію бензоат, натрію сахаринат моногідрат, етанол, аромат апельсиновий, натрію цитрат дигідрат, мальтодекстрин.
3. Протитуберкульозний засіб, який містить N-(2,4-діоксо-6-метил-5-піримідил)сульфоніл-N'-(4-піридинкарбоніл)гідразин формули (І)
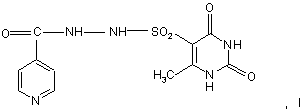
щонайменше один протитуберкульозний агент та цільові добавки.
4. Протитуберкульозний засіб за п. 3, який відрізняється тим, що як протитуберкульозний агент він містить ізоніазид, рифампіцин, піразинамід.
5. Протитуберкульозний засіб за одним з пп. 3 або 4, який відрізняється тим, що він виготовлений у вигляді таблеток, комбінованих таблеток, капсул, сиропу й ін'єкцій.
6. Протитуберкульозний засіб за одним з пп. 3-5, який відрізняється тим, що цільові добавки вибрані з групи, що включає пропіленгліколь, натрію цикламат, камедь ксантанову, фруктозовий сироп, натрію бензоат, натрію сахаринат моногідрат, етанол, аромат апельсиновий, натрію цитрат дигідрат, мальтодекстрин.
Текст
1. Імуностимулюючий засіб, який містить N(2,4-діоксо-6-метил-5-піримідил)сульфоніл-N'-(4піридинкарбоніл)гідразин формули (І) 3 83524 діяльності нирок, нервово-психічні, гематологічні, алергійні прояви й токсичні гепатити. Відомий також препарат феназид [див. патент РФ №2080114], що являє собою хелатний комплекс двовалентного заліза ізоніазиду формули (В). O C NH NH 2 . . FeSO4 2H2 O N , (B) Хоча цей препарат і має меншу токсичність, порівняно з сполукою А, однак її рівень досить високий (LD50 при внутрішньочеревному введенні дорівнює 163,2-382,9мг/кг). Крім того, великим недоліком є те, що лікарський препарат на основі сполуки В (феназид) не може використовуватися при серцево-легеневій недостатності й важких формах ішемічної хвороби серця. Завданням даного винаходу є розробка нового лікарського засобу, який зберігав би ті самі лікувальні властивості, але мав нижчу токсичність (приблизно в 50 разів меншу), був би стабільним в процесі зберігання, а також у якого побічні ефекти були б зведені до мінімуму. Завдання вирішується запропонованим лікарським засобом, що включає активну речовину й цільові добавки, відмінність якого полягає в тому, що як активну речовину він містить N-(2,4-діоксо-6метил-5-піримідил)сульфоніл-N'-(4піридинкарбоніл)гідразин формули (І) або його фармацевтичнo прийнятні солі в ефективній кількості. O O C NH NH SO2 H 3C N NH N H O , I Більш прийнятне лікарський засіб може бути виготовлений у вигляді таблеток, комбінованих таблеток, капсул, сиропу й ін'єкцій. Сполука (І) являє собою білий кристалічний порошок або безбарвні кристали з жовтува тим або рожевим відтінком. Сполука формули (І) мало розчинна в N,N-диметилформаміді, помітно розчинна в 0,1М соляній кислоті, не розчинна в етанолі, трихлорметані й воді. Температура плавлення запропонованої сполуки становить 247-256°С. Одержують запропоновану сполуку формули (І) шляхом взаємодії 6-метилурацил-5сульфо хлориду з гідразидом ізонікотинової кислоти в сухому ацетонітрилі шляхом кип'ятіння при перемішуванні. Зазначена сполука має антибактеріальну, антимікобактеріальну та імунотропну активність. Лікарський засіб на основі зазначеної сполуки може використовуватись у вигляді таблеток, розчинів для ін'єкцій, капсул, комбінованих таблеток (у поєднанні з іншими активними речовинами такими, як ізоніазид, рифампіцин, піразинамід), суспензій та супозиторій. Сполуки відповідно до винаходу можуть вводитися у звичайний спосіб орально, парентераль 4 но (підшкірно, внутрішньовенне, внутрішньом'язово, вн утрішньочеревне) або ректальне. Дозування залежить від віку, стан у та ваги пацієнта, а також від виду введення. Відповідно до винаходу, лікарський засіб містить запропоновану сполуку в кількості від 0,1 до 4г. Запропонований лікарський засіб на основі запропонованої сполуки виготовляється у звичайний спосіб. Разом з активною речовиною лікарські засоби можуть при цьому містити звичайні допоміжні речовини, прийняті в технології готування ліків, такі як сполучні для таблеток, наповнювачі, консерванти, речовини, які розприскують на таблетки, регулятори плинності, пом'якшувачі, змочувальні речовини, диспергатори, емульгатори, розчинники, пролонгатори дії, антиокислювачі й/або пропеленти [див. Н. Sucker et al.: Pharmazeutische Technologie, Thieme-Verlag, Stuttgard, 1991]. Крім того, лікарські засоби на основі запропонованої сполуки замість окремих активних речовин можуть містити комбінації різних активних речовин, щоб використовувати спільно якості окремих активних речовин при застосуванні, або також тому, що окремі активні речовини в поєднанні мають ефект синергізму, тобто, дають у результаті суперадитивне посилення дії. Далі наведені дані про біологічні випробування. Оцінка протитуберкульозної активності in vitro запропонованої сполуки. Критеріями оцінки були рівні мінімальної пригнічуючої та бактерицидної концентрації (МПК, МБК). Визначення МПК, МБК проводили стандартним методом серійних розведень відповідно до вимог Фармакологічного комітету [Руководство по экспериментальному (доклиническому) изучению новых лекарственных ве ществ, М., 2000г]. Тест-культура: H37Rv - лабораторний штам М. Tuberculosis, високовірулентний, чутливий до протитуберкульозних препаратів. Для готування матричного розчину запропонованої сполуки зважували 10 мг порошку й додавали 1 мл димексиду. Відбувалося неповне розчинення речовини (дрібнодисперсна завись). Для готування робочих розчинів використовували як розріджувач середовище Школьникової. Для визначення МПК і МБК протягом 2 тижнів вирощували тест-культур у в рідкому живильному середовищі Школьникової з додаванням різних концентрацій запропонованої сполуки в широкому діапазоні (128; 64; 32; 16; 8; 4; 2; 1; 0,5; 0,25; 0,125; 0,06мкг/мл). Потім готували мазки й забарвлювали за Цилем-Нільсеном. У мазках підраховували кількість мікробактерій, і на підставі отриманих результатів визначали МПК запропонованої сполуки, при якій спостерігалося пригнічення їх росту. Життєздатність МБТ після впливу запропонованої сполуки оцінювали за здатністю їх до росту на середовищі Левенштейна-Єнсена (після вилучення запропонованої сполуки шляхом відмивання фізіологічним розчином). МБК запропонованої сполуки встановлювали за відсутністю росту культури. 5 83524 У результаті проведених досліджень установлено, що МПК запропонованої сполуки варіювала від 8 до 16мкг/мл; МБК -16-32мкг/мл. Визначення бактеріостатичної активності (БАК) крові пацюків при введенні запропонованої сполуки. БАК визначали класичним методом, описаним у методичних рекомендаціях [«Определение концентраций антибактериальных препаратов и туберкулостатической активности крови больных туберкулезом», Москва, 1973г.] Попередньо відібраним і зваженим пацюкам внутрішньошлунково вводили запропоновану сполуку в 1% крохмальному гелі. Доза запропонованої сполуки -100мг/кг. Забір крові у тварин робили через 0,5; 1 і 2 години після введення запропонованої сполуки. З кожної проби крові готували розведення від 1:2 до 6 1:512 з подальшим внесенням у кожну пробірку 0,2мл суспензії культури мікробактерій туберкульозу штаму H37Rv з розрахунку 500 млн. клітин в 1 мл, приготовлену за стандартом мутності. Підготовлені в такий спосіб пробірки інкубували в термостаті при 37 градусах протягом 14 днів. По закінченні терміну з осаду робили мазки й забарвлювали за Цилем-Нільсоном без подальшого дозабарвлення синькою. При мікроскопії оцінювали ріст колоній за трибальною системою: суцільний ріст (+++); коси майже в кожному полі зору (++); одиничні в мазку (+) (Така культура зростаючою не визнається). Відсутність росту позначали (-). БАК проба вважається позитивною за відсутності росту культури (-) або при рості культури, що оцінюється як (+) у розведеннях крові 1:32 і вище. Дані мікроскопії мазків наведені в Таблиці 1. Таблиця 1 Картина мікроскопії мазків крові Запропонована сполука й час забору крові (година) Запропонована сполука/0,5 Запропонована сполука/1,0 Запропонована сполука/2,0 1:2 1:4 1:8 Розведення крові 1:16 1:32 1:64 + + 1:128 ++ + ++ 1:256 ++ + ++ 1:512 ++ ++ ++ Аналіз картини мікроскопії дав результати, наведені у таблиці 2. Таблиця 2 Результати визначення БАК Запропонована сполука й час забору крові (год.) Запропонована сполука/0,5 Запропонована сполука/1,0 Запропонована сполука/2,0 Бак проба вважається високою у разі відсутності росту в розведеннях вище 1:32. В отриманих результатах дослідження БАК при введенні запропонованої сполуки вища від вказаного еталона, що свідчить про високу чутливість культури МВТ до концентрацій запропонованої сполуки, які були створені в крові. Найбільш високою БАК проба є через 1 годину після введення запропонованої сполуки. При ентеральному введенні запропонованої сполуки в дозі 100мг/кг протягом 2 годин після введення створюються концентрації запропонованої сполуки, що забезпечують високі рівні БАК проби. Максимальне розведення крові, при якому відсутній ріст культури, 1:256 при введенні запропонованої сполуки. Позитивна БАК проба при розведенні крові 1:64 1:256 1:64 Визначення імуностимулюючої активності запропонованої сполуки за методом Ерне (синтез антитіл у селезінці) Імуностимулююча активність запропонованої сполуки характеризується індексом стимуляції (1C) імунної відповіді. В експериментах використовували 30 мишей лінії Fl (CBA´57BL), які найшли з розплідника "Крюково" РАМН РФ. Годування тварин проводили відповідно до наказу Мінздраву СРСР №1179 від 10.10.83 року "Про затвердження нормативів витрат кормів для лабораторних тварин в установах охорони здоров'я". Забій тварин для визначення імуностимулюючої активності запропонованої сполуки досліджуваної серії був проведений на четверту добу після імунізації. Результати наведені в Таблиці 3. 7 83524 Таблиця 3 Дослід № 1 (Імуностимулююча активність запропонованої сполуки) Число антитілоутворюючих клітин Контроль Дослід Розведення комплементу 1:15 11,7 п=15 48,1 п=15 Індекс стимуляції (1C) імунної відповіді =4,1 Отримана величина індексу стимуляції (1C) імунної відповіді даної серії становила 4,1, що говорить про високу імуностимулюючу активність запропонованої сполуки. Спосіб одержання запропонованої сполуки ілюструється таким прикладом. Приклад 1 Спосіб одержання N-(2,4-діоксо-6-метил-5піримідил)-сульфоніл-N'-(4-піридинкарбоніл)гідразину Змішують 137г (1моль) гідразиду ізонікотинової кислоти й 224,5г (1моль) 6-метилурацил-5сульфо хлориду в ацетонітрилі протягом 5 годин при температурі кипіння розчинника. Фільтрують, сушать на повітрі. Фільтрат нейтралізують. Потім очищають отриману речовину шляхом переосадження з ацетону, або шляхом 8 перекристалізації з N,N-диметилформаміду. Одержують 311,5г (86%) дрібно кристалічного порошку від білого до кремових кольору N-(2,4-діоксо-6метил-5-піримідил)сульфоніл-N'-(4-піридинкарбоніл)-гідразину (С11Н11N5 O5S) із ТПЛ=247256°С. Знайдено, %: С 40,44; Н 3,91; N 21,24; О 24,76; S 9,65. Обчислено, %: С 40,61; Н 3,41; N 21,53; 0 24,59; S 9,86. Вміст Н 2O за Карлом-Фішером, % - 0,15. ІЧ-спектр ( g , см -1, КВr) 3308, 3192, 3150 (NH); 3068,2816(=C-H, C-H); 1744, 1728, 1692, 1644 (C=O); 1588, 1544, 1528 (-C=C, C=N); 1336,1164(-SO2-). ПМР спектр у ДМСО: (3Н, урацил) - 2,37 м.ч.; (4Н, піридин) - 7,66 м.ч., 8,73 м.ч.; (2Н, NH урацил) - 9,3 м. ч., 10,86 м. ч.; (2Н; NHNH) -11,52 м. ч., 11,61 м. ч. Наведені нижче приклади ілюструють одержання вищевказаних готови х форм. Приклад А Одержання лікарської форми у вигляді таблеток. Змішують основну й допоміжні речовини в співвідношеннях, зазначених у таблиці 4 (розрахунок на масу таблетки): Таблиця 4 Маса таблетки (МТ), г 0,250 Запроп.сполука Лактоза Аеросил Стеарат Са Масовий склад, % 0,500 0,1 0,144 0,004 0,002 Запроп.Сполука Лактоза Аеросил Стеарат Са Діаметр кульок - 5мм. Маса кульок на 100г готової форми - 500г. Пресування таблеток здійснюють на пресі РТМ-12. На таблетки наносять покриття на основі ацетилфталілцелюлози (АФЦ) на апараті "Strea-1". Склад покриття (масові частини): ацетон - 56,4; етиловий спирт 96% - 37,6; рицинова олія - 1,0; АФЦ - 5,0; тропеолін - додають до світло 0,2 0,288 0,008 0,004 40 57,6 1,6 0,8 коричневого забарвлення розчину. Витрата покриття: кількість покриття (мл) = 50% від маси таблеток (г). Приклад Б Одержання лікарської форми у вигляді комбінованої таблетки. Таблетки одержують за відомою технологією. Склад наведений у таблиці 5. Таблиця 5 Складові Запроп.сполука ізоніазид рифампіцин піразинамід етамбутол 1 до 400 до 100 — — — 2 до 400 — до 150 до 300 — Використовують стандартні цільові добавки й допоміжні речовини для формування лікарської форми. Вага, мг 3 4 до 400 до 400 — до 75 до 150 до 150 — — — — 5 до 400 — до 150 — до 150 6 до 400 — до 150 до 300 до 250 Приклад В Одержання лікарської форми у вигляді желатинових капсул 9 83524 Запропоновану сполуку в желатинових капсулах по 0,1г і по 0,2г одержують фасуванням ручним способом у капсули №1 і №0 за допомогою капсульниць із запірним пристроєм. Склад: Запропонована сполука - 0,1г і 0,2г без наповнювачів і консервантів. Наважку запропонованої сполуки 10,0г приміщують на пластину капсульниці, розподіляють по поверхні пластини й далі відповідно до опису процесу роботи з капсульницею. Желатинові капсули складаються з: хіноліну епу - 0,05%, титану діоксиду- 1,0%, желатину - до 100%. Речовини, що входять до складу капсул, дозволені до медичного застосування в Росії. Приклад Г Одержання лікарської форми у вигляді суспензії (сиропу). На 100мл кінцевої лікарської форми беруть запропонованої сполуки - до 4г , фруктози - до 20г, ароматизатори, а також цільові добавки до збереження свіжоприготовленої суспензії (шляхом доведення її кип'яченою водою до 100мл) строком до 10 днів у прохолодному захищеному від світла місці. Цільові добавки й допоміжні речовини - пропіленгліколь, натрію цикламат, камедь ксантанова, фр уктозовий сироп, натрію бензоат, натрію сахаринат моногідрат, етанол 95%, аромат апельсиновий 51.94 І/А, натрію цитрат дигідрат, мальтодекстрин KMS Х-50, дистильована вода - вводять у звичайних кількостях, що використовуються для приготування суспензій (сиропів), за відомою технологією Приготовлену суспензію перед кожним вживанням збовтувати. Приклад Д Одержання лікарської форми у вигляді ін'єкцій. Препарат для ін'єкцій являє собою розсипку порошку лікарського засобу, що включає запропоновану сполуку і її фармацевтичне прийнятні солі в дозуванні 0,1-0,5г. Приклад Е Одержання лікарської форми у вигляді супозиторій. Маса однієї супозиторії для дорослих від 1 до 4г. Вміст активної речовини від 200 до 400мг. Маса однієї супозиторії для дітей від 0,5 до 1,5г Вміст активної речовини від 100 до 200мг. Для виготовлення супозиторії використовуються традиційні добавки. Комп’ютерна в ерстка Н. Лисенко 10 У якості ліпофільних основ для виготовлення супозиторіїв застосовують масло какао, сплави масла какао з парафіном або гідрогенізованими жирами, рослинні й тваринні гідрогенізовані жири, твердий жир, ланоль, сплави гідрогенізованих жирів з воском, твердим парафіном і інші основи, дозволені для медичного застосування. Як гідрофільні основи використовують желатино-гліцеринові гелі, сплави поліетиленоксидів з різними молекулярними масами й інші речовини, дозволені для медичного застосування. Желатино-гліцеринову основу виготовляють із желатину медичного, гліцерину й води. При виготовленні супозиторіїв можуть застосовува тися бутилокситолуол, бутилоксіанізол, лимонна кислота, емульгатор №1, емульгатор Т-1, емульгатор Т-2, твін-80, спирти шерстного воску, аеросил та інші допоміжні речовини, дозволені для медичного застосування. Переваги заявленого лікарського засобу полягають у наведеному далі. При визначенні токсичності запропонованої сполуки на мишах за методом Міллера та Тейнтера, LD50 при внутрішньочеревному введенні становить 1001-2000мг/кг, а токсичність Феназиду становить 163,2-382,9мг/кг. Оскільки токсичність Феназиду майже в 10 разів вища, запропонована сполука дозволяє одержати лікарський засіб, що може застосовуватися при резистентних формах захворювань, а також у більших дозуваннях і протягом більш тривалого часу. Крім того, запропонована сполука не має побічних ефектів, які притаманні Феназиду: не може застосовуватися при серцево-легеневій недостатності, важких формах ішемічної хвороби серця. Сучасна концепція лікування хворих на туберкульоз передбачає поряд з базисною хіміотерапією призначення різних імуномодулюючих засобів, що збільшує ризик розвитку побічних реакцій і підвищує вартість лікування. Значні перспективи в підвищенні ефективності хіміотерапії хворих на туберкульоз відкриває застосування препаратів, що мають поряд з антимікобактеріальною імунокорригуючу дію. Таким є запропонований лікарський засіб. Лікарський засіб на основі запропонованої сполуки є стабільним в процесі зберігання. Не змінюється зовнішній вигляд, фізичні характеристики й біологічні властивості протягом кількох років, наприклад, 3 років і більше. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюImmunostimulant and antituberculous agent
Автори англійськоюDmitriev Aleksandr Ivanovich
Назва патенту російськоюИммуностимулирующее средство и противотуберкулезное средство
Автори російськоюДмитриев Александр Иванович
МПК / Мітки
МПК: A61K 31/505, C07D 239/42, C07D 239/54, C07D 401/12, A61P 15/04, A61P 15/06
Мітки: імуностимулюючий, протитуберкульозний, засіб
Код посилання
<a href="https://ua.patents.su/5-83524-imunostimulyuyuchijj-zasib-ta-protituberkuloznijj-zasib.html" target="_blank" rel="follow" title="База патентів України">Імуностимулюючий засіб та протитуберкульозний засіб</a>









