Спосіб одержання хелатів перехідних металів з олігопероксидними лігандами
Номер патенту: 85344
Опубліковано: 12.01.2009
Автори: Волошиновський Анатолій Степанович, Мітіна Наталія Євгенівна, Зелікова Ольга Володимирівна, Заіченко Олександр Сергійович
Формула / Реферат
Спосіб одержання хелатів з олігопероксидними лігандами, що включає взаємодію гетерофункціонального олігопероксиду з сіллю перехідного металу, який відрізняється тим, що як гетерофункціональний олігопероксид використовують ліганд формули:
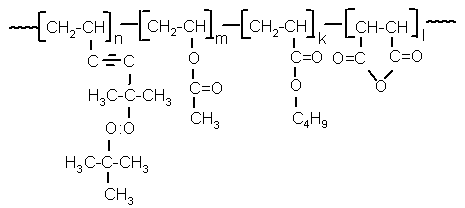 , (I)
, (I)
де n = 22,16-54,09 %, m = 12,78-21,50 %, l = 11,93-32,50 %,
або
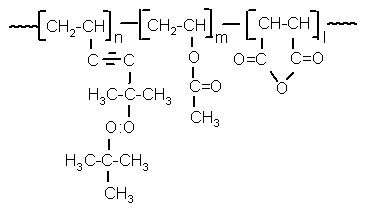 , (II)
, (II)
де n = 34 %, m = 26 %, l = 40 %,
у вигляді розчину в органічних розчинниках, таких як толуол або метанол, а як сіль перехідного металу - солі Се+3, Еu+3 у вигляді розчину у воді або органічному розчиннику.
Текст
Спосіб одержання хелатів з олігопероксидними лігандами, що включає взаємодію гетерофункціонального олігопероксиду з сіллю перехідного металу, який відрізняється тим, що як гетерофункціональний олігопероксид використовують ліганд формули: 2 3 85344 08 F 8 / 24, 218 / 08 "Хелати перехідних металів з олігопероксидними лігандами для низькотемпературного ініціювання радикальних реакцій", Бюл. №5, 31.10.97], що включає взаємодію гетерофункціонального олігопероксиду з сіллю перехідного метала. Як гетерофункціональний олігопероксид (ГФО) був використаний ліганд загальної формули: CH2-CH C CH 2-CH n C H3C-C-CH3 O:O m O C=O CH-CH l C=O O=C O CH2 -CH CH2 -CH n C CH2-CH CH-CH l k C=O O=C C=O m O C O H3C-C-CH3 C=O CH3 O:O O C4 H9 H3 C-C-CH3 CH3 , (I) де n = 22,16-54,09%, m = 12,78-21,50%, l = 11,93-32,50%, або CH 2-CH CH3 CH 2-CH n C H3 C-C-CH3 m O C CH-CH l C=O O=C H3C-C-CH 3 C=O CH 3 O:O CH3 де n = 16,4 - 53,3%, m = 1,5 - 41 %, l = 15,2 - 47,7% . М. м =2600-3500, а як солі перехідних металів - солі Сu2+, Со2+, 2+ Ni , Cr3+, Fe2+. Однак, одержані хелати хоча і використовуються як ініціатори радикальної полімеризації в інтервалі температур 273-298К завдяки окисновідновній взаємодії пероксидних фрагментів та катіону перехідного металу, але через природу катіонів (перехідних d-металів), а саме через відсутність можливості дипольно-дозволених переходів 4f ® 5d в цих елементах, що були використані для створення цих хелатів, вони нездатні до люмінесценції в певному діапазоні довжин хвиль, що не дозволяє використовувати їх як люмінесцентні маркери. При цьому гомофазний спосіб їх одержання є достатньо складним і потребує додаткового очищення готового продукту. В основу винаходу поставлене завдання створити спосіб одержання нового ряду хелатів перехідних металів з олігопероксидними лігандами, в якому використання солей нових перехідних металів(f-металів) забезпечило би можливість одержання сполук, здатних люмінесціювати в певному діапазоні довжин хвиль завдяки можливості збудження люмінесценції, обумовленої дипольнодозволеними переходами 4f ® 5d , що дасть можливість використовувати їх для створення люмінесцентних маркерів. А також їх можна було б використовувати як ініціатори-емульгатори радикальної полімеризації в інтервалі температур 303-353К. При цьому гетерофазний спосіб їх одержання є достатньо простим і не потребує додаткового очищення готового продукту. Поставлене завдання вирішується тим, що в способі одержання хелатів з олігопероксидними лігандами, що включає взаємодію гетерофункціонального олігопероксиду з сіллю перехідного метала, згідно з винаходом, як гетерофункціональний олігопероксид використовують ліганд формули: 4 O H 3C-C-CH3 CH 3 , (II) де n = 34%, m = 26%, l = 40%, у вигляді розчину в органічних розчинниках, наприклад, в толуолі або метанолі, а як сіль перехідного металу - солі Се+3, Еu+3 у вигляді розчину у воді або органічному розчиннику. В способі, що заявляється, хелати одержуються гетерофазним способом, коли ліганд знаходиться в олеофазі, а сіль у водній або спиртовій фазі. Це забезпечує більше входження катіонів перехідних металів у структур у хелату за рахунок локалізації гідрофільних комплексоутворюючих груп (карболанцюгових) на межі розподілу фаз, де відбувається більш ефективне зв'язування перехідних металів з полімерним лігандом. Крім того, це значно спрощує очищення отриманої речовини від непрореагованої солі. В одержаних хелатах формули: CH2-CH C CH2-CH n C H 3C-C-CH 3 O:O H 3C-C-CH 3 m O C=O CH3 CH 2-CH CH-CH l C-OH k C=O O=C O O C4H9 O Men+ L1 L1 L1 CH 3 (III), де Men + = Се+3, Еu+3; n = 22,16 – 54,09%, m = 12,78 – 21,50%, k = 14 – 51,95%, l = 11,93 – 32,50%. М.м.=5000-6000, L1 - низькомолекулярні ліганди, якими є молекули розчинника; або 5 CH 2-CH C n C 85344 CH2-CH m O H 3C-C-CH3 C=O CH-CH O CH3 O:O H3C-C-CH3 l C-OH O=C O Men+ L1 L1 L1 CH3 (IV), n+ +3 де Me = Се , Еu+3; = 34= 26 %, l 40 % . М.м.=2600-3500. L1 n %, m = низькомолекулярні ліганди, якими є молекули розчинника, катіони металів(Се+3, Еu+3) з олігопероксидними лігандами зв'язані в хелатний комплекс з функціональними групами карболанцюгового гетерофункціонального олігомеру, що містить в своєму складі також дитретбутилпероксидні фрагменти, які при розкладі здатні утворювати радикали (один з яких макрорадикал), що призводить до ініціювання радикальних процесів в інтервалі температур 303-353К внаслідок гемолітичного розпаду пероксидних фрагментів. Тому завдяки такій структурі данні сполуки доцільно використовува ти як ініціатори радикальних процесів, в т.ч. як ініціатори-емульгатори емульсійної полімеризації. А також завдяки вмісту в своїй стр уктурі рідкоземельного елементу такі сполуки можна використовува ти як основи для біоаналітичних препаратів - маркерів, за допомогою яких можна визначати природу і кількість складних біологічних об'єктів, таких як протеїни, полісахариди або апоптичні клітини. Характерною особливістю таких комплексів рідкоземельних металів є здатність до люмінесценції в певному діапазоні довжин хвиль. Що дозволяє визначати їх різними фізичними методами детекції. Способом, що заявляється, синтезовано та досліджено металокомплекси катіонів різних перехідних металів з гетерофункціональними пероксидами (табл. 1, 2). Вихідні ГФО отримували кополімеризацією таких речовин: Вінілацетат (ВА) (ТУ 6-09-5512-68), очищений подвійною перегонкою на колонці при атмосферному тиску, d4=0.9342 (літ. 0.9342), nD= 1.3960 (літ. 1.3968). 2-трет-бутилперокси-2-метил-5-гексен-3-ін (ВЕП) очищений, d420=0,867 (літ. 0,8670), nD20= 1,4480 (літ. 1,4482). Бутилакрилат (БАК), очищений перегонкою під вакуумом, d420=0,9076 (літ.0,9078), nD20= 1,4187 (літ.1,4190). Малеїновий ангідрид (МАНГ) (ТУ 6-09-5396-88) марки "ч", tпл= 324K (літ. 325.9К). Ініціатор: динітрилазобісізомасляна кислота (ДАК) (ТУ 6-09-3840-74), очищена перекристалізацією з етилового спирту. Розчинник: етилацетат (ГОСТ 22700-76), очищений і висушений. Вміст ВЕП-ланок в ГФО і хелатах визначали шляхом термічного розкладу розчинів олігоперок 6 сидів у толуолі при температурі 473К і подальшого газохроматографічного аналізу продуктів розкладу по відомій методиці [авт. св. СССР 1165982, кл. G 01 N 30/60. Способ количественного определения дитрет-алкил пероксидных групп в пероксидных олигомерах и сополимерах. Шевчук С. В., Минько С. С, Воронов С. А., П учин В. А., Г убар, 1985] Середньочислене значення молекулярних мас полімерів визначали методом гель-проникної хроматографії на приладі Waters 510. Характеристичну в'язкість розчинів олігомерів в ацетоні, диметилформаміді вимірювали в віскозиметрі Бішоффа при 298К. [Торопцева А. М., Белогородская К. В., Бондаренко В. М. Лабораторный практикум по химии и технологии высокомолекулярных соединений. Л.; Химия, 1972, с416.] Для синтезу хелатів були використані солі: Ce (NO3 )3 × 6H2O фірми «Merck» (вміст основної речовини ~ 98,5%), Німеччина; EuCl3 × 6H2O фірми «Aldrich» (вміст основної речовини ~ 99,99%), Німеччина. Розчинники: толуол, вода, метанол - використовувались без додаткової очистки. Будова хелатів була підтверджена УФ-, IЧ спектрами. УФ - спектри розчинів ГФО і хелатів в метанолі, підлужненій і підкисленій воді були зняті на приладі Specord-40M. ІЧ-спектри ГФО і хелатів знімали в плівках на КВr-кристалах на приладі Specord-20, плівки були відлиті із розчинів однакової концентрації. Вміст катіонів металів в хелатах визначали шляхом елементного аналізу і атомноадсорбційної хроматографії. Спектри люмінесценції одержаних хелатів реєструвались як з розчинів в метанолі, підлужненій і підкисленій воді в прозорих кварцевих кюветах, так і зразків у сухому вигляді за допомогою автоматизованої спектральної установки. Як джерело збудження використовували водневу лампу. Люмінесценцію збуджували світлом з довжиною хвилі 250, 270, 330, 340нм. Синтез хелатів Приклад 1 В реактор-змішувач з термостатом, який підтримує постійну температуру в реакторі (~298±1К), загрузили одержаний 10% водний розчин солі Ce (NO3 )3 × 6H2O і 10% розчин ГФО(І) в толуолі, співвідношення фаз 1:1 (табл. 1). Синтез вели при постійному інтенсивному перемішуванні протягом 0,5-1 год. Одержану суміш далі перелили в ділильну лійку для розшарування двох фаз (водної і толуольної) і відділили органічну фазу, в якій і міститься хелат. Одержаний хелат відмили від непрореагованої солі водою і сушили у вакуумі до постійної ваги. На електронному УФ- спектрі хелату Се +3 з'являється смуга поглинання при 280нм, якої немає в електронному спектрі ГФО. Цю смугу поглинання можна віднести до смуги поглинання катіонів церію, а зміщення відносно смуги поглинання вихідної солі церію можна пояснити електронними переходами з f- рівня на d- рівень катіону, такий перехід характерний саме для катіонів церію при комплексоутворенні. 7 85344 В ІЧ- спектрі поглинання хелату церію з карбоксилвмісним олігопероксидним лігандом присутні всі смуги поглинання, які спостерігаються в вихідному олігопероксиді. Поява розщеплення смуг поглинання карбонільних груп та їх зсув свідчать, про участь певної кількості карбоксильних груп олігомеру в комплексоутворенні. Підтвердженням утворення стійкого хелату Се+3 з олігопероксидним лігандом є його здатність до люмінісценції при l = 340 - 360нм в результаті збудження ультрафіолетовим джерелом випромінювання при 250нм (табл. 2). При чому, слід відмітити, що у ви хідного олігопероксиду здатність до люмінісценції відсутня. Дослідження колоїдно-хімічних властивостей водних розчинів хелату показали, що координація катіонів металу на олігопероксидному ліганді не впливає суттєво на поверхневу активність олігомеру. Для хелату є характерним пониження поверхневого натягу зі збільшенням їх концентрації у водно-аміачному розчині. Приклад 2 Хелат Се+3 отримували аналогічно до прикладу 1 з використанням 5% водного розчину солі Се+3 і 10% розчину ГФО(І) в толуолі. Склад реакційної суміші і умови синтезу наведені в табл. 1, характеристики отриманого хелату в табл. 2. Дослідження властивостей одержаного хелату проводили аналогічно прикладу 1. Приклад 3 Хелат Се+3 отримували аналогічно прикладу 2 з використанням 5% водного розчину солі Се+3 і 10% розчину ГФО(І) в толуолі, із співвідношенням толуольної і водної фази 1:2. Склад реакційної суміші і умови синтезу наведені в табл. 1, характеристики отриманого хелату наведені в табл. 2. Дослідження властивостей одержаного хелату проводили аналогічно прикладу 1. Приклад 4 В реактор-змішувач з термостатом, який підтримує постійну температуру в реакторі (~298±1К), загрузили одержаний 10% водний розчин солі EuCl3 × 6H2O і 10% розчин ГФО(І) в толуолі. Синтез вели при постійному інтенсивному перемішуванні протягом 0,5-1 год. Одержану суміш далі перелили в ділильну лійку для розшарування двох фаз (водної і толуольної) і відділили органічну фа 8 зу, в якій і міститься хелат. Одержаний хелат відмивали від непрореагованої солі водою і сушили у вакуумі до постійної ваги. Дослідженя властивостей одержаного хелату проводили аналогічно до прикладу 1. Підтвердженням утворення стійкого хелату Еu+3 з олігопероксидним лігандом є його здатність до люмінісценції при l =430, 590, 614нм в результаті збудження ультрафіолетовим джерелом випромінювання при 330, 340нм (табл. 2). При чому, слід відмітити, що у ви хідного олігопероксиду здатність до люмінісценції відсутня. Приклад 5 Хелат Еu+3 о тримували аналогічно прикладу 2 з використанням 5% водного розчину солі Еu+3 і 10% розчину ГФО(І) в толуолі. Склад реакційних сумішей і умови синтезу наведені в табл.1, характеристики отриманих хелатів наведені в табл. 2. Дослідження властивостей одержаних хелатів проводили аналогічно до прикладу 1. Приклад 6 Хелат Eu+3 отримували аналогічно до прикладу 3 з використанням 5% водного розчину солі Еu+3 і 10% розчину ГФО(І) в толуолі, із співвідношенням толуольної і водної фази 1:2. Склад реакційної суміші і умови синтезу наведені в табл. 1, характеристики отриманого хелату наведені в табл. 2. Дослідження властивостей одержаного хелату проводили аналогічно до прикладу 1. Приклади 7, 8 В колбах приготували 10% розчини солі Еu+3 або Се+3 і ГФО(ІІ) в метанолі. Далі загрузили одержані розчини в реактор-змішувач з термостатом і при температурі ~298±1К вели синтез при постійному інтенсивному перемішуванні протягом 0,5-1 год. Далі хелат виділяли з розчину переосадженням у дистильовану воду. Хелат відмивали від непрореагованої солі водою на фільтрі Шотта до негативної реакції на катіони металу у промивних водах. Після чого сушили у вакуумі до постійної ваги. Склад реакційних сумішей і умови синтезу наведені в табл. 1, характеристики отриманих хелатів наведені в табл. 2. Дослідження властивостей одержаних хелатів проводили аналогічно прикладу 1. Таблиця 1 Склади реакційних сумішей і умови синтезу халатів № прикладу 1 2 3 Ліганд ВА-ВЭП-МАНГ-БАК = 15,5:38:14:32,5%мас. ВА-ВЭП-МАНГ-БАК = 15,5:38,0:14,0:32,5%мас. ВА-ВЭП-МАНГ-БАК = 15,5:38,0:14 0:32,5%мас Співвідно- Вміст кашення орга- тіонів Сіль, Х6Н2О нічної і водMen + : комплексо- ної фаз Men + в утворюючі гр упи хелаті, % (мл:мл) Мольне співвідношення катіон Метод синтезу Ce(NO3)3 1:2 20:20 1,27 гетерофазний Ce(NO3)3 1:1 20:20 0,15 гетерофазний Ce(NO3)3 1:2 20:40 2,13 гетерофазний 9 85344 10 Продовження таблиці 1 ВА-ВЭП-МАНГ-БАК EuCl3 =15,5:38:14:32,5%мас ВА-ВЭП-МАНГ-БАК EuCl3 =15,5:38:14:32,5%мас. ВА-ВЭП-МАНГ-БАК ЕuСl3 =15,5:38:14:32,5%мас. ВА-ВЭПЕuСl3 МАНГ=24,8:40,0:35,2%мас ВА-ВЭПCe(NO3)3 МАНГ=24,8:40,0:35,2%мас 4 5 6 7 8 1:2 20:20 0,68 гетерофазний 1:1 20:20 1,00 гетерофазний 1:2 20:40 0,62 гетерофазний 1:2 10: 10 2,75 гомофазний 1:2 10: 10 2,83 гомофазний Як видно з таблиці 2, інтенсивність люмінісценції залежить від концентрації катіонів церію або європію в хелаті. Таблиця 2 Люмінесцентні властивості отриманих хелатів № прикладу Взірець, хар-ка Ехс при Стан котрій l ,nm I1, a.u. l max 2 ,nm I2, a.u. l max 3 ,nm I3, a.u. (тв./ р-н) збуджу- max 1 вали 1. ВА-ВЭП-МАНГ-БАК = 15,5:38,0:14,0:32,5%мас;+ Твердий 250 nm Ce (NO3 )3 × 6H2O %Се=1,27 340-360 105895 2. ВА-ВЭП-МАНГ-БАК = 15,5:38,0:14,0:32,5%мас;+ Твердий 250 nm Ce (NO3 )3 × 6H2O %Се=0,15 340-360 15465 3. ВА-ВЭП-МАНГ-БАК = 15,5:38,0:14,0:32,5%мас;+ Твердий 250 nm Ce (NO3 )3 × 6H2O %Се=2,13 340-360 108222 340 nm 430 19735 590 1237 614 1376 330 nm 420 87207 590 12446 615 39496 340 nm 430 22810 590 1611 614 1746 330 nm 430 74368 590 14520 614 49813 340 nm 430 19670 590 1219 614 1354 330 nm 420 64501 590 12444 615 39048 270 nm 430 8936 590 2854 614 8179 250 nm 340-360 122327 4. 5. 6. 7. 8. ВА-ВЭП-МАНГ-БАК = Водний 15,5:38:14:32,5%мас;+ розчин EuCl3 × 6H2O % Еu =0, 68 Твердий ВА-ВЭП-МАНГ-БАК = Водний 15,5:38:14:32,5%мас;+ розчин EuCl3 × 6H2O % Еu =1,00 Твердий ВА-ВЭП-МАНГ-БАК = Водний 15,5:38:14:32,5%мас;+ розчин EuCl3 × 6H2O % Еu =0,62 Твердий ВА-ВЭП-МАНГ= =34,0:26,0:40,0%мас;+ Твердий EuCl3 × 6H2O % Еu =2,75 ВА-ВЭП-МАНГ= =34,0:26,0:40,0%мас;+ Твердий Ce (NO3 )3 × 6H2O %Се=2,83 Комп’ютерна в ерстка В. Клюкін Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of chelates of transition metals with oligoperoxide ligands
Автори англійськоюZaichenko Oleksandr Serhiiovych, Mitina Nataliia Yevhenivna, Zelikova Olha Volodymyrivna, Voloshynovskyi Anatolii Stepanovych
Назва патенту російськоюСпособ получения хелатов переходных металлов с олигопероксидными лигандами
Автори російськоюЗаиченко Александр Сергеевич, Митина Наталия Евгеньевна, Зеликова Ольга Владимировна, Волошиновский Анатолий Степанович
МПК / Мітки
МПК: C09K 11/77, C08F 8/42
Мітки: лігандами, перехідних, металів, спосіб, олігопероксидними, хелатів, одержання
Код посилання
<a href="https://ua.patents.su/5-85344-sposib-oderzhannya-khelativ-perekhidnikh-metaliv-z-oligoperoksidnimi-ligandami.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання хелатів перехідних металів з олігопероксидними лігандами</a>
Попередній патент: Фототеодоліт
Наступний патент: Спосіб діагностики туберкульозу
Випадковий патент: Спосіб лікування виразкової хвороби, сполученої з helicobacter pylori









