Спосіб одержання полісахариду
Номер патенту: 91064
Опубліковано: 25.06.2010
Автори: Іванушкіна Ганна Олександрівна, Пирог Тетяна Павлівна
Формула / Реферат
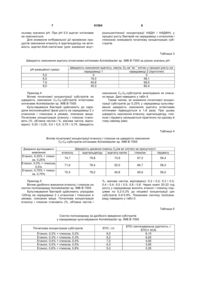
Спосіб одержання полісахариду, який включає періодичне культивування Acinetobacter sp. 1MB В-7005 і синтез полісахариду на поживному середовищі, що містить як джерело вуглецевого живлення суміш етанолу і глюкози у молярному співвідношенні 3:1, мінеральні солі і ростові фактори, який відрізняється тим, що вміст мінеральних речовин в середовищі складає КН2РО4 - 3,2; КОН - 0,8; NH4NO3 - 0,3; MgSO4 х 7Н2О - 0,4; СаСl2 х 2Н2О - 0,1; FeSO4 х 7Н2О - 0,001 г/л, початкова концентрація етанолу і глюкози у середовищі складає 0,2-0,3 % і надалі через 20-24 год. здійснюють дробне внесення цих субстратів порціями по 0,2-0,3 % до кінцевої концентрації 0,8-0,9 % етанолу (об'ємна частка) і 0,8-0,9 % глюкози (масова частка).
Текст
Спосіб одержання полісахариду, який включає періодичне культивування Acinetobacter sp. 1MB В7005 і синтез полісахариду на поживному середовищі, що містить як джерело вуглецевого живлення суміш етанолу і глюкози у молярному співвідношенні 3:1, мінеральні солі і ростові фактори, який відрізняється тим, що вміст мінеральних речовин в середовищі складає КН2РО4 - 3,2; КОН 0,8; NH4NO3 - 0,3; MgSO4 х 7Н2О - 0,4; СаСl2 х 2Н2О - 0,1; FeSO4 х 7Н2О - 0,001 г/л, початкова концентрація етанолу і глюкози у середовищі складає 0,2-0,3 % і надалі через 20-24 год. здійснюють дробне внесення цих субстратів порціями по 0,2-0,3 % до кінцевої концентрації 0,8-0,9 % етанолу (об'ємна частка) і 0,8-0,9 % глюкози (масова частка). Винахід відноситься до біотехнології, а саме, до способу одержання мікробних екзополісахаридів (ЕПС), які можуть використовуватись у нафтовидобувній, хімічній, парфумерній, харчовій та ін. промисловості, сільському господарстві, медицині. Відомі способи одержання полісахаридів, продуцентами яких є Xanthomonas campestris 8162 [А.с. №595379, СРСР, публікація 28.02.78, МПК2 С12К3/00], Xanthomonas campestris NRLL В-12075 та NRLL В-12074 [патент №4400467, США, публікація 23.08.83, МПК3 С12Р19/06], Xanthomonas campestris ATCC 31601 [патент №4418145, США, публікація. 29.11.83, МПК3 С12Р19/06]. Однак штами Xanthomonas campestris є фітопатогенними, деякі з них генетично нестабільні, оскільки дисоціюють на мукоїдні і немукоїдні форми, що спричиняє нестабільність якості синтезованих полісахаридів. Вказані негативні особливості штамів-продуцентів завдають шкоду довкіллю, а також обмежують використання препаратів. Найбільш близьким до запропонованого технічного рішення (прототип) є спосіб одержання ЕПС [патент України №25947, МПК7 С12Ρ19/04. Спосіб одержання полісахариду / Пирог Т.П., Висятецька Н.В.; Опубл. 27.08.2007, Бюл. №13], який перед бачає періодичне культивування Acinetobacter sp. ІMB В-7005 і синтез полісахариду на поживному середовищі, що містить джерело вуглецевого живлення, мінеральні солі і ростові фактори, а як посівний матеріал використовують культуру з середини експоненційної фази росту, вирощену на мінеральному середовищі з етанолом, у кількості 9-11% від об'єму середовища. Недоліком цього способу є високий вміст мінеральних солей у середовищі культивування (близько 10 тіл). В основу винаходу поставлено задачу створення нового способу одержання полісахариду, який знижує у два раза вміст мінеральних солей у середовищі культивування продуцента. Поставлена задача вирішується тим, що спосіб одержання полісахариду включає культивування Acinetobacter sp. ІMB В-7005 на поживному середовищі, що містить як джерело вуглецевого живлення суміш етанолу і глюкози у молярному співвідношенні 3:1, мінеральні солі і ростові фактори. Згідно винаходу початкову концентрацію етанолу і глюкози у середовищі знижують до 0,20,3% і надалі через 20-24год здійснюють дробне внесення цих субстратів порціями по 0,2-0,3% до (19) UA (11) 91064 (13) C2 (21) a200801607 (22) 07.02.2008 (24) 25.06.2010 (46) 25.06.2010, Бюл.№ 12, 2010 р. (72) ПИРОГ ТЕТЯНА ПАВЛІВНА, ІВАНУШКІНА ГАННА ОЛЕКСАНДРІВНА (73) НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ХАРЧОВИХ ТЕХНОЛОГІЙ (56) SU 595379, 22.11.1976 US 4400467, 23.08.1983 UA U 25947, 27.04.2007 RU C1 2241037, 24.04.2003 UA U 19138, 09.03.2006 UA C2 83318, 27.04.2007 US 4418145, 14.07.1980 Корж Ю.В. Регуляція с2-метаболізму у acinetobacter sp. b-7005 –продуцента екзополісахариду етаполану: Автореферат дисертації на 3 кінцевої концентрації 0,8-0,9% етанолу (об'ємна частка) і 0,8-0,9% глюкози (масова частка). Причинно-наслідковий зв'язок між запропонованими ознаками і очікуваним технічним результатом полягає в наступному. Дробне внесення етанолу і глюкози у середовище порціями по 0,20,3%, кожні 20-24год, до кінцевої концентрації 0,80,9% етанолу (об'ємна частка) і 0,8-0,9% глюкози (масова частка) дає змогу реалізувати синтез полісахариду на середовищі, в якому вміст солей знижено у 2 раза. Експериментально доведено, що зниження початкової концентрації етанолу і глюкози до 0,20,3% з наступним дробним їх внесенням порціями по 0,2-0,3% до кінцевої концентрації 0,8-0,9% дає змогу знизити у два раза концентрацію мінеральних солей у середовищі культивування. Спосіб здійснюється таким чином. Acinetobacter sp. ІMB В-7005 вирощують на середовищі такого складу (г/л): КН2РО4 - 3,2; КОН - 0,8; NH4NO3 - 0,3; MgSO4×7Н2О - 0,4; СаСІ2×2Н2О - 0,1; FeSO4×7H2O - 0,001. У середовище додатково вносять 0,5% (об'ємна частка) дріжджового автолізату та 0,0006% (масова частка) пантотенату кальцію. Початкова концентрація етанолу у середовищі становить 0,2-0,3% (об'ємна частка), глюкози - 0,2-0,3% (масова частка). Як посівний матеріал використовують культуру з експоненційної фази росту (20-24год), вирощену на мінеральному середовищі наведеного вище складу, що містить 0,5% (об'ємна частка) етанолу як джерело вуглецевого живлення. Кількість посівного матеріалу становить 10%. Культивування здійснюють у колбах об'ємом 750мл з 100мл середовища на качалці (220об/хв) при 30°С, рН 6,8-7,0 упродовж 120год. Через 20-24 год культивування здійснюють дробне внесення етанолу і глюкози порціями по 0,2-0,3% (об'ємна і масова частка відповідно) до кінцевої концентрації 0,8-0,9% (об'ємна і масова частка відповідно). Використання нового способу дає змогу знизити у два раза концентрацію солей у середовищі культивування продуцента полісахариду. Приклад 1 Синтез полісахариду під час росту Acinetobacter sp. 1MB В-7005 на середовищах зрізним вмістом солей Культивування бактерій здійснюють на мінеральних середовищах такого складу (г/л): КН2РО4 3,2; КОН - 0,8; NH4NO3 - 0,3; MgSO4×7Η2Ο - 0,4; СаСІ2×2Н2О - 0,1; FeSO4×7H2O - 0,001 (середовище 1) і КН2РО4 - 6,8; КОН - 1,8; NH4NO3 - 0,3; 91064 4 MgSO4×7Η2Ο - 0,4; СаСІ2×2Η2Ο - 0,1; FeSO4×7H2O - 0,001 (середовище 2). Молярність буферу у середовищі 1 становить 0,02М, у середовищі 2 0,05М. У середовища додатково вносять 0,5% (об'ємна частка) дріжджового автолізату та 0,0006% (масова частка) пантотенату кальцію. Як джерело вуглецю і енергії використовують суміш етанолу і глюкози у концентрації 0,75% (об'ємна частка) і 0,75% (масова частка) відповідно. Як посівний матеріал використовують культуру з експоненційної фази росту (20-24год), вирощену на мінеральних середовищах наведеного вище складу, що містять як джерело вуглецевого живлення етанол (0,5%, об'ємна частка). Кількість посівного матеріалу становить 10% від об'єму середовища. Концентрацію біомаси визначають за оптичною густиною клітинної суспензії з наступним перерахунком на абсолютно суху біомасу клітин (АСБ) у відповідності з калібрувальним графіком. Ефективність трансформації вуглецю субстратів в ЕПС оцінюють за наступними показниками: кількість синтезованих ЕПС, вихід ЕПС від субстрату, ЕПС-синтезувальна здатність. Кількість синтезованого полісахариду встановлюють ваговим методом. ЕПС-синтезувальну здатність розраховують як відношення кількості синтезованого ЕПС до біомаси та виражають у г ЕПС/ г АСБ. Концентрацію етанолу в культуральній рідині визначають за методом газорідинної хроматографії, глюкози - за глюкозооксидазним методом, пірувату - за реакцією з 2,4-динітрофенілгідразином, ацетату - ензиматичним методом з використанням ацетаткінази/Активність ацетил-КоА-синтетази (КФ 6.2.1.1) у безклітинних екстрактах аналізують за утворенням ацетил-КоА, що вступає у реакцію з гідроксиламіном з утворенням ацетилгідроксамату. Продукт реакції ацетилгідроксамату з хлорним залізом визначають спектрофотометрично при 540нм З даних, наведених у табл.1, видно, що показники синтезу полісахариду під час культивування продуцента на середовищі 1, в якому вміст солей знижено у 2 рази порівняно з прототипом, є також у 2 раза нижчими. При цьому рН культуральної рідини знижувалось до 5,0-5,2, що було зумовлено накопиченням ацетату (до 30мМ). У таких умовах культивування активність ацетил-КоА-синтетази (фермента, за участю якого ацетат залучається до метаболізму у Acinetobacter sp. ІMB В-7005) знижувалась у 3,3 раза. Ці результати свідчать про лімітування С2-метаболізму бактерій в умовах міксотрофного росту на середовищі 1. 5 91064 6 Таблиця 1 Синтез полісахариду Acinetobacter sp. ІMB В-7005 на середовищах з різним вмістом солей Показники процесу Середовище культивування Середовище 1 Середовище 2 (прототип) ЕПС, г/л Вихід ЕПС від субстрату, % pHкінцеве 4,5 33,5 5,2 30,0 0 Активність ацетил-КоАсинтетази, нмоль·хв·мг-1 білка 54,2 9,2 68,1 6,8 0 0 180,0 Ацетат у КР, Піруват у КР, мМ мМ Примітка. КР - культуральна рідина. Приклад 2 Вплив аденілатіе на активність ацетил-КоАсинтетази Культивування бактерій здійснюють в умовах, описаних вище, до середини експоненційної фази росту (18-22год). Для одержання безклітинних екстрактів культуральну рідину обробляють ультразвуком (22кГц) на апараті УЗДН-1 упродовж 60с, після чого центрифугують (5000g, 10хв, 4°С). Осад клітин тричі відмивають від залишків середовища та полісахариду 0,05Μ трис-НСІ буфером (рН 7,0), центрифугуючи (5000g, 10хв, 4°С). Така ультразвукова обробка культуральної рідини приводить до розщеплення високомолекулярних ЕПС на ни зькомолекулярні фрагменти. При цьому істотно знижується в'язкість культуральної рідини, що дає можливість відокремити клітини від фрагментів ЕПС при центрифугуванні. Відмиті клітини ресуспендують в 0,05Μ трисНСІ буфері (рН 7,0) та руйнують ультразвуком (22кГц) 4 рази по 50с при 4°С. Дезінтеграт центрифугують (12000g, 30хв, 4°С), осад відкидають, супернатант використовують як безклітинний екстракт. Активність ацетил-КоА-синтетази визначають як описано вище. Концентрація аденілатів (НАДН, НАДФН,АМФ, аденозин, аденін) у реакційній суміші - 1мМ. Таблиця 2 Активність ацетил-КоА-синтетази Acinetobacter sp. ІMB В-7005 за присутності аденілатів Аденілати (1мМ) НАДН НАДФН АМФ Аденін Аденозин Контроль (без аденілатів) Активність ацетил-КоА-синтетази (нмоль·хв-1мг-1 білка) у процесі росту на середовищі 1 середовищі 2 (прототип) 17,6 64,2 15,7 60,0 20,6 73,2 23,6 82,1 27,9 80,5 54,2 180,0 Таким чином, за присутності аденілатів активність ацетил-КоА-синтетази знижується майже у 3 раза. Окиснення етанолу й ацетальдегіду у Acinetobacter sp. ІMB В-7005 здійснюється НАД+та НАДФ+-залежними дегідрогеназами, отже, продукти окиснення С2-субстратів, зокрема, НАДН і НАДФН, інгібують активність ацетил-КоАсинтетази, що в свою чергу зумовлює накопичення ацетату у культуральній рідині і зниження рН. Наявність буферу у середовищі 2 (на відміну від середовища 1) «гасить» коливання рН, зумовлені накопиченням ацетату. При рН, близьких до нейтрального, екзогенний ацетат може знову поступати у клітини бактерій і залучатися до метаболізму. Приклад 3 Вплив рН на швидкість окиснення ацетату інтактними клітинами Acinetobacter sp. ІMB В-7005 Культивування бактерій здійснюють в умовах, описаних вище, до середини експоненційної фази росту. Для визначення швидкості окиснення субстрату клітини Acinetobacter sp. В-7005 центрифугують (4000g, 15хв, 4°С). Отриманий осад клітин двічі відмивають від залишків середовища 0,05Μ К+-фосфатним буфером (рН 7,0) центрифугуючи (4000g, 15хв, 4°С). Відмиті клітини ресуспендують у 0,05Μ К+-фосфатному буфері (рН 7,0). Для інкубації клітин при визначенні швидкості окиснення субстратів використовуть трис-НСІ буфер (0,05М, рН 7,0). Швидкість окиснення ацетату калію (10мМ) встановлюють за швидкістю поглинання кисню у реакційній суміші полярографічним методом за допомогою електроду закритого типу на полярографі ППТ-1 при температурі 28-30°С. Як видно з наведених у табл.3 даних, швидкість окиснення ацетату максимальна при нейтра 7 91064 льному значенні рН. При рН 5,0 ацетат клітинами не окиснюється. Для зниження інгібувальної дії проміжних продуктів окиснення етанолу й ацетальдегіду на активність ацетил-КоА-синтетази (для зниження внут 8 рішньоклітинної концентрації НАДН і НАДФН) у процесі росту бактерій на середовищі з етанолом і глюкозою знижували початкову концентрацію субстратів. Таблиця 3 Швидкість окиснення ацетату інтактними клітинами Acinetobacter sp. ІMB В-7005 за різних значень рН рН реакційної суміші 5,0 6,0 7,0 8,0 Швидкість окиснення ацетату, нмоль О2·хв-1мг-1 клітин у процесі росту на середовищі 1 середовищі 2 (прототип) 0 0 19,3 48,1 40,8 99,5 35,3 80,4 Приклад 4 Вплив початкової концентрації субстратів на швидкість окиснення С2-С6-субстратів інтактними клітинами Acinetobacter sp. ІMB В-7005 Культивування бактерій здійснюють до середини експоненційної фази росту на середовищі 2 з етанолом і глюкозою в умовах, описаних вище. Початкова концентрація етанолу і глюкози становить (%, об’ємна частка і %, масова частка, відповідно): 0,25 і 0,25; 0,5 і 0,5; 0,75 і 0,75. Швидкість окиснення С2-С6-субстратів аналізували як описано вище. Дані наведено у табл.4. Таким чином, за зниження початкової концентрації субстратів до 0,25% у середовищі культивування швидкість окиснення ацетату інтактними клітинами підвищується в 1,8 раза. При цьому швидкість окиснення етанолу, ацетальдегіду, глюкози і пірувату залишається практично на одному й тому самому рівні. Таблиця 4 Вплив початкової концентрації етанолу і глюкози на швидкість окиснення С2-С6-субстратів клітинами Acinetobacter sp. ІMB В-7005 Джерело вуглецевого живлення Етанол, 0,25% + глюкоза, 0,25% Етанол, 0,5% + глюкоза, 0,5% Етанол, 0,75% + глюкоза, 0,75% етанолу Швидкість дихання (нмоль C2/хв мг клітин) за присутності ацетальдегіду ацетату калію глюкози пірувату 74,7 79,8 73,9 67,3 59,4 71,6 78,4 52,5 66,7 58,3 70,3 78,2 40,8 65,6 56,2 Приклад 5 Вплив дробного внесення етанолу і глюкози на синтез полісахариду Acinetobacter sp. ІMB В-7005 Культивування бактерій здійснюють упродовж 120год на середовищі 2 з етанолом і глюкозою в умовах, описаних вище. Початкова концентрація етанолу і глюкози становить (%, об'ємна частка і %, масова частка, відповідно): 0,2 і 0,2; 0,3 і 0,3; 0,4 і 0,4; 0,5 і 0,5; 0,8 і 0,8. Через кожні 20-22 год росту у середовище вносять етанол і глюкозу порціями по 0,2-0,3% до кінцевої концентрації цих субстратів 0,8-0,9%. Показники синтезу полісахариду наведено у табл.5. Таблиця 5 Синтез полісахариду за дробного введення субстратів у середовище культивування Acinetobacter sp. ІMB В-7005 Початкова концентрація субстратів ЕПС, г/л Етанол, 0,2% + глюкоза, 0,2% Етанол, 0,3% + глюкоза, 0,3% Етанол, 0,4% + глюкоза, 0,4% Етанол, 0,5% + глюкоза, 0,5% Етанол, 0,8% + глюкоза, 0,8% 9,2 9,2 7,2 6,3 5,0 ЕПС-синтезувальна здатність, г ЕПС/г АСБ 6,15 6,20 4,92 3,95 3,35 Таким чином, зниження у середовищі 2 початкової концентрації етанолу і глюкози до 0,2-0,3% з наступним дробним внесенням субстратів порціями по 0,2-0,3% до кінцевої концентрації 0,8% дає змогу підвищити кількість синтезованого полісахариду до рівня згідно протитипу. Але згідно винаходу вміст солей у середовищі культивування удвічі нижчий, ніж у прототипі. Приклад 6 Синтез полісахариду залежно від інтервалу дробного внесення субстратів Культивування бактерій здійснюють упродовж 120год на середовищі 2 з етанолом і глюкозою в умовах, описаних вище. Початкова концентрація етанолу становить 0,2% (об'ємна частка), глюкози 0,2% (масова частка). Через 12, 16, 20 і 24год росту у середовище вносять етанол і глюкозу порціями по 0,2% до кінцевої концентрації 0,8%. Таблиця 6 Залежність синтезу полісахариду від режиму внесення субстратів Інтервал внесення субстратів, год ЕПС, г/л 12 16 20 24 7,5 8,4 9,25 9,2 Отже, показники синтезу полісахариду найвищі за умови дробного внесення субстратів у середовище через кожні 20-24год. Таким чином, використання запропонованого способу дає змогу реалізувати без зниження пока Комп’ютерна верстка А. Рябко ЕПС-синтезувальна здатність, г ЕПС/г АСБ 5,0 5,9 6,15 6,20 зників синтезу процес одержання полісахариду на середовищі, в якому вміст солей знижено у два рази, порівняно з прототипом. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for polysaccharide preparation
Автори англійськоюPyroh Tetiana Pavlivna, Ivanyshkina Hanna Oleksandrivna
Назва патенту російськоюСпособ получения полисахарида
Автори російськоюПирог Татьяна Павловна, Иванушкина Анна Александровна
МПК / Мітки
МПК: C12P 19/04
Мітки: полісахариду, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/5-91064-sposib-oderzhannya-polisakharidu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання полісахариду</a>
Попередній патент: Застосування безсироваткового культурального середовища для одержання рекомбінантних димерних гонадотропінів
Наступний патент: Спосіб обробки металів
Випадковий патент: Калійбіс(цитрато)германат (iv), що виявляє протиішемічну активність