Спосіб синтезу гідрохлориду ендо-2-амінонорборнену
Номер патенту: 91602
Опубліковано: 10.07.2014
Автори: Пальчиков Віталій Олександрович, Крещик Сергій Вікторович
Формула / Реферат
Спосіб синтезу гідрохлориду ендо-2-амінонорборнену, загальної формули C7H12ClN:
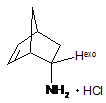 ,
,
який включає відновлення ендо-2-нітронорборнену, який відрізняється тим, що використовують як відновник 1,5 мольний надлишок гідриду алюмінію, який отримують in situ із еквімольних кількостей алюмогідриду літію та триметилсилілхлориду в тетрагідрофурані, реакцію проводять при кип'ятінні реакційної суміші протягом 8-12 годин, далі продукт переводять у трет-бутилоксикарбонільне похідне, яке очищують на силікагелі.
Текст
Реферат: UA 91602 U UA 91602 U 5 10 Корисна модель стосується нового способу синтезу гідрохлориду ендо-2-амінонорборнену (ендо2-амінобіцикло[2.2.1]гепт-5-ену) - біциклічного аміну, що містить фармакофорний, близький до природних терпенів, норборненовий фрагмент і використовується в синтезі багатьох біологічно активних речовин, а також в комбінаторній хімії [1-3]. Ендо-2-Амінонорборнен (І) відомий раніше, однак дослідження методів синтезу його окремих стереохімічно чистих форм залишається актуальною задачею, оскільки синтез цього аміну часто супроводжується отриманням ряду побічних продуктів. Із літературних джерел та наших досліджень відомо, що відновлення стереохімічно чистого ендо-2-нітронорборн-5-ену (II) алюмогідридом літію в киплячому діетиловому ефірі призводить до суміші стереоізомерних 1 ендо-екзоамінів (І), в якій вміст альтернативного продукту досягає 20 % (дані ЯМР Н), а загальний вихід ендо-аміну близько 30 % [4]. Крім зазначеної суміші амінів, як побічний продукт 1 імовірно утворюється 3-азабіцикло[3.2.1]окт-6-ен (до 10 %, дані ЯМР Н). Іншою вихідною речовиною для синтезу аміну (І, у вигляді гідрохлориду) є біцикло[2.2.1]гепт-5-ен-ендо-2карбонова кислота (IIІ) [5, 6]. Ключовою останнього методу синтезу є перегрупування Курціуса. 1) EtOCOCl, Et3N, Me2CO 2) NaN3, H2O LiAlH4 (3.38екв.) Еt2O, кип'ятіння 3) 2M HCl, 33 % 58 % NH2 NO2 15 20 25 30 I II CO2H III Найбільш близьким до об'єкта, що заявляється (прототип), є відомий спосіб синтезу аміну (І) відновленням нітропохідного (II) великим надлишком алюмогідриду літію в середовищі киплячого діетилового ефіру [4]. Значним недоліком цього способу синтезу є невисокий вихід стереохімічно чистого продукту. В основу цієї корисної моделі поставлено задачу розробки зручних умов мультиграмового синтезу стереохімічно однорідного гідрохлориду ендо-2-амінонорборнену (І, ендо2амінобіцикло[2.2.1] гепт-5-ену) із вмістом основного компоненту не менш 95 %. Така чистота є звичайною умовою, що пред'являється до комерційних синтетичних будівельних блоків (building block). Поставлена задача вирішується розробленим способом синтезу гідрохлориду аміну (І) з використанням як відновника ендо-2-нітронорборнену (її) 1,5 кратного мольного надлишку гідриду алюмінію, який отримують in situ із еквімольних кількостей алюмогідриду літію та триметилсилілхлориду в тетрагідрофурані, реакцію проводять при кип'ятінні реакційної суміші протягом 8-12 годин, далі продукт переводять у трет-бутилоксикарбонільне похідне, яке очищують на силікагелі. Зняття захисної Вос-групи за стандартною методикою призводить до цільового продукту (ї). Синтез вихідного ендо2-нітронорборн-5-ену (II) та нітроетилену здійснено за методами [5,7]. HO Boc2O, DІPEA CH2Cl2, 20 C NO2 O NH2 67 % >170 C 99 % нагрів до 180 C + NO2 HN O LiAlH4 (1.5 екв.) Me3SiCl (1.5 екв.) ТГФ, кип., 12 год 60 % O термоліз O 79 % 70 % Очистка на SiO2 O 7 -15 до 20 C 99 % 7 4 Et2O 5 2 6 HCl діоксан 4 5 3 2 1 6 NO2 ІІ 1 3 O І HN O 1 Hехо 95 % NH2HCl UA 91602 U 1 5 10 15 20 25 30 35 40 45 50 55 60 Структуру синтезованої сполуки (І) підтверджено даними спектра ЯМР Н. Найбільш суттєві розбіжності в спектральній поведінці ізомерних екзо/ендо-амінів (І) у дейтерохлороформі торкаються положення в спектрі (6.33 та 6.03 м.ч. для ендо-ізомеру І, 6.14 та 6.07 м.ч. для екзо5,6 ізомеру І) та ступеню нееквівалентності сигналів протонів олефінового фрагменту Η (Δδ 0.30 м. ч. для ендо-ізомеру І, 0.07 м.ч. для екзо-ізомеру І). Вказаний критерій дозволяє чітко контролювати стереохімічну чистоту проміжних сполук методом ядерного магнітного резонансу 1 на ядрах Н. Приклад синтезу Гідрохлорид ендо-2-амінобіцикло[2.2.1]гепт-5-ену (І). Реакцію проводили у 2-літровому тригорлому скляному реакторі з верхнім перемішуванням, зворотним холодильником та канальною лійкою. До 15.85 г (0.42 моль) алюмогідриду літію в 900 мл абсолютного тетрагідрофурану при 0 °C (льодяна баня) та перемішуванні додавали по краплях 45.05 г (0.42 моль) триметилсилілхлориду в токі сухого аргону. Після перемішування реакційної суміші впродовж 30 хвилин, повільно додавали по краплях розчин 38.67 г (0.28 моль) ендо-2нітронорборнену (II) в 100 мл абсолютного тетрагідрофурану. Отриманій суміші дали змогу нагрітися до 25 С і продовжили реакцію при кип'ятінні та перемішуванні протягом 12 годин (контроль методом тонкошарової хроматографії). Після охолодження надлишок відновника повільно розкладали додаванням води (16 мл), 20 %-ного розчину гідроксиду натрію (16 мл) та знову води (~40 мл). Осад гідроксидів відфільтровували та ретельно промивали на фільтрі хлористим метиленом (300 мл). Фільтрат висушували сульфатом натрію, концентрували на роторному випарювачі та переганяли маслоподібний залишок в вакуумі водоструминного насоса. Вихід аміну (І) 18.20 г (60 %), Ткип. 40-43 °C (18 мм рт. ст.), безбарвна рідина, вміст ендо-аміну 71.4 % (дані GC-MS спектроскопії). До 18.20 г (0.17 моль) отриманого аміну (І) в 350 мл сухого хлористого метилену при температурі 0 С та перемішуванні додавали 25.87 г (0.20 моль) діізопропілетиламіну (DTPEA) і повільно 43.65 г (0.20 моль) Вос-ангідриду. Отриману суміш перемішували 12 годин при 20 °C, промивали 6 %-м водним розчином лимонної кислоти (3100 мл) до кислої реакції водного шару, далі насиченим водним розчином хлориду натрію (3100 мл) до нейтральної реакції. Органічний шар висушували сульфатом натрію, концентрували на роторному випарювачі. Вихід суміші Вос-похідних аміну (І) 27.64 г (79 %), вміст ендо-ізомеру 86.3 % (дані LC-MS спектроскопії). З метою виділення стереохімічно чистого Вос-похідного ендо-аміну (І) проводили очистку отриманої суміші Вос-похідних в хроматографічній колоні (70 × 900 мм) заповненій силікагелем (40-63мкм), елюент - суміш етилацетату з гексаном у співвідношенні 1:10. Вос-похідне ендо-аміну (І) має більше значення Rf, ніж його екзо-ізомер. Вихід продукту після очистки становить 19.35 г (70 %), вміст ендоізомеру 96.5 % (дані LC-MS спектроскопії). Тпл. 90-92 °C, Rf (діетиловий ефір) 0.83, Rf 1 (етилацетат/гексан у співвідношенні 1:3) 0.58. Спектр ЯМР Н (400 МГц, CDCl3), δ, м.ч. (J, Гц): 3endo 7а 7s 0.66 д.т (1Н, H , J 12.2, 3.1 Гц), 1.30 д (1Н, Н , J 8.7 Гц), 1.42 с (9Н, 3CH3), 1.44 м (1Н, H ), 3exo 1 4 2ехo 5 2.18 м (1Н, Н ), 2.81 м (1Н, Н ), 3.00 м (1Н, Η ), 4.22 м (1Η, Н ), 6.01 д.д (1Η, Η , J 5.6, 2.8 6 13 Гц), 6.33 д.д (1Н, Н , J 5.6, 3.0 Гц). Спектр ЯМР С (100 МГц, CDCl3), δ, м. ч.: 28.6 (3СН3), 35.9 3 1 4 7 2 5 6 (С ), 42.6 (С ), 46.2 (С ), 48.8 (С ), 50.5 (С ), 79.2 (O-С(СН3)3), 131.8 (С ), 140.0 (С ), 155.7 (С=О). До 19.30 г отриманого Вос-похідного ендо-аміну (I) додавали 100 мл 4М діоксанового розчину НСl, суміш кип'ятили протягом 1 години і упарювали на роторному випарювачі, залишок обробляли 100 мл сухого диметилкетону, осад відфільтровували та висушували на повітрі. Вихід гідрохлориду (І) 12.76 г (95 %), фізичні та спектральні властивості відповідають літературним [1]. Аналогічний експеримент з синтезу гідрохлориду (Т), проведений при відновленні ендо-2нітронорборнену (11) протягом 8 годин, призводить до продукту (І) з виходом 42 %. 1 Спектри ЯМР Н реєстрували на радіоспектрометрі Bruker AVN 400 (робоча частота 1 13 генератора 400 МГц для ядер H та 100 МГц для ядер С) для розчинів сполук в дейтерохлороформі. Проходження реакцій та чистоту синтезованих сполук контролювали методом ТШХ на пластинах Silufol UV-254 в суміші етилацетат/гексан, 1:3, проявник - розчин марганцевокислого калію. До переваг запропонованого способу синтезу гідрохлориду ендо-2-амінонорборнену (1) можна віднести наступні: зменшення мольного надлишку цінного відновника (алюмогідриду літію, Li AlH 4); використання більш дешевого тетрагідрофурану як альтернативу діетиловому ефіру, обіг якого в Україні обмежено у зв'язку із внесенням його до списку прекурсорів; триметилсилілхлорид (Me3SiCl), що використовується в запропонованому способі, є багатотонажним доступним промисловим продуктом, який знайшов використання в хімії силіконових високомолекулярних сполук; 2 UA 91602 U 5 10 15 20 висока стереохімічна чистота цільового продукту (>95 %); запропонований спосіб розширяє можливості синтетичних підходів до аналогічних каркасних амінів. Джерела інформації: 6 1. The synthesis of the novel adenosine agonists, exo-and endo-N -(5,6-epoxynorborn-2y1)adenosine / Scammells P.J., Baker S.P., Bellardinelli L. et al. // Tetrahedron.-1996. - Vol. 52, № 13,- P. 4735-4744. 2. New potent and selective A, adenosine receptor agonists / Hutchinson S.A., Baker S.P., Linden J., Scammells P.J. // Bioorg. Med. Chem.-2004. - Vol. 12, № 18. - P. 4877-4884. 3. The design and synthesis of novel adenosine agonists / Scammells P.J., Baker S.P., Bellardinelli L. et al. // Bioorg. Med. Chem. Lett.-1996. - Vol. 6, № 7. - p. 8Ц-814. 4. Перегруппировка в реакции арилсульфонилирования эндо-5-аминобицикло[2.2.1]гепт-2ена / Касьян А.О., Тарабара И.Н., Касьян Л.И. // ЖОрХ. - 1999. - Т. 35, вып. 4. - С. 647-648. 5. Ring-rearrangement methathesis of substituted 2-aminonorbornencs / Nadany A.E., Mckendrick J.E. // Synlett.-2007. - № 11.-P. 1663-1666. 6. endo-5-Aminobicyclo[2.2.1 Jheptene-2 / W. E. Parham, W. T. Hunter, R. Hanson // J. Am. Chem. Soc.-1951.- Vol. 73, № 11.-P. 5068-5070. 7. Buckley G.D., Scaife C.W. Aliphatic Nitro-compounds. Part 1. Preparation of Nitro-olefins by Dehydration of 2-Nitro-alcohols // J. Chem. Soc.-1947.-P. 1471-1472. ФОРМУЛА КОРИСНОЇ МОДЕЛІ Спосіб синтезу гідрохлориду ендо-2-амінонорборнену, загальної формули C7H12ClN: Hехо 25 30 NH2 HCl , який включає відновлення ендо-2-нітронорборнену, який відрізняється тим, що використовують як відновник 1,5 мольний надлишок гідриду алюмінію, який отримують in situ із еквімольних кількостей алюмогідриду літію та триметилсилілхлориду в тетрагідрофурані, реакцію проводять при кип'ятінні реакційної суміші протягом 8-12 годин, далі продукт переводять у трет-бутилоксикарбонільне похідне, яке очищують на силікагелі. Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 3
ДивитисяДодаткова інформація
Автори англійськоюPalchikov Vitalii Oleksandrovych
Автори російськоюПальчиков Виталий Александрович
МПК / Мітки
МПК: C07C 211/03, C07C 209/48
Мітки: ендо-2-амінонорборнену, синтезу, спосіб, гідрохлориду
Код посилання
<a href="https://ua.patents.su/5-91602-sposib-sintezu-gidrokhloridu-endo-2-aminonorbornenu.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу гідрохлориду ендо-2-амінонорборнену</a>
Попередній патент: Субстрат для вивчення впливу гранулометричного складу піску на розвиток гідробіонтів
Наступний патент: Спосіб лікування обмеженої склеродермії
Випадковий патент: Електроліт осадження покриттів сплавом золото-мідь









